От социальной амёбы к социальным сетям
Часть 1. Геномные письма издалека
Что дало старт эволюции живых существ? Кто и как в ней выигрывает? Влияют ли на геном изменения образа жизни? Об этом с нашим корреспондентом беседует ведущий научный сотрудник лаборатории молекулярной генетики Института клеточной и молекулярной биологии СО РАН доктор биологических наук профессор Николай Николаевич Колесников.
Говоря об эволюции, мы должны, прежде всего, понимать, что со времен Чарльза Дарвина многое изменилось: появились не только новые знания, но и, прежде всего, новые специальности в науках о жизни. Например, молекулярная биология и геномика, входящие в круг моих интересов. Чем геном отличается от остальных источников информации? Тем, что во многом напоминает «послания последующим поколениям», популярные в советские времена, или ту платиновую пластинку для инопланетян, которую отправили на космическом зонде «Вояджер». Чем вызвано такое сравнение? Об этом чуть позже, а пока немного важной хронологии.
С начала появления жизни в течение еще двух миллиардов лет на нашей планете существовали только прокариоты — самые элементарные создания, не имеющие ядра. Затем пошли процессы, связанные не столько с изменениями среды (климат, радиация и т.п.), сколько с деятельностью самих живых существ. Они меняли планету собственными усилиями, если так можно выразиться. Следующим важным этапом было появление эукариот — клеточных организмов с ядром, защищающим их генетический аппарат.
Упомянутые мной два миллиарда лет жизнь существовала только в океане, где отдельные эукариоты постепенно перешли к образованию многоклеточных организмов. При этом водная среда была достаточно стабильной, без резких скачков температуры и химического состава. Около 600 миллионов лет тому назад (обратите внимание, счёт пошёл уже на миллионы) клетки «выяснили», что им гораздо выгоднее собираться в тесное сообщество, чтобы размножаться и распространяться в пространстве. Одни стали отвечать за прикрепление к субстрату, другие за прокачку пищи и так далее. И такая тяга к единению тоже прослеживается в геноме.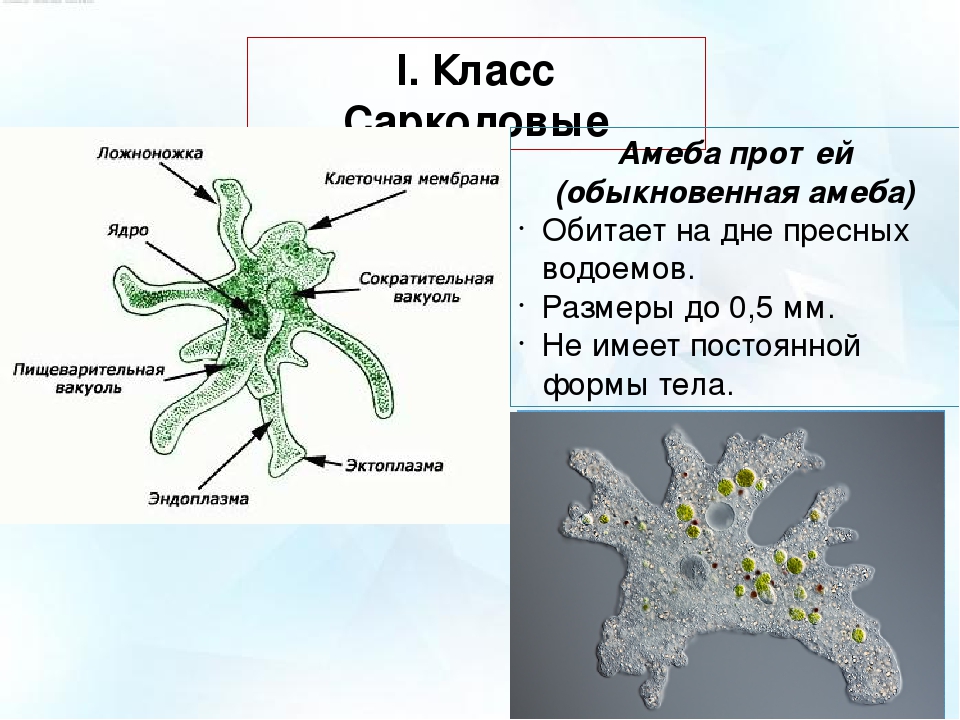
Пускай мы называем эти организмы простейшими, они несут набор генов, не принципиально отличающийся от набора более развитых видов. И схематически (естественно, многое упрощая) мы можем изобразить процесс эволюции следующим образом: есть наследственность, то есть воспроизводство генетического материала из поколения в поколение, и есть мутации, которые привносят изменчивость. Если мутации происходят в генеративных клетках, то они тоже наследуются, становясь устойчивыми признаками. Не будем забывать и про естественный отбор. Но его не следует представлять себе на уровне примитивного дарвинизма: волк съел ослабленного оленя, а сильный вожак увёл от хищника стадо, покрыл самок и передал свои гены потомству. В биологии пока не наблюдается ясности с критериями приспособленности. По крайней мере, ими далеко не всегда могут считаться сравнительно больший размер или активность. Крупная особь более заметна (в том числе и для врагов), а вожак больше рискует, как любой лидер. На всей линейке живых существ, от той же амёбы до человека, мы чаще видим более приспособленными не элиту, а середнячков.
И схематически (естественно, многое упрощая) мы можем изобразить процесс эволюции следующим образом: есть наследственность, то есть воспроизводство генетического материала из поколения в поколение, и есть мутации, которые привносят изменчивость. Если мутации происходят в генеративных клетках, то они тоже наследуются, становясь устойчивыми признаками. Не будем забывать и про естественный отбор. Но его не следует представлять себе на уровне примитивного дарвинизма: волк съел ослабленного оленя, а сильный вожак увёл от хищника стадо, покрыл самок и передал свои гены потомству. В биологии пока не наблюдается ясности с критериями приспособленности. По крайней мере, ими далеко не всегда могут считаться сравнительно больший размер или активность. Крупная особь более заметна (в том числе и для врагов), а вожак больше рискует, как любой лидер. На всей линейке живых существ, от той же амёбы до человека, мы чаще видим более приспособленными не элиту, а середнячков.
Разумеется, было бы глупо напрочь отрицать воздействие внешних факторов на процессы эволюции.
 Глобальный катаклизм мог погубить целые популяции тех же динозавров, а освободившиеся экологические ниши занимали другие семейства, у представителей которых начинались мутации, приводившие к появлению и закреплению новых признаков. Всё это так. Но мы недооцениваем роль внутрисоциальных (в широком смысле, начиная с эукариот) факторов. Например, полуостров, на котором жили мамонты, отделяется от материка. Стадо изолируется, скрещиваются одни и те же особи, попутно меняется пищевая база… и начинает проявляться мутация, приводящая к дварфизму, то есть карликовости. Или люди приручают животных и начинают потреблять молоко, у них закрепляется мутация, позволяющая во взрослом состоянии перерабатывать лактозу — молочный сахар.
Глобальный катаклизм мог погубить целые популяции тех же динозавров, а освободившиеся экологические ниши занимали другие семейства, у представителей которых начинались мутации, приводившие к появлению и закреплению новых признаков. Всё это так. Но мы недооцениваем роль внутрисоциальных (в широком смысле, начиная с эукариот) факторов. Например, полуостров, на котором жили мамонты, отделяется от материка. Стадо изолируется, скрещиваются одни и те же особи, попутно меняется пищевая база… и начинает проявляться мутация, приводящая к дварфизму, то есть карликовости. Или люди приручают животных и начинают потреблять молоко, у них закрепляется мутация, позволяющая во взрослом состоянии перерабатывать лактозу — молочный сахар. Вот мы и пришли от амёб к Homo Sapiens. И учёных (всех народов и времен), и простых обывателей прежде всего интересует два вопроса. Первый: какой эволюционный переход считать отправной точкой истории человечества как такового, а не его «предковых линий»? Тот же наш денисовец и его современник неандерталец, это «ещё» или «уже»? С одной стороны, внешне они на нас не очень похожи…Так и австралийский абориген с виду тоже не Ди Каприо.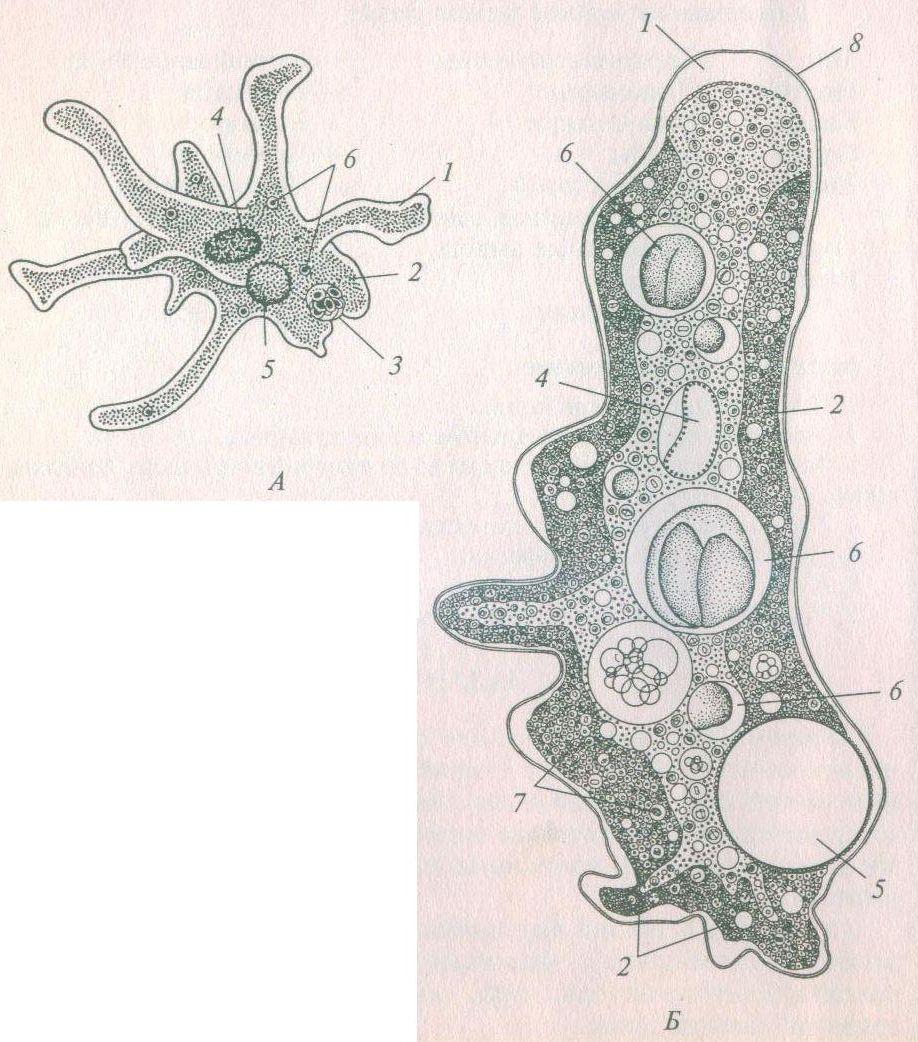 С другой стороны, денисовцы вовсю использовали огонь, а из камня и кости изготавливали не только орудия, но и украшения, причём весьма искусные. А любой археолог скажет, что древние украшения — вернейший маркёр и социальной иерархии, и определённых верований. Обитатели Денисовой пещеры владели сверлением, шлифовкой, и, по некоторым признакам, практиковали меновую торговлю с другими сообществами. Чем не люди? Но ведь приземисты, косматы, низколобы… И без интернета.
С другой стороны, денисовцы вовсю использовали огонь, а из камня и кости изготавливали не только орудия, но и украшения, причём весьма искусные. А любой археолог скажет, что древние украшения — вернейший маркёр и социальной иерархии, и определённых верований. Обитатели Денисовой пещеры владели сверлением, шлифовкой, и, по некоторым признакам, практиковали меновую торговлю с другими сообществами. Чем не люди? Но ведь приземисты, косматы, низколобы… И без интернета.
Второй же главный вопрос таков. Пускай не важно, который переход будет признан принципиальным, но каким был основной эволюционный фактор, приведший к нему? Воздействия внешней среды (климат, пищевые цепочки) или же, в большей степени, внутрисоциальные процессы (миграции, новые модели поведения и т.п.)? И что вызвало «скачок к началу человечества» в геномном плане: накопление генетически-наследственных изменений либо яркая новая мутация? Ещё 30 лет назад наша прекрасная марксистская наука со ссылкой на Фридриха Энгельса давала простой и однозначный ответ: «труд сделал из обезьяны человека».
Окончание следует.
Подготовил: Андрей Соболевский
Фото: 1 — wikipedia.org (Cymothoa exigua), 2 — demotivation.me
Десять простейших паразитов человека
Наталья Резник
Самый большой. Балантидий Balantidium coli
Крупнейшее простейшее — паразит человека, и единственная инфузория в этой компании. Ее размеры варьируют от 30 до 150 мкм в длину и от 25 до 120 мкм в ширину. Для сравнения: длина малярийного плазмодия в самой крупной стадии — около 15 мкм, и в разы меньше балантидия клетки кишечника, среди которых живет инфузория. Слон в посудной лавке.
Распространен везде, где есть свиньи — его основные носители. Обычно живет в подслизистом слое толстой кишки, хотя у людей встречается и в легочном эпителии. Питается B. coli бактериями, частичками пищи, фрагментами хозяйского эпителия. У животных инфекция протекает бессимптомно. У людей может развиться тяжелейшая диарея с кровавыми, слизистыми выделениями (балантидиаз), иногда в стенках толстой кишки образуются язвы. Умирают от балантидиаза редко, однако он вызывает хроническое истощение.
Обычно живет в подслизистом слое толстой кишки, хотя у людей встречается и в легочном эпителии. Питается B. coli бактериями, частичками пищи, фрагментами хозяйского эпителия. У животных инфекция протекает бессимптомно. У людей может развиться тяжелейшая диарея с кровавыми, слизистыми выделениями (балантидиаз), иногда в стенках толстой кишки образуются язвы. Умирают от балантидиаза редко, однако он вызывает хроническое истощение.
Люди заражаются через грязную воду или продукты, содержащие цисты. Частота инфицирования у людей не превышает 1%, в то время как свиньи могут быть заражены поголовно.
Лечится тетрациклином или метронидазолом, сообщений о лекарственной устойчивости этой инфузории пока не поступало.
Открыт шведским ученым Мальстемом в 1857 году. Сегодня балантидиаз связывают с тропическими и субтропическими районами, бедностью и плохой гигиеной.
Самая первая. Ротовая амеба Entamoeba gingivalis
Первая паразитическая амеба, найденная у человека.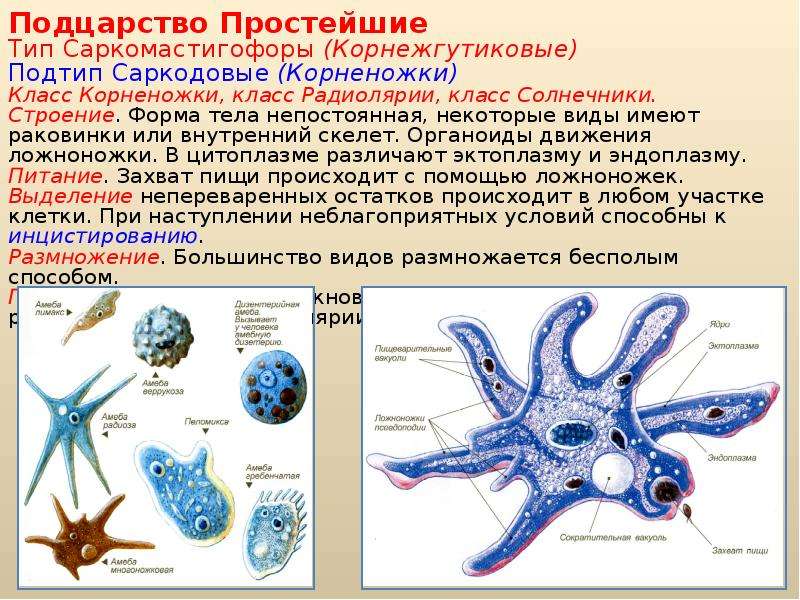 Этот человек был москвичом, и описание его амеб опубликовал московский исследователь Г. Гросс в 1849 году в Bulletin de la Société Impériale des Naturalistes de Moscou — старейшем русском научном журнале (выходит с 1829 года и посейчас индексируется ВАК под именем «Бюллетень Московского общества испытателей природы»). Гросс обнаружил амебу в зубном налете, отсюда и название от латинского gingivae — десны.
Этот человек был москвичом, и описание его амеб опубликовал московский исследователь Г. Гросс в 1849 году в Bulletin de la Société Impériale des Naturalistes de Moscou — старейшем русском научном журнале (выходит с 1829 года и посейчас индексируется ВАК под именем «Бюллетень Московского общества испытателей природы»). Гросс обнаружил амебу в зубном налете, отсюда и название от латинского gingivae — десны.
Живет во рту почти у всех людей с больными зубами или воспаленными деснами, населяет десневые карманы и зубной налет. Питается клетками эпителия, лейкоцитами, микробами, при случае эритроцитами. У людей со здоровой ротовой полостью встречается редко.
Это небольшое простейшее размером 10–35 мкм во внешнюю среду не выходит и цист не образует, к другому хозяину передается при поцелуях, через грязную посуду или зараженную пищу. E. gingivalis считают исключительно человеческим паразитом, но иногда ее находят у кошек, собак, лошадей и обезьян, живущих в неволе.
В начале ХХ века E. gingivalis описали как возбудителя пародонта, поскольку она всегда присутствует в воспаленных зубных ячейках. Однако ее патогенность не доказана.
Лекарства, действующие на эту амебу, неизвестны.
Самый всепроникающий. Дизентерийная амеба Entamoeba histolytica
Этот кишечный паразит с кровью проникает в ткани печени, легких, почек, мозга, сердца, селезенки, половых органов. Ест, что добудет: частички пищи, бактерии, эритроциты, лейкоциты и клетки эпителия.
Распространена повсеместно, особенно в тропиках. Обычно люди заражаются, проглотив цисту.
В странах умеренного климата амеба, как правило, остается в просвете кишечника, и инфекция протекает бессимптомно. В тропиках и субтропиках чаще начинается патологический процесс: E. histolytica атакуют стенки. Причины перехода в патогенную форму пока неясны, но описано уже несколько молекулярных механизмов происходящего. Так, понятно, что амебы выделяют лизирующие вещества, пробиваются через слизь и убивают клетки. По-видимому, амеба может уничтожить хозяйскую клетку двумя способами: запустив у нее апоптоз или просто отгрызая куски. Первый способ долгое время считался единственным. Кстати, механизм клеточного самоубийства с рекордной скоростью — за минуты — так и не выявлен. Второй способ описан совсем недавно, авторы назвали его трогоцитозом от греческого «трого» — грызть. Примечательно, что амебы, кусающие клетки, бросают добычу, как только она погибает. А другие могут фагоцитировать мертвые клетки целиком. Предполагают, что кусающие и пожирающие клетки различаются картиной экспрессии генов.
Так, понятно, что амебы выделяют лизирующие вещества, пробиваются через слизь и убивают клетки. По-видимому, амеба может уничтожить хозяйскую клетку двумя способами: запустив у нее апоптоз или просто отгрызая куски. Первый способ долгое время считался единственным. Кстати, механизм клеточного самоубийства с рекордной скоростью — за минуты — так и не выявлен. Второй способ описан совсем недавно, авторы назвали его трогоцитозом от греческого «трого» — грызть. Примечательно, что амебы, кусающие клетки, бросают добычу, как только она погибает. А другие могут фагоцитировать мертвые клетки целиком. Предполагают, что кусающие и пожирающие клетки различаются картиной экспрессии генов.
Сейчас способность амебы проникать в кровяное русло, печень и другие органы связывают именно с трогоцитозом.
Амебиаз — смертельно опасное заболевание, ежегодно от инфекции E. histolytica умирает около 100 тыс. человек.
У дизентерийной амебы есть непатогенный близнец, E. dispar, поэтому для диагностики заболевания микроскопии недостаточно.
dispar, поэтому для диагностики заболевания микроскопии недостаточно.
Для излечения необходимо уничтожить как подвижных E. histolytica (метронидазол, тинидазол), так и цисты (иодокинол или паромомицин).
Описал E. histolytica в 1875 году петербургский врач Федор Александрович Лёш у больного диареей, он же определил ее патогенную природу. Но латинское название амебе дал в 1903 году немецкий зоолог Фриц Шаудин. Histolytica означает «разрушающая ткани». В 1906 году ученый умер именно от амебного абсцесса кишечника.
Самый распространенный. Кишечная лямблия Giardia lamblia (G.intestinalis)
Лямблия, самый распространенный паразит кишечника, встречается повсеместно. Заражены 3–7% людей в развитых странах и 20–30% в развивающихся. То есть примерно 300 млн. человек.
Обитают паразиты в двенадцатиперстной кишке и желчных протоках хозяина, где то плавают, работая жгутиками, то прикрепляются к эпителию с помощью клейкого диска, расположенного на нижней стороне клетки.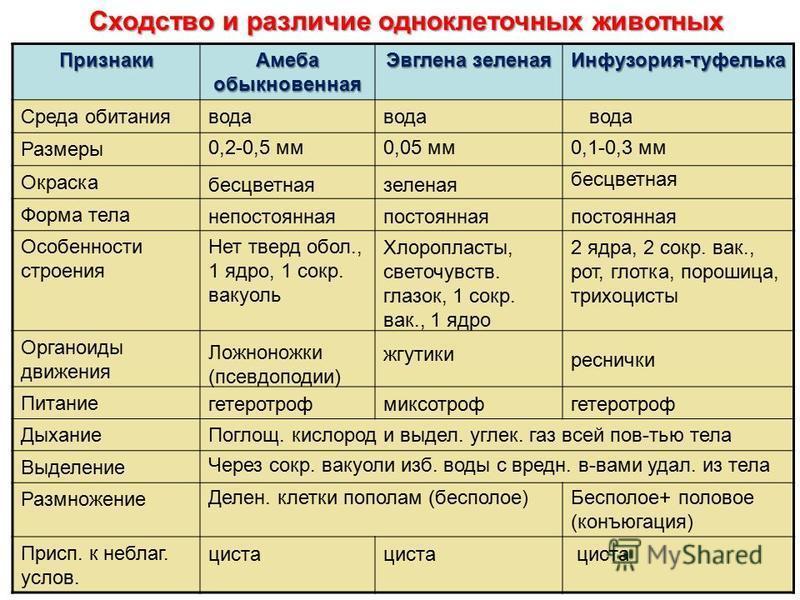 На 1 см2 эпителия налипает до миллиона лямблий. Они повреждают ворсинки, что нарушает всасывание питательных веществ, вызывает воспаление слизистой оболочки и диарею. Если болезнь затрагивает желчные протоки, она сопровождается желтухой.
На 1 см2 эпителия налипает до миллиона лямблий. Они повреждают ворсинки, что нарушает всасывание питательных веществ, вызывает воспаление слизистой оболочки и диарею. Если болезнь затрагивает желчные протоки, она сопровождается желтухой.
Лямблиоз — болезнь грязных рук, воды и продуктов. Жизненный цикл простейшего прост: в кишечнике — активная форма, а на выходе с фекальными массами — устойчивые цисты. Чтобы заразиться, достаточно проглотить десяток цист, которые в кишечнике опять перейдут в активную форму.
Главный секрет
повсеместности лямблий в изменчивости поверхностных белков. Организм человека борется с лямблиями антителами и, в принципе, способен выработать иммунитет. Но люди, живущие в одной и той же местности и пьющие одну и ту же воду, заражаются снова и снова потомками своих же паразитов. Почему? Потому что при переходе от активной фазы к цисте и обратно лямблия изменяет белки, к которым вырабатываются антитела, — вариант-специфичные поверхностные белки (variant-specific surface protein). В геноме есть около 190 вариантов этих белков, но на поверхности отдельного паразита всегда присутствует лишь один, трансляция остальных прерывается по механизму РНК-интерференции. А смена случается примерно раз на десять поколений.
В геноме есть около 190 вариантов этих белков, но на поверхности отдельного паразита всегда присутствует лишь один, трансляция остальных прерывается по механизму РНК-интерференции. А смена случается примерно раз на десять поколений.
Лечится метронидазолом. Болезнь проходит за неделю, но при инфицировании желчных протоков рецидивы возможны в течение многих лет. С цистами борются, иодируя воду.
Открыл Giardia lamblia в 1859 году чешский ученый Вилем Ламбль. С тех пор простейшее сменило несколько названий и нынешнее получило в честь первооткрывателя и французского паразитолога Альфреда Жиара, который лямблию не описывал.
А первую зарисовку лямблии сделал Антони ван Левенгук, обнаружив ее в собственном расстроенном стуле. Было это в 1681 году.
Кстати, лямблия еще и очень эволюционно древняя, происходит чуть ли не прямо от предка всех эукариот.
Самый интимный. Влагалищная трихомонада Trichomonas vaginalis.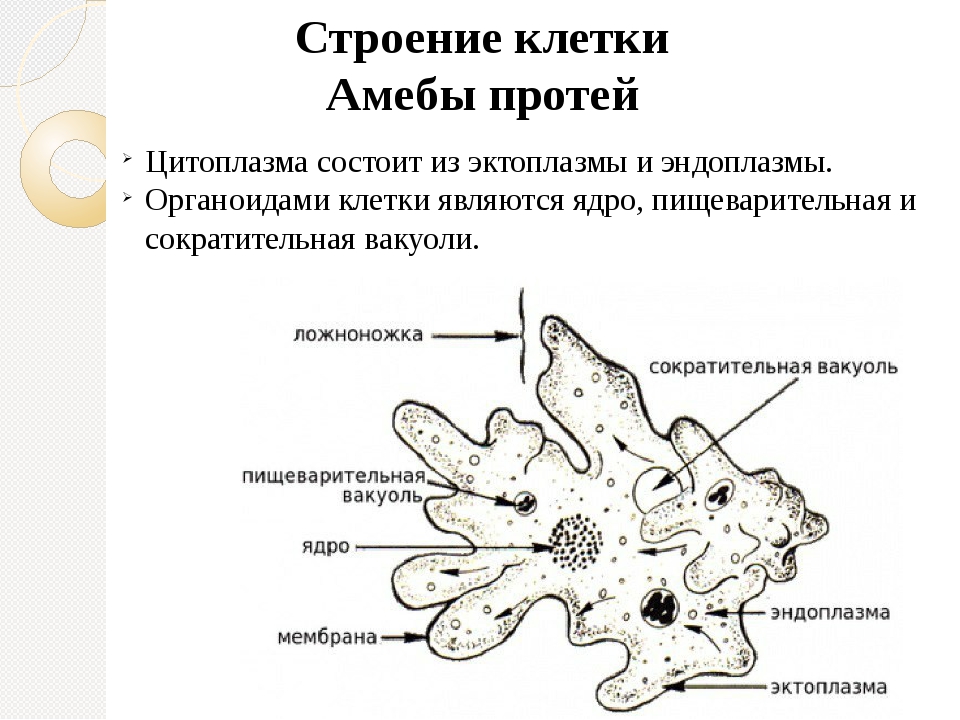
Простейшее, которое передается половым путем. Обитает во влагалище, а у мужчин — в мочеиспускательном канале, эпидидимисе и предстательной железе, передается половым путем или через влажные мочалки. Младенцы могут заразиться, проходя через родовые пути. У T. vaginalis 4 жгутика на переднем конце и относительно короткая ундулирующая мембрана, при необходимости он выпускает ложноножки. Максимальные размеры трихомонады — 32 на 12 мкм.
Трихомонада более распространена, чем возбудители хламидиоза, гонореи и сифилиса вместе взятые. Ей поражено около 10% женщин, а возможно и больше, и 1% мужчин. Последняя цифра недостоверна, потому что у мужчин сложнее обнаружить паразита.
T. vaginalis питается микроорганизмами, в том числе молочнокислыми бактериями вагинальной микрофлоры, которые поддерживают кислую среду, и таким образом создает оптимальный для себя рН выше 4.9.
Трихомонада разрушает клетки слизистой оболочки, вызывая воспаление.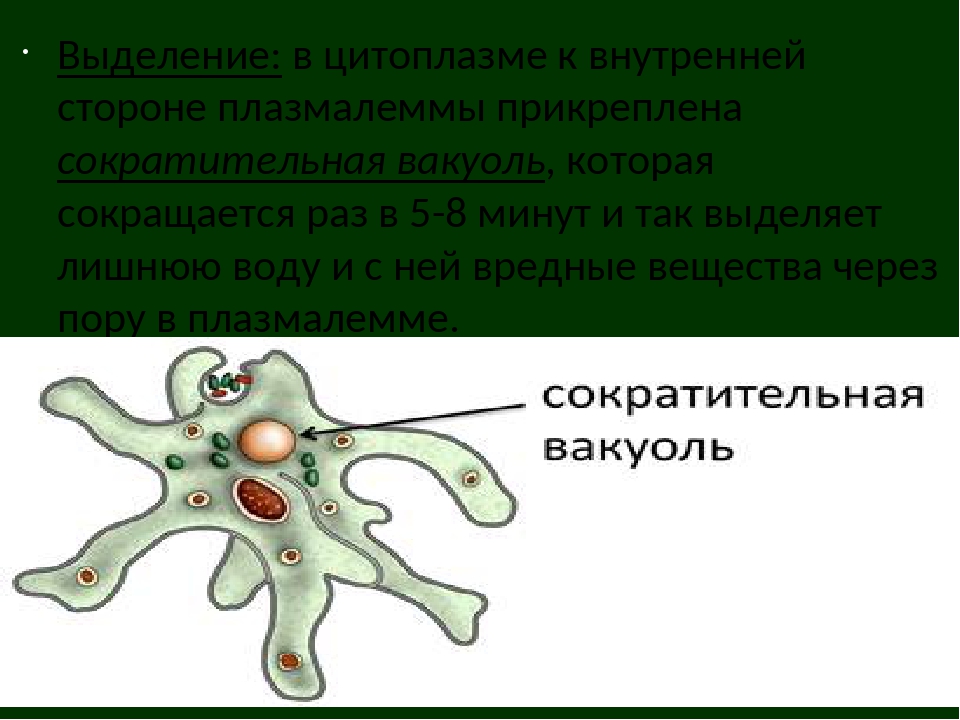 На симптомы жалуются около 15% инфицированных женщин.
На симптомы жалуются около 15% инфицированных женщин.
Лечится метронидазолом, но беременным он противопоказан. В качестве профилактики рекомендуют регулярные спринцевания разбавленным уксусом.
Описан в 1836 году французским бактериологом Альфредом Донне. Ученый не понял, что перед ним патогенный паразит, но определил размеры, внешность и тип движения простейшего.
Самый убийственный. Возбудитель сонной болезни Trypanosoma brucei
Возбудитель африканской сонной болезни — самое убийственное простейшее. Зараженный им человек без лечения умирает. Трипаносома — вытянутый жгутиконосец длиной 15—40 мкм. Известны два подвида, внешне неотличимые. Заболевание, вызванное T. brucei gambiense, длится 2—4 года. T. brucei rhodesiense — более вирулентный, возбудитель скоротечной формы, от которой умирают через несколько месяцев или недель.
Распространен в Африке, между 15-ми параллелями Южного и Северного полушарий, в естественном ареале переносчика — кровососущих насекомых рода Glossina (муха цеце). Из 31 вида мух для человека опасны 11. От сонной болезни страдает население 37 стран к югу от Сахары на 9 млн. км2. Ежегодно заболевает до 20 тыс. человек. Сейчас больных около 500 тыс., 60 млн. живут в зоне риска.
Из 31 вида мух для человека опасны 11. От сонной болезни страдает население 37 стран к югу от Сахары на 9 млн. км2. Ежегодно заболевает до 20 тыс. человек. Сейчас больных около 500 тыс., 60 млн. живут в зоне риска.
Из кишечника мухи T. brucei попадает в кровь человека, оттуда проникает в спинномозговую жидкость и поражает нервную систему. Болезнь начинается с лихорадки и воспаления лимфатических желез, затем следуют апатия, сонливость, мышечный паралич, истощение и необратимая кома.
Смертельность паразита связывают с его способностью преодолевать гематоэнцефалический барьер. Молекулярные механизмы до конца не изучены, но известно, что при проникновении в мозг паразит выделяет цистеиновые протеазы, а также использует некоторые белки хозяина. В центральной нервной системе, с другой стороны, трипаносома укрывается от иммунных факторов.
Первое описание сонной болезни в верховьях Нигера оставил арабский ученый ибн Хальдун (1332—1406).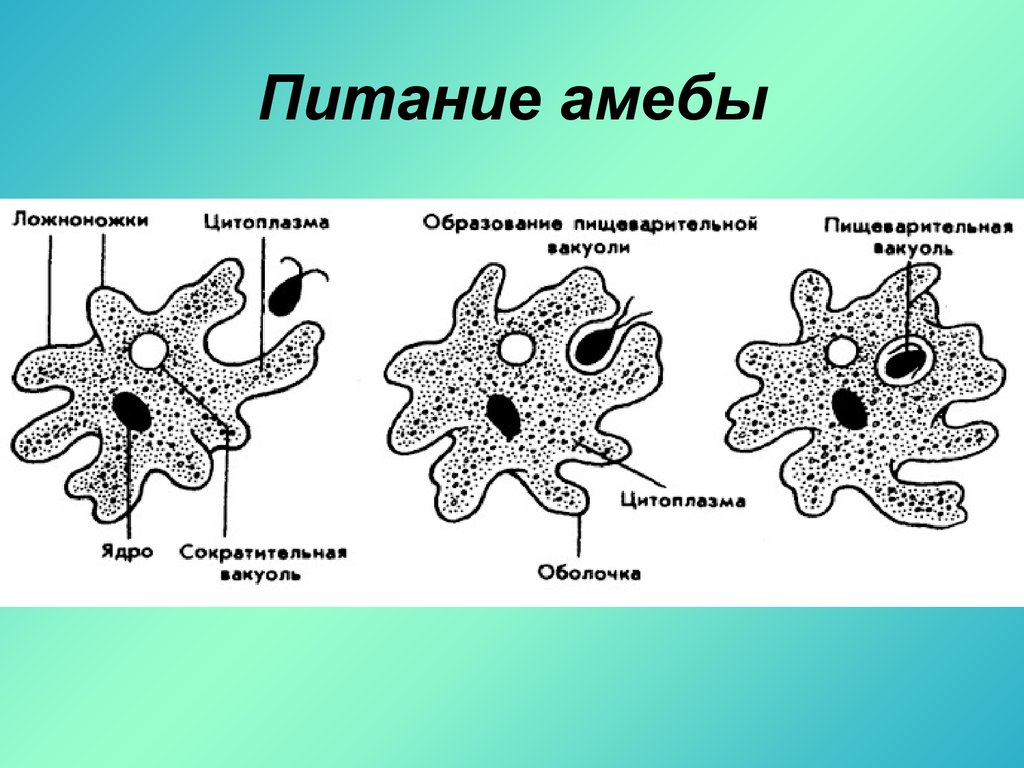 В начале XIX века европейцам был уже хорошо знаком начальный признак заболевания — вздутие лимфатических узлов на задней стороне шеи (симптом Уинтерботтома), и работорговцы обращали на него особое внимание.
В начале XIX века европейцам был уже хорошо знаком начальный признак заболевания — вздутие лимфатических узлов на задней стороне шеи (симптом Уинтерботтома), и работорговцы обращали на него особое внимание.
Открыл T. brucei шотландский микробиолог Дэвид Брюс, в честь которого она и названа, а в 1903 году он впервые установил связь между трипаносомой, мухой цеце и сонной болезнью.
Лечение зависит от стадии заболевания, лекарства вызывают тяжелые побочные эффекты. Паразит обладает высокой антигенной изменчивостью, поэтому вакцину создать невозможно.
Самый экстравагантный. Лейшмания Leishmania donovani
Лейшмании заслужили звание самых экстравагантных паразитов, потому что живут и размножаются в макрофагах — клетках, призванных паразитов уничтожать. L. donovani — самая опасная из них. Она вызывает висцеральный лейшманиоз, в просторечье лихорадку думдум, или кала-азар, от которой без лечения умирают почти все заболевшие. Зато выжившие приобретают длительный иммунитет.
Зато выжившие приобретают длительный иммунитет.
Существует три подвида паразита. L. donovani infantum (Средиземноморье и Средняя Азия) поражает в основном детей, его резервуаром часто служат собаки. L. donovani donovani (Индия и Бангладеш) опасен для взрослых и пожилых людей, природных резервуаров не имеет. Американский L. donovani chagasi (Центральная и Южная Америка) может жить в крови собак.
L. donovani — жгутиконосец не более 6 мкм в длину. Люди заражаются после укуса москитов рода Phlebotomus, иногда при половом контакте, младенцы — проходя через родовые пути. Попав в кровь, L. donovani проникают внутрь макрофагов, которые разносят паразита по внутренним органам. Размножаясь в макрофагах, паразит их разрушает. Молекулярный механизм выживания в макрофагах довольно сложен.
Симптомы заболевания — лихорадка, увеличение печени и селезенки, анемия и лейкопения, которые способствуют вторичной бактериальной инфекции. Ежегодно висцеральным лейшманиозом заболевает 500 тыс. человек и около 40 тыс. умирает.
Ежегодно висцеральным лейшманиозом заболевает 500 тыс. человек и около 40 тыс. умирает.
Лечение тяжелое — внутривенное введение препаратов сурьмы и переливание крови.
Таксономическую принадлежность L. donovani определил в 1903 году знаменитый исследователь малярии и нобелевский лауреат Рональд Росс. Родовым названием она обязана Уильяму Лейшману, а видовым — Чарльзу Доновану, которые в том же 1903 году независимо обнаружили клетки простейших в селезенке больных, умерших от кала-азара, один — в Лондоне, другой — в Мадрасе.
Самый сложный жизненный цикл. Babesia spp.
Бабезии, помимо многоступенчатого бесполого размножения в эритроцитах млекопитающего и полового в кишечнике клещей рода Ixodes, осложнили свое развитие трансовариальной передачей. Из кишечника самки клеща спорозоиты простейшего проникают в яичники и заражают эмбрионы. Когда личинки клещей вылупляются, бабезии переходят в их слюнные железы и с первым укусом входят в кровь позвоночного.
Распространены бабезии в Америке, Европе и Азии. Их природный резервуар — грызуны, собаки и крупный рогатый скот. Человека заражают несколько видов: B. microti, B. divergens, B. duncani и B. venatorum.
Симптомы бабезиоза напоминают малярию — периодическая лихорадка, гемолитическая анемия, увеличенные селезенка и печень. Большинство людей выздоравливает спонтанно, для больных с ослабленной иммунной системой бабезиозы фатальны.
Методы лечения еще разрабатывают, пока что прописывают курс клиндамицина с хинином, а в тяжелых случаях — переливание крови.
Описал бабезию румынский микробиолог Виктор Бабеш (1888), обнаруживший ее у больных коров и овец. Он решил, что имеет дело с патогенной бактерией, которую назвал Haematococcus bovis. Бабезию долго считали патогеном животных, пока не обнаружили ее в 1957 году у югославского пастуха, умершего от заражения B. divergens.
Самый влиятельный. Возбудитель токсоплазмоза Toxoplasma gondii
T. gondii — самый влиятельный паразит, поскольку управляет поведением промежуточных хозяев.
Распространен повсеместно, распределен неравномерно. Во Франции, например, заражено 84% жителей, в Соединенном Королевстве —22%.
Жизненный цикл токсоплазмы состоит из двух стадий: бесполая протекает в организме любых теплокровных, половое размножение возможно только в эпителиальных клетках кошачьего кишечника. Чтобы T. gondii могла завершить развитие, кошка должна съесть зараженного грызуна. Повышая вероятность этого события, T. gondii блокирует естественный страх грызунов перед запахом кошачьей мочи и делает его привлекательным, воздействуя на группу нейронов в миндалине. Как она это делает — неизвестно. Один из предполагаемых механизмов воздействия — локальный иммунный ответ на инфекцию. Он изменяет содержание цитокинов, что, в свою очередь, повышает уровень нейромодуляторов, таких как дофамин. Влияет токсоплазма и на поведение людей, что проявляется даже на популяционном уровне. Так, в странах с высоким уровнем токсоплазмоза чаще встречается невротизм и желание избегать неопределенных, новых ситуаций. Возможно, инфицированность T. gondii может привести к культурным изменениям.
Он изменяет содержание цитокинов, что, в свою очередь, повышает уровень нейромодуляторов, таких как дофамин. Влияет токсоплазма и на поведение людей, что проявляется даже на популяционном уровне. Так, в странах с высоким уровнем токсоплазмоза чаще встречается невротизм и желание избегать неопределенных, новых ситуаций. Возможно, инфицированность T. gondii может привести к культурным изменениям.
Инфекция у человека чаще протекает бессимптомно, но при ослабленном иммунитете разрушает клетки печени, легких, мозга, сетчатки, вызывая острый или хронический токсоплазмоз. Течение инфекции зависит от вирулентности штамма, состояния иммунной системы хозяина и его возраста — пожилые люди менее восприимчивы к T. gondii.
Лечат токсоплазмоз пириметамином и сульфадиазином.
Описан в 1908 году у пустынных грызунов. Эта честь принадлежит сотрудникам Института Пастера в Тунисе Шарлю Николю и Луису Мансо.
Самый патогенный. Малярийный плазмодий Plasmodium spр.
Малярийный плазмодий Plasmodium spр.
Малярийный плазмодий — самый патогенный паразит человека. Число больных малярией может достигать 300–500 млн., а смертность во время эпидемий — 2 млн. Болезнь до сих пор уносит в три раза больше жизней, чем вооруженные конфликты.
Малярию у человека вызывают пять видов плазмодия: Plasmodium vivax, P. falciparum, P. malariae, P. ovale и P. knowlesi, который поражает также макак.
Распространен в ареале переносчиков — комаров Anopheles, которым нужна температура 16–34°С и относительная влажность более 60%.
Сравнение генома самого вирулентного из плазмодиев, P. falciparum, с плазмодиями горилл, позволяет предполагать, что его предком люди заразились именно от этих обезьян. Возникновение этой формы плазмодия связывают с появлением сельского хозяйства в Африке, повлекшего за собой увеличение плотности населения и развитие оросительных систем.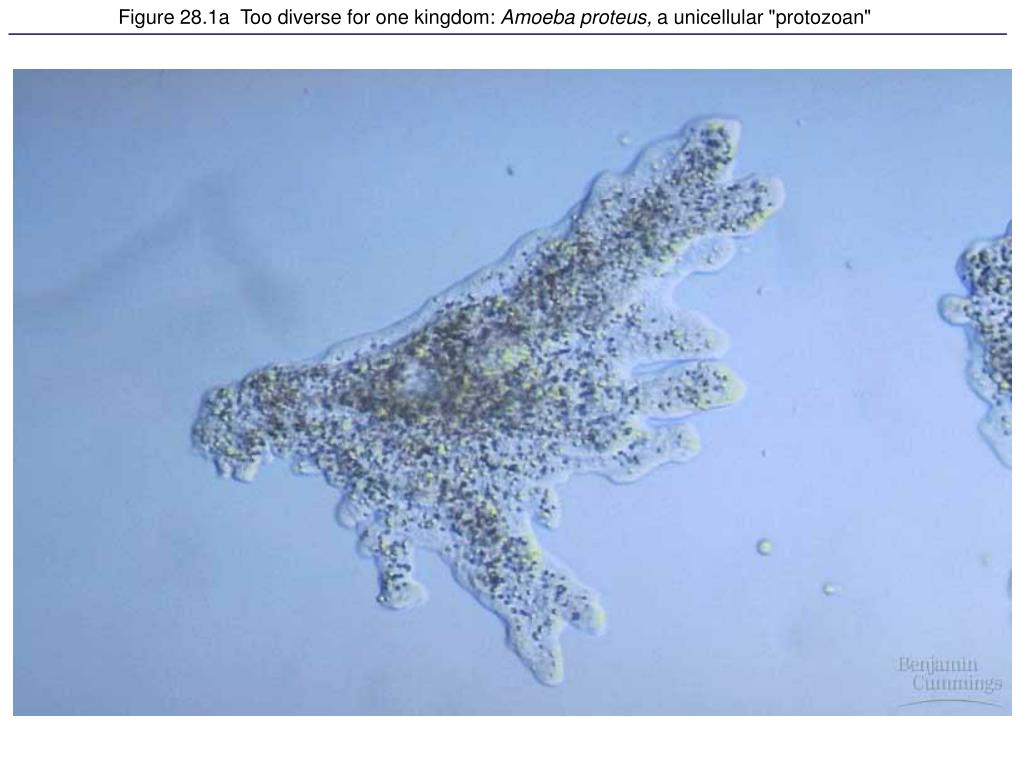
Половое размножение плазмодиев происходит в кишечнике комаров, а в организме человека это внутриклеточный паразит, который живет и размножается в гепатоцитах и эритроцитах до тех пор, пока клетки не лопаются. В 1 мл крови больного содержится 1 — 50 тыс. паразитов.
Болезнь проявляется как воспаление, периодическая лихорадка и анемия, в случае беременности опасна для матери и плода. Эритроциты, зараженные P. falciparum, закупоривают капилляры, и в тяжелых случаях развивается ишемия внутренних органов и тканей.
Лечение требует комбинации нескольких препаратов и зависит от конкретного возбудителя. Плазмодии приобретают устойчивость к лекарствам.
Американцы гибнут от пожирающей мозг водной амебы. Можно ли спастись от невидимой угрозы?
В США закрыли курорт для серфинга в Техасе после того, как побывавший там 29-летний мужчина умер от редкой болезни — амебного менингоэнцефалита. Выявить верный диагноз врачи смогли только после анализа спинно-мозговой жидкости. Причиной гибели стала амеба вида Неглерия Фоулера (Naegleria Fowleri), которая попадает в мозг человека через нос и съедает его. Можно ли уберечься от смертоносного одноклеточного и сколько еще скрытых угроз плещется в водной пучине — разбирался «360».
Выявить верный диагноз врачи смогли только после анализа спинно-мозговой жидкости. Причиной гибели стала амеба вида Неглерия Фоулера (Naegleria Fowleri), которая попадает в мозг человека через нос и съедает его. Можно ли уберечься от смертоносного одноклеточного и сколько еще скрытых угроз плещется в водной пучине — разбирался «360».
«Мама, голова болит»
Трагедия произошла в середине прошлого месяца. Фабрицио Стабиле (Fabrizio Stabile) 16 сентября косил газон на лужайке возле дома в Венторе, штат Нью-Джерси, когда почувствовал невыносимую головную боль. Он решил сделать перерыв и прилег отдохнуть, попросив у матери обезболивающее.
Врачи фиксируют вспышки менингита по всей России. Кто находится в зоне риска?
ПодробнееНа странице Фонда, созданного в память о нем и для информирования людей об опасности заболевания, сказано, что Фабрицио принял несколько пилюль и хорошенько выспался. Но в понедельник головная боль не прошла. Наоборот, он не смог связно объяснить матери, как себя чувствует, после чего она вызвала медиков.
Когда мужчину госпитализировали, то выявили отек мозга и лихорадку. Его стали лечить от бактериального менингита, но облегчения это не приносило. Его состояние ухудшалось.
Источник фото: gofundme.comМужчину тестировали на всевозможные вирусы, яды и инфекции, все тесты были отрицательными или неубедительными. И только на четвертый день, к 20 сентября, анализ спинно-мозговой жидкости выявил наличие амебы Naegleria Fowleri. Это стало сокрушительным для семьи и друзей известием, приговором, так как инфекция, вызываемая бактерией, смертельна для человека.
В США за последние 55 лет случаи амебного менингоэнцефалита, вызванного бактерией Naegleria Fowleri, фиксировались 143 раза. Смертность от этого заболевания — 98%. Когда диагноз удалось установить, было слишком поздно пытаться спасти Фабрицио.
В США известны трое выживших из пяти пациентов, которым успели ввести лекарство, которое к тому же не так просто достать. 21 сентября молодой мужчина скончался.
«Мы создали Фонд имени Фабрицио Стабиле, чтобы рассказать людям об опасности Naegleria Fowleri, чтобы привлечь внимание к болезни и помочь избежать этой редкой инфекции», — говорится в сообщении на странице по сбору средств на просветительскую деятельность. Из заявленных 50 тысяч долларов собрано более 24 тысяч.
Из заявленных 50 тысяч долларов собрано более 24 тысяч.
Пресноводные монстры
После гибели Фабрицио выяснилось, что в начале сентября он посещал парк водных развлечений и серфинга Surf Resort BSR Cable Park в Уэйко. Портал San Antonio Current сообщил, что собственник парка добровольно согласился его закрыть и сотрудничает со следствием после сообщения о гибели человека из-за водной бактерии.
Мертвая земля: как неубиваемый вирус сибирской язвы атакует людей
ПодробнееНа место, где был инфицирован Фабрицио, прибыли специалисты для забора проб воды. Инженер-эколог из Центра по контролю и профилактике заболеваний Миа Маттиоли (Mia Mattioli) побывала там в прошлый четверг, когда температура воздуха достигала +28 градусов. Она провела в аквапарке целый день, собирая пробы воды, чтобы выявить место обитания смертоносной амебы.
«Неглерия не любит холода, поэтому мы отправляем наши образцы воды на анализ, поддерживая в резервуарах комнатную температуру», — пояснила Миа.
Первичный амебный менингоэнцефалит — заболевание, вызываемое амебой Naegleria Fowleri. Первые симптомы очень похожи на грипп: сильная головная боль, жар. Миа уверена, что врачи Фабрицио вряд ли стали искать признаки менингита у пациента с сильной мигренью.
Китаец заразился вирусом птичьего гриппа H5N6
ПодробнееС 1962 года департамент здравоохранения США зарегистрировал только 143 случая заболевания. В среднем по стране в год — менее трех случаев. Последний был зарегистрирован в 2016 году.
«Фактически случай с Фабрицио — это первый раз, когда инфекция была обнаружена у жителя Нью-Джерси. Это заболевание более распространено в южных штатах, где вода более теплая», — сообщила государственный эпидемиолог Тина Тран, которая работала с врачами Фабрицио по выявлению места, где он мог заразиться.
На карте ниже — части США, где были зафиксированы случаи поражения людей бактерией с 1962-го по 2017 год. Желтым помечены штаты, где зафиксировали один случай; светло-оранжевым — 2-4 случая; темно-оранжевым — 5-9. Техас и Флорида являются штатами с более чем 10 эпизодами, а точнее — 35.
Эпидемиологи рассказывают, что амеба, которая вызывает смертельное заболевание мозга, распространена в пресной воде. Ее уже находили в озерах и реках на севере страны, в Миннесоте, где в 2010 году был зафиксирован первый случай заболевания: в бассейнах, аквапарках и муниципальных системах водоснабжения на юге США.
Исследователи в какой-то момент стали называть бактерию вездесущей и ожидают увеличения ареала ее распространения из-за глобального потепления.
Болезнь бедных и несчастных. Почему миллионы людей умирают от туберкулеза
ПодробнееУжас и парадокс смертоносной заразы в том, что питье воды, зараженной амебой, не смертельно и не приведет к заражению. Даже плавание в зараженной воде относительно безопасно. Чтобы представлять угрозу жизни человека, Неглериа Фоулера должна попасть в нос человека.
Так называемый факультативный паразит пробирается к мозгу по слизистой оболочке вдоль обонятельных нервов.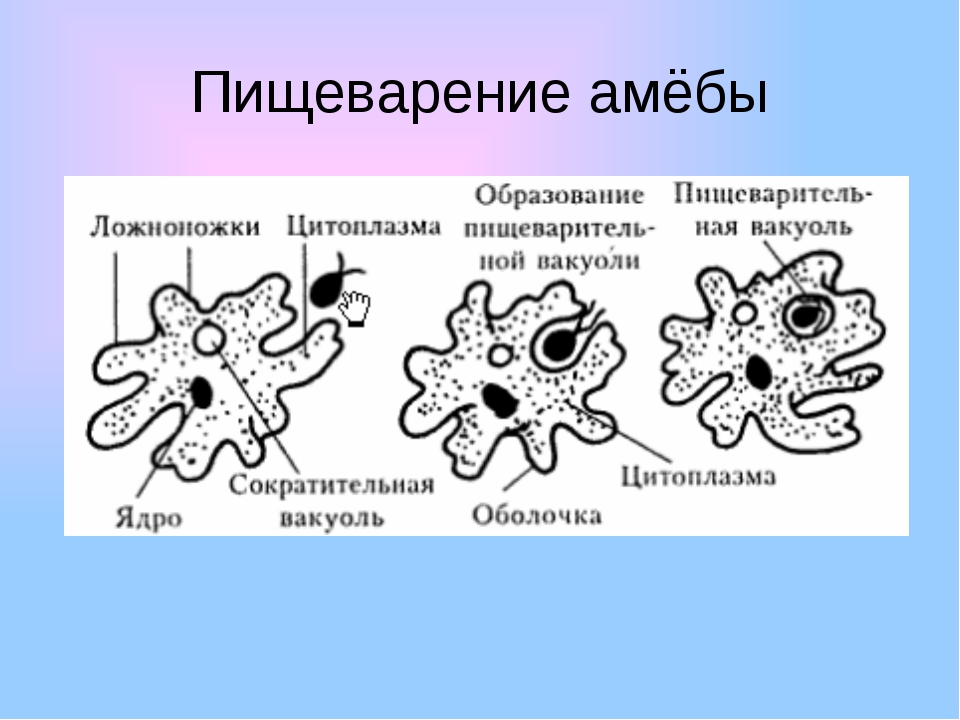 Затем поражает нервную систему, вызывая первичный амебный менингоэнцефалит. В ходе болезни амеба выделяет молекулы, разрушающие клетки мозга, и буквально пожирает ткань лобной доли мозга.
Затем поражает нервную систему, вызывая первичный амебный менингоэнцефалит. В ходе болезни амеба выделяет молекулы, разрушающие клетки мозга, и буквально пожирает ткань лобной доли мозга.
Симптомы заболевания проявляются в течение десяти дней после заражения. Как правило, за пять дней активной фазы болезни человек умирает. Без своевременного введения антидота.
Как защититься и спастись
Эпидемиолог Тина Тран подчеркивает, что инфекция и болезнь не передаются от человека к человеку. Кроме того, возможность подцепить Неглерию даже при 16 смертельных случаях в год (именно такую цифру указывают некоторые специалисты, уверяя, что Минздрав США недосчитывает погибших), у вас один шанс на 20 миллионов стать жертвой амебы.
«Вакцины от нее нет». Чем лихорадка Западного Нила грозит россиянам
ПодробнееВ США разрабатывают тесты для выявления в воде смертоносного одноклеточного, чтобы чиновники в регионах могли предупреждать людей об угрозе в случае, к примеру, резкого потепления.
В качестве средства лечения пока инфицированным Naegleria Fowleri пациентам дают милтефозин — экспериментальный препарат, который показал хорошие результаты в лечении амебного менингоэнцефалита.
В прошлом месяце исследователи из Калифорнийского университета в Сан-Диего объявили, что обнаружили три новые молекулярные мишени для лечения последствий попадания амебы в мозг и несколько препаратов, способных остановить ее распространение. Все препараты в ходе лабораторных испытаний были сильнее милтефозина.
«Это отправная точка, которая показывает, что мы можем найти более мощные соединения для борьбы с Naegleria Fowleri. Следующий шаг — подтвердить свои выводы на реальной модели инфекции, которую ученые также разработали в ходе поиска лекарства», — рассказал паразитолог из Калифорнийского университета в Сан-Диего и соавтор исследования Аньян Дебнат (Anjan Debnath).
Источник фото: pxhere.comСпециалисты-эпидемиологи отмечают, что бактериологические и инфекционные опасности скрывает в основном пресная вода в дикой природе: реки, озера, ручьи. Патогенные организмы в холодной воде практически не размножаются, но при +24 градусах, вода, особенно стоячая (болота, озера, лужи), начинает «цвести» микроорганизмами.
Патогенные организмы в холодной воде практически не размножаются, но при +24 градусах, вода, особенно стоячая (болота, озера, лужи), начинает «цвести» микроорганизмами.
Морская вода — богатая йодом и солью — большинство бактерий нейтрализует. Однако начеку следует быть в любой среде, стараться защищать рот и нос от попадания воды, а в случае малейшего недомогания после водных процедур — обращаться к врачу.
Другие пеломиксы: aspidisca — LiveJournal
Есть ещё несколько видов пеломикс, которые не влезли в предыдущую запись. Все они сейчас будут сворованы подвергнуты резервному сохранению с уже известного амёбского сайта, а то мало ли, денется куда-нибудь.Pelomyxa binucleata
В «Протистах» про этот вид сказано, что это просто мелкие экземпляры Pelomyxa palustris, которые были приняты за новый вид, но, судя по всему, позднее это было пересмотрено.
Ползущая амёба имеет форму от яйцевидной до сигарообразной, в зависимости от скорости движения. Гиалиновый уроид покрыт мелкими коническими выростами, с увеличением скорости он становится меньше.
 Медленно ползущая амёба может образовывать по бокам небольшие гиалиновые псевдоподии конической формы, при быстром движении имеется только узкий гиалиновый полумесяц на переднем конце клетки. Сидящая на месте амёба может принимать форму сферической фиговины без уроида, окружённой гиалиновым слоем с мелкими филоподиями.
Медленно ползущая амёба может образовывать по бокам небольшие гиалиновые псевдоподии конической формы, при быстром движении имеется только узкий гиалиновый полумесяц на переднем конце клетки. Сидящая на месте амёба может принимать форму сферической фиговины без уроида, окружённой гиалиновым слоем с мелкими филоподиями.Жгутики расположены по всей поверхности, обычно группами по 5 — 6 штук. Два одинаковых ядра с крупными центральными ядрышками «сложной пространственной организации». Структурных вакуолей мало. Цитоплазма всегда содержит много мелких преломляющих свет гранул размером примерно 3 мкм. Гранулы гликогена круглые, сплющенные, диаметром 10 — 15 мкм. Также рекомендуется обращать внимание на яркую контрастную окраску, которая для них характерна независимо от места обитания за счёт поедания зелёных водорослей, к тому же симбиотические бактерии часто окрашены в различные оттенки красного цвета. Бактерий визуально можно разделить на два типа, один имеет диаметр 1 мкм, а другой — не больше 0,5 мкм, длина у обоих типов колеблется от 3 до 30 мкм.

Длина амёбы при медленном передвижении 200 — 350 мкм, при быстром — 400 — 450, диаметр амёбы, принявшей сферическую форму, 150 — 300 мкм.
Является очень распространённым и часто встречающимся видом в донных отложениях любых стоячих и медленно текущих водоёмов на глубине 10 — 60 см, как летом, так и зимой.
Pelomyxa corona
Чаще всего сидят на месте и имеют круглую форму, цитоплазма ясно разделена на прозрачную однородную эктоплазму по краям и очень плотную эндоплазму в центре, содержащую ядра, пищеварительные вакуоли и включения. Вся поверхность амёбы покрыта гиалиновыми псевдоподиями разной конфигурации, которые могут ветвиться и часто имеют форму вилки. Ползущая амёба принимает обычную лимаксообразную форму, на заднем конце формируется уроид (видимо, не отделённый сужением от остальной клетки), покрытые мелкими почти одинаковыми цилиндрическими выростами.
Жгутики найдены не были, хотя в районе уроида можно иногда увидеть щетинки, которые могут быть жгутиками, а могут и не быть, точно не известно. Ядра круглые, с фрагментированным и рассеянным в основном по перифериии ядрышком. Чило ядер от 1 у молодых особей до 100 и больше у зрелых. Среди симбиотических бактерий можно различить три типа: крупные «расщеплённые» (что бы это ни значило), крупные эллиптические и более мелкие палочковидные. Там есть ещё кое-какие подробности насчёт расположения бактерий, но они от меня чё-то ускользают. Про структурные вакуоли ничего не сказано.
Ядра круглые, с фрагментированным и рассеянным в основном по перифериии ядрышком. Чило ядер от 1 у молодых особей до 100 и больше у зрелых. Среди симбиотических бактерий можно различить три типа: крупные «расщеплённые» (что бы это ни значило), крупные эллиптические и более мелкие палочковидные. Там есть ещё кое-какие подробности насчёт расположения бактерий, но они от меня чё-то ускользают. Про структурные вакуоли ничего не сказано.
Диаметр (для круглой формы) одноядерных особей 50 — 70, многоядерных — до 500 мкм.
Найдены на Северо-Западе России и в Нидерландах.
Ядро, окружённое бактериями:
Pelomyxa flava
Движущиеся особи имеют цилиндрическую форму. Цитоплазма прозрачная, кажущаяся жёлтой, жёлто-зелёной или коричневой из-за пищевых включений, выраженной гиалоплазмы нет. Клетки чаще всего двухъядерные, фрагментированное ядрышко располагается по периферии. Имеются подобающие пеламиксам неподвижные жгутики. Эндосимбионты представлены крупными палочковидными бактериями с явной «расщелиной» посередине (как у предыдущего вида, теперь понятно, что это такое) и двумя более мелкими палочковидными формами. Гранулы гликогена в количестве 30 — 40 штук более или менее яйцевидной формы, длиной 10 — 45 мкм. Про структурные вакуоли тоже ничего не говорят.
Гранулы гликогена в количестве 30 — 40 штук более или менее яйцевидной формы, длиной 10 — 45 мкм. Про структурные вакуоли тоже ничего не говорят.
От Pelomyxa binucleata отличается строением ядер и их (ядер) вдвое меньшим размером, а также отсутствием гиалиновой зоны.
Размер 100 — 300 мкм, диаметр ядра 19 — 23 мкм.
Ядро:
Очень большая добыча:
Pelomyxa gruberi
Во время движения принимают обычную для пеломикс вытянутую форму с хорошо выраженной гиалоплазмой и характерной более тонкой пальцевидной гиалиновой псевдоподией впереди. При делении могут образовывать розетки. Сидя на месте становятся округлыми, всегда облеплены частицами детрита. В жизненном цикле чередуются одноядерные и многоядерные (до 32) стадии. Ядра с одним центральным ядрышком. Бактерии двух видимых типов: уже два раза упоминавшиеся крупные с «расщелиной» и более мелкие палочковидные. Гликогеновых гранул не видно. Цвет цитоплазмы от светло-бежевого до тёмно-коричневого. Жгутики имеются, структурные вакуоли развиты слабо. Размер 80 — 350 мкм.
Жгутики имеются, структурные вакуоли развиты слабо. Размер 80 — 350 мкм.
Найдены на Северо-Западе России.
Жёлтыми стрелками показаны бактерии:
Фотография с другого сайта:
Упоминается ещё Pelomyxa prima, она больше всего походит на Pelomyxa gruberi, отличается большим числом ядер и более развитой системой вакуолей.
Серия учебников: Эволюционный перекресток в биологии развития: Dictyostelium discoideum
Развитие. 2011 1 февраля; 138(3): 387–396.
Primer Series
Колледж наук о жизни, Университет Данди, Данди, DD1 5EH, Великобритания.
Эта статья была процитирована другими статьями в PMC.Abstract
Dictyostelium discoideum принадлежит к группе многоклеточных форм жизни, которые также могут длительное время существовать в виде отдельных клеток. Эта способность переключаться между одноклеточной и многоклеточной делает группу идеальной для изучения генетических изменений, которые произошли на перекрестке между одноклеточной и многоклеточной жизнью. В этом учебнике я обсуждаю механизмы, которые контролируют многоклеточное развитие у Dictyostelium discoideum , и реконструирую, как некоторые из этих механизмов развились в результате реакции на стресс у одноклеточного предка.
В этом учебнике я обсуждаю механизмы, которые контролируют многоклеточное развитие у Dictyostelium discoideum , и реконструирую, как некоторые из этих механизмов развились в результате реакции на стресс у одноклеточного предка.
Ключевые слова: Эволюция многоклеточности, социальная амеба, инцистация, спороношение, диктиостелиум
введение тела, состоящие из стволовых клеток и спор (см. Глоссарий, вставка 1).Этот цикл развития является реакцией на голодание и включает в себя как хорошо скоординированное движение клеток, так и строго контролируемую программу клеточной дифференцировки. Социальные амебы принадлежат к надгруппе Amoebozoa (см. Глоссарий, вставка 1), сестринской группе клады Opisthokonts (см. Глоссарий, вставка 1), в которую входят животные и грибы. Все супергруппы содержат одноклеточные протистоподобные организмы (см. Глоссарий, вставка 1), а в некоторых группах многоклеточные формы жизни развились независимо (Minge et al.
 , 2009).
, 2009).Вставка 1. Глоссарий
Amoebozoa. Монофилетическая надгруппа эукариот, объединяющая лопастных амеб, пелобионтов, энтамебид, диктиостелид и миксогастрид.
Система Cre -loxP . Генетический инструмент для управления сайт-специфической рекомбинацией ДНК. Он состоит из фермента рекомбиназы Cre, который катализирует делецию нежелательных последовательностей ДНК, расположенных между последовательностями loxP . Последовательности loxP содержат специфические сайты связывания рекомбиназы Cre, где может происходить рекомбинация.
Инкапсулировать. Для создания защитной клеточной стенки.
Эпистаз. Генетические взаимодействия, при которых мутация одного гена маскирует фенотипические эффекты мутации в другом локусе.
Плодовое тело. Специализированная спорообразующая структура.
Опистоконты.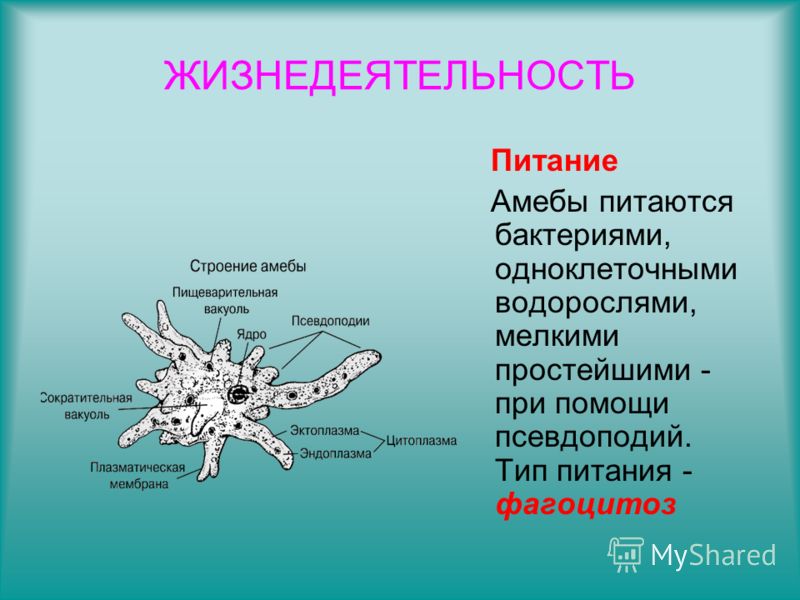 Широкая группа эукариот, включающая царства животных и грибов, а также некоторые группы эукариотических микроорганизмов, которые ранее относились к «царству» протистов.
Широкая группа эукариот, включающая царства животных и грибов, а также некоторые группы эукариотических микроорганизмов, которые ранее относились к «царству» протистов.
Осмоляльность. Концентрация раствора, выраженная в осмолях на килограмм растворителя.
Протист. Разнообразная группа преимущественно одноклеточных эукариот парафилетического происхождения, не имеющих между собой ничего общего, кроме относительно простой организации.
Протостелид. Парафилетическая коллекция амебозойных, образующих простые плодовые тела, состоящие из одной или нескольких спор на бесклеточной ножке.
Сенсор гистидинкиназы/фосфатазы. Белок, состоящий из сенсорной области, которая после связывания лиганда контролирует активность прикрепленного фермента гистидинкиназы/фосфатазы. После связывания лиганда этот фермент может проявлять либо аутофосфорилирование, либо аутодефосфорилирование остатка гистидина.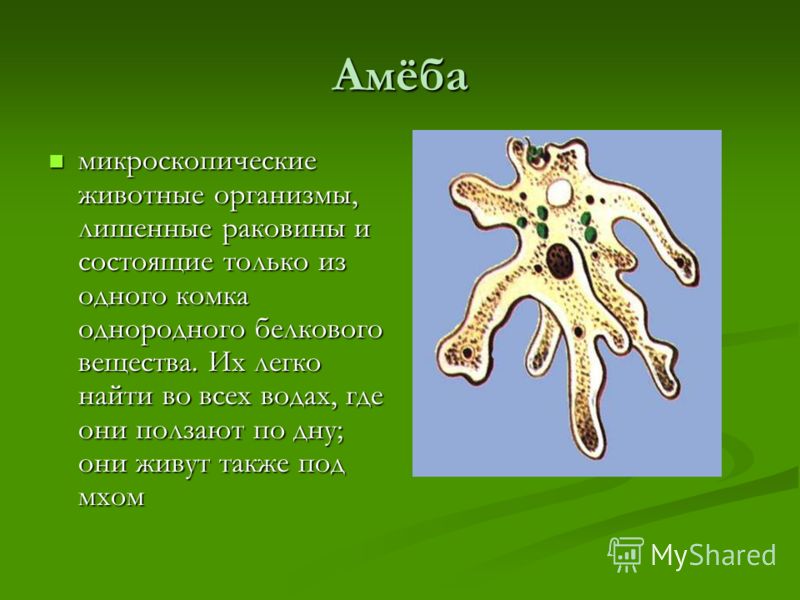
Спора. Спящая клеточная форма, обычно высушенная и окруженная эластичной стенкой, которая позволяет клетке пережить засуху, экстремальные температуры и отсутствие питания в течение длительного времени.
Стебель. Удлиненная опора или структура, которая у диктиостелид поддерживает массу спор.
Супергруппа. Одна из шести основных монофилетических групп эукариот.
Генетика супрессоров. Введение мутации, восстанавливающей фенотип дикого типа в организме с мутационно измененным генотипом.
Надгруппа Amoebozoa состоит в основном из одноклеточных амебоподобных организмов, имеющих простой жизненный цикл.Питающаяся амеба или трофозоит превращается в спящую цисту при недостатке пищи, засухе или других угрожающих жизни обстоятельствах (Cavalier-Smith et al., 2004). Несколько клад Amoebozoa дали начало протостелидоподобным организмам (см. Глоссарий, вставка 1), которые образуют очень простое плодовое тело (см. Глоссарий, вставка 1), состоящее из одной споры, сидящей на простой ножке, образованной одним и тем же клетка (Shadwick et al., 2009). Однако только Dictyostelia способны образовывать многоклеточные плодовые тела, содержащие до миллиона клеток ().
Глоссарий, вставка 1), состоящее из одной споры, сидящей на простой ножке, образованной одним и тем же клетка (Shadwick et al., 2009). Однако только Dictyostelia способны образовывать многоклеточные плодовые тела, содержащие до миллиона клеток ().
Жизненный цикл Dictyostelium discoideum . ( A ) Голодные D. discoideum амебы выделяют импульсы циклического аденозинмонофосфата (цАМФ, обозначены серыми кольцами), которые ( B ) вызывают хемотаксическую агрегацию клеток в холмики. Клетки холмика движутся вверх в ответ на продолжающуюся эмиссию цАМФ с его вершины ( C ), вызывая образование холмика с вершиной. В этих холмиках начинается дифференцировка клеток на два типа клеток, преспоры и предстебли А.( D ) Насыпь затем образует слизь, в которой происходит дальнейшая дифференциация клеток в предстеблевые клетки О, В и АВ. ( E ) Затем слизень падает и начинает мигрировать. ( F ) Наконец, он подвергается формированию плодового тела, во время которого различные типы клеток мигрируют в определенные места в плодовом теле и ( G ) в конечном итоге дифференцируются в споры, клетки стебля и структуры, поддерживающие стебель и головку споры. . ( H ) После распространения в богатые питательными веществами места обитания споры прорастают и ( I ) возобновляют размножение в виде отдельных амеб.Изменено с разрешения Schaap, 2007 (Schaap, 2007).
( F ) Наконец, он подвергается формированию плодового тела, во время которого различные типы клеток мигрируют в определенные места в плодовом теле и ( G ) в конечном итоге дифференцируются в споры, клетки стебля и структуры, поддерживающие стебель и головку споры. . ( H ) После распространения в богатые питательными веществами места обитания споры прорастают и ( I ) возобновляют размножение в виде отдельных амеб.Изменено с разрешения Schaap, 2007 (Schaap, 2007).
Известно около 120 видов Dictyostelia , и молекулярная филогения была построена, чтобы выявить порядок их эволюции (Schaap et al., 2006). Филогения подразделяет виды на четыре основные группы (), при этом модельная социальная амеба Dictyostelium discoideum принадлежит к последней дивергировавшейся группе 4. Многие виды в группах 1-3 все еще могут инцистироваться как отдельные клетки, когда условия неблагоприятны для агрегации. Однако виды группы 4 утратили способность к инцистированию. Поразительно, что все протестированные виды группы 4 выделяют циклический аденозинмонофосфат (цАМФ), который действует как хемоаттрактант для агрегации. Это очень необычно, потому что почти все другие организмы используют только цАМФ внутри клетки для передачи эффекта других секретируемых стимулов, таких как гормоны, факторы спаривания и нейротрансмиттеры. Ни один из видов в группах 1-3 не использует цАМФ для агрегации; некоторые используют глорин, модифицированный дипептид глутамата и орнитина, тогда как другие используют фолиевую кислоту, птерин или другие пока не идентифицированные хемоаттрактанты (Schaap et al., 2006).
Однако виды группы 4 утратили способность к инцистированию. Поразительно, что все протестированные виды группы 4 выделяют циклический аденозинмонофосфат (цАМФ), который действует как хемоаттрактант для агрегации. Это очень необычно, потому что почти все другие организмы используют только цАМФ внутри клетки для передачи эффекта других секретируемых стимулов, таких как гормоны, факторы спаривания и нейротрансмиттеры. Ни один из видов в группах 1-3 не использует цАМФ для агрегации; некоторые используют глорин, модифицированный дипептид глутамата и орнитина, тогда как другие используют фолиевую кислоту, птерин или другие пока не идентифицированные хемоаттрактанты (Schaap et al., 2006).
Филогения Dictyostelia . Все известные виды социальных амеб можно разделить на четыре основные группы на основании филогенетического анализа их последовательностей рибосомной РНК малых субъединиц (Schaap et al., 2006). Группа 1 (красная) наиболее тесно связана с одиночными предками амебозойных. Группы 1-3 сохранили наследственную стратегию выживания инцистирования отдельных амеб. Эта стратегия утрачена в группе 4 (фиолетовый), самой последней дивергентной группе, которая содержит модельный организм D.дискоидеум . Виды группы 4 также демонстрируют другие особенности, такие как использование циклического аденозинмонофосфата (цАМФ) в качестве хемоаттрактанта и клеточной поддержки плодового тела, которые не проявляются (или редко) проявляются видами в группах 1-3. Цветные стрелки указывают на виды с полностью секвенированным геномом. Секвенирование генома D. lacteum (группа 3, обозначено пунктирной стрелкой) все еще продолжается. Масштабная линейка: 0,1 замены на сайт. Толщина линий ветвей коррелирует с вероятностью того, что узлы, соединяющие непосредственных потомков, являются правильными, как определено байесовским выводом (Ronquist and Huelsenbeck, 2003).Изменено с разрешения Schaap et al. (Шаап и др., 2006).
Группы 1-3 сохранили наследственную стратегию выживания инцистирования отдельных амеб. Эта стратегия утрачена в группе 4 (фиолетовый), самой последней дивергентной группе, которая содержит модельный организм D.дискоидеум . Виды группы 4 также демонстрируют другие особенности, такие как использование циклического аденозинмонофосфата (цАМФ) в качестве хемоаттрактанта и клеточной поддержки плодового тела, которые не проявляются (или редко) проявляются видами в группах 1-3. Цветные стрелки указывают на виды с полностью секвенированным геномом. Секвенирование генома D. lacteum (группа 3, обозначено пунктирной стрелкой) все еще продолжается. Масштабная линейка: 0,1 замены на сайт. Толщина линий ветвей коррелирует с вероятностью того, что узлы, соединяющие непосредственных потомков, являются правильными, как определено байесовским выводом (Ronquist and Huelsenbeck, 2003).Изменено с разрешения Schaap et al. (Шаап и др., 2006).
В этом учебнике для начинающих я сначала объясню преимущества проведения исследований на этой модели организма и расскажу о методах, которые привели к основным достижениям в этой области. Затем я представляю
Затем я представляю
обзор модельного организма D. discoideum и систем клеточных коммуникаций, которые контролируют клеточную дифференцировку и морфогенетическое движение клеток во время его развития в многоклеточные плодовые тела.Наконец, я обсуждаю, как важные коммуникационные системы, которые использует D. discoideum , развились из реакции на стресс у их одноклеточного предка, и как разработка этой исходной реакции способствовала эволюции многоклеточности у Dictyostelia .
Экспериментальные преимущества работы с социальными амебами
D. discoideum поддается широкому спектру экспериментальных и генетических подходов. Все известные видов Dictyostelia , в том числе видов D.discoideum , можно культивировать в лаборатории на бактериальных газонах на агаре, а несколько видов можно выращивать в виде массовых культур в жидких средах, содержащих глюкозу и пептон, или в определенной смеси аминокислот и витаминов. Это значительно облегчает выделение и очистку клеточных продуктов для биохимического анализа и протеомики, а также позволяет использовать различные аналитические процедуры в исследованиях, которые зависят от изотопной маркировки клеточных компонентов.
Это значительно облегчает выделение и очистку клеточных продуктов для биохимического анализа и протеомики, а также позволяет использовать различные аналитические процедуры в исследованиях, которые зависят от изотопной маркировки клеточных компонентов.
Жизненный цикл D. discoideum (как более подробно обсуждается ниже) длится всего 24 часа, как и у большинства видов Dictyostelia . Его многоклеточные структуры также прозрачны, что позволяет визуализировать движение клеток и экспрессию генов с помощью широкого спектра флуоресцентных, ферментативных или антигенных белковых меток или путем гибридизации in situ (Gerisch and Muller-Taubenberger, 2003; Maeda et al. ., 2003).
Как D. discoideum , так и виды группы 2 Polysphondylium pallidum могут быть трансформированы плазмидными векторами, а интересующие гены могут быть изменены или нокаутированы путем гомологичной рекомбинации (вставка 2).При необходимости несколько генов могут быть нарушены в потенциально бесконечной последовательности путем вырезания селектируемого маркера после разрушения гена с помощью системы Cre- loxP (см. Glossary, Box 1) (Faix et al., 2004). Гены могут быть экспрессированы под конститутивными или индуцибельными промоторами с различными метками для визуализации или очистки родственного белка. Новые гены в важных процессах также могут быть идентифицированы с помощью меченого мутагенеза (вставка 2), а сложные пути и процессы могут быть раскрыты с помощью эпистаза и супрессорной генетики (см. Глоссарий, вставка 1) (Kuspa and Loomis, 1992; Shaulsky et al., 1996). Геном D. discoideum полностью секвенирован (Eichinger et al., 2005), и на ресурсе сообщества Dictybase (http://dictybase.org/) доступен браузер генома с отобранными и аннотированными моделями генов. Этот ресурс также содержит большую коллекцию из видов Dictyostelium , мутантов и плазмидных конструкций, которые бесплатно предоставляются сообществу.
Glossary, Box 1) (Faix et al., 2004). Гены могут быть экспрессированы под конститутивными или индуцибельными промоторами с различными метками для визуализации или очистки родственного белка. Новые гены в важных процессах также могут быть идентифицированы с помощью меченого мутагенеза (вставка 2), а сложные пути и процессы могут быть раскрыты с помощью эпистаза и супрессорной генетики (см. Глоссарий, вставка 1) (Kuspa and Loomis, 1992; Shaulsky et al., 1996). Геном D. discoideum полностью секвенирован (Eichinger et al., 2005), и на ресурсе сообщества Dictybase (http://dictybase.org/) доступен браузер генома с отобранными и аннотированными моделями генов. Этот ресурс также содержит большую коллекцию из видов Dictyostelium , мутантов и плазмидных конструкций, которые бесплатно предоставляются сообществу.
Вставка 2. Генетические подходы, доступные в Dictyostelia
В D можно использовать как обратный, так и прямой генетический подход.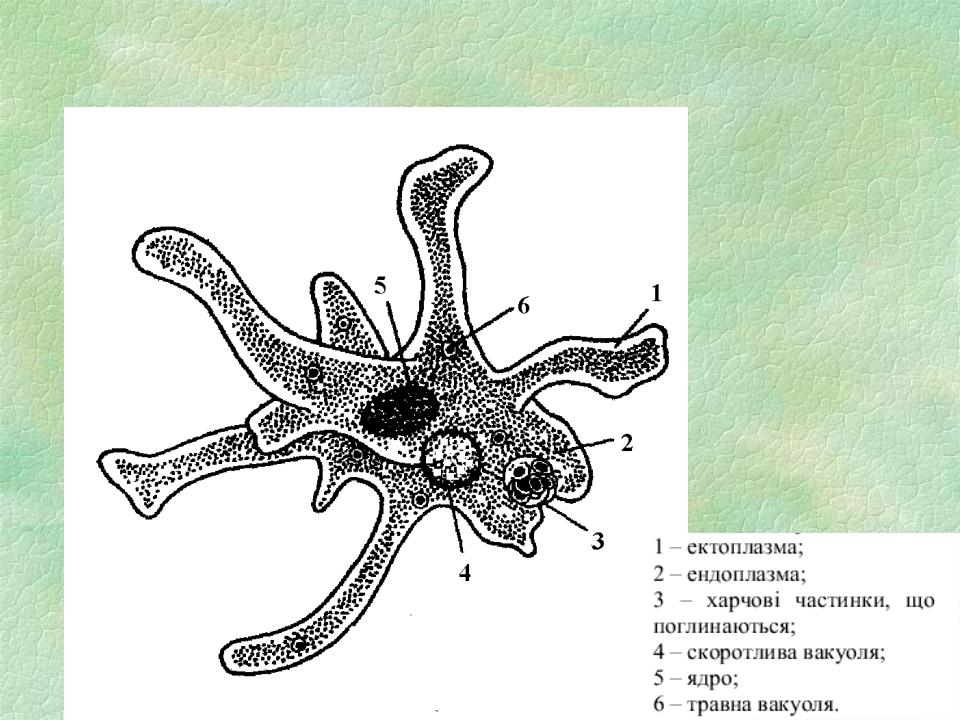 discoideum и в группе 2 вид P. pallidum. У обоих этих видов гены можно нокаутировать с помощью стандартного подхода гомологичной рекомбинации. Популяции меченых мутантов также могут быть получены путем опосредованной рестрикционными ферментами интеграции плазмидных векторов (REMI) (Kuspa and Loomis, 1992). Как показано на прилагаемом рисунке, бактериальная плазмида, несущая кассету селекции бластицидина (BsR), в дополнение к собственному источнику репликации (ori) и кассете устойчивости к ампициллину (AmpR), линеаризуется рестрикционным ферментом (таким как Bam Привет).Затем эту конструкцию электропорируют в клетки Dictyostelium вместе с Bam HI или ферментом, который производит такие же липкие концы. Фермент создает разрезы в геномной ДНК, которые восстанавливаются лигазами внутри клетки, что иногда приводит к вставке плазмиды и образованию мутанта. Клетки, несущие плазмидные вставки, отбирают путем роста в присутствии бластицидина, а затем могут подвергаться скринингу на мутантные фенотипы путем прямого наблюдения или с использованием ряда протоколов селекции.
discoideum и в группе 2 вид P. pallidum. У обоих этих видов гены можно нокаутировать с помощью стандартного подхода гомологичной рекомбинации. Популяции меченых мутантов также могут быть получены путем опосредованной рестрикционными ферментами интеграции плазмидных векторов (REMI) (Kuspa and Loomis, 1992). Как показано на прилагаемом рисунке, бактериальная плазмида, несущая кассету селекции бластицидина (BsR), в дополнение к собственному источнику репликации (ori) и кассете устойчивости к ампициллину (AmpR), линеаризуется рестрикционным ферментом (таким как Bam Привет).Затем эту конструкцию электропорируют в клетки Dictyostelium вместе с Bam HI или ферментом, который производит такие же липкие концы. Фермент создает разрезы в геномной ДНК, которые восстанавливаются лигазами внутри клетки, что иногда приводит к вставке плазмиды и образованию мутанта. Клетки, несущие плазмидные вставки, отбирают путем роста в присутствии бластицидина, а затем могут подвергаться скринингу на мутантные фенотипы путем прямого наблюдения или с использованием ряда протоколов селекции. Мутированный ген идентифицируют путем разрезания геномной ДНК подходящим ферментом ( Cla I в этом примере), циркуляризации всех фрагментов путем лигирования и введения фрагментов в Escherichia coli. Рост в присутствии ампициллина отбирает те бактерии, которые содержат плазмиду, которая затем секвенируется для идентификации фрагмента гена Dictyostelium . Затем плазмиду можно повторно ввести в Dictyostelium , где она должна воспроизвести мутантный фенотип после гомологичной рекомбинации.
Мутированный ген идентифицируют путем разрезания геномной ДНК подходящим ферментом ( Cla I в этом примере), циркуляризации всех фрагментов путем лигирования и введения фрагментов в Escherichia coli. Рост в присутствии ампициллина отбирает те бактерии, которые содержат плазмиду, которая затем секвенируется для идентификации фрагмента гена Dictyostelium . Затем плазмиду можно повторно ввести в Dictyostelium , где она должна воспроизвести мутантный фенотип после гомологичной рекомбинации.
Благодаря этой экспериментальной податливости D. discoideum стал одним из передовых организмов для изучения фундаментальных процессов в клеточной биологии, таких как хемотаксис, цитокинез, фагоцитоз, перенос везикул, подвижность клеток и передача сигналов. Он проложил путь к идентификации компонентов, которые составляют и контролируют систему актиновых микрофиламентов, и оказался чрезвычайно эффективным в визуализации того, как эти компоненты динамически взаимодействуют друг с другом во время хемотаксиса, фагоцитоза и цитокинеза (Cosson and Soldati, 2008; Shina et al. , 2010; Суони и др., 2010 г.; Чжан и др., 2008). Геном D. discoideum содержит множество ортологов генов, дефектных при ряде заболеваний человека, и становится популярной моделью для изучения того, как такие дефекты влияют на нормальное поведение клеток (Williams et al., 2006). Организм также лидирует в понимании того, как контролируемое движение клеток взаимодействует с
, 2010; Суони и др., 2010 г.; Чжан и др., 2008). Геном D. discoideum содержит множество ортологов генов, дефектных при ряде заболеваний человека, и становится популярной моделью для изучения того, как такие дефекты влияют на нормальное поведение клеток (Williams et al., 2006). Организм также лидирует в понимании того, как контролируемое движение клеток взаимодействует с
регулируемой дифференцировкой клеток для создания формы и паттерна во время многоклеточного развития (Kimmel and Firtel, 2004; Weijer, 2009; Williams, 2006).
Среда обитания и жизненный цикл
Dictyostelia Социальные амебы Dictyostelia встречаются в широком диапазоне почвенных местообитаний, от арктических до тропических регионов и от пустынь до тропических лесов. Они наиболее распространены в опавшей листве тропических и умеренных лесов, которая является самым богатым источником их бактериальной пищи (Swanson et al., 1999). Отдельные виды могут использовать одну из трех стратегий выживания, когда пища заканчивается. (1) Они могут инкапсулироваться (см. Глоссарий, вставка 1) по отдельности, образуя спящую кисту, называемую микроцистой.Этот процесс предпочтителен в темных и влажных условиях или при высоком уровне аммиака или осмоляльности (см. Глоссарий, вставка 1) (Raper, 1984). (2) Они могут сливаться, образуя зиготу. Обычно для этого требуются амебы противоположных типов спаривания. Затем зигота притягивает и поглощает окружающих амеб и использует их ресурсы для создания сферы с толстыми стенками, макроцисты. Этот половой жизненный цикл также происходит в темных и влажных условиях и запускается этиленом, вырабатываемым клетками (Amagai et al., 2007).(3) Они могут собираться вместе, образуя плодовую структуру, в которой часть клеток жертвуется для построения стебля, а оставшаяся часть дифференцируется в устойчивые спящие споры. Этот многоклеточный жизненный цикл () является общим для всех диктиостелид . Он состоит из взаимосвязанной программы клеточного движения и дифференцировки клеток и интенсивно изучался на модельном организме D.
(1) Они могут инкапсулироваться (см. Глоссарий, вставка 1) по отдельности, образуя спящую кисту, называемую микроцистой.Этот процесс предпочтителен в темных и влажных условиях или при высоком уровне аммиака или осмоляльности (см. Глоссарий, вставка 1) (Raper, 1984). (2) Они могут сливаться, образуя зиготу. Обычно для этого требуются амебы противоположных типов спаривания. Затем зигота притягивает и поглощает окружающих амеб и использует их ресурсы для создания сферы с толстыми стенками, макроцисты. Этот половой жизненный цикл также происходит в темных и влажных условиях и запускается этиленом, вырабатываемым клетками (Amagai et al., 2007).(3) Они могут собираться вместе, образуя плодовую структуру, в которой часть клеток жертвуется для построения стебля, а оставшаяся часть дифференцируется в устойчивые спящие споры. Этот многоклеточный жизненный цикл () является общим для всех диктиостелид . Он состоит из взаимосвязанной программы клеточного движения и дифференцировки клеток и интенсивно изучался на модельном организме D. discoideum .
discoideum .
От одноклеточной амебы до плодового тела
В процессе роста одноклеточные D.discoideum амебы контролируют плотность своих клеток относительно плотности их бактериального источника пищи, секретируя с постоянной скоростью гликопротеин, называемый фактором предварительного голодания (PSF). Когда отношение PSF к таковому у бактерий превышает определенный порог, клетки перестают пролиферировать и инициируют экспрессию генов, необходимых для их агрегации (Clarke, Gomer, 1995). На ранних стадиях агрегации экспрессия генов требует активности цАМФ-зависимой протеинкиназы (PKA) (Schulkes and Schaap, 1995), и считается, что высокое соотношение PSF и пищи активирует трансляцию каталитической субъединицы PKA-C (Souza и другие., 1999; Соуза и др., 1998).
Второй гликопротеин, CMF (фактор кондиционированной среды), секретируется во время голодания. CMF стимулирует экспрессию генов параллельно с PSF, и оба сигнала усиливают передачу сигналов цАМФ, индуцируя гены, участвующие в синтезе и обнаружении цАМФ (Clarke and Gomer, 1995; Deery and Gomer, 1999). Например, среди недавно активированных генов есть гены, кодирующие аденилатциклазу А (ACA, которая синтезирует цАМФ), рецепторы цАМФ (cARs, рецепторы, связанные с G-белком, которые обнаруживают цАМФ) и внеклеточную цАМФ-фосфодиэстеразу PdsA (которая гидролизует цАМФ).Эти белки вместе с PKA и RegA, внутриклеточной цАМФ-фосфодиэстеразой с регулятором ответа, образуют биохимическую сеть, которая генерирует импульсы цАМФ (Laub and Loomis, 1998).
Например, среди недавно активированных генов есть гены, кодирующие аденилатциклазу А (ACA, которая синтезирует цАМФ), рецепторы цАМФ (cARs, рецепторы, связанные с G-белком, которые обнаруживают цАМФ) и внеклеточную цАМФ-фосфодиэстеразу PdsA (которая гидролизует цАМФ).Эти белки вместе с PKA и RegA, внутриклеточной цАМФ-фосфодиэстеразой с регулятором ответа, образуют биохимическую сеть, которая генерирует импульсы цАМФ (Laub and Loomis, 1998).
Как только эти белки начинают функционировать, несколько голодающих клеток начинают излучать импульсы цАМФ (). Окружающие клетки реагируют, двигаясь к источнику цАМФ и передавая импульс более удаленным клеткам. Хемотаксис и передача сигнала вместе вызывают быструю агрегацию клеток в многоклеточные бугорки (4).Верх холмика продолжает излучать импульсы цАМФ и выталкивается вверх за счет движения клеток под ним (Siegert and Weijer, 1995). Появляющийся столбец клеток опрокидывается и теперь называется «слаг» (). Руководствуясь сигналами, такими как свет и тепло, слизень мигрирует к верхнему слою почвы, где приступает к формированию структуры плодоношения () (Боннер и Ламонт, 2005). Эта структура () состоит из сужающегося столбца клеток стебля, который несет наверху сферическую массу спор. Стебель поддерживается базальным диском, а соскальзывание споровой массы вниз по стеблю предотвращается фланкирующими опорными структурами, которые называются верхней и нижней чашечками ().
Эта структура () состоит из сужающегося столбца клеток стебля, который несет наверху сферическую массу спор. Стебель поддерживается базальным диском, а соскальзывание споровой массы вниз по стеблю предотвращается фланкирующими опорными структурами, которые называются верхней и нижней чашечками ().
Предположительные клетки стебля и споры можно распознать уже в агрегате, где они сначала кажутся вкраплениями недифференцированных клеток (Ozaki et al., 1993; Thompson et al., 2004). Преспоровые клетки становятся менее хемотаксически чувствительными к цАМФ (Matsukuma and Durston, 1979; Traynor et al., 1992) за счет снижения экспрессии определенных белков, таких как cAR1 и PdsA, которые необходимы для создания и восприятия крутых хемотаксических градиентов (Schaap и Spek, 1984; Weening et al., 2003). Это заставляет предстеблевые клетки избирательно перемещаться к колеблющемуся кончику (1). При формировании плодового тела предстебельные клетки сначала откладывают центральную целлюлозную трубку. Затем они заползают в трубку и дифференцируются в клетки стебля. Этот процесс дифференцировки включает массивную вакуолизацию клеток и построение клеточной стенки из целлюлозы (Raper and Fennell, 1952). Тем временем предспоровые клетки синтезировали первый слой стенки споры и дополнительные предшественники стенки споры в предспоровых везикулах, происходящих от Гольджи.Преспоровые клетки взбираются вверх по новообразованному стеблю и инициируют образование спор путем быстрого слияния предспоровых пузырьков с плазматической мембраной. Затем оставшаяся часть стенки спор синтезируется in situ из секретируемых предшественников (West, 2003).
Затем они заползают в трубку и дифференцируются в клетки стебля. Этот процесс дифференцировки включает массивную вакуолизацию клеток и построение клеточной стенки из целлюлозы (Raper and Fennell, 1952). Тем временем предспоровые клетки синтезировали первый слой стенки споры и дополнительные предшественники стенки споры в предспоровых везикулах, происходящих от Гольджи.Преспоровые клетки взбираются вверх по новообразованному стеблю и инициируют образование спор путем быстрого слияния предспоровых пузырьков с плазматической мембраной. Затем оставшаяся часть стенки спор синтезируется in situ из секретируемых предшественников (West, 2003).
цАМФ регуляция образования плодовых тел
Исследования 1980-х годов показали, что внеклеточный цАМФ действует на цАР, вызывая дифференцировку предспор в агрегатах (Schaap and Van Driel, 1985; Wang et al., 1988). В 1990-х годах стало ясно, что, помимо внеклеточного цАМФ, внутриклеточный цАМФ, действующий на PKA, также необходим для дифференцировки преспор и, кроме того, важен для созревания спор и стебля и для контроля прорастания спор (Harwood et al. , 1992; Хоппер и др., 1993; Ван Эс и др., 1996). Для созревания стебля и спор цАМФ продуцируется аденилатциклазой R (ACR), тогда как цАМФ для индукции дифференцировки преспор и контроля прорастания спор продуцируется аденилатциклазой G (ACG) (Soderbom et al., 1999; Van Es et al. ., 1996; Альварез-Курто и др., 2007). ACR содержит семь трансмембранных доменов и встроен в ядерную мембрану предстебельковых клеток (Soderbom et al., 1999; Alvarez-Curto et al., 2007; Chen et al., 2011).ACG содержит два трансмембранных домена, которые отделяют сенсорный домен от домена аденилатциклазы, обращенного к цитозолю. ACG трансляционно активируется в преспоровых клетках, где он локализуется на мембране преспоровых везикул. Во время образования спор ACG локализуется на поверхности спор, когда предспоровые везикулы сливаются с плазматической мембраной (Alvarez-Curto et al., 2007). цАМФ-фосфодиэстераза RegA также играет решающую роль в регуляции внутриклеточного уровня цАМФ (Shaulsky et al., 1996; Шаульский и др.
, 1992; Хоппер и др., 1993; Ван Эс и др., 1996). Для созревания стебля и спор цАМФ продуцируется аденилатциклазой R (ACR), тогда как цАМФ для индукции дифференцировки преспор и контроля прорастания спор продуцируется аденилатциклазой G (ACG) (Soderbom et al., 1999; Van Es et al. ., 1996; Альварез-Курто и др., 2007). ACR содержит семь трансмембранных доменов и встроен в ядерную мембрану предстебельковых клеток (Soderbom et al., 1999; Alvarez-Curto et al., 2007; Chen et al., 2011).ACG содержит два трансмембранных домена, которые отделяют сенсорный домен от домена аденилатциклазы, обращенного к цитозолю. ACG трансляционно активируется в преспоровых клетках, где он локализуется на мембране преспоровых везикул. Во время образования спор ACG локализуется на поверхности спор, когда предспоровые везикулы сливаются с плазматической мембраной (Alvarez-Curto et al., 2007). цАМФ-фосфодиэстераза RegA также играет решающую роль в регуляции внутриклеточного уровня цАМФ (Shaulsky et al., 1996; Шаульский и др. , 1998; Томасон и др., 1998).
, 1998; Томасон и др., 1998).
Активность самого RegA тесно регулируется внеклеточными сигналами, которые контролируют состояние фосфорилирования присоединенного к нему домена регулятора ответа (). Этот процесс опосредуется так называемыми сенсорными гистидинкиназами/фосфатазами (см. Глоссарий, вставка 1), которые либо фосфорилируют, либо дефосфорилируют себя по гистидиновому остатку, когда сигнальная молекула связывается с их сенсорным доменом. Затем фосфорильная группа в два этапа переносится к домену регулятора ответа RegA или от него, тем самым активируя или инактивируя его активность цАМФ-фосфодиэстеразы соответственно (Thomason et al., 1999). Например, аммиак, который ингибирует начало формирования плодовых тел и созревания стебля, активирует гистидинкиназную активность сенсорной гистидинкиназы C (DhkC), что приводит к активации RegA, гидролизу цАМФ и ингибированию активности PKA (Singleton et al., 1998). Фактор дифференцировки спор 2 (SDF-2) активирует активность гистидинфосфатазы DhkA (гистидинфосфатазы А), что приводит к инактивации RegA, накоплению цАМФ и активации PKA, что впоследствии вызывает созревание спор (Wang et al.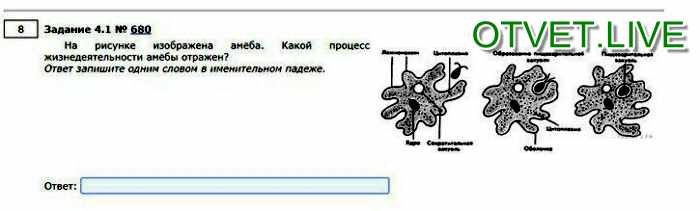 , 1999).
, 1999).
Регуляция цАМФ-фосфодиэстеразы RegA. RegA контролирует внутриклеточные уровни цАМФ в клетках D. discoideum и, таким образом, уровень активности PKA. На схеме показано внеклеточное и внутриклеточное окружение клетки D. discoideum и то, как RegA (зеленый) активируется путем фосфорилирования (P) аспартата (D) в его домене регулятора ответа (RR). Это фосфорилирование регулируется сенсорной гистидинкиназой, DhkC. ( A ) Связывание аммиака (NH 3 ) с сенсорным доменом DhkC (обведено черным) приводит к активации его гистидинкиназной активности и к аутофосфорилированию гистидинового (H) остатка DhkC.Затем фосфорильная группа переносится на аспартат в том же белке, оттуда на гистидин в промежуточном фосфопереносе RdeA ( B ) и, наконец, на RegA ( C ). Напротив, связывание SDF-2, присутствующего внеклеточно, с сенсорным доменом DhkA (обведено черным), вызывает гистидин-опосредованное дефосфорилирование присоединенного остатка аспартата ( D ) и обратный фосфоперенос через RdeA ( E ). Это оставляет RegA без фосфорильной группы, тем самым инактивируя гидролиз цАМФ.АДФ, аденозиндифосфат; АТФ, аденозинтрифосфат; цАМФ, циклический аденозинмонофосфат; DhkA, гистидинфосфатаза А; DhkC, гистидинкиназа C; PKA, цАМФ-зависимая протеинкиназа А; RdeA, интермедиат фосфотрансфера Rapid Development A; RegA, внутриклеточная цАМФ-фосфодиэстераза с регулятором ответа; SDF-2, фактор дифференцировки спор 2.
Это оставляет RegA без фосфорильной группы, тем самым инактивируя гидролиз цАМФ.АДФ, аденозиндифосфат; АТФ, аденозинтрифосфат; цАМФ, циклический аденозинмонофосфат; DhkA, гистидинфосфатаза А; DhkC, гистидинкиназа C; PKA, цАМФ-зависимая протеинкиназа А; RdeA, интермедиат фосфотрансфера Rapid Development A; RegA, внутриклеточная цАМФ-фосфодиэстераза с регулятором ответа; SDF-2, фактор дифференцировки спор 2.
Аденилатциклаза ACG также регулируется внешними раздражителями. Как упоминалось выше, ACG локализуется на поверхности спор, где он напрямую активируется своим внеклеточным осмочувствительным доменом (Van Es et al., 1996). Во время созревания спор высвобождается большое количество фосфата аммония. Эти высокие уровни фосфата аммония повышают осмоляльность споровой массы и удерживают споры в состоянии покоя, пока они еще находятся в плодовом теле (Cotter et al., 1999). Эффект высокой осмоляльности опосредуется действием АЦГ на ФКА (Van Es et al., 1996).
Множество важных ролей как внеклеточного, так и внутриклеточного цАМФ является наиболее поразительным аспектом развития D. discoideum . Таким образом, идентификация происхождения функции цАМФ у Amoebozoa и того, как эта функция развивалась в ходе эволюции Dictyostelia , является ключом к пониманию того, как развивалась эта форма многоклеточности.
discoideum . Таким образом, идентификация происхождения функции цАМФ у Amoebozoa и того, как эта функция развивалась в ходе эволюции Dictyostelia , является ключом к пониманию того, как развивалась эта форма многоклеточности.
Недавнее понимание сигналов развития в
D . discoideumВ этом разделе я обсуждаю недавнее понимание регуляции путей дифференцировки клеток стебля и спор и то, как эти пути могли развиться у Dictyostelia .
Путь стебля
Популяция клеток, не являющихся предспорами, у слизней традиционно подразделяется на четыре типа клеток на основе экспрессии генов предстебелькового образования ecmA и ecmB (Jermyn et al., 1989; Джермин и Уильямс, 1991 г .; Чеккарелли и др., 1991; Ранний и др., 1993). Клетки Prestalk AB, которые экспрессируют как ecmA , так и ecmB , занимают сердцевину кончика. При формировании плодового тела эти клетки дифференцируются в клетки стебля. Во время миграции слизней они отслаиваются и замещаются движением вперед клеток, расположенных более сзади. Это prestalk A и prestalk O клетки, которые экспрессируют ecmA из проксимальной ‘A’ и дистальной ‘O’ областей его промотора, соответственно, и занимают переднюю и заднюю половины предстебельчатой области (1).Как только престеблевые А-клетки достигают кончика, они также начинают экспрессировать ген ecmB . Предстеблевые О-клетки также можно найти в предспоровой области, и эти клетки продвигаются вперед, чтобы пополнить предстебельковую О-область. Наконец, престеблевые В-клетки, которые слабо экспрессируют ген ecmB , перемещаются вниз, образуя базальный диск и нижнюю чашечку (Jermyn et al., 1996) (4).
Во время миграции слизней они отслаиваются и замещаются движением вперед клеток, расположенных более сзади. Это prestalk A и prestalk O клетки, которые экспрессируют ecmA из проксимальной ‘A’ и дистальной ‘O’ областей его промотора, соответственно, и занимают переднюю и заднюю половины предстебельчатой области (1).Как только престеблевые А-клетки достигают кончика, они также начинают экспрессировать ген ecmB . Предстеблевые О-клетки также можно найти в предспоровой области, и эти клетки продвигаются вперед, чтобы пополнить предстебельковую О-область. Наконец, престеблевые В-клетки, которые слабо экспрессируют ген ecmB , перемещаются вниз, образуя базальный диск и нижнюю чашечку (Jermyn et al., 1996) (4).
В 1980-х годах был идентифицирован секретируемый поликетид, названный DIF-1 (фактор, индуцирующий дифференцировку 1), и было показано, что этот поликетид может индуцировать предстебельковую дифференцировку и созревание стебельков в клеточных монослоях в присутствии активатора PKA (Kay and Jermyn, 1983; Моррис и др. , 1987). Исследования за последнее десятилетие улучшили наше понимание синтеза и роли DIF-1.
, 1987). Исследования за последнее десятилетие улучшили наше понимание синтеза и роли DIF-1.
Первая стадия синтеза хлорированного поликетида DIF-1 катализируется поликетидсинтазой StlB (Austin et al., 2006). Затем DIF-1 подвергается промежуточному хлорированию флавин-зависимой галогеназой ChlA (Neumann et al., 2010) и метилируется метилтрансферазой DmtA (метилтрансферазой дез-метил-DIF-1) (Thompson and Kay, 2000). DIF-1 может индуцировать все предстеблевые подтипы и дифференцировку стволовых клеток в клеточных монослоях (Morris et al., 1987; Уильямс, 2006). Однако исследования мутантов stlB — и dmtA -null показали, что роль DIF-1 в интактном организме гораздо более ограничена. У мутантов stlB -null у слизней отсутствуют только предстеблевые В-клетки и, следовательно, не формируются базальный диск и нижняя чашечка плодового тела (Saito et al., 2008). У слизней dmtA -null число предстебельковых О-клеток снижено (Thompson and Kay, 2000), но это связано с накоплением des-methyl-DIF-1, субстрата DmtA, который ингибирует предстебельковую дифференцировку О-клеток ( Сайто и др. , 2008).
, 2008).
Эти находки оставляют нас без факторов, которые необходимы для предстебельчатой О, предстебельчатой А и дифференцировки стволовых клеток. Секретируемые DIF-подобные факторы, которые также могут индуцировать предстеблевые и стеблевые дифференцировки клеток в монослойной системе, были полностью или частично идентифицированы (Saito et al., 2006; Serafimidis and Kay, 2005), хотя их роль в нормальном развитии D. discoideum еще предстоит установить.
Споровый путь
Первый этап спорообразования, дифференцировка предспоровых клеток, требует как внеклеточного цАМФ, действующего на цАР, так и внутриклеточного цАМФ, действующего на ПКА (Hopper et al., 1993; Шаап и Ван Дрил, 1985 г.; Ван и др., 1988). цАМФ для обеих ролей предоставляется ACG. ACG экспрессируется после агрегации в задней преспоровой области слизняка (Alvarez-Curto et al., 2007). Следующий этап, созревание спор, требует второй фазы активации PKA (Mann et al., 1994), как и созревание клеток стебля (Harwood et al. , 1992). Формирование плодовых тел Dictyostelium полностью зависит от движения клеток, которое, скорее всего, опосредуется волнами цАМФ, выходящими из кончика (Dormann and Weijer, 2001; Schaap et al., 1984). Поскольку созревание как стебля, так и спор включает полную потерю клеточной подвижности, эти конечные стадии дифференцировки требуют очень точной пространственно-временной регуляции. Такая регуляция обеспечивается параллельными каскадами сигналов, которыми обмениваются созревающие предстеблевые и предспоровые клетки. Эти сигналы в конечном итоге контролируют состояние активации PKA ().
, 1992). Формирование плодовых тел Dictyostelium полностью зависит от движения клеток, которое, скорее всего, опосредуется волнами цАМФ, выходящими из кончика (Dormann and Weijer, 2001; Schaap et al., 1984). Поскольку созревание как стебля, так и спор включает полную потерю клеточной подвижности, эти конечные стадии дифференцировки требуют очень точной пространственно-временной регуляции. Такая регуляция обеспечивается параллельными каскадами сигналов, которыми обмениваются созревающие предстеблевые и предспоровые клетки. Эти сигналы в конечном итоге контролируют состояние активации PKA ().
Согласование D . discoideum созревание стебля и спор с помощью цАМФ. ( A ) В предстебельчатых клетках на кончике слизня цАМФ синтезируется ACR и может либо гидролизоваться RegA, либо связываться с PKA, вызывая инкапсуляцию стебля, что обычно происходит, когда кончик выступает вверх в начале формирования плодового тела.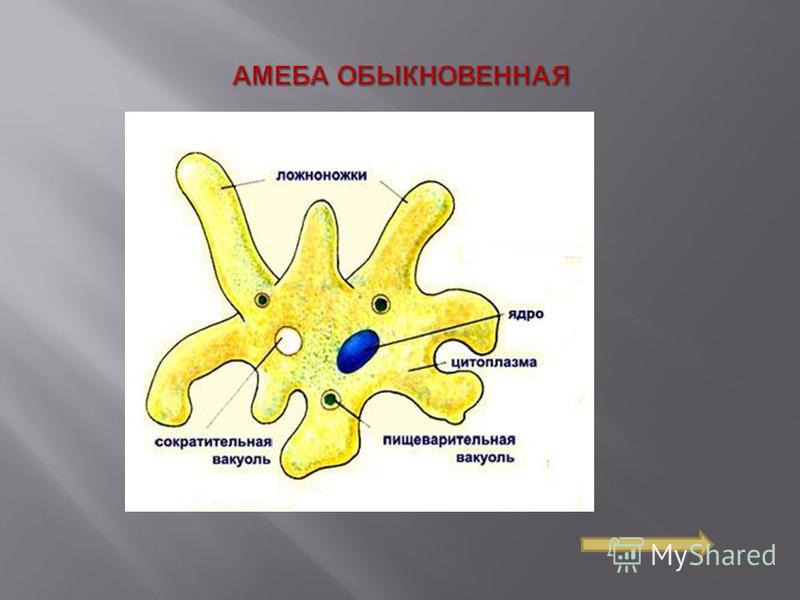 и теряет аммиак (NH 3 ) за счет газовой диффузии.NH 3 ингибирует PKA, опосредованно активируя гидролиз цАМФ посредством DhkC-RdeA-опосредованного фосфорилирования RegA. ( B ) В преспоровых клетках активация PKA происходит как следствие сигнального каскада, который активируется SDF-3, который запускает синтез ГАМК преспоровыми клетками. Секретируемая ГАМК затем воздействует на предстеблевые клетки, вызывая воздействие на клеточную поверхность домена сериновой протеазы транспортера ABC TagC. ГАМК также действует на предспоровые клетки, вызывая секрецию AcbA, который, в свою очередь, расщепляется протеазой TagC с образованием пептида SDF-2.Затем SDF-2 активирует активность гистидинфосфатазы DhkA, вызывая инактивацию гидролиза цАМФ с помощью RegA. Это позволяет цАМФ накапливаться и активировать РКА, что, в свою очередь, вызывает инкапсуляцию спор. ABC, АТФ-связывающая кассета; AcbA, белок, связывающий ацил-кофермент А; ACR, аденилатциклаза R; АТФ, аденозинтрифосфат; DhkA, гистидинфосфатаза А; цАМФ, циклический аденозинмонофосфат; DhkC, гистидинкиназа C; ГАМК, γ-аминомасляная кислота; GadA, глутаматдекарбоксилаза А; GrlA, рецептороподобный белок А, связанный с G-белком; GrlE, рецептороподобный белок Е, связанный с G-белком; PKA, цАМФ-зависимая протеинкиназа A, где R и C обозначают регуляторную и каталитическую субъединицы соответственно, а звездочка обозначает, что каталитическая субъединица активна в присутствии цАМФ; RdeA, интермедиат фосфотрансфера Rapid Development A; RegA, внутриклеточная цАМФ-фосфодиэстераза с регулятором ответа; SDF-2, фактор дифференцировки спор 2; SDF-3, фактор дифференцировки спор 3; TagC: плотный агрегат C, переносчик ABC с внутренним доменом сериновой протеазы.
и теряет аммиак (NH 3 ) за счет газовой диффузии.NH 3 ингибирует PKA, опосредованно активируя гидролиз цАМФ посредством DhkC-RdeA-опосредованного фосфорилирования RegA. ( B ) В преспоровых клетках активация PKA происходит как следствие сигнального каскада, который активируется SDF-3, который запускает синтез ГАМК преспоровыми клетками. Секретируемая ГАМК затем воздействует на предстеблевые клетки, вызывая воздействие на клеточную поверхность домена сериновой протеазы транспортера ABC TagC. ГАМК также действует на предспоровые клетки, вызывая секрецию AcbA, который, в свою очередь, расщепляется протеазой TagC с образованием пептида SDF-2.Затем SDF-2 активирует активность гистидинфосфатазы DhkA, вызывая инактивацию гидролиза цАМФ с помощью RegA. Это позволяет цАМФ накапливаться и активировать РКА, что, в свою очередь, вызывает инкапсуляцию спор. ABC, АТФ-связывающая кассета; AcbA, белок, связывающий ацил-кофермент А; ACR, аденилатциклаза R; АТФ, аденозинтрифосфат; DhkA, гистидинфосфатаза А; цАМФ, циклический аденозинмонофосфат; DhkC, гистидинкиназа C; ГАМК, γ-аминомасляная кислота; GadA, глутаматдекарбоксилаза А; GrlA, рецептороподобный белок А, связанный с G-белком; GrlE, рецептороподобный белок Е, связанный с G-белком; PKA, цАМФ-зависимая протеинкиназа A, где R и C обозначают регуляторную и каталитическую субъединицы соответственно, а звездочка обозначает, что каталитическая субъединица активна в присутствии цАМФ; RdeA, интермедиат фосфотрансфера Rapid Development A; RegA, внутриклеточная цАМФ-фосфодиэстераза с регулятором ответа; SDF-2, фактор дифференцировки спор 2; SDF-3, фактор дифференцировки спор 3; TagC: плотный агрегат C, переносчик ABC с внутренним доменом сериновой протеазы.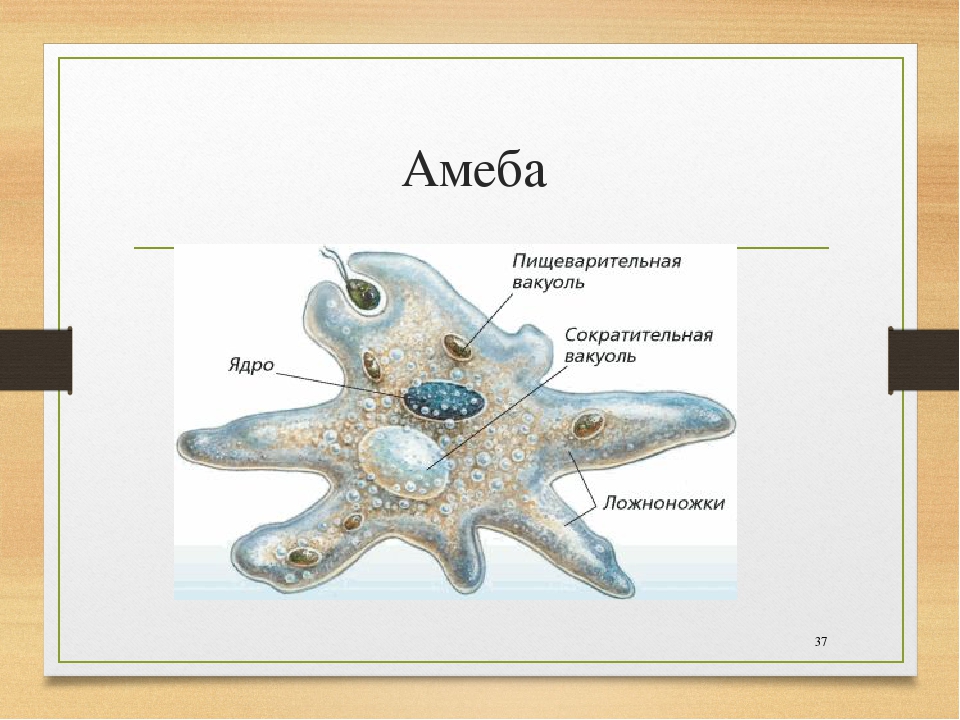
Формирование плодового тела начинается, когда мигрирующий слизень выбрасывает кончик в воздух. В природе это происходит в ответ на падающий свет, когда слизень достигает верхнего уровня почвы. Это позволяет аммиаку теряться из кончика снаряда за счет газовой диффузии. Аммиак вырабатывается в больших количествах в результате деградации белка в голодающих клетках и блокирует как переход от слизняка к плодовому телу, так и созревание клеток стебля (Schindler and Sussman, 1977; Wang and Schaap, 1989).Оба процесса требуют активности PKA, и аммиак косвенно инактивирует PKA, активируя DhkC (Singleton et al., 1998), что, в свою очередь, активирует гидролиз цАМФ с помощью RegA (как показано на рис. 1). Таким образом, потеря аммиака из кончика слизня приводит к активации PKA и инициированию инкапсуляции стебля (4).
Далее высвобождается стероид SDF-3 (фактор дифференцировки спор 3), который запускает продукцию ГАМК (γ-аминомасляной кислоты) преспоровыми клетками () (Anjard et al. , 2009). ГАМК имеет два эффекта: во-первых, он запускает секрецию AcbA (белок, связывающий ацил-кофермент А) из преспоровых клеток; и, во-вторых, это вызывает экспонирование домена сериновой протеазы TagC (плотный агрегат C) на поверхности клетки.Затем TagC расщепляет секретированный AcbA с образованием SDF-2 (Anjard and Loomis, 2006). SDF-2 активирует гистидинфосфатазу DhkA преспоровых клеток, которая дефосфорилирует и, таким образом, инактивирует RegA. Затем уровни цАМФ увеличиваются, вызывая активацию PKA и созревание спор (Wang et al., 1999).
, 2009). ГАМК имеет два эффекта: во-первых, он запускает секрецию AcbA (белок, связывающий ацил-кофермент А) из преспоровых клеток; и, во-вторых, это вызывает экспонирование домена сериновой протеазы TagC (плотный агрегат C) на поверхности клетки.Затем TagC расщепляет секретированный AcbA с образованием SDF-2 (Anjard and Loomis, 2006). SDF-2 активирует гистидинфосфатазу DhkA преспоровых клеток, которая дефосфорилирует и, таким образом, инактивирует RegA. Затем уровни цАМФ увеличиваются, вызывая активацию PKA и созревание спор (Wang et al., 1999).
Помимо этого каскада, для созревания спор необходимы еще два сигнала. SDF-1, другой секретируемый пептид, действует на ACG, активируя PKA (Anjard and Loomis, 2008), а discadenine действует на гистидинкиназу DhkB и ACR, активируя PKA.Дискаденин также действует параллельно с высокой осмоляльностью, удерживая споры в состоянии покоя в головке споры (Anjard and Loomis, 2008; Zinda and Singleton, 1998). Эта избыточность регуляторных путей подчеркивает исключительную важность образования и прорастания спор только в нужное время и в нужном месте.
Эволюционное происхождение передачи сигналов цАМФ
Наиболее интересным аспектом превращения амеб D. discoideum в многоклеточные плодовые тела является то, что большая часть этого процесса регулируется цАМФ и что, помимо DIF, большинство других сигналов развития их эффекты путем изменения обнаружения, производства или деградации цАМФ.До недавнего времени было неясно, в какой степени широкое использование цАМФ было общим для всех Dictyostelia , но недавние исследования изучали сохранение и изменение сигнальных генов цАМФ и связанные с ними функции цАМФ на протяжении всей филогении Dictyostelia .
ACG, активируемая осмолитом аденилатциклаза, которая решающим образом регулирует дифференцировку преспор и прорастание спор у D. discoideum , функционально консервативна на протяжении всей филогении Dictyostelia (Ritchie et al., 2008). Многие ранние дивергентные виды сохранили наследственный механизм инцистации (4). Подобно прорастанию спор, прорастание цист также ингибируется высокой осмоляльностью, но, в отличие от спорообразования, инцистирование может быть напрямую вызвано высокой осмоляльностью. Для почвенных амеб высокая осмоляльность, вероятно, является сигналом приближающейся засухи, повышающей концентрацию почвенных минералов. Осмолит-индуцированная инцистация опосредована продукцией цАМФ и активацией PKA (Ritchie et al., 2008), что указывает на то, что роль внутриклеточного цАМФ и PKA в дифференцировке и прорастании спор эволюционно связана с аналогичной ролью в инцистации одиночных амеб. ).
Эволюция передачи сигналов цАМФ у Dictyostelia . Предварительная гипотеза эволюции передачи сигналов цАМФ в процессе развития у Dictyostelia из опосредованной цАМФ реакции на стресс у одиночного предка. Четыре группы Dictyostelia (см. ) приблизительно оцениваются по накопленным изменениям в их малых субъединичных рибосомных РНК и последовательностях α-тубулина, которые отделились от их последнего общего амебозойного предка около 1 миллиарда лет назад (Schaap et al., 2006). ( A ) Предок амебозоя, вероятно, использовал цАМФ в качестве внутриклеточного вторичного мессенджера для вызванной стрессом инцистации. В течение долгой эпохи эволюции Dictyostelia механизмы, связанные с синтезом, продукцией и деградацией цАМФ, усложнились и приобрели новые роли в клеточной дифференцировке и контроле клеточного движения. ( B ) Накопление секретируемого цАМФ, вероятно, впервые использовалось в агрегатах в качестве сигнала, побуждающего клетки образовывать споры.( C ) Затем развилась пульсирующая секреция цАМФ для координации движения клеток во время формирования плодового тела. ( D ) Наконец, этот процесс был перенесен в разработку для координации процесса агрегации. ACA, аденилатциклаза А; ACG, аденилатциклаза G; ACR, аденилатциклаза R; цАМФ, циклический аденозинмонофосфат; cAR, рецептор цАМФ; PKA, цАМФ-зависимая протеинкиназа A.
В течение долгой эпохи эволюции Dictyostelia механизмы, связанные с синтезом, продукцией и деградацией цАМФ, усложнились и приобрели новые роли в клеточной дифференцировке и контроле клеточного движения. ( B ) Накопление секретируемого цАМФ, вероятно, впервые использовалось в агрегатах в качестве сигнала, побуждающего клетки образовывать споры.( C ) Затем развилась пульсирующая секреция цАМФ для координации движения клеток во время формирования плодового тела. ( D ) Наконец, этот процесс был перенесен в разработку для координации процесса агрегации. ACA, аденилатциклаза А; ACG, аденилатциклаза G; ACR, аденилатциклаза R; цАМФ, циклический аденозинмонофосфат; cAR, рецептор цАМФ; PKA, цАМФ-зависимая протеинкиназа A.
Рецептор цАМФ cAR1 и, следовательно, внеклеточная передача сигналов цАМФ также сохраняются на протяжении всей филогении Dictyostelia .У видов группы 4, таких как D. discoideum , cAR1 экспрессируется с отдельных промоторов во время агрегации и постагрегационного развития (Louis et al. , 1993). Примечательно, что в группах 1-3 cAR1 экспрессируется только после агрегации (Alvarez-Curto et al., 2005). Ингибирование осцилляторной передачи сигналов цАМФ блокирует агрегацию и морфогенез плодового тела у видов группы 4, но нарушает морфогенез плодового тела только у видов группы 1-3 (Alvarez-Curto et al., 2005). Это говорит о том, что все Dictyostelia используют осцилляторную передачу сигналов цАМФ для координации движения клеток во время формирования слизней и плодовых тел.Таким образом, эта роль осцилляторной передачи сигналов цАМФ развилась первой, а ее дополнительная роль в координации агрегации появилась совсем недавно в эволюции Dictyostelia .
, 1993). Примечательно, что в группах 1-3 cAR1 экспрессируется только после агрегации (Alvarez-Curto et al., 2005). Ингибирование осцилляторной передачи сигналов цАМФ блокирует агрегацию и морфогенез плодового тела у видов группы 4, но нарушает морфогенез плодового тела только у видов группы 1-3 (Alvarez-Curto et al., 2005). Это говорит о том, что все Dictyostelia используют осцилляторную передачу сигналов цАМФ для координации движения клеток во время формирования слизней и плодовых тел.Таким образом, эта роль осцилляторной передачи сигналов цАМФ развилась первой, а ее дополнительная роль в координации агрегации появилась совсем недавно в эволюции Dictyostelia .
Нарушение гена cAR у видов группы 2 P. pallidum не только дезорганизует морфогенез плодового тела, но также приводит к низкорослым структурам, которые формируют цисты вместо спор в головке споры (Kawabe et al., 2009). Это связано с тем, что мутант с нулевым cAR больше не экспрессирует гены предспор в ответ на стимуляцию цАМФ (Kawabe et al.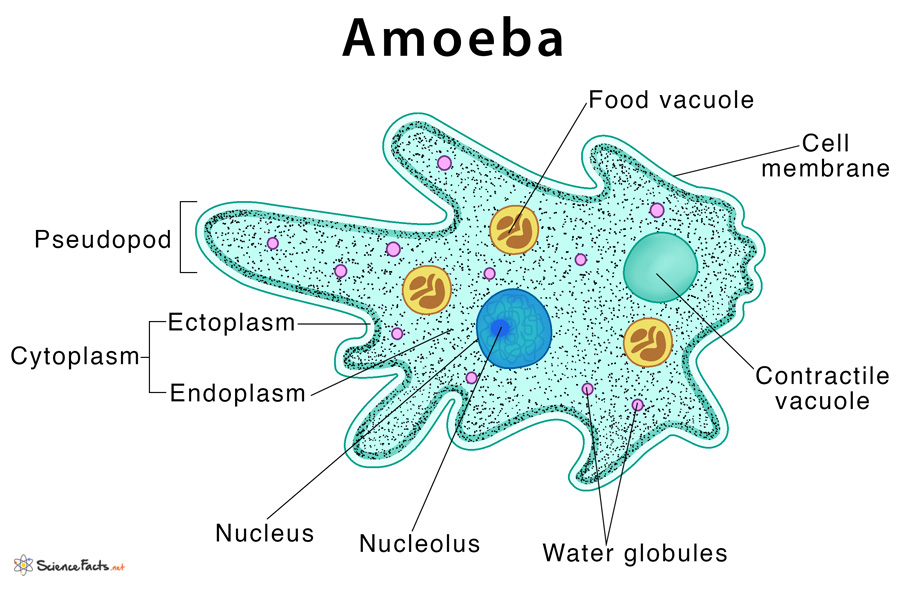 , 2009). Как обсуждалось выше, для спорообразования и инцистирования требуется внутриклеточный цАМФ, действующий на PKA, но для спорообразования дополнительно требуется внеклеточный цАМФ, действующий на цАР. При удалении последнего пути cAR-нулевые клетки возвращаются к наследственной стратегии выживания инцистации.
, 2009). Как обсуждалось выше, для спорообразования и инцистирования требуется внутриклеточный цАМФ, действующий на PKA, но для спорообразования дополнительно требуется внеклеточный цАМФ, действующий на цАР. При удалении последнего пути cAR-нулевые клетки возвращаются к наследственной стратегии выживания инцистации.
Вместе эти результаты указывают на возможный сценарий эволюции передачи сигналов цАМФ у Dictyostelia , который начинается с цАМФ, функционирующего как внутриклеточный сигнал, который преобразует восприятие экологического стресса в реакцию инцистации у одиночного предка (1).Базальные диктиостелиды не используют цАМФ для агрегации, и по крайней мере один вид ( D. minutum ) использует тот же аттрактант (фолиевую кислоту) для поиска пищи, что и для агрегации. Таким образом, первые колониальные амебы могли адаптировать свою стратегию поиска пищи для агрегации, при этом все еще используя внутриклеточно цАМФ для запуска инцистации. Dictyostelia секретируют большую часть продуцируемого ими цАМФ, но могут накапливать микромолярные концентрации, необходимые для дифференцировки предспор (Schaap and Van Driel, 1985), после того как они агрегированы. Таким образом, микромолярный цАМФ сигнализирует об агрегированном состоянии и побуждает клетки образовывать споры, а не цисты (4).
Таким образом, микромолярный цАМФ сигнализирует об агрегированном состоянии и побуждает клетки образовывать споры, а не цисты (4).
Осцилляторная секреция цАМФ, которая требует опосредованной цАР положительной и отрицательной обратной связи на синтез цАМФ с помощью ACA (Devreotes, 1994), первоначально эволюционировала для формирования плодовых тел со сложной архитектурой, а затем эволюционировала для координации агрегации в недавно дивергировавшейся группе 4 () . Анализ промоторов cAR1 и PdsA , которые необходимы для осцилляторной передачи сигналов цАМФ, позволяет предположить, что это происходило за счет вставки дистального «раннего» промотора рядом с существующим «поздним» промотором, который направляет постагрегативную экспрессию. этих генов (Faure et al., 1990; Луи и др., 1993; Альварез-Курто и др., 2005).
Ограничения и будущие направления
Хотя эволюционной реконструкции передачи сигналов цАМФ способствовала хорошо консервативная природа генов передачи сигналов цАМФ, что позволяет легко амплифицировать их с помощью полимеразной цепной реакции у разных видов, полная эволюционная реконструкция связанных механизмов контроля и др. сигнальных путей, которые опосредуют развитие Dictyostelium , требуется геномный подход, охватывающий всю филогенез.Помимо генома модели D. discoideum (Eichinger et al., 2005), в настоящее время также исследованы геномы D. fasciculatum (вид группы 1) и P. pallidum (группа 2). полностью секвенированы (AJ Heidel, HM Lawal, M. Felder, C. Schilde, NR Helps, B. Tunggal, R. Rivero, U. John, M. Schleicher, L. Eichinger, M. Platzer, AA Noegel, PS и G. , Глекнер, неопубликовано). Также доступны предварительные данные о последовательности для D. purpureum (группа 4) (см. ниже), и в настоящее время собирается геном вида Dictyostelium lacteum группы 3.Геномы D. fasciculatum, P. pallidum и D. purpureum теперь находятся в открытом доступе (http://sacgb.fli-leibniz.de/cgi/index.pl; http://genomes.dictybase. org/purpureum), и их доступность открывает огромные возможности для выявления сохранения и изменения во всех значимых для развития генах.
сигнальных путей, которые опосредуют развитие Dictyostelium , требуется геномный подход, охватывающий всю филогенез.Помимо генома модели D. discoideum (Eichinger et al., 2005), в настоящее время также исследованы геномы D. fasciculatum (вид группы 1) и P. pallidum (группа 2). полностью секвенированы (AJ Heidel, HM Lawal, M. Felder, C. Schilde, NR Helps, B. Tunggal, R. Rivero, U. John, M. Schleicher, L. Eichinger, M. Platzer, AA Noegel, PS и G. , Глекнер, неопубликовано). Также доступны предварительные данные о последовательности для D. purpureum (группа 4) (см. ниже), и в настоящее время собирается геном вида Dictyostelium lacteum группы 3.Геномы D. fasciculatum, P. pallidum и D. purpureum теперь находятся в открытом доступе (http://sacgb.fli-leibniz.de/cgi/index.pl; http://genomes.dictybase. org/purpureum), и их доступность открывает огромные возможности для выявления сохранения и изменения во всех значимых для развития генах. Сравнительную геномику также можно использовать для сопоставления тенденций эволюции генов и генома с тенденциями фенотипической эволюции. Модификация генов-кандидатов в более раннюю или более позднюю форму у подходящих тестируемых видов с последующим наблюдением за фенотипическими последствиями может показать, как изменения в генотипе вызвали фенотипическую эволюцию.Генетически послушные Dictyostelia в высшей степени подходят для исследования этого фундаментального биологического вопроса.
Сравнительную геномику также можно использовать для сопоставления тенденций эволюции генов и генома с тенденциями фенотипической эволюции. Модификация генов-кандидатов в более раннюю или более позднюю форму у подходящих тестируемых видов с последующим наблюдением за фенотипическими последствиями может показать, как изменения в генотипе вызвали фенотипическую эволюцию.Генетически послушные Dictyostelia в высшей степени подходят для исследования этого фундаментального биологического вопроса.
В дополнение к этим сравнительным подходам многое еще предстоит узнать о сигналах и связанных с ними путях, которые контролируют развитие D. discoideum . Например, молекулы, которые индуцируют дифференцировку предстеблевых и стволовых клеток, еще предстоит идентифицировать. И, хотя некоторые из онтогенетических сигналов D. discoideum известны, задействованные пути передачи сигналов охарактеризованы лишь частично.Собираясь в агрегаты, клетки становятся сильно сплоченными, и имеются убедительные доказательства того, что прямые межклеточные взаимодействия необходимы для постагрегативной экспрессии генов (Kibler et al.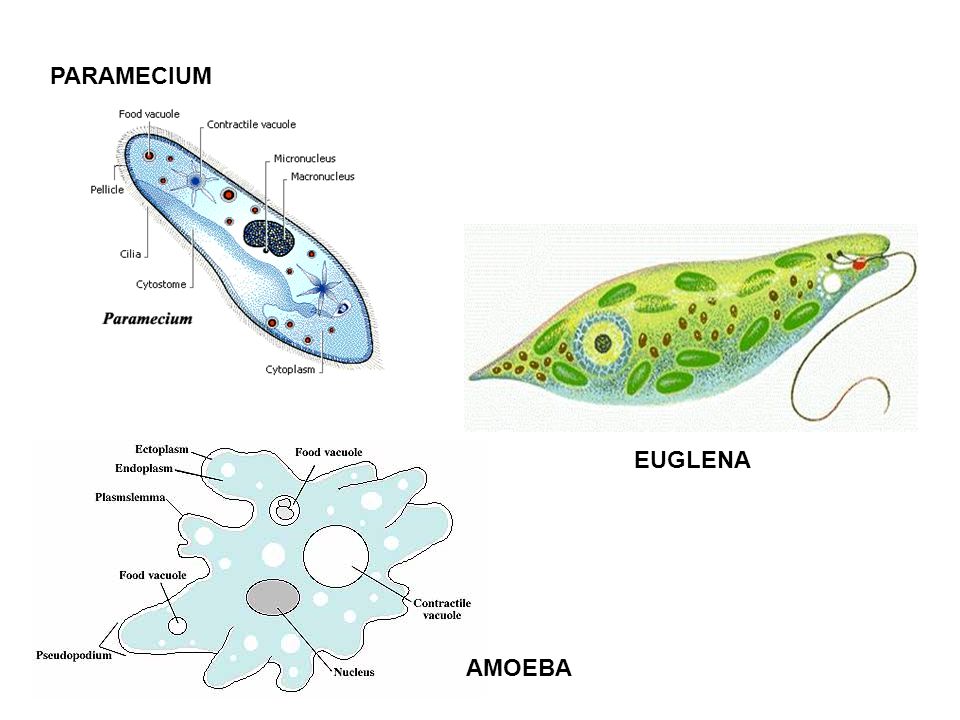 , 2003). Однако неизвестно, как воспринимаемый сигнал межклеточного взаимодействия трансдуцируется, чтобы повлиять на регуляцию генов.
, 2003). Однако неизвестно, как воспринимаемый сигнал межклеточного взаимодействия трансдуцируется, чтобы повлиять на регуляцию генов.
Хотя теоретически экспериментальные и генетические подходы, доступные для D. discoideum , хорошо подходят для изучения его сигнальных путей, на практике эти подходы отнимают много времени и технически сложны, что замедляет прогресс.Разработка высокопроизводительных подходов, которые позволяют разрушать или нокдаун генов по всему геному, может значительно облегчить эту проблему, но анализ мутаций и устранение ложноположительных результатов останутся трудоемкими узкими местами (Mohr et al., 2010). Вычислительные подходы, такие как Genepath, который строит генетические сети из данных о мутантах (Juvan et al., 2005), и эпистатический анализ глобальных транскрипционных фенотипов (Van Driessche et al., 2005) успешно использовались для D.discoideum , чтобы получить более быстрое и новое понимание архитектуры сигнальных путей. Разработка усовершенствованных вычислительных инструментов и инструментов для крупномасштабного анализа генома, транскриптома и протеома, вероятно, окажет самое сильное влияние на эту область биологических исследований в ближайшие десять лет.
Выводы
Отличная доступность D. discoideum как для генетических, так и для биохимических подходов, а также для методов визуализации сделала его выдающейся моделью для решения фундаментальных вопросов клеточной биологии и биологии развития.Исследования этого и других организмов подчеркивают сложность сигнальных процессов, которые контролируют клеточные функции и программы развития, с взаимодействующими и параллельными путями, обеспечивающими как точную настройку, так и избыточность в их регуляции. Взаимосвязанные пути, которые контролируют созревание спор в D. discoideum , являются хорошим примером этой сложности.
Как перекрестные помехи, так и избыточность между сигнальными путями часто могут скрывать то, как сигнал на самом деле проходит через данный путь.Поскольку любой процесс в биологии является конечным продуктом оппортунистических событий, произошедших в ходе эволюции, единственной внутренней логикой этого пути является порядок, в котором эволюционировали его составные части.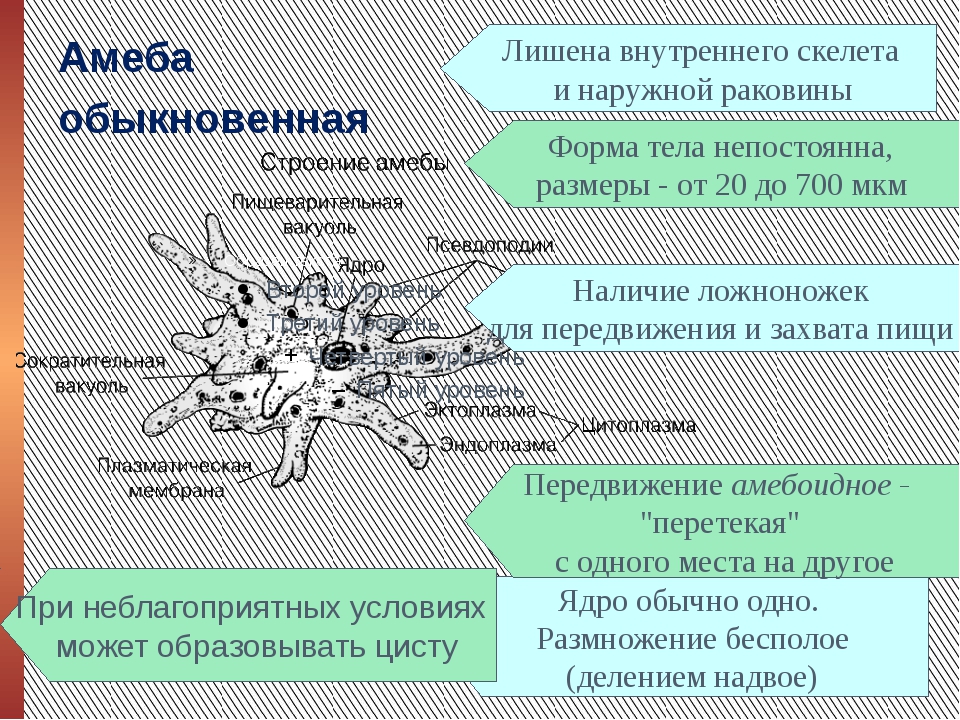 Сравнительный анализ передачи сигналов цАМФ у социальных амеб позволил реконструировать, как роль цАМФ в морфогенезе и дифференцировке у модели D. discoideum развилась из реакции на стресс у ее одноклеточного предка. Этот подход расширил наше понимание эволюции многоклеточности, но также дал представление об иерархии сигнальных путей, которые опосредуют эффекты цАМФ, причем цАМФ, действующий на PKA, находится на вершине этой иерархии.Таким образом, в дополнение к экспериментальным и генетическим подходам эволюционная реконструкция является мощным инструментом для раскрытия и понимания сигнальных процессов во всех многоклеточных организмах.
Сравнительный анализ передачи сигналов цАМФ у социальных амеб позволил реконструировать, как роль цАМФ в морфогенезе и дифференцировке у модели D. discoideum развилась из реакции на стресс у ее одноклеточного предка. Этот подход расширил наше понимание эволюции многоклеточности, но также дал представление об иерархии сигнальных путей, которые опосредуют эффекты цАМФ, причем цАМФ, действующий на PKA, находится на вершине этой иерархии.Таким образом, в дополнение к экспериментальным и генетическим подходам эволюционная реконструкция является мощным инструментом для раскрытия и понимания сигнальных процессов во всех многоклеточных организмах.
Благодарности
Автор финансируется BBSRC и Wellcome Trust.
Сноски
Заявление о конкурирующих интересах
Автор заявляет об отсутствии конкурирующих финансовых интересов.
Каталожные номера
- Альварес-Курто Э., Розен Д.Э., Ричи А.В., Фуке К., Бальдауф С.Л.
 , Шаап П. (2005). Эволюционное происхождение хемоаттракции на основе цАМФ у социальных амеб. Проц. Натл. акад. науч. США 102, 6385-6390
[Бесплатная статья PMC] [PubMed] [Google Scholar]
, Шаап П. (2005). Эволюционное происхождение хемоаттракции на основе цАМФ у социальных амеб. Проц. Натл. акад. науч. США 102, 6385-6390
[Бесплатная статья PMC] [PubMed] [Google Scholar] - Альварес-Курто Э., Саран С., Мейма М., Зобель Дж., Скотт С., Шаап П. (2007). Продукция цАМФ аденилатциклазой G индуцирует дифференцировку преспор в Dictyostelium . слизни. Развитие 134, 959-966 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Амагай А., Сорамото С.С., Сайто С.Х., Маэда Ю. (2007). Этилен индуцирует образование зигот посредством усиленной экспрессии zyg1 в Dictyostelium mucoroides . Экспл. Сотовый рез. 313, 2493-2503 [PubMed] [Академия Google]
- Анджард С., Лумис В.Ф. (2006). ГАМК индуцирует терминальную дифференцировку Dictyostelium через рецептор ГАМК(В). Развитие 133, 2253-2261 [PubMed] [Академия Google]
- Анджард С., Лумис В.Ф. (2008). Цитокинины индуцируют спороношение у Dictyostelium .
 Развитие 135, 819-827
[PubMed] [Академия Google]
Развитие 135, 819-827
[PubMed] [Академия Google] - Анджард С., Су Ю., Лумис В.Ф. (2009). Стероиды инициируют сигнальный каскад, запускающий быструю споруляцию в Dictyostelium . Развитие 136, 803-812 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Остин М.Б., Сайто Т., Боуман М.Е., Хейдок С., Като А., Мур Б.С., Кей Р.Р., Ноэль Дж.П. (2006). Биосинтез фактора, индуцирующего дифференцировку Dictyostelium discoideum , с помощью гибридной поликетидсинтазы жирных кислот типа I и поликетидсинтазы типа III. Нац. хим. биол. 2, 494-502 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Боннер Дж. Т., Ламонт Д. С. (2005). Поведение клеточных слизевиков в почве. Микология 97, 178-184 [PubMed] [Академия Google]
- Кавалье-Смит Т., Чао Э.Э.-Ю., Оутс Б. (2004). Молекулярная филогения Amoebozoa и эволюционное значение униконта Phalansterium. евро. Дж. Протист. 40, 21-48 [Академия Google]
- Чеккарелли А.
 , Махбубани Х., Уильямс Дж. Г. (1991). Положительно и отрицательно действующие сигналы, регулирующие дифференцировку стволовых и переднеподобных клеток у Dictyostelium. Сотовый 65, 983-989
[PubMed] [Академия Google]
, Махбубани Х., Уильямс Дж. Г. (1991). Положительно и отрицательно действующие сигналы, регулирующие дифференцировку стволовых и переднеподобных клеток у Dictyostelium. Сотовый 65, 983-989
[PubMed] [Академия Google] - Чен З.-Х., Шильде К., Шаап П. (2011). Функциональное рассечение ACB, глубоко консервативного индуктора инкапсуляции спор. Дж. Биол. хим. (в печати). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кларк М., Гомер Р. Х. (1995). PSF и CMF, аутокринные факторы, которые регулируют экспрессию генов во время роста и раннего развития Dictyostelium . Опыт 51, 1124-1134 [PubMed] [Академия Google]
- Коссон П., Солдати Т. (2008). Съешь, убей или умри: когда амеба встречает бактерии. Курс. мнение микробиол. 11, 271-276 [PubMed] [Академия Google]
- Коттер Д. А., Данбар А. Дж., Буконич С. Д., Велдрейк Дж. Ф. (1999). Фосфат аммония в сорусах Dictyostelium discoideum способствует покою спор посредством стимуляции осмосенсора ACG.
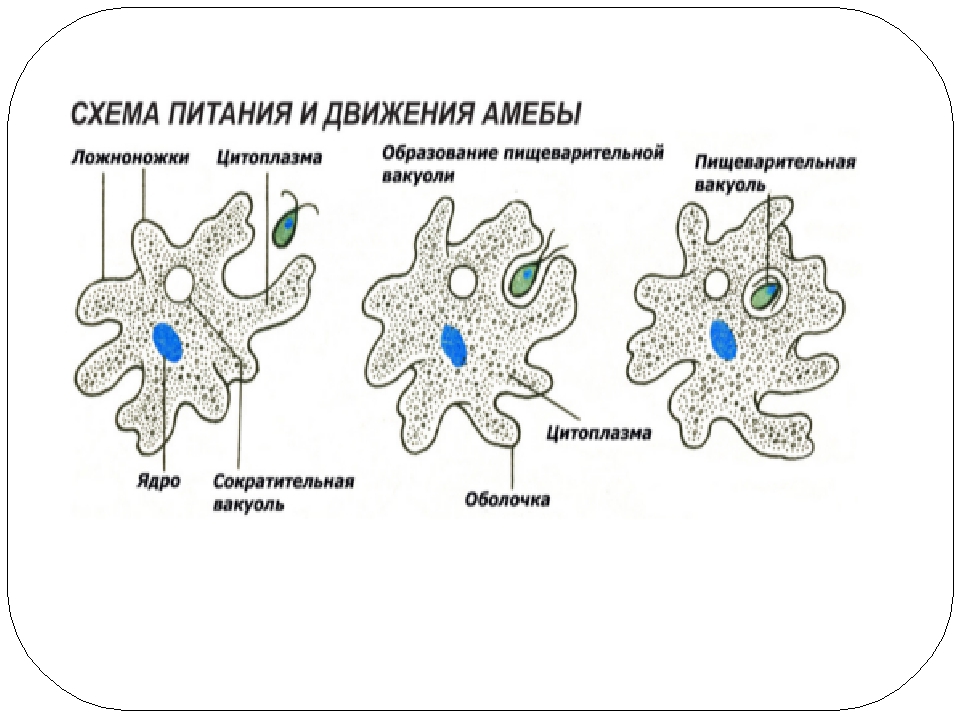 Микробиология 145, 1891-1901
[PubMed] [Академия Google]
Микробиология 145, 1891-1901
[PubMed] [Академия Google] - Дири В.Дж., Гомер Р. Х. (1999). Предполагаемый рецептор, опосредующий определение клеточной плотности у Dictyosteli um. Дж. Биол. хим. 274, 34476-34482 [PubMed] [Академия Google]
- Девреотес П. Н. (1994). Сигнальные пути, связанные с G-белком, контролируют программу развития Dictyostelium . Нейрон 12, 235-241 [PubMed] [Академия Google]
- Дорманн Д., Вейер С.Дж. (2001). Распространяющиеся волны хемоаттрактанта координируют периодическое движение клеток у слизней Dictyostelium . Развитие 128, 4535-4543 [PubMed] [Академия Google]
- Ранний А.Э., Гаскелл М.Дж., Трейнор Д., Уильямс Дж.Г. (1993). Две разные популяции предстебельковых клеток на кончике мигрирующего слизня Dictyostelium с разными судьбами в кульминации. Развитие 118, 353-362 [PubMed] [Академия Google]
- Эйхингер Л., Пачебат Дж. А., Глокнер Г.
 , Раджандрим М. А., Сукганг Р., Берриман М., Сонг Дж., Олсен Р., Шафрански К., Сюй К. и соавт. (2005). Геном социальной амебы Dictyostelium discoideum. Природа 435, 43-57
[Бесплатная статья PMC] [PubMed] [Google Scholar]
, Раджандрим М. А., Сукганг Р., Берриман М., Сонг Дж., Олсен Р., Шафрански К., Сюй К. и соавт. (2005). Геном социальной амебы Dictyostelium discoideum. Природа 435, 43-57
[Бесплатная статья PMC] [PubMed] [Google Scholar] - Фейкс Дж., Креппель Л., Шаульский Г., Шлейхер М., Киммель А. Р. (2004). Быстрый и эффективный метод создания множественных нарушений генов в Dictyostelium discoideum с использованием одного селектируемого маркера и системы Cre-loxP. Рез. нуклеиновых кислот. 32, е143 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фор М., Франке Дж., Холл А.Л., Подгорски Г.Дж., Кессин Р.Х. (1990).Ген циклической нуклеотидной фосфодиэстеразы Dictyostelium discoideum содержит три промотора, специфичных для роста, агрегации и позднего развития. Мол. Клетка. биол. 10, 1921-1930 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гериш Г., Мюллер-Таубенбергер А. (2003). Белки слияния GFP в качестве флуоресцентных репортеров для изучения динамики органелл и цитоскелета при хемотаксисе и фагоцитозе.
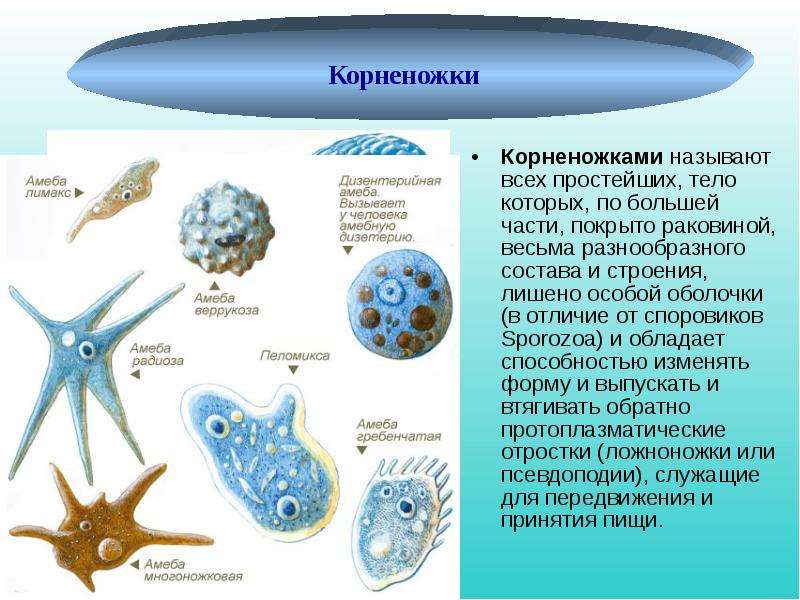 В Биофотоника , Pt B, vol. 361, стр. 320-337 Сан-Диего: Academic Press;
[PubMed] [Академия Google]
В Биофотоника , Pt B, vol. 361, стр. 320-337 Сан-Диего: Academic Press;
[PubMed] [Академия Google] - Харвуд А.Дж., Хоппер Н.А., Саймон М.-Н., Дрисколл Д.М., Верон М., Уильямс Дж.Г. (1992). Кульминация у Dictyostelium регулируется цАМФ-зависимой протеинкиназой. Сотовый 69, 615-624 [PubMed] [Академия Google]
- Хоппер Н.А., Харвуд А.Дж., Бузид С., Верон М., Уильямс Дж.Г. (1993). Активация пути преспоровых и споровых клеток дифференцировки Dictyostelium с помощью цАМФ-зависимой протеинкиназы и свидетельство ее восходящей регуляции аммиаком. EMBO J. 12, 2459-2466 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Джермин К.А., Уильямс Дж. Г. (1991). Анализ кульминации у Dictyostelium с использованием предстебельных и стебель-специфических клеточных автономных маркеров. Развитие 111, 779-787 [PubMed] [Академия Google]
- Джермин К.А., Даффи К.Т.И., Уильямс Дж.Г. (1989). Новая анатомия предстебельковой зоны у Dictyostelium .
 Природа 340, 144-146
[PubMed] [Академия Google]
Природа 340, 144-146
[PubMed] [Академия Google] - Джермин К., Трейнор Д., Уильямс Дж. (1996). Инициация формирования базального диска у Dictyostelium discoideum является ранним событием в кульминации. Разработка 122, 753-760 [PubMed] [Академия Google]
- Юван П., Демсар Дж., Шаульский Г., Зупан Б. (2005). GenePath: от мутаций к генетическим сетям и обратно. Рез. нуклеиновых кислот. 33, В749-В752 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кавабе Ю., Морио Т., Джеймс Дж. Л., Прескотт А. Р., Танака Ю., Шаап П. (2009).Активированные рецепторы цАМФ переключают инцистацию на спорообразование. Проц. Натл. акад. науч. США 106, 7089-7094 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кей Р.Р., Джермин К.А. (1983). Возможный морфоген, контролирующий дифференцировку Dictyostelium . Природа 303, 242-244 [PubMed] [Академия Google]
- Киблер К., Светц Дж., Нгуен Т.Л., Шоу К.
, Шаульский Г. (2003). Путь клеточной адгезии регулирует межклеточную коммуникацию во время развития Dictyostelium. Дев. биол. 264, 506-521 [PubMed] [Академия Google]
- Киммель А. Р., Фиртель Р. А. (2004). Нарушение симметрии: регуляция развития Dictyostelium через хемоаттрактант и сигнал-ответ морфогена. Курс. мнение Жене. Дев. 14, 540-549 [PubMed] [Академия Google]
- Куспа А., Лумис В.Ф. (1992). Маркировка генов развития в Dictyostelium путем интеграции плазмидной ДНК, опосредованной рестрикционными ферментами. Проц. Натл. акад. науч. США 89, 8803-8807 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лауб М.Т., Лумис В.Ф. (1998). Молекулярная сеть, производящая спонтанные колебания в возбудимых клетках Dictyostelium . Мол. биол. Сотовый 9, 3521-3532 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Louis JM, Saxe CL, III, Kimmel AR (1993). Два трансмембранных сигнальных механизма контролируют экспрессию гена рецептора цАМФ cAR1 во время развития Dictyostelium .
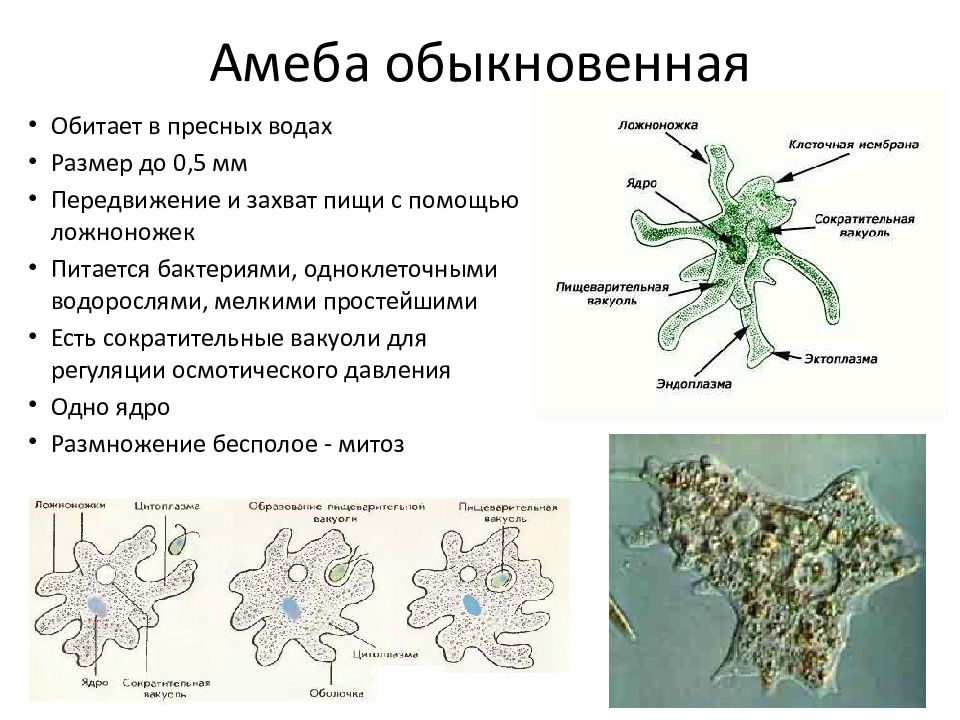 Проц. Натл. акад. науч. США 90, 5969-5973
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Проц. Натл. акад. науч. США 90, 5969-5973
[Бесплатная статья PMC] [PubMed] [Google Scholar] - Маэда М., Сакамото Х., Иранфар Н., Фуллер Д., Маруо Т., Огихара С., Морио Т., Урушихара Х., Танака Ю., Лумис В. Ф. (2003). Изменение характера экспрессии генов в подтипах предстеблевых клеток Dictyostelium , распознаваемых гибридизацией in situ с генами, полученными в результате анализа микрочипов. Эукариот. Сотовый 2, 627-637 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Манн С.К.О., Ричардсон Д.Л., Ли С., Киммел А.Р., Фиртел Р.А. (1994). Экспрессии цАМФ-зависимой протеинкиназы в преспоровых клетках достаточно, чтобы вызвать дифференцировку споровых клеток у Dictyostelium . Проц. Натл. акад. науч. США 91, 10561-10565 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мацукума С., Дерстон А.Дж. (1979). Хемотаксическая сортировка клеток Dictyostelium discoideum. Дж. Эмбриол. Эксп. Морфол. 50, 243-251 [PubMed] [Академия Google]
- Минге М.А., Зильберман Дж.Д., Орр Р.Дж., Кавальер-Смит Т., Шальчиан-Табризи К., Бурки Ф., Скьявеланд А., Якобсен К.С. (2009). Эволюционная позиция коротконогих амеб и первичная дивергенция эукариот. Проц. биол. науч. 276, 597-604 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мор С., Бакал С., Перримон Н. (2010). Геномный скрининг с помощью РНКи: результаты и проблемы. год. Преподобный Биохим. 79, 37-64 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моррис Х.Р., Тейлор Г.В., Масенто М.С., Джермин К.А., Кей Р.Р. (1987). Химическая структура фактора, индуцирующего дифференцировку морфогена, из Dictyostelium discoideum . Природа 6133, 811-814 [PubMed] [Академия Google]
- Нейманн С.С., Уолш С.Т., Кей Р.Р. (2010). Флавинзависимая галогеназа катализирует стадию хлорирования в биосинтезе фактора 1, индуцирующего дифференцировку Dictyostelium . Proc. Натл. акад. науч. США 107, 5798-5803 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Одзаки Т., Накао Х., Ории Х., Морио Т., Такеучи И., Тасака М. (1993). Регуляция развития транскрипции нового гена, специфичного для преспор (Dp87), у Dictyostelium discoideum. Развитие 117, 1299-1308 [PubMed] [Академия Google]
- Рапер К.Б. (1984). Диктиостелиды . Принстон, Нью-Джерси: Издательство Принстонского университета; [Академия Google]
- Рапер К.Б., Феннелл Д.И. (1952). Формирование стебля у Dictyostelium. Бык. Торри . Клуб 79, 25-51 [Академия Google]
- Ричи А.В., ван Эс С., Фуке К., Шаап П. (2008). От ощущения засухи к контролю развития: эволюция передачи сигналов циклического AMP у социальных амеб. Мол. биол. Эвол. 25, 2109-2118 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ронквист Ф., Huelsenbeck JP (2003). MrBayes 3, байесовский филогенетический вывод в смешанных моделях. Биоинформатика 19, 1572-1574 [PubMed] [Академия Google]
- Сайто Т., Тейлор Г.В., Ян Дж.К., Нейхаус Д., Стеценко Д., Като А., Кей Р.Р. (2006). Идентификация новых факторов, индуцирующих дифференцировку, из Dictyostelium discoideum . Биохим. Биофиз. Акта 1760, 754-761 [PubMed] [Академия Google]
- Сайто Т., Като А., Кей Р.Р. (2008). DIF-1 индуцирует базальный диск плодового тела Dictyostelium . Дев. биол. 317, 444-453 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шаап П. (2007). Эволюция размера и рисунка социальных амеб. BioEssays 29, 635-644 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шаап П., Спек В. (1984). Связывание циклического АМФ с клеточной поверхностью во время развития Dictyostelium discoideum. Дифференциация 27, 83-87 [Академия Google]
- Шаап П., Ван Дриэль Р. (1985). Индукция постагрегативной дифференцировки в Dictyostelium discoideum с помощью цАМФ.Доказательства участия рецептора цАМФ клеточной поверхности. Экспл. Сотовый рез. 159, 388-398 [PubMed] [Академия Google]
- Шаап П., Конийн Т.М., Ван Хаастерт П.Дж.М. (1984). Импульсы цАМФ координируют морфогенетическое движение во время формирования плодового тела Dictyostelium minutum . Проц. Натл. акад. науч. США 81, 2122-2126 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шаап П., Винклер Т., Нельсон М., Альварес-Курто Э., Элджи Б., Хагивара Х., Кавендер Дж., Милано-Курто А., Розен Д.Е., Дингерманн Т. и соавт. (2006). Молекулярная филогения и эволюция морфологии социальных амеб. Наука 314, 661-663 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шиндлер Дж., Суссман М. (1977). Аммиак определяет выбор морфогенетических путей у Dictyostelium discoideum . Дж. Мол. биол. 116, 161-169 [PubMed] [Академия Google]
- Шулькес К., Шаап П. (1995). Активность цАМФ-зависимой протеинкиназы необходима для преагрегативной экспрессии генов у Dictyostelium . ФЭБС Письмо. 368, 381-384 [PubMed] [Академия Google]
- Серафимидис И., Кей Р.Р. (2005). Новые сигналы, индуцирующие престебель и преспору, у Dictyostelium . Дев. биол. 282, 432-441 [PubMed] [Академия Google]
- Шадвик Л.Л., Шпигель Ф.В., Шедвик Дж.Д., Браун М.В., Зильберман Дж.Д. (2009). Eumycetozoa = Amoebozoa ?: филогения SSurDNA протостелоидных слизевиков и ее значение для супергруппы амебозойных. ПЛОС ОДИН 4, e6754 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шаульский Г., Эскаланте Р., Лумис В.Ф. (1996). Пути передачи сигнала развития, обнаруженные генетическими супрессорами. Проц. Натл. акад. науч. США. 93, 15260-15265 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шаульский Г., Фуллер Д., Лумис В. Ф. (1998). цАМФ-фосфодиэстераза контролирует PKA-зависимую дифференцировку. Развитие 125, 691-699 [PubMed] [Академия Google]
- Шина М. К., Мюллер-Таубенбергер А., Унал К., Шлейхер М., Штайнерт М., Айхингер Л., Muller R., Blau-Wasser R., Glockner G., Noegel A.A. (2010)Резервные и уникальные роли корониновых белков в Dictyostelium. Сотовый. Мол. Жизнь наук. (в печати). [PubMed] [Академия Google]
- Зигерт Ф., Вейер С.Дж. (1995). Спиральные и концентрические волны организуют многоклеточные Dictyostelium холмики. Курс. биол. 5, 937-943 [PubMed] [Академия Google]
- Синглтон С.К., Зинда М.Дж., Микитка Б., Ян П. (1998). Гистидинкиназа dhkC регулирует выбор между мигрирующими слизнями и терминальной дифференцировкой у Dictyostelium discoideum. Дев. биол. 203, 345-357 [PubMed] [Академия Google]
- Содербом Ф., Анджард К., Иранфар Н., Фуллер Д., Лумис В.Ф. (1999). Аденилатциклаза, функционирующая на поздних стадиях развития Dictyostelium . Разработка. 126, 5463-5471 [PubMed] [Академия Google]
- Соуза Г.М., Лу С.Дж., Куспа А. (1998). YakA, протеинкиназа, необходимая для перехода от роста к развитию у Dictyostelium . Развитие 125, 2291-2302 [PubMed] [Академия Google]
- Соуза Г.М., да Силва А.М., Куспа А. (1999). Голодание способствует развитию Dictyostelium, снимая ингибирование PufA трансляции PKA через путь киназы YakA. Развитие 126, 3263-3274 [PubMed] [Академия Google]
- Суани К.Ф., Хуанг С.Х., Девреотс П.Н. (2010)Эукариотический хемотаксис: сеть сигнальных путей контролирует подвижность, определение направления и полярность. год. Преподобный Биофиз. 39, 265-289 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Суонсон А.Р., Ваделл Э.М., Кавендер Дж. К. (1999). Глобальное распространение диктиостелид лесных почв. Ж. Биогеогр. 26, 133-148 [Академия Google]
- Томасон П.А., Трейнор Д., Кавет Г., Чанг В.Т., Харвуд А.Дж., Кей Р.Р. (1998). Пересечение цАМФ/ПКА и двухкомпонентных систем передачи сигнала в Dictyostelium . EMBO J. 17, 2838-2845 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Томасон П. А., Трейнор Д., Сток Дж. Б., Кей Р. Р.(1999). Система RdeA-RegA, эукариотический фосфорный реле, контролирующий расщепление цАМФ. Дж. Биол. хим. 274, 27379-27384 [PubMed] [Академия Google]
- Томпсон Ч.Р., Кей Р.Р. (2000). Роль передачи сигналов DIF-1 в развитии Dictyostelium . Мол. Сотовый 6, 1509-1514 [PubMed] [Академия Google]
- Томпсон С. Р., Райхельт С., Кей Р. Р. (2004). Демонстрация формирования паттерна без позиционной информации у Dictyostelium. Дев.Разница в росте. 46, 363-369 [PubMed] [Академия Google]
- Трейнор Д., Кессин Р. Х., Уильямс Дж. Г. (1992). Хемотаксическая сортировка цАМФ на многоклеточной стадии развития Dictyostelium. Проц. Натл. акад. науч. США 89, 8303-8307 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ван Дрисше Н., Демсар Дж., Бут Э.О., Хилл П., Юван П., Зупан Б., Куспа А., Шаульский Г. (2005). Анализ эпистаза с глобальными транскрипционными фенотипами. Нац. Жене. 37, 471-477 [PubMed] [Академия Google]
- Ван Эс С., Вирди К.Дж., Питт Г.С., Мейма М., Сэндс Т.В., Девреотес П.Н., Коттер Д.А., Шаап П. (1996). Аденилатциклаза G, осмосенсор, контролирующий прорастание спор Dictyostelium . Дж. Биол. хим. 271, 23623-23625 [PubMed] [Академия Google]
- Ван М., Шаап П. (1989). Истощение аммиака и DIF запускают дифференцировку клеток стебля у интактных слизней Dictyostelium discoideum . Развитие 105, 569-574 [Академия Google]
- Ван М., Ван Дриэль Р., Шаап П. (1988). Циклическая АМФ-фосфодиэстераза индуцирует дедифференцировку преспоровых клеток у слизней Dictyostelium discoideum : доказательство того, что циклический АМФ является морфогенетическим сигналом для дифференцировки преспор. Развитие 103, 611-618 [Академия Google]
- Ван Н., Содербом Ф., Анжард С., Шаульский Г., Лумис В. Ф. (1999). Индукция терминальной дифференцировки SDF-2 у Dictyostelium discoideum опосредуется трансмембранной сенсорной киназой DhkA. Мол. Клетка. биол. 19, 4750-4756 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Венинг К.Э., Вейк И.В., Томпсон К.Р., Кессин Р.Х., Подгорски Г.Дж., Шаап П. (2003). Противопоставление активности агрегационных и поздних промоторов PdsA в развитии Dictyostelium . Дев. биол. 255, 373-382 [PubMed] [Академия Google]
- Weijer CJ (2009). Коллективная миграция клеток в процессе развития. J. Cell Sci. 122, 3215-3223 [PubMed] [Академия Google]
- Вест С.М. (2003). Сравнительный анализ образования споровой оболочки, структуры и функции Dictyostelium. Междунар. Преподобный Цитол. 222, 237-293 [PubMed] [Академия Google]
- Уильямс Дж. Г. (2006). Транскрипционная регуляция формирования паттерна Dictyostelium. EMBO Реп. 7, 694-698 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Уильямс Р.С., Бекелер К., Граф Р., Мюллер-Таубенбергер А., Ли З., Исберг Р.Р., Весселс Д., Солл Д.Р., Александр Х., Александр С. (2006).К молекулярному пониманию болезней человека с использованием Dictyostelium discoideum. Тенденции Мол. Мед. 12, 415-424 [PubMed] [Академия Google]
- Чжан С., Чарест П.Г., Фиртель Р.А. (2008). Пространственно-временная регуляция активности Ras обеспечивает направленное зондирование. Курс. биол. 18, 1587-1593 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зинда М.Дж., Синглтон С.К. (1998). Гибридная гистидинкиназа dhkB регулирует прорастание спор у Dictyostelium discoideum . Дев. биол. 196, 171-183 [PubMed] [Google Scholar]
Ученые раскрывают динамику и детерминанты сообщества амеб, появление и численность в водах субтропической среды обитания —- Китайская академия наук
Ученые добились нового прогресса в понимании динамики и детерминант амебы сообщество, встречаемость и численность в субтропических водоемах и реках.
Ученые из группы водного экоздоровья вместе с Кристофером Ренсингом и Регином Ронном из Института городской среды Китайской академии наук выбрали различные воды среды обитания (включая водохранилища и реки) в соответствии с градиентом от города к деревне, простирающимся от городских участков. в более сельские районы в субтропическом городе.
Свободноживущие амебы — это одноклеточные эукариотические микроорганизмы, они широко распространены как в естественных, так и в искусственных водных экосистемах и играют ключевую роль в очистке воды, биогеохимическом круговороте и поддержании плодородия водных и наземных экосистем.
Состав сообществ амеб меняется в зависимости от сезона в системе очистки питьевой воды, но механизмы, которые опосредуют сезонные колебания в структуре сообщества, недостаточно изучены.Точно так же большинство исследований сообществ амеб были сосредоточены на одном типе среды обитания, в то время как различия в составе свободноживущих сообществ амеб между средами обитания остаются плохо изученными.
В ходе исследования было отобрано в общей сложности 108 проб поверхностных вод на сезонной основе из четырех водохранилищ и двух рек в городе Сямэнь, субтропический Китай. Они использовали высокопроизводительное секвенирование и методы количественной ПЦР для изучения наличия и численности свободноживущих амеб.
Всего было выявлено 335 ОТЕ амеб, и только 32 ОТЕ были общими для водоемов и рек.В водохранилищах и реках обитали уникальные сообщества амеб, состав сообществ которых демонстрировал отчетливые сезонные закономерности.
Кроме того, временные закономерности сообществ амеб были в значительной степени связаны с температурой воды, что указывает на то, что температура является важной переменной, контролирующей экологическую динамику популяций амеб. Однако дальнейший сравнительный анализ показал, что как экологический отбор, так и нейтральные процессы в значительной степени способствовали сборке сообщества амеб.
Обнаруженные здесь роды включают патогенные виды и виды, которые могут действовать как переносчики микробных патогенов, вызывающих инфекции у человека.
В целом, результаты этого исследования показывают, что на сообщества свободноживущих амеб больше влияет среда обитания (река или водохранилище), чем время года в этих субтропических водных экосистемах.
Результаты также показывают, что абиотические факторы, в частности температура воды, играют важную роль в экологии амеб.И экологический отбор, и нейтральные процессы играют важную роль в сборке сообщества, тогда как стохастические процессы были более важны для формирования сообществ свободноживущих амеб в водохранилище, чем в реке.
Исследование было опубликовано в журнале Water Research под названием «Динамика и детерминанты сообщества амеб, встречаемость и численность в субтропических водоемах и реках».
Это исследование было поддержано Национальным фондом естественных наук Китая, Муниципальным бюро науки и технологий Сямыня.
Взаимодействие почвенных амеб с Paracoccidioides spp.
Реферат
Paracoccidioides spp. являются термодиморфными грибами, вызывающими запущенную тропическую болезнь (паракокцидиоидомикоз), эндемичную для Латинской Америки. Эти грибы населяют почву, где они живут как сапрофиты, не нуждаясь в млекопитающем-хозяине для завершения своего жизненного цикла. Несмотря на это, у них развились сложные признаки вирулентности, позволяющие им не только выживать в тканях хозяина, но и вызывать болезни.Гипотеза селективного давления, вызывающего появление или поддержание вирулентности почвенных грибов, заключается в их взаимодействии с почвенными хищниками, такими как амебы и гельминты. Мы оценили присутствие экологических амебоидных хищников в почве из нор броненосцев, где ранее был обнаружен и протестирован Paracoccidioides , если взаимодействие Paracoccidioides с амебами ведет к отбору грибов с повышенной вирулентностью. Нематоды, инфузории и амебы — все потенциальные хищники грибов — выросли в культурах из образцов почвы.Микроскопическое наблюдение и секвенирование ITS идентифицировали амеб как Acanthamoeba spp, Allovahlkampfia spelaea и Vermamoeba vermiformis . Эти три амебы эффективно проглатывают, убивают и переваривают Paracoccidioides spp. дрожжевые клетки, как и лабораторно адаптированный аксеник Acanthamoeba castellanii . Последовательное совместное культивирование Paracoccidioides с A . castellanii , выбранный по фенотипическим признакам, связанным с выживанием гриба в среде естественного хищника, а также в макрофагах мыши и в естественных условиях ( Galleria mellonella и мыши).Эти изменения вирулентности были связаны с накоплением альфа-глюканов клеточной стенки, полисахаридов, которые маскируют распознавание грибковых молекулярных паттернов рецепторами распознавания паттернов хозяина. В целом наши результаты показывают, что Paracoccidioides населяет сложную среду с множеством амебоидных хищников, которые могут оказывать избирательное давление, чтобы направлять эволюцию признаков вирулентности.
Резюме автора
Грибы из рода Paracoccidioides вызывают паракокцидиоидомикоз, забытую тропическую болезнь, которая в основном поражает бедных сельских рабочих в Латинской Америке. Paracoccidioides может жить всю свою жизнь в почве без необходимости заражать людей или других животных для завершения своего жизненного цикла. Исследования с другими такими свободноживущими организмами показывают, что они приобрели способность выживать и вызывать болезни у людей, взаимодействуя с почвенными хищниками, такими как амебы и черви. В этом исследовании мы исследовали организмы, присутствующие в почве, в которой ранее были обнаружены Paracoccidioides , с акцентом на хищных амеб. Культуры из образцов почвы показали многочисленные амебы, которые были выделены и идентифицированы с помощью генетических инструментов.Эти амебы смогли проглотить и уничтожить дрожжевых клеток Paracoccidioides . Более подробные эксперименты, проведенные с лабораторным штаммом Acanthamoeba castellanii , показали, что взаимодействие с амебами увеличивает способность грибов выживать и убивать не только клетки, такие как амебы и мышиные макрофаги, но и целые организмы, такие как личинки Galleria mellonella . и мыши. Это лучшее понимание среды обитания, в которой Paracoccidioides живет в природе, может привести к новым и улучшенным стратегиям предотвращения инфекции и, таким образом, уменьшить бремя этого заболевания.
Образец цитирования: Albuquerque P, Nicola AM, Magnabosco DAG, Derengowski LdS, Crisóstomo LS, Xavier LCG, et al. (2019) Скрытая битва в грязи: взаимодействие почвенных амеб с Paracoccidioides spp. PLoS Negl Trop Dis 13(10): e0007742. https://doi.org/10.1371/journal.pntd.0007742
Редактор: Тодд Б. Рейнольдс, Университет Теннесси, США
Получено: 18 июня 2019 г.; Принято: 2 сентября 2019 г.; Опубликовано: 7 октября 2019 г.
Авторское право: © 2019 Albuquerque et al.Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные содержатся в рукописи и файлах вспомогательной информации.
Финансирование: Эта работа была поддержана грантами бразильских агентств Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (http://www.cnpq.br/) и Fundação de Apoio à Pesquisa do Distrito Federal (FAP-DF-Brazil) (www.fap.df.gov.br/) для PA и ISP. AC был частично поддержан грантами NIH 5R01HL059842, 5R01AI052733. Это исследование также частично финансировалось за счет стипендий от Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Капс-Бразилия, финансовый код 001). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Люди постоянно сталкиваются с микроорганизмами практически в любой среде и при любых обстоятельствах. Однако эффективные иммунные реакции хозяина гарантируют, что очень немногие из них вызывают заболевание. Патогенные микроорганизмы обычно обладают сложным набором признаков вирулентности, которые позволяют им ускользать от иммунных эффекторов, размножаться и вызывать заболевания [1]. Иммунитет является решающим селективным давлением, определяющим эволюцию признаков вирулентности у микробных патогенов, тесно связанных с хозяевами-млекопитающими.Однако эволюция вирулентности у микробов, которым не нужно взаимодействовать с млекопитающими для завершения своего жизненного цикла, таких как возбудители большинства грибковых инвазивных заболеваний, гораздо менее ясна. Эти агенты включают патогенные виды рода Paracoccidioides . Пять видов этого рода термодиморфных грибов, P . бразильский , P . американа , P . остатки , P . venezuelensis и P . lutzii , вызывают паракокцидиоидомикоз (ПКМ), один из наиболее распространенных системных микозов в Латинской Америке [2, 3]. Это забытое заболевание является важной причиной заболеваемости и смертности среди мужчин из сельской местности в этих странах. Заражение происходит при вдыхании переносимых по воздуху грибковых пропагул (фрагментов мицелия или конидий) из окружающей среды, и большинство инфекций протекает бессимптомно. Однако у некоторых пациентов все же развивается ПКМ, которая варьируется от легкой пневмонии до опасного для жизни системного заболевания [4, 5].
За последние два десятилетия несколько исследований, проводимых с другими видами инвазивных грибковых патогенов ( Cryptococcus Neofmors , C . Gattii , Sporothrix Schenckii , Blastomyces Dermatitidis , Histoplasma Capsulatum и Aspergillus fumigatus ) дали убедительное объяснение эволюции вирулентности у этих почвенных сапрофитов: чтобы избежать нападения почвенных амеб, необходимы фенотипические признаки, которые также обеспечивают защиту от иммунной защиты млекопитающих и, таким образом, связаны с вирулентностью [6–10].Каждый из этих грибов выжил после совместного культивирования с фагоцитирующими одноклеточными организмами, такими как Acanthamoeba castellanii и Dictyostelium discoideum , благодаря фенотипическим признакам, которые также эффективны в уклонении от макрофагов человека. Более того, их совместное культивирование с амебами отбирает выживших, которые более вирулентны в моделях млекопитающих. Воздействие других почвенных хищников, таких как инфузории и гельминты, предполагает более сложный сценарий взаимодействия, чем тот, который наблюдается у амеб [11, 12].Однако эти исследования проводились в контролируемых лабораторных условиях с использованием в основном чистых и аксеничных культур лабораторно адаптированных хищников; эта очень информативная система, тем не менее, является крайним упрощением сложной экосистемы почвенных сапрофитов, встречающихся в природе. В этой работе мы углубились в экологию почвенной среды в регионе, где Paracoccidioides spp. ранее были подтверждены гнездовой ПЦР, изучающей как состав популяций хищников, так и взаимодействие между некоторыми из них и клетками Paracoccidioides .
Материалы и методы
Paracoccidioides spp. обслуживание и подготовка к взаимодействиюДля наших исследований мы использовали три Paracoccidioides spp. изоляты: Pb18, a P . клинический изолят brasiliensis ; PbT16B1, P . Изолят brasiliensis , полученный ранее из селезенки девятипоясного броненосца ( Dasypus novemcinctus ) [13], и Pb01, a P . lutzii клинический изолят. PbT16B1 был получен из микологических коллекций Лаборатории биологии грибов (Отдел микробиологии и иммунологии, Институт биологических наук, UNESP, Ботукату, СП). Pb18 и Pb01 являются частью коллекции микологии Университета Бразилиа (кафедра клеточной биологии). Дрожжевую фазу этих изолятов поддерживали путем субкультивирования каждые семь дней в среде Фава-Нетто (1% мас./об. пептона, 0,5% мас./об. дрожжевого экстракта, 0,3% мас./об. протеозопептона, 0,5% мас./об. экстракта говядины, 0,5% мас./об. .5 % масс./об. NaCl, 4 % масс./об. глюкозы и 1,4 % масс./об. агара, pH 7,2) или среда GPY (2 % глюкозы масс./об., 1 % пептона масс./об., 0,5 % дрожжевого экстракта масс./об. и 2% агара вес/объем) и инкубируют при 37°C. Для опытов использовали пятидневные культуры. Перед анализом взаимодействия грибковые клетки собирали, трижды промывали PBS и разводили до соответствующей плотности клеток. Использовали только культуры с жизнеспособностью выше 80%, измеренной с помощью красителя жизнеспособности флоксина В (Sigma-Aldrich).
Аксенические амебы
А . castellanii 30234 ( American Type Culture Collection — ATCC, Манассас, Вирджиния, США) культивировали в среде PYG (2% протеозопептона, 0,1% дрожжевого экстракта, 1,8% глюкозы, 0,1% дигидрата цитрата натрия, 2,5 мМ Na ). 2 HPO 4 , 2,5 мм kh 2 , 4 мм 4 , 4 мм MGSO 4 , 400 мкм CaCl 2 и 50 мкм Fe (NH 4 ) 2 (SO 4 ) 2 ) при 28°C, как описано ранее [8].
Изоляция почвенных амеб и уход за ними
Почвенные амебы были выделены из образцов нор броненосцев, расположенных на ферме Лагеадо (−22° 50’ 14.36” широты и −48° 25’ 31,35″ долготы), район отлова броненосца, из которого был выделен PbT16B1; в этом месте гриб также был обнаружен в почве с помощью гнездовой ПЦР [13]. Кроме того, сельские рабочие, которые жили и/или работали в этом регионе, были диагностированы или умерли от ПКМ [14]. Около пяти граммов каждого образца почвы смешивали с 20 мл стерильного солевого раствора Неффа, модифицированного Пейджем (PAS– 2 мМ NaCl, 33 мМ MgSO 4 , 27 мМ CaCl 2 , 1 мМ Na 2 HPO 4 ). , 1 мМ KH 2 PO 4 ) и энергично перемешивали для гомогенизации образцов.После седиментации в течение 5 минут 100 мкл каждого образца распределяли по чашке с непитательным агаром (ПАС + 1,5% агар), содержащей газон убитых нагреванием Escherichia coli OP50. Чашки инкубировали при 25°С в течение 10–14 дней и ежедневно наблюдали под световой микроскопией на наличие цист амеб или трофозоитов [15, 16]. Срезы агара, содержащие цисты или трофозоиты, вырезали и переносили на новые чашки для обогащения культур. Наконец, амебы переносили в PAS, подсчитывали и подвергали клонированию в предельном разведении.Было невозможно получить аксеновые культуры, поэтому эти свежевыделенные амебы содержались в PAS или в чашках с непитательным агаром с E . coli штамм OP50 в качестве источника пищи.
Выделение ДНК для типирования почвенных амеб
ВыделениеДНК из почвенных амеб проводили с использованием протокола UNSET [17] или набора QIAamp DNA Blood Mini Kit (Qiagen). Идентификацию изолятов амеб проводили методом ПЦР с использованием общих праймеров для амеб AmeF977 (GATYAGATACCGTCGTAGTC) и AmeR1534 (TCTAAGRGCATCACAGACCTG) [18] или специфичных для Acanthamoeba праймеров JDP1 (GGCCCAGATCGTTTACCGTGAA) и JDP2 (TCTCACAAGCTGCTAGGGAGTCA) [19].ПЦР-фрагменты очищали и клонировали в вектор TOPO TA (Thermo Fisher) и трансформировали в DH5-α E . кишечная палочка . По меньшей мере три плазмидных клона очищали и секвенировали по Сэнгеру для каждого изолята амебы. Последовательности были бластированы против GenBank и депонированы в BioProject 506281. Все последовательности для клонов, полученных из каждого из 7 изолятов, привели к одинаковым попаданиям BLAST.
Почвенная амеба и
P . brasiliensis анализы взаимодействияОтдельные изоляты амеб были собраны из наших запасов культур, трижды промыты для удаления бактерий, высеяны на чашки со стеклянным дном и совместно инкубированы с P .Клетки brasiliensis предварительно окрашивали FITC или pHrodo (Thermo Fisher). Множественность заражения (MOI) равнялась единице, коинкубацию проводили в течение 24 часов при 25°С. Затем образцы окрашивали Uvitex 2B (Polysciences, Inc) для различения внутриклеточных и внеклеточных грибковых клеток [20] и исследовали в инвертированном микроскопе Zeiss Axio Observer Z1 с использованием объектива 40X/NA 0,6 для количественной оценки фагоцитоза. Анализировали не менее 100 амеб на образец, эксперименты проводили не менее трех раз в разные дни.В качестве альтернативы, анализы хищничества, в которых почвенные амебы инкубировались в твердом непитательном агаре с газоном P . Клетки brasiliensis проводили, как описано ниже. Жизнеспособность почвенных амеб после взаимодействия оценивали по исключению трипанового синего, как описано ранее [8].
Почвенная амеба и
P . brasiliensis анализы хищничестваР . Клетки дрожжей brasiliensis промывали в PBS и большие скопления клеток удаляли, пропуская клетки через 40-микронные фильтры для клеток или многократными пассажами через иглы 26-го калибра.После этого с помощью гемоцитометра определяли плотность клеток и определенное количество грибковых клеток высевали в центр чашек с непитательным агаром. После высыхания газона с грибковыми клетками мы помещали аликвоты суспензии различных изолятов почвенных амеб в центр чашек. Планшеты хранили при 25°С и ежедневно проверяли на наличие бляшек лизиса грибковых клеток.
Анализ фагоцитоза и уничтожения на взаимодействие
Paracoccidioides spp с аксеником A . КастелланиЯчейки A . castellanii высевали на 96- или 24-луночные микропланшеты в количестве 5 x 10 4 и 2 x 10 5 клеток на лунку соответственно и инкубировали с дрожжевыми клетками (1 x 10 5 и 4 x 10 ). 5 клеток/лунку) для разных временных интервалов (6, 24 или 48 часов) при 28°С или 37°С (MOI = 2). После совместной инкубации супернатант удаляли, клетки фиксировали холодным метанолом в течение 30 мин при 4°С и окрашивали в течение ночи по Гимзе.Затем образцы наблюдали и фотографировали в инвертированном микроскопе Zeiss Axio Observer Z1. В каждом состоянии процент фагоцитоза оценивали после окрашивания по Гимза. Альтернативно, фагоцитоз оценивали с помощью флуоресцентной микроскопии с использованием грибковых клеток, предварительно окрашенных CMFDA или FITC перед взаимодействием. Анализировали не менее 100 амеб на образец, эксперименты проводили не менее трех раз в разные дни. А . Жизнеспособность castellanii после взаимодействия оценивали по исключению трипанового синего, как описано ранее [8].Выживаемость грибов после взаимодействия оценивали путем подсчета КОЕ после лизиса амеб, как описано ниже.
Paracoccidioides spp. выживаемость после взаимодействия с амебамиДля оценки выживаемости грибка при совместной инкубации с амебами организмы совместно культивировали в течение шести или 24 часов в 24-луночных планшетах (MOI два). Затем клетки отделяли от планшетов и подвергали 5–8 пассажам через шприц 26 размера для лизиса амеб. Оставшиеся дрожжевые клетки серийно разбавляли и высевали на твердый BHI с добавлением 4% лошадиной сыворотки, 5% кондиционированной среды штамма Pb192 P . brasiliensis (BHI-sup) [21] и хлорамфеникол (34 мкг/мл). Планшеты инкубировали при 37°С в течение 7–10 дней для подсчета колоний. Для каждого условия анализировали не менее трех скважин, а эксперименты проводили не менее трех раз в разные дни.
Конфокальная микроскопия
Стерильные покровные стеклапомещали на шестилуночные планшеты и в каждую лунку добавляли 5×10 6 клеток амебы в среде PYG. После двух часов адгезии амебы метили флуоресцентными красителями (DiD-DS для клеточной мембраны или DDAO-SE для внутриклеточных белков).После этого амебы совместно инкубировали с 10 7 клеток P . brasiliensis (MOI два), предварительно окрашенный CMFDA. После двух часов взаимодействия покровные стекла промывали, фиксировали холодным метанолом и помещали на предметные стекла для конфокальной микроскопии в микроскопе Leica SP5 с использованием объектива 63x NA 1,4.
Трансмиссионная электронная микроскопия (ПЭМ)
Для электронной микроскопии, P . Клетки дрожжей brasiliensis инкубировали отдельно или в присутствии амеб (MOI два) в течение двух, четырех или 24 часов при 25°C или 28°C.Образцы фиксировали в 2,5% глутаральдегиде, 3 мМ MgCl 2 , 0,1 М буфере какодилата натрия, рН 7,2, в течение ночи при 4°С. После промывки буфером образцы фиксировали в 1% четырехокиси осмия в буфере (1 час) на льду в темноте с последующим повторным ополаскиванием 0,1 М буфером какодилата натрия. Образцы оставляли при 4°C на ночь в буфере, промывали 0,1 М малеатным буфером, en bloc окрашивали 2% уранилацетатом (фильтр 0,22 мкм, 1 час, в темноте) в 0,1 М малеате, обезвоживали в градуированной серии. этанола и пропиленоксида и залитых смолой Eponate 12 (Ted Pella) [22].Образцы полимеризовали при 60°С в течение ночи. Тонкие срезы размером от 60 до 90 нм каждый вырезали алмазным ножом на ультрамикротоме Reichert-Jung Ultracut E и собирали с помощью голых медных сеток 200 меш. Сетки окрашивали 2% ацетатом уранила (водн.), а затем цитратом свинца и наблюдали в ПЭМ Philips CM120 при 80 кВ. Изображения были сняты с помощью 8-мегапиксельной камеры высокого разрешения AMT XR80 (16 бит).
Сканирующая электронная микроскопия (СЭМ)
Для электронной микроскопии, P .Клетки дрожжей brasiliensis инкубировали отдельно или в присутствии амеб (MOI два) в PAS в течение двух, четырех или 24 часов при 25°C или 28°C в 24-луночных планшетах, содержащих полилизиновые покровные стекла. После этого образцы были обработаны для РЭМ по ранее опубликованным протоколам с некоторыми изменениями. Вкратце, образцы фиксировали в 2,5% глутаральдегиде, 3 мМ MgCl 2 , в 0,1 М буфере какодилата натрия, рН 7,2, в течение ночи при 4°С. После ополаскивания буфером образцы фиксировали в 1% четырехокиси осмия в буфере (1 час) на льду в темноте с последующим двухкратным ополаскиванием дистиллированной водой и обезвоживанием в этаноле.[23]. Образцы были высушены для СЭМ с помощью HMDS и установлены на стержни с углеродным покрытием, покрытые 20 нм AuPd, и визуализированы на Leo FE-SEM при 1 кВ.
Последовательное взаимодействие
A . castellanii и Paracoccidioides spp.Мы совместно культивировали Paracoccidioides spp. ячейки с А . castellanii в течение шести часов при 28°C в среде PYG при множественности инфекций, равной двум. Затем клетки отделяли от планшетов и пропускали 5–8 раз через шприц 26G для лизиса амеб.Оставшиеся дрожжевые клетки высевали на твердый BHI-Sup (4% лошадиная сыворотка, 5% кондиционированная среда штамма Pb192 P . brasiliensis , 34 мкг/мл хлорамфеникола). Планшеты инкубировали при 37°C в течение недели, и восстановленные клетки собирали с планшетов, трижды промывали PBS, подсчитывали и использовали в последующем раунде взаимодействия с A . castellanii еще на шесть часов. Этот процесс был повторен в общей сложности пять раз, и полученные пассированные штаммы были затем названы Pb18-Ac.Штамм Pb18, культивированный в PYG в течение шести часов при 28°C, а затем высеянный на BHI-Sup, использовали для сравнения.
Galleria mellonella инфекцияЛичинки восковой моли содержались в стеклянных флаконах в темноте в инкубаторе при 29°С. Колонию содержали на искусственной диете, состоящей из порций 500 г овсяных хлопьев, 100 г сахарозы, 100 мл глицерина, 100 г меда и 100 мл дистиллированной воды [24]. В тестах на выживаемость использовали личинок массой от 180 до 250 мг.Перед каждым экспериментом собирали личинок, рандомизировали их на группы по 12–16 особей и очищали поверхность 70%-ным этанолом. Каждая группа получала инъекцию 10 мкл PBS или суспензии дрожжевых клеток (Pb18 или Pb18-Ac) в количестве 10 ± клеток/мл в заднюю левую ложную ногу. Все суспензии дрожжей содержали ампициллин (20 мг/кг) для предотвращения заражения бактериями с поверхности личинки. Группы зараженных личинок помещали в чашки Петри, инкубировали при 37°С и ежедневно отслеживали на выживаемость [25].
Анализ инфекции и выживания мышей
Мы заразили изогенных 10-недельных самцов мышей BALB/c Pb18-Ac или непассированным Pb18. Клетки из каждой группы собирали с планшетов BHI-sup через пять дней культивирования, промывали в PBS, подсчитывали, оценивали на жизнеспособность и разводили до подходящей плотности клеток. Мышей анестезировали с использованием комбинации 100 мг/кг массы тела кетамина и 10 мг/кг массы тела ксилазина, вводимых внутрибрюшинно. Для инфицирования 10 6 клеток каждого образца интратрахеально инокулировали в две группы по 14 мышей в каждой.Животные находились под клиническим наблюдением в течение 12 мес после заражения и умерщвленных животных (определяемых по вялости, одышке и потере веса) подвергали эвтаназии. Эксперимент был организован как слепой: исследователи, которые заражали и наблюдали за мышами, не знали, какой штамм вводили каждой группе, до окончания эксперимента.
Количественная ОТ-ПЦР
P . brasiliensis Гены Pb18 и Pb18-Ac, потенциально участвующие во взаимодействии хозяин-патогенСуммарную РНК клеток Pb18 и Pb18-Ac экстрагировали с использованием мини-набора Qiagen RNeasy Plant Minikit в соответствии с прилагаемым протоколом, включая обработку не содержащей РНКазы ДНКазой поставщика, чтобы избежать загрязнения ДНК.Образцы количественно определяли на спектрофотометре Nanodrop (Thermo Fisher). Для синтеза кДНК 2 мкг общей РНК из каждого образца подвергали обратной транскрипции с использованием набора для обратной транскрипции кДНК высокой емкости (Thermo Fisher) в соответствии с инструкциями производителя. кДНК использовали в качестве матрицы для количественной ПЦР в трех повторностях с использованием Fast SYBR Green Master Mix (Thermo Fisher) с условиями циклирования в соответствии с протоколом производителя, адаптированным для реакционного объема 10 мкл. Транскрипт L34 использовали в качестве эндогенного контроля [26].Эффективность амплификации использованных праймеров оценивали методом стандартной кривой, и они перечислены в таблице S1. Изменения количества транскриптов определяли количественно методом 2 -ΔΔCt [27], при этом кратность изменения определяли как отношение значений для каждого транскрипта между непассированными и пассированными штаммами. Олигонуклеотиды, использованные в этих экспериментах, описаны в таблице S1.
Анализ методом проточной цитометрии для обнаружения α-глюкана в клеточной стенке грибка
После пятого цикла взаимодействия с амебой Pb18-Ac и клетки Pb18 высевали на твердый BHI-sup и выращивали около недели.После этого клетки собирали, промывали 3 раза PBS, фиксировали параформальдегидом и инкубировали с MOPC 104E (Sigma), антителом, которое специфически распознает α-(1,3)-глюкан. Затем их промывали и инкубировали со вторичным антителом к IgM, конъюгированным с Alexa Fluor 488 (Thermo Fisher). После промывки клеточные суспензии анализировали на проточном цитометре BD LSR Fortessa. Полученные данные были проанализированы с помощью программного обеспечения FlowJo.
Статистический анализ
Все статистические анализы проводились с использованием GraphPad Prism 8.0 (программное обеспечение GraphPad). Процент фагоцитоза и процент жизнеспособности амебы (% мертвой амебы) оценивали с помощью точного критерия Фишера. Кривые выживания анализировали с использованием логарифмического рангового критерия и критерия Уилкоксона. Для экспериментов с КОЕ мы использовали однофакторный дисперсионный анализ с посттестом множественного сравнения Тьюки или непарный t-критерий при сравнении только двух образцов. Количественный ПЦР-анализ проводили с помощью непарных t-тестов.
Заявление об этике
Все эксперименты на мышах были предварительно одобрены Комитетом по использованию животных в исследованиях Католического университета Бразилиа (протокол 017/14) в соответствии с бразильскими законами об использовании экспериментальных животных и Этическими принципами исследований на животных, принятыми бразильским Колледж по контролю над экспериментами на животных.
Результаты
Несколько групп потенциальных хищников присутствуют в среде, в которой
P . brasiliensis жизниПервоначальный микроскопический анализ культур, полученных из проб почвы с положительной ДНК Paracoccidioides , как схематически представлено на рис. 1A, выявил присутствие нескольких потенциальных хищников, включая несколько морфотипов амеб, инфузорий и нематод (рис. 1B–1I). Хотя инфузории и нематоды известны C . neoformans хищников [11, 12], мы решили сосредоточиться на амебоидных хищниках. После использования предельного разведения для получения чашек, которые, казалось, содержали только один тип амебы, мы предприняли несколько попыток установить аксеновые или моноксенные культуры. Однако нам не удалось добиться успеха даже при наличии нескольких антибиотиков. Мы очистили ДНК из различных изолятов и провели ПЦР с использованием праймеров, специфичных для Amoebozoa и для идентификации Acanthamoeba spp. Секвенирование и сравнение с GenBank показало, что у нас было два изолята Allovahlkampfia spelaea , три изолята Vermamoeba vermiformis (ранее Hartmannella vermiformis ) и два изолята Acanthamoeba spp (Sequences были депонированы в разделе 682Projects150).Все последовательности из одних и тех же изолятов привели к одинаковым совпадениям в GenBank.
Рис. 1. Почвенные организмы, разделяющие предполагаемую среду обитания P . бразильский .
A) Схематическое представление методологии выделения почвенной амебы. Образцы почвы из нор броненосца положительны на P . ДНК brasiliensis собирали и использовали для выделения почвенных амеб. Образцы помещали в чашки с непитательным агаром, содержащим бактериальный газон в качестве источника пищи, и наблюдали в инвертированном микроскопе. B) Микроскопия в светлом поле реснитчатых трофозоитов (черные наконечники стрел), присутствующих в образце почвы.Масштабная линейка = 20 μ м, C) Светлопольная микроскопия нематоды, присутствующей в образце почвы. Масштабная линейка = 50 мкм м, D) и E) ДИК-микроскопия трофозоитов A . спелеа . Масштабная линейка = 10 мкм м. F и G) ДИК-микроскопия трофозоитов V . червеобразный . Масштабная линейка = 10 мкм м. H и I) ДИК-микроскопия трофозоитов Acanthamoeba spp. Масштабная линейка = 10 мкм м.
https://дои.org/10.1371/journal.pntd.0007742.g001
Изоляты почвенной амебы взаимодействуют с
P и убивают его. brasiliensis дрожжевые клеткиМы проверили, способны ли эти почвенные амебы фагоцитировать P . brasiliensis путем совместного инкубирования их в течение 24 часов в PAS после добавления антибиотика и удаления большинства бактериальных клеток, которые использовались для питания амеб. Каждый из трех изолятов амебы был способен фагоцитировать P . brasiliensis (рис. 2А), даже в присутствии оставшихся бактериальных клеток из культур амеб, которые, вероятно, являются предпочтительным источником пищи.Мы также наблюдали, что выделенный Acanthamoeba spp. снизилась жизнеспособность после 24 часов совместной инкубации с P . brasiliensis , а изолированный A . spelaea лучше выживал в присутствии дрожжевых клеток (рис. 2В).
Рис. 2. Взаимодействие между P . brasiliensis Pb18 с амебами, выделенными из почвы нор броненосца, положительными на P . бразильский .
Изоляты амеб совместно инкубировали с Pb18, предварительно окрашенным pHrodo или FITC, при множественности заражения два при 25°C в течение 24 часов в среде PYG. А) Процент клеток амебы, взаимодействующих с P . бразильский Pb18. После взаимодействия неинтернализированные клетки Pb18 окрашивали с использованием Uvitex 2B. Б) Жизнеспособность различных изолятов амеб после 24 часов взаимодействия с Pb18. A и B изображают результаты как минимум трех независимых экспериментов. Для каждого анализа подсчитывали не менее 100 клеток на повтор каждого образца.Столбцы представляют 95% доверительные интервалы. C-F) суспензия A . Клетки spelaea помещали рядом с колонией P . Клетки brasiliensis в непитательном агаре. Клетки совместно инкубировали при 25°С и ежедневно исследовали в инвертированном микроскопе. C) Макроскопический вид грибковой колонии на 35-мм пластине. D) Микроскопический вид лужайки грибковых клеток после семи дней взаимодействия. E) Микроскопический вид трофозоитов амеб, растущих на периферии грибного газона.F) Микроскопический вид трофозоитов амебы, взаимодействующих с грибковой клеткой. Шкала баров = 50 μ м. Черные стрелки указывают на трофозоиты. Белые стрелки указывают на грибковые клетки.
https://doi.org/10.1371/journal.pntd.0007742.g002
Присутствие устойчивых к антибиотикам бактерий в выделенных культурах амеб помешало нам оценить P . brasiliensis жизнеспособность после взаимодействия с почвенными амебами путем подсчета КОЕ. Из-за медленного роста этого грибка все чашки были покрыты бактериями, прежде чем мы смогли наблюдать грибковые колонии.Чтобы устранить это ограничение, мы провели анализ хищничества в чашке с непитательным агаром, где P . brasiliensis газонов подвергались воздействию изолятов почвенных амеб. Мы смогли наблюдать участки клиренса грибковых клеток, начиная с 7-го дня взаимодействия со всеми изолятами амебы, примером чего является чашка с агаром, содержащая P . brasiliensis клеток с A . spelaea показан на рис. 2C–2F. После семи дней совместной инкубации мы могли видеть множество трофозоитов, смешанных в газоне грибковых клеток и вокруг колонии (рис. 2D).Большинство грибковых клеток имели измененную морфологию, напоминающую мертвые пустые раковины (рис. 2Е), и мы наблюдали, как некоторые грибковые клетки взаимодействовали с амебами (рис. 2F). Взаимодействия с другими изолятами показаны на рис. S1. Кроме того, после двух недель или более взаимодействия мы наблюдали скудные грибковые филаментации в образцах совместной культуры, возможно, потому, что большинство грибковых клеток были мертвы, в то время как контрольные грибковые пятна без амеб демонстрировали интенсивный рост. филаментация (S2 рис.).
Мы дополнительно оценили взаимодействие грибов с тремя различными видами амеб в солевой суспензии после 4 или 24 часов взаимодействия с помощью ПЭМ и СЭМ, как показано на рис. 3.Анализ ПЭМ выявил интернализированные грибковые клетки и/или остатки клеточных стенок внутри вакуолей амеб трех разных видов, A . spelaea (рис. 3A и 3B), Acanthamoeba spp. (рис. 3E и 3F) и V . vermiformis (рис. 3I и 3J) в обе временные точки. SEM подтвердил контакт между тремя разными видами амеб с P . brasiliensis во всех взаимодействиях (фиг. 3C, 3D, 3G, 3H, 3K и 3L). Следует отметить, что V .Клетки vermiformis могут быть значительно меньше крупных клеток P . Материнские клетки brasiliensis (фиг. 3K и 3L). Оба подхода электронной микроскопии выявили крайние морфологические изменения в большинстве клеток грибов при взаимодействии с тремя амебами по сравнению с клетками грибов, растущими отдельно, которые были включены в качестве контроля (рис. S3, панели A-D). Контрольные грибковые клетки демонстрировали более сохранное содержимое цитоплазмы и общую морфологию как в ПЭМ, так и в СЭМ. С другой стороны, мы наблюдали множество разрушенных грибковых клеток в совместных культурах, в том числе материнские клетки с сокращающимися почками и перфорациями в клеточной стенке, что может объяснить наблюдение пустых оболочек клеточных стенок в TEM (рис. 3 и S3 рис.).В целом эти результаты подтверждают способность амеб убивать Paracoccidioides и предполагают, что для объяснения того, как они это делают, необходимо рассмотреть стратегии, выходящие за рамки фагоцитоза грибов.
Рис. 3. Анализ ПЭМ и СЭМ взаимодействия P . brasiliensis Клетки Pb18 и различные почвенные амебы.
Изоляты совместно инкубировали с Pb18 при множественности заражения два при 25°C в течение 4 или 24 часов в PAS и фиксировали для микроскопии. A-B) TEM взаимодействия P . brasiliensis с A . spelaea (4 ч, 24 ч). Шкала баров = 500 нм. C-D) SEM взаимодействия P . brasiliensis с A . спелеа . Шкала баров = 10 мкм. E-F) ПЭМ взаимодействия P . brasiliensis с Acanthamoeba spp. (4 ч, 24 ч). Шкала баров = 2 мкм. G-H) SEM взаимодействия P . brasiliensis с Acanthamoeba spp. . Шкала баров = 10 мкм.I-J) ТЭМ взаимодействия P . brasiliensis с V . vermiformis (4 ч, 24 ч). Шкала баров = 2 мкм. K-L) SEM взаимодействия P . brasiliensis с V . червеобразный . Шкала баров = 10 мкм. Белые стрелки указывают на грибковые клетки или их остатки, а черные стрелки указывают на клетки амеб.
https://doi.org/10.1371/journal.pntd.0007742.g003
Acanthamoeba castellanii из аксенических культур может эффективно фагоцитировать и уничтожать P . brasiliensis клетокПоскольку почвенные бактерии, оставшиеся в культурах амеб, были третьим компонентом системы микробного взаимодействия и, следовательно, искажающим фактором, мы решили дополнительно оценить взаимодействие грибковых клеток с почвенными амебами с использованием аксенизированных культур A . кастелланий . Анализ кокультуры A . castellanii с Pb18 с помощью световой микроскопии после окрашивания по Гимзе (рис. 4А и 4В), просвечивающей электронной микроскопии (рис. 4С) и конфокальной микроскопии (рис. 4D) выявили взаимодействие и проглатывание дрожжевых клеток амебами.Краситель для маркировки клеточных стенок Uvitex 2B (синий), который не проникает в жизнеспособные или непермеабилизированные клетки, подтвердил интернализацию некоторых грибов. Черная стрелка на рис. 4D указывает на интернализованную дрожжевую клетку, которая не помечена CMFDA, что вместе с неправильной морфологией предполагает, что эта дрожжевая клетка, вероятно, мертва.
Рис. 4. P . brasiliensis Взаимодействие Pb18 с аксеником A . кастелланий штамм .
А) Р . brasiliensis и A . castellanii совместно инкубировали при множественности заражения один в течение одного часа при 28°C, а затем окрашивали по Гимзе и наблюдали с помощью световой микроскопии. B) Увеличение площади, изображенной в квадратной области панели A. C) TEM взаимодействия A . castellanii и клетки Pb18. Инкубация проводилась при MOI один в течение шести часов при 28°C, а затем фиксировалась. Черная стрелка указывает на интернализированный P . brasiliensis (Шкала = 2 мкм).Г) Конфокальная микроскопия. А . castellanii был окрашен DiD-DS (красный), а P . Клетки brasiliensis метили сначала CMFDA (зеленый), а после взаимодействия с Uvitex 2B (синий). Стрелками показаны грибковые клетки внутри амебы. (Шкала шкалы = 10 мкм). E и F) Выживание P . brasiliensis после взаимодействия с A . кастелланий . Инкубация проводилась при MOI, равной двум, при 28°C в течение шести (E) или 24 часов (F), с использованием одного грибка в качестве контроля.После взаимодействия клетки амебы лизировали, а клетки грибов высевали на чашки для подсчета КОЕ. На рисунке представлены результаты трех независимых экспериментов. Столбики погрешностей представляют собой стандартную ошибку среднего.
https://doi.org/10.1371/journal.pntd.0007742.g004
Процент фагоцитоза P . brasiliensis по A . castellanii наблюдали через разные промежутки времени, от 30 минут до 24 часов взаимодействия.Он варьировался от 39% через 30 минут до 68% через шесть часов (рис. S4).
Мы также оценили результат хищничества амеб путем измерения жизнеспособности грибковых клеток с помощью КОЕ после шести и 24 часов взаимодействия с A . кастелланий клеток. Не было значительного снижения выживаемости грибов с амебой или без нее в более ранний момент времени (рис. 4E), но количество грибковых КОЕ уменьшилось на 90% после 24 часов взаимодействия (рис. 4F), что указывает на то, что A . castellanii был очень эффективен в уничтожении грибков.С другой стороны, анализ исключения трипанового синего на амебах после взаимодействия с P . brasiliensis показал, что жизнеспособность амебы практически не пострадала от грибка. Мы обнаружили небольшую разницу в их жизнеспособности только через шесть часов при 28°C, но не в другие моменты времени при этой температуре или в любые моменты времени при 37°C по сравнению с неинфицированным контролем (S5A Рис. ). Чтобы оценить, является ли этот эффект результатом более широкой потери вирулентности из-за субкультивирования грибка in vitro, мы проверили вирулентность того же изолята Pb18 против макрофагов J774.В отличие от наших наблюдений с амебами, мы наблюдали значительное снижение жизнеспособности макрофагов через 24 часа (увеличение мертвых клеток на 16-25%) или 48 часов взаимодействия (на 22-33%) (рис. S5B).
Существуют различия в способности разных штаммов
Paracoccidioides spp. выжить при взаимодействии с амебамиМы также оценили взаимодействие A . castellanii с P . lutzii (Pb01) и P . brasiliensis PbT16B1, изолят, полученный от броненосца. А . castellanii был способен интернализовать клетки трех различных изолятов Paracoccidioides spp. с аналогичными показателями (рис. 5А). Не было никакой разницы в способности P . lutzii штамма Pb01 по отношению к Pb18 для уничтожения амеб или для выживания в течение шести часов взаимодействия (фиг. 5B и 5C). Однако совместная инкубация с T16B1 приводила к зависящему от времени увеличению смертности амебы по сравнению с обоими другими штаммами (рис. 5B и S6, рис.), в то время как два других изолята были способны вызывать временное снижение жизнеспособности амебы только через 6 часов взаимодействия.Кроме того, изолят броненосца также был способен выживать при взаимодействии с амебами лучше, чем два других штамма (рис. 5C). Мы наблюдали примерно пятикратное увеличение КОЕ T16B1 после взаимодействия по сравнению с двумя другими штаммами.
Рис. 5. Взаимодействие штаммов Paracoccidioides spp с A . castellanii в шесть часов.
Amoeba и три разных штамма Paracoccidiodes spp (Pb18 – P . brasiliensis , Pb01 – P . лутции , PbT16B1 – P . brasiliensis , выделенный из селезенки броненосца), совместно инкубировали при множественности заражения два в течение шести часов при 28°C. А) Процент от А . Клетки castellanii , взаимодействующие с клетками Paracoccidioides spp. Взаимодействие оценивали путем подсчета не менее 100 фагоцитирующих клеток на повтор каждого образца после окрашивания образцов по методу Гимза. Столбцы представляют 95% доверительные интервалы.B) Жизнеспособность A . castellanii при взаимодействии с Paracoccidioides spp. Жизнеспособность оценивали путем подсчета не менее 100 клеток в повторности каждого образца после окрашивания трипановым синим. Столбцы представляют средние значения плюс 95% доверительные интервалы. C) Выживание грибковых клеток различных штаммов Paracoccidioides spp после взаимодействия с амебами. Столбики погрешностей представляют собой стандартную ошибку среднего. На рисунках представлены объединенные результаты как минимум трех независимых экспериментов.* Все штаммы показали значительную разницу в % мертвых амеб через шесть часов по сравнению с контрольными амебами, растущими поодиночке.
https://doi.org/10.1371/journal.pntd.0007742.g005
Последовательное взаимодействие
P . brasiliensis с A . castellanii отбирает клетки грибов со значительными изменениями в их способности выживать и взаимодействовать с различными моделями хозяевМы оценили последовательные раунды взаимодействия P . brasiliensis с амебами смогли отобрать грибковые клетки с повышенной вирулентностью по сравнению с непассированным штаммом, как сообщалось ранее для H . капсула [7]. Мы подвергали грибок шестичасовому взаимодействию с амебами при 28°C в среде PYG. Затем амебы лизировали и все взаимодействующие грибковые клетки (внутриклеточные и внеклеточные) собирали и помещали в твердую среду BHI-sup. Эту процедуру повторяли еще 4 раза, в результате чего получали штаммы Pb18-Ac.Штаммы Pb18-Ac и Pb18 использовали в совместных культурах с A . castellanii и макрофаги J774 и инфицировать G . mellonella и мышей BALB/c. При сравнении клеток Pb18-Ac с непассированным штаммом фагоцитоз амебами снизился с 55,4% до 44,6% (рис. 6А), доля погибших амеб увеличилась с 10,8% до 15,9% (рис. 6В), а количество КОЕ увеличились в 2,5 раза (рис. 6С).
Рис. 6. Эффекты последовательного пассирования Pb18 с амебами, оцененные на нескольких моделях заражения.
Клетки Pb18 и Pb18 Pb-Ac совместно инкубировали с A . castellanii при множественности заражения два при 28°C в течение шести часов. А) Процент от А . Клетки castellanii , взаимодействующие с Pb18 и Pb18-Ac. B) Жизнеспособность A . castellanii после шести часов взаимодействия с Pb18 и Pb18-Ac. C) Выживаемость Pb18 и Pb18-Ac при взаимодействии с A . кастелланий . D) Выживание Pb18 и Pb18 Pb-Ac при взаимодействии с макрофагами J774.E) Кривая выживания G . mellonella , инфицированные Pb18 и Pb18-Ac. Кривая репрезентативна для двух биологических повторов. P<0,0001 для сравнения кривой выживания личинок, инфицированных двумя разными штаммами (критерий логарифмического ранга). F) Кривая выживания мышей BALB/c, инфицированных Pb18 или Pb18 Pb-Ac. В каждой группе было по 15 мышей. p = 0,0003 для сравнения кривой выживания мышей, инфицированных двумя штаммами (логарифмический ранговый критерий). A-D изображают объединенные результаты как минимум двух независимых экспериментов.Столбцы представляют средние значения плюс 95% доверительные интервалы в A и B и среднее значение стандартной ошибки в C и D.
https://doi.org/10.1371/journal.pntd.0007742.g006
Кроме того, мы также проверили, могут ли изменения во взаимодействии Pb-Ac с амебами быть переведены в другие модели. Количество восстановленных грибов в лунках с Pb18-Ac было значительно выше, чем у контрольного штамма после шести часов взаимодействия с макрофагами J774 (фиг. 6D). Кроме того, Pb18-Ac также был способен убить G . mellonella личинки и мыши BALB/c значительно быстрее, чем непассированные штаммы (рис. 6E и 6F).
Последовательное прохождение
P . brasiliensis влияет на накопление отдельных транскриптов вирулентности и увеличивает накопление α-глюканов клеточной стенкиМы предположили, что последовательные взаимодействия, выбранные для клеток с генетическими или эпигенетическими изменениями, повышают экспрессию генов, участвующих во взаимодействии хозяин-патоген.Затем был проведен количественный ПЦР-анализ для поиска изменений уровней грибковых транскриптов, которые, как было показано ранее, модулируются при взаимодействии с амебами или макрофагами [28-30]. Никаких серьезных изменений в накоплении транскриптов выбранных генов между двумя штаммами замечено не было. Наблюдаемые незначительные изменения включали небольшое увеличение экспрессии HADH и HSP60 в Pb18-Ac (рис. 7B и 7E) и небольшое снижение экспрессии MS1 и SOD1 (рис. 7C и 7D).
Рис. 7. Изменения экспрессии гена P. brasiliensis Pb18 после циклов взаимодействия с амебой.
A–G) Модуляция экспрессии гена Pb18 после предыдущих пассажей с амебами. Накопление транскрипта определяли сравнительным пороговым методом по величине ΔCt, полученной после нормализации по конститутивно экспрессируемому гену L34. Данные представлены как отдельные значения 2 -ΔΔCt из трех независимых экспериментов для каждой группы, а столбцы представляют их соответствующие средние значения.FC = кратное изменение накопления мРНК, полученное как отношение Pb18-Ac/Pb18. A) AGS1: α-глюкансинтаза, B) HADH: гидроксиацил-КоА-дегидрогеназа, C) MS1: малатсинтаза, D) SOD1: супероксиддисмутаза 1, E) HSP60: белок теплового шока 60, F) HSP70: белок теплового шока 70 , G) HSP90: белок теплового шока 90. H) Окрашивание клеточной поверхности на α-глюкан на поверхности клеток Pb18, которые подвергались (Pb18-Ac) или нет (Pb18) серийным пассажам взаимодействия с A . кастелланий . Клетки из двух типов клеток (Pb18 и Pb18-Ac) метили антителом к α-глюкану MOPC 104E, а затем вторичным антителом IgM-Alexa fluor 488 и анализировали с помощью проточной цитометрии.
https://doi.org/10.1371/journal.pntd.0007742.g007
Как мы наблюдали снижение процента фагоцитоза A . castellanii , инкубированных совместно с пассированным штаммом, мы оценили, были ли какие-либо изменения на поверхности гриба, которые могли бы повлиять на его интернализацию. Для этого фиксированные параформальдегидом клетки Pb18 и Pb18-Ac инкубировали с моноклональным антителом MOPC-104E, связывающимся с α-(1,3)-глюканами грибов [31], и анализировали методом проточной цитометрии.На фиг.7Н показано 3,3-кратное увеличение сигнала для α-(1,3)-глюкана в пассированных клетках по сравнению с непассированным штаммом. Поскольку увеличение накопления транскриптов α-глюкансинтазы не было обнаружено с помощью количественной ПЦР (рис. 7А), эти результаты позволяют предположить, что прохождение через амеб влияет на содержание α-(1,3)-глюканов в P . brasiliensis через механизмы, отличные от накопления мРНК.
Обсуждение
Paracoccidioides spp. .являются термодиморфными грибковыми патогенами, вызывающими PCM, системный микоз, распространенный в Латинской Америке [2]. Хотя это заболевание известно уже более века, остается еще много нерешенных вопросов об экологии его возбудителей. Прямая изоляция Paracoccidiodes spp. из почвы является сложной задачей и сообщалось лишь несколько раз. Однако об обнаружении ДНК Paracoccidioides в образцах почвы и аэрозолей сообщается гораздо чаще, что позволяет предположить, что эти грибы являются сапрофитами, как и представители родов Cryptococcus , Histoplasma и Blastomyces [14, 32, 33].
В этом исследовании мы проанализировали взаимодействие Paracoccidioides spp. с разными почвенными амебами. Наша основная гипотеза заключалась в том, что Paracoccidioides spp. признаки вирулентности могли быть выбраны путем взаимодействия с хищниками из окружающей среды, такими как амебы, как ранее предполагалось для других почвенных грибковых и бактериальных патогенов. Мы провели анализ взаимодействия между клетками Paracoccidioides spp и четырьмя различными амебами, включая три амебы, которые мы выделили из почвы: Acanthamoeba spp, A . speleaa , V . vermiformis — и аксенический лабораторный штамм A . кастелланий . Acanthamoeba — род почвенных амеб, которые могут вызывать кератит и гранулематозный амебный энцефалит [34]. А . spelaea был впервые идентифицирован в 2009 г. и также может быть вовлечен в кератит человека, но в литературе о нем мало информации [35]. В . vermiformis часто выделяют из почвы и водной среды, включая водопроводную воду больниц [36].Интересно, что ранее сообщалось, что все три рода содержат потенциально патогенные внутриклеточные микробы, такие как Legionella pneumophila [37–39]. Кроме того, есть несколько сообщений о взаимодействии A . castellanii с различными патогенными грибами и V . Было показано, что vermiformis способствует развитию Candida spp. рост в водопроводной воде и конидиальное филаментирование A . fumigatus [7, 8, 10, 40–42].В наших экспериментах все четыре амебы смогли интернализировать и убить клеток Paracoccidioides ; кроме того, культуры неаксеничных амеб могли расти, используя грибковые клетки в качестве основного источника пищи.
В дополнение к фагоцитозу различные методы микроскопии, которые мы использовали, выявили мертвые грибковые клетки с сильно измененной морфологией, включая перфорации на их поверхности. Наряду с тем фактом, что материнская клетка Paracoccidioides spp с множественными почками намного больше, чем у большинства наблюдаемых нами амеб, эти перфорированные клетки указывают на другие механизмы гибели Paracoccidioides spp амебами, не требующие фагоцитоза.Наши наблюдения подтверждаются предыдущими сообщениями конца 1970-х годов о гигантских почвенных амебах-вампиреллидах, которые перфорировали конидии и гифы почвенных грибов, таких как Cochliobolus sativus и Alternaria alternata , чтобы питаться их содержимым [43, 44]. Совсем недавно Радоса и его сотрудники также описали грибоядных амеб, питающихся нитчатыми грибами путем перфорации и внедрения гиф [45]. Эта стратегия имеет поразительное сходство с прямым антимикробным действием CD8+ T- и NK-клеток позвоночных, которые напрямую взаимодействуют с Cryptococcus neoformans и P и убивают их. brasiliensis путем перфорации их клеточных стенок [46–48]. Избирательное давление, оказываемое на грибы этой стратегией питания амеб, могло привести к появлению грибов с клеточными стенками, более устойчивыми к антимикробному действию CD8+ T- и NK-клеток.
Эффективное хищничество Paracoccidioides spp. клеток амебами, которые мы наблюдали в наших экспериментах, напоминает наблюдения, сделанные несколько десятилетий назад в отношении A . castellanii с использованием C . neoformans в качестве источника пищи и играет роль в борьбе с грибами в окружающей среде [49, 50].Напротив, в ряде исследований, опубликованных в начале 2000-х годов, были обнаружены патогенные грибы, такие как C . neoformans , Histoplasma capsulatum и Blastomyces dermatitidis , выживающие при взаимодействии с амебами [7, 8]. Это кажущееся противоречие можно объяснить принципиальным различием в плане эксперимента. Fu и Casadevall недавно сообщили, что двухвалентные катионы увеличивают выживаемость амеб, взаимодействующих с C . neoformans , а также усиливают их противогрибковую активность [51]. Мы проводили наши эксперименты по взаимодействию в среде PYG или PAS, оба из которых содержат кальций и магний, тогда как сообщения о том, что грибы выжили при взаимодействии, были сделаны в PBS без двухвалентных катионов.
Явно более высокая восприимчивость Paracoccidioides к амебе в наших экспериментах также может быть объяснена использованием клеток гриба, которые не были регулярно пересеяны через животное-хозяина.Это, по-видимому, относится к культурам, которые мы использовали, учитывая длительную среднюю выживаемость мышей, инфицированных непассированным штаммом. Хотя Paracoccidioides spp является первичным патогеном, предыдущие отчеты и наш собственный опыт показали, что длительное субкультивирование этих грибов in vitro приводит к ослаблению или потере вирулентности, которая может быть восстановлена путем пассирования животных [52, 53]. Однако, когда мы сравниваем взаимодействие одного и того же грибкового штамма с амебой и макрофагами, Pb18 все еще способен убивать большую часть макрофагов.Эти данные свидетельствуют о том, что, несмотря на некоторое сходство между амебами и макрофагами, существуют важные различия между этими двумя системами клеток-хозяев и/или что длительное субкультивирование in vitro привело к тому, что штамм гриба утратил атрибуты вирулентности, которые более специфичны для его взаимодействия с амебами.
Далее мы проанализировали взаимодействие A . castellanii с родственными видами P . lutzii (Pb01) и с P .Штамм brasiliensis , выделенный из броненосца (PbT16B1). Что касается скорости интернализации, способности убивать амеб и выживать при взаимодействии, Pb01 вел себя идентично Pb18. Однако взаимодействие A . castellanii с T16B1 показал, что этот штамм более эффективен в выживании и уничтожении амеб. Учитывая, что штамм броненосца был выделен около 7 лет назад, тогда как Pb18 и Pb01 были выделены примерно 90 и 30 лет назад соответственно [54, 55], эти результаты указывают на аттенуацию Paracoccidioides spp.после длительного пересева in vitro. Наши результаты также совместимы с предыдущей работой других групп, показывающей, что P . Изоляты brasiliensis Armadillo могут быть более вирулентными для моделей мышей и хомяков, чем некоторые клинические штаммы, подвергнутые длительному культивированию in vitro, такие как Pb18 [52, 56, 57].
Мы хотели оценить, могут ли циклы взаимодействия с амебами обратить вспять это очевидное ослабление вирулентности Paracoccidioides spp. Наша первоначальная идея состояла в том, чтобы использовать для этого анализа изолированные почвенные амебы, потому что это дало бы нам модель, более тесно связанную с тем, что может происходить в природе.Однако присутствие устойчивых к антибиотикам бактерий-контаминантов в выделенных культурах амеб нарушало восстановление клеток грибов после взаимодействия. Чтобы преодолеть это ограничение, мы вместо этого использовали аксенизированный лабораторный штамм A . castellanii , который был проверен на нескольких других грибковых патогенах [7, 8, 10] в качестве хозяина для проверки этой гипотезы. Несмотря на то, что эта амеба была приспособлена к аксеническому росту в лабораторных условиях, она смогла эффективно проглотить и убить P . бразильских клеток . Последовательные циклы взаимодействия грибов с амебами, каждый цикл достаточно короткий, чтобы позволить грибам выжить, отобранные по изменениям вирулентности P . бразильский Pb18. В новых анализах взаимодействия с A . castellanii , пассированные штаммы (Pb18-Ac) более эффективно уклонялись от фагоцитоза, выживали при взаимодействии и убивали амеб, чем непассированные штаммы (Pb18). Пассированный штамм также лучше выживал при взаимодействии с макрофагами J774 и обладал повышенной способностью уничтожать G . mellonella личинок и мышей, что подтверждает взаимодействие с A . castellanii удалось отобрать по более широким изменениям вирулентности грибов. Эти результаты соответствуют тому, что было описано для Н . капсула и С . neoformans при их взаимодействии с амебами [7, 58]. Учитывая, что клетки Pb18-Ac более эффективно избегают фагоцитоза и что α-(1,3) глюкан клеточной стенки, как было показано, маскирует распознавание диморфных грибов клетками-хозяевами [31], мы предположили, что пассированный штамм может иметь увеличение клеточной активности. стенки α-(1,3) глюканов по отношению к Pb18.Эксперименты с проточной цитометрией подтвердили эту гипотезу, предполагая аналогичную роль α-(1,3) глюканов в избегании фагоцитарных рецепторов у амеб и млекопитающих. Интересно, что это увеличение α-(1,3) глюканов клеточной стенки не было результатом повышенного накопления транскрипта α-глюкансинтазы, что предполагает нетранскрипционный механизм регуляции. Точно так же большинство других генов, экспрессия которых мы тестировали, не были изменены или имели лишь небольшие изменения экспрессии в пассированном штамме.
В целом, наши результаты согласуются с недавно сформулированной гипотезой о вирулентности амебоидных хищников и грибов для животных, согласно которой существует причинно-следственная связь от селективного давления амебоидных хищников из окружающей среды и эволюции вирулентности грибов против млекопитающих [59].Мы показали, что Paracoccidioides spp. действительно может взаимодействовать с различными видами амеб в окружающей среде, и что почвенные простейшие, среди многих других хищников, могут играть роль селективного давления для появления признаков вирулентности у этого рода. Учитывая, что ПКМ обычно не передается от человека к человеку, лучшее понимание окружающей среды, в которой живет этот грибок, может привести к улучшению профилактических мер, направленных на снижение воздействия грибка на сельских рабочих.
Вспомогательная информация
S1 Рис. Взаимодействие
P . brasiliensis Клетки Pb18 с изолятами почвенных амеб в твердых чашках с непитательным агаром.Подвеска 1,5×10 7 P . Клетки brasiliensis Pb18 высевали на непитательный агар и наносили на 10 4 клеток Acanthamoeba spp (панели A-D), A. spelaea (панели E-H) или V . vermiformis (панели I-L) в аликвотах по 10 микролитров непосредственно в центре газона грибковых клеток.Планшеты инкубировали при 25°C в течение 19 дней и проверяли на образование пластин для лизиса и переваривание грибковых клеток на 1-й день (панели A, E, I), 3-й день (панели B, F, J), 7-й день (панели C, G, K) и 19-й день взаимодействия (панели D, H, L). Черные стрелки обозначают области очищения от грибка.
https://doi.org/10.1371/journal.pntd.0007742.s001
(TIF)
S2 Рис. Морфология колоний
P . brasiliensis Клетки Pb18 после 30 дней взаимодействия с почвенной амёбой.Пять микролитров суспензии 1,5 x 10 7 P . Клетки brasiliensis Pb18 высевали на непитательный агар, наносили изоляты амеб и фотографировали после 30 дней взаимодействия. A) Контрольная колония P . brasiliensis Pb18 с интенсивной филаментацией. Б) Колония Р . brasiliensis Pb18 при совместной инкубации с A. spelaea . В) Колония Р . brasiliensis Pb18, инкубированный совместно с V . червеобразный . Г) Колония Р . brasiliensis Pb18 в совместной инкубации с Acanthamoeba spp.
https://doi.org/10.1371/journal.pntd.0007742.s002
(TIF)
S3 Рис. Изменения в
P . brasiliensis Морфология клеток Pb18 после взаимодействия с различными почвенными амебами.Изоляты совместно инкубировали с Pb18 при множественности заражения два при 25°C в течение 4 или 24 часов в PAS и фиксировали для TEM или SEM. A-B) ТЭМ P .Клетки brasiliensis растут поодиночке. Шкала баров = 10 мкм. E, F) ПЭМ, показывающая морфологию P . Клетки brasiliensis после взаимодействия с клетками Acanthamoeba spp. Шкала баров = 5 мкм. I и J) ПЭМ, показывающая морфологию P . Клетки brasiliensis после взаимодействия с A . spelaea или V . vermiformis соответственно. Шкала баров = 5 мкм и 500 нм. C-D) SEM P .Клетки brasiliensis растут поодиночке. Шкала баров = 5 мкм и 10 мкм, соответственно. G и H) СЭМ, показывающая морфологию P . Клетки brasiliensis после взаимодействия с V . червеобразный или А . спелеа . Шкала баров = 10 мкм и 5 мкм. K, L) SEM, показывающий морфологию P . Клетки brasiliensis после взаимодействия с V . vermiformis или Acanthamoeba spp.соответственно. Шкала баров = 10 мкм и 5 мкм соответственно. Красные стрелки указывают на грибковые клетки или их остатки.
https://doi.org/10.1371/journal.pntd.0007742.s003
(TIF)
S4 Рис. Кинетика фагоцитоза
P . brasiliensis по A . кастелланий .Амебы и P . Клетки дрожжей brasiliensis (маркированные CMFDA) инкубировали совместно (MOI два). В каждый момент времени процент фагоцитоза оценивали с помощью флуоресцентной микроскопии.Анализировали минимум 300 амеб на образец для расчета процента фагоцитоза. На графике представлены результаты трех независимых экспериментов, каждый из которых был проведен в трех повторностях. Столбики погрешностей представляют 95% доверительный интервал.
https://doi.org/10.1371/journal.pntd.0007742.s004
(TIF)
S5 Рис. Жизнеспособность
A . castellanii и макрофаги J774 после взаимодействия с P . бразильский Pb18.A) Клетки амебы инкубировали отдельно или в присутствии P . brasiliensis при 28°C или 37°C в течение шести, 24 и 48 часов (MOI два). (B) Макрофаги J774 инкубировали отдельно или в присутствии P . brasiliensis при 37°C в инкубаторе CO 2 в течение шести, 24 и 48 часов (MOI два). Жизнеспособность оценивали в каждый момент времени путем подсчета не менее 300 фагоцитирующих клеток в повторности после окрашивания трипановым синим. Столбики погрешностей указывают на 95% доверительный интервал.
https://doi.org/10.1371/journal.pntd.0007742.s005
(ТИФ)
S6 Рис. Жизнеспособность
A . castellanii (Ac) после взаимодействия с различными штаммами Paracoccidioides spp.A) Амебы инкубировали отдельно или в присутствии P . brasiliensis Pb18, P . lutzii Pb01 или P . brasiliensis дрожжевые клетки T16B1 при 28°C в течение шести, 24 и 48 часов (MOI два). Жизнеспособность оценивали в каждый момент времени путем подсчета не менее 300 фагоцитирующих клеток в повторности после окрашивания трипановым синим.Столбики погрешностей указывают на 95% доверительный интервал.
https://doi.org/10.1371/journal.pntd.0007742.s006
(TIF)
Благодарности
Мы благодарны за неоценимую помощь нескольким людям в разработке этой работы, включая Барбару Смит, Фалеса Д. Арантес, Ракель Теодоро, Марлюс Ф. Хрисик, Карлоса Эдуардо Винтера, Джессику Феррао, Габриэлу Матос, Кристин Баррето, Изабеллу Монтейро Рицци. де Азеведу, Бьянка Оливейра ду Вале Лира и Каллиандра де Соуза.
Каталожные номера
- 1. Касадевалл А. Детерминанты вирулентности патогенных грибов. Fungal Biol Rev. 2007;21(4):130–2. пмид: 19513186; Центральный PMCID в PubMed: PMC2693381.
- 2. Мартинес Р. Новые тенденции в эпидемиологии паракокцидиомикоза. J Fungi (Базель). 2017;3(1). пмид: 29371520; Центральный PMCID в PubMed: PMC5715958.
- 3. Туриссини Д.А., Гомес О.М., Тейшейра М.М., Макьюэн Дж.Г., Матуте Д.Р. Границы видов возбудителя человека Paracoccidioides .Генетика грибов Биол. 2017;106:9–25. пмид: 28602831.
- 4. Бокка А.Л., Амарал А.С., Тейшейра М.М., Сато П.К., Шиканай-Ясуда М.А., Соареш Фелипе М.С. Паракокцидиоидомикоз: экоэпидемиология, таксономия и клинико-терапевтические вопросы. Будущая микробиология. 2013;8(9):1177–91. пмид: 24020744.
- 5. Сан-Блас Г. Паракокцидиоидомикоз и его этиологический агент Paracoccidioides brasiliensis . J Med Vet Mycol. 1993;31(2):99–113. пмид:8509955.
- 6.Malliaris SD, Steenbergen JN, Casadevall A. Cryptococcus neoformans var. gattii может использовать для роста Acanthamoeba castellanii . Мед Микол. 2004;42(2):149–58. пмид: 15124868.
- 7. Steenbergen JN, Nosanchuk JD, Malliaris SD, Casadevall A. Взаимодействие Blastomyces dermatitidis , Sporothrix schenckii и Histoplasma capsulatum с Acanthamoeba castellanii . Заразить иммун.2004;72(6):3478–88. пмид:15155655; Центральный PMCID в PubMed: PMC415723.
- 8. Steenbergen JN, Shuman HA, Casadevall A. Взаимодействия Cryptococcus neoformans с амебами предполагают объяснение его вирулентности и внутриклеточной патогенной стратегии в макрофагах. Proc Natl Acad Sci U S A. 2001;98(26):15245–50. пмид:11742090; Центральный PMCID в PubMed: PMC65014.
- 9. Хиллманн Ф., Новоградская С., Маттерн Д.Дж., Форбергер Т., Хайнекамп Т., Вестерманн М. и др.Детерминанты вирулентности патогенного для человека грибка Aspergillus fumigatus защищают от хищничества почвенных амеб. Окружающая среда микробиол. 2015;17(8):2858–69. пмид: 25684622.
- 10. Van Waeyenberghe L, Bare J, Pasmans F, Claeys M, Bert W, Haesebrouck F, et al. Взаимодействие конидий Aspergillus fumigatus с Acanthamoeba castellanii аналогично взаимодействию макрофагов и грибков. Environ Microbiol Rep. 2013;5(6):819–24. пмид: 24249290.
- 11.Frager SZ, Chrisman CJ, Shakked R, Casadevall A. Виды Paramecium поглощают и убивают клетки патогенного грибка человека Cryptococcus neoformans . Мед Микол. 2010;48(5):775–9. пмид: 20233022; Центральный PMCID в PubMed: PMC4294704.
- 12. Милонакис Э., Аусубель Ф.М., Перфект Дж.Р., Хейтман Дж., Колдервуд С.Б. Уничтожение Caenorhabditis elegans с помощью Cryptococcus neoformans в качестве модели патогенеза дрожжей. Proc Natl Acad Sci U S A.2002;99(24):15675–80. пмид:12438649; Центральный PMCID в PubMed: PMC137775.
- 13. Арантес Т.Д., Теодоро Р.К., Да Грака Макорис С.А., Багальи Э. Обнаружение Paracoccidioides spp. в пробах аэрозолей окружающей среды. Мед Микол. 2013;51(1):83–92. пмид: 22762209.
- 14. Hrycyk MF, Garcia Garces H, Bosco SMG, de Oliveira SL, Marques SA, Bagagli E. Экология Paracoccidioides brasiliensis , P . lutzii и родственные виды: инфекция у броненосцев, распространение в почве и микологические аспекты.Мед Микол. 2018. пмид:29325170.
- 15. да Силва М.А., да Роса Дж.А. Выделение потенциально патогенных свободноживущих амеб в больничной пыли. Преподобный Сауд Публика. 2003;37(2):242–6. Эпб 18.04.2003. пмид:12700848.
- 16. Карлессо А.М., Симонетти А.Б., Артузо Г.Л., Ротт М.Б. [Выделение и идентификация потенциально патогенных свободноживущих амеб в образцах окружающей среды в государственной больнице в городе Порту-Алегри, Риу-Гранди-ду-Сул]. Rev Soc Bras Med Trop.2007;40(3):316–20. Эпб 2007/07/27. пмид: 17653468.
- 17. Хьюго Э.Р., Стюарт В.Дж., Гаст Р.Дж., Т.Дж. Б. Очистка мтДНК амебы с использованием процедуры UNSET. В: Soldo A, JJ L, редакторы. Протоколы в протозоологии. Лоуренс, Канзас, США: издательство Allen Press; 1992. с. п. Д–7: 1–2.
- 18. Лян С.И., Цзи Д.Р., Ся К.Т., Хун К.С., Шэн В.Х., Хсу Б.М. и др. Выделение и идентификация видов Acanthamoeba , связанных с амебным энцефалитом, и непатогенных свободноживущих видов амеб с рисового поля.J Appl Microbiol. 2010;109(4):1422–9. пмид: 20553339.
- 19. Schroeder JM, Booton GC, Hay J, Niszl IA, Seal DV, Markus MB, et al. Использование субгенной 18S рибосомальной ДНК ПЦР и секвенирование для идентификации рода и генотипа Acantamoebae от людей с кератитом и из осадка сточных вод. Дж. Клин Микробиол. 2001;39(5):1903–11. пмид:11326011; Центральный PMCID в PubMed: PMC88046.
- 20. Никола А.М., Касадевалл А. Измерение in vitro фагоцитоза и уничтожение Cryptococcus neoformans макрофагами.Методы Мол Биол. 2012; 844: 189–97. пмид:22262444.
- 21. Кастанеда Э., Браммер Э., Перлман А.М., Макьюэн Дж.Г., Стивенс Д.А. Культуральная среда для Paracoccidioides brasiliensis с высокой эффективностью посева и эффектом сидерофоров. J Med Vet Mycol. 1988;26(6):351–8. пмид: 2977619.
- 22. Коппенс И, Столяр К.А. Холестерин хозяина, но не паразита, контролирует проникновение Toxoplasma в клетку, модулируя разряд органелл. Мол Биол Селл. 2003;14(9):3804–20.пмид:12972565; Центральный PMCID в PubMed: PMC196568.
- 23. Диас М.Ф., Мескита Дж., Родригес Н., Филгейра А.Л., Де Соуза В. Жизнеспособность клеток дрожжевой формы Paracoccidioides brasiliensis после обработки ультразвуком. Мед Микол. 2004;42(1):43–9. пмид: 14982113.
- 24. Мохамед М.А., Коппель Х.К. Массовое разведение большой восковой моли, Galleria mellonella (Lepidoptera: Pyralidae), для мелкомасштабных лабораторных исследований. Энтомолог Великих озер. 1983;16(4):139–41.
- 25. Фукс Б.Б., О’Брайен Э., Хури Дж.Б., Милонакис Э. Методы использования Galleria mellonella в качестве модельного хозяина для изучения патогенеза грибков. Вирулентность. 2010;1(6):475–82. пмид: 21178491.
- 26. Лима Пде С., Казалетти Л., Байлао А.М., де Васконселос А.Т., Фернандес Гда Р., Соареш К.М. Транскрипционные и протеомные реакции на углеродное голодание у Paracoccidioides . PLoS Negl Trop Dis. 2014;8(5):e2855. пмид: 24811072; Центральный PMCID в PubMed: PMC4014450.
- 27. Шмитген ТД, Ливак КДж. Анализ данных ПЦР в реальном времени сравнительным методом C(T). Нат Проток. 2008;3(6):1101–8. пмид: 18546601.
- 28. Таварес А.Х., Сильва С.С., Дантас А., Кампос Э.Г., Андраде Р.В., Маранхао А.К. и др. Ранний транскрипционный ответ Paracoccidioides brasiliensis при интернализации мышиными макрофагами. микробы заражают. 2007;9(5):583–90. пмид: 17387029.
- 29. Derengowski Lda S, Paes HC, Albuquerque P, Tavares AH, Fernandes L, Silva-Pereira I, et al.Транскрипционный ответ Cryptococcus neoformans на проглатывание Acanthamoeba castellanii и макрофагами дает представление об эволюционной адаптации к хозяину-млекопитающему. Эукариотическая клетка. 2013;12(5):761–74. пмид: 23524994; Центральный PMCID в PubMed: PMC3647765.
- 30. Тамайо Д., Муньос Дж. Ф., Торрес И., Алмейда А. Дж., Рестрепо А., МакИвен Дж. Г. и др. Участие белка теплового шока 90 кДа при адаптации Paracoccidioides brasiliensis к различным условиям окружающей среды.Генетика грибов Биол. 2013;51:34–41. пмид: 23207691.
- 31. Rappleye CA, Eissenberg LG, Goldman WE. Histoplasma capsulatum альфа-(1,3)-глюкан блокирует врожденное иммунное распознавание бета-глюкановым рецептором. Proc Natl Acad Sci U S A. 2007;104(4):1366–70. пмид: 17227865; Центральный PMCID в PubMed: PMC1783108.
- 32. Рестрепо А. Экология Paracoccidioides brasiliensis : загадка до сих пор не решена. Сабураудиа. 1985;23(5):323–34. пмид:35.
- 33. Франко М., Багальи Э., Скаполио С., да Силва Лаказ С. Критический анализ выделения Paracoccidioides brasiliensis из почвы. Мед Микол. 2000;38(3):185–91. пмид:10892985.
- 34. Сиддики Р., Хан Н.А. Биология и патогенез Acanthamoeba . Векторы паразитов. 2012;5:6. пмид:22229971; Центральный PMCID в PubMed: PMC3284432.
- 35. Толба М.Е., Хусейн Э.А., Фарраг Х.М., Мохамед Хель Д., Кобаяши С., Судзуки Дж. и др. Allovahlkampfia spelaea Вызывает кератит у людей. PLoS Negl Trop Dis. 2016;10(7):e0004841. пмид: 27415799; Центральный PMCID в PubMed: PMC4945048.
- 36. Делафон В., Родье М. Х., Мезоннёв Э., Като Э. Vermamoeba vermiformis : представляющая интерес свободноживущая амеба. Микроб Экол. 2018;76(4):991–1001. пмид: 29737382.
- 37. Kuiper MW, Wullings BA, Akkermans AD, Beumer RR, van der Kooij D. Внутриклеточная пролиферация Legionella pneumophila в Hartmannella vermiformis в водных биопленках, выращенных на пластифицированном поливинилхлориде.Appl Environ Microbiol. 2004;70(11):6826–33. пмид:15528550; Центральный PMCID в PubMed: PMC525122.
- 38. Мохамед М., Хусейн Э.А., Фарраг Х.М., Мостафа Ф.А.А., Хассан А.Т. Allovahlkampfia spelaea является потенциальным хозяином в окружающей среде для патогенных бактерий J Bacteriol Parasitol. 2016;7(1):1–7. http://dx.doi.org/10.4172/2155-9597.1000255.
- 39. Балчун С., Шейд П.Л. Свободноживущие амебы как хозяева и переносчики внутриклеточных микроорганизмов, имеющих значение для общественного здравоохранения.Вирусы. 2017;9(4). пмид: 28368313; Центральный PMCID в PubMed: PMC5408671.
- 40. Maisonneuve E, Cateau E, Kaaki S, Rodier MH. Vermamoeba vermiformis — Aspergillus fumigatus взаимоотношения и сравнение с другими фагоцитирующими клетками. Паразитол рез. 2016;115(11):4097–105. пмид: 27381330.
- 41. Vanessa B, Virginie M, Nathalie Q, Marie-Helene R, Christine I. Hartmannella vermiformis может способствовать размножению Candida spp.в водопроводной воде. Вода Res. 2012;46(17):5707–14. пмид: 22951330.
- 42. Новоградская С., Ферлинг И., Хиллманн Ф. Изучение детерминант вирулентности мицелиальных грибковых патогенов посредством взаимодействия с почвенными амебами. Front Cell Infect Microbiol. 2017;7:497. пмид: 222; Центральный PMCID в PubMed: PMC5723301.
- 43. Старый КМ. Гигантские почвенные амебы вызывают перфорацию конидий Cochliobolus sativus . Труды Британского микологического общества. 1977; 68 (2): 277–81.https://doi.org/10.1016/S0007-1536(77)80018-1.
- 44. Старый КМ, Дарбишир JF. Почвенные грибы как пища для гигантских амеб. Почвенная биология и биохимия. 1978; 10 (2): 93–100.
- 45. Радоса С., Ферлинг И., Спраг Дж. Л., Вестерманн М., Хиллманн Ф. Различная морфология дрожжей и мицелиальных грибов запускает различные механизмы уничтожения и питания грибоядной амебы. Окружающая среда микробиол. 2019; 21 (5): 1809–20. пмид:30868709.
- 46. Хименес Б.Э., Мерфи Дж.В.In vitro эффекты естественных клеток-киллеров на дрожжевую фазу Paracoccidioides brasiliensis . Заразить иммун. 1984; 46 (2): 552–8. пмид:6500701; Центральный PMCID в PubMed: PMC261570.
- 47. Longhi LN, da Silva RM, Fornazim MC, Spago MC, de Oliveira RT, Nowill AE, et al. Фенотипическая и функциональная характеристика NK-клеток в иммунном ответе человека против диморфного гриба Paracoccidioides brasiliensis . Дж Иммунол. 2012;189(2):935–45. пмид: 22723518.
- 48.Ma LL, Spurrell JC, Wang JF, Neely GG, Epelman S, Krensky AM, et al. Опосредованное Т-клетками CD8 уничтожение Cryptococcus neoformans требует гранулизин и зависит от Т-клеток CD4 и IL-15. Дж Иммунол. 2002;169(10):5787–95. пмид:12421959.
- 49. Бантинг Л.А., Нейлсон Дж.Б., Балмер Г.С. Cryptococcus neoformans : гастрономическое наслаждение почвенной амебы. Сабураудиа. 1979;17(3):225–32. пмид:394365.
- 50. Руис А., Нейлсон Дж. Б., Балмер Г. С.Контроль Cryptococcus neoformans в природе с помощью биотических факторов. Сабураудиа. 1982; 20(1):21–9. пмид: 6801787.
- 51. Fu MS, Casadevall A. Катионы двухвалентных металлов усиливают хищническую способность амебы в отношении Cryptococcus neoformans . Appl Environ Microbiol. 2018;84(3). пмид: 207; Центральный PMCID в PubMed: PMC5772251.
- 52. Macoris SA, Sugizaki MF, Peracoli MT, Bosco SM, Hebeler-Barbosa F, Simoes LB, et al. Аттенуация вирулентности и фенотипическая изменчивость изолятов Paracoccidioides brasiliensis , полученных от броненосцев и пациентов.Мем Инст Освальдо Круз. 2006;101(3):331–4. пмид: 16862332.
- 53. Браммер Э., Рестрепо А., Хэнсон Л.Х., Стивенс Д.А. Вирулентность Paracoccidiodes brasiliensis : влияние пассажа и хранения in vitro. Микопатология. 1990;109(1):13–7. пмид: 2139178.
- 54. Кашино С.С., Зингер-Вермес Л.М., Калич В.Л., Бургер Э. Изменения патогенности одного изолята Paracoccidioides brasiliensis не коррелируют с его ростом in vitro.Микопатология. 1990;111(3):173–80. пмид: 2233986.
- 55. Соареш К.М., Мадлун Э.Э., да Силва С.П., Перейра М., Фелипе М.С. Характеристика изолятов Paracoccidioides brasiliensis с помощью анализа случайной амплификации полиморфной ДНК. Дж. Клин Микробиол. 1995;33(2):505–7. пмид:7714219; Центральный PMCID в PubMed: PMC227979.
- 56. Hebeler-Barbosa F, Montenegro MR, Bagagli E. Профили вирулентности десяти изолятов Paracoccidioides brasiliensis , полученных от броненосцев (Dasypus novemcinctus).Мед Микол. 2003;41(2):89–96. пмид:12964840.
- 57. Nishikaku AS, Peracoli MT, Bagagli E, Sugizaki MF, Sartori A. Экспериментальные инфекции с помощью Paracoccidioides brasiliensis , полученных от броненосцев: сравнение с клиническими изолятами. Braz J Infect Dis. 2008;12(1):57–62. пмид: 18553016.
- 58. Steenbergen JN, Nosanchuk JD, Malliaris SD, Casadevall A. Вирулентность Cryptococcus neoformans усиливается после роста в генетически гибком хозяине Dictyostelium discoideum .Заразить иммун. 2003;71(9):4862–72. пмид:12933827; Центральный PMCID в PubMed: PMC187309.
- 59. Касадевалл А., Фу М.С., Гимарайнс А.Дж., Альбукерке П. Гипотеза «амебоидной вирулентности хищников и грибковых животных». J Fungi (Базель). 2019;5(1). пмид:30669554.
Инфекция Dientamoeba fragilis: основы практики, патофизиология, эпидемиология
Автор
Мария А. Гарсия Фернандес, доктор медицинских наук Врач, отделение инфекционных заболеваний, Детская исследовательская больница Св. Иуды
Раскрытие информации: Ничего не раскрывается.
Соавтор (ы)
Мария А. Каррильо-Маркес, доктор медицины доцент кафедры педиатрии, отделение инфекционных заболеваний, Детская больница Ле Бонёр, Медицинский колледж Университета Теннесси, Центр медицинских наук
Мария А. Каррильо-Маркес, доктор медицины, является членом следующие медицинские общества: Американская академия педиатрии, Американское общество инфекционистов, Общество педиатрических инфекционистов
Раскрытие информации: Нечего раскрывать.
Редакционная коллегия специалистов
Мэри Л. Виндл, PharmD адъюнкт-профессор Фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Нечего раскрывать.
Главный редактор
Russell W Steele, MD Клинический профессор, Медицинский факультет Тулейнского университета; Штатный врач, Ochsner Clinic Foundation
Russell W Steele, MD, является членом следующих медицинских обществ: Американская академия педиатрии, Американская ассоциация иммунологов, Американское педиатрическое общество, Американское общество микробиологии, Американское общество инфекционных заболеваний, Медицинское учреждение штата Луизиана. Общество детских инфекционных заболеваний, Общество педиатрических исследований, Южная медицинская ассоциация
Раскрытие информации: Нечего раскрывать.
Дополнительные участники
Дэвид Р. Мак, доктор медицинских наук, FRCPC профессор кафедры педиатрии Медицинского факультета Оттавского университета; Заведующий отделением гастроэнтерологии, гепатологии и питания, отделение педиатрии, Детская больница Восточного Онтарио, Канада
Дэвид Р. Мак, доктор медицинских наук, FRCPC является членом следующих медицинских обществ: Канадское педиатрическое общество, Канадская ассоциация гастроэнтерологов, Американская Гастроэнтерологическая ассоциация, Североамериканское общество детской гастроэнтерологии, гепатологии и питания
Раскрытие информации: Нечего раскрывать.
Майкл Д. Ниссен, MBBS FRACP, FRCPA, адъюнкт-профессор биомолекулярных, биомедицинских наук и здравоохранения Университета Гриффита; Директор отдела инфекционных заболеваний и заведующий отделением Квинслендской детской инфекционной лаборатории, Центр вирусных исследований сэра Альберта Сакзевски, Королевская детская больница
Майкл Д. Ниссен, MBBS, является членом следующих медицинских обществ: Американская академия педиатрии, Королевский колледж патологов Австралии , Королевский Австралазийский колледж врачей, Американское общество микробиологии, Общество детских инфекционных заболеваний
Раскрытие информации: Нечего раскрывать.
тихоходок
- Общее название:
- тихоходки
- Научное название:
- Tardigrada
- Диета:
- Всеядные
- Размер:
- 0,5 миллиметр
Тихоходки — микроскопические восьминогие животные, побывавшие в открытом космосе и пережившие апокалипсис. Бонус: они выглядят как очаровательные миниатюрные мишки.
Во всем мире обитает около 1300 видов тихоходок. Считающиеся водными, потому что им требуется тонкий слой воды вокруг их тел, чтобы предотвратить обезвоживание, они также наблюдались во всех видах окружающей среды, от морских глубин до песчаных дюн. Их предпочтительной средой обитания являются пресноводные мхи и лишайники, отсюда и их прозвище «моховой поросенок».
Несмотря на то, что тихоходки выглядят мягкими, они покрыты прочной кутикулой, похожей на экзоскелеты кузнечиков, богомолов и других насекомых, с которыми они связаны.Как и эти насекомые, тихоходкам приходится сбрасывать кутикулы, чтобы расти. У них есть от четырех до шести когтей на каждой ноге, которые помогают им цепляться за растительные вещества, и специальный ротовой аппарат, называемый щечно-глоточным аппаратом, который позволяет им высасывать питательные вещества из растений и микроорганизмов.
Крошечные и выносливыеТихоходки принадлежат к элитной категории животных, известных как экстремофилы, т. е. существа, способные выживать в условиях, недоступных большинству других. Например, тихоходки могут обходиться без еды и воды до 30 лет.Они также могут жить при температурах, равных абсолютному нулю или выше точки кипения, при давлении в шесть раз выше, чем в самых глубоких впадинах океана, и в космическом вакууме.
Их устойчивость отчасти обусловлена наличием в их телах уникального белка под названием Dsup — сокращение от «подавитель повреждений», — который защищает их ДНК от повреждения такими вещами, как ионизирующее излучение, присутствующее в почве, воде и растительности.
Еще один удивительный способ выживания — криптобиоз, состояние бездействия, вызванное сухой средой.Микроживотные выжимают из своих тел всю воду, втягивают головы и конечности, сворачиваются в комочек и впадают в спячку. Когда условия улучшаются, они разворачиваются и идут по своим делам.
Спаривание и размножениеЕстественно, у тихоходок тоже есть необычные брачные привычки. В зависимости от вида животные могут размножаться бесполым или половым путем. У некоторых видов самцы откладывают сперму внутрь кутикулы линяющей самки, несущей яйца, в течение часового процесса спаривания.Некоторые самки сбрасывают кутикулу, а затем откладывают внутрь яйца, которые позже оплодотворяются самцами.
Яйца вылупляются примерно через 40 дней или до 90 дней, если они находятся в высушенном состоянии.
ЗНАЕТЕ ЛИ ВЫ
Тихоходки жили на Земле около 600 миллионов лет, опередив динозавров примерно на 400 миллионов лет.
— Американский музей естественной истории
Впервые они были описаны в 1773 году немецким пастором Дж.AE Goeze, который назвал их kleiner Wasserbär , или «маленький водяной медведь». Более поздние эксперименты показали, что животные, вероятно, погибли при ударе.1 был первоначально собран в Северной Каролине [17]. NC28.1 rfp представляет собой производное, сконструированное для экспрессии красного флуоресцентного белка ( rfp ) [18]. Мы выращивали D. discoideum на штамме бактерий Klebsiella pneumoniae (полученных от N. Buttery) со спонтанной резистентностью к противомикробному препарату G418. Мы хранили штаммов D. discoideum и K. pneumoniae при -80°C в 20% (об./об.) глицерине. Мы получили дикий тип (Canton-S) Drosophila melanogaster от Y.Ben-Shahar (Вашингтонский университет) и поддерживали их при 22°C в 200 мл флаконах, содержащих 50 мл Formula 4–24 Instant Drosophila Medium (Carolina Biological Supply, Берлингтон, Северная Каролина, США) при постоянном освещении.
Анализ распространения
Мы проверили, как плодовые тела влияют на распространение, подвергая мух воздействию либо неповрежденных плодовых тел, либо плодовых тел, поврежденных таким образом, чтобы большинство спор располагалось на субстрате, а не на концах вертикальных стеблей (рис. 1). Чтобы получить свежие споры, с которыми можно было бы начать эксперименты, мы позволили амебам расти и развиваться при К.pneumoniae на 2,0% (вес/объем) агаровых чашках со средой SM (Formedium, Hunstanton, United Kingdom) при 22°C. Мы удаляли споровые массы с плодовых тел, переворачивая пластины вверх дном, собирали споры с крышки планшета с 1,0 мл буфера KK2 (на литр: 2,25 г KH 2 HPO 4 , 0,67 г K 2 HPO 4 , 0,67 г) , и ресуспендировали их в KK2 до 1 × 10 7 клеток/мл с использованием подсчета спор в гемацитометре.
Для получения плодовых тел D. discoideum мы сначала посеяли 10 6 D.discoideum на чашки SM со 100 мкл культуры стационарной фазы K. pneumoniae , выращенной в течение 2 дней в бульоне SM при 22°C без встряхивания. Мы инкубировали чашки в течение 2 дней при 22 °C с пассивной влажностью и верхним светом. Мы собрали клеток D. discoideum в логарифмической фазе с этих планшетов с помощью стерилизованного этанолом пластикового шпателя и ресуспендировали их в 12 мл холодного KK2. Мы центрифугировали клетки в течение 3 мин при 300 × g, трижды промывали их в 12 мл холодного KK2 и ресуспендировали до 1.0 × 10 8 клеток/мл с использованием подсчета спор в гемацитометре. Мы поместили 10 7 клеток (100 мкл) на 10 мл агара KK2 (2,0% масс./об.) на дно конической пробирки объемом 50 мл. Мы инкубировали эти пробирки в течение 4 дней при температуре 22 °C, влажности окружающей среды и верхнем свете, в течение которых клеток D. discoideum создали плодовые тела.
Мы оставили плодовые тела в контрольных пробирках нетронутыми. Для экспериментальной обработки мы разрушали плодовые тела, несколько раз ударяя коническими трубками о твердую поверхность, в результате чего плодовые тела падали и/или споровые массы падали на поверхность агара.Мы анестезировали взрослых мух с помощью FlyNap (Carolina Biological Supply, Берлингтон, Северная Каролина, США), помещали в каждую пробирку по 5 самцов и 5 самок и оставляли пробирки боком без дальнейшего беспокойства. Мы поставили конические трубки сбоку, чтобы мухам нужно было входить или лететь в плодовые тела, а не просто падать на них. Чтобы собрать образцы мух в пробирке, мы анестезировали мух, собрали их вместе в 250 мкл буфера KK2 с добавлением 0,1% детергента NP-40, встряхивали пробирку в течение ~ 20 секунд и определяли плотность восстановленных спор, используя подсчет в гемацитометре. .Мы воспроизвели эти эксперименты, используя бактерии и амебы, независимо выращенные из замороженных запасов в разные дни.
Мы проанализировали данные путем подгонки обобщенных линейных моделей к данным о количестве спор в R v2.15.3 с помощью команды glm . Данные были чрезмерно разбросаны, поэтому мы использовали квазипуассоновские ошибки с функцией логарифмической связи. Мы учитывали вариации количества мух и площади гемацитометра, подсчитанные с помощью команды offset . Поскольку каждая точка данных была взята из отдельной трубки (деструктивная выборка), мы смоделировали время как фиксированный эффект.Мы проверили значимость терминов модели, выполнив тесты F на моделях, подходящих с интересующим термином и без него.
Микроскопия
Для визуализации спор на мухах мы подвергли 10 мух воздействию плодовых тел NC28.1 rfp в течение 24 часов, как описано выше, за исключением того, что для максимального сигнала флуоресценции мы добавили в среду SM 5 мкг/мл аминогликозидного антибиотика. G418 для отбора против нефлуоресцентных мутантов, которые появляются в процессе культивирования клеток. После воздействия мы анестезировали мух и инкубировали их 20 мин при -20°C.Мы получили изображения мух в отраженном свете и красной флуоресценции с помощью стереомикроскопа Zeiss SV11 (Carl Zeiss Microscopy LLC., Торнвуд, штат Нью-Йорк, США) и собрали составные изображения с помощью Adobe Photoshop (Adobe Systems, Сан-Хосе, Калифорния, США).
Насекомые, пауки, многоножки, многоножки — Национальный морской берег Пойнт-Рейес (Служба национальных парков США)
СтрекозыНасекомые
В штате Калифорния насчитывается более 30 000 видов насекомых, которых ученые относят к классу насекомых.Они встречаются во всех наземных местообитаниях на Земле, кроме полюсов, и, безусловно, в изобилии встречаются в Пойнт-Рейес. Как первичные потребители они едят мертвые и разлагающиеся вещи, которые возвращают эти вещи на землю в качестве питательных веществ.
Два качества делают насекомое насекомым. Во-первых, у них есть 3 сегмента тела: голова, грудь и брюшко. Во-вторых, у них 3 пары ног. Все насекомые проходят «этапы жизни», когда они принимают одну форму, а затем превращаются в другую форму. Хорошим примером этого является превращение гусеницы в бабочку.Часто на каждом жизненном этапе используются разные типы ресурсов. Гусеница будет ползать по земле и есть листья, а бабочка будет летать с цветка на цветок и пить нектар. Это важно, потому что, когда ученые пытаются сохранить определенные виды, они должны сохранять ресурсы, которые используются на каждой стадии жизни.
К началу страницы
Многоножки
У многоножекесть собственный класс под названием Chilopoda. Они выделяются из-за своих очень уникальных особенностей. Тела сороконожек разделены на множество частей, и каждый сегмент имеет одну пару ног.Все они плотоядны и питаются другими членистоногими, дождевыми червями и улитками. Так, их можно найти, ища добычу в сырых местах под листьями, гнилыми бревнами и камнями. Виды в этой области не причиняют вреда человеку — не нужно бояться.
Многоножки
Многоножек часто принимают за многоножек, но у многоножек есть два набора ног на каждом из их сегментов. С таким количеством ног кажется, что волна проходит через его ноги, когда он ходит. У них тоже есть свой класс, называемый Diplopoda.
