амеб | Earthling Nature
by Piter Kehoma Boll
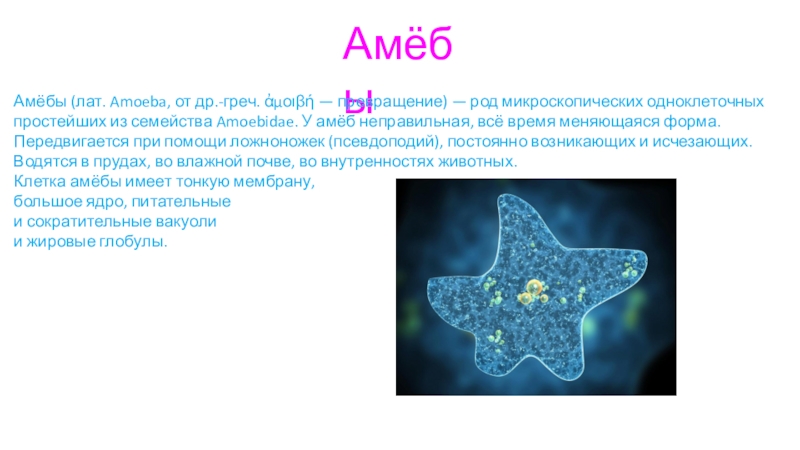
Пришло время снова поговорить об амебе, и одна конкретная группа этих протистов, которая еще не была представлена здесь, — это панцирные или панцирные амебы. Поскольку, как я уже неоднократно говорил ранее, найти достоверную информацию о большинстве протистов очень сложно, так как они не так популярны, как многие группы животных и растений, мне придется представить наиболее «обычных» из раковинных амеб. , Arcella vulgaris , арцелла обыкновенная.
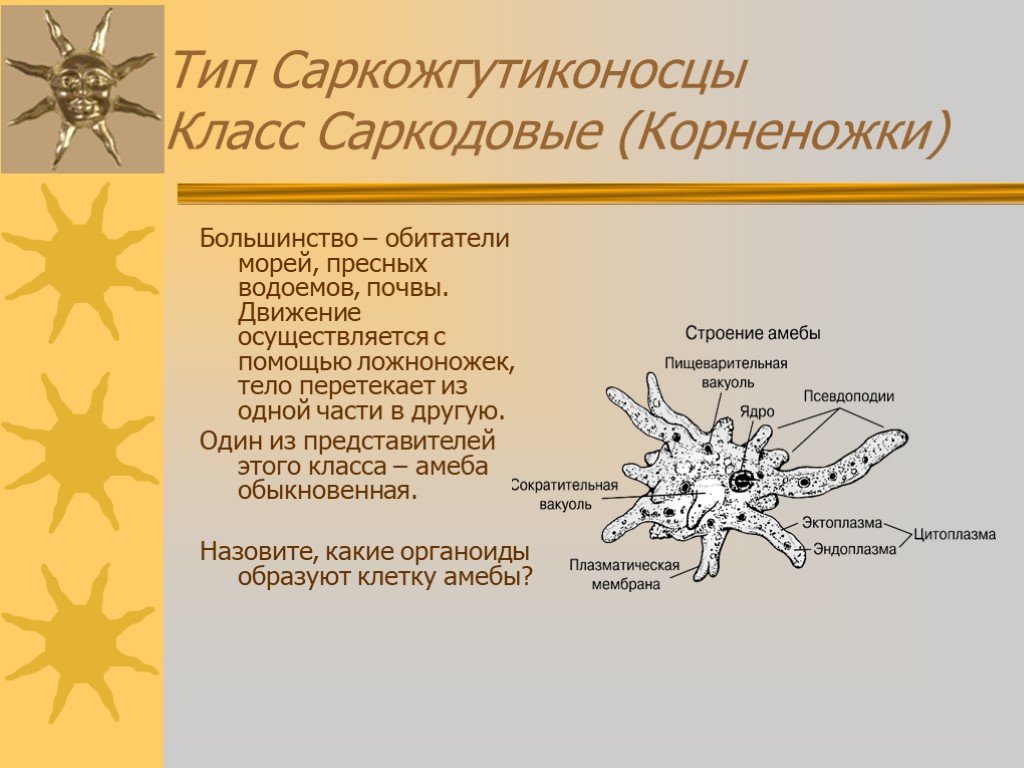
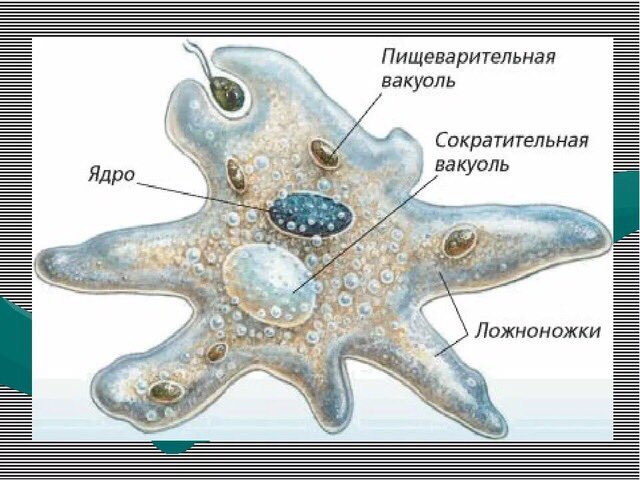
Как и большинство амеб, арцелла обыкновенная имеет амебоидное тело, образованное неправильной клеткой, от которой отходят ложноножки, помогающие передвигаться и захватывать добычу. Однако у арцеллы обыкновенной также есть красивая и правильная раковина. Раковина образована хитином, как экзоскелет членистоногих или клеточная стенка грибов.
Красивая арчелла обыкновенная, вид сверху. Кредиты для Microworld. Если смотреть сверху, его оболочка имеет круглую форму и имеет диаметр около 100 мкм (0,1 мм).
Арцелла обыкновенная – это пресноводный вид, который можно найти в озерах, неглубоких прудах или даже в пропитанной водой почве. Его диета состоит из мелких одноклеточных организмов, включая бактерии, водоросли и грибы. Бактерии, однако, являются наиболее важным элементом в его рационе, поскольку лабораторные эксперименты показали, что его развитие нарушается, когда он выращивается только на водорослях, только на грибах или на комбинации водорослей в грибах. С другой стороны, он нормально развивается при смешанной диете, включающей бактерии, или при питании только бактериями.
Как и большинство видов рода Arcella , обыкновенная дуга обычно имеет в своей клетке два ядра. Его размножение происходит бинарным делением и весьма интересно. Когда он чувствует, что ему нужно разделить на две части, обыкновенная дуга втягивает удлиненные ложноножки в свою раковину и создает новую, толстую и округлую ложноножку, которая образует выпуклость, выходящую из отверстия раковины. Затем он начинает строить новую оболочку вокруг этой выпуклости, используя ее как способ смоделировать новую оболочку, придав ей адекватную форму. Как только новая оболочка будет готова, ядра разделятся, и два из них мигрируют в ту часть амебы, которая находится в новой оболочке. После этого клетка делится в месте соединения двух оболочек, и в итоге мы получаем двух амеб, одну из которых живет в старой оболочке, а другую — в новой. Иногда обыкновенная дуга также может построить эту новую оболочку и войти в нее целиком, не разделяясь надвое и оставляя старую оболочку пустой, явление, известное как экзувиация.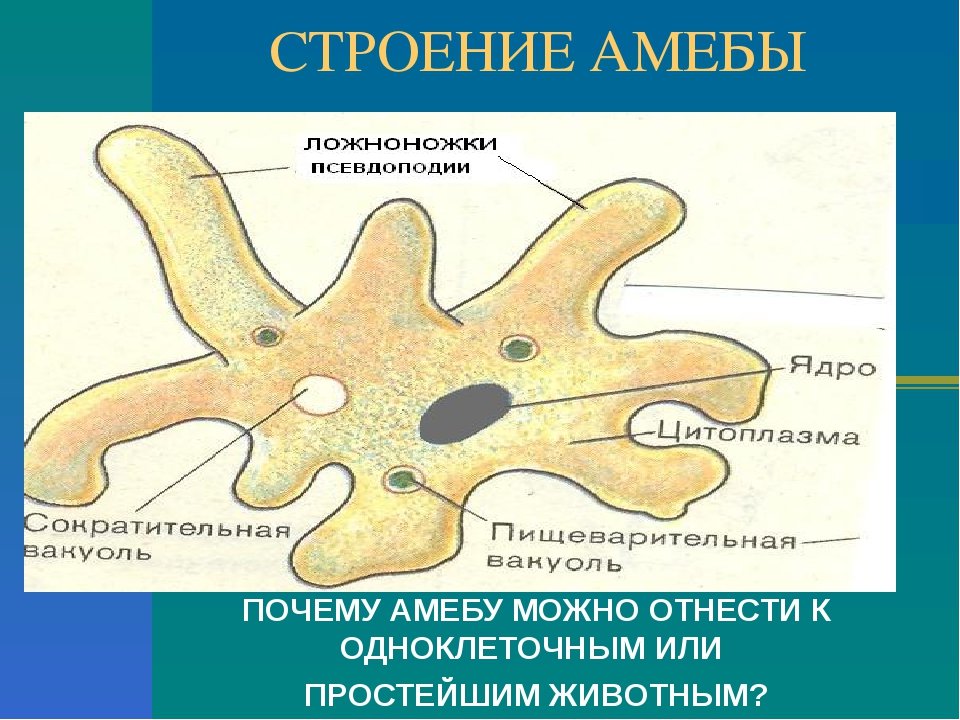
В некоторых редких случаях амеба также может построить новую оболочку и просто выбросить ее пустой. Зачем это делать? Никто не знает.
В лабораторных экспериментах, когда с арцеллы обыкновенной механически удаляли оболочку, амебы могли какое-то время выживать без своей оболочки и в конечном итоге строить новую, хотя эта регенерированная оболочка всегда имела неправильную форму и влияла на типичное поведение амебы. Процесс регенерации оболочки занимает гораздо больше времени, чем построение новой для дочерней клетки. Если изготовление скорлупы для размножения происходит всего за несколько минут, не более получаса, то на регенерацию скорлупы для себя уходит до трех дней. Однако при делении этой регенерировавшей амебы с деформированной оболочкой дочерние клетки имели оболочки нормальной формы.
Таким образом, панцирь является не только защитой для дуги обыкновенной, но и формирует все ее тело и поведение.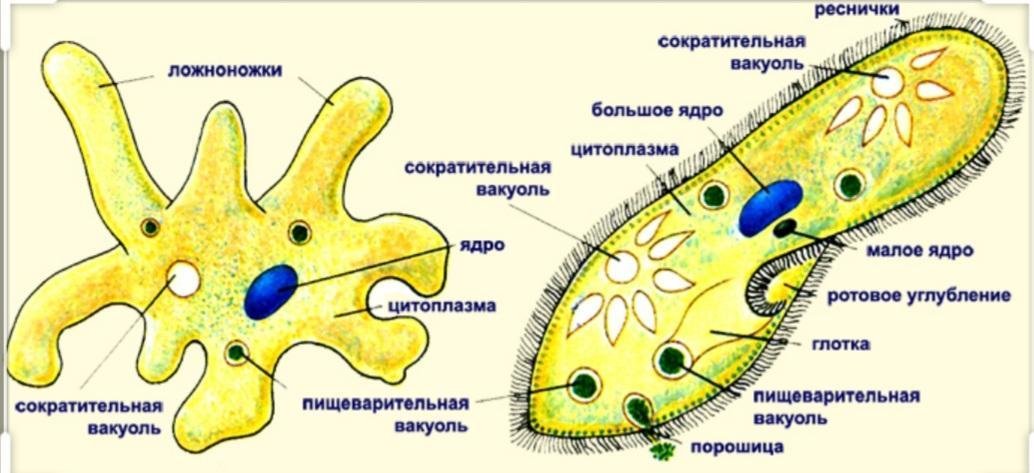
– – –
Нравится нам на Facebook!
Подпишитесь на нас в Twitter!
– – –
Ссылки:
Laybourn, G., & Whymant, L. (1980). Влияние диеты и температуры на репродуктивную способность Arcella vulgaris Ehrenberg (Sarcodina: Testacida). Экология , 45 (2), 282-284. https://doi.org/10.1007/BF00346471
Пчелин И. М. (2010). Раковинная амеба Arcella vulgaris (Amoebozoa, Arcellidae) способна выжить без раковины и построить новую. Протистология , 6 (4), 251-257.
Porfírio-Sousa AL, Lahr DJG (2020) Текущие знания и перспективы исследования процесса формирования раковин у представителей рода Arcella (Arcellinida: Amoebozoa). Протистология 14(1): 3–14. https://doi.org/10.21685/1680-0826-2020-14-1-1
– – –
* Эта работа находится под лицензией Creative Commons Attribution-ShareAlike 3.0 Unported License.
Оцените это:
Нравится:
Нравится Загрузка…
Характеристика транс-сплайсинга сплайсированного лидера у фотосинтетической ризариевой амебы Paulinella micropora и его возможная роль в функциональном переносе генов
1. Ласда Э.Л., Блюменталь Т. Транс-сплайсинг. Междисциплинарные обзоры Wiley: РНК. 2011 г.; 2: 417–34. 10.1002/wrna.71
[PubMed] [CrossRef] [Google Scholar]
Ласда Э.Л., Блюменталь Т. Транс-сплайсинг. Междисциплинарные обзоры Wiley: РНК. 2011 г.; 2: 417–34. 10.1002/wrna.71
[PubMed] [CrossRef] [Google Scholar]
2. Murphy WJ, Watkins KP, Agabian N. Идентификация новой структуры Y-ветви как промежуточного звена в процессинге мРНК трипаносомы: доказательства транс-сплайсинга. Клетка. 1986; 47: 517–25. [PubMed] [Google Scholar]
3. Sutton RE, Boothroyd JC. Доказательства транс-сплайсинга в трипаносомах. Клетка. 1986 год; 47: 527–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Bitar M, Boroni M, Macedo AM, Machado CR, Franco GR. Механизм транс-сплайсинга сплайсированного лидера у разных организмов: молекулярные детали и возможные биологические роли. Границы в генетике. 2013; 4: 199 10.3389/fgene.2013.00199 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Bruzik JP, Maniatis T. Сплайсированные лидерные РНК низших эукариот транс-сплайсированы в клетках млекопитающих. Природа. 1992 год; 360: 692–95. 10.1038/360692а0
[PubMed] [CrossRef] [Google Scholar]
10.1038/360692а0
[PubMed] [CrossRef] [Google Scholar]
6. Tschudi C, Ullu E. Разрушение малых ядерных РНК U2, U4 или U6 блокирует транс-сплайсинг в трипаносомных клетках. Клетка. 1990 г.; 61: 459–66. [PubMed] [Google Scholar]
7. Hannon GJ, Maroney PA, Nilsen TW. Требования малых ядерных рибонуклеопротеинов U для цис- и транс-сплайсинга нематод in vitro. Дж. Биол. хим. 1991; 266: 22792–5. [PubMed] [Google Scholar]
8. Марони П.А., Ю.Т., Янковская М., Нильсен Т.В. Прямой анализ цис- и транс-сплайсосом нематод: функциональная роль мяРНК U5 в транс-сплайсинге с добавлением лидера сплайсинга и идентификация новых мяРНП Sm. РНК. 1996 год; 2: 735–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Liang X-h, Haritan A, Uliel S, Michaeli S. Транс- и цис-сплайсинг в трипаносоматидах: механизм, факторы и регуляция. Эукариот. Клетка. 2003 г.; 2: 830–40. 10.1128/ЕС.2.5.830-840.2003 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Luz Ambrosio D, Lee JH, Panigrahi AK, Nguyen TN, Cicarelli RMB, Günzl A.
11. Tkacz ID, Gupta SK, Volkov V, Romano M, Haham T, Tulinski P, et al. Анализ сплайсосомных белков у трипаносоматид выявил новые функции в процессинге мРНК. Дж. Биол. хим. 2010 г.; 285: 27982–99. 10.1074/jbc.M109.095349 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
12. Thomas JD, Conrad RC, Blumenthal T. Транс-сплайсированная лидерная РНК C. elegans связана с Sm и имеет триметилгуанозиновый кэп. Клетка. 1988 год; 54: 533–9. [PubMed] [Google Scholar]
13. Ferguson KC, Heid PJ, Rothman JH. Транс-сплайсированная лидерная РНК SL1 выполняет важную эмбриональную функцию у Caenorhabditis elegans, которая также может обеспечиваться РНК SL2. Гены Дев. 1996 год; 10: 1543–1556. [PubMed] [Академия Google]
14. Lustig Y, Sheiner L, Vagima Y, Goldshmidt H, Das A, Bellofatto V, et al.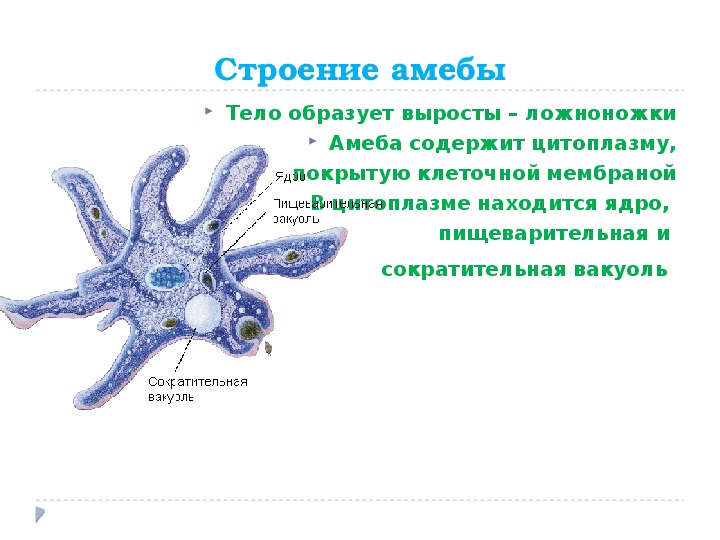 Сайленсинг РНК-лидера сплайсинга: новый стресс-индуцированный механизм у Trypanosoma brucei. Представитель ЕМБО 2007 г.; 8: 408–13. 10.1038/сж.эмбор.7400930
[Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Сайленсинг РНК-лидера сплайсинга: новый стресс-индуцированный механизм у Trypanosoma brucei. Представитель ЕМБО 2007 г.; 8: 408–13. 10.1038/сж.эмбор.7400930
[Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
15. Джонсон П.Дж., Кутер Дж.М., Борст П. Инактивация транскрипции УФ-облучением T. brucei свидетельствует о наличии мультицистронной единицы транскрипции, включающей ген VSG. Клетка. 1987 год; 51: 273–81. [PubMed] [Академия Google]
16. Мухич М.Л., Бутройд Дж.К. Полицистронные транскрипты в трипаносомах и их накопление во время теплового шока: свидетельство роли предшественников в синтезе мРНК. Мол. Клетка. биол. 1988 год; 8: 3837–46. 10.1128/МКВ.8.9.3837 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Tschudi C, Ullu E. Полигенные транскрипты являются предшественниками мРНК кальмодулина в трипаносомах. ЕМБО Дж. 1988; 7: 455–63. [Статья бесплатно PMC] [PubMed] [Google Scholar]
18. Spieth J, Brooke G, Kuersten S, Lea K, Blumenthal T. Опероны в C. elegans: предшественники полицистронной мРНК процессируются путем транс-сплайсинга SL2 в нижестоящие области кодирования. Клетка. 1993; 73:521–32. [PubMed] [Google Scholar]
Опероны в C. elegans: предшественники полицистронной мРНК процессируются путем транс-сплайсинга SL2 в нижестоящие области кодирования. Клетка. 1993; 73:521–32. [PubMed] [Google Scholar]
19. Davis RE. Транс-сплайсинг лидерной РНК сплайсинга у Metazoa. Паразитол. Сегодня. 1996 год; 12: 33–40. [PubMed] [Google Scholar]
20. Zeiner GM, Sturm NR, Campbell DA. Лидер сплайсинга Leishmania tarentolae содержит детерминанты ассоциации с полисомами. Дж. Биол. хим. 2003 г.; 278: 38269–75. 10.1074/jbc.M304295200 [PubMed] [CrossRef] [Google Scholar]
21. Hastings KEM. Транс-сплайсинг SL: легко прийти или легко уйти? Тенденции Жене. 2005 г.; 21: 240–7. 10.1016/j.tig.2005.02.005 [PubMed] [CrossRef] [Академия Google]
22. Ченг Г., Коэн Л., Ндегва Д., Дэвис Р.Э. Лидер сплайсинга плоских червей 3′-концевой AUG в качестве инициатора трансляции метионин. Дж. Биол. хим. 2006 г.; 281: 733–43. 10.1074/jbc.M506963200 [PubMed] [CrossRef] [Google Scholar]
23. Дурис В.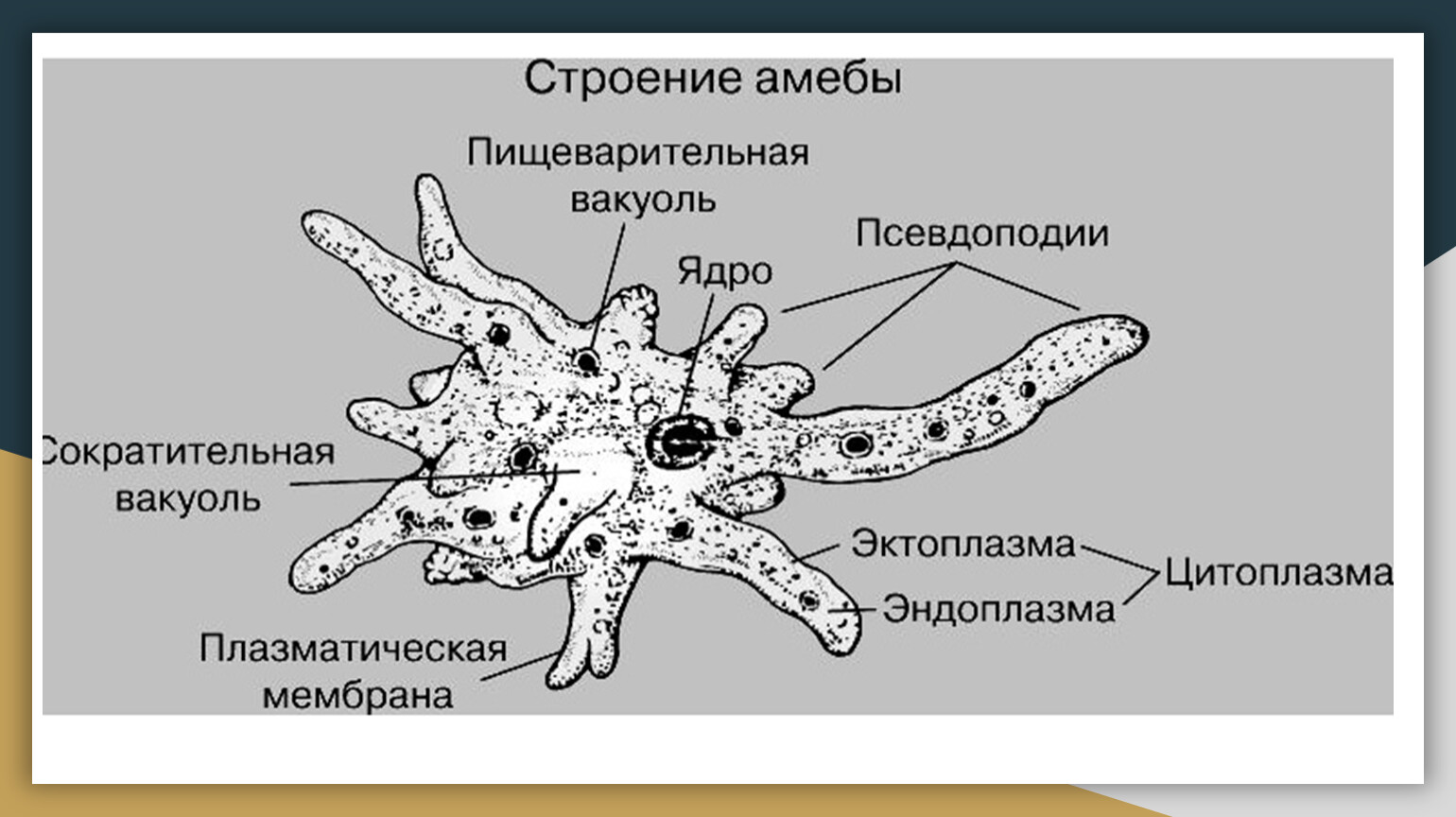 , Телфорд М.Дж., Авероф М. Доказательства множественного независимого происхождения транс-сплайсинга у Metazoa. Мол. биол. Эвол. 2010 г.; 27: 684–93. 10.1093/молбев/мсп286
[PubMed] [CrossRef] [Google Scholar]
, Телфорд М.Дж., Авероф М. Доказательства множественного независимого происхождения транс-сплайсинга у Metazoa. Мол. биол. Эвол. 2010 г.; 27: 684–93. 10.1093/молбев/мсп286
[PubMed] [CrossRef] [Google Scholar]
24. Tessier LH, Keller M, Chan RL, Fournier R, Weil JH, Imbot P. Короткие лидерные последовательности могут быть перенесены с малых РНК на незрелые мРНК путем транс-сплайсинга. в Эвглена. EMBO J. 1991; 10: 2621–2625. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Zhang H, Hou Y, Miranda L, Campbell DA, Sturm NR, Gaasterland T, et al. Транс-сплайсинг лидерной РНК сплайсинга у динофлагеллят. проц. Натл. акад. науч. США, 2007 г.; 104: 4618–23. 10.1073/пнас.0700258104 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Zhang H, Campbell DA, Sturm NR, Dungan CF, Lin S. Сплайсированные лидерные РНК, сдвиг рамки считывания митохондриальных генов и многобелковая филогения расширяют поддержку род Perkinsus как уникальная группа альвеолят. ПЛОС ОДИН. 2011 г.; 6(5): e19933
10.1371/journal.pone.0019933
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2011 г.; 6(5): e19933
10.1371/journal.pone.0019933
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Nowack ECM, Price DC, Bhattacharya D, Singer A, Melkonian M, Grossman AR. Перенос генов от различных бактерий компенсирует редуктивную эволюцию генома в хроматофоре Paulinella chromatophora. проц. Натл. акад. науч. США 2016; 113: 12214–9. 10.1073/пнас.1608016113 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Vandenberghe AE, Meedel TH, Hastings KE. Транс-сплайсинг 5′-лидера мРНК у хордовых. Гены Дев. 2001 г.; 15:294–303. 10.1101/гад.865401 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Ganot P, Kallesøe T, Reinhardt R, Chourrout D, Thompson EM. Транс-сплайсинг РНК-лидера сплайсинга у хордовых Oikopleura dioica с компактным геномом. Мол. Клетка. биол. 2004 г.; 24: 7795–805. 10.1128/МКБ.24.17.7795-7805.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Yang F, Xu D, Zhuang Y, Yi X, Huang Y, Chen H, et al. Транс-сплайсинг лидерной РНК сплайсинга обнаружен у копепод. Научный представитель 2015 г.; 5: 17411
10.1038/srep17411
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Транс-сплайсинг лидерной РНК сплайсинга обнаружен у копепод. Научный представитель 2015 г.; 5: 17411
10.1038/srep17411
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Стовер Н.А., Стил Р.Э. Добавление лидера транс-сплайсинга к мРНК у книдарии. проц. Натл. акад. науч. США, 2001 г.; 98: 5693–8. 10.1073/пнас.101049998 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Derelle R, Momose T, Manuel M, Da Silva C, Wincker P, Houliston E. Конвергентное происхождение и быстрая эволюция транс-сплайсинга лидеров сплайсинга в многоклеточные: взгляды на гребневиков и гидрозоа. РНК. 2010 г.; 16: 696–707. 10.1261/РНК.1975210 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Hannon GJ, Maroney PA, Yu YT, Hannon GE, Nilsen TW. Взаимодействие мяРНК U6 с последовательностью, необходимой для функции SL РНК нематоды при транс-сплайсинге. Наука. 1992 год; 258: 1775–80. [PubMed] [Google Scholar]
34. Marin B, Nowack ECM, Melkonian M. Создание пластиды: свидетельство второго первичного эндосимбиоза. Протист. 2005 г.; 156: 425–32. 10.1016/ж.протис.2005.09.001
[PubMed] [CrossRef] [Google Scholar]
Создание пластиды: свидетельство второго первичного эндосимбиоза. Протист. 2005 г.; 156: 425–32. 10.1016/ж.протис.2005.09.001
[PubMed] [CrossRef] [Google Scholar]
35. Yoon HS, Reyes-Prieto A, Melkonian M, Bhattacharya D. Минимальная эволюция пластидного генома у эндосимбионта Paulinella. Курс. биол. 2006 г.; 16: Р670–2. 10.1016/j.cub.2006.08.018 [PubMed] [CrossRef] [Академия Google]
36. Nowack ECM, Melkonian M, Glöckner G. Хроматофорная последовательность генома Paulinella проливает свет на приобретение фотосинтеза эукариотами. Курс. биол. 2008 г.; 18: 410–8. 10.1016/j.куб.2008.02.051 [PubMed] [CrossRef] [Google Scholar]
37. Delaye L, Valadez-Cano C, Pérez-Zamorano B. Насколько древняя Paulinella Chromatophora? PLOS Токи Древо Жизни. 2016. Издание 1. 10.1371/currents.tol.e68a099364bb1a1e129a17b4e06b0c6b [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Санчес-Баракальдо П., Рэйвен Дж. А., Пизани Д., Нолл А. Х. Ранние фотосинтезирующие эукариоты населяли слабосоленые местообитания. проц. Натл. акад. науч. США 2017; 114: Е7737–Е45. 10.1073/пнас.1620089114
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США 2017; 114: Е7737–Е45. 10.1073/пнас.1620089114
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Nakayama T, Ishida K-i. Еще одно приобретение первичной фотосинтетической органеллы происходит у Paulinella chromatophora. Курс. биол. 2009 г.; 19: Р284–5. 10.1016/j.куб.2009.02.043 [PubMed] [CrossRef] [Академия Google]
40. Nowack E, Vogel H, Groth M, Grossman A, Melkonian M, Glöckner G. Эндосимбиотический перенос генов и регуляция транскрипции переносимых генов у Paulinella chromatophora. Мол. биол. Эвол. 2011 г.; 28: 407–22. 10.1093/молбев/мск209 [PubMed] [CrossRef] [Google Scholar]
41. Nomura M, Nakayama T, Ishida K-i. Подробный процесс строительства раковины фотосинтезирующей раковинной амебы Paulinella chromatophora (euglyphid, Rhizaria). Дж. Эукариот. микробиол. 2014; 61: 317–21. 10.1111/ев.12102 [PubMed] [CrossRef] [Академия Google]
42. Lhee D, Yang EC, Kim JI, Nakayama T, Zuccarello G, Andersen RA, et al. Разнообразие фотосинтетических видов Paulinella с описанием Paulinella micropora sp. ноябрь и последовательность генома хроматофора для штамма KR01. Протист. 2017; 168: 155–70. 10.1016/ж.протис.2017.01.003
[PubMed] [CrossRef] [Google Scholar]
Разнообразие фотосинтетических видов Paulinella с описанием Paulinella micropora sp. ноябрь и последовательность генома хроматофора для штамма KR01. Протист. 2017; 168: 155–70. 10.1016/ж.протис.2017.01.003
[PubMed] [CrossRef] [Google Scholar]
43. Carninci P, Hayashizaki Y. Высокоэффективное клонирование полноразмерной кДНК. Методы Энзимол. 1999 г.; 303: 19–44. [PubMed] [Google Scholar]
44. Татусов Р.Л., Федорова Н.Д., Джексон Дж.Д., Джейкобс А.Р., Кирютин Б., Кунин Е.В., и соавт. База данных COG: обновленная версия включает эукариоты. Биоинформатика BMC. 2003 г.; 4(1): 1 10.1186/1471-2105-4-41 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Гальперин М.Ю., Макарова К.С., Вольф Ю.И., Кунин Е.В. Расширенный охват микробного генома и улучшенная аннотация семейства белков в базе данных COG. Нуклеиновые Кислоты Res. 2015 г.; 43 (проблема с базой данных): D261–9. 10.1093/нар/гку1223 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Цукер М. Веб-сервер Mfold для предсказания укладки нуклеиновых кислот и гибридизации. Нуклеиновые Кислоты Res. 2003 г.; 31: 3406–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Цукер М. Веб-сервер Mfold для предсказания укладки нуклеиновых кислот и гибридизации. Нуклеиновые Кислоты Res. 2003 г.; 31: 3406–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Денкер Дж.А., Марони П.А., Ю.Т., Каност Р.А., Нильсен Т.В. Множественные требования к функции RNP лидера сплайсинга нематод в транс-сплайсинге. РНК. 1996; 2: 746–55. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Мандельбойм М., Барт С., Битон М., Лян Xh, Михаэли С. Замалчивание белков Sm в Trypanosoma brucei с помощью РНК-интерференции захватило новый цитоплазматический промежуточный продукт в сплайсированной лидерной РНК. биогенез. Дж. Биол. хим. 2003 г.; 278: 51469–78. 10.1074/jbc.M308997200 [PubMed] [CrossRef] [Google Scholar]
49. Гибсон В., Бингл Л., Блендеман В., Браун Дж., Вуд Дж., Стивенс Дж. Структура и вариации последовательности лидерного транскрипта, сплайсированного трипаносомами. Мол. Биохим. Паразитол. 2000 г.; 107: 269–77. [PubMed] [Google Scholar]
50. Sturm NR, Yu MC, Campbell DA. Терминация транскрипции и процессинг 3′-конца сплайсированной лидерной РНК в кинетопластидах. Мол. Клетка. биол. 1999 г.; 19: 1595–604. 10.1128/МКВ.19.2.1595
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Sturm NR, Yu MC, Campbell DA. Терминация транскрипции и процессинг 3′-конца сплайсированной лидерной РНК в кинетопластидах. Мол. Клетка. биол. 1999 г.; 19: 1595–604. 10.1128/МКВ.19.2.1595
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Zhang H, Campbell DA, Sturm NR, Lin S. Гены лидерной РНК сплайсинга динофлагеллят демонстрируют множество последовательностей и геномных расположений. Мол. биол. Эвол. 2009 г.; 26: 1757–71. 10.1093/молбев/msp083 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Бурки Ф. Эукариотическое древо жизни с глобальной филогеномной точки зрения. Перспективы Колд-Спринг-Харбор в биологии. 2014; 6(5): а016147–а. 10.1101/cshperspect.a016147 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Hannon GJ, Maroney PA, Ayers DG, Shambaugh JD, Nilsen TW. Транскрипция транс-сплайсированной лидерной РНК нематоды требует внутренних элементов как для инициации, так и для формирования 3′-конца. EMBO Дж. 1990; 9: 1915–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1990; 9: 1915–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Лалл С., Фридман С.С., Янковска-Анышка М., Степински Дж., Дарзинкевич Э., Дэвис Р.Е. Вклад транс-сплайсинга, длины 5′-лидера, синергизма кэп-поли(А) и факторов инициации в трансляцию нематод в бесклеточной системе эмбрионов Ascaris suum. Дж. Биол. хим. 2004 г.; 279: 45573–85. 10.1074/jbc.M407475200 [PubMed] [CrossRef] [Google Scholar]
55. Curtis BA, Tanifuji G, Burki F, Gruber A, Irimia M, Maruyama S, et al. Геномы водорослей раскрывают эволюционный мозаицизм и судьбу нуклеоморфов. Природа. 2012 г.; 492: 59–65. 10.1038/природа11681 [PubMed] [CrossRef] [Google Scholar]
56. Schwelm A, Fogelqvist J, Knaust A, Jülke S, Lilja T, Bonilla-Rosso G, et al. Геном Plasmodiophora brassicae раскрывает информацию о его жизненном цикле и происхождении хитинсинтаз. Научный представитель 2015 г.; 5: 11153 10.1038/srep11153 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Glöckner G, Hülsmann N, Schleicher M, Noegel AA, Eichinger L, Gallinger C, et al. Геном фораминифер Reticulomyxa filosa. Курс. биол. 2014; 24: 11–8. 10.1016/j.cub.2013.11.027
[PubMed] [CrossRef] [Академия Google]
Геном фораминифер Reticulomyxa filosa. Курс. биол. 2014; 24: 11–8. 10.1016/j.cub.2013.11.027
[PubMed] [CrossRef] [Академия Google]
58. Краузе М., Хирш Д. Транс-сплайсированная лидерная последовательность актиновой мРНК у C. elegans. Клетка. 1987 год; 49: 753–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Pelle R, Murphy NB. Стадийно-специфическое дифференциальное полиаденилирование РНК, происходящей из мини-экзона, в африканских трипаносомах. Мол. Биохим. Паразитол. 1993 год; 59: 277–86. [PubMed] [Google Scholar]
60. Lamontagne J, Papadopoulou B. Регуляция развития гена сплайсированной лидерной РНК у амастигот Leishmania donovani опосредована специфическим полиаденилированием. Дж. Биол. хим. 1999; 274: 6602–9. 10.1074/jbc.274.10.6602 [PubMed] [CrossRef] [Google Scholar]
61. Nilsen TW, Shambaugh J, Denker J, Chubb G, Faser C, Putnam L, et al.
Характеристика и экспрессия сплайсированной лидерной РНК у паразитической нематоды Ascaris lumbricoides var. сум. Мол. Клетка. биол. 1989 год; 9: 3543-7. 10.1128/МКБ.9.8.3543
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
сум. Мол. Клетка. биол. 1989 год; 9: 3543-7. 10.1128/МКБ.9.8.3543
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Wang P, Palfi Z, Preusser C, Lücke S, Lane WS, Kambach C, et al. Коровая вариация Sm в сплайсосомных малых ядерных рибонуклеопротеинах Trypanosoma brucei. EMBO J. 2006; 25: 4513–23. 10.1038/sj.emboj.7601328 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Пушкина-Станчева Н.Н., Таннаклифф А. Транс-сплайсинг, опосредованный лидерной РНК сплайсинга у Phylum Rotifera. Мол. биол. Эвол. 2005 г.; 22: 1482–1489. 10.1093/молбев/msi139 [PubMed] [CrossRef] [Google Scholar]
64. Гладышев Э.А., Мезельсон М., Архипова И.Р. Массивный горизонтальный перенос генов у бделлоидных коловраток. Наука. 2008 г.; 320: 1210–3. 10.1126/науч.1156407 [PubMed] [CrossRef] [Google Scholar]
65. Song B, Morse D, Song Y, Fu Y, Lin X, Wang W и др.
Сравнительная геномика выявила два основных периода ретропозиции генов, совпадающих с решающими периодами эволюции симбиодиниума.