Слово ЭВГЛЕНА — Что такое ЭВГЛЕНА?
Слово состоит из 7 букв: первая э, вторая в, третья г, четвёртая л, пятая е, шестая н, последняя а,
Слово эвглена английскими буквами(транслитом) — evglena
Значения слова эвглена. Что такое эвглена?
Эвглена
Эвглена (Euglena), род микроскопических подвижных одноклеточных организмов из отдела эвгленовых водорослей. Тело веретеновидное или лентовидное, одетое мягкой оболочкой (пелликулой)…
БСЭ. — 1969—1978
Эвглена эвгле́на род эвгленовых водорослей. Встречаются преимущественно в пресных водах. Одноклеточные организмы зелёного цвета. На переднем конце имеется мешковидное углубление – глотка…
Биологический энциклопедический словарь. — 1986
ЭВГЛЕНА, род эвгленовых водорослей. Встречаются преимущественно в пресных водах. Одноклеточные организмы зелёного цвета. На переднем конце имеется мешковидное углубление – глотка…
Биологический словарь
Эвглена зелёная
Эвглена зелёная (лат. Euglena viridis) — вид протистов из типа Эвгленозои (Euglenozoa). Наиболее известный представитель эвгленовых водорослей.
ru.wikipedia.org
ЭВГЛЕНОВЫЕ ВОДОРОСЛИ (Euglenophyta)
Эвглениды (лат. Euglenida) — отряд протозоа. Объединяет около 1000 видов, среди них имеется много бесцветных форм. Эвглениды имеют один или несколько жгутиков, за исключением небольшой группы безжгутиковых форм, а также прикрепленных организмов.Эвгленоидеи Эвглена зелёная (Euglena viridis) Научная классификация Международное научное название Euglenoidea Bütschli, 1884.
Изображения на Викискладе ITIS 43804 EOL 4842 Эвглениды (лат. ru.wikipedia.org
ЭВГЛЕНОВЫЕ ВОДОРОСЛИ ЭВГЛЕНОВЫЕ ВОДОРОСЛИ (Euglenophyta), отдел водорослей. Одноклеточные микроскопические (дл. от 4 до 500 мкм) подвижные организмы, реже прикреплённые и колониальные.Род эвглена (Euglend) — объект лабораторных исследований. Происхождение (возможно, от предков, общих с зелёными водорослями) и филогенетич. связи Э. в. неясны. (см. ФИТОМАСТИГИНЫ).
Биологический энциклопедический словарь. — 1986
ЭВГЛЕНОВЫЕ ВОДОРОСЛИ (Eugle-nophyta), отдел- водорослей. Одноклеточные микроскопические (дл. от 4 до 500 мкм) подвижные организмы, реже прикреплённые и колониальные.Род эвглена (Euglena) — объект лабораторных исследований. Происхождение (возможно, от предков, общих с зелёными водорослями) и филогенетич; связи Э. в.
Биологический словарьнеясны.
Отдел эвгленовые водоросли (Euglenophyta)
Отдел эвгленовые водоросли (Euglenophyta) Эвгленрвые водоросли — обычные обитатели небольших пресных стоячих водоемов. В летние месяцы можно наблюдать, как в небольшом пруду или луже внезапно зеленеет вода.Процесс деления может продолжаться от 2— 4 ч (у эвглен) до двух суток (у факусов). В своем цикле развития большинство эвгленовых водорослей сохраняет подвижный образ жизни.
Биологическая энциклопедия
Русский язык
Эвгле́на, -ы.
Орфографический словарь. — 2004
- эвбея
- эвгемеризм
- эвгенол
- эвглена
- эвдемонизм
- эвдемонистический
- эвдиалит
Эвглена что это? Значение слова Эвглена
Эвглена в Энциклопедическом словаре:
Эвглена — род жгутиковых одноклеточных зеленых водорослей. Длина до 0,1мм. Содержат хлорофилл, но обладают смешанным типом питания (авто- игетеротрофным). Ок. 60 видов, преимущественно в мелких пресных водоемах,часто вызывают «цветение» воды. Зоологи эвглену относят к простейшим -растительным жгутиконосцам.
Длина до 0,1мм. Содержат хлорофилл, но обладают смешанным типом питания (авто- игетеротрофным). Ок. 60 видов, преимущественно в мелких пресных водоемах,часто вызывают «цветение» воды. Зоологи эвглену относят к простейшим -растительным жгутиконосцам.
Значение слова Эвглена по словарю Брокгауза и Ефрона:
Эвглена (Euglena) — род семейства эвглен (Euglenina), подотряда эвгленовых (Euglenoidina), отряда Flagellata или Autoflagellata, класса биченосцев (см. Биченосцы, табл., фиг. 10, 11) или Mastigophora. Э., одноклеточные животные микроскопической величины (0,03—0,2 мм), встречаются как в пресных водах (по преимуществу в лужах, канавках, болотах и др. стоячих водах), так и в морях. Тело продолговатое, веретенообразное, или цилиндрическое, или лентовидное, тупо срезанное на переднем и заостренное на заднем конце. Жгутик прикрепляется в углублении на переднем конце тела. Эктоплазма тонкая, у некоторых видов снабжена спирально расположенными утолщениями или полосками. Хроматофоров обыкновенно несколько (разнообразной формы) или один (лентовидный или разрезной). одно ядро. пиреноиды у немногих видов. на переднем конце тела глазок (stigma) и несколько сократительных вакуолей, открывающихся в резервуар с выводным каналом (рот и глотка по прежнему обозначению). Тело метаболично. Размножаются продольным делением. инцистируются легко. Различают ок. 12 видов, найденных во всех частях света. В. Ш.
Хроматофоров обыкновенно несколько (разнообразной формы) или один (лентовидный или разрезной). одно ядро. пиреноиды у немногих видов. на переднем конце тела глазок (stigma) и несколько сократительных вакуолей, открывающихся в резервуар с выводным каналом (рот и глотка по прежнему обозначению). Тело метаболично. Размножаются продольным делением. инцистируются легко. Различают ок. 12 видов, найденных во всех частях света. В. Ш.
Определение слова «Эвглена» по БСЭ:
Эвглена (Euglena)
род микроскопических подвижных одноклеточных организмов из отдела эвгленовых водорослей. Тело веретеновидное или лентовидное, одетое мягкой оболочкой (пелликулой), спереди с одним наружным жгутом и прилегающей к глотке стигмой (глазком красного цвета). Хлоропласты зелёные, часто сложно построенные. Известно около 60 видов Э. Живут преимущественно в мелких водоёмах, где плавают в толще воды. Некоторые Э. (Е. viridis) могут сбрасывать жгут и ползать или, округлившись, жить в неподвижном состоянии на поверхности воды, ила, почвы. При неблагоприятных условиях превращаются в споры (цисты). Питание у большинства миксотрофное, иногда (при потере хлорофилла) и сапрофитное. Э. широко распространены, нередко вызывают цветение воды. Е. sanguinea, богатая каротином, придаёт воде красный цвет. Э. — объект лабораторных экспериментов.
При неблагоприятных условиях превращаются в споры (цисты). Питание у большинства миксотрофное, иногда (при потере хлорофилла) и сапрофитное. Э. широко распространены, нередко вызывают цветение воды. Е. sanguinea, богатая каротином, придаёт воде красный цвет. Э. — объект лабораторных экспериментов.
Эвглена зеленая — Животные
Эвглена зеленая — это одноклеточный организм, представитель простейших, относится к роду эвглен.
Эвглена зеленая сочетает в себе признаки как растений, так и животных. Ее клетка содержит хлорофилл и на свету может питаться за счет процесса фотосинтеза, как это делают растения. В темноте и при обилии органической пищи эвглена питается гетеротрофно, как животное, поглощая органику. Кроме способа питания ее роднит с животными также способность к активному передвижению.
Эвглена зеленая обычно обитает в загрязненных пресных водоемах. При ее сильном размножении вода приобретает зеленый оттенок («цветение воды»).
Тело вытянуто, на переднем конце есть один длинный жгутик, задний конец слегка расширен и заострен. Эвглена имеет эластичную оболочку, которая придает ей форму, но позволяет незначительно изменять форму клетки. Движение осуществляется в том направлении, где находится жгутик.
В клетке жгутик переходит в базальное тельце. Оно плотное и служит для крепления жгутика.
С той же стороны, где находится жгутик у эвглены зеленой находится клеточный рот, с помощью которого она заглатывает органические частицы. Этому помогает жгутик.
Также в передней части клетки находится светочувствительное образование – глазок, имеющий красный цвет. Эвглена зеленая обладает положительным фототаксисом, т. е. плывет в сторону света.
В передней части клетки эвглены находится сократительная вакуоль. С ее помощью из клетки выводятся избытки воды, вредные вещества.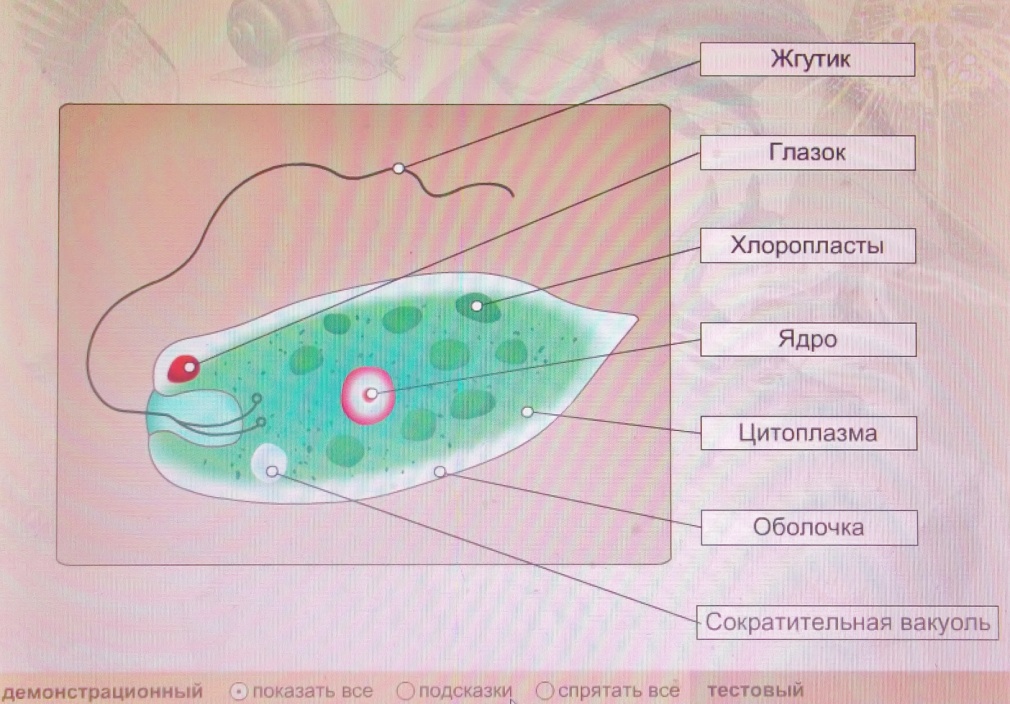
В остальной части клетки находятся ядро, хлоропласты, другие клеточные органеллы, а также пищеварительные вакуоли.
Эвглена зеленая заглатывает органику не только клеточным ртом. Растворенные органические вещества могут поглощаться через всю ее оболочку. Выброс непереваренных остатков из пищеварительных вакуолей происходит не в любом месте поверхности клетки (как это происходит у амебы), а только у заднего конца.
Дышит эвглена всей поверхностью. В нее из воды поступает кислород, который окисляет в митохондриях органические вещества и происходит выделение энергии. Побочными продуктами при дыхании являются вода и углекислый газ.
Последний удаляется из клетки также как поступает кислород, т. е. через клеточную мембрану.
Для эвглены зеленой описан бесполый способ размножения. При этом клетка делится вдоль продольной оси (по длинной стороне). Дочерние клетки, которые не получают те или иные органеллы, достраивают их самостоятельно.
В неблагоприятных условиях (низкая температура, высыхание водоема) эвглена зеленая образует цисту. При образовании цисты происходит отпадание жгутика, клетка приобретает округлую форму и покрывается плотной оболочкой.
При образовании цисты происходит отпадание жгутика, клетка приобретает округлую форму и покрывается плотной оболочкой.
Дорогие друзья! Сегодня мы будем с вами говорить об Эвглене зеленой. Эвглена зеленая — это представитель типа саркожгутиковых, класса жгутиконосцев.
Все жгутиковые имеют один или несколько жгутиков, с помощью которых они передвигаются и захватывают пищу.
По типу питания жгутиковые делятся на две группы — это автотрофы и гетеротрофы. Гетеротрофы — это животные одноклеточные, которые питаются бактериями либо мельчайшими простейшими. Автотрофы — это растительные одноклеточные, которые могут синтезировать органические вещества из неорганических с помощью фотосинтеза.
Эвглена зеленая может совмещать автотрофный и гетеротрофный тип питания, то есть она является миксотрофным организмом, она относится одновременно и к царству растений и к царству животных. Эвглена зеленая имеет веретонообразную форму тела, форма ее тела постоянна за счет эластичной пелликулы.
Передний конец тела эвглены притупленный, задний — заостренный. На переднем конце тела есть глотка, рядом с глоткой располагается один жгутик, в основании которого есть базальное тельце. С помощью движений жгутика эвглена зеленая может перемещаться и захватывать пищу. Рядом с глоткой есть светочувствительный глазок, с его помощью эвглена определяет, где света больше и перемещается в наиболее освещенные участки водоема, так как свет ей нужен для автотрофного питания.
Процесс перемещения к свету называется положительным фототаксисом. У эвглены зеленой есть сократительная вакуоль, которая участвует в процессе осморегуляции, сократительная вакуоль открывается в глотку.
Эвглена имеет одно гаплоидное ядро (то есть имеющее одинарный набор хромасом). В цитоплазме эвглены зеленой есть несколько десятков хлоропластов и большое количество гранул резервного белка — парамила. На свету эвглена питается как зеленое растение с помощью фотосинтеза.
Газообмен происходит через всю поверхность тела. При недостатке солнечного света эвглена зеленая теряет хлорофилл и переходит на гетеротрофный тип питания.
При недостатке солнечного света эвглена зеленая теряет хлорофилл и переходит на гетеротрофный тип питания.
Размножается эвглена зеленая только бесполым путем, при этом одна материнская клетка делится продольной бороздой на две дочерние. Непосредственно перед делением ядро делится митотически. В неблагоприятных условиях эвглена зеленая может образовывать цисту.
Наталья ПоповаЭвглена зеленая — это одноклеточное животное, относящееся к подцарству Простейшие (Protozoa), типу Саркодовые и жгутиконосцы (Sarcomastigophora), классу Жгутиконосцы (Mastigophora). Все представители класса Жгутиконосцев имеют на поверхности клетки длинные выросты — жгутики, с помощью которых они могут активно передвигаться. Количество жгутиков может быть от 1 до нескольких сотен. У эвглены зеленой имеется 1 жгутик.
Строение и среда обитания эвглены зеленой
Эвглена зеленая живет в загрязненных пресных водоемах, вызывая «цветение воды»: из за огромного количества особей эвглены зеленой вода в пруду, канаве или луже становится зеленого цвета.
Тело эвглены зеленой вытянутое, веретеновидной формы, заостренное на конце, состоит из одной клетки, и покрыто тонкой эластичной оболочкой, помогающей эвглене сохранять свою форму, а также вытягиваться, сокращаться и извиваться. На переднем конце тела у эвглены зеленой имеется длинный жгутик, который переходит в углубление — клеточный рот. Жгутик вращается, благодаря чему эвглена движется в воде, совершая при этом вращательные движения в сторону, противоположную вращению жгутика, как бы ввинчиваясь в воду.
Кроме того вращение жгутика способствует засасыванию в клеточный рот органических микрочастиц, которыми питается эвглена зеленая. В основании жгутика лежит плотное базальное тельце. На переднем же конце тела расположен красный светочувствительный глазок, и сократительная вакуоль.
В цитоплазме также имеется ядро, ближе к заднему концу эвглены зеленой, и хлоропласты, содержащие зеленый пигмент — хлорофилл. Периодически в цитоплазме эвглены зеленой у клеточного рта образуется пищеварительная вакуоль, которая так же, как у амебы, движется в цитоплазме и опорожняется у заднего конца эвглены, выбрасывая непереваренные частицы пищи.
[custom_ads_shortcode1]
Питание эвглены зеленой.
Эвглена зеленая — представитель так называемых растительных жгутиконосцев, у которых в цитоплазме имеются хлоропласты, благодаря которым эвглена может питаться, как растение — автотрофно, с помощью фотосинтеза синтезируя органические веществаиз воды и углекислого газа, растворенного в воде. Этот процесс происходит на свету. Благодаря наличию специального органа — глазка, расположенного на переднем конце эвглены, она может различать свет, и всегда плывет туда, где больше света, то есть туда, где фотосинтез идет активнее. Органические вещества, образующиеся при фотосинтезе, запасаются в виде гранул в цитоплазме, и расходуются, когда эвглена голодает.
Однако, в отличие от растений, эвглена зеленая может питаться и гетеротрофно, поглощая готовые органические вещества, засасывая их через клеточный рот, при этом образуется пищеварительная вакуоль. Или непосредственно через клеточную оболочку — пелликулу, образующую микротрубочки — впячивания, через которые в цитоплазму поступают растворенные в воде органические вещества.
Пищей для эвглены зеленой могут служить одноклеточные водоросли и животные, бактерии, микрочастицы органических веществ. В темноте эвглена зеленая питается только гетеротрофно, а на свету у нее присутствуют оба способа питания. Если поместить эвглену на долгое время в темноту, хлорофилл у нее исчезает, и она переходит полностью на гетеротрофное питание.
Таким образом, эвглена зеленая занимает промежуточное положение между растением и животным.
[custom_ads_shortcode2]
Дыхание
Эвглена зеленая дышит кислородом, растворенным в воде, и так же, как и у амебы, кислород поступает в цитоплазму через всю поверхность тела. При участии кислорода идут реакции окисления органических веществ, в результате чего образуется необходимая для жизнедеятельности эвглены энергия.
[custom_ads_shortcode3]
Выделение
В процессе жизнедеятельности эвглены зеленой в цитоплазму поступают вредные вещества (так называемые продукты распада), которые собираются в сократительную вакуоль и выталкиваются в клеточный рот, сообщающийся с внешней средой. Вместе с вредными веществами из клетки удаляется также избыток воды.
Вместе с вредными веществами из клетки удаляется также избыток воды.
[custom_ads_shortcode1]
Размножение эвглены зеленой
Эвглена зеленая делится бесполым путем — простым делением на 2 части, которое происходит вдоль продольной оси животного. При этом сначала делится ядро, а затем все тело эвглены делится надвое вдоль продольной перетяжки. Если какой — то орган, например, жгутик, не попал в одну из частей, то он там образуется.
В неблагоприятных условиях, например, при пересыхании водоема, эвглена зеленая так же, как и амеба, образует цисту. При этом жгутик отпадает, а клетка приобретает округлую форму, и покрывается очень плотной оболочкой. Циста помогает же эвглене и перезимовать.
Эвглена зелёная – лат. Euglenophyta, относится к надцарству эукариоты и семейству – Euglenaceae. Эвглены зелёные – это одноклеточные простейшие животные, встречаются эвглены в основном в пресных водах, канавах, болотах. Тело эвглены зелёной имеет разную форму. Также при изучении строения эвглены, видно, что она состоит из одной микроскопической клетки./euglena_gracilis-567a007d3df78ccc154c8a2b.jpg)
Вероятно, каждый из вас замечал, как иногда вода в пруде или луже приобретает зеленую окраску, или, как говорят, «цветёт». Если зачерпнуть такой воды и рассмотреть каплю ее под микроскопом, можно заметить в воде, наряду с другими простейшими животными и растениями, быстро плавающие продолговатые зеленые живые существа. Это – эвглены зелёные. При массовом размножении эвглены вода становится зеленой.
[custom_ads_shortcode2]
Передвижение эвглены зелёной
Передвижение эвглены зеленой осуществляется с помощью длинного и тонкого протоплазматического выроста – жгутика, расположенного на переднем конце тела эвглены. Благодаря ему эвглена зеленая передвигается. Жгутик производит винтообразные движения, как бы ввинчиваясь в воду. Действие его можно сравнить с действием винта моторной лодки или парохода. Такое движение более совершенно, чем передвижение с помощью ложноножек. Эстроглена передвигается значительно быстрее, чем инфузория туфелька.
[custom_ads_shortcode3]
Питание эвглены зелёной
Рассматривая эвглену зелёную под микроскопом, можно заметить в протоплазме её тела большое количество маленьких зелёных телец овальной формы. Это хроматофоры, в которых находится хлорофилл. Этим эвглена напоминает зелёные растения. Подобно им она с помощью хлорофилла может усваивать углерод из углекислого газа, образуя в своём теле органические вещества из неорганических. Но наряду с таким типично растительным питанием эвглена зелёная может питаться также готовыми органическими веществами, которые всегда находятся в растворенном состоянии в воде сильно заросших или загрязненных водоемов. Эти вещества она переваривает с помощью пищеварительных вакуолей, как это делает амёба обыкновенная. Следовательно, эвглена зеленая может питаться и как растение, и как животное.
Это хроматофоры, в которых находится хлорофилл. Этим эвглена напоминает зелёные растения. Подобно им она с помощью хлорофилла может усваивать углерод из углекислого газа, образуя в своём теле органические вещества из неорганических. Но наряду с таким типично растительным питанием эвглена зелёная может питаться также готовыми органическими веществами, которые всегда находятся в растворенном состоянии в воде сильно заросших или загрязненных водоемов. Эти вещества она переваривает с помощью пищеварительных вакуолей, как это делает амёба обыкновенная. Следовательно, эвглена зеленая может питаться и как растение, и как животное.
Характер ее питания зависит от наличия или отсутствия света в водоемах, в которых обитает это животное. Днем, при наличии света, эвглена зеленая питается как растение. При отсутствии света способ ее питания изменяется: подобно животным, эвглена питается готовыми органическими веществами.
При таком питании имеющийся в хроматофорах хлорофилл исчезает, и эвглена теряет свою зеленую окраску. Если поместить эвглену в темноту, она обесцвечивается и начинает питаться, как животное.
Если поместить эвглену в темноту, она обесцвечивается и начинает питаться, как животное.
Двоякий способ питания эвглены зеленой – чрезвычайно интересное явление. Оно указывает на общее происхождение растений и животных. Сравнивая высших многоклеточных животных с высшими растениями, мы без труда их различаем. Такого очевидного различия мы не обнаружим, если будем сравнивать низших одноклеточных животных (например, эвглену зеленую) и одноклеточные растения.
[custom_ads_shortcode1]
Размножение эвглены зелёной
Размножаются эвглены, как и малярийные паразиты – продольным делением. Сначала делится ядро, а затем и протоплазма. При не благоприятных условиях, например, при высыхании водоёма, эвглены, подобно амёбам, образуют цисты. В таком виде они могут разноситься с пылью.
Источники:
Euglena — обзор | ScienceDirect Topics
4 пластидных генома: ускоренная эволюция и интроны ушли в прошлое
К настоящему времени опубликовано 17 пластидных геномов эвгленофитов (хпДНК). Выборка охватывает большую часть разнообразия семейства Euglenaceae с 14 хпДНК (6 из рода Euglena и 8 из других родов), одной хпДНК из семейства Phacaceae и двумя хпДНК из двух родов Eutreptiales (Bennet, Wiegert, & Triemer, 2012; Bennett & Triemer, 2015; Bennett et al., 2014; Даббаг и Присфельд, 2016; Гокель и Хахтель, 2000; Халлик и др., 1993; Hrdá et al., 2012; Касиборски, Беннетт, Линтон и Лейн, 2016; Помберт и др., 2012; Wiegert et al., 2012, 2013). ХПДНК эвгленофитов обычно имеют форму кольцевой хромосомы. Четыре генома неполны и не подверглись циркуляризации из-за неизвестного числа повторяющихся последовательностей (Kasiborski et al., 2016) или неизвестного числа рибосомных оперонов (Wiegert et al., 2012, 2013). Их основные характеристики, включая сравнение с хпДНК P.parkeae (Turmel et al., 2009) приведены в таблице 1.
Выборка охватывает большую часть разнообразия семейства Euglenaceae с 14 хпДНК (6 из рода Euglena и 8 из других родов), одной хпДНК из семейства Phacaceae и двумя хпДНК из двух родов Eutreptiales (Bennet, Wiegert, & Triemer, 2012; Bennett & Triemer, 2015; Bennett et al., 2014; Даббаг и Присфельд, 2016; Гокель и Хахтель, 2000; Халлик и др., 1993; Hrdá et al., 2012; Касиборски, Беннетт, Линтон и Лейн, 2016; Помберт и др., 2012; Wiegert et al., 2012, 2013). ХПДНК эвгленофитов обычно имеют форму кольцевой хромосомы. Четыре генома неполны и не подверглись циркуляризации из-за неизвестного числа повторяющихся последовательностей (Kasiborski et al., 2016) или неизвестного числа рибосомных оперонов (Wiegert et al., 2012, 2013). Их основные характеристики, включая сравнение с хпДНК P.parkeae (Turmel et al., 2009) приведены в таблице 1.
Таблица 1. Характеристики пластидных геномов 17 Euglenophytes и Pyramimonas parkeae в соответствии с последовательностями, хранящимися в GenBank
| Таксономия | Виды / Штамм | cp Размер генома (bp) | Число генов | Число интронов | Содержание GC (%) | ||||
|---|---|---|---|---|---|---|---|---|---|
| Euglena gracilis Z | 143,171 | 90 | 145 | 26. 1 1 | |||||
| E. gracilis var . bacillaris | 132,034 | 90 | 134 | 25,8 | |||||
| Euglena longa | 73,345 | 57 | 60 | 22,4 | |||||
| Euglena viridis 92,693 | 77 | 26,4 | |||||||
| E. viridis SAG 1224-17d | 76,156 | 92 | 77 | 26.2 | |||||
| Euglena mutabilis | 86975 | 92 | 76 | 26,7 | |||||
| Monomorphina aenigmatica | 74,746 | 92 | 53 | 29,4 | 29,4 | 580147 | 93 | 80 | 28,0 |
| Cryptoglena skujai | 106843 | 92 | 84 | 26.3 | |||||
| Euglenaria anabaena | 88,487 | 93 | 82 | 28,0 | |||||
| Trachelomonas volvocina | 85,392 * | 93 | 94 | 16rombumin | 144,166 | 93 | 110 | 26,6 | |
| Colacium vesiculosum * | 128,892 | 92 | 130 | 26.1 | |||||
| Euglenaformisxima | 94,185 | 91 | 113 | 26,9 | |||||
| Phacus orbicularis * | 65,992 | 90 | 66 | 16 27,225 | Eutreptia viridis * | 65,523 | 86 | 27 | 28,6 |
| Eutreptiella gymnastica | 67,623 | 87 | 8 | 34.3 | |||||
| Pyramimonas parkeae | 101,605 | 110 | 1 | 34,7 | |||||
«Количество генов» указывает на кодирование как белка, так и РНК, но дубликаты и ORF не включены. Размеры генома, отмеченные звездочкой , обозначают неполные геномы. Первые три столбца, отмеченные таксономией, символизируют филогенетические отношения между организмами — объединенные строки представляют определенные клады; Euglenales окрашены в оранжевый и дополнительно подразделяются на Euglenaceae ( светло-оранжевый ) и Phacaceae ( светло-красный ), Eutreptiales окрашены в желтый , а празинофиты фиолетового .
ХПДНК P. parkeae, ближайшего известного родственника эвгленофитной пластиды, имеет длину 101,605 п.н. и содержит 110 генов (Turmel et al., 2009). Эти значения, по-видимому, снизились во время вторичного закрепления пластид — 22 гена (например, все гены НАДН-пластохинон оксидоредуктазы пластидной дыхательной цепи) были потеряны или перенесены в ядро общего предка эвгленофитов (рис. 2). Высококонсервативное ядро хпДНК эвгленофитов состоит из 89 генов (в том числе rrn5 , отсутствующих в P.parkeae ). К ним относятся 32 гена фотосинтетических белков, 5 генов белков транскрипции / трансляции, 22 гена рибосомных белков, 3 рРНК и 27 тРНК. От одного до четырех из этих генов не было обнаружено в некоторых линиях, но их отсутствие не показывает какой-либо филогенетической закономерности. Четыре гена были получены после вторичного эндосимбиоза: Eureptiales получили ycf13 (синоним кодируемой интроном maturase mat1 ), Phacaceae обладают тремя дополнительными генами, ycf13 , mat5 (обнаружено в пределах psbA psbA ). ген Lepocinclis spirogyroides — запись GenBank) и roaA (ген, связанный с рибосомным опероном), а Euglenaceae обладают mat2 в дополнение к трем вышеупомянутым генам (рис.2; Bennett & Triemer, 2015). Ген mat5 был утерян в нескольких независимых случаях в пределах Euglenales (Bennett & Triemer, 2015; Kasiborski et al., 2016). Неудивительно, что гены фотосинтетических белков были потеряны у Euglena longa , пластида которого не обладает фотосинтетической активностью. Содержание генов представлено на рис. 2.
Рис. 2. Содержание генов в пластидных геномах 14 эвгленофитов и Pyraminonas parkeae . Звездочки обозначают гены, отсутствующие в определенных пластидных геномах.Схематическое филогенетическое дерево составлено согласно Bennett and Triemer (2015).
Организация пластидного генома различается между P. parkeae , который содержит два инвертированных повтора с рибосомным опероном и большой и малой единственной копией области (Turmel et al., 2009), и большинством эвгленофитов, которые не имеют этого четырехчастного расположения. ХпДНК Eutreptiella gymnastica представляет собой единственное исключение, поскольку она содержит два инвертированных повтора (один из них прерывистый), каждый с опероном рРНК (Hrdá et al., 2012). Оперон рРНК в E. gracilis и E. longa организован в трех тандемно повторяющихся копиях (Gockel & Hachtel, 2000; Hallick et al., 1993). Истоки репликации хпДНК эвгленофитов предположительно расположены в области VNTR (переменное количество тандемных повторов) (Koller & Delius, 1982; Ravel-Chapuis, Heizmann, & Nigon, 1982). В целом гены организованы в 15 консервативных кластеров генов, порядок и ориентация которых были чрезмерно перестроены, и трудно проследить и реконструировать ход этих перестроек (Dabbagh & Preisfeld, 2016).
Самая заметная тенденция в эволюции генома пластид эвгленофита — это, несомненно, быстрое увеличение интронов. Количество распознанных интронов в геномах меняется со временем по мере улучшения аннотаций, поэтому числа, представленные в таблице 1, отражают статус аннотаций генома, опубликованных в базе данных GenBank по состоянию на июль 2017 года. Примечательно, что хпДНК Pyramimonas содержит только одиночный интрон, как и у других водорослей-празинофитов, таких как Ostreococcus tauri и Pycnococcus provasoli (Turmel et al., 2009). Число интронов начало расти после приобретения пластид предковыми эвгленидами до разделения Eutreptiales и Euglenales: хпДНК Eutreptiella и Eutreptia , которые представляют собой самые глубокие расщепления от других эвгленофитов, уже содержат 8 и 27 интронов соответственно (Hrdáptiella и Eutreptia ). et al., 2012; Wiegert et al., 2012). Интрон гена psbC , который несет кодируемую интроном матуразу ycf13 , считается предковым интроном, поскольку это единственный гомологичный интрон в хпДНК эвгленофитов (Bennett & Triemer, 2015; Pombert et al., 2012). Основное усиление и усиление интронов происходило внутри линии Euglenales, что привело к появлению нескольких видов, содержащих более 100 интронов в своих хпДНК, наиболее крайним случаем является модель E. gracilis , штамм Z , по крайней мере, со 145 интронами (Bennett & Triemer, 2015; Bennett et al., 2014; Hallick et al., 1993; Wiegert et al., 2013). Накопление интронов кажется непрерывным процессом, который происходит в данный момент, и было бы потенциально очень интересно рассмотреть некоторые из «старых» последовательностей и посмотреть, изменились ли они во время длительного культивирования людьми в течение крошечной части период их ускоренной эволюции.
Интроны пластид эвгленофитов не только многочисленны, но и уникальны по своей структуре. Большинство из них относятся к интронам группы II, которые известны из прокариот, митохондрий и пластид эукариот. Они функционируют как самосплайсирующие рибозимы и содержат шесть доменов, образующих стебель-петлю, и консервативный 5′-граничный мотив (GUGYG). Интроны группы II являются мобильными элементами, и их подвижность опосредуется созреваниями (Bonen & Vogel, 2001; Sheveleva & Hallick, 2004).Интроны эугленофитной пластидной группы II часто значительно короче (средняя длина интрона эугленофитной группы II составляет 463 нуклеотида — примерно на 100 нуклеотидов короче, чем средний интрон группы II печеночника; Dabbagh & Preisfeld, 2016), при этом некоторые консервативные домены отсутствуют и / или расходящиеся до неузнаваемости. Помимо интронов группы II, геномы пластид эвгленофитов содержат интроны группы III, которые являются исключительными для этих организмов. Они кажутся чрезвычайно производной формой интронов группы II, которая намного короче (средняя длина около 100 нуклеотидов) и лишена почти всех ядерных структур, сохраняющих только один модифицированный консервативный домен на 3′-конце и вырожденный 5′-граничный мотив ( консенсус — это NUNNG) (Bonen & Vogel, 2001; Doetsch, 2000; Doetsch, Favreau, Kuscuoglu, Thompson, & Hallick, 2001; Jenkins, Hong, & Hallick, 1995; Thompson, Copertino, Thompson, Favreau, & Hallick, 1995) .Чтобы еще больше усложнить ситуацию, геномы пластид эвгленофитов также содержат ряд твинтронов — интронов, вложенных внутри других интронов (называемых внутренними и внешними интронами соответственно), которые впоследствии соединяются. Твинтроны бывают разных типов: группа II, группа III и смешанные или даже сложные, где несколько внутренних интронов (Copertino, Christopher, & Hallick, 1991; Copertino & Hallick, 1991, 1993) или даже дополнительные интроны внутри внутреннего интрона (Drager & Hallick, 1993) можно наблюдать в одном внешнем интроне.В некоторых случаях недавнее преобразование простого интрона в твинтрон прослеживается на определенных сайтах вставки. Например, шесть локусов, содержащих твинтрон в хпДНК E. gracilis , содержат только один интрон в Monomorphina aenigmatica . В большинстве этих случаев интроны M. aenigmatica ортологичны внешним интронам их двойниковых аналогов в E. gracilis (Pombert et al., 2012). Это дополнительно подтверждает представление о том, что распространение интронов и твинтронов в хпДНК эвгленофитов является недавним и, вероятно, все еще активным процессом.
Относительно низкое содержание GC в хпДНК эвгленофитов также связано с накоплением интронов, поскольку интроны пластид эвгленид обычно богаты АТ и имеют тенденцию смещать общее содержание GC во всем геноме. Это особенно очевидно в случае E. longa , хпДНК которого имеет наименьшее количество генов, но при этом все еще богата интронами, в результате чего содержание GC чрезвычайно низкое (22,4%) (Gockel & Hachtel, 2000).
Метаболический ответ Euglena gracilis и его обесцвеченного мутантного штамма на свет
Abstract
Euglena , новый суперпродукт на рынке, представляет собой богатый питательными веществами зеленый одноклеточный микроорганизм, который обладает характеристиками как растений, так и животных.При выращивании в разных условиях Euglena производит разные биоактивные питательные вещества. Интересно, что Euglena — единственный известный микроорганизм, хлоропласты которого легко теряются при стрессе и становятся навсегда обесцвеченными. Мы применили газовую хроматографию-масс-спектрометрию (ГХ-МС) для определения метаболомов дикого типа (WT) Euglena gracilis и его обесцвеченного мутанта OflB2 при световой стимуляции. Мы обнаружили значительную метаболическую разницу между клетками WT и OflB2 в ответ на свет.Повышение содержания мембранных компонентов (фосфолипидов и ациламидов) наблюдалось у WT, тогда как снижение некоторых метаболитов стимуляторов было обнаружено у OflB2. Эти метаболические изменения после световой стимуляции имеют большое значение для развития хлоропластов Euglena и их связи с ядром.
Образец цитирования: Shao Q, Hu L, Qin H, Liu Y, Tang X, Lei A, et al. (2019) Метаболомический ответ Euglena gracilis и его обесцвеченного мутантного штамма на свет.PLoS ONE 14 (11): e0224926. https://doi.org/10.1371/journal.pone.0224926
Редактор: Хайтао Ши, Хайнаньский университет, КИТАЙ
Поступила: 5 июня 2019 г .; Одобрена: 24 октября 2019 г .; Опубликовано: 7 ноября 2019 г.
Авторские права: © 2019 Shao et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Эта работа была поддержана Национальным фондом естественных наук Китая (31670116 для AL), Фондом исследовательской группы по инновациям провинции Гуандун (2014ZT05S078 для JW) и Шэньчжэньским грантовым планом для науки и технологий (JCYJ20160308095
7, JCYJ2095770818, оба к JW). Они используются для дизайна исследования, сбора данных, анализа данных и написания рукописи соответственно.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Euglena — одноклеточная эукариотическая микроводоросль, имеющая общие характеристики как животных, так и растений. Он не имеет клеточной стенки, но содержит структуру светочувствительного глазного пятна и жгутик. Среди его множества питательных веществ — 14 типов витаминов, 9 минералов, 18 аминокислот, 11 ненасыщенных жирных кислот и 7 других, таких как хлорофилл и парамилон (β-глюкан).Различные культивирования Euglena приводят к значительному разнообразию питательных веществ внутри клеток [1]. Клетки Euglena содержат полностью развитые хлоропласты, которые могут расти как автотрофно под светом, так и гетеротрофно, поглощая органические вещества из окружающей среды [2]. Считается, что хлоропласты Euglena произошли от прохлорона в результате эндосимбиоза. В отличие от хлоропластов других микроводорослей или растений более высокого уровня, хлоропласты Euglena имеют плохую стабильность и склонны терять часть генома хлоропластов при стрессе, например, при применении антибиотиков [2].Клетки Euglena , теряющие часть своих генов, связанных с фотосинтезом, приводят к появлению обесцвеченных мутантов, которые могут стабильно расти и размножаться в гетеротрофных средах.
Хлоропласты отличаются от пропластидов без внутренней структуры. В разных средах или тканях пропластиды могут развиваться в пластидные структуры с разными функциями, такие как лейкопласты, амилопласты, хромопласты и хлоропласты. Свет является предпосылкой для биосинтеза хлорофилла Euglena , и обычно хлоропласты не могут развиваться в темноте.В процессе сборки хлоропластов фотопигменты регулируют синтез белков, связанных с хлоропластами, при световой стимуляции [3]. Некоторые из белков, связанных с хлоропластами, кодируются ядерными генами и транспортируются из цитоплазмы в протопласты с помощью транспортных пептидов. Эти белки помогают улучшить структуру и функциональное развитие хлоропластов. Например, увеличение количества хлорофилла, образование тилакоидов и развитие некоторых комплексов цепи переноса электронов зависят от этих белков [3].Кроме того, деление клеток и деление хлоропластов поддерживается синхронно, что приводит к изменению метаболического состояния клетки во время развития хлоропласта [4].
Метаболомика относится к изучению метаболитов различных метаболических путей определенного организма. Качественная и количественная метаболомика может быть использована для выявления изменений метаболического состояния, выявления биомаркеров и выяснения связанных метаболических путей и механизмов реакции организма на раздражители окружающей среды [5–10].Метаболомика играет важную роль в системной биологии и способствует разработке лекарств [5], токсикологическим исследованиям [6] и диагностике заболеваний [7]. Наиболее распространенные методы, используемые в метаболомике, включают спектроскопию ядерного магнитного резонанса (ЯМР), газовую хроматографию-масс-спектрометрию (ГХ-МС), жидкостную хроматографию в сочетании с масс-спектрометрией (ЖХ-МС). Применение метаболомики в микроводорослях увеличивается с каждым годом. Например, изменение метаболома, вызванное стрессом, было исследовано у Ectocarpus siliculosu , Chlorella vulgaris и Pseudochoricystis ellipsoidea [11–13].В Euglena , хотя существует бесчисленное количество отчетов об исследовании развития хлоропластов на морфологическом уровне [14–16], метаболомических исследований почти не наблюдается [17]. ГХ-МС может идентифицировать сотни соединений одновременно и обладает такими преимуществами, как высокая чувствительность, высокое разрешение и поддержка базы данных. Мы использовали эту технологию разделения и идентификации для обнаружения изменений метаболитов водорослей при световой стимуляции [17, 18].
Чтобы раскрыть связанные механизмы развития хлоропластов при световой стимуляции у Euglena , мы применили световую стимуляцию к двум штаммам Euglena gracilis — дикого типа (WT) и обесцвеченному мутанту OflB2, полученному обработкой оксфлаксицином и проведенному методом ГХ-МС. для обнаружения метаболома.Это исследование выявляет физиологические изменения, связанные с развитием хлоропластов на метаболомном уровне, и обеспечивает теоретическую основу для дальнейших исследований биосинтеза хлоропластов и его ретроградной регуляции с ядром.
Материалы и методы
Выращивание водорослей и световая стимуляция
Широкий тип E . gracilis CCAP 1224 / 5Z был приобретен из Коллекции культур водорослей и простейших (CCAP) и содержался в нашей лаборатории.Обесцвеченный мутант OflB2 навсегда потерял функциональные хлоропласты и был получен обработкой WT E . gracilis CCAP 1224 / 5Z с офлоксацином [2]. WT E . gracilis и обесцвеченный мутант OflB2 культивировали в среде Hetero (pH 3) [19] при температуре 23 ± 1 ° C.
Спектр поглощения пигментов
10 6 клеток смешивали с 1 мл 95% этанола и инкубировали при 4 ° C в течение ночи. После центрифугирования при 8000 g в течение 5 мин спектр поглощения супернатанта регистрировали спектрометром.Длину волны детектирования устанавливали равной 300-700 нм, а скорость сканирования составляла 20 нм мин -1 .
Обнаружение метаболома с помощью ГХ-МС
Для исследования влияния световой стимуляции на состав метаболитов WT и OflB2, WT и OflB2 сначала культивировали в темноте. После 6 дней культивирования в темноте (образцы вводили в платформу) часть клеток собирали (использовали для образца 0 ч на свету), а оставшиеся клетки стимулировали светом при интенсивности света 65 ± 5 мкмоль м -2 с -1 .Образцы, обработанные светом, собирали через 4 часа, 12 часов, 24 часа, 48 часов и 72 часа. Каждый образец имел по три параллели. Метод извлечения метаболома описан в ранее опубликованной литературе [17, 18]. Метаболом исследовали с использованием системы газовой хроматографии-масс-спектрометрии GC-7890A-MS-5975C (Agilent Technologies, Inc.). Колонка для ГХ представляла собой капиллярную колонку HP-5MS (номер детали: 19091S-433), которая имела размер 30,0 м (длина) × 250 мкм (внутренний диаметр) × 0,25 мкм (толщина пленки). Температура на входе ГХ была установлена на 230 ° C.В качестве газа-носителя использовался гелий с чистотой более 99,999%. 2 мкл образца вводили в режиме без разделения. Температуру термостата колонок устанавливали следующим образом: 45 ° C инкубировали в течение 2 мин, повышали до 280 ° C со скоростью 5 ° C мин. -1 , 280 ° C инкубировали в течение 2 минут. Температура линии передачи, температура источника ионов и квадруполь МС были установлены на 290 ° C, 230 ° C и 150 ° C, соответственно. Метаболиты задерживаются в капиллярной колонке не менее 10 минут. Использовался режим полного сканирования, а диапазон определения отношения заряда к массе был установлен на 50–550.
Необработанные данные анализа ГХ-МС были проанализированы с использованием системы Agilent Automated Mass Spectrometry Deconvolution and Recognition System (AMDIS). Для качественного анализа метаболитов спектры масс-фрагментации были сопоставлены с базой данных Fiehn и базой данных Национального института стандартов и технологий (NIST). Относительное количество каждого метаболита — это отношение площади пика метаболита к площади пика внутреннего стандарта. Наконец, относительное количество метаболита было нормализовано по количеству клеток.
Анализ главных компонентов (PCA) был проведен, чтобы показать взаимосвязь между образцами. Чтобы выявить изменения в паттернах экспрессии метаболитов, был проведен кластерный анализ (CA) и составлена тепловая карта. На тепловой карте необработанные данные были преобразованы log 10 , чтобы лучше показать различия в паттернах экспрессии [20].
Результаты
Рост WT
E . gracilis и OflB2Ростки WT E . gracilis и OflB2 в темноте или на свету показаны на рис. 1. Независимо от света или темноты, рост WT E . gracilis всегда был лучше OflB2. Плотность клеток WT была выше, чем у OflB2, с 3 по 9 день. С 6 по 9 день влияние света на рост было более очевидным для WT E . gracilis , чем для OflB2. В темноте самая высокая плотность клеток WT была достигнута на 7-й день, а на свету — на 9-й день.Для OflB2 наблюдались небольшие различия в росте в темноте и на свету.
Состав пигментов в
E . gracilis и OflB2Для исследования различий в составе пигментов между WT E . gracilis и OflB2 регистрировали спектры поглощения пигментов (рис. 2). Пики поглощения были при 433 нм и 665 нм в WT E . gracilis , но такие пики поглощения не были обнаружены в OflB2, что указывает на то, что WT имеет пигменты, тогда как OflB2 не содержит пигментов.
Анализ ГХ-МС
Всего было собрано 36 образцов (2 штамма в 6 временных точках с 3 биологическими повторностями) для обнаружения метаболома. После фильтрации метаболитов с низкими показателями качества (ниже 70) в WT E было обнаружено 78 и 61 метаболит. gracilis и OflB2 соответственно (см. Таблицу S1).
Анализ главных компонентов (PCA)
PCA был проведен, чтобы увидеть, существуют ли значительные метаболомные различия между WT E . gracilis и OflB2 после световой стимуляции. Результаты показаны на рис. 3. Совокупный вклад PC1 и PC2 составил 76,1% для WT E . gracilis и 73,6% для OflB2, что указывает на то, что на эти первые два основных компонента приходится большая часть вариаций. Для WT E . gracilis , образцы с разной продолжительностью света были отделены друг от друга (рис. 3), что позволяет предположить, что метаболом WT E . gracilis меняется в зависимости от продолжительности свечения и WT E . gracilis клетки адаптируются к изменению световой стимуляции посредством необходимых физиологических и биохимических изменений. В OflB2 (рис. 3) можно найти три кластера (образцы с менее чем 24-часовой световой стимуляцией, образцы с 48-часовой световой стимуляцией и образцы с 72-часовой световой стимуляцией), что позволяет предположить, что небольшие изменения метаболического пути произошли в Первые 24 часа световой стимуляции и определенная продолжительность света более 24 часов могут вызвать изменение метаболома в обесцвеченных мутантных клетках OflB2.Также не исключено, что изменение компонентов метаболитов через 24 ч может быть вызвано другими факторами, например, старением клеток.
Кластерный анализ
Кластерный анализ проводили для выявления метаболических изменений после световой стимуляции у WT E . gracilis и OflB2. В WT E . gracilis , световая стимуляция приводит к активации некоторых метаболитов (рис. 4). Эти метаболиты включают аминокислоты и липидные метаболиты, такие как фосфонолипид (фосфорная кислота, бис (триметилсилил) монометиловый эфир), бензойный эфир (фталевая кислота, 6-этилокт-3-ил 2-этилгексиловый эфир) и сложный эфир глицина (глицин, N , N-бис (триметилсилил) -, триметилсилиловый эфир), а также энергетическое вещество, такое как сахарид (d-манноза).Световая стимуляция также изменила внутриклеточный метаболизм в OflB2 (рис. 4), а некоторые метаболиты стимуляторов снизились после световой стимуляции.
Обсуждение
Поскольку WT Euglena может расти до высокой плотности клеток как в светлых, так и в темных условиях, мы предположили, что полностью развитые хлоропласты не будут полезны, даже не обременены, для клеток, выращиваемых в темноте, где фотосинтетическая функция не требуется. В темноте WT Euglena не может фотосинтезировать, и хлоропласты внутри клеток могут быть бременем для клеток.Ожидалось, что без хлоропластов в темноте мутантные клетки будут расти лучше, чем WT, поскольку у них нет материалов и энергии для хлоропластов. Таким образом, обесцвеченные мутанты, растущие только гетеротрофно, могут демонстрировать преимущество для лучшего роста по сравнению с дикими животными при тех же условиях. Однако неожиданно рост мутанта OflB2 был намного медленнее, чем рост WT в темноте, вероятно, из-за того, что мутант OflB2 потерял хлоропластный и частичный пластидный геном, что может повлиять на рост и размножение мутанта OflB2 в темноте [2] .
Еще в 1970–80-х годах появились сообщения о фотоиндуцированном синтезе ферментов для фиксации углекислого газа на ранней стадии развития хлоропластов [21], демонстрирующих, что Rubisco увеличивал свою активность в течение 12 часов после предварительного освещения. стимуляция клеток Euglena [22, 23]. Также сообщалось, что под воздействием света было обнаружено снижение площади митохондриальной поверхности, митохондриальных липидов, цитохромов [24] и циклофоразы, такой как дельта-аминолевулиновая кислота (произносится) синтаза (АЛК-синтаза) [25, 26 ] и митохондриальный фактор элонгации G также подавлялся [27], тогда как фосфоенол-пируваткарбоксилаза слегка повышалась [28, 29].Было обнаружено, что под воздействием света 44 митохондриальных белка на цельноклеточном 2-D геле уменьшились на 31 в относительном количестве, примерно на 70% в WT Euglena [30, 31]. Селективность, индуцированная видимым светом, изменяет скорость синтеза специфического митохондриального белка. Кроме того, после воздействия света была обнаружена несколько более низкая активность цитозольной альдолазы [32], аналогичная подавляемая активность наблюдалась также у фосфофруктокиназы [32], фосфоенолпируваткарбоксикиназы [33], НАД-глицеральдегид-3-фосфатдегидрогеназы [21]. ] и яблочный фермент [34].Был сделан вывод, что по сравнению с OflB2, WT Euglena будет испытывать изменение режима питания после световой стимуляции, постепенно переходя из гетеротрофного в фотоавтотрофное состояние. Этот процесс в основном включает синтез хлорофилла, сборку хлоропластов и изменение энергоснабжения митохондрий. Изменения уровней ферментов, вызванные различными физиологическими и биохимическими реакциями в цитоплазме, в конечном итоге приведут к изменениям некоторых основных компонентов метаболитов.
В этом исследовании мы сообщили об относительно значительных различиях либо в паттернах ответа, либо в компонентах метаболитов между WT и OflB2 при световой стимуляции. Отдельные существенно измененные компоненты так или иначе участвуют в накоплении хлорофилла, формировании тилакоидных структур [35] и синтезе белков, связанных с фотосинтезом, и других в процессе развития хлоропластов. Когда-то сообщалось, что биосинтез фосфатидилглицерина (PG) является основой эмбрионального развития, а также нормальной мембранной структуры хлоропластов и митохондрий [36].Было заявлено, что галактолипиды, моногалактозил-диацилглицерин (MGDG) и дигалактозил-диацилглицерин (DGDG), основные липиды тилакоидной мембраны, необходимые для ее развития, могут быть важны для поддержания оптимальной эффективности фотосинтеза [37, 38]. Рентгеноструктурные исследования фотосистемы I (ФС I) и фотосистемы II (ФС II) также показали, что тилакоидные липиды содержались в кристаллических структурах обоих соединений, и что PG и MGDG были обнаружены вблизи реакционного центра PS I и ПС II [39, 40].Кроме того, мы обнаружили, что по сравнению с контрольной группой WT-0h, WT-4h имел другой состав метаболитов, что дополнительно указывает на клеточный метаболизм WT E . gracilis изменяется очень быстро, через 4 часа после световой стимуляции. Это изменение в значительной степени представлено увеличением некоторых важных метаболитов. Например, увеличение содержания фосфонолипидов может быть связано с увеличением компонентов мембраны; образование тилакоидов в хлоропластах будет ускорено после световой стимуляции; а увеличение количества других аминокислот и амидов связано с синтезом некоторых фотосинтетических белков.Таким образом, можно с уверенностью заключить, что изменения компонентов метаболитов и содержания WT Euglena после световой обработки в основном связаны с накоплением веществ и энергии для фотосинтеза.
Начиная с WT E . gracilis выполняет фотосинтез, можно понять, что усиление метаболической активности заключается в подготовке некоторых веществ для фотосинтеза. Однако обесцвеченный мутант OflB2 не содержал функциональных хлоропластов и, следовательно, не осуществлял фотосинтез, и мы пришли к выводу, что световая стимуляция может снизить транскрипцию определенных генов и привести к снижению уровней основных метаболитов в клетках.
В сочетании с другими анализами данных Omic, такими как геномные, транскриптомные и протеомные данные (неопубликованные), проведенные в WT E . gracilis и обесцвеченных мутантов, мы предполагаем, что регуляция индуцированной светом фотореактивности в Euglena с большей вероятностью происходит на посттранскрипционном уровне. Метаболомический анализ показал, что метаболом WT E . gracilis при световой стимуляции в основном представлен его связью с увеличением компонентов мембраны.Например, свет способствует образованию тилакоидов в хлоропластах; увеличение других аминокислот и амидов связано с синтезом некоторых фотосинтетических белков. Однако при световой стимуляции метаболом обесцвеченного OflB2 характеризуется подавлением некоторых компонентов метаболита. Предполагается, что световая стимуляция замедляет метаболизм обесцвеченных клеток Euglena до определенной степени, делая его похожим на полудремящее состояние за короткий период времени, тем самым уменьшая повреждение световым стрессом клеток без каких-либо функциональных хлоропластов .Таким образом, метаболомный анализ WT E . gracilis и обесцвеченный мутант OflB2 показали, что изменения компонентов метаболита происходят в обоих штаммах после световой стимуляции. В WT E . gracilis , он в основном представлен увеличением некоторых метаболитов, таких как сложный эфир фосфорной кислоты, участвующий в синтезе мембран, и различные аминокислоты в синтезе белков для фотосинтеза. Напротив, в обесцвеченном OflB2 метаболомы в основном характеризовались снижением количества некоторых вторичных метаболитов.Кроме того, клетки двух штаммов показали разные образцы ответа на световую стимуляцию: WT E . gracilis изменялся быстрее, чем обесцвеченные клетки. Следовательно, существует значительная разница в механизме ответа между двумя штаммами на световую стимуляцию. Мы предлагаем основную причину в WT E . gracilis предназначен для перехода от гетеротрофии к аутотрофии, чтобы подготовиться к развитию хлоропластов и фотосинтезу. Однако обесцвеченные мутантные клетки OflB2 находятся в гетеротрофном состоянии, и световая стимуляция может работать как стресс вместо развития хлоропластов.В результате его клетки адаптируются к новой среде, изменяя метаболомный статус.
Список литературы
- 1. Шварцбах SD. Крупномасштабное выращивание Euglena . В кн .: Биохимия, клеточная и молекулярная биология. Springer International Publishing AG; 2017. С. 289–290.
- 2. Ван JX, Ши ZX, Сюй XD. Остаточные пластиды обесцвеченных мутантов Euglena gracilis и их влияние на экспрессию генов, кодируемых ядром.Prog Nat Sci. 2004; 3: 21–25.
- 3. Раст А., Хайнц С., Никельсен Дж. Биогенез тилакоидных мембран. Biochim Biophys Acta. 2015; 1847 (9): 821–830. pmid: 25615584.
- 4. Waters MT, Langdale JA. Изготовление хлоропласта. EMBO J. 2009; 28 (19): 2861–2873. pmid: 19745808.
- 5. Son J, Lyssiotis CA, Ying H, Wang X, Hua S, Ligorio M и др. Глютамин поддерживает рост рака поджелудочной железы через метаболический путь, регулируемый KRAS. Природа.2013; 496 (7443): 101–105. pmid: 23535601.
- 6. Zhang ZH, Zhao YY, Cheng XL, Dai Z, Zhou C, Bai X и др. Общая токсичность Pinellia ternata (Thunb.) Berit. у крыс: метабономический метод определения профиля метаболических изменений в сыворотке крови. J Ethnopharmacol. 2013; 149 (1): 303–310. pmid: 23831079.
- 7. Sreekumar A, Poisson LM, Rajendiran TM, Khan AP, Cao Q, Yu JD, et al. Метаболомные профили определяют потенциальную роль саркозина в прогрессировании рака простаты.Природа. 2009; 457 (7231): 910–914. pmid: 19212411.
- 8. Файн О., Копка Дж., Дорманн П., Альтманн Т., Третуэй Р. Н., Уиллмитцер Л. Профилирование метаболитов для функциональной геномики растений. Nat Biotechnol. 2000; 18 (11): 1157–1161. pmid: 11062433.
- 9. Файн О. Объединение геномики, анализа метаболома и биохимического моделирования для понимания метаболических сетей. Comp Funct Genomics. 2001; 2 (3): 155–168. pmid: 18628911.
- 10. Машего MR, Rumbold K, Heijnen JJ, Vand amme E, Soetaert W, Heijnen JJ.Микробная метаболомика: прошлые, настоящие и будущие методологии. Biotechnol Lett. 2007; 29 (1): 1–16. pmid: 170.
- 11. Риттер А., Диттами С.М., Гулиткер С., Корреа Дж. А., Бойен С., Потин П. и др. Транскриптомный и метаболомный анализ адаптации меди к стрессу у Ectocarpus siliculosus подчеркивает механизмы передачи сигналов и толерантности у бурых водорослей. BMC Plant Biol. 2014; 14: 116. pmid: 24885189.
- 12. Чжан В., Тан Н.Г., Ли С.Ф. Метаболомика на основе ЯМР и количественная оценка ЖХ-МС / МС выявляют металло-специфическую толерантность и окислительно-восстановительный гомеостаз у Chlorella vulgaris .Mol BioSyst. 2014; 10 (1): 149–160. pmid: 24226509.
- 13. Ито Т., Сугимото М., Тоя Ю., Ано Ю., Курано Н., Сога Т. и др. Метаболомика с временным разрешением новой водоросли trebouxiophycean с использованием кормления 13 CO 2 . J Biosci Bioeng. 2013; 116 (3): 408–415. pmid: 23706992.
- 14. Buetow DE. Молекулярная структура хлоропластов с особым упором на тилакоиды и оболочки. В: Биология Euglena . Academic Press: Нью-Йорк; 1982 г.Vol. III, стр. 254–255.
- 15. Ван JX, Ши ZX, Сюй XD. 2002. Бесхлоропластные мутанты двух видов Euglena . Acta Hydrobiologica Sinica, 26 (2): 175–179.
- 16. Heizmann P, Doly J, Hussein Y, Nicolas P, Nigon V, Bernardi G. Геном хлоропласта обесцвеченного мутанта Euglena gracilis . Biochim Biophys Acta. 1981; 653 (3): 412–415. pmid: 6788086.
- 17. Цзэн М., Хао В.Л., Цзоу Ю.Д., Ши М.Л., Цзян Ю.Г., Сяо П. и др.Подходы с использованием жирных кислот и метаболомного профилирования позволяют дифференцировать гетеротрофные и миксотрофные условия культивирования в пищевой добавке для микроводорослей « Euglena ». BMC Biotechnol. 2016; 16 (1): 49. pmid: 27255274.
- 18. Ван И, Ши М., Ню Х, Чжан Х, Гао Л., Чен Л. и др. Метаболомические основы лабораторной эволюции толерантности к бутанолу у фотосинтезирующих Synechocystis sp. PCC 6803. Факт о микробных клетках. 2014; 13, 151. pmid: 25366096.
- 19. Огбонна Дж. К., Томияма С., Танака Х.Гетеротрофное культивирование Euglena gracilis Z для эффективного производства α-токоферола. J Appl Phycol. 1998; 10 (1): 67–74.
- 20. Гудакр Р., Бродхерст Д., Смилд А. К., Кристал Б. С., Бейкер Д. Д., Бегер Р. и др. Предлагаемые минимальные стандарты отчетности для анализа данных в метаболомике. Метаболомика. 2007; 3: 231–241.
- 21. Боварник Дж. Г., Чанг С. В., Шифф Дж. А., Шварцбах С. Д.. События, связанные с ранним развитием хлоропластов Euglena : клеточное происхождение ферментов хлоропластов в Euglena .J Gen Microbiol. 1974; 83: 63–71. pmid: 4213097.
- 22. Freyssinet G, Eichholz RL, Buetow DE. Кинетика накопления рибулозо-1,5-бисфосфаткарбоксилазы при созревании у Euglena gracilis . Plant Physiol. 1984; 75 (3): 850–857. pmid: 16663716.
- 23. Пино Б. Биосинтез рибулозо-1,5-бисфосфаткарбоксилазы в зеленеющих клетках Euglena gracilis : накопление рибулозо-1,5-бисфосфаткарбоксилазы и ее субъединиц.Planta. 1982; 156 (2): 117–128. pmid: 24272307.
- 24. Шанц Р., Шанц М.-Л., Дюрантон Х. Изменения аминокислотного и пептидного состава клеток Euglena gracilis во время развития хлоропластов. Plant Sci Lett. 1975; 5: 313–324.
- 25. Бил С.И., Фоли Т., Дзельзкалнс В. Синтаза δ-аминолевулиновой кислоты из Euglena gracilis . Proc Natl Acad Sci USA. 1981; 78 (3): 1666–1669. pmid: 6940180.
- 26. Фоли Т., Дзельзкалнс В., Бил С.И.Синтаза δ-аминолевулиновой кислоты Euglena gracilis : регуляция активности. Plant Physiol. 1982; 70 (1): 219–226. pmid: 16662450.
- 27. Эберли С.Л., Спремулли Г.Х., Спремулли Л.Л. Световая индукция факторов удлинения синтеза белка хлоропластов Euglena : относительная эффективность различных диапазонов длин волн. Arch Biochem Biophys. 1986; 245 (2): 338–347. pmid: 3082283.
- 28. Лаваль-Мартин Д., Фарино Дж., Пино Б., Кальвайрак Р.Эволюция ферментов, участвующих в углеродном обмене (фосфоенолпируват и рибулозо-бисфосфаткарбоксилазы, фосфоенолпируваткарбоксикиназа) во время светоиндуцированного позеленения Euglena gracilis штаммов Z и ZR. Planta. 1981; 151 (2): 157–167. pmid: 24301724.
- 29. Пёнсген-Шмидт Э., Шнайдер Т., Хаммер У., Бец А. Сравнение фосфоенолпируват-карбоксикиназы из автотрофно и гетеротрофно выращенной Euglena и ее роль во время темного анаэробиоза.Растительный физиол. 1988; 86 (2): 457–462. pmid: 16665930.
- 30. Монрой А.Ф., Маккарти С.А., Шварцбах С.Д. Доказательства трансляционной регуляции биогенеза хлоропластов и митохондрий в Euglena . Plant Sci. 1987; 51: 61–76.
- 31. Монрой А.Ф., Гомес-Сильва Б., Шварцбах С.Д., Шифф Дж. Фотоконтроль уровня хлоропластов и митохондриальных полипептидов в Euglena . Plant Physiol. 1986; 80 (3): 618–622. pmid: 16664673.
- 32.Докерти А, Мерретт MJ. Выделение и ферментативная характеристика пропластидов Euglena . Plant Physiol. 1979; 63 (3): 468–473. pmid: 16660749.
- 33. Миятаке К., Ито Т., Китаока С. Субклеточное расположение и некоторые свойства фосфоенолпируваткарбоксикиназы (PEPCK) в Euglena gracilis . Agri Biol Chem. 1984; 48: 2139–2141.
- 34. Карн Р.С., Худок Г.А. Фоторепрессируемый изофермент яблочного фермента в штамме Euglena gracilis Z.J Protozool. 1973; 20 (2): 316–320. pmid: 4145408.
- 35. Прибыл М., Лабс М., Лейстер Д. Структура и динамика тилакоидов наземных растений. J Exp Bot. 2014; 65 (8): 1955–1972. pmid: 24622954.
- 36. Тануэ Р., Кобаяши М., Катаяма К., Нагата Н., Вада Х. Биосинтез фосфатидилглицерина необходим для развития эмбрионов и нормальных мембранных структур хлоропластов и митохондрий арабидопсиса . FEBS Lett. 2014; 588 (9): 1680–1685.pmid: 24632290.
- 37. Кобаяси К., Наризе Т., Сонойке К., Хашимото Х., Сато Н., Кондо М. и др. Роль биосинтеза галактолипидов в координированном развитии фотосинтетических комплексов и тилакоидных мембран в биогенезе хлоропластов у арабидопсиса . Plant J. 2013; 73 (2): 250–261. pmid: 22978702.
- 38. Кобаяши К., Вада Х. Роль липидов в биогенезе хлоропластов. Subcell Biochem. 2016; 86: 103–125. pmid: 27023233.
- 39. Джордан П., Фромм П., Витт Х.Т., Клукас О., Сенгер В., Краусс Н.Трехмерная структура фотосистемы I цианобактерий при разрешении 2,5 А. Природа. 2001; 411 (6840): 909–917. pmid: 11418848.
- 40. Гуськов А., Керн Дж., Габдулхаков А., Брозер М., Зуни А., Сэнгер В. Фотосистема II цианобактерий с разрешением 2,9 Å и роль хинонов, липидов, каналов и хлорида. Nat Struct Mol Biol. 2009; 16 (3): 334–342. pmid: 19219048.
Исследование моторики плавания Euglena
Предоставлено: Нозелли и др.Некоторые виды эвгленид, разнообразного семейства водных одноклеточных организмов, могут совершать элегантно скоординированные деформации тела большой амплитуды. Хотя такое поведение известно веками, его функция до сих пор широко обсуждается.
Исследователи из SISSA, Национального института океанографии и прикладной геофизики (OGS), Scuola Superiore Sant’Anna и Universitat Politècnica de Catalunya недавно провели исследование подвижности Euglena Gracilis, эвгленида, особенно в его реакции на заключение.В своем исследовании, опубликованном в журнале « Nature Physics », они изучили реакцию плавающих Euglena gracilis в условиях контролируемой скученности и геометрии.
«Скоординированные движения клеток эвглены с большой амплитудой, называемые метаболизмом, описывались веками и до сих пор восхищают микробиологов, биофизиков и микроскопистов-любителей», — сказал Phys.org Марино Арройо, один из исследователей, проводивших исследование. . «Насколько нам известно, ни один другой одноклеточный организм не может двигаться с такой элегантностью и координацией.Но как и зачем они это делают — загадка. Любопытство побудило нас изучить подвижность эвглены ».
Скоординированные деформации тела большой амплитуды, наблюдаемые у эвглены, обычно называют «эвгленоидным движением» или «метаболизмом». Метаболизм сильно различается между видами, а иногда и внутри вида, начиная от округления и плавного изгиба или поворота до периодических и сильно согласованных перистальтических волн, которые проходят по телу клетки.
«Среди биофизиков метаболизм считался способом плавать в жидкости, где живут эти клетки», — сказал Арройо.«Однако протистологов не убеждает эта функция метаболизма, поскольку эвглена может плавать очень быстро, обгоняя свой жгутик, как и многие другие типы клеток. деформации тела, чтобы поглотить крупную добычу. Наблюдая за тем, как клетки исполняют такой красивый и скоординированный танец, мы не верили, что это бесполезно.«
Разбавленные культуры клеток эвглены обычно плавают, используя свой жгутик, не меняя формы тела. Однако Арройо и его коллеги заметили, что с течением времени жидкость под микроскопом испарялась, их культура становилась более тесной, и в клетках начинался метаболизм.
«Вдохновленные этими наблюдениями и любительскими видео на YouTube, мы выдвинули гипотезу, что деформации клеток могут быть вызваны контактом с другими клетками или границами в многолюдной среде, и что в этих условиях метаболизм может быть полезен для ползания, а не плавания», Антонио Де Симоне, другой исследователь, участвовавший в исследовании, сказал Phys.орг. «Подтвердить эту гипотезу было на удивление легко. Как только мы слегка зажали клетки между двумя стеклянными поверхностями или загнали их в тонкие капилляры, они начали систематически выполнять метаболизм, что привело к самому быстрому ползанию среди всех типов клеток, насколько нам известно. «, — добавил Джованни Нозелли, первый автор исследования.
После того, как они закончили проверку этой гипотезы, исследователи начали сравнивать поведение ползания, которое они наблюдали в Эвглене, с поведением животных клеток, для которого в настоящее время доступно большее количество исследований.Предыдущие исследования показали, что клетки животных, ползающие по тонкой трубке, имеют тенденцию давить на ее стенки, чтобы двигаться вперед и преодолевать сопротивление жидкости в трубке.
«Мы обнаружили, что благодаря перистальтическим деформациям эвглена может толкаться либо на стенки, либо на жидкость, чтобы двигаться вперед, что делает метаболизм удивительно надежным способом ограниченного передвижения», — сказал Де Симон. «Они могут фактически перемещаться, вытесняя очень небольшое количество жидкости в« скрытом »режиме движения, и их нельзя остановить, даже если гидравлическое сопротивление в капилляре существенно увеличится.«
В своих экспериментах Арройо, Де Симоне, Нозелли и их коллега Альфред Беран заметили, что клетки эвглены были способны адаптировать свою походку к разным степеням ограничения. Для выполнения этого поведения клетки могут использовать сенсорную систему для обнаружения окружающей среды и некоторую форму внутренней обработки информации, чтобы адаптировать свою активность в соответствии со степенью ограничения.
Исследователи нашли это объяснение озадачивающим, особенно учитывая, что эвглена — это отдельные клетки без нервной системы.Чтобы лучше понять, как отдельная клетка эвглены может контролировать такой адаптируемый и надежный режим передвижения, Арройо и его коллеги с помощью компьютерных расчетов смоделировали подвижный аппарат клеток эвглены, который по сути представляет собой полосатую клеточную оболочку.
«Мы задавались вопросом, будет ли их активная оболочка, называемая пленкой, отвечающая за деформации клеток, механически самоадаптироваться к меняющимся механическим условиям», — сказал Арройо. «Чтобы проверить это, мы разработали вычислительную модель, показывающую, что соответствие материалов и молекулярных двигателей, составляющих активную оболочку Эвглены, может объяснить эту адаптивность, которая в робототехнике называется механическим или воплощенным интеллектом.«
Арройо и его коллеги собрали интересные наблюдения о деформациях тела некоторых эвгленид, предполагая, что это поведение в некоторых случаях могло быть вызвано заключением. В дополнение к демонстрации одной функции метаболизма, их исследование установило новую категорию клеточных краулеров, которые являются особенно быстрыми, надежными и адаптируемыми.
«Если ползание посредством метаболизма настолько выгодно, можно задаться вопросом, почему оно не сохраняется среди других видов», — сказал Арройо.»Ответ заключается в том, что для этого требуется сложный механизм, пленка, которая представляет собой полосатую оболочку, сделанную из эластичных полос, соединенных молекулярными двигателями. Эта избирательно деформируемая поверхность находится где-то между жесткой стенкой растительных клеток и жидкой оболочкой клеток животных. Помимо биологии, мы думаем, что лежащие в основе физические / геометрические принципы, которые позволяют изменять форму этой оболочки, могут быть применены к искусственно созданным системам, например, в мягкой робототехнике ».
Вычислительная модель, разработанная Арройо и его коллегами, могла, наконец, пролить свет на функцию широко задокументированных эвгленоидных движений.Их находки предполагают, что приспособляемость этих организмов к походке не требует специфической механочувствительной обратной связи, а скорее может быть объяснена механической саморегуляцией эластичной и расширенной двигательной системы.
В своем недавнем исследовании исследователи успешно определили одну функцию и принципы действия, лежащие в основе адаптируемой деформации тела клеток эвглены. В настоящее время они планируют дальнейшее исследование клеточных механизмов, с помощью которых запускается метаболизм и посредством которых распространяются клеточные деформации.
«Мы планируем изучить метаболизм у разных видов эвглены», — сказал Дезимоун. «Предварительные наблюдения показывают различные вкусы метаболизма. Мы также работаем над созданием искусственных материалов и устройств, вдохновленных активной и деформируемой оболочкой клеток эвглены».
Жители пруда под названием эвглена плавают полигонами, чтобы избежать света
Дополнительная информация: Джованни Нозелли и др.Плавательная эвглена реагирует на заключение изменением поведения, позволяющим эффективно ползать, Nature Physics (2019). DOI: 10.1038 / s41567-019-0425-8 www.nature.com/articles/s41567-019-0425-8
© 2019 Сеть Science X
Ссылка : Исследование моторики плавательной эвглены (2019, 8 марта) получено 23 апреля 2021 г. с https: // физ.org / news / 2019-03-motility-euglena.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Транскриптом, протеом и проект генома Euglena gracilis | BMC Biology
Добелл К. Энтони ван Левенгук и его «Маленькие животные». 1932 г. doi: https: //doi.org/10.1038/130679a0.
Ким Дж. Т., Бу С. М., Закрысь Б. Флористические и таксономические описания рода Euglena (Euglenophyceae) из пресных вод Кореи. Водоросли. 1998. 13: 173–97.
Google Scholar
Gojdics M. Род Euglena . Американская ассоциация развития науки; 1953. doi: https: // doi.org / 10.1126 / science.120.3124.799-а.
Zakryś B, Walne PL. Флористические, таксономические и фитогеографические исследования зеленых Euglenophyta из юго-востока США с упором на новые и редкие виды. Algol Stud für Hydrobiol Suppl Vol. 1994. 72: 71–114.
Zakryś B. Уровень ядерной ДНК как потенциальный таксономический признак в Euglena Ehr. (Euglenophyceae). Algol Stud für Hydrobiol Suppl Vol. 1988;: 483–504.
Buetow DE. Биология Euglena : Academic Press; 1968; 49.
McFadden GI. Первичный и вторичный эндосимбиоз и происхождение пластид. J Phycol. 2001; 37: 951–9. https://doi.org/10.1046/j.1529-8817.2001.01126.x.
Артикул Google Scholar
Драгош Н., Петерфи Л., Попеску К. Сравнительная тонкая структура пелликулярного цитоскелета у Euglena Ehrenberg. Arch Protistenkd.1997. 148: 277–85. https://doi.org/10.1016/S0003-9365(97)80008-5.
Артикул Google Scholar
Daiker V, Lebert M, Richter P, Häder D-P. Молекулярная характеристика кальмодулина, участвующего в цепи передачи сигнала гравитаксиса в Euglena gracilis . Planta. 2010; 231: 1229–36. https://doi.org/10.1007/s00425-010-1126-9.
CAS Статья PubMed Google Scholar
van der Horst MA, Hellingwerf KJ. Фоторецепторные белки, «звездные актеры современности»: обзор функциональной динамики в структуре репрезентативных членов шести различных семейств фоторецепторов. Acc Chem Res. 2004; 37: 13–20. https://doi.org/10.1021/ar020219d.
CAS Статья PubMed Google Scholar
Хейде М., Ульм Р. Передача сигналов, опосредованная фоторецепторами УФ-В, у растений. Trends Plant Sci. 2012; 17: 230–7.https://doi.org/10.1016/j.tplants.2012.01.007.
CAS Статья PubMed Google Scholar
Исэки М., Мацунага С., Мураками А., Оно К., Шига К., Йошида К. и др. Аденилатциклаза, активируемая синим светом, опосредует фотоизбежание у Euglena gracilis . Природа. 2002; 415: 1047–51. https://doi.org/10.1038/4151047a.
CAS Статья PubMed Google Scholar
Масуда С. Детектирование света и преобразование сигнала в фоторецепторах BLUF. Physiol растительной клетки. 2013; 54: 171–9. https://doi.org/10.1093/pcp/pcs173.
CAS Статья PubMed Google Scholar
Richter PR, Schuster M, Lebert M, Streb C, Häder D-P. Гравитаксис Euglena gracilis лишь частично зависит от пассивной плавучести. Adv Sp Res. 2007; 39: 1218–24. https://doi.org/10.1016/J.ASR.2006.11.024.
Артикул Google Scholar
Adl SM, Simpson AGB, Lane CE, Lukeš J, Bass D, Bowser SS и др. Пересмотренная классификация эукариот. J Eukaryot Microbiol. 2012; 59: 429–93. https://doi.org/10.1111/j.1550-7408.2012.00644.x.
Артикул PubMed PubMed Central Google Scholar
Флегонтова О., Флегонтов П., Мальвия С., Аудик С., Винкер П., де Варгас С. и др.Чрезвычайное разнообразие эукариот диплонемид в океане. Curr Biol. 2016; 26: 3060–5.
CAS Статья Google Scholar
О’Нил Е.К., Трик М., Хилл Л., Рейзек М., Дуси Р.Г., Гамильтон С.Дж. и др. Транскриптом Euglena gracilis обнаруживает неожиданные метаболические возможности для биохимии углеводов и природных продуктов. Mol BioSyst. 2015; 11: 2808–20. https://doi.org/10.1039/C5MB00319A.
CAS Статья PubMed Google Scholar
O’Neill EC, Trick M, Henrissat B, Field RA. Euglena во времени: эволюция, контроль центральных метаболических процессов и многодоменных белков в биохимии углеводов и природных продуктов. Perspect Sci. 2015; 6: 84–93. https://doi.org/10.1016/J.PISC.2015.07.002.
Артикул Google Scholar
Йошида Ю., Томияма Т., Марута Т., Томита М., Исикава Т., Аракава К. Сборка de novo и сравнительный анализ транскриптома Euglena gracilis в ответ на анаэробные условия.BMC Genomics. 2016; 17: 182. https://doi.org/10.1186/s12864-016-2540-6.
CAS Статья PubMed PubMed Central Google Scholar
Мур А.Н., Макваттерс, округ Колумбия, Хадсон А.Дж., Рассел АГ. RNA-Seq с использованием новой стратегии истощения рРНК обнаруживает богатый репертуар snoRNAs в Euglena gracilis , включая box C / D и Ψ-направляющие РНК, нацеленные на модификацию конечностей рРНК. RNA Biol. 2018; 15: 1309–18. https: // doi.org / 10.1080 / 15476286.2018.1526561.
Артикул PubMed Google Scholar
Лукеш Я., Скалицкий Т., Тыч Я., Вотипка Я., Юрченко В. Эволюция паразитизма у кинетопластидных жгутиконосцев. Мол Биохим Паразитол. 2014; 195: 115–22. https://doi.org/10.1016/j.molbiopara.2014.05.007.
CAS Статья PubMed Google Scholar
Flegontov P, Votýpka J, Skalický T, Logacheva MDD, Penin AAA, Tanifuji G, et al.Паратрипаносома — это новая трипаносоматида с ранним ветвлением. Curr Biol. 2013; 23: 1787–93.
CAS Статья Google Scholar
Джексон А.П., Отто Т.Д., Аслетт М., Армстронг С.Д., Бринго Ф., Шлахт А. и др. Филогеномика кинетопластид выявляет эволюционные инновации, связанные с истоками паразитизма. Curr Biol. 2016; 26: 161–72. https://doi.org/10.1016/j.cub.2015.11.055.
CAS Статья PubMed PubMed Central Google Scholar
Джексон А.П. Филогения семейства генов и эволюция поверхности клеток паразита. Мол Биохим Паразитол. 2016; 209: 64–75. https://doi.org/10.1016/j.molbiopara.2016.03.007.
CAS Статья PubMed Google Scholar
Langousis G, Hill KL. Подвижность и другое: жгутик Trypanosoma brucei. Nat Rev Microbiol. 2014; 12: 505–18.
CAS Статья Google Scholar
Perdomo D, Bonhivers M, Robinson D. Трипаносомный воротник кармана жгутика и его кольцевой белок — TbBILBO1. Клетка. 2016; 5: 9. https://doi.org/10.3390/cells5010009.
CAS Статья Google Scholar
Kalb LC, Frederico YCA, Boehm C, Moreira CM do N, Soares MJ, Field MC. Сохранение и дивергенция внутри клатринового интерактома Trypanosoma cruzi. Научный отчет 2016; 6: 31212. https://doi.org/10.1038/srep31212.
CAS Статья PubMed PubMed Central Google Scholar
Zoltner M, Horn D, de Koning HP, Field MC. Использование ахиллесовой пяты мембранной торговли трипаносомами. Curr Opin Microbiol. 2016; 34: 97–103. https://doi.org/10.1016/j.mib.2016.08.005.
CAS Статья PubMed PubMed Central Google Scholar
Hovel-Miner G, Mugnier MR, Goldwater B, Cross GAM, Papavasiliou FN.Консервативный повтор ДНК способствует отбору разнообразного репертуара поверхностных антигенов Trypanosoma brucei из геномного архива. PLoS Genet. 2016; 12: e1005994. https://doi.org/10.1371/journal.pgen.1005994.
CAS Статья PubMed PubMed Central Google Scholar
Devault A, Bañuls A-L. Семейство генов поверхностных антигенов промастигот паразита Leishmania: дифференциальная эволюция путем положительного отбора и рекомбинации.BMC Evol Biol. 2008; 8: 292. https://doi.org/10.1186/1471-2148-8-292.
CAS Статья PubMed PubMed Central Google Scholar
Chamakh-Ayari R, Bras-Gonçalves R, Bahi-Jaber N, Petitdidier E, Markikou-Ouni W., Aoun K, et al. Оценка in vitro растворимого поверхностного антигена Leishmania promastigote в качестве потенциальной вакцины-кандидата против лейшманиоза человека. PLoS One. 2014; 9: e92708. https://doi.org/10.1371/journal.pone.0092708.
CAS Статья PubMed PubMed Central Google Scholar
Mahapatra DM, Chanakya HN, Ramachandra TV. Euglena sp. в качестве подходящего источника липидов для потенциального использования в качестве биотоплива и устойчивой очистки сточных вод. J Appl Phycol. 2013; 25: 855–65. https://doi.org/10.1007/s10811-013-9979-5.
CAS Статья Google Scholar
Фурухаси Т., Огава Т., Накай Р., Накадзава М., Окадзава А., Падермшоке А. и др. Профилирование воскового эфира и липофильных соединений Euglena gracilis с помощью газовой хроматографии-масс-спектрометрии: к пониманию ферментации воскового эфира в условиях гипоксии. Метаболомика. 2015; 11: 175–83. https://doi.org/10.1007/s11306-014-0687-1.
CAS Статья Google Scholar
Ямада К., Сузуки Х., Такеучи Т., Казама Ю., Митра С., Абэ Т. и др.Эффективное селективное разведение живых масличных растений Euglena gracilis с сортировкой клеток с активацией флуоресценции. Научный доклад 2016; 6: 26327. https://doi.org/10.1038/srep26327.
CAS Статья PubMed PubMed Central Google Scholar
Миазек К., Иванек В., Ремакл С., Ришель А., Гоффин Д. Влияние металлов, металлоидов и металлических наночастиц на рост микроводорослей и биосинтез промышленных продуктов: обзор.Int J Mol Sci. 2015; 16: 23929–69. https://doi.org/10.3390/ijms161023929.
CAS Статья PubMed PubMed Central Google Scholar
Rodrzguez-Zavala JS, GarcÍa-Garca JD, Ortiz-Cruz MA, Moreno-Sánchez R. Молекулярные механизмы устойчивости к тяжелым металлам у протистов Euglena gracilis . J Environ Sci Heal Part A. 2007; 42: 1365–78. https://doi.org/10.1080/10934520701480326.
CAS Статья Google Scholar
душ Сантуш Феррейра V, Роккетта I, Конфорти V, Бенч С, Фельдман Р., Левин М.Дж. и др. Паттерны экспрессии генов в Euglena gracilis : понимание клеточного ответа на стресс окружающей среды. Ген. 2007; 389: 136–45.
Артикул Google Scholar
Zeng M, Hao W., Zou Y, Shi M, Jiang Y, Xiao P, et al. Подходы жирных кислот и метаболомного профилирования позволяют дифференцировать гетеротрофные и миксотрофные условия культивирования в пищевой добавке для микроводорослей « Euglena ».BMC Biotechnol. 2016; 16:49. https://doi.org/10.1186/s12896-016-0279-4.
CAS Статья PubMed PubMed Central Google Scholar
Добакова Э., Флегонтов П., Скалицкий Т., Лукеш Дж. Неожиданно упорядоченный митохондриальный геном эвгленозойского животного Euglena gracilis . Genome Biol Evol. 2015; 7: 3358–67. https://doi.org/10.1093/gbe/evv229.
Faktorová D, Dobáková E, Peña-Diaz P, Lukeš J.От простого к суперкомплексу: митохондриальные геномы простейших эвгленозойных. F1000 Исследования. 2016; 5: 392. DOI: https: //doi.org/10.12688/f1000research.8040.1.
Hallick RB, Hong L, Drager RG, Favreau MR, Monfort A, Orsat B, et al. Полная последовательность ДНК хлоропласта Euglena gracilis . Nucleic Acids Res. 1993; 21: 3537–44.
CAS Статья Google Scholar
Роджерс М.Б., Гилсон П.Р., Су В., Макфадден Г.И., Килинг П.Дж.Полный геном хлоропластов хлорарахниофита Bigelowiella natans: доказательства независимого происхождения хлорарахниофитов и вторичных эндосимбионтов эвгленид. Mol Biol Evol. 2007; 24: 54–62. https://doi.org/10.1093/molbev/msl129.
CAS Статья PubMed Google Scholar
Маруяма С., Сузаки Т., Вебер А.П., Арчибальд Дж. М., Нозаки Х. Перенос гена от эукариот к эукариотам приводит к мозаицизму генома у эвгленид.BMC Evol Biol. 2011; 11: 105. https://doi.org/10.1186/1471-2148-11-105.
Артикул PubMed PubMed Central Google Scholar
Хоу СиДжей, Барбрук А.С., Нисбет РЭР, Локхарт П.Дж., Ларкум AWD. Происхождение пластид. Philos Trans R Soc Lond Ser B Biol Sci. 2008; 363: 2675–85. https://doi.org/10.1098/rstb.2008.0050.
CAS Статья Google Scholar
Dooijes D, Chaves I, Kieft R, Dirks-Mulder A, Martin W, Borst P. Основание J, первоначально обнаруженное в кинетопластиде, также является второстепенным компонентом ядерной ДНК Euglena gracilis . Nucleic Acids Res. 2000; 28: 3017–21.
CAS Статья Google Scholar
Станкевич А.Ю., Фальчук К.Х., Валле БЛ. Состав и структура цинкодефицитного хроматина Euglena gracilis . Биохимия. 1983; 22: 5150–6.
CAS Статья Google Scholar
Mazus B, Falchuk KH, Vallee BL. Образование гистонов, экспрессия генов и дефицит цинка у Euglena gracilis . Биохимия. 1984; 23: 42–7.
CAS Статья Google Scholar
Эбенезер Т.Э., Кэррингтон М., Леберт М., Келли С., Филд М.С. Euglena gracilis Геном и транскриптом: органеллы, стратегии сборки ядерного генома и начальные особенности.В кн .: Успехи экспериментальной медицины и биологии; 2017. с. 125–40. https://doi.org/10.1007/978-3-319-54910-1_7.
Забронировать Google Scholar
Шанц М.Л., Шанц Р. Последовательность клона кДНК, кодирующего бета-тубулин из Euglena gracilis . Nucleic Acids Res. 1989; 17: 6727.
CAS Статья Google Scholar
Джексон А.П., Воан С., Галл К.Эволюция массивов генов тубулина у паразитов трипаносоматид: реструктуризация генома у Leishmania. BMC Genomics. 2006; 7: 261. https://doi.org/10.1186/1471-2164-7-261.
CAS Статья PubMed PubMed Central Google Scholar
Levasseur PJ, Meng Q, Bouck GB. Гены тубулина у протиста водорослей Euglena gracilis . J Eukaryot Microbiol. 1994; 41: 468–77.
Milanowski R, Karnkowska A, Ishikawa T, Zakryś B.Распределение обычных и нетрадиционных интронов в генах тубулина (α и β) эвгленид. Mol Biol Evol. 2014; 31: 584–93. https://doi.org/10.1093/molbev/mst227.
CAS Статья PubMed Google Scholar
Milanowski R, Gumińska N, Karnkowska A, Ishikawa T., Zakryś B. Промежуточные интроны в ядерных генах эвгленид — это отдельный тип? BMC Evol Biol. 2016; 16:49.
Артикул Google Scholar
Canaday J, Tessier LH, Imbault P, Paulus F. Анализ Euglena gracilis генов альфа-, бета- и гамма-тубулина: интроны и созревание пре-мРНК. Mol Gen Genomics. 2001; 265: 153–60.
CAS Статья Google Scholar
Tessier L, Keller M, Chan RL, Fournier R, Weil J. Короткие лидерные последовательности могут быть перенесены с малых РНК на преждевременные мРНК путем транс-сплайсинга в Euglena . EMBO J. 1991; 10: 2621–5.
CAS Статья Google Scholar
Keller M, Chan RL, Tessier L-H, Weil J-H, Imbault P. Посттранскрипционная регуляция с помощью света биосинтеза Euglena малой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы / оксигеназы. Завод Мол Биол. 1991; 17: 73–82. https://doi.org/10.1007/BF00036807.
CAS Статья PubMed Google Scholar
Rawson JR. Характеристика ДНК Euglena gracilis по кинетике ее реассоциации. Biochim Biophys Acta. 1975. 402: 171–8.
CAS Статья Google Scholar
Парра Г., Брэднам К., Корф И. CEGMA: конвейер для точной аннотации основных генов в геномах эукариот. Биоинформатика. 2007; 23: 1061–7. https://doi.org/10.1093/bioinformatics/btm071.
CAS Статья PubMed Google Scholar
Slater GSC, Birney E. Автоматизированная генерация эвристик для сравнения биологических последовательностей. BMC Bioinformatics. 2005; 6: 31. https://doi.org/10.1186/1471-2105-6-31.
CAS Статья PubMed PubMed Central Google Scholar
Mair G, Shi H, Li H, Djikeng A, Aviles HO, Bishop JR, et al. Новый поворот в метаболизме трипаносомной РНК: цис-сплайсинг пре-мРНК. РНК. 2000; 6: 163–9.
CAS Статья Google Scholar
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J, et al. Реконструкция последовательности транскрипта de novo из RNA-seq с использованием платформы Trinity для создания и анализа ссылок. Nat Protoc. 2013; 8: 1494–512.
CAS Статья Google Scholar
Fu L, Niu B, Zhu Z, Wu S, Li W. CD-HIT: ускорен для кластеризации данных секвенирования следующего поколения. Биоинформатика. 2012; 28: 3150–2.
CAS Статья Google Scholar
Симау Ф.А., Уотерхаус Р.М., Иоаннидис П., Кривенцева Е. В. БУСКО: оценка сборки генома и полноты аннотации с помощью ортологов с единственной копией. Биоинформатика. 2015; 31 (19): 3210–12.
Джексон А.П., Квейл М.А., Бериман М. Анализ геномной последовательности свободноживущей кинетопластиды: Bodo saltans (Kinetoplastida: Euglenozoa). BMC Genomics. 2008; 9: 594. https://doi.org/10.1186/1471-2164-9-594.
CAS Статья PubMed PubMed Central Google Scholar
Берриман М., Гедин Э., Герц-Фаулер С., Бландин Г., Рено Х., Бартоломеу Д.К. и др. Геном африканской трипаносомы Trypanosoma brucei. Наука. 2005; 309: 416–22.
CAS Статья Google Scholar
Fritz-Laylin LK, Prochnik SE, Ginger ML, Dacks JB, Carpenter ML, Field MC, et al. Геном Naegleria gruberi свидетельствует о ранней универсальности эукариот. Клетка. 2010; 140: 631–42. https://doi.org/10.1016/j.cell.2010.01.032.
CAS Статья PubMed Google Scholar
Ван Ассше Э., Ван Пуйвелде С., Вандерлейден Дж., Стинакерс ХП. РНК-связывающие белки, участвующие в посттранскрипционной регуляции у бактерий. Front Microbiol. 2015; 6: 141. https://doi.org/10.3389/fmicb.2015.00141.
Артикул PubMed PubMed Central Google Scholar
Araújo PR, Teixeira SM.Регуляторные элементы, участвующие в посттранскрипционном контроле стадийно-специфической экспрессии генов у Trypanosoma cruzi: обзор. Mem Inst Oswaldo Cruz. 2011; 106: 257–66.
Артикул Google Scholar
Montandon PE, Stutz E. Структура и экспрессия ядерного гена Euglena , кодирующего фактор элонгации трансляции EF-1 альфа. Nucleic Acids Res. 1990; 18: 75–82.
CAS Статья Google Scholar
Эммс Д.М., Келли С. OrthoFinder: устранение фундаментальных ошибок при сравнении полных геномов значительно повышает точность вывода ортогрупп. Genome Biol. 2015; 16: 157. https://doi.org/10.1186/s13059-015-0721-2.
CAS Статья PubMed PubMed Central Google Scholar
Лосось Д., Ванваллегем Г., Мориас Ю., Деноуд Дж., Крумбхольц С., Ломм Ф. и др. Аденилатциклазы Trypanosoma brucei подавляют врожденный иммунный ответ хозяина.Наука. 2012; 337: 463–6. https://doi.org/10.1126/science.1222753.
CAS Статья PubMed Google Scholar
Понсе-Толедо Р.И., Морейра Д., Лопес-Гарсия П., Дешам П. Вторичные пластиды эвгленид и хлорарахниофитов функционируют с помощью смеси генов происхождения красных и зеленых водорослей. Mol Biol Evol. 2018; 35: 2198–204. https://doi.org/10.1093/molbev/msy121.
Артикул Google Scholar
Jackson C, Knoll AH, Chan CX, Verbruggen H. Филогеномика пластид с широким отбором таксонов дополнительно проливает свет на различные эволюционные корни и время появления вторичных зеленых пластид. Научный доклад 2018; 8: 1523. https://doi.org/10.1038/s41598-017-18805-w.
CAS Статья PubMed PubMed Central Google Scholar
Curtis BA, Tanifuji G, Burki F, Gruber A, Irimia M, Maruyama S, et al. Геномы водорослей обнаруживают эволюционный мозаицизм и судьбу нуклеоморфов.Природа. 2012; 492: 59–65. https://doi.org/10.1038/nature11681.
CAS Статья PubMed Google Scholar
Доррелл Р.Г., Джил Дж., МакКаллум Дж., Мехуст Р., Баптест Е.П., Клингер С.М. и др. Химерное происхождение охрофитов и гаптофитов выявлено с помощью древнего пластидного протеома. Элиф. 2017; 6. https://doi.org/10.7554/eLife.23717.
Дунин-Хоркавич С, Лупас АН. Всесторонний анализ доменов HAMP: значение для трансмембранной передачи сигнала.J Mol Biol. 2010; 397: 1156–74. https://doi.org/10.1016/j.jmb.2010.02.031.
CAS Статья PubMed Google Scholar
Anantharaman V, Aravind L. Cache — сигнальный домен, общий для субъединиц Са (2 +) — каналов животных и класс прокариотических рецепторов хемотаксиса. Trends Biochem Sci. 2000; 25: 535–7.
CAS Статья Google Scholar
Szöör B, Haanstra JR, Gualdrón-López M, Michels PA.Эволюция, динамика и специализированные функции гликозом в метаболизме и развитии трипаносоматид. Curr Opin Microbiol. 2014; 22: 79–87. https://doi.org/10.1016/J.MIB.2014.09.006.
Артикул PubMed Google Scholar
Моралес Дж., Хашимото М., Уильямс Т.А., Хиравакэ-моги Х., Макиучи Т., Цубучи А. и др. Дифференциальное ремоделирование функции пероксисом лежит в основе экологической и метаболической адаптируемости диплонемидов и кинетопластид.Proc R Soc B. 2016; 283: 20160520.
Артикул Google Scholar
Güther MLS, Urbaniak MD, Tavendale A, Prescott A, Ferguson MAJ. Протеом гликозомы с высокой степенью достоверности для проциклической формы Trypanosoma brucei путем обогащения органелл с эпитоп-меткой и протеомики SILAC. J Proteome Res. 2014; 13: 2796–806. https://doi.org/10.1021/pr401209w.
CAS Статья PubMed PubMed Central Google Scholar
Lonergan TA. Регулировка формы клеток в Euglena . IV. Локализация актина, миозина и кальмодулина. J Cell Sci. 1985. 77: 197–208.
CAS PubMed Google Scholar
Гадельха К., Чжан В., Чемберлен Дж. У., Чайт Б. Т., Викстед Б., Филд МС. Архитектура интерфейса паразит-хозяин: сложные механизмы нацеливания, выявленные с помощью протеомики. Протеомика клеток Mol. 2015; 14: 1911–26. https://doi.org/10.1074/mcp.M114.047647.
CAS Статья PubMed PubMed Central Google Scholar
Barsanti L, Passarelli V, Walne PL, Gualtieri P. Фоторецепторный белок Euglena . FEBS Lett. 2000; 482: 247–51.
CAS Статья Google Scholar
Венкатеш Д., Бём С., Барлоу Л.Д., Нанкиссур Н.Н., О’Рейли А., Келли С. и др. Эволюция эндомембранных систем трипаносоматид — сохранение и специализация.J Cell Sci. 2017; 130: 1421–34. https://doi.org/10.1242/jcs.197640.
CAS Статья PubMed PubMed Central Google Scholar
Zhou Q, Gheiratmand L, Chen Y, Lim TK, Zhang J, Li S, et al. Сравнительный протеомный анализ выявляет новый двухлепестковый белок, необходимый для двухлепестковой дупликации и деления клеток у Trypanosoma brucei. PLoS One. 2010; 5: e9660. https://doi.org/10.1371/journal.pone.0009660.
CAS Статья PubMed PubMed Central Google Scholar
Эссон Х. Дж., Моррисвуд Б., Явуз С., Видиласерис К., Донг Дж., Уоррен Г. Морфология трипаносомного билоба, новой структуры цитоскелета. Эукариотическая клетка. 2012; 11: 761–72. https://doi.org/10.1128/EC.05287-11.
CAS Статья PubMed PubMed Central Google Scholar
Моррисвуд Б., Хавличек К., Деммель Л., Явуз С., Сили-Кардона М., Видиласерис К. и др. Новые компоненты bilobe в Trypanosoma brucei идентифицированы с помощью зависимого от близости биотинилирования.Эукариотическая клетка. 2013; 12: 356–67. https://doi.org/10.1128/EC.00326-12.
CAS Статья PubMed PubMed Central Google Scholar
McAllaster MR, Ikeda KN, Lozano-Núñez A, Anrather D, Unterwurzacher V, Gossenreiter T, et al. Протеомная идентификация новых белков цитоскелета, связанных с TbPLK, важным регулятором клеточного морфогенеза у Trypanosoma brucei. Mol Biol Cell. 2015; 26: 3013–29. https: // doi.org / 10.1091 / mbc.E15-04-0219.
CAS Статья PubMed PubMed Central Google Scholar
Aslett M, Aurrecoechea C, Berriman M, Brestelli J, Brunk BP, Carrington M, et al. TriTrypDB: функциональный геномный ресурс для Trypanosomatidae. Nucleic Acids Res. 2010; 38 (выпуск базы данных): D457–62. https://doi.org/10.1093/nar/gkp851.
CAS Статья PubMed Google Scholar
Бугреев Д.В., Пецца Р.Ж., Мазина О.М., Волошин О.Н., Камерини-Отеро Р.Д., Мазин А.В. Устойчивость D-петель DMC1 к диссоциации может объяснять потребность в DMC1 в мейозе. Nat Struct Mol Biol. 2011; 18: 56–60. https://doi.org/10.1038/nsmb.1946.
CAS Статья PubMed Google Scholar
Корены Л, Полевая МЦ. Древнее эукариотическое происхождение и эволюционная пластичность ядерной пластинки. Genome Biol Evol. 2016; 8: 2663–71.
Артикул Google Scholar
Obado SO, Brillantes M, Uryu K, Zhang W, Ketaren NE, Chait BT, et al. Картирование интерактомов показывает эволюционную историю комплекса ядерных пор. PLoS Biol. 2016; 14: e1002365. https://doi.org/10.1371/journal.pbio.1002365.
CAS Статья PubMed PubMed Central Google Scholar
Акиёси Б., Гулл К.Открытие нетрадиционных кинетохор в кинетопластидах. Клетка. 2014; 156: 1247–58. https://doi.org/10.1016/j.cell.2014.01.049.
CAS Статья PubMed PubMed Central Google Scholar
D’Archivio S, Wickstead B. Белки внешней кинетохоры трипаносомы предполагают сохранение механизма сегрегации хромосом у эукариот. J Cell Biol. 2017; 216: 379–91. https://doi.org/10.1083/jcb.201608043.
CAS Статья PubMed PubMed Central Google Scholar
Lukeš J, Guilbride DL, Votýpka J, Zíková A, Benne R, Englund PT. Сеть кинетопластов ДНК: эволюция невероятной структуры. Эукариотическая клетка. 2002; 1: 495–502.
Артикул Google Scholar
Давид В., Флегонтов П., Герасимов Е., Танифуджи Г., Хашими Н., Логачева М.Д. и др. Потеря генов и подверженное ошибкам редактирование РНК в митохондрии Perkinsela, эндосимбиотической кинетопластиды. MBio. 2015; 6: 1–12.
Артикул Google Scholar
Pusnik M, Schmidt O, Perry AJJ, Oeljeklaus S, Niemann M, Warscheid B, et al. Митохондриальная препротеин-транслоказа трипаносоматид имеет бактериальное происхождение. Curr Biol. 2011; 21: 1738–43.
CAS Статья Google Scholar
Zarsky V, Tachezy J, Dolezal P. Tom40, вероятно, является общим для всех митохондрий. Curr Biol. 2012; 22: R479–81.
CAS Статья Google Scholar
Pusnik M, Schmidt O, Perry AJ, Oeljeklaus S, Niemann M, Warscheid B, et al. Ответ Зарскому и др. Curr Biol. 2012; 22: R481–2.
CAS Статья Google Scholar
Мани Дж., Мейзингер С., Шнайдер А. Подглядывание за TOM — различные входные ворота в митохондрии дают представление об эволюции эукариот. Mol Biol Evol. 2016; 33: 337–51.
CAS Статья Google Scholar
Perez E, Lapaille M, Degand H, Cilibrasi L, Villavicencio-Queijeiro A, Morsomme P, et al. Митохондриальная дыхательная цепь вторичной зеленой водоросли Euglena имеет много дополнительных субъединиц с паразитическими Trypanosomatidae. Митохондрия. 2014; 19: 338–49.
CAS Статья Google Scholar
Гомес-Сильва Б., Тимко М.П., Шифф Дж. Биосинтез хлорофилла из глутамата или 5-аминолевулината в интактных хлоропластах Euglena .Planta. 1985; 165: 12–22. https://doi.org/10.1007/BF00392206.
CAS Статья PubMed Google Scholar
Ким Д., Филц М.Р., Proteau PJ. Метилэритритолфосфатный путь способствует биосинтезу каротиноидов, но не фитола в Euglena . J Nat Prod. 2004; 67: 1067–9. https://doi.org/10.1021/np049892x.
CAS Статья PubMed Google Scholar
Эггиманн Г., Суини К., Болт Х., Розатиан Н., Кобб С., Денни П. Роль фосфогликанов в восприимчивости Leishmania mexicana к семейству антимикробных пептидов temporin. Молекулы. 2015; 20: 2775–85. https://doi.org/10.3390/molecules20022775.
CAS Статья PubMed PubMed Central Google Scholar
Saint-Guily A, Schantz ML, Schantz R. Структура и экспрессия кДНК, кодирующей гистон h3A из Euglena .Завод Мол Биол. 1994; 24: 941–8.
CAS Статья Google Scholar
Vogel C, Marcotte EM. Понимание регуляции обилия белка на основе протеомного и транскриптомного анализов. Nat Rev Genet. 2012; 13: 227–32. https://doi.org/10.1038/nrg3185.
CAS Статья PubMed PubMed Central Google Scholar
Hutner SH, Zahalsky AC, Aaronson S, Baker H, Frank O.Питательная среда для Euglena . В кн .: Методы клеточной биологии. Академическая пресса; 1966. с. 217–28. https://doi.org/10.1016/S0091-679X(08)62140-8.
Забронировать Google Scholar
Cox J, Mann M. MaxQuant обеспечивает высокую скорость идентификации пептидов, индивидуальную погрешность масс в диапазоне p.p.b. и количественное определение белка в масштабе всего протеома. Nat Biotechnol. 2008; 26: 1367–72. https://doi.org/10.1038/nbt.1511.
CAS Статья PubMed Google Scholar
Тянова С., Тему Т., Синицын П., Карлсон А., Хейн М.Ю., Гейгер Т. и др. Вычислительная платформа Perseus для всестороннего анализа (проте )омических данных. Нат методы. 2016; 13: 731–40. https://doi.org/10.1038/nmeth.3901.
CAS Статья PubMed Google Scholar
Reynolds ES. Использование цитрата свинца при высоком pH в качестве электронно-непрозрачного красителя в электронной микроскопии. J Cell Biol. 1963; 17: 208–12 http: //www.ncbi.nlm.nih.gov/pubmed/13986422.
Bolger AM, Lohse M, Usadel B. Trimmomatic: гибкий триммер для данных последовательности Illumina. Биоинформатика. 2014; 30: 2114–20. https://doi.org/10.1093/bioinformatics/btu170.
CAS Статья PubMed PubMed Central Google Scholar
Patro R, Duggal G, Love MI, Irizarry RA, Kingsford C. Salmon обеспечивает быструю и достоверную количественную оценку экспрессии транскрипта.Нат методы. 2017; 14: 417–9. https://doi.org/10.1038/nmeth.4197.
CAS Статья PubMed PubMed Central Google Scholar
Лав М.И., Хубер В., Андерс С. Умеренная оценка кратного изменения и дисперсии данных РНК-seq с помощью DESeq2. Genome Biol. 2014; 15: 550. https://doi.org/10.1186/s13059-014-0550-8.
CAS Статья PubMed PubMed Central Google Scholar
Obado S, Field MC, Chait BT, Rout MP. «Высокоэффективное выделение белковых комплексов ядерной оболочки из трипаносом». Методы Mol Biol. 2016; 1411: 67–80.
Hornett EA, Wheat CW. Количественный анализ РНК-Seq у немодельных видов: оценка транскриптомных сборок в качестве основы и полезности эволюционно расходящихся геномных эталонных видов. BMC Genomics. 2012; 13: 361. https://doi.org/10.1186/1471-2164-13-361.
CAS Статья PubMed PubMed Central Google Scholar
O’Neil ST, Emrich SJ. Оценка показателей сборки транскриптомов de novo на предмет согласованности и полезности. BMC Genomics. 2013; 14: 465. https://doi.org/10.1186/1471-2164-14-465.
Артикул PubMed PubMed Central Google Scholar
Кадзитани Р., Тошимото К., Ногучи Х., Тойода А., Огура Ю., Окуно М. и др. Эффективная сборка de novo высокогетерозиготных геномов из коротких считываний полногеномного дробовика. Genome Res. 2014; 24: 1384–95.https://doi.org/10.1101/gr.170720.113.
CAS Статья PubMed PubMed Central Google Scholar
Boetzer M, Henkel CV, Jansen HJ, Butler D, Pirovano W. Предварительно собранные контиги для строительных лесов с использованием SSPACE. Биоинформатика. 2011; 27: 578–9. https://doi.org/10.1093/bioinformatics/btq683.
CAS Статья PubMed Google Scholar
Симпсон Дж. Т., Дурбин Р.Эффективная сборка больших геномов de novo с использованием сжатых структур данных. Genome Res. 2012; 22: 549–56. https://doi.org/10.1101/gr.126953.111.
CAS Статья PubMed PubMed Central Google Scholar
Gnerre S, Maccallum I, Przybylski D, Ribeiro FJ, Burton JN, Walker BJ, et al. Высококачественные черновые сборки геномов млекопитающих из массивно параллельных данных последовательностей. Proc Natl Acad Sci U S. A. 2011; 108: 1513–8.https://doi.org/10.1073/pnas.1017351108.
CAS Статья PubMed Google Scholar
Vurture GW, Sedlazeck FJ, Nattestad M, Underwood CJ, Fang H, Gurtowski J, et al. GenomeScope: быстрое безреференсное профилирование генома на основе коротких чтений. Биоинформатика. 2017; 33: 2202–4. https://doi.org/10.1093/bioinformatics/btx153.
CAS Статья PubMed PubMed Central Google Scholar
Копылова Э., Ноэ Л., Тузе Х. SortMeRNA: быстрая и точная фильтрация рибосомных РНК в метатранскриптомических данных. Биоинформатика. 2012; 28: 3211–7. https://doi.org/10.1093/bioinformatics/bts611.
CAS Статья PubMed Google Scholar
Николенко С.И., Коробейников А.И., Алексеев М.А. BayesHammer: Байесовская кластеризация для исправления ошибок при секвенировании отдельных клеток. BMC Genomics. 2013; 14 (Приложение 1): S7. https: // doi.org / 10.1186 / 1471-2164-14-S1-S7.
Артикул PubMed PubMed Central Google Scholar
Крузо М.Р., Аламелдин Х.Ф., Авад С., Бушер Е., Колдуэлл А., Картрайт Р. и др. Кхмерский программный пакет: обеспечение эффективного анализа нуклеотидных последовательностей. F1000 Исследования. 2015; 4. DOI: https: //doi.org/10.12688/f1000research.6924.1.
Langmead B, Salzberg SL. Быстрое выравнивание с пропуском чтения с Bowtie 2. Натурные методы.2012; 9: 357–9. https://doi.org/10.1038/nmeth.1923.
CAS Статья PubMed PubMed Central Google Scholar
Уокер Б.Дж., Абил Т., Ши Т., Прист М., Абуэллиэль А., Сактикумар С. и др. Pilon: интегрированный инструмент для комплексного обнаружения вариантов микробов и улучшения сборки генома. PLoS One. 2014; 9: e112963. https://doi.org/10.1371/journal.pone.0112963.
CAS Статья PubMed PubMed Central Google Scholar
Канехиса М., Сато Й., Кавашима М., Фурумичи М., Танабе М. KEGG как справочный ресурс для аннотации генов и белков. Nucleic Acids Res. 2016; 44: D457–62.
Тан С., Ломсадзе А., Бородовский М. Идентификация участков, кодирующих белок в транскриптах РНК. Nucleic Acids Res. 2015; 43: e78. https://doi.org/10.1093/nar/gkv227.
CAS Статья PubMed PubMed Central Google Scholar
Эль-Гебали С., Мистри Дж., Бейтман А., Эдди С. Р., Лучани А., Поттер С. К. и др.База данных семейств белков Pfam в 2019 году. Nucleic Acids Res. 2018. https://doi.org/10.1093/nar/gky995.
Conesa A, Götz S, García-gómez JM, Terol J, Talón M, Robles M. Blast2GO: универсальный инструмент для аннотации, визуализации и анализа в исследованиях функциональной геномики. Биоинформатика. 2005; 21: 3674–6. https://doi.org/10.1093/bioinformatics/bti610.
CAS Статья Google Scholar
Канехиса М., Фурумичи М., Танабэ М., Сато Ю., Моришима К.KEGG: новые взгляды на геномы, пути развития, болезни и лекарства. Nucleic Acids Res. 2017; 45: D353–61. https://doi.org/10.1093/nar/gkw1092.
CAS Статья PubMed PubMed Central Google Scholar
Джонс П., Биннс Д., Чанг Х.Й., Фрейзер М., Ли В., МакАнулла С. и др. InterProScan 5: классификация функций белков в масштабе генома. Биоинформатика. 2014; 30: 1236–40. https://doi.org/10.1093/bioinformatics/btu031.
CAS Статья PubMed PubMed Central Google Scholar
Ларкин М.А., Блэкшилдс Г., Браун Н.П., Ченна Р., Макгеттиган П.А., МакВильям Х. и др. Clustal W и Clustal X версии 2.0. Биоинформатика. 2007; 23: 2947–8. https://doi.org/10.1093/bioinformatics/btm404.
CAS Статья PubMed Google Scholar
Katoh K, Standley DM. Программное обеспечение MAFFT для множественного выравнивания последовательностей, версия 7: улучшения производительности и удобства использования. Mol Biol Evol. 2013; 30: 772–80. https://doi.org/10.1093 / молбев / mst010.
CAS Статья PubMed PubMed Central Google Scholar
Гуиндон С., Дюфаярд Дж. Ф., Лефорт В., Анисимова М., Хордийк В., Гаскуэль О. Новые алгоритмы и методы для оценки филогении максимального правдоподобия: оценка производительности PhyML 3.0. Syst Biol. 2010; 59: 307–21. https://doi.org/10.1093/sysbio/syq010.
CAS Статья PubMed Google Scholar
Стаматакис А. RAxML версия 8: инструмент для филогенетического анализа и постанализа крупных филогений. Биоинформатика. 2014; 30: 1312–3. https://doi.org/10.1093/bioinformatics/btu033.
CAS Статья PubMed PubMed Central Google Scholar
Цена МН, Дехал П.С., Аркин А.П. FastTree 2 — деревья приблизительно максимального правдоподобия для больших трасс. PLoS One. 2010; 5: e9490. https://doi.org/10.1371/journal.pone.0009490.
CAS Статья PubMed PubMed Central Google Scholar
Huelsenbeck JP, Ronquist F. MRBAYES: Байесовский вывод филогенетических деревьев. Биоинформатика. 2001; 17: 754–5.
CAS Статья Google Scholar
Stöver BC, Müller KF. TreeGraph 2: объединение и визуализация данных различных филогенетических анализов.BMC Bioinformatics. 2010; 11: 7. https://doi.org/10.1186/1471-2105-11-7.
Артикул PubMed PubMed Central Google Scholar
Карвер Т., Харрис С.Р., Берриман М., Паркхилл Дж., Маккуиллан Дж. А.. Artemis: интегрированная платформа для визуализации и анализа высокопроизводительных экспериментальных данных на основе последовательностей. Биоинформатика. 2012; 28: 464–9. https://doi.org/10.1093/bioinformatics/btr703.
CAS Статья PubMed Google Scholar
Quinlan AR, зал IM. BEDTools: гибкий набор утилит для сравнения геномных характеристик. Биоинформатика. 2010; 26: 841–2. https://doi.org/10.1093/bioinformatics/btq033.
CAS Статья PubMed PubMed Central Google Scholar
Райс П., Лонгден И., Близби А. ЭМБОСС: Открытый программный пакет европейской молекулярной биологии. Тенденции Genet. 2000; 16: 276–7 http://www.ncbi.nlm.nih.gov/pubmed/10827456.
Capella-Gutiérrez S, Silla-Martínez JM, Gabaldón T. trimAl: инструмент для автоматической обрезки совмещения в крупномасштабных филогенетических анализах. Приложение Bioinforma ПРИМЕЧАНИЕ. 2009; 25: 1972–3. https://doi.org/10.1093/bioinformatics/btp348.
CAS Статья Google Scholar
Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M. KAAS: сервер автоматической аннотации генома и реконструкции путей. Nucleic Acids Res. 2007; 35 (выпуск веб-сервера): W182–5.https://doi.org/10.1093/nar/gkm321.
Артикул PubMed PubMed Central Google Scholar
Эмануэльссон О., Брунак С., фон Хейне Г., Нильсен Х. Определение местонахождения белков в клетке с помощью TargetP, SignalP и связанных с ними инструментов. Nat Protoc. 2007; 2: 953–71. https://doi.org/10.1038/nprot.2007.131.
CAS Статья PubMed Google Scholar
Петерсен Т.Н., Брунак С., фон Хейне Г., Нильсен Х.SignalP 4.0: различение сигнальных пептидов из трансмембранных областей. Нат методы. 2011; 8: 785–6. https://doi.org/10.1038/nmeth.1701.
CAS Статья Google Scholar
Hiller K, Grote A, Scheer M, Münch R, Jahn D. PrediSi: предсказание сигнальных пептидов и их положений расщепления. Nucleic Acids Res. 2004; 32 (ВЕБ-СЕРВЕР ISS): W375–9. https://doi.org/10.1093/nar/gkh478.
CAS Статья PubMed PubMed Central Google Scholar
Emanuelsson O, Nielsen H, von Heijne G. ChloroP, метод на основе нейронной сети для прогнозирования транзитных пептидов хлоропластов и их сайтов расщепления. Protein Sci. 1999; 8: 978–84. https://doi.org/10.1110/ps.8.5.978.
CAS Статья PubMed PubMed Central Google Scholar
Bruley C, Dupierris V, Salvi D, Rolland N, Ferro M. AT_CHLORO: база данных белков хлоропластов, посвященная субпластидальной локализации.Фронтальный завод им. 2012; 3: 205. https://doi.org/10.3389/fpls.2012.00205.
Артикул PubMed PubMed Central Google Scholar
Xie C, Mao X, Huang J, Ding Y, Wu J, Dong S, et al. KOBAS 2.0: веб-сервер для аннотации и идентификации обогащенных путей и болезней. Nucleic Acids Res. 2011; 39 (выпуск веб-сервера): W316–22. https://doi.org/10.1093/nar/gkr483.
CAS Статья PubMed PubMed Central Google Scholar
Потенциал вашего пруда — ScienceDaily
Ученые из Центра Джона Иннеса обнаружили, что Euglena gracilis , одноклеточная водоросль, которая обитает в большинстве садовых прудов, имеет целый ряд новых неклассифицированных генов, которые могут создавать новые формы углеводов и натуральных продуктов.
Даже с использованием новейших технологий секвенирование всей ДНК в Euglena остается сложной и долгой задачей. Доктор Эллис О’Нил и профессор Роб Филд из Центра Джона Иннеса в Норвиче секвенировали транскриптом Euglena gracilis , который предоставляет информацию обо всех генах, которые организм активно использует. На основе этого анализа молекул РНК профессор Филд и его команда предположили, что Euglena имеет не менее 32000 активных генов, кодирующих белок, что значительно больше, чем у людей, у которых их примерно 21000.
Они обнаружили, что Euglena обладает генетической информацией, позволяющей производить множество различных природных соединений: мы просто еще не знаем, что это такое и что они могут делать. Около 60% активных генов не совпадают с генами, обнаруженными ни в одном другом организме, изученном на сегодняшний день, что позволяет предположить, что еще многое предстоит узнать о биологии Euglena .
Команда также обнаружила, что различные наборы генов становятся активными, когда Euglena выращивается в темноте, и когда он выращивается на свету.Это указывает на то, что Euglena может резко изменить свой метаболизм в зависимости от окружающей среды, что отражает его «способность успешно жить в очень разнообразных средах».
Euglena создает множество хорошо известных, ценных натуральных продуктов, включая витамины, незаменимые аминокислоты и сахарный полимер, который, как сообщается, оказывает анти-ВИЧ действие. Учитывая полезность соединений, о которых мы знаем, эти открытия могут, при дальнейших исследованиях, привести к открытию новых лекарств, включая новые антибиотики, питательные вещества и новые формы биотоплива, а также другие продукты.
Генетическая информация о том, что мы считаем простыми водорослями, на самом деле огромна, что усложняет определение того, на что способны эти организмы, и побудило научное сообщество сосредоточить внимание на более простых микроорганизмах (бактериях, грибах, вирусах).
Не обращая внимания на эту проблему, команда JIC определила гены-кандидаты в транскриптоме Euglena для всех путей и метаболических процессов, которые можно ожидать от подвижного фотосинтетического организма.Они также обнаружили неожиданную способность производить и модифицировать углеводные полимеры и производить еще неизвестные натуральные продукты. Профессор Филд и его команда теперь обращаются к научному сообществу, чтобы помочь классифицировать эти новые продукты и определить, как их можно использовать.
Профессор Филд сказал:
«Мы знаем, что существует множество продуктов, изготовленных из Euglena , которые уже представлены на рынке — косметические добавки и пищевые добавки, продукты питания и даже топливо для автомобилей — все они популярны в Японии и на Дальнем Востоке.Чего мы не осознавали, так это того, что Euglena может производить гораздо больше, что может дать нам новые методы лечения, лекарства и промышленные возможности. Мы надеемся, что это знаменательное исследование побудит других ученых основывать наши выводы на Euglena и других водорослях, чтобы выяснить, какие именно соединения они производят и как мы можем их использовать ».
История Источник:
Материалы предоставлены центром John Innes Center . Примечание. Содержимое можно редактировать по стилю и длине.
Разница между эвгленоидами и эвгленой
Ключевое различие между эвгленоидами и эвгленой состоит в том, что эвгленоидов — большая группа одноклеточных организмов, принадлежащих королевству Протиста, а эвглена — наиболее широко изученный репрезентативный род эвгленоидов.
Эвгленоиды — одноклеточные организмы, в большинстве своем автотрофные. Они принадлежат королевству Протиста и демонстрируют как растения, так и животные.Как и растения, они фотосинтезируют. Подобно животным, они двигаются и меняют свою форму. Кроме того, у них есть два жгутика; следовательно, они — жгутиковые организмы. Они живут в основном в пресной воде, особенно в воде, богатой органическими веществами. Они также могут жить в морской воде. Существует 54 рода эвгленоидов, включая Trypanosoma , Euglena и Eutreptia .
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое эвгленоиды
3. Что такое эвглена
4.Сходства между эвгленоидами и эвгленой
5. Сравнение бок о бок — эвгленоиды и эвглена в табличной форме
6. Резюме
Что такое эвгленоиды?
Эвгленоиды — одноклеточные жгутиковые организмы, принадлежащие Королевству Протиста. Это большая группа водорослей. В этой группе около 54 родов и 900 видов. Они могут жить в пресной, стоячей и морской воде. Но они обычно встречаются в пресной воде, богатой органическими веществами. Euglena и Phacus — два репрезентативных рода эвгленоидов.Эвгленоиды одноклеточные, за исключением колониального рода Colacium . Многие эвгленоиды имеют веретеновидную форму. Многие из них также имеют хлоропласты. Следовательно, они фотосинтезируют. Другие питаются фагоцитозом или диффузией.
Рисунок 01: Эвгленоиды
Кроме того, у них есть два жгутика; один длинный и функциональный, а другой короткий и не выступает. Эвгленоиды не имеют клеточной стенки. У них есть богатое белком клеточное покрытие, называемое пленкой, которая обеспечивает гибкость эвгленоидов.Кроме того, у эвгленоидов есть глазное пятно, которое действует как светочувствительное устройство. У них также есть сократительная вакуоль. Это помогает эвгленоидам откачивать лишнюю воду из своего тела. Кроме того, некоторые эвгленоиды способны производить покоящиеся споры, которые полезны в неблагоприятных условиях окружающей среды.
Что такое эвглена?
Эвглена — наиболее широко известный и изученный род эвгленоидов. Это одноклеточный организм, принадлежащий к типу Protista. E.viridis — самый распространенный вид. Однако существует 152 вида Euglena. Эвглена обитает в пресной и соленой воде. Также они встречаются во влажных почвах. Он имеет как характеристики растений, так и животных. Это фотосинтезирующие организмы, содержащие хлорофиллы. Они двигаются и меняют форму, как животные. Подобно другим эвгленоидам, Euglena также имеет пленку, состоящую из белкового слоя.
Рисунок 02: Эвглена
В неблагоприятных условиях окружающей среды Euglena может образовывать вокруг себя защитную стену и переходить в состояние покоя, как циста в состоянии покоя. Euglena воспроизводится в основном за счет двойного деления. Некоторые виды Euglena ответственны за эвтрофикацию.
Каковы сходства между эвгленоидами и эвгленой?
- Эвглена — эвгленоид.
- Они принадлежат к типу Protista.
- Оба представляют собой жгутиковые одноклеточные организмы.
- Они живут в водной среде, в основном в пресной воде.
- Оба содержат хлорофиллы и хлоропласты.
- Они способны к фотосинтезу.
- Эвгленоиды и эвглена имеют красное пятно для глаз, которое помогает зондировать свет.
- Они размножаются двойным делением, поэтому обычно размножаются бесполым путем.
- Кроме того, у них есть клеточное покрытие, называемое пленкой, которое позволяет им изменять свою форму.
В чем разница между эвгленоидами и эвгленой?
Эвгленоиды — большая группа одноклеточных жгутиконосцев, принадлежащих королевству Протиста. Эвглена — род эвгленоидов. Итак, в этом ключевое отличие эвгленоидов от эвглены.Большинство эвгленоидов автотрофны, а некоторые — гетеротрофны. Виды Euglena в основном автотрофны.
Следующая инфографика суммирует разницу между эвгленоидами и эвгленой.
Резюме — Эвгленоиды против Эвглены
Эвгленоиды — одноклеточные жгутиковые. Они обитают в пресноводных и влажных почвах. У них есть клеточное покрытие, называемое пленкой, которое обеспечивает гибкие движения тела. Существует много родов эвгленоидов, в том числе Euglena, Phacus, Eutreptia, Trachelomonas, и Peranema .Эвглена — самый распространенный и широко изученный род. Виды Euglena живут в пресной и солоноватой воде, богатой органическими веществами.
Артикул:
1. «Эвгленоиды». Lifeofplant.Blogspot.Com, 2020, Доступно здесь.
2. «Эвглена». En.Wikipedia.Org, 2020 г., доступно здесь.
Изображение предоставлено:
1. «Ehrenberg euglena viridis» К. Г. Эренберг 1838 — Die Infusionsthierchen, 1838 (общественное достояние) через Commons Wikimedia
2. «Euglena mutabilis» Дэвид Дж.Паттерсон — (CC BY 4.0) через Commons Wikimedia
Каковы признаки, места обитания, классификации и жизненные роли Euglenophyta
Каковы признаки, места обитания, классификации и жизненные роли Euglenophyta
A. определение
Протисты эукариотические (имеют ядерную мембрану), одноклеточные или многоклеточные (многоклеточные), и автотрофы или гетеротрофы. Протиста делится на 3, а именно: простейшие, водоросли, и грибки. Протисты, обладающие такие черты, как животные (простейшие), такие как Rhizopoda, передвигаются и задерживают пищу, используя ложные стопы или псевподии.Ризоноды обитают в море, пресной воде, животных. тела или людей, например Entamoeba histolityca (причина дизентерии). Протисты, у которых есть сходные с растениями (водоросли / водоросли) характерны для Euglenophyta, одноклеточные, не имеет клеточной стенки, имеет хлорофилл, способный к фотосинтезу, и имеет flagellum, например Euglena, Pyrophyta. Большинство Pyrophyta — это Dinoflagellata, живут в морской воде, но некоторые живут в пресной воде, одноклеточные, имеют клеточные стенки, и умеют активно двигаться, например Ceratium.Протисты, у которых есть такими характеристиками, как грибки (грибки), является Myxomycota (слизистая плесень), при ее жизни В цикле Myxomycota продуцируют свободноживущие клетки, имеющие форму амебоида. Когда При недостатке пищи эти свободные клетки образуют слизистый период. В этой статье будет более подробно обсудили протисты, которые имеют характеристики растений (водоросли / водоросли) — это Euglenophyta.
А. Особенности Эвгленофита
характерная черта Euglenophyta · Обычно имеет жгутик разной длины (Heterokontae) Количество жгутиков 2 или 4 · Обычно проживают в пресная вода, богатая органическими веществами · Автотрофный, потому что в нем есть хлорофиллы А и В, β-каротин и немного ксантофиляиту астаксантина · Гетеротрофность из-за есть органические вещества / бактерии.· У некоторых есть хлоропласты (могут фотосинтезировать) некоторые не могут фотосинтезировать. · Фотосинтез — это называется фототрофным Не фотосинтез — это называется осмотрофным (питание за счет диффузии) · Третья группа — это называется фаготрофным (есть за счет захвата пищи) · Клеточные стенки не сделаны из целлюлозы, но тонкие мембраны состоят из спиралевидного белка слои · Иметь пятна на глазах, называемые стигмы · Пятно на глазах (стигма) ярко-красный светочувствительный. Этот красный пигмент — астаксантин. · Продовольственные запасы paramilum — промежуточные формы полисахаридов· Передний конец клетка в виде цитостомы и ниже — глотка
Б.Среда обитания / Распределение
Среда обитания Euglenophyta
В соответствии с устройство движения (жгутик) большая часть Euglenophyta обитает в водах от пресная вода, морская вода и грязь. Даже в экстремальных условиях эвглена может жить в головастике.C. Структура ячейки
Euglenophyta уже имеет фиксированное ядро и хлоропласт, как у высоких растений. Поэтому Эвглена может осуществлять фотосинтез и расти так же хорошо, как и на высоких растениях. Все эвгленоиды имеют один или два жгутика, которые заставляют их активно двигаться.Эугленофита клетка имеет фиксированную форму, ее клеточная стенка состоит из тонкой пленки, которая может следовать жесты эвгленоидных клеток, которые могут менять форму в любой момент.· Части эвгленофиты ячейки
1. Передний край клетка в виде ситостомы 2. Пищевод состоит узкой и задней шеи 6. Красный пигмент, который есть глазные пятнаD. Репродуктивная система
1. Бесполые
воспроизведение Эвгленофита
Эвглена размножается деление двоичным делением.Сначала разбивается его ядро, затем дилики пликая дибиликан удлиненной формы. Затем образуются две дочерние клетки. Каждая дочерняя ячейка имеет клеточная мембрана, цитоплазма и ядро. Элегантно движущаяся площадка, ячейка деление начинается от переднего края. У родов с одним жгутиком блефаропласт сначала делится на два, один несет жгутик, а другой производит новую флегеллу. У тех, у кого два жгутика, может встречаться один из побегов. клетки, несущие два старых жгутика и другие клетки тиллера, будут производить два новые жгутики или могут возникать каждая из клеток побега menggabawa по одному жгутику и затем каждый производит еще один жгутик.Деление клетки в неактивной клетке может проходят в состоянии, обернутом слизистой оболочкой. Иногда протопласты не выходить из мембран до повторного разделения. В таких случаях сформируется непостоянная колония, после чего клетка снова двинется.Сексуальный
Наличие выращивание вегетативных клеток на эвгленоидах никогда не встречалось. Тогда есть еще автогамия (слияние двух побегов сеянцев в ячейке), когда-либо встречавшаяся на фокус. В целом euglena sp.продольно расщепляясь в течение жизни, как планктон, который может делиться, когда находится в кисте.
E. Классификация и примеры
Класс эвгленофитов делится на три порядка, а именно: 2. Паранемки / Eutreptiales Примеры видов из группы Euglenophyta· Эвглена (зеленая)
Включает всех членов Euglenophyceae, у которых в течение жизни клетки имеют жгутик и могут двигаться. Его жизнь уединенная, никогда не образует колоний. Диски в форме хлоропластов для формирования ленты.Пища Euglenophyta сильно различается у всех живых организмов. Когда Эвглена растет в темноте с подходящим органическим вычитанием, тогда цвет будет исчезнут, но вернутся к цвету при освещении. Заповедник эвглены образуют парамилум, который представляет собой углевод в виде кольцевых дисков, стеблей или круглые, иногда относительно большие по размеру.
Эвглена также может дать цвет воды при обнаружении в больших количествах. Обычно встречается во многих небольших пруды, содержащие много органического материала.Euglena viridis вид

 — 1986
— 1986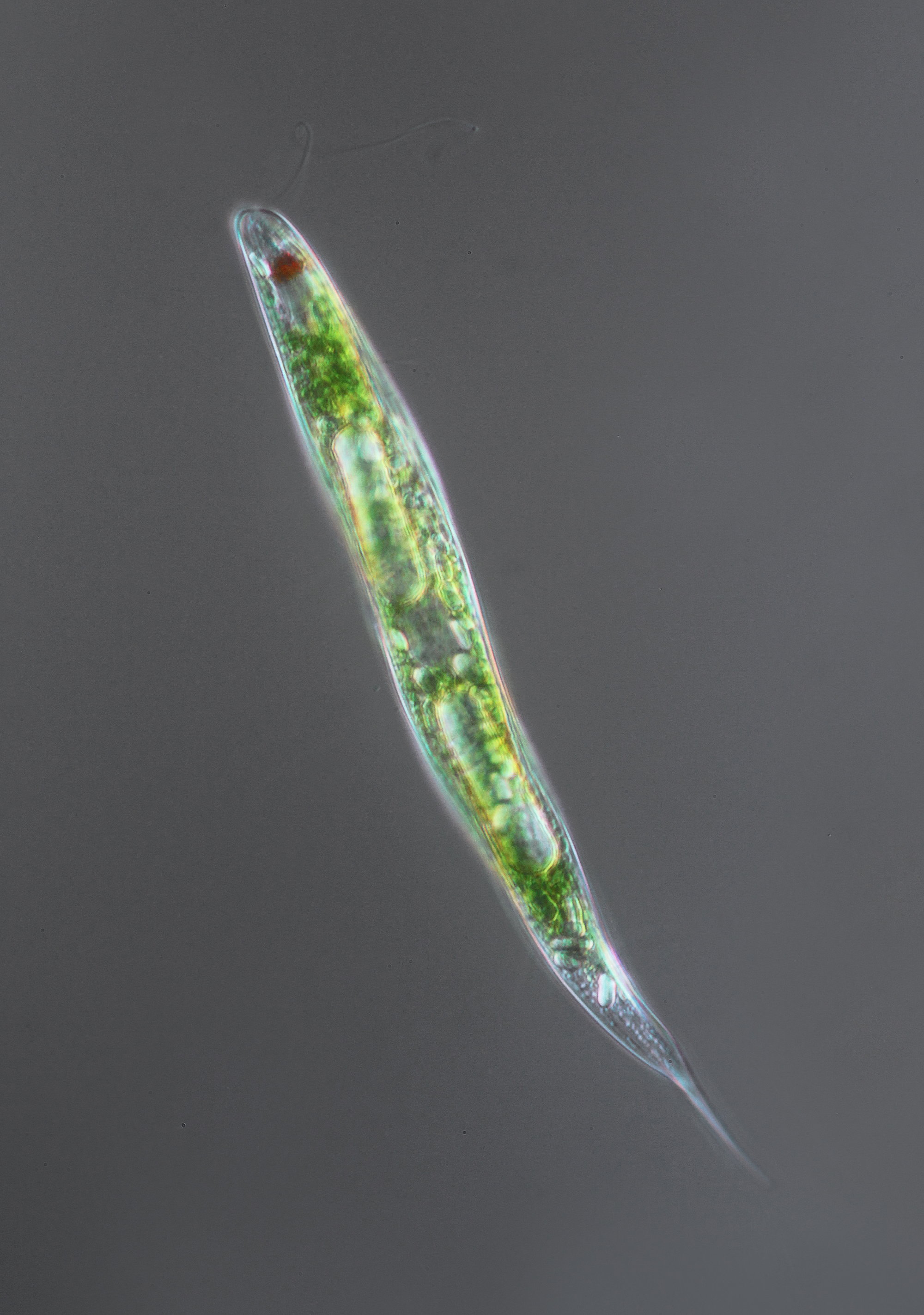
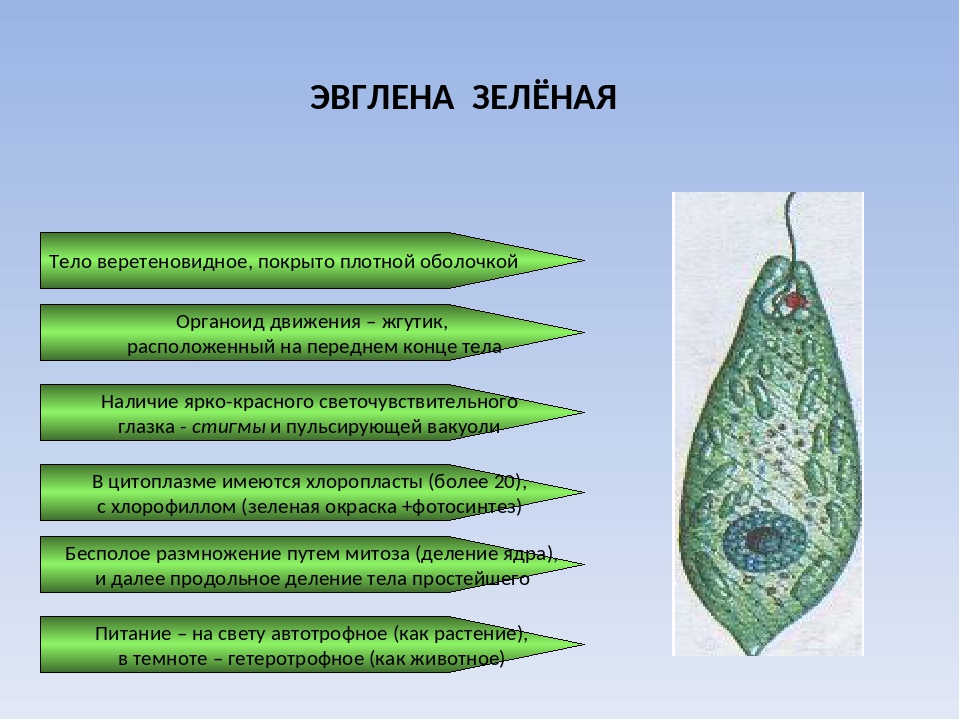 неясны.
неясны.