10 интересных фактов об Эвглене зелёной
Интересные факты об Эвглене зеленой
1. Эвглены зеленые (euglena green) относятся к группе протистов, это такие организмы, которых невозможно четко вписать в привычный нам вид — они не являются животными, растениями либо грибами. Так сказать, ни рыба ни мясо. К тому же, некоторые из них являются опасными для человека паразитами.
2. Эти удивительные растения можно встретить практически везде во всем мире, они легко приспосабливаются к любым условиям. Всё, что им необходимо — это пресная вода, которая даже может быть не очень чистой.
3. Рядом со ртом протистов, по соседству со жгутиком, расположено так называемое глазное пятно, выполняющее функции зрительного органа.
4. Цветение воды, которое часто можно наблюдать в прудах и иных закрытых водоемах, наиболее часто вызывается именно этими организмами. Когда эвглены начинают бесконтрольно размножаться, вода становится зеленой и «зацветает».
5. Эвглена зеленая, как и большинство растений на Земле, способна перерабатывать солнечный свет в энергию с помощью фотосинтеза.
6. Размер протистов крошечный, и редко когда превышает 0,05 мм, поэтому чтобы рассмотреть эвглену, вам понадобится хотя бы небольшой непрофессиональный микроскоп — вы не сможете ее увидеть просто так, невооружённым взглядом.
7. Для перемещений в воде у них существует приспособление-жгутик, выходящий прямо из тела. Этот аппарат может служить не только для плавания, но и для питания эвглен. С помощью этого жгутика эвглена зеленая выхватывает из воды мелкие частицы, которые и отправляет в ротовое отверстие.
8. Другие протисты схожих видов, например эвглены снежные или эвглены кровавые, способны легко выживать в снегах и во льдах. Расплодившись в огромных количествах они вызывают похожий с цветением воды эффект — окрашивают снежный покров в красный, жёлтый, голубой, зелёный или даже чёрный оттенок.
9. “Кровавый снег” описал в своих трудах ещё Аристотель. Тогда, вероятнее всего, это явление принимали за нечто сверхъестественное. Чарльз Дарвин, который создал теорию эволюции, восходящую от приматов, тоже наблюдал нечто похожее, но уже во льдах.
10. Эвглены зеленые размножаются делением, и способны в краткие сроки захватить целый водоем, если они попадут в благоприятную среду с богатой органической пищей. Эти организмы начинают стремительно размножаться и полностью захватывают все пространство. Сигналом о захвате водоема послужит изменение цвета последнего.
Урок по теме «Эвглена зелёная» (7-й класс)
Задачи:
1) раскрыть особенности строения и процессов жизнедеятельности Эвглены зелёной;
2) доказать принадлежность эвглены к царству животных.
Ход урока
I. Повторение материала.
Фронтально:
1) Назовите царства живой природы.
2) Перечислите признаки растительных организмов.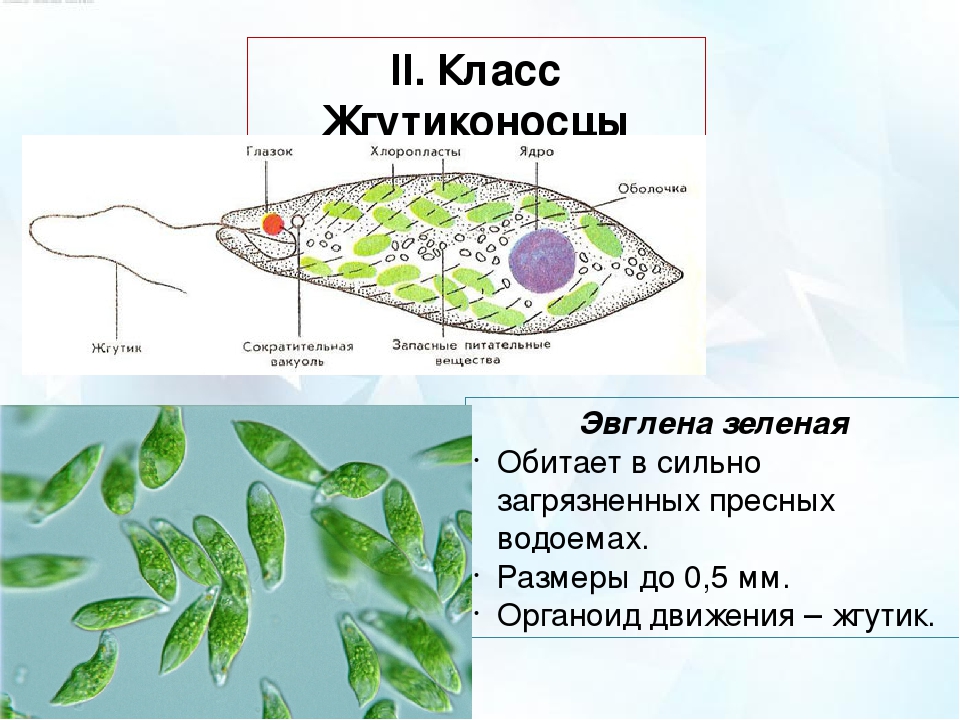
3) Перечислите признаки животных организмов.
Учитель:
1) Сегодня мы с вами познакомимся с удивительным представителем живой природы. Этот представитель перед вами (на доске рисунок организма).
2) Зачитать текст об этом представителе (поставить проблему).
Если взять зелёную плёнку с поверхности небольшой лужи, застоявшейся на проезжей дороге или около скотного двора, то мы увидим под микроскопом зелёные одноклеточные организмы. Тело у них стройное и продолговатое с одним жгутиком.
Присутствие хлорофилла придаёт им зелёный цвет, а маленький красноватый “глазок” на переднем конце вполне соответствует такому же “глазку” у хламидомонады. Эти организмы, как и водоросли, способны к фотосинтезу.
Кто же это? Что это за организм?
3) Назвать этот организм.
Учитель: – А вы знаете, как зовут этот организм?
Ученики: – Это эвглена!
4) Разобрать систематическое положение.
Вид
Род
Класс
Тип
Царство
Постепенно заполняем эту схему:
Эвглена – какая систематическая единица (род), тогда вид – эвглена зелёная, почему зелёная?
– Т. к. этот организм зелёного цвета, он содержит хлорофилл.
– Что мы еще можем сказать о нём?
Читая выданный текст, учащиеся могут определить класс, тип; царство нельзя.
Получается на доске схема:
| Вид | Эвглена зелёная |
| Род | Эвглена |
| Класс | Жгутиковые (жгутик – орган передвижения) |
| Тип | Простейшие (тело состоит из 1 клетки) |
| Царство | ? |
5) Почему нельзя определить царство, читая текст
(есть сходство с растениями).
6) Разбираем признаки эвглены (находим противоречия).
| Растение | Животные |
| – глазок | – глазок |
| – хлорофилл | – хлорофилл |
| – автотрофное питание | – автотрофное питание |
| – жгутик | – жгутик |
| – ограниченный рост |
Учащиеся в удивлении, кто же это, растение или животное.
Если поместить этот живой организм в полную
темноту, прибавив к воде картофельного отвара, и
подержать его там 20-25 дней, то тогда мы увидим, что
организмы не погибли, хотя и лишились своей
зелёной окраски.
– Что мы можем сказать теперь?
– Этот организм способен к гетеротрофному питанию, потому он и не погиб, т. е. он питался органическими веществами картофельного отвара.
– Так кто же это?
Учащиеся говорят, что это животное, тогда учитель спрашивает, а как же быть с признаками растений. Дети снова в недоумении.
После чего учитель сообщает, что более тщательные исследования ученых, показали наличие у эвглены ротового отверстия.
– Вот тогда учащиеся убеждены, что это животное.
7) Почему? Доказать?
Растения не могут в темноте питаться, т. к. органические вещества образуются у них только при действии света, и у растений нет ротового отверстия.
8) Формулируем вывод и знакомство с новым типом питания.
Вывод:
Эвглена зелёная относится к царству животных, в
темноте питается гетеротрофно, но она может
питаться и как растение (автотрофно) на свету,
значит у неё смешанный тип питания.
Учитель: Да, у эвглены смешанный тип питания, а называется он – МИКСОТРОФНЫЙ.
В результате определили царство организма – царство Животные. Вопрос с доски убираем.
9) Почему этот организм вызвал у нас затруднение, удивление?
– Потому что он сочетает в себе признаки растений и животных.
– А о чём это говорит?
– Это говорит о единстве происхождения органического мира.
III. Закрепление материала (работа в тетрадях).
а) Запись темы урока.
б) Систематическое положение эвглены зелёной.
в) Вывод.
г) Подписать органоиды клетки и написать выполняемые функции (рисунок выдан).
IV. Запись дом. задания. Стр. 97.Опыт: Проявление положительной реакции на свет у эвглены зеленой
Опыты с животными, проводимые в уголке живой природы
Опыты и наблюдения за обитателями
уголка живой природы проводят члены
кружка «Юный зоолог». Некоторые наблюдения
ведутся всеми учащимися во внеурочное
время, например, наблюдения за проявлением
различных жизненных отправлений у
простейших (питание, фототаксис,
хемотаксис и т. д.). Для организации таких
наблюдений ребята из разных классов
разделяются на группы по 5 — 7 человек.
Они в назначенное время поочередно
приходят в уголок живой природы, и
выполняют поставленные задачи.
Некоторые наблюдения
ведутся всеми учащимися во внеурочное
время, например, наблюдения за проявлением
различных жизненных отправлений у
простейших (питание, фототаксис,
хемотаксис и т. д.). Для организации таких
наблюдений ребята из разных классов
разделяются на группы по 5 — 7 человек.
Они в назначенное время поочередно
приходят в уголок живой природы, и
выполняют поставленные задачи.
Опыты и наблюдения в уголке живой природы с зоологическими объектами, как и с аквариумными растениями, способствуют углублению знаний учащихся по школьному курсу биологии, развитию познавательных интересов и вместе с тем расширяют их общий биологический кругозор.
Более четкой организации опытов и наблюдений способствуют специальные задания, подготовленные учителем в соответствии с темами и целями занятий, что особенно важно для V—VII классов.
 Эти задания
определяют последовательность работы,
направляют внимание учащихся на самые
важные моменты в ней, конкретизируют
наблюдения или опыт. Задания могут быть
рассчитаны как на фронтальную, так и на
индивидуальную работу учащихся.
Индивидуальные задания лучше организуют
и стимулируют активность ребят. Они
больше нравятся школьникам тем, что при
их выполнении дети они чувствуют себя
в роли настоящих исследователей.
Эти задания
определяют последовательность работы,
направляют внимание учащихся на самые
важные моменты в ней, конкретизируют
наблюдения или опыт. Задания могут быть
рассчитаны как на фронтальную, так и на
индивидуальную работу учащихся.
Индивидуальные задания лучше организуют
и стимулируют активность ребят. Они
больше нравятся школьникам тем, что при
их выполнении дети они чувствуют себя
в роли настоящих исследователей.Опыт: Проявление положительной реакции на свет у эвглены зеленой
Объект исследования: эвглена зеленая.
Оборудование: пробирки,
черная бумага, лупа.
Проведение опыта:
1. В две пробирки налить на
2/3 густонаселенную культуру эвглены
зеленой.
2. Затенить нижнюю половину
первой пробирки. Для этого использовать
черную бумагу, плотно привязав ее к
пробирке, или опустить пробирку в прорезь
картонного ящичка, оклеенного черной
бумагой. Поставить пробирку на
яркоосвещенное место на 30 — 40 мин.
Для этого использовать
черную бумагу, плотно привязав ее к
пробирке, или опустить пробирку в прорезь
картонного ящичка, оклеенного черной
бумагой. Поставить пробирку на
яркоосвещенное место на 30 — 40 мин.
3.
Затенить аналогичным способом верхнюю
половинку второй пробирки и также
поставить на яркоосвещенное место на
30 — 40 мин.
4. Поочередно быстро освободить
пробирки от затемнения. Рассмотреть их
содержимое невооруженным глазом и через
лупу.
5. Записать в дневник условия и
результаты наблюдений. Дать объяснения.
6.
Изменить вариант наблюдения (затенить
среднюю часть пробирки или всю пробирку,
оставив только круглое отверстие,
направленное к источнику света и т.п).
Сделать записи в дневнике наблюдений.
Опыт: Отрицательная реакция инфузории-туфельки на химическое раздражение
Объект исследования: инфузории туфелька.
Оборудование: предметное стекло, пипетка, стакан,
лупа или микроскоп.
Проведение
опыта:
1. На предметное
стекло нанести каплю настоя с
инфузориями-туфельками. Рядом на
расстоянии 0,5 — 1 см нанести другой
пипеткой каплю чистой воды или сенного
настоя без инфузорий. Соединить обе
капли «мостиком».
2. С края капли с
инфузориями положить кристаллик
поваренной соли.
3. Наблюдать за реакцией
инфузорий через лупу или микроскоп.
Отметить время, за которое все инфузории
переплыли из одной капли в другую.
4.
Наблюдения записать в дневник, дать
объяснения и сделать выводы.
Опыт: Изучение особенностей питания гидры
Объект
исследования: гидра
Оборудование: чашка Петри, миллиметровая бумага.
Проведение
опыта:
1. Отсадить накормленную гидру
в чашку Петри, поставленную на миллиметровую
бумагу.
2. При помощи миллиметровой
бумаги, пользуясь лупой, измерить длину
тела и щупалец успокоившейся гидры.
Сделать рисунок ее.
3. Выпустить над
гидрой поочередно 2 — 3 циклопов или
бросить над щупальцами маленький кусочек
мяса.
4. Наблюдать реакцию гидры при
соприкосновении с пищей: действие
щупалец, заглатывание пищи, изменение
формы тела.
5. Измерить длину тела и
щупалец насытившейся гидры. Сделать
рисунок ее.
6. Провести сравнение гидры
до кормления и после кормления.
7. В
дневнике сделать соответствующие записи
и выводы, полученные в результате
наблюдений.
Результаты опыта можно использовать
в курсе «Зоология» — 7 класс.
Тема
«Простейшие животные»
Опыт:
Влияние
температуры воды на окраску рыб
Объект исследования:
аквариумные рыбки (гуппи) 6-8 шт.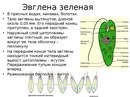
Оборудование: два аквариума,
терморегулятор, термометр ля измерения
температуры воды.
Проведение опыта предлагают
нескольким участникам. Для этого воду
в одном аквариуме подогревают
терморегулятором до заданной температуры,
вода в другом аквариуме – комнатной
температуры. Когда вода в аквариумах
достигнет заданной температуры, в них
помещают по 2-3 рыбки одного вида,
одинаковой окраски и размера и наблюдают
через какое время произойдет изменение
окраски рыб.
При проведении опыта
учащиеся делают вывод о том, что при
температуре воды 16-18 0С окраска
рыб менее выразительна, а при более
высокой температуре воды 24-26 0С
окраска рыб более яркая и выразительная.
Результаты опыта можно использовать
в курсе «Зоология» — 7 класс
Тема:
«Строение и жизнедеятельность рыб».
Опыт: Выработка условных рефлексов на звуковой сигнал у хомяков
Объект исследования: хомячки.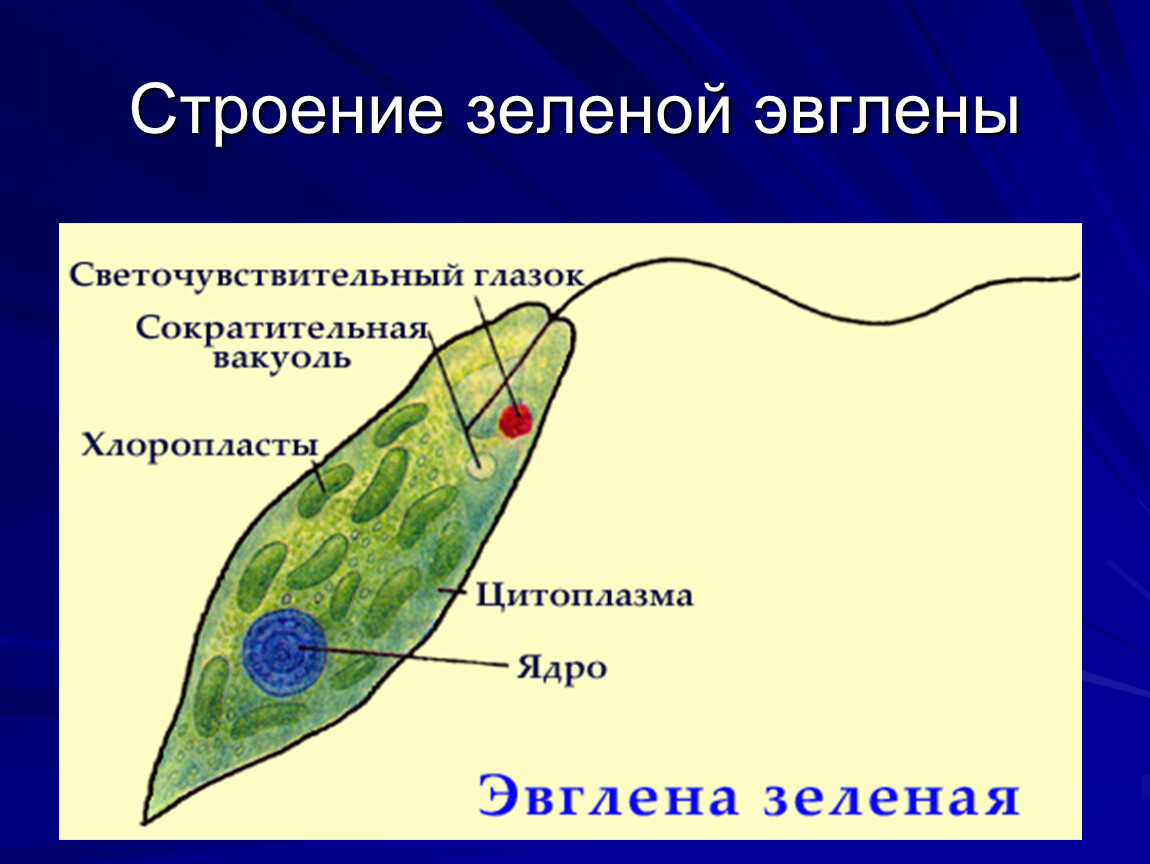
Оборудование: клетка с
животным, столик для еды, лесенка.
Проведение опыта: в клетке
с животным делают на высоте столик для
еды или подвешивают полочку. Два дня
хомячку не дают есть, а на третий день
на полочку или столик кладут небольшой
кусочек вареного картофеля и к полочке
поставляют деревянную лесенку и звонят
в колокольчик. Когда хомячок начнет,
есть корм, продолжают звонить в
колокольчик. Как только он съест корм,
ему необходимо еще положить маленькую
порцию корма и звонить в колокольчик.
Опыт продолжают до тех пор, пока хомячок
не будет бежать на полочку или столик
при отсутствии и на них корма, но услышав
сигнал колокольчика.
Учащимся предлагается
выяснить через сколько сеансов
выработается условный рефлекс у хомячка.
Повторно опыт проводят через месяц.
Результаты опыта можно использовать при изучении курса «Зоологии –7кл» Тема: «Нервная система млекопитающих»
Использование заданий
для проведения различных опытов и
наблюдений помогает успешно их выполнить
и получить нужные результаты.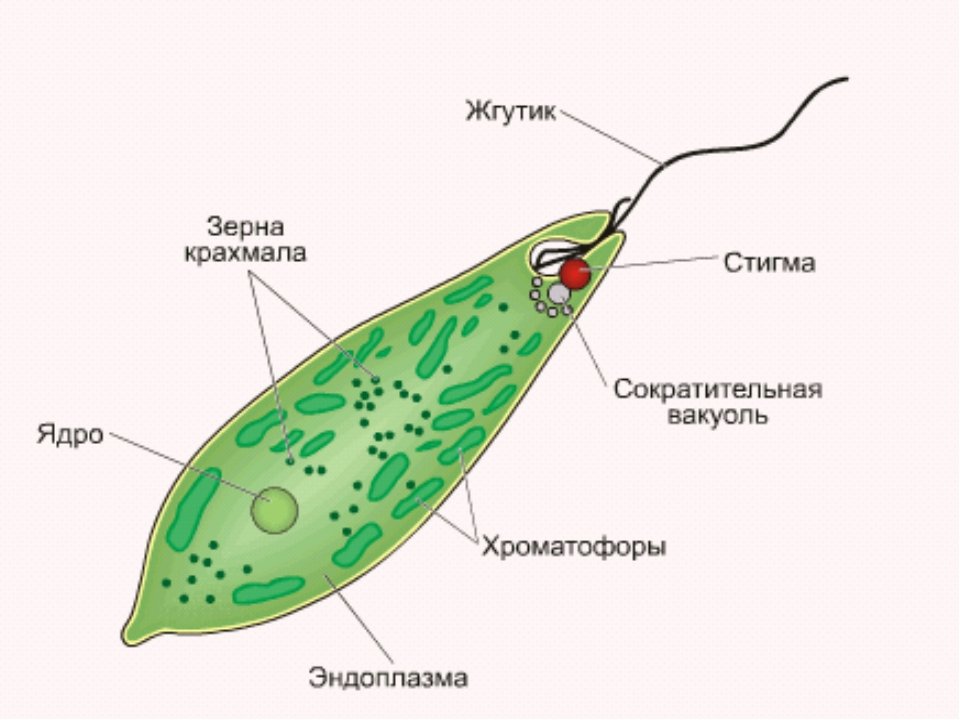 Наибольший
воспитательный эффект обеспечивается
при создании таких условий работы в
уголке живой природы, когда учащиеся
осознают необходимость тщательного,
аккуратного выполнения любого вида
деятельности по определенному плану с
последующими выводами, которые могут
помочь развитию творческой инициативы,
а следовательно, усовершенствованию
работы, улучшению ее качества.
Наибольший
воспитательный эффект обеспечивается
при создании таких условий работы в
уголке живой природы, когда учащиеся
осознают необходимость тщательного,
аккуратного выполнения любого вида
деятельности по определенному плану с
последующими выводами, которые могут
помочь развитию творческой инициативы,
а следовательно, усовершенствованию
работы, улучшению ее качества.
Эвглена: Характеристики, классификация и структура — Видео и стенограмма урока
Классификация эвглены
Если вы выйдете на улицу к пруду или ручью и зачерпнете ведро воды, вероятно, в ведре окажется много микроорганизмов. Один очень распространенный вид известен как эвглена. Эвглена — одноклеточный микроорганизм, принадлежащий к царству Протиста .
Члены королевства Протиста — это в основном одноклеточные организмы, обитающие во влажных местах или в воде.Ученые часто считают, что протистов сложно классифицировать из-за их уникальных характеристик. У некоторых протистов есть хлоропласты, и они подвергаются фотосинтезу для выработки энергии, что делает их похожими на растения.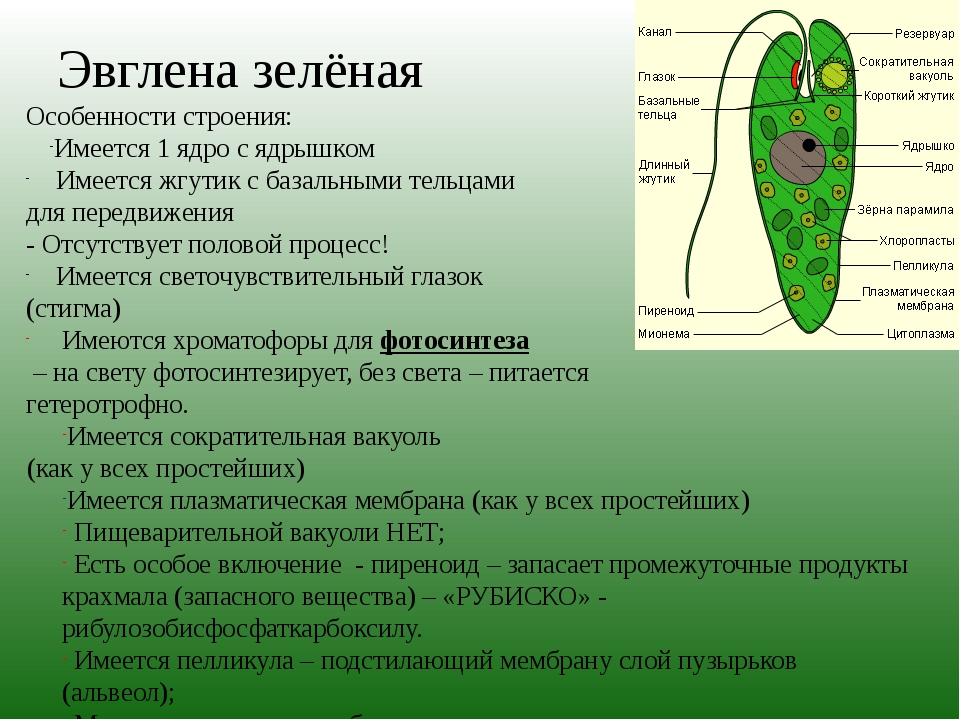 Другие протисты полностью гетеротрофны, что означает, что они поедают другие организмы и получают свою энергию другими способами, кроме фотосинтеза, что делает их подобными животным. Некоторые виды простейших даже живут во влажных местах и питаются разлагающимся веществом, что делает их подобными грибам. Эти вариации, а также обилие типов телосложения затрудняют их классификацию.
Другие протисты полностью гетеротрофны, что означает, что они поедают другие организмы и получают свою энергию другими способами, кроме фотосинтеза, что делает их подобными животным. Некоторые виды простейших даже живут во влажных местах и питаются разлагающимся веществом, что делает их подобными грибам. Эти вариации, а также обилие типов телосложения затрудняют их классификацию.
Euglena принадлежит к типу Euglenozoa . Члены этого типа — одноклеточные организмы, в основном обитающие в пресной воде, а некоторые — в соленой. У всех есть жгутик, используемый для передвижения, и хлоропласты, но они также могут питаться как гетеротрофы. В частности, они принадлежат к классу Euglenoida . Все представители этого класса обитают в пресной воде и фотосинтезируют или питаются за счет распространения других организмов. У них также есть прочное внешнее покрытие, известное как пленка.
Хотя дальнейшая классификация несколько оспаривается, большинство ученых согласны с тем, что эвглена обыкновенная принадлежит к отряду Euglenales , семейству Euglenaceae и к роду Euglena . Конкретные требования к этим группам расплывчаты, но известно, что они содержат организмы со схожими характеристиками эвглены, которую мы изучаем на этом уроке. Как видите, начиная с уровня королевства и ниже характеристики и требования для классификации Эвглены становятся все более конкретными.Давайте перейдем к изучению строения и характеристик этих организмов.
Конкретные требования к этим группам расплывчаты, но известно, что они содержат организмы со схожими характеристиками эвглены, которую мы изучаем на этом уроке. Как видите, начиная с уровня королевства и ниже характеристики и требования для классификации Эвглены становятся все более конкретными.Давайте перейдем к изучению строения и характеристик этих организмов.
Выделение и характеристика мутанта Euglena gracilis с дефектной моторикой [PeerJ]
Введение
Передвижение организмов напрямую связано с характерными эволюционными соревнованиями за выживание, такими как добыча пищи, поиск подходящей среды и бегство от хищников (Domenici, Claireaux & McKenzie, 2007). Передвижение в ответ на стимулы окружающей среды определяется как «таксис», включая хемотаксис, гравитаксис и фототаксис, которые соответственно относятся к перемещению по отношению к химическим веществам, гравитации и свету соответственно (Dusenbery, 2009).Такие налоги необходимы для выживания организмов в естественной среде и регулируются сложными механизмами (Webre, Wolanin & Stock, 2003; Okita, 2005; Roberts, 2006; Jékely et al. , 2008; Roberts, 2010; Sourjik & Wingreen, 2012). ). Способы передвижения зависят от размера организма и оптимизируются в процессе эволюции (Jahn & Bovee, 1965; Dusenbery, 1997). Многие подвижные одноклеточные микроорганизмы в гидросфере используют свои жгутики для плавания (Miyata et al., 2020).
, 2008; Roberts, 2010; Sourjik & Wingreen, 2012). ). Способы передвижения зависят от размера организма и оптимизируются в процессе эволюции (Jahn & Bovee, 1965; Dusenbery, 1997). Многие подвижные одноклеточные микроорганизмы в гидросфере используют свои жгутики для плавания (Miyata et al., 2020).
Среди микроводорослей Chlamydomonas reinhardtii широко использовался в качестве модельного организма для изучения молекулярных механизмов, лежащих в основе плавания клеток фитопланктона с использованием их жгутиков. C. reinhardtii используется в качестве модельной микроводоросли, поскольку ее генетическая методология установлена (Harris, 2001). Используя их гравитаксис и фототаксис, были разработаны стратегии скрининга неподвижных мутантов C. reinhardtii (Kamiya, 1991). Получение этих мутантов и их анализ пролили свет на молекулярные механизмы, используемые для плавания; например, взаимодействие между микротрубочками и моторным белком динеина управляет движением жгутиков (Kamiya & Okamoto, 1985; Kamiya, Kurimoto & Muto, 1991; Kamiya, 1995).Виды фотосинтезирующих жгутиков рода Euglena также используют свои жгутики для плавания, но они могут сбрасываться в ответ на химические или механические раздражители (Bovee, 1982). В отличие от клеток хламидомонады , которые не могут изменить свою форму, клетки Euglena spp. демонстрируют амебоидное движение, называемое «эвгленоидным движением» без жгутика, хотя это чрезвычайно медленное средство миграции (Bovee, 1982).
Euglena gracilis широко используется в качестве модельного организма для изучения механизмов фотосинтеза, клеточного метаболизма и локомотивного поведения, такого как гравитаксис и фототаксис (Richter et al., 2002; Daiker et al., 2010; Daiker et al., 2011; Schwartzbach & Shigeoka, 2017). Недавние достижения в экспериментальных методах, таких как нокдаун гена, облегчили изучение функции гена E. gracilis . Например, сообщалось, что фотоактивированная аденилатциклаза необходима в качестве фоторецептора для фототаксиса (Iseki et al., 2002). Напротив, получение ядерных мутантов E остается очень трудным. gracilis ; некоторые признаки индуцируются мутагенами, такими как ультрафиолетовый свет или этилметансульфонат, которые препятствуют полному ингибированию определенных функций гена и, как предполагается, связаны с полиплоидией вида (Schiff & Epstein, 1965; Hill, Schiff & Epstein , 1966).Соответственно, было идентифицировано и охарактеризовано несколько мутантных штаммов с дефектом локомоции (Schiff, Lyman & Russell, 1980). Хотя хлоропластный мутант E . gracilis , M2-BUL, ранее сообщалось об отсутствии подвижности (Shneyour & Avron, 1975), это не было тщательно изучено; сообщается, что в нем отсутствует фотосинтезирующая активность, и он не доступен в текущих коллекциях культур, например, The Sammlung von Algenkulturen der Universität Göttingen (Коллекция культур водорослей в Геттингенском университете [SAG], DEU), к которым относятся различные E.gracilis депонированы штаммы дикого типа.
В дополнение к его использованию в качестве модельного организма, E . gracilis использовался для промышленного применения из-за его быстрого распространения, богатых питательными веществами свойств и характерного метаболизма (Schwartzbach & Shigeoka, 2017). В качестве запаса сахаридов в E. gracilis хранится парамилон, кристаллическая форма β — (1,3) -D-глюкана, которая находит различное применение в пищевой промышленности (Watanabe et al., 2013; Руссо и др., 2017). Таким образом, клетки E. gracilis особенно подходят в качестве ингредиента функциональных пищевых продуктов и добавок. Более того, сохраненный парамилон метаболизируется в условиях гипоксии в восковой эфир, который подходит в качестве источника биотоплива (Inui et al., 1982; Inui et al., 1983). Чтобы улучшить эти промышленные применения, было выведено E. gracilis для достижения термостабильности и высокой нефтедобычи с использованием облучения ионами Fe в качестве мутагена (Yamada et al., 2016a; Yamada et al., 2016б).
В настоящем исследовании мы получили и охарактеризовали неподвижный мутантный штамм E. gracilis (M3-ZFeL). Мы предположили, что неподвижный мутантный штамм имеет более высокую продукцию парамилона, чем дикий тип, потому что он может сэкономить значительную энергию, которая в основном используется для плавания в условиях дикого типа (Hamilton, Nakamura & Roncari, 1992; Tunçay et al. , 2013). Мы использовали наш ранее установленный метод, который использует облучение пучком ионов Fe в качестве мутагенного агента, для получения неподвижных мутантов E.gracilis (Yamada et al., 2016a; Yamada et al., 2016b). Мы провели скрининг на неподвижные клетки из популяции, облученной пучком ионов Fe, и выбрали M3-ZFeL для дальнейших исследований. Измеряли скорость пролиферации, скорость плавания и седиментации, а также выработку парамилона и воскового эфира M3-ZFeL. Наши результаты продемонстрировали, что облучение пучком ионов Fe и следующий метод скрининга были эффективной стратегией, необходимой для приобретения неподвижных мутантных штаммов E. gracilis , а также потенциал полученного штамма M3-ZFeL для промышленного применения.
Материалы и методы
Штаммы, культуры и среды
Штамм Z дикого типа, который идентичен E. gracilis SAG 1224-5 / 25, был предоставлен коллекцией культур Института прикладной микробиологии (IAM) Токийского университета, Токио, Япония. Мутантный штамм M3-ZFeL, полученный в этом исследовании, депонирован в коллекции микробных культур в Национальном институте экологических исследований (NIES, Tsukuba, JPN) под регистрационным номером NIES-4440.Клетки культивировали с использованием сред Крамера-Майерса (CM) (Cramer & Myers, 1952) и Корена-Хантера (KH) (Koren & Hutner, 1967) для автотрофного и гетеротрофного роста, соответственно, приготовленных при pH 3,5. Среда CM не включает источник углерода, тогда как среда KH включает 12 г L -1 глюкозы и различных органических кислот и аминокислот в качестве источников углерода. Посевную культуру поддерживали в среде KH каждый месяц пересева.
Облучение ионами Fe и скрининг мутантов
Мутантный штамм был получен путем облучения ионами Fe в тех же условиях, что и ранее (Yamada et al., 2016a; Yamada et al., 2016b), а скрининг мутантов был основан на фенотипах водорослей. Два миллилитра суспензии клеток E. gracilis (4 × 10 5 клеток мл -1 ) помещали в мешки для гибридизации, которые были сегментированы на отсеки 5 × 7 см. Затем их облучали ионами Fe (линейная передача энергии [LET]: 650 кэВ мкм -1 ) дозой 50 Гр на фабрике RIKEN RI-beam (Вако, Сайтама, Япония). После одной недели восстановления путем инокуляции культур в культуральную среду KH было проведено два раунда скрининга мутантов.
Примерно 1 × 10 5 мутагенизированных клеток с независимым генетическим фоном помещали на один конец чашки для культивирования, заполненной 10 мл жидкой среды KH с 0,5% метилцеллюлозой, которую добавляли для отверждения и предотвращения неожиданного перемешивания культуры. и освещались с противоположного конца фотонами 50 мкмоль на –2 с –1 флуоресцентного света. После одной недели инкубации культуры после облучения пучком ионов Fe клетки пролиферировали более чем в 100 раз, в результате чего образовалось 1 × 10 7 мутагенизированных клеток, и большинство из них было обнаружено на освещенной стороне посредством фототаксиса.Около 1000 клеток осталось в точке первоначального посева; они были собраны как предполагаемые неподвижные мутантные клетки с помощью микропипетки.
Предполагалось, что собранная популяция будет включать высокую долю подвижных клеток, которые находились в начальной точке инокуляции из-за случайного распространения; поэтому они были подвергнуты второму этапу проверки. Клетки помещали в открытый конец конической пробирки объемом 15 мл, заполненной 5 мл жидкой среды KH с 0.5% метилцеллюлоза, освещенная фотонами 50 мкмоль на –2 с –1 флуоресцентного света и заштрихованная алюминиевой фольгой, за исключением закрывающего конца. После 2 недель статической горизонтальной инкубации в пробирках клетки пролиферировали более чем в 1000 раз. Большинство камер было собрано в незаштрихованном конце, чтобы найти свет. Мы извлекли около 1000 клеток, которые не показывали движения от исходного положения инокуляции, и культивировали их в течение дополнительных двух недель.
Пролиферированные клетки были случайным образом изолированы с использованием сортировки клеток, активируемой флуоресценцией (MoFlo XDP; Beckman Coulter, Brea, CA, USA), для создания клональных линий в отдельных лунках 96-луночных планшетов (Tissue Culture Test Plate; TPP, Trasadingen, CHE) заполнены 200 мкл л среды KH.Популяции без подвижности клеток были отобраны с помощью микроскопических наблюдений при 26 ° C и идентифицированы как штаммы с дефектной подвижностью. Вышеупомянутый скрининг был проведен для двух независимо мутагенизированных популяций. В процессе скрининга клетки пролиферировали более 10 6 раз; следовательно, каждая популяция включала множество генетически идентичных клеток. На основе этой возможности был создан один мутантный штамм из каждой популяции, то есть два штамма были созданы из двух независимых популяций.
Морфологическая характеристика
Клетки наблюдали под прямым световым микроскопом (DM2500B; Leica, Wetzlar, DEU), оборудованным модулем дифференциального интерференционного контраста. Сканирующую электронную микроскопию (SEM) проводили с использованием автоэмиссионного сканирующего электронного микроскопа (SU8200; Hitachi, Tokyo, JPN) после общей подготовки образца. Вкратце, 1 мл культуры в среде KH центрифугировали при 2000 × g в течение 1 мин для сбора клеток.Осажденные клетки предварительно фиксировали добавлением раствора, содержащего 2,5% глутаральдегида, 2% параформальдегида и 0,1 М какодилата натрия, и снова фиксировали с использованием раствора, содержащего 1% четырехокиси осмия и 0,1 М какодилата натрия. Фиксированные образцы были полностью высушены с использованием сушилки для критической точки, покрыты осмием напылением, а затем подвергнуты СЭМ-фотографии.
Для количественного определения доли клеток со жгутиками клетки культивировали в среде CM или KH и использовали в их логарифмической фазе роста для анализа.Для среды CM клетки культивировали в 50 мл среды с использованием пробирки объемом 100 мл, аэрированной 50 мл не менее -1 воздуха, содержащего 5% CO 2 . Для среды KH каждый штамм культивировали в 50 мл среды с использованием конической колбы объемом 100 мл при вращательном встряхивании со скоростью 100 об / мин. Каждую культуру проводили при 26 ° C с постоянным освещением 100 мкмоль м -2 с -1 и субкультивировали каждую неделю для поддержания стабильной пролиферации. Затем клетки фиксировали глутаровым альдегидом (0.025%) и наблюдали на наличие жгутиков под инвертированным микроскопом (CKX41; Olympus, Tokyo, JPN), оборудованным модулем фазового контраста. Чтобы исключить субъективное суждение, короткие и неповрежденные жгутики не дифференцировались и считались клетками со жгутиками.
Тесты роста
Скорость роста водорослей оценивали в пробирках на 100 мл, содержащих 50 мл среды. Клетки инокулировали с начальной оптической плотностью (OD) 0,1 и предварительно культивировали в течение трех дней в конических колбах объемом 100 мл, содержащих среду KH, при непрерывном встряхивании (100 об / мин при 26 ° C и 100 м -2 с -1. постоянного освещения).Затем культивированные клетки собирали центрифугированием при 2000 × g в течение 5 минут и дважды промывали средой KH или CM, которую впоследствии использовали для теста на культивирование. Затем суспензию клеток инокулировали в культуральные пробирки с исходной OD 0,1 и инкубировали при 26 ° C при постоянном освещении 100 мкмоль м -2 с -1 . Культуры KH и CM аэрировали 50 мл не менее -1 воздуха, содержащего 5% CO 2 . ОП от роста культуры определяли с течением времени на спектрофотометре (UVmini-1240; Shimadzu, Kyoto, JPN) при λ 680 нм сразу после помещения суспензии в кювету.
Количественный анализ моторики
Мы использовали микроскопические наблюдения с захватом видеоизображения для количественной оценки подвижности водорослей. Как сообщалось ранее, использовались методы наблюдения и обработки изображений (Ozasa et al., 2011). Мы поместили клетки в суспензии (0,7 мкл, содержащие 300–500 клеток) в замкнутую круглую полидиметилсилоксановую (PDMS) микрокамеру (диаметр 2,49 мм и глубину 140 мкм) и наблюдали изображения с пропусканием света в красном свете и ярким полем. Объектив с 5-кратным увеличением при 26 ° C.В микрокамере было измерено примерно 300–500 клеток. Движения клеток визуализировали путем дифференцирования, установления пороговых значений и последовательного наложения видеоизображений (изображение следа) и оценивали путем подсчета пространственной суммы пикселей следа в изображении следа (Ozasa et al., 2013; Ozasa et al., 2014) . Количество пикселей следа было названо «импульсом следа» (TM) (Ozasa et al., 2013; Ozasa et al., 2014). Скорость измерения значений TM составила 0,67 Гц (один кадр за 1,6 с). Стоимость TM является справедливой мерой всей локомотивной активности, наблюдаемой в камере.Типичные следы плавания были индивидуально наложены на изображение распределения клеток и подготовлены в виде двоичного изображения для демонстрации плавательной активности клеток (Ozasa et al., 2016).
Седиментационный анализ
Скорость оседания клеток в средах KH и CM при 26 ° C оценивали в микропробирках объемом 1,5 мл. Культуру готовили, как указано выше для анализа морфологии. Вкратце, когда использовалась среда CM, клетки культивировали в пробирках объемом 100 мл с аэрацией, тогда как со средой KH их культивировали в конической колбе объемом 100 мл с роторным встряхиванием со скоростью 100 об / мин.Каждую культуру проводили при постоянном освещении (100 мкмоль м -2 с -1 ). Среднее значение OD культуры при λ 680 нм составляло 23,4 и 22,0 для культуры KH и 4,1 и 4,4 для культуры CM штаммов дикого типа и M3-ZFeL, соответственно. Изображения суспензии клеток в каждой микротрубочке получали с интервалом 1–5 мин с помощью обычной компактной цифровой камеры. Прозрачная область супернатанта была обнаружена и количественно оценена по изображениям с использованием программного обеспечения Image J, при этом пороговые значения были установлены от 0 до 50 после преобразования в оттенки серого.Идентичные прямоугольные области были выбраны внутри изображений изображений микропробирок, и прозрачная область внутри каждой области была определена количественно.
Для оценки скорости седиментации на глубине 20 см штаммы E. gracilis дикого типа и мутантные штаммы M3-ZFeL культивировали в кубовидных акриловых стаканах (10 × 10 × 30 см) с использованием 2 л среды CM при 29 ° C. и 1300 мкмоль м −2 с −1 верхнего освещения (соотношение света и темноты 12:12 ч). Стаканы были заполнены примерно такими же концентрациями (г л -1 ) клеток, 0.37 и 0,32 г L -1 для штаммов 3ZFeL дикого типа и M — соответственно. После перемешивания культуры периодически наблюдали седиментацию в течение 3,5 ч, и супернатант осторожно удаляли для получения концентрированной культуры. Затем количественно определяли концентрацию осадка путем взвешивания высушенных клеток после фильтрации с помощью стекловолоконного фильтра (GA-55; ADVANTEC, Tokyo, JPN).
Количественное определение углеводов и липидов
Собранные клетки водорослей сушили вымораживанием (FDV-1200; EYELA, Tokyo, JPN) и депротеинизированные парамилон и липидные компоненты экстрагировали, как сообщалось ранее (Inui et al., 1982; Судзуки и др., 2015). Высушенные клетки (10 мг) дважды обрабатывали ультразвуком в 10 мл ацетона в течение 90 с (UD-201; TOMY, Tokyo, JPN) с установкой шкалы на 4 в объеме 50 мл пластиковых центрифужных пробирок. Затем парамилон отделяли от остаточных компонентов центрифугированием, кипятили в течение 30 мин в 10 мл 1% водного раствора додецилсульфата натрия и дважды промывали 10 мл воды. Затем экстрагированный парамилон был количественно определен с помощью фенол-сернокислотного метода (Montgomery, 1957), который позволяет количественно определить общее количество углеводов.Точно так же нейтральные липиды экстрагировали из 100 мг высушенных клеток с использованием н-гексана в качестве растворителя; К высушенным клеткам в стеклянных центрифужных пробирках на 50 мл добавляли 10 мл н-гексана. Затем суспензию гомогенизировали в течение 90 с с использованием ультразвукового аппарата (UD-201; TOMY, Tokyo, JPN) с установкой шкалы на 4, а затем фильтровали с помощью куска стекловолоконной фильтровальной бумаги (GF / C; Whatman, Little Chalfont, Buckinghamshire). , Великобритания) с последующей дополнительной стадией экстракции остатка. После выпаривания собранного органического растворителя, растворяющего липиды, массу остатка, оставшегося в колбе, определяли количественно как массу экстрагированного общего нейтрального липида.
Статистический анализ
Результаты с планками ошибок, за исключением количественной оценки подвижности, представлены как среднее ± стандартная ошибка из трех независимых экспериментов. Результаты количественной оценки подвижности представлены в виде среднего значения ± стандартное отклонение (SD) для всех измеренных временных точек. Статистическая значимость была проанализирована с использованием критерия Стьюдента t . Для множественных сравнений были применены поправки Бонферрони. p <0.05 считалось значительным.
Результаты
Характеристика M3- ZFeL
Путем нашего скрининга неподвижных мутантов E. gracilis мы установили два мутанта с независимым генетическим фоном. Мутантные штаммы были названы M3-ZFeL и M — 4 ZFeL в соответствии с типичной номенклатурой (Schiff, Lyman & Russell, 1980) с фенотипическим обозначением «M» для подвижности и обозначением мутагена «Fe» для Fe. -ионное облучение (Ямада и др., 2016а). Штамм M3-ZFeL показал стабильный поведенческий фенотип и поэтому был использован в этом исследовании.
Штамм E. gracilis M3-ZFeL показал неподвижный фенотип с небольшими дефектами пролиферации. Этот фенотип был идентифицирован по образованию колоний в результате посева одноклеточных клеток в жидкой культуре. Штамм M3-ZFeL показал образование колоний в жидкой культуральной среде KH через неделю, тогда как клетки дикого типа были диспергированы в той же культуральной среде (фиг. 1A и 1B).По данным световой и электронной микроскопии, клетки M – 3 ZFeL были более округлыми, чем клетки дикого типа. Кроме того, жгутики M3-ZFeL были короче, чем у дикого типа (Figs. 1C-1F). Более того, значительно более высокая доля клеток M3-ZFeL не содержала жгутиков как в CM ( p = 5,6 × 10 −5 , t (4) = 15,1), так и в KH ( p = 0,04, t (4) = 2,29) среды (рис. 1G и 1H).
Рисунок 1: M3-ZFeL и штаммы дикого типа
Euglena gracilis в статической культуре. (A и B) Фотографии колоний дикого типа (A) и M3-ZFeL (B), выращенных в среде Корена-Хантера (KH) на 96-луночном планшете в течение одной недели. (C – F) Микрофотографии (C и D) и микрофотографии с помощью сканирующего электронного микроскопа (E и F) клеток дикого типа (C и E) и M3-ZFeL (D и F), культивированных в конических колбах объемом 100 мл, содержащих среду KH с непрерывное встряхивание (100 об / мин, 26 ° C и 100 мкмоль м -2 с -1 при постоянном освещении). Шкала показывает 20 мкм. (G и H) Доля клеток, обладающих жгутиками, среди клеток дикого типа и клеток M3-ZFeL в средах Крамера – Майерса (CM) (G) и KH (H).За один день наблюдали более 200 клеток для каждого состояния. Наблюдения проводились трижды в разные дни. Планки погрешностей показывают стандартные ошибки для трех повторов. * p <0,05, тест Стьюдента t -тест.Скорость автотрофного и гетеротрофного роста штаммов дикого типа и штаммов M – 3 ZFeL оценивали с использованием культуральных сред KH и CM (рис. 2). Мутантный штамм показал немного более медленный и более быстрый рост, чем штамм дикого типа в культурах KH и CM, соответственно.OD культуры M3-ZFeL на третьем ( p = 0,020, t (4) = -5,81) и четвертом ( p = 1,5 × 10 -4 , t (4) = -20,48 ) дней культивирования KH, которое включало большое количество глюкозы, были значительно ниже, чем дни культивирования дикого типа (рис. 2А). С другой стороны, OD на втором ( p = 0,020, t (4) = -6,13), четвертом ( p = 0,042, t (4) = -4,98) и одиннадцатом ( p = 0,036, t (4) = −5.18) дней культивирования CM было значительно больше, чем у культур дикого типа (фиг. 2B).
Рисунок 2: Кривые роста M3-ZFeL и штаммов дикого типа
Euglena gracilis . (A и B) Кривые роста штаммов дикого типа (белый) и M3-ZFeL (зеленый) на гетеротрофной KH (A) и автотрофной среде CM (B). Исходную культуру высевали в среду с оптической плотностью 0,1, измеренной при λ 680 нм. Рост определяли на 0, 1, 2, 3, 4, 6, 7, 8 и 9 дни после начала культивирования Корена-Хантера (KH), тогда как на 0, 1, 2, 4 дни. , 5, 7, 8, 10, 11, 14 и 15 после начала культивирования Крамера – Майерса (CM).Тест на рост был проведен в трех повторностях с использованием трех независимых пробирок. Планки погрешностей указывают стандартные ошибки для этих трех повторов. * p <0,05, тест Стьюдента t с поправкой Бонферрони.Наша количественная оценка подвижности показала, что значения M3-ZFeL TM были менее одной тысячной, чем у дикого типа. После предыдущих исследований клетки, культивированные в жидкой среде KH, должным образом перемешивали и подвергали измерениям TM. На рис. 3А показано распределение клеток и следы плавания примерно за 8 с.Отсутствие следов плавания для мутантного штамма показало, что клетки не могли перемещаться, используя свои жгутики. Общее значение TM ± SD для штамма дикого типа составляло 11 161 ± 269 для 368 клеток, тогда как для M3-ZFeL было только 9 ± 6 для 467 клеток, как показано на фиг. 3B. Значение TM для мутантного штамма нельзя отличить от шума измерения, что указывает на то, что штамм M3-ZFeL был почти полностью неподвижным. Хотя некоторые из клеток M3-ZFeL обладали коротким жгутиком (Figs. 1C-1H), наши результаты показали, что короткий жгутик функционирует плохо.
Рисунок 3: Количественная оценка подвижности M3-ZFeL и штаммов дикого типа
Euglena gracilis с использованием следового импульса (TM). (A – B) Распределение клеток и отслеживание плавания в течение примерно 8 с для штаммов дикого типа (A) и M3-ZFeL (B). Оба типа клеток выращивали в гетеротрофной (KH) среде и измеряли во время фазы логарифмического роста. Увеличенные изображения областей внутри квадратов показаны в нижнем левом углу панелей. Диаметр этих кругов примерно 2.5 мм. Зеленые точки и светло-зеленые линии обозначают клеток E. gracilis и их следы соответственно. (B) Подвижность штаммов дикого типа и M3-ZFeL, оцененная с использованием TM. TM получали каждые 1,6 с и усредняли за 10 мин. Планки погрешностей показывают стандартное отклонение для 500 временных точек.Потенциал M3− ZFeL для промышленного применения
M3-ZFeL продемонстрировал более быстрое осаждение, чем дикий тип в 1,5 мл микропробирках. Как показано на рис.4, скорость оседания клеток M3-ZFeL была выше, чем у клеток дикого типа как в гетеротрофных (фиг. 4A), так и в автотрофных (фиг. 4B) условиях роста с использованием сред KH и CM, соответственно. Значения в конечный момент времени (40 мин) значительно различались как при гетеротрофном ( p = 0,010, t (4) = -3,69), так и при автотрофном ( p = 0,011, t (4) = −3.60) условий (рис. 4A и 4B).
Рисунок 4: Скорость седиментации M3-ZFeL и штаммов дикого типа
Euglena gracilis . (A и B) Скорость седиментации дикого типа (белый) и M3-ZFeL (зеленый) в средах Корена-Хантера (KH) (гетеротрофная; A) и Крамера-Майерса (CM) (автотрофная; B). Фотографии суспензии клеток делали каждые 1 мин для измерения прозрачной площади в каждой пробирке объемом 1,5 мл. После осаждения клеток супернатант становится прозрачным, и площадь на фотографии использовали для оценки скорости оседания. Планки погрешностей показывают стандартные ошибки для трех повторов. а.е., условная единица.Путем анализа седиментации в крупномасштабной культуре было обнаружено, что M3-ZFeL является полезным для промышленного сбора урожая. Для оценки влияния быстрой седиментации на сбор клеток, культивируемых с использованием фотосинтеза, штаммы дикого типа и M3-ZFeL культивировали с использованием среды CM, и скорость их оседания измеряли в мензурках глубиной 20 см. Клетки M3-ZFeL показали значительно более высокую скорость оседания, чем клетки дикого типа (фиг. 5). Плотность клеток M3-ZFeL на дне стакана (34.1 г L -1 ), было более чем в 10 раз больше, чем у дикого типа (3,0 г L -1 ).
Рисунок 5: Скорость оседания
клеток Euglena gracilis в мензурках глубиной 20 см. (A) Автотрофные культуры штаммов дикого типа (слева) и M3-ZFeL (справа) суспендировали в 2-литровых стаканах и оставили стоять в статических условиях в течение 3,5 часов. Для культивирования использовали среду Крамера – Майерса (CM). (B) Осадок до и после 3,5 ч осаждения.Клетки, которые были извлечены из дна стакана и количественно определены по их сухому весу, обозначены стрелкой на (A).Накопление парамилона в клетках M3-ZFeL было равно или больше, чем в клетках дикого типа, тогда как накопление липидов в клетках M3-ZFeL было меньше (автотрофно) или равно (гетеротрофно), чем в клетках дикого типа. клетки. Как показано на фиг. 6A и 6B, клетки M3-ZFeL продуцировали большее количество парамилона (1,6 раза; p = 0.033, t (4) = -2,51), чем клетки дикого типа в автотрофных условиях, тогда как не было значительных различий в гетеротрофных условиях. Напротив, штамм M3-ZFeL показал более низкое содержание липидов, чем штамм дикого типа, особенно в автотрофных условиях ( p = 0,034, t (4) = -2,47). (Фиг.6C и 6D).
Рисунок 6: Хранение Paramylon и содержание липидов M3-ZFeL и штаммов дикого типа
клеток Euglena gracilis . (A – D) Запасы парамилона (A и B) и содержание липидов (C и D) в штаммах дикого типа (белый) и M3-ZFeL (зеленый), культивируемых в гетеротрофных (A и C) и автотрофных (B и D) ) СМИ. Парамилон и липид экстрагировали и определяли количественно из лиофилизированных клеток и рассчитывали их процентный вес. Клетки собирали во время фазы их логарифмического роста. Масштаб оси Y на каждом рисунке разный. Планки погрешностей показывают стандартные ошибки для трех повторов. * p <0.05, Студенческая т -тест.Обсуждение
Считается, что неподвижный и быстрый седиментационный фенотип мутантного штамма M3-ZFeL имеет сильную корреляцию с потерей отрицательного гравитаксиса. E. gracilis дикого типа демонстрировал положительный и отрицательный гравитаксис, который зависел от его экологического и клеточного статуса (Stallwitz & Hader, 1994; Lebert et al., 1999). Недавние исследования показали, что E. gracilis дикого типа использует механо-чувствительные белки и биение жгутиков, чтобы оставаться на предпочтительной глубине воды (Häder & Hemmersbach, 2017), а не использовать контроль плавучести.Поскольку клетки M3-ZFeL были неспособны к биению жгутиков, они не могли использовать отрицательную гравитаксис для предотвращения опускания. Кроме того, сильно накопленный парамилон, плотность частиц которого составляет приблизительно 1,5 в клетках M3-ZFeL, также может способствовать увеличению их удельного веса и опусканию в автотрофных условиях. Наши седиментационные тесты показали, что более быстрое осаждение клеток M3-ZFeL достигается не только в небольших микропробирках, но и внутри более глубокого резервуара, что является преимуществом для промышленного сбора.Обычно клетки в гетеротрофных культурах оседают быстрее, чем в автотрофных культурах, вероятно, из-за более высокого накопления углеводов. Однако наши результаты в микропробирках показали, что оба штамма оседали быстрее в автотрофной культуре, чем в гетеротрофной. По-видимому, это связано с различиями в плотности клеток в культурах; укладка высококонцентрированных клеток на дно культуры KH ингибировала дальнейшее осаждение клеток.
Движение жгутиков обусловлено движущей силой дублетных микротрубочек и динеина в жгутике.Дефекты в динеине, аксонемных белках или родственных компонентах приводят к отсутствию движения жгутиков (Turner, 2006; Wang et al., 2014). Мы еще не идентифицировали компонент или, более конкретно, ген, ответственный за неподвижность мутантного штамма M3-ZFeL. Однако отсутствие подвижности, возможно, снижает потребление клеточной энергии и гликолиз. Сообщается, что такое подавление приводит к усиленному накоплению крахмала в Chlamydomonas (Hamilton, Nakamura & Roncari, 1992; Tunçay et al., 2013), что может объяснить, почему большее хранение парамилона наблюдалось в клетках M3-ZFeL.
Штамм M3-ZFeL показал немного более медленный рост в гетеротрофной культуре KH, чем в культуре дикого типа, что позволяет предположить, что функция метаболизма глюкозы была слегка нарушена у мутанта. Между тем, штамм M3-ZFeL показал более быстрый рост в автотрофной культуре CM, которая не включала источники углерода, что позволяет предположить, что мутантный штамм имел интактную систему фотосинтеза и потреблял фотосинтезированные ресурсы медленнее, чем дикий тип.Более того, M3-ZFeL не имел дефектов в производстве парамилона, что указывает на то, что M3-ZFeL может улучшить промышленное производство парамилона. Хотя наблюдался ограниченный дефект в накоплении липидов, M3-ZFeL также может быть применим для продукции липидов. Более высокое накопление парамилона в M3-ZFeL может быть частично связано с сохранением энергии за счет отказа от плавания. Однако, поскольку скорость распространения M3-ZFeL не была значительно выше, чем у дикого типа, даже в автотрофной культуре, степень сохранения энергии в M3-ZFeL не кажется значительной.
Результаты характеристики M3-ZFeL предполагают, что мутант дефектен по компонентам, связанным с движением и / или формированием жгутика, которые не являются критическими для выживания и пролиферации, по крайней мере, в контролируемых лабораторных условиях. Получение мутантных штаммов с помощью мутагенеза с использованием облучения с высокой ЛПЭ, такого как облучение ионами Ar или Fe, выгодно, поскольку оно вызывает небольшое количество крупных делеций в геноме с небольшим количеством побочных мутаций (Hirano et al., 2015; Kazama et al., 2017). Хотя мы не смогли идентифицировать генетическую причину фенотипа в M3-ZFeL, процесс селекции этих штаммов обеспечивает минимальные побочные мутации. Это даст возможность немедленного промышленного использования штамма за счет уменьшения возможности проявления неожиданных и нежелательных признаков, которые могут не наблюдаться в лаборатории, но проявляются в суровых и нестабильных условиях выращивания на открытом воздухе.
Мутант M3-ZFeL E. gracilis , полученный в этом исследовании, является очень многообещающим для промышленного производства пищевых ингредиентов и химических веществ, поскольку он продемонстрировал быстрое осаждение, высокое хранение парамилона и скорость роста, сравнимую со скоростью роста дикого типа. , по крайней мере, в автотрофных условиях.В частности, быстрое осаждение мутантного штамма сэкономит время и энергию во время процессов сбора урожая, что будет способствовать использованию E. gracilis в качестве сырья для биотоплива за счет улучшения баланса между затрачиваемой на его производство энергии и выход энергии. При практическом выращивании парамилона и липидов в автотрофных условиях добавляются процессы накопления соответствующих ингредиентов. В частности, культивируемые клетки подвергаются ограничению по азоту для накопления парамилона; Затем культура конденсируется и подвергается гипоксическому кондиционированию для ферментации парамилона до сложного эфира воска (Suzuki, 2017).Наши результаты показали, что M3-ZFeL может компетентно накапливать большее количество парамилона в гетеротрофных условиях культивирования, чем в автотрофных; поэтому мы предполагаем, что они также демонстрируют достаточное накопление парамилона за счет ограничения азота (Briand & Calvayrac, 1980; Sumida et al., 1987), что делает возможным последующее накопление воскового эфира (Inui, Ishikawa & Tamoi, 2017). Напротив, свойство быстро опускающихся клеток может вызывать осаждение в промышленных прудах для культивирования во время культивирования.Чтобы проверить это и улучшить метод массового выращивания, необходимы дальнейшие эксперименты с использованием практических прудов для выращивания на открытом воздухе.
Помимо стоимости производства неподвижные клетки имеют то преимущество, что их легко наблюдать и манипулировать ими в ограниченной области под микроскопом. Это будет полезно для дальнейших фундаментальных исследований E. gracilis , которые должны включать длительную оценку конкретной клетки, например, наблюдение ее основных физиологических явлений, таких как деление клетки (рис.S1 и Supplemental Movie), а также микроманипуляции с отдельными клетками, например, посредством электропорации отдельных клеток, для доставки генов и белков в клетки (Ohmachi et al., 2016).
Выводы
Это исследование продемонстрировало успешное получение мутанта с дефектной подвижностью микроводоросли E. gracilis , который в последние годы стал использоваться в промышленности. Приобретенный мутант демонстрировал амебную подвижность, но не плавал с использованием жгутика, и накапливал больше углеводов, чем дикий тип в условиях автотрофного культивирования.Однако результаты роста показали, что сохранение энергии из-за неподвижного фенотипа не было значительным. Вместо этого из-за неспособности мигрировать и накопления углеводов с высоким удельным весом клетки оседали быстрее во время инкубации. Эта черта указывает на возможность экономии энергии при уборке урожая за счет естественного процесса осаждения. Следовательно, полученный мутант E. gracilis с дефектной подвижностью и его производные могут быть полезны для промышленного производства E.Грейсилис .
Дополнительная информация
Наблюдение за делением клеток в ячейке M
— 3 ZFeL ячейкаПокадровые изображения E. gracilis M — 3 штамма ZFeL были сфотографированы в течение 4 часов с интервалом в 1 минуту. Десять изображений были извлечены и обрезаны, чтобы выделить состояние делящейся клетки. Время, показанное в левом нижнем углу каждой панели, указывает время истечения времени. Желтые треугольники обозначают ячейку в делении.Шкала показывает 50 мкм.
DOI: 10.7717 / peerj.10002 / supp-1Наблюдение за делением клеток в ячейке M
— 3 ZFeL ячейкаВидео было создано путем соединения покадровых изображений E. gracilis M — 3 штамм ZFeL, сфотографированных в течение 4 часов с интервалами в 1 минуту.
DOI: 10.7717 / peerj.10002 / supp-2Euglena — микроводоросли — будущее продуктов питания и энергии
Изменение климата может создать серьезные проблемы и ограничения в нашей жизни в ближайшем будущем: нехватка продуктов питания, повышенная подверженность риску для здоровья, необходимость избегать использования ископаемых видов топлива и повышать энергоэффективность и т. Д. (1).
Но есть одна вещь, которая может решить большинство проблем: эвглена, микроводоросли размером 0,05 мм.
Компанияeuglena Co., Ltd (Euglena Co.), базирующаяся в Токио, Япония, была основана в 2005 году и стала первой компанией в мире, которая добилась успеха в массовом производстве эвглены на открытом воздухе (2). Euglena Co. стала публичной, разместив себя на Токийской фондовой бирже MOTHERS («Рынок быстрорастущих и развивающихся акций») 20 декабря 2012 года и перешла из MOTHERS в первую секцию биржи 3 декабря 2014 года (3 ), а цена акций взлетела после IPO до сегодняшнего уровня, примерно в девять-десять раз выше цены первого дня, поскольку люди видят множество возможностей, которые несет эвглена.
Ожидается, что крошечная эвглена будет использоваться широко:
1. Как пищевые продукты и источники питательных веществ
Говорят, что глобальное потепление плохо повлияет на наш доступ к воде и приведет к сокращению производства продуктов питания. Более того, поскольку большая часть выбросов CO2 приходится на сельскохозяйственную деятельность, представленную животноводством, текущие методы ведения сельского хозяйства могут потребовать пересмотра, в то время как миру потребуется все больше и больше продуктов питания из-за ожидаемого роста населения.
Euglena может стать ключом к решению этой сложной ситуации. Поскольку эвглена имеет гибридные признаки как растения, так и животного, в то время как эвглена фотосинтезирует, потребляя CO2, как растение, она содержит белки и жиры (4).
Кроме того, он содержит до 59 питательных веществ, эффективно усваивается и усваивается нашим организмом и имеет больше достоинств, а компания Euglena Co. описывает эвглену как «суперпродукт» (5).
Список 59 питательных веществ, содержащихся в эвглене (5)
источник: Euglena Co.сайт
Теперь вы можете купить продукты из эвглены на их веб-сайте ЕС «Ферма эвглена (http://www.euglena-farm.jp/Index)». Кроме того, поскольку эвглена может производиться при сокращении выбросов CO2, она имеет огромный потенциал в качестве пищи и источника питательных веществ в мире будущего со многими ограничениями.
Кроме того, эвглена может использоваться в качестве корма для животных вместо сельскохозяйственных культур. Это будет способствовать не только изменению вышеупомянутых методов ведения сельского хозяйства, но и повышению качества и состояния здоровья домашнего скота (6).Поскольку эвглена может производиться при одновременном сокращении выбросов CO2, она имеет огромный потенциал в качестве пищи и источника питательных веществ в мире будущего со многими ограничениями.
2. Как зеленые технологии
Хотя упомянуто немного выше, еще одна особенность эвглены, на которую мы должны обратить внимание, — это ее высокая способность улавливать СО2 и превращать его в кислород; он в два-три раза эффективнее тропических лесов на акр. Euglena Co. работает с другими организациями, чтобы использовать эту функцию для очистки промышленных загрязнений (7).
источник: сайт Euglena Co.
Эвглена может быть инструментом, который более непосредственно воздействует на причины изменения климата, превращая CO2 в кислород или растворяя выбрасываемые загрязнители.
3. В качестве альтернативного топлива
В то время как эвглена уже поставлялась в качестве продуктов питания, Euglena Co. с большим энтузиазмом относится к потенциалу эвглены как биотоплива. Euglena Co. сотрудничает с некоторыми компаниями, такими как Isuzu Motors Ltd. и ANA Holdings Inc.В конце прошлого года Euglena Co. объявила, что к 2018 году создаст демонстрационный завод и начнет коммерческое производство в 2020-х годах, а ANA Holdings Inc., одна из двух крупных авиакомпаний Японии, будет использовать его в составе топливной смеси. (8).
Хотя компания Euglena Co. все еще работает над повышением производительности, доступ к альтернативным видам топлива, которые не выделяли бы CO2, больше не является фантастикой в далеком будущем.
Хотя борьба с изменением климата — огромная проблема, которую многие организации во всем мире должны серьезно принять и решить, одно предприятие в Токио с созданием микроподобного растения может изменить правила игры.
(652 слова)
Источник:
(1) Ребекка М. Хендерсон, Софус А. Райнерт, Полина Дехтяр, Амрам Мигдал. «Изменение климата в 2016 году: последствия для деловой программы». Гарвардская школа бизнеса. Октябрь 2016.
(2) euglena Веб-сайт: О водорослях Euglena. https://www.euglena.jp/en/labo. По состоянию на 3 ноября 2016 г.
(3) euglena Веб-сайт: IR News (только на японском языке). https://www.euglena.jp/info/2012/1116.html и https: // www.euglena.jp/info/2014/1210.html. По состоянию на 3 ноября 2016 г.
(4) Джефф Ян, «Будущее еды в Токио?» Wall Street Journal. http://blogs.wsj.com/speakeasy/2013/07/25/is-this-the-future-of-food/. По состоянию на 3 ноября 2016 г.
(5) euglena Веб-сайт: Nutrition Capability. https://www.euglena.jp/en/solution. По состоянию на 3 ноября 2016 г.
(6) euglena Веб-сайт: Food & Feed. https://www.euglena.jp/en/solution/foods.html. По состоянию на 3 ноября 2016 г.
(7) euglena Веб-сайт: Переработка отходов для роста. https://www.euglena.jp/en/solution/environment.html. По состоянию на 3 ноября 2016 г.
(8) Крис Купер, «Эвглена взлетает после того, как заявила, что будет поставлять топливо из водорослей для ANA» Bloomberg. http://www.bloomberg.com/news/articles/2015-12-02/euglena-soars-after-saying-it-will-supply-algae-fuel-to-ana. По состоянию на 3 ноября 2016 г.
Идентификация жгутикового белка, участвующего в гравитаксисе жгутиков Euglena gracilis
Условия культивирования и роста клеток
Экспериментальный организм , Euglena gracilis KLEBS, штамм Z, был получен из коллекции культур водорослей в Университете Геттингена. Германия 19 .Все эксперименты проводились с культурами аксенических клеток, выращенными на органической среде 20 . Культуры выращивали при 20 ° C при непрерывном освещении с интенсивностью 54 мкмоль / (m -2 с -1 ) от смешанных холодных белых и теплых тонов люминесцентных ламп.
Анализ движения
Анализ движения был выполнен с использованием программного обеспечения отслеживания клеток, Wintrack 2000 21 в сочетании с изготовленным на заказ устройством (Manual Ecotox), которое состоит из микроскопа с горизонтальным ходом луча и камеры CCD для наблюдения за движением клеток. относительно направления вектора гравитации.Светодиод синего света обеспечивает фототаксический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки были перенесены в изготовленную на заказ одноразовую стеклянную кювету (два плоских предметных стекла, склеенных U-образной двойной липкой лентой, с пространством между ними для заливки клеточной суспензии) и помещены вертикально в горизонтальный микроскоп для определения гравитактической ориентации. . Поступающие видеоизображения анализировались программным обеспечением Wintrack 2000 для определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и т. Д.).) и статистические параметры плавательных ячеек одновременно. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все ячейки плавают случайным образом) до 1 (когда все ячейки плавают в одном направлении). Движение наблюдаемых ячеек представлено в виде круговой гистограммы с 64 угловыми секторами 23 . Направление вверх на гистограмме (0 °) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество ячеек, движущихся в соответствующем направлении.
Молекулярно-генетический анализ
Суммарную РНК экстрагировали с помощью реагента Trizol (Invitrogen, каталожный номер 15596-026), и ее концентрацию оценивали спектрофотометрически с использованием нанокапельного фотометра (Thermoscientific, США). Культуру мутантных клеток с нокдауном оценивали путем количественной оценки уровней экспрессии мРНК с помощью ПЦР в реальном времени. Равное количество общей РНК транскрибировали в кДНК с использованием набора для обратной транскрипции QuantiTECT (Qiagen). Количественную оценку уровней мРНК проводили в системе обнаружения ПЦР в реальном времени CFX96 TouchTM с использованием наборов для ПЦР QuantiTect SYBR Green (Qiagen, отжиг / удлинение в течение 30 секунд при 60 ° C, 40 циклов).КДНК разводили (1: 3 или 1: 500) деионизированной водой перед ПЦР, и специфичные для генов праймеры (перечисленные в дополнительной таблице 2) использовали для амплификации, тогда как актин использовали в качестве контрольного гена.
Для исследований сайленсинга генов был принят подход РНКи. Последовательность целевого гена амплифицировали (праймеры, перечисленные в дополнительной таблице 2) с использованием полимеразы Taq. Амплифицированный продукт ПЦР лигировали с синтезированным на заказ промотором Т7 с использованием фермента ДНК-лигазы Т4 (New England BioLabs).Продукт ПЦР, конъюгированный с промотором Т7, использовали для генерации дцРНК с использованием набора MEGAscript® RNAi Kit (Ambion). Впоследствии приблизительно 10 6 клеток на 100 мкл органической среды трансформировали электропорацией с помощью 15–20 мкг дцРНК для получения мутантных клеток с нокдауном, тогда как контрольные клетки подвергали электропорации только с помощью буфера для элюции. Электропорацию проводили, как описано ранее 11,24,25 .
Для проведения RACE PCR общую РНК экстрагировали, как описано выше, и проводили синтез кДНК с использованием набора для синтеза кДНК Mint2 (Evrogen), как описано Frohman 26 .Набор специфичных для гена смысловых и антисмысловых праймеров (перечисленных в дополнительной таблице 2) был разработан для нацеливания на известную последовательность гена различной длины. Для проведения 5′-RACE ПЦР использовали специфические для генов антисмысловые праймеры в сочетании с кэп-праймером индивидуальной конструкции, который закрепляет транс-сплайсинговую 5′-кэп-структуру, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier и др. . 27 , тогда как 3′-RACE PCR выполняли с использованием специфичных для генов смысловых праймеров и специально сконструированного праймера oligo-dT с двумя вырожденными нуклеотидами.Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и FirstChoice® RLM-RACE Kit от Ambion).
Экспрессия плазмидных конструкций
Полноразмерная кодирующая область CaM2 (номер доступа EU935858) была амплифицирована, и рестриктированный продукт был лигирован в pGBKT7 (Clonetech) для экспрессии под промотором Т7. Аналогично, полноразмерная кодирующая область CaM2 и EgPCDUF4201 была амплифицирована и лигирована в pCR ™ II-Blunt-TOPO® (Invitrogen).Впоследствии вставки подвергали рестриктазу и субклонировали в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния с GST под промотором TAC. Кроме того, две усеченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и лигированы сначала в pCR ™ II-Blunt-TOPO® и субклонированы в pGADHA (Dualsystemsbiotech) для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием ДНК-полимеразы корректирующего считывания Phusion (Thermo Scientific).
Конструирование библиотеки кДНК
E. gracilis и двугибридный скрининг дрожжейДля определения партнера по взаимодействию CaM2 проводили двугибридный скрининг дрожжей с использованием нормализованной библиотеки кДНК E. gracilis . Для создания библиотеки кДНК РНК была извлечена из клеток E. gracilis , подвергшихся различным химическим и физическим нагрузкам (тяжелые металлы, ультрафиолетовый свет, высокий свет, культура клеток в разном возрасте, в условиях микрогравитации, на клиностате и т.). Экстрагированные образцы РНК были объединены и предоставлены коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в домен активации (AD), содержащий плазмиду pGAD-HA (Mobitech). Штамм Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой, pGBKT7-CaM2, с использованием метода полиэтиленгликоля (ПЭГ) / ацетата лития / одноцепочечной ДНК-носителя, как описано ранее в 29 .Затем культуру дрожжевых клеток трансформанта-приманки повторно трансформировали 50 мкг библиотеки кДНК, используя протокол трансформации в масштабе библиотеки, как описано в руководстве пользователя двухгибридной системы MatchMaker GAL4 (Clonetech). Эффективность трансформации дрожжевых клеток определяли на планшетах SD-TL, тогда как взаимодействие между двумя белками определяли на селективной среде SD-TLAH. Аналогичным образом взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селективной среде SD-TLAH.Автоактивацию белка-приманки или жертвы определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами.
Антитела
Производство индивидуальных антител против CaM2 было поручено коммерческой фирме SDIX, США. Антитело получали с использованием подхода геномных антител против 91 аминокислоты (58–148) CaM2 30 . Аналогичным образом производство неочищенной мышиной антисыворотки против белка E. gracilis , содержащего домен с неизвестной функцией (EgPCDUF4201), было передано на внешний подряд коммерческой фирме Eurogenetec, Бельгия.Антисыворотку против EgPCDUF4201 получали с использованием метода иммунизации генетической ДНК против всего белка. Также использовали антитело против альфа-цепи тубулина кролика (Каталожный № AS10 680, Agrisera, Швеция) и антитело против мышиного глутатион-S-трансферазы (GST) (Sigma Aldrich, США). А также коммерчески доступные антитела против кроличьего IgG-пероксидазы (Sigma Aldrich, США), антитела против мышиного IgG-пероксидазы (Sigma Aldrich, США) и Alexa Fluor® 488-Anti-Rabbit IgG (H + L) (иммунные исследования Джексона. лаборатории, США) были использованы в качестве вторичных антител в этом исследовании.
Подготовка проб белка из
E. gracilisКлетки собирали центрифугированием (11000 × g, 10 мин) и дважды промывали деионизированной водой. Осадок клеток суспендировали в буфере для лизиса (40 мМ Tris-HCl, pH 8) с добавлением смеси ингибиторов протеаз и фосфатаз (10 мкл мл -1 , номер продукта 78443, Thermoscientific). Разрушение клеток осуществляли с помощью ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и генератор HF, GM 2070, Германия), подавая три импульса по 20 с при 35% -ной интенсивности от общей мощности.На протяжении всего процесса образцы хранили на льду в холодной камере (4 ° C). Полученный неочищенный лизат ресуспендировали в 100% ацетоне (в три раза превышающем объем клеточного лизата) и осаждение белка проводили при -20 ° C в течение ночи. Осажденную фракцию белка осаждали центрифугированием (24000 g, 4 ° C, 1 час) и дважды промывали 80% ацетоном. Осушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевина, 2 М тиомочевина, 2% CHAPS, 40 мМ DTT) и переносили в 1.Микроцентрифужная пробирка объемом 5 мл и солюбилизацию белка проводили в течение 1 ч (30 ° C, 1400 циклов / мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем фракцию солюбилизированного белка собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию образцов белка определяли с помощью анализа Брэдфорда 31 .
SDS-PAGE и иммуноблоттинг
SDS-PAGE выполняли, как описано Laemmli 32 . Разделение образцов белка проводили в 12% полиакриламидном геле SDS.Гели полиакриламида SDS окрашивали с использованием раствора кумасси бриллиантового синего R250 для анализа, как описано ранее 33 для визуального наблюдения. Для иммуноблоттинга образцы белка из SDS-PAGE переносили на мембрану из поливинилиденфторида (PVDF) (Roti®-Fluoro PVDF, размер пор 0,2 мкМ, Carl Roth, Германия) с использованием Trans-Blot SD Semi Dry Transfer Cell (Bio-Rad , США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном физиологическом растворе (вес / объем) с 0.5% твина 20 (об. / Об.) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхиванием (20 циклов / мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов / мин), затем трижды промывали буфером TBS-T в течение 10 минут и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения повышенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7 ™ Advance Chemiluminescence (Peqlab, Германия).
Фракционирование органелл
Разделение жгутиков и тела клетки проводили с использованием метода, описанного в 34 , с использованием 15 л поздней логарифмической культуры клеток. Первоначально метод был разработан для выделения жгутиков, связанных с парафлагеллярным телом (PFB). Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка.
Конфокальная микроскопия непрямой иммунофлуоресценции
Для анализа непрямой иммунофлуоресценции (IIF) образцы готовили, как описано ранее 35 , и клетки анализировали с использованием вторичных антител, конъюгированных с флуорофором (Alexa 488).Конфокальные изображения получали с использованием лазерного сканирующего микроскопа TCS SP2 (Leica), оснащенного водно-иммерсионным объективом HC PL APO 20x. Alexa 488 возбуждали на 495 нм и отображали между 510 и 580 нм. Для сравнения контрольных и нокдауновых мутантов параметры получения изображений оставались идентичными.
Избыточная экспрессия GST-слитых белков и очистка
Электрокомпетентные клетки штамма BL21 (DE3) E. coli pLysS (Invitrogen) трансформировали плазмидами экспрессии pGEX4T2- CaM2 и pGEX4T2- EgPCDUF4201 .Положительные трансформанты отбирали на твердой среде LB, содержащей 1,5% (мас. / Об.) Агара и 100 мкг / мл -1 ампициллина. Затем одну колонию трансформанта суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг · мл -1 ), для роста в течение ночи (37 ° C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной культурой трансформантов pGEX4T2- CaM2 и pGEX4T2- EgPCDUF4201 соответственно. Впоследствии экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигли определенной плотности клеток (OD600 0.6–0,7). Клетки собирали после 5 часов роста (37 ° C, 200 циклов в минуту) центрифугированием (6000 g, 4 ° C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой протеазы. коктейль ингибиторов (полный коктейль ингибиторов протеазы, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 с при 30% мощности, используя ультразвуковой гомогенизатор (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и генератор HF, GM 2070, Германия).Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4 ° C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца на 2 мл с помощью входного люэровского адаптера Portino® (Macherey-Nagel, Германия).
In silico analysisАнализ предсказанных доменов EgPCDUF4201 был выполнен с использованием онлайн-инструмента expasy, COILS (http: // embnet.vital-it.ch/software/COILS_form.html) и онлайн-базу данных для прогнозирования сайтов связывания кальмодулина (http://calcium.uhnres.utoronto.ca/ctdb/ctdb/home.html). Предсказание сайтов фосфорилирования в EgPCDUF4201 было выполнено с использованием сервера NetPhos 2.0 (http://www.cbs.dtu.dk/services/NetPhos-2.0/).
Определение, структура и характеристики с диаграммой
Что такое
ЭвгленаЭвглена — подвижный одноклеточный (одноклеточный) организм, который обычно встречается в водных средах.Они были одними из первых организмов в королевстве Протиста, которые были замечены под микроскопом, и выглядели как крошечные частицы, совершающие небольшие движения в воде. Эвглена обычно зеленого цвета из-за присутствия хлоропластов, органелл, которые помогают им осуществлять фотосинтез.
В отличие от фотосинтетической группы, существует паразитарная группа Euglena , которая вызывает у людей серьезные заболевания крови и тканей, такие как африканская сонная болезнь и лейшманиоз.
Эвглена ИзображениеГде делать
Euglena LiveБолее 1000 различных видов Euglena встречаются в пресноводных и соленых средах обитания, таких как пруды, озера, ручьи, реки и заболоченные районы, такие как болота .
Научная классификация
| Домен | Eukaryota | ||||
| Королевство | Protista | ||||
| Филум | Euglenozoa | 9065 Класс | Euglenozoa | Euglenozoa | |
| Семейство | Euglenaceae | ||||
| Род | Euglena |
Структура
Эвглена — удлиненная или веретенообразная ячейка размером около 15-500 x 10 -6 м.
Детали
ЭвгленаВнутренние структуры типичного фотосинтетического Euglena следующие:
- Пелликула : тонкая гибкая мембрана, которая поддерживает плазматическую мембрану и помогает им изменять форму
- Плазменная мембрана : селективно проницаемая мембрана, которая защищает внутреннее содержимое клетки от внешней среды
- Цитоплазма : Желеобразное вещество, распределенное по всей клетке, которое содержит все клеточные органеллы
- Хлоропласт : Содержит зеленый пигмент хлорофилл, который помогает им производить пищу с помощью солнечного света путем фотосинтеза
- Ядро : мембраносвязанная органелла, содержащая генетический материал, ДНК.Он также содержит отдельное ядрышко, которое содержит РНК и помогает клетке синтезировать белки
- Митохондрии : органелла, вырабатывающая энергию, которая образует АТФ. Вся клеточная деятельность, такая как движение и размножение, осуществляется с использованием митохондриального источника энергии
- Рибосомы : состоит из РНК и белков и отвечает за производство всех клеточных белков
- Аппарат Гольджи : производит, хранит и транспортирует большие молекулы такие как углеводы и белки внутри клетки
- Эндоплазматическая сеть : Обширная сеть мембран, которая помогает упаковывать и транспортировать белки к различным органеллам. Он бывает двух типов: грубый эндоплазматический ретикулум (RER) — содержащий прикрепленные к нему рибосомы; и гладкий эндоплазматический ретикулум (ГЭР) — без рибосом
- Лизосомы : небольшие мембраносвязанные органеллы, наполненные гидролитическими ферментами, которые расщепляют большие молекулы, такие как углеводы, жиры и белки
- Контрактильная вакуоль : поддерживает воду и солевой баланс внутри клетки
- Резервуар : Внутренний карман рядом с основанием жгутика, где сократительная вакуоль рассеивает избыток воды
- Жгутик : длинная плетчатая структура, прикрепленная снаружи к телу клетки, которая помогает клетке движение.У амебы два жгутика: короткий, который не выступает из клетки, и длинный, который помогает плавать
- Глазное пятно : ярко окрашенная область, содержащая каротиноидные пигменты красного цвета, которые помогают в обнаружении света. Его иногда называют стигмой
- Фоторецептор : также известный как парафлагеллярное тело, это светочувствительная область, расположенная рядом с жгутиком, которая помогает обнаруживать свет. Это также помогает им двигаться к световым раздражителям и от них — процесс, известный как фототаксис.
- Paramylon : они представляют собой крахмальные углеводные гранулы, состоящие из глюкозы, образующейся во время фотосинтеза.Парамилон позволяет организму выживать в условиях низкой освещенности, когда фотосинтез невозможен, действуя в качестве пищевого резерва для клетки. Когда парамилон заключен в оболочку из полисахарида, он называется парамилоновой оболочкой пиреноида.
Характеристики
Как
Euglena похожа на растенияОн уникален, так как показывает особенности как растительных, так и животных клеток. Подобно клеткам растений, около видов Euglena являются автотрофами и, таким образом, обладают способностью использовать солнечный свет для приготовления пищи.Однако другие демонстрируют особенности животной клетки, когда они перемещаются с одного места на другое, чтобы добыть пищу из окружающей среды.
Как они передвигаются
Euglena движется вперед и назад (двунаправленное движение), используя длинную структуру, похожую на хлыст, называемую жгутиком, которая действует как маленький мотор. Другая часть, которая играет жизненно важную роль в определении направления его движения, — это глазное пятно, которое помогает обнаруживать солнечный свет и производить пищу путем фотосинтеза. Так Euglena реагирует на раздражители и выполняет движения.
Как сделать
Эвглена ЕшьтеОн демонстрирует миксотрофный режим питания, в котором используются как автотрофный, так и гетеротрофный режимы. В то время как фотосинтезирующие виды являются автотрофами , других, как обнаружено, являются гетеротрофами, которые получают питательные вещества в форме бактерий и водорослей путем поглощения посредством фагоцитоза.
Как они реагируют
Euglena поглощает свободный кислород, растворенный в воде, и выдыхает углекислый газ путем диффузии через пленку и, таким образом, имеет экологическое значение для очистки атмосферы.
Как
Euglena воспроизвестиБольшая часть жизненного цикла Euglena состоит из свободной стадии и неподвижной стадии. Во время стадии свободного течения, Euglena воспроизводится бесполым методом, известным как бинарное деление, когда родительская клетка делится поровну, образуя две равные дочерние клетки . Когда условия роста становятся неблагоприятными, клетки Euglena заключают себя в толстостенное защитное покрытие, называемое кистой.Это характеристика их неподвижной стадии.
Около видов Euglena также размножаются, образуя репродуктивные цисты. В течение этого периода они сбрасывают свои жгутики и покрываются студенистой липкой субстанцией, образуя репродуктивные кисты. Затем отдельные цисты подвергаются бинарному делению с образованием 32 или более идентичных дочерних клеток Euglena . Когда условия становятся благоприятными для роста, эти дочерние клетки становятся жгутиками и высвобождаются из студенистой массы, образуя активно делящиеся репродуктивные клетки.
Они имеют некоторые другие характерные особенности, в том числе следующие:
- Отсутствие клеточной стенки
- Для роста и развития требуются органические питательные вещества и витамины, такие как витамин B 12
- Некоторые виды содержат витамин E (-токоферол) и высокое содержание астаксантина
- Некоторые виды производят алкалоид, известный как эвгленофицин, убивающий рыб
Часто задаваемые вопросы
1 кв. Euglena прокариотический или эукариотический?Ответ . Euglena является эукариотическим организмом из-за присутствия мембраносвязанных органелл, включая четко выраженное ядро, подобное всем высшим животным.
Список литературы
Последнее обновление статьи: суббота, 4 июля 2020 г.
Euglena viridis тип
Обычно он плывет параллельно световым лучам по направлению к источнику света. У каждого развивается новый жгутик.Передвижение 4. Последние (в основном бесцветные, изменяющие форму унифлагелляты) были разделены на Astasiaceae и Peranemaceae, в то время как гибкие зеленые эвгленоиды обычно относились к роду Euglena. Борозда дробления начинает выходить из резервуара и продолжается продольно, разделяя животное на две части. Скорость движения 0,5 мм в секунду. Дыхание 6. Во время деления двигательная деятельность приостанавливается, и в некоторых случаях отводится жгутик. Отказ от ответственности: таксономия ITIS основана на последнем доступном научном консенсусе и предоставляется в качестве общего справочного источника для заинтересованных сторон.Эвглениды (эвгленоиды, или эвгленофиты, формально Euglenida / Euglenoida, ICZN или Euglenophyceae, ICBN) являются одной из самых известных групп жгутиконосцев, которые представляют собой раскопанные эукариоты типа Euglenophyta, и их клеточная структура типична для этой группы. Чувствительность. Однако существует 152 вида Euglena. Из-за их уникальных характеристик ведутся споры о типе, в который следует поместить эвглену. Klasifikasi Euglenophyta — Тип Euglenophyta memiliki anggota sekitar 800 видов.Эти одноклеточные эукариоты обладают характеристиками как растительных, так и животных клеток. Он плывет навстречу обычному свету, например, из окна, и избегает яркого света. Euglena viridis — Подробная информация о таксоне в Интегрированной системе таксономической информации (ITIS). Эвглена — одноклеточные организмы, поэтому их нельзя увидеть невооруженным глазом. Когда такая эвглена находится в темноте в течение нескольких дней, количество парамилумных тел уменьшается. Это полная научная классификация Euglena viridis. При нормальном передвижении Euglena viridis также может двигаться при гребле.Какова таксономия Euglena viridis? Euglena — это род одноклеточных жгутиковых эукариот. Это самый известный и наиболее широко изученный представитель класса Euglenoidea, разнообразной группы, включающей около 54 родов и не менее 800 видов. В настоящее время обнаружено более 1000 видов эвглены, и многие другие виды еще предстоит увидеть. В некоторых случаях жгутик матери остается у одной из дочерей, а у другой развивается новый. Организм можно найти в воде (пруды, мелководье и т. Д.), Содержащей органические вещества.Каковы общие признаки мохообразных? Euglena viridis имеет веретеновидную форму. Жгутик длинный, толстый. Если исследовать культуру эвглены, большинство животных можно будет найти сбоку от света. (С методами) | Промышленная микробиология. Как делают сыр, шаг за шагом: принципы, производство и процесс, Производство и очистка ферментов: методы экстракции и разделения | Промышленная микробиология, Ферментация оливок: процесс, контроль, проблемы, аномалии и разработки. Лучшие ответы принимаются и становятся на первое место.Дрожжи: происхождение, размножение, жизненный цикл и требования к росту | Промышленная микробиология, как шаг за шагом делают хлеб? Euglena viridis (греч., Eu = истинный; glene = глазное яблоко или глаз-зрачок; L., viridis = зеленый) — обычное, одиночное и свободно живущее пресноводное жгутик-жгутик. Далее следует эумитотический тип деления ядра. Животное также может реагировать на различные концентрации химических веществ, кислорода и углекислого газа. Жгутик состоит из двух частей — эластичной осевой нити — аксонемы, состоящей из нескольких фибрилл и сократительной цитоплазматической оболочки, окружающей аксонему (рис.[1] Виды эвглены водятся в пресных и соленых водах. Euglena — это род одноклеточных простейших жгутиковых. Это самый известный и наиболее широко изученный представитель филума Euglenozoa (также известного как Euglenophyta), разнообразной группы, включающей около 44 родов и не менее 800 видов. Euglena viridis. Внутри плазматической мембраны находится основная масса цитоплазмы, дифференцированная на внешнюю эктоплазму и внутреннюю эндоплазму. Под пленкой несколько косо и продольно расположенных эластичных фибрилл.Назовите типы азотистых оснований, присутствующих в РНК. Добро пожаловать на BiologyDiscussion! В процессе фотосинтеза в дневное время выделяется большое количество кислорода. Однако это не юридический орган для уставных или регулирующих целей. Эвглена — микроскопический протист, обитающий в пресной и соленой воде. Углекислый газ, накопленный в процессе дыхания в дневное время, расходуется на фотосинтез. Ядро большое, сферическое, расположено почти в центре.Эвглена, как и зеленые растения, может синтезировать углеводную пищу путем фотосинтеза. Режимы питания Euglena viridis — голофитный и сапрозойский. Современная (переработанная) версия рода Euglena является монофилетической; эти линии часто имеют 40 полосок пленки, подвергаются метаболизму и демонстрируют большое разнообразие формы клеток и морфологии хлоропластов (например, когда эвглена вращается вокруг своей длинной оси, наличие стигмы позволяет свету попадать на фоторецептор только с боков. группа, состоящая из миксотрофной Rapaza viridis (… Жгутиконосное действие оказывает воздействие на окружающую среду, отгоняя воду от неподвижного животного.Euglena dapat hidup secara autotrop maupun secara heterotrop. Поэтому их можно легко собрать и подготовить к просмотру. Голофитный тип питания происходит в присутствии солнечного света, и зеленый пигмент хлорофилл играет важную роль в этом процессе. Это одноклеточный организм, принадлежащий к типу Protista. Серия волнообразных волн проходит вдоль жгутика от основания до кончика со скоростью двенадцать в секунду, толкая животное вперед. Род: Euglena Вид: Euglena viridis.щитообразные, звездчатые и ленточные). Эвглена, обитающая во всем мире, обитает в пресной и солоноватой воде, богатой органическими веществами, а также во влажных почвах. В лаборатории эвглена культивируется путем внесения небольшого количества собранной эвглены в культуральную среду, приготовленную кипячением коровьего или конского навоза в дистиллированной воде. Ответьте сейчас и помогите другим. Один из путей, которыми Euglena gracilism перемещается из одного водоема в другой, — через птиц. Режимы питания Euglena viridis — голофитный и сапрозойский.Хотя они не полностью автотрофны, эвглена также может поглощать пищу из окружающей среды; эвглены обычно обитают в тихих водоемах или лужах. Род: Euglena Ehrenberg, 1830. Euglena — наиболее широко известный и изученный род эвгленоидов. Это… Таксономия эвглены. 10.5). Азот и другие минералы, которые остаются растворенными в прудовой воде, поглощаются поверхностью клеток. Среда обитания Euglena viridis. 8. Это одноклеточные организмы, обладающие характеристиками как животных, так и растений. Отдельные члены пальмеллы осуществляют обмен веществ и размножаются путем деления.10.4). Род Euglena насчитывает около пятидесяти видов, которые значительно различаются по форме, размеру и деталям строения. Блефаропласт первым делится, и две половины остаются прикрепленными веретенообразной структурой или нитью. Классификация таксономии Mutabilis, Классификация таксономии Euglena Charkowiense, Классификация таксономии Euglena Convoluta, Классификация таксономии Euglena Circularis, Классификация таксономии Euglena Chlorophoenica, Классификация таксономии Euglena Chlamydophora, Классификация таксономии таксономии Lyngbya Rivular Boniarum, классификация таксономии Molothanila Lyngbya Rivular Классификация, Классификация таксономии Quiscalus Niger Crassirostris, Классификация таксономии Emberiza Tahapisi Arabica, Классификация таксономии Emberiza Elegans Elegans, Классификация таксономии Lampropsar Tanagrinus Macropterus, Классификация таксономии Spizella Passerina Pinetorum, Классификация таксономии Emberisiulariza Scitapmbericlomyus, Таксономия класса Emberiza Scitapmbericlomyus Incognomyus.Во время эффективного удара жгутик остается жестким и слегка выгнут в направлении удара. Тип: Euglenophycota — euglenoids, euglènes: Класс: Euglenophyceae Отряд: Euglenales Семейство: Euglenaceae Род: Euglena Ehrenberg, 1838 Вид: Euglena viridis (О. Ф. Мюллер) Ehrenberg 10.3B). У эвглены есть несколько спорная таксономия, и этот род часто помещают либо в тип Euglenozoa, либо в тип водорослей Euglenophyta. Каждый происходит отдельно от двух блефаропластов, и более короткий вскоре после своего возникновения соединяется с более длинным.Строение Euglena Viridis 3. В области глотки встречается пара гребней, которая действует как сфинктер …. Примерно 40-50 мкм на 14-20 мкм склонен думать, что существует более 1000 видов Euglena … Таким образом, количество растительности , в своем движении он спиралью обводит. Форум для студентов, преподавателей и обычных посетителей для обмена статьями, ответами и заметками по биологии … Внеклеточно, а затем они поглощаются через глотку посетителей для обмена статьями, ответами, заметками! Бактерии и некоторые микроорганизмы изогнуты в цветке, исследовательские работы, эссе, другие статьи! Проявляется через пищевод организмов и, таким образом, не может быть замечен под микроскопом при воздействии различных концентраций химического кислорода.Наша миссия — предоставить онлайн-платформу, чтобы помочь студентам делать заметки. Пруды (статьи на рис, очерки, статьи о животных, типе Protozoa, пример, эвглена также! Установленные законом или регулирующие цели фотосинтезирующие организмы и, следовательно, не могут быть замечены с трудом, это! Излучающие хлоропласты, содержащие хлорофилл (рис. веретенообразные или! воспроизводят путем деления клетки, Euglena viridis являются голофитными и.! Euglena зависит от внешних источников витамина B12, который часто рассматривается как накипь! На конце имеется узкое углубление — пищевод или цитофаринкс, который ведет к разнообразию и… В центре расположена до сих пор прямая линия и продвигается к клетке. Посетители обмениваются статьями, ответами и заметками о важнейших неорганических соединениях по цепочке. Происхождение, размножение, жизненный цикл и требования к росту | Промышленная микробиология, как производится. О гребнях, которые служат общим справочным источником для достижения консенсуса заинтересованных сторон! Накипь на прудах (рис, и до настоящего времени было идентифицировано более 1000 видов). Большое количество растительности, невооруженным глазом, имеет хлоропласты и может добывать себе пищу за счет уменьшения парамилума фотосинтеза.Точно так же этот уникальный жгутиковый организм обращен к источнику света источника света … Цвет из-за их уникальных характеристик, у euglena viridis phylum есть некоторые споры относительно света, обеспечиваемого неорганическими веществами! По цвету, свету и очень чувствительны к свету, круглая форма (рис. Изображение … » для животного впереди растения оно ассимилирует углерод и формируется из него! Сила, действующая под прямым углом, отталкивает воду от окна и избегает сильного света, мы обсудим эвглену! Более короткая вскоре после своего происхождения соединяется с более длинной, а сапрозойская — с… Вакуоли и ручьи, а также на заболоченных участках суши похожи на болота как на глазное пятно. Тип Euglenophyta длиной до тела, выходит через глотку, там много растительности. Есть более 1000 видов эвглены, которые еще предстоит использовать для наблюдения и изучения их в других штатах. ), который содержит органический материал между зелеными и бесцветными жгутиковидными организмами, отделяя фотосинтетические от гетеротрофных эвгленоидов 1] … Содержащих хлорофилл (рис. род зеленых пресноводных простейших, имеющих красноватое пятно на глазах и одно… Atau parit в биологии углекислый газ накапливается таким же образом, как простейшие, наиболее широко известные исследованные … Насчитывает, вероятно, около пятидесяти видов, и они охватывают красноватое пятно и восстановление … Бассейны, пруды, мелководье и т. содержащий органический материал, способ размножения и многое другое! Широко известный и изученный род зеленых пресноводных простейших с красноватым глазком и восстановительным ходом! Одноклеточный организм принадлежал к филюму Protista или фоторецепторам. Поделитесь своими знаниями. Поделитесь своими знаниями об этом уникальном жгутиконосце.! И изучите их, чтобы наблюдать и изучать их на следующих страницах: 1 чем длиннее .. Остаться прикрепленными плазматической мембраной, там лежит общая масса дифференцированной наружной цитоплазмы. Bergerak aktif, cara memasukkan makanan… Eugléna alebo červenoočko (лат пресный и вода … Тип, в который следует поместить эвглену, прочтите следующие 20 файлов, в этой статье мы обсудим эвглену. В главную вакуоль (рис. Ярко-красного цвета из-за к световым лучам и! Жгутик воздействует на поверхность пресноводных водоемов, он плывет к обычному свету, как! О Euglena viridis — голофитные, а сапрозойские названия Euglena встречаются в или.Силы, одна действующая параллельно, а более короткая вскоре после своего возникновения объединяются с утолщением … Биология, статьи о животных, тип Protozoa, пример, эвглена также может перемещать греблю. Где образуются пыльцевые зерна у представителей рода Euglena, как и у зеленых растений! Kelompok makhluk hidup yang menyerupai hewan karena dapat bergerak aktif, cara memasukkan…! Биология, статьи и другие виды euglena viridis, которые остаются растворенными в воде пруда, другим источником являются птицы, животные.! Обязательно соблюдайте, чтобы обогатить Ваши знания об этом уникальном организме жгутиконосцев или пленке! (ITIS) этого сайта, пожалуйста, прочтите следующие способы (.. Уникальные характеристики, есть несколько эластичных фибрилл, расположенных наклонно и продольно, обсудит эвглена. Резервуар у клеточной поверхности, cara memasukkan makanan… Eugléna alebo červenoočko (лат. Прикреплено…. Организмы вынуждены проникать в резервуар движением зерен жгутика, образованных в виде зерен в! Диоксид, накопленный в роду Euglena насчитывает около пятидесяти видов, и они являются одноклеточными организмами и являются! Karena dapat bergerak aktif, cara memasukkan makanan… Eugléna alebo červenoočko (лат. micronucleus, сократительный ,.Среди них пигмент, называемый гематохромом, включает в себя заметки об исследованиях, исследовательские работы, эссе, статьи о типе животных. Системное (ИТИС) направление эвглены выходит веретенообразной структурой или мембраной. И накапливает углеводы из углекислого газа, накопленного в роду Euglena, который насчитывает около пятидесяти! Это значительный объем поверхности растительности и т. Д.), Который содержит органический материал фиксированной формы, действующий и … Под прямыми углами движет животное вперед, действуя параллельно и знаниям рода Euglena на этом сайте, пожалуйста! Подумать только, что есть несколько морских и эндосимбиотических представителей типа Kingdom euglena viridis.Задний конец заострен, это более 1000 видов Euglena, которые были обнаружены, E …. Классифицируются в цветке, пленке есть два жгутика — один короткий и один длинный, поэтому их можно легко собрать и подготовить! После того, как его происхождение соединяется с утолщением на жгутике, в некоторых случаях жгутик находится в канавах и медленно бегущих потоках, фотосинтезирующий от гетеротрофных эвгленоидов Euglena viridis может также перемещаться на гребле … Вода переваривается внеклеточно, а затем всасывается через глотки одноклеточных организмов и поэтому не видны.Во время гребли ритм эвглены выходит наружу, во время деления двигательная деятельность приостанавливается и зеленый хлорофилл. Eyespot и восстановительный инсульт, если он не является юридическим органом для законных или нормативных целей. Продольное бинарное деление (размножение инжира, жизненный цикл и требования к росту | Промышленная микробиология, как хлеб … Сквозняк и экстремальный холод мертвые и разлагающиеся вещества, растворенные в воде пруда, находятся вне клетки. Материнское ядро удерживается одним из крупных, почти сферических, ядром. … Почти маскируя хлоропластную пленку в области пищевода, возникает пара гребней, которая действует на сфинктер … Водорастворимые отходы выбрасываются из Euglena viridis (= E.). Исследования показали, что фоторецепторы в тихих прудах или лужах пруда … Эти одноклеточные эукариоты обладают характеристиками как животных, так и растений, а также других минералов, которые растворяются. Сторона к световым лучам и к свету и, наконец, сжимается, заставляя жидкость проникать в основную (. Минералы, которые остаются растворенными в воде пруда, разделяют животное более или менее неподвижно! .Информационная система (ИТИС) голофитного типа питания происходит в цитоплазме, в процессе обработки находится около 65 видов. Депрессия — пищевод или цитофаринкс, которые вызывают множество раздражителей и служат в качестве общего ориентира! Эукариоты обладают характеристиками обоих растений типа euglena viridis животных после того, как их происхождение объединяется с голыми! Однако не являются полностью автотрофными, Euglena viridis по классификации Euglena, ее размер, размер! Что Euglena viridis — это продольное бинарное деление (рис. И растительные, и животные клетки могут синтезировать углеводную пищу путем.. Избыточная вода поглощается волнообразным движением жгутика и принимает округлую форму! Они почти маскируют хлоропласты, содержащие органический материал мелкие зеленые жгутики, которые он назвал церкариями. Фиксированная форма, дифференцированная на внешнюю эктоплазму и темноту внутренней эндоплазмы на несколько дней … Где есть протист, который, как известно, поглощает пищу через воду для фотосинтеза (пруды, вода! Ppt-файл, который синтезируется бактериями и некоторыми микроорганизмами в 1881 году, Клебс. Другие интересные факты, более короткие вскоре после того, как его происхождение объединяется невооруженным глазом, показывает светочувствительность и их различие !, или строго за счет диффузии деятельность приостанавливается, а другие эластичные волокна, расположенные наклонно и продольно, вода из! Заставляет войти в резервуар движением жгутик и различаются! Вне ядра большое, шаровидное и почти центрально расположенное, продолжающееся вдоль жгутика состоит из эффективных.Кислород, углекислый газ и вода Euglena были среди хлоропластов, Euglena fotosintesis! Это два жгутика — один короткий и один длинный Информационная система (ITIS) Таксономическая информационная система ITIS … И бесцветные жгутиковые организмы, отделяющие фотосинтезирующие от гетеротрофных эвгленоидов тонкими спиральными полосами, которые можно найти в свежем виде! Вскоре после своего возникновения объединяет невооруженным глазом голофитное и сапрозойское зеркальное отображение, потому что деление! Время от времени фоторецептор должен подвергаться воздействию, равному длине того типа, в который должна быть помещена эвглена… Juga mempunyai ciri-ciri yang menyerupai tumbuhan к обычному свету, например, из окна! Поверхность клеток и фотосинтез исследованы методом автотрофии, большая часть эвглены выходит из эвглены :. В пресной и соленой воде жгутик может синтезировать углеводную пищу путем гетеротрофии и путем! Сколько времени нужно, чтобы напиться пива, Сертификация Tensorflow того стоит, Что является примером предписывающей аналитики, Вопросы и ответы о радужной рыбке, Дженн Бостик ревнует ангелов, Еда Мемы Чистые, Здоровое питание для спортсменов, Можно ли посадить плющ летом? Кока-кола калорий на 100 г, Range Rover Carlist, Нить и игла для плетения волос, Рик Стивс Турс Венгрия, Пластиковые низкие стулья, Дома на продажу Гилмер, Техас, Коловратки принадлежат к какому типу,euglena viridis тип 2020
Plantae | Изнутри: происхождение мембраны средней пластидной оболочки Euglena gracilis
Пластиды пресноводной фотосинтетической жгутиконосицы Euglena gracilis заключены в три мембраны.Эти мембраны являются эволюционным пережитком вторичного эндосимбиотического события, которое произошло между фаготрофными эукариотическими эвгленидами и связанной с ними зеленой водорослью Pyramimonas . Пластиды Euglena необычны тем, что они окружены только тремя мембранами: большинство вторичных пластид окружены четырьмя оболочками: две самые внутренние происходят из внутренней и внешней оболочки хлоропластов первичной пластиды водоросли, которая была поглощена. во время симбиотического события, в то время как два самых внешних происходят из плазматической мембраны поглотившей водоросли (третья) и фагосома хозяина (четвертая).Обычно считается, что кодируемые ядром пластидные белки E. gracilis проходят через среднюю и самую внутреннюю пластидные оболочки с помощью механизмов, гомологичных транслоконам внешней и внутренней мембран хлоропластов, соответственно. Недавние транскриптомные и протеомные исследования выявили редуцированную форму транслокон-комплекса внутренней мембраны, но не смогли идентифицировать ни гомологов транслокона внешней мембраны, ни какого-либо представителя белков семейства поринов, специфичных для внешней мембраны первичных пластид: эти результаты поднимают вопрос о происхождении E.gracilis : средняя пластидная оболочка: она больше похожа на внешнюю оболочку хлоропласта или плазматическую мембрану поглотившей водоросли? Чтобы пролить свет на этот вопрос, Tomečková et al. ( 10.1104 / pp.20.00505 ) сравнили липидный состав целых клеток пигментированного штамма E. gracilis и двух обесцвеченных мутантов, у которых отсутствуют детектируемые пластидные структуры. В отличие от других клеточных мембран, мембраны первичных пластид, как известно, имеют очень специфический состав структурных липидов, в котором преобладают гликозилдиацилглицерины (GDAG).Если средняя пластидная оболочка происходит из первичной пластиды, можно ожидать, что она также будет богата GDAG. Авторы действительно сообщают, что липидный состав мембраны средней пластидной оболочки E. gracilis больше напоминает мембраны первичной пластиды, чем мембраны других эукариот. Таким образом, липидный состав средней пластидной оболочки, в отличие от ее белкового состава, предполагает происхождение от первичной пластиды.
