Даже у инфузорий есть память. Это подтвердило повторение эксперимента столетней давности — Наука
ТАСС, 5 декабря. Биологи из Гарвардского университета повторили один из противоречивых экспериментов столетней давности и доказали, что некоторые инфузории могут запоминать информацию и учитывать ее в своей дальнейшей жизнедеятельности. Их выводы опубликовал научный журнал Current Biology.
«Эти организмы сначала делают одну простую вещь, однако, если их стимулировать достаточно долго, они «решают» переключиться на другую стратегию поведения. У этих инфузорий нет мозга, однако в их клетках существует какой-то механизм, позволяющий им «менять мнение» через некоторое время», — прокомментировал исследование один из его авторов, математик и биолог из Гарварда Джереми Гунавардена.
Более века назад американский зоолог Герберт Спенсер Дженнингс выяснил, что у одноклеточных организмов из числа ресничных инфузорий, которые принадлежат к виду Stentor roeselii, есть своеобразная память.
Дженнингс пришел к такому выводу, пытаясь «накормить» трубачей частицами кармина, едкой красной краской, которая вызывает у тех раздражение. Изначально инфузории сдвигали в сторону свое тело, пытаясь избежать контакта с кармином и не дать краске попасть в окрестности волосков на поверхности их клетки, которые непрерывно захватывают кусочки пищи и транспортируют их внутрь.
Если этого не удавалось сделать, трубачи меняли стратегию поведения — они начинали вращать этими волосками в противоположную сторону, отталкивая кармин. В случае провала этой стратегии, инфузории начинали сжимать свое тело, а затем просто откреплялись от поедаемой органической материи и уплывали.
Впоследствии, многие другие группы ученых пытались повторить опыты Дженнингса, используя культуры других видов трубачей. Никто ранее не мог зафиксировать столь сложных форм поведения, в результате чего биологи начали игнорировать заявления американского зоолога и пришли к выводу, что у простейших живых существ нет памяти.
Зачатки «клеточного мышления»
Несколько лет назад, как отмечает Гунавардена, он случайно познакомился и с трудами Дженнингса, и с работами его критиков. Он сразу же обратил внимание на то, что повторные эксперименты проводились на другом виде инфузорий, Stentor coeruleus, которые добывают пищу несколько иным путем, не прикрепляясь к поедаемой органике.
Эти различия натолкнули его на мысль, что авторы этих исследований могли сами ошибаться, приписывая одинаковый характер поведения и отсутствие памяти двум разным видам трубачей, которые занимают разные экологические ниши. Долгое время его предложения провести повторную проверку опытов Дженнингса не находили поддержки среди коллег по Гарварду, что вынудило Гунавардену и его единомышленников провести этот эксперимент за свой счет и в свободное от работы время.
Большую часть времени ученые потратили на поиски колоний Stentor roeselii в американских водоемах. Ученые нашли этих инфузорий в пруду на территории одного из британских гольф-клубов.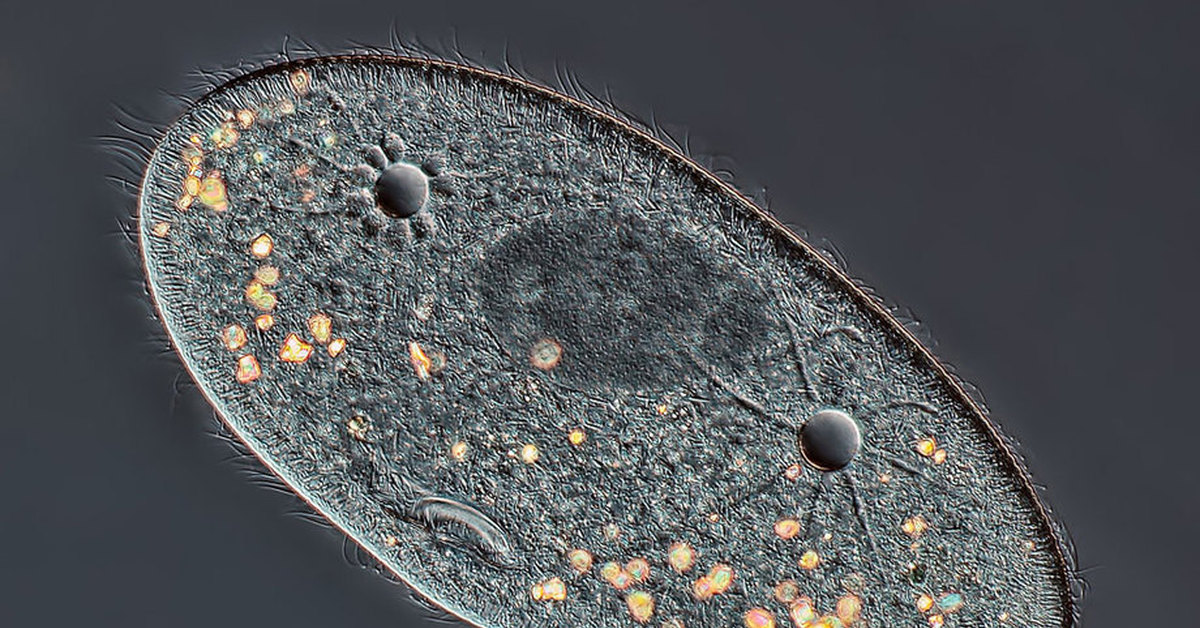 Вырастив достаточное количество трубачей, биологи повторили опыты Дженнингса, заменив кармин на пластиковые шарики, которые, как оказалось, раздражали инфузорий заметно сильнее, чем природный краситель.
Вырастив достаточное количество трубачей, биологи повторили опыты Дженнингса, заменив кармин на пластиковые шарики, которые, как оказалось, раздражали инфузорий заметно сильнее, чем природный краситель.
Эти эксперименты не только подтвердили выводы предшественника Гунавардены и его команды, но и раскрыли одну удивительную вещь, которая ускользнула от внимания Дженнингса. Оказалось, что в клетки трубачей встроен своеобразный «генератор случайных чисел» — они сжимаются при контакте с шариками или же сразу открепляются от поедаемой органики с вероятностью в 50%. Как инфузория совершает этот выбор, ученые пока не могут сказать, однако раскрытие этого механизма поможет им понять в том числе и то, как возникают метастазы рака.
«Этот эксперимент заставляет нас осторожно думать о том, что существует некая форма «клеточного мышления», позволяющая одиночным клеткам обрабатывать большие массивы информации и принимать сложные решения в ответ на конкретные сигналы, поступающие извне. Учитывая то, что вся жизнь на Земле происходит из одного источника, наше открытие имеет широкое применение и очень важное значение для всей биологии», — сказал Гунавардена.
Учитывая то, что вся жизнь на Земле происходит из одного источника, наше открытие имеет широкое применение и очень важное значение для всей биологии», — сказал Гунавардена.
Российские ученые обнаружили сходства в клетках животных и простейших организмов
Ионные каналы – это белки, встроенные в клеточные мембраны всех живых организмов и действующие как своеобразные поры. Они открываются на всевозможные стимулы и пропускают различные ионы через мембрану клетки. Ионные каналы принимают участие во всех важнейших процессах как у одноклеточных, так и у многоклеточных организмов. Отдельные части ионного канала, называемые домены, выполняют различные функции: структурные, регуляторные, стабилизирующие. В составе различных ионных каналов бывает разное количество доменов. Например, в проведении нервных импульсов у животных участвуют четырехдоменные каналы.
Ранее считалось, что четырехдоменные каналы характерны в первую очередь для высших многоклеточных организмов. С помощью же методов биоинформатики ученые из Института цитологии Российской академии наук в Санкт-Петербурге выявили такие каналы у целого ряда одноклеточных эукариот (клетки, имеющие в своем составе ядро) и показали, что некоторые группы простейших, например инфузории, имеют большое число различных четырехдоменных каналов.
С помощью же методов биоинформатики ученые из Института цитологии Российской академии наук в Санкт-Петербурге выявили такие каналы у целого ряда одноклеточных эукариот (клетки, имеющие в своем составе ядро) и показали, что некоторые группы простейших, например инфузории, имеют большое число различных четырехдоменных каналов.
«На основании того, что четырехдоменные каналы встречаются в эволюционно далеких группах эукариот (например, у человека и зеленой одноклеточной водоросли хламидомонады, у дрожжей и инфузории-туфельки), можно с уверенностью сказать, что такие каналы появились еще у общего предка человека и простейших, то есть на заре эволюции всех эукариот», – рассказал первый автор статьи, один из основных исполнителей проекта РНФ, младший научный сотрудник лаборатории одноклеточных организмов Института цитологии РАН Илья Поздняков.
Авторы исследования также выдвинули предположения о свойствах, которыми могли обладать четерехдоменные ионные каналы общего предка всех эукариотических организмов миллионы лет назад. Оказалось, что многие из них совершенно аналогичны механизмам ионного обмена в клетках человека и других животных.
Оказалось, что многие из них совершенно аналогичны механизмам ионного обмена в клетках человека и других животных.
«Эти каналы обладали сенсорами напряжения и поэтому могли открываться в ответ на изменение потенциала мембраны. Именно это свойство играет ключевую роль в функционировании нашей нервной системы. Кроме того, предковые четырехдоменные каналы были способны пропускать ионы кальция, играющие важную роль во внутриклеточной сигнализации всех современных организмов», – дополняет соавтор статьи, младший научный сотрудник лаборатории одноклеточных организмов Института цитологии РАН Ольга Матанцева.
Исследователи сообщают, что открытие не только поможет лучше понять эволюцию очень важных для клеток молекулярных комплексов, но и даст возможность предсказать некоторые свойства еще не охарактеризованных экспериментально ионных каналов простейших, в том числе микроорганизмов из такой социально и экологически значимой группы, как динофлагелляты. Эти организмы играют важную роль в морской экосистеме, являясь, по сути, низшим звеном пищевой цепочки. Динофлагелляты также способны образовывать опасные для рыб и человека токсины.
Эти организмы играют важную роль в морской экосистеме, являясь, по сути, низшим звеном пищевой цепочки. Динофлагелляты также способны образовывать опасные для рыб и человека токсины.
«Наш проект РНФ направлен на получение новых знаний о физиологии динофлагеллят, необходимых, чтобы разобраться в том, каким образом регулируется их численность в природе и какие факторы среды запускают их неконтролируемое размножение, приводящее к «цветению воды» и вредоносным красным приливам, а также стимулируют производство ими токсичных веществ. Исследования ионных каналов являются необходимым этапом на пути к решению поставленных задач», – отметил соавтор статьи, руководитель проекта, заведующий лабораторией цитологии одноклеточных организмов Сергей Скарлато.
Биологи изучили микробиом инфузорий — Индикатор
Группа ученых из Санкт-Петербургского государственного университета, Института клеточного и внутриклеточного симбиоза УрО РАН, университетов Пизы и Флоренции представила результаты исследования микробиома инфузорий-трубачей (Stentor coeruleus). Это одно из первых в мире исследований микробиомов одноклеточных эукариот, которое стало возможно благодаря метагеномному анализу. Научная работа опубликована в журнале Scientific Reports.
Это одно из первых в мире исследований микробиомов одноклеточных эукариот, которое стало возможно благодаря метагеномному анализу. Научная работа опубликована в журнале Scientific Reports.
Микробиом — это совокупность микроорганизмов, населяющих общую экологическую нишу. Он существует и в природных биотопах (например, водоеме или участке лесной почвы), и у живых многоклеточных организмов-хозяев (человека, животного или растения). В состав микробиома могут входить бактерии, археи и одноклеточные эукариоты — протисты и грибы.
На протяжении трех лет ученые проводили анализ микробиомов двух видов инфузорий: туфелек (Paramecium, или парамеций) и трубачей (Stentor, или стенторов). Результаты исследования инфузорий-туфелек были опубликованы минувшей зимой. Новая публикация — следующий шаг на пути изучения микробиомов протистов.
«Исследования микробиомов человека и животных сейчас очень популярны, но микробиомы протистов только начинают изучать. Ранее вопрос о том, могут ли сами протисты обладать микробиомом, то есть выступать в качестве хозяев для сообщества прокариот, практически не затрагивался, поэтому наши результаты, по сути, формируют новое научное направление», — отмечает руководитель исследования, профессор кафедры микробиологии СПбГУ кандидат биологических наук Алексей Потехин.
Мысль о том, что у инфузорий может быть свой микробиом, возникла не случайно: ученым известно, что эти организмы погибают в стерильных условиях. Для поддержания их в жизнеспособном состоянии необходимо присутствие бактерий в среде. Однако охарактеризовать состав этих бактерий подробно, а также отделить «население» инфузории от обитателей водоема, из которого она была взята, было практически невозможно из-за отсутствия методов. Приблизиться к разгадке позволил метагеномный анализ, который раньше практически не применялся к протистам.
«Этот подход позволяет выявить и прочитать все маркерные последовательности ДНК в образце, по которым можно затем идентифицировать их хозяев (для бактерий и архей это последовательность гена 16S рРНК). Благодаря метагеномному анализу и высокопроизводительному секвенированию в последние 10–15 лет колоссально выросли наши представления о разнообразии микроорганизмов в природе. Мы применили метагеномный анализ для выявления бактерий, ассоциированных с клетками широко распространенных пресноводных инфузорий — Stentor и Paramecium», — рассказывает ученый.
Исследователи выяснили, что состав микроорганизмов в среде обитания инфузорий, будь то природный водоем или лабораторная культура, всегда заметно отличается от совокупности бактерий, в значительном количестве обнаруживающихся в ассоциации с самими инфузориями. Разнообразие микроорганизмов в природных водоемах всегда богаче, чем в клетках инфузорий, однако ученым удалось обнаружить в них представителей десятков родов бактерий. Каждая клетка инфузории оказалась самостоятельной экологической нишей.
«Таким образом, у инфузорий действительно существует собственный микробиом», — подчеркивает Алексей Потехин.
Второй важный вывод, к которому пришли ученые, — микробиом стенторов отличается от микробиома парамеций, то есть разные инфузории, даже выделенные из одного водоема, сосуществуют с разными бактериями. Однако чтобы определить видовые особенности микробиомов, их стабильность и специфичность, понадобятся дальнейшие исследования.
И наконец, третье открытие, которое сделали биологи, — в микробиомах инфузорий, особенно трубачей, живут представители родов бактерий, в которых встречаются виды-комменсалы, оппортунисты и патогены человека и животных (например, Mycobacterium, Streptococcus и Neisseria). Метод исследования не позволяет точно определять виды (только роды), поэтому на данный момент нельзя утверждать, что инфузории являются переносчиками патогенных бактерий.
Метод исследования не позволяет точно определять виды (только роды), поэтому на данный момент нельзя утверждать, что инфузории являются переносчиками патогенных бактерий.
«В любом случае очевидно, что в сожительство с инфузориями вступают преимущественно такие бактерии, которые «умеют» жить в ассоциации с организмами-хозяевами. По всей видимости, эти бактерии, оказавшись вне хозяина, в водоеме, за неимением лучшего приспосабливаются к колонизации протистов — как-никак это крупные эукариотические клетки, сходные с клетками многоклеточных, и выжить некоторое время можно или у них внутри, или снаружи, в зависимости от тактики конкретной бактерии. Бактерии-сожители редко чувствуют себя в таких ассоциациях по-настоящему хорошо для быстрого размножения (их количества, как показал наш анализ, всегда невелики), но им достаточно комфортно для того, чтобы пережить трудные времена. Таким образом, инфузории (и, весьма вероятно, другие протисты) выступают в роли природного резервуара для бактерий, которые оказались вне предпочтительного для них многоклеточного хозяина», — заключает ученый.
Ученые исследовали механизмы размножения семиполой инфузории — РБК
Биологи обнаружили генетические механизмы, с помощью которых инфузория тетрахимена (Tetrahymena thermophila) приобретает один из семи возможных для нее полов. Об этом в четверг пишет Nature News.
Фото: Global Look Press
По информации издания, у молодых инфузорий Tetrahymena thermophila принадлежность к одному из типов спаривания определяется случайно — путем выделения из организма шести «лишних» полоопеределяющих сегментов ДНК. При этом, отмечают ученые, потомство простейшего может иметь любой пол, за исключением того, к которому принадлежит материнский организм.
При этом, отмечают ученые, потомство простейшего может иметь любой пол, за исключением того, к которому принадлежит материнский организм.Это стало возможно благодаря тому, что, как и у других инфузорий, у тетрахимены геном разделен на рабочую и архивную копии, которые содержатся в разных ядрах клетки. Архивная копия передается потомству: в ней и содержатся гены, необходимые для формирования всех семи полов, однако в процессе жизни одноклеточного эти гены никак не проявляются.
Начиная с 1930-х гг. ученым было известно о существовании семиполой инфузории, однако механизм, с помощью которого простейшее определяет свою принадлежность к одному из них, исследован не был.
Как отмечает издание, инфузория тетрахимена является важным объектом для молекулярных биологов: многие механизмы этого уровня впервые были открыты именно при изучении ДНК Tetrahymena thermophila.
Ресничные инфузории: строение
Ресничные инфузории: строение
Инфузории имеют крайне разнообразную форму, но чаще они продольно овальные
(
рис.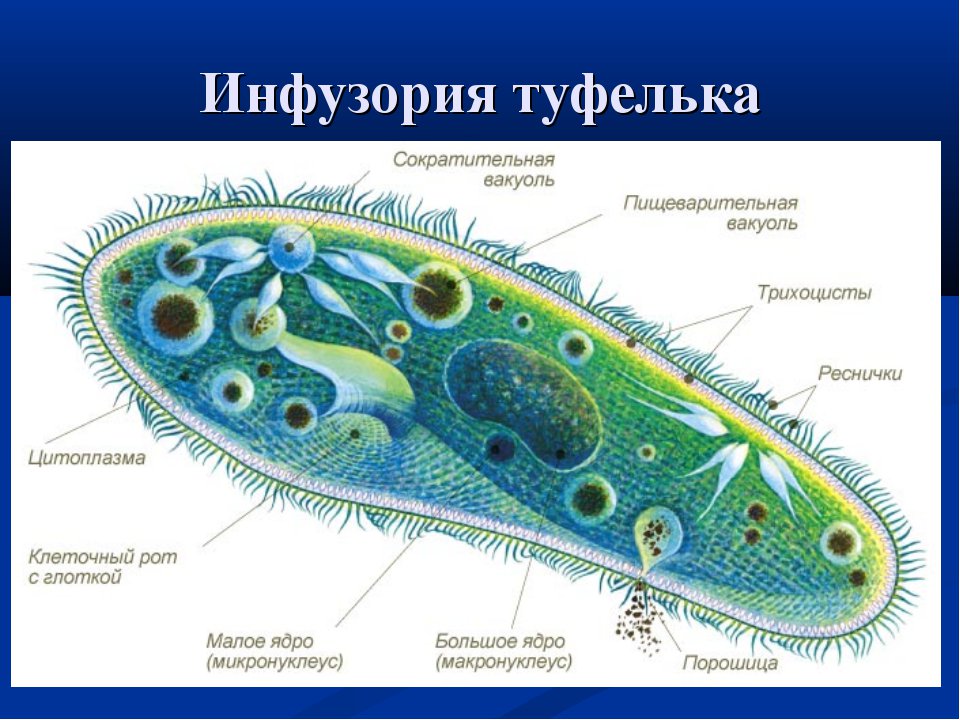 54
). Размеры их варьируют в широких пределах. Длина от 30-40 мкм до
миллиметра и более. Большинство инфузорий относится к числу относительно
крупных одноклеточных организмов. Это наиболее сложно устроенные
простейшие. Цитоплазма всегда ясно разделяется на два слоя — наружный
(эктоплазму, или кортекс) и эндоплазму. Наружный слой эктоплазмы образует
прочную эластичную пелликулу (
табл. I
). Электронная микроскопия показывает, что она слагается из наружной
двойной мембраны, внутренней двойной мембраны и просвета между ними.
Снаружи пелликула часто бывает скульптурирована, образуя закономерно
расположенные утолщения. У инфузории туфельки (Paramecium), например,
утолщения пелликулы представляют собой правильно расположенные
шестиугольники, напоминающие собой пчелиные соты. Подобная
скульптурированность пелликулы повышает ее прочность.
54
). Размеры их варьируют в широких пределах. Длина от 30-40 мкм до
миллиметра и более. Большинство инфузорий относится к числу относительно
крупных одноклеточных организмов. Это наиболее сложно устроенные
простейшие. Цитоплазма всегда ясно разделяется на два слоя — наружный
(эктоплазму, или кортекс) и эндоплазму. Наружный слой эктоплазмы образует
прочную эластичную пелликулу (
табл. I
). Электронная микроскопия показывает, что она слагается из наружной
двойной мембраны, внутренней двойной мембраны и просвета между ними.
Снаружи пелликула часто бывает скульптурирована, образуя закономерно
расположенные утолщения. У инфузории туфельки (Paramecium), например,
утолщения пелликулы представляют собой правильно расположенные
шестиугольники, напоминающие собой пчелиные соты. Подобная
скульптурированность пелликулы повышает ее прочность.
Снаружи тело инфузории покрыто ресничками, которые в эктоплазме берут
начало от
кинетосом
(базальных телец). Число ресничек может быть очень велико; так, у
инфузории туфельки их 10-15 тыс. Ультраструктура ресничек совершенно
идентична таковой
жгутиков
(
табл. I
,
табл. II
). В центре реснички расположены 2 фибриллы, 9 двойных фибрилл проходят по
периферии. Они продолжаются и в кинетосому, где становятся тройными.
Равномерное расположение большого числа ресничек представляет собой
исходный и более примитивный признак для инфузорий.
Ультраструктура ресничек совершенно
идентична таковой
жгутиков
(
табл. I
,
табл. II
). В центре реснички расположены 2 фибриллы, 9 двойных фибрилл проходят по
периферии. Они продолжаются и в кинетосому, где становятся тройными.
Равномерное расположение большого числа ресничек представляет собой
исходный и более примитивный признак для инфузорий.
Специализация локомоторного аппарата идет в двух направлениях. Во- первых,
реснички концентрируются на определенных участках тела. Во- вторых,
отдельные реснички могут сливаться (слипаться), сохраняя свою
индивидуальность, в более крупные и соответственно более мощно работающие
комплексы. Если соединяются реснички, расположенные в один или большее
число рядов, то получается мерцательная перепонка. Такие структуры в
зависимости от длины получают название мембранелл или мембран. Если
соединяются рядом расположенные реснички в виде кисточки, то такие
образования называются цирри (
табл. II
).
Особенно сложный ресничный аппарат дифференцируется обычно в области ротового отверстия, где он приобретает новую функцию — направления пищи к ротовому отверстию.
С кинетосомами связаны три основные системы фибрилл кортекса, в различной степени развитые у разных групп инфузорий. На рис. 56 схематично представлен поперечный разрез кинетосомы (на основе электронно-микроскопических данных) с девятью триплетами перерезанных продольных фибриллей (сравните с рис. 20 ). От кинетосомы отходит поперечно исчерченное волоконце — кинетодесма и два пучка фибрилл, слагающиеся из микротрубочек. Основание кинетосомы окружено подковообразной зоной уплотненной цитоплазмы. На рис. 55 показано соотношение всех названных компонентов в кортексе инфузории Tetrahymena руriformis. Все эти структуры имеют, вероятно, опорное значение.
У некоторых инфузорий в эктоплазме располагаются сократительные волоконца
— мионемы (
табл. I
), благодаря чему такие виды способны к резкому сокращению (Stentor,
Spirostomum).
I
), благодаря чему такие виды способны к резкому сокращению (Stentor,
Spirostomum).
В эктоплазме многих инфузорий залегают особые защитные приспособления — трихоцисты — короткие палочки, контактирующие с наружным слоем пелликулы при посредстве особого выроста и расположенные перпендикулярно поверхности тела. При раздражении животного трихоцисты выстреливают наружу, превращаясь в длинную упругую нить ( табл. I ). Нити вонзаются в тело врага или добычи и, по-видимому, вносят в него какое-то ядовитое вещество, так как оказывают сильное парализующее действие на пораженных животных.
Многие инфузории способны жить при очень различных парциальных давлениях
кислорода. Например, инфузория туфелька, при дыхании поглощающая
значительное количество кислорода, может жить в среде, имеющей лишь следы
кислорода. При этом меняется характер обмена, в котором преобладающее
значение приобретают расщепительные процессы (гликолиз), идущие в
отсутствие кислорода. Некоторые группы паразитических инфузорий (например,
живущие в передних отделах желудка жвачных) всецело существуют за счет
расщепительного обмена, и свободный кислород для них ядовит.
Некоторые группы паразитических инфузорий (например,
живущие в передних отделах желудка жвачных) всецело существуют за счет
расщепительного обмена, и свободный кислород для них ядовит.
Многие инфузории имеют специальные неподвижные освязательные реснички.
Ссылки:
CILIATES IN FISH-BREEDING RESERVOIRS OF KYIV REGION. I. PLANKTON. (Инфузории рыбоводных водоемов Киевской области. I. Планктон.). (In Russian).
6
32 РИБОГОСПОДАРСЬКА НАУКА УКРАЇНИ • № 2/2012
МАТЕРИАЛЫ И МЕТОДЫ
Исследованы нагульный пруд № 5
Таращанской рыбоводно-мелиоративной
станции у с. Тараща (TPMC), пруд Киев-
ской рыбоводно-мелиоративной станции
у с. Здоровка (КРМС), водоем комплек-
сного назначения (фактически — малое
водохранилище) у с. Саливонки (ВКНС).
На других прудах осуществлены несисте-
матические отборы (у с. Снетинка, № 3 и
№ 6 ТРМС). Водоемы (кроме ВКНС и водо-
ема у с. Снетинка) являются спускными.
Площадь спускных нагульных прудов Ки-
евской РМС — 32 га, Таращанской РМС —
8 га, ВКНС — 215 га.
Исследования инфузорий проводили
в 1988–1989 гг. Пробы планктона отби-
рали в двух повторностях на середине
водоемов с помощью батометра Рут-
тнера объемом 3 л на глубине 0,5–1 м
в средней части водоема. Этого вполне
достаточно, поскольку исследованные
водоемы мелководные (глубины до 1,5 м),
с интенсивным ветровым перемеши-
ванием. Часть отобранной пробы в
равных объемах воды сливали в банки
объемом от 250 до 500 мл с герметич-
ными крышками, которые доставляли
в лабораторию, где их обрабатывали в
“живом” состоянии, по возможности мак-
симально быстро. Если по техническим
причинам это было невозможно, пробы
помещали в холодильник при темпера-
туре 6–8°С, что позволяло предотвратить
быстрые качественные и количествен-
ные изменения в сообществах инфу-
зорий.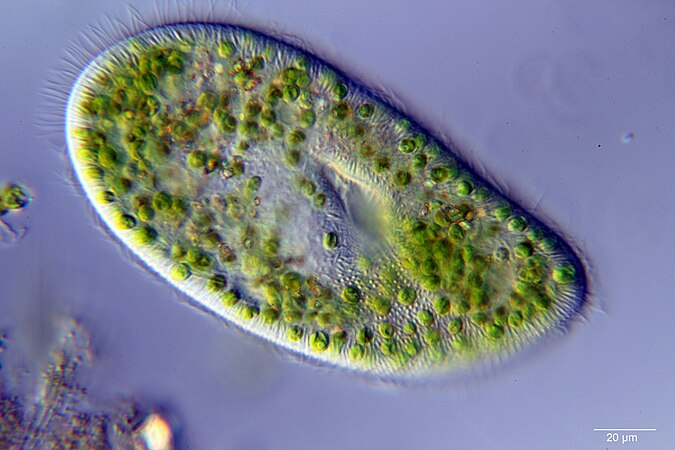 Просчет инфузорий был много-
Просчет инфузорий был много-
уровневым, когда первыми просчиты-
вали наиболее многочисленные виды
путем последовательного просмотра
вытяжек воды из пробы в камере На-
жота, на предметном стекле и в камере
Богорова-Цееба [2, 3 и др.]. Определение
инфузорий проводили в висячей капле
параллельно с просчетом. Для заторма-
живания живых инфузорий применя-
ли раствор оксипропилцеллюлозы [4].
Иногда использовали также несколько
модифицированный “сухой” метод се-
ребрения по Кляйну [16], позволяющий
работать с отдельными клетками инфу-
зорий. Видовое опреде ление инфузорий
проводили с помощью ряда источников
[11–15]. Продукцию и деструкцию ОВ
инфузориями рассчитывали с помощью
формул, представленных в наших ра-
ботах [2, 3].
Кроме инфузорий, учитывали и дру-
гие группы организмов, которые встре-
чались в ходе обработки, в частности,
гетеротрофных жгутиконосцев, ракооб-
разных и коловраток, из них до вида,
как правило, определяли только коло-
враток.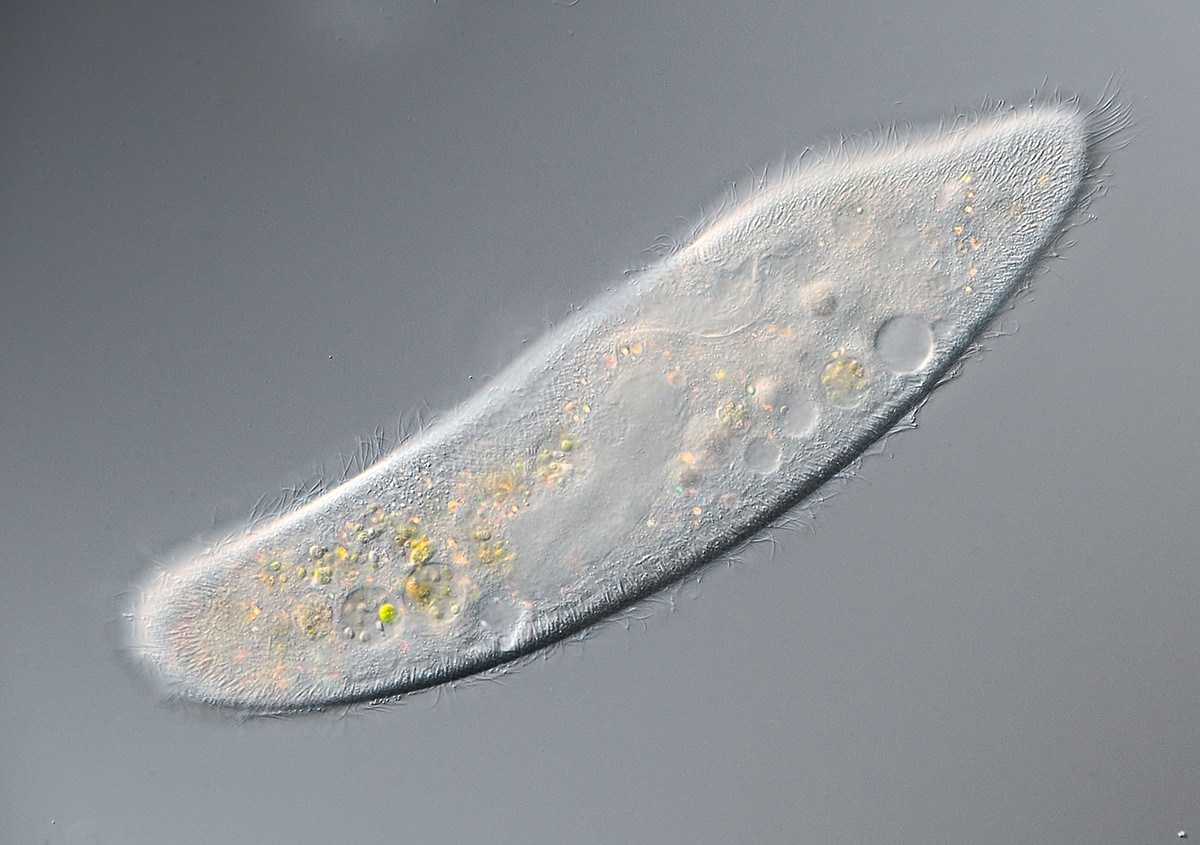
Первичные результаты просчетов
подвергали компьютерной обработке с
помощью авторских специализирован-
ных программ, написанных на языке
Turbo Basic.
Интервалы между отборами проб
составляли от 2 недель до месяца. Боль-
шие интервалы могли возникать по тех-
ническим причинам в холодное время
года. Естественно, если пруды спускные,
отборы в зимнее время становились не-
возможными. Общее количество обрабо-
танных проб — 50.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
И ИХ ОБСУЖДЕНИЕ
В результате исследований в водое-
мах обнаружено 102 вида инфузорий
(табл. 1), в том числе 47 видов и внут-
ривидовых таксонов из класса Kinetof-
ragminophora, 29 — Oligohymenophora,
2 вида из класса Colpodea и 24 — из
Polyhymenophora. В водоеме ВКНС уста-
новлено 55 видов, Тараща № 5 — 66 ви-
дов и КРМС — 73 вида. Зимой выявлен
21 вид инфузорий, весной — 58, летом —
87 и осенью — 49 видов. Наиболее ра-
Наиболее ра-
спространенными видами в изученных
водоемах были C. hirtus, M. balbianii,
P. rouxi, C. margaritaceum и U. halophila,
которые встречались во все сезоны и во
всех изученных водоемах.
Вместе с тем некоторые виды были
весьма редкими и выявлены по одному
разу: A. collaris, B. truncata, C. elongatus,
S. carinata, C. sapropellicum, V. subsinuata,
P. viridis, всего 32 вида инфузорий.
Интересным является нахождение
в составе планктона некоторых видов,
которые ранее считались типично бен-
тосными, а именно: Loxodes magnus и
L. striatus.
Некоторые виды для Украины ранее
не указывались, в частности: Vorticella
subsinuata, Strombidium velox и Colpodi-
dium viridis, который до наших исследо-
А.А. Ковальчук
границ | Подвижные реснички: инновации и выводы из модельных организмов инфузорий
Введение
Инфузории — одноклеточные простейшие, сгруппированные в тип Ciliophora (Cavalier-Smith, 1993). Виды инфузорий разнообразны морфологически, но, как следует из названия, инфузории объединены тем, что содержат множество подвижных ресничек. Paramecium tetaurelia / caudatum и Tetrahymena thermophila — два вида инфузорий, которые оказали наибольшее влияние на наше понимание как подвижных ресничек, так и их основной нуклеирующей / якорной структуры, базального тела.
Виды инфузорий разнообразны морфологически, но, как следует из названия, инфузории объединены тем, что содержат множество подвижных ресничек. Paramecium tetaurelia / caudatum и Tetrahymena thermophila — два вида инфузорий, которые оказали наибольшее влияние на наше понимание как подвижных ресничек, так и их основной нуклеирующей / якорной структуры, базального тела.
И Tetrahymena , и Paramecium являются генетически управляемыми системами. У них полностью секвенированные геномы (Aury et al., 2006; Eisen et al., 2006), и их генетика, хотя и нетрадиционная, хорошо поддается как прямым, так и обратным генетическим подходам, включая геномные нокауты, нокауты и слияния генов ( Bruns, Cassidy-Hanley, 2000; Hai et al., 2000; Kung et al., 2000; Yu, Gorovsky, 2000; Shang et al., 2002b; Beisson et al., 2010). Важно отметить, что реснички ресничек структурно и молекулярно консервативны у высших эукариот (Carvalho-Santos et al., 2011). Их реснички расположены в виде массива, сравнимого с множественными ресничками человека, и их реснички бьются двухфазным движением, похожим на хлыст, что согласуется с их собратьями у людей (Wood et al. , 2007; Funfak et al., 2015) . Возможно, наиболее важным преимуществом инфузорий для исследования ресничек и базального тела является их большое количество ресничек на клетку. Типичная многоклеточная эпителиальная клетка позвоночных содержит 200–300 ресничек на клетку, однако клеток Tetrahymena и Paramecium содержат более 750 и 4000 ресничек на клетку, соответственно (Рисунок 1 и дополнительная таблица S1; Pearson and Winey, 2009). ; Тилли и др., 2015). Большое количество ресничек сделало инфузории идеальной системой как для световой и электронной микроскопии, так и для протеомики. В следующих разделах этого обзора мы специально сконцентрируемся на совместном вкладе Tetrahymena и Paramecium в наше понимание состава, сборки, структуры и функции базальных тел и подвижных ресничек.
, 2007; Funfak et al., 2015) . Возможно, наиболее важным преимуществом инфузорий для исследования ресничек и базального тела является их большое количество ресничек на клетку. Типичная многоклеточная эпителиальная клетка позвоночных содержит 200–300 ресничек на клетку, однако клеток Tetrahymena и Paramecium содержат более 750 и 4000 ресничек на клетку, соответственно (Рисунок 1 и дополнительная таблица S1; Pearson and Winey, 2009). ; Тилли и др., 2015). Большое количество ресничек сделало инфузории идеальной системой как для световой и электронной микроскопии, так и для протеомики. В следующих разделах этого обзора мы специально сконцентрируемся на совместном вкладе Tetrahymena и Paramecium в наше понимание состава, сборки, структуры и функции базальных тел и подвижных ресничек.
Рисунок 1. Иммунофлуоресцентные изображения и схематическое изображение ресничек ресничек и дополнительных структур.Иммунофлуоресцентные изображения клеток Paramecium tetaurelia (слева) и Tetrahymena thermophila (в центре) . Клетка Paramecium tetaurelia (слева) окрашивается на наличие ресничек (α-GT335, белый; α-TAP952, красный), а клетка Tetrahymena thermophila (в центре) окрашивается на базальные тельца (α-центрин, зеленый) и реснички (α-GT335, красный). Масштабная линейка = 10 мкм. Красный прямоугольник на изображении Tetrahymena (в центре) схематично представлен на правом изображении , показывающем вид сверху вниз организации базального тела с соответствующими вспомогательными структурами.CW, колесо телеги; pcMT, пост-ресничные микротрубочки; TM — поперечные микротрубочки; KF, Кинетодесмальное волокно.
Клетка Paramecium tetaurelia (слева) окрашивается на наличие ресничек (α-GT335, белый; α-TAP952, красный), а клетка Tetrahymena thermophila (в центре) окрашивается на базальные тельца (α-центрин, зеленый) и реснички (α-GT335, красный). Масштабная линейка = 10 мкм. Красный прямоугольник на изображении Tetrahymena (в центре) схематично представлен на правом изображении , показывающем вид сверху вниз организации базального тела с соответствующими вспомогательными структурами.CW, колесо телеги; pcMT, пост-ресничные микротрубочки; TM — поперечные микротрубочки; KF, Кинетодесмальное волокно.
Базальные тела
Базальные тельца образуют ядро и закрепляют подвижные реснички в клетке, и как таковые они важны для функции подвижных ресничек. Базальные тела инфузорий дают исследователям ряд преимуществ. Базальные тела инфузорий поразительно сходны с таковыми у других эукариот как по структуре, так и по молекулярному составу (Carvalho-Santos et al. , 2011). Они собираются поэтапно, аналогично центриолям; однако, базальные тела ресничек никогда не функционируют как центриоли (Dippell, 1968; Allen, 1969).Это экспериментально выгодно, потому что базальные дефекты тела никогда не смешиваются с митотическими дефектами. Кроме того, подобно многослойным реснитчатым клеткам, обнаруженным у высших эукариот, таких как человек и Xenopus laevis , базальные тельца ресничек расположены и ориентированы в виде массива через обширную сеть вспомогательных структур (Рисунок 1 и Дополнительная таблица S1) (Bayless et al. ., 2015; Tassin et al., 2015; Zhang, Mitchell, 2015; Vertii et al., 2016). Также были разработаны методы выделения и очистки базальных тел, оставляя исследователям чистые фракции для проведения биохимических и протеомных исследований (Argetsinger, 1965; Tiedtke, 1985).
, 2011). Они собираются поэтапно, аналогично центриолям; однако, базальные тела ресничек никогда не функционируют как центриоли (Dippell, 1968; Allen, 1969).Это экспериментально выгодно, потому что базальные дефекты тела никогда не смешиваются с митотическими дефектами. Кроме того, подобно многослойным реснитчатым клеткам, обнаруженным у высших эукариот, таких как человек и Xenopus laevis , базальные тельца ресничек расположены и ориентированы в виде массива через обширную сеть вспомогательных структур (Рисунок 1 и Дополнительная таблица S1) (Bayless et al. ., 2015; Tassin et al., 2015; Zhang, Mitchell, 2015; Vertii et al., 2016). Также были разработаны методы выделения и очистки базальных тел, оставляя исследователям чистые фракции для проведения биохимических и протеомных исследований (Argetsinger, 1965; Tiedtke, 1985).
Идентификация базальных компонентов тела
Протеом базальных телец Tetrahymena был завершен в 2007 г. (Kilburn et al., 2007). Протеом Tetrahymena в значительной степени перекрывается с двумя другими протеомами базальных тел из центриолей человека и базальных тел Chlamydomonas , открытие, которое подчеркивает высокомолекулярную консервативность между филогенетически удаленными видами (Andersen et al. , 2003; Keller et al. ., 2005). Важно отметить, что протеом Tetrahymena продвинулся в этой области, локализуя идентифицированные белки с помощью GFP-тегирования и иммуно-ЭМ картирования (Kilburn et al., 2007). Эти данные о локализации послужили важным первым шагом в функциональной характеристике многих компонентов, включая основные компоненты базального тела Bld10, Poc1 и Sas6 (Culver et al., 2009; Pearson et al., 2009; Bayless et al., 2012; Meehl et al., 2016).
, 2003; Keller et al. ., 2005). Важно отметить, что протеом Tetrahymena продвинулся в этой области, локализуя идентифицированные белки с помощью GFP-тегирования и иммуно-ЭМ картирования (Kilburn et al., 2007). Эти данные о локализации послужили важным первым шагом в функциональной характеристике многих компонентов, включая основные компоненты базального тела Bld10, Poc1 и Sas6 (Culver et al., 2009; Pearson et al., 2009; Bayless et al., 2012; Meehl et al., 2016).
Сборка и обслуживание базального тела
Сборка базального тела начинается с образования радиально-симметричного колеса тележки, за которым следует добавление и удлинение триплетных микротрубочек к концам каждой спицы колеса тележки.Соседние триплетные микротрубочки соединяются AC-линкерами, тогда все базальное тело закрывается на своем дистальном конце в области, называемой переходной зоной, где триплетные микротрубочки базального тела уступают место дублетным микротрубочкам цилиарной аксонемы (Рисунок 1; Карвальо. -Santos et al., 2010). Первое структурное и временное рассечение ранней сборки базального тела у инфузорий было завершено в конце 1960-х (Dippell, 1968; Allen, 1969). В этих комплексных цитологических исследованиях использовалась электронная микроскопия, чтобы идентифицировать ранние стадии сборки базального тела, включая временное упорядочение сборки колеса тележки и стенок микротрубочек (Dippell, 1968; Allen, 1969).Кроме того, эти исследования четко определяют основные структурные домены базального тела, такие как колесо тележки, линкеры A-C и переходная зона. Некоторые из этих структур хорошо определены в недавних исследованиях электронной томографии (Höög et al., 2012; Li et al., 2012; Meehl et al., 2016; Greenan et al., 2018).
-Santos et al., 2010). Первое структурное и временное рассечение ранней сборки базального тела у инфузорий было завершено в конце 1960-х (Dippell, 1968; Allen, 1969). В этих комплексных цитологических исследованиях использовалась электронная микроскопия, чтобы идентифицировать ранние стадии сборки базального тела, включая временное упорядочение сборки колеса тележки и стенок микротрубочек (Dippell, 1968; Allen, 1969).Кроме того, эти исследования четко определяют основные структурные домены базального тела, такие как колесо тележки, линкеры A-C и переходная зона. Некоторые из этих структур хорошо определены в недавних исследованиях электронной томографии (Höög et al., 2012; Li et al., 2012; Meehl et al., 2016; Greenan et al., 2018).
В основе строения базального тела лежат триплетные микротрубочки. Сборка и стабильность триплетных микротрубочек зависят от ряда неканонических тубулинов, и инфузории оказали влияние на их изучение и классификацию.Существенная роль γ-tubulin на самых ранних стадиях зарождения микротрубочек базального тельца была впервые описана у инфузорий (Ruiz et al. , 1999; Shang et al., 2002a). дельта-тубулин, как было показано в Paramecium , необходим для сборки С-канальца базального тела (Garreau de Loubresse et al., 2001). Более редкие изоформы тубулина ε- и ζ-тубулин также обнаруживаются в инфузориях и необходимы для удвоения и стабилизации базального тельца (Dupuis-Williams et al., 2002; Ruiz et al., 2004; Ross et al., 2013). Tetrahymena также использовался для изучения того, как биение ресничек влияет на распределение белков и посттрансляционных модификаций тубулина в триплетных микротрубочках (Bayless et al., 2016). Из этой работы было показано, что глутамилирование тубулина и триплетный белок Fop1, локализующий микротрубочки, асимметрично связаны с областью базального тела, которая испытывает наибольшую сжимающую силу от биения ресничек (Bayless et al., 2016).
, 1999; Shang et al., 2002a). дельта-тубулин, как было показано в Paramecium , необходим для сборки С-канальца базального тела (Garreau de Loubresse et al., 2001). Более редкие изоформы тубулина ε- и ζ-тубулин также обнаруживаются в инфузориях и необходимы для удвоения и стабилизации базального тельца (Dupuis-Williams et al., 2002; Ruiz et al., 2004; Ross et al., 2013). Tetrahymena также использовался для изучения того, как биение ресничек влияет на распределение белков и посттрансляционных модификаций тубулина в триплетных микротрубочках (Bayless et al., 2016). Из этой работы было показано, что глутамилирование тубулина и триплетный белок Fop1, локализующий микротрубочки, асимметрично связаны с областью базального тела, которая испытывает наибольшую сжимающую силу от биения ресничек (Bayless et al., 2016).
Во многих эукариотических системах сборка базального тела инициируется PLK4 (Habedanck et al., 2005). Инфузории не имеют четкого гомолога PLK4, хотя они действительно содержат многие др. Ключевые белки, участвующие в ранней сборке (Carvalho-Santos et al., 2010). Функциональные исследования основной составляющей колеса телеги, Sas-6, показали, что полностью сформированное колесо телеги необходимо для сборки базального тела (Culver et al., 2009). Прикреплению колеса тележки к триплетным микротрубочкам способствует Bld10, белок, впервые идентифицированный и охарактеризованный в Chlamydomonas , хотя работа с инфузориями установила, что Bld10 необходим для сборки и стабильности базальных тел (Matsuura et al., 2004; Хираки и др., 2007; Jerka-Dziadosz et al., 2010; Bayless et al., 2012). Это не только связь между колесами тележки и триплетными микротрубочками, которая необходима для стабилизации базального тельца, но также необходим линкер A-C между соседними триплетными микротрубочками. Tetrahymena Poc1 необходим для установления линкера A-C между соседними триплетными микротрубочками (Meehl et al., 2016). Когда Poc1 теряется из клеток Tetrahymena , базальные тела распадаются в условиях, когда сила, создаваемая ресничками, увеличивается, подчеркивая роль структурных связей в поддержании общей стабильности базального тела (Pearson et al.
Ключевые белки, участвующие в ранней сборке (Carvalho-Santos et al., 2010). Функциональные исследования основной составляющей колеса телеги, Sas-6, показали, что полностью сформированное колесо телеги необходимо для сборки базального тела (Culver et al., 2009). Прикреплению колеса тележки к триплетным микротрубочкам способствует Bld10, белок, впервые идентифицированный и охарактеризованный в Chlamydomonas , хотя работа с инфузориями установила, что Bld10 необходим для сборки и стабильности базальных тел (Matsuura et al., 2004; Хираки и др., 2007; Jerka-Dziadosz et al., 2010; Bayless et al., 2012). Это не только связь между колесами тележки и триплетными микротрубочками, которая необходима для стабилизации базального тельца, но также необходим линкер A-C между соседними триплетными микротрубочками. Tetrahymena Poc1 необходим для установления линкера A-C между соседними триплетными микротрубочками (Meehl et al., 2016). Когда Poc1 теряется из клеток Tetrahymena , базальные тела распадаются в условиях, когда сила, создаваемая ресничками, увеличивается, подчеркивая роль структурных связей в поддержании общей стабильности базального тела (Pearson et al. , 2009; Meehl et al., 2016).
, 2009; Meehl et al., 2016).
Работа с инфузориями показала, что центрин 2 необходим для удлинения базального тела и образования переходной зоны, тогда как центрин 3 необходим для закрепления базального тела на месте (Guerra et al., 2003; Stemm-Wolf et al., 2005 ; Vonderfecht et al., 2011, 2012; Aubusson-Fleury et al., 2012; Jerka-Dziadosz et al., 2013). Взятые вместе, эти работы представляют большое влияние инфузорий на наше понимание сборки и стабильности базального тела.
Размещение базального тела в матрице
Сложная организация массивов базальных тел инфузорий хорошо изучена. И у Paramecium , и у Tetrahymena базальные тела расположены в ряды, называемые кинети, которые проходят вдоль передне-задней оси клетки (Рисунок 1; Lynn, 1981; Iftode and Fleury-Aubusson, 2003). Расположение базальных телец вдоль кинетиды является сложным и использует координацию по крайней мере трех дополнительных структур: поперечных микротрубочек, постцилиарных микротрубочек и полосатого корешка (кинетодесмального волокна). Две структуры на основе микротрубочек, по-видимому, специфичны для инфузорий с поперечными микротрубочками, доходящими через кинети, и постцилиарными микротрубочками, доходящими за базальное тело внутри кинети (Figure 1; Lynn, 1981; Iftode and Fleury-Aubusson, 2003). Поперечно-полосатый корешок формирует прикрепление базального тела к плазматической мембране и закрепляет его на месте. Поперечно-полосатые корешки обнаруживаются в большинстве систем, содержащих мульти-ресничные клетки, что подчеркивает важность этой корковой связи (Steinman, 1968; Anderson, 1972; Sandoz et al., 1988). В более поздних работах использовался автоматический анализ изображений для выявления трехмерного расположения цилиарного массива Tetrahymena (Galati et al., 2016). В эпохальном исследовании, проверяющем теорию структурного наследования, Джанин Бейссон и Трейси Соннеборн сгенерировали перевернутую кинетику базальных тел в Paramecium и обнаружили, что все вспомогательные структуры, построенные впоследствии, стали перевернутыми, чтобы соответствовать перевернутому положению базальных тел (Beisson and Sonneborn, 1965).
Две структуры на основе микротрубочек, по-видимому, специфичны для инфузорий с поперечными микротрубочками, доходящими через кинети, и постцилиарными микротрубочками, доходящими за базальное тело внутри кинети (Figure 1; Lynn, 1981; Iftode and Fleury-Aubusson, 2003). Поперечно-полосатый корешок формирует прикрепление базального тела к плазматической мембране и закрепляет его на месте. Поперечно-полосатые корешки обнаруживаются в большинстве систем, содержащих мульти-ресничные клетки, что подчеркивает важность этой корковой связи (Steinman, 1968; Anderson, 1972; Sandoz et al., 1988). В более поздних работах использовался автоматический анализ изображений для выявления трехмерного расположения цилиарного массива Tetrahymena (Galati et al., 2016). В эпохальном исследовании, проверяющем теорию структурного наследования, Джанин Бейссон и Трейси Соннеборн сгенерировали перевернутую кинетику базальных тел в Paramecium и обнаружили, что все вспомогательные структуры, построенные впоследствии, стали перевернутыми, чтобы соответствовать перевернутому положению базальных тел (Beisson and Sonneborn, 1965). Этот эксперимент продемонстрировал, что не вся информация кодируется ДНК, но некоторая на самом деле является эпигенетической. Результат, который позже был воспроизведен в Tetrahymena (Ng and Frankel, 1977). Более того, кинетодесмальные волокна изменяют свою длину в ответ на измененные силы, генерируемые ресничками, подтверждая, что структурное наследование настраивается и способно адаптироваться к сигналам окружающей среды (Galati et al., 2016).
Этот эксперимент продемонстрировал, что не вся информация кодируется ДНК, но некоторая на самом деле является эпигенетической. Результат, который позже был воспроизведен в Tetrahymena (Ng and Frankel, 1977). Более того, кинетодесмальные волокна изменяют свою длину в ответ на измененные силы, генерируемые ресничками, подтверждая, что структурное наследование настраивается и способно адаптироваться к сигналам окружающей среды (Galati et al., 2016).
Молекулярный состав дополнительных структур базального тела четко не определен, но инфузории внесли большой вклад в то, что мы знаем.Поперечно-полосатое волокно Tetrahymena состоит, по крайней мере частично, из белка DisAp (Galati et al., 2014). Ориентация базальных тел нарушается из-за потери Paramecium белков Meckelin и Centrin 3, тогда как ODF-1 и VFL3 необходимы для стыковки базальных тел Paramecium с корой клеток (Jerka-Dziadosz et al., 2013; Picariello et al., 2014; Bengueddach et al., 2017). Эти исследования подчеркивают силу подходов к обратной генетике инфузорий. Недавняя работа также установила связь между глицилированием посттрансляционной модификации тубулина и прикреплением базальных тел Tetrahymena к коре клеток (Junker et al., 2019). Сборка, поддержание и точное позиционирование базальных тел остается важной основой для построения функциональных ресничек, а инфузории остаются и будут оставаться в авангарде исследований базальных тел.
Недавняя работа также установила связь между глицилированием посттрансляционной модификации тубулина и прикреплением базальных тел Tetrahymena к коре клеток (Junker et al., 2019). Сборка, поддержание и точное позиционирование базальных тел остается важной основой для построения функциональных ресничек, а инфузории остаются и будут оставаться в авангарде исследований базальных тел.
Подвижные реснички
Подвижные реснички и жгутики выполняют функцию перемещения внеклеточной жидкости. Структурно подвижная ресничка ресничек обычно состоит из девяти наборов дублетных микротрубочек, расположенных радиально вокруг центральной пары одиночных микротрубочек. Эти реснички бьются двухфазным образом, похожим на хлыст, который согласуется с подвижными ресничками человеческих клеток (дополнительная таблица S1; Tuxhorn et al., 1998; Bayless et al., 2015; Funfak et al., 2015). Экспериментально генетические методы, такие как маркировка белков, позволяют легко визуализировать реснички, и простого кальциевого шока достаточно для отделения ресничек от клетки, что позволяет легко изолировать их для биохимических анализов (Rosenbaum and Carlson, 1969; Adoutte et al.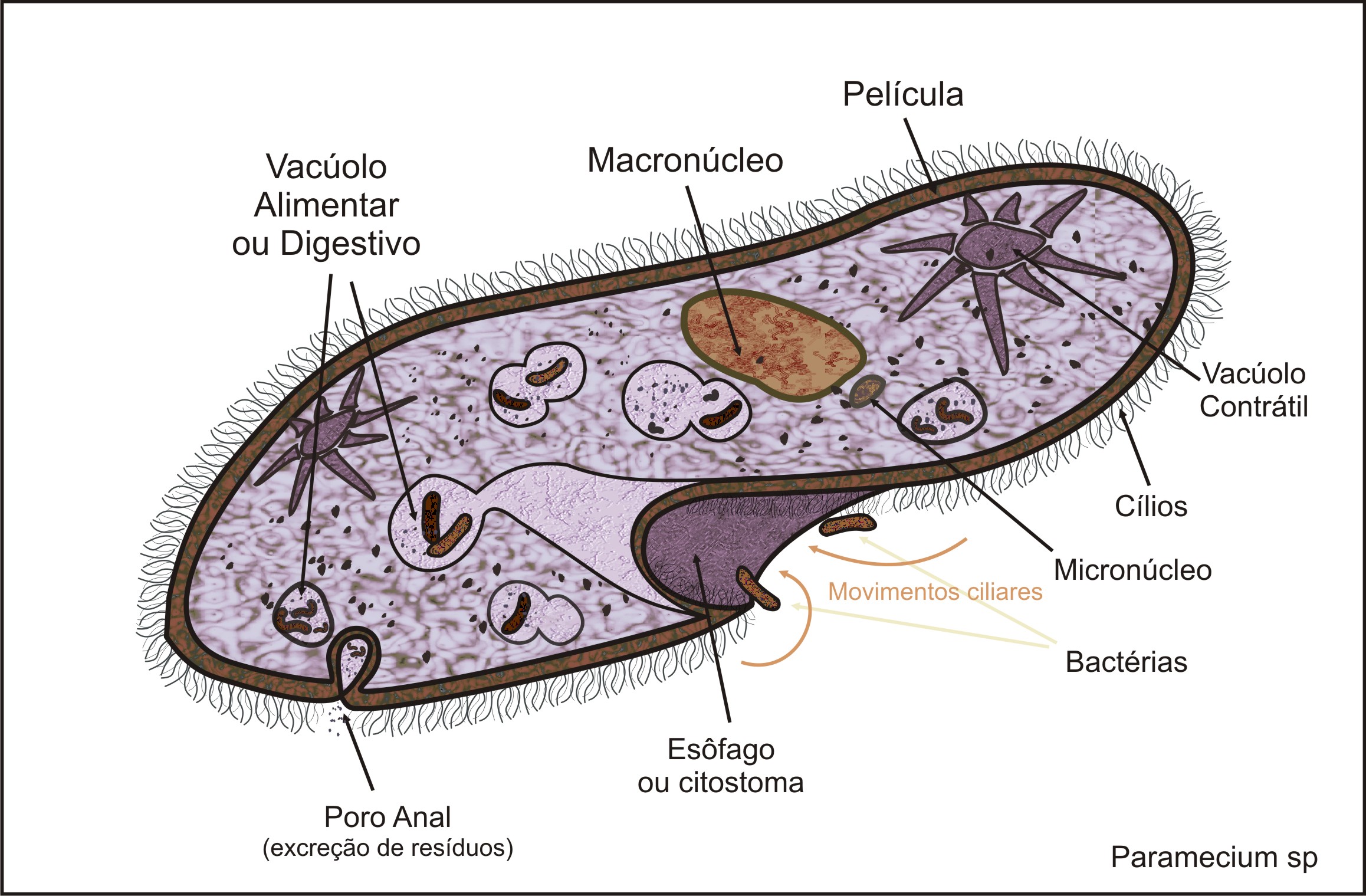 , 1980). Как описано ниже, исследования с использованием инфузорий сделали многое для освещения молекулярного состава, структуры, сборки и функции подвижных ресничек.
, 1980). Как описано ниже, исследования с использованием инфузорий сделали многое для освещения молекулярного состава, структуры, сборки и функции подвижных ресничек.
Идентификация подвижных компонентов ресничек
Многие из тех же способов, которыми инфузории были эффективны для идентификации молекулярных компонентов базальных телец, инфузории также успешно использовались для идентификации молекулярных компонентов подвижных ресничек.Существенное перекрытие между протеомами ресничек позвоночных и протистов было выявлено в масс-спектрометрическом скрининге с использованием ресничек Tetrahymena , названных «цилиомами» (Smith et al., 2005). Выделение и очистка цилиарной мембраны Paramecium также дала протеом цилиарной мембраны, первый в своем роде (Yano et al., 2013). Помимо протеомики, профили экспрессии всего генома использовались для идентификации генов, которые активируются во время цилиогенеза, что является хорошей отправной точкой для нового открытия и характеристики белков цилиогенеза (Arnaiz et al. , 2010).
, 2010).
Структура подвижных ресничек
Как и в случае с базальными тельцами, электронная микроскопия использовалась для исследования структурного состава реснитчатых аксонем ресничек. Подробный цитологический анализ переходной зоны между базальными тельцами и аксонемами ресничек был проведен как в Paramecium , так и в Tetrahymena (Dippell, 1968; Allen, 1969; Hufnagel, 1969; Dute and Kung, 1978). На дистальном конце аксонемы окончание центральной пары микротрубочек и кончик ресничек впервые были подробно описаны в аксонемах Tetrahymena (Sale and Satir, 1977). Tetrahymena аксонемы также использовались в тонкой структурной работе, детализируя комплексы динеина радиальной спицы и аксонемы, которые необходимы для движения ресничек (Gastedough and Heuser, 1985).
Возможно, самое большое влияние, которое инфузории оказали в области структуры ресничек, произошло благодаря использованию криоэлектронной микроскопии одиночных частиц (крио-ЭМ) и криоэлектронной томографии (крио-ЭТ) для исследования структуры дублета ресничек. микротрубочки. Дублетные микротрубочки исключительно стабильны, что делает их идеальным субстратом для крио-ЭМ и крио-ЭТ.В ранних исследованиях использовались жгутики сперматозоидов морского ежа для крио-ЭМ / ЭТ, в последнее время предпочтительными модельными системами стали жгутиков Chlamydomonas, и аксонем Tetrahymena, (Pigino et al., 2012). В настоящее время одночастичная крио-ЭМ аксонем Tetrahymena достигла лучшего разрешения дублетных микротрубочек на сегодняшний день при разрешении ниже нанометра (Ichikawa et al., 2017). Есть две области, где крио-ЭМ и крио-ЭТ структурная работа из аксонем Tetrahymena оказала влияние: наше понимание механизма за пределами дублетных микротрубочек и наше понимание внутренней части дублетных микротрубочек.Белки радиальных спиц и динеиновые рукава заставляют двигаться подвижные реснички. Структура этих больших комплексов была выяснена с помощью структурных исследований Chlamydomonas , а также с помощью Tetrahymena (Pigino et al.
микротрубочки. Дублетные микротрубочки исключительно стабильны, что делает их идеальным субстратом для крио-ЭМ и крио-ЭТ.В ранних исследованиях использовались жгутики сперматозоидов морского ежа для крио-ЭМ / ЭТ, в последнее время предпочтительными модельными системами стали жгутиков Chlamydomonas, и аксонем Tetrahymena, (Pigino et al., 2012). В настоящее время одночастичная крио-ЭМ аксонем Tetrahymena достигла лучшего разрешения дублетных микротрубочек на сегодняшний день при разрешении ниже нанометра (Ichikawa et al., 2017). Есть две области, где крио-ЭМ и крио-ЭТ структурная работа из аксонем Tetrahymena оказала влияние: наше понимание механизма за пределами дублетных микротрубочек и наше понимание внутренней части дублетных микротрубочек.Белки радиальных спиц и динеиновые рукава заставляют двигаться подвижные реснички. Структура этих больших комплексов была выяснена с помощью структурных исследований Chlamydomonas , а также с помощью Tetrahymena (Pigino et al. , 2011). Также было показано, что в просвете дублетных микротрубочек есть сложные сети белков, которые называются внутренними белками микротрубочек или MIP (Рисунок 2; Ichikawa et al., 2017; Ichikawa and Bui, 2018; Stoddard et al., 2018). Полагают, что эти MIP стабилизируют дублетную микротрубочку, чтобы обеспечить повторное изгибание без разрыва.Структурные исследования дублетных микротрубочек у инфузорий показали нам, насколько сложна аксонема, подчеркивая важность точного процесса сборки.
, 2011). Также было показано, что в просвете дублетных микротрубочек есть сложные сети белков, которые называются внутренними белками микротрубочек или MIP (Рисунок 2; Ichikawa et al., 2017; Ichikawa and Bui, 2018; Stoddard et al., 2018). Полагают, что эти MIP стабилизируют дублетную микротрубочку, чтобы обеспечить повторное изгибание без разрыва.Структурные исследования дублетных микротрубочек у инфузорий показали нам, насколько сложна аксонема, подчеркивая важность точного процесса сборки.
Рис. 2. Структура микротрубочек дублета аксонемы. Поперечный разрез микротрубочек дублета цилиарного аксонемы. Показаны A- и B-канальцы. Протофиламенты тубулина окрашены в серый цвет и пронумерованы. Внутренние белки микротрубочек (MIP) и нитчатые MIP (fMIP) различаются по цвету, как показано в таблице справа.По материалам Ichikawa and Bui (2018) и Stoddard et al. (2018).
Сборка подвижных ресничек
Сборка подвижных ресничек происходит посредством согласованного процесса, называемого внутрижладжеллярным транспортом (IFT; Nakayama and Katoh, 2018).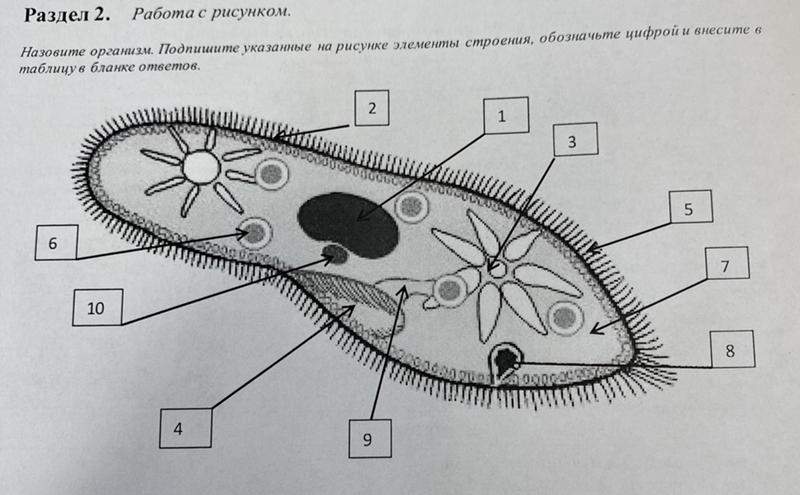 Инфузории имеют двоякое преимущество при изучении сборки ресничек. Во-первых, инфузории имеют большое количество ресничек. Во-вторых, сборка ресничек может быть индуцирована и отслеживаться в реальном времени (Jiang et al., 2015). Первым шагом в сборке реснички является установка ресничного колпачка.В Tetrahymena это многоступенчатый процесс, включающий слияние трех различных структур (Seixas et al., 2017). После создания цилиарного колпачка IFT используется для сборки аксонемы. В Paramecium IFT46 необходим для перемещения других компонентов IFT между цитоплазмой и аксонемой ресничек, что делает его вышестоящим регулятором IFT (Shi et al., 2018). В аксонемах Chlamydomonas и Paramecium неспособность IFT транспортировать аксонемный динеин в ресничку приводит к коротким ресничкам, которые неподвижны (Fassad et al., 2018). Кроме того, было показано, что поезда IFT выстраиваются в очередь у основания аксонем Chlamydomonas и Tetrahymena , ожидая своей очереди во время сборки (Wingfield et al.
Инфузории имеют двоякое преимущество при изучении сборки ресничек. Во-первых, инфузории имеют большое количество ресничек. Во-вторых, сборка ресничек может быть индуцирована и отслеживаться в реальном времени (Jiang et al., 2015). Первым шагом в сборке реснички является установка ресничного колпачка.В Tetrahymena это многоступенчатый процесс, включающий слияние трех различных структур (Seixas et al., 2017). После создания цилиарного колпачка IFT используется для сборки аксонемы. В Paramecium IFT46 необходим для перемещения других компонентов IFT между цитоплазмой и аксонемой ресничек, что делает его вышестоящим регулятором IFT (Shi et al., 2018). В аксонемах Chlamydomonas и Paramecium неспособность IFT транспортировать аксонемный динеин в ресничку приводит к коротким ресничкам, которые неподвижны (Fassad et al., 2018). Кроме того, было показано, что поезда IFT выстраиваются в очередь у основания аксонем Chlamydomonas и Tetrahymena , ожидая своей очереди во время сборки (Wingfield et al. , 2017). Интересно, что член семейства киназ Tetrahymena LF4 / MOK, LF4a, регулирует длину ресничек, ограничивая скорость IFT (Jiang et al., 2019). Помимо механизмов, связанных с IFT, инфузории выделили многие др. Белки, необходимые для сборки аксонемы ресничек. Tetrahymena Dyf-1 необходим для цилиогенеза, как и PHLP2, оба из которых помогают в сборке микротрубочек аксонемы (Dave et al., 2009; Bregier et al., 2013). Микротрубочки аксонемы также демонстрируют тщательную координацию контроля своей длины. В аксонемах Tetrahymena FAP256 / CEP104 способствует удлинению A-канальцев, тогда как CHE-12 / Crescerin и ARMC9 специфически регулируют длину B-канальцев (Louka et al., 2018). В целом работа инфузорий помогла нам понять сложности сборки ресничек, в частности нюансы IFT.
, 2017). Интересно, что член семейства киназ Tetrahymena LF4 / MOK, LF4a, регулирует длину ресничек, ограничивая скорость IFT (Jiang et al., 2019). Помимо механизмов, связанных с IFT, инфузории выделили многие др. Белки, необходимые для сборки аксонемы ресничек. Tetrahymena Dyf-1 необходим для цилиогенеза, как и PHLP2, оба из которых помогают в сборке микротрубочек аксонемы (Dave et al., 2009; Bregier et al., 2013). Микротрубочки аксонемы также демонстрируют тщательную координацию контроля своей длины. В аксонемах Tetrahymena FAP256 / CEP104 способствует удлинению A-канальцев, тогда как CHE-12 / Crescerin и ARMC9 специфически регулируют длину B-канальцев (Louka et al., 2018). В целом работа инфузорий помогла нам понять сложности сборки ресничек, в частности нюансы IFT.
Функция подвижных ресничек
Биение ресничек — сложный процесс, требующий многих молекулярных взаимодействий.Во время биений цилиарный аксонема д. Поддерживать регулярную форму волны, оставаясь согласованной со своими соседними ресничками (Wan, 2018). С помощью инфузорий был дан ответ на один из самых фундаментальных вопросов о подвижных ресничках: как движутся реснички? В 1960-х Ян Гиббонс идентифицировал и очищал аксонемальный динеин из аксонем Tetrahymena (Гиббонс, 1963; Гиббонс и Роу, 1965). Это был первый идентифицированный молекулярный мотор микротрубочек, и его открытие представляет собой важную веху в клеточной биологии.Последующие исследования с использованием ресничек Paramecium и Tetrahymena определили, как сила скольжения между дублетными микротрубочками преобразуется в силу изгиба, которая наблюдается во время биения, и потребность в передаче сигналов кальция и кальция для распространения биения ресничек (Bancroft, 1906). ; Satir, 1965, 1968; Mogami, Takahashi, 1983; Funfak et al., 2015; Yano et al., 2015). Эти работы представляют собой значительный прогресс в нашем понимании того, как облегчается биение ресничек.
С помощью инфузорий был дан ответ на один из самых фундаментальных вопросов о подвижных ресничках: как движутся реснички? В 1960-х Ян Гиббонс идентифицировал и очищал аксонемальный динеин из аксонем Tetrahymena (Гиббонс, 1963; Гиббонс и Роу, 1965). Это был первый идентифицированный молекулярный мотор микротрубочек, и его открытие представляет собой важную веху в клеточной биологии.Последующие исследования с использованием ресничек Paramecium и Tetrahymena определили, как сила скольжения между дублетными микротрубочками преобразуется в силу изгиба, которая наблюдается во время биения, и потребность в передаче сигналов кальция и кальция для распространения биения ресничек (Bancroft, 1906). ; Satir, 1965, 1968; Mogami, Takahashi, 1983; Funfak et al., 2015; Yano et al., 2015). Эти работы представляют собой значительный прогресс в нашем понимании того, как облегчается биение ресничек.
На молекулярном уровне легкость обратных генетических подходов у инфузорий делает возможным направленное исследование белков ресничек. Консервативный ленточный белок протофиламентов, Rib72, является не только MIP, но и необходим для локализации большинства MIP в A-канальце аксонем цилиарной системы Tetrahymena (Stoddard et al., 2018). Когда MIP A-канальца теряются из аксонем, структурная целостность аксонемы нарушается, что приводит к аномальному изгибу ресничек при их движении через типичный жесткий силовой удар (Stoddard et al., 2018). В результате нарушается их форма волны и координация с соседними ресничками, указывая тем самым, что MIPs играют важную роль в структурной поддержке аксонемы ресничек (Figure 2). Tetrahymena также использовались для функциональной характеристики цилиарных компонентов радиальных спиц и динеиновых плеч, и оба они необходимы для правильного биения ресничек (Urbanska et al., 2015, 2018).
Консервативный ленточный белок протофиламентов, Rib72, является не только MIP, но и необходим для локализации большинства MIP в A-канальце аксонем цилиарной системы Tetrahymena (Stoddard et al., 2018). Когда MIP A-канальца теряются из аксонем, структурная целостность аксонемы нарушается, что приводит к аномальному изгибу ресничек при их движении через типичный жесткий силовой удар (Stoddard et al., 2018). В результате нарушается их форма волны и координация с соседними ресничками, указывая тем самым, что MIPs играют важную роль в структурной поддержке аксонемы ресничек (Figure 2). Tetrahymena также использовались для функциональной характеристики цилиарных компонентов радиальных спиц и динеиновых плеч, и оба они необходимы для правильного биения ресничек (Urbanska et al., 2015, 2018).
Последней и важной областью исследований, в которую внесли большой вклад инфузории, является изучение посттрансляционных модификаций тубулина.Ацетилирование тубулина — обычная посттрансляционная модификация, обнаруживаемая в стабильных популяциях микротрубочек. Ацетилтрансфераза MEC-17 отвечает за ацетилирование тубулина K40 и впервые была идентифицирована в Tetrahymena (Akella et al., 2010). Идентификация и характеристика семейства TTLL модифицирующих тубулин ферментов также была проведена в Tetrahymena (Janke et al., 2005). Из этих исследований мы обнаружили, что глутамилирование и глицилирование тубулина влияют на стабильность и форму волны биения ресничек в аксонемах Tetrahymena (Wloga et al., 2008, 2009, 2010; Сурьяванши и др., 2010; Юнкер и др., 2019). В целом, инфузории использовались, чтобы продемонстрировать, как действуют подвижные реснички и молекулярные игроки, которые влияют на структуру и функцию ресничек.
Перспективы и перспективы на будущее
Сильные стороны исследования ресничек на ресничках заключаются в их благоприятной генетике и большом количестве ресничек в каждой клетке. Простота выделения базальных телец и ресничек в сочетании с легкостью функциональной характеристики специфических компонентов ресничек гарантирует, что инфузории будут жизнеспособным вариантом для исследования базальных тельцов и подвижных ресничек. Разрешение, достигаемое с помощью однокомпонентных крио-ЭМ и крио-ЭТ аксонем Tetrahymena , является захватывающим и представляет собой многообещающую платформу для будущих структурных работ. Инфузории также готовы сыграть большую роль в понимании биомеханики биения ресничек. У инфузорий возможна высокоскоростная визуализация биения ресничек, и ее использование в сочетании с генетическим изучением конкретных белков будет важно для понимания того, как выполняется и поддерживается биение ресничек, напоминающее хлыст (Funfak et al., 2015; Стоддард и др., 2018). Процесс разборки ресничек изучен недостаточно, и простота индукции децилиации инфузорий может оказаться важной для будущих исследований. Кроме того, инфузории хорошо подходят для изучения цилиарных заболеваний человека. Генетические варианты первичной цилиарной дискинезии (PCD) были смоделированы в Paramecium , предлагая беспрецедентное понимание патологии этого разрушительного расстройства (Fassad et al., 2018). Учитывая уже достигнутые успехи и открывающиеся возможности для изучения, есть основания полагать, что у исследований инфузорий блестящее будущее и лучшее еще впереди.
Разрешение, достигаемое с помощью однокомпонентных крио-ЭМ и крио-ЭТ аксонем Tetrahymena , является захватывающим и представляет собой многообещающую платформу для будущих структурных работ. Инфузории также готовы сыграть большую роль в понимании биомеханики биения ресничек. У инфузорий возможна высокоскоростная визуализация биения ресничек, и ее использование в сочетании с генетическим изучением конкретных белков будет важно для понимания того, как выполняется и поддерживается биение ресничек, напоминающее хлыст (Funfak et al., 2015; Стоддард и др., 2018). Процесс разборки ресничек изучен недостаточно, и простота индукции децилиации инфузорий может оказаться важной для будущих исследований. Кроме того, инфузории хорошо подходят для изучения цилиарных заболеваний человека. Генетические варианты первичной цилиарной дискинезии (PCD) были смоделированы в Paramecium , предлагая беспрецедентное понимание патологии этого разрушительного расстройства (Fassad et al., 2018). Учитывая уже достигнутые успехи и открывающиеся возможности для изучения, есть основания полагать, что у исследований инфузорий блестящее будущее и лучшее еще впереди.
Авторские взносы
BB и MW задумали и написали рукопись. FN создал цифры и легенды.
Финансирование
Эта работа была поддержана финансированием Национальных институтов здравоохранения (GM127571-02, MW), Университета Санта-Клары через грант декана на стартап от Колледжа искусств и наук (BB) и Программу стипендий Клэр Бут-Люс (FN). .
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотели бы поблагодарить Сэма Ли и Эми Фабрициус за их критическое прочтение и проницательные комментарии к рукописи. Авторы также хотели бы поблагодарить Анн-Мари Тассен и Пьера ле Борна за изображение Paramecium , используемое на Рисунке 1.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www. frontiersin.org/articles/10.3389/fcell.2019.00265/full#supplementary-material
frontiersin.org/articles/10.3389/fcell.2019.00265/full#supplementary-material
ТАБЛИЦА S1 | Сравнение обычных модельных организмов, используемых в исследованиях подвижных ресничек.
Список литературы
Adoutte, A., Ramanathan, R., Lewis, R.M., Dute, R.R., Ling, K.Y., Kung, C., et al. (1980). Биохимические исследования возбудимой мембраны Paramecium tetraurelia . III. Белки ресничек и ресничных оболочек. J. Cell Biol. 84, 717–738. DOI: 10.1083 / jcb.84.3.717
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Акелла, Дж. С., Влога, Д., Ким, Дж., Старостина, Н. Г., Лайонс-Эбботт, С., Морриссетт, Н.S., et al. (2010). MEC-17 представляет собой альфа-тубулинацетилтрансферазу. Природа 467, 218–222. DOI: 10.1038 / nature09324
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аллен Р. Д. (1969). Морфогенез базальных телец и добавочных структур коры мерцательного простейшего Tetrahymena pyriformis . J. Cell Biol. 40, 716–733. DOI: 10.1083 / jcb.40.3.716
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андерсен, Дж.С., Уилкинсон, К. Дж., Мэр, Т., Мортенсен, П., Нигг, Э. А., и Манн, М. (2003). Протеомная характеристика центросомы человека с помощью профилирования корреляции белков. Природа 426, 570–574. DOI: 10.1038 / nature02166
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Arnaiz, O., Goût, J.-F., Bétermier, M., Bouhouche, K., Cohen, J., Duret, L., et al. (2010). Экспрессия гена в палеополиплоиде: ресурс транскриптома для инфузории Paramecium tetraurelia . BMC Genomics 11: 547. DOI: 10.1186 / 1471-2164-11-547
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Обюссон-Флери, А., Лемуллуа, М., де Лубресс, Н.Г., Лалинь, К., Коэн, Дж., Роснет, О. и др. (2012). Консервативный центросомный белок FOR20 необходим для сборки переходной зоны и стыковки базальных тел на поверхности клетки.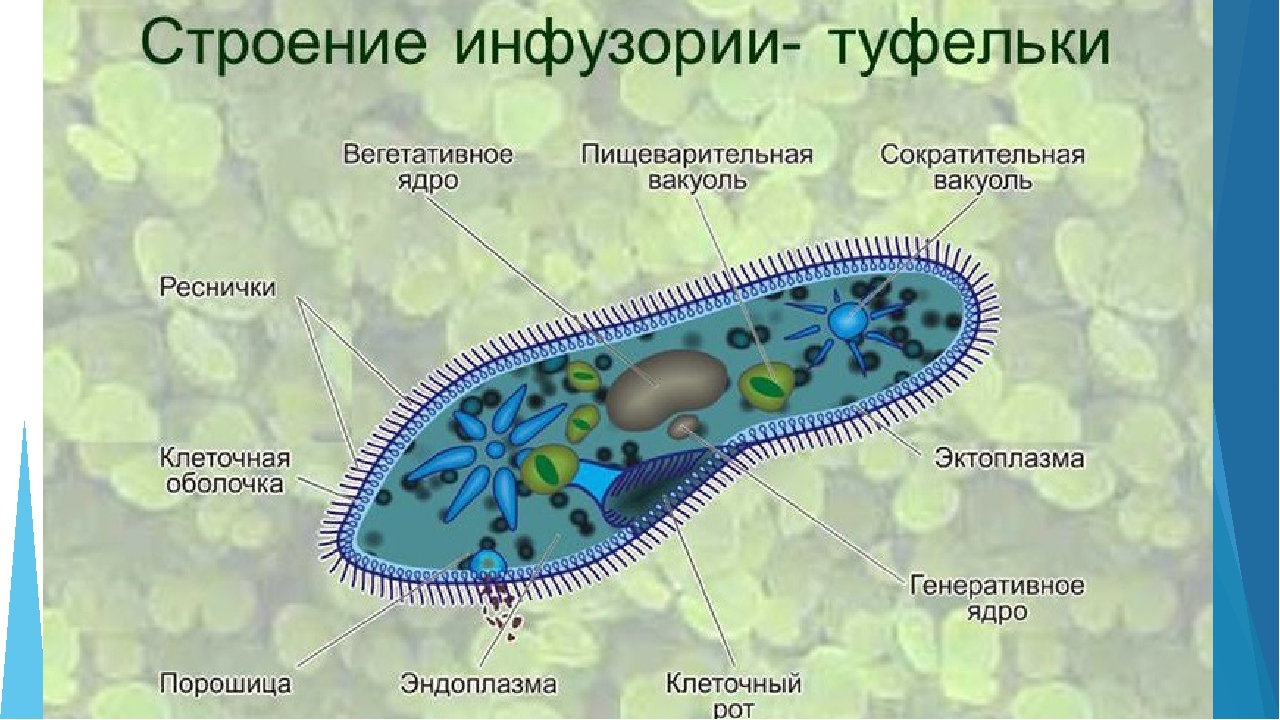 J. Cell Sci. 125, 4395–4404. DOI: 10.1242 / jcs.108639
J. Cell Sci. 125, 4395–4404. DOI: 10.1242 / jcs.108639
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аури, Дж.-M., Jaillon, O., Duret, L., Noel, B., Jubin, C., Porcel, B.M, et al. (2006). Глобальные тенденции полногеномных дупликаций инфузории Paramecium tetraurelia . Природа 444, 171–178.
PubMed Аннотация | Google Scholar
Бэнкрофт, Ф. У. (1906). О влиянии относительной концентрации ионов кальция на изменение полярных эффектов гальванического тока в Paramecium . J. Physiol. 34, 444–463. DOI: 10.1113 / jphysiol.1906.sp001167
CrossRef Полный текст | Google Scholar
Бэйлесс, Б. А., Галати, Д. Ф., Юнкер, А. Д., Бэкер, К. Б., Гэртиг, Дж., И Пирсон, К. Г. (2016). Асимметрично локализованные белки стабилизируют базальные тельца против сил биения ресничек. J. Cell Biol. 215, 457–466. DOI: 10.1083 / jcb.201604135
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бэйлесс, Б. А., Гиддингс, Т.Х., Вини, М., и Пирсон, К.Г. (2012).Bld10 / Cep135 стабилизирует базальные тельца, чтобы противостоять силам, создаваемым ресничками. Мол. Биол. Cell 23, 4820–4832. DOI: 10.1091 / mbc.E12-08-0577
А., Гиддингс, Т.Х., Вини, М., и Пирсон, К.Г. (2012).Bld10 / Cep135 стабилизирует базальные тельца, чтобы противостоять силам, создаваемым ресничками. Мол. Биол. Cell 23, 4820–4832. DOI: 10.1091 / mbc.E12-08-0577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Beisson, J., Bétermier, M., Bré, M.-H., Cohen, J., Duharcourt, S., Duret, L., et al. (2010). Подавление специфических генов Paramecium tetraurelia путем кормления двухцепочечной РНК. Харб Холодного источника. Protoc. , 2010: 5363.
Google Scholar
Бейссон, Дж., и Соннеборн, Т. М. (1965). Цитоплазматическая наследственность организации клеточной коры у Paramecium aurelia . Proc. Natl. Акад. Sci. США 53, 275–282. DOI: 10.1073 / pnas.53.2.275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенгуеддах, Х., Лемуллуа, М., Обюссон-Флери, А., и Колл, Ф. (2017). Позиционирование и закрепление базального тела в многоцелевой клетке Paramecium tetraurelia : роли OFD1 и VFL3. Реснички 6: 6.DOI: 10.1186 / s13630-017-0050-z
Реснички 6: 6.DOI: 10.1186 / s13630-017-0050-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bregier, C., Krzemień-Ojak, L., Włoga, D., Jerka-Dziadosz, M., Joachimiak, E., Batko, K., et al. (2013). PHLP2 важен и играет роль в цилиогенезе и сборке микротрубочек у Tetrahymena thermophila . J. Cell. Physiol. 228, 2175–2189. DOI: 10.1002 / jcp.24384
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брунс, П.Дж., И Кэссиди-Хэнли, Д. (2000). Биолистическая трансформация макро- и микроядер. Methods Cell Biol. 62, 501–512. DOI: 10.1016 / s0091-679x (08) 61553-8
CrossRef Полный текст | Google Scholar
Карвалью-Сантос, З., Азимзаде, Дж., Перейра-Лил, Дж. Б., и Беттанкур-Диас, М. (2011). Эволюция: прослеживание происхождения центриолей, ресничек и жгутиков. J. Cell Biol. 194, 165–175. DOI: 10.1083 / jcb.201011152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Carvalho-Santos, Z. , Machado, P., Branco, P., Tavares-Cadete, F., Rodrigues-Martins, A., Pereira-Leal, J. B., et al. (2010). Поэтапная эволюция пути сборки центриолей. J. Cell Sci. 123, 1414–1426. DOI: 10.1242 / jcs.064931
, Machado, P., Branco, P., Tavares-Cadete, F., Rodrigues-Martins, A., Pereira-Leal, J. B., et al. (2010). Поэтапная эволюция пути сборки центриолей. J. Cell Sci. 123, 1414–1426. DOI: 10.1242 / jcs.064931
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калвер, Б. П., Мил, Дж. Б., Гиддингс, Т. Х. и Вини, М. (2009). Два гомолога SAS-6 в Tetrahymena thermophila выполняют различные функции в сборке базального тела. Мол.Биол. Cell 20, 1865–1877. DOI: 10.1091 / mbc.E08-08-0838
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэйв Д., Влога Д., Шарма Н. и Гэртиг Дж. (2009). DYF-1 Требуется для сборки аксонемы в Tetrahymena thermophila . Эукариот. Cell 8, 1397–1406. DOI: 10.1128 / EC.00378-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дюпюи-Вильямс, П., Флери-Обюссон, А., де Лубресс, Н.Г., Жоффрой, Х., Вайсси, Л., Гальвани, А. и др. (2002). Функциональная роль эпсилон-тубулина в сборке каркаса центриолярных микротрубочек. J. Cell Biol. 158, 1183–1193. DOI: 10.1083 / jcb.200205028
J. Cell Biol. 158, 1183–1193. DOI: 10.1083 / jcb.200205028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эйзен, Дж. А., Койн, Р. С., Ву, М., Ву, Д., Тиагараджан, М., Вортман, Дж. Р. и др. (2006). Макроядерная последовательность генома инфузории Tetrahymena thermophila , модельного эукариота. PLoS Biol. 4: e286.
PubMed Аннотация | Google Scholar
Фассад, М. Р., Шумарк, А., Ле Борн, П., Колл, Ф., Патель, М., Диксон, М., и др. (2018). Мутации C11orf70, нарушающие зависящую от транспорта сборку множественных аксонемных динеинов, вызывают первичную цилиарную дискинезию. г. J. Hum. Genet. 102, 956–972. DOI: 10.1016 / j.ajhg.2018.03.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Funfak, A., Fisch, C., Abdel Motaal, H.T., Diener, J., Combettes, L., Baroud, C.N., et al. (2015). Paramecium модели плавания и биения ресничек: исследование четырех интерференционных мутаций РНК. Integr. Биол. 7, 90–100. DOI: 10.1039 / c4ib00181h
Integr. Биол. 7, 90–100. DOI: 10.1039 / c4ib00181h
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галати, Д. Ф., Абуин, Д. С., Таубер, Г. А., Фам, А. Т., и Пирсон, К. Г. (2016). Автоматический анализ изображений показывает динамическую трехмерную организацию мультицилиарных массивов. Biol.Открытым. 5, 20–31. DOI: 10.1242 / bio.014951
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галати, Д. Ф., Бонни, С., Кроненберг, З., Кларисса, К., Янделл, М., Элде, Н. С. и др. (2014). DisAp-зависимое удлинение поперечно-полосатых волокон необходимо для организации цилиарного массива. J. Cell Biol. 207, 705–715. DOI: 10.1083 / jcb.201409123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарро де Лубресс, Н., Руис, Ф., Бейссон, Дж., и Клотц, К. (2001). Роль дельта-тубулина и С-канальца в сборке базальных телец Paramecium . BMC Cell Biol. 2: 4.
PubMed Аннотация | Google Scholar
Гуденаф, У. У., и Хойзер, Дж. Э. (1985). Субструктура внутренних динеиновых плеч, радиальных спиц и комплекса центральных пар / выступов ресничек и жгутиков. J. Cell Biol. 100, 2008–2018 гг. DOI: 10.1083 / jcb.100.6.2008
У., и Хойзер, Дж. Э. (1985). Субструктура внутренних динеиновых плеч, радиальных спиц и комплекса центральных пар / выступов ресничек и жгутиков. J. Cell Biol. 100, 2008–2018 гг. DOI: 10.1083 / jcb.100.6.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гринан, Г.А., Кестхейи, Б., Вейл, Р. Д., и Агард, Д. А. (2018). Понимание геометрии центриолей, выявленное криотомографией дублетных и триплетных центриолей. eLife 7: e36851. DOI: 10.7554 / eLife.36851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герра К., Вада Ю., Лейк В., Белл А. и Сатир П. (2003). Клонирование, локализация и аксонемная функция Tetrahymena centrin. Мол. Биол. Cell 14, 251–261. DOI: 10,1091 / мбк.e02-05-0298
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Habedanck, R., Stierhof, Y.-D., Wilkinson, C.J., and Nigg, E.A. (2005). Полокиназа Plk4 участвует в дупликации центриолей. Нац. Cell Biol. 7, 1140–1146. DOI: 10.1038 / ncb1320
Cell Biol. 7, 1140–1146. DOI: 10.1038 / ncb1320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хай Б., Гэртиг Дж. И Горовский М. А. (2000). Нокаутные гетерокарионы позволяют легко провести мутагенный анализ основных генов в Tetrahymena . Methods Cell Biol. 62, 513–531. DOI: 10.1016 / s0091-679x (08) 61554-x
CrossRef Полный текст | Google Scholar
Хираки М., Накадзава Ю., Камия Р. и Хироно М. (2007). Bld10p представляет собой кончик спицы колеса тележки и стабилизирует 9-кратную симметрию центриоли. Curr. Биол. 17, 1778–1783. DOI: 10.1016 / j.cub.2007.09.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Höög, J. L., Bouchet-Marquis, C., McIntosh, J.Р., Хенгер А., Гулл К. (2012). Криоэлектронная томография и трехмерный анализ интактного жгутика у Trypanosoma brucei . J. Struct. Биол. 178, 189–198. DOI: 10.1016 / j.jsb.2012.01.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Итикава, М. , и Буй, К. Х. (2018). Внутренние белки микротрубочек: сеть люминальных белков, стабилизирующих дублет микротрубочек. Bioessays 40, 15035. doi: 10.1002 / bies.201700209
, и Буй, К. Х. (2018). Внутренние белки микротрубочек: сеть люминальных белков, стабилизирующих дублет микротрубочек. Bioessays 40, 15035. doi: 10.1002 / bies.201700209
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Итикава, М., Лю Д., Кастрит П. Л., Басу К., Сюй, Т. С., Ян, С. и др. (2017). Структура субнанометрового разрешения дублетной микротрубочки выявляет новые классы белков, ассоциированных с микротрубочками. Нац. Commun. 8: 15035. DOI: 10.1038 / ncomms15035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ифтоде, Ф., и Флери-Обюссон, А. (2003). Структурное наследование в Paramecium : ультраструктурные доказательства передачи полярности базального тельца и связанных корешков через бинарное деление. Biol. Cell 95, 39–51. DOI: 10.1016 / s0248-4900 (03) 00005-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янке, К., Роговски, К., Влога, Д., Регнард, К., Каява, А. В., Струб, Ж.-М., и др. (2005). Ферменты тубулина и полиглутамилазы являются членами семейства белков домена TTL. Наука 308, 1758–1762. DOI: 10.1126 / science.1113010
В., Струб, Ж.-М., и др. (2005). Ферменты тубулина и полиглутамилазы являются членами семейства белков домена TTL. Наука 308, 1758–1762. DOI: 10.1126 / science.1113010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jerka-Dziadosz, M., Gogendeau, D., Клотц, К., Коэн, Дж., Бейссон, Дж., И Колл, Ф. (2010). Дублирование базального тела в Paramecium : ключевая роль Bld10 в сборке и стабильности колеса тележки. Цитоскелет 67, 161–171. DOI: 10.1002 / cm.20433
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jerka-Dziadosz, M., Koll, F., Włoga, D., Gogendeau, D., Garreau de Loubresse, N., Ruiz, F., et al. (2013). Centrin3-зависимый, переходный, придаток материнского базального тельца руководит позиционированием дочернего базального тельца в Paramecium . Протист 164, 352–368. DOI: 10.1016 / j.protis.2012.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзян, Й.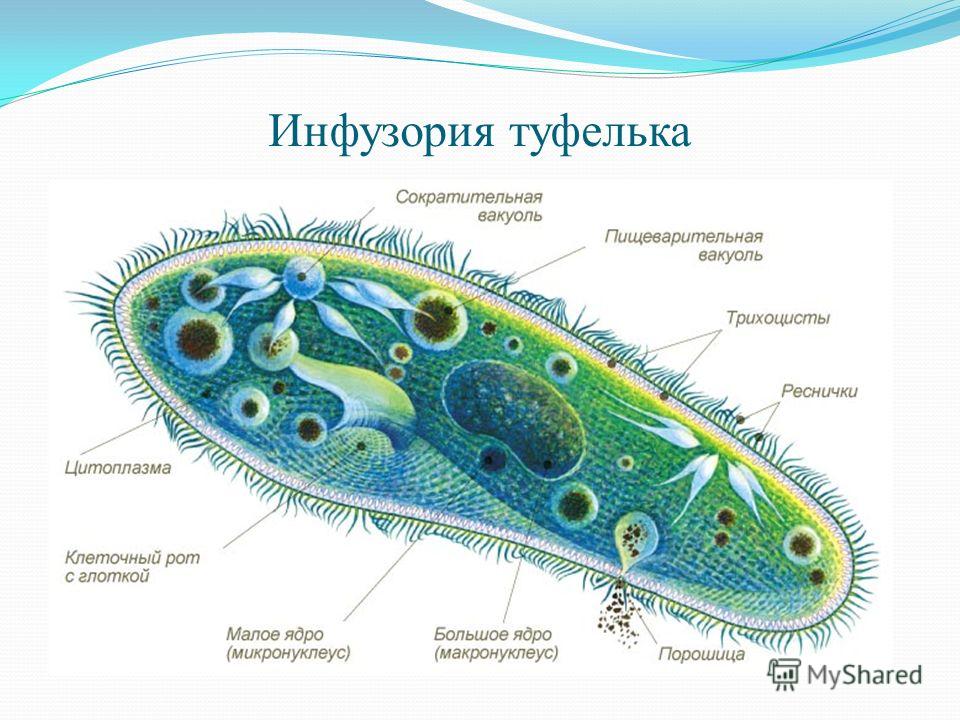 -Й., Лехтрек, К., и Гэртиг, Дж. (2015). Флуоресцентная микроскопия полного внутреннего отражения внутрижгутикового транспорта у Tetrahymena thermophila . Methods Cell Biol. 127, 445–456. DOI: 10.1016 / bs.mcb.2015.01.001
-Й., Лехтрек, К., и Гэртиг, Дж. (2015). Флуоресцентная микроскопия полного внутреннего отражения внутрижгутикового транспорта у Tetrahymena thermophila . Methods Cell Biol. 127, 445–456. DOI: 10.1016 / bs.mcb.2015.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзян, Ю.-Й., Майер, В., Баумейстер, Р., Миневич, Г., Иоахимиак, Э., Влога, Д. и др. (2019). LF4 / MOK и родственная CDK киназа регулируют количество и длину ресничек в Tetrahymena . PLoS Genet. 15: e1008099. DOI: 10.1371 / journal.pgen.1008099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юнкер, А. Д., Со, А. В. Дж., О’Тул, Э. Т., Мил, Дж. Б., Гуха, М., Вайни, М., и др. (2019). Глицилирование микротрубочек способствует прикреплению базального тела к коре клеток. J. Cell Sci. 132: jcs233726. DOI: 10.1242 / jcs.233726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Келлер, Л. К., Ромейн, Э.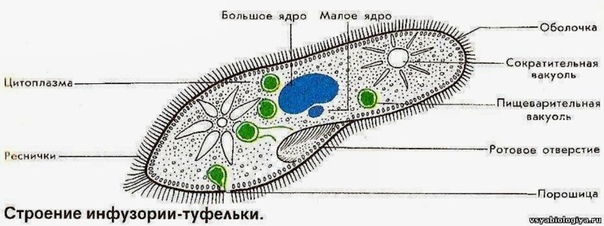 П., Замора, И., Йейтс, Дж. Р., и Маршалл, В. Ф. (2005). Протеомный анализ выделенных центриолей Chlamydomonas выявил ортологи генов цилиарной болезни. Curr. Биол. 15, 1090–1098. DOI: 10.1016 / j.cub.2005.05.024
П., Замора, И., Йейтс, Дж. Р., и Маршалл, В. Ф. (2005). Протеомный анализ выделенных центриолей Chlamydomonas выявил ортологи генов цилиарной болезни. Curr. Биол. 15, 1090–1098. DOI: 10.1016 / j.cub.2005.05.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Килберн, К.Л., Пирсон, К. Г., Ромейн, Э. П., Мил, Дж. Б., Гиддингс, Т. Х., Калвер, Б. П. и др. (2007). Новые белковые компоненты базального тела Tetrahymena определяют доменную структуру базального тела. J. Cell Biol. 178, 905–912. DOI: 10.1083 / jcb.200703109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кунг, К., Сайми, Ю., Хейнс, В. Дж., Линг, К. Ю., и Киссмель, Р. (2000). Последние достижения в молекулярной генетике Paramecium . Дж.Эукариот. Microbiol. 47, 11–14.
PubMed Аннотация | Google Scholar
Ли С., Фернандес Дж. Дж., Маршалл В. Ф. и Агард Д. А. (2012). Трехмерная структура триплета базальных тел, обнаруженная с помощью электронной крио-томографии.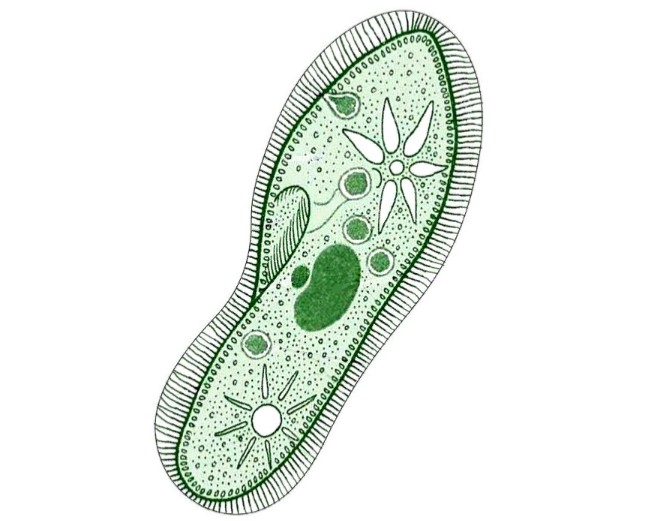 EMBO J. 31, 552–562. DOI: 10.1038 / emboj.2011.460
EMBO J. 31, 552–562. DOI: 10.1038 / emboj.2011.460
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лука П., Васудеван К. К., Гуха М., Иоахимиак Э., Влога Д., Томази Р. Ф.-Х. и др. (2018).Белки, контролирующие геометрию микротрубочек на концах ресничек. J. Cell Biol. 217, 4298–4313. DOI: 10.1083 / jcb.201804141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линн, Д. Х. (1981). Организация и эволюция микротрубочковых органелл у ресничных простейших. Biol. Ред. 56, 243–292. DOI: 10.1111 / j.1469-185x.1981.tb00350.x
CrossRef Полный текст | Google Scholar
Мацуура К., Лефевр П. А., Камия Р. и Хироно М. (2004). Bld10p, новый белок, необходимый для сборки базального тела у Chlamydomonas : локализация на колесе тележки, первая девятичастная симметричная структура, появляющаяся во время сборки. J. Cell Biol. 165, 663–671. DOI: 10.1083 / jcb.200402022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мил, Дж. Б., Бэйлесс, Б. А., Гиддингс, Т. Х., Пирсон, К. Г., и Вини, М. (2016). Tetrahymena Poc1 обеспечивает правильные межтройные связи микротрубочек для поддержания целостности базального тела. Мол. Биол. Cell 27, 2394–2403. DOI: 10.1091 / mbc.E16-03-0165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Могами Ю. и Такахаши К. (1983). Скольжение кальция и микротрубочек в аксонемах ресничек, выделенных из Paramecium caudatum . J. Cell Sci. 61, 107–121.
PubMed Аннотация | Google Scholar
Накаяма, К., Катох, Ю. (2018). Перенос цилиарного белка опосредуется комплексами IFT и BBSome с помощью моторов кинезина-2 и динеина-2. J. Biochem. 163, 155–164. DOI: 10.1093 / jb / mvx087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ng, S. F., and Frankel, J. (1977). Поворот на 180 градусов цилиарных рядов и его морфогенетические последствия у Tetrahymena pyriformis . Proc. Natl. Акад. Sci. США 74, 1115–1119. DOI: 10.1073 / pnas.74.3.1115
Natl. Акад. Sci. США 74, 1115–1119. DOI: 10.1073 / pnas.74.3.1115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пирсон, К. Г., Осборн, Д. П. С., Гиддингс, Т.Х., Билз П. Л. и Вини М. (2009). Стабильность базального тельца и цилиогенез нуждается в консервативном компоненте Poc1. J. Cell Biol. 187, 905–920. DOI: 10.1083 / jcb.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пикариелло, Т., Валентин, М.С., Яно, Дж., И Ван Хаутен, Дж. (2014). Уменьшение количества мекелина приводит к общей потере ресничек, смещению микротрубочек ресничек и нарушению организации клеточной поверхности. Реснички 3: 2. DOI: 10.1186 / 2046-2530-3-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пигино, Г., Буй, К. Х., Махешвари, А., Лупетти, П., Динер, Д., Ишикава, Т. (2011). Криоэлектронная томография радиальных спиц ресничек и жгутиков. J. Cell Biol. 195, 673–687. DOI: 10.1083 / jcb. 201106125
201106125
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пигино, Г., Махешвари, А., Буй, К. Х., Шингёдзи, К., Камимура, С., Ишикава, Т. (2012).Сравнительный структурный анализ жгутиков и ресничек эукариот от Chlamydomonas , Tetrahymena и морских ежей. J. Struct. Биол. 178, 199–206. DOI: 10.1016 / j.jsb.2012.02.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росс И., Кларисса К., Гиддингс Т. Х. и Вини М. (2013). ε-тубулин необходим в Tetrahymena thermophila для сборки и стабильности базальных телец. J. Cell Sci. 126, 3441–3451.DOI: 10.1242 / jcs.128694
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руис Ф., Бейссон Дж., Россье Дж. И Дюпюи-Вильямс П. (1999). Для дупликации базального тела в Paramecium требуется гамма-тубулин. Curr. Биол. 9, 43–46. DOI: 10,1016 / s0960-9822 (99) 80045-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ruiz, F. , Dupuis-Williams, P., Klotz, C., Forquignon, F., Bergdoll, M., Beisson, J., et al. (2004).Генетические данные о взаимодействии эта- и бета-тубулинов. Эукариот. Cell 3, 212–220. DOI: 10.1128 / ec.3.1.212-220.2004
, Dupuis-Williams, P., Klotz, C., Forquignon, F., Bergdoll, M., Beisson, J., et al. (2004).Генетические данные о взаимодействии эта- и бета-тубулинов. Эукариот. Cell 3, 212–220. DOI: 10.1128 / ec.3.1.212-220.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сейл, В. С., Сатир, П. (1977). Окончание центральных микротрубочек от ресничек Tetrahymena pyriformis . Cell Biol. Int. Реп. 1, 45–49. DOI: 10.1016 / 0309-1651 (77) -x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сандос, Д., Chailley, B., Boisvieux-Ulrich, E., Lemullois, M., Laine, M.C., and Bautista-Harris, G. (1988). Организация и функции цитоскелета в ресничных клетках многоклеточных животных. Biol. Cell 63, 183–193. DOI: 10.1016 / 0248-4900 (88)-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сатир, П. (1965). Исследования ресничек: II. исследование дистальной области цилиарного вала и роли нитей в моторике. J. Cell Biol. 26, 805–834.DOI: 10.1083 / jcb.26.3.805
J. Cell Biol. 26, 805–834.DOI: 10.1083 / jcb.26.3.805
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сейшас, К., Гонсалвес, Дж., Мело, Л. В., и Соареш, Х. (2017). Tetrahymena Cilia cap создается в многоэтапном процессе: исследование методом атомно-силовой микроскопии. Протист 168, 697–717. DOI: 10.1016 / j.protis.2017.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шан, Ю., Сонг, X., Боуэн, Дж., Корстанье, Р., Гао, Ю., Гэртиг, Дж., и другие. (2002b). Надежный индуцибельно-репрессируемый промотор значительно облегчает нокауты генов, условную экспрессию и сверхэкспрессию гомологичных и гетерологичных генов в Tetrahymena thermophila . Proc. Natl. Акад. Sci. США 99, 3734–3739. DOI: 10.1073 / pnas.052016199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шанг Ю., Ли Б. и Горовский М. А. (2002a). Tetrahymena thermophila содержит обычный гамма-тубулин, который по-разному необходим для поддержания различных центров организации микротрубочек. J. Cell Biol. 158, 1195–1206. DOI: 10.1083 / jcb.200205101
J. Cell Biol. 158, 1195–1206. DOI: 10.1083 / jcb.200205101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши, Л., Ши, X., и Шен, Ю. (2018). Внутрилагеллярный транспорт 46 (IFT46) важен для транспортировки белков IFT между ресничками и цитоплазмой в Paramecium . Sci. Реп. 8: 9259. DOI: 10.1038 / s41598-018-27050-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, Дж. К., Норти, Дж.Г. Б., Гарг, Дж., Перлман, Р. Э., и Сиу, К. В. М. (2005). Надежный метод протеомного анализа с помощью МС / МС с использованием всего транслированного генома: демонстрация на цилиоме Tetrahymena thermophila . J. Proteome Res. 4, 909–919. DOI: 10.1021 / pr050013h
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Штейнман Р. М. (1968). Электронно-микроскопическое исследование цилиогенеза в развивающемся эпидермисе и трахее эмбриона Xenopus laevis . г. J. Anat. 122, 19–55.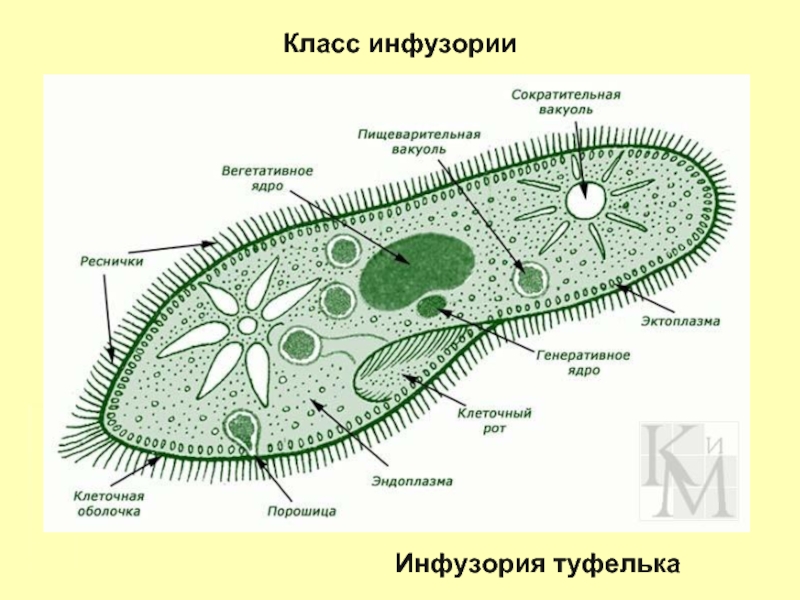 DOI: 10.1002 / aja.1001220103
DOI: 10.1002 / aja.1001220103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стемм-Вольф, А. Дж., Морган, Г., Гиддингс, Т. Х., Уайт, Э. А., Маркионе, Р., Макдональд, Х. Б. и др. (2005). Для дупликации и поддержания базального тела требуется один член семейства генов центрина Tetrahymena thermophila . Мол. Биол. Cell 16, 3606–3619. DOI: 10.1091 / mbc.e04-10-0919
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоддард, Д., Zhao, Y., Bayless, B.A., Gui, L., Louka, P., Dave, D., et al. (2018). Tetrahymena RIB72A и RIB72B представляют собой внутренние белки микротрубочек в микротрубочках дублета ресничек. Мол. Биол. Cell 29, 2566–2577. DOI: 10.1091 / mbc.E18-06-0405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сурьяванши, С., Эдде, Б., Фокс, Л. А., Герреро, С., Хард, Р., Хеннесси, Т. и др. (2010). Глутамилирование тубулина регулирует подвижность ресничек, изменяя активность внутреннего динеина. Curr. Биол. CB 20, 435–440. DOI: 10.1016 / j.cub.2009.12.062
Curr. Биол. CB 20, 435–440. DOI: 10.1016 / j.cub.2009.12.062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тидтке А. (1985). Выделение чистых пленок, содержащих интактные базальные тельца Tetrahymena pyriformis . J. Cell Sci. 77, 155–165.
PubMed Аннотация | Google Scholar
Тилли А. Э., Уолтерс М. С., Шайхиев Р., Кристал Р. Г. (2015). Дисфункция ресничек при заболевании легких. Annu.Rev. Physiol. 77, 379–406. DOI: 10.1146 / annurev-Physiol-021014-071931
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таксхорн, Дж., Дейз, Т., и Дентлер, У. Л. (1998). Регулировка длины жгутика у Chlamydomonas . Cell Motil. Цитоскелет 40, 133–146. DOI: 10.1002 / (sici) 1097-0169 (1998) 40: 2 <133 :: help-cm3> 3.3.co; 2-e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урбанска, П., Иоахимиак, Э., Bazan, R., Fu, G., Poprzeczko, M., Fabczak, H. , et al. (2018). Ресничные белки Fap43 и Fap44 взаимодействуют друг с другом и необходимы для правильного биения ресничек и жгутиков. Ячейка. Мол. Life Sci. 75, 4479–4493. DOI: 10.1007 / s00018-018-2819-7
, et al. (2018). Ресничные белки Fap43 и Fap44 взаимодействуют друг с другом и необходимы для правильного биения ресничек и жгутиков. Ячейка. Мол. Life Sci. 75, 4479–4493. DOI: 10.1007 / s00018-018-2819-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урбанска, П., Сонг, К., Иоахимиак, Э., Кшемиен-Ояк, Л., Копровски, П., Хеннесси, Т. и др. (2015). Белки CSC FAP61 и FAP251 строят базальные субструктуры радиальных спиц 3 в ресничках. Мол. Биол. Cell 26, 1463–1475. DOI: 10.1091 / mbc.E14-11-1545
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vonderfecht, T., Cookson, M. W., Giddings, T.H., Clarissa, C., and Winey, M. (2012). Два гомолога центрина человека имеют сходные, но разные функции в базальных тельцах Tetrahymena . Мол. Биол. Cell 23, 4766–4777. DOI: 10.1091 / mbc.E12-06-0454
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vonderfecht, T., Стемм-Вольф, А. Дж., Хендершотт, М., Гиддингс, Т. Х., Мил, Дж. Б. и Вини, М. (2011). Два домена центрина выполняют различные функции базального тела в Tetrahymena . Мол. Биол. Cell 22, 2221–2234. DOI: 10.1091 / mbc.E11-02-0151
Дж., Хендершотт, М., Гиддингс, Т. Х., Мил, Дж. Б. и Вини, М. (2011). Два домена центрина выполняют различные функции базального тела в Tetrahymena . Мол. Биол. Cell 22, 2221–2234. DOI: 10.1091 / mbc.E11-02-0151
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wingfield, J. L., Mengoni, I., Bomberger, H., Jiang, Y.-Y., Walsh, J. D., Brown, J. M., et al. (2017). IFT тренируется на разных стадиях очереди сборки в основании ресничек для последовательного высвобождения в ресничку. eLife 6: 2017. DOI: 10.7554 / eLife.26609
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Влога Д., Дэйв Д., Мигли Дж., Роговски К., Джерка-Дзядош М. и Гэртиг Дж. (2010). Гиперглутамилирование тубулина может стабилизировать или дестабилизировать микротрубочки в одной и той же клетке. Эукариот. Cell 9, 184–193. DOI: 10.1128 / EC.00176-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Влога, Д. , Роговски, К., Шарма, Н., Ван Дейк, Дж., Янке, К., Эдде, Б. и др. (2008). Глутамилирование альфа-тубулина не является существенным, но влияет на сборку и функции субнабора микротрубочек у Tetrahymena thermophila . Эукариот. Cell 7, 1362–1372. DOI: 10.1128 / EC.00084-08
, Роговски, К., Шарма, Н., Ван Дейк, Дж., Янке, К., Эдде, Б. и др. (2008). Глутамилирование альфа-тубулина не является существенным, но влияет на сборку и функции субнабора микротрубочек у Tetrahymena thermophila . Эукариот. Cell 7, 1362–1372. DOI: 10.1128 / EC.00084-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wloga, D., Webster, D. M., Rogowski, K., Bré, M.-H., Levilliers, N., Jerka-Dziadosz, M., et al. (2009). TTLL3 — это тубулинглицинлигаза, регулирующая сборку ресничек. Dev. Cell 16, 867–876. DOI: 10.1016 / j.devcel.2009.04.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вуд К. Р., Хард Р. и Хеннесси Т. М. (2007). Направленное разрушение гена тяжелой цепи 7 динеина из Tetrahymena thermophila приводит к изменению формы волны в ресничках и снижению скорости плавания. J. Cell Sci. 120, 3075–3085. DOI: 10.1242 / jcs.007369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яно, Дж. , Раджендран А., Валентин М. С., Саха М., Баллиф Б. А. и Ван Хаутен Дж. Л. (2013). Протеомный анализ мембраны ресничек Paramecium tetraurelia . J. Proteomics 78, 113–122. DOI: 10.1016 / j.jprot.2012.09.040
, Раджендран А., Валентин М. С., Саха М., Баллиф Б. А. и Ван Хаутен Дж. Л. (2013). Протеомный анализ мембраны ресничек Paramecium tetraurelia . J. Proteomics 78, 113–122. DOI: 10.1016 / j.jprot.2012.09.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яно Дж., Валентин М. С. и Ван Хаутен Дж. Л. (2015). Новое понимание развития и функции ресничек с использованием преимуществ клетки парамеции и множества ее ресничек. Ячейки 4, 297–314. DOI: 10.3390 / Cell4030297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ю. Л., Горовский М. А. (2000). Мечение белков в Tetrahymena . Methods Cell Biol. 62, 549–559. DOI: 10.1016 / s0091-679x (08) 61556-3
CrossRef Полный текст | Google Scholar
границ | Сезонность планктонных пресноводных инфузорий: коррелируют ли анализы, основанные на участках V9 гена 18S рРНК, с количеством морфоспидов?
Введение
В озерах умеренного пояса сезонные смены фито- и метазоопланктона часто демонстрируют прогнозируемую динамику, которая была описана в концептуальной структуре, модели Plankton Ecology Group (PEG) (Sommer et al. , 1986). За последние 30 лет экологические исследования расширили понимание механизмов, ответственных за сезонность, с ключевым выводом о том, что динамику гетеротрофных протистов следует рассматривать отдельно от структуры зоопланктона многоклеточных животных (Sommer et al., 2012). Микрозоопланктон может составлять основную долю от общего выпаса на фитопланктоне, потребляя более 50% первичной продукции в определенные периоды года (Weisse et al., 1990; Straile, 1998). Во фракции водорослевых простейших часто преобладают инфузории (Ciliophora), представляющие, например, e.g., первых и наиболее эффективных травоядных растений весеннего цветения фитопланктона (Geller et al., 1991; Sommaruga, Psenner, 1993; Tirok, Gaedke, 2007; Posch et al., 2015). Однако режимы питания инфузорий весьма разнообразны (бактериоядные, водоядные, всеядные, хищные), поэтому они составляют основную часть протистанского планктона в течение всего года (Mathes and Arndt, 1995; Straile, 1998). Инфузории могут даже быть доминирующими бактериоядными животными (Kisand, Zingel, 2000; Zingel et al.
, 1986). За последние 30 лет экологические исследования расширили понимание механизмов, ответственных за сезонность, с ключевым выводом о том, что динамику гетеротрофных протистов следует рассматривать отдельно от структуры зоопланктона многоклеточных животных (Sommer et al., 2012). Микрозоопланктон может составлять основную долю от общего выпаса на фитопланктоне, потребляя более 50% первичной продукции в определенные периоды года (Weisse et al., 1990; Straile, 1998). Во фракции водорослевых простейших часто преобладают инфузории (Ciliophora), представляющие, например, e.g., первых и наиболее эффективных травоядных растений весеннего цветения фитопланктона (Geller et al., 1991; Sommaruga, Psenner, 1993; Tirok, Gaedke, 2007; Posch et al., 2015). Однако режимы питания инфузорий весьма разнообразны (бактериоядные, водоядные, всеядные, хищные), поэтому они составляют основную часть протистанского планктона в течение всего года (Mathes and Arndt, 1995; Straile, 1998). Инфузории могут даже быть доминирующими бактериоядными животными (Kisand, Zingel, 2000; Zingel et al. , 2007) или потребителями автотрофного пикопланктона (Šimek et al., 1995) в некоторых озерах. Сезонные смены ассоциаций инфузорий и вовлеченных в них видов хорошо описаны для различных озер с умеренным климатом (Beaver, Crisman, 1989; Müller et al., 1991; Carrias et al., 1998; Sonntag et al., 2006; Zingel and Nõges, 2010). ; см. также обширный обзор литературы в Foissner et al., 1999). Эти исследования имеют одну общую черту — их результаты основаны на идентификации и количественной оценке морфологически четко определенных видов (morphospecies, Foissner et al., 1999) с помощью различных методов микроскопии. Подсчет морфологических видов позволяет количественно определять численность и биомассу на единицу объема воды, что является необходимым условием для изучения потоков энергии между трофическими объектами в озерах.
, 2007) или потребителями автотрофного пикопланктона (Šimek et al., 1995) в некоторых озерах. Сезонные смены ассоциаций инфузорий и вовлеченных в них видов хорошо описаны для различных озер с умеренным климатом (Beaver, Crisman, 1989; Müller et al., 1991; Carrias et al., 1998; Sonntag et al., 2006; Zingel and Nõges, 2010). ; см. также обширный обзор литературы в Foissner et al., 1999). Эти исследования имеют одну общую черту — их результаты основаны на идентификации и количественной оценке морфологически четко определенных видов (morphospecies, Foissner et al., 1999) с помощью различных методов микроскопии. Подсчет морфологических видов позволяет количественно определять численность и биомассу на единицу объема воды, что является необходимым условием для изучения потоков энергии между трофическими объектами в озерах.
За 20 лет традиционные подходы, основанные на морфологии, были либо дополнены, либо даже заменены молекулярными методами в экологических исследованиях (Caron et al.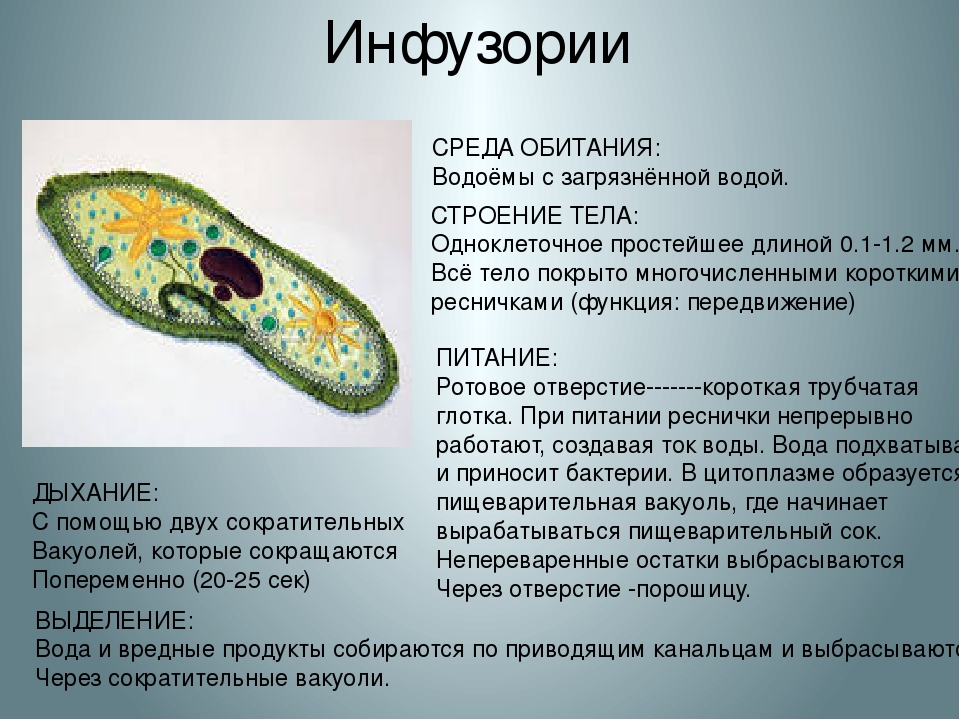 , 1999; Stoeck et al., 2006; Duff et al., 2008; Berdjeb et al., 2018). ). В настоящее время технологии высокопроизводительного секвенирования (HTS) произвели революцию в изучении протистанских сообществ в пресноводных экосистемах (Simon et al., 2015; Banerji et al., 2018; Bock et al., 2018; Михайлов и др., 2018). Среди прочего, HTS в окружающей среде дает возможность обнаружить загадочные и редкие виды, которые, скорее всего, не распознаются микроскопом (Amaral-Zettler et al., 2009; Nolte et al., 2010). Тем не менее, молекулярные методы анализа про- и эукариотических микробов должны иметь дело с множеством источников систематической ошибки. Прежде всего, ПЦР является основным источником ошибок из-за смещения праймеров и предпочтительной амплификации (Stoeck et al., 2006; Shakya et al., 2013; Трагин и др., 2018; Wear et al., 2018). Одной из основных проблем, возникающих из-за ПЦР и смещения праймеров, является критическое преобразование численности ампликонов в численность организма (Egge et al.
, 1999; Stoeck et al., 2006; Duff et al., 2008; Berdjeb et al., 2018). ). В настоящее время технологии высокопроизводительного секвенирования (HTS) произвели революцию в изучении протистанских сообществ в пресноводных экосистемах (Simon et al., 2015; Banerji et al., 2018; Bock et al., 2018; Михайлов и др., 2018). Среди прочего, HTS в окружающей среде дает возможность обнаружить загадочные и редкие виды, которые, скорее всего, не распознаются микроскопом (Amaral-Zettler et al., 2009; Nolte et al., 2010). Тем не менее, молекулярные методы анализа про- и эукариотических микробов должны иметь дело с множеством источников систематической ошибки. Прежде всего, ПЦР является основным источником ошибок из-за смещения праймеров и предпочтительной амплификации (Stoeck et al., 2006; Shakya et al., 2013; Трагин и др., 2018; Wear et al., 2018). Одной из основных проблем, возникающих из-за ПЦР и смещения праймеров, является критическое преобразование численности ампликонов в численность организма (Egge et al. , 2013; Weber and Pawlowski, 2013; Stoeck et al., 2014), но решения см. Также Giner et al. (2016). К другим источникам ошибок относятся секвенирование (Huse et al., 2007), кластеризация ампликонов (Huse et al., 2010; Forster et al., 2016), а также неполнота и ошибки в справочных базах данных (Stoeck et al., 2014). Такие ошибки могут иметь обширные последствия для оценок разнообразия инфузорий, часто приводя к переоценке богатства операционных таксономических единиц (OTU) в окружающей среде.Кроме того, многие OTU все еще остаются неназначенными, а многочисленные морфовиды инфузорий еще не представлены в справочных базах данных (например, NCBI). Более того, высокое число копий генов 18S рРНК у инфузорий (Gong et al., 2013) и тот факт, что число копий сильно варьируется между видами, может сделать количественные результаты еще более ненадежными (Medinger et al., 2010). Таким образом, сомнительно, можно ли использовать только подходы HTS для ответа на экологические вопросы о видах инфузорий, таких как модели сукцессии и их значимость для функционирования экосистемы.
, 2013; Weber and Pawlowski, 2013; Stoeck et al., 2014), но решения см. Также Giner et al. (2016). К другим источникам ошибок относятся секвенирование (Huse et al., 2007), кластеризация ампликонов (Huse et al., 2010; Forster et al., 2016), а также неполнота и ошибки в справочных базах данных (Stoeck et al., 2014). Такие ошибки могут иметь обширные последствия для оценок разнообразия инфузорий, часто приводя к переоценке богатства операционных таксономических единиц (OTU) в окружающей среде.Кроме того, многие OTU все еще остаются неназначенными, а многочисленные морфовиды инфузорий еще не представлены в справочных базах данных (например, NCBI). Более того, высокое число копий генов 18S рРНК у инфузорий (Gong et al., 2013) и тот факт, что число копий сильно варьируется между видами, может сделать количественные результаты еще более ненадежными (Medinger et al., 2010). Таким образом, сомнительно, можно ли использовать только подходы HTS для ответа на экологические вопросы о видах инфузорий, таких как модели сукцессии и их значимость для функционирования экосистемы. В нескольких исследованиях использовалось сочетание молекулярных и морфологических методов для изучения разнообразия и динамики сообществ планктонных инфузорий как из морских (Bachy et al., 2013, 2014; Santoferrara et al., 2014, 2016), так и из пресноводных систем ( Medinger et al., 2010; Luo et al., 2011; Stoeck et al., 2014). Одновременная идентификация морфоспортов помимо секвенирования в окружающей среде помогает отличить значимые OTU от потенциальных ошибок секвенирования. Наконец, выделение и последующее секвенирование генов таксономических маркеров от идентифицированных видов инфузорий позволит нам связать данные секвенирования (OTU) с организмами и их известной аутэкологией.
В нескольких исследованиях использовалось сочетание молекулярных и морфологических методов для изучения разнообразия и динамики сообществ планктонных инфузорий как из морских (Bachy et al., 2013, 2014; Santoferrara et al., 2014, 2016), так и из пресноводных систем ( Medinger et al., 2010; Luo et al., 2011; Stoeck et al., 2014). Одновременная идентификация морфоспортов помимо секвенирования в окружающей среде помогает отличить значимые OTU от потенциальных ошибок секвенирования. Наконец, выделение и последующее секвенирование генов таксономических маркеров от идентифицированных видов инфузорий позволит нам связать данные секвенирования (OTU) с организмами и их известной аутэкологией.
В этом исследовании мы провели трехлетнюю кампанию по отбору проб в озере Цюрих (отбор проб раз в две недели, n = 74), чтобы установить значительный набор данных для оценки и улучшения данных HTS, специфичных для инфузорий. Оба метода, классический подсчет морфовидов с помощью количественной импрегнации серебром и секвенирование ампликона 18S рРНК, были использованы для исследования изменчивости сообщества инфузорий во времени. Чтобы проверить, совпадают ли два разных подхода друг с другом, мы сосредоточились на сезонных моделях двенадцати специфических морфовидов инфузорий.Эти виды были выделены непосредственно из воды озера, и большинство из них успешно культивировалось. Впоследствии их области V9 гена 18S рРНК были секвенированы и использованы в качестве семян для анализа HTS. Этот рабочий процесс привел к получению новой информации о последовательности для нескольких хорошо известных морфоспортов инфузорий, обитающих в пресноводных системах. Мы намеревались достичь следующих целей: (а) Коррелируют ли сезонные модели численности, а также редких и эфемерных видов инфузорий с помощью HTS с сукцессиями, наблюдаемыми при подсчете морфоспецифических видов? (b) Позволяет ли HTS более точно описать сезонность редких и эфемерных видов инфузорий? (c) Есть ли связь между количеством считываний последовательностей и значениями клеточной численности или биомассы для видов инфузорий? (d) Отражает ли относительное количество считываний последовательностей количественную структуру сообщества, определенную путем подсчета морфоспецифических видов?
Чтобы проверить, совпадают ли два разных подхода друг с другом, мы сосредоточились на сезонных моделях двенадцати специфических морфовидов инфузорий.Эти виды были выделены непосредственно из воды озера, и большинство из них успешно культивировалось. Впоследствии их области V9 гена 18S рРНК были секвенированы и использованы в качестве семян для анализа HTS. Этот рабочий процесс привел к получению новой информации о последовательности для нескольких хорошо известных морфоспортов инфузорий, обитающих в пресноводных системах. Мы намеревались достичь следующих целей: (а) Коррелируют ли сезонные модели численности, а также редких и эфемерных видов инфузорий с помощью HTS с сукцессиями, наблюдаемыми при подсчете морфоспецифических видов? (b) Позволяет ли HTS более точно описать сезонность редких и эфемерных видов инфузорий? (c) Есть ли связь между количеством считываний последовательностей и значениями клеточной численности или биомассы для видов инфузорий? (d) Отражает ли относительное количество считываний последовательностей количественную структуру сообщества, определенную путем подсчета морфоспецифических видов?
Материалы и методы
Место исследования, отбор проб и параметры окружающей среды
Цюрихское озеро (47 ° 19. 3’N, 8 ° 33,9’E; Швейцария) — это предальпийское, олигомезотрофное и мономиктическое озеро, которое уже пять десятилетий является объектом интенсивных лимнологических исследований (Posch et al., 2012; Yankova et al., 2017). Основными морфометрическими дескрипторами являются: высота = 406 м над ур. Озеро служит резервуаром для питьевой воды более 1 миллиона человек. Пробы планктона отбирались каждые две недели с марта 2014 г. по 2017 г. ( n = 74 образца).Озерная вода была собрана с глубины 5 м с помощью пробоотборника Ruttner объемом 5 л. Объем воды 5 л каждой пробы был разделен на 300 мл для метода подсчета морфологических видов и 4 л для HTS (см. Ниже), т. Е. Анализируемая вода поступала из одного и того же начального объема для обоих методов (см. Также схему рабочего процесса в Дополнительных документах). Рисунок S1). Кроме того, чистые уловы (размер ячеек 10 мкм) собирали в течение всего периода отбора проб с верхних 20 м для идентификации, выделения и культивирования живых особей.
3’N, 8 ° 33,9’E; Швейцария) — это предальпийское, олигомезотрофное и мономиктическое озеро, которое уже пять десятилетий является объектом интенсивных лимнологических исследований (Posch et al., 2012; Yankova et al., 2017). Основными морфометрическими дескрипторами являются: высота = 406 м над ур. Озеро служит резервуаром для питьевой воды более 1 миллиона человек. Пробы планктона отбирались каждые две недели с марта 2014 г. по 2017 г. ( n = 74 образца).Озерная вода была собрана с глубины 5 м с помощью пробоотборника Ruttner объемом 5 л. Объем воды 5 л каждой пробы был разделен на 300 мл для метода подсчета морфологических видов и 4 л для HTS (см. Ниже), т. Е. Анализируемая вода поступала из одного и того же начального объема для обоих методов (см. Также схему рабочего процесса в Дополнительных документах). Рисунок S1). Кроме того, чистые уловы (размер ячеек 10 мкм) собирали в течение всего периода отбора проб с верхних 20 м для идентификации, выделения и культивирования живых особей. Сопутствующие абиотические параметры, то есть температура воды и концентрация кислорода, были измерены in situ для глубины отбора проб (5 м) с помощью многопараметрического зонда (6600 V2, Yellow Springs Instruments, США). Данные для описания трофического статуса, то есть концентрации общего фосфора (TP) и нитратов (NO 3 -N), а также общей численности фитопланктона были получены от Water Supply Company Zurich. Для подсчета бактерий 20 мл каждого 5 л образца консервировали формальдегидом (конечная концентрация 2%), окрашивали SYBR Green I (Sigma Aldrich) и оценивали с помощью проточной цитометрии (Cytoflex S, Beckman Coulter; Petrou and Nielsen, 2018).
Сопутствующие абиотические параметры, то есть температура воды и концентрация кислорода, были измерены in situ для глубины отбора проб (5 м) с помощью многопараметрического зонда (6600 V2, Yellow Springs Instruments, США). Данные для описания трофического статуса, то есть концентрации общего фосфора (TP) и нитратов (NO 3 -N), а также общей численности фитопланктона были получены от Water Supply Company Zurich. Для подсчета бактерий 20 мл каждого 5 л образца консервировали формальдегидом (конечная концентрация 2%), окрашивали SYBR Green I (Sigma Aldrich) и оценивали с помощью проточной цитометрии (Cytoflex S, Beckman Coulter; Petrou and Nielsen, 2018).
Идентификация, численность и биомасса инфузорий
Определение живых инфузорий из уловов сети проводилось впоследствии после отбора проб в лаборатории с использованием микроскопа Zeiss Axio ImagerM1 (увеличение: от 100 × до 840 ×) и стереомикроскопа Zeiss Discovery.V8 (увеличение: от 10 × до 80 ×). Одиночные или множественные клетки идентифицированных инфузорий (таблица 1 и дополнительный рисунок S1) выделяли с помощью вытянутой стеклянной микропипетки и промывали 3-5 каплями стерильной фильтрованной озерной воды или среды (минеральная вода Volvic). Культуры поддерживали стерилизованными зернами пшеницы, поддерживающими рост бактерий для бактериоядных инфузорий, или штаммом Cryptomonas SAG 26.80 (Коллекция культур водорослей Геттингенского университета, Германия), служащим источником пищи для водорослевых / всеядных видов. Культуры инфузорий хранили при 18 ° C и цикле 14 часов света (20 мкмоль м -2 с -1 ) / 8 часов темноты.
Культуры поддерживали стерилизованными зернами пшеницы, поддерживающими рост бактерий для бактериоядных инфузорий, или штаммом Cryptomonas SAG 26.80 (Коллекция культур водорослей Геттингенского университета, Германия), служащим источником пищи для водорослевых / всеядных видов. Культуры инфузорий хранили при 18 ° C и цикле 14 часов света (20 мкмоль м -2 с -1 ) / 8 часов темноты.
Таблица 1. Список из двенадцати видов инфузорий, которые были изолированы и частично культивированы в период исследований (март 2014–2017 гг.).
Для подсчета и расчета биомассы 300 мл озерной воды консервировали свежеприготовленным 15 мл раствора Буэна [содержащего 10,7 мл насыщенной пикриновой кислоты, 3,6 мл формальдегида (37% исходный раствор) и 0,7 мл ледяной уксусной кислоты; Скиббе, 1994]. Части образцов (100–150 мл) фильтровали через фильтры из нитрата целлюлозы с диаметром пор 0,8 мкм, снабженные счетными сетками (Sartorius, Германия). Затем был применен метод количественного окрашивания протарголом (протеинатом серебра) (QPS) в соответствии с протоколом Skibbe (1994) с небольшими изменениями после Pfister et al.(1999). После процедуры окрашивания инфузории на фильтрах, импрегнированные серебром, заливали канадским бальзамом (Merck, Германия), обеспечивая постоянные предметные стекла, сохраняющие свое качество в течение многих лет. Препараты анализировали при увеличении от 200 до 1600 с помощью микроскопа Zeiss Axio ImagerM1. Идентификацию живых и окрашенных видов инфузорий проводили согласно Foissner et al. (1991, 1992, 1994, 1995, 1999) и Sonntag et al. (2008). Мы следовали системам классификации Lynn (2008) и Gao et al.(2016) о таксономической принадлежности обнаруженных видов. Для каждого образца мы проверяли эквивалентную площадь фильтра до тех пор, пока не было определено и подсчитано не менее 400 клеток. Наконец, общая площадь фильтра была проверена на наличие редких видов, которые не были бы учтены нашей стандартной процедурой подсчета.
Затем был применен метод количественного окрашивания протарголом (протеинатом серебра) (QPS) в соответствии с протоколом Skibbe (1994) с небольшими изменениями после Pfister et al.(1999). После процедуры окрашивания инфузории на фильтрах, импрегнированные серебром, заливали канадским бальзамом (Merck, Германия), обеспечивая постоянные предметные стекла, сохраняющие свое качество в течение многих лет. Препараты анализировали при увеличении от 200 до 1600 с помощью микроскопа Zeiss Axio ImagerM1. Идентификацию живых и окрашенных видов инфузорий проводили согласно Foissner et al. (1991, 1992, 1994, 1995, 1999) и Sonntag et al. (2008). Мы следовали системам классификации Lynn (2008) и Gao et al.(2016) о таксономической принадлежности обнаруженных видов. Для каждого образца мы проверяли эквивалентную площадь фильтра до тех пор, пока не было определено и подсчитано не менее 400 клеток. Наконец, общая площадь фильтра была проверена на наличие редких видов, которые не были бы учтены нашей стандартной процедурой подсчета. Биомасса (т.е. сырой вес) для каждого идентифицированного вида инфузорий рассчитывалась путем умножения численности инфузорий на видоспецифичные коэффициенты пересчета, опубликованные Foissner et al. (1992, 1994, 1999). Эти опубликованные коэффициенты основаны на среднем размере клетки вида, геометрическом приближении формы клетки для расчета объема клетки и удельной плотности 1 пг мкм -3 (подробности см. В главе 2 в Foissner et al., 1992).
Биомасса (т.е. сырой вес) для каждого идентифицированного вида инфузорий рассчитывалась путем умножения численности инфузорий на видоспецифичные коэффициенты пересчета, опубликованные Foissner et al. (1992, 1994, 1999). Эти опубликованные коэффициенты основаны на среднем размере клетки вида, геометрическом приближении формы клетки для расчета объема клетки и удельной плотности 1 пг мкм -3 (подробности см. В главе 2 в Foissner et al., 1992).
Секвенирование изолированных видов инфузорий
Неполные гены 18S рРНК, включая область V9, были секвенированы либо у культивируемых инфузорий, либо непосредственно у живых особей, собранных из уловов сети (таблица 1 и дополнительный рисунок S1). Клетки промывали, как описано выше, и голодали в течение ~ 24 часов в стерильной фильтрованной озерной воде или среде, чтобы гарантировать, что все потенциальные частицы пищи были переварены. Затем инфузории переносили в 1-2 мкл воды для ПЦР, которую затем использовали непосредственно в качестве матрицы для вложенной ПЦР с использованием праймеров от Marin et al. (2003; см. Дополнительный рисунок S2). В качестве альтернативы, праймеры Euk360F (Edgcomb et al., 2011) и Univ1492RE (Stoeck et al., 2006) были использованы для нашего стандартного протокола ПЦР (дополнительный рисунок S2).
(2003; см. Дополнительный рисунок S2). В качестве альтернативы, праймеры Euk360F (Edgcomb et al., 2011) и Univ1492RE (Stoeck et al., 2006) были использованы для нашего стандартного протокола ПЦР (дополнительный рисунок S2).
Условия вложенной ПЦР были следующими: первая денатурация при 96 ° C в течение 1 мин, затем 30 циклов, каждый из которых состоит из 1 мин при 96 ° C, 2 мин при 55 ° C, 3 мин при 72 ° C, а затем заключительное удлинение в течение 10 минут при 72 ° C с использованием смеси GoTaq ® Green Master Mix (Promega). Эта процедура была успешно применена для вида Cinetochilum margaritaceum (таблица 1).Частичная 18S рДНК оставшихся одиннадцати видов была амплифицирована с использованием стандартного протокола ПЦР. Условия были следующими: первая денатурация при 94 ° C в течение 3 минут, затем 35 циклов, каждый из которых состоит из 1 минуты при 94 ° C, 1 минуты при 52 ° C и 2 минут при 72 ° C, с последующим окончательным удлинением. 5 мин при 72 ° C с использованием смеси GoTaq ® Green Master Mix (Promega). Продукты ПЦР очищали с помощью набора для очистки Agencourt AMPure XP PCR Purification Kit (Beckman Coulter) и секвенировали по Сэнгеру с помощью химии ABI BigDye на генетическом анализаторе ABI 3130x (Applied Biosystems).В некоторых случаях использовались дополнительные праймеры для секвенирования E528F (Marin et al., 2003) и SR10f (Nakayama et al., 1998) для секвенирования всей области V9.
Продукты ПЦР очищали с помощью набора для очистки Agencourt AMPure XP PCR Purification Kit (Beckman Coulter) и секвенировали по Сэнгеру с помощью химии ABI BigDye на генетическом анализаторе ABI 3130x (Applied Biosystems).В некоторых случаях использовались дополнительные праймеры для секвенирования E528F (Marin et al., 2003) и SR10f (Nakayama et al., 1998) для секвенирования всей области V9.
Извлечение, амплификация и секвенирование ДНК
Пробы сырой воды (2 × 2 л) предварительно фильтровали через сетку 150 мкм для удаления более крупного зоопланктона, а затем фильтровали через мембранный фильтр 0,65 мкм (Durapore, Millipore) с использованием перистальтического насоса с низкой скоростью потока 50 мл / мин. -1 . Фильтры (дубликаты) непосредственно переносили в криопробирку, содержащую 1.5 мл RNAlater (QIAGEN), помещают в холодильник (~ 5 ° C) на ночь и, наконец, хранят при -80 ° C до дальнейшей обработки. Для экстракции ДНК каждый фильтр переносили в пробирку с лизирующим матриксом (Lysing Matrix E, MP Biomedicals) и добавляли 600 мкл буфера RLT и 6 мкл β-меркаптоэтанола. Оставшуюся жидкость в каждой криопробирке центрифугировали и выбрасывали. К остаточному осадку добавляли 200 мкл буфера RLT и 2 мкл β-меркаптоэтанола и перемешивали. Эту смесь добавляли в пробирку с лизирующим матриксом. Для разрушения и удаления клеток из фильтра каждую пробирку с матрицей подвергали отбиванию шариками в течение 45 с с частотой 30 Гц.Затем общую ДНК окружающей среды экстрагировали с использованием мини-набора AllPrep DNA / RNA Mini Kit (QIAGEN).
Оставшуюся жидкость в каждой криопробирке центрифугировали и выбрасывали. К остаточному осадку добавляли 200 мкл буфера RLT и 2 мкл β-меркаптоэтанола и перемешивали. Эту смесь добавляли в пробирку с лизирующим матриксом. Для разрушения и удаления клеток из фильтра каждую пробирку с матрицей подвергали отбиванию шариками в течение 45 с с частотой 30 Гц.Затем общую ДНК окружающей среды экстрагировали с использованием мини-набора AllPrep DNA / RNA Mini Kit (QIAGEN).
Гипервариабельный участок V9 (длиной около 150 п.н.) 18S рДНК амплифицировали из экстрагированной ДНК в соответствии с протоколом Stoeck et al. (2010). Прямой праймер был 1391F (5′-GTACACACCGCCCGTC-3 ‘; относящийся к положению 1629–1644 в ссылке Saccharomyces cerevisiae с номером доступа U53879 в GenBank NCBI; Lane, 1991) и обратный праймер EukB (5′-TGATCCGTTCTTCG 3 ′; относится к позиции 1774–1797 в S.cerevisiae ; Medlin et al., 1988). В протоколе ПЦР для амплификации V9 использовалась начальная стадия денатурации при 98 ° C в течение 30 с, затем 30 циклов по 10 с при 98 ° C, 20 с при 61 ° C, 25 с при 72 ° C и последние 5 мин. удлинение при 72 ° C. Реакции проводили в объемах 50 мкл с использованием 0,5 мкл полимеразы Phusion (Biolabs), 10 мкл 5-кратного буфера Phusion GC (Biolabs), 1 мкл 10 мМ dNTP, 0,5 мкл матричной ДНК, 32,5 мкл чистой воды и 0,5 мкл прямой и 0,5 мкл обратных праймеров. Успешную амплификацию проверяли электрофорезом в агарозном геле с использованием 1.0 г агарозы (Carl Roth GmbH), 100 мл буфера TAE (1 ×) и 5 мкл бромистого этидия. Для каждого экстракта ДНК проводили трехкратные реакции ПЦР, чтобы минимизировать смещение ПЦР. Перед очисткой (набор Qiagen’s MinElute) были объединены реплики ПЦР, полученные из того же экстракта ДНК.
удлинение при 72 ° C. Реакции проводили в объемах 50 мкл с использованием 0,5 мкл полимеразы Phusion (Biolabs), 10 мкл 5-кратного буфера Phusion GC (Biolabs), 1 мкл 10 мМ dNTP, 0,5 мкл матричной ДНК, 32,5 мкл чистой воды и 0,5 мкл прямой и 0,5 мкл обратных праймеров. Успешную амплификацию проверяли электрофорезом в агарозном геле с использованием 1.0 г агарозы (Carl Roth GmbH), 100 мл буфера TAE (1 ×) и 5 мкл бромистого этидия. Для каждого экстракта ДНК проводили трехкратные реакции ПЦР, чтобы минимизировать смещение ПЦР. Перед очисткой (набор Qiagen’s MinElute) были объединены реплики ПЦР, полученные из того же экстракта ДНК.
Из полученных продуктов ПЦР были созданы библиотеки для секвенирования с использованием набора для подготовки библиотек ДНК NEB Next ® Ultra TM для Illumina (NEB). Качество библиотек оценивали с помощью системы Agilent Bioanalyzer 2100.Восемнадцать образцов набора данных временных рядов (март 2014 г. — октябрь 2014 г.) были секвенированы на платформе Illumina NextSeq, сгенерировав считывания с парным концом 250 пар оснований.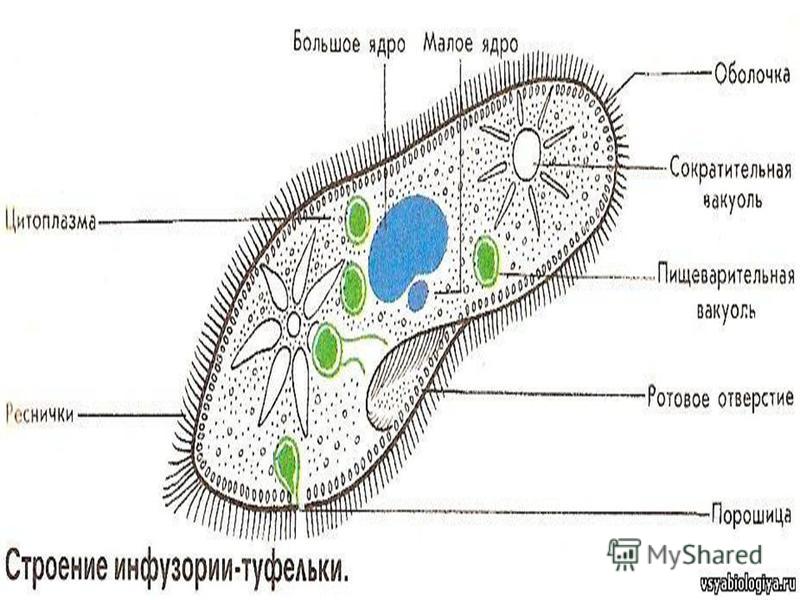 Все остальные образцы (ноябрь 2014 г. — март 2017 г.) секвенировали на платформе Illumina MiSeq, генерируя считывания парных концов длиной 300 пар оснований. Высокопроизводительное секвенирование было проведено компанией SeqIT GmbH & Co. KG (Кайзерслаутерн, Германия). Мы использовали по крайней мере 250 bp-чтений NextSeq, чтобы гарантировать максимально возможное качество последовательности (100% перекрытие последовательностей чтения 1 и чтения 2; обратите внимание: последовательности превышали длину 150 bp из-за мультиплексирования и адаптеров).
Все остальные образцы (ноябрь 2014 г. — март 2017 г.) секвенировали на платформе Illumina MiSeq, генерируя считывания парных концов длиной 300 пар оснований. Высокопроизводительное секвенирование было проведено компанией SeqIT GmbH & Co. KG (Кайзерслаутерн, Германия). Мы использовали по крайней мере 250 bp-чтений NextSeq, чтобы гарантировать максимально возможное качество последовательности (100% перекрытие последовательностей чтения 1 и чтения 2; обратите внимание: последовательности превышали длину 150 bp из-за мультиплексирования и адаптеров).
Предварительная и постобработка данных высокопроизводительного секвенирования
Парные чтения были объединены с помощью специального сценария. Качество данных HTS оценивалось следующим образом: на начальном этапе чрезмерные выступы праймеров были обрезаны с помощью CUTADAPT версии 1.18 (Martin, 2011). Затем чтение было отфильтровано по качеству с помощью команды split.libraries.py в QIIME версии 1.8.0 (Caporaso et al. , 2010). Сохранялись только такие считывания, которые имели точно совпадающие штрих-коды и праймеры, содержали исключительно однозначные нуклеотиды и имели минимальную длину 90 пар оснований.На заключительном этапе качественной фильтрации все чтения подверглись химерному анализу de novo в UCHIME v5.2.236 (Edgar et al., 2011).
, 2010). Сохранялись только такие считывания, которые имели точно совпадающие штрих-коды и праймеры, содержали исключительно однозначные нуклеотиды и имели минимальную длину 90 пар оснований.На заключительном этапе качественной фильтрации все чтения подверглись химерному анализу de novo в UCHIME v5.2.236 (Edgar et al., 2011).
Все высококачественные чтения были в конечном итоге реплицированы в ампликоны и сгруппированы в SWARM версии 2.2.2 (Mahé et al., 2015) с использованием d = 1. Это значение d относится к локальному порогу кластеризации вместо произвольный глобальный порог кластеризации. Кроме того, SWARM не зависит от порядка ввода. OTU растут итеративно, сравнивая каждое поколение назначенных ампликонов с оставшимися чтениями в наборе данных.OTU закрывается, когда OTU не может быть назначен новый ампликон с d или меньше различий. С помощью специального сценария была создана таблица непредвиденных обстоятельств OTU на основе выходных файлов SWARM (сценарий можно получить напрямую по запросу от Доминика Форстера, Университет Кайзерслаутерна).
Отнесение данных HTS к культивируемым видам инфузорий
Перед сравнением данных HTS с данными о последовательностях культивируемых видов инфузорий, таблица сопряженности OTU была нормализована до наименьшего числа последовательностей во всех образцах (110 100 последовательностей в образце 31 марта 2014 г.).Нормализация была выполнена в R версии 3.5.1 (R Development Core Team, 2008) с помощью команды rrarefy в пакете vegan . Из каждой OTU мы извлекли исходную последовательность как репрезентативную. Затем представители набора данных HTS сравнивали с последовательностями, полученными от двенадцати отобранных видов инфузорий с использованием blastn в BLAST версии 2.6.0 (Altschul et al., 1990). Последовательности HTS должны были иметь общий фрагмент из не менее 90 последовательных нуклеотидов и сходство 97%, чтобы быть отнесенными к одной из этих двенадцати культивируемых инфузорий.Только те OTU, репрезентативные последовательности которых совпадают с нашими двенадцатью отобранными инфузориями (таблица 1), были извлечены из нормализованной таблицы сопряженности для дальнейшего анализа.
Статистический анализ: сравнение молекулярных и морфологических данных
Чтобы проверить, похожи ли модели сукцессии подсчета морфологических видов данными HTS, для каждого из двенадцати исследованных видов инфузорий был рассчитан коэффициент ранговой корреляции Спирмена. Поскольку мы выполнили несколько корреляционных тестов на одном и том же наборе данных, была применена поправка Бонферрони для защиты от инфляции альфа-уровня.Кроме того, подсчет клеток, значения биомассы и количество считываний последовательностей на дату отбора проб были использованы для составления трех матриц несходства (Брей Кертис) — по одной для каждого измерения. Корреляцию последовательности с количеством клеток или матрицей биомассы проверяли с помощью простого теста Мантеля с 10 000 перестановок. Все статистические анализы были выполнены с использованием R версии 3.4.4 (R Development Core Team, 2008).
Результаты
Сезонность скопления инфузорий с особым вниманием к двенадцати избранным видам
Цюрихское озеро является мономиктичным, и оборот воды обычно происходит ранней весной, т. е.е., с февраля по апрель. Параметры окружающей среды имели типичную сезонную закономерность, т. Е. В период исследований не было экстремальных климатических лет (рисунок 1). Температура воды на глубине отбора проб (5 м) достигала минимум 4,7 ° C зимой и максимум 23,7 ° C летом. Максимальные концентрации кислорода были измерены во время весеннего цветения фитопланктона (апрель – май). К концу года концентрация кислорода немного снизилась, однако значения на глубине 5 м все еще были выше 8.7 мг. L -1 (насыщение> 70%) даже зимой. Концентрации общего фосфора и нитратов (NO 3 -N) снизились из-за поглощения автотрофами к концу года и увеличились в результате круговорота воды ранней весной. Максимальная численность фитопланктона была достигнута в летние месяцы, тогда как общее количество гетеротрофных бактерий увеличивалось весной и оставалось на высоком уровне (примерно 4 × 10 9 бактерий L -1 ) до осени. Общая численность инфузорий следовала типичному повторяющемуся годовому графику со слегка выраженными пиками в весеннее время и максимальными значениями (ок.
е.е., с февраля по апрель. Параметры окружающей среды имели типичную сезонную закономерность, т. Е. В период исследований не было экстремальных климатических лет (рисунок 1). Температура воды на глубине отбора проб (5 м) достигала минимум 4,7 ° C зимой и максимум 23,7 ° C летом. Максимальные концентрации кислорода были измерены во время весеннего цветения фитопланктона (апрель – май). К концу года концентрация кислорода немного снизилась, однако значения на глубине 5 м все еще были выше 8.7 мг. L -1 (насыщение> 70%) даже зимой. Концентрации общего фосфора и нитратов (NO 3 -N) снизились из-за поглощения автотрофами к концу года и увеличились в результате круговорота воды ранней весной. Максимальная численность фитопланктона была достигнута в летние месяцы, тогда как общее количество гетеротрофных бактерий увеличивалось весной и оставалось на высоком уровне (примерно 4 × 10 9 бактерий L -1 ) до осени. Общая численность инфузорий следовала типичному повторяющемуся годовому графику со слегка выраженными пиками в весеннее время и максимальными значениями (ок.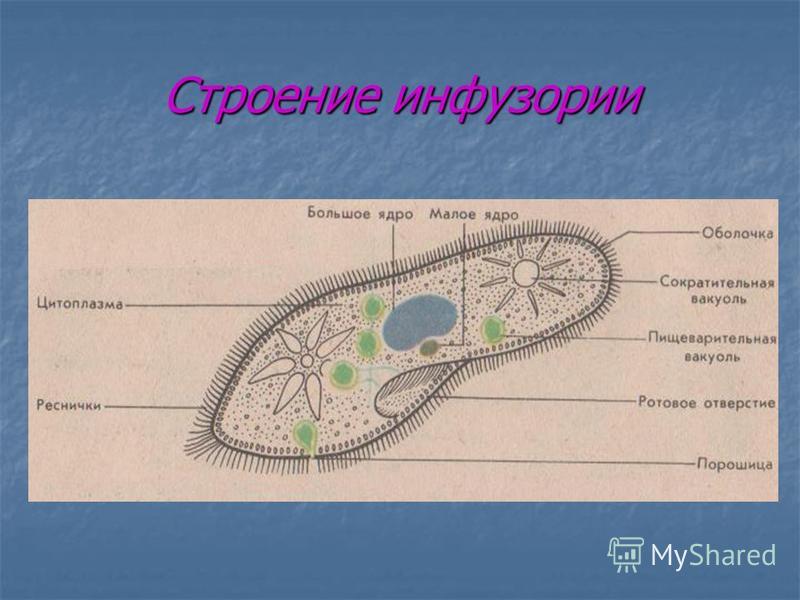 60 × 10 3 клеток L -1 ) летом при самых высоких температурах воды (рисунок 1). В течение 3 лет исследований мы выявили 48 различных морфотипов инфузорий на основании микроскопических подсчетов, и 31 из этих морфотипов можно было четко отнести к уровню морфотипов (дополнительная таблица S1). Семнадцать морфотипов были отнесены только к уровню рода, частично (i) представляющие еще неописанные виды и (ii) морфотипы, которые не могли быть связаны с известными видами из-за методологических ограничений при оценке препаратов QPS.
60 × 10 3 клеток L -1 ) летом при самых высоких температурах воды (рисунок 1). В течение 3 лет исследований мы выявили 48 различных морфотипов инфузорий на основании микроскопических подсчетов, и 31 из этих морфотипов можно было четко отнести к уровню морфотипов (дополнительная таблица S1). Семнадцать морфотипов были отнесены только к уровню рода, частично (i) представляющие еще неописанные виды и (ii) морфотипы, которые не могли быть связаны с известными видами из-за методологических ограничений при оценке препаратов QPS.
Рис. 1. Экологические данные и общая численность инфузорий Цюрихского озера, определенные для 5-метрового слоя с марта 2014 по 2017 гг. (Отбор проб раз в две недели, n = 74). (A) Температура воды (° C) и концентрация кислорода (мг л -1 ). (B) Концентрации общего фосфора (мкг л -1 ) и нитрата NO 3 -N (мкг л -1 ). (C) Общая численность фитопланктона (10 6 клеток L –1 ) и общая численность гетеротрофных бактерий (10 9 бактерий L –1 ). (D) Общая численность инфузорий (10 3 инфузорий L -1 ), определенная подсчетом морфовидов у образцов, пропитанных протарголом.
(D) Общая численность инфузорий (10 3 инфузорий L -1 ), определенная подсчетом морфовидов у образцов, пропитанных протарголом.
С помощью нашего рабочего процесса выделения и культивирования (дополнительный рисунок S1) мы определили конкретные последовательности (включая области V9 гена 18S рРНК) для двенадцати видов инфузорий, отнесенных к пяти классам из озера Цюрих, которые были использованы в качестве семян для анализа HTS (Таблица 1, инвентарные номера: LR025746, LS999896, LS999898-LS999904, LS999906-LS999908).Пять из этих видов еще не были представлены в публичных генетических базах данных. Несколько очень распространенных и очень часто встречающихся видов можно охарактеризовать с помощью подсчета морфовидов, а также HTS (рис. 2). Сравнение обоих методологических подходов привело к следующим результатам: (i) Сезонные сукцессии для наиболее распространенных морфоспортов, основанные на подсчетах, показали замечательную корреляцию с данными HTS (см. Семь верхних панелей на Рисунке 2, Таблице 2 и Дополнительном Рисунке S3). Даже для видов с резкими колебаниями численности, например.g., Cinetochilum margaritaceum, Histiobalantium bodamicum , Pelagostrombidium mirabile , миксотрофный Coleps sp. и Rimostrombidium lacustris , оба метода дали очень сопоставимую временную динамику. Однако корреляция считываний, специфичных для Balanion planctonicum , с количеством клеток была довольно низкой (см. Обсуждение возможных причин). Умеренная корреляция между двумя методами наблюдалась для второго по численности вида Halteria bifurcata . Halteria , вероятно, включали два едва различимых вида, а именно H. bifurcata и H. grandinella , что привело к потенциальным ошибкам при подсчете морфологических видов. Тем не менее, были статистически значимые положительные корреляции (порядок рангов Спирмена) между микроскопическими подсчетами и данными HTS для одиннадцати из двенадцати выбранных инфузорий, но высокие коэффициенты> 0,6 были определены только для пяти видов (таблица 2).
Семь верхних панелей на Рисунке 2, Таблице 2 и Дополнительном Рисунке S3). Даже для видов с резкими колебаниями численности, например.g., Cinetochilum margaritaceum, Histiobalantium bodamicum , Pelagostrombidium mirabile , миксотрофный Coleps sp. и Rimostrombidium lacustris , оба метода дали очень сопоставимую временную динамику. Однако корреляция считываний, специфичных для Balanion planctonicum , с количеством клеток была довольно низкой (см. Обсуждение возможных причин). Умеренная корреляция между двумя методами наблюдалась для второго по численности вида Halteria bifurcata . Halteria , вероятно, включали два едва различимых вида, а именно H. bifurcata и H. grandinella , что привело к потенциальным ошибкам при подсчете морфологических видов. Тем не менее, были статистически значимые положительные корреляции (порядок рангов Спирмена) между микроскопическими подсчетами и данными HTS для одиннадцати из двенадцати выбранных инфузорий, но высокие коэффициенты> 0,6 были определены только для пяти видов (таблица 2). Для восьми видов значимые корреляции были обнаружены для всего набора данных за 3 года, но не в пределах каждого года (Таблица 2).(ii) На основании морфологических исследований было замечено расхождение между подсчетом HTS и морфологических видов для эфемерных и редких видов (например, Uroleptus willii , Stokesia vernalis ). Здесь HTS показались более точным методом описания сезонности, чем классический подход (Рисунки 2, 3 и Дополнительный Рисунок S3). Например, HTS продемонстрировал ежегодный внешний вид Codonella cratera и Pelagodileptus trachelioides за все 3 года исследования, хотя эти виды можно было обнаружить только через 2 из 3 лет с помощью микроскопии.Наибольшее расхождение между обоими методами наблюдалось для Stentor roeselii . Мы обнаружили этот вид микроскопически только через 1 год (то есть на одном из 74 проанализированных слайдов, пропитанных протарголом), тогда как считывания ампликонов продемонстрировали появление на всех 3-х годах исследований (рис.
Для восьми видов значимые корреляции были обнаружены для всего набора данных за 3 года, но не в пределах каждого года (Таблица 2).(ii) На основании морфологических исследований было замечено расхождение между подсчетом HTS и морфологических видов для эфемерных и редких видов (например, Uroleptus willii , Stokesia vernalis ). Здесь HTS показались более точным методом описания сезонности, чем классический подход (Рисунки 2, 3 и Дополнительный Рисунок S3). Например, HTS продемонстрировал ежегодный внешний вид Codonella cratera и Pelagodileptus trachelioides за все 3 года исследования, хотя эти виды можно было обнаружить только через 2 из 3 лет с помощью микроскопии.Наибольшее расхождение между обоими методами наблюдалось для Stentor roeselii . Мы обнаружили этот вид микроскопически только через 1 год (то есть на одном из 74 проанализированных слайдов, пропитанных протарголом), тогда как считывания ампликонов продемонстрировали появление на всех 3-х годах исследований (рис. 2).
2).
Рис. 2. Сезонные сукцессии двенадцати отобранных видов инфузорий, определенные путем подсчета морфотипов импрегнированных серебром образцов (площади) и высокопроизводительного секвенирования (HTS) областей V9 гена (линий) 18S рРНК в течение 3 лет исследований ( n = 74 для каждого вида и применяемого метода; глубина отбора проб = 5 м).Порядок видов отражает их среднюю численность, основанную на подсчете: самые многочисленные виды находятся вверху, а самые редкие представители — внизу. Наброски морфовидов инфузорий являются оригинальными рисунками Джанны Питч. Масштабные линейки: 40 мкм.
Таблица 2. Анализ корреляции рангового порядка Спирмена для двенадцати выбранных видов инфузорий в сравнении с количеством считываний для их конкретных последовательностей V9.
Рисунок 3. Обнаружение двенадцати выбранных видов во всех проанализированных образцах (100% = 74 образца) путем подсчета морфотипов и HTS. Соотношение числа считываний и числа появлений указано в таблице над панелью. Из-за ограничений, связанных с конкретным методом, общий объем исследуемой пробы при микроскопическом подходе составлял не более 150 мл. Данные HTS основаны на 4 л отфильтрованного объема пробы.
Соотношение числа считываний и числа появлений указано в таблице над панелью. Из-за ограничений, связанных с конкретным методом, общий объем исследуемой пробы при микроскопическом подходе составлял не более 150 мл. Данные HTS основаны на 4 л отфильтрованного объема пробы.
В целом, HTS показал более высокий процент встречаемости для всех, кроме одного вида инфузорий ( B. planctonicum ), чем при микроскопическом подсчете (рис. 3). Различия между двумя методами были разительны для некоторых инфузорий, например.g., специфические чтения для R. lacustris были зарегистрированы для всех исследованных образцов ( n = 74), но мы обнаружили этот вид только в 50% исследованных препаратов QPS. Основываясь на подсчете клеток, мы бы определили S. vernalis и C. cratera как действительно эфемерные виды, однако данные HTS показали их появление в 80 и 77% образцов соответственно (рис. 3).
Значения численности и биомассы в сравнении с числом считываний последовательности
Сначала мы определили порядки ранжирования для семи наиболее распространенных видов на основе количества и определили, отражаются ли эти классификации также в биомассах и количестве считываний последовательностей для конкретных видов (рис. 4).Соответствие между числом считываний последовательностей и биомассой было заметно выше, чем между числом считываний последовательностей и численностью морфоспортов. Однако для некоторых видов мы обнаружили поразительную недооценку или переоценку их количественного значения в сообществе инфузорий с помощью HTS. Например, подсчет выявил небольшие B. planctonicum (∼20 × 15 мкм) как численно доминирующий вид на протяжении всего периода исследования, в то время как количество считываний последовательностей для этого конкретного таксона было низким по сравнению со всеми другими изученными инфузориями (рис. Дополнительная таблица S2).Противоположное соотношение было обнаружено, например, для более крупного вида R. lacustris (120 × 70 мкм), который характеризовался большим количеством считываний последовательностей, но низкой численностью подсчитанных особей (рисунки 2, 4 и дополнительная таблица S2). На протяжении всего исследования наибольшее количество считываний последовательностей было получено для H.
4).Соответствие между числом считываний последовательностей и биомассой было заметно выше, чем между числом считываний последовательностей и численностью морфоспортов. Однако для некоторых видов мы обнаружили поразительную недооценку или переоценку их количественного значения в сообществе инфузорий с помощью HTS. Например, подсчет выявил небольшие B. planctonicum (∼20 × 15 мкм) как численно доминирующий вид на протяжении всего периода исследования, в то время как количество считываний последовательностей для этого конкретного таксона было низким по сравнению со всеми другими изученными инфузориями (рис. Дополнительная таблица S2).Противоположное соотношение было обнаружено, например, для более крупного вида R. lacustris (120 × 70 мкм), который характеризовался большим количеством считываний последовательностей, но низкой численностью подсчитанных особей (рисунки 2, 4 и дополнительная таблица S2). На протяжении всего исследования наибольшее количество считываний последовательностей было получено для H. bodamicum , вида, который также достиг высоких значений общей биомассы (рис. 4).
bodamicum , вида, который также достиг высоких значений общей биомассы (рис. 4).
Рис. 4. Порядок ранжирования семи наиболее массовых видов инфузорий на основе численности по сравнению с их биомассой и количества видоспецифичных прочтений (HTS) за 3 года исследования ( n = 74 для каждого вида).Порядок ранжирования для конкретных методов указан в таблице над панелью. Столбцы показывают 25-й, 50-й и 75-й процентили, линии на каждом столбце показывают медианы, усы обозначают 10-й и 90-й процентили, а точки указывают 5-й и 95-й процентили. Белые линии в столбцах — средние значения.
Для окончательного обзора мы сравнили отношения двенадцати выбранных видов друг к другу по отношению к численности, биомассе и количеству считываний последовательностей за весь период исследования (Рисунок 5).Из-за различий в средних размерах клеток этих видов вклад в биомассу отличался от их доли в численности клеток. Например, B. planctonicum составлял 38% от совокупной численности двенадцати выбранных видов, но составлял только 11% кумулятивной биомассы и 0,5% считываний последовательностей, соответственно. Противоположная картина наблюдалась, например, для R. lacustris с вкладом 0,9, 7 и 19% в значения совокупной численности, биомассы и прочтений соответственно.Таким образом, отношения видоспецифичных считываний друг к другу лучше отражают состав сообщества на основе определения биомассы (рис. 5). Эта тенденция была подтверждена при сравнении расстояний Брея Кертиса между каждой парой образцов ( n = 74) с использованием подсчета клеток, биомассы и количества считываний последовательностей для каждого вида. Тест Mantel показал более сильную корреляцию между расстояниями, основанными на количестве считываний последовательностей и биомассе на вид ( r = 0,425, p <0.001), а не на основе количества считываний последовательностей и количества клеток на вид ( r = 0,231, p <0,001).
Противоположная картина наблюдалась, например, для R. lacustris с вкладом 0,9, 7 и 19% в значения совокупной численности, биомассы и прочтений соответственно.Таким образом, отношения видоспецифичных считываний друг к другу лучше отражают состав сообщества на основе определения биомассы (рис. 5). Эта тенденция была подтверждена при сравнении расстояний Брея Кертиса между каждой парой образцов ( n = 74) с использованием подсчета клеток, биомассы и количества считываний последовательностей для каждого вида. Тест Mantel показал более сильную корреляцию между расстояниями, основанными на количестве считываний последовательностей и биомассе на вид ( r = 0,425, p <0.001), а не на основе количества считываний последовательностей и количества клеток на вид ( r = 0,231, p <0,001).
Рис. 5. Отношение двенадцати выбранных видов друг к другу по отношению к численности (слева), биомассе (в центре) и количеству считываний (справа) за весь период исследования (в среднем 74 образца для каждого вида и примененных). метод).
метод).
Обсуждение
Сильные и слабые стороны количественной оценки на основе морфологических видов
С тех пор, как впервые была формализована концепция микробной петли и ее значение для динамики пищевой сети (Azam et al., 1983), исследованиям роли инфузорий как внутренних компонентов морских и пресноводных пелагических систем уделяется значительное внимание. Сегодня мы можем извлечь пользу из «продолжительной» истории исследований в области анализа морфотипов инфузорий, уделяя особое внимание планктону. С 1990-х гг. Новые методологические подходы (Montagnes, Lynn, 1987; Skibbe, 1994) и отличные таксономические компиляции (Foissner, Berger, 1996; Foissner et al., 1999) позволили детально описать сукцессии комплексов инфузорий.Таким образом, сезонные закономерности некоторых ключевых планктонных видов хорошо описаны, включая данные о факторах окружающей среды (например, источниках пищи, температурных эффектах, нисходящем давлении выпаса скота), которые вызывают сукцессии инфузорий (см. Foissner et al., 1999; и ссылки в нем. ). Следовательно, для любого исследования планктонных инфузорий правильная идентификация морфовидов является предпосылкой для использования этих глубоких знаний. Здесь количественное окрашивание протарголом (QPS) оказалось предпочтительным инструментом для количественной оценки инфузорий в сочетании с относительно высоким таксономическим разрешением (Montagnes, Lynn, 1987; Jerome et al., 1993; Скиббе, 1994).
Foissner et al., 1999; и ссылки в нем. ). Следовательно, для любого исследования планктонных инфузорий правильная идентификация морфовидов является предпосылкой для использования этих глубоких знаний. Здесь количественное окрашивание протарголом (QPS) оказалось предпочтительным инструментом для количественной оценки инфузорий в сочетании с относительно высоким таксономическим разрешением (Montagnes, Lynn, 1987; Jerome et al., 1993; Скиббе, 1994).
Благодаря нашему многолетнему опыту работы с этим методом (Pfister et al., 1999), мы можем определить его плюсы, а также недостатки и ограничения: (i) консервированные и окрашенные образцы концентрируются на фильтрах и заделываются в слой Сначала агар, а в конце — канадский бальзам, препараты имеют определенную толщину, что может отрицательно повлиять на оптическую оценку во время светлопольной микроскопии. Это особенно проблематично для идентификации очень крошечных видов, где незначительные различия, например.g., в их оральном или соматическом цилиарном паттерне, необходимо распознать. Например, трудно различить мелкие морфовиды в пределах родов Urotricha и Cyclidium на слайдах QPS (дополнительная таблица S1). Таким образом, неколичественные методы импрегнации серебром необходимы дополнительно для точной идентификации видов (Foissner, 2014). (ii) Вся рабочая процедура QPS является трудоемким методом, и обычно для окрашивания 8 образцов требуется 5 часов, а для оценки одного препарата обычно требуется несколько часов.Как следствие, у нас есть ограничения на выборочные кампании, нацеленные на высокое пространственное и временное разрешение динамики скоплений инфузорий. (iii) Все методы количественного определения планктонных инфузорий позволяют анализировать только ограниченный объем воды. Например, мы могли бы сконцентрировать максимум 150 мл на образец, чтобы получить хорошие препараты для олигомезотрофного озера Цюрих.
Например, трудно различить мелкие морфовиды в пределах родов Urotricha и Cyclidium на слайдах QPS (дополнительная таблица S1). Таким образом, неколичественные методы импрегнации серебром необходимы дополнительно для точной идентификации видов (Foissner, 2014). (ii) Вся рабочая процедура QPS является трудоемким методом, и обычно для окрашивания 8 образцов требуется 5 часов, а для оценки одного препарата обычно требуется несколько часов.Как следствие, у нас есть ограничения на выборочные кампании, нацеленные на высокое пространственное и временное разрешение динамики скоплений инфузорий. (iii) Все методы количественного определения планктонных инфузорий позволяют анализировать только ограниченный объем воды. Например, мы могли бы сконцентрировать максимум 150 мл на образец, чтобы получить хорошие препараты для олигомезотрофного озера Цюрих.
Два последних недостатка (ограничения на анализируемые образцы и объемы воды), кажется, затрудняют анализ эфемерных и редких видов с одной стороны, но также затрудняют описание динамики численности массовых и быстрорастущих представителей, с другой стороны. В более раннем исследовании динамики весеннего цветения в озере Цюрих мы обнаружили с помощью высокой частоты отбора проб (интервалы отбора проб 2–4 дня), что весенние пики численности многих видов продолжались всего несколько дней (Posch et al., 2015). Такая быстрая популяционная динамика наблюдалась в нескольких озерах (например, Müller et al., 1991; Šimek et al., 2014) и была связана с высокими темпами роста инфузорий, приводящими к временам удвоения на 1-2 дня (Müller and Geller, 1993 ; Macek et al., 1996). Следовательно, определенно необходимо исследовать большие объемы образцов с высоким временным разрешением (например,г., ежедневно в теплое время года) для выяснения динамики планктонных сообществ инфузорий. Здесь HTS, по-видимому, является многообещающим дополнительным подходом к методам, основанным на морфологических видах.
В более раннем исследовании динамики весеннего цветения в озере Цюрих мы обнаружили с помощью высокой частоты отбора проб (интервалы отбора проб 2–4 дня), что весенние пики численности многих видов продолжались всего несколько дней (Posch et al., 2015). Такая быстрая популяционная динамика наблюдалась в нескольких озерах (например, Müller et al., 1991; Šimek et al., 2014) и была связана с высокими темпами роста инфузорий, приводящими к временам удвоения на 1-2 дня (Müller and Geller, 1993 ; Macek et al., 1996). Следовательно, определенно необходимо исследовать большие объемы образцов с высоким временным разрешением (например,г., ежедневно в теплое время года) для выяснения динамики планктонных сообществ инфузорий. Здесь HTS, по-видимому, является многообещающим дополнительным подходом к методам, основанным на морфологических видах.
Выбор региона V9 в качестве маркера
Различные гипервариабельные области использовались для мониторинга сообществ эукариотического планктона в предыдущих исследованиях, и их полезность обсуждалась исследователями. Для обзора и сравнения мы ссылаемся на Tanabe et al. (2016). Среди трех наиболее популярных маркерных областей (V1 – V2, V4 и V9) мы выбрали область V9 по следующим причинам: (i) Хотя универсальность праймеров очень похожа для всех трех конкретных стандартных наборов праймеров, в настоящее время область V9 это лучший компромисс между охватом базы данных и таксономическим разрешением (изменчивость последовательностей; Tanabe et al., 2016). (ii) Кроме того, эта область заметно короче, чем области V1 – V2 и V4, и, таким образом, позволяет получить гораздо большую глубину последовательности при меньших затратах, что особенно актуально в исследованиях с большим количеством образцов. (iii) Наконец, в крупнейшем на сегодняшний день исследовании экологического секвенирования сообществ эукариотического планктона (Де Варгас и др., 2015) использовалась область V9, что позволило обеспечить хороший охват большинства (если не всех) основных таксономических линий эукариот. Будущие исследования метаданных экологических последовательностей эукариотического планктона выиграют от исследований, в которых уже использовался этот генетический маркер.
Для обзора и сравнения мы ссылаемся на Tanabe et al. (2016). Среди трех наиболее популярных маркерных областей (V1 – V2, V4 и V9) мы выбрали область V9 по следующим причинам: (i) Хотя универсальность праймеров очень похожа для всех трех конкретных стандартных наборов праймеров, в настоящее время область V9 это лучший компромисс между охватом базы данных и таксономическим разрешением (изменчивость последовательностей; Tanabe et al., 2016). (ii) Кроме того, эта область заметно короче, чем области V1 – V2 и V4, и, таким образом, позволяет получить гораздо большую глубину последовательности при меньших затратах, что особенно актуально в исследованиях с большим количеством образцов. (iii) Наконец, в крупнейшем на сегодняшний день исследовании экологического секвенирования сообществ эукариотического планктона (Де Варгас и др., 2015) использовалась область V9, что позволило обеспечить хороший охват большинства (если не всех) основных таксономических линий эукариот. Будущие исследования метаданных экологических последовательностей эукариотического планктона выиграют от исследований, в которых уже использовался этот генетический маркер.
Корреляция данных HTS с подсчетом морфотипов
Преобразование численности ампликонов в наборах данных HTS в численность клеток — критическая проблема в молекулярной экологии и экологическом секвенировании. В более ранних исследованиях сообществ макетов протистана, в то время как все виды были обнаружены после секвенирования HTS, относительная доля типов последовательностей не коррелировала с численностью клеток в смесях клеток (Egge et al., 2013; Weber and Pawlowski, 2013). Кроме того, сравнительные исследования в природных экосистемах показали, что численность последовательностей и численность клеток часто несовместимы (Bachy et al., 2013; Сантоферрара и др., 2014; Stoeck et al., 2014). Однако эти исследования не являются окончательными, поскольку другие исследования поддерживают количественное использование данных HTS. Giner et al. (2016) сообщили об адекватной корреляции между микроскопическим количеством планктонных пикоэукариот и молекулярными сигналами после HTS. Это подтверждается более поздними исследованиями Forster et al. (2018) и Stoeck et al. (2018), показав, что анализ ассоциаций, основанный на данных обилия HTS инфузорий, отражает закономерности, полученные в результате морфологических исследований тех же образцов.Giner et al. (2016) утверждали, что ошибки ПЦР (Stoeck et al., 2006; Shakya et al., 2013; Tragin et al., 2018) и предполагаемые артефакты секвенирования (Huse et al., 2007) не влияют на корреляцию между относительным считыванием и изобилие клеток. Авторы продемонстрировали, что чем больше чтения, тем выше доля ячеек. По мнению этих авторов, использование относительного количества читателей в качестве показателя состава сообщества для целей сравнения оправдано. Противоречивые результаты упомянутых исследований демонстрируют, что относительная численность данных HTS может быть интерпретирована количественно, но также предупреждает о рассмотрении их как прямых заместителей численности клеток в естественных сообществах.Обстоятельства, при которых количественный анализ и интерпретация данных HTS возможны и надежны, еще предстоит определить.
Это подтверждается более поздними исследованиями Forster et al. (2018) и Stoeck et al. (2018), показав, что анализ ассоциаций, основанный на данных обилия HTS инфузорий, отражает закономерности, полученные в результате морфологических исследований тех же образцов.Giner et al. (2016) утверждали, что ошибки ПЦР (Stoeck et al., 2006; Shakya et al., 2013; Tragin et al., 2018) и предполагаемые артефакты секвенирования (Huse et al., 2007) не влияют на корреляцию между относительным считыванием и изобилие клеток. Авторы продемонстрировали, что чем больше чтения, тем выше доля ячеек. По мнению этих авторов, использование относительного количества читателей в качестве показателя состава сообщества для целей сравнения оправдано. Противоречивые результаты упомянутых исследований демонстрируют, что относительная численность данных HTS может быть интерпретирована количественно, но также предупреждает о рассмотрении их как прямых заместителей численности клеток в естественных сообществах.Обстоятельства, при которых количественный анализ и интерпретация данных HTS возможны и надежны, еще предстоит определить.
В нашем исследовании оба метода показали четкую сезонную сукцессию для всех выбранных видов, а динамика популяций, основанная на HTS, в большинстве случаев заметно коррелировала с данными морфоспортов (рисунок 2 и дополнительный рисунок S3). До сих пор было всего несколько попыток сравнить временные наборы данных HTS с микроскопическим анализом пресноводных систем. Medinger et al.(2010) обнаружили значительную корреляцию между численностью клеток и данными о последовательности только для двух из пяти исследованных видов протистанов. Stoeck et al. (2014) провели исследование комплекса инфузорий из олигомезотрофного озера с помощью микроскопии и пиросеквенирования области V4 гена 18S рРНК. В последнем исследовании данные секвенирования вообще не отражали численность морфо-видов. Одной из основных причин этого несоответствия была неадекватность базы данных референсных генов с чрезвычайно низким охватом типичных пресноводных инфузорий.Авторы уже заявили, что дальнейшие инициативы по штрих-кодированию для пресноводных инфузорий (не только ориентированные на область V4) были срочно необходимы для полного использования потенциала HTS в экологических исследованиях пресноводных простейших. Кроме того, более глубокая стратегия секвенирования, достижимая с помощью пиросеквенирования, будет полезна для полного охвата разнообразия протистанского планктона в пресноводных средах (Stoeck et al., 2014).
Кроме того, более глубокая стратегия секвенирования, достижимая с помощью пиросеквенирования, будет полезна для полного охвата разнообразия протистанского планктона в пресноводных средах (Stoeck et al., 2014).
Как показало наше исследование, динамика сукцессии инфузорий, основанная на численности прочитанных, была очень похожа на закономерности, выведенные из подсчета морфо-видов.Двумя шагами к лучшему согласованию паттернов, полученных с помощью микроскопии и секвенирования, являются (i) более глубокий охват последовательностей с помощью технологии секвенирования Illumina и (ii) доступность референсных последовательностей инфузорий, полученных от местных представителей сообщества. С помощью этого рабочего процесса HTS действительно помогли пролить свет на динамику популяций эфемерных и редких видов (рис. 2). Преимущество HTS перед микроскопией в этом контексте, безусловно, заключалось в возможности скрининга более высоких объемов образцов (HTS: 4 л, морфоспецифический анализ: макс.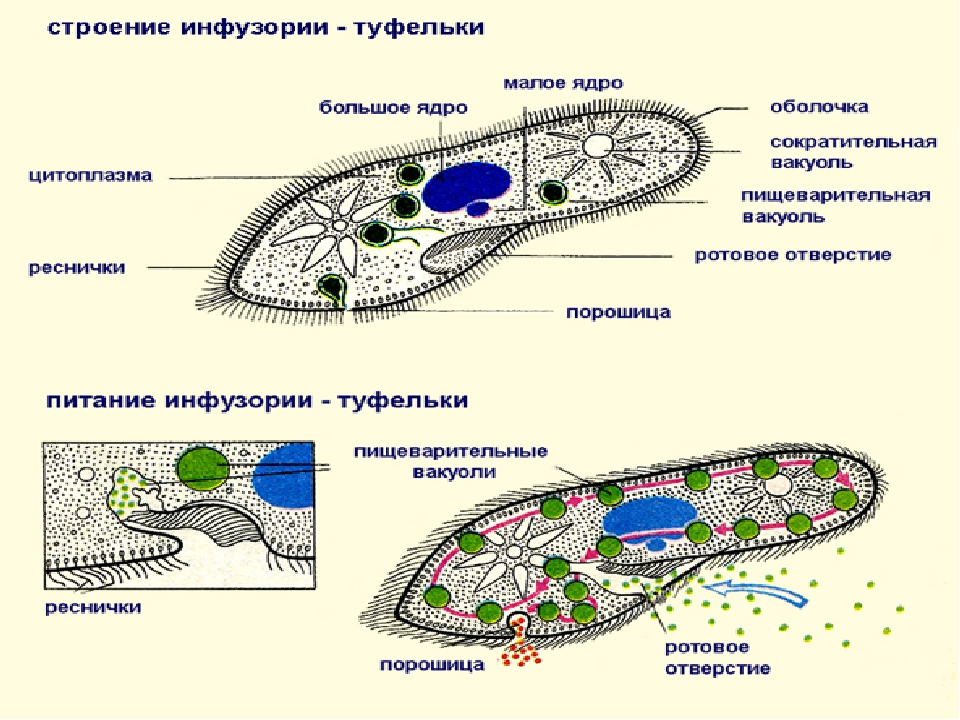 150 мл), что является необходимым условием для ответа на этот вопрос (Dolan and Stoeck, 2011). Поскольку в определенные периоды года редкие виды могут упасть ниже предела микроскопического обнаружения, считывания ампликонов все равно будут обнаруживаться HTS. И наоборот, секвенирование не позволяет различить клетки, проявляющиеся как активные трофозоиты или как покоящиеся цисты в пелагиали. Таким образом, популяционная динамика эфемерных и редких видов инфузорий остается предметом дальнейших исследований.
150 мл), что является необходимым условием для ответа на этот вопрос (Dolan and Stoeck, 2011). Поскольку в определенные периоды года редкие виды могут упасть ниже предела микроскопического обнаружения, считывания ампликонов все равно будут обнаруживаться HTS. И наоборот, секвенирование не позволяет различить клетки, проявляющиеся как активные трофозоиты или как покоящиеся цисты в пелагиали. Таким образом, популяционная динамика эфемерных и редких видов инфузорий остается предметом дальнейших исследований.
Balanion planctonicum представлял собой единственный вид, который был обнаружен в большем количестве образцов с помощью микроскопии, чем с помощью HTS (рис. 2, 3).Для интерпретации данных HTS мы могли использовать только одну эталонную последовательность, полученную из клонального штамма B. planctonicum (таблица 1). Однако этот морфовид может представлять собой комплекс видов, укрывающий криптические таксоны, которые не были бы обнаружены с помощью нашего рабочего процесса, и в будущем потребуется секвенирование большего количества клональных культур. Следующее наблюдение подтверждает наш тезис: установив порог идентичности 99% по сравнению с примененными 97%, мы получили очень похожее количество конкретных считываний для всех видов, за исключением B.planctonicum , который не может быть обнаружен с использованием более высокого порогового уровня (дополнительная таблица S2). Кроме того, наибольшее расхождение между морфологическими подсчетами и численностью считываний ампликонов наблюдалось в летние месяцы, когда общая численность инфузорий достигала максимальных значений. Поскольку количество считываний, специфичных для B. planctonicum , было per se маргинальным, сигналы ампликона, вероятно, терялись по сравнению с большим количеством считываний всех других инфузорий из-за процедур нормализации анализа HTS.
Следующее наблюдение подтверждает наш тезис: установив порог идентичности 99% по сравнению с примененными 97%, мы получили очень похожее количество конкретных считываний для всех видов, за исключением B.planctonicum , который не может быть обнаружен с использованием более высокого порогового уровня (дополнительная таблица S2). Кроме того, наибольшее расхождение между морфологическими подсчетами и численностью считываний ампликонов наблюдалось в летние месяцы, когда общая численность инфузорий достигала максимальных значений. Поскольку количество считываний, специфичных для B. planctonicum , было per se маргинальным, сигналы ампликона, вероятно, терялись по сравнению с большим количеством считываний всех других инфузорий из-за процедур нормализации анализа HTS.
Взаимосвязь между числами считываний и значениями численности или биомассы
Мы проверили, отражают ли отношения прочтений между двенадцатью выбранными видами состав сообщества, выведенный из подсчета клеток (рис. 5). Можно ожидать расхождения между двумя методами (Santoferrara et al., 2014; Stoeck et al., 2014), поскольку, вероятно, все виды инфузорий имеют чрезвычайно высокое число копий оперона рДНК на индивидуальную клетку. Например, Gong et al. (2013) сообщили о величине ∼316000 (± 7100 стандартного отклонения) копий на клетку для перитрихозных инфузорий ( Vorticella sp.). Авторы также задокументировали, что количество копий рДНК на клетку заметно различается между (от 3385 до 315 786) и даже внутри 14 исследованных изолятов. Последнее изменение может быть связано с образованием или распадом макронуклеаров во время различных фаз роста и половой жизни клетки. В нашем исследовании видоспецифические вариации числа копий оперона рДНК могут быть причиной того, что некоторые, даже многочисленные, виды (например, B. planctonicum и C. margaritaceum ) характеризовались низким числом прочтений.Напротив, чтения H. bodamicum достигли наивысших значений на протяжении всего исследования, хотя и не были самым многочисленным видом.
5). Можно ожидать расхождения между двумя методами (Santoferrara et al., 2014; Stoeck et al., 2014), поскольку, вероятно, все виды инфузорий имеют чрезвычайно высокое число копий оперона рДНК на индивидуальную клетку. Например, Gong et al. (2013) сообщили о величине ∼316000 (± 7100 стандартного отклонения) копий на клетку для перитрихозных инфузорий ( Vorticella sp.). Авторы также задокументировали, что количество копий рДНК на клетку заметно различается между (от 3385 до 315 786) и даже внутри 14 исследованных изолятов. Последнее изменение может быть связано с образованием или распадом макронуклеаров во время различных фаз роста и половой жизни клетки. В нашем исследовании видоспецифические вариации числа копий оперона рДНК могут быть причиной того, что некоторые, даже многочисленные, виды (например, B. planctonicum и C. margaritaceum ) характеризовались низким числом прочтений.Напротив, чтения H. bodamicum достигли наивысших значений на протяжении всего исследования, хотя и не были самым многочисленным видом. Систематическое недопредставление видоспецифичных считываний также может быть вызвано паттернами амплификации, специфичными для праймеров. Однако относительно высокая конгруэнтность составов сообществ, основанная на биомассах и количестве прочтений (рис. 5), скорее говорит о связи между размером клеток вида и числом копий рДНК. Такая связь ранее была показана для 18 штаммов водорослей, представляющих несколько классов эукариот (Zhu et al., 2005). Fu and Gong (2017) опубликовали единственное исследование, в котором изучалась связь между рДНК и количеством копий рРНК и фенотипическими признаками у инфузорий. Взаимосвязь между рДНК или рРНК и размером (объемом) клеток изучаемых инфузорий (масштабирование риботипа) согласуется как с метаболической теорией экологии, так и с гипотезой скорости роста, давая количественную основу для связи числа копий клеточной рРНК с размером клетки, ростом (активность) и стехиометрия биомассы. Эти результаты могут объяснить наблюдаемое соответствие между изобилием генов таксономических маркеров и клеточной биомассой в природных сообществах инфузорий.
Систематическое недопредставление видоспецифичных считываний также может быть вызвано паттернами амплификации, специфичными для праймеров. Однако относительно высокая конгруэнтность составов сообществ, основанная на биомассах и количестве прочтений (рис. 5), скорее говорит о связи между размером клеток вида и числом копий рДНК. Такая связь ранее была показана для 18 штаммов водорослей, представляющих несколько классов эукариот (Zhu et al., 2005). Fu and Gong (2017) опубликовали единственное исследование, в котором изучалась связь между рДНК и количеством копий рРНК и фенотипическими признаками у инфузорий. Взаимосвязь между рДНК или рРНК и размером (объемом) клеток изучаемых инфузорий (масштабирование риботипа) согласуется как с метаболической теорией экологии, так и с гипотезой скорости роста, давая количественную основу для связи числа копий клеточной рРНК с размером клетки, ростом (активность) и стехиометрия биомассы. Эти результаты могут объяснить наблюдаемое соответствие между изобилием генов таксономических маркеров и клеточной биомассой в природных сообществах инфузорий.
Необходимость метабаркодирования планктонных пресноводных инфузорий
В этом методологическом исследовании мы не сосредотачивались на очевидных сильных сторонах HTS для анализа планктонных инфузорий, т. Е. (I) для выяснения бета-разнообразия в течение сезонного цикла, (ii) для получения указаний на загадочные, близкородственные виды, и (iii) обнаружить, вероятно, еще неизвестные и неописанные виды (Santoferrara et al., 2016). Нашей целью было сравнить данные HTS с подсчетом морфотипов в отношении сезонности как многочисленных, так и редких видов.Нам было известно, что информация о последовательностях (18S рДНК) для большинства известных морфотипов в озере Цюрих (Posch et al., 2015) не существовала в начале нашего исследования. Наш выбор двенадцати видов, которые были изучены более подробно, частично зависел от успешной изоляции и культивирования образцов. Основываясь на подсчете морфологических видов, мы обнаружили, что несколько видов в пределах рода Urotricha (Foissner and Pfister, 1997) были так же многочисленны, как B. planctonicum за 3 года исследований (дополнительная таблица S1).Однако нам не удалось выделить и секвенировать Urotricha spp., И, к сожалению, в общедоступной базе данных последовательностей нет ни одной записи, касающейся области V9 этого рода. Таким образом, мы не смогли извлечь специфических прочтений Urotricha из наших данных HTS, что свидетельствует о необходимости дальнейшего штрих-кодирования ДНК морфологически хорошо описанных планктонных пресноводных инфузорий. На основе подробного обзора литературы Foissner et al. (1999) предположили, что около 180 описанных морфологических видов действительно могут быть эупланктонными и что общее количество планктонных видов в одном озере (альфа-разнообразие) может варьироваться от 50 до 100 (см. Также Sonntag et al., 2006; Зингель и Ныгес, 2010). Для озера Цюрих мы обнаружили 48 различных морфотипов инфузорий на основе микроскопических подсчетов для эпипелагической области в течение 3 лет исследований. Это число кажется довольно низким по сравнению с ожидаемым и частично описанным разнообразием почв или проточных вод (см.
planctonicum за 3 года исследований (дополнительная таблица S1).Однако нам не удалось выделить и секвенировать Urotricha spp., И, к сожалению, в общедоступной базе данных последовательностей нет ни одной записи, касающейся области V9 этого рода. Таким образом, мы не смогли извлечь специфических прочтений Urotricha из наших данных HTS, что свидетельствует о необходимости дальнейшего штрих-кодирования ДНК морфологически хорошо описанных планктонных пресноводных инфузорий. На основе подробного обзора литературы Foissner et al. (1999) предположили, что около 180 описанных морфологических видов действительно могут быть эупланктонными и что общее количество планктонных видов в одном озере (альфа-разнообразие) может варьироваться от 50 до 100 (см. Также Sonntag et al., 2006; Зингель и Ныгес, 2010). Для озера Цюрих мы обнаружили 48 различных морфотипов инфузорий на основе микроскопических подсчетов для эпипелагической области в течение 3 лет исследований. Это число кажется довольно низким по сравнению с ожидаемым и частично описанным разнообразием почв или проточных вод (см. Таблицу 3.7 в Foissner et al., 1999). Однако инфузории в пелагических царствах нуждаются в особых адаптациях к планктонной жизни и уникальных стратегиях, чтобы встретить достаточное количество частиц пищи в окружающей среде, зачастую бедной питательными веществами.Принимая эти числа как приближение к разнообразию планктонных инфузорий, инициативы по штрих-кодированию ДНК возможны даже тогда, когда можно ожидать загадочных или все еще неописанных таксонов. Тем не менее, это остается сложной задачей, поскольку многие виды инфузорий демонстрируют очень выраженные сезонные изменения с отчетливыми максимумами популяции, длящимися всего несколько дней или недель и редкими в течение большей части года.
Таблицу 3.7 в Foissner et al., 1999). Однако инфузории в пелагических царствах нуждаются в особых адаптациях к планктонной жизни и уникальных стратегиях, чтобы встретить достаточное количество частиц пищи в окружающей среде, зачастую бедной питательными веществами.Принимая эти числа как приближение к разнообразию планктонных инфузорий, инициативы по штрих-кодированию ДНК возможны даже тогда, когда можно ожидать загадочных или все еще неописанных таксонов. Тем не менее, это остается сложной задачей, поскольку многие виды инфузорий демонстрируют очень выраженные сезонные изменения с отчетливыми максимумами популяции, длящимися всего несколько дней или недель и редкими в течение большей части года.
Наконец, оценка HTS зависит от обширной базы данных эталонных последовательностей. Связывая OTU с известными морфовидами, мы можем использовать обширные знания об аутэкологии этих видов.Этот аспект имеет решающее значение для науки и особенно для прикладных исследований, основанных на идентификации видов-индикаторов.
Авторские взносы
TP, TS, BS и GP разработали и разработали исследование. GP и EB провели подсчет морфологических видов и секвенирование выделенных / культивируемых видов. TS, ZQ и DF провели и оценили анализ HTS. Все авторы обсудили результаты и внесли свой вклад в концепцию рукописи. GP и TP написали рукопись и создали все рисунки и таблицы.
Финансирование
Это исследование финансировалось Швейцарским национальным научным фондом (SNF, проект: 31003A-182489 и 310030E-160603/1), Немецким исследовательским фондом (DFG, проект: STO 414 / 13-1), Австрийским научным фондом (FWF). , Project: I2238-B25) и исследовательский грант Фонда Карла Цейса для DF.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Томаса Прёшольда за разработку стратегии вложенной ПЦР для области V9. Мы также благодарим Себастьяна Диррена, Дебору Кнапп, Ойгена Лоэра, Дэниела Марти и Катю Пушкареву за их помощь в отборе проб и лабораторных работах. Мы также благодарны Барбаре Каммерландер, Микаэле Сальчер, Эдварду Митчеллу и Стефану Андрею за их критические комментарии к рукописи.
Мы также благодарим Себастьяна Диррена, Дебору Кнапп, Ойгена Лоэра, Дэниела Марти и Катю Пушкареву за их помощь в отборе проб и лабораторных работах. Мы также благодарны Барбаре Каммерландер, Микаэле Сальчер, Эдварду Митчеллу и Стефану Андрею за их критические комментарии к рукописи.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fmicb.2019.00248/full#supplementary-material
Сноски
- https://cran.ism.ac.jp/web/packages/vegan/vegan.pdf
Список литературы
Альтшул, С. Ф., Гиш, В., Миллер, В., Майерс, Э. У. и Липман, Д. Дж. (1990). Базовый инструмент поиска локального выравнивания. J. Mol. Биол. 215, 403–410. DOI: 10.1016 / S0022-2836 (05) 80360-2
CrossRef Полный текст | Google Scholar
Амарал-Цеттлер, Л.А., Макклимент, Э. А., Даклоу, Х. У., и Хьюз, С. М. (2009). Метод изучения разнообразия протистанов с использованием массового параллельного секвенирования гипервариабельных участков V9 малых субъединичных генов рибосомной РНК.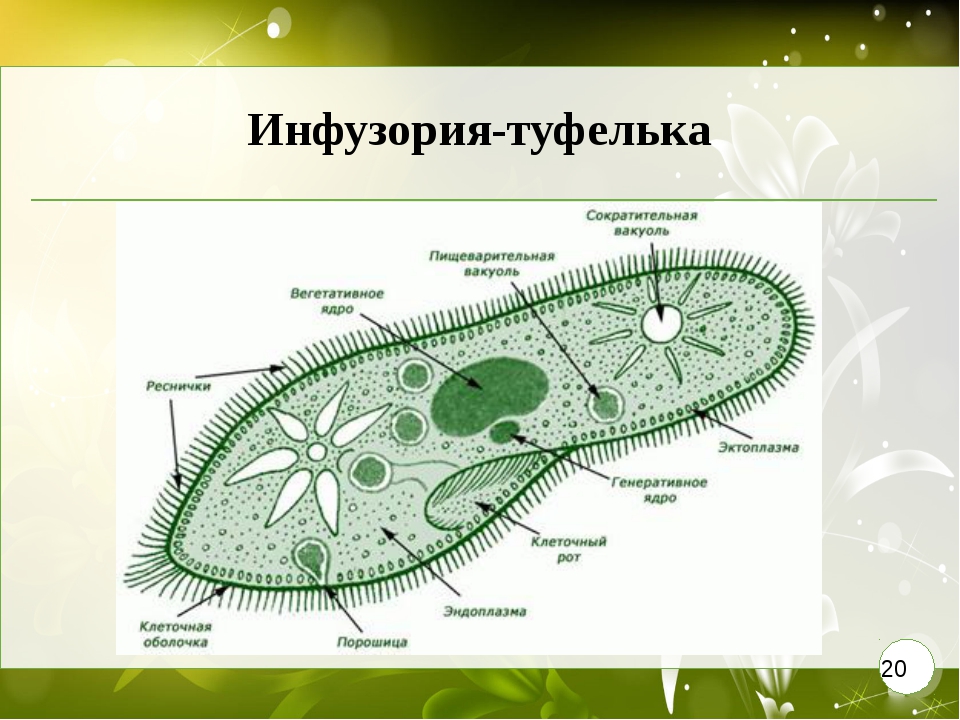 PLoS One 4: e6372. DOI: 10.1371 / journal.pone.0006372
PLoS One 4: e6372. DOI: 10.1371 / journal.pone.0006372
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Азам, Ф., Фенчел, Т., Филд, Дж. Г., Грей, Дж. С., Мейер-Рейл, Л. А., и Тингстад, Т. Ф. (1983). Экологическая роль микробов водяного столба в море. Мар. Экология. Прог. Сер. 10, 257–263. DOI: 10.3354 / meps010257
CrossRef Полный текст | Google Scholar
Бачи, К., Долан, Дж. Р., Лопес-Гарсия, П., Дешам, П., и Морейра, Д. (2013). Точность оценок разнообразия протистов: морфология по сравнению с клонированием и прямым пиросеквенированием генов 18S рРНК и ITS-регионов с использованием заметных инфузорий тинтиннид в качестве примера. ISME J. 7, 244–255. DOI: 10.1038 / ismej.2012.106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бахи, К., Гомес, Ф., Лопес-Гарсия, П., Долан, Дж. Р., и Морейра, Д. (2012). Молекулярная филогения тинтиннид инфузорий (тинтинниды, цилиофоры). Protist 163, 873–887. DOI: 10.1016 / j.protis.2012.01.001
DOI: 10.1016 / j.protis.2012.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бачи, К., Морейра, Д., Долан, Дж. Р., и Лопес-Гарсия, П. (2014). Сезонная динамика свободноживущих сообществ инфузорий тинтиннид, выявленная по экологическим последовательностям Северо-Западного Средиземного моря. FEMS Microbiol.Ecol. 87, 330–342. DOI: 10.1111 / 1574-6941.12224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Банерджи А., Бэгли М., Элк М., Пилигрим Э., Мартинсон Дж. И Санто-Доминго Дж. (2018). Пространственная и временная динамика сообщества пресноводного эукариотического планктона, выявленная с помощью метабаркодирования гена 18S рРНК. Hydrobiologia 818, 71–86. DOI: 10.1007 / s10750-018-3593-0
CrossRef Полный текст | Google Scholar
Берджеб, Л., Парада, А., Нидхэм, Д. М., Фурман, Дж. А. (2018). Краткосрочная динамика и взаимодействия сообществ морских протистов во время весенне-летнего перехода. ISME J. 12, 1907–1917. DOI: 10.1038 / s41396-018-0097-x
ISME J. 12, 1907–1917. DOI: 10.1038 / s41396-018-0097-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бок К., Сальчер М., Дженсен М., Пандей Р. В. и Бенигк Дж. (2018). Синхронность планктонных сообществ эукариот и прокариот в трех австрийских озерах, где проводились сезонные пробы. Фронт. Microbiol. 9: 1290. DOI: 10.3389 / fmicb.2018.01290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Caporaso, J. G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F. D., Costello, E. K., et al. (2010). QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нац. Методы 7, 335–336. DOI: 10.1038 / nmeth.f.303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэрон, Д. А., Гаст, Р. Дж., Лим, Э. Л. и Деннет, М.Р. (1999). Структура сообщества протистана: молекулярные подходы к ответам на экологические вопросы. Hydrobiologia 401, 215–227. DOI: 10.1023 / A: 1003721
DOI: 10.1023 / A: 1003721
- 9
- 1.
Agasild, H, Nõges, T (2005) Cladoceran и коловратки, пасущиеся на бактериях и фитопланктоне в двух неглубоких эвтрофных озерах: in situ измерение с флуоресцентными микросферами. J Plankton Res 27: 1155–1174
Google Scholar
- 2.
Бивер, Дж. Р., Крисман, Т. Л. (1989) Роль мерцательных простейших в пелагических пресноводных экосистемах. Microbial Ecol 17: 111–136
Статья Google Scholar
- 3.
Бидданда, Б., Опсал, С., Беннер, Р. (1994) Дыхание планктона и поток углерода через бактериопланктон на шельфе Луизианы. Limnol Oceanogr 39: 1259–1275
CAS Google Scholar
- 4.
Блум, Дж. (1989) Бактериальное производство, выпас простейших и минерализация в стратифицированном озере Фехтен. Диссертация
- 5.
Borsheim, KY, Bratbak, G (1987) Коэффициенты преобразования объема клетки в клеточный углерод для бактериоядных Monas sp.обогащен морской водой. Mar Ecol Prog Ser 36: 171–175
Google Scholar
- 6.
Bottrell, HH, Duncan, A, Gliwicz, ZM, Grygierek, E, Herzig, A, Hillbricht-Illkowska, A, Kurasawa, H, Larsson, P, Weglenska, T (1976) Обзор некоторых проблемы исследования продукции зоопланктона. Norw J Zool 419–456
- 7.
Comerma, M, Garcia, JC, Armengol, J, Romero, M, Šimek, K (2001) Структура планктонной пищевой сети вдоль водохранилища Сау (Испания) летом 1997 года.Int Rev Hydrobiol 86: 195–209
Статья CAS Google Scholar
- 8.
del Giorgio, PA, Cole, JJ, Cimbleris, A (1997) Частота дыхания бактерий превышает производство фитопланктона в непродуктивных водных системах. Nature 385: 148–151
Статья Google Scholar
- 9.
Diehl, S, Feissel, M (2001) Добыча внутри гильдии страдает от обогащения своих ресурсов: эксперимент микрокосма с инфузориями.Экология 82: 2977–2983
Статья Google Scholar
- 10.
Dumont, HJ, Van de Velde, I., Dumont, S (1975) Оценка сухого веса биомассы и выборки Cladocera, Copepoda и Rotifera из планктона, перифитона и бентоса континентальных вод. Oecologia 19: 75–97
Статья Google Scholar
- 11.
Фойсснер, В., Бергер, Х, Шаумбург, Дж. (1999) Идентификация и экология лимнетических инфузорий планктона.Bayerisches Landesamt für Wasserwirtschaft, München
Google Scholar
- 12.
Gasol, JM (1995) Закономерности регулирования гетеротрофных нанофлагеллат в озерах умеренного пояса по принципу «сверху вниз» и «снизу вверх». J Plankton Res 17: 1879–1903
Статья Google Scholar
- 13.
Хансен AM (2000) Ответ инфузорий и криптомонад на весеннюю когорту циклопоидных веслоногих в неглубоком гиперэвтрофном озере.J Plankton Res 22: 185–203
Статья Google Scholar
- 14.
Infante, A, Abella, SEB (1985) Ингибирование дафний с помощью Oscillatoria в озере Вашингтон. Лимнол Океаногр 30: 1046–1052
Google Scholar
- 15.
Юргенс, К. (1994) Воздействие дафний на пищевые сети планктонных микробов. Обзор. Mar Microb Food Webs 8: 295–324
Google Scholar
- 16.
Jürgens, K, Jeppesen, E (2000) Влияние метазоопланктона на структуру микробной пищевой сети в неглубоком гипертрофическом озере. J Plankton Res 22: 1047–1070
Статья Google Scholar
- 17.
Юргенс, К., Скиббе, О., Джеппенсен, Э. (1999) Влияние метазоопланктона на состав и динамику популяций планктонных инфузорий в мелководном гипертрофическом озере. Aquat Microb Ecol 17: 61–75
Google Scholar
- 18.
Kim, HW, Hwang, SJ, Joo, GJ (2000) Зоопланктон, выпасающий бактерии и фитопланктон в регулируемой большой реке (река Накдонг, Корея). J Plankton Res 22: 1559–1577
Статья CAS Google Scholar
- 19.
Кисанд, В., Ныгес, Т. (1998) Сезонная динамика бактерио- и фитопланктона в большом и мелководном эвтропическом озере Выртсъярв, Эстония. Int Rev Hydrobiol 83: 205–216
Google Scholar
- 20.
Кисанд, В., Зингель, П. (2000) Преобладание выпаса инфузорий бактериями весной в мелководном эвтрофном озере. Aquat Microb Ecol 22: 135–142
Google Scholar
- 21.
Ламперт, В., Флекнер, В., Рай, Х., Тейлор, Б.Э. (1986) Контроль фитопланктона с помощью выпаса зоопланктона — исследование весенней фазы чистой воды. Limnol Oceanogr 31: 478–490
Google Scholar
- 22.
Lignell, R (1992) Проблемы при фильтрационном фракционировании образцов первичной продуктивности 14 C. Limnol Oceanogr 37: 172–178
CAS Google Scholar
- 23.
Лоферер-Кроссбахер, М., Клима, Дж., Псеннер, Р. (1998) Определение сухой массы бактериальных клеток с помощью просвечивающей электронной микроскопии и денситометрического анализа изображений. Appl Environ Microbiol 64: 688–694
PubMed CAS Google Scholar
- 24.
Macek, M, Šimek, K, Bittl, T (2001) Заметный пик олиготрихоподобных инфузорий после зимней стратификации в болотном озере. J Plankton Res 23: 353–363
Статья CAS Google Scholar
- 25.
Накано, С., Койтабаши, Т., Уэда, Т. (1998) Сезонные изменения численности гетеротрофных нанофлагеллят и потребления ими бактерий в озере Бива с особым упором на трофические взаимодействия с Daphia galeata .Arch Hydrobiol 142: 21–34
Google Scholar
- 26.
Nielsen, TG, Kiorboe, T (1994) Регулирование биомассы и продукции зоопланктона в умеренной прибрежной экосистеме. 2. Инфузории. Лимнол Океаногр 39: 508–519
Google Scholar
- 27.
Ниеми, М., Купаринен, Дж., Ууси-Раува, А., Корхонен, К. (1983) Подготовка образцов водорослей для жидкостного сцинтилляционного счета. Hydrobiologia 106: 149–159
Статья CAS Google Scholar
- 28.
Nixdorf, B, Arndt, H (1993) Сезонные изменения в динамике планктона эвтрофного озера, включая микробную сеть. Int Rev Gesamten Hydrobiol 78: 403–410
Google Scholar
- 29.
Nõges, P, Tuvikene, L, Nõges, T, Kisand, A (1999) Первичная продукция, осаждение и ресуспендирование в большом мелководном озере Выртсъярв. Aquat Sci 61: 168–182
Статья Google Scholar
- 30.
Nõges, T, Nõges, P, Haberman, J, Kisand, V, Kangur, K, Kangur, A, Järvalt, A (1998) Структура пищевой сети в мелководном эвтрофном озере Выртсъярв. Лимнологика 28: 115–128
Google Scholar
- 31.
Портер, К.Г., Фейг, Ю.С. (1980) Использование DAPI для идентификации и подсчета водной микрофлоры. Лимнол Океаногр 25: 943–948
Google Scholar
- 32.
Портер, KG, McDonough, R (1984) Энергетическая стоимость реакции Cladocerans на сине-зеленые водорослевые волокна.Limnol Oceanogr 29: 365–369
Статья Google Scholar
- 33.
Putt, M, Stoecker, DK (1989) Экспериментально определенное соотношение углерода к объему для морских «олиготриховых» инфузорий из устьевых и прибрежных вод. Limnol Oceanogr 34: 1097–1103
Google Scholar
- 34.
Rothhaupt, KO, Güde, H (1996) Влияние зоопланктона многоклеточных животных на микробное сообщество до и после наступления весенней фазы чистой воды в Боденском озере (Боденское озеро).Arch Hydrobiol Ergebn Limnol 48: 21–30
Google Scholar
- 35.
Sanders, RW, Porter, KG, Bennett, SJ, DeBiase, AE (1989) Сезонные паттерны бактериального развития жгутиконосцев, инфузорий, коловраток и кладоцер в пресноводном планктонном сообществе. Лимнол Океаногр 34: 673–687
Google Scholar
- 36.
Schelske, CL, Carrick, HJ, Aldridge, FJ (1995) Может ли ветровое ресуспендирование меропланктона повлиять на динамику фитопланктона? J North Am Benthol Soc 14: 616–630
Статья Google Scholar
- 37.
Sherr, EB, Sherr, BF (2002) Значение хищничества простейших в водных микробных пищевых сетях. Anton van Leeuwenhoek Int J G 81: 293–308
Статья CAS Google Scholar
- 38.
Шимек, К., Бабензиен, Д., Битл, Т., Кошель, Р., Мацек, М., Недома, Дж., Врба, Дж. (1998) Микробные пищевые сети в искусственно разделенном кислотном болотном озере. Int Rev Hydrobiol 83: 3–18
Google Scholar
- 39.
Шимек, К., Бобкова, Дж., Мацек, М., Недома, Дж., Псеннер, Р. (1995) Выпас инфузорий на пикопланктоне в эвтрофном резервуаре во время летнего максимума фитопланктона: исследование на уровне видов и сообществ. Limnol Oceanogr 40: 1077–1090
Статья Google Scholar
- 40.
Шимек, К., Мацек, Дж., Седа, Дж., Выхналек, В. (1990) Возможные взаимосвязи пищевой цепи между бактериопланктоном, простейшими и кладоцерами в водоеме.Int Rev Gesamten Hydrobiol 75: 583–596
Google Scholar
- 41.
Саймон М., Азам Ф. (1989) Содержание белка и скорость синтеза белка планктонными морскими бактериями. Mar Ecol Prog Ser 51: 201–213
CAS Google Scholar
- 42.
Sommaruga, R, Psenner, R (1993) Наноцилиаты отряда Prostomatida: их значение в микробной пищевой сети мезотрофного озера.Aquat Sci 55: 179–187
Статья Google Scholar
- 43.
Zingel, P (1999) Пелагические мерцательные простейшие в мелководном эвтрофном озере: структура сообщества и сезонная динамика. Arch Hydrobiol 146: 495–511
Google Scholar
- 44.
Zingel, P, Paaver, T (2005) Быстрые весенние изменения в структуре сообщества пелагических простейших с ресничками. Arch Hydrobiol 163: 525–537
Статья Google Scholar
- 45.
Tadonleke, RD, Planas, D, Lucotte, A (2005) Микробные пищевые сети в бореальных гумусовых озерах и водохранилищах: инфузории как главный фактор, связанный с динамикой наиболее активных бактерий. Microb Ecol 49: 325–341
PubMed Статья CAS Google Scholar
- 46.
Utermöhl, H (1958) Zur Vervollkommung der quaatitativen Phytoplanktonmethodik. Mitt Int Ver Theor Angew Limnol 9: 1–38
Google Scholar
- 47.
Weisse, T (1990) Трофические взаимодействия между гетеротрофным микропланктоном, нанопланктоном и бактериями в Боденском озере. Hydrobiol 191: 111–122
Статья Google Scholar
- 48.
Weisse, T, Frahm, A (2001) Видовые взаимодействия между мелкими планктонными инфузориями ( Urotricha spp.) И коловратками ( Keratella spp.). J Plankton Res 23: 1329–1338
Статья Google Scholar
- 49.
Worden, AZ, Nolan, JK, Palenik, B (2004) Оценка динамики и экологии морского пикофитопланктона: важность эукариотического компонента. Limnol Oceanogr 49: 168–179
CAS Статья Google Scholar
↵ † Кому следует обращаться с запросами на перепечатку.
CrossRef Полный текст | Google Scholar
Карриас, Дж. Ф., Амблард, К., и Бурдье, Г. (1998). Сезонная динамика и вертикальное распределение планктонных инфузорий и их связь с микробными пищевыми ресурсами в олигомезотрофном озере Павин. Arch. Hydrobiol. 143, 227–255. DOI: 10.1127 / архив-гидробиол / 143/1998/227
CrossRef Полный текст | Google Scholar
Де Варгас, К., Audic, S., Henry, N., Decelle, J., Mahé, F., Logares, R., et al. (2015). Разнообразие эукариотического планктона в залитом солнцем океане. Наука 348: 6237. DOI: 10.1126 / science.1261605
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Долан, Дж. Р., и Стоук, Т. (2011). Повторный отбор проб показывает различную изменчивость в показателях видового богатства и состава сообществ планктонных простейших. Environ. Microbiol. Rep. 3, 661–666. DOI: 10.1111 / j.1758-2229.2011.00250.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дафф, Р. Дж., Болл, Х., Лаврентьев, П. Дж. (2008). Применение комбинированных морфолого-молекулярных подходов к идентификации планктонных простейших в пробах окружающей среды. J. Eukaryot. Microbiol. 55, 306–312. DOI: 10.1111 / j.1550-7408.2008.00328.x
Дж., Болл, Х., Лаврентьев, П. Дж. (2008). Применение комбинированных морфолого-молекулярных подходов к идентификации планктонных простейших в пробах окружающей среды. J. Eukaryot. Microbiol. 55, 306–312. DOI: 10.1111 / j.1550-7408.2008.00328.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдгар, Р. К., Хаас, Б. Дж., Клементе, Дж.К., Айва К. и Найт Р. (2011). UCHIME улучшает чувствительность и скорость обнаружения химер. Биоинформатика 27, 2194–2200. DOI: 10.1093 / биоинформатика / btr381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эджкомб В., Орси В., Бунге Дж., Чон С., Кристен Р., Леслин С. и др. (2011). Микробная обсерватория Протистана в бассейне Кариако, Карибский бассейн. I. Пиросеквенирование и понимание Сэнгера видового богатства. ISME J. 5, 1344–1356.DOI: 10.1038 / ismej.2011.6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эгге, Э., Биттнер, Л., Андерсен, Т.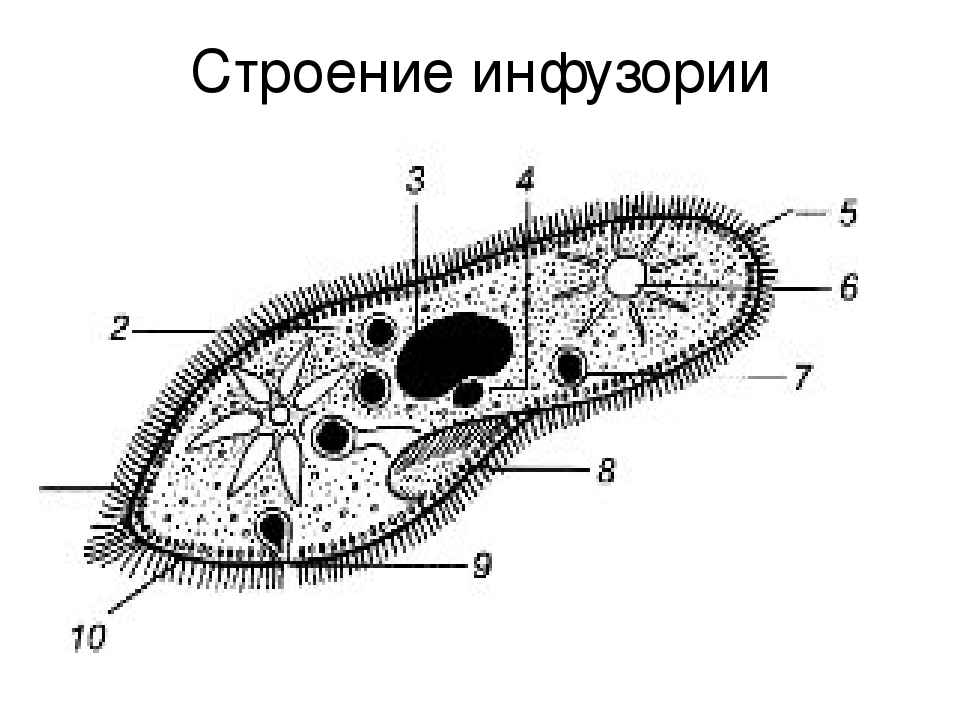 , Аудик, С., Де Варгас, К., и Эдвардсен, Б. (2013). 454 Пиросеквенирование для описания состава микробного эукариотического сообщества, разнообразия и относительной численности: тест на морские гаптофиты. PLoS One 8: e74371. DOI: 10.1371 / journal.pone.0074371
, Аудик, С., Де Варгас, К., и Эдвардсен, Б. (2013). 454 Пиросеквенирование для описания состава микробного эукариотического сообщества, разнообразия и относительной численности: тест на морские гаптофиты. PLoS One 8: e74371. DOI: 10.1371 / journal.pone.0074371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фойсснер, В.(2014). Обновление «основных методов световой и сканирующей электронной микроскопии для таксономических исследований реснитчатых простейших». Внутр. J. Sys. Evol. Microbiol. 64, 271–292. DOI: 10.1099 / ijs.0.057893-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фойсснер В. и Бергер Х. (1996). Удобный справочник по инфузориям (Protozoa, Ciliophora), обычно используемым гидробиологами в качестве биоиндикаторов в реках, озерах и сточных водах, с примечаниями по их экологии. Freshw. Биол. 35, 375–482. DOI: 10.1111 / j.1365-2427.1996.tb01775.x
CrossRef Полный текст | Google Scholar
Фойсснер В.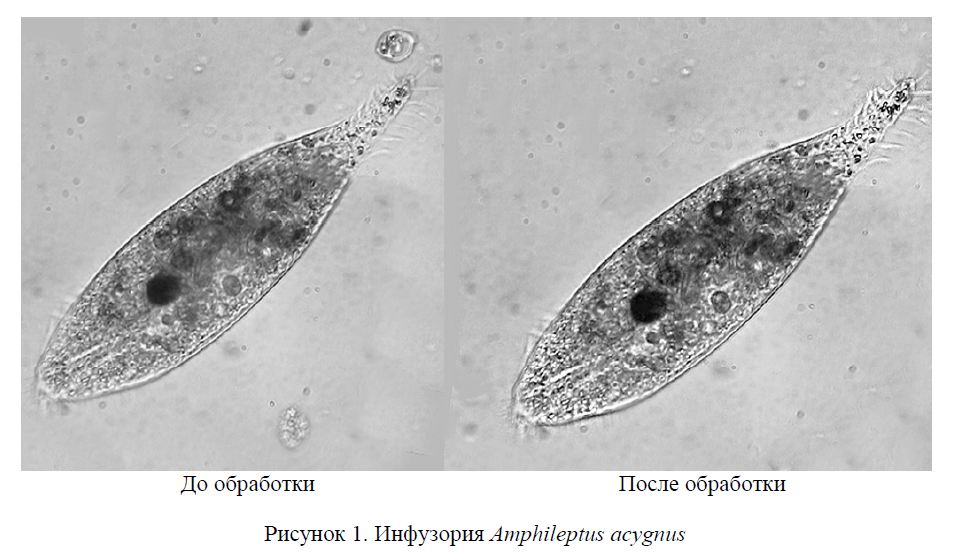 , Бергер Х., Блаттерер Х. и Кохманн Ф. (1995). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа IV: гимнастоматея, локсодезы, суктории. informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/95: 540.
, Бергер Х., Блаттерер Х. и Кохманн Ф. (1995). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа IV: гимнастоматея, локсодезы, суктории. informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/95: 540.
Google Scholar
Фойсснер В., Бергер Х. и Кохманн Ф. (1992).Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа II: перитрихии, гетеротрихиды, одонтостоматиды. informationsberichte des bayer. Landesamtes Wasserwirtschaft 5/92: 502.
Google Scholar
Фойсснер В., Бергер Х. и Кохманн Ф. (1994). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа III: гименостомы, простоматида, нассулида. informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/94: 548.
Фойсснер В., Бергер Х. и Шаумбург Дж. (1999). Идентификация и экология инфузорий лимнетического планктона. Informationsberichte des Bayer. Landesamtes Wasserwirtschaft Heft 3/99: 793.
Google Scholar
Фойсснер В., Блаттерер Х., Бергер Х. и Кохманн Ф. (1991). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа I: циртофориды, олиготрихиды, гипотрихии, кольподеи. Informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/91: 478.
Google Scholar
Фойсснер, В., и Пфистер, Г. (1997). Таксономическая и экологическая ревизия уротрих (Ciliophora, Prostomatida) с тремя или более каудальными ресничками, включая удобный ключ. Limnologica 27, 311–347.
Google Scholar
Форстер Д., Дантхорн М., Стоук Т. и Маэ Ф. (2016). Сравнение трех подходов к кластеризации для обнаружения нового микробного разнообразия окружающей среды. PeerJ 4: e1692. DOI: 10.7717 / peerj.1692
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Форстер, Д., Филкер, С., Кохемс, Р., Брейнер, Х.-В., Кордье, Т., Павловски, Дж. И др. (2018). Сравнение различных генов метабаркода инфузорий как биоиндикаторов для оценки воздействия на окружающую среду аквакультуры лосося. J. Eukaryot. Microbiol. doi: 10.1111 / jeu.12670 [Epub перед печатью].
J. Eukaryot. Microbiol. doi: 10.1111 / jeu.12670 [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу Р. и Гонг Дж.(2017). Анализ отдельных клеток, связывающий количество копий рибосомной (r) ДНК и рРНК с размером и скоростью роста клеток, дает представление об экологии молекулярного протистана. J. Eukaryot. Microbiol. 64, 885–896. DOI: 10.1111 / jeu.12425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gao, F., Warren, A., Zhang, Q., Gong, J., Miao, M., Sun, P., et al. (2016). Основанная на данных эволюционная гипотеза реснитчатых протистов с пересмотренной классификацией филума Ciliophora (Eukaryota.Альвеолаты). Sci. Реп. 6: 24874. DOI: 10.1038 / srep24874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Геллер В., Берберович Р., Гаедке У., Мюллер Х., Паули Х. Р., Тильцер М. М. и др. (1991). Отношения между компонентами автотрофного и гетеротрофного планктона в сезонном цикле 1987 г. в Боденском озере. Верх. Междунар. Verein Limnol. 24, 831–836. DOI: 10.1080 / 03680770.1989.11898860
в Боденском озере. Верх. Междунар. Verein Limnol. 24, 831–836. DOI: 10.1080 / 03680770.1989.11898860
CrossRef Полный текст | Google Scholar
Гинер, К.Р., Форн, И., Ромак, С., Логарес, Р., Де Варгас, К., и Массана, Р. (2016). Секвенирование окружающей среды дает разумные оценки относительной численности конкретных пикоэукариот. заявл. Environ. Microbiol. 82, 4757–4766. DOI: 10.1128 / aem.00560-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонг, Дж., Донг, Дж., Лю, X., и Массана, Р. (2013). Чрезвычайно высокое число копий и полиморфизм оперона рДНК, оцененный на основе анализа отдельных клеток инфузорий олиготрих и перитрих. Protist 164, 369–379. DOI: 10.1016 / j.protis.2012.11.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюз, С. М., Хубер, Дж. А., Моррисон, Х. Г., Согин, М. Л., и Уэлч, Д. М. (2007). Точность и качество массово-параллельного пиросеквенирования ДНК. Genome Biol. 8: R143. DOI: 10.1186 / GB-2007-8-7-r143
8: R143. DOI: 10.1186 / GB-2007-8-7-r143
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюз, С. М., Велч, Д. М., Моррисон, Х. Г., и Согин, М.Л. (2010). Разглаживание морщин в редкой биосфере за счет улучшенной кластеризации OTU. Environ. Microbiol. 12, 1889–1898. DOI: 10.1111 / j.1462-2920.2010.02193.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джером, К. А., Монтань, Д. Дж. С., и Тейлор, Ф. Дж. Р. (1993). Влияние количественного окрашивания протарголом и фиксаторов Люголя и Буэна на размер клеток: более точная оценка биомассы видов инфузорий. J. Eukaryot. Microbiol. 40, 254–259. DOI: 10.1111 / j.1550-7408.1993.tb04913.x
CrossRef Полный текст | Google Scholar
Кисанд В., Зингель П. (2000). Преобладание поедания инфузорий бактериями весной в мелководном эвтрофном озере. Aquat. Microb. Ecol. 22, 135–142. DOI: 10.3354 / ame022135
CrossRef Полный текст | Google Scholar
Lane, D.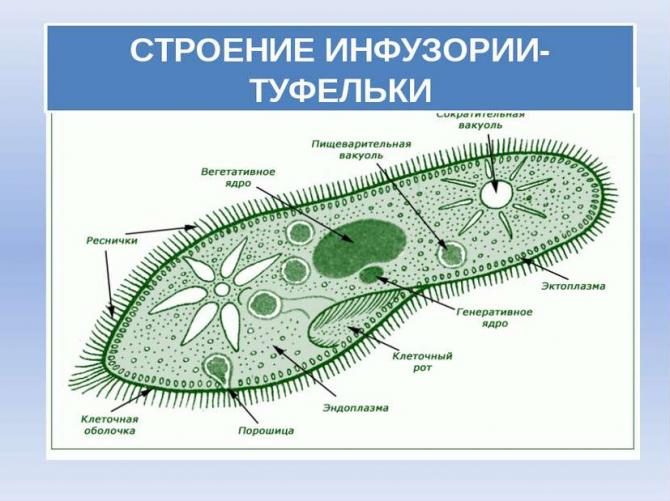 J. (1991). «Секвенирование 16S / 23S» в Nucleic Acid Technologies in Bacterial Systematic , ред. Э. Стакебрандт и М.Гудфеллоу (Нью-Йорк, Нью-Йорк: Wiley), 115–175.
J. (1991). «Секвенирование 16S / 23S» в Nucleic Acid Technologies in Bacterial Systematic , ред. Э. Стакебрандт и М.Гудфеллоу (Нью-Йорк, Нью-Йорк: Wiley), 115–175.
Google Scholar
Лю А., Йи З., Лин Х., Ху Х., Аль-Фаррадж С. А. и Аль-Рашейд К. А. С. (2015). Молекулярно-филогенетическое происхождение Plagiopogon и Askenasia (Protozoa, Ciliophora), выявленное по последовательностям их генов. J. Ocean Univ. Китай 14, 724–730. DOI: 10.1007 / s11802-015-2559-3
CrossRef Полный текст | Google Scholar
Луо, В., Бок, К., Ли, Х. Р., Падисак, Дж., и Krienitz, L. (2011). Молекулярное и микроскопическое разнообразие планктонных эукариот в олиготрофном озере Стехлин (Германия). Hydrobiologia 661, 133–143. DOI: 10.1007 / s10750-010-0510-6
CrossRef Полный текст | Google Scholar
Линн, Д. Х. (2008). Ресничные простейшие. Характеристика, классификация и руководство по литературе , 3-е изд. Берлин: Springer.
Google Scholar
Мацек, М., Шимек, К., Пернталер, Дж., Выхналек, В.и Р. Псеннер (1996). Темпы роста доминирующих планктонных инфузорий в двух пресноводных водоемах разной трофической степени. J. Plankt. Res. 18, 463–481. DOI: 10.1093 / планкт / 18.4.463
CrossRef Полный текст | Google Scholar
Марин Б., Палм А., Клингберг М. А. X. и Мелконян М. (2003). Филогения и таксономическая ревизия пластидсодержащих эвгленофитов на основе сравнения последовательностей рДНК SSU и синапоморфных сигнатур во вторичной структуре рРНК SSU. Протист 154, 99–145. DOI: 10.1078 / 143446103764928521
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин, М. (2011). Cutadapt удаляет последовательности адаптеров из операций чтения с высокой пропускной способностью. EMBnet.Journal 17, 10–12. DOI: 10.14806 / ej.17.1.200
CrossRef Полный текст | Google Scholar
Матес, Дж., И Арндт, Х. (1995). Годовой цикл протозоопланктона (инфузорий, жгутиконосцев и саркодинов) по отношению к фито- и метазоопланктону в озере Ноймюлер-Зее (Мекленбург, Германия). Arch. Hydrobiol. 134, 337–358.
Arch. Hydrobiol. 134, 337–358.
Google Scholar
Medinger, R., Nolte, V., Pandey, R.V, Jost, S., Ottenwälder, B., Schlötterer, C., et al. (2010). Разнообразие в скрытом мире: потенциал и ограничения секвенирования следующего поколения для исследований молекулярного разнообразия эукариотических микроорганизмов. Мол. Ecol. 19, 32–40. DOI: 10.1111 / j.1365-294X.2009.04478.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Медлин, Л., Элвуд, Х. Дж., Стикель, С., и Согин, М. Л. (1988). Характеристика ферментативно амплифицированных областей, кодирующих 16S-подобную рРНК эукариот. Gene 71, 491–499. DOI: 10.1016 / 0378-1119 (88) -2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Михайлов И.С., Захарова Ю.Р., Букин Ю.С., Галачянц Ю.П., Петрова Д.П., Сакирко М.В. и др. (2018). Сети совместного возникновения среди бактерий и микробных эукариот озера Байкал во время весеннего цветения фитопланктона.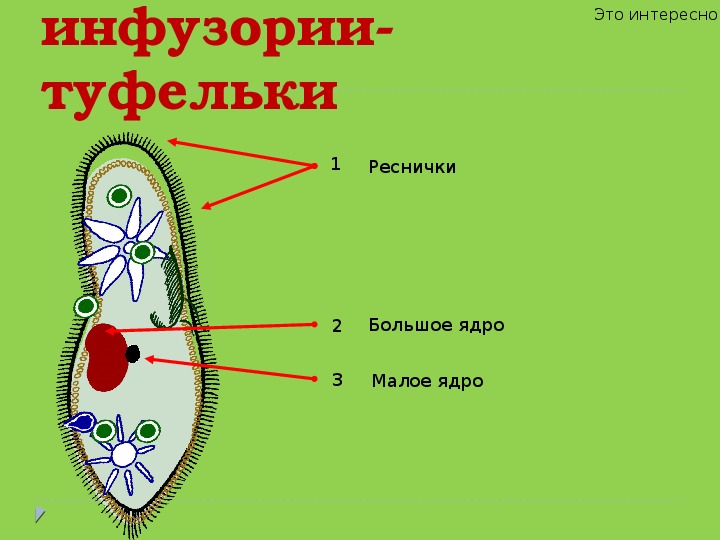 Microb. Ecol. 77, 96–109. DOI: 10.1007 / s00248-018-1212-2
Microb. Ecol. 77, 96–109. DOI: 10.1007 / s00248-018-1212-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монтань, Д. Дж. С. и Линн, Д. Х. (1987). Количественное окрашивание протарголом (QPS) для инфузорий: описание метода и проверка его количественной природы. мар. Microb. Food Webs 2, 83–93.
Google Scholar
Мюллер, Х. и Геллер, В. (1993). Максимальные темпы роста водных реснитчатых простейших: пересмотр зависимости от размеров тела и температуры. Arch. Hydrobiol. 126, 315–327.
Google Scholar
Мюллер, Х., Шене, А., Пинто-Коэльо, Р. М., Швайцер, А., и Вайсс, Т. (1991). Сезонная гибель инфузорий в Боденском озере. Microb. Ecol. 21, 119–138. DOI: 10.1007 / BF02539148
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накаяма Т., Марин Б., Кранц Х. Д., Сурек Б., Хус В. А. Р., Иноуэ И. и др. (1998). Базальное положение чешуйчатых зеленых жгутиконосцев среди зеленых водорослей (Chlorophyta) выявляется путем анализа кодируемых ядром последовательностей рРНК SSU. Протист 149, 367–380. DOI: 10.1016 / S1434-4610 (98) 70043-4
Протист 149, 367–380. DOI: 10.1016 / S1434-4610 (98) 70043-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nolte, V., Pandey, R.V, Jost, S., Medinger, R., Ottenwälder, B., Boenigk, J., et al. (2010). Контрастное сезонное разделение ниш между редкими и многочисленными таксонами скрывает степень разнообразия протистов. Мол. Ecol. 19, 2908–2915. DOI: 10.1111 / j.1365-294X.2010.04669.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петру, К., и Нильсен, Д. А. (2018). Поглощение диметилсульфониопропионата (DMSP) диатомовыми водорослями Thalassiosira weissflogii : модель для исследования клеточной функции DMSP. Биогеохимия 141, 265–271. DOI: 10.1007 / s10533-018-0507-1
CrossRef Полный текст | Google Scholar
Пфистер, Г., Зоннтаг, Б., и Пош, Т. (1999). Сравнение прямого подсчета живых организмов и улучшенного количественного окрашивания протарголом (QPS) при определении численности и клеточных объемов пелагических пресноводных простейших. Aquat. Microb. Ecol. 18, 95–103. DOI: 10.3354 / ame018095
Aquat. Microb. Ecol. 18, 95–103. DOI: 10.3354 / ame018095
CrossRef Полный текст | Google Scholar
Пош, Т., Эугстер, Б., Помати, Ф., Пернталер, Дж., Питч, Г., и Эккерт, Э. М. (2015). Сеть взаимодействий между инфузориями и фитопланктоном весной. Фронт. Microbiol. 6: 1289. DOI: 10.3389 / fmicb.2015.01289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Posch, T., Köster, O., Salcher, M.M, and Pernthaler, J.(2012). Вредные нитчатые цианобактерии, которым способствует снижение круговорота воды при потеплении озера. Нац. Клим. Изменить 2, 809–813. DOI: 10.1038 / nclimate1581
CrossRef Полный текст | Google Scholar
Сантоферрара, Л. Ф., Граттепанче, Ж.-Д., Кац, Л. А., и Макманус, Г. Б. (2014). Пиросеквенирование для оценки разнообразия эукариотических микробов: анализ данных о морских планктонных инфузориях и сравнение с традиционными методами. Environ. Microbiol. 16, 2752–2763.DOI: 10. 1111 / 1462-2920.12380
1111 / 1462-2920.12380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантоферрара, Л. Ф., Граттепанче, Ж.-Д., Кац, Л. А., и Макманус, Г. Б. (2016). Паттерны и процессы в микробной биогеографии: дают ли молекулы и морфологии одинаковые ответы? ISME J. 10, 1779–1790. DOI: 10.1038 / ismej.2015.224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шакья, М., Айва, К., Кэмпбелл, Дж. Х., Янг, З. К., Шадт, К.W., and Podar, M. (2013). Сравнительная характеристика метагеномного и микробного разнообразия рРНК с использованием синтетических сообществ архей и бактерий. Environ. Microbiol. 15, 1882–1899. DOI: 10.1111 / 1462-2920.12086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шимек, К., Бобкова, Дж., Мацек, М., Недома, Дж., И Псеннер, Р. (1995). Выпас инфузорий на пикопланктоне в эвтрофном водоеме во время летнего максимума фитопланктона: исследование на уровне видов и сообществ. Лимнол. Oceanogr. 40, 1077–1090. DOI: 10.4319 / lo.1995.40.6.1077
CrossRef Полный текст | Google Scholar
Шимек, К., Недома, Дж., Значор, П., Касалицки, В., Езбера, Дж., Хорнак, К., и др. (2014). Точно настроенная симфония факторов модулирует микробную пищевую сеть пресноводного водоема весной. Лимнол. Oceanogr. 59, 1477–1492. DOI: 10.4319 / lo.2014.59.5.1477
CrossRef Полный текст | Google Scholar
Симон, М., Лопес-Гарсия, П., Дешам П., Морейра Д., Ресту Г., Бертолино П. и др. (2015). Выраженная сезонность и высокая пространственная изменчивость сообществ протистов в мелководных пресноводных системах. ISME J. 9, 1941–1953. DOI: 10.1038 / ismej.2015.6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скиббе, О. (1994). Улучшенное количественное окрашивание протарголом инфузорий и других планктонных протистов. Arch. Hydrobiol. 130, 339–347.
Google Scholar
Соммаруга, р.и Р. Псеннер (1993). Наноцилии отряда prostomatida: их значение в микробной пищевой сети мезотрофного озера. Aquat. Sci. 55, 179–187. DOI: 10.1007 / BF00877447
CrossRef Полный текст | Google Scholar
Зоммер, У., Адриан, Р., Де Сенерпонт, Домис, Л., Эльзер, Дж. Дж., Гаедке, У., Ибелингс, Б., и др. (2012). Помимо модели группы экологии планктона (ПЭГ): механизмы, управляющие сукцессией планктона. Annu. Rev. Ecol. Evol. Syst. 43, 429–448.DOI: 10.1146 / annurev-ecolsys-110411-160251
CrossRef Полный текст | Google Scholar
Зоммер, У., Гливич, З. М., Ламперт, В., и Дункан, А. (1986). PEG-модель сезонной сукцессии планктонных явлений в пресных водах. Arch. Hydrobiol. 106, 433–471.
Google Scholar
Зоннтаг, Б., Пош, Т., Кламмер, С., Тойбнер, К., и Псеннер, Р. (2006). Фаготрофные инфузории и жгутиковые в олиготрофном глубоком альпийском озере: контрастная изменчивость в зависимости от сезона и глубины. Aquat. Microb. Ecol. 43, 193–207. DOI: 10.3354 / ame043193
CrossRef Полный текст | Google Scholar
Sonntag, B., Strüder-Kypke, M.C., and Summerer, M. (2008). Uroleptus willii нояб. sp., эупланктонная пресноводная инфузория (Dorsomarginalia, Spirotrichea, Ciliophora) с водорослевыми симбионтами: морфологическое описание, включая филогенетические данные последовательности гена малой субъединицы рРНК и экологические примечания. Денис 23, 279–288.
Google Scholar
Стоук, Т., Басс, Д., Небель, М., Кристен, Р., Джонс, М. Д. М., Брейнер, Х.-В. и др. (2010). Секвенирование ДНК окружающей среды с множественными маркерами и параллельными метками показывает очень сложное сообщество эукариот в морской бескислородной воде. Мол. Ecol. 19, 21–31. DOI: 10.1111 / j.1365-294X.2009.04480.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоук Т., Брейнер Х.-В., Филкер С., Остермайер В., Каммерландер Б. и Зоннтаг Б. (2014). Морфогенетическое исследование планктона инфузорий из горного озера указывает на необходимость маркеров штрих-кода, специфичных для клонов, в микробной экологии. Environ. Microbiol. 16, 430–444. DOI: 10.1111 / 1462-2920.12194
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоук Т., Хейворд Б., Тейлор Г. Т., Варела Р. и Эпштейн С. С. (2006). Подход с использованием нескольких ПЦР-праймеров для доступа к разнообразию микроэукариот в образцах окружающей среды. Protist 157, 31–43. DOI: 10.1016 / j.protis.2005.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоук Т., Кочемс Р., Форстер, Д., Лейзерович, Ф., и Павловски, Дж. (2018). Метабаркодирование сообществ бентосных инфузорий показывает высокий потенциал экологического мониторинга в аквакультуре лосося. Ecol. Индийский. 85, 153–164. DOI: 10.1016 / j.ecolind.2017.10.041
CrossRef Полный текст | Google Scholar
Стрейл, Д. (1998). Распределение биомассы и поток углерода в пелагической пищевой сети Боденского озера. Arch. Hydrobiol. Спец. Проблемы Advanc. Лимнол. 53,545–563.
Google Scholar
Танабэ, А.С., Нагаи, С., Хида, К., Ясуике, М., Фудзивара, А., Накамура, Ю. и др. (2016). Сравнительное исследование пригодности трех регионов гена 18S-рРНК для мониторинга планктонного сообщества эукариот на основе массового параллельного секвенирования. Мол. Ecol. Ресурс. 16, 402–414. DOI: 10.1111 / 1755-0998.12459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тирок, К., Гаедке, У. (2007). Регулирование динамики и функционального состава планктонных инфузорий весной в Боденском озере. Aquat. Microb. Ecol. 49, 87–100. DOI: 10.3354 / ame01127
CrossRef Полный текст | Google Scholar
Трагин, М., Зингон, А., Вауло, Д. (2018). Сравнение состава прибрежного фитопланктона, оцененного по участкам V4 и V9 гена 18S рРНК, с акцентом на фотосинтетические группы и особенно Chlorophyta. Environ. Microbiol. 20, 506–520. DOI: 10.1111 / 1462-2920.13952
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wear, E.К., Уилбэнкс, Э. Г., Нельсон, К. Э., и Карлсон, К. А. (2018). Выбор праймера влияет на численность конкретных популяций, но не на динамику сообществ в ежемесячном анализе ампликона гена 16S рРНК во временном ряду прибрежного морского бактериопланктона. Environ. Microbiol. 20, 2709–2726. DOI: 10.1111 / 1462-2920.14091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вебер А.Т., Павловски Дж. (2013). Можно ли определить численность простейших на основании данных о последовательностях: на примере фораминифер. PLoS One 8: e56739. DOI: 10.1371 / journal.pone.0056739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weisse, T., Müller, H., Pinto-Coelho, R.M., Schweizer, A., Springmann, D., and Baldringer, G. (1990). Ответ микробной петли на весеннее цветение фитопланктона в большом предальпийском озере. Лимнол. Oceanogr. 35, 781–794. DOI: 10.4319 / lo.1990.35.4.0781
CrossRef Полный текст | Google Scholar
Янкова Ю., Нойеншвандер С., Кёстер, О., Пош, Т. (2017). Резкая остановка глубоководного круговорота с потеплением озера: тяжелые последствия для первичных продуцентов водорослей. Sci. Реп. 7: 13770. DOI: 10.1038 / s41598-017-13159-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу, Ф., Массана, Р., Нот, Ф., Мари, Д., и Вауло, Д. (2005). Картирование пикоэукариот в морских экосистемах с помощью количественной ПЦР гена 18S рРНК. FEMS Microbiol. Ecol. 52, 79–92. DOI: 10.1016 / j.фемсек.2004.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зингель П., Агасилд Х., Ныгес Т. и Кисанд В. (2007). Инфузории являются основными травоядными на пико- и нанопланктоне в мелком, естественно высоко эвтрофном озере. Microb. Ecol. 53, 134–142. DOI: 10.1007 / s00248-006-9155-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zingel, P., and Nõges, T. (2010). Сезонная и годовая динамика численности инфузорий мелководного эвтрофного озера. Фонд. Прил. Лимнол. 176, 133–143. DOI: 10.1127 / 1863-9135 / 2010 / 0176-0133
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Основными эпиплазматическими белками инфузорий являются артикулины: клонирование, рекомбинантная экспрессия и структурная характеристика. | Журнал клеточной биологии
Цитоскелет некоторых протистов включает обширный мембранный скелет, эпоплазму, которая вносит вклад в форму клеток и формирование паттерна видоспецифической корковой архитектуры.Изолированная эпоплазма мерцательного протиста Pseudomicrothorax dubius состоит из двух основных групп белков с молекулярными массами 78-80 кДа и 11-13 кДа соответственно. Чтобы охарактеризовать структуру этих белков, были определены пептидные последовательности двух основных полипептидов (78-80 кДа), а также кДНК, представляющая всю кодирующую последовательность минорного и до сих пор не идентифицированного компонента (60 кДа; p60) эпоплазмы. Все три полипептида имеют сходство последовательностей. Они содержат повторяющиеся мотивы, богатые валином и пролином из 12 остатков с консенсусом VPVP — V-V-V-.В p60 центральный коровой домен состоит из 24 тандемно повторяющихся мотивов VPV. Внутри повторяющихся мотивов положительно и отрицательно заряженные остатки, если они присутствуют, показывают чередующийся узор в соответствии с положениями V и P. Рекомбинантный p60 очищали в 8 М мочевине и диализовали против буфера. Инфракрасные спектроскопические измерения показывают 30% -ный бета-лист. Электронная микроскопия выявляет короткие нитевидные полимеры с довольно однородным диаметром (примерно 15-20 нм), но различной длины. Маленькие полимеры образуют более толстые волокна, ленты и более крупные листы или трубки.Центральный домен, подобный таковому у P. dubius p60, также обнаружен в недавно описанных эпиплазматических белках жгутиков Euglena, так называемых артикулинах. Наши результаты показывают, что члены этого семейства белков не ограничиваются флагеллятами, но также присутствуют в отдаленно родственных инфузориях, где они являются основными составляющими эпоплазмы. Сравнение артикулинов жгутиков и инфузорий подчеркивает общие черты этого нового семейства белков цитоскелета.
Сказка о хвосте инфузории
Ученые недавно обнаружили, что некоторые простейшие могут двигаться быстрее, чем мгновение ока.Используя сверхвысокоскоростные видеокамеры, и специализированные исследователи-оптики из Института морских наук Техасского университета и Океанографического института Вудс-Хоул обнаружили, что инфузории с хвостами могут использовать эти придатки для передвижения с невероятной скоростью, почти в 1500 раз больше их собственного размера каждую секунду, что в 11-33 раза быстрее своих нехвостых собратьев. Чтобы представить эту высокую скорость в перспективе, гепард движется с максимальной скоростью, которая в 20-30 раз превышает его собственную длину каждую секунду. Интересно, что они не используют хвост, как можно было бы ожидать, например, взмахивая им взад и вперед, чтобы создать силу для плавания.Эти организмы быстро сжимают хвост внутрь и тянутся вперед. Они также могут реагировать на угрозу с одним из самых коротких времен отклика на побег за каждые измеренные 0,89 миллисекунды. Впечатляющий подвиг, учитывая, что крыло медоносной пчелы взмахивает крыльями за 5 миллисекунд и за целых 300 миллисекунд, чтобы моргнуть вашим глазом.
Исследователи также обнаружили, что потоки, создаваемые быстрым сокращением хвоста, создают два очень короткоживущих вихревых кольца, которые являются зеркальными противоположностями друг друга.Это дает то преимущество, что обеспечивает «гидродинамический камуфляж», поскольку хищники (которые не используют глаза для охоты) не могут определить направление, в котором убегают инфузории.
Так почему же этим одноклеточным животным нужно перемещаться с такой высокой скоростью? Инфузории являются основой пищевой цепи, а это означает, что они являются пищей почти для всего, кроме бактерий. У инфузорий с хвостом есть уникальное преимущество, потому что это дает им гораздо больше шансов спастись от хищников.
Статья ученых (Брэд Геммелл, Хоушо Цзян и Эд Буски), в которых обсуждаются их исследования и результаты, опубликована в журнале Proceedings of the Royal Society, выпущенном сегодня, 15 июля.
инфузорий являются доминирующими травоядными на пико- и нанопланктоне в мелком, естественно, высокоэвтрофном озере по JSTOR
АбстрактныйЧисленность и биомасса членов микробной петли [бактерии, гетеротрофные нанофлагелляты (HNF) и инфузории] были сезонно измерены в естественных эвтрофных и мелководных (2.8 средняя глубина) Озеро Выртсъярв с большой открытой поверхностью (в среднем 270 км²) и очень мутной водой (глубина Секки <1 м). Скорости выпаса (скорости подачи фильтра) на частицах диаметром 0,5, 3 и 6 мкм были измерены для оценки выпаса пико- и нанопланктона (питание фильтра) микро- и метазоопланктоном. Среди травоядных HNF характеризовались низкой численностью (<50 клеток на мл⁻¹) и из-за своей низкой специфической скорости фильтрации они поедали лишь незначительную часть бактериопланктона (≤4,2% от общего выпаса).Инфузории были относительно многочисленными (≤158 клеток / мл) и, учитывая их высокие удельные нормы питания, были способны выпасать более 100% продукции бактериальной биомассы в открытой части озера, тогда как средний ежедневный выпас составлял 9,3 % бактериального стада. Инфузории были потенциально важными поедателями нанопланктонных организмов (в среднем ежедневно выпасалось около 20% постоянного запаса частиц размером 3 мкм). Метазоопланктон поедал незначительную часть бактериопланктона, составляя только 0.1% постоянного запаса бактерий. Поедание метазоопланктоном нанопланктона (3-6 мкм) было выше (0,4% от запаса на корню). Предлагается гипотеза, что инфузории доминируют из-за отсутствия регуляции сверху вниз со стороны хищников, а HNF имеют низкую численность из-за сильного давления со стороны инфузорий.
Информация о журналеМикробная экология лежит в основе функционирования почти каждой экосистемы на планете, от глубоководных жерл и подземных систем до благополучия людей и животных; от первозданной морской и наземной среды до функционирования промышленных биореакторов.Microbial Ecology представляет собой специализированный международный форум для презентации высококачественных научных исследований того, как микроорганизмы взаимодействуют со своей биотической и абиотической средой, друг с другом, а также со своими соседями и хозяевами для выполнения своих разнообразных функций. Microbial Ecology предлагает статьи с оригинальными исследованиями в бумажном формате и в формате заметок, а также краткие обзоры и актуальные программные документы. Охват включает экологию микроорганизмов в естественной и искусственно созданной среде; геномные и молекулярные достижения в понимании микробных взаимодействий и филогении; микробные драйверы биогеохимических процессов; меж- и внутривидовая микробная коммуникация; экологические исследования микробиологии и болезней животных, растений и насекомых; микробные процессы и взаимодействия в экстремальных или необычных условиях; микробное население и экология сообществ и многое другое.
Информация об издателеSpringer — одна из ведущих международных научных издательских компаний, издающая более 1200 журналов и более 3000 новых книг ежегодно по широкому кругу вопросов, включая биомедицину и науки о жизни, клиническую медицину, физика, инженерия, математика, компьютерные науки и экономика.
инфузорий являются доминирующими травоядными на пико- и нанопланктоне в мелководном, естественно высокоэвтрофном озере
Эволюция IES и скремблирование в гене актина I у гипотрихозных инфузорий
Реферат
зародышевых (микроядерных) генов гипотрихозных инфузорий: прерывается многочисленными короткими некодируемыми сегментами, богатыми AT, называемыми внутренние исключенные сегменты, или IES.IES делят ген на сегменты макроядерного назначения или МДС. IES вычеркиваются из микроядерные гены, и МДС сращиваются, когда микроядерный геном перерабатывается в макроядерный геном после спаривания клеток. в микроядерный вариант внутримолекулярной рекомбинации гена актина I между IES в процессе эволюции привел к беспорядку MDS в некоторые, но не все гипотричи. Исследования с использованием последовательностей рДНК для определения филогенетические отношения между восемью гипотрихами предполагают, что эволюция микроядерного гена актина I происходит за счет последовательных добавление IES в ранее расходящиеся виды без скремблирования MDS.Дальнейшее добавление IES и рекомбинация между IES в дальнейшем расходящиеся виды продуцировали гены актина I с зашифрованными МДС. После скремблирования MDS в недавно развившиеся виды. Таким образом, вставки IES и скремблирование генов происходят постепенно в процессе эволюции видов, чтобы произвести микроядерные гены актина I возрастающей структурной сложности.
Гены в микроядрах ДНК гипотрихозных инфузорий (зародышевой линии) прерваны множественными, короткие некодирующие сегменты с большим количеством AT, называемые внутренними исключенными сегментами, или IES.IES делят ген на макроядерные сегменты, или МДС. В некоторых генах внутримолекулярная рекомбинация между ИЭС во время эволюция неупорядочила МДС, т. е. МДС стали беспорядочными. В течение развитие микроядра в новое макроядро за клеткой спаривания, IESs сплайсируются из генов, а MDS реорганизуются и лигированы в ортодоксальном порядке для получения транскрибируемого гена (1). После лигирования МДС гены вырезаются из хромосомной ДНК как отдельные короткие молекулы ДНК и вся остальная ДНК (спейсер ДНК), что составляет ≈95% сложности нуклеотидной последовательности. в микроядерном геноме разрушается.Обычно один ген присутствует на молекулу, но небольшой процент молекул может содержать два гена (2) или даже три гена (D.M.P., J. D. Prescott и R.M. Прескотт, неопубликованное наблюдение).
Значение IES в микроядерных генах не изучено, хотя было высказано предположение, что они способствуют развитию новых гены; рекомбинация между IES, которая приводит к перетасовке MDS, возможно, могут создать новые, межгенные комбинации МДС. Таким образом наличие зашифрованных МДС у современных гипотрихов проявление внутригенной перетасовки МДС, пойманной во времени эволюции.Кроме того, положение IES в гене может изменяться (сдвигаться), что изменяет состав последовательности и размер МДС в этом гене (3), дальнейшее повышение универсальности тасования MDS. По крайней мере, Сдвиг IES и скремблирование MDS путем рекомбинации IES, как подтверждено в данные, представленные здесь, свидетельствуют об исключительно динамичном характере геном зародышевой линии у гипотрихов в течение эволюционного времени.
В этой статье обсуждается происхождение и эволюция IES и внутригенных МДС-перетасовка, или генная схватка.Мы определили структуру МДС гена актина I в микроядерном геноме пяти гипотрих. Мы сравнили их между собой и со структурой MDS Ген актина I ранее был опубликован для трех других гипотрих. Эти сравнения подразумевают путь к возникновению и эволюции ИЭС и для скремблирования MDS — путь, который также близко совпадает с эволюционный путь для этих организмов, как определено нуклеотидом последовательности рДНК.
Материалы и методы
Организмы.
Oxytricha sp. (Мисти) была недавно изолирована из пруда в Сарасота, Флорида. Stylonychia lemnae выделен из Озеро Теллер в Боулдере, штат Колорадо. Stylonychia pustulata был изолирован от реки Ревущей Вилки, Аспен, Колорадо. Все трое были выращен на Chlorogonium , как описано (4). Энгельманниелла mobilis был подарком В. Фойсснера (Universität Salzburg, Зальцбург, Австрия). Его культивировали на смеси неизвестных бактерии в зерновых культурах риса. Urostyla grandis г. изолирован от пруда в кампусе Университета Колорадо, Боулдер. Выращен на Tetrahymena thermophila .
Препарат ДНК.
Макронуклеусы и микроядра выделяли из 10–20 мл упакованной клетки, как описано (4). ДНК очищали фенолом / хлороформом. экстракции. Микроядерная ДНК фильтровалась через Sephacryl 1000s. колонка (Amersham Pharmacia), которая удалила большую часть загрязняющих веществ. макронуклеарная ДНК.После фильтрации сефакрила 1000 сек микроядерная ДНК из U. grandis лечили 2 ед. Bal31 экзонуклеазой (New England Biolabs) в 50 мкл буфера в течение одного часа при 30 ° C для удаления остаточной макронуклеарной ДНК (5). Сефакрил Обработанная 1000s микроядерная ДНК E. mobilis была освобождена от следы контаминации макронуклеарной ДНК при гель-электрофорезе, снятие Преимущество гораздо более быстрой миграции макроядерной ДНК. Для ПЦР микроядерного гена актина I Oxytricha sp.(Мисти), Было использовано S. lemnae и S. pustulata . инверсии MDS 2 и расположения ниже по потоку MDS 1 к разработать пары праймеров, которые дали продукт ПЦР только с микроядерными ДНК (см. Рис. 1 и 3 для МДС локации).
Рисунок 1Структура микроядерных и макроядерных генов актина I в U. grandis ( A ), E. mobilis ( B ), Oxytricha sp. (Мисти) ( C ), S.pustulata ( D ), и S. lemnae ( E ). Микроядерная ДНК ПЦР продукты обозначены линиями над каждым микроядерным геном. МДС являются блоки и IES — это линии между блоками. Неупорядоченные регионы обозначены пунктирными блоками и пунктирными линиями.
Макроядерные последовательности актина I.
Последовательность актина I для U. grandis была получена из База данных GenBank (инвентарный номер AF188160).Описание актина I последовательность для E. mobilis , S. lemnae , S. pustulata и Oxytricha sp. (Мисти) и завершение последовательность макронуклеарного актина I для Sterkiella sp. (Осина) [ранее Oxytricha sp. (Aspen) (6)] будет опубликовано в другом месте и депонированы под номерами AY044837, AY046534, AY044838, AY044839 и U63566 соответственно.
Микроядерные последовательности актина I.
Они были определены из продуктов ПЦР, созданных с помощью разработанных праймеров. из макроядерных последовательностей. Продукты ПЦР клонировали в pGEM-T Easy. Вектор (Promega) и секвенированный отделением секвенирования, с использованием праймеров для секвенирования M13F и M13R и видоспецифичных внутренних грунтовки.
Результаты
Филогенетические деревья.
Анализ экономичности как рДНК, так и аминокислотной последовательности Ген актина I был применен с использованием критериев исчерпывающего поиска в программа PAUP 4.0 бета 8 (7). Поддержка узлов на деревья экономии были созданы с помощью бутстраповской передискретизации (% от 1000 повторностей). Метод квартетной головоломки применялся только к Набор данных рДНК. В этом методе используется дерево максимального правдоподобия. реконструкция всех возможных квартетов, которые могут быть сформированы из всех последовательности, которые служат отправными точками для восстановления набора оптимальных деревья n-таксонов (8). Было показано, что этот метод одинаково или лучше способный восстановить истинное дерево, чем методы объединения соседей (8).Значения (рис. 2) представляют собой процент раз, когда конкретный кластер был обнаружен среди 1000 промежуточные деревья [квартет головоломных шагов (QPS) значений].
Рисунок 2Деревья максимальной экономии на основе последовательности рДНК ( A ; оцрДНК – ITSI – 5.8S рДНК – ITS2–1400 п.н. большого субъединица lsrDNA; первое число — это значение начальной загрузки, а второе для квартета) и последовательность аминокислот в актине I ген ( B ).
U.grandis .Восемь перекрывающихся продуктов ПЦР микроядерного гена актина I. полученные с праймерами, созданными из последовательности макронуклеарного актина I. с помощью единственного препарата микроядерной ДНК, обработанной Bal31 (рис. 1 А ). Структура микроядерной версии ген актина I был собран из этих последовательностей, как показано на рис. 1 А . Присутствуют два ИЭС. IES 1 (102 п.н .; 91% AT) расположен в 5 ‘лидере. IES 2 (28 п.н .; 96% AT) расположен в 3 ‘ трейлер.Два ИЭС делят микроядерный предшественник на три МДС. MDS 1 содержит 5 ‘лидер. Последовательность первых 62 п.н. MDS 1 не был получен для микроядерного гена, потому что продукт ПЦР не может быть сгенерирован из этой богатой AT области (80% AT). Конец 3 ‘ MDS 1, где он присоединяется к IES 1, содержит последовательность TTACTTAT. 5 ‘ конец MDS 2 начинается с TTACTTAT. AT на 3 ‘конце этого повтора в MDS 2 за ним следует G в MDS 2, образуя стартовый кодон ATG.
MDS 2 содержит всю кодирующую область актина I (за исключением AT ATG start) и заканчивается в 3 ‘трейлере на 19 п.н. ниже стопа TGA кодон.MDS 3 содержит остальную часть 3-дюймового трейлера. Последовательность последние 66 п.н. 3’-трейлера в микроядерном предшественнике не могли быть определяется с помощью ПЦР из-за его содержания AT (77% AT). Маловероятно что первые 62 п.н. в MDS 1 и / или последние 66 п.н. в MDS 3 являются прервано дополнительными IES. Среди 13 микроядерных генов полностью упорядочены в Sterkiella / Stylonychia группа IES не было найдены в нескольких сотнях пар оснований на концах микроядерные предшественники.ORF состоит из 1131 п.н., включая TGA, кодирующий предполагаемый белок из 376 аминокислот. Нуклеотидная последовательность микроядерная ORF отличается от макроядерной ORF двумя должности; ни то, ни другое не приводит к разнице в аминокислотной последовательности.
E. mobilis .Два перекрывающихся продукта ПЦР микроядерного гена актина I были генерируется с праймерами, созданными из макронуклеарной последовательности с использованием очищенная гелем микроядерная ДНК.Собранная микроядерная последовательность (Рис. 1 B ) не содержит 40 п.н. MDS 1 на 5′-конце и 97 п.н. МДС 4 на 3 ‘конце. Присутствуют три IES: IES 1 (85 п.н .; 81% AT) в 5’-лидере и IES 2 (37 п.н .; 86% AT) и IES 3 (12 п.н .; 100% AT) находятся в ORF. Три IES фланкированы повторяющимися последовательностями ATA, GAAAAGA и AATGC соответственно. Четыре MDS находятся в православный порядок. ORF (1131 п.н.) простирается от MDS 2 до MDS 4 и кодирует предполагаемый белок из 376 аминокислот. Микроядерная ORF отличается от макронуклеарная ORF в одном нуклеотиде, которая не изменяет амино кислота.
Oxytricha sp. (Мисти).Мы считали, что микроядерный ген актина I в этом организме может имеют зашифрованный рисунок, например Sterkiella nova (ранее Oxytricha nova ), Sterkiella histriomuscorum (ранее Oxytricha trifallax ) и Sterkiella sp. (Осина). MDS 2 в микроядерном гене актина I у этих трех организмов перевернут (см. рис. 3). Праймеры были сконструированы из макроядерной последовательности Oxytricha sp.(Мисти) для предполагаемых МДС 3 и 2. Эти дали продукт ПЦР, содержащий ≈90% микроядерного актина I ген (рис.1 C ). Он содержит девять IES, которые разделяют PCR последовательность на восемь полных MDS и два частичных MDS, MDS 3 и 2. Двести пятнадцать п.н. на 5′-конце MDS 3 отсутствуют в Продукт ПЦР. Двести двадцать пять п.н., соответствующих 5 ′ часть MDS 2 (перевернутая) и все MDS 1 и 11 отсутствуют в правый конец микроядерного гена.Наличие MDS 11 (14 п.н.) определяется макроядерным сегментом, отсутствующим в ПЦР последовательность между МДС 10 и 12 в микроядерной ДНК на рис. 1 С . Мы постулируем существование IES неопределенного размер (IES 10 на рис. 1 C ), который создает MDS 1 и 2, поскольку он в скремблированных генах актина I в S. nova , S. histriomuscorum и Sterkiella sp. (Осина). В положение MDS 11 не установлено, но предполагается, что он будет следовать МДС 1.Кажется маловероятным наличие каких-либо дополнительных IES, хотя MDS 1 может быть разделен IES. В любом случае ≈90% микроядерный ген учитывается в продукте ПЦР, что позволяет подробное сравнение со структурами гена актина I другого гипотричи. С этими предположениями о MDS 1 и 11 и IES 10 и 11, микроядерный ген актина I в Oxytricha sp. (Misty) состоит из 11 IES и 12 MDS. MDS 1 содержит весь 5′-некодирующий лидер. Стоп-кодон (TGA) находится в конце MDS. 9 и MDS 10, 11 и 12 содержат 3 ‘некодирующий концевик.
Рисунок 3Эволюционная схема для вставки IES и скремблирования МДС в микроядерном гене актина I у восьми гипотрих. МДС являются блоки, а IES — линии между блоками. Регионы не упорядочены Микроядерная ДНК — пунктирные блоки и линии.
Stylonychia pustulata .Пары праймеров были сконструированы из последовательности макронуклеарного актина I. исходя из предположения, что микроядерная версия будет перемешаны по образцу, аналогичному образцу Sterkiella ноя а, с.histriomuscorum и Sterkiella sp. (Осина) (рис. 3). Праймеры охватывали область предполагаемого МДС. 3 — MDS 1, определяя микроядерную структуру гена на рис. 1 Д . Схема такая же, как у S. nova и Sterkiella sp. (Aspen), но в продукте ПЦР не хватает 255 п.н. 5′-конец MDS 3 и всего MDS 8 (8 п.н.). Таким образом, микроядерный ген S. pustulata состоит из девяти MDS и восьми IES, с перевернутым MDS 2.ATG находится в MDS 2, а TGA — в MDS 6.
Stylonychia lemnae .Опять же предполагалось, что микроядерный ген актина I S. lemnae будет иметь схему скремблирования, аналогичную S. nova , S. histriomuscorum и Sterkiella sp. (Осина). Пара праймеров, предназначенная для охвата области от MDS 3 до инвертированный MDS 2 давал специфичный для микроядер продукт (рис. 1 E ).Последовательность продукта ПЦР определяет MDS. узор 3-4-5-7-2. О существовании МДС 1, 6 и 8 можно вывести из последовательности микроядерного продукта ПЦР и макроядерного последовательность, но их положение предполагается исходя из микроядерного Структура гена актина I в S. nova , S. histriomuscorum и Sterkiella sp. (Осина). Пятьдесят два п.н. отсутствуют на 5′-конце MDS 3 в продукте микроядерной ПЦР. (5′-конец MDS 3 определяется в макроядерной молекуле, потому что непосредственно примыкающий 3 ‘конец MDS 2 [перевернутый] известен из последовательность микроядерного продукта ПЦР).5′-конец MDS 2 — это неопределенный. Последовательность MDS 6 определяется как сегмент между MDS. 5 и 7 в макронуклеарной ДНК. Последовательность MDS 8 определяется как области в макроядерной молекуле от 3’-конца MDS 7 до теломер. Короче говоря, микроядерный ген актина I в S. lemnae состоит из восьми MDS и семи IES. Возможно, но маловероятно, что МДС 1, 6 и / или 8, отсутствующие в микроядерной ПЦР продукт, разделены дополнительными IES. Точно так же возможно, но маловероятно, что недостающие части MDS 2 и 3 содержат IES.
Обсуждение
С секвенированием микроядерного гена актина I в пяти новых организмов общее количество, у которых большая часть строения Известно восемь микроядерных генов. Полные последовательности микроядерные гены актина I в S. nova и S. histriomuscorum , и частичная последовательность для Sterkiella sp. (Aspen) были опубликованы ранее (3, 9). Наша цель — сравнить расположение IES и MDS в микроядерном гене актина I в эти восемь организмов, чтобы сделать выводы о происхождении и эволюции IES и эволюция скремблирования MDS.
В качестве отправной точки деревья максимальной экономии на основе последовательностей рДНК (E.A.H., K.M.M., D.J.H. и D.M.P., неопубликованные наблюдения) и аминокислотные последовательности актина I для восьми организмов были построены (рис.2 A и B ). Последовательности рДНК простираются от начала малой субъединицы (оц) -рДНК, через ITS1, 5.8S рДНК, ITS2 и 1400 оснований большой субъединицы (ls) -рДНК. Два дерева определяют идентичные филогенетические отношения. для ранней дивергенции U.grandis , за которым следует дивергенция E. mobilis , S. lemnae , S. pustulata и Sterkiella sp. (Осина). Они отличаются что касается более позднего расхождения S. nova , Oxytricha sp. (Misty) и S. histriomuscorum . Деревья, основанные на рДНК, обычно считаются филогенетическими. отношения более точны, чем деревья, основанные на актине I.
Сравнительный анализ восьми микроядерных генов актина I показал имеет важное значение для двух важных вопросов: ( i ) вставка IESs в микроядерную ДНК во время гипотриховой эволюции; и ( ii ) время эволюции и механизм гена схватка в гипотрихах.
Микроядерные генные структуры восьми организмов расположены на рис.3 согласно филогенетическому дереву, определяемому их рДНК последовательности. Дерево уходит корнями в гипотетический прародитель, у которого отсутствуют IES в гене актина I. В первом отделении U. grandis приобрел два IES, и три MDS не скремблируются [шаг (1) на рис. 3]. U. grandis следует за E. mobilis [шаг (2) на фиг. 3], чей ген актина I содержит три IES и четыре МДС.Ни один из трех IES в E. mobilis не соответствует ни одному из два IES в U. grandis по положению, размеру или последовательности. Тем не менее, один или даже два IES в E. mobilis могут произошли от того же события вставки IES, что и одно или два IES в U. grandis , потому что IES сдвигают положение вдоль ДНК на пошаговые мутации, накопление мутаций с высокой скоростью и изменение длина в процессе эволюции. Ближайшее соответствие по позиции — между IES 1 в двух организмах; IES 1 прерывает шестерку лидеров 5 ‘ базы перед АТГ в U.grandis и 37 б.н. вверх по течению АТГ в E. mobilis ; этот IES составляет 102 б.п. и 83 б.п. в два организма, соответственно, и никакой идентичности последовательностей за пределами того, что ожидается для АТ-богатой ДНК (91 и 81% АТ соответственно). между этими двумя IES. Тем не менее, они могут представлять собой единый исходный IES, который сместил положение вдоль ДНК и накапливал много мутаций. Также возможно, что IES в U. grandis и E. mobilis были вставлены отдельно, независимые события после расхождения двух эволюционных линий.
После разветвления E. mobilis , еще четыре IES были вставлены, чтобы получить в общей сложности восемь MDS, одна из которых — MDS 2 [шаг (3) на фиг. 3]. В этом теоретическом промежуточном звене MDS 2 был инвертирована рекомбинацией между двумя IES, которые фланкируют MDS 2 [шаг (4) на рис. 3]. Затем два события транслокации МДС произвели паттерн, наблюдаемый у S. lemnae [шаги (5) и (6) на рис. 3]. Этот шаблон был доработан путем добавления еще одного IES [шаг (7) на рис.3] и тремя транслокациями МДС [шаги (8), (9), и (10) на фиг. 3], создавая узор 3-4-6-5-7-9-2-1-8 в общий, теоретический предок S. pustulata и Oxytricha sp. (Мисти) на правой ветви на рис. три микроорганизма Sterkiella на левой ветви на рис. Образец теоретического предка сохраняется в S. pustulata , S. nova и Sterkiella sp. (Осина). Вставка еще трех IES в этот паттерн, создание трех другие нескремблированные MDS, образец получен в Oxytricha sp.(Misty) (правая ветвь внизу рис. 3). Вставка одного IES в паттерне, разделяемом S. nova и Sterkiella sp. (Аспен) дала дополнительные, незашифрованные МДС у S. histriomuscorum (левая ветвь внизу рис. 3).
Схема на рис. 3, описывающая эволюцию структуры гена актина I в восемь организмов, несомненно, могут быть усовершенствованы и переработаны включение дополнительных гипотрих, возможно, даже обнаружение одного или нескольких теоретических интермедиатов на рис.3. Однако основные постулаты этой эволюционной схемы IES / MDS подтверждены близким соответствием схемы с эволюционным деревом, определяемым последовательностями рДНК (Рис.2 A ). Мы пришли к выводу, что IES последовательно добавлялись в эволюции гипотриховых генов. Либо они когда-либо удалялись в процессе эволюции, сомнительно; нет наблюдения, которые предполагают удаление IES. Накопление IES в гене создает возможность для внутригенной рекомбинации между IES, что приводит к скремблированию MDS.Что может подтолкнуть такие рекомбинации неизвестно. Рекомбинация происходила не всегда; в Ген βTP в S. histriomuscorum содержит шесть IES, но семь МДС остались в ортодоксальном порядке (10). Параллельно с рекомбинации, которые скремблируют MDS, новые IES продолжают вставляться в существующие MDS, увеличивая количество MDS, например, Oxytricha sp. (Мисти).
Хотя мы считаем, что начали разгадывать происхождение и эволюция IES и MDS скремблирования, мы не понимаем значение этих явлений в эволюции и генетической функции организмов.Возможно, IES создают возможности для перетасовки сегментов (MDS) межгенно путем рекомбинации, тем самым облегчая эволюция новых генов. Скремблирование MDS может быть не более чем проявление такой перетасовки МДС в эволюции новых генов.
Благодарности
Мы благодарны Гейл Прескотт за то, что она напечатала несколько версий рукопись. Работа поддержана Национальным институтом общей медицины. Грант на исследования в области медицинских наук R01 GM 56161 и Национальная наука Грант Фонда на исследования MCB-9974680 (Д.М.П.). Д.Дж.Х. был частично при поддержке программы бакалавриата Хьюза по биологическим наукам Инициатива, Университет Колорадо по исследованиям в бакалавриате Программа возможностей и Центр рака Университета Колорадо. К.Е.О. была частично поддержана Университетом Колорадо Программа возможностей для исследований в бакалавриате. К.М.М. был поддержан стартовые фонды Университета Ватерлоо.
