Инфузория обыкновенная. Описание, строение и размеры инфузории-туфельки
Инфузория-туфелька относится к типу Инфузории, который принадлежит Простейшим (одноклеточным эукариотам). Часто инфузориями-туфельками называют несколько похожих видов. Характерными особенностями всех инфузорий являются наличие ресничек (которые являются органами передвижения) и более сложное строение их клетки-организма по сравнению с другими простейшими (например, амебами и эвгленами).
Инфузория-туфелька обитает в пресноводных, обычно загрязненных, водоемах. Размеры клетки от 0,2 до 0,6 мм. Форма тела похожа на подошву туфельки. При этом передний конец, которым инфузория плывет вперед, — это «пятка туфельки»; а «носок» — это задний конец.
Тело инфузории-туфельки окружено ресничками. На рисунках и схемах реснички изображены только вокруг клетки. На самом деле они проходят своеобразными тяжами по всему телу (т.
Двигается клетка благодаря волнообразным сокращениям ресничек (каждая следующая в ряду изгибается чуть позже предыдущей). При этом каждая ресничка резко двигается в одну сторону, после чего медленно возвращается на место. Скорость передвижение инфузории составляет около 2 мм в секунду.
Реснички крепятся к базальным тельцам . При этом половина из них ресничек не имеет. Базальные тельца, имеющие реснички и неимеющие их, чередуются.
Внешняя часть цитоплазмы (под клеточной мембраной) имеет структуры, позволяющие инфузории-туфельке сохранять свою форму. Эту часть цитоплазмы называют цитоскелетом .
В мембране есть трихоцисты , представляющие собой палочки, которые выбрасываются и «жалят» хищников, нападающих на инфузории-туфельки.
У клетки инфузории-туфельки есть достаточно глубокая впадина (как бы мембрана вогнута внутрь клетки). Это образование называют клеточным ртом , переходящим в клеточную глотку .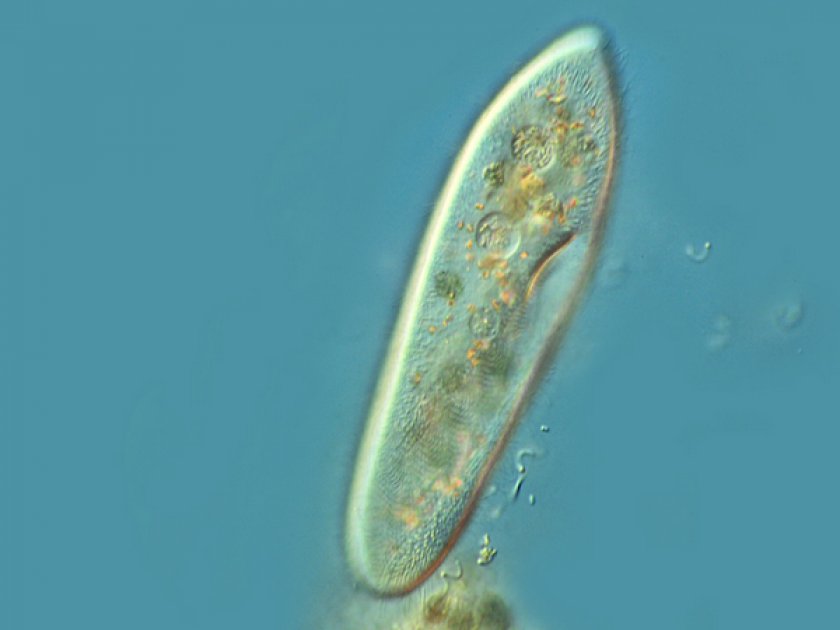 Они окружены более длинными и толстыми ресничками, которые загоняют в них пищу. Чаще всего едой служат бактерии, одноклеточные водоросли. Инфузории их находят по выделяемым ими веществам.
Они окружены более длинными и толстыми ресничками, которые загоняют в них пищу. Чаще всего едой служат бактерии, одноклеточные водоросли. Инфузории их находят по выделяемым ими веществам.
От клеточной глотки отделяются пищеварительные вакуоли . Каждая такая вакуоль после своего образования проходит сначала в заднюю часть клетки, затем двигается в переднюю, после чего снова в заднюю. Это перемещение обеспечивается постоянным движением цитоплазмы. К пищеварительной вакуоли подходят лизосомы и различные ферменты, питательные вещества в вакуолях расщепляются и попадают в цитоплазму. Когда пищеварительная вакуоль обойдет круг и вернется в заднюю часть клетки, то ее содержимое будет выброшено за пределы через порошицу .
У инфузории-туфельки две сократительные вакуоли
 Заполненные резервуары отделяются от канальцев и через поверхность клетки, сокращаясь, выбрасывают раствор. Вакуоли сокращаются поочередно.
Заполненные резервуары отделяются от канальцев и через поверхность клетки, сокращаясь, выбрасывают раствор. Вакуоли сокращаются поочередно.Дышит инфузория-туфелька кислородом, растворенным в воде. Однако при дефиците кислорода может переходить на бескислородный способ дыхания.
Инфузории-туфельки размножаются делением клетки надвое. В отличие от эвглены зеленой родительская клетка делится не вдоль, а поперек (т. е. одна дочерняя клетка получает заднюю часть клетки-родителя, а другая — переднюю, после чего они достраивают недостающие части).
Кроме бесполого способа размножения, у инфузорий есть половой процесс. При нем не происходит увеличения количества особей, но происходит обмен генетической информации.
У инфузории-туфельки два ядра — большое (макронуклеус) и малое (микронуклеус). Макронуклеус полиплоден (в нем несколько наборов хромосом). Микронуклеус диплоден. Макронуклеус отвечает за контроль жизнедеятельности клетки. На содержащемся в нем ДНК происходит синтез РНК, которая отвечает за синтез белков.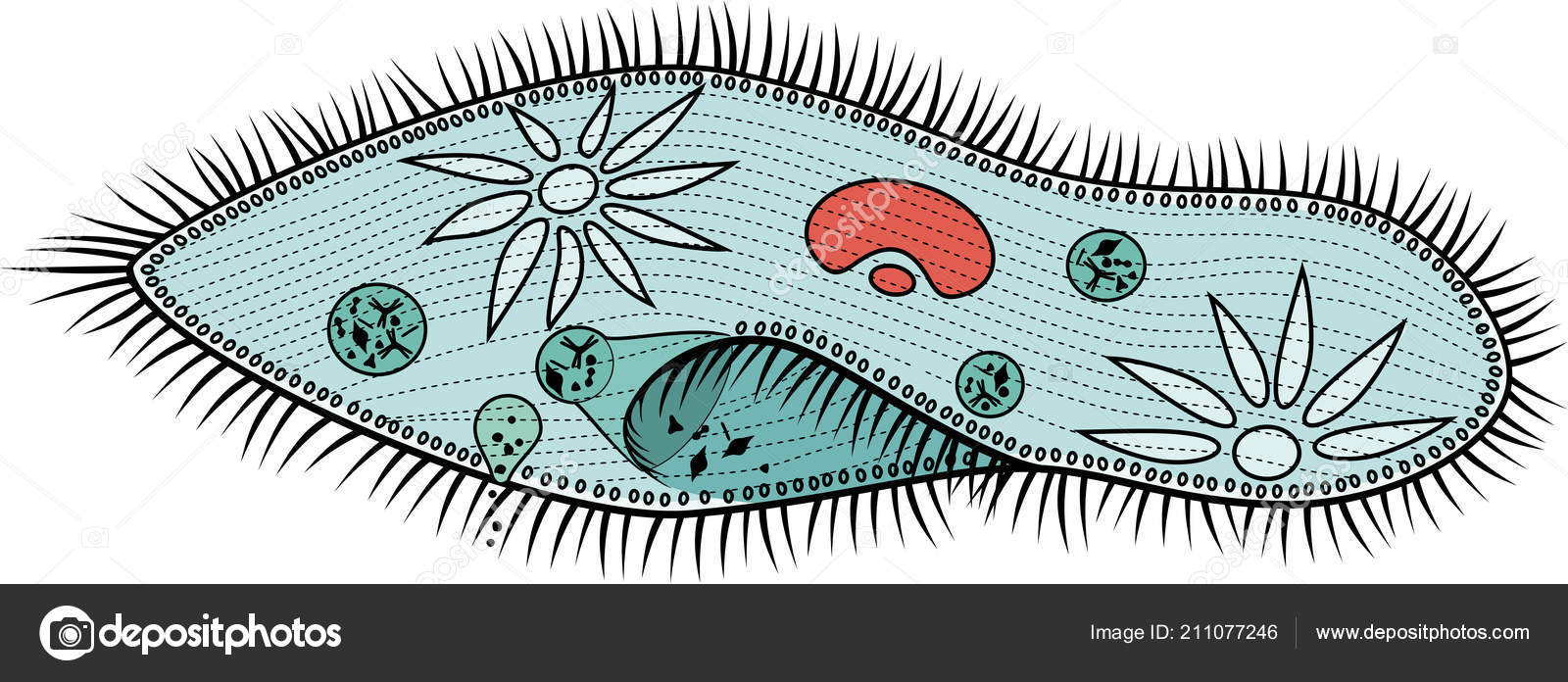 Микронуклеус отвечает за половой процесс.
Микронуклеус отвечает за половой процесс.
При половом процессе две инфузории-туфельки подходят друг к другу со стороны клеточных ртов. Между клетками образуется цитоплазматический мостик. В это время в каждой клетке макронуклеус растворяется, а микронуклеус делится мейозом. В результате получаются четыре гаплоидных ядра. Три из них растворяются, а оставшееся делится митозом. В результате получаются два гаплоидных ядра. Одно из низ остается в своей клетке, а другое по цитоплазматическому мостику уходит в другую инфузории. Из второй инфузории перемещается одно из ее гаплоидных ядер. Далее в каждой клетке сливаются два ядра (одно свое и одно чужое). Уже образованное диплоидное ядро (микронуклеус) потом делится, образуя макронуклеус.
Инфузория туфелька — простейший одноклеточный организм размером около 0,1 мм. Встречается в тех же водоемах, что и эвглена, и амеба простейшая. Питается преимущественно бактериями и микроскопическими водорослями. Служит пищей для личинок, мелких рыбок, рачков.
Внешний вид инфузории туфельки
За свое сходство с подошвой женской обуви этот вид инфузорий приобрел второе название — «туфелька». Форма этого одноклеточного организма постоянна и не меняется с ростом или другими факторами. Все тело покрыто мельчайшими ресничками, похожими на жгутики эвглены. Удивительно, но этих ресничек на каждой особи насчитывается около 10 тысяч! С их помощью клетка передвигается в воде и захватывает пищу.
Инфузория туфелька, строение которой так знакомо по учебникам биологии, не видна невооруженным глазом. Инфузории представляют собой мельчайшие одноклеточные организмы, но при большом скоплении их можно увидеть и без увеличительных приборов. В мутной воде они будут выглядеть как продолговатые белые точки, находящиеся в постоянном движении.
Строение инфузории туфельки
Особенности строения инфузории туфельки заключаются не только в ее внешнем сходстве с подошвой обуви. Внутренняя организация этого простейшего, на первый взгляд, организма всегда представляла огромный интерес для науки. Одна-единственная клетка покрыта плотной мембраной, внутри которой содержится цитоплазма. В этой студенистой жидкости размещены два ядра, большое и малое. Большое отвечает за питание клетки и выделения, малое — за размножение.
Одна-единственная клетка покрыта плотной мембраной, внутри которой содержится цитоплазма. В этой студенистой жидкости размещены два ядра, большое и малое. Большое отвечает за питание клетки и выделения, малое — за размножение.
Отверстие, выполняющее роль рта, расположено с широкой стороны клетки. Оно ведет в глотку, на конце которой образуются пищеварительные вакуоли.
Строение тела инфузории туфельки отличается также весьма интересной особенностью — наличием трихоцист. Это особые органы, а точнее — органеллы, служащие клетке для питания и защиты. Заметив пищу, инфузория выбрасывает трихоцисты и удерживает ими добычу. Их же она выдвигает, когда хочет защитить себя от хищников.
Питание инфузории туфельки
Одноклеточные организмы питаются бактериями, которые обитают в большом количестве в загрязненной мутной воде. Не исключение и инфузория туфелька, строение рта которой позволяет захватывать проплывающие мимо бактерии и быстро отправлять их в пищеварительную вакуоль. Рот инфузории окружен ресничками, которые в этом месте длиннее, чем на других участках тела. Они образуют околоротовую воронку, позволяющую захватывать как можно больше пищи. Вакуоли образуются в цитоплазме по мере необходимости. Одновременно пища может перевариваться сразу в нескольких вакуолях. Время переваривания составляет около одного часа.
Рот инфузории окружен ресничками, которые в этом месте длиннее, чем на других участках тела. Они образуют околоротовую воронку, позволяющую захватывать как можно больше пищи. Вакуоли образуются в цитоплазме по мере необходимости. Одновременно пища может перевариваться сразу в нескольких вакуолях. Время переваривания составляет около одного часа.
Инфузория питается почти беспрерывно, если температура воды выше 15 градусов. Питание прекращается перед началом размножения.
Дыхание и выделение инфузории туфельки
Что касается дыхания, то здесь инфузория туфелька строение имеет, схожее с другими простейшими. Дыхание осуществлятся всей поверхностью тела организма. Две сократительные вакуоли обеспечивают этот процесс. Отработанный газ проходит по специальным канальцам и выбрасывается через одну из сократительных вакуолей. Выделение лишней жидкости, являющейся результатом жизнедеятельности, происходит каждые 20-25 секунд тоже посредством сокращения. При неблагопрятных условиях инфузория перестает питаться, и сократительные движения вакуолей значительно замедляются.
Размножение инфузории туфельки
Инфузория туфелька размножается делением. Примерно один раз в сутки ядра, большое и малое расходятся в разные стороны, растягиваются и разделяются надвое. В каждой новой особи остаются по одному ядру и по одной сократительной вакуоли. Вторая образуется через несколько часов. Каждая инфузория туфелька строение имеет идентичное родительскому.
У инфузорий, прошедших многократное деление, наблюдается такое явление, как половое размножение. Две особи соединяются друг с другом. Внутри получившейся большой клетки происходит деление ядер и обмен хромосомами. После завершения такого сложного химического процесса инфузории разъединяются. Количество особей от этого не увеличивается, но они становятся более жизнеспособными в изменяющихся внешних условиях.
Строение и жизнедеятельность инфузории туфельки мало зависит от внешних факторов. Все туфельки выглядят одинаково, имеют одну и ту же форму и размер вне зависимости от условий. Жизнедеятельность тоже протекает по одному сценарию.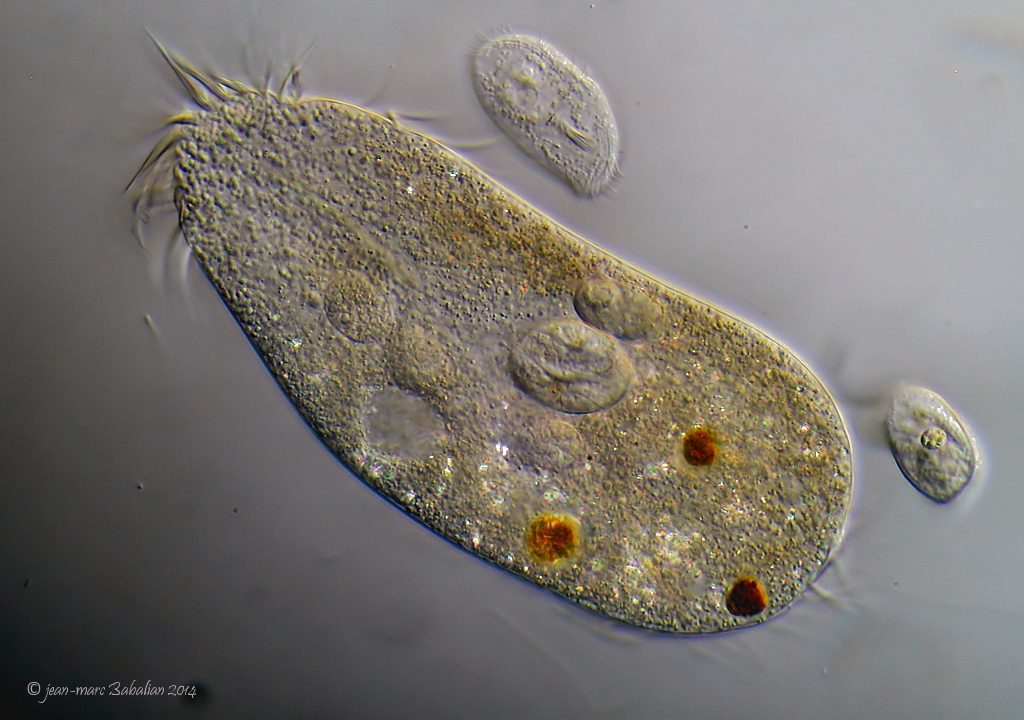 Имеет значение только температурный и световой факторы. Инфузории очень чувствительны к изменениям освещенности. Можно провести небольшой эксперимент: затемнить сосуд, в котором живут инфузории, оставив маленькое светлое окошко. К этому отверстию уже через пару часов стянутся все особи. Также инфузории воспринимают и изменение температуры. При снижении ее до 15 о C туфельки перестают питаться и размножаться, впадая в своеобразный анабиоз.
Имеет значение только температурный и световой факторы. Инфузории очень чувствительны к изменениям освещенности. Можно провести небольшой эксперимент: затемнить сосуд, в котором живут инфузории, оставив маленькое светлое окошко. К этому отверстию уже через пару часов стянутся все особи. Также инфузории воспринимают и изменение температуры. При снижении ее до 15 о C туфельки перестают питаться и размножаться, впадая в своеобразный анабиоз.
На земле встречаются разнообразные живые организмы. Большие и не очень, сложные и простейшие. За одними человек может наблюдать невооруженным глазом, для исследования других требуется специальное оборудование. Любое живое существо состоит из клеток – миллионов, миллиардов .
Инфузория-туфелька — один из простейших одноклеточных организмов. Лучшим ответом на вопрос, что это такое, будет представление окружности или любой другой замкнутой фигуры. Ограничивающий контур — стенки клетки или клеточные мембраны, внутри контура находится все необходимое для жизнедеятельности организма.
Вконтакте
Почему туфелька?
Инфузории бывают разных размеров, но большинство их невидимы невооруженным глазом. Своим названием этот организм обязан внешнему виду. Клетки бывают довольно подвижными и даже могут менять свою форму. У инфузории-туфельки таких возможностей нет.
Мембрана всегда неподвижна, и вся клетка напоминает подошву обуви. Существо постоянно в движении. Достигается это посредством ресничек , покрывающих его внешнюю поверхность .
Все они движутся синхронно , с одинаковой частотой и силой. Интересно, что плавает туфелька тупым концом вперед , а особенности строения и направление движения заставляют ее вращаться вокруг продольной оси.
Где живет инфузория?
Проживают инфузории в водоемах и очень часто становятся
 Встретить ее можно и в домашних аквариумах. Волнообразное движение ресничек позволяет ей передвигаться со скоростью до 2 мм/с.
Встретить ее можно и в домашних аквариумах. Волнообразное движение ресничек позволяет ей передвигаться со скоростью до 2 мм/с.Направление движения может меняться двумя способами:
- изгиб самой клетки — обычный вариант;
- столкновение с каким-то препятствием.
В последнем случае туфелька может развернуться на 180 градусов . Реснички туфельки помогают ей не только в передвижении. Они отвечают также за питание, создавая ток жидкости в направлении ротового отверстия инфузории. Часть ресничек прогоняет бактерии вдоль тела инфузории. Часть, склеенная в более сложные формы, помогает «заглатывать» еду. Ротовое отверстие, или клеточный рот, инфузории находится примерно посередине вогнутой части.
Внимание! Разводят туфельку и искусственным путём. Опытные аквариумисты знают, что идеальным кормом для мальков рыб является именно инфузория-туфелька. Более того, среди новорожденных существуют привереды, которые, кроме нее, ничем не питаются. На множестве интернет-проектов, посвященных аквариумистике, люди рассказывают о способах ее разведения.
На множестве интернет-проектов, посвященных аквариумистике, люди рассказывают о способах ее разведения.
Дыхание и выделение
Отдельных органов, ответственных за данные функции, инфузория не имеет. Дыхание происходит всей поверхностью тела инфузории-туфельки. Кислород , поступая через цитоплазму клетки , расщепляет пищу на , углекислый газ , а также ряд других соединений.
Процесс сопровождается высвобождением энергии, необходимой существу для поддержания жизни. Второй функцией дыхания является
Остальные вещества выводятся в пару специальных полостей , расположенные в разных концах туфельки. Их называют вакуоли . В процессе расщепления сложных органических веществ они наполняются водой с продуктами распада. В момент достижения критического наполнения вакуоль перемещается к поверхности тела и опустошается .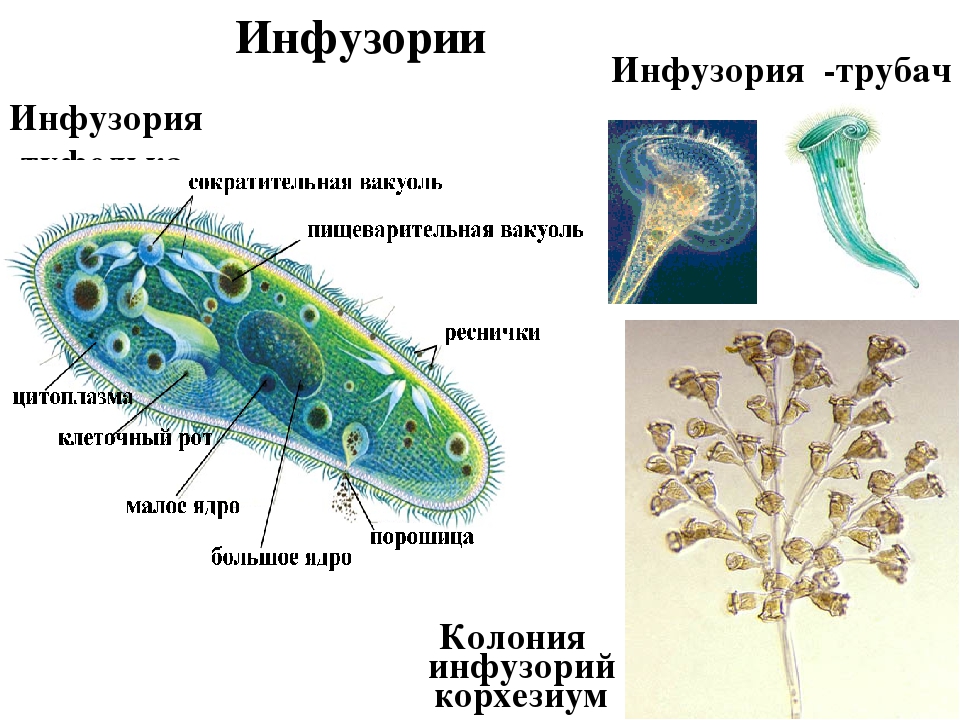 Таким образом, выделения выводятся из организма инфузории-туфельки.
Таким образом, выделения выводятся из организма инфузории-туфельки.
В спокойном положении вакуоли расположены в передней (у «каблука») и задней («пальцы») частях клетки инфузории. Ученые вычислили что вакуоли, попеременно сокращаясь, способны за час выбросить объем воды , примерно равный самому размеру клетки .
Химия жизни
Инфузория является первоклассным химиком . Двигаясь вперед, она находит пропитание по незаметным изменениям состава воды . В месте большого скопления бактерий химический состав несколько изменяется, что позволяет инфузории-туфельке безошибочно находить себе пропитание.
Хоть туфелька и живет в стоячих водах , поедая бактерии и водоросли, она очищает водоем. В таких местах вода всегда чиста и прозрачна, ведь первыми загрязнителями естественных водоемов являются именно бактерии и споры водорослей — лучший корм для инфузорий.
Инфузории-туфельки очень разборчивы. Идеальная среда обитания должна быть пресной.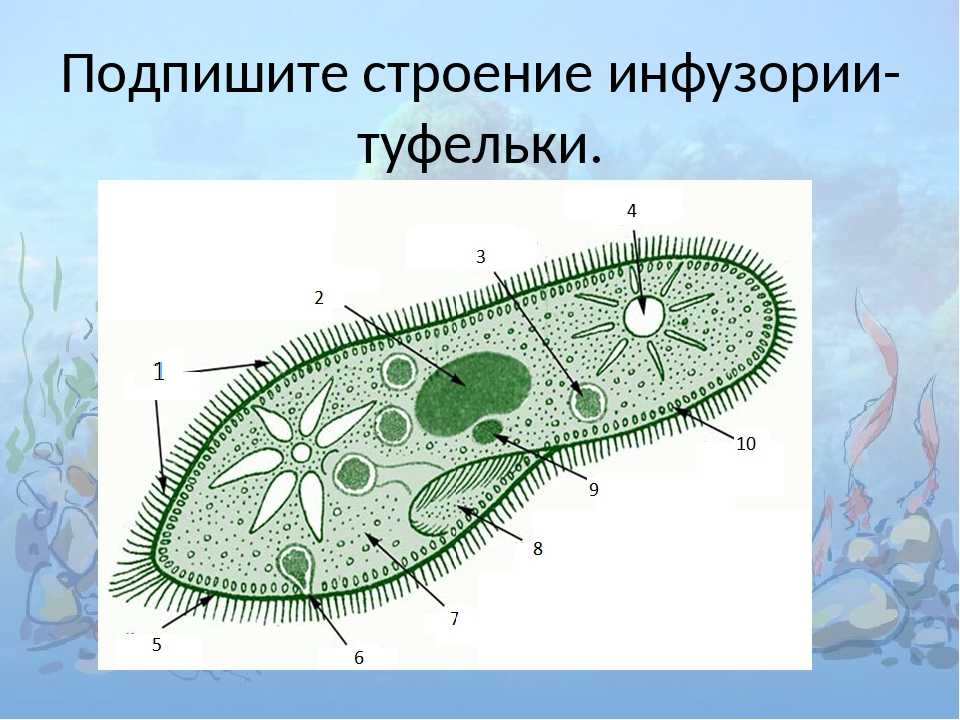 Важным факторов их размножения является большое количество органических остатков, бактерий и мелких водорослей. Если последних мало, инфузории стараются уйти из такого места . Ощутив неблагоприятные условия , инфузории также постараются переместиться.
Важным факторов их размножения является большое количество органических остатков, бактерий и мелких водорослей. Если последних мало, инфузории стараются уйти из такого места . Ощутив неблагоприятные условия , инфузории также постараются переместиться.
К плохим условиям для процессов, способствующих их проживанию, относятся похолодание, появление в воде примесей соли, а также недостаток света. Проявление любого из указанных свойств заставит инфузории переместиться – из менее освещенных слоев жидкости на поверхность, из соленого места в более чистое, пресное. Если же температура приближается к нулю, то инфузории мигрируют.
Важно! Владельцам рыбных хозяйств нужно понимать, что туфелька — стартовый корм для мальков. Если в водоеме планируется разводить рыбу, нужно позаботиться и создать инфузориям благоприятные условия для размножения.
Миграции
При ухудшении условий для жизнедеятельности инфузории могут перебраться на новое место обитания . Процесс состоит из нескольких этапов:
Процесс состоит из нескольких этапов:
- Сотни тысяч туфелек собираются группками.
- Каждая собирается в правильный шарик .
- Многоклеточная особь переносится на новое место
- На новом месте распадается на отдельные существа.
Перемещаться инфузории могут ветром или «пассажирами» на птицах и животных. Для шарика, в виде которого инфузории путешествуют, ученые придумали название — циста .
Может быть и другой вариант — инфузории впадают в «спячку» . Группы не собираются, а отдельные существа создают собственные панцири-цисты, в которых могут находиться, пока условия не станут благоприятными.
Хищники
Есть у простейших свои охотники и свои жертвы . В роли последних чаще всего оказываются именно туфельки . На противоположном конце находятся особые виды инфузорий. Люди нашли два вида охотников:
- бурсария ;
- дилептус .
Первая в несколько раз больше инфузории-туфельки. Ее размеры могут достигать 1 мм. Выглядит она, как рыболовная верша — воронка. В узком конце находится рот. Инфузория гоняется за туфельками, передвигаясь резкими размашистыми движениями .
Ее размеры могут достигать 1 мм. Выглядит она, как рыболовная верша — воронка. В узком конце находится рот. Инфузория гоняется за туфельками, передвигаясь резкими размашистыми движениями .
Настигнув жертву, она замирает и пытается «пообедать». Дается ей это не так легко. Она обладает длинными ротовыми ресницами, которые загоняют туфельку в рот. Та отчаянно пытается вырваться. Часто довольно успешно.
Но если туфелька попала с током воды внутрь глотки, бурсария может праздновать победу, выбраться обратно инфузория-туфелька просто не успеет. Протоплазма бурсарии сжимается, умерщвляя добычу, после чего та переваривается.
Передвигаясь неспешными движениями, на туфелек может охотиться и дилептус — другой хищник. В отличие от бурсарии, которая просто хватает добычу ртом, одноклеточная инфузория дилептус действует хитрее. Имея длинный хобот , снабженный стрекательными иглами, инфузория использует его для умерщвления добычи. Им наносятся удары оказавшимся по соседству инфузориям, а уколы парализуют жертву . Далее начинается трапеза. Дилептус открывает широко растягивающийся рот и заглатывает добычу, которая может оказаться больше его размером.
Далее начинается трапеза. Дилептус открывает широко растягивающийся рот и заглатывает добычу, которая может оказаться больше его размером.
Срок жизни туфельки
Выше были описаны два самых частых охотника. Но ответ на вопрос, сколько живут инфузории , зависит не только от количества желающих ими пообедать. Свое влияние оказывает и способ размножения (бесполое или половое), и среда обитания, и отсутствие или изменение качества питания. В обычной благоприятной среде инфузории-туфельки размножаются простым делением . Такой вариант назван бесполым . Но возможность такого размножения должна ограничиваться определенным количеством раз, в противном случае инфузория погибнет.
С другой стороны, половое размножение бывает только при серьезных угрозах жизни — резком похолодании или отсутствии пищи. Учитывая все варианты, срок жизни инфузории варьируется от нескольких дней до одного месяца .
Инфузория туфелька (Paramecium caudatum).
Бесполое размножение инфузории туфельки
Вывод
Простейшее одноклеточное существо — инфузория-туфелька является одним из звеньев в цепи эволюции. Несмотря на свой короткий срок , каждая особь приносит большую пользу окружающему миру. С одной стороны, она может очищать закрытые водоемы, питаясь бактериями и микроскопичными водорослями. С другой стороны, является первоклассным кормом для мальков рыбы.
Несмотря на свой короткий срок , каждая особь приносит большую пользу окружающему миру. С одной стороны, она может очищать закрытые водоемы, питаясь бактериями и микроскопичными водорослями. С другой стороны, является первоклассным кормом для мальков рыбы.
Все помнят классическое изображение инфузории-туфельки из учебника биологии, копируемого из издания в издание. Однако немногие задумываются, почему честь представлять неисчислимое количество одноклеточных организмов — простейших и бактерий — выпала именно инфузории-туфельке. Фото , полученное с помощью одного из микроскопов и видеоокуляра Альтами, позволит детально рассмотреть образец высшего совершенства элементарной ячейки жизни.
Прежде чем мы рассмотрим готовый микропрепарат инфузории-туфельки, строение ее тела-клетки под микроскопом , узнаем, что представляет собой это простейшее в среде обитания. Какую роль выполняет инфузория-туфелька в природе, какое место занимает в пищевой цепочке?
Инфузория или парамеция хвостатая (от лат. Paramecium caudatum) обитает в пресных водах. Свое название одноклеточное получило за удлиненные реснички на задней половине тельца. Между ресничками, которых насчитывается по всему тельцу более десяти тысяч, расположены трихоцисты или мелкие веретеновидные тельца. Они представляют собой органеллы (органы у многоклеточных) нападения и защиты, которые с силой выбрасываются и вонзаются в вражеское тело или в жертву. Сбоку на тельце инфузории находится предротовое углубление, переходящее в рот. Пищу инфузория переваривает образуя специальные пищеварительные вакуоли, отделяемые от глотки, которые проходят через весь организм, увлекаемые током цитоплазмы. При благоприятных температурных условиях и обилии пищи вакуоли образуются каждую минуту. Функцию выделения выполняют две сократительные вакуоли. Инфузория питается другими простейшими, одноклеточными водорослями, и сама служит кормом для личинок рыб и амфибий. Именно поэтому простейших рода Paramecium интенсивно выращивают на рыболовных хозяйствах, а также в аквариумистике.
Paramecium caudatum) обитает в пресных водах. Свое название одноклеточное получило за удлиненные реснички на задней половине тельца. Между ресничками, которых насчитывается по всему тельцу более десяти тысяч, расположены трихоцисты или мелкие веретеновидные тельца. Они представляют собой органеллы (органы у многоклеточных) нападения и защиты, которые с силой выбрасываются и вонзаются в вражеское тело или в жертву. Сбоку на тельце инфузории находится предротовое углубление, переходящее в рот. Пищу инфузория переваривает образуя специальные пищеварительные вакуоли, отделяемые от глотки, которые проходят через весь организм, увлекаемые током цитоплазмы. При благоприятных температурных условиях и обилии пищи вакуоли образуются каждую минуту. Функцию выделения выполняют две сократительные вакуоли. Инфузория питается другими простейшими, одноклеточными водорослями, и сама служит кормом для личинок рыб и амфибий. Именно поэтому простейших рода Paramecium интенсивно выращивают на рыболовных хозяйствах, а также в аквариумистике.
Теперь можем приступить к исследованию инфузории под микроскопом . Не беда, если готового микропрепарата не окажется под рукой. Любой аквариумист поделится с вами пару-тройкой секретов разведения инфузорий-туфелек либо самими особями, вместе с водой из аквариума. Также можно добыть простейших в любом стоячем водоеме и для получения критической массы, достаточной для исследования, создать наиболее благоприятные условия для размножения туфелек. Эти простейшие легко разводятся в домашних условиях на высушенных банановых корках или настое сенной трухи.
Мы поделимся с вами самым простым, но от этого не менее эффективным, способом разведения инфузории на кусочке моркови. Замоченный кусочек моркови (грамм на литр) долго не разлагается бактериями, а вода остается прозрачной. Емкость помещается в темное место с температурой чуть выше комнатной. Через несколько суток можно увидеть невооруженным взглядом белесоватую взвесь, окружающую морковь, которая представляет собой скопление инфузорий-туфелек, хаотично плавающих в толще воды.
Размножается инфузория-туфелька один-два раза в сутки изначально бесполым способом, то есть делением клетки пополам по экватору. Через несколько таких делений клетка готова размножаться половым способом — сложным обменом частицами малого ядра. Причем при половом размножении число особей остается прежним, не увеличивается, но клетка получает усовершенствованную способность приспосабливаться к окружающим условиям среды.
Далее помещаем капельку воды между предметным и покровным стеклом. Живые инфузории под микроскопом , уже при 80-тикратном увеличении, представляют собой не перестающее двигаться скопище клеток длиной 0,2—0,3 мм. Поэтому строение животной клетки под микроскопом можно изучить лишь на погибающем от высыхания простейшем. Подсыхающие инфузории под микроскопом выглядят более одутловатыми и практически не двигаются. Меняя объектив, устанавливаем увеличение в 200 раз: картина та же, но крупнее, различимо внутренне строение простейших.
Двухмерное изображение простейшего не соответствует тому, что вы увидите в объективе. Клетка под микроскопом вовсе не похожа на пресловутую дамскую туфельку или веретено, как изображают инфузорию художники-анималисты. Форма тела одноклеточного организма имеет «хребет» и в поперечном разрезе оказывается не овалом, а ромбом. По-видимому, выступ усиливает гидродинамику и улучшает маневренность инфузории. Овальную форму тельце простейшего принимает лишь при усыхании.
Клетка под микроскопом вовсе не похожа на пресловутую дамскую туфельку или веретено, как изображают инфузорию художники-анималисты. Форма тела одноклеточного организма имеет «хребет» и в поперечном разрезе оказывается не овалом, а ромбом. По-видимому, выступ усиливает гидродинамику и улучшает маневренность инфузории. Овальную форму тельце простейшего принимает лишь при усыхании.
Хоть инфузория-туфелька под микроскопом выглядит несколько иначе, чем на иллюстрации из школьного учебника, все же, при восьмисоткратном увеличении можно увидеть основные элементы строения животной клетки. Под микроскопом различимы ядро, цитоплазма и другие форменные элементы животной клетки. Состоящая из полисахаридов и белков оболочка клетки под микроскопом (световым) не видна. Ее строение смогут изучить счастливые обладатели электронного микроскопа.
Мы уверены, теперь вы будете проводить целые часы с микроскопом Альтами, ведя наблюдение за жизнью отнюдь не примитивного простейшего со сложным латинским названием Paramecium caudatum или инфузория-туфелька. Фото , которые вы сделаете с помощью видеоокуляра Альтами, будут напоминать вам о том, что природа совершенна.
Фото , которые вы сделаете с помощью видеоокуляра Альтами, будут напоминать вам о том, что природа совершенна.
Ученые полагают, что в ходе эволюции инфузории произошли от древних примитивных жгутиконосцев. Представители данного типа – балантидий, трубач, инфузория-туфелька. Некоторые виды могут вести одиночный подвижный образ жизни. Встречаются прикрепленные, иногда колониальные формы.
Инфузории могут иметь стебель и быть его лишены, сократимые и панцирные. Но все микроорганизмы, принадлежащие к данному типу, имеют определенные особенности, присущие только этой группе животных.
Это наличие ресничек для передвижения и захвата пищи, двух видов ядер, протекание полового процесса в форме конъюгации.Туфелька Инфузории (Infusoria) представляют собой одноклеточных животных, относящихся к типу простейших, микроскопически мелких существ, который насчитывает порядка 8 тысяч видов. Из всех простейших инфузории имеют самое сложное строение. Инфузория-туфелька относится к типу Infusoria, и виду Paramecium Caudatum.
Размеры инфузории-туфельки составляют от 0,1 до 0,35 мм. Свое название она получила благодаря форме своего тела. Наружный слой ее цитоплазмы плотный, за счет чего и сохраняется постоянная форма тела инфузории. Питаются инфузории главным образом бактериями и микроводорослями переваривая и проводя их через себя при помощи образующейся в цитоплазме пищеварительной вакуоли. Мелкие пищевые частицы проникают в тело инфузории через ротовое отверстие (которое всегда открыто) , и там скапливаются.
После чего пища проделывает в теле инфузории сложный путь, по ходу которого и осуществляется пищеварительный процесс. Все тело инфузории покрыто продольными рядами мелких ресничек, с помощью которых инфузория туфелька передвигается, совершая ими волнообразные движения. Инфузория туфелька достаточно подвижна. Скорость ее перемещения такова, что она за 1 секунду преодолевает
расстояние, превышающее длину ее тела в 10- 15 раз. Средой обитания инфузории туфельки является любой пресноводный водоем со стоячей водой и наличием в воде разлагающихся органических веществ.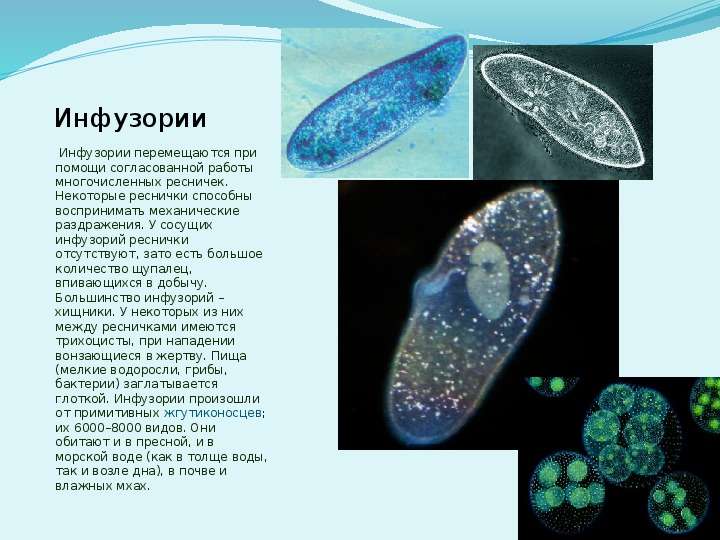 Ее можно обнаружить даже в аквариуме, взяв пробы воды с илом, и рассмотреть их под микроскопом.
Ее можно обнаружить даже в аквариуме, взяв пробы воды с илом, и рассмотреть их под микроскопом.
Infusoria Paramecium Caudatum – инфузория туфелька является очень популярным (стартовым) кормом для мальков большинства видов аквариумных рыб. А для некоторых (гурами) и незаменимым. Согласно анализам в инфузории туфелька содержится 6,8% сухого вещества, из которого 58,1% — белок, 31,7% — жиры, 3,4% — зола.
Существует множество способов разведения туфелек, на банановой кожуре, на сене, на молоке, на сушенных листьях салата и на пекарских дрожжах и т.д.
Для себя я выбрал самое простое, на банановой кожуре, или на молоке. Что то из этих продуктов у меня всегда было под рукой.
Объясню в чем разница.
На молоке культура туфелек, размножается и развивается более быстро, но и пропадает достаточно быстро. На банановой кожуре (которой нужно совсем чуть-чуть S=1- 3 см2) культура и живет дольше, но и разводиться по дольше, но есть огромный плюс, молока в доме может не оказаться, а кожуру спелого банана нужно высушить и можно использовать довольно долго.
Любое живое существо, даже одноклеточное, нуждается в питании. Не исключение и инфузория-туфелька. Питательной средой для неё являются микроорганизмы. Значит, требуется подготовить среду, где они будут находиться в достаточном числе. Берите любую ёмкость и наливайте туда аквариумную воду. Старайтесь собрать её поближе к поверхности там, где наружу выходят растения. Почти в каждом аквариуме со сформировавшейся биологической структурой уже есть свои инфузории, пусть их пока и немного.
Та и другая культура должна быть выдержана на солнце как минимум неделю (если больший срок, то ещё лучше). Оптимальное время для ращения инфузорий, таким образом – лето. Когда вода становится тёмной, это признак того, что бактериальная колония развилась. Далее в дело вступают инфузории. Отследить их появление можно даже без микроскопов и увеличительных стёкол: вода должна стать розоватой.
Всё получилось? Можно размножить колонию, взяв другую ёмкость с похожей бактериальной культурой и добавив туда немного воды из первой. Мальков нужно подкармливать буквально каплями воды из ёмкости, где обитают инфузории. Если вы добавите больше корма, чем мальки смогут съесть, то туфельки просто погибнут, а продукты их распада отравят воду. Конечно же, лучше начинать всё с воды из открытого водоёма, где инфузорий намного больше. И в любом случае желательно иметь микроскоп, чтобы оценить содержание микроорганизмов точно.
Мальков нужно подкармливать буквально каплями воды из ёмкости, где обитают инфузории. Если вы добавите больше корма, чем мальки смогут съесть, то туфельки просто погибнут, а продукты их распада отравят воду. Конечно же, лучше начинать всё с воды из открытого водоёма, где инфузорий намного больше. И в любом случае желательно иметь микроскоп, чтобы оценить содержание микроорганизмов точно.
В качестве корма для инфузорий можно использовать сен-ный настой, высушенные корки банана, тыквы, дыни, желтой брюквы, нарезанную кружками морковь, гранулы рыбьего комбикорма, молоко, сушеные листья салата, кусочки печени, дрожжи, водоросли, т.е. те субстанции, которые или непосредственно потребляются туфельками (дрожжи, водоросли), или являются субстратом для развития бактерий.
При использовании сена, его берут 10 г и помещают в 1 л воды, кипятят в течение 20 мин, затем фильтруют и разбавляют равным количеством или двумя третями отстоянной воды. Во время кипячения погибают все микроорганизмы, но сохраняются споры бактерий. Через 2 — 3 дня из спор развиваются сенные палочки, служащие пищей для инфузорий. По мере необходимости настой добавляют в культуру. Настой хранится в прохладном месте в течение месяца.
Наиболее простым способом является разведение туфелек на снятом, кипяченом или сгущенном (без сахара) молоке: его вносят в культуру 1 — 2 капли на 1 л) один раз в неделю. Туфельки используют молочнокислых бактерий.
При использовании вышеуказанных кормов важно не передозировать питание. В противном случае быстро размножающиеся бактерии оставят инфузорий без кислорода. При выращивании инфузории на бактериях они обладают положительным фототаксисом, т.е. стремятся к свету.
Можно разводить инфузорий на водорослях сценедесмусе и хлорелле. Хороших результатов можно добиться при культивировании инфузорий со слабой продувкой, когда на 1 л водорослей вносится 1 гранула карпового комбикорма. Инфузории, накормленные водорослями, обладают отрицательным фототаксисом: они стремятся в темноту. Это их свойство можно использовать при выкармливании т.е нелюбивых личинок рыб.
Используют культуру инфузорий, как правило, не дольше 20 дней. Для постоянного поддержания культуры ее заряжают в двух банках с интервалом в неделю, при этом каждую банку перезаряжают каждые две недели. Для длительного хранения культуры инфузорий, ее помещают в холодильник и хранят при температуре + 3°- + 10°С.
Недавно совершенно случайно обнаружил еще один способ получения культуры туфельки. После сифонки аквариума воду слил с осадка и налил в три пластиковые 2-литровые бутылки, выставил их на балкон, на солнце (нужна была «зеленая» вода, подкармливать наловленных дафний в течении недели). Две использовал по назначению, а третью не успел-зеленка осела. Такое всегда бывает, если не подливать свежей воды — микроводоросли «выедают» всю органику и микроэлементы и погибают.
Так вот, когда «зеленка» выпала в осадок, в бутылке оказалось просто офигенное количество инфузорий, крупных, откормленных, все как на подбор. И, кстати, без всяких подкормок культура держалась больше недели — на гниющих остатках микроводорослей.
На планете миллионы лет доминировали гигантские инфузории-туфельки | Статьи
В палеозойскую эру — 550 млн лет назад — Землю населяли гигантские одноклеточные организмы, достигающие метровой длины, и мелкие хищные животные, выяснили ученые Института нефтегазовой геологии и геофизики им. А.А. Трофимука СО РАН и Института геологии и минералогии СО РАН. По их данным, в этот период мир пережил первую настоящую гонку вооружений — именно тогда у организмов стали появляться средства нападения и защиты: зубы и панцири. Те, кто не смог обзавестись оружием, стали расти. Правда, шансов у них все равно не оказалось.
— Мы недооцениваем возможности простейших организмов. Примитивные одноклеточные организмы очень долго оставались маленькими одноклеточными, но когда начали появляться первые животные, мы видим, что простейшие организмы очень резко увеличиваются, становятся гигантскими. Палеонтологический период, когда у нас в морях доминировали гигантские протисты, увеличенные до метра, был очень кротким — длился всего 30–40 млн лет, — говорит один из авторов проекта «Крупнейшие эндогенные, палеоклиматические и биотические события в интервале 800–650 млн лет» кандидат геолого-минералогических наук Дмитрий Гражданкин.
По мнению Гражданкина, древние останки, которые ранее ученых принимали за вымерших медуз, на самом деле и есть останки тех самых простейших. В эволюционные возможности простейших поверил и академик, специалист по физиологии микроорганизмов Георгий Заварзин. Микробиологи подтвердили Гражданкину, что простейшие организмы в процессе эволюции действительно могли достичь впечатляющих размеров.
— Представьте себе надувной матрас, который состоит из многих отсеков. Эти организмы выглядели, как различные надувные матрасы причудливой формы, состоящие из одинаковых отсеков. Ведь понятно, что обычная клетка такого размера не может достичь, поэтому пришлось внутри клетки образовывать множество перегородок. То есть фактически одноклеточные придумали, как увеличить свои размеры не за счет увеличения количества клеток. Просто раньше было сложно представить, что такие размеры и такая форма может быть у одноклеточных организмов.
В этот же период — 550 млн лет назад, согласно последним исследованиям палеонтологов, происходила так называемая гонка вооружений. Считается, что сложные организмы, например животные, возникли 2 млрд лет назад, так как в эти же времена в почве находятся «родственники» животных — грибы. Но при этом ни останков самих сложных организмов, ни свидетельств их влияния на среду ранее 550 млн лет назад не встречается. Зато именно в этот период в палеонтологической летописи появляются одновременно и останки древних животных, и косвенные признаки их присутствия. Таким образом, Гражданкин делает вывод, что именно в тот период зародившиеся около 2 млрд лет назад животные начали преобразовываться в сложных хищников.
Часть из них эволюция практически не затронула. На примитивном уровне остались, например, морские губки. Другие организмы в этот период стали эволюционировать, чтобы лучше охотиться. Хищники обзаводились зубами и щупальцами, жертвы — панцирем. Простейшие не смогли заполучить ни того, ни другого, единственное, что им оставалось — увеличится в размерах, чтобы не быть съеденными мелкими хищниками. Однако позднее они не смогли конкурировать с развивающимися более успешными организмами и были вытеснены путем естественного отбора.
Гражданкин и соавторы считают свою теорию о выросших простейших более консервативной, чем гипотеза о существовании в то время больших и сложных организмов. Но не все биологи разделяют это мнение.
— Мне эта теория кажется очень маловероятной. Клетка очень ранимая, может легко погибнуть. Гипотетически, если представить, что это была спора, то еще можно было бы рассматривать, — говорит доктор биологических наук, заведующая лабораторией микробиологии среды обитания Института медико-биологических проблем РАН Наталья Новикова. — Устойчивыми к неблагоприятным факторам окружающей среды могут быть только организмы, которые способны находиться в состоянии покоя — например, в диапаузе. Так, личинка африканского комара может сохраняться в сушеном виде десятки лет, а помещенная в воду, она через 45 минут превращается в полноценного червяка. Что касается выживаемости простейших больших размеров, вопрос очень сомнительный. Представить себе покоящуюся форму такого размера я не могу, и она не имела бы такого строения, а вегетативная форма такого размера никогда бы не сохранилась даже. Гражданкин, вероятно, нашел нечто, напоминающее одноклеточный организм.
Исследователи уверены, что ошибки быть не могло — их теория стройно объясняет отсутствующие данные в палеонтологической летописи. Единственный вопрос, на который у них нет однозначного ответа: что именно 550 млн лет назад способствовало началу активной эволюции? На данный момент они предполагают, что это были возросшая магматическая активность и повышение уровня атмосферного кислорода.
Инфузория (Paramecium caudatum) | АкваДомик
Среди множества видов инфузорий, входящих в состав «прудовой пыли», основное место занимает инфузория-туфелька (Paramecium caudatum), размеры которой колеблются от 0,1 до 0,3 мм.
Туфелька относится к инфузориям среднего размера и имеет стройное веретенообразное тело, по форме действительно напоминающее подошву туфли.
Ее существование зависит от наличия в воде разлагающегося органического вещества. Движется она очень быстро, при поступательном движении животное вращается вокруг своей оси. Невооруженному глазу инфузории кажутся просто мелкими движущимися точками, но при небольшом увеличении с помощью хорошей лупы можно разглядеть, что это живые существа. Новорожденные мальки их хорошо видят и поедают в несметных количествах. Для совсем крошечных мальков некоторых видов, например гурами, инфузории на начальном этапе жизни просто незаменимы, и если их нет, большая часть мальков погибнет.
Добыть туфельку можно в любом стоячем водоеме. Обильно населены ею небольшие, непроточные пруды с опавшей листвой, маленькие торфяные болота, загородные ямы с гниющими органическими веществами.
Такие водоемы часто издают характерный сероводородный запах и обычно кишат множеством различных инфузорий, в особенности у берега. Если набрать в бутылочку или пробирку воды из такого водоема, то через лупу можно просмотреть ее население. Инфузории отличаются от ракообразных своими плавными движениями и округленными очертаниями. У большинства ракообразных движения скачкообразны и под лупой уже вполне заметны их членистые конечности.
Врагами простейших, в том числе туфельки, являются все мелкие животные, питающиеся ими, — хищные инфузории, коловратки, дафнии, циклопы, насекомые и их личинки. Поэтому, учитывая предпочтительность использования для корма именно парамеции, нужно выбрать культуру, где есть только инфузории, — в большинстве туфельки.
Инфузория легко разводится в домашних условиях на различных питательных средах (корки банана, сено, молоко, листья салата, очистки картофеля, горох, фасоль и т. д.). Основные трудности заключаются в получении чистой культуры, а также в очистке от бактерий перед скармливанием. Разведение инфузорий следует приурочить приблизительно к началу нереста. Ниже мы приведем наилучшие способы разведения инфузорий. Все они базируются на едином принципе: наличии в воде какого-то разлагающегося растительного материала, что обеспечивает бактериальную среду для питания инфузорий.
Трехлитровую банку на две трети заполняют остуженной кипяченой или «старой» аквариумной водой. В банку помещают пятую часть свежей или подсушенной корки банана. Питательная среда для инфузорий готова уже через сутки, когда вода в банке помутнеет. Если вода в банке слишком мутная и имеет сильный запах сероводорода, что свидетельствует о том, что в банке слишком высокая концентрация культуральной среды (положено слишком много банановых корок), воду необходимо слить и заложить новую культуру, поскольку в таких условиях инфузории размножаться не будут. Именно для этого рекомендуется подготавливать питательную среду для инфузорий в нескольких банках: если в одной культура окажется негодной, можно будет использовать остальные.
Для получения чистой культуры туфелек берется немного воды из природной культуры, в которой были замечены туфельки, и просматривается под лупой. Если в стекле окажется много инфузорий различных видов, то культуру нужно разбавить водой, чтобы инфузории распределились реже, затем под лупой можно вылавливать отдельных инфузорий-туфелек, что делается с помощью пипетки, с тонко оттянутым концом стеклянной трубки. Выловленных в числе одного-двух десятков туфелек пускают в заготовленный питательный раствор.
Если инфузорий нет, из пруда, где обитают инфузории, берут немного подгнивших водных растений и помещают их в банку с питательной средой.
Банку с инфузориями ставят в теплое место. Сосуд с культурой не следует ставить под прямые солнечные лучи, он может стоять в темном месте. Не следует бояться понижения температуры даже до 10 °С и ниже. Но хорошо размножаются инфузории только при комнатной температуре 18—22 °С.
Туфельки размножаются быстро, деление происходит не реже раза в сутки и через неделю при благоприятных условиях их можно увидеть даже невооруженным глазом в виде массы беловатых подвижных точек , в верхней части сосуда.
Для постоянного разведения инфузорий необходим 1 запас засушенных банановых корок, сушеного салата 1 или сена. Остаток раствора, в котором содержались инфузории, выливать не следует, достаточно добавить свежей воды. Когда инфузории потребуются вновь, в банку с раствором достаточно бросить корку банана, и через 3—5 дней в ней снова появятся инфузории.
Для постоянного поддержания культуры добавляют кипяченое молоко не чаще двух раз в месяц, исходя из пропорции 5 капель на 100 см3 воды.
Существует также способ разведения инфузорий на сыром молоке. Вместо банановых корок в банку добавляют 3—4 капли молока на 2 л воды каждые 2—3 суток. Далее инфузорий можно подкармливать или банановыми корками, или одной-двумя каплями молока, не забывая подливать воду.
Кроме того, инфузорий разводят на сенном настое (1—2 г сена на 10 л воды), кормовых дрожжах (1 г на 100 л воды), салате, на кожуре тыквы или дыни и др.
Вода, в которой содержится культура инфузорий, имеет неприятный запах. Если вылить ее прямо в аквариум, это приведет к порче воды и гибели мальков. Поэтому, как уже говорилось выше, инфузорий надо очищать. Для этого используют фильтровальную или промокательную бумагу, которую закладывают в воронку. Затем через нее тщательно процеживают инфузорий, чтобы освободить от бактерий, после чего бумага обмывается в местах скопления мальков.
Поскольку вода в сосудах, где находятся инфузории, часто портится, они погибают. Чтобы сохранить разведенную культуру, лучше содержать их в нескольких банках.
Для солоноватоводных рыб подходят морские инфузории (Euplotes vannus) размером 0,05—0,08 мм. В 10-литровую емкость помещается в качестве питательного субстрата 50 г икры морских рыб (соленость воды должна быть не ниже 12 %, температура — 23—25 °С). Перед скармливанием морских инфузорий малькам ее обрабатывают 0,001 %-ным раствором фуразолидона.
В отличие от коловраток инфузории — простейшие одноклеточные животные, то есть все их тело — это одна-единственная клетка.
Среди инфузорий, наловленных в естественном водоеме, могут оказаться и опасные для рыб (ловят инфузорий, как и коловраток, очень частым сачком, ведь инфузории, коловратки— это и есть «живая пыль»). Поэтому инфузорий, как и коловраток, лучше всего развести дома в стеклянной банке.
Наиболее подходящие для разведения дома — инфузории-туфельки. Туфелек просто отличить от других мельчайших животных по их быстрому характерному движению и по оригинальной форме. Тело у туфелек веретенообразное, и, двигаясь, они вращаются вокруг своей оси. Размер туфельки 0,25—0,3 мм.
Разводить инфузорий, как и коловраток, можно на сенном настое. Готовят сенной настой так же: кипятят воду с сеном (литр воды и 10 г сена), чтобы погибли все простейшие организмы, но кипятят недолго (не более 10—15 мин), чтобы сохранились в таком сенном настое споры бактерий — сенной палочки, которой и будет питаться инфузория-туфелька. После того как настой будет готов (он должен настояться после кипения в течение двух-трех дней), в него и помещают инфузорий. В этом случае настой не разбавляют водой, как при разведении коловраток.
Добыть инфузорий-туфелек можно либо из естественного водоема, либо из аквариума.
Если вы добываете инфузорий из естественного водоема, то их следует отделить от других живых существ, попавшихся вместе с ними.
«Если в пробе не обнаружится никаких животных, кроме туфельки, то культура пригодна для массового разведения. В противном случае большая капля воды с максимальной концентрацией инфузорий располагается на чистом стекле, рядом с ней, со стороны света, располагается капля свежей, отстоявшейся воды. Обе капли соединяются с помощью отточенной спички водным мостиком; туфельки устремляются в сторону свежей воды и света с большей скоростью, чем все остальные микроорганизмы»— так советует отделять туфелек от прочих животных, находящихся в капле воды, Михаил Николаевич Ильин в своей книге «Аквариумное рыбоводство». Это очень нужная книга для серьезного аквариумиста. Издана она в Москве.
Если вы будете добывать инфузорий из аквариума, то поступить надо так: взять из аквариума отмирающие части растений и, сдавив пальцами лист или стебелек, выдавить из них капельки воды. В этих капельках обязательно будут инфузории-туфельки, которых можно тут же поместить в сенной настой.
Если инфузории и в сенном настое будут развиваться медленно, то в банку, где они разводятся, можно добавить одну-две капли кипяченого молока, и тогда через два-три дня вы увидите в своей банке легкие белые облачка — полоски мельчайших живых существ.
Если банку закрыть чем-нибудь и таким образом ограничить доступ воздуха к сенному настою, то инфузории поднимутся к поверхности воды, где их легко собрать пипеткой, трубочкой или очень частым сачком. Так же поступают обычно и с коловратками. Помните, что «живая пыль» собирается тоже у наиболее освещенной части сосуда, в котором ее выращивают. Здесь относительно просто и собрать урожай прекрасного корма для мальков.
Можно собрать урожай «живой пыли» и с помощью колбы с высоким и узким горлом. В колбу наливают сенной настой вместе с «живой пылью». Наливают с таким расчетом, чтобы настой поднялся в колбе до середины горлышка. После этого на раствор опускают кусочек ваты так, чтобы он примерно на треть был опущен в раствор. Затем осторожно, пипеткой или трубочкой, в колбу доливают свежей, отстоявшейся воды — доливают воду так, чтобы она не смешалась с раствором и осталась светлым чистым столбиком над ваткой. В этот столбик чистой, свежей воды тут же станет подниматься «живая пыль»— она устремится к свежей воде. Очень хорошо поместить над колбой лампу, чтобы горлышко освещалось, а нижнюю часть колбы можно даже затенить. Через некоторое время почти вся «живая пыль» пройдет через вату и поднимется в столбик воды над ватой. Теперь эту воду вместе с «живой пылью» можно собрать и вылить в аквариум, где мальки поджидают корм.
Тип Инфузории — урок. Биология, Животные (7 класс).
Представители Типа Инфузории, или Ресничные — наиболее высокоорганизованные простейшие животные.
Характерные особенности инфузорий:
- на поверхности тела у них имеются реснички (органы передвижения), которые находятся в постоянном движении, что обеспечивает быстрое перемещение инфузорий.
- В клетке инфузорий два ядра, разных по размеру и функциям. Большое (вегетативное) ядро — макронуклеус — отвечает за питание, дыхание, движение, обмен веществ; малое (генеративное) ядро — микронуклеус — участвует в половом процессе.
Инфузория туфелька
В тех же водоёмах, где живут амёба протей и эвглена зелёная, встречается и это одноклеточное животное длиной \(0,5\) мм с формой тела, напоминающей туфельку — инфузория туфелька.
Строение инфузории туфельки
Инфузории-туфельки быстро плавают тупым концом вперёд, передвигаясь при помощи ресничек.
На теле инфузории имеется углубление — клеточный рот, который переходит в клеточную глотку. Около рта располагаются более крупные реснички. Они загоняют в глотку вместе с потоком воды бактерий — основную пищу туфельки. На дне глотки формируется пищеварительная вакуоль, в которую попадает пища. Пищеварительные вакуоли перемещаются в теле инфузории током цитоплазмы. В пищеварительной вакуоли происходит переваривание пищи, переваренные продукты поступают в цитоплазму и используются для жизнедеятельности инфузории.
Оставшиеся в пищеварительной вакуоли непереваренные остатки выбрасываются наружу через особую структуру в заднем конце тела — порошицу.
В организме инфузории-туфельки находятся две сократительные вакуоли, которые располагаются у переднего и заднего концов тела.
Обрати внимание!
Сократительные вакуоли выводят наружу излишек воды.
Каждая вакуоль состоит из центрального резервуара и \(5\)–\(7\) направленных к этим резервуарам каналов. Весь цикл сокращения этих вакуолей проходит один раз за \(10\)–\(20\) секунд: сначала заполняются жидкостью каналы, потом она попадает в центральный резервуар, а затем жидкость изгоняется наружу.
Как и у других свободноживущих одноклеточных животных, у инфузорий дыхание происходит через покровы тела.
Источники:
Биология. Животные. 7 кл.: учеб. для общеобразоват. учреждений / В. В. Латюшин, В. А. Шапкин. — 10-е изд., стереотип. М.: Дрофа
Константинов В. М., Бабенко В. Г., Кучменко B. C. / Под ред. Константинова В. М. Биология. 7 класс Издательский центр ВЕНТАНА-ГРАФ.
Иллюстрации:
http://cmd4win.ucoz.hu/blog/prezentacija_na_temu_bespoloe_razmnozhenie/2013-05-27-44
http://uchise.ru/kak-vyglyadyat-infuzorii.html
http://www.zoofirma.ru/knigi/kurs-zoologii-t-1-abrikosov.html?start=460
http://www.krugosvet.ru/enc/nauka_i_tehnika/biologiya
Расшифрован геном инфузории Oxytricha trifallax — эукариотический геном из 16 000 хромосом
Oxytricha trifallax — удивительный одноклеточный организм, принадлежащий к типу инфузорий. Как и все инфузории, она имеет два ядра — макро- и микронуклеус: первое обеспечивает вегетативный рост и размножение, а второе нужно для обмена генетической информацией при половом процессе. Рабочий геном макронуклеуса получается из неактивного микронуклеуса, причем этому процессу сопутствует почти полное уничтожение ДНК микронуклеуса и массовые перестройки с участием некодирующих РНК. Группа американских исследователей расшифровала геном макронуклеуса окситрихи и обнаружила, что количество хромосом у нее приближается к 16 000. Около 10% хромосом имеют изоформы (разные варианты), образующиеся в результате альтернативной сборки кусочков ДНК. Весь геном представлен почти 2000 копиями, то есть одновременно в ядре содержатся миллионы хромосом. Проанализировав геномную последовательность, авторы ответили на вопрос, каким образом Oxytricha обеспечивает столь обширную перестройку генома и как поддерживает десятки миллионов теломер (концевых структур хромосом).
Инфузория Oxytricha trifallax — дальняя родственница инфузории-туфельки Paramecium caudatum, которую можно встретить в каждой луже. Вместе с другой «туфелькой» Paramecium tetraurelia и инфузорией Tetrahymena thermophila она является излюбленным модельным организмом для изучения молекулярной биологии эукариот. Эти три вида относятся к типу ресничных, или инфузорий (Ciliata), который является подразделом большого царства простейших — древних одноклеточных эукариот. Инфузории составляют значительную часть мирового планктона, живут как в пресной, так и в соленой воде и заселили даже такие экзотические ниши, как кишечник лягушки.
Надо сказать, что инфузории всё время подкидывают ученым сюрпризы. Всё у них не как у людей: например, в генетическом коде стоп-кодоны иногда кодируют аминокислоты, хотя должны были бы обозначать окончание синтеза белка (см.: Число генов в геноме инфузории оказалось таким же, как у человека, «Элементы», 07.09.2006), а для хранения информации используется РНК вместо ДНК (см.: Программа перестройки генома записана в РНК, «Элементы», 03.12.2007). Естественно, что расшифровка геномов инфузорий представляет большой интерес для молекулярных биологов. По мнению авторитетного журнала Cell, который в начале 2013 года опубликовал обзор, посвященный особенностям генетики простейших, исследования в этой области находятся на переднем крае науки и могут существенно изменить наше представление о молекулярной биологии.
Геномы инфузорий Tetrahymena и Paramecium были прочитаны несколько лет назад, и вот наконец большой коллектив ученых из Америки представил широкой публике геном Oxytricha. По выражению авторов, это эукариотический геном с необычной архитектурой и большой степенью генетической вариабельности.
Уникальной особенностью всех инфузорий является ядерный диморфизм (или, иначе, ядерный дуализм) — наличие в одной клетке двух ядер. Такая особенность обусловлена наличием двух циклов в их жизни (рис. 2).
Если всё хорошо и еды вокруг хватает, клетки растут и размножаются вегетативно, простым делением пополам. В это время у них работает большое ядро — макронуклеус (соматическое, или вегетативное, ядро). Оно содержит функциональный геном, то есть активно транскрибирующуюся ДНК, и обеспечивает все жизненные функции клетки (это подтверждается тем, что инфузории спокойно могут воспроизводиться с одним только макронуклеусом). Второе ядро — микронуклеус (генеративное ядро) — содержит ДНК в неактивной форме и предназначено для обмена информацией с другой клеткой. Грубо говоря, это просто хранилище генома.
Если клетка решает, что наступили неблагоприятные условия (например, мало еды), она вступает в половой процесс, целью которого является обновление генофонда за счет обмена генетической информацией с другой клеткой. Вдруг новая комбинация генов в сложившихся условиях окажется полезней, чем старая? Во время полового процесса у инфузорий две клетки сливаются (происходит конъюгация) и обмениваются половинками своих микронуклеусов, которые получаются в результате деления микронуклеуса мейозом — этот тип деления ядра лежит в основе генетического разнообразия у всех эукариот. Когда в клетке появляется новый микронуклеус, находящийся в клетке макронуклеус разрушается и из микронуклеуса образуется новый макронуклеус. Теперь инфузория продолжает размножаться вегетативно, уже с новым набором генов. Таким образом, имея в одной клетке два ядра, вегетативное и генеративное, инфузории обеспечивают процесс, ради которого многоклеточным организмам приходится заводить отдельные половые клетки — гаметы. (Более подробно жизненный цикл инфузорий описан в подписи к рис. 2 и в статье Александра Маркова Программа перестройки генома записана в РНК, посвященной окситрихе.)
Важно, что, хотя микронуклеус является своеобразным хранилищем генома, образующийся из него макронуклеус в итоге содержит совсем не ту же самую генетическую информацию! ДНК, содержащаяся в микронуклеусе, содержит огромное количество некодирующих последовательностей (они называются IES — internally eliminated sequences), которые должны быть удалены. Таким образом, на первом этапе формирования функционального генома значительная часть ДНК уничтожается. Если у Tetrahymena и Paramecium выбрасывается около 30% ДНК, то у Oxytricha это 96%! Зачем хранить и бережно передавать другим клеткам такое количество ненужной ДНК — загадка.
На втором этапе оставшиеся кусочки (MDS — macronuclear destined sequences) нужно склеить в правильном порядке, чтобы получить гены. У окситрихи в микронуклеусе они содержатся не по порядку, как у других инфузорий, а хаотично (см. рис. 3). Для правильной сборки необходима РНК-матрица — длинные некодирующие молекулы РНК (это уникальная особенность окситрихи; подробнее см. всё в той же статье Программа перестройки генома записана в РНК).
Наконец, получившиеся фрагменты ДНК подвергаются амплификации, то есть увеличивается количество их копий. Если микронуклеус содержит просто компактизованный клубок ДНК, практически неактивной, то в результате описанных процессов формируется макронуклеус, содержащий рабочий геном, состоящий из огромного количества маленьких хромосом (исследователи называют их нанохромосомами). Нанохромосомы — это еще одно отличие окситрихи от других модельных инфузорий.
Итак, американские исследователи сумели разобраться в этом хаосе и расшифровали геном макронуклеуса окситрихи (в настоящее время они работают над расшифровкой содержимого микронуклеуса). Размер генома — около 50 миллионов пар оснований. Он заключен примерно в 16 000 нанохромосомах, размер которых составляет от 500 до 66 тысяч пар нуклеотидов (для сравнения, у Tetrahymena и Paramecium хромосом «всего» около 200, у человека в соматических клетках хромосом — 46, а у культурных растений число хромосом достигает нескольких сотен). Все хромосомы представлены большим количеством копий. В среднем, геном окситрихи размножен примерно в 2000 раз, то есть реально в ядре одновременно присутствуют миллионы хромосом!
Удивительно, что количество копий, судя по всему, строго не регулируется, и при делении хромосомы расходятся по дочерним клеткам как попало. Некоторые колебания в количестве копий хромосом соотносятся с колебаниями уровней экспресии соответствующих генов, но, судя по всему, изменение копийности не является средством регуляции экспресии. Также в процессе геномных перестроек некоторые фрагменты ДНК могут «нарезаться» и «склеиваться» по-разному, что приводит к образованию изоформ (то есть различных вариантов) примерно у 10% хромосом (интересная аналогия с альтернативным сплайсингом у других эукариот). Такое ощущение, что у инфузорий РНК и ДНК поменялись ролями — РНК необходима для хранения информации, а ДНК подвергается перестройкам и редактированию! Количество генов в геноме окситрихи достигает 18,5 тысяч, причем большинство нанохромосом содержит всего один ген. Интересно, что альтернативной фрагментации подвергаются именно те немногие хромосомы, которые содержат несколько генов (максимум 8 на одной хромосоме).
Несмотя на обилие в клетке нанохромосом, каждая из них, как и полагается, ограничена по краям теломерами — структурами, которые необходимы для предотвращения укорачивания хромосом в процессе репликации. Эти структуры представляют собой множество коротких повторов, с которыми связаны специальные белки. Чем большее число раз клетка поделится, тем меньше остается повторов. Фермент теломераза обеспечивает воспроизводство теломер на основе собственной РНК-матрицы. (У млекопитающих в соматических клетках теломераза неактивна, поэтому клетки могут поделиться ограниченное число раз, что является одной из причин старения. Теломераза работает только в стволовых и половых клетках, а также в клетках раковых опухолей — это позволяет им неограниченно делиться.)
Большое количество теломер, очевидно, требует большого количества белков, участвующих в их формировании. Неудивительно, что в геноме окситрихи обнаружились специфичные для нее гены (их нет у других инфузорий), кодирующие дополнительные белки, необходимые для поддержания теломер. Это 9 новых генов, произошедших от двух предковых в результате удвоений участков генома (такие гены называются паралогами). Все эти белки являются структурными, то есть связываются с повторами ДНК в составе теломер. Теломераза у окситрихи всего одна. Учитывая роль теломер и теломеразы в таких процессах, как старение и развитие рака, изучение того, как окситрихия справляется с миллионами теломер, может подкинуть интересные идеи ученым, работающим в области биомедицины.
Вернемся к крайне сложным перестройкам генома, характерным для окситрихи. Возникает вопрос: откуда так много ненужных последовательностей, от которых приходится избавляться? Самой вероятной гипотезой является «нашествие» транспозонов — своеобразных паразитических последовательностей ДНК, способных перемещаться в пределах генома хозяина, — которое когда-то пришлось пережить инфузориям. Существует несколько разновидностей транспозонов, и некоторые из них, для того чтобы перемещаться, пользуются специальным ферментом — транспозазой (чаще всего она закодирована в последовательности транспозона), которая осуществляет вырезание мобильного элемента из ДНК. Судя по всему, в процессе эволюции инфузории «одомашнили» транспозазы и стали ими пользоваться для удаления из генома последовательностей (IES), произошедших от транспозонов. В геномах макронуклеусов Tetrahymena и Paramecium имеется копия транспозазы из класса PiggyBac, а в геноме микронуклеуса Oxytricha найдено множество копий гена транспозазы класса Tc1/mariner (см. обзор: Plasterk R.H., 1999. Resident aliens. The Tc1/mariner superfamily of transposable elements, PDF, 240 Кб) — это огромный класс мобильных элементов, распространенных практически у всех организмов, начиная от грибов и заканчивая человеком.
В пользу того, что у современных инфузорий транспозазы работают на благо хозяина, вырезая IES-последовательности, говорит тот факт, что их ингибирование приводит к накоплению высокомолекулярной ДНК и наличию транспозонов в МАК-геноме (в норме все транспозоны из макронуклеуса удаляются). Проанализировав МАК-геном окситрихии, исследователи обнаружили еще два класса «домашних» транспозаз, которые могут участвовать в перестройке генома в процессе формирования макронуклеуса. По-видимому, для той же цели (борьбы с транспозонами), у окситрихи появилась система коротких и длинных некодирующих РНК, принимающих участие в перестройке генома.
В свете открытий последних лет молекулярная биология ресничных инфузорий представляется как набор универсальных механизмов, которые у многоклеточных эукариот представлены в сильно редуцированном и упрощенном виде. Если мы хотим глубже понимать природу геномных перестроек, происходящих при многих болезнях, такие модели, как Oxytricha trifallax, являются просто кладезем информации. Мобильные элементы, регуляция сборки генома некодирующими РНК, эпигенетическое наследование с участием РНК — всё это в изобилии имеется у одноклеточной инфузории, которую удобно размножать в лаборатории.
Источники:
1) Estienne C. Swart, John R. Bracht, Vincent Magrini, Patrick Minx, Xiao Chen, et al. The Oxytricha trifallax Macronuclear Genome: A Complex Eukaryotic Genome with 16,000 Tiny Chromosomes // PLOS Biology. 2013. V. 11(1): e1001473. Doi:10.1371/journal.pbio.1001473.
2) John R. Bracht, Wenwen Fang, Aaron David Goldman, Egor Dolzhenko, Elizabeth M. Stein, Laura F. Landweber. Genomes on the edge: programmed genome instability in ciliates // Cell. 31 January 2013. V. 152. Issue 3. P. 406–416. Doi: 10.1016/j.cell.2013.01.005.
См. также:
1) Число генов в геноме инфузории оказалось таким же, как у человека, «Элементы», 07.09.2006.
2) Программа перестройки генома записана в РНК, «Элементы», 03.12.2007.
Дарья Спасская
ИНФУЗОРИИ • Большая российская энциклопедия
В книжной версии
Том 11. Москва, 2008, стр. 500
Скопировать библиографическую ссылку:
Авторы: С. А. Карпов
Схема строения инфузории туфельки (по Ю. И. Полянскому и А. А. Стрелкову): 1 – комплекс сократительных вакуолей; 2 – макронуклеус; 3 – экструсомы; 4 – реснички; 5 – пищев…
ИНФУЗО́РИИ, цилиаты (Ciliophora), подтип ресничных одноклеточных эукариот (протистов) типа Alveolata (ранее рассматривались как тип простейших). Объединяет более 8 тыс. видов, населяющих разнообразные биотопы: морские и пресные воды, почву, термальные источники, айсберги, пустыни. Длина клетки от 15 мкм до 3 мм. Для И. характерно наличие многочисл. ресничек, кортекса (покровы и подстилающие скелетные структуры), двух типов ядер и полового процесса в форме конъюгации. У большинства И. есть спец. ротовое отверстие в форме воронки, на дне которой формируются пищеварит. вакуоли. Последние перемещаются по определённому пути внутри клетки, переваривая пищу (бактерии, мелкие водоросли). Непереваренные остатки удаляются путём экзоцитоза через т. н. порошицу (цитопрокт). Избыток жидкости у пресноводных видов выводится через комплекс сократительных вакуолей.
Реснички расположены продольными рядами; в области ротового отверстия формируют поперечные или косые ряды. Они служат для передвижения (плавания и ползания), а также участвуют в процессе питания, подгоняя пищевые частицы ко рту. Реснички могут быть собраны в «кисточки» (напоминают конечности и используются для «шагания» по субстрату) или в уплощённые группы (мембранеллы). Кортекс состоит из пелликулы, образованной клеточной мембраной и подстилающим её слоем альвеол [уплощённых пузырьков, в которых могут откладываться белковые (напр., род Euplotes) или кальцинированные полисахаридные (напр., род Coleps) пластинки], и инфрацилиатуры, сформированной основаниями ресничек (кинетосомами) и отходящими от каждой кинетосомы (или пары кинетосом) тремя корешками, состоящими из микротрубочек и микрофиламентов (см. Цитоскелет). В кортексе находятся также выстреливающие органеллы – экструсомы (напр., трихоцисты, токсицисты, гаптоцисты), служащие как для защиты, так и для нападения (при раздражении они выбрасывают наружу своё содержимое, поражая жертву). Среди И. часто встречаются хищники (напр., представители рода Didinium), нападающие на др. протистов; крупные И. рода Dileptus могут питаться многоклеточными животными (неск. особей нападают на крупную добычу и поедают её, разрывая на куски). Сидячие хищники из подкласса суктории (Suctoria), напр. Tokophrya, отличаются от других И. отсутствием ресничного покрова и рта на поздних стадиях развития: их шаровидные клетки имеют радиальные цитоплазматич. выросты (щупальца). С помощью экструсом эти И. парализуют проплывающую мимо жертву; содержимое последней попадает внутрь клетки через щупальце и переваривается.
И. имеют один или неск. макронуклеусов – крупных, часто различающихся размером и строением, соматич. ядер, содержащих неполный набор многократно повторенных (амплифицированных) генов, обеспечивающих метаболизм, а также одно или неск. мелких диплоидных генеративных ядер – микронуклеусов, которые являются хранителями наследственной информации, почти не участвуют в жизнедеятельности клетки, но обеспечивают половой процесс. Во время последнего две особи одного вида частично сливаются друг с другом, микронуклеусы делятся путём мейоза, в результате чего в каждой особи остаётся по 2 гаплоидных ядра (остальные дегенерируют), одно из которых мигрирует в клетку-партнёра и сливается с оставшимся в клетке ядром, восстанавливая диплоидный набор хромосом. После такого обмена генетич. материалом партнёры разделяются; макронуклеусы разрушаются и воссоздаются заново из модифицированных микронуклеусов. Каждая особь, образовавшаяся в результате полового процесса, становится потенциальным родоначальником нового клона, который создаётся путём бесполого размножения (клетка делится поперёк на две дочерние; одна из них, получившая материнское ротовое отверстие, формирует новый задний конец – цитопрокт, другая – достраивает ротовой аппарат).
Большинство И. свободноживущие, но есть и комменсалы (в рубце жвачных), и паразитич. виды родов ихтиофтириус, балантидий; многие содержат симбиотич. бактерии и водоросли. Водные И. играют важную роль в биологич. очистке сточных вод, многие служат пищей для молоди рыб. И. – одна из наиболее изученных групп эукариот. Некоторые виды используются в качестве модельных объектов в науч. исследованиях, напр. Tetrahymena thermophila и инфузория туфелька (Paramecium caudatum).
Тест на тему: » Инфузория туфелька»
Готовимся к ЕГЭ
Тест на тему: « Инфузория туфелька»
Выполнил: учитель химии – биологии Алиев Сагынган Кабирович МБОУ «Фоминская СОШ» Называевского муниципального района Омской области
Категория А .
Вариант № 1.
Каков приблизительно размер инфузории туфельки?
0, 01 – 0, 03 мм
0, 1 – 0, 3
1 – 3 мм
10 – 30 мм
Какой конец тела инфузории туфельки является более острым?
Передний конец
Задний конец
Какой из двух слоев цитоплазмы инфузории туфельки является более плотным. Чем другой ?
внутренний слой
наружный слой
Назовите структуры, с помощью которых инфузория туфелька передвигается.
жгутики
реснички
ложноножки
Что в переводе с латинского означает слово « инфузория »?
изменчивая
настойка
трава
двигающаяся
Назовите участок тела инфузории туфельки, в котором расположен желобок, заканчивающийся ротовым отверстием.
передний конец
задний конец
боковая сторона
Назовите участок тела инфузории туфельки, который содержит наиболее длинные реснички.
передний конец тела
задний конец тела
края желобка, заканчивающегося ротовым отверстием
В каком направлении у инфузории туфельки проходит желобок, заканчивающийся ротовым отверстием?
от заднего конца до середины тела
от переднего конца до середины тела
от середины до заднего конца тела
от середины до переднего конца тела.
В каком участка тела инфузории туфелька начинается деление её цитоплазмы?
в переднем конце тела
в заднем конце тела
в середине тела
Назовите структуру инфузории туфельки, через которую она выбрасывает непереваренные остатки пищи.
глотка
ротовое отверстие
порощица
канал сократительной вакуоли
Сколько ядер у инфузории туфельки?
1
2
3
4
Сколько сократительных вакуолей у инфузории туфельки?
1
2
3
4
В каком порядке ( относительно друг друга ) сокращается две сократительные вакуоли инфузории туфельки?
одновременно
попеременно
Назовите периодичность сокращений сократительной вакуоли инфузории туфельки.
2 – 2, 5 с
20 – 25 с
2 – 2. 5 мин
20 – 25 мин
Как у инфузории туфельки называют особый участок поверхности тела, через который непереваренные остатки пищи удаляются из пищеварительной вакуоли?
порошица
анальное отверстие
клоака
выделительное отверстие
рот
Назовите структуру инфузории туфельки, из которой непереваренные остатки пищи через порошицу удаляются наружу.
сократительная вакуоль
глотка
пищеварительная вакуоль
ядро
Назовите наиболее существенный признак, по которому два ядра инфузории туфельки отличаются друг от друга.
размер
цвет
расположение в клетке
форма
Где в теле инфузории туфельки располагаются два ядра?
в средней части тела
в передней части тела
в задней части тела
в одно – в передней части тела, в другое – в задней
Назовите структуру инфузории туфельки, которая удаляет наружу излишек воды и вредные продукты обмена веществ.
порошица
глотка
сократительная вакуоль
пищеварительная вакуоль
Что происходит с питанием инфузории туфельки во время её деления?
ослабевает
прекращается
усиливается
С какого участка начинается и в каком направлении происходит деление цитоплазмы инфузории туфельки во время размножения?
начинается с переднего конца и идет вдоль всего тела
начинает с заднего конца и идет вдоль всего тела
начинается в средней части тела и идет поперек тела
Где в теле инфузории туфельки располагаются сократительные вакуоли?
в средней части тела
в передней части тела
в задней части тела
одна – в передней части тела, а другая – в задней.
Категория А .
Вариант № 2.
Назовите структуру простейших, на которую по своему строению похожи реснички инфузории туфельки.
жгутик
ложноножка
Какие движения совершают реснички инфузории туфельки?
вращательные
волнообразные
возвратно – поступательные
Что для инфузории туфельки является обычной пищей?
бактерии
амёбы
мелкие водоросли
комочки органического вещества
Назовите участок тела инфузории туфельки, в области которой захватывающая пища поступает непосредственно в цитоплазму этого простейшего.
ротовое отверстие
нижний слепозамкнутый участок глотки
порошица
передний открывающийся наружу участок глотки
Назовите участок тела инфузории туфельки, в области которого образуется пищеварительная вакуоль.
ротовое отверстие
нижний слепозамкнутый участок глотки
порошица
передний открывающийся наружу участок глотки
Назовите участок тела инфузории туфельки, в котором происходит разрушение крупных питательных веществ до более простых химических соединений, поступающих затем в цитоплазму.
сократительная вакуоль
глотка
порошица
пищеварительная вакуоль
малое ядро
большое ядро
Процесс выделения у инфузории туфельки характеризуется некоторыми особенностями. Что из нижеперечисленного связано НЕ с процессом выделения, а с другим проявлением жизнедеятельности инфузории туфельки?
удаляется избыток воды
удаляется вредные продукты обмена веществ
осуществляется двумя сократительными вакуолями
удаляемые вещества поступают в сократительную вакуоль по приводящим канальцам
непереваренные остатки пищи удаляются через порошицу
Назовите у инфузории туфельки процесс, в котором главная роль принадлежит малому ядру.
движение
питание
дыхание
размножение
выделение
В каком направлении на теле инфузории туфельки расположены ряды многочисленных ресничек?
поперек её удлиненного тела
вдоль её удлиненного тела
Какова ( приблизительно ) обычная продолжительность интервала, через который инфузории туфелька приступает к очередному делению?
минута
час
сутки
месяц
При делении старой инфузории туфельки одна из двух её сократительных вакуолей оказывается в одной новой инфузории, а другая – в другой инфузории. Как в каждой из этих новых инфузорий образуется вторая сократительная вакуоль?
вакуоль старой инфузории делится на две вакуоли
образуется заново
Назовите ядро, которому у инфузории туфельки принадлежит главная роль в размножении.
малое ядро
большое ядро
Сколько приводящих канальцев обычно подходит к каждой сократительной вакуоли инфузории туфельки?
2 – 3
5 – 8
10 – 15
Инфузория туфелька имеет более сложное строение по сравнению с такими простейшими, как обыкновенная амёба и зеленая эвглена. Что из перечисленного НЕ является отражением характерного для инфузории более сложного строения?
два ядра, выполняющие разные функции
две сократительные вакуоли
порошица
глотка
рот
предротовой желобок
многочисленные реснички
пищеварительные вакуоли
приводящие канальцы сократительных вакуолей
Какую форму имеет большое ядро инфузории туфельки?
шаровидную
веретеновидную
кольцевидную
спиралевидную
бобовидную
.Назовите ядро инфузории туфельки, которое оказывает влияние в основном на
процессы движения, питания и выделения .
малое ядро
большое ядро
У инфузории туфельки пищеварительная вакуоль, образовавшись в области
глотки, перемещается затем по цитоплазме. В которую часть тела инфузории
образовавшаяся пищеварительная вакуоль направляется в первую очередь?
в переднюю часть тела
в заднюю часть тела
Назовите участок тела инфузории туфельки, в котором расположена порошица,
через которую из пищеварительной вакуоли непереваренные остатки пищи
выбрасывают наружу.
передняя часть тела
средняя часть тела
задняя часть тела
Какое из двух ядер инфузории туфельки при размножении делится первым?
малое ядро
большое ядро
Что из перечисленного ниже привлекает к себе инфузории туфелек?
раствор поваренной соли
скопление бактерий
Что произойдет с частотой пульсации сократительных вакуолей инфузории туфельки, если её переместить из естественной среды в дистиллированную воду?
уменьшится
не изменится
увеличится
Что из перечисленного ниже НЕ характерно для строения глотки инфузории туфельки?
начинается ротовым отверстием
имеет короткий размер
имеет вид трубки
имеет боковые ответвления
заканчивается слепо
Ключи к тесту: « Инфузория туфелька»
Категория А.
Вариант № 1
Категория Б
Вариант № 2
Фотографирование инфузорий — канадский фотограф природы
доктора Роберта Бердана
17 июля 2018 г.
Spirostomum минус (вверху) и Urocentrum turbo (внизу) — оба являются обычными инфузориями в пресной воде. ДИК (дифференциальная интерференционная микроскопия) Микрон = 1 \ 1000 миллиметра.
Введение в инфузории
Возможно, вы познакомились с Paramecium на уроках биологии, одноклеточной (одноклеточной) «простой» инфузории, обнаруженной в воде пруда.Только инфузории не простые, а одни из самых сложных клеток на планете. У них сложный цитоскелет (поддерживающая сеть микротрубочек и нитчатых волокон), реснички нескольких разных типов, 2 разных типа ядер и бывают самых разных форм и размеров. Инфузории можно найти везде, где есть вода; в прудах, ручьях, озерах, океанах, почве и воде внутри и вокруг растений, мхов и печеночников. Неизвестно, сколько существует видов, но описано около 9000 видов, а оценки предполагают, что их может быть до 30 000 или больше.Большинство инфузорий микроскопические по размеру, но некоторые достигают 4 мм в длину (например, Stentor).
Реснички — это небольшие волосовидные образования, покрывающие большинство инфузорий на определенном этапе их жизненного цикла. Реснички означают «ресницы». У организмов могут быть реснички разного размера. Реснички используются для передвижения, а также для направления пищи в рот. Реснички могут быть объединены в длинные пластинки (волнистые мембраны) или расположены в виде серии коротких вымпелов; они могут образовывать подвижные пучки (усики) или жесткие щетинки (щетинки).Однако не наличие ресничек характеризует эту группу, а наличие двух типов ядер — макронуклеуса и микронуклеуса.
Spirostomum minus — ДИК-микроскопия
Макронуклеус часто бывает большим и иногда легко просматривается внутри клеток, он также полиплоидный (содержит несколько копий генов). Функция макронуклеуса — регулировать метаболизм и повседневные функции клеток. Может быть одно или несколько микроядер, которые участвуют в генетике и обмене ДНК.
Размножение обычно происходит путем двойного деления по длинной оси, и они также могут подвергаться конъюгации, когда они обмениваются генетическим материалом с другими инфузориями того же вида. Конъюгация включает частичное слияние парных клеток, обеспечивающее взаимный обмен генетическим материалом. При сингамии две клетки полностью сливаются. Их также можно воспроизвести с помощью множества других методов (см. Ниже). После примерно 200 делений клеток у некоторых инфузорий проявляются признаки старения, и реорганизация их ДНК во время конъюгации каким-то образом восстанавливает их жизнеспособность и снова делает их молодыми.
Большинство инфузорий делятся бинарным делением, но они могут размножаться, используя множество других методов, показанных выше. Диаграмма любезно предоставлена Википедией Deuterostome.
Paramecium caudatum делится. Я обычно вижу деление инфузорий по вечерам. Обычно они продолжают двигаться во время деления, возможно, чтобы избежать нападения хищников.
Инфузория делительная
Два scuticociliates Dexiotricha granulosa с кольцеобразными гранулами гликогена в цитоплазме, соединенными вместе, возможно, подвергающимися конъюгации.(ID любезно предоставлен Брюсом Тейлором — видео на YouTube).
Еще две инфузории, которые, по-видимому, подвергаются спряжению.
Палинтомия — процесс, во время которого большая родительская клетка подвергается быстрой последовательности повторяющихся делений без прерывания роста. Стрелки указывают на границы между 4 инфузориями Colpoda. Несколько кадров были извлечены из фильма и наложены фокусировки, DIC-микроскопия 600X.
Большинство инфузорий проглатывают пищу через цитозомы, когда проглоченная пища оказывается заключенной в пищевую вакуоль.Переваренное пищевое содержимое высвобождается через анус инфузорий, который может быть хорошо определен (цитопрокт). Инфузории также содержат одну или несколько сократительных вакуолей, которые служат для удаления избытка воды или ионов, которые попадают в клетки путем осмоса. В Paramecium вы можете наблюдать, как сократительная вакуоль расширяется и сжимается через равные промежутки времени. Положение сократительной вакуоли может быть полезно для идентификации некоторых видов.
Spirostomum минус с адоральной зоной мембранелл (более крупных ресничек) на правой стороне тела почти на половину длины тела.600-кратная ДИК-микроскопия.
Выше, Spirostomum минус задний конец, сократительная вакуоль находится в более темной области, и вы можете увидеть спиральный узор на пленке, состоящей из кортикальных гранул. 600-кратная ДИК-микроскопия.
Ресничная кора (внешнее покрытие) демонстрирует особенности, используемые для характеристики и идентификации различных видов, а также их форму и приблизительный размер. Кора головного мозга часто делится на две области: соматическую (тело) и оральную.Ресничная структура вокруг ротовой полости важна для классификации организмов. Элемент коры — это кинетида, состоящая из одной или нескольких кинетосом с их фибриллами и ресничками. Кинети — это просто ряды ресничек (кинети — это один ряд ресничек). Соматические кинетиды могут иметь 1, 2 или более кинетосом, посредством которых образуются реснички. Наличие и распределение кинетид на поверхности тела — характеристика таксона.
Обтекаемая, как космический корабль пришельцев, эта инфузория способна быстро плавать.Я нашел его во мхе, когда искал водяных медведей (Tardigrades). Инфузория уплощена дорсально — вентрально. Phacodinium metchnikoffi , по-видимому, является редкой инфузорией (см. Публикацию M. Kruetz и W. Foissner, стр. 141 — бесплатный PDF-файл с превосходными микрофотографиями).
У некоторых инфузорий отсутствует цистосома, и они приобретают питательные вещества на поверхности клетки путем адсорбции и пиноцитоза (попадания в организм мелких мембранных пузырьков). Сукторианцы — это группа инфузорий, которые во взрослой жизни ведут оседлый образ жизни без ресничек и глотают пищу на концах длинных щупалец (см. Ниже).
Вверху — сукторианец с длинными щупальцами, используемыми для захвата добычи ( Podophyra fixa ). Фазово-контрастная микроскопия, микроскоп Olympus E. У этих инфузорий есть реснички только на ранней стадии. Часто они размножаются внешним почкованием.
Spathidium spathula , обнаруженная во мхе при поиске водяных медведей, область рта (вверху) заметно опухла.
Реснички не ограничиваются инфузориями, но встречаются у многих других животных, и на самом деле реснички отвечают за удаление пыли и других патогенов из наших легких.Однако у многих инфузорий реснички позволяют им быстро передвигаться, возвращаться назад и даже вращаться, что порой затрудняет фотографирование этих организмов. Чтобы получить резкие снимки, мне нужно использовать короткую выдержку (1 \ 500 секунды или быстрее) или ловить животных, удаляя воду из-под верхнего покровного стекла фильтровальной бумагой (см. Мою статью Советы по созданию лучших снимков с помощью микроскопа) . Техника сжатия, кажется, работает с некоторыми из более крупных инфузорий. Еще один способ замедлить рост инфузорий — повысить вязкость воды (например,грамм. добавление метилцеллюлозы). Слегка нагревая предметное стекло микроскопа в течение нескольких секунд под пламенем, можно также остановить или замедлить их движение, но часто это приводит к свариванию организмов, и вскоре после этого они лопаются. Также можно использовать высокоскоростную вспышку, чтобы остановить движение некоторых инфузорий.
Urocentrum turbo (семейство Parameciidae) — быстро движущиеся инфузории, обнаруживаемые в воде пруда, часто вместе с Paramecium. Они вращаются и двигаются беспорядочно.
Самая быстрая инфузория на планете?
Halteria sp — вид сбоку, на котором видны некоторые длинные щетинки, такие как cirri
Halteria sp — вид сверху вниз, демонстрирующий адоральную зону мембранелл.Этот организм может перемещаться в сотни раз больше своего тела менее чем за секунду и часто исчезает из поля зрения при наблюдении в световой микроскоп.
Схема Halteria от C.R. Curds (1982) British and Other Freshwater Ciliated Protozoa. Издательство Кембриджского университета. Лондон (стр. 439).
Halteria — это небольшая, но обычная инфузория, встречающаяся в прудовой воде. Что делает эту инфузорию интересной, так это то, что в какой-то момент она будет лежать неподвижно, а затем будет казаться, что она выпрыгивает из поля или через горку на очень высокой скорости — как прыжок на варп-драйв.Исследование с использованием высокоскоростного цифрового видео зафиксировало биение ресничек Halteria grandinell между 105 и 260 Гц (циклов в секунду). Эти частоты являются самыми высокими, наблюдаемыми для ресничек и жгутиков, о которых сообщалось на сегодняшний день (2005).
На изображениях выше показаны гигантская инфузория Spirostomum минус и меньшая Paramecium caudatum .
Идентифицировать разные инфузории сложно, потому что существует очень много разных форм и разновидностей, и многие из них могут быстро перемещаться.Таксономия этих организмов также меняется, поскольку все больше исследователей применяют методы молекулярной биологии для анализа сходств и различий.
В этой статье я покажу несколько довольно распространенных инфузорий. Я почти всегда сталкиваюсь с новыми, которых никогда раньше не видел, в любой кувшине с прудовой водой, которую собираю. Меня интригует большое разнообразие инфузорий. Я купил несколько книг и руководств, чтобы помочь мне идентифицировать многие организмы, а также отправляю фотографии другу и эксперту по инфузории (Брюсу Тейлору) для проверки или исправления.Однако не обязательно уметь идентифицировать каждый вид, чтобы оценить его.
Инфузории встречаются в водоемах круглый год, даже подо льдом. Можно также культивировать инфузории, производя слияние сена, когда сено помещается в воду с небольшим количеством сухого молока, зерна пшеницы или риса (подробнее читайте на сайте Microbe hunter). Инфузории питаются бактериями, которые, в свою очередь, питаются сухим молоком или зерном. Я сделал несколько инфузий сена, когда был моложе, когда хотел наблюдать за простейшими в течение зимних месяцев.Вы также можете приобрести инфузорий для занятий в классе или частного обучения, например, Бореальная наука. В феврале этого года я купил несколько Paramecium и несколько других беспозвоночных в компании Boreal — маленькая трубка стоит всего 12 долларов. В остальное время года в любом водоеме могут быть инфузории. Вы даже можете собрать дождевую воду со своей крыши, чтобы увидеть инфузорий и других протистов (см. Мою статью «Микроскопическая жизнь в прудах и дождевой воде»). Я также использую центрифугу, которую купил на Киджджи, чтобы сконцентрировать некоторые пробы воды.Обычно я вращаю пробы воды в течение 2 минут при 1800 г — хотя часто я могу найти много инфузорий и других организмов, взяв пробы воды из кувшина и / или включая некоторые водные растения.
Colpoda cucullus (Класс: Colpodea). Инфузории, которые у хорошо питающихся особей забиты до 200 компактными пищевыми вакуолями размером 5-8 мкм. Эти инфузории среднего размера обычны и часто имеют бобовидную форму. Это одни из первых инфузорий, появившихся в настое сена.Они часто встречаются в почве и мхе из-за их способности образовывать цисты. Питаются в основном бактериями. Узнайте больше и посетите веб-сайт EOL для более подробного описания этого вида.
Неопознанные реснички среднего размера с мембранами вокруг переднего конца, несколькими крупными макронуклеарами и заметной сократительной вакуолью. Гетеротрих.
Vorticella или Pseudovorticella — это инфузория Перитриха, которая прикрепляется к субстрату с помощью выдвигающейся ножки.Стебель может быстро сокращаться, и инфузории часто встречаются группами, прикрепленными к подводным растениям. Реснички переносят бактерии в свои цитозомы вместе с другими небольшими организмами, такими как водоросли — по сути, они являются питателями-фильтрами. У них крупное С-образное макронуклеус (больше фотографий смотрите в моей статье о простейших). ДВС-микроскопия — узнайте больше о Vorticella. Примечание Pseudovorticella имеет вид кирпичной кладки, тогда как Vorticella имеет боковые гофры на своей поверхности.
Peritrich, у которого стебель был коротким и не сокращался, как у Vorticella. Класс: Oligohymenophorea; Подкласс: Peritrichia — эпистилид.
Peritrich — Epistylis sp на широкой плоской ножке, не сократительной.
На двух фотографиях выше — это фаза роевой (телотрох) инфузории перитриха — вероятно, Vorticella. Во время роения они сбрасывают стебли, приобретают несколько цилиндрическую форму и в задней части образуют венец из ресничек.Большинство перитрихов имеют фазу телотроха (идентифицированную Брюсом Тейлором). Посмотрите видео Брюса Тейлора и прочтите дополнительную информацию о телотрохах на сайте www.microscopy-uk.org.uk.
Сначала я подумал, что это Stylonchia mytilus , очень часто встречающаяся в прудовой воде и почве инфузория. Он имеет три длинных усика сзади и реснички, сгруппированные в мембранеллы вдоль рта и усики над телом. Однако эксперт по инфузориям Брюс Тейлор предположил, что это, вероятно, Tetmemena , поскольку три представителя Stylonchia были перемещены в этот род несколько десятилетий назад.
Самый простой способ понаблюдать за инфузориями и другими простейшими — это собрать воду из пруда, канавы, края ручья, озера, лимана или налить немного бутилированной или дистиллированной воды на сухой мох или почву в посуде и подождать час, затем исследовать немного воды на предметном стекле микроскопа с помощью микроскопа. Подойдет простой микроскоп с подсветкой светлого поля. Я начал с игрушечного микроскопа за 30 долларов. Интерес к микроскопии привел меня к карьере в области клеточной биологии и фотографии природы.Микроскопы с фазовым контрастом или дифференциальной интерференцией облегчат просмотр инфузорий, поскольку большинство протистов полупрозрачны, но любой приличный микроскоп с увеличением 100-400X позволит вам увидеть и изучить эти организмы. Вы также можете окрасить инфузории, хотя это обычно убивает их, и вы не можете наблюдать за их интересным поведением — для получения дополнительной информации о подготовке образцов см. Бесплатный PDF-файл — Протоколы по протозоологии.
Hypotrich — инфузория неустановленная. Hypotrichs обладают составными цилиарными органеллами, называемыми «усиками», которые состоят из толстых пучков ресничек, редко расположенных на вентральной поверхности клетки.
Выше две фотографии неопознанной инфузории с эндосимбиотическими водорослями и одиночного крупного макронуклеуса. Некоторые инфузории поедают зеленые водоросли ( Chlorella sp ) или приобретают их от предыдущих поколений. Эти водоросли не перевариваются, но образуют симбиотические отношения со своим хозяином.Водоросли делятся с хозяином сахарами, которые они производят посредством фотосинтеза, а хозяин, в свою очередь, обеспечивает им некоторую защиту и питательные вещества. Не совсем понятно, почему некоторые проглоченные водоросли не перевариваются и как водоросли могут связываться со своим хозяином, чтобы высвобождать для них сахар. Симбиотические водоросли могут передаваться из поколения в поколение и могут быть тесно интегрированы с клеткой-хозяином и даже могут сохраняться в форме кисты. В лабораторных условиях некоторые инфузории могут быть лишены своих симбионтов и повторно инфицированы новыми, но неизвестно, как часто это происходит в природе.Филогенетический анализ показывает, что штаммы Chlorella в различных инфузориях связаны друг с другом и отличаются от «диких» chlorellae (личное сообщение Брюса Тейлора — дополнительную информацию см. В этой ссылке).
Stentor polymorphus с эндосимбиотическими водорослями внутри. Светлопольная микроскопия.
Инфузории, заполненные зелеными водорослями (эндосимбиотическими) — возможно, Holophyra ovum (идентификатор предложен Брюсом Тейлором).
Trachelius ovum — эта необычная инфузория выбрасывала часть своего клеточного содержимого, когда была захвачена покровным стеклом, чтобы стать меньшим организмом. Его тело кажется очень хрупким, и это может быть механизмом, позволяющим избежать хищников. Ниже вы можете увидеть тот же организм после того, как он избавился от своих внутренних компонентов. Рот круглый, расположен у основания короткого хоботка.
Trachelius ovum — рядом с частями тела линяет.Это необычное поведение наблюдалось ранее в Trachelius и сообщалось в J. of Natural History С. Г. Фоулком, 2009 г., в котором описаны наблюдения мистера Чарльза Робертсона в 1867 г. См. Также наблюдения К. Гегенбаура (1857 г.).
Trachelius ovum — после изгнания частей тела.
Flattened Trachelius ovum — иногда под давлением покровного стекла этот организм просто взрывается на куски.
Nassophorean Nassula ornata — его рот ведет к частоколу из палочек или нематодесм, видимых внутри клетки в правом верхнем углу (яркая белая область). Тело яйцевидной формы, равномерно реснитчатое, с одним макронуклеусом (белый кружок). Они питаются сине-зелеными водорослями, и когда водоросли расщепляются, они могут приобретать различные яркие цвета. Класс: Nassophorea, отряд Nassulida, семейство: Nassulidae. Узнайте больше и просмотрите видео об этом микроорганизме.
Nassula ornata — инфузорий с одной нитью сине-зелёных водорослей (цианобактерии — прокариоты, клетки без ядерной мембраны), видимой внутри справа ( Anabaena sp).
Оральная область, кажется, составляет более 2/3 вентральной поверхности. Lembadion lucens. Посмотрите видео об этой инфузории на YouTube.
Frontonia atra с гранулами темного пигмента. Я думал, что темные гранулы могут быть бактериями, живущими внутри, но это могут быть просто гранулы темного пигмента. В целом было обнаружено, что инфузории являются хозяевами 60 различных видов бактерий.
Инфузории можно окрасить метиленовым синим, нейтральным красным или йодом Люголя, хотя это может или убьет их.Также вы можете использовать технику, называемую микроскопией темного поля, которая представляет инфузории на черном фоне (см. Выше Nassula sp ), и организмы имеют тенденцию светиться белым. Эту технику можно имитировать, поместив монету на источник света или под конденсатор на фильтре. Косое освещение можно создать, поместив держатель фильтра конденсатора частично перед источником света, и это создаст трехмерный вид образцов, напоминающий микроскопию ДИК.Конечно, вам понадобятся несколько предметных стекол для микроскопа, покровные стекла и пипетка, чтобы нанести на предметное стекло каплю воды из пруда для просмотра.
Выше одна инфузория, кажется, пожирает другую. Я наблюдал за ними в течение 45 минут, как они боролись, часто сильно трясясь, когда кто-то пытался убежать.
Кисты
Из тысяч известных на данный момент видов инфузорий только один, Balantidium coli , как известно, вызывает заболевания у людей.Его обычным хозяином являются свиньи, и заражение может произойти при употреблении воды, зараженной цистами этой инфузории. Многие пресноводные инфузории, простейшие и другие беспозвоночные способны пережить иссушение, образуя цисты. Я вижу много цист в своих образцах из пруда, но трудно определить, к какой группе организмов принадлежат цисты, за исключением, возможно, некоторых цист коловраток, где я могу увидеть их мастакс (челюсти) через оболочку кисты.
Выше только одна из сотен различных неопознанных цист или яиц, которые я видел в воде пруда.Кисты позволяют многим микроорганизмам пережить иссушение, но, за исключением некоторых цист коловраток и тихоходок, по ним трудно определить, к каким организмам они принадлежат.
Lacrymaria olor инфузория с длинной растяжимой «шейкой». Этот организм иногда называют «лебединой слезой». Эта инфузория обычно имеет два макронуклеуса и одно микроядро. Реснички тела расположены по спирали (см. Ниже). Он имеет две сократительные вакуоли, по одной на каждом теле, а его шея может расширяться или сжиматься обратно в его тело.( Класс : Litostomatea, Семейство : Lacrymariidae).
Lacrymaria olor сжимается, демонстрируя гибкость и большой овальный макронуклеус.
Lacrymaria olor с макронуклеусом около 600X DIC микроскопия
Paramecium caudatum ДИК-микроскопия. Я сосредоточился на внешней пленке.
Неизвестные виды инфузорий? Вверху слева на заднем плане изображения Spirillum «W-образных» бактерий.Большие цветные вакуоли в этой инфузории собрались на «дне» этого экземпляра.
Loxophyllum helus — обычная удлиненная инфузория с шейной областью и округлым хвостом, двумя яйцевидными макронуклеарами (только видимыми внутри, ближе к центру) и единственной сократительной вакуолью (не видимой). Инфузория может быть длиной до 160 мкм.
Loxodes rostrum Цитоплазма в этой инфузории сильно вакуолизирована и, по-видимому, имеет форму клюва на переднем конце.Есть небольшая диатомовая водоросль, которую также можно увидеть внутри, недалеко от центра. Loxodes относится к группе Karyorelictea, где макронуклеусы не делятся. Loxodes в переводе с греческого означает «наклонный, наклонный». Больше фотографий и информации о Loxodes на заводе Pling.
Неопознанная инфузория с монилиформным макронуклеусом (бусинки на нити) и двумя сократительными вакуолями (темные круги), без эндосимбиотических водорослей — возможно, лизостоматических (например, гапторид).
Euplotes sp ?
Инфузории — гипотрих веретенообразной формы, возможно, заразился Stichotricha или Stongylidium (ID предложен Брюсом Тейлором)
Инфузория с адоральной зоной перепонок, покровным стеклом она кажется слегка уплощенной.
Coleps hirtus имеет сложный орнамент из эктоплазматических пластинок, составляющих его панцирь. Эти пластинки расположены внутри альвеолярных пузырьков коры клетки и содержат пластинки карбоната кальция. ДИК-микроскопия подробнее.
Coleps hirtus Микроскопия темного поля. Coleps питается бактериями, водорослями и жгутиками. Он использует токсицисты — органеллы, содержащие токсин, чтобы оглушить или убить свою жертву.
Классификация инфузорий (по Википедии)
Домен: Эукариот (клетки с ядерной мембраной) — другие включают: прокариоты, археи, — Вирусы и прионы в настоящее время рассматриваются.
Королевство: Chromista
Тип : Ciliophora — простейшие с ресничками, 2 типа ядер (> 3500 видов)
Subphylum: Postciliodesmataphora — общие стопки постцилиарных микротрубочковых лент, связанных с соматическими кинетосомами, и называемые postciliodesmat a
Класс: Heterotrichaea — адоральная зона макроядер мембран делится посредством экстрамакроядерных микротрубочек.например Стентор
Класс: Karyorelictea — большинство из них морские, за исключением Loxodes, альвеолы отсутствуют у большинства
Подтип: Intramacronucleata — делящийся макронуклеус, основанный на внутримакронуклеарных микротрубочках
Класс : Armophorea — мелкие анеаэробные инфузории — например, см. сайт EOL
Класс: Listomatea — например, Lacrymaria olor и паразит человека Balantidium coli
Класс: Colpodea — e.грамм. Colpod sp . бобовидная инфузория с однородными ресничками
Класс: Nassophorea — устье, ведущее к частоколу палочек или нематодесм
Класс: Phyllopharyngea — у некоторых только молодые имеют реснички, например. хонотрики и суктории
Класс: Prostomatea — например, Coleps — характеристики см. На сайте EOL
Класс: Plagiopylea — инфузории, распространенные в анаэробных местообитаниях
Класс: Олигименофореа — вентральная бороздка ведет к цитозоме e.грамм. Парамеций
Класс: Protocurziea — см. Примеры — предковая форма инфузории?
Класс: Spirotreachea — выступающие реснички полости рта, например. Euplotes
Класс: Cariotrichea — только один вид Cariacothrix caudata из Венесуэлы
Subphylum: Mesodiniea — новая группа клиатов — дополнительная информация (только для компьютерных фанатов).
Spirostomum минус в контрактном состоянии. Слева на заднем конце видна сократительная вакуоль. Зона перепонок справа вверху занимает примерно половину длины тела.
Микрофотография
Подробнее о том, как я сделал эти снимки, читайте в моей статье — Советы по созданию лучших снимков с помощью микроскопа — Микрофотография. Я использовал камеры Nikon D500 и Nikon D800, Zeiss Axioscope с DIC, ярким полем и темным полем освещения и управлял своими камерами с помощью бесплатного программного обеспечения Digicam control.Изображения были записаны на ноутбук Alienware и обработаны в Adobe Photoshop. Во многих случаях мне приходилось складывать 2–12 изображений, чтобы увеличить глубину резкости — для получения дополнительной информации об этой процедуре см. Мою статью о наложении фокуса.
Сводка
Инфузории являются одними из самых сложных и разнообразных одноклеточных организмов на планете, которые составляют важный компонент водных экосистем, выступая в роли хищников и обеспечивающих питание организмов на более высоких трофических уровнях.Инфузории также важны для очистки сточных вод и очистки воды (Madoni 2011). Моя цель в этой статье состояла в том, чтобы поделиться небольшой подборкой микрофотографий и некоторыми интересными сведениями об этих организмах, и я надеюсь, что это может вдохновить вас узнать о них больше.
Интернет-ссылки большинство или все ссылки можно найти с помощью поиска Google
(2016) F. Gao et al. Основанная на данных эволюционная гипотеза реснитчатых протистов с пересмотренной классификацией типа Ciliophora (Eukaryota, Alveolata).Научные отчеты о природе
(2016) Первое обнаружение двух видов инфузорий Spirostomum из Кореи — скачать PDF.
(2016) Т. Паттинсон. Микроскоп Фресуотера — Часть 2. Доступно на Blurb.com
(2015) Т. Паттинсон. Пресноводный микроскоп. Доступно на Blurb.com
(2014) С. И. Фокин, В. Сера. Скрытое биоразнообразие инфузорий-эндосимбионтов. Мини-обзор SciMedCentral — скачать PDF.
(2013) Морфология и последовательность гена 18S рДНК Spirostomum минус и Spirostomum terres из Рио-де-Жанейро, Бразилия — Zoologia 30: 72-79 — загрузить PDF.
(2012) C. Shao et. al. Повторное описание окситрихид Tetmemena pustulata …. European J. Protistology. 49: 272-282.
(2011) П. Мадони. Простейшие в процессах очистки сточных вод: Миниобзор. Итальянский. Journ. Zool. 78: 3-11.
(2007) Д. Х. Линн Ресничные простейшие. Springer Verlag.
(2007) W. Foissner, A. Chao, Laura A. Katz, журнал «Биоразнообразие и сохранение», Том 17, № 2, 345–363 — скачать PDF
(2004) Н.Г. Сенлер и И. Йылдыз. Фаунистические и морфологические исследования инфузорий из небольшого пруда, с реакцией популяций инфузорий на изменение условий окружающей среды — скачать PDF.
(2000) Иллюстрированный справочник по простейшим 2-го издания Общества протозоологов. Аллен Пресс, США доступен на Amazon.com последний «ключ к инфузории» — проверьте свою библиотеку — отличная справочная книга.
(1999) W. Foissner, H. Berger и I. Schumberg. Идентификация и экология инфузорий лимнетического планктона.Баварское государственное управление водного хозяйства. 798 страниц — скачать бесплатно электронную книгу PDF
(1994) W. Foissner and S. Wölfl Ревизия рода Stentor Oken (Protozoa, Ciliophora) и описание S. araucanus из озер Южной Америки. J. Plankton Res. 16: 225-289 — включает ключ к Stentors — PDF (см. Другие публикации доктора Фойсснера на его веб-сайте)
(1982) К. Р. Курдс Британский и другие пресноводные ресничные простейшие. Издательство Кембриджского университета.
(1972) Х.Бик. Ресничные простейшие Всемирная организация здравоохранения, Женева — электронная книга бесплатно PDF
(1959) W.T. Edmondson Биология пресной воды, 2-е изд. Джон Уайли, Нью-Йорк (Уорд Уиппл) — Определитель пресноводных беспозвоночных (устаревшие, но отличные иллюстрации). 1141 стр. — Скачать PDF
(1953) W.J. Garnett Freshwater Microscopy. Constable & Co. Ltd Лондон — Amazon.com $ 54.
Общая ссылка инфузорий — Википедия
Слеза лебедя — Lacrymaria olor — www.microscopy-uk.org
Paramecium (1985) под редакцией Х. Д. Горца Springer Verlag, NY
Биология Stentor (1961) Vance Tartar, Pergamon Press, NY
Пресноводные беспозвоночные — экология и общая биология (2010) под редакцией J.H. Торп и Д.К. Роджерс, Academic Press, NY — Отличный справочник — книгу можно приобрести в Elsevier
Pling Factory — На немецком языке используйте перевод Google — Loxodes rostrum pictures and other
Микроскопия с самого начала — бесплатная книга, выпущенная Zeiss PDF
Boreal Science \ Ward Science — позволяет приобрести некоторые прудовые организмы.
Quality Microscopes в Калгари — дилер Zeiss продает стереомикроскопы
Macrophotography.net — Форум по макро и микрофотографии
Заинтересованы в покупке микроскопа — Посетите New York Microscope Company
www.microscopeinternational.com
Всем посетителям, пожалуйста, получите 5% скидку при заказе, используя код 5BLCNP
Благодарности
Я хотел бы поблагодарить Брюса Тейлора за помощь в идентификации некоторых инфузорий, предложив исправления и предоставив мне многочисленные исследовательские работы по инфузориям.Вы можете посетить его веб-сайт «Оно пришло из пруда» для получения дополнительной информации о инфузориях. Также просмотрите видео Брюса о инфузориях.
Обратите внимание на учителей, что у вас есть разрешение использовать мои фотографии для обучения, я благодарен за кредит и \ или ссылку на мой веб-сайт, если это возможно. Для коммерческого использования моих фотографий свяжитесь со мной.
Биография и контактная информация авторов
Роберт Бердан — профессиональный фотограф природы, живущий в Калгари, штат Алабама, специализирующийся на фотографии природы, дикой природы и научных исследований.Роберт ушел из исследований Cell \ Neurobiology, чтобы полностью посвятить себя фотографии много лет назад. Роберт предлагает услуги гида по фотографии и частные инструкции по всем аспектам фотографии природы и обучение Adobe Photoshop, включая микрофотографию и макрофотографию.
Соответствующие статьи Роберта Бердана о микроскопии на этом веб-сайте
1. Фотографирование стенторов — большого одноклеточного простейшего (инфузории), живущего в пресной воде
2.Как собирать и фотографировать водяных медведей (тихоходок).
3. Советы по получению лучших снимков с помощью микроскопа
4. Микроскопические прудовые организмы из Силвер-Спрингс, Калгари
5. Микроскопическая жизнь в прудах и дождевой воде — прудовая пена I
6. Фотосъемка микроскопических растений и животных — прудовая пена II
7. Микрофотография и видео простейших, вольвокса и коловраток
8. На главную Микроскопия Лаборатория микрофотографии
9. Искусство и наука микрофотографии в поляризованном свете
10.Фотосъемка через микроскоп Микрофотография — внутреннее пространство
11. Совмещение фокуса для сравнения Photoshop, Helicon Focus и Zerene
12. Фильтры Рейнберга для микрофотографии
13. Сканирующая электронная микроскопия — Фотография
14. Микрофотографии диатомовых водорослей 1877 года, сделанные Джоном Т. Редмэйном
Электронная почта: [email protected]
Веб-сайт: www.canadiannaturephotographer.com
Телефон: MST 9: 00-19: 00 (403) 247-2457.
Нажмите на кнопки ниже и поделитесь этим сайтом со своими друзьями
Frontiers | Сравнительный геномный анализ инфузорий дает представление об истории эволюции в составе комплекса «Nassophorea – Synhymenia – Phyllopharyngea»
Введение
Члены отряда Synhymeniida характеризуются цитофарингеальной корзиной из хорошо развитых нематодесм, проксимально связанных наличием полосы соматических дикинетидных ресничек (Kivimaki et al., 2009; Рисунок 1). Корлисс отнес Synhymeniida к подклассу Hypostomata и поместил нассулид и микроторацид в отдельный отряд (Nassulida) внутри того же подкласса (Corliss, 1979; Таблица 1). Впоследствии Synhymeniida была отнесена к классу Nassophorea, потому что она обладает цитофарингеальной корзиной (nasse), характерной для типичных нософорных групп (нассулид и микроторацид) (Small and Lynn, 1985; Lynn and Small, 2002; Lynn, 2008; Table). 1). Однако филогенетические исследования, основанные в основном на гене малой субъединицы рибосомной ДНК (SSU рДНК) и других родственных генах (например,g., LSU рДНК, ITS, альфа-тубулин), а также сравнение ультраструктурных синапоморфий и аутапоморфий предположили, что подкласс Synhymenia следует переместить из класса Nassophorea в Phyllopharyngea (Gong et al., 2009; Zhang et al. , 2014; Gao et al., 2016; таблица 1). На основании изучения ультраструктуры типичного синименического вида Zosterodasys agamalievi Kivimaki et al. (1997) пришли к выводу, что сингимений нельзя отнести ни к Phyllopharyngea, ни к Nassophorea, потому что у них есть комбинация признаков, исключающая их включение ни в одну из них.В недавнем исследовании использовался филогеномный подход для проверки эволюционных отношений внутри класса Nassophorea, однако набор данных не представлял широкую выборку всех основных клад инфузорий (Lynn et al., 2018). Например, еще не сообщалось о геномах типичных синимениид (Lynn and Small, 2002).
Рисунок 1. Гипотетическая эволюция простейших с ресничками, основанная как на морфологических, так и на молекулярных данных, чтобы показать взаимосвязь и положение таксонов на уровне класса.Выделены Synhymenia, Phyllopharyngea и Nassophorea. Этот рисунок был изменен из Gao et al. (2016).
Таблица 1. Таксономические схемы для классификации 10 видов инфузорий в четырех систематических схемах.
Каждый подкласс Cyrtophoria, Rhynchodia, Chonotrichia и Suctoria составляет кладу внутри монофилетического класса Phyllopharyngea (de Puytorac, 1994; Lynn and Small, 1997; Lynn, 2008; Таблица 1). Хонотрихи — сидячие симбионты, обычно встречающиеся в ротовой полости ракообразных, давно признаны филлофарингеями (Corliss, 1979; Lynn, 2016).Предыдущие исследования выявили сильное сходство между кортикальными микротрубочковыми компонентами хонотрихий (представленными Chilodochona ) с корковыми компонентами свободноживущих циртофориан (Dobrzaprnska-Kaczanowska, 1963; Grain and Batisse, 1974; Fahrni, 1982). Однако молекулярная филогения для хонотрихов отсутствовала (Gao et al., 2012, 2014). Cyrtophorians характеризуются голой дорсальной стороной и выступающей цитофарингеальной корзиной, состоящей из большого количества микротрубочек (Lynn, 2008).Хотя несколько циртофориан были недавно изучены (Chen et al., 2016; Pan et al., 2016; Zhang et al., 2018), систематика этой группы остается неоднозначной. Следовательно, класс Phyllopharyngea необходимо пересмотреть на основании дополнительных данных. В настоящем исследовании геномные и транскриптомные данные использовались для анализа эволюционных взаимоотношений между синтимениями, нософореями и филлофарингеями.
Материалы и методы
Приготовление одноклеточного образца
Шесть пресноводных видов инфузорий ( Chilodontopsis depressa , Trithigmostoma cucullulus , Trochilia petrani , Trochilia sp., Dysteria derouxi и Hartmannula sinica ) были собраны из озера Сяосиху, Циндао, Китай (120,35 ° E, 36,06 ° N). Для каждого вида клетки промывали фосфатно-солевым буфером (PBS) (без Mg 2+ или Ca 2+ ), и геномную ДНК, выделенную из одной клетки, амплифицировали с использованием набора Single Cell WGA Kit (Yikon, YK001A) на основе технологии MALBAC (Lu et al., 2012). РНК C. depressa и D. derouxi экстрагировали из одной клетки с использованием набора RNeasy (Qiagen, Hilden, Германия) и расщепляли ДНКазой.Фракцию рРНК истощали с использованием набора GeneRead rRNA Depletion Kit (Qiagen, Hilden, Германия). Исходные данные секвенирования одноклеточного генома Chilodochona sp. были предоставлены доктором Денисом Х. Линном (Университет Британской Колумбии, Ванкувер, Канада).
Высокопроизводительное секвенирование и обработка данных
Библиотеки Illumina размером 300 п.н. получали из амплифицированной геномной ДНК одной клетки с использованием набора Nextera DNA Flex Library Prep Kit методом случайной ПЦР с праймерами (Illumina # 20018704, США) в соответствии с инструкциями производителя.Парное секвенирование (длина считывания 150 п.н.) выполняли с использованием секвенатора Illumina HiSeq4000. Адаптер секвенирования был обрезан, и считывания низкого качества (чтения, содержащие> 10% Ns или 50% оснований со значением Q <= 5) были отфильтрованы Trimmomatic v0.36 (с использованием параметров: LEADING: 3 TRAILING: 3 SLIDINGWINDOW: 4:15 MINLEN: 36) (Bolger et al., 2014).
Одноклеточные геномы семи видов были собраны с использованием SPAdes v3.11.1 (параметры по умолчанию и — k = 21, 33, 55, 77) (Bankevich et al., 2012; Нурк и др., 2013). Митохондриальные геномные пептиды инфузорий вместе с последовательностями бактериального и человеческого генома были загружены из NCBI GenBank в качестве баз данных BLAST для удаления загрязнения, вызванного митохондриями, бактериями или поддельными источниками (BLAST + v2.6.0, E -value cutoff = 1 e −5). CD-HIT v4.7 (CD-HIT-EST, -c 0,98 -n 10 -r 1) использовали для устранения избыточности контигов (с порогом идентичности последовательностей = 98%) (Fu et al., 2012). Плохо поддерживаемые контиги (охват <1 и длина <400 п.н.) были отброшены специальным сценарием Perl с учетом характеристик, присущих методике секвенирования генома одной клетки (Zong et al., 2012). QUAST v4.6.1 использовался для оценки полученных контигов (- M = 0) (Gurevich et al., 2013).
Для трех видов нософоров, Nassula variabilis , Furgasonia blochmanni и Pseudomicrothorax dubius , последовательности РНК были получены из опубликованного набора данных (регистрационный номер NCBI PRJNA434361). Адаптеры чтения были обрезаны Trimmomatic v0.36 (параметры, как описано выше), а чистые чтения были использованы для сборки транскриптома с помощью Trinity v2.6.6 (параметры по умолчанию) (Grabherr et al., 2011). Любая избыточность и загрязнение сборок транскриптомов удаляли с помощью BLAST и CD-HIT, как описано выше.
Данные транскриптомаRNA-seq для другого 21 вида инфузорий были загружены из проекта по секвенированию транскриптомов морских микробов эукариот плюс шесть видов инфузорий, чьи высококачественные данные были получены из общедоступных баз данных (источники данных суммированы в дополнительной таблице S1).
Распределение длины интрона и определение предпочтения стоп-кодонов
Данные последовательности РНК C.depressa были сопоставлены с соответствующей сборкой эталонного генома с помощью HISAT2 v2.1.0 (Kim et al., 2015), а транскриптом был собран с помощью StringTie v1.3.4d (Pertea et al., 2016). Распределение интронов по размерам было проанализировано с помощью специальных сценариев Perl, а граничный мотив интронов был визуализирован с помощью WebLogo3 (Crooks et al., 2004). Частоту использования стоп-кодона оценивали с помощью специального сценария Perl, который распознавал три нуклеотида, следующих за кодоном последней аминокислоты в каждой согласованной полной последовательности белка.BLAST идентифицирует его как потенциальный стоп-кодон ( E -значение ≤ 1 e −10, идентичность ≥ 30%, длина выравнивания ≥ 50 аминокислот) последовательности транскриптов исследуемых видов против базы данных белков инфузорий в Uniprot (подробности о был загружен в репозиторий GitHub: Bryan0425 / Stop_codon_usage). Среди различных групп инфузорий тест Стьюдента t проводился во внутреннем и внешнем классах.
Предсказание и аннотация гена
транскриптомов были проанализированы с помощью TransDecoder v5.1.0 ( генетических кодов Tetrahymena для N. variabilis , универсальных генетических кодов для трех других видов, F. blochmanni , P. dubius и C. depressa ) для поиска самых длинных ORF, которые генерировали предсказания белка длиннее 100 аминокислот. Для проверки потенциальных ORF предсказанные последовательности белков были перенесены в базу данных Swiss-Prot (значение E <1 e −5) (UniProt, 2018) и сопоставлены с базой данных Pfam-A (El-Gebali et al. al., 2018) от HMMER v3.1b2 (Эдди, 2009). Подтвержденные белковые продукты были дополнительно аннотированы с использованием четырех баз данных (CDD, Pfam, SUPERFAMILY и TIGRFAM) с помощью InterProScan v5.29 (Mitchell et al., 2018) и базы данных генов инфузорий из NCBI GenBank с помощью BLAST + v2.6.0 ( E -значение отсечения <1 e −5). RepeatMasker v4.0.7 (Smit, 1996) использовался для аннотирования некодирующих РНК и повторяющихся последовательностей. De novo предсказание гена было выполнено с помощью AUGUSTUS v3.3 (–species = tetrahymena, реорганизация только TGA в качестве стоп-кодона, TAA / TAG в качестве глутамина) (Keller et al., 2011).
Обнаружение ортологов и путь GO
Ортологи среди C. depressa и других инфузорий были обнаружены методом реципрокного удара BLAST (RBH) (значение E <1 e −5, идентичность ≥ 30%, длина выравнивания ≥ 50 а.о.) и попарно взаимное лучшие хиты были определены как предполагаемые ортологи. Диаграмма Венна была создана с помощью R-пакета VennDiagram (Chen and Boutros, 2011). Обогащенный термин Gene Ontology (GO) был выполнен с помощью BiNGO v3.0.3 (p.adjust <0,05) (Maere et al., 2005), который был интегрирован в Cytoscape v3.4.0 (Shannon et al., 2003). Пузырьковые диаграммы были созданы с помощью пакета R ggplot2 (Wickham, 2016).
Наборы данных и сопоставления
Недавно охарактеризованные последовательности, которые объединили соответствующие последовательности, полученные из базы данных GenBank, были собраны в два набора данных: (1) данные филогеномики (всего 59 таксонов), т.е. 2 вновь секвенированных транскриптома; 5 вновь секвенированных геномов; и 39 других инфузорий, плюс 9 апикомплексанов и 4 динофлагеллят как внешние группы; (2) База данных SSU-рДНК (всего 56 таксонов), т.е.е., 5 вновь секвенированных генов плюс 3 гетеротрих и кариореликтиды как внешние группы. Информация о последовательностях и регистрационные номера GenBank показаны в дополнительной таблице S2.
Филогенетические и филогеномные анализы
Последовательности малой субъединицы рибосомной ДНК были многократно выровнены и обрезаны до тупого с помощью BioEdit 7.1.3.0 (алгоритм ClustalW) с параметрами по умолчанию. Анализы максимального правдоподобия (ML) и байесовского вывода (BI) выполнялись на онлайн-сервере CIPRES Science Gateway (Miller et al., 2010; Penn et al., 2010), используя RAxML-HPC2 на XSEDE v8.2.10 (Stamatakis, 2014) с моделью GTRGAMMA и MrBayes на XSEDE v3.2.6 (Ronquist et al., 2012) с моделью GAMMA, рассчитанной с помощью MrModeltest v2.3 ( Nylander, 2004) соответственно. При анализе машинного обучения было выполнено 1000 бутстрепов для оценки надежности внутренних веток. Для байесовского анализа моделирование цепей Маркова методом Монте-Карло (MCMC) проводилось с двумя наборами по четыре цепочки для 4 000 000 поколений, с выборкой каждые 100 поколений и выгоранием 10 000 (Chen et al., 2015). Все оставшиеся деревья использовались для расчета апостериорных вероятностей (PP) с использованием консенсуса по правилу большинства. MEGA v7.0.20 (Kumar et al., 2016) использовалась для визуализации топологий дерева.
Филогеномный анализ проводился с помощью конвейера GPSit (с использованием параметров -e 1e-10 -d 50 -g 100000 -f 100 в режиме расслабленной маскировки) на основе 157 ортологов, общих для всех 46 инфузорий, с использованием подхода «суперматрицы» (Chen et al. др., 2018б). Множественное выравнивание последовательностей было загружено в CIPRES Science Gateway.RAxML-HPC2 v8.2.9 (с использованием параметров: LG-модель аминокислотной замены + Γ-распределение + F, четыре категории скорости, 500 бутстрап-реплик) и PHYLOBAYES MPI 1.5a (с использованием параметров: модель CAT-GTR + Γ-распределение, четыре независимых цепочки , 10000 поколений для матрицы ослабленного маскирования или 20000 поколений для матрицы строгого режима, с первыми 10% всех поколений как выгорание, сходимость Maxdiff <0,3) были выполнены для генерации деревьев ML и BI соответственно (Le and Gascuel , 2008; Лартиллот и др., 2009; Миллер и др., 2010; Стаматакис, 2014; Gentekaki et al., 2017). Все деревья визуализированы программой MEGA v7.0.20. Чтобы визуализировать все доступные филогенетические сигналы в суперматрице, филогенетический сетевой анализ был рассчитан с помощью SPLITSTREE v4.14.4 (с использованием параметров: Network = NeighborNet; 1000 повторений начальной загрузки) (Huson and Bryant, 2005).
Результаты
Морфология Synhymenians, Nassophoreans и Phyllopharyngeans
Основные морфологические характеристики синхименид, нософорид и филлофарингеев представлены на рис. 2А.Их дивергенция / конвергенция подробно описывалась и обсуждалась ранее (Hausmann, Peck, 1978; Eisler, 1988; Chen et al., 2018a). Вкратце, у сингимений и нософориев есть сингимений, который представляет собой кинетическую структуру под ротовым аппаратом, в основном на вентральной поверхности. У сингимений сингимений простирается слева направо на вентральной поверхности, но у Nassophorea он ограничен левой вентральной поверхностью. Это служит основной характеристикой для различения этих двух групп.За исключением сингимений, эта структура отсутствует у Phyllopharyngea.
Рис. 2. Chilodontopsis depressa Морфология и черновой профиль генома. (A) Кладограмма, показывающая эволюционные отношения внутри Synhymeniida, Nassophorea и Phyllopharyngea на основе морфологических данных. Части (a – d) являются оригинальными, а часть (e) принадлежит Янковскому (1973). 1, Synhymenium ограничен на левой вентральной, иногда на дорсальной поверхности; 1 ‘сингимений простирается от левой на правую вентральную поверхность; 1 ″ , сингимений отсутствует; 2 сингимений обычно состоит из трех адоральных поликинетидов; 2 ‘сингимений включает более трех адоральных поликинетидов; 3, свободноживущие, меротелокинетальное деление, присутствуют оральные кинетофрагменты; 3 ′, сидячий, деление почкованием, оральные кинетофрагменты отсутствуют. (B) Гистограмма, показывающая распределение размеров интронов, рассчитанное с помощью специального скрипта Perl. Розовые столбики представляют собой процент от частоты интронов. Интроны длиной более 200 п.н. были интегрированы в правую полоску. (C) Комбинация секвенирования генома и транскриптома идентифицировала 5′-GT-AG-3 ‘как репрезентативный мотив с третьим консервативным сайтом A с помощью WebLogo3. (D) Круговая диаграмма, показывающая пропорции различных типов некодирующей РНК, предсказанные и вычисленные с помощью аннотации RepeatMask: тРНК (фиолетовый), мяРНК (оранжевый), рРНК (коричневый) и других типов (желтый). (E) Весь геном аннотировали с использованием Interproscan, и WEGO выполнял анализ обогащения с помощью генетической онтологии (GO) для C. depressa (синий) и T. thermophila (зеленый). Гистограмма, показывающая процентное соотношение чисел генов.
Геномные особенности классов Phyllopharyngea и Nassophorea
Хотя вновь секвенированные инфузории имеют разные размеры генома и содержание GC, большинство геномных ансамблей филлофарингей составляют около 40 M (Table 2). Chilodontopsis depressa имеет небольшие, богатые AT интроны, большинство из которых имеют длину 36 п.н. (рис. 2B) с мотивом GT-AG и консервативным третьим сайтом A (рис. 2C). Кроме того, из некодирующих типов РНК, предсказанных RepeatMasker, 55% представляют собой тРНК (171), 21% — мяРНК (65), 13% — рРНК (40) и 11% — другие РНК (34) (рисунок 2D). . Предсказанные гены были аннотированы в соответствии с клеточным компонентом, молекулярной функцией и биологическим процессом (рисунок 2E и дополнительный рисунок S2). По сравнению с Tetrahymena thermophila , C.depressa имеет высокое содержание генов в его путях связывания и связывания с белками, что может быть связано с молекулярной функцией его хорошо развитой цитофарингеальной корзины микротрубочек и его альгоядным способом питания (Tucker, 1968; Weisenberg et al., 1968 ; Chaaban, Brouhard, 2017).
Таблица 2. Информация о сборке генома из одноклеточного секвенирования.
Ортологичные гены были идентифицированы среди семи видов, секвенированных в данной работе, и других ранее секвенированных инфузорий (рис. 3 и дополнительный рисунок S1).Было идентифицировано 703 ортологичных гена, общих для Chilodontopsis depressa и четырех модельных инфузорий (рис. 3А). C. depressa имеет меньше ортологичных генов с филлофарингеями (550), чем с nassophoreans (1141), что согласуется с его более близким морфологическим сходством с последними, например, наличием (а не отсутствием) сингимения (Рисунки 2A, 3B). , В). Более того, результаты обогащения термина GO предполагают, что C. depressa имеет больше метаболических свойств с филлофарингеями, чем с нософориками (Рисунок 4A и дополнительный рисунок S2), таких как регуляция клеточных процессов, регуляция биологических процессов, клеточный ответ на стимул и пути биологической регуляции.Такие особенности имеют тенденцию быть обогащенными у nassophoreans, а не у phyllopharyngeans.
Рис. 3. Диаграмма Венна, показывающая обнаружение ортолога у Chilodontopsis depressa , филлофарингей, нософориев и других модельных инфузорий. (A) Диаграмма Венна, показывающая сравнение количества ортологичных генов у C. depressa (серый) и других типичных видов инфузорий, включая Tetrahymena thermophila (синий), Paramecium tetraurelia (розовый), Oxytricha trifallax (желтый) и Stentor coeruleus (зеленый), рассчитано с помощью пакета R. (B) Диаграмма Венна, показывающая сравнение количества ортологичных генов у C. depressa и инфузорий филлофаринге, включая Trithigmostoma cucullulus , Dysteria derouxi и Chilodochona sp. (C) Диаграмма Венна, показывающая сравнение количества ортологичных генов у C. depressa и инфузорий нософора, включая Nassula variabilis , Furgasonia blochmanni и Pseudomicrothorax dubius.
Рисунок 4. Сравнительный геномный анализ Chilodontopsis depressa и инфузорий филлофарингеальных и нософорических. (A) Пузырьковая диаграмма, показывающая сравнение генов, контролирующих биологический процесс среди назофорических ( Furgasonia blochmanni , Pseudomicrothorax dubius ) (1-2), синименических ( C. depressa ) (3) (3) и филлохлофаринджиновых sp., Dysteria derouxi , Hartmannula sinica , Trithigmostoma cucullulus , Trochilia petrani и Trochilia sp.) (4–9) инфузории на основе анализа генной онтологии с помощью пакета R ggplot2. Верхняя и нижняя панели показывают пути обогащения генов с повышенной и пониженной регуляцией, соответственно. Цветная полоса и размер точки измеряют значения p обогащения генов и процент покрытых генов в соответствующих путях, соответственно. (B) Гистограмма, показывающая смещение использования стоп-кодонов у C. depressa , филлофарингей, нософориев и других хорошо аннотированных инфузорий.
На основе поиска гомологов между транскриптами C. depressa и последовательностями белков других инфузорий, наиболее часто используемый стоп-кодон в C. depressa был идентифицирован как TAA (91,3%, рис. 4B). По сравнению с модельными инфузориями, такими как T. thermophila и Oxytricha trifallax , также было предсказано использование стоп-кодонов другими недавно секвенированными филлофарингеями и nassophoreans. Результаты показали, что использование стоп-кодона C.depressa был ближе к видам Chilodonella uncinata и D. derouxi (оба принадлежат к Phyllopharyngea) (отклонение = 1,9), чем к видам Nassophorea (отклонение = 25,6). Предпочтение использования стоп-кодонов хорошо сохранялось внутри каждого класса ( p -значение = 0,01538 <0,05 по t -тест).
Филогенетические и филогеномные анализы
Набор данных рДНК SSU предоставил самую многочисленную выборку таксонов. Мы провели филогенетический анализ на основе 56 последовательностей SSU-рДНК (рис. 5).На полученных деревьях C. depressa сгруппированы с типичными сингимениями, хотя и в базальном положении. Подкласс Synhymenia сгруппирован с классом Phyllopharyngea (или «Subkinetalia», название, придуманное для класса Phyllopharyngea за исключением синимений), с высокими поддерживающими значениями (ML / BI, 93 / 1.00). Монофилия Subkinetalia полностью поддерживается. Класс Nassophorea является парафилетическим в дереве рДНК SSU, при этом три отряда (Microthoracida, Nassulida и Discotrichida) разделяются на различные позиции в комплексе CONthreeP (прочная клада, включающая классы Colpodea, Oligohymenophorea, Nassophorea, Phagiopylea и Plagiopylea, Plagiopylea ) (Lynn, 2008; Adl et al., 2019).
Рис. 5. Филогенетическое дерево на основе данных последовательности рДНК SSU. Пять новых секвенированных видов выделены жирным шрифтом и красными стрелками. Числа в узлах представляют значения начальной загрузки ML из 1000 повторов и апостериорную вероятность BI, соответственно. Клады с разной топологией между ML и BI-деревом обозначаются как « ∗ ». Масштабная полоса соответствует 10 заменам на 100 нуклеотидных позиций.
В настоящем исследовании было создано семь новых геномов и два новых транскриптома.Таким образом, «омический» источник данных ортологичных генов для филогеномного анализа был увеличен до 46 инфузорий, хотя C. depressa остается единственной репрезентативной сингименией (рис. 6). Используя GPSit в расслабленном режиме (Chen et al., 2018b), мы создали базу данных с 157 генами, содержащими 173 835 аминокислотных остатков. В полученном филогеномном дереве с использованием алгоритма ML C. depressa сгруппированы с Subkinetalia с умеренной поддержкой (ML, 78). Монофилия Subkinetalia была решительно подтверждена анализом ML и BI.Паттерн ветвления в пределах Subkinetalia согласуется с выводами о филогении рДНК SSU (рис. 5), хотя нынешняя выборка таксона ограничена подклассом Cyrtophoria. Для класса Nassophorea данные транскриптома доступны для трех видов, представляющих два отряда, то есть Nassulida и Microthoracida. Три вида сгруппированы вместе с умеренной поддержкой (ML / BI, 78 / 0,50). Классы Nassophorea и Colpodea сформировали умеренно поддерживаемую кладу в ML-дереве, которая впоследствии сгруппировалась с классом Oligohymenophorea.Класс Phyllopharyngea был сестрой клады Colpodea + Nassophorea + Oligohymenophorea согласно алгоритму ML.
Рисунок 6. Филогеномное дерево, составленное из анализов ML и BI. Жирным шрифтом выделены новые секвенированные таксоны. Микрофотографии Chilodontopsis depressa из жизни (A – C) и после окрашивания натратом серебра (D, E) . Числа в узлах — это апостериорная вероятность BI, за которой следуют значения начальной загрузки ML. Масштабная шкала соответствует 0.1 ожидаемая замена на сайт. Клады с разной топологией между ML и BI-деревом обозначаются как « ∗ ».
Обсуждение
Систематическое отнесение Synhymenians – Nassophoreans – Phyllopharyngeans Assemblage
Систематическое положение сингимений долгое время озадачивало систематиков, и их отнесение к классу Nassophorea (нассулиды и микроторакиды) или к субкинеталии было спорным. Synhymenians разделяют ультраструктурные и морфологические сходства как с Nassophorea, так и с Phyllopharyngea, что позволяет предположить, что они, вероятно, являются переходной группой между этими двумя классами (Eisler and Bardele, 1983; Small and Lynn, 1985; Kivimaki et al., 1997; Линн и Смолл, 2002). Исчерпывающее сравнение морфологии и ультраструктуры у сингимений, Nassophorea и Subkinetalia ранее обращалось к этой проблеме (Gong et al., 2009). Филогения рДНК SSU (рис. 5) и предыдущие исследования подтверждают тесную взаимосвязь между синимениями и субкинеталиями, и, таким образом, сингимении были предложены в качестве подкласса (Synhymenia) внутри класса Phyllopharyngea (Zhang et al., 2014; Gao et al., 2016, 2017; Ляо и др., 2018).
В этом исследовании мы предоставляем геномные данные для сингимений, т.е.е., Chilodontopsis depressa , впервые. C. depressa занимала базальное положение в подклассе Synhymenia (рис. 5), что указывает на то, что этот вид может быть идеальным представителем для демонстрации предкового кандидата сингимений. Филогеномный анализ умеренно подтвердил (ML, 78) принадлежность C. depressa к Subkinetalia, в то время как nassophoreans (представленные нассулидами и микроторацидами) сформировали другую умеренно поддерживаемую монофилетическую группу (Рисунок 6).Это согласуется с результатами предыдущих исследований, основанных на рДНК SSU и данных о нескольких генах, из которых следует, что сингимении более тесно связаны с Phyllopharyngea, чем с Nassophorea (Gong et al., 2009; Gao et al., 2016).
Примечательно, что значения поддержки бутстрапа для группировки C. depressa с Subkinetalia ниже в филогеномном анализе, чем значения, основанные на данных рДНК SSU (ML, 78 против ML / BI, 93 / 1.00), тогда как поддержка монофилии субкинеталии высоки в обоих анализах.Эти данные означают, что в масштабе генома сингимении и субкинеталии более расходятся, чем указывает ген рДНК SSU (рис. 5, 6). Это согласуется с очевидными ультраструктурными различиями между этими двумя группами: у сингимений постцилиарные микротрубочки каждой кинетосомы образуют двойной ряд (по сравнению с триадами у циртофориан), а синименические монокинетиды лишены как субкинетальных лент микротрубочек, так и плотных поперечных фибрилл. которые характеризуют филлофарингеи (Kivimaki et al., 1997). Более того, в Subkinetalia есть несколько чрезвычайно специализированных субкинеталийских групп, таких как suctorians и chonotrichians (рис. 2A), взрослые особи которых сидячие и делятся почкованием. В совокупности эти данные указывают на то, что существовала долгая история и что ряд эволюционных событий произошел после того, как синхименицы и субкинеталии отошли от своего общего предка.
Филогеномное дерево восстановило только слабую или умеренную поддержку монофилии Nassophorea (i.э., отряды Nassulida и Microthoracida, за исключением Discotrichida). Это согласуется с недавним филогеномным исследованием нассулид (Lynn et al., 2018) и мультигенным анализом основных линий инфузорий (Gao et al., 2016). Цитофарингеальная корзина нассулидов состоит из одного или нескольких из трех наборов микротрубочковых пластинок, а именно цитостомальных (Z), субцитостомальных (Y) и нематодесмальных (X) пластинок (Hausmann and Peck, 1978; de Puytorac and Njiné, 1980; Эйслер, 1988). Микроторекиды (например,g., Pseudomicrothorax и Leptopharynx ) имеют только X-ламеллы (Hausmann, Peck, 1978; de Puytorac, Njiné, 1980; Eisler, 1988), у синименидов есть только Z-ламеллы (Kivimaki et al., 1997), а у циртофориан имеют только Z- и Y-ламели (Kurth, Bardele, 2001). Были предложены противоречивые сценарии для вывода эволюции аппарата цитофарингеальной корзины на основе филогенетического (Gong et al., 2009) и филогеномного анализов (Lynn et al., 2018). Включение новых геномных данных для синимений в анализ приводит к частичному подтверждению предыдущей гипотезы: синименицы и субкинеталии являются членами класса Phyllopharyngea, а не Nassophorea (Gong et al., 2009; Гао и др., 2016). Согласно сценарию морфологической эволюции, выведенному Lynn et al. (2018), если нынешнее филогеномное древо является вероятным представлением порядка дивергенции этих групп, то есть цитофарингеальная корзина с микротрубочковыми нематодесмами и только с Z микротрубочковыми лентами, вероятно, была бы наследственной особенностью основной клады CONthreeP. Утрата Z-ламелл могла произойти у микроторакис, в то время как X- и Y-ламеллы у назофориев и филлофарингей могли быть апоморфиями, приобретенными позже, чтобы обеспечить быстрое поглощение различных пищевых ресурсов (Tucker, 1968; Hausmann and Peck, 1978; Lynn et al. ., 2018).
В настоящее время рДНК SSU является мощным филогенетическим маркером для разрешения многих эволюционных взаимосвязей, хотя и имеет свои ограничения (Hasegawa and Hashimoto, 1993). Напр., Последовательности SSU рДНК, сходные по нуклеотидному составу, могли быть неправильно размещены близко друг к другу на филогенетических деревьях (Woese et al., 1991). Кроме того, из-за случайной вариабельности отдельных генов рискованно делать вывод о филогенезе по любому отдельному гену. Таким образом, предполагается, что филогенетический анализ одного гена должен быть подтвержден использованием других филогенетических маркеров (Ludwig and Klenk, 2001).После развития секвенирования с использованием иллюминатора филогеномный анализ используется в качестве золотого стандарта для оценки эволюционных отношений на «уровне генома» (Brown et al., 2001; Ciccarelli et al., 2006; Wu and Eisen, 2008). Обычно ожидается, что филогеномные данные будут хорошо разрешены без многих ограничений небольших наборов данных, например, относительно менее информативных признаков из независимых локусов и случайного шума (Delsuc et al., 2005; Jeffroy et al., 2006). В рамках настоящего анализа 157 последовательностей белков 59 видов были использованы для построения филогеномного дерева.Таким образом, можно получить более надежную оценку эволюционных отношений. С другой стороны, наши результаты показывают, что в масштабе генома указано больше вариаций, чем в филогенетическом анализе отдельного гена, таких как SSU рДНК (рисунки 5, 6). Филогеномный анализ применяет гораздо больше данных из всего генома / транскриптома по сравнению с одним конкретным геном. Более того, последовательности белков обнаруживают больше различий и вариаций между видами, когда их используют в качестве материала для анализа. Некоторые значения статистической поддержки в дереве были относительно высокими, но некоторые были низкими или не такими высокими, как в филогенетическом анализе одного гена, например.г., 58 / 0,79 по сравнению с полной стоимостью в филиале Dysteria и Trochilia . Более высокие значения поддержки могут быть достигнуты, если количество информационных сайтов недостаточно или ключевые виды не включены в анализ. Кроме того, важным процессом является отбор генов для филогеномного анализа. При анализе необходимо учитывать ортологи, особенно филогенетические маркеры, такие как HSP70, и тубулин (Baldauf et al., 2000; Ludwig and Klenk, 2001).
Крошечные интроны характеризуют геномы инфузорий как уровень класса
Все секвенированные геномы эукариот содержат интроны, но до сих пор ни один из них не был идентифицирован у прокариот.Размер интрона варьирует в геномах разных видов, например, от 169 п.н. у модельного цветущего растения Arabidopsis thaliana до 7,386 п.н. в среднем у человека (Jo and Choi, 2015; Piovesan et al., 2015). Предыдущие исследования геномов человека показали, что размер интрона может играть важную роль в управлении альтернативным сплайсингом и восприятии собственных / чужеродных кольцевых РНК (Fox-Walsh et al., 2005; Dewey et al., 2006; Kim et al., 2006; Chen et al., 2017). Кроме того, считается, что минимальная длина интронов, необходимая для реакции сплайсинга и других продвинутых биологических функций, составляет 30 п.н. (Roy et al., 2008; Piovesan et al., 2015). Тем не менее, интроны меньшего размера (15 п.н.) описаны у разнородных инфузорий (например, Stentor coeruleus и Condylostoma magnum ) (Slabodnick et al., 2017). Крошечные интроны также были идентифицированы в классах Armophorea ( Nyctotherus ovalis : 27 п.н.) (McGrath et al., 2007; Ricard et al., 2008), Spirotrichea ( O. trifallax : 38 п.н.) (Swart et al. ., 2013) и Oligohymenophorea ( T. thermophila : 74 п.н. и видов Paramecium : 26 п.н.) (Swart et al., 2013; Arnaiz et al., 2017). Настоящее исследование впервые сообщает о крошечных интронах (36 п.н.) в геноме видов класса Phyllopharyngea (рис. 2A, B). Таким образом, на основании настоящих и предыдущих исследований, крошечные интроны являются еще одной преобладающей важной особенностью геномов инфузорий, как и вариация числа копий рДНК (Wang et al., 2019). Нарушает ли небольшой размер этих интронов их биологические функции, например, регулируя альтернативный сплайсинг, требует дальнейшего изучения.
Использование стоп-кодонов в различных группах инфузорий
Предпочтение стоп-кодонов в терминальной области интенсивно исследовалось биологами-эволюционистами (Alff-Steinberger and Epstein, 1994; Smith and Smith, 1996; Jungreis et al., 2011). Предыдущие исследования сообщили о гибкости ядерного генетического кода у инфузорий, продемонстрировав, что стандартные стоп-кодоны переназначены аминокислотам (Lozupone et al., 2001; Heaphy et al., 2016; Swart et al., 2016). Одна из возможных причин заключается в том, что неоднозначные генетические коды позволяли предкам инфузорий процветать в определенные периоды их эволюционной истории (Swart et al., 2016). Чтобы определить, как реаранжировка стоп-кодонов сохраняется в разных клонах, мы систематически оценивали предпочтение использования стоп-кодонов у 33 инфузорий на основе их данных транскриптомов (рис. 4В). Наши результаты показывают, что использование стоп-кодонов варьируется в зависимости от класса и, в некоторых случаях, внутри класса. Например, использование стоп-кодона C. depressa (ранее классифицировалось в классе Nassophorea, отряд Synhymeniida) более похоже на использование стоп-кодона C. uncinata (класс Phyllopharyngea, отряд Chlamydodontida) и D.derouxi (класс Phyllopharyngea, отряд Dysteriida), чем nassophoreans (например, N. variabilis , P. dubius и F. blochmanni ), что позволяет предположить, что у Synhymeniida и других филлофарингов мог быть общий недавний предок. Тесная связь между Synhymeniida и Phyllopharyngea также подтверждается результатами филогеномного анализа (рис. 6). Таким образом, мы полагаем, что предпочтение использования стоп-кодонов может быть принято как дополнительный параметр для разрешения филогенетических отношений.Однако вопрос о том, как предпочтение использования стоп-кодонов передается по наследству, остается плохо изученным и должен быть рассмотрен в будущих исследованиях.
Заявление о доступности данныхВсе наборы данных секвенирования Illumina депонированы в NCBI под номером доступа PRJNA546036.
Авторские взносы
MM, BP и XC разработали исследование. BP и XC проанализировали данные и интерпретировали результаты, используя методы биоинформатики. LH, QZ и ZQ выполнили филогенетический анализ, идентификацию и описание морфологии.AW отредактировал написание рукописи. Все авторы внесли свой вклад в рукопись и согласовали рукопись перед рецензированием.
Финансирование
Эта работа была поддержана Морским научно-техническим фондом провинции Шаньдун для экспериментальной национальной лаборатории морских наук и технологий (Циндао) (2018SDKJ0406-2), Китайским фондом естественных наук (31672279, 31672251), Фондом естественных наук провинции Шаньдун. (JQ201706), Университет Китайской академии наук (Y8540XX1W2) и Совет по стипендиям Китая.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим: проф. Weibo Song (Океанский университет Китая, Китай) за его любезную помощь и советы по подготовке рукописи; Д-ру Денису Х. Линну (Университет Британской Колумбии, Канада) за предоставление геномных данных для Chilodochona sp.; и проф. Fangqing Zhao (Китайская академия наук, Китай) за институциональную поддержку.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2019.02819/full#supplementary-material
РИСУНОК S1 | Молекулярная информация о Chilodontopsis depressa и инфузории глотки филлофаринге. Распределение видов с лучшими попаданиями по BLAST. Ось X представляет процент контигов или генов. (A) Hartmannula sinica , (B) Chilodochona sp., (C) Dysteria deroux i, (D) Trithigmostoma cucullulus pet E 96 , (F) Trochilia sp. И (G) Chilodontopsis depressa .
РИСУНОК S2 | Сравнительный геномный анализ Chilodontopsis depressa и инфузорий филлофарингеальных и назофорических.Пузырьковая диаграмма, показывающая сравнение генов, контролирующих клеточный компонент (A) и молекулярную функцию (B) среди нософора ( Furgasonia blochmanni , Pseudomicrothorax dubius ) (1,2), синтименского ( Chilodontopsis depressa) ) и филлофарингиевой ( Chilodochona sp., Dysteria derouxi , Hartmannula sinica , Trithigmostoma cucullulus , Trochilia petrani и Trochilia sp.) (4–9) инфузории на основе анализа генной онтологии с помощью пакета R ggplot2.
Сноски
Список литературы
Адл, С. М., Басс, Д., Лейн, К. Э., Лукеш, Дж., Шох, К. Л., Смирнов, А. и др. (2019). Изменения в классификации, номенклатуре и разнообразии эукариот. J. Eukaryot. Microbiol. 66, 4–119. DOI: 10.1111 / jeu.12691
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альф-Штайнбергер, К.и Эпштейн Р. (1994). Предпочтение кодонов в концевой области генов E. coli и эволюция использования стоп-кодонов. J. Theor. Биол. 168, 461–463. DOI: 10.1006 / jtbi.1994.1124
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арнаис, О., Ван Дейк, Э., Бетермье, М., Луйе-Акакпо, М., де Ванссе, А., Дуаркур, С. и др. (2017). Улучшенные методы и ресурсы для геномики Paramecium : единицы транскрипции, аннотации генов и экспрессия генов. BMC Genomics 18: 483. DOI: 10.1186 / s12864-017-3887-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Балдауф, С. Л., Роджер, А., Венк-Зиферт, И., и Дулиттл, В. Ф. (2000). Филогения эукариот на уровне царства, основанная на комбинированных данных о белках. Наука 290, 972–977. DOI: 10.1126 / science.290.5493.972
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Банкевич А., Нурк С., Антипов Д., Гуревич А.А., Дворкин М., Куликов А.С. и др. (2012). SPAdes: новый алгоритм сборки генома и его приложения для секвенирования отдельных клеток. J. Comput. Биол. 19, 455–477. DOI: 10.1089 / cmb.2012.0021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун, Дж. Р., Дуади, К. Дж., Италия, М. Дж., Маршалл, У. Э. и Стэнхоуп, М. Дж. (2001). Универсальные деревья, основанные на больших наборах данных комбинированных последовательностей белков. Нат. Genet. 28, 281–285. DOI: 10.1038 /
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Х.и Бутрос П. С. (2011). VennDiagram: пакет для создания настраиваемых диаграмм Венна и Эйлера в R. BMC Bioinformatics 12:35. DOI: 10.1186 / 1471-2105-12-35
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, X., Ли, Л., Аль-Фаррадж, С.А., Ма, Х., и Пан, Х. (2018a). Таксономические исследования Aegyria apoliva sp. ноя и Trithigmostoma cucullulus (Müller, 1786) Jankowski, 1967 (Ciliophora, Cyrtophoria) с филогенетическими анализами. евро. J. Protistol. 62, 122–134. DOI: 10.1016 / j.ejop.2017.12.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, X., Ван, Y., Sheng, Y., Warren, A., and Gao, S. (2018b). GPSit: автоматизированный метод эволюционного анализа некультивируемых реснитчатых микроэукариот. Мол. Ecol. Ресурс. 18, 700–713. DOI: 10.1111 / 1755-0998.12750
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, X., Пан, Х., Хуанг, Дж., Уоррен, А., Аль-Фаррадж, С.А., и Гао, С. (2016). Новые взгляды на филогению циртофорных инфузорий (Protozoa, Ciliophora): расширенный отбор проб для понимания их эволюционных взаимоотношений. Zool. Scr. 45, 334–348. DOI: 10.1111 / zsc.12150
CrossRef Полный текст | Google Scholar
Чен, X., Чжао, X., Лю, X., Уоррен, А., Чжао, Ф., и Мяо, М. (2015). Филогеномика немодельных инфузорий на основе транскриптомного анализа. Protein Cell 6, 373–385.DOI: 10.1007 / s13238-015-0147-143
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, Y. G., Kim, M. V., Chen, X., Batista, P.J., Aoyama, S., Wilusz, J. E., et al. (2017). Восприятие собственных и чужих кольцевых РНК по идентичности интронов. Мол. Cell 67, 228–238. DOI: 10.1016 / j.molcel.2017.05.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ciccarelli, F. D., Doerks, T., Von Mering, C., Creevey, C. J., Snel, B., and Bork, P.(2006). К автоматической реконструкции дерева жизни с высоким разрешением. Наука 311, 1283–1287. DOI: 10.1126 / science.1123061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корлисс Дж. (1979). Ресничные простейшие. Характеристика, классификация и руководство по литературе. Оксфорд: Pergamon Press.
Google Scholar
де Пуйторак, П. (1994). «Phylum ciliophora doflein, 1901», в Traitéde Zoologie, Tome II, Infusoires Ciliés, Fasc.2, Systématoque. Ed. П. де Пуйторак. (Париж: Массон) 1–15.
Google Scholar
де Пуйторак, П., и Нджине, Т. (1980). Предлагаемые ультраструктуры кортикальной и буксальной ресничек гипостомы Nassula tumida Maskell, 1887. Protistologica 16, 315–327.
Google Scholar
Дьюи, К. Н., Рогозин, И. Б., Кунин, Е. В. (2006). Компенсаторная взаимосвязь между сайтами сплайсинга и экзонными сигналами сплайсинга в зависимости от длины интронов позвоночных. BMC Genomics 7: 311. DOI: 10.1186 / 1471-2164-7-311
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dobrzaprnska-Kaczanowska, J. (1963). Сравнение морфогенеза ресничек: Chilodonella uncinata (Ehrbg.), Allosphaerium paraconvexa sp. п. et Heliochona scheuteni (Stein). Acta Protozool. 1, 353–394.
Google Scholar
Эдди, С. Р. (2009). Новое поколение инструментов поиска гомологии на основе вероятностного вывода. Genome Inform. 23, 205–211.
PubMed Аннотация | Google Scholar
Эйслер, К. (1988). Электронно-микроскопические наблюдения инфузории Furgasonia blochmanni Fauré-Fremiet, 1967: часть I: обновленная информация о морфологии. евро. J. Protistol. 24, 75–93. DOI: 10,1016 / s0932-4739 (88) 80012-80019
CrossRef Полный текст | Google Scholar
Эйслер К. и Барделе К. (1983). Альвеолоцисты Nassulida: ультраструктура и некоторые филогенетические соображения. Protistologica 19, 95–102.
Google Scholar
Эль-Гебали С., Мистри Дж., Бейтман А., Эдди С. Р., Лучани А., Поттер С. С. и др. (2018). База данных семейств белков Pfam в 2019 году. Nucleic Acids Res. 47, D427 – D432. DOI: 10.1093 / nar / gky995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фарни, Дж. Ф. (1982). Морфология и ультраструктура Spirochona gemmipara Stein, 1852 (Ciliophora, Chonotrichida).I. Structures corticales et buccales de I’adulte 1. J. Protozool. 29, 170–184. DOI: 10.1111 / j.1550-7408.1982.tb04009.x
CrossRef Полный текст | Google Scholar
Фокс-Уолш, К. Л., Доу, Ю., Лам, Б. Дж., Хунг, С.-П., Балди, П. Ф., и Хертель, К. Дж. (2005). Архитектура пре-мРНК влияет на механизмы сплайсинга сайтов. PNAS 102, 16176–16181. DOI: 10.1073 / pnas.0508489102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу, Л., Ниу, Б., Чжу, З., Ву, С., и Ли, В. (2012). CD-HIT: ускорен для кластеризации данных секвенирования следующего поколения. Биоинформатика 28, 3150–3152. DOI: 10.1093 / биоинформатика / bts565
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, Ф., Хуанг, Дж., Чжао, Ю., Ли, Л., Лю, В., Мяо, М., и др. (2017). Систематические исследования инфузорий (Alveolata, Ciliophora) в Китае: прогресс и достижения на основе молекулярной информации. евро. J. Protistol. 61, 409–423. DOI: 10.1016 / j.ejop.2017.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, Ф., Сонг, В., и Кац, Л. А. (2014). Структура генома определяет закономерности эволюции семейства генов у инфузорий, тематическое исследование с использованием Chilodonella uncinata (Protista, Ciliophora, Phyllopharyngea). Evolution 68, 2287–2295. DOI: 10.1111 / evo.12430
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, Ф., Уоррен, А., Zhang, Q., Gong, J., Miao, M., Sun, P., et al. (2016). Основанная на всех данных эволюционная гипотеза реснитчатых протистов с пересмотренной классификацией филума Ciliophora (Eukaryota, Alveolata). Sci. Отчет 6: 24874. DOI: 10.1038 / srep24874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, С., Хуан, Дж., Ли, Дж., И Сун, В. (2012). Молекулярная филогения инфузорий циртофорид (Protozoa, Ciliophora, Phyllopharyngea). PLoS One 7: e33198.DOI: 10.1371 / journal.pone.0033198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гентекаки Э., Колиско М., Гонг Ю. и Линн Д. (2017). Филогеномика решает давнюю эволюционную загадку в мире инфузорий: подкласс Peritrichia является монофилетическим. Мол. Филоген. Evol. 106, 1–5. DOI: 10.1016 / j.ympev.2016.09.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гун, Дж., Стоук, Т., И, З., Мяо, М., Чжан, К., Робертс, Д. М. и др. (2009). Филогения малых субъединиц рРНК показывает, что класс Nassophorea не является монофилетическим (Phylum Ciliophora). J. Eukaryot. Microbiol. 56, 339–347. DOI: 10.1111 / j.1550-7408.2009.00413.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Grabherr, M.G., Haas, B.J., Yassour, M., Levin, J.Z., Thompson, D.A., Amit, I., et al. (2011). Тринити: реконструкция полноразмерного транскриптома без генома из данных RNA-Seq. Нат.Biotechnol. 29, 644–652. DOI: 10.1038 / NBT.1883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грейн Дж. И Батисс А. (1974). Étude ultrastructurale du cilié chonotriche Chilodochona quennerstedti Wallengren, 1895. I. Cortex et columns buccales. J. Protozool. 21, 95–111. DOI: 10.1111 / j.1550-7408.1974.tb03621.x
CrossRef Полный текст | Google Scholar
Гуревич А., Савельев В., Вяххи Н., Теслер Г.(2013). QUAST: инструмент оценки качества сборки генома. Биоинформатика 29, 1072–1075. DOI: 10.1093 / биоинформатика / btt086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаусманн К. и Пек Р. К. (1978). Микротрубочки и микрофиламенты как основные компоненты фагоцитарного аппарата: цитофарингеальная корзина инфузории Pseudomicrothorax dubius . Дифференциация 11, 157–167. DOI: 10.1111 / j.1432-0436.1978.tb00979.х
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хипи, С. М., Мариотти, М., Гладышев, В. Н., Аткинс, Дж. Ф., и Баранов, П. В. (2016). Новые варианты генетического кода инфузорий, включая переназначение всех трех стоп-кодонов на сенсорные кодоны в Condylostoma magnum . Мол. Биол. Evol. 33, 2885–2889. DOI: 10.1093 / molbev / msw166
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янковский, А. В. (1973). Таксономическая ревизия подтипа Ciliophora Doflein, 1901. Zool. Ж. 52, 165–175.
Google Scholar
Jungreis, I., Lin, M. F., Spokony, R., Chan, C. S., Negre, N., Victorsen, A., et al. (2011). Свидетельства обильного считывания стоп-кодонов у Drosophila и других многоклеточных. Genome Res. 21, 2096–2113. DOI: 10.1101 / gr.119974.110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Келлер, О., Коллмар, М., Станке, М., и Ваак, С. (2011). Новый метод предсказания гибридных генов, использующий выравнивание множественных последовательностей белков. Биоинформатика 27, 757–763. DOI: 10.1093 / биоинформатика / btr010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кивимаки, К. Л., Боудич, Б. М., Риордан, Г. П., и Липскомб, Д. Л. (2009). Филогения и систематическое положение Zosterodasys (Ciliophora, Synhymeniida): комбинированный анализ родства инфузорий с использованием морфологических и молекулярных данных. J. Eukaryot. Microbiol. 56, 323–338. DOI: 10.1111 / j.1550-7408.2009.00403.х
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кивимаки, К. Л., Риордан, Г. П., и Липскомб, Д. (1997). Ультраструктура Zosterodasys agamalievi (Ciliophora: Synhymeniida). J. Eukaryot. Microbiol. 44, 226–236. DOI: 10.1111 / j.1550-7408.1997.tb05705.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар, С., Стечер, Г., Тамура, К. (2016). MEGA7: анализ молекулярной эволюционной генетики, версия 7.0 для больших наборов данных. Мол. Биол. Evol. 33, 1870–1874. DOI: 10.1093 / molbev / msw054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Курт Т. и Барделе К. Ф. (2001). Тонкая структура циртофорид инфузории Chlamydodon mnemosyne Ehrenberg, 1837. Acta Protozool. 40, 33–47.
Google Scholar
Лартильо, Н., Лепаж, Т., и Бланкар, С. (2009). PhyloBayes 3: байесовский программный пакет для филогенетической реконструкции и молекулярного датирования. Bioinformatics 25, 2286–2288. DOI: 10.1093 / биоинформатика / btp368
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ляо, В., Фань, X., Чжан, К., Сюй, Ю., и Гу, Ф. (2018). Морфология и филогения двух новых инфузорий, Arcanisutura chongmingensis n. gen., n. sp. и Naxella paralucida n. sp. из Шанхая, Китай. J. Eukaryot. Microbiol. 65, 48–60. DOI: 10.1111 / jeu.12431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лозупоне, К.А., Найт, Р. Д., Ландвебер, Л. Ф. (2001). Молекулярные основы изменения ядерно-генетического кода инфузорий. Curr. Биол. 11, 65–74. DOI: 10.1016 / s0960-9822 (01) 00028-28
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, С., Цзун, К., Фан, В., Янг, М., Ли, Дж., Чепмен, А. Р. и др. (2012). Исследование мейотической рекомбинации и анеуплоидии отдельных сперматозоидов с помощью полногеномного секвенирования. Наука 338, 1627–1630. DOI: 10.1126 / science.1229112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Людвиг, В., и Кленк, Х. (2001). «Филогенетическая основа и таксономическая основа для систематики прокариот», В Археи и глубоко ветвящиеся и фототрофные бактерии. ред DR. Boone. И RW. Кастенхольц (Нью-Йорк, Нью-Йорк: Springer-Verlag).
Google Scholar
Линн, Д. Х. (2008). Ресничные простейшие: характеристика, классификация и руководство по литературе. Берлин: Springer.
Google Scholar
Линн, Д. Х. (2016). Последовательность гена малой субъединицы рРНК chonotrich Chilodochona carcini Jankowski, 1973 подтверждает, что chonotrichs являются кладой, происходящей от дистериидов (Phyllopharyngea, Ciliophora). Внутр. J. Syst. Evol. Microbiol. 66, 2959–2964. DOI: 10.1099 / ijsem.0.001127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линн Д. Х., Колиско М. и Бурланд В. (2018). Филогеномный анализ Nassula variabilis n. sp., Furgasonia blochmanni и Pseudomicrothorax dubius подтверждают нассофорическую кладу. Protist 169, 180–189. DOI: 10.1016 / j.protis.2018.02.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линн, Д.Х. и Смолл Э. (1997). Пересмотренная классификация филума Ciliophora Doflein, 1901. Rev. Soc. Мекс. Hist. Nat. 47, 65–78.
PubMed Аннотация | Google Scholar
Линн, Д. Х., Смолл, Э. Б. (2002). «Иллюстрированный путеводитель по простейшим», в Общество протозоологов, Тип Ciliophora Doflein, 1901, , 2-е изд., Ред. Дж. Дж. Ли., Дж. Ф. Лидейл и П. Брэдбери, (Лоуренс: Allen Press), 371–656.
Google Scholar
Маэре, С., Хейманс, К., и Койпер, М. (2005). BiNGO: плагин Cytoscape для оценки чрезмерной представленности категорий генной онтологии в биологических сетях. Биоинформатика 21, 3448–3449. DOI: 10.1093 / биоинформатика / bti551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакГрат, К. Л., Зуфалл, Р. А., и Кац, Л. А. (2007). Вариация содержания макронуклеарного генома у трех инфузорий с обширной фрагментацией хромосом: предварительный анализ. J. Eukaryot.Microbiol. 54, 242–246. DOI: 10.1111 / j.1550-7408.2007.00257.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер М. А., Пфайфер В. и Шварц Т. (2010). «Создание научного шлюза CIPRES для вывода больших филогенетических деревьев», в 2010 Gateway Computing Environments Workshop (GCE) , (Piscataway, NY: IEEE), 1–8.
Google Scholar
Митчелл, А.Л., Эттвуд, Т.К., Бэббит, П.К., Блюм, М., Борк, П., Бридж, А., и другие. (2018). InterPro в 2019 году: улучшение охвата, классификации и доступа к аннотациям последовательностей белков. Nucleic Acids Res. 47, D351 – D360. DOI: 10.1093 / nar / gky1100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нурк С., Банкевич А., Антипов Д., Гуревич А. А., Коробейников А., Лапидус А. и др. (2013). Сборка одноклеточных геномов и мини-метагеномов из химерных продуктов MDA. J. Comput. Биол. 20, 714–737. DOI: 10.1089 / куб.2013.0084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нюландер, Дж. (2004). MrModeltest v2. Программа распространяется автором. Упсала: Уппсальский университет.
Google Scholar
Пан, Х., Ван, Л., Цзян, Дж., И Стоук, Т. (2016). Морфология четырех циртофорных инфузорий (Protozoa, Ciliophora) из дельты Янцзы, Китай, с примечаниями о филогении рода Phascolodon . евро. J. Protistol. 56, 134–146.DOI: 10.1016 / j.ejop.2016.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пенн, О., Привман, Э., Ашкенази, Х., Ландан, Г., Граур, Д., и Пупко, Т. (2010). GUIDANCE: веб-сервер для оценки показателей достоверности согласования. Nucleic Acids Res. 38 (Дополнение_2), W23 – W28. DOI: 10.1093 / nar / gkq443
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пертеа М., Ким Д., Пертеа Г. М., Лик Дж. Т. и Зальцберг С. Л. (2016).Анализ экспрессии на уровне транскриптов в экспериментах с РНК-секвенцией с помощью HISAT, StringTie и Ballgown. Нат. Protoc. 11, 1650–1667. DOI: 10.1038 / nprot.2016.095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пиовезан, А., Каракаузи, М., Риччи, М., Стрипполи, П., Витале, Л., и Пеллери, М. К. (2015). Идентификация минимальных эукариотических интронов с помощью GeneBase, удобного инструмента для анализа банка данных NCBI Gene. DNA Res. 22, 495–503. DOI: 10.1093 / днарес / dsv028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ricard, G., de Graaf, R.M., Dutilh, B.E., Duarte, I., van Alen, T.A., van Hoek, A.H., et al. (2008). Макроядерная структура генома инфузории Nyctotherus ovalis : моногенные хромосомы и крошечные интроны. BMC Genomics 9: 587. DOI: 10.1186 / 1471-2164-9-587
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ронквист, Ф., Тесленко, М., Ван Дер Марк, П., Эйрес, Д. Л., Дарлинг, А., Хона, С. и др. (2012). MrBayes 3.2: эффективный байесовский филогенетический вывод и выбор модели в большом модельном пространстве. Syst. Биол. 61, 539–542. DOI: 10.1093 / sysbio / sys029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рой М., Ким Н., Син Ю. и Ли К. (2008). Влияние длины интрона на соотношение создания экзонов в ходе эволюции геномов млекопитающих. РНК 14, 2261–2273. DOI: 10.1261 / rna.1024908
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шеннон П., Маркиел А., Озьер О., Балига Н. С., Ван Дж. Т., Рэймидж Д. и др. (2003). Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Genome Res. 13, 2498–2504. DOI: 10.1101 / gr.1239303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Слабодник, М. М., Руби, Дж. Г., Рейфф, С. Б., Сварт, Э. К., Госаи, С., Prabakaran, S., et al. (2017). Макроядерный геном Stentor coeruleus обнаруживает крошечные интроны в гигантской клетке. Curr. Биол. 27, 569–575. DOI: 10.1016 / j.cub.2016.12.057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смолл, Э. Б. и Линн, Д. Х. (1985). «Phylum Ciliophora, Doflein, 1901» в г. Иллюстрированное руководство по простейшим. Eds J.J. Ли., С. Х. Хатнер и Э. К. Бови (Канзас: Общество протозоологов) 393–575.
Google Scholar
Сварт, Э. К., Брахт, Дж. Р., Магрини, В., Минкс, П., Чен, X., Чжоу, Ю. и др. (2013). Макроядерный геном Oxytricha trifallax : сложный эукариотический геном с 16 000 крошечных хромосом. PLoS Biol. 11: e1001473. DOI: 10.1371 / journal.pbio.1001473
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сварт, Э. К., Серра, В., Петрони, Г., и Новацки, М. (2016). Генетические коды без выделенного стоп-кодона: контекстно-зависимое завершение трансляции. Cell 166, 691–702. DOI: 10.1016 / j.cell.2016.06.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такер, Дж. Б. (1968). Тонкая структура и функция цитофарингеальной корзины инфузорий Nassula . J. Cell Sci. 3, 493–514. DOI: 10.1016 / j.lwt.2014.09.005
CrossRef Полный текст | Google Scholar
Ван, Ю., Ван, К., Цзян, Ю., Кац, Л. А., Гао, Ф., и Янь, Ю. (2019). Дальнейший анализ вариации числа копий рибосомной ДНК и полиморфизма у инфузорий обеспечивает понимание, относящееся к исследованиям как молекулярной экологии, так и филогении. Sci. China Life Sci. 62, 203–214. DOI: 10.1007 / s11427-018-9422-9425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weisenberg, R.C., Broisy, G.G., и Taylor, E.W. (1968). Колхицин-связывающий белок мозга млекопитающих и его связь с микротрубочками. Биохимия 7, 4466–4479. DOI: 10.1021 / bi00852a043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уикхэм, Х. (2016). Ggplot2: Элегантная графика для анализа данных. Берлин: Springer.
Google Scholar
Woese, C., Achenbach, L., Rouviere, P., and Mandelco, L. (1991). Филогения архей: пересмотр филогенетического положения Archaeoglohus fulgidus в свете некоторых артефактов, обусловленных составом. Syst. Appl. Microbiol. 14, 364–371. DOI: 10.1016 / s0723-2020 (11) 80311-80315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, К., И, З., Фань, X., Уоррен, А., Гонг Дж. И Сонг У. (2014). Дальнейшее изучение филогении двух классов инфузорий Nassophorea и Prostomatea (Protista, Ciliophora). Мол. Филоген. Evol. 70, 162–170. DOI: 10.1016 / j.ympev.2013.09.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Т., Ван, К., Кац, Л. А., и Гао, Ф. (2018). Парадокс: быстрые темпы эволюции последовательностей, ограниченных зародышевой линией, связаны с законсервированными паттернами перестроек у криптических видов Chilodonella uncinata (Protista, Ciliophora). Sci. China Life Sci. 61, 1071–1078. DOI: 10.1007 / s11427-018-9333-9331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zong, C., Lu, S., Chapman, A. R., and Xie, X. S. (2012). Общегеномное обнаружение однонуклеотидных вариаций и вариаций числа копий одной клетки человека. Наука 338, 1622–1626. DOI: 10.1126 / science.1229164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бактерии
Идентификация: Инфузории — более сложные организмы, чем амебы и жгутиковые.Более 7000 известных разновидности существуют одних из самых сложных одноклеточных организмов, когда-либо существовавших. Вольно плавающие инфузории покрыты ресничками, волосковидные выступы, однородные и выровненные рядами. Инфузории перемещаются и захватывают пищу с помощью ресничек. Передняя часть инфузории — это оральная область, которая также покрыта ресничками. Ареал инфузорий в свободном плавании размером от 20-400 м и имеют два вида ядер. Половое размножение — спряжение. Свободные пловцы плавают быстрее чем жгутиковые, поэтому они могут побеждать их в борьбе за еду.Инфузории питаются бактериями, а не растворенной органикой. Пока бактерии и жгутики конкурируют за растворенные органические вещества, инфузории конкурируют с другими инфузориями и коловратками за бактерии. Обычно они являются показателем отстоя хорошего качества. Обычно они встречаются в илах молодого и среднего возраста.Дополнительная информация: Свободно плавающие инфузории — это простейшие, принадлежащие к типу Ciliophora. Много разных существуют виды свободно плавающих инфузорий, в том числе «ползающие» инфузории.Некоторые типы, обычно встречающиеся в сточных водах: Paramecium, Euplotes и Aspidisca.
У ползающих инфузорий есть реснички в основном на нижней поверхности тела, которые делают их ногами. Это организмы со сложными цилиарными органеллами, называемыми усиками, раньше ходили. Обычно они уплощены дорсовентрально. Обычно в сточных водах встречаются представители рода Aspidisca и рода Euplotes. Чтобы ползучие инфузории были доминирующей, должны присутствовать крупные хлопьевидные структуры, которые препятствуют свободному плаванию и перемещению жгутиконосцев и обеспечивают поверхность, по которой «ходят» краулеры.Это означает, что F: M становится ниже, и бактерии начали образовывать конструкции из хлопьев. Кроулеры также требуют высокого D.O. содержание в смешанном ликере. Возраст ила ближе к средневековью, чем молодой. Ползучие инфузории обычно указывают на стабильную среду сточных вод и здоровый ил.
Где найдено: Они встречаются в различных типах воды, включая пресную и сточную воду. Свободное плавание инфузории важны, потому что они работают с бактериями.Они питаются бактериями и, таким образом, помогают прояснить сточные воды. Они могут быть обнаружены в большинстве периодов отстоя, но преобладают в среднем возрасте отстоя.
Как их найти: Микроскопическое исследование мокрого образца.
Инфузории
1. Возьмите одну 11,5 унций. (340 мл) банку сока XX (я полагаю, подойдет любой овощной сок) и процедите его через сито 500 микрон. Типичная сетка окна составляет 1000 микрон, а те маленькие ситечки из нержавеющей стали, которые вы можете купить в супермаркете, имеют размер около 500 микрон.Это процеживание удаляет более крупные частицы, которые не помогают культуре.2. Разбавьте процеженный сок примерно одним литром (950 мл) холодной пресной воды. Сок легче процедить, если его предварительно разбавить или во время процеживания.
3. Добавьте две чайные ложки пекарских дрожжей. Дрожжи не являются обязательными, это в основном кормовая добавка к частицам сока, но я считаю, что культура более стабильна, так как пища дольше остается в суспензии, и это помогает коловраткам поддерживать высокий уровень популяции и снижает потребность в более частых кормлениях. .Количество или даже использование дрожжей — предмет будущих экспериментов.
4. Затем я добавляю несколько капель добавки с жирными кислотами омега-3 (Super Selco, другой вид пищевой добавки для рыб или даже добавки с омега-3 или рыбьим жиром из магазина здорового питания) в раствор сока, а также добавляю предварительно растворенная таблетка витаминного комплекса B и таблетка витамина C. Плотно положить верхнюю часть на емкость и хорошо встряхнуть. Вполне возможно, что разные добавки или разное количество этих добавок дадут лучший корм для коловраток.Предстоит провести много экспериментов.
Эту смесь затем хранят в холодильнике, и порцию ежедневно скармливают культурам коловраток в количестве, соответствующем цели культуры. Я скармливаю от 30 до 50 мл в день каждой галлоновой банке с коловратками, чтобы поддерживать популяции коловраток на низком уровне в периоды между проектами разведения. Для высокой продуктивности потребуется как минимум два, а возможно, три одинаковых кормления в день. Перед кормлением хорошо перемешайте смесь.
Одной из хороших / плохих новостей при работе с этой формулой коловраток было то, что она была превосходной средой для инфузорий нескольких видов и размеров.Один был размером примерно 10 микрон, а другой — примерно 30 микрон, с некоторыми промежуточными размерами, и они иногда процветали в огромных количествах. Мне пришлось разработать методы для отсеивания коловраток и создания новых культур, когда количество коловраток начинает уменьшаться. Позволяя культуре осесть, откачивая смесь коловраток / инфузорий над осадком, а затем пропуская культуру через сетку размером 53 микрона, коловратки и инфузории достаточно хорошо отделяются. (Интересно отметить, что некоторые представители аквакультуры в Японии используют инфузории для улучшения здоровья культур коловраток, поскольку инфузории питаются бактериями в культурах.)
Это дает нам инструмент для поиска инфузорий, которые могут быть полезны при выращивании личинок некоторых морских рыб. Также можно использовать другие органические препараты, картофель, солому, фруктовый сок, водоросли и т. Д., И вполне может быть лучшая основа, но я бы начал с формулы овощного сока, указанной выше, просто потому, что раньше она работала хорошо.
После приготовления формулы овощного сока следующим шагом будет создание нескольких галлоновых банок смеси и добавление легкой аэрации, чтобы смесь оставалась суспендированной и насыщенной кислородом.На каждую банку с соленой водой нужно от 30 до 50 мл смеси. Теперь все, что нам нужно сделать, это найти источник некоторых видов инфузорий, которые могут оказаться полезными. Некоторые виды инфузорий могут быть доступны из коммерческих образовательных культур, таких как Didinium, Paramecium и Euplotes, и их можно попробовать, но лучшая возможность для морских видов может быть естественным источником. Эти экспериментальные культуры можно засеять живым песком, живыми камнями или даже водой из природного морского источника. Также можно попробовать немного живого песка и / или камня из старого установленного рифового аквариума.Эксперименты с различной соленостью, температурой и источниками потенциальных инфузорий, вероятно, приведут к появлению большого разнообразия культивируемых инфузорий, которые могут быть выбраны для более крупных видов. Микроскоп будет наиболее полезным инструментом для этой работы, но 10-кратной петли может быть достаточно.
Как только возможный вид-кандидат найден, нужного размера и в большом количестве, следует попытаться создать чистую культуру этого вида. Следует попытаться посеять новую культуру чистым образцом только этого организма.Однако без хорошей лабораторной техники это может быть невозможно. Фактически, возможно, что культуры инфузорий лучше, когда в культуре присутствуют некоторые коловратки. В примитивных условиях иногда лучшее, что можно сделать, — это начать новую культуру с максимально возможной массированной инокуляцией целевого организма и надеяться, что преимущество, данное желаемым видам, будет достаточным, чтобы вырастить конкуренцию, по крайней мере. первоначально.
Дайте культуре осторожно вращаться с помощью воздушного камня и наблюдайте за ней в течение недели или около того.Я уверен, что вы попадете в дикую культуру инфузорий (неизвестно каких видов). Будут ли они работать как успешный корм для личинок — это другой вопрос. В наши дни нетрудно содержать гнездящуюся пару или гарем свиней-ангелов, стрекоз, иногда мандаринок, может быть, одного или двух видов губанов и некоторых мелких бычков с икрой. Эти и другие виды могут предоставить большое количество личинок для экспериментальных испытаний первого кормления. Добавьте кормовые организмы в количестве примерно 3 на мл в личиночный резервуар, возможно, за день или ночь перед ожидаемым первым кормлением.Это примерно то время, когда желточный мешок демерсально отнерестившейся личинки абсорбируется и примерно через три дня после вылупления пелагически нерестившихся личинок. Когда начинается первое кормление, должны произойти две вещи. Личинки рыбы должны иметь полный кишечник всегда, кроме первых дел с утра, а личинки рыбы должны заметно вырасти через два-три дня после начала кормления. Опять же, 10-кратная петля или, еще лучше, микроскоп для рассечения очень важен. Если эти два события происходят, то личинки рыб могут принимать пищевые организмы, и этот пищевой организм, по крайней мере, является адекватным с точки зрения питания.Пришло время выпить шампанское.
Размер тела, размер генома и внутренняя скорость увеличения ресничных простейших по JSTOR
Взаимосвязь между rm и размером тела инфузорий была рассмотрена с использованием данных, в основном взятых из литературы. Даже в диапазоне 3,5 порядка величины объема тела только на размер приходится около 42% вариации rm. Были представлены данные, которые указывают на то, что остаточная вариация связана с относительным размером макронуклеуса и микронуклеуса, что интерпретируется как отражение размера генома.Инфузории, которые могут быстро размножаться из-за своего размера, имеют относительно небольшие микроядра или геномы для своего размера, и наоборот. Предполагается, что ядерный дуализм, как и многоклеточность, является средством достижения определенной степени независимости между размером тела и rm. Эти идеи обсуждаются в связи с гипотезой отбора r-K и экологическими свойствами видов. Мы предлагаем, чтобы rm или размер не использовались сами по себе как индикаторы положения вида в континууме r-K. Отмечается потенциал этих результатов в качестве основы для оценки темпов роста диких популяций.
Текущие выпуски теперь размещены на веб-сайте Chicago Journals. Прочтите последний выпуск. С момента своего создания в 1867 году журнал The American Naturalist сохраняет свои позиции в качестве одной из ведущих рецензируемых публикаций в мире по вопросам экологии, эволюции и исследований поведения. Его цели — публиковать статьи, представляющие широкий интерес читателям, ставить новые и важные проблемы, знакомить с новыми предметами, развивать концептуальную унификацию и изменять образ мышления людей.AmNat делает упор на сложные методологии и новаторские теоретические синтезы — все в попытке продвинуть знание органической эволюции и других широких биологических принципов.
С момента своего основания в 1890 году в качестве одного из трех основных подразделений Чикагского университета, University of Chicago Press взяла на себя обязательство распространять стипендии высочайшего стандарта и публиковать серьезные работы, которые способствуют образованию и способствуют пониманию общества. , и обогатить культурную жизнь.Сегодня Отдел журналов издает более 70 журналов и сериалов в твердом переплете по широкому кругу академических дисциплин, включая социальные науки, гуманитарные науки, образование, биологические и медицинские науки, а также естественные науки.
Перейти к основному содержанию ИскатьИскать
- Где угодно
- Быстрый поиск где угодно
Искать Искать
- Войти | регистр
- Подписка / продление
- Учреждения
- Индивидуальные подписки
- Индивидуальное продление
- Библиотекари 9174 9174 9174 9174 9174
- Пакет для Чикаго
- Полный цикл и охват содержимого
- Файлы KBART и RSS-каналы
- Разрешения и перепечатки
- Инициатива для развивающихся стран Чикаго
- Даты отправки и претензии
- Часто задаваемые вопросы библиотекарей
- , заказы
- и платежи
- О нас
- Публикуйте у нас
- Новые 12 изданий
- tners
- Подпишитесь на уведомления eTOC
- Пресс-релизы
- СМИ
- Книги издательства Чикагского университета
- Распределительный центр в Чикаго
- Чикагский университет
- Положения и условия
- Заявление об издательской этике
- Уведомление о конфиденциальности
- Доступность Chicago Journals
- Доступность университета
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
- Свяжитесь с нами
- Запросы СМИ и рекламы
- Открытый доступ в Чикаго
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
% PDF-1.2 % 132 0 объект > endobj xref 132 70 0000000016 00000 н. 0000001751 00000 н. 0000001902 00000 н. 0000002813 00000 н. 0000003046 00000 н. 0000003113 00000 п. 0000003351 00000 п. 0000003441 00000 п. 0000003530 00000 н. 0000003640 00000 н. 0000003743 00000 н. 0000003884 00000 н. 0000003984 00000 н. 0000004091 00000 н. 0000004207 00000 н. 0000004335 00000 н. 0000004453 00000 п. 0000004714 00000 н. 0000005542 00000 н. 0000006101 00000 п. 0000006631 00000 н. 0000007097 00000 п. 0000007278 00000 н. 0000025282 00000 п. 0000025304 00000 п. 0000025989 00000 п. 0000026446 00000 н. 0000027143 00000 п. 0000027165 00000 п. 0000027479 00000 п. 0000027951 00000 п. 0000028258 00000 п. 0000028424 00000 п. 0000034415 00000 п. 0000035004 00000 п. 0000035026 00000 п. 0000035284 00000 п. 0000035704 00000 п. 0000035792 00000 п. 0000036093 00000 п. 0000036384 00000 п. 0000036578 00000 п. 0000036826 00000 п. 0000036899 00000 н.
