Статьи
У Вас появился инвертированный биологический микроскоп Эврика 40х-320х! Вы изучили под ним воду из канавы, воду из вазы с букетом цветов… Вы посмотрели все, что можно было быстро налить в чашечку Петри. Что же теперь? Давайте попробуем провести настоящие научные исследования. От Вас потребуется терпение, время и фантазия.
Мы вырастим колонии бактерий в чашечке, которая идет в комплекте с микроскопом. Вы можете приобрести несколько чашек, чтобы выращивать несколько разных колоний одновременно. Думаю, Вы будете поражены разнообразием бактерий, которые окружают нас.
Будьте осторожны! Эти опыты рекомендуются для детей старше 8 лет и только под наблюдением взрослых! Опыты включают использование кипящей воды и хлорки. Взрослый контроль обязателен!
Нам понадобится:
• Порошок агар-агар. Он продается в продуктовых магазинах в том же отделе, где ванилин, желатин, корица и другие вкусности для выпечки.
• ¼ стакана воды.
• 1 чайная ложка сахара.
• Маленькая кастрюлька или ковшик для кипящей смеси.
• Чашки Петри.
• Ложка.
• Клейкая лента.
• Резиновые перчатки.
• Ватные палочки.
• Инкубатор. В качестве инкубатора мы будем использовать какое-нибудь теплое место. Зимой удобно использовать место рядом с обогревателем. А летом, когда батареи выключены, можно использовать место за холодильником.
Приступим:
Для начала не забываем пригласить взрослого человека присоединиться к нашему опыту. Нам очень потребуется его помощь.
1. Наливаем воду в кастрюлю (ковшик) и доводим до кипения. Растворяем сахар в этой воде.
2. Добавляем порошок агар-агар в кипящую воду и перемешиваем в течение минуты, пока он полностью растворится.
3. Охлаждаем смесь в течение нескольких минут. Во-первых, смесь должна быть еще горячей, чтобы избежать установки желе прямо в кастрюле. А во-вторых, нам необходимо предотвратить загрязнение нашей смеси бактериями из воздуха. Наши домашние условия далеки от стерильности, но мы постараемся избежать лишних загрязнений.
Охлаждаем смесь в течение нескольких минут. Во-первых, смесь должна быть еще горячей, чтобы избежать установки желе прямо в кастрюле. А во-вторых, нам необходимо предотвратить загрязнение нашей смеси бактериями из воздуха. Наши домашние условия далеки от стерильности, но мы постараемся избежать лишних загрязнений.
4. Открываем чашку Петри. И сразу просим взрослого помощника налить на ее дно горячую смесь из кастрюльки. Заранее открывать не надо, чтобы лишние бактерии не мешали нашему опыту.
5. Накрываем крышкой чашку Петри и убираем ее в холодильник примерно на 4 часа. За это время установится желе.
6. Теперь пришло время собирать бактерии и выращивать колонии на агар-агаре в чашке Петри.
Примечание: чашки Петри с застывшим агар-агаром можно хранить в холодильнике в течение 1-2 месяцев перед использованием. Нужно их перевернуть, чтобы конденсат не испортил подготовленную питательную среду.
7. Бактерии собрать не трудно, потому что они есть повсюду. Берем чистую ватную палочку и проводим ею там, где хотим найти бактерии – на грязной посуде или под ногтями на руках, или на земле, или на ручке двери, или на мобильном телефоне, или на клавиатуре. Потом аккуратно проводим этой палочкой по застывшему агар-агару в чашке Петри.
Бактерии собрать не трудно, потому что они есть повсюду. Берем чистую ватную палочку и проводим ею там, где хотим найти бактерии – на грязной посуде или под ногтями на руках, или на земле, или на ручке двери, или на мобильном телефоне, или на клавиатуре. Потом аккуратно проводим этой палочкой по застывшему агар-агару в чашке Петри.
8. Закрываем чашки Петри крышками и заклеиваем скотчем. Чтобы не перепутать чашки, наклеиваем на них наклейки с надписями (откуда были собраны бактерии). Переворачиваем и убираем в инкубатор (теплое темное место). Переворачивать нужно для того, чтобы капли, которые могут образоваться на крышке от испарения, не падали на наш объект исследования. Оставляем на несколько дней.
9. Через несколько дней можно наблюдать под микроскопом, что происходит в чашке Петри. Мы увидим, как начали расти колонии. Раз в день или раз в несколько дней можно проверять, какие происходят изменения.
10. Хотя бактерии, которые мы собрали дома, вероятно, будут безвредными, предосторожность не помешает. Нам снова потребуется помощь взрослого, поскольку пластмассовую чашку Петри нужно хорошенько вымыть хлорным раствором, и только потом утилизировать. Если у Вас стеклянная чашка Петри, то ее можно использовать повторно после стерилизации. Напомните Вашему взрослому помощнику о необходимости надеть резиновые перчатки. Ни в коем случае не работайте с хлоркой самостоятельно!
Нам снова потребуется помощь взрослого, поскольку пластмассовую чашку Петри нужно хорошенько вымыть хлорным раствором, и только потом утилизировать. Если у Вас стеклянная чашка Петри, то ее можно использовать повторно после стерилизации. Напомните Вашему взрослому помощнику о необходимости надеть резиновые перчатки. Ни в коем случае не работайте с хлоркой самостоятельно!
Если опыт не получился с первого раза, не отчаивайтесь. Попросите совета у учителя биологии в школе. Некоторые виды бактерий любят животную среду, и для них нужно добавить в агар-агар питательную среду, например говяжий бульон. Другие бактерии хорошо размножаются на растительно среде, для них можно добавить картофельный отвар.
Почему это происходит?
Бактерии настолько малы, что их нельзя увидеть невооруженным глазом. Но если их поместить на питательную среду и создать им комфортные условия для размножения, то каждая бактерия вырастает в колонию из тысячи бактерий. И вот колонию уже можно разглядеть в микроскоп. Вырастить бактерии может оказаться не просто. Поэтому не сдавайтесь, если ваши первые попытки потерпят неудачу. Но когда опыт будет удачным, подсчитайте количество колоний и обратите внимание на различия в цвете, форме и размере. Где Вы обнаружили больше бактерий? Попробуйте в середину растущей колонии добавить капельку дезинфицирующего средства для рук или средство для мытья унитаза. Произойдут ли изменения в росте и форме колонии?
И вот колонию уже можно разглядеть в микроскоп. Вырастить бактерии может оказаться не просто. Поэтому не сдавайтесь, если ваши первые попытки потерпят неудачу. Но когда опыт будет удачным, подсчитайте количество колоний и обратите внимание на различия в цвете, форме и размере. Где Вы обнаружили больше бактерий? Попробуйте в середину растущей колонии добавить капельку дезинфицирующего средства для рук или средство для мытья унитаза. Произойдут ли изменения в росте и форме колонии?
Микроскопия в домашних условиях | Наука и жизнь
Вот уже два года, как я наблюдаю за микромиром у себя дома, и год, как снимаю его на фотокамеру. За это время собственными глазами увидел, как выглядят клетки крови, чешуйки, опадающие с крыльев бабочек, как бьётся сердце улитки. Конечно, многое можно было бы узнать из учебников, видеолекций и тематических сайтов. Но при этом не было бы ощущения присутствия, близости к тому, что не видно невооружённым глазом. Что это не просто слова из книжки, а личный опыт. Опыт, который сегодня доступен каждому.
Опыт, который сегодня доступен каждому.Кожица лука. Увеличение 1000×. Окраска йодом. На фотографии видно клеточное ядро.
Кожица лука. Увеличение 1000×. Окраска азур-эозином. На фотографии в ядре заметно ядрышко.
Картофель. Синие пятна — зёрна крахмала. Увеличение 100×. Окраска йодом.
Плёнка на спине таракана. Увеличение 400×.
Кожура сливы. Увеличение 1000×.
Крыло жучка бибиониды. Увеличение 400×.
Крыло бабочки боярышницы. Увеличение 100×.
Чешуйки с крыльев моли. Увеличение 400×.
Хлоропласты в клетках травы. Увеличение 1000×.
Детёныш улитки. Увеличение 40×.
Лист клевера. Увеличение 100×. Некоторые клетки содержат тёмно-красный пигмент.
Лист земляники. Увеличение 40×.
Хлоропласты в клетках водоросли. Увеличение 1000×.
Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: эозинофил на фоне эритроцитов.
Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: слева — моноцит, справа — лимфоцит.
На фотографии: слева — моноцит, справа — лимфоцит.
‹
›
Открыть в полном размере
Что купить
Театр начинается с вешалки, а микросъёмка с покупки оборудования, и прежде всего — микроскопа. Одна из основных его характеристик — набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива.
Не всякий биологический образец хорош для просмотра при большом увеличении. Связано это с тем, что чем больше увеличение оптической системы, тем меньше глубина резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров, позволяющий вести наблюдения с увеличением от 10—20 до 900—1000×. Иногда бывает оправданно добиться увеличения 1500× (окуляр 15 и объектив 100×). Большее увеличение бессмысленно, так как более мелкие детали не позволяет видеть волновая природа света.
Следующий немаловажный момент — тип окуляра. «Сколькими глазами» вы хотите рассматривать изображение? Обычно выделяют монокулярную, бинокулярную и тринокулярную его разновидности. В случае монокуляра придётся щуриться, утомляя глаз при длительном наблюдении. В бинокуляр смотрят обоими глазами (не следует путать его со стереомикроскопом, дающим объёмное изображение). Для фото- и видеосъёмки микрообъектов понадобится «третий глаз» — насадка для установки аппаратуры. Многие производители выпускают специальные камеры для своих моделей микроскопов, но можно использовать и обычный фотоаппарат, купив к нему переходник.
«Сколькими глазами» вы хотите рассматривать изображение? Обычно выделяют монокулярную, бинокулярную и тринокулярную его разновидности. В случае монокуляра придётся щуриться, утомляя глаз при длительном наблюдении. В бинокуляр смотрят обоими глазами (не следует путать его со стереомикроскопом, дающим объёмное изображение). Для фото- и видеосъёмки микрообъектов понадобится «третий глаз» — насадка для установки аппаратуры. Многие производители выпускают специальные камеры для своих моделей микроскопов, но можно использовать и обычный фотоаппарат, купив к нему переходник.
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры объективов. Световой пучок от осветителя, преобразованный в оптическом устройстве — конденсоре, освещает препарат. В зависимости от характера освещения существует несколько способов наблюдения, самые распространённые из которых — методы светлого и тёмного поля. В первом, самом простом, знакомом многим ещё со школы, препарат освещают равномерно снизу.
Оптические системы не идеальны: прохождение света через них сопряжено с искажениями изображения — аберрациями. Поэтому объективы и окуляры стараются изготавливать так, чтобы эти аберрации максимально устранить.
Иногда следует обратить внимание на устройство предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который ярче и греется меньше. Микроскопы тоже имеют индивидуальные особенности. Каждая дополнительная опция — это добавка в цене, поэтому выбор модели и комплектации остаётся за потребителем.
Сегодня нередко покупают недорогие микроскопы для детей, монокуляры с небольшим набором объективов и скромными параметрами. Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Как смотреть
Можно купить далеко не дешёвые наборы готовых препаратов, но тогда не таким ярким будет ощущение личного участия в исследовании, да и наскучат они рано или поздно. Поэтому следует позаботиться и об объектах для наблюдения, и о доступных средствах для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект достаточно тонок. Даже кожура ягоды или фрукта слишком толста, поэтому в микроскопии исследуют срезы. В домашних условиях их делают обычными бритвенными лезвиями. Чтобы не смять кожуру, её помещают между кусочками пробки или заливают парафином. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, а в идеале следует работать с моноклеточным слоем ткани — несколько слоёв клеток создают нечёткое сумбурное изображение.
Исследуемый препарат помещают на предметное стекло и в случае необходимости закрывают покровным. Купить стёкла можно в магазине медицинской техники. Если препарат плохо прилегает к стеклу, его фиксируют, слегка смачивая водой, иммерсионным маслом или глицерином. Не всякий препарат сразу открывает свою структуру, иногда ему нужно «помочь», подкрасив его форменные элементы: ядра, цитоплазму, органеллы. Неплохими красителями служат йод и «зелёнка». Йод достаточно универсальный краситель, им можно окрашивать широкий спектр биологических препаратов.
При выезде на природу следует запастись баночками для набора воды из ближайшего водоёма и маленькими пакетиками для листьев, высохших остатков насекомых и т.п.
Что смотреть
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного — например, кожуры репчатого лука. Тонкая сама по себе, подкрашенная йодом, она обнаруживает в своём строении чётко различимые клеточные ядра. Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10—15 минут, после чего промыть под струёй воды.
Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10—15 минут, после чего промыть под струёй воды.
Кроме того, йод можно использовать для окраски картофеля. Срез необходимо сделать как можно более тонким. Буквально 5—10 минут его пребывания в йоде проявят пласты крахмала, который окрасится в синий цвет.
На балконах часто скапливается большое количество трупиков летающих насекомых. Не торопитесь от них избавляться: они могут послужить ценным материалом для исследования. Как видно из фотографий, вы обнаружите, что на крыльях насекомых есть волоски, которые защищают их от намокания. Большое поверхностное натяжение воды не позволяет капле «провалиться» сквозь волоски и коснуться крыла.
Если вы когда-нибудь задевали крыло бабочки или моли, то, наверное, замечали, что с неё слетает какая-то «пыль». На снимках отчётливо видно, что это не пыль, а чешуйки с крыльев. Они имеют разную форму и довольно легко отрываются.
Кроме того, с помощью микроскопа можно изучить строение конечностей насекомых и пауков, рассмотреть, например, хитиновые плёнки на спине таракана. И при должном увеличении убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.
Не менее интересный объект для наблюдения — кожура ягод и фруктов. Однако либо её клеточное строение может быть неразличимым, либо её толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем получится хороший препарат: перебрать разные сорта винограда, чтобы найти тот, у которого красящие вещества кожуры имели бы интересную форму, или сделать несколько срезов кожицы сливы, добиваясь моноклеточного слоя. В любом случае вознаграждение за проделанную работу будет достойным.
Ещё более доступны для исследования трава, водоросли, листья. Но, несмотря на повсеместную распространённость, выбрать и приготовить из них хороший препарат бывает непросто. Самое интересное в зелени — это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.
Самое интересное в зелени — это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.
Приемлемой толщиной нередко обладают зелёные водоросли, встречающиеся в любых открытых водоёмах. Там же можно найти плавучие водоросли и микроскопических водных обитателей — мальков улитки, дафний, амёб, циклопов и туфелек. Маленький детёныш улитки, оптически прозрачный, позволяет разглядеть у себя биение сердца.
Сам себе исследователь
После изучения простых и доступных препаратов захочется усложнить технику наблюдения и расширить класс исследуемых объектов. Для этого понадобится и специальная литература, и специализированные средства, свои для каждого типа объектов, но всё-таки обладающие некоторой универсальностью. Например, метод окраски по Граму, когда разные виды бактерий начинают различаться по цвету, можно применить и для других, не бактериальных, клеток. Близок к нему и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из его компонентов — азура и эозина. Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.
Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.
Продолжая тему исследования крови, следует упомянуть камеру Горяева — устройство для подсчёта количества клеток крови и оценки их размеров. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
***
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить деньги. Это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Находятся и те, кто отводит свой взор от экранов и направляет его далеко в космос, приобретая телескоп. Микроскопия может стать интересным хобби, а для кого-то даже и искусством, средством самовыражения. Глядя в окуляр микроскопа, проникают глубоко внутрь той природы, часть которой мы сами.
Фото автора.
***
«Наука и жизнь» о микросъёмке:
Микроскоп «Аналит» — 1987, № 1.
Ошанин С. Л. С микроскопом у пруда. — 1988, № 8.
Ошанин С. Л. Невидимая миру жизнь. — 1989, № 6.
Милославский В. Ю. Домашняя микрофотография. — 1998, № 1.
Мологина Н. Фотоохота: макро и микро. — 2007, № 4.
***
Словарик к статье
Апертура — действующее отверстие оптической системы, определяемое размерами зеркал, линз, диафрагм и других деталей. Угол α между крайними лучами конического светового пучка называется угловой апертурой. Числовая апертура А = n sin(α/2), где n — показатель преломления среды, в которой находится объект наблюдения. Разрешающая способность прибора пропорциональна А, освещённость изображения А2. Чтобы увеличить апертуру, применяют иммерсию.
Иммерсия — прозрачная жидкость с показателем преломления n > 1. В неё погружают препарат и объектив микроскопа, увеличивая его апертуру и тем самым повышая разрешающую способность.
В неё погружают препарат и объектив микроскопа, увеличивая его апертуру и тем самым повышая разрешающую способность.
Планахроматический объектив — объектив с исправленной хроматической аберрацией, который создаёт плоское изображение по всему полю. Обычные ахроматы и апохроматы (аберрации исправлены для двух и для трёх цветов соответственно) дают криволинейное поле, которое исправить невозможно.
Фазовый контраст — метод микроскопических исследований, основанный на изменении фазы световой волны, прошедшей сквозь прозрачный препарат. Фаза колебания не видна простым глазом, поэтому специальная оптика — конденсор и объектив — превращает разность фаз в негативное или позитивное изображение.
Моноциты — одна из форм белых клеток крови.
Хлоропласты — зелёные органеллы растительных клеток, отвечающие за фотосинтез.
Эозинофилы — клетки крови, играющие защитную роль при аллергических реакциях.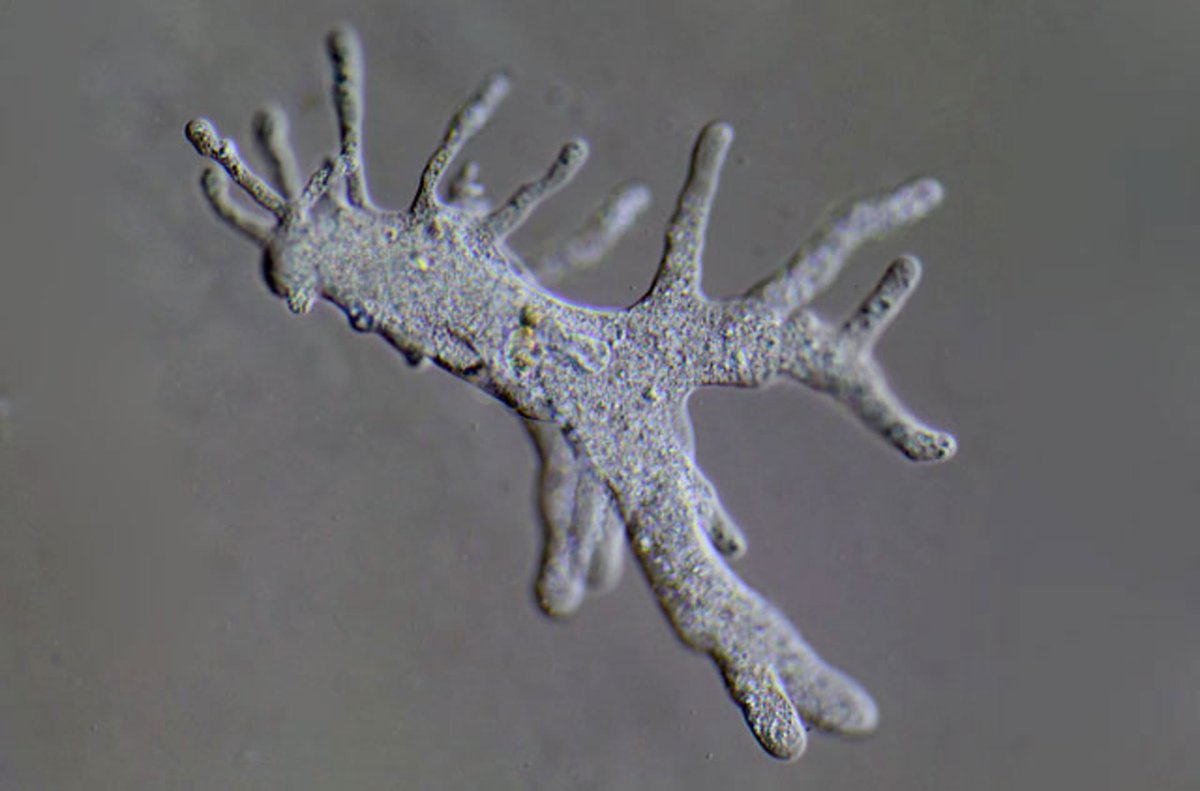
| ||||||||||||||||||||
Выращивание патогенных и условно-патогенных свободноживущих амеб
1. Адам, К. М. Г. 1959. Рост Acanthamoeba sp. в химически определенной среде. J. Gen. Microbiol. 21 : 519-529. [PubMed] [Google Scholar]
2. Адам, К. М. Г. и Д. А. Блеветт. 1967. Утилизация углеводов почвенной амебой Hartmannella castellanii . Дж. Протозол. 14 : 227-282. [PubMed] [Google Scholar]
М. Г. и Д. А. Блеветт. 1967. Утилизация углеводов почвенной амебой Hartmannella castellanii . Дж. Протозол. 14 : 227-282. [PubMed] [Google Scholar]
3. Анзил, А. П., К. Рао, М. А. Врзолек, Г. С. Висвесвара, Дж. Х. Шер и П. Б. Козловски. 1991. Амебный менингоэнцефалит у больного СПИДом, вызванный недавно обнаруженным оппортунистическим возбудителем. Арка Патол. лаборатория Мед. 115 : 21-25. [PubMed] [Google Scholar]
4. Balamuth, W. 1964. Исследования питания аксенических культур Naegleria gruberi . Дж. Протозол. 11 (дополнение) : 19-20. [Google Scholar]
5. Band, RN 1961. Биотин, необходимый для роста четырех почвенных амеб. Nature 192 : 674. [PubMed] [Google Scholar]
6. Band, RN 1962. Потребность почвенной амебы в аминокислотах Hartmannella rhysodes Singh. Дж. Протозол. 9 : 377-379. [PubMed] [Академия Google]
9 : 377-379. [PubMed] [Академия Google]
7. Бэнд, Р. Н. и В. Баламут. 1974. Гемин заменяет сыворотку в качестве условия роста для Naegleria . заявл. микробиол. 28 : 64-65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Баркер Дж., Т. Дж. Хамфри и М. В. Браун. 1999. Выживание Escherichia coli 0157 в почвенном простейшем. Последствия для болезни. ФЭМС микробиол. лат. 173 : 291-295. [PubMed] [Google Scholar]
9. Байерс, Т.Дж., Р.А. Акинс, Б.Дж. Мейнард, Р.А. Лефкен и С.М. Мартин. 1980. Быстрый рост Acanthamoeba в определенных средах; индукция инцистирования глюкозо-ацетатным голоданием. Дж. Протозол. 27 : 216-219. [PubMed] [Google Scholar]
10. Cerva, L. 1969. Амебный менингоэнцефалит: аксеническая культура Naegleria . Science 163 : 576. [PubMed] [Google Scholar]
11. Cerva, L. 1978. Некоторые дополнительные характеристики роста Naegleria fowleri и Naegleria gruberi в аксенической культуре. Фолиа Паразитол. (Прага) 25 : 1-8. [PubMed] [Google Scholar]
Cerva, L. 1978. Некоторые дополнительные характеристики роста Naegleria fowleri и Naegleria gruberi в аксенической культуре. Фолиа Паразитол. (Прага) 25 : 1-8. [PubMed] [Google Scholar]
12. Cerva, L. 1980. Лабораторная диагностика первичного амебного менинго-энцефалита и методы обнаружения лимаксных амеб в окружающей среде. Фолиа Паразитол. (Прага) 27 : 1-9. [PubMed] [Google Scholar]
13. Chang, S.L. 1971. Маленькие свободноживущие амебы: культивирование, количественный анализ, идентификация, классификация, патогенез и устойчивость. Курс. Вершина. Комп. патобиол. 1 : 201-254. [PubMed] [Google Scholar]
14. Chang, S.L. 1974. Этиологические, патологические, эпидемиологические и диагностические аспекты первичного менингоэнцефалита. крит. Преподобный Микробиолог. 3 : 135-159. [Google Scholar]
15. Chang, S.L. 1978. Устойчивость патогенных Naegleria к некоторым обычным физическим и химическим агентам. заявл. Эниврон. микробиол. 35 : 368-375. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Chang, S.L. 1978. Устойчивость патогенных Naegleria к некоторым обычным физическим и химическим агентам. заявл. Эниврон. микробиол. 35 : 368-375. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Чирилло, Дж. Д., С. Л. Чирилло, Л. Ян, Л. Э. Бермудес, С. Фальков и Л. С. Томпкинс. 1999. Внутриклеточный рост Acanthamoeba castellanii влияет на механизмы проникновения моноцитов и повышает вирулентность Legionella pneumophila . Заразить. Иммун. 67 : 4427-4434. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Клайн М., Ф. Марчиано-Кабрал и С. Г. Брэдли. 1983. Сравнение Naegleria fowleri и Naegleria gruberi , культивируемых на той же питательной среде. Дж. Протозол. 30 : 387-391. [PubMed] [Google Scholar]
18. Culbertson, CG 1971. Патогенность почвенных амеб. Анну. Преподобный Микробиолог. 25 : 231-254. [PubMed] [Google Scholar]
25 : 231-254. [PubMed] [Google Scholar]
19. Калбертсон, К.Г., Дж.В. Смит и Дж.Р. Миннер. 1958. Acanthamoeba : наблюдения за патогенностью животных. Science 127 : 1506. [PubMed] [Google Scholar]
20. Cursons, RTM, JJ Donald, TJ Brown и EA Keys. 1979. Выращивание патогенных и непатогенных свободноживущих амеб. Дж. Паразитол. 65 : 189-191. [PubMed] [Google Scholar]
21. De Jonckheere, J. 1977. Использование аксенической среды для дифференциации патогенных и непатогенных изолятов Naegleria fowleri . заявл. Эниврон. микробиол. 33 : 751-757. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. De Jonckheere, J. 1980. Характеристики роста, цитопатический эффект в культуре клеток и вирулентность у мышей 36 типовых штаммов, принадлежащих к 19 различным Acanthamoeba spp. заявл. Окружающая среда. микробиол. 39 : 681-685. [Бесплатная статья PMC] [PubMed] [Google Scholar]
микробиол. 39 : 681-685. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Эссиг, А., М. Хайнеманн, У. Симнахер и Р. Марре. 1997. Заражение Acanthamoeba castellanii Chlamydia pneumoniae . заявл. Окружающая среда. микробиол. 63 : 1396-1399. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Fritsche, T.R., R.K. Gautom, S. Seyedirashti, DL Bergeron, and TD Lindquist. 1993. Наличие бактериальных эндосимбионтов у Acanthamoeba spp. выделены из образцов роговицы и окружающей среды и контактных линз. Дж. Клин. микробиол. 31 : 1122-1126. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Фриче, Т. Р., М. Хорн, М. Вагнер, Р. П. Хервиг, К. Х. Шлейфер и Р. К. Гаутом. 2000. Филогенетическое разнообразие среди географически рассредоточенных эндосимбионтов Chlamydiales , выделенных из клинических и экологических изолятов Acanthamoeba spp. заявл. Окружающая среда. микробиол. 66 : 2613-2619. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. Окружающая среда. микробиол. 66 : 2613-2619. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Fritsche, T.R., D. Sobele, and R.K. Gautom. 1998. Усиление цитопатогенности in vitro с помощью Acanthamoeba spp. после приобретения бактериальных эндосимбионтов. ФЭМС микробиол. лат. 166 : 231-236. [PubMed] [Google Scholar]
27. Fulton, C. 1974. Аксеническое культивирование Naegleria gruberi. Потребность в метионине. Эксп. Сотовый рез. 88 : 365-370. [PubMed] [Google Scholar]
28. Fulton, C., C. Webster, and JS Wu. 1984. Среда определенного химического состава для культивирования Naegleria gruberi . проц. Натл. акад. науч. США 81 : 2406-2410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Ссылка удалена.
30. Гордон, С. М., Дж. П. Стейнберг, М. Дюпюи, П. Э. Козарский, Дж. Ф. Никерсон и Г. С. Висвесвара. 1992. Выделение культур видов Acanthamoeba и лептомиксидных амеб от больных амебным менингоэнцефалитом, в том числе от двух больных СПИДом. клин. Заразить. Дис. 15 : 1024-1030. [PubMed] [Google Scholar]
Э. Козарский, Дж. Ф. Никерсон и Г. С. Висвесвара. 1992. Выделение культур видов Acanthamoeba и лептомиксидных амеб от больных амебным менингоэнцефалитом, в том числе от двух больных СПИДом. клин. Заразить. Дис. 15 : 1024-1030. [PubMed] [Google Scholar]
31. Гриффитс, А. Дж. и Д. Э. Хьюз. 1968. Голодание и инцистирование почвенной амебы Hartmannella castellanii . Дж. Протозол. 15 : 673-677. [PubMed] [Google Scholar]
32. Хейт, Дж. Б. и Д. Т. Джон. 1980. Рост Naegleria fowleri на нескольких аксенических средах. Фолиа Паразитол. (Прага) 27 : 207-212. [PubMed] [Google Scholar]
33. Хейт, Дж. Б. и Д. Т. Джон. 1982. Варьирование компонента сыворотки в аксенических культурах Naegleria fowleri . проц. Гельминтол. соц. Вашингтон 49 : 127-134. [Google Scholar]
34. Hu, W. -N., R.N. Band, and W.J. Kopachik. 1991. Синтез белка, связанного с вирулентностью, у Naegleria fowleri . Заразить. Иммун. 59 : 4278-4282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
-N., R.N. Band, and W.J. Kopachik. 1991. Синтез белка, связанного с вирулентностью, у Naegleria fowleri . Заразить. Иммун. 59 : 4278-4282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Hu, WN., W. Kopachik, and RN Band. 1992. Клонирование и характеристика транскриптов, демонстрирующих экспрессию генов, связанных с вирулентностью, у Naegleria fowleri . Заразить. Иммун. 60 : 2418-2424. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Ingalls, C.S., and MM Brent. 1983. Определена минимальная питательная среда для Acanthamoeba polyphaga . Дж. Протозол. 30 : 606-608. [PubMed] [Google Scholar]
37. Инглис, Т.Дж.Дж., П. Ригби, Т.А. Робертсон, Н.С. Даттон, М. Хендерсон и Б.Дж. Чанг. 2000. Взаимодействие между видами Burkholderia pseudomallei и Acanthamoeba приводит к спиральному фагоцитозу, выживанию эндамебных бактерий и их побегу. Заразить. Иммун. 68 : 1681-1686. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить. Иммун. 68 : 1681-1686. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Jensen, T., WG Barnes, and D. Meyers. 1970. Аксеничное культивирование больших популяций Acanthamoeba castellanii (JBM). Дж. Паразитол. 56 : 904-906. [PubMed] [Google Scholar]
39. John, DT 1982. Первичный амебный менингоэнцефалит и биология Naegleria fowleri . Анну. Преподобный Микробиолог. 36 : 101-123. [PubMed] [Академия Google]
40. John, D. T. 1993. Условно-патогенные свободноживущие амебы, с. 143-246. В Дж. П. Крайер и Дж. Р. Бейкер (ред.), Parasitic protozoa, 2nd ed., vol. 3. Academic Press, New York, NY [Google Scholar]
41. John, D. T., and M. J. Howard. 1995. Сезонное распространение патогенных свободноживущих амеб в водах Оклахомы. Паразитол. Рез. 81 : 193-201. [PubMed] [Google Scholar]
42. Джон Д. Т. и К. В. Маккатчен. 1995. Снижение вирулентности Naegleria fowleri после роста с холестерином. Фолиа Паразитол. (Прага) 42 : 236-238. [PubMed] [Google Scholar]
Джон Д. Т. и К. В. Маккатчен. 1995. Снижение вирулентности Naegleria fowleri после роста с холестерином. Фолиа Паразитол. (Прага) 42 : 236-238. [PubMed] [Google Scholar]
43. Джонс, Д. Б., Г. С. Висвесвара и Н. М. Робинсон. 1975. Acanthamoeba polyphaga кератит и Acanthamoeba увеит, связанный с фатальным менингоэнцефалитом. Транс. Офтальмол. соц. Великобритания 95 : 221-232. [PubMed] [Google Scholar]
44. Кинде, Х., Г. С. Вишвесвара. Б. К. Барр, Р. В. Нордхаузен и П. Х. В. Чиу. 1998. Амебный менингоэнцефалит, вызванный Balamuthia mandrillaris (лептомиксидная амеба) у лошади. Дж. Вет. Диагн. расследование 10 : 378-381. [PubMed] [Google Scholar]
45. Ссылка удалена.
46. ЛаВерде, А. В. и М. М. Брент. 1980. Упрощенная растворимая среда для аксенического культивирования Naegleria . Protistologica 16 : 11-15. [Академия Google]
Protistologica 16 : 11-15. [Академия Google]
47. Ly, T.M., and H.E. Muller. 1990. При попадании внутрь Listeria monocytogenes выживает и размножается в простейших. Дж. Мед. микробиол. 33 : 51-54. [PubMed] [Google Scholar]
48. Ма, П., Г. С. Висвесвара, А. Дж. Мартинес, Ф. Х. Теодор, П.-М. Даггетт и Т.К. Сойер. 1990. Инфекции Naegleria и Acanthamoeba : обзор. Преподобный Заразить. Дис. 12 : 490-513. [PubMed] [Академия Google]
49. Ма, П., Э. Уилларт, К. Б. Юхтер и А. Р. Стивенс. 1981. Случай кератита, вызванного Acanthamoeba в Нью-Йорке, штат Нью-Йорк, и особенности 10 случаев. Дж. Заразить. Дис. 143 : 662-667. [PubMed] [Google Scholar]
50. Marciano-Cabral, F. 1988. Биология Naegleria spp. микробиол. 52 : 114-133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Martinez, AJ 1985. Свободноживущие амебы: естественная история, профилактика, диагностика, патология и лечение болезней. CRC Press, Inc., Бока-Ратон, Флорида,
Martinez, AJ 1985. Свободноживущие амебы: естественная история, профилактика, диагностика, патология и лечение болезней. CRC Press, Inc., Бока-Ратон, Флорида,
52. Мехлотра, Р. К. и О. П. Шукла. 1997. Патогенные свободноживущие амебы: культивирование, потребности в питании и химиотерапия инфекций. Ind. J. Microbiol. 37 : 113-123. [Google Scholar]
53. Мишель Р. и К. Яничке. 1996. Аксеничное и моноксенное культивирование Balamuthia mandrillaris (Visvesvara et al. 1993) Leptomyxidae, p. 100-102. In Христиан Готфрид Эренберг Festschrift. Leipziger Universitätsverlag, Лейпциг, Германия.
54. Наполитано, Дж. Дж. и Х. Р. Гэмбл. 1978. Стимуляция фолиевой кислотой аксенически выращенных Naegleria gruberi . Protistologica 14 : 183-187. [Google Scholar]
55. Наполитано Дж. Дж., А. В. ЛаВерде и Х. Р. Гэмбл. 1977. Культивирование Naegleria с использованием бактерий, убитых спиртом. Акта Протистол. 16 : 207-217. [Google Scholar]
Культивирование Naegleria с использованием бактерий, убитых спиртом. Акта Протистол. 16 : 207-217. [Google Scholar]
56. Нефф, Р. Дж. 1957. Очистка, аксеническое культивирование и описание почвенной амебы. Акантамеба зр. Дж. Протозол. 4 : 176-182. [Google Scholar]
57. Нельсон, Э. К. и М. М. Джонс. 1970. Культуральное выделение возбудителей первичного амебного менингоэнцефалита. Дж. Паразитол. 56 : 248. (Abstract.) [Google Scholar]
58. Нерад, Т. А., Г. Висвесвара, П.-М. Даггет. 1983. Среда определенного химического состава для культивирования Naegleria : патогенных и устойчивых к высоким температурам видов. Дж. Протозол. 30 : 383-387. [PubMed] [Академия Google]
59. Ньюсом, А. Л., Т. М. Скотт, Р. Ф. Бенсон и Б. С. Филдс. 1998 г. Выделение амебы, естественно являющейся убежищем для отличительных видов Legionella . заявл. Окружающая среда. микробиол. 64 : 1688-1693. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. Окружающая среда. микробиол. 64 : 1688-1693. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. О’Делл, У. Д. и М. М. Брент. 1974. Исследование питания трех штаммов Naegleria gruberi . Дж. Протозол. 21 : 129-133. [PubMed] [Академия Google]
61. О’Делл В.Д. и А.Р. Стивенс. 1973. Количественный рост Naegleria в аксенной культуре. заявл. микробиол. 25 : 621-627. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Pigon, A. 1970. Hartmannella : вещества, контролирующие рост в культуральной среде. Протоплазма 70 : 405-414. [Google Scholar]
63. Schuster, F. L. 1961. Аксеническое культивирование Naegleria gruberi . Дж. Протозол. 8 : 19. (Abstract.) [Google Scholar]
64. Schuster, F. L. 1979. Small ameba and ameboflagellates, p. 215-285. В М. Левандовски и С.Х. Хатнер (ред.), Биохимия и физиология простейших, том. 1. Academic Press, New York, NY [Google Scholar]
215-285. В М. Левандовски и С.Х. Хатнер (ред.), Биохимия и физиология простейших, том. 1. Academic Press, New York, NY [Google Scholar]
65. Schuster, F.L. and G. Svilha. 1968. Рибонуклеопротеинсодержащие везикулы в кистах Naegleria gruberi . Дж. Протозол. 15 : 752-758. [PubMed] [Академия Google]
66. Шустер Ф. Л. и Г. С. Висвесвара. 1996. Исследования аксенического роста и чувствительности к лекарственным средствам Balamuthia mandrillaris , возбудителя амебного менингоэнцефалита у людей и других животных. Дж. Клин. микробиол. 34 : 385-388. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Schuster, F.L., and GS Visvesvara. 1998. Эффективность новых противомикробных препаратов против клинических изолятов условно-патогенных амеб. Дж. Эукариот. микробиол. 45 : 612-618. [PubMed] [Google Scholar]
68. Шукла, О. П., С. М. Каул и Р. К. Мехлотра. 1989. Разработка улучшенной среды для аксенического культивирования Acanthamoeba culbertsoni , Singh and Das 1970. Ind. J. Exp. биол. 27 : 785-791. [PubMed] [Google Scholar]
П., С. М. Каул и Р. К. Мехлотра. 1989. Разработка улучшенной среды для аксенического культивирования Acanthamoeba culbertsoni , Singh and Das 1970. Ind. J. Exp. биол. 27 : 785-791. [PubMed] [Google Scholar]
69. Шукла, О. П., С. М. Каул и Р. К. Мехлотра. 1990. Исследования питания Acanthamoeba culbertsoni и разработка среды с определенным химическим составом. Дж. Протозол. 37 : 237-242. [PubMed] [Google Scholar]
70. Сингх, Б. Н. и Г. Д. П. Датта. 1984. Мелкие свободноживущие аэробные амебы: почва как подходящая среда обитания, изоляция, культура, классификация, патогенность, эпидемиология и химиотерапия. Ind. J. Паразитол. 8 : 1-23. [Google Scholar]
71. Сисон Дж. П., К. А. Кемпер, М. Лавлесс, Д. Макшейн, Г. С. Висвесвара и С. К. Дерезински. 1995. Диссеминированная инфекция Acanthamoeba у больных СПИДом: отчеты о клинических случаях и обзор. клин. Заразить. Дис. 20 : 1207-1216. [PubMed] [Google Scholar]
клин. Заразить. Дис. 20 : 1207-1216. [PubMed] [Google Scholar]
72. Steinert, M., K. Birkness, E. White, B. Fields, and F. Quinn. 1998. Бациллы Mycobacterium avium растут сапрозоически в сокультуре с Acanthamoeba polyphaga и выживают в стенках кисты. заявл. Окружающая среда. микробиол. 64 : 2256-2261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Stothard, D.R., J. Hay, JM Schroeder-Diedrich, DV Seal и TJ Byers. 1999. Флуоресцентные олигонуклеотидные зонды для клинического и экологического обнаружения Acanthamoeba и последовательности гена 18S рРНК T4. Дж. Клин. микробиол. 37 : 2687-2693. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Том, С. Д. Уорхерст и Б. С. Драсар. 1992. Ассоциация Vibrio cholerae с пресноводными амебами. Дж. Мед. микробиол. 35 : 303-306. [PubMed] [Google Scholar]
75. Вишвесвара Г. С. 1999. Патогенные и условно-патогенные свободноживущие амебы, с. 1383-1390 гг. В П. Р. Мюррей, Э. Дж. Барон, М. А. Пфаллер, Ф. К. Теновер и Р. Х. Йолкен (ред.), Руководство по клинической микробиологии, 7-е изд. ASM Press, Washington, D.C.
Вишвесвара Г. С. 1999. Патогенные и условно-патогенные свободноживущие амебы, с. 1383-1390 гг. В П. Р. Мюррей, Э. Дж. Барон, М. А. Пфаллер, Ф. К. Теновер и Р. Х. Йолкен (ред.), Руководство по клинической микробиологии, 7-е изд. ASM Press, Washington, D.C.
76. Visvesvara, G.S., A.J. Martinez, F.L. Schuster, G.J. Leitch, S.V. Wallace, T.K. Sawyer, and M. Anderson. 1990. Лептомиксидная амеба, новый возбудитель амебного менингоэнцефалита у человека и животных. Дж. Клин. микробиол. 28 : 2750-2756. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Висвесвара, Г. С., С. С. Мирра, Ф. Х. Брандт, Д. М. Мосс, Х. М. Мэтьюз и А. Дж. Мартинес. 1983. Выделение двух штаммов Acanthamoeba castellanii из тканей человека и их патогенность и изоферментные профили. Дж. Клин. микробиол. 18 : 1405-1412. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Висвесвара, Г. С., Р. К. Нифи и А. Дж. Мартинес. 1997. Патогенные и условно-патогенные свободноживущие амебы, с. 257-267. В Ч. Р. Хорсбру-младший и А. М. Нельсон (ред.), Патология новых инфекций. Американское общество микробиологии, Вашингтон, округ Колумбия,
С., Р. К. Нифи и А. Дж. Мартинес. 1997. Патогенные и условно-патогенные свободноживущие амебы, с. 257-267. В Ч. Р. Хорсбру-младший и А. М. Нельсон (ред.), Патология новых инфекций. Американское общество микробиологии, Вашингтон, округ Колумбия,
79. Висвесвара, Г. С., Ф. Л. Шустер и А. Дж. Мартинес. 1993. Balamuthia mandrillaris , n. г., н. sp., возбудитель амебного менингоэнцефалита человека и других животных. Дж. Эукариот. микробиол. 40 : 504-514. [PubMed] [Академия Google]
80. Weekers, P.H.H., P.L.E. Bodelier, J.P.H. Wijen и G.D. Vogels. 1993. Влияние выпаса свободноживущих почвенных амеб Acanthamoeba castellanii , Acanthamoeba polyphaga и Hartmannella vermiformis на различные бактерии. заявл. Окружающая среда. микробиол. 59 : 2317-2319. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Weekers, PHH и GD Vogels. 1994. Аксеническое культивирование свободноживущих почвенных амеб, Acanthamoeba castellanii и Hartmannella vermiformis в хемостате. Дж. Микробиол. Методы 19 : 13-18. [Google Scholar]
1994. Аксеническое культивирование свободноживущих почвенных амеб, Acanthamoeba castellanii и Hartmannella vermiformis в хемостате. Дж. Микробиол. Методы 19 : 13-18. [Google Scholar]
82. Weekers, P.H.H., JPH Wijen, B.P. Lomans, and G.D. Vogels. 1996. Аксеничное массовое культивирование свободноживущей почвенной амебы. Acanthamoeba castellanii в лабораторном ферментере. Антони Левенгук 69 : 317-322. [PubMed] [Google Scholar]
83. Вейк Р. Р. и Д. Т. Джон. 1977. Массовое культивирование Naegleria fowleri с перемешиванием. Дж. Паразитол. 63 : 868-871. [PubMed] [Google Scholar]
84. Вейк Р. Р. и Д. Т. Джон. 1977. Размер клеток, макромолекулярный состав и потребление O 2 при культивировании с перемешиванием Naegleria gruberi . Дж. Протозол. 24 : 196-200. [PubMed] [Google Scholar]
85.


 Если берут пробу амебы
из воды выливают на чашку Петри, в которую добавлено 2% агара.
депонированный. Для пресной воды 2% агар должен находиться в солевом растворе Неффа (см.
ниже). Если вода морская, то пластины должны содержать
2% агара в 75% морской воде (по непонятной причине многие амебы из полностью
морская среда справляется с этим лучше, чем со 100% морской водой (стр.
19). Если пробы почвы/отложений отбираются, небольшое количество
материал должен быть нанесен на пластины с подходящей водой для
крышка. Амебам нужно дать несколько дней собраться на тарелках,
после чего маленькие кубики ( А ,
рисунок 1) следует вырезать и поместить вверх дном на свежую пластину в
какие бактерии (обычно E.coli ) были распространены и допущены к
сухой. Инфузории и другие неползающие простейшие вместе с
под этим блоком остаются метазои (иногда нематоды выкручиваются, если
тарелки слишком влажные), а амебы свободно выползают из-под
блок, потребляющий бактерии и растущий по мере их удаления.
Если берут пробу амебы
из воды выливают на чашку Петри, в которую добавлено 2% агара.
депонированный. Для пресной воды 2% агар должен находиться в солевом растворе Неффа (см.
ниже). Если вода морская, то пластины должны содержать
2% агара в 75% морской воде (по непонятной причине многие амебы из полностью
морская среда справляется с этим лучше, чем со 100% морской водой (стр.
19). Если пробы почвы/отложений отбираются, небольшое количество
материал должен быть нанесен на пластины с подходящей водой для
крышка. Амебам нужно дать несколько дней собраться на тарелках,
после чего маленькие кубики ( А ,
рисунок 1) следует вырезать и поместить вверх дном на свежую пластину в
какие бактерии (обычно E.coli ) были распространены и допущены к
сухой. Инфузории и другие неползающие простейшие вместе с
под этим блоком остаются метазои (иногда нематоды выкручиваются, если
тарелки слишком влажные), а амебы свободно выползают из-под
блок, потребляющий бактерии и растущий по мере их удаления. Через несколько дней на поверхности появляются характерные кольца роста.
(Рисунок 1, слева). Амебы часто очень многочисленны на переднем крае (красный),
но почему-то Acanthamoeba не делает этого. Существование
этой концентрированной области амебы присутствуют в виде небольших групп и
особи, но без большого количества бактерий, которыми можно питаться (синий),
дальше к исходному блоку, амебы, особенно из почвы и
в пресной воде образуются кисты в результате высыхания и отсутствия
бактерии (зеленый).
Кисты часто флоккулируют. Амеба из этой культуры оказалась
быть Naegleria gruberi .
Через несколько дней на поверхности появляются характерные кольца роста.
(Рисунок 1, слева). Амебы часто очень многочисленны на переднем крае (красный),
но почему-то Acanthamoeba не делает этого. Существование
этой концентрированной области амебы присутствуют в виде небольших групп и
особи, но без большого количества бактерий, которыми можно питаться (синий),
дальше к исходному блоку, амебы, особенно из почвы и
в пресной воде образуются кисты в результате высыхания и отсутствия
бактерии (зеленый).
Кисты часто флоккулируют. Амеба из этой культуры оказалась
быть Naegleria gruberi . Небольшие блоки из этих плит сейчас вырезаны
и перевернутые на свежие бактериальные газонные пластины и процесс
повторил. К настоящему времени культура должна быть клональной, но единственный способ
быть уверенным в том, чтобы изолировать одну амебу, аккуратно вырезав блок на
в котором отдыхает только одна амеба.
Небольшие блоки из этих плит сейчас вырезаны
и перевернутые на свежие бактериальные газонные пластины и процесс
повторил. К настоящему времени культура должна быть клональной, но единственный способ
быть уверенным в том, чтобы изолировать одну амебу, аккуратно вырезав блок на
в котором отдыхает только одна амеба. 
 будь лучше. Пруд, море или почва высеиваются на подходящие чашки с агаром.
как указано выше, и амеба может осесть. Также стоит сделать
без агара. Одна интересная более крупная амеба может быть
аккуратно зачерпнул пипеткой и перенес в
в 24-луночном планшете. Пусть все устаканится, а потом ищи
успешно перенесенная амеба. Если он есть и есть
нет других амёб аналогичного размера, рост можно стимулировать
добавление пищевых организмов, таких как бактерии или Тетрагимена .
Более крупным амебам, как правило, требуется больше, чем просто бактерии, для роста.
инфузории или даже другие амебы.
будь лучше. Пруд, море или почва высеиваются на подходящие чашки с агаром.
как указано выше, и амеба может осесть. Также стоит сделать
без агара. Одна интересная более крупная амеба может быть
аккуратно зачерпнул пипеткой и перенес в
в 24-луночном планшете. Пусть все устаканится, а потом ищи
успешно перенесенная амеба. Если он есть и есть
нет других амёб аналогичного размера, рост можно стимулировать
добавление пищевых организмов, таких как бактерии или Тетрагимена .
Более крупным амебам, как правило, требуется больше, чем просто бактерии, для роста.
инфузории или даже другие амебы. Один из способов их сбора
опустить прозрачную стеклянную банку в воду, чтобы воздух удерживался до тех пор, пока
губа достигает илистого дна пруда. Затем выпускают воздух, чтобы
набегающая вода всасывает верхний слой ила. Переместите
сосуд (кувшин) вокруг, чтобы всасывать большую поверхность дна пруда.
Высокие банки особенно полезны, так как следующим шагом будет отстаивание
содержимое банки в рассеянном (не прямом солнечном свете) дном
банка, покрытая фольгой. Амеба и Хаос являются
фототактический (не знаю, является ли Peloxyma ). амеба будет
сконцентрируйтесь на поверхности «водоема» внутри банки.
Один из способов их сбора
опустить прозрачную стеклянную банку в воду, чтобы воздух удерживался до тех пор, пока
губа достигает илистого дна пруда. Затем выпускают воздух, чтобы
набегающая вода всасывает верхний слой ила. Переместите
сосуд (кувшин) вокруг, чтобы всасывать большую поверхность дна пруда.
Высокие банки особенно полезны, так как следующим шагом будет отстаивание
содержимое банки в рассеянном (не прямом солнечном свете) дном
банка, покрытая фольгой. Амеба и Хаос являются
фототактический (не знаю, является ли Peloxyma ). амеба будет
сконцентрируйтесь на поверхности «водоема» внутри банки. В качестве альтернативы инфузории, такие как Tetrahymena можно выращивать и скармливать амебам.
В качестве альтернативы инфузории, такие как Tetrahymena можно выращивать и скармливать амебам.