Что разъедает стекло. Какая кислота разъедает стекло
Содержание
- Что разъедает стекло. Какая кислота разъедает стекло
- Плавиковая кислота растворяет человека. Плавиковая кислота. Свойства и применение плавиковой кислоты
- Почему плавиковая кислота слабая. Ответы
- Плавиковая кислота сильная или слабая. Разница между Плавиковой кислотой и Соляной кислотой
- Фтористоводородная кислота, что растворяет. Влияние фторида водорода на организм человека. Водный раствор фтороводорода
- Плавиковая кислота нейтрализация. Как правильно утилизировать кислоты
- Видео КИСЛОТА, РАСТВОРЯЮЩАЯ СТЕКЛО!
Что разъедает стекло. Какая кислота разъедает стекло
Еще из курса школьной химии мы помним, что все мензурки и колбы в школьной лаборатории были сделаны из стекла, поскольку оно не вступает в реакцию с большинством активных соединений, таких как кислоты.
Кислоты взаимодействуют в основном с металлами, щелочами и солями, а стекло — это уже окисленный кремний, окислить его второй раз не получится .
Кроме того, кремний и кислород с стекле связаны очень прочно, и разорвать такую связь очень трудно.
Единственная кислота, способная разъесть стекло, — плавиковая, представляющая собой водный раствор фтороводорода (HF).
Чем же она лучше или может быть сильнее?
Вовсе нет, просто процесс идет немного по другому.
Атомы кислорода во время реакции замещаются фтором, который является еще более сильным окислителем ( SiO2+4HF=SiF4(стрелка вверх) +2h3O ). На выходе получается тетрахлорид кремния (газ) и вода.
Название «плавиковая» происходит от названия минерала — плавикового шпата (СаF2), из которого получают фтороводород.
Уникальной особенностью плавиковой кислоты является способность растворять стекло.
Поэтому плавиковую кислоту хранят не в стеклянной посуде, а в сосудах с пластиковым или тефлоновым покрытием.
Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита
Обладает слабым наркотическим действием.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие.
Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При этом антидоты практически отсутствуют.
Поэтому при получении кожей смертельной дозы фтороводорода человек может жить несколько суток на обезбаливающих, но без надежды на спасение.
Плавиковая кислота растворяет человека. Плавиковая кислота. Свойства и применение плавиковой кислоты
Плавиковая кислота и флюорит . Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15-ом веке. Он-то и нарек его флюоритом , от латинского fluor – «течь».
Имя объясняется применением породы в качестве флюса . Его добавка к шихте снижает температуру ее плавления.
Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота , и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор , соединяясь с водородом. Получается фтороводород.
То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810-ом году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору . Название нового элемента «фтор» закрепилось лишь в России , переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом.
Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой.
Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке .
Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло . Это инертный материал, не подвластный другим кислотам.
Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17-ом столетии.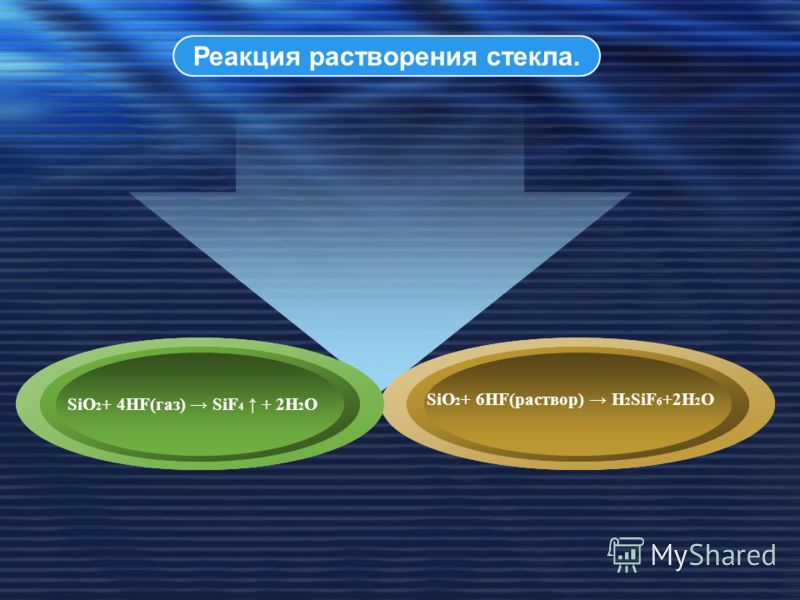 Проводя опыты, он использовал сосуд из флюорита.
Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты.
Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови .
Выявлен слабый наркотический эффект. Все вкупе дает 2-ой класс опасности. Он присвоен кислоте официально.
Попадая на кожу, фторводород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог.
Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках.
Разъедая стекло , прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин.
Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец . Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику.
Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение , естественно, находит в стекольной промышленности.
Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь , убирая с его поверхности все шероховатости.
В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли.
Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики.
Почему плавиковая кислота слабая. Ответы
Nico
Путаница возникает из термина « слабый» , который следует интерпретировать только в терминах химии.
Слабая кислота, как вы говорите, просто означает, что кислота не легко диссоциирует, а не то, что ее действие слабое! Проще говоря, HF разъедает стекло, что не делает даже HCl.
Плавиковая кислота является очень едкой жидкостью и является контактным ядом. С ним следует обращаться с особой осторожностью, помимо того, что присуще другим минеральным кислотам. Вследствие своей низкой константы диссоциации HF как нейтральная жирорастворимая молекула проникает в ткани быстрее, чем типичные минеральные кислоты. Из-за способности плавиковой кислоты проникать в ткани, отравление может происходить легко через воздействие на кожу или в глаза, а также при вдыхании или проглатывании. Симптомы воздействия плавиковой кислоты могут не проявляться сразу. HF влияет на нервную функцию, а это означает, что ожоги изначально не могут быть болезненными. Случайные воздействия могут остаться незамеченными, задерживая лечение и увеличивая степень и серьезность травмы.
Из-за способности плавиковой кислоты проникать в ткани, отравление может происходить легко через воздействие на кожу или в глаза, а также при вдыхании или проглатывании. Симптомы воздействия плавиковой кислоты могут не проявляться сразу. HF влияет на нервную функцию, а это означает, что ожоги изначально не могут быть болезненными. Случайные воздействия могут остаться незамеченными, задерживая лечение и увеличивая степень и серьезность травмы.
После попадания в кровь через кожу он вступает в реакцию с кальцием крови и может вызвать остановку сердца. Ожоги с площадью более 25 квадратных дюймов (160 см2) могут вызвать серьезную системную токсичность из-за влияния на уровень кальция в крови и тканях. В организме плавиковая кислота реагирует с вездесущими биологически важными ионами Ca2 + и Mg2 +. Образование нерастворимого фторида кальция предлагается в качестве этиологии как для резкого падения кальция в сыворотке, так и для сильной боли, связанной с токсичностью в тканях.
Плавиковая кислота сильная или слабая.
 Разница между Плавиковой кислотой и Соляной кислотой
Разница между Плавиковой кислотой и Соляной кислотойКлючевое различие между Плавиковой кислотой и Соляной кислотой состоит в том, что Плавиковая кислота является слабой кислотой , тогда как Соляная кислота является сильной кислотой. Кроме того, Плавиковая кислота способна образовывать водородные связи, в то время как Соляная кислота не способна образовывать водородные связи.
Еще одно важное различие между Плавиковой кислотой и Соляной кислотой заключается в их молекулярной структуре. Молекула Плавиковой кислоты имеет ион фтора, тогда как молекула соляной кислоты имеет ион хлора. Кроме того, плавиковая и соляная кислоты являются донорами протонов. Следовательно, эти молекулы кислоты могут ионизироваться в водных средах с выделением протонов (H+). Эти протоны вызывают кислотность в водной среде.
- Обзор и основные отличия
- Что такое Плавиковая кислота
- Что такое Плавиковая кислота
- В чем разница между Плавиковой кислотой и Соляной кислотой
- Заключение
Что такое Плавиковая кислота?
Плавиковая кислота — это раствор фтористого водорода с водой. Фтористый водород представляет собой кислотное соединение, имеющее химическую формулу HF и молярную массу 20 г/моль. Кроме того, эта кислота является исходным соединением практически для всех фторсодержащих соединений. Пример: тефлон. Эта кислота обладает высокой химической активностью по отношению к стеклу и умеренно активной по отношению к металлам. Поэтому она хранится в пластиковых контейнерах. К онтейнер из тефлона слегка проницаем для этой кислоты.
Фтористый водород представляет собой кислотное соединение, имеющее химическую формулу HF и молярную массу 20 г/моль. Кроме того, эта кислота является исходным соединением практически для всех фторсодержащих соединений. Пример: тефлон. Эта кислота обладает высокой химической активностью по отношению к стеклу и умеренно активной по отношению к металлам. Поэтому она хранится в пластиковых контейнерах. К онтейнер из тефлона слегка проницаем для этой кислоты.
Плавиковая кислота
Плавиковая кислота является слабой кислотой, так как она имеет более низкую константу диссоциации. Диссоциация этой кислоты дает ионы гидрония (комбинация протонов и молекул воды образуют ионы гидрония) и ионы фтора. Среди галогенводородных кислот это единственная слабая кислота. П олучают эту кислоту путем добавления концентрированной серной кислоты к минеральному флюориту (CaF2).
Что такое Соляная кислота?
Соляная кислота представляет собой водный раствор хлористового водорода. Хлористый водород имеет химическую формулу HCl, её молярная масса составляет 36,5 г/моль. Эта кислота имеет резкий запах. Она применяется в качестве исходного соединения для многих неорганических химических веществ, таких как винилхлорид.
Хлористый водород имеет химическую формулу HCl, её молярная масса составляет 36,5 г/моль. Эта кислота имеет резкий запах. Она применяется в качестве исходного соединения для многих неорганических химических веществ, таких как винилхлорид.
Соляная кислота
В отличие от HF, HCl является сильной кислотой, которая может полностью ионизироваться в водной среде, образуя ионы гидроксония и ионы хлорида. Таким образом, эта кислота имеет высокое значение Ka. Получают эту кислоту, из газообразного хлороводорода путём растворения его в воде.
В чем разница между Плавиковой кислотой и Соляной кислотой?
Плавиковая кислота — это раствор фтористого водорода с водой. Это слабая кислота, и она может образовывать водородные связи. Соляная кислота — водный раствор хлористового водорода. Это сильная кислота, и она не может образовывать водородные связи.
Кроме того, молекула Плавиковой кислоты имеет ион фтора, тогда как молекула Соляной кислоты имеет ион хлора. При этом, обе они являются галогенводородными кислотами, у которых атом водорода связан с галогеном. Плавиковая кислота является единственной слабой кислотой среди других галогеноводородных кислот.
При этом, обе они являются галогенводородными кислотами, у которых атом водорода связан с галогеном. Плавиковая кислота является единственной слабой кислотой среди других галогеноводородных кислот.
Заключение — Плавиковая кислота против Соляной кислоты
Плавиковая и Соляная кислота являются галогенводородными кислотами, так как оба этих кислотных соединения имеют галогенид, связанный с атомом водорода. Разница между Плавиковой кислотой и Соляной кислотой заключается в том, что Плавиковая кислота является слабой кислотой и может образовывать водородные связи, тогда как Соляная кислота является сильной кислотой и не способна образовывать водородные связи.
Фтористоводородная кислота, что растворяет. Влияние фторида водорода на организм человека. Водный раствор фтороводорода
Фтороводород (HF) — негорючее бесцветное вещество с резким раздражающим запахом, дымит на воздухе. Попадая в организм человека, оказывает токсичное воздействие. В реакции с соединениями может вызвать пожар или взрыв. Растворяясь в воде, образует фтороводородную кислоту.
Растворяясь в воде, образует фтороводородную кислоту.
Образование HF может быть связано со взрывом при взаимосвязи с водородом, в процессе взаимодействия плавикового шпата и сильных нелетучих кислот. Процедура выполняется в печах из стали при 120-300 градусах C, и занимает много времени. Установочные части, предназначенные для вбирания HF, производятся из свинца.
Водный раствор фтороводорода
В сжиженном виде фтористый водород представляет собой плавиковую кислоту, и применяется как 40-72 %-ный раствор. В ней могут содержаться примеси железа, мышьяка, сернистого газа. Концентрация 60 % раствора участвует в химии органического синтеза. Хранение смеси производится в полиэтиленовых или тефлоновых сосудах, а многотоннажная плавиковая кислота транспортируется в резервуарах из стали. Применяется при производстве кремнефторидов, синтетических смазочных масел и борфторида аммония, который служит компонентом флюсов в металлургии. Используется при электролизе для получения чистого бора, цементов и эмалей, не восприимчивых к минеральным кислотам. Флюаты обеспечивают водонепроницаемость стройматериалов. Большую значимость имеет раствор в матировании стекла и полупроводниковой индустрии, участвуя в травлении кремния. Используется для получения криолита, фтористых производных урана, фреонов. При добавлении в примесь акцепторов фтора образуются сверхкислые среды. В нефтехимической промышленности раствор необходим для обработки и очистки поверхностей. Применяется в призабойных зонах добывающих скважин. В сочетании с прочими кислотами счищает со стенок аппаратуры отложения асфальтов и парафинов, что увеличивает эффективность нефтедобычи. Присутствует в системах фильтрации.
Флюаты обеспечивают водонепроницаемость стройматериалов. Большую значимость имеет раствор в матировании стекла и полупроводниковой индустрии, участвуя в травлении кремния. Используется для получения криолита, фтористых производных урана, фреонов. При добавлении в примесь акцепторов фтора образуются сверхкислые среды. В нефтехимической промышленности раствор необходим для обработки и очистки поверхностей. Применяется в призабойных зонах добывающих скважин. В сочетании с прочими кислотами счищает со стенок аппаратуры отложения асфальтов и парафинов, что увеличивает эффективность нефтедобычи. Присутствует в системах фильтрации.
Влияние фторида водорода на человека
Вещество ядовито и представляет большую опасность для человека, как в состоянии газа, так и виде жидкости. Плавиковая кислота оказывает наркотическое воздействие, и пагубно сказывается на работе сердечно-сосудистой, выделительной, дыхательной системы, поражает кожные покровы и слизистые оболочки. Отравление смесью через кожные покровы протекает безболезненно, симптомы проявляются на следующий день: образование язв на участках кожи и ожогов на слизистой глаз. Попадание в организм путем вдыхания, влечет за собой разрушение тканей легких. При острой интоксикации первой помощью является 2 % раствор СаСЬ. При ожогах пострадавшую область необходимо долгое время промывать под струей холодной воды, после чего наложить компресс 20 %-ной взвеси MgO в глицерине.
Попадание в организм путем вдыхания, влечет за собой разрушение тканей легких. При острой интоксикации первой помощью является 2 % раствор СаСЬ. При ожогах пострадавшую область необходимо долгое время промывать под струей холодной воды, после чего наложить компресс 20 %-ной взвеси MgO в глицерине.
Обеспечение безопасности при работе с HF
В промышленном производстве возможны утечки высокотоксичного вещества FH, поэтому должна проводиться постоянная проверка концентрации фтороводорода в рабочем помещении. ПДК на заводских объектах с барабанными печами, составляет 0, 1 мг/м3. Для контроля содержания ядовитого газа в воздухе на предприятиях должно быть установлено специальное газоаналитическое оборудование, наиболее востребованное на рынке КИПиА: Vector , Бинар-1П , ИГМ-13 , Лидер 021 , Лидер 041 , Микросенс М3 , ПГУ-А , ССС-903МТ , ССС-903МЕ , Хоббит-Т переносной , Эколаб , ОКА-92МТ . Данные приборы вовремя оповестят персонал о превышении допустимого порога концентрации примеси, что поможет избежать отравления сотрудников, а также исключит вероятность взрывов и пожаров в здании.
Качественную и надежную аппаратуру можно приобрести в компании RTECO — проверенного поставщика КИПиА известных производителей.
Дополнительными средствами индивидуальной защиты от ядовитых примесей в воздухе являются респираторы, фильтрующие и изолирующие противогазы. Для защиты от химических и термических ожогов при работе со смесью нужно пользоваться шерстяной спецодеждой, резиновой обувью, перчатками и изолирующими очками. Несоблюдение перечисленных мер может привести к аварийной ситуации на производстве, интоксикации или смерти работников.
Плавиковая кислота нейтрализация. Как правильно утилизировать кислоты
Важно! Известно, что кислоты являются ядовитыми. При неаккуратном обращении с ними, при попадании их на кожу или внутрь организма могут произойти ожоги, сильные отравления и даже летальный исход.
Процесс, касающийся утилизации таких агрессивных сред на предприятиях, начинается с емкости, в которой эти вещества перевозятся и хранятся. Требования к таре при утилизации:
- Строго должны соблюдаться условия герметичности тары (она должна быть полностью герметичной), на нее должна быть нанесена специальная маркировка.

- Контейнер должен быть изготовлен из материала, инертного по отношению к перевозимым в нем веществам во избежание повреждения самого контейнера.
- Запрещается осуществлять смешивание разных кислот.
- Транспортировка тары с агрессивными отходами должна производиться специальным транспортом.
Поступившие на переработку кислотные отходы нейтрализуют (обезвреживают) с помощью реагентов, что позволяет снизить концентрацию отработанных соединений до допустимого уровня. Если в «отработке» содержатся твердые примеси, то их следует отделить. Отделение производят с помощью реакционного аппарата, который имеет мешалку и камерный фильтр-пресс. Осадок, полученный в ходе процесса отделения, обычно вывозят на полигоны опасных отходов или подвергают захоронению. Оставшуюся жидкость, в зависимости от состава отработанной кислоты, направляют на дальнейшую переработку либо уничтожают.
Отработанные синильная кислота, плавиковая кислота, пикриновая кислота также подвергаются утилизации в соответствии с особенностями происходящего процесса (для каждого вещества) по всем правилам техники безопасности. Утилизация азотной кислоты протекает по описанной выше общей технологии с учетом некоторых нюансов.
Утилизация азотной кислоты протекает по описанной выше общей технологии с учетом некоторых нюансов.
Об особенностях утилизации других распространенных кислотных отходов рассказано ниже.
Источник: https://interesnyefakty.com/novosti/kakaya-kislota-rastvoryaet-steklo-kakaya-kislota-razedaet-steklo
Видео КИСЛОТА, РАСТВОРЯЮЩАЯ СТЕКЛО!
Плавиковая кислота и стекло. Какая кислота разъедает стекло
Содержание
- Плавиковая кислота и стекло. Какая кислота разъедает стекло
- Утилизация Плавиковой кислоты. Утилизация кислот
- Установка для утилизации кислот методом ректификации
- Плавиковая кислота растворяет человека. Из треснувшей под Владимиром цистерны разлилась плавиковая кислота
- Плавиковая кислота сильная или слабая. Действие кислот на живые ткани
- Почему плавиковая кислота слабая.
 Разница между Плавиковой кислотой и Соляной кислотой
Разница между Плавиковой кислотой и Соляной кислотой - Видео растворение стекла в плавиковой кислоте
Плавиковая кислота и стекло. Какая кислота разъедает стекло
Еще из курса школьной химии мы помним, что все мензурки и колбы в школьной лаборатории были сделаны из стекла, поскольку оно не вступает в реакцию с большинством активных соединений, таких как кислоты. Кислоты взаимодействуют в основном с металлами, щелочами и солями, а стекло — это уже окисленный кремний, окислить его второй раз не получится. Кроме того, кремний и кислород с стекле связаны очень прочно, и разорвать такую связь очень трудно.
Единственная кислота, способная разъесть стекло, — плавиковая, представляющая собой водный раствор фтороводорода (HF). Чем же она лучше или может быть сильнее? Вовсе нет, просто процесс идет немного по другому. Атомы кислорода во время реакции замещаются фтором, который является еще более сильным окислителем ( SiO2+4HF=SiF4(стрелка вверх) +2h3O ). На выходе получается тетрахлорид кремния (газ) и вода.
Название «плавиковая» происходит от названия минерала — плавикового шпата (СаF2), из которого получают фтороводород. Уникальной особенностью плавиковой кислоты является способность растворять стекло. Поэтому плавиковую кислоту хранят не в стеклянной посуде, а в сосудах с пластиковым или тефлоновым покрытием.
Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита и обладает слабым наркотическим действием. При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу. При этом антидоты практически отсутствуют, поэтому при получении кожей смертельной дозы фтороводорода человек может жить несколько суток на обезбаливающих, но без надежды на спасение.
В промышленности плавиковая кислота используется для травления стекла, очистки от породы при добыче редких металлов и многих других областях.
Утилизация Плавиковой кислоты. Утилизация кислот
Наше производство одно из немногочисленных в России, которое имеет производственные мощности для утилизации кислот. Все кислоты достаточной степени чистоты являются ценным сырьем в химической промышленности. Они применяются в гальваническом производстве, для обработки поверхностей металлов, пассивации, травления, придания шероховатостей или наоборот полировки. Очень часто кислоты используются для синтеза других химических соединений.
Утилизируемые отходы на участке
Химические отходы Жидкие отходы
В некоторых случаях мы готовы рассмотреть варианты покупки отходов кислот, в настоящее время у нас существует потребность в отходах фосфорной кислоты.
При использовании, кислоты теряют свои первоначальные свойства. В них накапливаются соли металлов, снижается концентрация и такие растворы выводятся из производственного цикла, хотя имеют в своем составе все еще большое количество кислоты.
оборудование
сложность переработки состоит в том, что горячие кислоты являются крайне активными и взаимодействуют практически со всеми видами металлов, многими видами пластика. пары соляной кислоты приведут к коррозии любой нержавеющей стали за очень короткое время и при этом готовый продукт будет загрязнен солями этой самой стали. поэтому, для утилизации кислот, мы применяем оборудование полностью изготовленное из борсиликатного химически стойкого стекла производства всемирно известного завода kavalier.
пары соляной кислоты приведут к коррозии любой нержавеющей стали за очень короткое время и при этом готовый продукт будет загрязнен солями этой самой стали. поэтому, для утилизации кислот, мы применяем оборудование полностью изготовленное из борсиликатного химически стойкого стекла производства всемирно известного завода kavalier.
Стекло, находящееся в контакте с перерабатываемым отходом не вступает в реакции и не загрязняет получаемый продукт. Эти особенности позволяет получать в качестве продукции не просто кислоты, а кислоты высокой чистоты, например, получаемая нами азотная кислота отвечает требованиям ГОСТа и соответствует требованиям квалификации «Ч» или «ЧДА», в зависимости от перерабатываемого отхода.
Установка позволяет проводить ректификацию до 50 литров кислоты в час и работает под остаточным давлением 20 мм.рт.ст. Это позволяет перерабатывать высококипящие кислоты, например отходы серной кислоты.
Установка для утилизации кислот методом ректификации
Оборудование собрано из боросиликатного стекла, которое характеризуется высокой термической и химической стабильностью. Позволяет получать кислоты по химическим показателям от «чистый» до «химически чистый». Применяется для ректификации следующих кислот: азотной, ортофосфорной, серной, соляной и уксусной.
Позволяет получать кислоты по химическим показателям от «чистый» до «химически чистый». Применяется для ректификации следующих кислот: азотной, ортофосфорной, серной, соляной и уксусной.
Плавиковая кислота растворяет человека. Из треснувшей под Владимиром цистерны разлилась плавиковая кислота
Кислота вылилась из цистерны на станции Муром под Владимиром. Состав с цистерной следовал из Москвы в Екатеринбург. Причиной утечки стала разгерметизация емкости с плавиковой кислотой. Люди от разлива кислоты не пострадали.
Предварительная причина ЧП — трещина в дне железнодорожной цистерны, сообщает РИА Новости . Дефектная цистерна отцеплена от состава и поставлена на запасной путь.
Место разлива кислоты обрабатывается специальными материалами. Из треснувшей цистерны вытекло около пяти кубометров плавиковой кислоты.
Плавиковая кислота – это фтороводородная кислота. Название ей дал материал, из которого кислоту производят – плавиковый шпат. Плавиковая кислота бесцветная жидкость, которая растворяет стекло и силикаты. Из-за ее свойств кислоту хранят и транспортируют обычно в полиэтиленовой таре.
Из-за ее свойств кислоту хранят и транспортируют обычно в полиэтиленовой таре.
Кислота не действует на парафин, который используют при хранении этой кислоты. Плавиковая кислота реагирует с металлами, образуя фториды. Свинец в кислоте не растворяется: на его поверхности образуется нерастворимый фторид свинца. К кислоте также устойчивы золото, палладий и платина.
Крупный потребитель плавиковой кислоты – алюминиевая промышленность. Кислоту используют для травления кремния в полупроводниковой промышленности, а также для нанесения надписей на стекло.
Кислота ядовита, обладает слабым наркотическим действием. При отравлении страдают органы кроветворения и пищеварительной системы, возможен отек легких. При попадании на кожу кислота первоначально не вызывает резкой сильной боли. Однако затем развиваются отек, сильная боль, химический ожог и общее отравление организма. При попадании в кровь через кожу связывает кальций крови и может вызвать нарушение сердечной деятельности.
Плавиковая кислота сильная или слабая.
 Действие кислот на живые ткани
Действие кислот на живые тканиМногие смотрели сериал «Во все тяжкие», где главные герои лихо растворяли трупы в плавиковой кислоте (она же фтороводородная). Мне лично их выбор показался очень странным, ведь эта кислота очень летучая (легко испаряется), весьма ядовитая и агресивна для любых материалов, кроме пластика.
Я бы лично выбрал другую кислоту, но чтобы не быть голословным, решил провести наглядный эксперимент. Возьмём 4 кислоты — азотную, серную, соляную, плавиковую и щёлочь для сравнения. Раньше считалось, что на мыловаренных заводах утилизируют бездомных животных после отстрела и иногда людей, например, выражение судью на мыло, как раз из этой темы. А мыло как раз делают путём варки масла или животного жира с щёлочью.
Так как соляная и плавиковая кислоты очень летучие и ядовитые, то работать с ними возможно только в вытяжном шкафу с соблюдением техники безопасности, ну или в противогазе, костюме химической зашиты и резиновых перчатках, как в фильме. Вот только, после того как наши герои закрыли крышку на бочке, пары кислот никуда не делись и вонища будет стоять знатная в помещении.
Вот только, после того как наши герои закрыли крышку на бочке, пары кислот никуда не делись и вонища будет стоять знатная в помещении.
У кислот разная плотность, поэтому в некоторых стаканах ножка тонет, а в серной кислоте плавает сверху.
Чрез один час реакция видна невооружённым глазом.
Через 2 часа
На ночь оставлять включённым вытяжной шкаф нельзя, поэтому заркрываем стаканы резиновыми перчатками. Плавиковая кислота разъедает стекло, поэтому оставлять её в стеклянном стакане нельзя, переливаем содержимое в пластиковый стакан.
На следующий день через 14 часов
Азотная кислота справилась лучше всех, от ножки осталась только пенка, серная кислота чуть похуже, косточку растворила довольно плохо, соляная кислота и плавиковая кислота кость растворила, но мяса осталось многовато, щёлочь растворила только кожу.
Будьте здоровы и соблюдайте технику безопасности при работе с кислотами!
Почему плавиковая кислота слабая.
 Разница между Плавиковой кислотой и Соляной кислотой
Разница между Плавиковой кислотой и Соляной кислотойКлючевое различие между Плавиковой кислотой и Соляной кислотой состоит в том, что Плавиковая кислота является слабой кислотой , тогда как Соляная кислота является сильной кислотой. Кроме того, Плавиковая кислота способна образовывать водородные связи, в то время как Соляная кислота не способна образовывать водородные связи.
Еще одно важное различие между Плавиковой кислотой и Соляной кислотой заключается в их молекулярной структуре. Молекула Плавиковой кислоты имеет ион фтора, тогда как молекула соляной кислоты имеет ион хлора. Кроме того, плавиковая и соляная кислоты являются донорами протонов. Следовательно, эти молекулы кислоты могут ионизироваться в водных средах с выделением протонов (H+). Эти протоны вызывают кислотность в водной среде.
- Обзор и основные отличия
- Что такое Плавиковая кислота
- Что такое Плавиковая кислота
- В чем разница между Плавиковой кислотой и Соляной кислотой
- Заключение
Что такое Плавиковая кислота?
Плавиковая кислота — это раствор фтористого водорода с водой. Фтористый водород представляет собой кислотное соединение, имеющее химическую формулу HF и молярную массу 20 г/моль. Кроме того, эта кислота является исходным соединением практически для всех фторсодержащих соединений. Пример: тефлон. Эта кислота обладает высокой химической активностью по отношению к стеклу и умеренно активной по отношению к металлам. Поэтому она хранится в пластиковых контейнерах. К онтейнер из тефлона слегка проницаем для этой кислоты.
Фтористый водород представляет собой кислотное соединение, имеющее химическую формулу HF и молярную массу 20 г/моль. Кроме того, эта кислота является исходным соединением практически для всех фторсодержащих соединений. Пример: тефлон. Эта кислота обладает высокой химической активностью по отношению к стеклу и умеренно активной по отношению к металлам. Поэтому она хранится в пластиковых контейнерах. К онтейнер из тефлона слегка проницаем для этой кислоты.
Плавиковая кислота
Плавиковая кислота является слабой кислотой, так как она имеет более низкую константу диссоциации. Диссоциация этой кислоты дает ионы гидрония (комбинация протонов и молекул воды образуют ионы гидрония) и ионы фтора. Среди галогенводородных кислот это единственная слабая кислота. П олучают эту кислоту путем добавления концентрированной серной кислоты к минеральному флюориту (CaF2).
Что такое Соляная кислота?
Соляная кислота представляет собой водный раствор хлористового водорода. Хлористый водород имеет химическую формулу HCl, её молярная масса составляет 36,5 г/моль. Эта кислота имеет резкий запах. Она применяется в качестве исходного соединения для многих неорганических химических веществ, таких как винилхлорид.
Хлористый водород имеет химическую формулу HCl, её молярная масса составляет 36,5 г/моль. Эта кислота имеет резкий запах. Она применяется в качестве исходного соединения для многих неорганических химических веществ, таких как винилхлорид.
Соляная кислота
В отличие от HF, HCl является сильной кислотой, которая может полностью ионизироваться в водной среде, образуя ионы гидроксония и ионы хлорида. Таким образом, эта кислота имеет высокое значение Ka. Получают эту кислоту, из газообразного хлороводорода путём растворения его в воде.
В чем разница между Плавиковой кислотой и Соляной кислотой?
Плавиковая кислота — это раствор фтористого водорода с водой. Это слабая кислота, и она может образовывать водородные связи. Соляная кислота — водный раствор хлористового водорода. Это сильная кислота, и она не может образовывать водородные связи.
Кроме того, молекула Плавиковой кислоты имеет ион фтора, тогда как молекула Соляной кислоты имеет ион хлора. При этом, обе они являются галогенводородными кислотами, у которых атом водорода связан с галогеном. Плавиковая кислота является единственной слабой кислотой среди других галогеноводородных кислот.
При этом, обе они являются галогенводородными кислотами, у которых атом водорода связан с галогеном. Плавиковая кислота является единственной слабой кислотой среди других галогеноводородных кислот.
Заключение — Плавиковая кислота против Соляной кислоты
Плавиковая и Соляная кислота являются галогенводородными кислотами, так как оба этих кислотных соединения имеют галогенид, связанный с атомом водорода. Разница между Плавиковой кислотой и Соляной кислотой заключается в том, что Плавиковая кислота является слабой кислотой и может образовывать водородные связи, тогда как Соляная кислота является сильной кислотой и не способна образовывать водородные связи.
Видео растворение стекла в плавиковой кислоте
Кремнефтористоводородная кислота, химические свойства, получение
1
H
ВодородВодород
1,008
1s
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10
4s11,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s 2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
О едком и не очень / Хабр
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмония
На самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню.Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном.
Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF2, XeF2, XeF4, XeF6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13. Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Даже нашёл, присмотрелся и понял, что Рипли там жила в таких суровых условиях, что инопланетный зверь — просто няшка
Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
Примеры — фторсерная и хлорсерная кислоты
У фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.
Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
Трифторметансульфоновая кислота
— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красотка
Это — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно — трифторуксусная и трихлоруксусная кислота
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Правда, если косметолог заболтается по телефону, возможен фэйл
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали, что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН — вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это пермуравьиная кислота HCOOOН, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?
Может ли желудочная кислота растворять стекло?
Желудочная кислота не может растворить стекло. Осколок стекла любого размера нанесет урон. Стекло сделано из кристаллов. Некоторым кристаллам для растворения требуется очень сильная кислота.
Устойчиво ли стекло к кислоте? Стекло устойчиво к большинству кислот, но очень восприимчиво к воздействию щелочных материалов, особенно концентрации ионов ОН-, дающей рН более 9,0. Результатом является атака сети, образующей связи кремний-кислород (Si-O), что приводит к растворению поверхности стекла.
Может ли ваш желудок разбить стекло? Маленькие дети, а иногда дети старшего возраста и взрослые могут проглатывать игрушки, монеты, английские булавки, пуговицы, кости, дерево, стекло, магниты, батарейки или другие посторонние предметы. Эти объекты часто проходят весь путь через пищеварительный тракт за 24–48 часов и не причиняют вреда.
Эти объекты часто проходят весь путь через пищеварительный тракт за 24–48 часов и не причиняют вреда.
Может ли кислота очистить стекло? Азотную кислоту можно использовать для очистки стекла. Он делает это, высасывая ионы изнутри поверхности стекла. Приготовьте азотнокислую ванну в полипропиленовой емкости по следующему рецепту. Налейте деионизированную воду в контейнер, затем добавьте кислоту.
Опасно ли глотать стекло? Маленькие дети, а иногда дети старшего возраста и взрослые могут проглатывать игрушки, монеты, английские булавки, пуговицы, кости, дерево, стекло, магниты, батарейки или другие посторонние предметы. Эти объекты часто проходят весь путь через пищеварительный тракт за 24–48 часов и не причиняют вреда.
Что произойдет, если я выпью NaOH?
Употребление в пищу или питье гидроксида натрия может вызвать сильные ожоги и немедленную рвоту, тошноту, диарею или боль в груди и желудке, а также затруднения при глотании. Поражение рта, горла и желудка происходит немедленно.
Что делать, если стекло попадает в желудок?
Случаи преднамеренного проглатывания стекла редки, поэтому особых указаний по обращению с ними нет. В этих случаях ожидаются разрывы полости рта, слюнотечение, неспособность глотать, боль в шее или груди. Если предметы могли пройти через пищевод, могут появиться легкие боли в животе или даже признаки острого живота.
Может ли больно есть крошечные кусочки стекла?
Острые предметы могут застрять и привести к проколу пищеварительного тракта. Мелкие осколки стекла обычно проходят без каких-либо симптомов.
На что распадается NaOH?
Когда гидроксид натрия (NaOH) растворяется в воде, он разделяется на положительно заряженные ионы натрия (катионы) и отрицательно заряженные гидроксид-ионы (анионы).
Что можно есть через стекло?
Фторсурьмяная кислота производится путем тщательного смешивания фтористого водорода (HF) и пентафторида сурьмы (SbF5). Фторантимоник достаточно силен, чтобы проесть стекло, а это означает, что его необходимо хранить в специально изготовленных контейнерах с фторполимерным покрытием.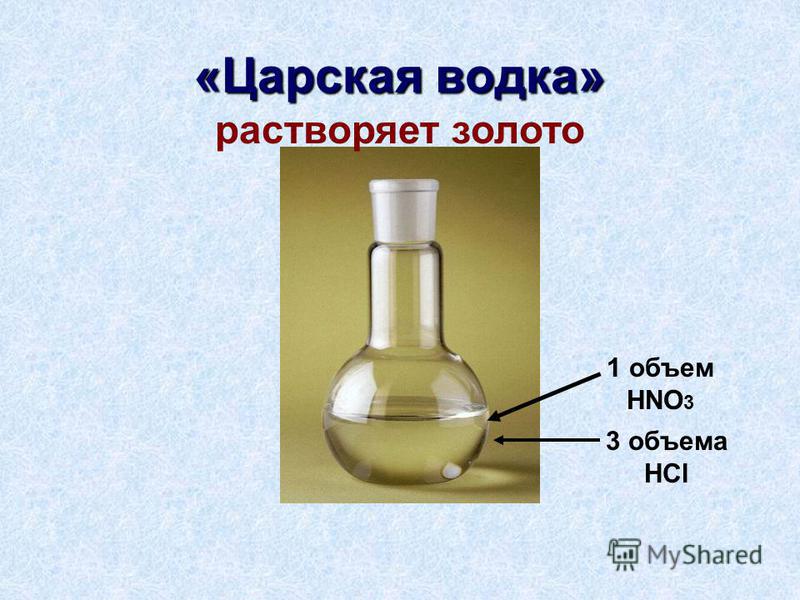
Растворяет ли желудочный сок пластик?
Первичный пищеварительный сок вашего желудка, соляная кислота, может растворять металл, но пластиковые игрушки, попадающие в люк, выходят из него как новые. (Однако опасность удушья остается опасностью удушья.)
Что лучше всего очищает стекло?
Лучший способ очистить стеклянные окна или столешницы — использовать кофейный фильтр или салфетку из микрофибры. В конце концов, использование салфеток из микрофибры или фильтров для кофе немного проще и дает более или менее такой же блеск без разводов, как и при правильном использовании ракеля.
Что будет, если вдохнуть маленький кусочек стекла?
Кристаллический кремнезем в таком маленьком размере чрезвычайно опасен для человека. Вдыхание его может вызвать силикоз, серьезные проблемы с легкими и рак.
Разъедает ли соляная кислота стекло?
Известно, что соляная кислота разъедает некоторые стекла при температуре выше 150 °C. Кислотная коррозия стекла значительно усугубляется присутствием низких концентраций фтористоводородной кислоты и/или ионов фтора. Атака соляной кислотой обычно проявляется как общая атака и потеря огнеупорности.
Атака соляной кислотой обычно проявляется как общая атака и потеря огнеупорности.
Устойчиво ли стекло к серной кислоте?
Труба из боросиликатного стекла с прокладками из ПТФЭ устойчива ко всем концентрациям серной кислоты вплоть до температурного предела пластика. Так что смотровое стекло должно работать.
Что будет, если проглотить стекло?
Острые предметы, такие как битое стекло и маленькие булавки от чертежной доски, скорее всего, выйдут из желудка, если они попадут в желудок или дальше. Очень маловероятно, что они вызовут внутренние повреждения после того, как попадут в желудок. Разработан отделениями неотложной помощи и хирургии Королевской детской больницы.
Можно ли расплавить стекло кислотой?
На практике плавиковая кислота растворяет стекло. Другие кислоты могут разъедать стекло, но это МЕДЛЕННЫЙ процесс. Удивительно, но HF — довольно слабая кислота, более сильная, чем уксусная кислота (уксус), но слабее, чем большая тройка минеральных кислот: соляная, серная и азотная.
Что будет, если проглотить каустическую соду?
При проглатывании едкие вещества могут обжечь все ткани, к которым прикасаются, — от губ до желудка. Симптомы могут включать боль (особенно при глотании), кашель, одышку и рвоту.
Наох растворяет стекло?
Наох растворяет стекло?
Повредит ли соляная кислота стекло?
Соляную кислоту можно хранить в стеклянной колбе годами, она не вступает в реакцию со стеклом. Примечание о безопасности. Соляная кислота представляет собой концентрированную минеральную кислоту. Опасно лить воду на концентрированную кислоту; безопаснее добавлять кислоту в воду.
Вредна ли каустическая сода для человека?
Гидроксид натрия очень агрессивен. Это может вызвать раздражение глаз, кожи и слизистых оболочек; аллергическая реакция; ожоги глаз и кожи; и временное выпадение волос. Рабочие могут пострадать от воздействия гидроксида натрия.
Сериал «Во все тяжкие»: сколько в нем реальной науки?
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, AMC
Подпись к фото,Уолт Уитман, учитель химии и наркобарон
Известный американский телесериал Breaking Bad («Во все тяжкие») вступил в заключительную фазу — с 11 августа выходят в свет последние восемь эпизодов. Его обожатели строят сейчас предположения, чем закончится история школьного учителя из американской глубинки, который сделался сначала изготовителем метамфитамина, а затем главой преступной группировки. Но вот химика доктора Джонатана Хэйра интересует совсем другой вопрос — насколько достоверна научная подоплека этого незаурядного телеповествования.
«Химию нужно уважать», — говорит главный герой фильма Уолтер Уайт. Он в прошлом блестящий химик, которому по семейным обстоятельствам пришлось оставить научную карьеру и стать учителем химии в заурядной средней школе в городе Альбукерке в штате Нью-Мексико.
Обнаружив, что он болен неоперабельным раком легких, он решает обеспечить семью после своей смерти и принимается за изготовление опаснейшего наркотического средства — метамфетамина — в партнерстве со своим бывшим учеником Джесси Пинкманом.
Хотя отношения между ними поначалу настороженные, и Джесси весьма раздражает учительский тон Уолта, вскоре он убеждается, что его бывший учитель способен производить кристаллы метамфетамина высочайшего качества.
Уолт не может удержаться от учительского соблазна и превращает процесс изготовления или «варки» мефамфетамина в увлекательные уроки химии.
Насколько научно достоверными являются его уроки?
Голубые кристаллы
Изготовляемые Уолтом в походной лаборатории, укрытой в трейлере, кристаллы имеют необычный голубой оттенок и отличаются невероятной чистотой. Это увлекательная подробность, но обычно цвет кристалла не свидетельствует о его химической чистоте. Примеси в минералах типа кварца могут делать их розовыми или фиолетовыми (аметист), но обычно цвет является результатом взаимодействия электронов вещества с видимым светом и не является показателем беспримесности.
Фосфиновый газ
Автор фото, AMC
В одной из первых сцен телесериала Уолт оказывается в своей передвижной лаборатории, укрытой в пустыне Нью-Мексико, под дулами пистолетов двух гангстеров. Он на ходу приходит к мысли покончить с ними, бросив порошок красного фосфора в колбу с кипятком. Уолту удается выскочить из автофургона и запереть в нем гангстеров, которые гибнут от образовавшегося в результате реакции фосфинового газа.
Он на ходу приходит к мысли покончить с ними, бросив порошок красного фосфора в колбу с кипятком. Уолту удается выскочить из автофургона и запереть в нем гангстеров, которые гибнут от образовавшегося в результате реакции фосфинового газа.
Красный фосфор может реагировать с водородом, но не с горячей водой. Так что это не очень правдоподобно с научной точки зрения. Правда, белый фосфор может дать такую реакцию, но только в сочетании с гидроксидом натрия, широко распространенном в быту. Но об этом Уолт ничего не рассказывает Джесси.
Ванна для растворения трупов
Автор фото, AMC
На самом деле от газа гибнет только один из гангстеров. Уолт убивает другого, но теперь ему надо избавиться от трупа. В жуткой сцене Джесси наполняет ванну фтористоводородной кислотой, чтобы растворить в ней тело. Эта кислота, которая еще называется плавиковой, обладает необычными химическими свойствами. Она растворяет стекло и хранить ее приходится в пластиковых емкостях.
Это очень едкая кислота, но ее едкость определяется ее химическими свойствами, а не концентрацией, как говорится в фильме. К сожалению, Джесси не следует настойчивыми указаниям Уолта о приобретении пластиковой бочки, а просто сливает кислоту в обычную чугунную эмалевую ванну. В результате кислота не только растворяет труп, но проедает чугун и бетонное перекрытие, и остатки ванны обрушиваются в подвал.
Самопальная батарея
В другом эпизоде Уолт и Джесс занимаются «варкой» метамфетамина в пустыне, но когда настает время возвращаться, оказывается, что аккумулятор древнего автофургона безнадежно разрядился и мотор не завести. Уолт изготовляет из подручных средств — кислоты, металлических обломков и проводов — новую самодельную батарею и объясняет попутно химическую сторону вопроса Джесси. Если металлическую пару поместить в кислотный раствор или даже электролит типа морской воды, возникает электродвижущая сила.
Все, кому в детстве делали ртутные пломбы, знают о странном ощущении, которое возникает, если взять в рот кусочек алюминиевой фольги. Это классический пример из урока электрохимии. Слюна выполняет роль электролита, так как является слабой кислотой. Объяснения Уолта вполне правдоподобны, но, к сожалению, изготовленная им батарея не могла дать тока достаточной силы, чтобы провернуть стартер.
Это классический пример из урока электрохимии. Слюна выполняет роль электролита, так как является слабой кислотой. Объяснения Уолта вполне правдоподобны, но, к сожалению, изготовленная им батарея не могла дать тока достаточной силы, чтобы провернуть стартер.
Гремучая ртуть
Автор фото, AMC
Еще один эпизод — в нем Уолт решает раз и навсегда покончить с гангстером и убийцей Туко. Он приходит к нему в контору и предлагает ему порцию кристаллов метамфетамина, но при этом требует немедленной оплаты. На самом деле пластиковый мешок с наркотиком, врученный им Туко, содержит кристаллы гремучей ртути. Уолт бросает его на пол и раздается мощный взрыв. Мы видим, как Уолт покидает пылающий дом с мешком денег в руках. Реально ли всё это? Может ли небольшое количество этого вещества произвести такой взрыв?
Гремучая ртуть или фульминат ртути действительно является весьма неустойчивым и взрывоопасным соединением, и в школьной химической лаборатории его можно изготовить без особого труда.
Но уже кристаллы с размерами более 3-5 мм являются крайне неустойчивыми и могут в любой момент взорваться. Пластиковый мешок, который Уолт вручает Туко, по виду содержит граммов 200 крупных кристаллов гремучей ртути. Такое количество должно взрываться от малейшего сотрясения, и у Уолта не было бы ни малейшего шанса донести его до места. Правда, если бы ему это каким-то чудом удалось, взрыв был бы действительно крайне мощным.
Термитная смесь
Уолт и Джесси выжигают замок в стальной двери, чтобы пробраться на склад с химикатами. Уолт рассказывает Джесси, что для этого он применил термитный заряд. Термит представляет собой смесь оксида железа с порошком алюминия или другого металла с высокой реактивной способностью. Температура их реакции обычно очень высока и термитная смесь широко используется при сварке железнодорожных рельсов, например, или при вскрытии сейфов. С научной точки зрения с этим эпизодом всё в порядке.
Может ли кислота растворять стекло? Объяснение науки – Углубленная физика
Кислоты, особенно сильные, могут растворять множество различных веществ и материалов. Стекло, однако, не растворяется большинством веществ, но может ли кислота растворить его?
Стекло, однако, не растворяется большинством веществ, но может ли кислота растворить его?
Короче говоря, кислота может растворять стекло. Однако лишь некоторые кислоты, в основном кислоты, содержащие элемент фтор, обладают достаточной коррозионной активностью, чтобы должным образом растворять стекло. Примером этого является фтористоводородная кислота, которая способна вступать в реакцию с диоксидом кремния, содержащимся в стекле, растворяя его.
Однако большинство других кислот практически не действуют на стекло. Лишь немногие кислоты действительно соответствуют химическим требованиям для растворения стекла.
Содержание
Какие кислоты могут растворять стекло?
Только определенные виды кислот действительно способны растворять стекло, но какие именно?
Обычно растворяют стекло кислоты, содержащие фтор. Это связано с химической способностью фтора разрушать связи диоксида кремния, обнаруженные в стекле. Примерами кислот, которые могут растворять стекло, являются фтористоводородная кислота, фтористоводородная кислота и фторантимоновая кислота.
Below is a table of acids that can dissolve glass as well as their chemical formulas:
| Acid Capable Of Dissolving Glass | Chemical Formula |
|---|---|
| Hydrofluoric Acid | HF |
| Флуоантоновая кислота (супероцид) | H 2 FSBF 6 |
| Антимона пентафлуорид | SBF 5 |
| 4343 | |
| 4443 | |
| 44443 | |
| 44443 | |
| 44434443443 | |
| HSO 3 F | |
| Борнофтористая кислота | HBF 4 |
Далее в статье вы найдете дополнительную информацию о том, как эти конкретные кислоты реагируют со стеклом и способны растворять его.
Почему стекло не подвержено влиянию большинства кислот?
Стекло является распространенным материалом, используемым для хранения кислот, поскольку оно обладает высокой устойчивостью к большинству кислот. Но почему именно на стекло не действует большинство кислот?
Но почему именно на стекло не действует большинство кислот?
Кислота не действует на стекло, так как оно имеет очень прочную и стабильную атомную структуру. Это связано с тем, что наиболее распространенный материал в стекле, диоксид кремния, является особенно нереактивным веществом из-за его сильных химических связей, что делает стекло очень устойчивым к большинству кислот.
Итак, чтобы стекло чем-то растворялось, должна была произойти химическая реакция .
Растворение стекла (или любого другого твердого вещества в этом отношении) на самом деле просто означает разрыв химических связей на атомном уровне.
Наиболее распространенным материалом, из которого изготавливается большинство стекол, является диоксид кремния или диоксид кремния , который имеет химическую формулу SiO 2 . Это молекула, состоящая из атома кремния и двух атомов кислорода.
Химическая связь между атомом кремния и атомами кислорода достаточно прочная, а это означает, что ее нелегко разорвать. Это, с другой стороны, означает, что стекло , как правило, довольно устойчиво к большинству кислот .
Это, с другой стороны, означает, что стекло , как правило, довольно устойчиво к большинству кислот .
Применительно к стеклу и кислоте, диоксид кремния, из которого изготовлено стекло должен вступить в реакцию с соединениями, содержащимися в кислоте , чтобы стекло растворилось.
Большинство кислот на самом деле недостаточно агрессивны для этого, за исключением тех, которые содержат фтор .
Типичным реальным примером этого является серная кислота, которая обычно хранится в стеклянных контейнерах.
Серная кислота, H 2 SO 4 , не способна растворять стекло, поэтому ее можно безопасно хранить в стеклянной таре. Это связано с тем, что серная кислота просто недостаточно агрессивна, чтобы разъедать чрезвычайно сильный диоксид кремния (SiO 2 ) соединения, которые являются основным компонентом стекла.
Почему кислоты на основе фтора способны растворять стекло?
Почти единственные кислоты, способные растворять стекло (реагировать с диоксидом кремния), это те, которые содержат элемент фтор .
Причина, по которой кислоты, содержащие фтор, могут растворять стекло, заключается в том, что фтор обладает очень сильной способностью притягивать к себе электроны (именно так образуются химические связи, «делясь» электронами между двумя атомами).
Эта способность называется электроотрицательностью и по сути является показателем того, насколько легко два атома будут реагировать.
Чем больше разница электроотрицательностей между двумя атомами, тем сильнее один из атомов будет притягивать к себе электроны и тем легче будет образоваться химическая связь между ними.
Ниже приведена таблица некоторых значений электроотрицательности различных элементов. Чтобы получить разницу электроотрицательностей между двумя элементами, просто возьмите большее значение минус меньшее значение .
| Element | Electronegativity |
|---|---|
| Silicon (Si) | 1. 9 9 |
| Oxygen (O) | 3.4 |
| Hydrogen (H) | 2.2 |
| Chlorine (Cl ) | 3,2 |
| Фтор (F) | 4,0 |
Из этой таблицы видно, что фтор и кремний имеют большую разность электроотрицательностей (4,0 – 1,9 = 2,1) , чем кремний и кислород (3,4 – 1,9 = 1,5).
Теперь это означает, что когда кислота на основе фтора вступает в контакт со стеклом (диоксидом кремния), атом фтора сильнее притягивает к себе электроны, и, таким образом, связь между кремнием и кислородом разрывается, и стекло растворяется. .
Большая разница в электроотрицательности между фтором и кремнием является причиной того, что только кислоты на основе фтора могут растворять стекло, а что-то вроде соляной кислоты не может, хотя это очень сильная кислота.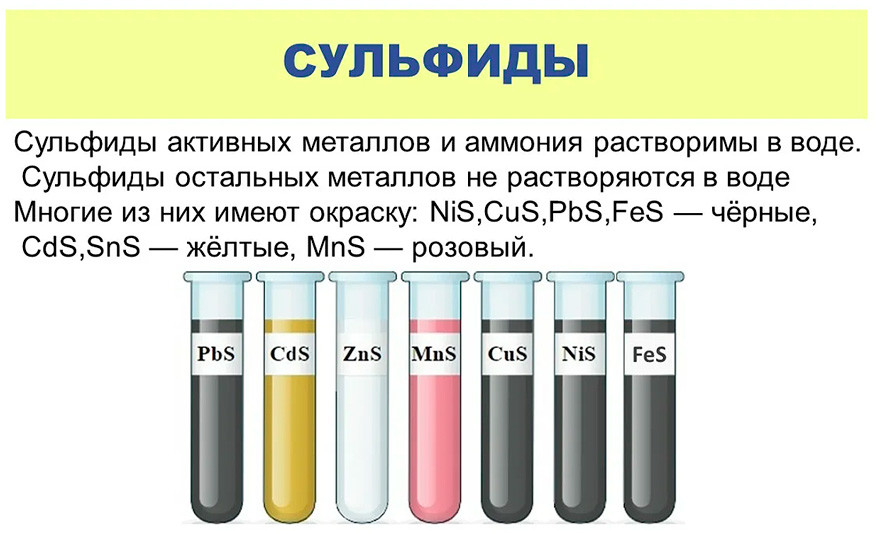
По этой причине большинство чрезвычайно сильных кислот можно безопасно хранить в стеклянной бутылке или контейнере.
Суть в том, что для того, чтобы кислота могла растворять стекло, она должна быть кислотой на основе фтора .
Как различные кислоты растворяют стекло?
Здесь я объяснил, как различные кислоты на основе фтора реагируют со стеклом, растворяя его, а также некоторые происходящие химические реакции.
Плавиковая кислота
Возможно, наиболее распространенным является фтористоводородная кислота (HF), которая состоит из фтора и водорода, образующих кислоту после их смешивания с водным раствором.
Плавиковая кислота действительно очень эффективно растворяет стекло, в результате чего от него ничего не остается.
То, как работает эта реакция, основано на том факте, что фтор имеет такую высокую электроотрицательность (способность притягивать электроны).
Он буквально похищает атомы кремния из диоксида кремния и образует с ним новые связи, образуя вещество под названием 9. 0005 тетрафторид кремния . Происходит следующая химическая реакция:
0005 тетрафторид кремния . Происходит следующая химическая реакция:
Существует также другой вариант реакции, которая может произойти вместо гексафторкремниевой кислоты :
Обе эти реакции растворяют диоксид кремния (стекло) в процессе. Это связано с тем, что соединения, полученные в результате реакции (тетрафторид кремния и гексафторкремниевая кислота), будут растворяться в воде, которая также образуется в результате реакции.
Самое интересное, что здесь может быть тот факт, что фтористоводородная кислота даже не считается сильной кислотой, но все же обладает чрезвычайно сильной способностью растворять многие вещи, включая стекло.
Фторсурьмяная кислота
Другой растворяющей стекло кислотой (также на основе фтора) является фторсурьмяная кислота (H 2 FSbF 6 ).
Фторсурьмяная кислота — это суперкислота , которая легко в триллионы раз сильнее плавиковой кислоты (по определению, даже без преувеличения) и считается самой сильной кислотой в мире.
Так что, разумеется, эта кислота легко растворяет стекло. Практически единственный способ хранить фторантимоновую кислоту — в тефлоновый контейнер , так как тефлон состоит из очень прочных углерод-фтористых связей, поэтому даже суперкислота его не растворит.
Пятифтористая сурьма
Еще одна кислота, растворяющая стекло при контакте с ней, — пятифтористая сурьма (SbF 5 ). Загвоздка здесь в том, что его водный раствор (кислоты обычно представляют собой водные растворы) фактически образует плавиковую кислоту.
Это связано с тем, что пентафторид сурьмы будет реагировать с водой с образованием фтористого водорода (= фтористоводородной кислоты) одним из следующих способов (второй способ также требует некоторого количества тепла):
Образовавшаяся фтористоводородная кислота будет реагировать с диоксидом кремния в стекле, растворяя его. Вот почему, например, Национальная медицинская библиотека США не рекомендует хранить пентафторид сурьмы во влажной или сырой среде (поскольку влага содержит воду) или в стеклянных контейнерах.
Фторсерная кислота
Фторсерная кислота (HSO 3 F) действует почти так же, как описанный выше пентафторид сурьмы. При контакте с водой образуется фтористоводородная кислота , а также серная кислота со следующей реакцией:
Это, конечно, делает его водный раствор способным растворять стекло. При нагревании (примерно до 900 °C) фтористоводородная кислота также распадается на фтористый водород и некоторые другие вещества.
Фтороборная кислота
Фтороборная кислота — сильная кислота с химической формулой HBF 4 , однако чистая фтороборная кислота фактически не может непосредственно растворять стекло . При нагревании он снова разлагается на сероводород, способный растворять стекло.
При превращении в водный раствор борфтористоводородная кислота вступает в реакцию с молекулами воды, в результате чего снова образуется фтористоводородная кислота, что приводит к растворению стекла в водном растворе.
Как слабая кислота может растворить стекло? Учебное пособие
Стеклянный контейнер может агрессивно реагировать с плавиковой кислотой, но, как правило, он инертен или не реагирует с большинством кислот.
ВВЕДЕНИЕ:
Вы, должно быть, сталкивались с таким мастерством на куске стекла в своей повседневной жизни. Вы когда-нибудь задумывались, как были созданы эти конструкции? Пользователь делает эти рисунки на стекле с помощью процесса, называемого «травлением стекла». Способы создания произведений искусства на поверхности стекла с использованием кислотных, едких или абразивных химикатов называются травлением стекла. Шероховатая поверхность и прозрачный вид матового стекла вызваны потерей мельчайших кусочков стекла. Однако этого можно достичь только с помощью нескольких очень специфических химических веществ, поскольку стекло инертно по отношению к большинству химических веществ. Одним из таких химических веществ является плавиковая кислота, которая является слабой кислотой.
Способы создания произведений искусства на поверхности стекла с использованием кислотных, едких или абразивных химикатов называются травлением стекла. Шероховатая поверхность и прозрачный вид матового стекла вызваны потерей мельчайших кусочков стекла. Однако этого можно достичь только с помощью нескольких очень специфических химических веществ, поскольку стекло инертно по отношению к большинству химических веществ. Одним из таких химических веществ является плавиковая кислота, которая является слабой кислотой.
Источник
Хотите знать, что такое слабая кислота? Слабая кислота – это кислота, которая частично диссоциирует на составляющие ее ионы в водном растворе или воде. При этом давайте вернемся к нашей теме и обсудим инертность стекла по отношению к большинству химических веществ.
ИНЕРТНОСТЬ СТЕКЛА
Стекло может растворяться кислотой. Только некоторые кислоты, в основном содержащие фтор, обладают достаточной коррозионной активностью, чтобы адекватно растворять стекло. Соляная кислота не реагирует со стеклом.
Соляная кислота не реагирует со стеклом.
ПОЧЕМУ БОЛЬШИНСТВО КИСЛОТ НЕ ВЛИЯЕТ НА СТЕКЛО?
Поскольку стекло очень устойчиво к большинству кислот, оно обычно используется для хранения кислот. Но почему большинство кислот не действуют на стекло?
Поскольку стекло имеет чрезвычайно прочную и стабильную атомную структуру, на него не действует кислота. Из-за сильных химических связей наиболее распространенный компонент стекла, диоксид кремния, является нереакционноспособным веществом, что делает стекло очень устойчивым к большинству кислот.
Растворение стекла (или любого другого материала в этом отношении) по существу представляет собой разрыв химических связей на атомном уровне. За исключением фторсодержащих кислот, большинство кислот недостаточно агрессивны для этого.
КАК КИСЛОТЫ НА ОСНОВЕ ФТОРА СПОСОБНЫ РАСТВОРЯТЬ СТЕКЛО?
Поскольку фтор имеет сильное свойство притягивать к себе электроны, кислоты, содержащие фтор, могут вызывать эрозию стекла (электроотрицательность).
Когда кислота на основе фтора, такая как плавиковая кислота, вступает в контакт со стеклом (диоксидом кремния), атом фтора притягивает к себе электроны, разрывая связь между кремнием и кислородом и растворяя стекло.
ПРОЧИЕ ПРИМЕНЕНИЯ ФТОРИСТОЙ КИСЛОТЫ
Плавиковая кислота имеет широкий спектр применения. Его можно использовать для удаления ржавчины с предметов белья. Очистка алюминия, гальваническое покрытие, подготовка поверхности для процессов производства кремния в электронике и даже в качестве реагента при синтезе широкого спектра органических соединений, содержащих фтор, — все это основные промышленные применения (например, тефлон).
Источник
На слое тефлона, который обычно используется для покрытия посуды с антипригарным покрытием, пролитое вино образует «пузыри», как видно на изображении выше.
ЗАКЛЮЧЕНИЕ:
- Стекло может растворяться кислотой. Только некоторые кислоты, в основном содержащие фтор, обладают достаточной коррозионной активностью, чтобы адекватно растворять стекло.

- Процесс растворения стекла известен как травление стекла.
Часто задаваемые вопросы:
1. Существует ли кислота, растворяющая стекло?
Плавиковая кислота является предшественником практически всех соединений фтора и представляет собой раствор фтористого водорода (HF) в воде. Это бесцветный, чрезвычайно агрессивный раствор, способный растворять широкий спектр материалов и стекла.
2. Что растворяет стекло?
Мы дезинтегрируем стекло с помощью гидроксида натрия (очиститель канализации). Поскольку стекло почти непроницаемо для химикатов, оно является предпочтительным материалом для химических контейнеров и реакционных сосудов. С другой стороны, стекло растворяется при контакте с расплавленным гидроксидом натрия.
3. Что растворяет соляная кислота?
Соляная кислота используется для растворения различных металлов, оксидов металлов и карбонатов металлов, аналогично тому, как она используется для травления.
4. Может ли соляная кислота плавить пластик?
Пластмассы вообще плохо реагируют с кислотами, а кислотостойкие пластмассы чрезвычайно устойчивы. В результате соляная кислота не способна растворить пластик.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Может ли соляная кислота растворять стекло ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, это делает учебу намного веселее! 😎
ИСТОЧНИКИ:
- Использование плавиковой кислоты. https://www.ck12.org/c/chemistry/acid/rwa/How-Can-A-Weak-Acid-Dissolve-Glass/. По состоянию на 26 января 2022 г.
- Травление стекла. https://profoundphysics.com/can-acid-dissolve-glass/. По состоянию на 26 января 2022 г.
- Инертность стекла.
 https://www.britannica.com/science/водород-фторид. По состоянию на 26 января 2022 г.
https://www.britannica.com/science/водород-фторид. По состоянию на 26 января 2022 г.
Кислота, которая действительно разъедает все насквозь
Благодаря большому экрану многие из нас думают о кислотах как об опасных, прожигающих все вещества. Подумайте о тех сценах в фильмах об инопланетянах, где кровь инопланетянина капает сквозь твердый металл, уничтожая все на своем пути.
Конечно, подавляющее большинство кислот намного скучнее. Уксус (который содержит этановую кислоту) и лимонную кислоту (содержащуюся, угадайте, в цитрусовых фруктах) – это распространенные кислоты, которые мы едим постоянно, и они не прожигают дырки во рту. В вашем желудке есть еще более сильная кислота, соляная кислота (HCl), и она не только не обжигает вас изнутри (как правило), но и помогает переваривать пищу и защищает вас от неприятных бактерий.
Но есть кислота, которая действительно пугает. И имя ему плавиковая кислота.
Плавиковая кислота имеет химическую формулу HF, но, в отличие от HCl, вы не найдете ее в школьной лаборатории, а если она окажется у вас в желудке, у вас будут большие проблемы. В настоящей кинематографической кислоте он способен растворять многие материалы, и особенно известен своей способностью растворять стекло (которое в основном состоит из диоксида кремния). Он также растворяет большую часть керамики (содержащей алюмосиликаты: соединения, состоящие из химически связанных алюминия, кремния и кислорода). И, как и многие другие кислоты, она также вступает в реакцию с металлами, поэтому хранить ее довольно сложно. Куда вы кладете то, что ест через свой контейнер? Ну, в наши дни он хранится в специальных пластиковых бутылках, но в 17 века, когда он был впервые обнаружен, химикам приходилось использовать стеклянные бутылки, покрытые изнутри воском, и надеяться, что покрытие было хорошим.
В настоящей кинематографической кислоте он способен растворять многие материалы, и особенно известен своей способностью растворять стекло (которое в основном состоит из диоксида кремния). Он также растворяет большую часть керамики (содержащей алюмосиликаты: соединения, состоящие из химически связанных алюминия, кремния и кислорода). И, как и многие другие кислоты, она также вступает в реакцию с металлами, поэтому хранить ее довольно сложно. Куда вы кладете то, что ест через свой контейнер? Ну, в наши дни он хранится в специальных пластиковых бутылках, но в 17 века, когда он был впервые обнаружен, химикам приходилось использовать стеклянные бутылки, покрытые изнутри воском, и надеяться, что покрытие было хорошим.
HF на протяжении веков был важным промышленным химикатом. Он используется для вытравливания узоров и очистки стекла и керамики, а также для растворения образцов горных пород, например, для извлечения химических веществ или окаменелостей из горных пород. Он также используется для очистки нержавеющей стали и, в последнее время, для подготовки кремниевых пластин (используемых для изготовления кремниевых чипов) в электронной промышленности.
Химик Карл Вильгельм Шееле (снова он – он просто постоянно появляется, не так ли?) был первым, кто произвел HF в больших количествах в 1771 году. Шееле особенно известен своей дурной привычкой нюхать и пробовать любые новые вещества. он открыл. Совокупное воздействие ртути, мышьяка, свинца, их соединений, плавиковой кислоты и других веществ сказалось на нем, и он умер 21 мая 1786 года в возрасте всего 43 лет. или выпить в лаборатории.
Так чем же так опасен фтористый водород? Во-первых, газ — это сильный яд, который немедленно и навсегда повреждает легкие и роговицу глаз — прекрасно. Раствор плавиковой кислоты – это контактно-ядовитый яд, который вызывает глубокие, первоначально безболезненные ожоги, приводящие к необратимой отмиранию тканей. Он также препятствует метаболизму кальция, а это означает, что его воздействие может вызвать и вызывает остановку сердца (сердечный приступ) и смерть. Прикосновение к коже площадью всего 160 квадратных сантиметров (25 квадратных дюймов) может привести к смертельному исходу — это примерно площадь вашей ладони.
А теперь жуткая и трагическая история: в 1995 году химик, работавший в Австралии, сидел у вытяжного шкафа и опрокинул небольшое количество (100-230 миллилитров, что эквивалентно стакану, полному воды) фтористоводородной кислоты. кислота ему на колени, забрызгав оба бедра. Он тут же вымыл ноги водой, прыгнул в хлорированный бассейн в задней части рабочего места и пробыл там около 40 минут, пока не приехала скорая помощь. (Если вам когда-нибудь понадобится знать, правильное лечение воздействия HF – это гель глюконата кальция: глюконат кальция очень быстро вступает в реакцию с плавиковой кислотой с образованием нетоксичного фторида кальция, что делает его безвредным.) К сожалению, его состояние ухудшилось в больнице, и, несмотря ему ампутировали правую ногу через 7 дней после аварии, он умер от полиорганной недостаточности через 15 дней после разлива плавиковой кислоты. Помните, это был разлив размером со стакан воды.
Поскольку фтористоводородная кислота нарушает работу нервов, ожоги от нее часто не вызывают болезненных ощущений. Небольшие случайные воздействия могут остаться незамеченными, а это означает, что люди не сразу обращаются за лечением, что только усугубляет ситуацию. Выполните поиск изображений в Google по запросу «ожоги фтористым водородом», и вы увидите некоторые изображения, которые действительно вызовут у вас тошноту.
Небольшие случайные воздействия могут остаться незамеченными, а это означает, что люди не сразу обращаются за лечением, что только усугубляет ситуацию. Выполните поиск изображений в Google по запросу «ожоги фтористым водородом», и вы увидите некоторые изображения, которые действительно вызовут у вас тошноту.
Так кого бы ты предпочел встретить? Инопланетянин с кислой кровью и привычкой откладывать яйца в вашем желудке или невидимый газ, разрушающий ваши ткани и оставляющий вас если не мертвым от полиорганной недостаточности, то страдающим от ужасных уродующих ожогов? У вас может быть больше шансов против инопланетянина…
Комментарии к этому сообщению отключены. Если вы планируете проект «сделай сам», плавиковая кислота, вероятно, не ваш друг. Попробуйте Google и/или YouTube; почти наверняка существует множество более безопасных способов сделать то, что вы пытаетесь сделать.
Весь контент © Kat Day 2017. Здесь вы можете делиться чем угодно или ссылаться на что угодно, но при этом вы должны указать ссылку на этот сайт.
Нравится:
Нравится Загрузка…
Факты о фтороводороде (плавиковой кислоте)
ТЕХНИЧЕСКИЕ ДАННЫЕ
Что такое фтористый водород
- Фтористый водород представляет собой химическое соединение, содержащее фтор. Он может существовать в виде бесцветного газа или дымящейся жидкости, а также может быть растворен в воде.
- Когда фтористый водород растворяется в воде, его можно назвать фтористоводородной кислотой.
- Фторид водорода может выделяться при смешивании с водой других фторсодержащих соединений, таких как фторид аммония.
Где встречается фтористый водород и как он используется
- Фторид водорода используется для производства хладагентов, гербицидов, фармацевтических препаратов, высокооктанового бензина, алюминия, пластмасс, электрических компонентов и люминесцентных ламп. Шестьдесят процентов фтористого водорода, используемого в производстве, используется в процессах производства хладагентов.

- Фторид водорода также используется для травления стекла и металла.
Как вы можете подвергнуться воздействию фтористого водорода
- Во время стихийного бедствия вы можете подвергнуться воздействию высоких уровней фтористого водорода, когда складские помещения или контейнеры повреждены и химическое вещество высвобождается. Этот выброс может произойти на промышленной площадке или даже в магазине.
- Вы можете подвергнуться воздействию фтористого водорода, если он используется в качестве химического агента терроризма.
- Если вы работаете с использованием фтористого водорода, вы можете подвергаться воздействию этого химического вещества на рабочем месте.
- Вы можете подвергнуться воздействию фтористого водорода в рамках своего хобби.
Как действует фтороводород
- Фтороводород легко и быстро проникает через кожу в ткани организма. Там он повреждает клетки и заставляет их работать неправильно.

- Серьезность отравления, вызванного фтористым водородом, зависит от количества, пути и продолжительности воздействия, а также от возраста и ранее существовавшего состояния здоровья человека, подвергшегося воздействию.
- Вдыхание фтороводорода может повредить легочную ткань и вызвать отек и накопление жидкости в легких (отек легких).
- Контакт кожи с фтористым водородом может вызвать сильные ожоги, которые развиваются через несколько часов и образуют кожные язвы.
Непосредственные признаки и симптомы воздействия фтористого водорода
- Проглатывание даже небольшого количества высококонцентрированного фтористого водорода повлияет на основные внутренние органы и может привести к летальному исходу.
- Газообразный фтористый водород даже в небольших количествах может раздражать глаза, нос и дыхательные пути. Вдыхание фтористого водорода в больших количествах или в сочетании с контактом с кожей может привести к смерти от нерегулярного сердцебиения или скопления жидкости в легких.

- Даже небольшие брызги высококонцентрированных фтороводородных продуктов на кожу могут быть смертельными. Контакт кожи с фтористым водородом может не вызывать немедленной боли или видимых повреждений кожи (признаков воздействия).
- Часто пациенты, подвергшиеся воздействию низких концентраций фтористого водорода на коже, не проявляют никаких эффектов или немедленно испытывают боль. Причем сильная боль в месте воздействия может быть единственным симптомом в течение нескольких часов. Видимые повреждения могут появиться только через 12–24 часа после воздействия.
- В зависимости от концентрации химического вещества и продолжительности воздействия, контакт кожи с фтористым водородом может вызвать сильную боль в месте контакта; сыпь; и глубокие, медленно заживающие ожоги. Сильная боль может возникать, даже если ожогов не видно.
- Наличие этих признаков и симптомов не обязательно означает, что человек подвергся воздействию фтористого водорода. Другие химические вещества также могут вызывать эти эффекты.

- Воздействие фтористого водорода может привести к серьезным проблемам с электролитом.
Долгосрочные последствия острого воздействия фтористого водорода на здоровье
- Люди, выжившие после тяжелых травм, вдыхаемых фтористым водородом, могут страдать длительным хроническим заболеванием легких.
- Повреждения кожи, вызванные концентрированным фтористым водородом, могут заживать долго и могут привести к серьезным рубцам.
- Повреждения кончиков пальцев фтористым водородом могут привести к стойкой боли, потере костной массы и повреждению ногтевого ложа.
- Воздействие на глаза фтористого водорода может вызвать длительные или необратимые дефекты зрения, слепоту или полное разрушение глаза.
- Проглатывание фтористого водорода может повредить пищевод и желудок. Повреждение может прогрессировать в течение нескольких недель, что приводит к постепенному и длительному сужению пищевода.
Как вы можете защитить себя и что делать, если вы подверглись воздействию фтористого водорода
- Во-первых, если фтористый водород попал в воздух, выйдите на свежий воздух, покинув место, где произошел выброс химиката.

- Если выброс фтористого водорода произошел снаружи, отойдите от места, где произошел выброс химиката.
- Если выброс фтористого водорода произошел в помещении, выйдите из здания.
- Если вы находитесь вблизи места выброса фтора или фтористого водорода, координаторы по чрезвычайным ситуациям могут порекомендовать вам либо эвакуироваться из района, либо «укрыться на месте» внутри здания, чтобы избежать воздействия химического вещества. Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте».
- Если вы считаете, что могли подвергнуться воздействию фтористого водорода, вам следует снять одежду, быстро вымыть все тело водой и как можно быстрее обратиться за медицинской помощью.
- Снятие одежды
- Быстро снимите одежду, на которой может быть фтористый водород.
 Любая одежда, которую приходится надевать через голову, должна быть срезана с тела.
Любая одежда, которую приходится надевать через голову, должна быть срезана с тела. - Если вы помогаете другим людям снимать одежду, старайтесь не прикасаться к загрязненным участкам и снимайте одежду как можно быстрее.
- Быстро снимите одежду, на которой может быть фтористый водород.
- Мыться
- Как можно быстрее смойте фтороводород с кожи большим количеством воды.
- Если ваши глаза горят или ваше зрение затуманено, промойте глаза простой водой.
- Если вы носите контактные линзы, снимите их после мытья рук и положите вместе с загрязненной одеждой. Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их.
- Утилизация одежды
- После того, как вы вымылись, положите одежду в полиэтиленовый пакет. Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, какие участки загрязнены, положите одежду в пакет с помощью щипцов, рукояток инструментов, палок или подобных предметов.
 Все, что касается загрязненной одежды, также должно быть помещено в пакет.
Все, что касается загрязненной одежды, также должно быть помещено в пакет. - Запечатайте пакет, а затем запечатайте этот пакет в другом пластиковом пакете. Утилизация одежды таким образом поможет защитить вас и других людей от любых химических веществ, которые могут быть на вашей одежде.
- Когда прибудут сотрудники местного или государственного департамента здравоохранения или службы экстренной помощи, сообщите им, что вы сделали со своей одеждой. Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно.
- После того, как вы вымылись, положите одежду в полиэтиленовый пакет. Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, какие участки загрязнены, положите одежду в пакет с помощью щипцов, рукояток инструментов, палок или подобных предметов.
- Для получения дополнительной информации об очистке тела и утилизации одежды после выброса химикатов см. «Химические агенты: факты о личной чистке и утилизации загрязненной одежды».
- Если кто-то проглотил фтористый водород, не вызывать рвоту. Не давать человеку активированный уголь.
- Немедленно обратитесь за медицинской помощью.
 Наберите 911 и объясните, что произошло.
Наберите 911 и объясните, что произошло. - Если вы уверены, что человек проглотил фтороводород, не пытайтесь проводить сердечно-легочную реанимацию, если вы не в состоянии принять соответствующие меры для защиты себя от воздействия фтороводорода. Выполнение сердечно-легочной реанимации человека, проглотившего фтористый водород, может подвергнуть вас воздействию этого химического вещества.
Как лечить отравление фтористым водородом
Люди, подвергшиеся воздействию, должны как можно скорее обратиться за медицинской помощью. Ваш врач может порекомендовать или использовать продукты, помогающие нейтрализовать последствия отравления. Глюконат кальция (сахар кальция), содержащий гели, растворы и лекарства, используется для лечения отравления фтористым водородом.
Где можно получить дополнительную информацию о фтороводороде
Люди могут обращаться по одному из следующих номеров:
- Региональный токсикологический центр: 1-800-222-1222
- Центры по контролю и профилактике заболеваний
- Горячая линия общественного реагирования (CDC)
- 800-CDC-INFO
- 888-232-6348 (TTY)
- Электронная почта для запросов: cdcinfo@cdc.
 gov
gov
- Горячая линия общественного реагирования (CDC)
- Центры по контролю и профилактике заболеваний (CDC), Национальный институт безопасности и гигиены труда (NIOSH), Карманный справочник по химическим опасностям
Плавиковая кислота
Плавиковая кислота, фтористый водород в воде, широко используется в исследовательских лабораториях. HF можно использовать для травления кремния при работе с полупроводниками, а также для растворения образцов горных пород. Использование плавиковой кислоты (HF) в любой концентрации требует определенной уникальной лабораторной подготовки и соблюдения мер предосторожности. Со всеми агрессивными материалами следует обращаться осторожно, но высокая коррозионная природа HF и его способность проникать в ткани вызывают особую озабоченность. Если вы намерены использовать HF в своих исследованиях, ознакомьтесь с информацией в этом разделе и следуйте требуемой UC СОП, утвержденной вашим PI. Если для вашей лаборатории не существует СОП по HF, охватывающей ваш процесс, перед использованием свяжитесь с EH&S для получения помощи в разработке СОП для конкретного процесса, которая будет проверена и одобрена вашим PI.
Дополнительную информацию о ВЧ можно найти на веб-сайте Calgonate: http://www.calgonate.com/safety_info.php.
Вопросы безопасности и хранения
Плавиковая кислота вызывает коррозию и легко разрушает ткани и кости. HF легко проникает через кожу человека, что позволяет ей разрушать мягкие ткани под ней и декальцинировать кость (гипокальциемия). HF оказывает умеренное коррозионное воздействие на металлы и растворяет стекло – плавиковую кислоту нельзя хранить в стеклянных бутылях.
Воздействие на кожу концентрированного HF (49% или выше) немедленно приводит к серьезному и болезненному разрушению ткани. Одним из самых коварных свойств HF является то, что контакт с кожей при более низких концентрациях может не вызывать боли или жжения в течение нескольких часов после воздействия. Из-за способности HF вызывать серьезное отсроченное повреждение тканей без боли, при любом контакте с HF на коже, глазах или тканях следует немедленно оказать первую помощь и провести медицинское обследование, даже если травма кажется незначительной или не ощущается боли.
Вдыхание паров HF может серьезно повредить легкие. Отсроченные реакции вплоть до смертельного отека легких (заполнение легких биологическими жидкостями) могут не проявляться в течение нескольких часов после первоначального воздействия. Концентрации в воздухе от 10 до 15 частей на миллион раздражают глаза, кожу и дыхательные пути. Тридцать частей на миллион считаются непосредственными опасными для жизни и здоровья и могут иметь необратимые последствия для здоровья. При концентрациях в воздухе выше 50 частей на миллион даже кратковременное воздействие может быть смертельным. Все операции с ВЧ должны проводиться в вытяжном шкафу.
Любое пространство, использующее HF, должно быть четко обозначено на протяжении всего процесса. Знак «Используется плавиковая кислота» нельзя снимать до тех пор, пока работа не будет завершена и участок не будет очищен. Специальное оборудование для оказания первой помощи, глюконат кальция (Calgonate ® ) должно находиться под рукой и быть легко доступным. Чтобы справиться с небольшим разливом (<20 мл), карбонат кальция или коммерческий комплект для разлива, предназначенный для HF, следует хранить рядом с рабочей площадкой HF.
Чтобы справиться с небольшим разливом (<20 мл), карбонат кальция или коммерческий комплект для разлива, предназначенный для HF, следует хранить рядом с рабочей площадкой HF.
Средства защиты
Ношение и правильное снятие средств индивидуальной защиты (СИЗ) необходимо для безопасного обращения с HF. Перед использованием СИЗ всегда проверяйте состояние и функциональность (например, проверяйте перчатки на наличие точечных отверстий или обесцвеченных или ломких участков; защитные очки от брызг химикатов и лицевой щиток на наличие трещин или грязи, пальто на наличие отверстий или разрывов).
Защита глаз: Работа с HF должна проводиться в защитных очках, а не в защитных очках; защитные очки не обеспечивают достаточной защиты. Рекомендуется использовать полнолицевой щиток, особенно при работе с высокими концентрациями или объемами.
Защита кожи и тела: Лабораторный халат соответствующего размера должен быть надет и застегнут на всю длину. Рукава лабораторного халата должны быть достаточной длины, чтобы предотвратить воздействие на кожу при ношении перчаток. Полноразмерные штаны и туфли с закрытыми носками должны постоянно носиться лицом, проводящим работу, и всеми остальными в лаборатории. Ни одна часть тела не должна быть обнажена. Материал пальто должен быть хлопком, полиэстером или их смесью. Покрытия из номекса не следует носить, так как кислота проникает в материал.
Полноразмерные штаны и туфли с закрытыми носками должны постоянно носиться лицом, проводящим работу, и всеми остальными в лаборатории. Ни одна часть тела не должна быть обнажена. Материал пальто должен быть хлопком, полиэстером или их смесью. Покрытия из номекса не следует носить, так как кислота проникает в материал.
При работе с концентрированным HF, винилом или другим химически стойким веществом (Tychem) лабораторный фартук следует надевать поверх перечисленных средств защиты.
Выбор перчаток: Концентрированный HF – надевайте плотные (22 мил) нитриловые или неопреновые перчатки при работе с концентрированным (49%) HF. Эти перчатки должны иметь длинную манжету, доходящую до предплечья. Проверьте химическую совместимость перчаток с другими реагентами, используемыми при работе с HF.
Разбавленный HF — одноразовые перчатки (5 мил) можно использовать, но их следует удвоить (на один размер больше обычного размера) при использовании разбавленного (<20%) HF. Внешнюю перчатку можно снять и заменить при обнаружении случайного контакта. После работы с HF снимите перчатки и вымойте руки водой с мылом.
После работы с HF снимите перчатки и вымойте руки водой с мылом.
Если ожидается прямой контакт, проконсультируйтесь с EH&S, чтобы выбрать подходящие защитные перчатки.
Добавление фтористоводородной кислоты в LHAT
Инструмент оценки опасности не распространяется прямо на использование фтористоводородной кислоты, а только на общее использование коррозионно-активных веществ. Политикой UCSC является добавление индивидуальной опасности к оценке любой лаборатории, проводящей работы с HF. Следующая информация должна быть добавлена в раздел «Лабораторная деятельность на заказ» LHAT. Обратите внимание, что сотрудники лаборатории по-прежнему должны пройти очное обучение по использованию ВЧ.
Лабораторная деятельность | Потенциальные опасности | Активные исследователи СИЗ | СИЗ лиц, находящихся рядом |
|---|---|---|---|
| Работа с разбавленным HF (<20% фтористоводородной кислоты) |
|
|
|
| Работа с концентрированным HF (>20% плавиковой кислоты) |
|
|
|
Ожоги плавиковой кислотой — StatPearls
Непрерывное обучение
Плавиковая кислота (HF) является чрезвычайно мощной неорганической кислотой и сильным дегидратирующим агентом, который используется во многих отраслях промышленности. Бытовая концентрация плавиковой кислоты обычно составляет около 0,5 процента, а промышленная концентрация приближается к 100 процентам. Плавиковая кислота очень токсична и разрушительна. Он проникает в глубокие ткани, вызывая разжижающий некроз и выделение клеточных продуктов. Проглатывание растворов или вдыхание дымов и паров при непреднамеренном или преднамеренном воздействии плавиковой кислоты вызывает кожные ожоги, травмы глаз, острые респираторные симптомы, а также вызывает системную токсичность фтора, включая сердечно-сосудистые, легочные, почечные и нервно-мышечные симптомы, дисбаланс электролитов и ингибирование ферментов. что может привести к сердечной аритмии и смерти. В этом мероприятии рассматривается оценка и лечение ожогов плавиковой кислотой и подчеркивается роль межпрофессиональной команды в лечении пациентов, пострадавших от нее.
Бытовая концентрация плавиковой кислоты обычно составляет около 0,5 процента, а промышленная концентрация приближается к 100 процентам. Плавиковая кислота очень токсична и разрушительна. Он проникает в глубокие ткани, вызывая разжижающий некроз и выделение клеточных продуктов. Проглатывание растворов или вдыхание дымов и паров при непреднамеренном или преднамеренном воздействии плавиковой кислоты вызывает кожные ожоги, травмы глаз, острые респираторные симптомы, а также вызывает системную токсичность фтора, включая сердечно-сосудистые, легочные, почечные и нервно-мышечные симптомы, дисбаланс электролитов и ингибирование ферментов. что может привести к сердечной аритмии и смерти. В этом мероприятии рассматривается оценка и лечение ожогов плавиковой кислотой и подчеркивается роль межпрофессиональной команды в лечении пациентов, пострадавших от нее.
Цели:
Обзор патофизиологии ожогов плавиковой кислотой.
Опишите типичную клиническую картину пациента с ожогом плавиковой кислотой.

Обобщите эпидемиологию ожогов плавиковой кислотой.
Обобщите важность сотрудничества и общения между межпрофессиональной командой для улучшения оказания помощи пациентам, пострадавшим от ожогов плавиковой кислотой.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Плавиковая кислота была открыта в 1771 году шведским химиком-фармацевтом Карлом Вильгельмом Шееле, когда он исследовал минерал под названием флюорит (фторид кальция). Фторид водорода (HF) имеет несколько синонимов: плавиковая кислота, плавиковая кислота, гидрофторид, моногидрид фтора, фторан. Плавиковая (HF) кислота является чрезвычайно мощной неорганической кислотой и сильным дегидратирующим агентом, который используется во многих отраслях промышленности, включая производство алюминия, нержавеющей стали и гидрофторуглеродов, травление стекла, стивидорные и транспортные отрасли, производство неорганической и органической химии, переработку полезных ископаемых, нефтеперерабатывающие заводы, производство огнетушителей, сталелитейные заводы, системы очистки HVAC, а также в качестве предшественника всех фторсодержащих соединений в фармацевтической промышленности. [1][2][3][4] Потребительские товары, содержащие фтористоводородную кислоту, включают средства для удаления ржавчины, моющие средства, чистящие средства для мрамора, кирпича и камня, средства для очистки унитазов, инсектициды, средства для чистки автомобильных колес и средства для очистки кондиционеров. [4][5]
[1][2][3][4] Потребительские товары, содержащие фтористоводородную кислоту, включают средства для удаления ржавчины, моющие средства, чистящие средства для мрамора, кирпича и камня, средства для очистки унитазов, инсектициды, средства для чистки автомобильных колес и средства для очистки кондиционеров. [4][5]
Плавиковая кислота состоит из двухатомного соединения атомов водорода и фтора в виде газа, а в жидком состоянии имеет прочные водородные связи между цепями, образующими полимерное соединение. [6] Внешний вид безводной плавиковой кислоты и плавиковой кислоты в водных растворах варьируется от бесцветного до слегка окрашенного в зависимости от концентрации и примесей. Он имеет температуру кипения 20 градусов по Цельсию (68 градусов по Фаренгейту) при 760 мм рт.ст., плотность пара выше, чем у воздуха, и легко растворяется в воде, которая при разбавлении (экзотермическая реакция) визуально неотличима от воды. Плавиковая кислота имеет неприятный резкий запах при концентрации 0,04 промилле, что намного ниже PEL (допустимого предела воздействия) OSHA, равного 3 промилле, и является чрезвычайно агрессивной и обладает способностью растворять ряд материалов, особенно оксиды. [4]
[4]
Основным источником производства плавиковой кислоты является обработка флюорита концентрированной серной кислотой при температуре 265 градусов по Фаренгейту с получением плавиковой кислоты и сульфата кальция. Альтернативное производство является побочным продуктом производства фосфорной кислоты из минерального апатита. Плавиковая кислота также образуется в результате промышленных и сварочных процессов, а также в результате воздействия окружающей среды, например, извержения вулканов. Производство HF превышает один миллион тонн во всем мире рядом производителей и транспортируется и хранится под высоким давлением в виде высококонцентрированной жидкости. [7] В Соединенных Штатах Америки на этикетке опасности Министерства транспорта и Национальной ассоциации противопожарной защиты (NFPA) 704 указано значение 4 для здоровья (может быть смертельным), значение воспламеняемости 0 (не горит в обычных условиях пожара). , значение нестабильности 2 (легко подвергается сильным химическим изменениям при повышенных температурах и давлениях) и особое значение W со сквозной линией (бурно или экспоненциально реагирует с водой). Бытовая концентрация плавиковой кислоты обычно составляет около 0,5%, а промышленная концентрация приближается к 100%.
Бытовая концентрация плавиковой кислоты обычно составляет около 0,5%, а промышленная концентрация приближается к 100%.
Первичные последствия для здоровья, включая кожные ожоги, травмы глаз, острые респираторные симптомы, желудочно-кишечные симптомы и сердечные аномалии, могут возникнуть в результате прямого контакта с кожей/глазами, проглатывания растворов или вдыхания дымов и паров при непреднамеренном или преднамеренном воздействии. Непреднамеренное воздействие фтористоводородной кислоты на рабочем месте и вне его включает неправильные действия, механические неисправности оборудования, взрывы контейнеров и резервуаров, содержащих HF, во время дорожно-транспортных происшествий с утечкой HF, неадекватное защитное оборудование и случайное воздействие на детей при проглатывании бытовых чистящих средств. [4] [8] [9]][10] Были задокументированы случаи преднамеренного проглатывания фтористоводородной кислоты с суицидальными и смертоносными намерениями.[4][11]
Плавиковая кислота высокотоксична и повреждает человека из-за свойств «двойной опасности» коррозионного характера ионов водорода и токсического действия из-за способности ионов фтора проникать в глубокие ткани, вызывая разжижающий некроз и выделение клеточных продуктов . Ожоги плавиковой кислотой связаны с уникальной проблемой системной токсичности фтора, включая сердечно-сосудистые, легочные, почечные и нервно-мышечные симптомы, дисбаланс электролитов и ингибирование ферментов, которые могут привести к сердечным аритмиям и смерти. [12] Хронические симптомы могут возникать или сохраняться в течение нескольких месяцев после приема HF или воздействия на органы дыхания. [3][9]
Ожоги плавиковой кислотой связаны с уникальной проблемой системной токсичности фтора, включая сердечно-сосудистые, легочные, почечные и нервно-мышечные симптомы, дисбаланс электролитов и ингибирование ферментов, которые могут привести к сердечным аритмиям и смерти. [12] Хронические симптомы могут возникать или сохраняться в течение нескольких месяцев после приема HF или воздействия на органы дыхания. [3][9]
Этиология
Воздействие фтористоводородной кислоты требует немедленного специфического и специализированного лечения для предотвращения проникновения фтористоводородной кислоты в глубокие ткани, уменьшения распространения ионов фтора через кровоток и последующего снижения токсического воздействия на органы или сведения к минимуму прогрессирования поражения систем органов. [4] Плавиковая кислота технически классифицируется как слабая кислота по сравнению с другими галогеноводородными кислотами, но ион фтора может быстро всасываться через кожу, вызывая потенциально опасные для жизни ожоги и сердечные аритмии. Разбавленные растворы вызывают отсроченное повреждение, поскольку ионы проникают через кожу, прежде чем диссоциировать и вызывать осложнения. Сообщается, что кожная травма является наиболее часто наблюдаемой травмой, а ожоги пальцев являются одной из наиболее серьезных травм для рабочих. [13]
Разбавленные растворы вызывают отсроченное повреждение, поскольку ионы проникают через кожу, прежде чем диссоциировать и вызывать осложнения. Сообщается, что кожная травма является наиболее часто наблюдаемой травмой, а ожоги пальцев являются одной из наиболее серьезных травм для рабочих. [13]
Эпидемиология
Воздействие фтористоводородной кислоты является редким явлением во всем мире по сравнению с другими производственными травмами с примерно 1000 случаев ежегодно, хотя фактическая частота инцидентов неизвестна. 15-летнее исследование, проведенное Stuke et al., показало, что частота возникновения химических ожогов составила 35 пациентов (17%) из 204. [2] В 10-летнем исследовании, проведенном в Китае, сообщалось о 690 пациентах с химическими ожогами, из которых немногим более половины пострадали от плавиковой и серной кислот. Большинство химических ожогов приходится на летний и осенний сезоны. [14] 20-летнее исследование, проведенное на Тайване, выявило только 324 случая применения фтористоводородной кислоты, причем большинство из этих случаев носили кожный характер. [1] Из-за характера занятий, связанных с наибольшим потенциальным травматизмом и воздействием плавиковой кислоты, большинство пациентов — взрослые мужчины. Наиболее часто вовлекалась локализация в верхней конечности. [2]
[1] Из-за характера занятий, связанных с наибольшим потенциальным травматизмом и воздействием плавиковой кислоты, большинство пациентов — взрослые мужчины. Наиболее часто вовлекалась локализация в верхней конечности. [2]
Патофизиология
Существует три (3) пути поступления фтористоводородной кислоты в организм человека: попадание на кожу/глаза, вдыхание и проглатывание. Воздействие на кожу, при неповрежденной или поврежденной коже, является наиболее частым путем проникновения водных растворов. Вдыхание может быть результатом воздействия газообразного фтористого водорода, а также паров, выделяющихся из жидкого фтористого водорода. [4]
Плавиковая кислота является высоко липофильной кислотой и легко проникает через кожу в более глубокие ткани. [4][12] Он имеет три отдельных механизма повреждения:
При высоких концентрациях (> 50%) фтористоводородная кислота действует как сильная кислота, которая вызывает коррозионные ожоги при непосредственном контакте с кожей, глазами, слизистой оболочкой дыхательных путей и желудочно-кишечного тракта.
 Возникающие в результате разъедающие ожоги возникают немедленно с видимой деструкцией тканей, участками изъязвления и некроза, за которыми следует интенсивная боль из-за активации основных болевых рецепторов
Возникающие в результате разъедающие ожоги возникают немедленно с видимой деструкцией тканей, участками изъязвления и некроза, за которыми следует интенсивная боль из-за активации основных болевых рецепторовПри более низких сокращениях фтористоводородной кислоты небольшие ионы фтора способны проникать в кожный слой. Ион фтора отличается от других форм кислоты, которая высвобождает катионы водорода, вызывая коагуляционный некроз, тем, что ион фтора продолжает растворяться через кожу, вызывая дальнейшую деструкцию тканей нервов, кровеносных сосудов, нижележащих мягких тканей посредством разжижающего некроза и гибели клеток [4][12]. ]
Всасывание ионов фтора в кровоток в присутствии других катионов (в частности, кальция и магния) образует нерастворимый хелатный соль посредством гидрофтористой фиксации. Связывание иона фтора с кальцием и магнием вызывает гипокальциемию и гипомагниемию, а также разрушение подлежащей ткани. Истощение кальция вызывает ингибирование натрий-калиевой АТФазной помпы, что приводит к проницаемости клеточных мембран для калия, что приводит к гиперкалиемии.
 Дисбаланс электролитов приводит к сердечным аритмиям, включая удлинение интервала QTc (из-за гипокальциемии), полиморфную желудочковую тахикардию (из-за гипомагниемии) и подъем зубца T и расширение комплекса QRS (из-за гиперкалиемии) [4][12]
Дисбаланс электролитов приводит к сердечным аритмиям, включая удлинение интервала QTc (из-за гипокальциемии), полиморфную желудочковую тахикардию (из-за гипомагниемии) и подъем зубца T и расширение комплекса QRS (из-за гиперкалиемии) [4][12]
Анамнез и физикальное исследование
В зависимости от места воздействия фтористоводородной кислоты и процентного содержания кислоты у пациентов могут сразу же возникнуть сильные ожоги тела едким наполнителем и сильная боль, характерным признаком которой является непропорциональная боль. Растворы с концентрацией более 14,5 % вызывают немедленные симптомы, растворы с концентрацией 12 % могут занять до часа, а растворы с концентрацией менее 7 % могут занять несколько часов до появления симптомов. Существует опасение по поводу глазных и респираторных повреждений, когда любое химическое вещество разбрызгивается/распыляется на лицо.
В анамнезе должно быть указано любое воздействие плавиковой кислоты на рабочем месте или в быту, включая потенциальные продукты, содержащие плавиковую кислоту, такие как средства для удаления ржавчины или чистящие средства, в течение последних 24 часов. Следует выяснить концентрацию раствора, время воздействия HF, использование защитных средств или любых других химических веществ, содержащихся в растворе. Дополнительная информация включает в себя любое лечение, которое до сих пор применялось к человеку.
Следует выяснить концентрацию раствора, время воздействия HF, использование защитных средств или любых других химических веществ, содержащихся в растворе. Дополнительная информация включает в себя любое лечение, которое до сих пор применялось к человеку.
Физическая оценка должна включать немедленную оценку опасных для жизни неотложных состояний, включая нарушение проходимости дыхательных путей, респираторный дистресс и сердечные аритмии. Кроме того, можно оценить отек легких, повреждения глаз и симптомы гипокальциемии, включая симптомы Хвостека и Труссо и тетанию.
Химические ожоги следует оценивать на основе пути воздействия, но они должны включать:
Воздействие на кожу: Место ожога с наиболее частыми участками повреждения: голова и шея, руки, ноги и руки, цвет кожи вокруг ожога, степень изъязвления и некроза вместе с нижележащими структурами, такими как сухожилия или поражение костей. [15][16] Воздействие 70% HF в течение всего 20 секунд может вызвать клеточное изменение в четырех-пяти слоях эпидермиса в течение одной минуты и полное проникновение в дерму в течение пяти минут.
 Некроз всех слоев кожи был обнаружен через час воздействия с полным некрозом эпидермального слоя кожи и нижележащих структур через 24 часа. [4][17][4]
Некроз всех слоев кожи был обнаружен через час воздействия с полным некрозом эпидермального слоя кожи и нижележащих структур через 24 часа. [4][17][4]Воздействие на глаза: Признаки раздражения с болью являются начальными первыми признаками, за которыми следует конъюнктивит с отеком и конгестией. Последующая эрозия роговицы с отторжением и изъязвлением эпителия роговицы может привести к помутнению роговицы при незначительных брызгах плавиковой кислоты. [7] Низкие концентрации фтористоводородной кислоты (2,5%) могут привести к полной диффузии в роговицу с обнаружением ожогов глаз через 4 минуты. [7][4] Продолжительное воздействие может привести к полному разрушению глаз и потере зрения. Офтальмологическая оценка включает простую и широко используемую классификацию химических ожогов глаз Ропера-Холла.
Воздействие при вдыхании: Токсичные газы или пары вызывают раздражение носа с воспалением слизистой оболочки, кровотечением из слизистой оболочки, изъязвлением и/или перфорацией носовой перегородки.
 Дополнительные респираторные симптомы, основанные на концентрации фтористоводородной кислоты и хроническом воздействии, могут включать кашель, одышку, симптомы ларингита верхних дыхательных путей, ларингоспазмы, трахеобронхит со стридором или симптомы нижних дыхательных путей, включая свистящее дыхание, бронхиолярную обструкцию, кровотечение из дыхательных путей, легочную недостаточность. отек и гиперемия или пневмоторакс. Сообщалось о хронической одышке у пациентов с хроническим повторяющимся воздействием паров или газов, содержащих фтористоводородную кислоту. [4]
Дополнительные респираторные симптомы, основанные на концентрации фтористоводородной кислоты и хроническом воздействии, могут включать кашель, одышку, симптомы ларингита верхних дыхательных путей, ларингоспазмы, трахеобронхит со стридором или симптомы нижних дыхательных путей, включая свистящее дыхание, бронхиолярную обструкцию, кровотечение из дыхательных путей, легочную недостаточность. отек и гиперемия или пневмоторакс. Сообщалось о хронической одышке у пациентов с хроническим повторяющимся воздействием паров или газов, содержащих фтористоводородную кислоту. [4]Проглатывание: Ожоги едкого типа слизистой оболочки ротоглотки, пищевода и желудка проявляются при проглатывании растворов, содержащих плавиковую кислоту. Люди жалуются на дисфагию, тошноту, рвоту, диарею и сильную боль в животе. Проглатывание фтористоводородной кислоты может привести к эрозивному гастриту, ведущему к кровавой рвоте и мелане от геморрагического гастрита или, что более важно, к потенциальной перфорации желудка.
 [4]
[4]Нервно-мышечные симптомы: При индивидуальном воздействии любым путем могут развиться неврологические и мышечные расстройства из-за гипокальциемии и гиперкалиемии, вызывающих нарушение нормальной передачи электрических сигналов в нейронах. Эти симптомы могут включать тревожность, спутанность сознания, головные боли, парестезии, судороги или паралич, карпопедальную и генерализованную тетанию и кому, вторичную по отношению к отеку мозга. [4]
Оценка
Электролитный дисбаланс является одним из основных признаков системного отравления фтористоводородной кислотой через все пути проникновения. Немедленная оценка уровня электролитов, как минимум, включает уровни кальция, калия и магния для подтверждения гипокальциемии, гипомагниемии и гиперкалиемии. Несмотря на то, что проблема связана с системным отравлением, у пациентов с простым воздействием может развиться гипокальциемия, гипомагниемия и гиперкалиемия.
Кардиомониторинг и электрокардиография (ЭКГ/ЭКГ) важны для оценки клинически значимого электролитного дисбаланса, включая удлинение интервала QT из-за гипокальциемии (рис. 1), остроконечные зубцы T/аритмии из-за гиперкалиемии и полиморфную желудочковую тахикардию (особенно Torsades de Pointes) из-за гипомагниемии .
1), остроконечные зубцы T/аритмии из-за гиперкалиемии и полиморфную желудочковую тахикардию (особенно Torsades de Pointes) из-за гипомагниемии .
Рентген грудной клетки следует проводить всем пациентам с респираторным воздействием для оценки отека легких или пневмонита. Включение мониторинга EtCO2 может быть рассмотрено для лиц с ингаляционным воздействием. Анализ мочи с оценкой гематурии и протеинурии укажет на почечную дисфункцию, недостаточность и некроз коркового слоя почки.
Лечение/управление
Первоочередная задача в связи с высокой коррозионной активностью и токсичностью фтористоводородной кислоты должна заключаться в предотвращении воздействия. Все лица, использующие HF, должны быть осведомлены о токсических свойствах агента, включая информацию и процедуры по безопасному обращению с кислотой, соответствующие средства транспортировки и хранения, обращение с отходами, содержащими HF, процедуры грубой и тонкой дезактивации и лечение при воздействии. и опьянение. Плавиковую кислоту следует использовать исключительно в промышленных условиях и лабораториях, которые должным образом оборудованы для работы с химическим веществом, имеют соответствующие планы контроля воздействия, которые включают наличие соответствующих методов лечения на месте для начала терапии до транспортировки подвергшегося воздействию человека в больницу. Аналогично, бытовые и чистящие средства следует хранить в недоступном для детей месте.
Плавиковую кислоту следует использовать исключительно в промышленных условиях и лабораториях, которые должным образом оборудованы для работы с химическим веществом, имеют соответствующие планы контроля воздействия, которые включают наличие соответствующих методов лечения на месте для начала терапии до транспортировки подвергшегося воздействию человека в больницу. Аналогично, бытовые и чистящие средства следует хранить в недоступном для детей месте.
Средства индивидуальной и общей защиты и меры должны применяться и соблюдаться в любое время с оборудованием, включая:
Средства индивидуальной защиты
Laboratory coat
Long pants
Acid resistant apron
Closed-toed shoes
Full-face shiled in conjunction with tightly sealed goggles
Rubber gloves made from nitrile , бутил или неопрен
Дыхательный фильтр
Средства общей защиты
Handled inside of a fume hood
Ventilation / exhaust system
Sign «Danger, Hydrofluoric Acid Used in this Area»
Easy access to a good supply of running water
Аварийный душ и средство для промывания глаз
Стандартная рабочая процедура (СОП), документ
Контейнеры HFA
Polyethylene or Teflon
Clearly labelled
Securely supported and not likely to tip over
Tightly cosed and kept in a safe place
Away from heat and direct sunlight
Аптечка/лекарства
2,5 % гель глюконата кальция
1 % раствор глюконата кальция для промывания глаз с 0,13 % раствором бензалкония хлорида (Zephiran Chloride)
Первоначальная обработка от кислоты HF включает быструю оценку, снятие загрязненной одежды, а также украшений, которые могут улавливать HF, следует немедленно снять и упаковать в двойные пакеты для предотвращения вторичного воздействия. Обеззараживание большим количеством воды, физиологического раствора или раствора мыла и воды вместе с нейтрализацией глюконатом кальция, бензалкония хлоридом, полиэтиленгликолем, оксидом магния или гексафторином. [4] Оценка и лечение угрожающих жизни состояний, таких как нарушение проходимости дыхательных путей или сердечные аритмии.
Обеззараживание большим количеством воды, физиологического раствора или раствора мыла и воды вместе с нейтрализацией глюконатом кальция, бензалкония хлоридом, полиэтиленгликолем, оксидом магния или гексафторином. [4] Оценка и лечение угрожающих жизни состояний, таких как нарушение проходимости дыхательных путей или сердечные аритмии.
Процесс дезактивации и нейтрализации при воздействии фтористоводородной кислоты в первую очередь осуществляется за счет механического ополаскивания и разбавляющего действия воды в виде гипотонического раствора. Точно так же он не обладает активной способностью связывать или хелатировать какое-либо химическое вещество при воздействии фтористоводородной кислоты, и поэтому нейтрализующие агенты с их механизмом действия могут помочь уменьшить некроз от иона фтора. Глюконат кальция является основным нейтрализующим агентом и способен хелатировать свободные ионы фтора, образуя нерастворимые соли. Глюконат кальция следует наносить несколько раз, чтобы уменьшить повреждение от ионов фтора. [4]
[4]
Раствор гексафтора, разработанный лабораториями ПРЕВОР, предназначен для активной промывки брызг плавиковой кислоты. Раствор обладает тройным эффектом: он обладает теми же промывающими и разбавляющими свойствами, что и вода, может нейтрализовать ионы водорода и хелатировать ионы фтора, тем самым снижая коррозионное и цитотоксическое действие фтористоводородной кислоты. Хотя в экспериментальном исследовании, проведенном Hulten et al., не было обнаружено большой разницы в уменьшении электролитных нарушений, вызванных воздействием плавиковой кислоты на кожу, по сравнению с ополаскиванием водой. [4] [18]
Методы лечения
Воздействие на кожу (сначала или в больнице)
Наиболее часто используемая процедура обеззараживания – ополаскивание холодной или теплой проточной водой или физиологическим раствором в течение не менее 30 минут. Помогут процедуры деконтаминации с помощью мягкой щетки, движениями вниз (с головы до пят) с хозяйственными средствами для мытья посуды (Dawn, Palmolive) и водой, с показателем pH не ниже 8 и не выше значения pH 10,5.
 нейтрализовать плавиковую кислоту с низким pH. Промывку следует проводить тщательно до тех пор, пока загрязнения не будут удалены.
нейтрализовать плавиковую кислоту с низким pH. Промывку следует проводить тщательно до тех пор, пока загрязнения не будут удалены.Первичный процесс нейтрализации СН с использованием пропитывания глюконатом кальция, внутривенного введения глюконата кальция (10%) и местного применения геля глюконата кальция (2,5%).
При использовании в виде геля следует нанести 2,5 % глюконат кальция и втереть его в пораженный участок в течение 15–30 минут, нанося повторно каждые 10–15 минут. Гель глюконата кальция станет белым, поскольку кальций связывается с ионами фтора, образуя фторид кальция (CaF). При использовании в качестве окончательного лечения 2,5% глюконат кальция следует применять 4–6 раз в день в течение 3–4 дней. [4]
Через 30 минут провести повторное обследование пациента, и при сохранении болей рекомендуется подкожная инфильтрация глюконата кальция в дозе 0,5 мл 5% раствора на квадратный сантиметр поверхности ожога с выходом на 0,5 см за пределы края ожога.
 вовлеченная ткань. [19]
вовлеченная ткань. [19]При подозрении на компартмент-синдром инъекции в кисть следует ограничить до 0,5 мл на фалангу с повторными инъекциями по мере необходимости. [20]
Дополнительная местная терапия включает ледяной раствор бензалкония хлорида (Zephiran Chloride) концентрации (0,13%). Побочные эффекты применения включают жгучую боль или аллергическую реакцию (крапивница, зуд, одышка, стеснение в груди, отек лица, губ или языка) или раствор гексафторина. [12][13][21][22]
Ожоги концентрированной HF обычно очень серьезны, с потенциалом серьезных осложнений из-за фторидной токсичности. Концентрированная жидкость или пары HF могут вызвать серьезные ожоги, нарушение обмена веществ, отек легких и опасные для жизни сердечные аритмии. Даже умеренное воздействие концентрированного HF может быстро привести к летальному исходу, если его не лечить. Ожоги площадью более 25 квадратных дюймов (160 квадратных см) могут привести к серьезной системной токсичности. Облегчение боли является единственным признаком эффективности лечения. Поэтому применение любых обезболивающих средств нецелесообразно. [12][13][21]
Облегчение боли является единственным признаком эффективности лечения. Поэтому применение любых обезболивающих средств нецелесообразно. [12][13][21]
Человек с ВЧ-ожогами площадью более четырех квадратных дюймов должен быть немедленно госпитализирован в отделение интенсивной терапии и находиться под тщательным наблюдением в течение 24–48 часов. Любой, кто подвергся воздействию газообразного HF и испытывает раздражение дыхательных путей, также должен быть госпитализирован и находиться под наблюдением в отделении интенсивной терапии. Следует брать образцы крови для контроля уровня фтора, калия и кальция. В некоторых случаях необходим гемодиализ для удаления фтора и коррекции гиперкалиемии и рецидивирующей гипокальциемии.
Дифференциальный диагноз
Химические ожоги
Токсичность хлора
Токсичность флорида
9363393939339Токсичность флорида
9363393939393939393939393939393939393939393939393399.
. Изоляция и эвакуация
В качестве непосредственной меры предосторожности изолируйте зону разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых веществ.
РАЗЛИВ: При необходимости увеличьте в подветренном направлении изоляционное расстояние, указанное выше.
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна загорелись, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях.
Пожаротушение
Примечание. Некоторые пеноматериалы вступают в реакцию с материалом и выделяют едкие/токсичные газы.
НЕБОЛЬШОЙ ПОЖАР: CO2 (кроме цианидов), сухой химикат, сухой песок, спиртоустойчивая пена.
БОЛЬШОЙ ПОЖАР: Распыление воды, туман или спиртоустойчивая пена.
 Переместите контейнеры из зоны пожара, если вы можете сделать это без риска. Используйте распыление воды или туман; не используйте прямые потоки. Обваловка противопожарной воды для последующего удаления; не рассыпать материал.
Переместите контейнеры из зоны пожара, если вы можете сделать это без риска. Используйте распыление воды или туман; не используйте прямые потоки. Обваловка противопожарной воды для последующего удаления; не рассыпать материал.ПОЖАР, СВЯЗАННЫЙ С ЦИСТЕРНАМИ ИЛИ АВТОМОБИЛЯМИ/ТРЕЙЛЕРАМИ: Тушить огонь с максимального расстояния или использовать автоматические держатели шлангов или мониторные насадки. Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем.
Непожарный ответ
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя в непосредственной близости). Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если вы не надели соответствующую защитную одежду.
 Остановите утечку, если вы можете сделать это без риска. Для уменьшения паров можно использовать пароподавляющую пену. НЕ ПОЛУЧАЙТЕ ВОДУ ВНУТРИ КОНТЕЙНЕРОВ. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства.
Остановите утечку, если вы можете сделать это без риска. Для уменьшения паров можно использовать пароподавляющую пену. НЕ ПОЛУЧАЙТЕ ВОДУ ВНУТРИ КОНТЕЙНЕРОВ. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства.НЕБОЛЬШОЙ РАЗЛИВ: Накрыть СУХОЙ землей, СУХИМ песком или другим негорючим материалом, а затем накрыть полиэтиленовой пленкой, чтобы свести к минимуму распространение или контакт с дождем. Используйте чистые, искробезопасные инструменты для сбора материала и поместите его в неплотно закрытые пластиковые контейнеры для последующей утилизации.
Защитная одежда
Наденьте автономный дыхательный аппарат с положительным давлением (SCBA).
Носите одежду химической защиты, специально рекомендованную производителем. Он может обеспечивать небольшую тепловую защиту или вообще не обеспечивать ее.

Строительная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в условиях пожара; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом.
Выдержка из
Руководство по реагированию на чрезвычайные ситуации (ERG) 157, 2016
вещества-Toxic и / OR Corrosive (Non-Combustrable / Water-Sensity)
9
Enhingcarecarecarecarecare CareScarecare CareScarecare CareScarecare CareScarecare CareScarecare CareScareCare.
. Кислота является распространенным химическим веществом, которое используется в некоторых бытовых и промышленных продуктах и обработках для производства других промышленных продуктов. Хотя литература по лечению плавиковой кислотой основана на исследованиях на животных и некоторых отчетах о случаях/небольших сериях случаев, основное лечение не изменилось с середины 19 века.70-е годы. Врачи догоспитальной и неотложной медицины должны быть знакомы с первоначальным и текущим ведением и лечением потенциально опасных для жизни аритмий, вызванных секвестрацией кальция, магния и высвобождением калия.
 Должен быть обеспечен легкий перевод в ожоговые центры для постоянного наблюдения и лечения пациентов с глубокими ожогами плавиковой кислотой.
Должен быть обеспечен легкий перевод в ожоговые центры для постоянного наблюдения и лечения пациентов с глубокими ожогами плавиковой кислотой.Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Рисунок
ЭКГ Удлиненный интервал QTc. Предоставлено Daniel Schwerin, MD, FACEP, FAEMS, FAAEM
Ссылки
- 1.
Wu ML, Yang CC, Ger J, Tsai WJ, Deng JF. Тайваньский токсикологический центр сообщил об остром воздействии плавиковой кислоты, 1991–2010 годы. Hum Exp Toxicol. 2014 май; 33(5):449-54. [PubMed: 23892993]
- 2.
Stuke LE, Arnoldo BD, Hunt JL, Purdue GF. Ожоги плавиковой кислотой: 15-летний опыт. J Burn Care Res. 2008 ноябрь-декабрь;29(6):893-6. [PubMed: 18849854]
- 3.
Ким И, Шин Дж, Кан С, Кён С, Пак Дж. В., Ли С, Ли С, Чжон Ш. Легочный альвеолярный протеиноз, вызванный воздействием плавиковой кислоты во время испытаний огнетушителя.
 J Occup Med Toxicol. 2015;10:6. [PMC бесплатная статья: PMC4347543] [PubMed: 25737738]
J Occup Med Toxicol. 2015;10:6. [PMC бесплатная статья: PMC4347543] [PubMed: 25737738]- 4.
Ожоги и системная токсичность, меры защиты, неотложная и стационарная медицинская помощь. Открытый доступ Maced J Med Sci. 2018 25 ноября; 6 (11): 2257-2269. [Бесплатная статья PMC: PMC62
] [PubMed: 30559898]- 5.
Franzblau A, Sahakian N. Астма после воздействия фтористоводородной кислоты в домашних условиях. Am J Ind Med. 2003 г., сен; 44 (3): 321-4. [PubMed: 12929153]
- 6.
Смендра-Казмирска А., Кендзьерски М., Барздо М., Юрчик А., Шрам С., Берент Дж. Случайное отравление смесью соляной и плавиковой кислот. Arch Med Sadowej Kryminol. 2014 январь-март;64(1):50-8. [PubMed: 25184427]
- 7.
Атли К., Ридьярд Э. Лечение воздействия плавиковой кислоты на глаза. Int J Офтальмол. 2015;8(1):157-61. [Бесплатная статья PMC: PMC4325260] [PubMed: 25709926]
- 8.
Озой Г.
 , Кендирли Т., Атес У., Перк О., Азапагаси Э., Озджан С., Баран С., Гоктуг А., Диндар Х. Рефрактерный желудочковый смертельный исход Фибрилляция из-за приема фтористоводородной кислоты. Педиатр Неотложная помощь. 2019 ноябрь;35(11):e201-e202. [PubMed: 30020244]
, Кендирли Т., Атес У., Перк О., Азапагаси Э., Озджан С., Баран С., Гоктуг А., Диндар Х. Рефрактерный желудочковый смертельный исход Фибрилляция из-за приема фтористоводородной кислоты. Педиатр Неотложная помощь. 2019 ноябрь;35(11):e201-e202. [PubMed: 30020244]- 9.
Gradinger R, Jung C, Reinhardt D, Mall G, Figulla HR. Токсический миокардит вследствие перорального приема фтористоводородной кислоты. Циркуляция сердца и легких. 2008 июнь; 17 (3): 248-50. [PubMed: 17822953]
- 10.
Вохра Р., Велес Л.И., Ривера В., Бенитес Ф.Л., Делани К.А. Рецидивирующие опасные для жизни желудочковые аритмии, связанные с острым приемом фтористоводородной кислоты: наблюдения в одном случае и последствия для механизма токсичности. Клин Токсикол (Фила). 2008 Январь; 46 (1): 79-84. [В паблике: 173]
- 11.
Whiteley PM, Aks SE. Материалы дела консорциума Toxikon в Чикаго: выживание после преднамеренного приема плавиковой кислоты.
 J Med Toxicol. 2010 г., сен; 6 (3): 349-54. [Статья PMC бесплатно: PMC3550485] [PubMed: 20661686]
J Med Toxicol. 2010 г., сен; 6 (3): 349-54. [Статья PMC бесплатно: PMC3550485] [PubMed: 20661686]- 12.
McKee D, Thoma A, Bailey K, Fish J. Обзор лечения ожогов плавиковой кислотой. Пласт Сург (Оакв). 2014 Лето; 22(2):95-8. [Бесплатная статья PMC: PMC4116323] [PubMed: 25114621]
- 13.
Alper N, Desai K, Rabinowitz S. Лечение ожогов плавиковой кислотой. Эпластика. 2014;14:ic42. [Бесплатная статья PMC: PMC4215592] [PubMed: 25525489]
- 14.
Ye C, Wang X, Zhang Y, Ni L, Jiang R, Liu L, Han C. Десятилетняя эпидемиология химических ожогов в западной Провинция Чжэцзян, Китай. Бернс. 2016 май; 42(3):668-74. [PubMed: 26803372]
- 15.
Zhang Y, Zhang J, Jiang X, Ni L, Ye C, Han C, Sharma K, Wang X. Ожоги плавиковой кислотой в западной провинции Чжэцзян, Китай: 10 -летнее эпидемиологическое исследование. J Occup Med Toxicol. 2016;11:55. [Бесплатная статья PMC: PMC5142164] [PubMed: 27980604]
- 16.

Pu Q, Qian J, Tao W, Yang A, Wu J, Wang Y. Экстракорпоральная мембранная оксигенация в сочетании с постоянной заместительной почечной терапией при кожных ожогах и ингаляционных повреждениях, вызванных плавиковой и азотной кислотами . Медицина (Балтимор). 2017 Декабрь;96(48):e8972. [Статья бесплатно PMC: PMC5728805] [PubMed: 29310404]
- 17.
Dennerlein K, Kiesewetter F, Kilo S, Jäger T, Göen T, Korinth G, Drexler H. Поглощение кожи и повреждение кожи после воздействия плавиковой кислоты на модели кожи человека ex vivo. Токсикол Летт. 2016 25 апр; 248:25-33. [В паблике: 26930472]
- 18.
Hultén P, Höjer J, Ludwigs U, Janson A. Сравнение гексафторина со стандартной дезактивацией для снижения системной токсичности после кожного воздействия плавиковой кислоты. J Toxicol Clin Toxicol. 2004;42(4):355-61. [PubMed: 15461243]
- 19.
Диббелл Д.Г., Айверсон Р.Е., Джонс В., Лауб Д.Р., Мэдисон М.С. Плавиковая кислота ожога руки.


