Карточки по теме «Простейшие». Биология, 7 класс
Ф.И.______________________________________
Карточка «Строение амебы обыкновенной»
1 2
3
4
5
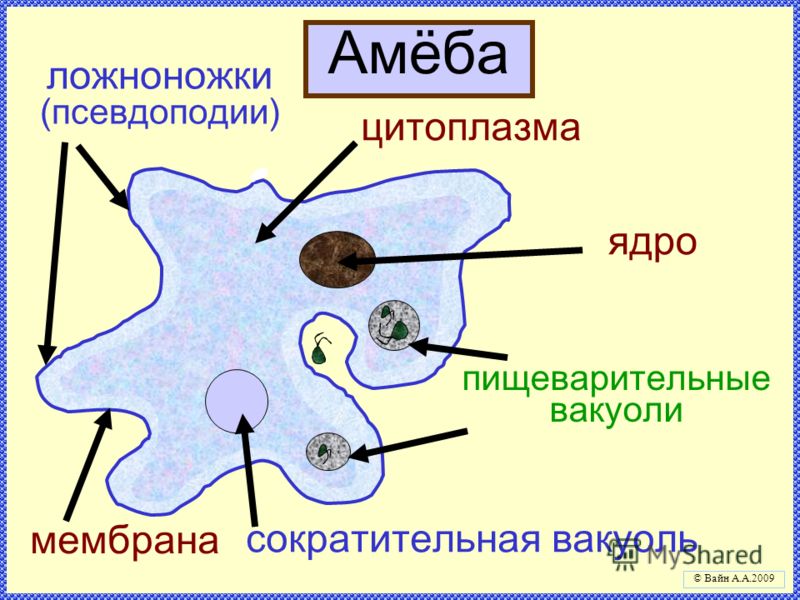
1. Подпишите строение амебы:
1-___________________________________________
2-___________________________________________
3-___________________________________________
4-___________________________________________
5-___________________________________________
2. Что за процесс изображен на нижнем рисунке?
Ответ:____________________________________
Характеристика эвглены зеленой
Среда обитания
Форма тела
Строение
Питание
1-
2-
Дыхание
Выделение
Размножение
Циста
Карточка «Строение эвглены зеленой»
1) Опишите строение клетки эвглены зеленой
1 ______________________
2_______________________
3_______________________
________________________
4_______________________
5_______________________
Тест
1. Эвглена зеленая двигается
Эвглена зеленая двигается
А) с помощью жгутиков
Б) с помощью ресничек
В) с помощью псевдоподий
Г) по реактивному принципу
2. Эвглена зеленая относится к классу
А) Саркодовые
Б) Жгутиконосцы
В) Инфузории
Г) Реснитчатые
3. Эвглена зеленая питается гетеротрофно
А) только при отсутствии света
Б) путем фагоцитоза через всю поверхность тела
В) путем фагоцитоза через клеточный рот
Г) путем фотосинтеза
4. Эвглена зеленая питается автотрофно
А) только при отсутствии света
Б) путем фагоцитоза через всю поверхность тела
В) путем фагоцитоза через клеточный рот
Г) путем фотосинтеза
5. Эвглена зеленая имеет
А) 1 жгутик
Б) 2 жгутика
В) 3 жгутика
Г) 4 жгутика
Карточка 1. Соотнесите простейшего и информацию, относящуюся к нему:
1
Амеба дизентерийная
А
Разрушает кровяные клетки человека, выделяя в кровь ядовитые вещества
2
Фораминиферы (морские корненожки)
Б
Не причиняют вреда, способствуют перевариванию клетчатки в желудке жвачных млекопитающих
3
Инфузории панцирные
В
Образуют значительную часть морских илов, морских осадков и пород
4
Малярийный плазмодий
Г
Обитает в толстой кишке человека
5
Трипаносома
Д
Передается через укус мухи со слюной
Карточка 2.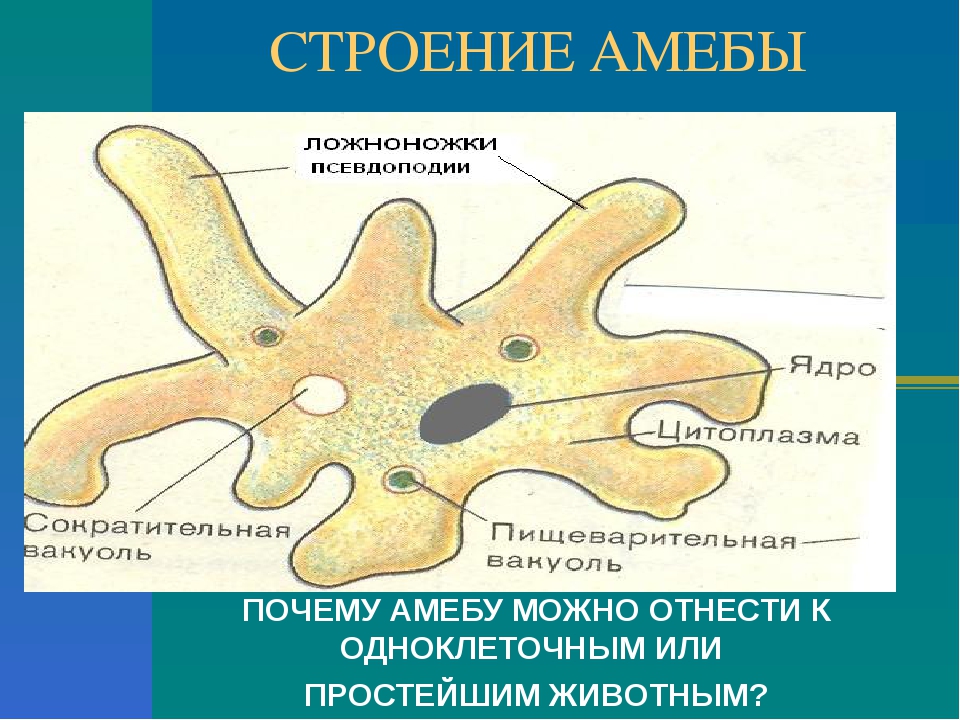 Соотнесите простейшего и информацию, относящуюся к нему:
Соотнесите простейшего и информацию, относящуюся к нему:
1
Амеба дизентерийная
А
Переносчиком служат мухи це-це
2
Фораминиферы (морские корненожки)
Б
Болезнь передают малярийные комары
3
Инфузории панцирные
В
Вызывает язвы в кишечнике и кровяной понос
4
Малярийный плазмодий
Г
Образуют отложения известняка
5
Трипаносома
Д
Живут в желудке жвачных животных, способствуя перевариванию клетчатки
Название простейшего
Значение
Где живет
Что вызывает?
Фораминефера (амеба)- морская корненожка
Лучевики(радиолярии, морские амебы)
Дизентерийная амебаПанцирные инфузории
Малярийный плазмодий
Трипаносома
Лейшмании
« Сходство и различие простейших»
Органоиды
П р о с т е й ш и е
Амеба
Евглена зеленая
Инфузория-туфелька
1. Оболочка
Оболочка
2.Цитоплазма
3 Ядро
4. Ложноножка
5. Жгутик
6. Ресничка
7.Пищеварительная вакуоль
8.Сократительная вакуоль
9.Ротовое отверстие
10.Порошица
11.Хлоропласты
12.Светочувствительный глазок
Примечание: если данный органоид имеется, ставим +
Характеристика инфузории-туфельки
Среда обитания
Форма тела
Движение
Строение
Питание
Дыхание
Выделение
Размножение
Раздражимость
Циста
Ф.И.______________________________
Строение инфузории-туфельки
1 — _____________________
2 — ______________________
3 — ______________________
4 — ______________________
5 — ______________________
6 — ______________________
_________________________
7 — ______________________
_________________________
8 — ______________________
_________________________
9 — ______________________
Ф. И.______________________________
И.______________________________
Тест «Инфузория-туфелька»
1. Дыхание инфузории осуществляется
А) через всю поверхность тела
Б) благодаря органам передвижения
В) с помощью вакуолей
Г) с помощью специальных органоидов
2. Органоиды движения у инфузорий
А) жгутики
Б) реснички
В) ложноножки
Г) отсутствуют
3. Малое ядро инфузории туфельки
А) необходимо для полового процесса, при конъюгации делится
Б) необходимо для полового процесса, при конъюгации исчезает
В) снабжает клетку информацией о строении белков, при конъюгации делится
Г) снабжает клетку информацией о строении белков, при конъюгации исчезает
4. Какой органоид присутствует в клетке у инфузории-туфельки в отличие от амебы и эвглены?
А) ядро
Б) сократительная вакуоль
В) порошица
Г) пищеварительная вакуоль
5. К какому типу относится инфузория-туфелька?
А) саркомастигофоры
Б) споровики
В) жгутиковые
Г) ресничные
6.
А) образует цисту
Б) размножается бесполым путем
В) размножается половым путем
Г) размножается половым путем и образует цисту
7. Процесс, при котором происходит обновление генетического материала между инфузориями, но количество особей остается неизменным
А) обмен веществ
Б) бесполое размножение
В) половое размножение
Г) пищеварение
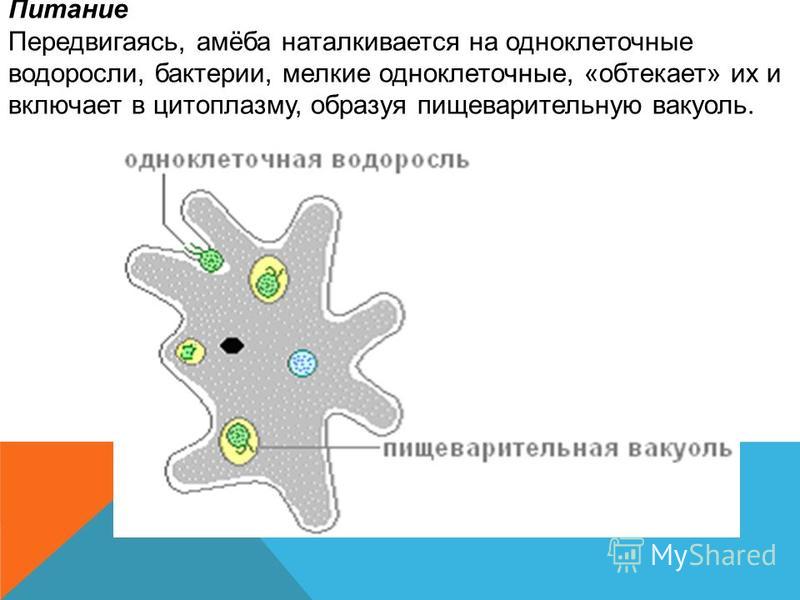
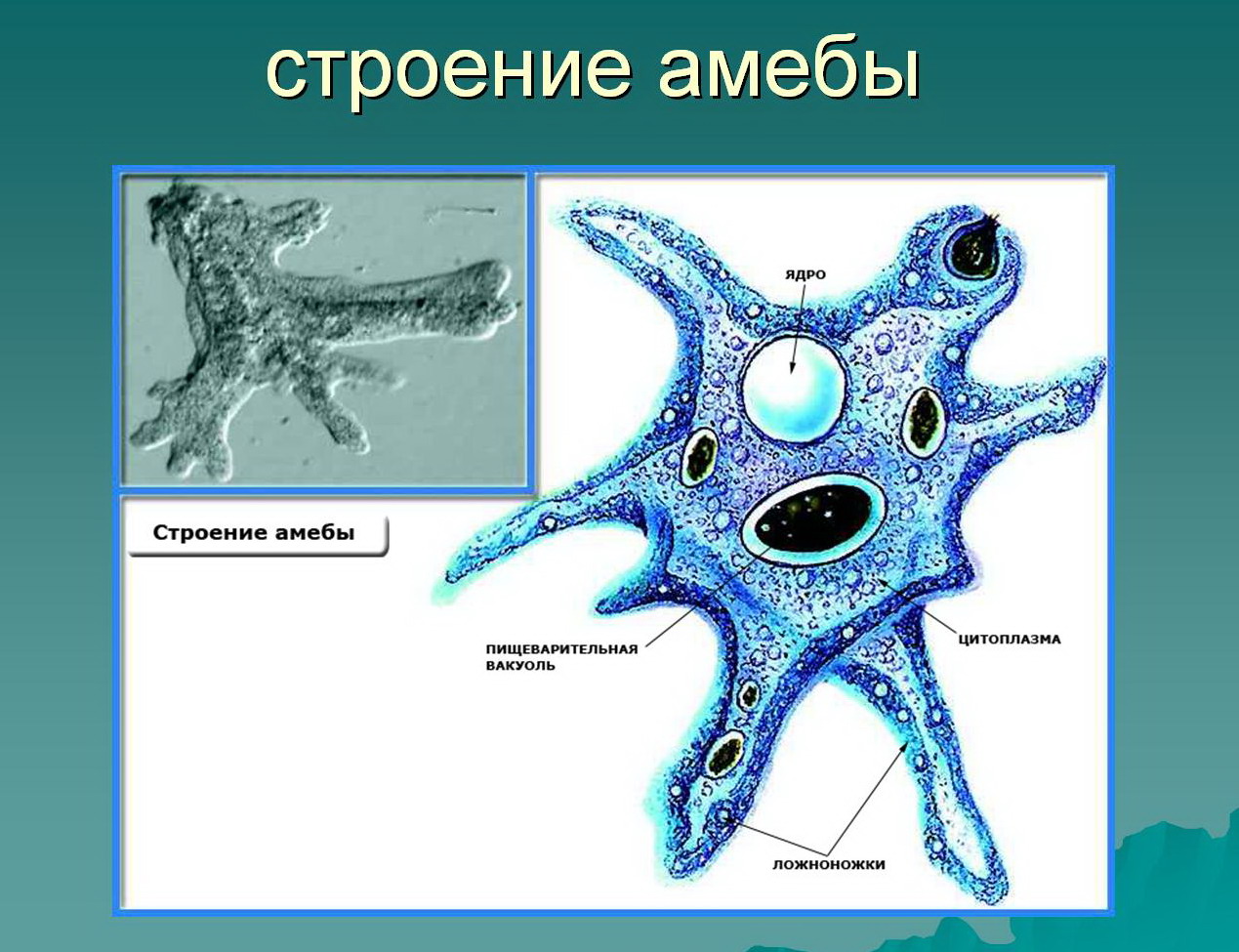
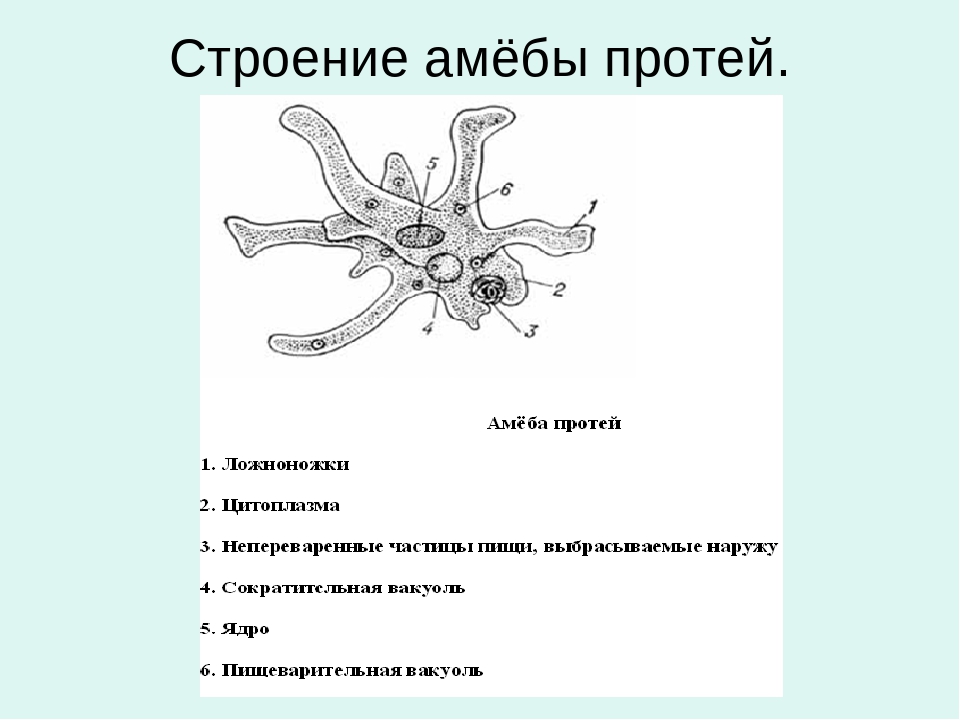
Внешний вид строение и движение амебы рисунок. Класс саркодовые (или корненожки)
Амёба протей или обыкновенная амёба – лат. Amoeba proteus. Амёба протей или представляет собой огромный амебоидный организм, представитель класса лобозные амёбы, относится к типу простейшие . Встречается в пресных водах, аквариумах .
В капле воды, взятой из пруда, болота, канавы или аквариума, если ее рассматривать под микроскопом, открывается целый мир живых существ. Среди них имеются крошечные полупрозрачные беспозвоночные животные, непрестанно изменяющие форму своего тела.
Обыкновенная амеба, как и инфузория туфелька – самые простые по своему строению животные. Чтобы рассмотреть обыкновенную амёбу, необходимо поместить каплю воды с амебами под микроскоп. Все тело обыкновенной амебы состоит из крошечного студенистого комочка живого вещества – протоплазмы с ядром внутри. Из курса ботаники известно, что комочек протоплазмы с ядром – это клетка. Значит, обыкновенная амёба – одноклеточное беспозвоночное животное. Тело её состоит только из протоплазмы и ядра.
Наблюдая за амебой протей под микроскопом, мы замечаем, что через некоторое время форма ее тела изменяется. Амеба протей не имеет постоянной формы тела. Поэтому она и получила название «амёба», что в переводе с греческого языка означает «изменчивая».
Также под микроскопом, можно заметить, что она медленно переползает на затемненную часть стекла. Яркий солнечный свет быстро убивает обыкновенных амеб. Если внести в капельку воды кристаллик поваренной соли, амеба пере-стает двигаться, втягивает ложноножки и приобретает шарообразную форму.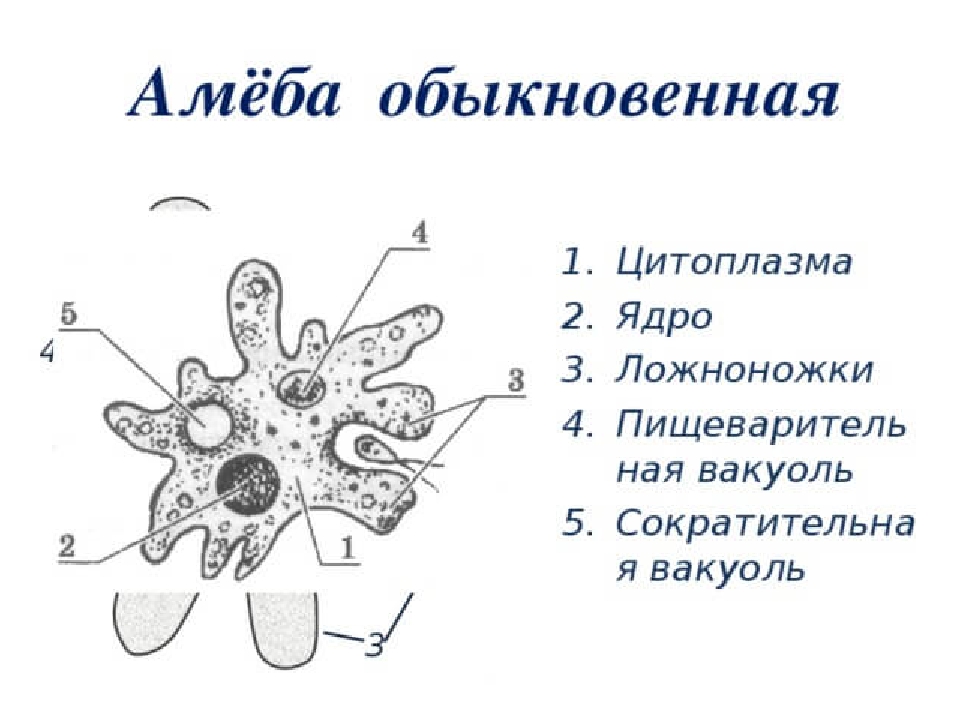
Обыкновенных амеб можно найти даже в канавах и лужах, образовавшихся совсем недавно. Когда водоем, в котором живут обыкновенные амебы и другие простейшие, начинает высыхать, они не погибают, а покрываются плотной оболочкой, превращаясь в цисту. В таком состоянии амебы и другие простейшие могут переносить как высокую температуру (до +50, +60°), так и сильное охлаждение (до – 273 градусов). Ветром цисты разносятся на значительные расстояния. Когда такая циста снова попадает в благоприятные условия, она начинает питаться и размножаться. Благодаря такому приспособлению, обыкновенные амёбы переживают неблагоприятные для них условия жизни и расселяются по всей планете. Передвижение амёбы происходит при помощи ложноножек.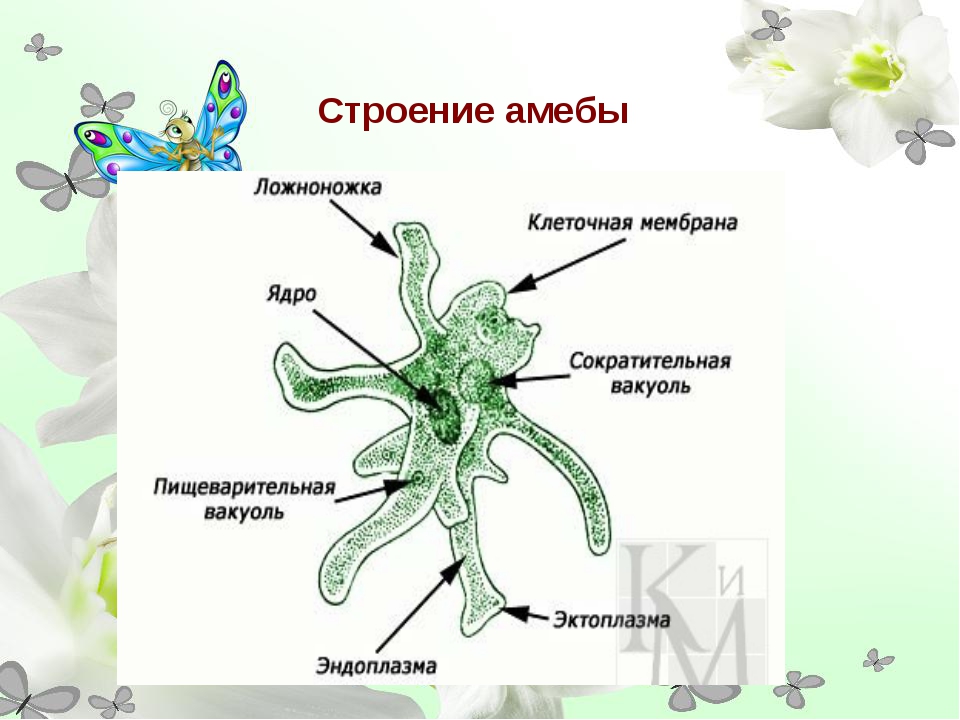
Питается амёба бактериями, водорослями, микроскопическими грибами. С помощью ложноножек (из-за которых осуществляется перемещение амёбы), захватывает пищу.
Амёбе протей, также, как и всем животным, необходим кислород. Дыхание амёбы осуществляется за счёт усваивания кислорода из воды и выделением углекислого газа.
Размножаются обыкновенные амёбы делением. При этом ядро амебы удлиняется, а затем делится пополам.
Самый простейший организм – амеба протей, хотя существуют разные виды амеб. Свое название она получила в честь Протея – персонажа греческой мифологии, особенностью которого было менять свою внешность. Существо – прокариот, поскольку это не бактерия, как думает множество людей. Это бесцветный организм гетеротрофного типа, эукариот, который способен питаться микроорганизмами и одноклеточными водорослями. Несмотря на свою простоту и короткий жизненный цикл, этот тип животного играет важную роль в природе.
Описание
Согласно классификации, амебу обыкновенную относят к царству «Животные», подцарству «Простейшие», классу свободноживущих саркодовых.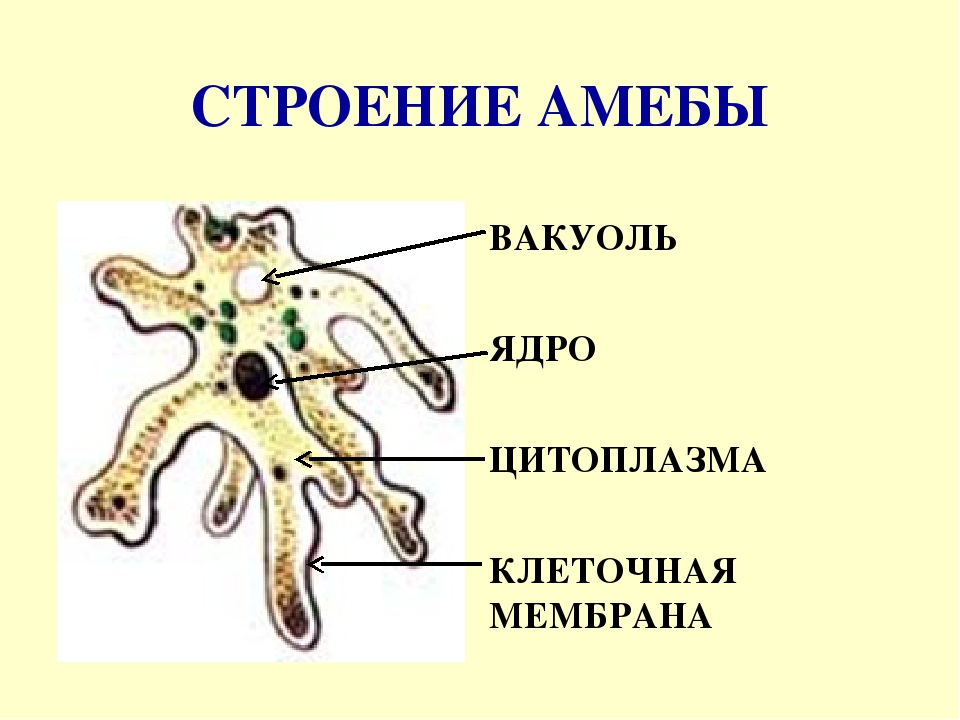 Строение существа примитивное, а передвигается оно благодаря временно появляющимся выпячиваниям цитоплазмы (называют еще корненожка). Тело протей состоит всего лишь из единственной клетки, являющейся независимым и полноценным организмом.
Строение существа примитивное, а передвигается оно благодаря временно появляющимся выпячиваниям цитоплазмы (называют еще корненожка). Тело протей состоит всего лишь из единственной клетки, являющейся независимым и полноценным организмом.
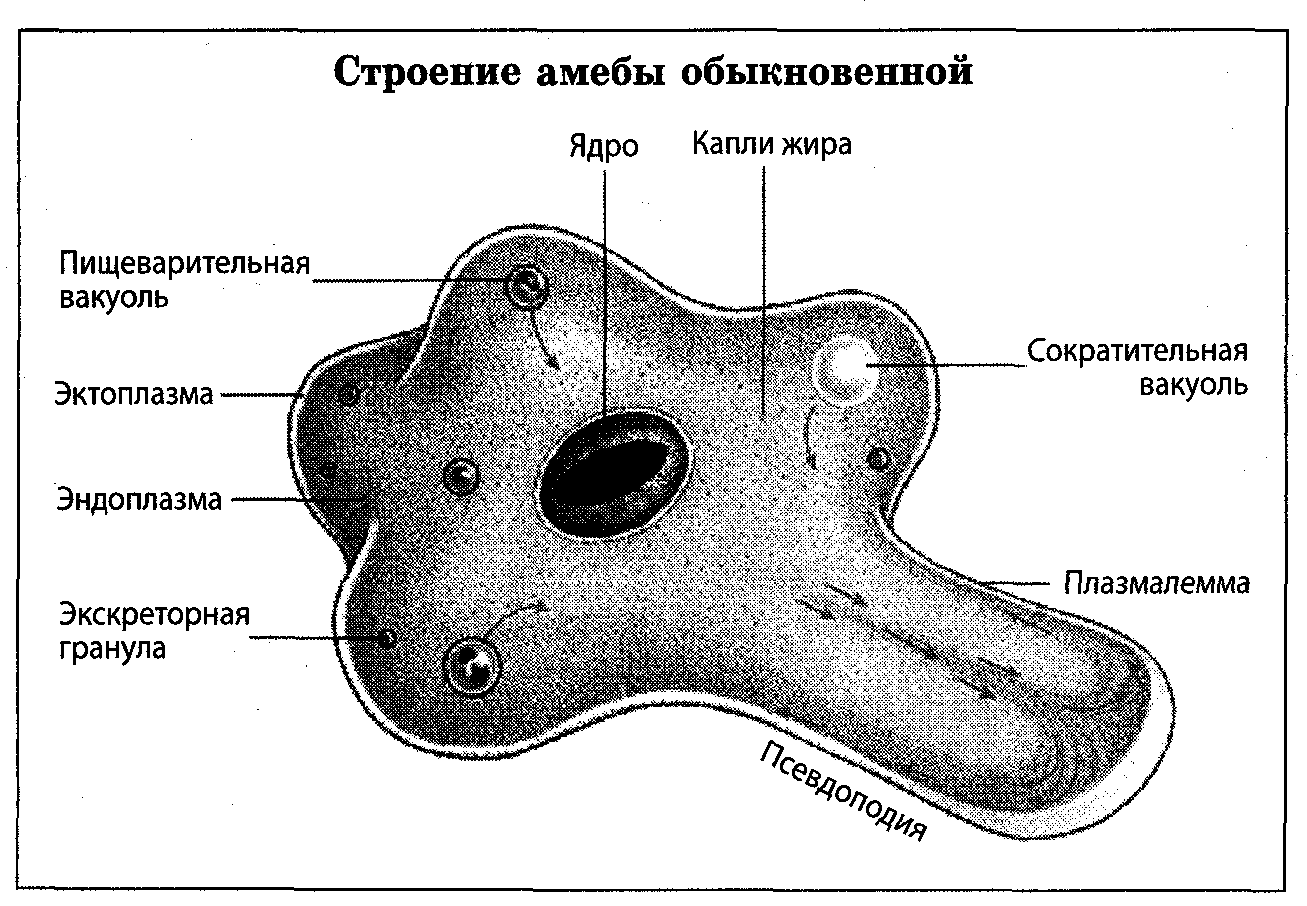
Амёба обыкновенная – эукариот, одноклеточное независимое животное. Характеристика его такова: тело полужидкое, размер достигает 0,2-0,7 мм в длину, и хорошо разглядеть существо можно только под микроскопом. По всей поверхности амебная клетка покрыта цитоплазмой, защищающей собой «внутренности». Сверху находится цитоплазматическая оболочка. У амебы строение цитоплазмы – двухслойное. Внешний слой – прозрачный и плотный, внутренний ‑ зернистый и текучий. В цитоплазме располагаются сократительная вакуоль амебы (за счет нее происходит выделение ненужных веществ наружу), ядро и пищеварительная вакуоль. При движении постоянно меняется форма цитоплазмы. Исследовав изображения, ученые определили, что у Протея более пятисот хромосом, настолько мелких, что за ними нет возможности наблюдать.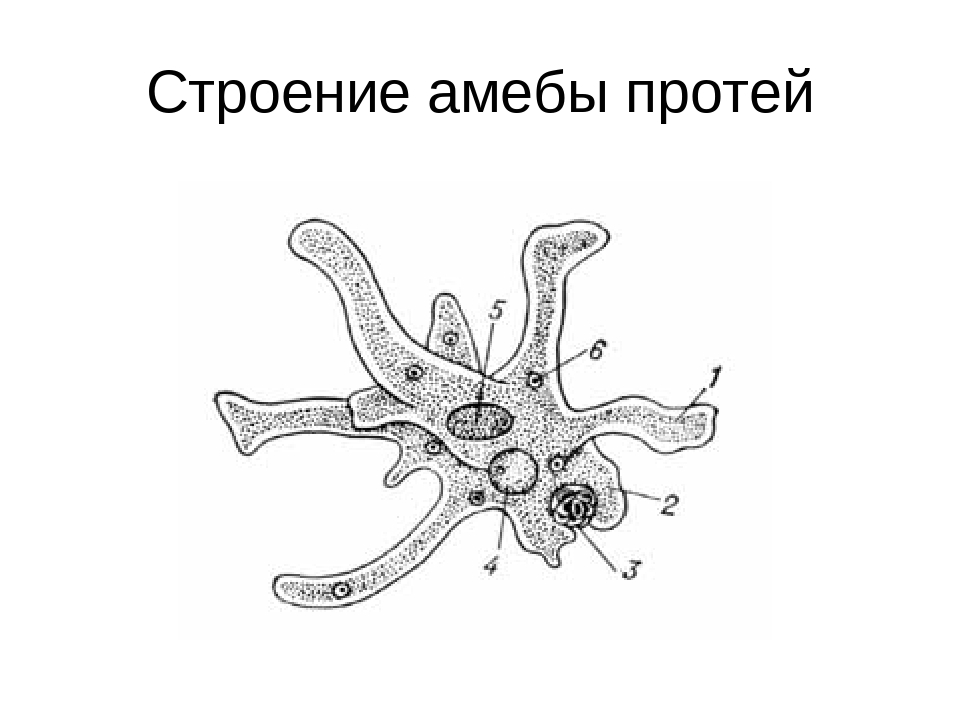
Дыхание осуществляется всем телом. Скелет отсутствует. Размножение амебы бесполое. Органом чувств (в том числе дыхания) амебная клетка также не располагает.
Тем не менее, одноклеточная амеба дышит, чувствительна к химическим веществам, раздражителям механического типа и избегает солнечных лучей.
Одно из особенностей животного – способность к регенерации. Это означает, что в случае повреждения клетка сможет самостоятельно восстановиться, достроив отсутствующие фрагменты. Единственное условие – полное сохранение ядра, поскольку оно является носителем всех информационных данных о строении. Без ядра амебный организм просто погибнет.
Передвижение амеб происходит при помощи ложноножек, так называемых непостоянных выростов цитоплазмы, которые еще именуют псевдоподиями. Мембрана клетки очень эластична и способна растягиваться в любом месте. Чтобы образовать ложноножку, сначала происходят выпячивания цитоплазмы наружу тела, так, чтобы они выглядели наподобие толстых щупалец. После – выполняются те же действия, только в обратном порядке – цитоплазма движется внутрь, ложноножка прячется и появляется в другой части тела. Именно такой способ передвижения не дает животному иметь постоянную форму тела. Несмотря на малый размер, передвигаются существа сравнительно быстро – около 10 мм/час.
После – выполняются те же действия, только в обратном порядке – цитоплазма движется внутрь, ложноножка прячется и появляется в другой части тела. Именно такой способ передвижения не дает животному иметь постоянную форму тела. Несмотря на малый размер, передвигаются существа сравнительно быстро – около 10 мм/час.
Амеба двигается при помощи ложноножек, именно поэтому она не имеет постоянную форму тела
Как питаются и дышат одноклеточные?
Амебный жизненный цикл полностью зависит от того, как питается животное и какова окружающая среда. В рацион протея входят остатки гниения, одноклеточные водоросли, бактерии, а также микроорганизмы, имеющие подходящий размер. Питание амебы происходит путем захвата «добычи» ложноножками и затягивания внутрь тела. Вокруг пищи формируется вакуоль, в которую затем и поступает пищеварительный сок. Интересно то, что процесс захватывания и дальнейшее переваривание могут происходить в любом участке тела и даже в нескольких частях одновременно. Получаемые при переваривании питательные вещества попадают в цитоплазму и расходуются на построение тела амебы. В процессе рассасывания водорослей и бактерий простейшие незамедлительно выводят наружу остатки жизнедеятельности, причем это может также происходить любым участком цитоплазмы.
Получаемые при переваривании питательные вещества попадают в цитоплазму и расходуются на построение тела амебы. В процессе рассасывания водорослей и бактерий простейшие незамедлительно выводят наружу остатки жизнедеятельности, причем это может также происходить любым участком цитоплазмы.
Как и все простейшие класса одноклеточных, у протей отсутствуют специальные органеллы. Дыхание у амебы происходит за счет поглощения растворенного в воде (или жидкости) кислорода поверхностным аппаратом. Клеточная мембрана животного проницаема, и через нее свободно проходят углекислый газ и кислород.
Как размножаются?
Для вывода потомства используется бесполое размножение с разделением тела на две одинаковые части. Подробнее, сколько стадий проходит клетка при делении.
Процесс происходит только в теплую пору и включает в себя несколько стадий:
- Первым делом делению подвергается ядро. Оно выпячивается, растягивается, в нем появляются перетяжки, с помощью которых затем и происходит деление на две совершенно идентичные части.
 При этом наблюдается расхождение дочерних хромосом к противоположным полюсам материнской клетки.
При этом наблюдается расхождение дочерних хромосом к противоположным полюсам материнской клетки. - Далее происходит разделение цитоплазмы между двумя ядрами. Ее зоны располагаются и сосредотачиваются вокруг ядер, тем самым формируя две новые клетки.
- Поскольку в теле амебы сократительная вакуоль имеется только в единичном экземпляре, она достается лишь одной новой клетке. В другой она формируется заново. Подробнее описание процесса деления и расхождения хромосом демонстрирует рисунок.
Деление клетки таким способом называется митозом, поэтому полученные два организма являются копией «мамы». Половой процесс отсутствует, поэтому обмен хромосом также не происходит.
Размножаются обыкновенные амебы очень быстро. Если судить по времени, существо каждые 3 часа делится на 2 клетки, поэтому живет амебный организм мало.
Особенности существования и развития
Жизненный цикл прост. Единственная клетка, являющаяся по совместительству и телом животного, в процессе развития растет, а по достижению взрослого состояния «размножается», делясь на два тела бесполым путем с расхождением материнских хромосом «детям». Попадая в негативные для жизни условия (холодное время года, высыхание водоема), такая клетка способна «умереть» на время. При этом тело претерпевает изменения: псевдоподии втягиваются, из цитоплазмы выделяется вода и покрывает весь амебный организм, образуя двойную оболочку с последующим формированием цисты. Протея «замирает». Когда окружающая среда станет пригодной для жизни, существо «возрождается», циста амебы вскрывается, выпускаются ложноножки (чтобы передвигаться), и существо размножается. Подробно узнать, что такое амеба, можно на видео.
Попадая в негативные для жизни условия (холодное время года, высыхание водоема), такая клетка способна «умереть» на время. При этом тело претерпевает изменения: псевдоподии втягиваются, из цитоплазмы выделяется вода и покрывает весь амебный организм, образуя двойную оболочку с последующим формированием цисты. Протея «замирает». Когда окружающая среда станет пригодной для жизни, существо «возрождается», циста амебы вскрывается, выпускаются ложноножки (чтобы передвигаться), и существо размножается. Подробно узнать, что такое амеба, можно на видео.
Животное имеет огромное значение в природе. Оно – источник еды многоклеточных организмов (амёбами питаются черви, ракообразные, мальки рыб, различные моллюски). Обитающая в водоемах протея в процессе жизни очищает водоемы, поедая различного типа микроорганизм, бактерии и гниющие части водорослей, простейшие раковинные амебы участвуют в формировании меловых отложений и известняков.
Простейшие в капле прудовой воды (под микроскопом).
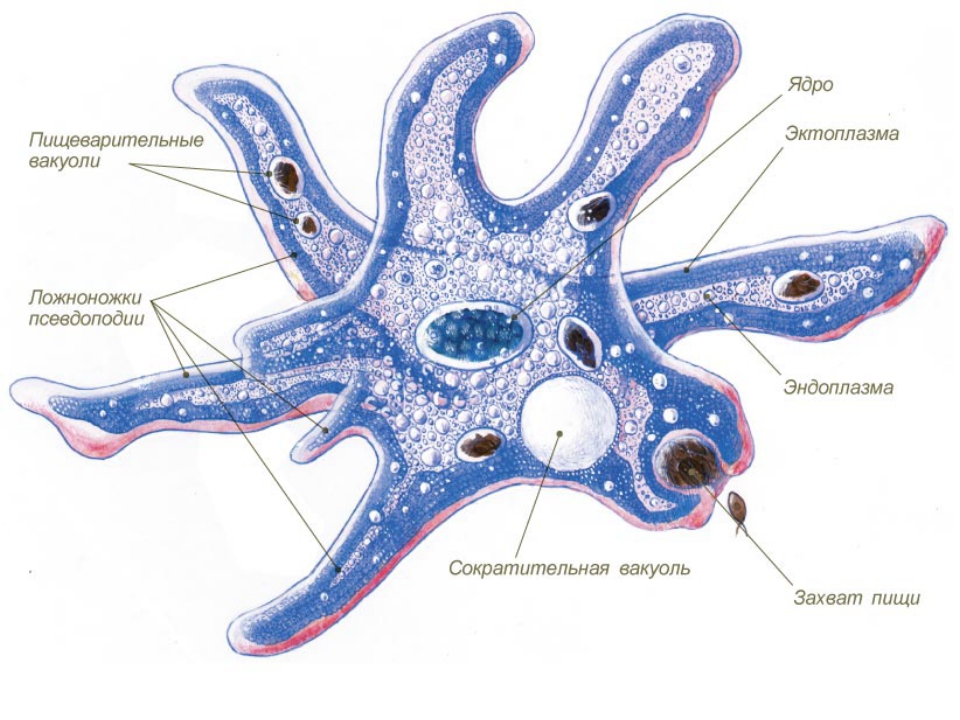
Класс корненожек объединяет наиболее простых одноклеточных животных, тело которых лишено плотной оболочки, а потому не имеет постоянной формы.Для них характерно образование ложноножек, которые представляют собой временно образующиеся выросты цитоплазмы, способствующие передвижению и захвату пищи.
Среда обитания, строение и передвижение амёбы. Обыкновенная амёба встречается в иле на дне прудов с загрязненной водой. Она похожа на маленький (0,2-0,5 мм), едва заметный простым глазом бесцветный студенистый комочек, постоянно меняющий свою форму («амеба» означает «изменчивая»). Рассмотреть детали строения амёбы можно только под микроскопом.
Тело амёбы состоит из полужидкой цитоплазмы с заключенным внутрь неё небольшим пузыревидным ядром . Амёба состоит из одной клетки, но эта клетка — целый организм, ведущий самостоятельное существование.
Цитоплазма клетки находится в постоянном движении. Если ток цитоплазмы устремляется к одной какой-то точке поверхности амёбы,
в этом месте на её теле появляется выпячивание.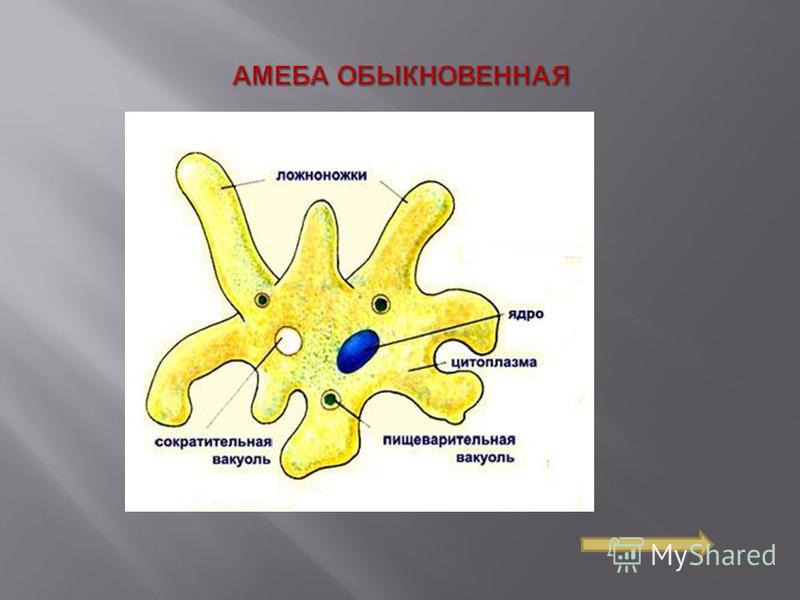 Оно увеличивается, становится выростом тела — ложноножкой, в него перетекает цитоплазма,
и амёба таким способом передвигается. Амёбу и других простейших, способных образовывать ложноножки, относят к группе корненожек . Такое название они получили за внешнее сходство ложноножек с корнями растений.
Оно увеличивается, становится выростом тела — ложноножкой, в него перетекает цитоплазма,
и амёба таким способом передвигается. Амёбу и других простейших, способных образовывать ложноножки, относят к группе корненожек . Такое название они получили за внешнее сходство ложноножек с корнями растений.
Жизнидеятельность Амёбы.
Питание . У амёбы одновременно может образовываться несколько ложноножек, и тогда они окружают пищу — бактерии, водоросли, других простейших. Из цитоплазмы, окружающей добычу, выделяется пищеварительный сок. Образуется пузырёк — пищеварительная вакуоль. Пищеварительный сок растворяет часть веществ, входящих в состав пищи, и переваривает их. В результате пищеварения образуются питательные вещества, которые просачиваются из вакуоли в цитоплазму и идут на построение тела амебы. Нерастворенные остатки выбрасываются наружу в любом месте тела амебы.
Дыхание Амёбы . Амёба дышит растворенным в воде кислородом, который проникает в ее цитоплазму через всю поверхность тела.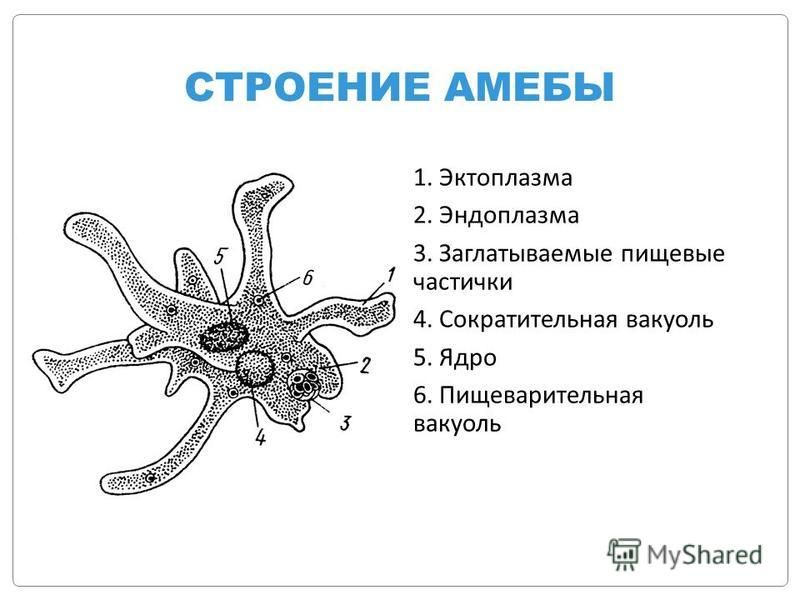 При участии кислорода происходит разложение сложных пищевых веществ цитоплазмы на более простые.
При этом выделяется энергия, необходимая для жизнидеятельности организма.
При участии кислорода происходит разложение сложных пищевых веществ цитоплазмы на более простые.
При этом выделяется энергия, необходимая для жизнидеятельности организма.
Выделение вредных веществ жизнидеятельности и избытка воды. Вредные вещества удаляются из организма амёбы через поверхность ее тела, а также через особый пузырек — сократительную вакуоль. Окружающая амебу вода постоянно проникает в цитоплазму, разжижая ее. Избыток этой воды с вредными веществами постепенно наполняет вакуоль. Время от времени содержимое вакуоли выбрасывается наружу. Итак, из окружающей среды в организм амёбы поступают пища, вода, кислород. В результате жизнедеятельности амёбы они претерпевают изменения. Переваренная пища служит материалом для построения тела амёбы. Образующиеся вредные для амёбы вещества удаляются наружу. Происходит обмен веществ. Не только амёба, но и все другие живые организмы не могут существовать без обмена веществ как внутри своего тела, так и с окружающей средой.
Размножение Амёбы .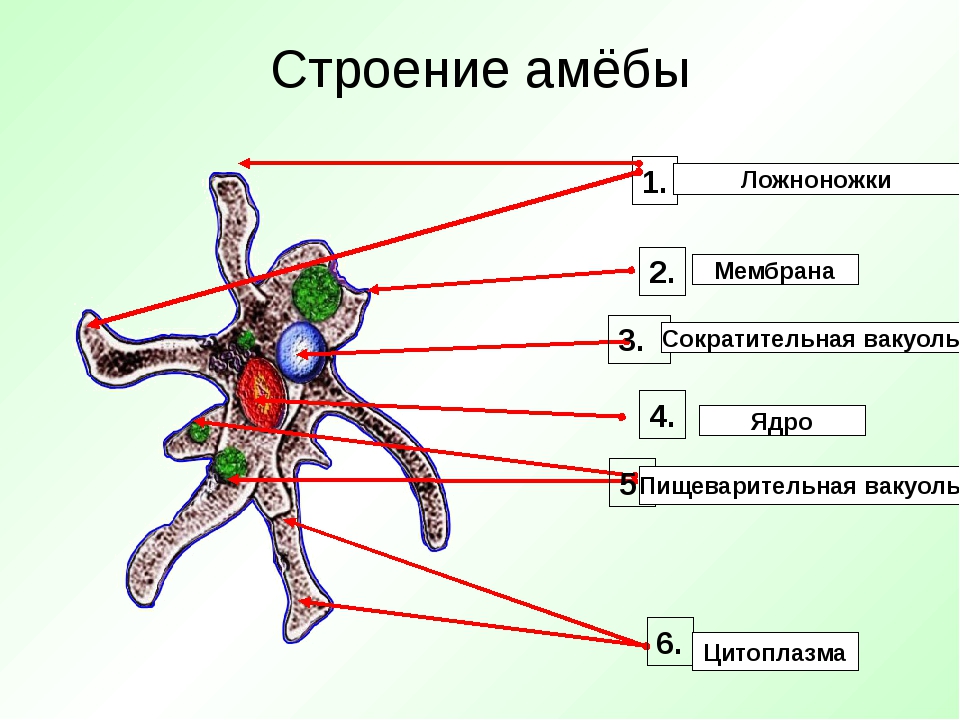 Питание амёбы приводит к росту ее тела. Выросшая амёба приступает к размножению.
(? Наверное вследствии превышения определённой массы её тела.) Размножение начинается с изменения ядра.
Оно вытягивается, поперечной бороздкой делится на две половинки, которые расходятся в разные стороны — образуется два новых ядра.
Тело амёбы разделяет на две части перетяжка. В каждую из них попадает по одному ядру. Цитоплазма между обеими частями разрывается, и образуются две новые амёбы.
Сократительная вакуоль остается в одной из них, в другой же возникает заново. Итак, амёба размножается делением надвое.
В течение суток деление может повторяться несколько раз.
Питание амёбы приводит к росту ее тела. Выросшая амёба приступает к размножению.
(? Наверное вследствии превышения определённой массы её тела.) Размножение начинается с изменения ядра.
Оно вытягивается, поперечной бороздкой делится на две половинки, которые расходятся в разные стороны — образуется два новых ядра.
Тело амёбы разделяет на две части перетяжка. В каждую из них попадает по одному ядру. Цитоплазма между обеими частями разрывается, и образуются две новые амёбы.
Сократительная вакуоль остается в одной из них, в другой же возникает заново. Итак, амёба размножается делением надвое.
В течение суток деление может повторяться несколько раз.
Деление (размножение) Амёбы.
Циста . Питание и размножение амёбы происходит в течение всего лета. Осенью при наступлении холодов амёба перестает питаться, тело ее становится округлым,
на его поверхности выделяется плотная защитная оболочка — образуется циста. То же самое происходит при высыхании пруда , где живут амёбы. В состоянии цисты амёба переносит неблагоприятные для неё условия жизни. При наступлении благоприятных условий амёба покидает оболочку цисты.
Она выпускает ложноножки, начинает питаться и размножаться. Цисты, разносимые ветром, способствуют расселению (распространению) амеб.
В состоянии цисты амёба переносит неблагоприятные для неё условия жизни. При наступлении благоприятных условий амёба покидает оболочку цисты.
Она выпускает ложноножки, начинает питаться и размножаться. Цисты, разносимые ветром, способствуют расселению (распространению) амеб.
Возможные дополнительные вопросы для самостоятельного изучения.
- Что заставляет Цитоплазму планомеренно перетекать из одного участка Амёбы в другой, заставляя её передвигаться в заданном направлении?
- Как происходит распознавание оболочкой цитоплазмы Амёбы питательных веществ, вследствии чего амёба целенаправленно формирует ложноножки и пищеварительную вакуоль?
Цитоплазма полностью окружается мембраной, которая подразделяется на три слоя: наружный, средний и внутренний. Во внутреннем слое, который носит название эндоплазма, находятся необходимые элементы для самостоятельного организма:
- рибосомы;
- элементы аппарата Гольджи;
- опорные и сократительные волокна;
- пищеварительные вакуоли.

Пищеварительная система
Одноклеточное может активно размножаться только во влаге, в сухом месте обитания амебы питание и репродукция невозможны.
Дыхательная система и реакция на раздражение
Амёба протей
Деление амебы
Наиболее благоприятная среда существования отмечается в водоеме и человеческом теле . В этих условиях амеба размножается быстро, активно питается бактериями в водоемах и постепенно разрушает ткани органов постоянного хозяина, которым выступает человек.
Размножение амебы происходит бесполым путем . Бесполое размножение подразумевает собой деление на клетки и образование нового одноклеточного.
Отмечается, что одна взрослая особь может делиться несколько раз в день. Этим определяется наибольшая опасность для человека, который страдает амебиазом.
Именно поэтому при первых же симптомах заболевания, врачи настоятельно рекомендуют обратиться за помощью к специалисту, а не начинать самолечение. Неправильно подобранные препараты и вовсе могут нанести пациенту больше вреда, нежели пользы.
Неправильно подобранные препараты и вовсе могут нанести пациенту больше вреда, нежели пользы.
Вконтакте
возможные причины заражения, симптомы, терапия
Entamoeba gingivalis, или ротовая амеба обитает в ротовой полости (на зубах, миндалинах неба, в альвеолах, в зубном налете) и относится к простейшим паразитам. Как правило, этот микроорганизм питается грибками и бактериями и достигает 60 микрометров в длину. Десневая амеба развивается у людей, страдающих различными патологиями полости рта, к примеру кариесом. Лечение паразита проводится в сочетании с лечением других заболеваний и заключается в применении медикаментов местного воздействия, ополаскивателей и пероральном использовании лекарственных средств.
Жизненный цикл ротовой амебы
В основном хозяином микроорганизма может быть только человек. Иногда десневую амебу обнаруживают в пасти лошадей, кошек и собак, а также у живущих в зоопарках обезьян. Стоит отметить, что жизненный цикл паразита состоит только из трофозоитной стадии.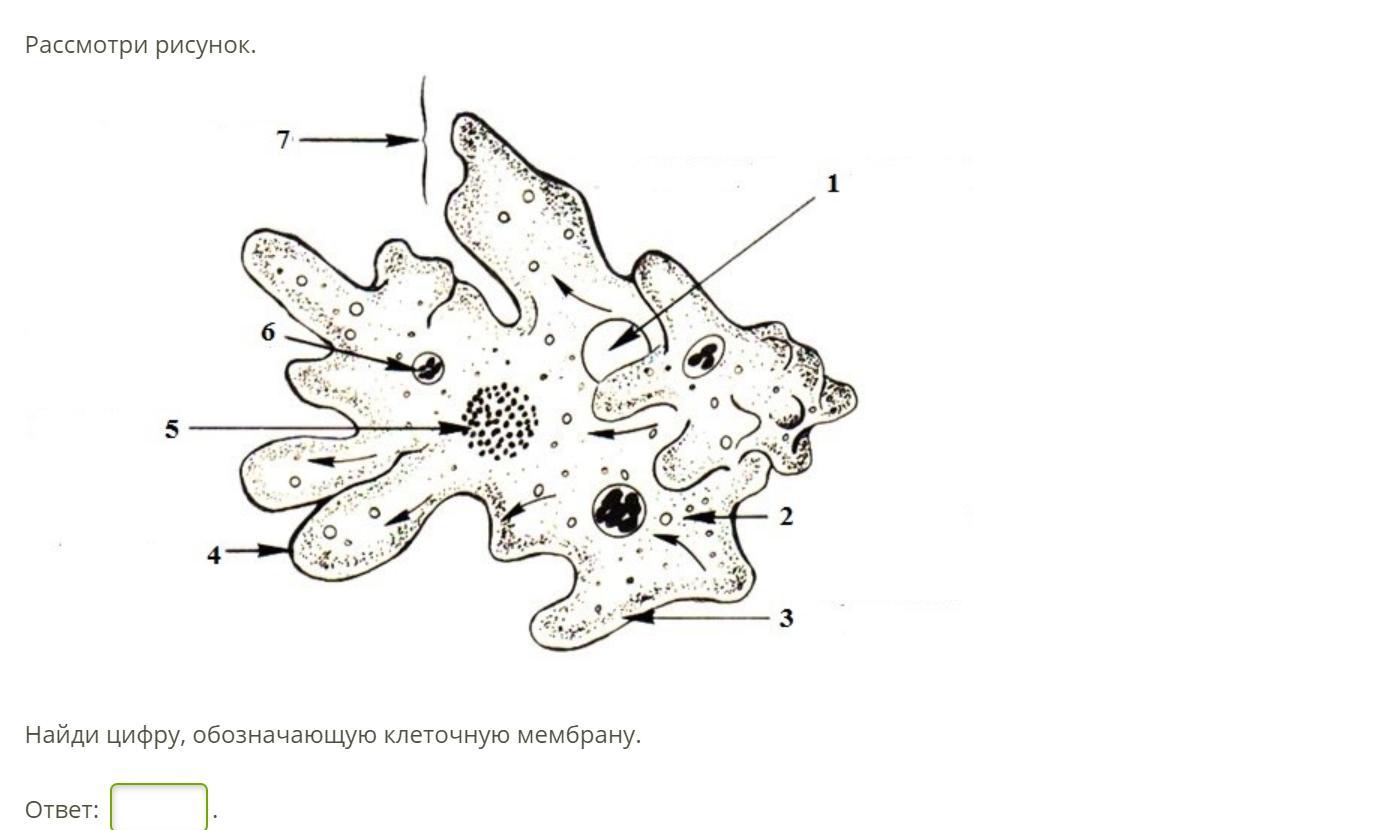 Иногда у Entamoeba gingivalis появляется одна ложноножка, но чаще всего средством для передвижения выступают псевдоподии.
Иногда у Entamoeba gingivalis появляется одна ложноножка, но чаще всего средством для передвижения выступают псевдоподии.
Размножение паразита происходит простым делением ядра – две дочерние клетки образуются из одной материнской. Паразит неспособен к жить вне полости рта. Строение ротовой амебы позволяет ей переходить в стадию цисты при неблагоприятных факторах. В этот момент она покрывается прочной оболочкой и втягивает псевдоподии.
Как можно заразиться
Инфицирование десневой амебой происходит воздушно-капельным путем, то есть попасть в организм паразит может вместе с микроскопическими капельками слизи и слюны во время кашля или чихания. Также заражение простейшей ротовой амебой может случиться при использовании одной зубной щетки, поцелуе или употреблении пищи из одной посуды с инфицированным человеком.
Симптомы
Специалисты считают, что Entamoeba gingivalis не является паразитическим микроорганизмом, но все же ее часто встречают при воспалительных процессах в ротовой полости.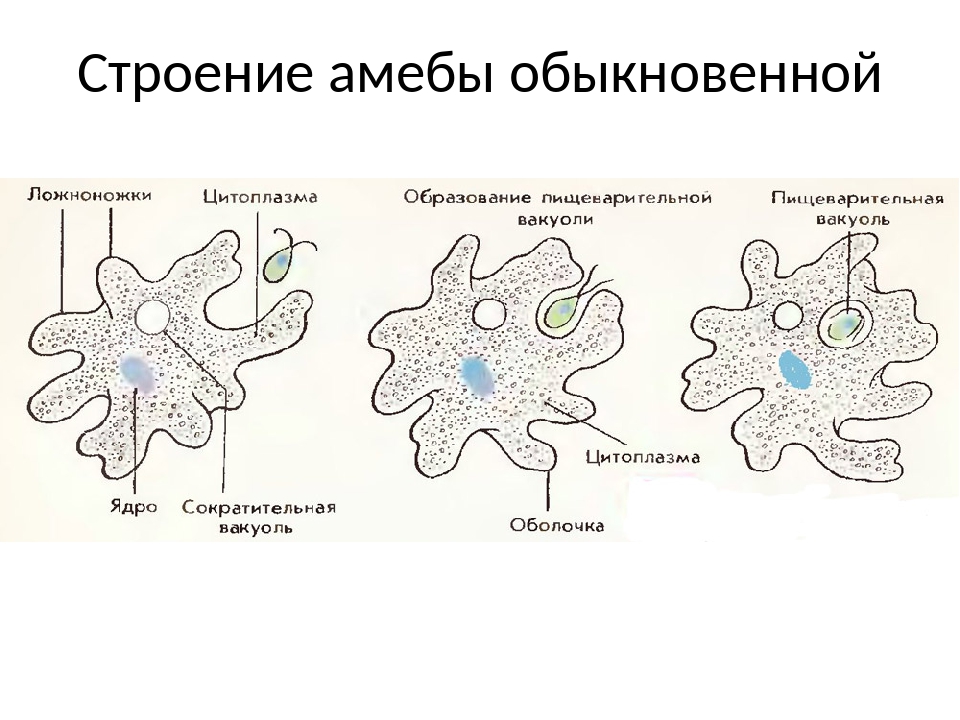
При ослабленном иммунитете амеба провоцирует такие заболевания, как гингивит, стоматит, периодонтит и другие патологии слизистой рта. Как правило, такими болезнями страдают дети в раннем возрасте. В последнее время случаи заражения ротовой амебой все чаще фиксируются и у взрослых.
Стоматит
После инфицирования паразитом в скором времени на слизистой оболочке рта появляется небольшая язвочка круглой формы. По виду она окружена ореолом, а в центральной части отлично видно белую пленку. В этот период во рту появляется неприятное жжение, а зараженные места краснеют и отекают. Иногда при заражении может повышаться температура тела, появляться кровоточивость десен и увеличиваться слюноотделение. При стоматите прием еды становится проблематичным, так как пережевывание пищи приносит болезненные ощущения, а изо рта появляется плохой запах.
Гингивит
Гингивит – это воспаление десен без нарушения целостности соединения зубов с десневой тканью. Этот процесс чаще всего бывает вызван ротовой амебой. Как правило, заболевание появляется при снижении иммунитета. Чаще всего паразит вызывает гингивит у детей дошкольного возраста, которые берут игрушки и грязные пальцы в рот. Также заболевание может быть вторичным осложнением кариеса. Если патологию не лечить, появляется большой риск развития пародонтита и потери зубов.
Как правило, заболевание появляется при снижении иммунитета. Чаще всего паразит вызывает гингивит у детей дошкольного возраста, которые берут игрушки и грязные пальцы в рот. Также заболевание может быть вторичным осложнением кариеса. Если патологию не лечить, появляется большой риск развития пародонтита и потери зубов.
Гингивит может протекать как в острой, так и в хронической форме. Обострение чаще всего бывает осенью и зимой. Следует знать, что острая стадия протекает на фоне воспаления и отека десен, чаще всего в месте поражения сочится кровь. Во время тяжелой формы заболевания могут образовываться некротические повреждения тканей, а также язвы. Как правило, больной испытывает боль в деснах, появляется плохой запах изо рта, возможно повышение температуры тела.
Глоссит
Это заболевание, спровоцированное в процессе цикла развития ротовой амебы, чаще всего появляется у взрослых. Глосситу характерно изменение структуры языка. Он становится мягким, увеличивается и меняет цвет с розового на бордовый.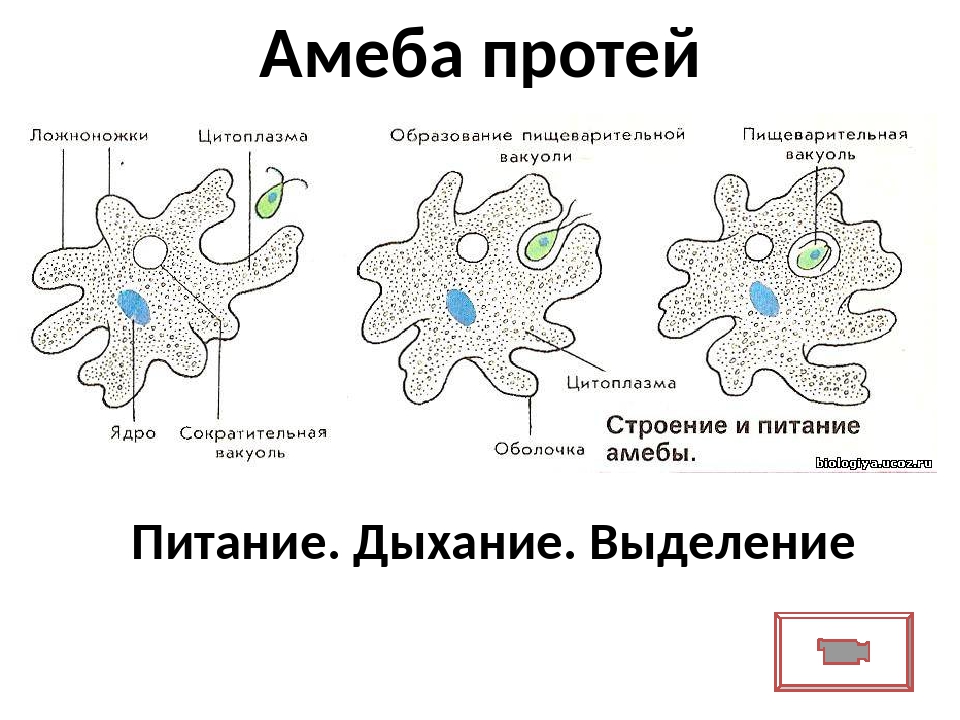 Больные испытывают сильное жжение и болезненные ощущения при проглатывании и пережевывании еды. В некоторых случаях язык распухает настолько, что становится сложно дышать. Основными признаками заболевания считаются;
Больные испытывают сильное жжение и болезненные ощущения при проглатывании и пережевывании еды. В некоторых случаях язык распухает настолько, что становится сложно дышать. Основными признаками заболевания считаются;
- повышенное слюноотделение;
- снижение или потеря вкуса;
- налет на языке;
- плохое самочувствие;
- повышенная утомляемость.
Анализы
Чтобы определить причастность к заболеванию ротовой амебы, проводятся лабораторные анализы. Для этого берут мазок из ротовой полости, а также соскоб с зубов. После чего проводится исследование под микроскопом биологического материала. В случае необходимости может быть дополнительно проведено серологическое исследование.
Лечение
Чтобы избавиться от микроорганизма, необходимо обратиться к врачу. После сдачи всех анализов и подтверждения наличия ротовой амебы, специалист назначает подходящую терапию. Лечение заболевания включает в себя использование препаратов местного действия и специальных ополаскивателей.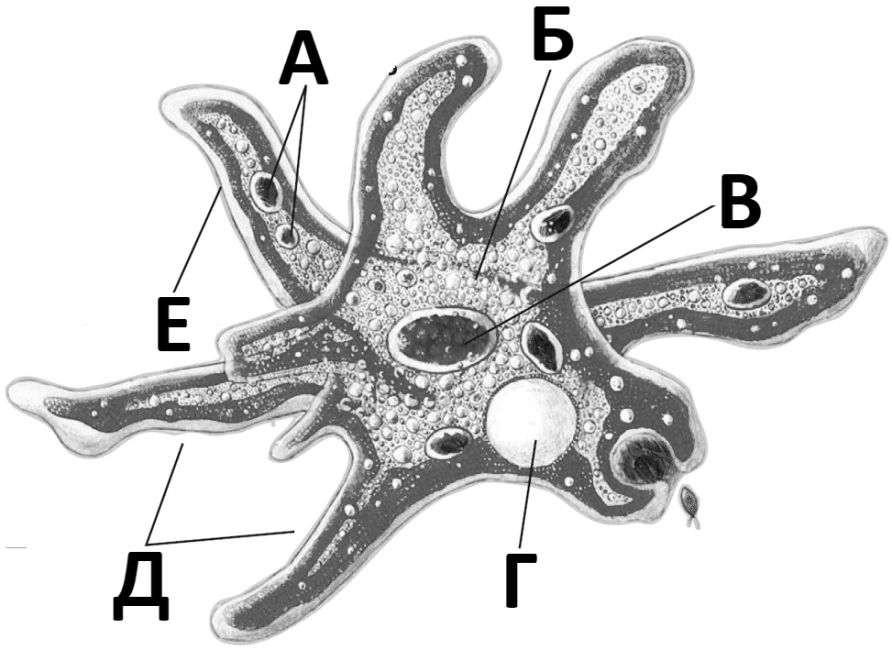 Зачастую применяются народные средства: настои и отвары лекарственных растений.
Зачастую применяются народные средства: настои и отвары лекарственных растений.
Препараты
Длительность лечения зависит от соблюдения личной гигиены во время терапии. При прохождении лечебного курса необходимо постоянно очищать зубы и язык от налета. В этот период не рекомендуется употреблять твердые и горячие блюда. В качестве лекарственных препаратов используют: «Хлоргексидин», раствор марганцовки и «Фурацилин».
Для дезинфекции рта применяют «Ротокан», а для лечения язвочек — «Ируксол». Если больной жалуется на болезненные ощущения, назначаются «Анестезин», «Лидокаин» и подобные препараты. Современная фармакология выпускает множество гелей и спреев, способных эффективно бороться с паразитом.
Необходимо понимать, что самостоятельное лечение заболеваний рта, вызванных ротовой амебой, может привести к негативным последствиям, вплоть до выпадения зубов. Поэтому при возникновении первых признаков следует обратиться к врачу.
Народные средства
Первый рецепт.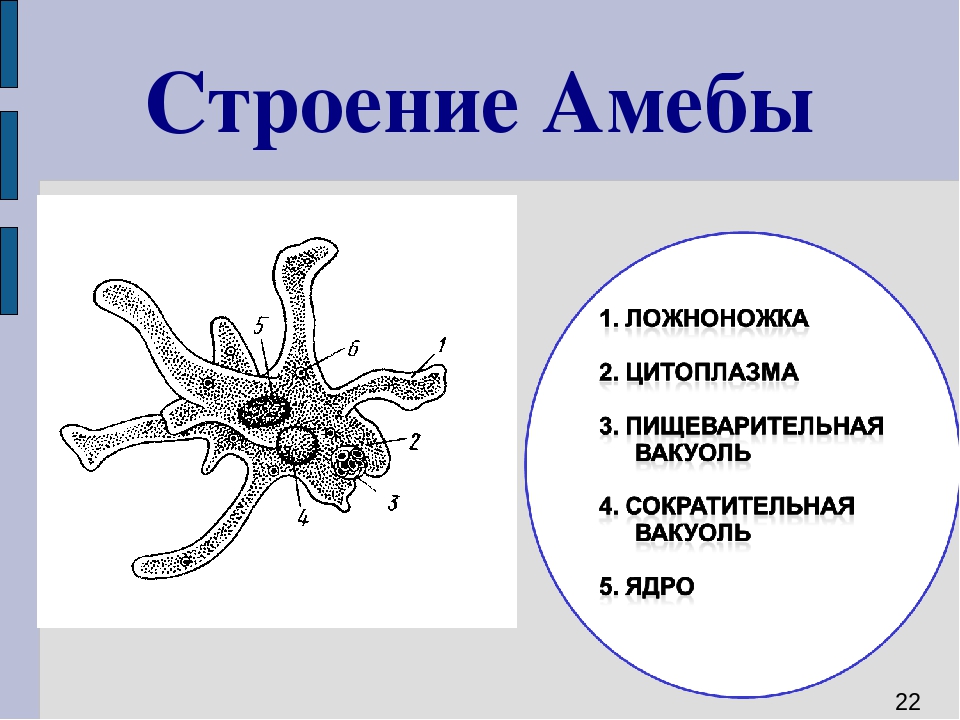 Тридцать граммов ромашки и шалфея смешать с двадцатью граммами чистотела и лавровых листьев, залить смесь кипятком и настоять в течение двух часов. Применять для ополаскивания ротовой полости в утреннее и вечернее время.
Тридцать граммов ромашки и шалфея смешать с двадцатью граммами чистотела и лавровых листьев, залить смесь кипятком и настоять в течение двух часов. Применять для ополаскивания ротовой полости в утреннее и вечернее время.
Второй рецепт. Лечебный отвар, помогающий снять жжение: по тридцать граммов коры дуба, корня аира и листьев крапивы залить половиной литра холодной воды и довести до кипения на малом огне. Кипятить полчаса, затем добавить столовую ложку шалфея и процедить, предварительно настояв 10 минут. Полоскать отваром рот три раза в день.
Третий рецепт. По одной столовой ложке сурепки, листьев эвкалипта и цветков календулы, залить тремя стаканами воды и кипятить двадцать минут. После остудить. Отваром полоскать ротовую полость после еды. Данное средство обладает противовоспалительным эффектом.
Заключение
Десневая амеба вызывает неприятные болезни ротовой полости. При правильно составленной терапии паразит легко поддается лечению. Самолечение не рекомендуется, это может привести к серьезным осложнениям.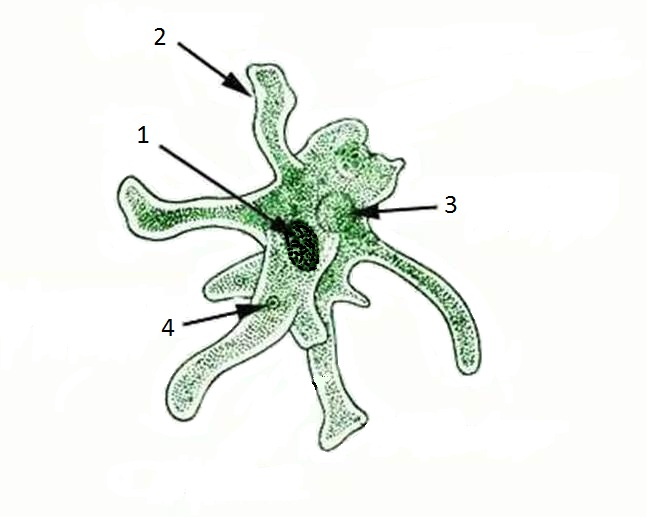
Лучшие научные фотографии года — РИА Новости, 24.08.2017
https://ria.ru/20170823/1500916177.html
Лучшие научные фотографии года
Лучшие научные фотографии года — РИА Новости, 24.08.2017
Лучшие научные фотографии года
Британское королевское фотографическое общество опубликовало список финалистов Международного конкурса научной фотографии этого года. Кадры, объясняющие научные понятия, или отражающие роль науки в повседневной жизни — в фотоленте Ria.ru.
2017-08-23T18:05
2017-08-23T18:05
2017-08-24T12:27
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/1500916177.jpg?15009117551503566832
весь мир
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2017
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
фото, весь мир
18:05 23.08.2017 (обновлено: 12:27 24.08.2017)Британское королевское фотографическое общество опубликовало список финалистов Международного конкурса научной фотографии International Images for Science competition этого года. Кадры, объясняющие научные понятия, или отражающие роль науки в повседневной жизни — в фотоленте Ria.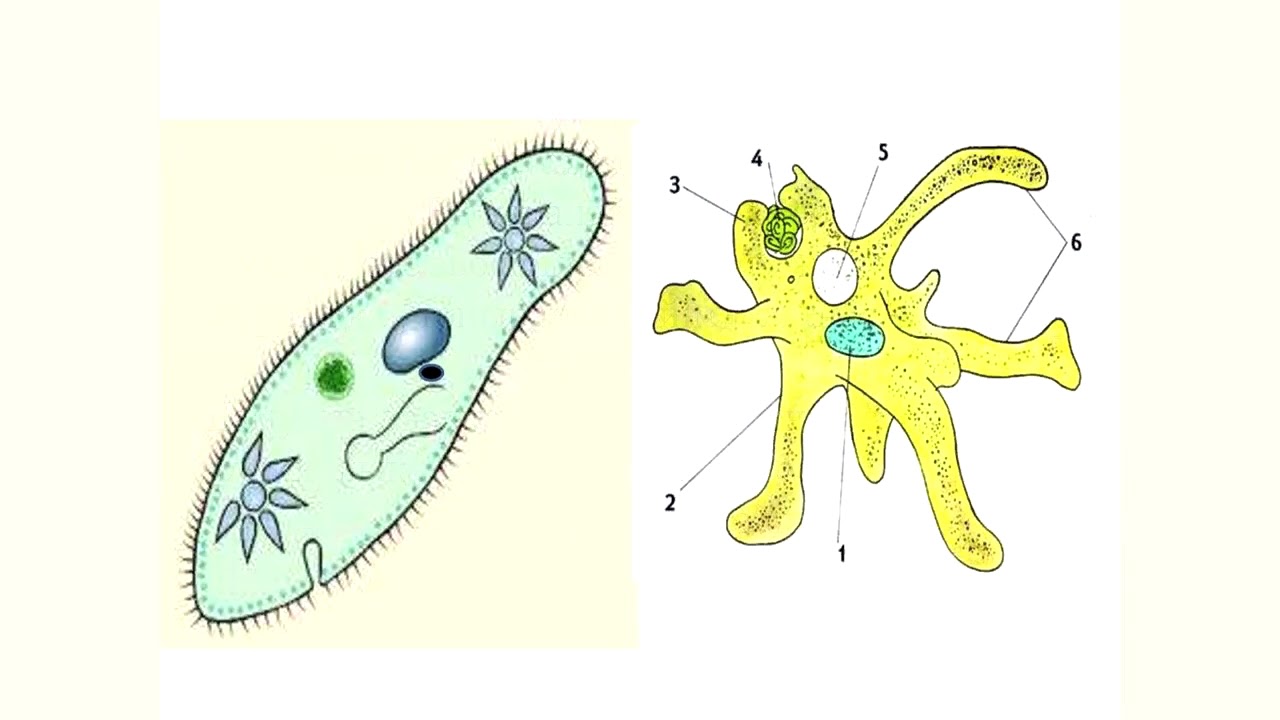 ru.
ru.
© Фото : Houda Chaloun/ IIFS 2017Снимок «Ледяные ворота» фотографа Гуды Чалун. На кадре — айсберг, плывущий в море у берегов Антарктиды. Эта арка сформировалась из-за воздействия ветра и температурных изменений, разрушивших лед.
1 из 18
Снимок «Ледяные ворота» фотографа Гуды Чалун. На кадре — айсберг, плывущий в море у берегов Антарктиды. Эта арка сформировалась из-за воздействия ветра и температурных изменений, разрушивших лед.
© Фото : Andrey Narchuk/ IIFS 2017Снимок «Любовь ангелов» фотографа Андрея Нарчука. Эти маленькие морские слизни обитают в холодных водах северной части Тихого и Атлантического океанов. Морские ангелы являются моллюсками, однако они сбрасывают свои раковины во время роста.
2 из 18
Снимок «Любовь ангелов» фотографа Андрея Нарчука. Эти маленькие морские слизни обитают в холодных водах северной части Тихого и Атлантического океанов. Морские ангелы являются моллюсками, однако они сбрасывают свои раковины во время роста.
© Фото : Enrico Sacchetti/ IIFS 2017Снимок «Радиотелескоп Аресибо» фотографа Энрико Саккетти. На кадре — телескоп, установленный в астрономической обсерватории в Пуэрто-Рико. До 2016 года это был крупнейший радиотелескоп, использующий одну апертуру. Телескоп используется для исследований в области радиоастрономии, физики атмосферы и радиолокационных наблюдений объектов Солнечной системы.
На кадре — телескоп, установленный в астрономической обсерватории в Пуэрто-Рико. До 2016 года это был крупнейший радиотелескоп, использующий одну апертуру. Телескоп используется для исследований в области радиоастрономии, физики атмосферы и радиолокационных наблюдений объектов Солнечной системы.
3 из 18
Снимок «Радиотелескоп Аресибо» фотографа Энрико Саккетти. На кадре — телескоп, установленный в астрономической обсерватории в Пуэрто-Рико. До 2016 года это был крупнейший радиотелескоп, использующий одну апертуру. Телескоп используется для исследований в области радиоастрономии, физики атмосферы и радиолокационных наблюдений объектов Солнечной системы.
© Фото : Oleksandr Rupeta/ IIFS 2017Снимок «Больница Красного Креста в Кабуле» фотографа Александра Рупеты. На фото — лаборант берет у женщины кровь на анализ.
4 из 18
Снимок «Больница Красного Креста в Кабуле» фотографа Александра Рупеты. На фото — лаборант берет у женщины кровь на анализ.
© Фото : Håken Kvarnström/ IIFS 2017Снимок «Женская особь вида симоцефал» фотографа Хокена Кварнстрема.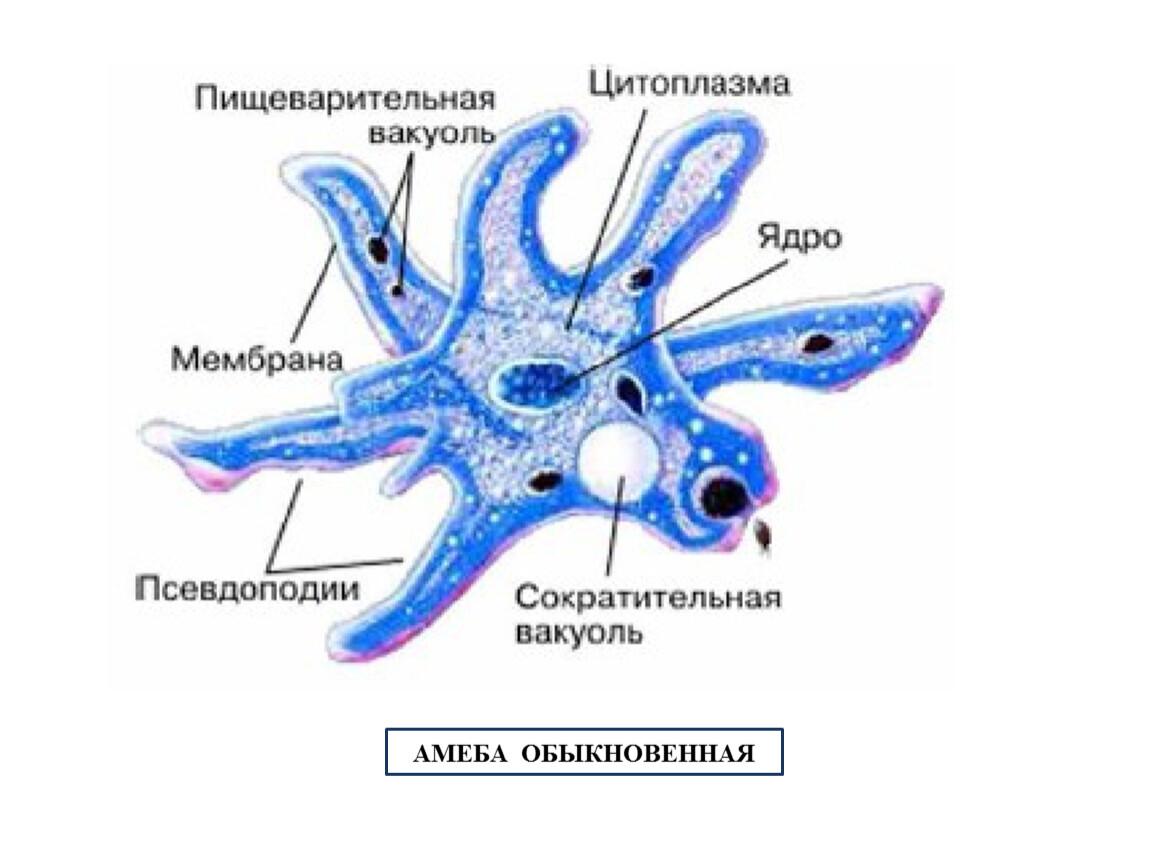 На фото — представительница вида водных блох, которые обычно не превышают в размере 3 мм. Маленькие желтые шарики у нее на спине — икринки.
На фото — представительница вида водных блох, которые обычно не превышают в размере 3 мм. Маленькие желтые шарики у нее на спине — икринки.
5 из 18
Снимок «Женская особь вида симоцефал» фотографа Хокена Кварнстрема. На фото — представительница вида водных блох, которые обычно не превышают в размере 3 мм. Маленькие желтые шарики у нее на спине — икринки.
© Фото : Gabriel Kelemen PhD/ IIFS 2017Снимок «Голубые кольца Лизеганга» доктора философии Габриэля Клемена. На фото — концентрические кольца, возникшие в результате объединения бихромата калия, нитрата серебра и сульфата церия с раствором желатина.
6 из 18
Снимок «Голубые кольца Лизеганга» доктора философии Габриэля Клемена. На фото — концентрические кольца, возникшие в результате объединения бихромата калия, нитрата серебра и сульфата церия с раствором желатина.
© Фото : Richard Beech/ IIFS 2017Снимок «Объектив камеры» фотографа Ричарда Бича. На фото — крупный план зум-объектива Кэнон 24-105 мм f/4 для цифровой зеркальной камеры.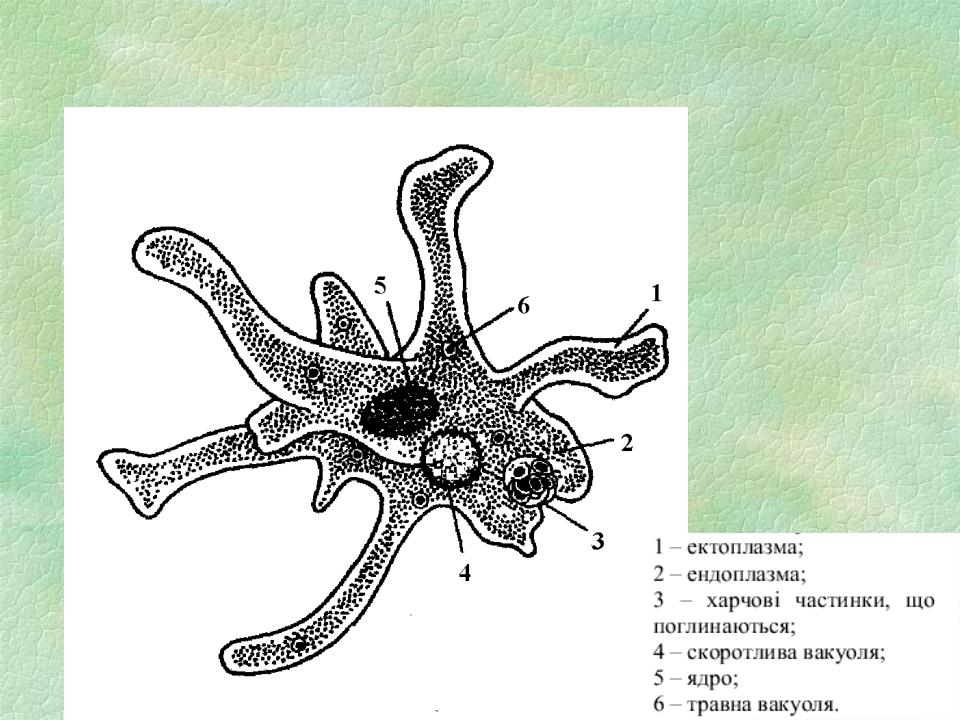 Источник света, установленный за макро-объективом, позволил осветить различные слои и цвета, а остальная структура была получена благодаря дифракции.
Источник света, установленный за макро-объективом, позволил осветить различные слои и цвета, а остальная структура была получена благодаря дифракции.
7 из 18
Снимок «Объектив камеры» фотографа Ричарда Бича. На фото — крупный план зум-объектива Кэнон 24-105 мм f/4 для цифровой зеркальной камеры. Источник света, установленный за макро-объективом, позволил осветить различные слои и цвета, а остальная структура была получена благодаря дифракции.
© Фото : Gerd-A. Günther/ IIFS 2017Снимок «Раковинные амебы» фотографа Герда А. Гюнтера. На фото запечатлены диффлюгии — одноклеточные амебные организмы, строящие свои раковины из песчинок. Снимок покрывает область в 0.9 мм.
8 из 18
Снимок «Раковинные амебы» фотографа Герда А. Гюнтера. На фото запечатлены диффлюгии — одноклеточные амебные организмы, строящие свои раковины из песчинок. Снимок покрывает область в 0.9 мм.
© Фото : Luis Davilla/ IIFS 2017Снимок «Клетка Фарадея» фотографа Луиса Давилла. На фото запечатлен момент использования клетки Фарадея для изоляции телевизионной антенны. Это устройство предназначено для экранирования аппаратуры от внешних электромагнитных полей.
Это устройство предназначено для экранирования аппаратуры от внешних электромагнитных полей.
9 из 18
Снимок «Клетка Фарадея» фотографа Луиса Давилла. На фото запечатлен момент использования клетки Фарадея для изоляции телевизионной антенны. Это устройство предназначено для экранирования аппаратуры от внешних электромагнитных полей.
© Фото : Dr Jeremy Burgess/ IIFS 2017Снимок «Лист водяной лилии» доктора Джереми Берджесса. Это микрофотография среза стебля кувшинки, на которой видны полые трубки, которые обеспечивают подачу растению воздуха. Именно благодаря им обеспечивается плавучесть листьев водяной лилии.
10 из 18
Снимок «Лист водяной лилии» доктора Джереми Берджесса. Это микрофотография среза стебля кувшинки, на которой видны полые трубки, которые обеспечивают подачу растению воздуха. Именно благодаря им обеспечивается плавучесть листьев водяной лилии.
© Фото : James Woodend/ IIFS 2017Снимок «Северное сияние над ледниковой лагуной» Джеймса Вуденда.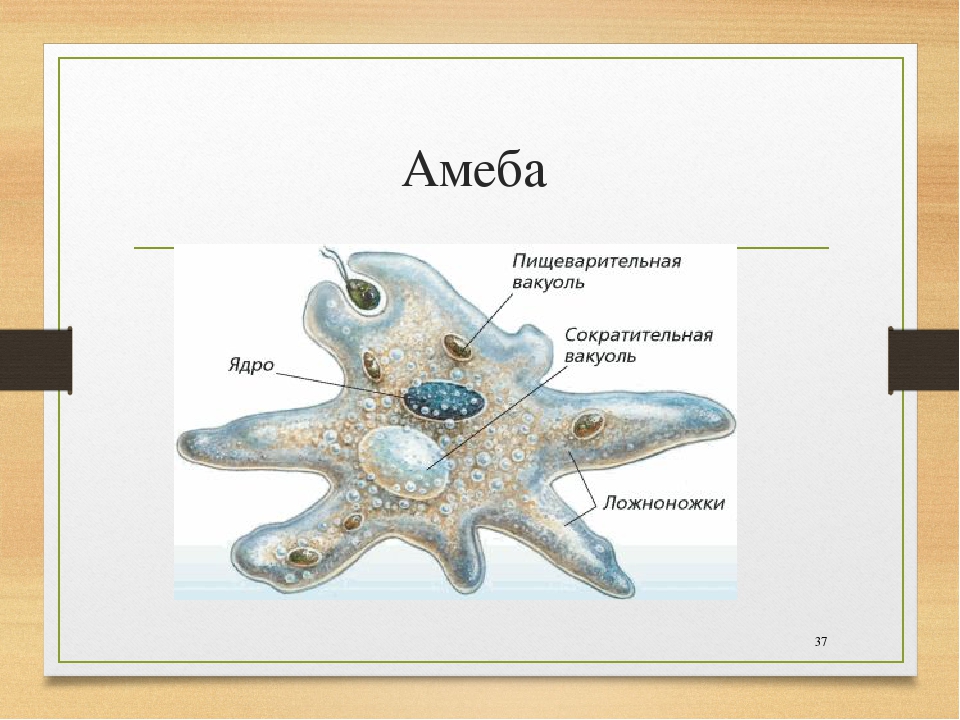 Фото было сделано на озере Йекюльсаурлоун, расположенном на юге огромного ледника Ватнайекюдль в Исландии.
Фото было сделано на озере Йекюльсаурлоун, расположенном на юге огромного ледника Ватнайекюдль в Исландии.
11 из 18
Снимок «Северное сияние над ледниковой лагуной» Джеймса Вуденда. Фото было сделано на озере Йекюльсаурлоун, расположенном на юге огромного ледника Ватнайекюдль в Исландии.
© Фото : Stephen Gschmeissner/ IIFS 2017Снимок «Лапки комара» Стивена Гшмейзнера. На фото — строение нижней части лапки насекомого: коготки, цепляющая подушечка с клейкими щетинками и окружающие чешуйки.
12 из 18
Снимок «Лапки комара» Стивена Гшмейзнера. На фото — строение нижней части лапки насекомого: коготки, цепляющая подушечка с клейкими щетинками и окружающие чешуйки.
© Фото : Phred Petersen/ IIFS 2017Снимок «Рост мухомора» Фреда Петерсена. На фото — три этапа развития красного мухомора, которые гриб проходит за 24-36 часов.
13 из 18
Снимок «Рост мухомора» Фреда Петерсена. На фото — три этапа развития красного мухомора, которые гриб проходит за 24-36 часов.
© Фото : Daniela Rapavá, Observatory Rimavaská Sobota/ IIFS 2017Снимок «Замороженный пузырь» Даниэлы Рапавы из Обсерватории Римавска Собота. На фото: пузырь, стенки которого состоят из слоя воды, зажатого между двумя слоями мыла. Когда вода замерзает, появляются древовидные кристаллы, а затем трещины, которые при расширении уничтожают пузырь.
14 из 18
Снимок «Замороженный пузырь» Даниэлы Рапавы из Обсерватории Римавска Собота. На фото: пузырь, стенки которого состоят из слоя воды, зажатого между двумя слоями мыла. Когда вода замерзает, появляются древовидные кристаллы, а затем трещины, которые при расширении уничтожают пузырь.
© Фото : Plant & Food Research/ IIFS 2017Снимок «Органы осязания», сделанный электронным микроскопом. На фото: простейшие кожные органы чувств, отвечающие за осязание, вкус и обоняние. Волоски позволяют насекомому не только находить пищу, но и обнаруживать феромоны, выделяемые представителем противоположного пола.
15 из 18
Снимок «Органы осязания», сделанный электронным микроскопом. На фото: простейшие кожные органы чувств, отвечающие за осязание, вкус и обоняние. Волоски позволяют насекомому не только находить пищу, но и обнаруживать феромоны, выделяемые представителем противоположного пола.
На фото: простейшие кожные органы чувств, отвечающие за осязание, вкус и обоняние. Волоски позволяют насекомому не только находить пищу, но и обнаруживать феромоны, выделяемые представителем противоположного пола.
© Фото : Gerd-A. Günther/ IIFS 2017Снимок «Чистотел» Герда А. Гюнтера. На фото — зерно чистотела, которое имеет белый отросток на нижней части семенного зерна. Это любимое лакомство муравьев. Размер семени — менее 1,5 мм.
16 из 18
Снимок «Чистотел» Герда А. Гюнтера. На фото — зерно чистотела, которое имеет белый отросток на нижней части семенного зерна. Это любимое лакомство муравьев. Размер семени — менее 1,5 мм.
© Фото : Richard Sharrocks/ IIFS 2017Снимок «Эквилибристика» фотографа Ричарда Шаррокса. На фото запечатлен момент столкновения трех капель в миске с водой. Первая капля дала всплеск, вторая, достигнув вершины пика, сформировала «корону», а третья замерла на вершине «шипа».
17 из 18
Снимок «Эквилибристика» фотографа Ричарда Шаррокса. На фото запечатлен момент столкновения трех капель в миске с водой. Первая капля дала всплеск, вторая, достигнув вершины пика, сформировала «корону», а третья замерла на вершине «шипа».
На фото запечатлен момент столкновения трех капель в миске с водой. Первая капля дала всплеск, вторая, достигнув вершины пика, сформировала «корону», а третья замерла на вершине «шипа».
© Фото : Sergii Dymchenko/ IIFS 2017Снимок «Золотой грибной комарик» фотографа Сергея Димченко. На фото — представитель отряда двукрылых сциарид, покрытый очень тонким слоем золота для того, чтобы создать его визуализацию под электронным микроскопом.
18 из 18
Снимок «Золотой грибной комарик» фотографа Сергея Димченко. На фото — представитель отряда двукрылых сциарид, покрытый очень тонким слоем золота для того, чтобы создать его визуализацию под электронным микроскопом.
Присосковидных структур на патогенной амебе Naegleria fowleri.
Appl Environ Microbiol. 1984 Jan; 47 (1): 12–14.
Эта статья цитируется в других статьях в PMC.Abstract
С помощью сканирующей электронной микроскопии мы наблюдали присоски-подобные структуры на амебах 13 человеческих изолятов Naegleria fowleri. Количество присосок на амебу, по-видимому, варьировалось в зависимости от вирулентности штамма. Мы предлагаем термин амебастом для описания этой уникальной присоской структуры N.fowleri.
Количество присосок на амебу, по-видимому, варьировалось в зависимости от вирулентности штамма. Мы предлагаем термин амебастом для описания этой уникальной присоской структуры N.fowleri.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (937K) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Избранные ссылки .
Изображения в этой статье
Щелкните изображение, чтобы увидеть его в увеличенном виде.
Избранные ссылки
Эти ссылки находятся в PubMed.Это может быть не полный список ссылок из этой статьи.
- Brown T. Наблюдения с помощью иммунофлуоресцентной микроскопии и электронной микроскопии цитопатогенности Naegleria fowleri в культурах эмбриональных клеток мыши. J Med Microbiol. 1979 августа; 12 (3): 363–371. [PubMed] [Google Scholar]
- Chang SL.
 Патогенез патогенной амебы Naegleria. Folia Parasitol (Прага) 1979; 26 (3): 195–200. [PubMed] [Google Scholar]
Патогенез патогенной амебы Naegleria. Folia Parasitol (Прага) 1979; 26 (3): 195–200. [PubMed] [Google Scholar] - Cursons RT, Brown TJ, Keys EA. Вирулентность патогенных свободноживущих амеб.J Parasitol. 1978, август; 64 (4): 744–745. [PubMed] [Google Scholar]
- Де Йонкхере Дж. Различия в вирулентности Naegleria fowleri. Патол Биол (Париж), октябрь 1979 г., 27 (8): 453–458. [PubMed] [Google Scholar]
- Dunnebacke TH, Schuster FL. Природа цитопатогенного материала, присутствующего в амебах рода Naegleria. Am J Trop Med Hyg. 1977 Май; 26 (3): 412–421. [PubMed] [Google Scholar]
- Hysmith RM, Franson RC. Повышенный уровень клеточных и внеклеточных фосфолипаз из патогенной Naegleria fowleri.Biochim Biophys Acta. 1982, 15 апреля; 711 (1): 26–32. [PubMed] [Google Scholar]
- John DT. Первичный амебный менингоэнцефалит и биология Naegleria fowleri. Annu Rev Microbiol. 1982; 36: 101–123. [PubMed] [Google Scholar]
- Lushbaugh WB, Hofbauer AF, Pittman FE, Pittman JC.
 Ультраструктура поверхности Entamoeba histolytica; исследование с помощью просвечивающей электронной микроскопии высокого напряжения (HVTEM) и сканирующей электронной микроскопии (SEM). Arch Invest Med (Мексика) 1978; 9 (Приложение 1): 191–202. [PubMed] [Google Scholar]
Ультраструктура поверхности Entamoeba histolytica; исследование с помощью просвечивающей электронной микроскопии высокого напряжения (HVTEM) и сканирующей электронной микроскопии (SEM). Arch Invest Med (Мексика) 1978; 9 (Приложение 1): 191–202. [PubMed] [Google Scholar] - Марчиано-Кабрал FM, Паттерсон М., Джон Д. Т., Брэдли С. Г..Цитопатогенность Naegleria fowleri и Naegleria gruberi для установленных культур клеток млекопитающих. J Parasitol. 1982 декабрь; 68 (6): 1110–1116. [PubMed] [Google Scholar]
- Page FC. Таксономические критерии для limax amoebae с описанием 3 новых видов Hartmannella и 3 видов Vahlkampfia. J Protozool. Август 1967; 14 (3): 499–521. [PubMed] [Google Scholar]
- Вейк Р.Р., Джон Д.Т. Агитируемое массовое выращивание Naegleria fowleri. J Parasitol. 1977 Октябрь; 63 (5): 868–871. [PubMed] [Google Scholar]
- Вонг М.М., Карр С.Л., младший, Чоу К.К.Изменения вирулентности Naegleria fowleri сохраняются in vitro. J Parasitol. 1977 Октябрь; 63 (5): 872–878.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
Здесь представлены статьи по прикладной микробиологии и микробиологии окружающей среды, любезно предоставленные Американским обществом микробиологов (ASM)
Биолог получил грант на изучение структуры и развития клеток амеб
Фото Фреда Шпигеля, Университет Арканзаса.Amoeba proteus — архетипическая амеба, в честь которой была названа группа Amoebozoa.Он живет в воде и питается другими простейшими и некоторыми бактериями.
FAYETTEVILLE, Ark. — Фред Шпигель — защитник невидимого, поборник недостаточно изученного мира биологии, который существует за пределами животных, растений и патогенных микроорганизмов.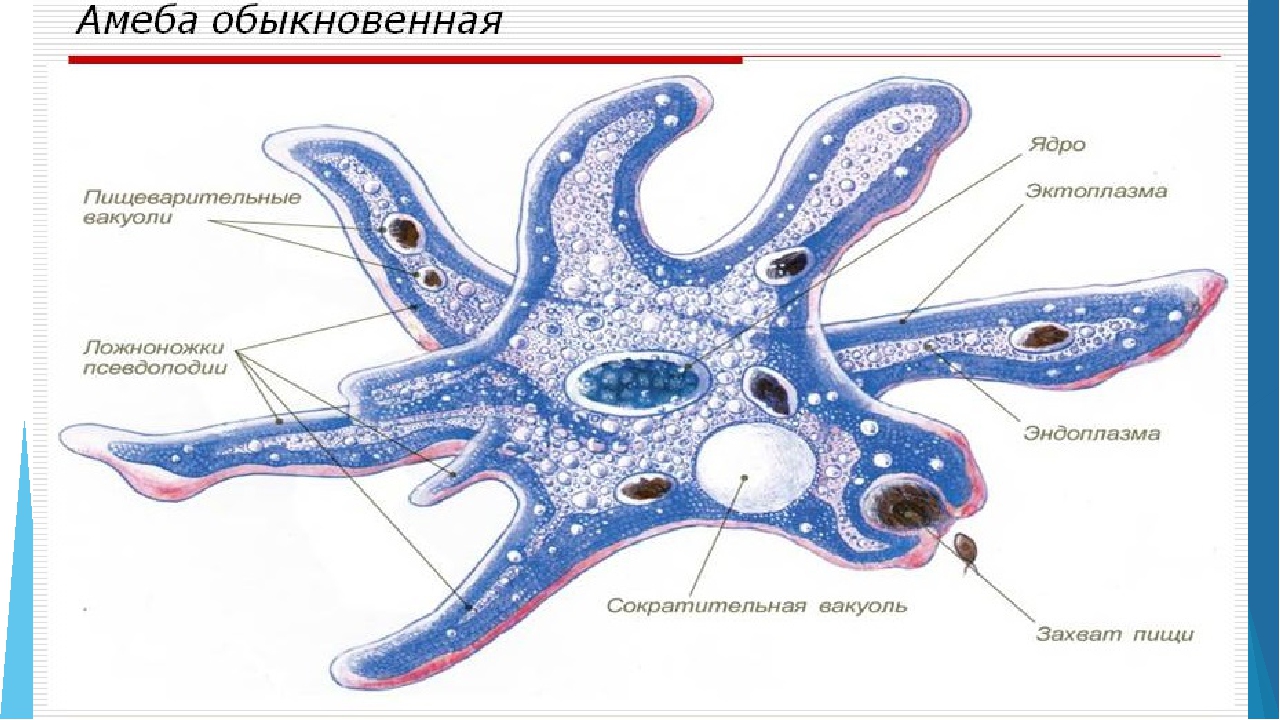
Он изучает амеб.
«Амебы часто считают не более чем гибкими пятнами цитоплазмы», — сказал Шпигель, профессор биологических наук в Университете Арканзаса.«Это одноклеточные организмы, когда они ползают и активно кормятся. Для большинства людей они выглядят как капли. Но они тонкие и демонстрируют широкий спектр структурного разнообразия, если вы знаете, что ищете ».
Государственный университет Миссисипи в рамках проекта, финансируемого Национальным научным фондом, недавно предоставил Spiegel грант в размере 141 335 долларов на изучение клеточных структур и развития определенных видов амеб, представляющих весь диапазон их разнообразия.
Общий проект направлен на лучшее понимание биологии, таксономии и эволюции амебоидных одноклеточных организмов в группе, официально известной как Amoebozoa, основной группе простейших, которые являются объектом исследования.Мэтью Браун, доцент штата Миссисипи и один из бывших студентов Шпигеля в Университете Австралии, является главным исследователем гранта NSF.
Чтобы просмотреть другие изображения амеб, посетите Research Frontiers .
Подробное понимание того, как амебы связаны друг с другом и как каждый вид меняется в течение своего жизненного цикла, предоставит полезную биологическую информацию, сказал Шпигель.
| Фред Шпигель, Арканзасский университет |
«Мы будем извлекать информационную РНК из клеток, чтобы увидеть, какие белки экспрессируются в течение жизненных циклов различных амеб», — сказал Шпигель.«Из этого мы можем получить хорошее представление о геноме организма. Мы пытаемся выяснить характеристики, которые были у последнего общего предка всех амебозоидов. И исходя из этого, имея филогенетическое дерево, мы можем предположить несколько вещей, например, как возникли различные формы амеб, был ли секс в жизненном цикле, а какие из них не имеют секса и почему у них нет.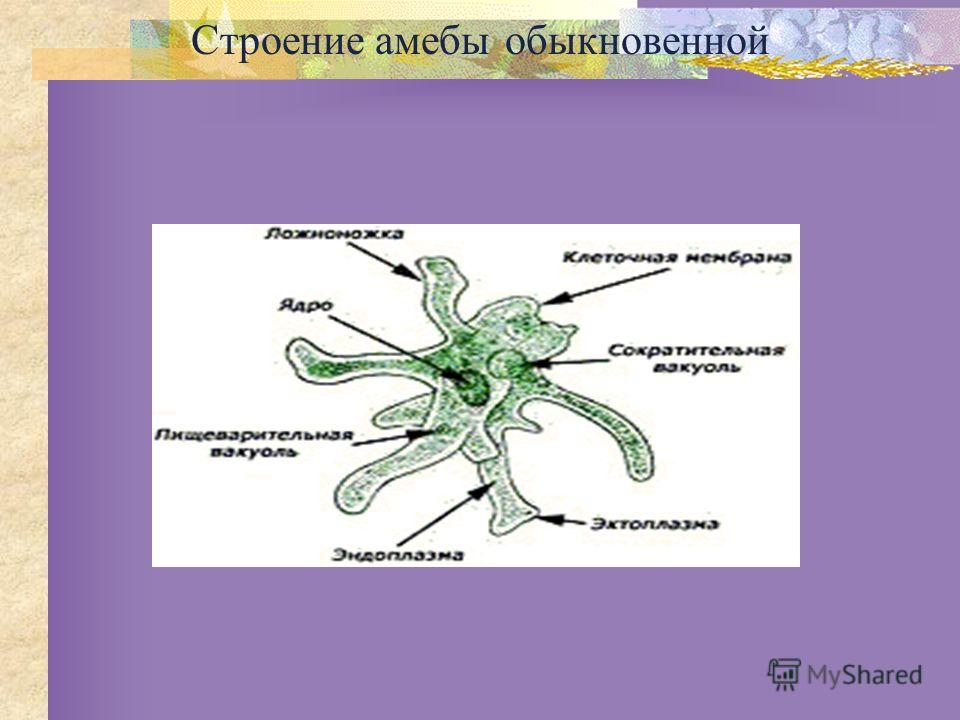 секс. »
секс. »
Секс у амеб включает в себя те же основные генетические механизмы, которые участвуют в таких процессах, как производство спермы и яйцеклеток и оплодотворение у более известных животных и растений, сказал Шпигель.Однако способы, которыми они упаковывают эту генетику в определенные клетки, часто выглядят совершенно иначе, чем то, с чем мы знакомы. Одна из целей этого проекта — выяснить, как разные амебоидные клетки участвуют в половых процессах.
30 июля Американское микологическое общество наградило Spiegel Премией Уильяма Х. Уэстона за выдающиеся достижения в области преподавания. Премия, врученная на ежегодном собрании общества в Эдмонтоне, провинция Альберта, Канада, была основана на номинациях его бывших учеников.
CDC — DPDx — Амебиаз
Лабораторная диагностика
Дифференциальный диагноз среди других амеб
Патогенные Entamoeba виды должны быть дифференцированы от других кишечных простейших, таких как непатогенные амебы ( Entamoeba coli , E.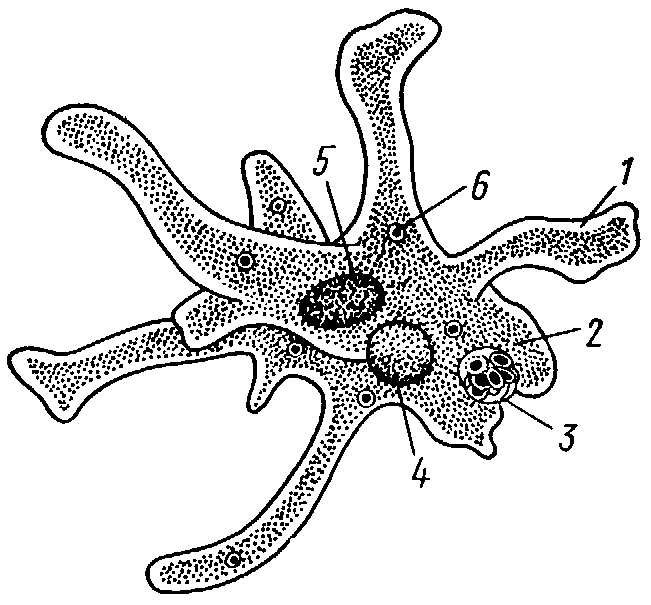 hartmanni , E. gingivalis , Endolimax nana , Iodamoeba74 buetschli ). и жгутиконосец Dientamoeba fragilis .Морфологическая дифференциация между ними возможна, но потенциально осложнена на основании морфологических характеристик цист и трофозоитов.
hartmanni , E. gingivalis , Endolimax nana , Iodamoeba74 buetschli ). и жгутиконосец Dientamoeba fragilis .Морфологическая дифференциация между ними возможна, но потенциально осложнена на основании морфологических характеристик цист и трофозоитов.
В культуре различные характеристики роста E. moshkovskii могут помочь отличить его от других видов, но методы культивирования имеют важные ограничения (отсутствие смешанных инфекций, контаминация, трудоемкость, ограниченная доступность). Исторически сложилось так, что дифференциация от E. dispar и E.histolytica был основан на изоферментных или иммунологических анализах, но они больше не являются предпочтительными из-за доступности эффективных молекулярных методов и выполняются редко. В настоящее время рекомендуются молекулярные методы для выявления патогенных видов Entamoeba .
Микроскопическое обнаружение
Микроскопическая идентификация цист и трофозоитов в кале является распространенным методом диагностики патогенных Entamoeba видов . Это можно сделать с помощью:
Это можно сделать с помощью:
- Свежий стул: влажный стул и постоянно окрашенные препараты (например, трихром).
- Концентраты свежего стула: влажные препараты, с пятнами йода или без них, и постоянно окрашенные препараты (например, трихром). Хотя методы концентрации полезны для кист, они могут быть бесполезны для демонстрации трофозоитов.
- Микроскопия также имеет низкую чувствительность, если анализируется только один образец кала, и требует наличия персонала, обученного морфологической диагностике.Сбор и анализ трех последовательных образцов стула в течение десяти дней увеличивает шансы на обнаружение. Кроме того, E. dispar , E. histolytica, и E. moshkovskii не различимы по морфологии.
Трофозоиты также можно идентифицировать в аспиратах или биоптатах, полученных во время колоноскопии или хирургического вмешательства.
Иммунодиагностика
Наборы для иммуноферментного анализа (EIA) для обнаружения антител Entamoeba histolytica , а также наборы для EIA для обнаружения антигенов коммерчески доступны в Соединенных Штатах.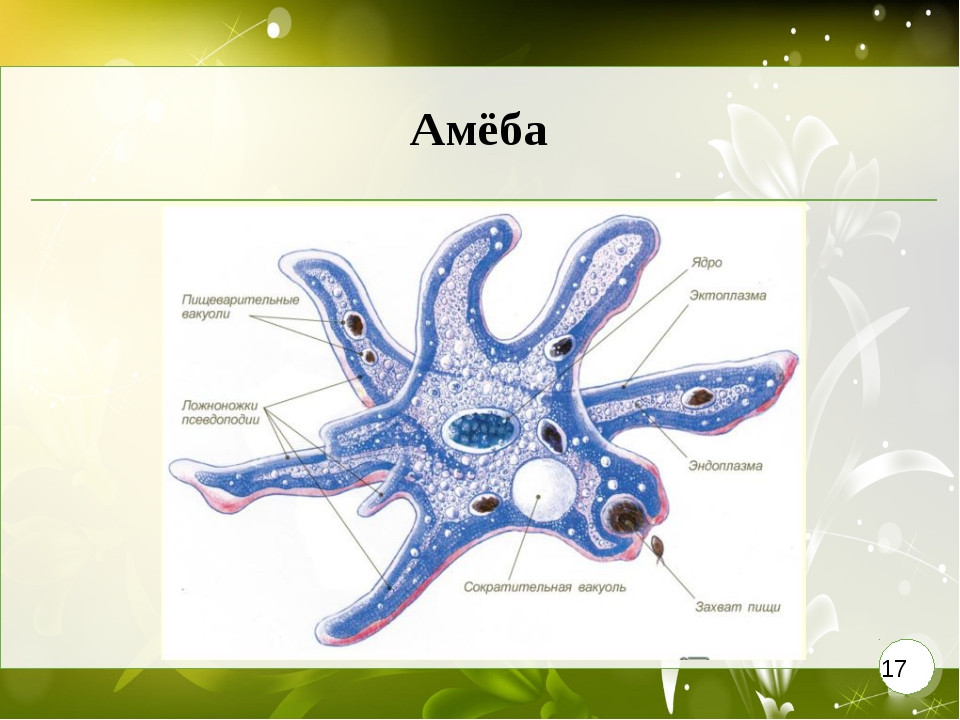 Выявление антител наиболее полезно у пациентов с внекишечным заболеванием (например, амебным абсцессом печени), когда микроорганизмы обычно не обнаруживаются при исследовании кала. Обнаружение антител имеет ограниченную диагностическую ценность для пациентов из высокоэндемичных регионов, которые, вероятно, ранее подверглись заражению и сероконверсии, но может быть более полезным для пациентов из районов, где присутствуют патогенные виды Entamoeba spp. редки. Обнаружение антигена во время активных инфекций может быть полезным в качестве дополнения к микроскопической диагностике при обнаружении паразитов и может различать патогенные и непатогенные инфекции.
Выявление антител наиболее полезно у пациентов с внекишечным заболеванием (например, амебным абсцессом печени), когда микроорганизмы обычно не обнаруживаются при исследовании кала. Обнаружение антител имеет ограниченную диагностическую ценность для пациентов из высокоэндемичных регионов, которые, вероятно, ранее подверглись заражению и сероконверсии, но может быть более полезным для пациентов из районов, где присутствуют патогенные виды Entamoeba spp. редки. Обнаружение антигена во время активных инфекций может быть полезным в качестве дополнения к микроскопической диагностике при обнаружении паразитов и может различать патогенные и непатогенные инфекции.
Тест непрямой гемагглютинации (IHA) был заменен коммерчески доступными тест-наборами EIA для рутинной серодиагностики амебиаза. Антиген состоит из неочищенного растворимого экстракта организмов, выращенных в аксенических культурах. Тест EIA выявляет антитела, специфичные для E. histolytica , примерно у 95% пациентов с внекишечным амебиазом, у 70% пациентов с активной кишечной инфекцией и у 10% бессимптомных лиц, у которых проходят кисты E.Гистолитика . Если антитела не обнаруживаются у пациентов с острым проявлением подозрения на амебный абсцесс печени, второй образец следует взять через 7-10 дней. Если второй образец не показывает сероконверсию, следует рассмотреть возможность применения других агентов. Обнаруживаемые антитела, специфичные для E. histolytica , могут сохраняться в течение многих лет после успешного лечения, поэтому наличие антител не обязательно указывает на острую или текущую инфекцию. Кроме того, пациенты, которые жили в высокоэндемичных районах, вероятно, будут серопозитивными из-за воздействия в прошлом.Специфичность 95% и выше: ложноположительные реакции возникают редко.
histolytica , примерно у 95% пациентов с внекишечным амебиазом, у 70% пациентов с активной кишечной инфекцией и у 10% бессимптомных лиц, у которых проходят кисты E.Гистолитика . Если антитела не обнаруживаются у пациентов с острым проявлением подозрения на амебный абсцесс печени, второй образец следует взять через 7-10 дней. Если второй образец не показывает сероконверсию, следует рассмотреть возможность применения других агентов. Обнаруживаемые антитела, специфичные для E. histolytica , могут сохраняться в течение многих лет после успешного лечения, поэтому наличие антител не обязательно указывает на острую или текущую инфекцию. Кроме того, пациенты, которые жили в высокоэндемичных районах, вероятно, будут серопозитивными из-за воздействия в прошлом.Специфичность 95% и выше: ложноположительные реакции возникают редко.
Хотя сообщалось об обнаружении антител IgM, специфичных для E. histolytica , у пациентов с текущим инвазивным заболеванием чувствительность составляет только около 64%. В США доступно несколько коммерческих наборов EIA для обнаружения антител. Для E. dispar или E. moshkovskii или E. bangladeshi не существует коммерческих наборов для обнаружения антител.
В США доступно несколько коммерческих наборов EIA для обнаружения антител. Для E. dispar или E. moshkovskii или E. bangladeshi не существует коммерческих наборов для обнаружения антител.
Обнаружение антигена может быть полезным в качестве дополнения к микроскопической диагностике при обнаружении паразитов и различении патогенных и непатогенных инфекций.Однако использование замороженных или фиксированных образцов и образцов после обработки ограничено. Недавние исследования указывают на повышенную чувствительность и специфичность анализов фекальных антигенов с использованием моноклональных антител, которые могут различать инфекции E. histolytica и E. dispar . Доступен по крайней мере один коммерческий набор, который обнаруживает только патогенную инфекцию E. histolytica в стуле; Доступно несколько наборов, которые обнаруживают антигены E. histolytica в кале, но не исключают антигены E. dispar инфекций.
dispar инфекций.
Молекулярная диагностика
Обычный ПЦР
В лабораториях референсной диагностики молекулярный анализ с помощью обычных тестов на основе ПЦР является методом выбора для различения между E. histolytica и E. dispar . Некоторые анализы также могут различать E. moshkovskii.
ПЦР в реальном времени
Метод ПЦР в реальном времени TaqMan был одобрен CDC и используется для дифференциальной лабораторной диагностики амебиаза.Анализ направлен на ген 18S рРНК с видоспецифическими зондами TaqMan в дуплексном формате, что позволяет обнаруживать как E. histolyrica , так и E. dispar в одном реакционном сосуде.
Ссылки:
Qvarnstrom Y, James C., Xayavong M, Holloway B, Moura I, Visvesvara GS, et al. Сравнение обоснований ПЦР в реальном времени для дифференциальной лабораторной диагностики амебиаза. J Clin Microbiol 2005; 43: 5491-5497.
Лабораторная безопасность
Кисты в незафиксированных образцах стула потенциально заразны.Соблюдайте стандартные меры предосторожности, применяемые к образцам стула: https://www.cdc.gov/dpdx/diagnosticprocedures/stool/safety.html.
Гигантский вирус против амебы: борьба за господство | Virology Journal
Мимивирус и теория «Чеширского кота»
Мимивирусы были первыми обнаруженными гигантскими вирусами, заражающими амебы, что впоследствии привело к образованию семейства Mimiviridae . Мимивирус Acanthamoeba polyphaga (APMV) (также известный как мимивирус) был первым изолятом и, как таковой, стал прототипом вида Mimivirus [1, 26].В настоящее время обнаружено множество изолятов мимивируса в некоторых из самых разнообразных сред, связанных с амебой из рода Acanthamoeba , основным известным хозяином мимивируса [1, 27, 28, 29]. Стратегия побега «Чеширского кота» — это явление, ранее описанное между одноклеточным эукариотом, Emiliana huxleyi , и вирусом emiliania huxleyi, фикоднавирусом.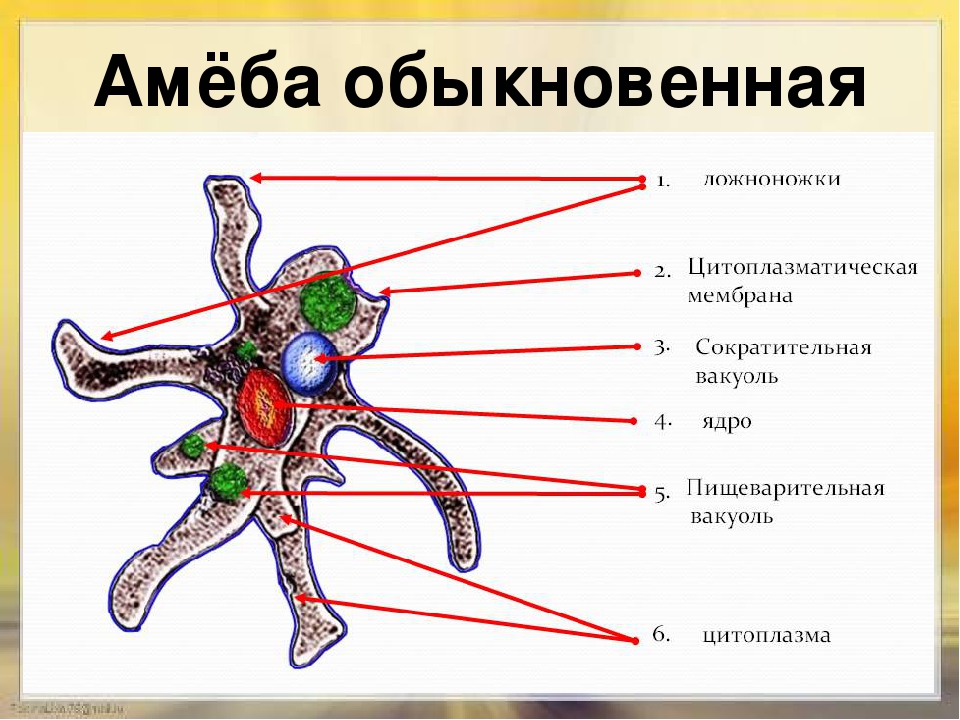 Emiliania huxleyi имеет две стадии в своем жизненном цикле: гаплоидную некальцифицированную фазу и диплоидную кальцифицированную фазу [30].Исследователи продемонстрировали, что только клетки диплоидной фазы могут быть инфицированы вирусом emiliania huxleyi, в отличие от гаплоидной фазы, которая устойчива к инфекции. Более того, воздействие фикоднавируса на диплоидную фазу Emiliania huxleyi вызывает переход соседних клеток в гаплоидную фазу [30]. Acanthamoeba проходит две стадии жизненного цикла (трофозоит и циста), и APMV не может инфицировать цисты. С другой стороны, было показано, что при заражении трофозоитами титр вирусного потомства увеличивается примерно на 2.Через 5 log (500 раз) через 24 часа после инфицирования наблюдается выраженный цитопатический эффект (ЦПЭ) [31, 32]. Процесс инцистирования включает высокий уровень клеточной и молекулярной регуляции, вызванный такими сигналами, как осмотический стресс, голод и температура [33,34,35,36]. Предыдущие исследования показали, что цитоскелет, а также сериновые протеазы и другие факторы играют решающую роль в процессе инцистирования [37,38,39,40].
Emiliania huxleyi имеет две стадии в своем жизненном цикле: гаплоидную некальцифицированную фазу и диплоидную кальцифицированную фазу [30].Исследователи продемонстрировали, что только клетки диплоидной фазы могут быть инфицированы вирусом emiliania huxleyi, в отличие от гаплоидной фазы, которая устойчива к инфекции. Более того, воздействие фикоднавируса на диплоидную фазу Emiliania huxleyi вызывает переход соседних клеток в гаплоидную фазу [30]. Acanthamoeba проходит две стадии жизненного цикла (трофозоит и циста), и APMV не может инфицировать цисты. С другой стороны, было показано, что при заражении трофозоитами титр вирусного потомства увеличивается примерно на 2.Через 5 log (500 раз) через 24 часа после инфицирования наблюдается выраженный цитопатический эффект (ЦПЭ) [31, 32]. Процесс инцистирования включает высокий уровень клеточной и молекулярной регуляции, вызванный такими сигналами, как осмотический стресс, голод и температура [33,34,35,36]. Предыдущие исследования показали, что цитоскелет, а также сериновые протеазы и другие факторы играют решающую роль в процессе инцистирования [37,38,39,40].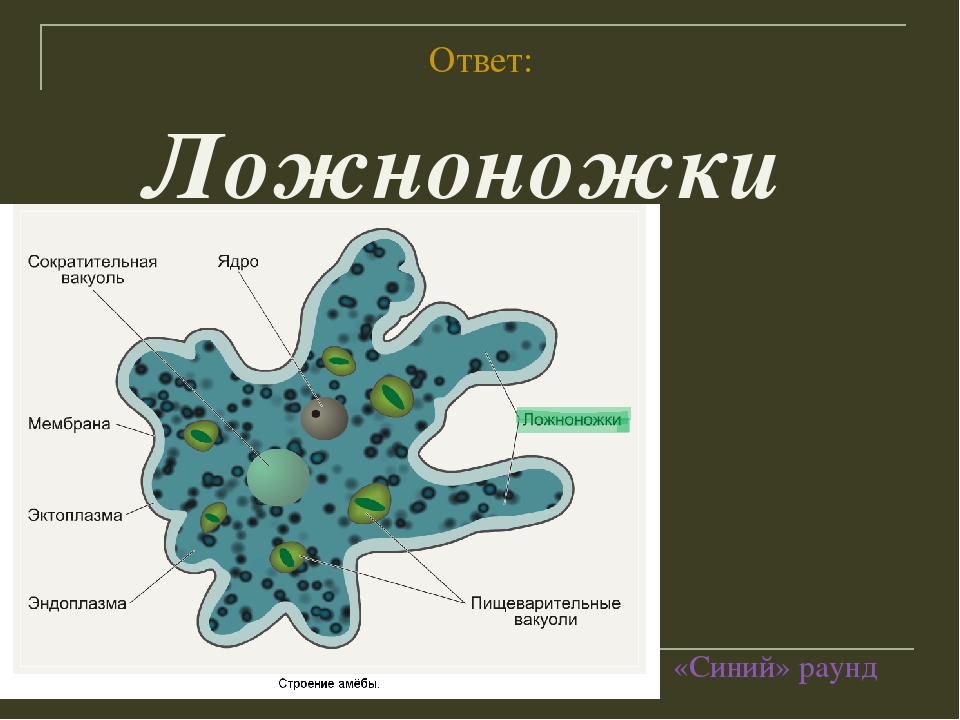 Протеиназа серинового типа, называемая опосредующей инцистирование субтилизин-подобной сериновой протеиназой (EMSP), была связана с процессом инцистирования у Acanthamoeba. Предыдущая работа продемонстрировала, что мимивирусная инфекция снижает уровни как мРНК, так и белка этой сериновой протеиназы в Acanthamoeba castellanii . Кроме того, вирус был способен предотвращать экспрессию EMSP при добавлении инфицированных клеток к физиологическому раствору для инцистенции [31]. Пока не описано, как мимивирус может снижать экспрессию EMSP. Было показано, что ингибирование генов серин-протеиназ отрицательно влияет на энцистмент. Анализ экспрессируемых мимивирусом генов, связанных с данными, полученными в этом исследовании, показал, что ген R700, присутствующий в геноме APMV, который кодирует ингибитор сериновой протеазы, может быть одним из генов, участвующих в подавлении этого процесса [32 ].Другие белки могут действовать в регуляции процесса инцистирования в Acanthamoeba castellanii , инфицированных мимивирусом, и необходимы дальнейшие исследования, чтобы лучше понять роль этих ингибиторов протеаз.
Протеиназа серинового типа, называемая опосредующей инцистирование субтилизин-подобной сериновой протеиназой (EMSP), была связана с процессом инцистирования у Acanthamoeba. Предыдущая работа продемонстрировала, что мимивирусная инфекция снижает уровни как мРНК, так и белка этой сериновой протеиназы в Acanthamoeba castellanii . Кроме того, вирус был способен предотвращать экспрессию EMSP при добавлении инфицированных клеток к физиологическому раствору для инцистенции [31]. Пока не описано, как мимивирус может снижать экспрессию EMSP. Было показано, что ингибирование генов серин-протеиназ отрицательно влияет на энцистмент. Анализ экспрессируемых мимивирусом генов, связанных с данными, полученными в этом исследовании, показал, что ген R700, присутствующий в геноме APMV, который кодирует ингибитор сериновой протеазы, может быть одним из генов, участвующих в подавлении этого процесса [32 ].Другие белки могут действовать в регуляции процесса инцистирования в Acanthamoeba castellanii , инфицированных мимивирусом, и необходимы дальнейшие исследования, чтобы лучше понять роль этих ингибиторов протеаз.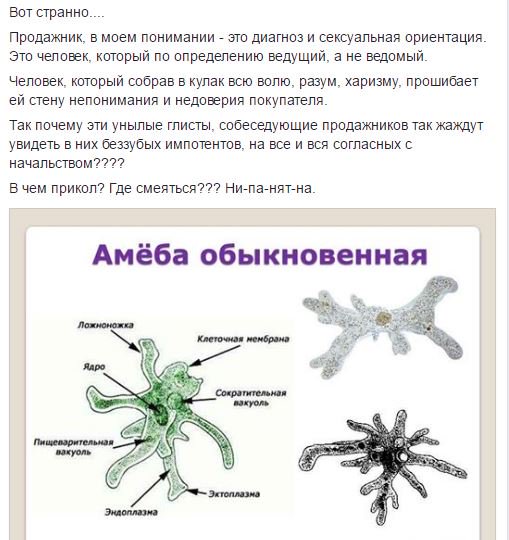 Это исследование показало, что процесс инцистирования может позволить популяциям Acanthamoeba избежать мимивирусных инфекций; однако мимивирус обладает способностью реагировать на эту тактику уклонения, предотвращая процесс инцистирования (рис. 1а). Это исследование было одним из первых, изучавших тип взаимодействия между гигантскими вирусами и их хозяином в отношении модуляции жизненного цикла хозяина.
Это исследование показало, что процесс инцистирования может позволить популяциям Acanthamoeba избежать мимивирусных инфекций; однако мимивирус обладает способностью реагировать на эту тактику уклонения, предотвращая процесс инцистирования (рис. 1а). Это исследование было одним из первых, изучавших тип взаимодействия между гигантскими вирусами и их хозяином в отношении модуляции жизненного цикла хозяина.
Взаимодействие между мимивирусом и марсельлевирусом и их хозяином Acanthamoeba . a Mimivirus способен инфицировать и устанавливать продуктивную репликацию в трофозоитах A. castellanii (1), но он не может инфицировать цисты (2). Когда A. castellanii инфицирован мимивирусом, экспрессия гена сериновой протеиназы блокируется (3), инцистирование затрудняется (4), и происходит инфицирование. b Везикулы, содержащие частицы марсельлевируса, вызывают фагоцитоз A.castellanii (1), поскольку они удовлетворяют требованиям к размеру> 500 нм. Происходит продуктивная инфекция, и частицы могут высвобождаться в виде отдельных частиц или везикул (2). Везикулы способствуют инфекционности и повышают устойчивость к окружающей среде по сравнению с отдельными частицами (3). Вирусная фабрика: VF
Происходит продуктивная инфекция, и частицы могут высвобождаться в виде отдельных частиц или везикул (2). Везикулы способствуют инфекционности и повышают устойчивость к окружающей среде по сравнению с отдельными частицами (3). Вирусная фабрика: VF
Рассмотрение вышеупомянутого исследования привело к тому, что Сильва и его сотрудники в 2016 году предположили, что теорию «Чеширского кота» можно расширить для описания отношений между мимивирусом и его хозяевами [30, 32].Можно провести параллели между данными, относящимися к инфицированию Acanthamoeba мимивирусом и заражению Emiliana huxleyi вирусом emiliana huxleyi. Во-первых, оба хозяина проходят две стадии жизни. Подобно Emiliana huxleyi , который может быть инфицирован только во время диплоидной фазы своего жизненного цикла, мимивирус способен инфицировать только трофозоитную стадию жизненного цикла Acanthamoeba , в то время как цисты устойчивы к инфекции (рис. 1а). Более того, было показано, что во время инфицирования APMV небольшой процент клеток акантамебы способен энцистировать [30,31,32]. Что касается амебной коммуникации и связанных с ней факторов, в литературе есть пробелы. В результате остается множество исследовательских возможностей для изучения взаимодействий гигантского вируса с хозяином.
Что касается амебной коммуникации и связанных с ней факторов, в литературе есть пробелы. В результате остается множество исследовательских возможностей для изучения взаимодействий гигантского вируса с хозяином.
Вирусная мания величия: марсельвирусы и их гигантские инфекционные везикулы
Марсельвирусы были второй обнаруженной группой амебных гигантских вирусов. Первый марсельлевирус был выделен из клеток Acanthamoeba castellanii , инокулированных образцом воды, взятым из градирни в Париже, Франция [2].Этот вирус был назван marseillevirus marseillevirus (MsV), и с тех пор были описаны многие другие марсельлевирусоподобные вирусы. Они были изолированы во Франции, а также в других странах, включая Тунис, Сенегал, Австралию, Японию, Малайзию, Индию и Бразилию [2, 41, 42, 43, 44, 45, 46, 47, 48]. Исследователи продемонстрировали, что геном MsV составляет примерно 400 т.п.н. и состоит из множества генов, очевидно полученных от хозяев и их паразитов или симбионтов. На основании этих и других открытий было высказано предположение, что амебы подобны «плавильным котлам», где могут возникать гигантские вирусы, содержащие сложные репертуары генов различного происхождения [2]. Фагоцитоз — это процесс, с помощью которого большинство гигантских вирусов могут инициировать свои циклы репликации у амеб [1, 2, 4, 6, 7, 25, 49]. Однако для запуска процесса фагоцитоза частицы должны иметь размер> 500 нм, чтобы их можно было распознать [50]. MsV имеет икосаэдрическую частицу диаметром около 250 нм, окруженную поверхностными волокнами длиной 12 нм [2]. Любопытно, что хотя MsV не достигает необходимого размера для фагоцитоза, этот вирус все еще способен успешно реплицироваться в Acanthamoeba , что позволяет предположить, что может существовать другой механизм взаимодействия между MsV и его хозяином, функционирующий для запуска вирусного цикла.
Фагоцитоз — это процесс, с помощью которого большинство гигантских вирусов могут инициировать свои циклы репликации у амеб [1, 2, 4, 6, 7, 25, 49]. Однако для запуска процесса фагоцитоза частицы должны иметь размер> 500 нм, чтобы их можно было распознать [50]. MsV имеет икосаэдрическую частицу диаметром около 250 нм, окруженную поверхностными волокнами длиной 12 нм [2]. Любопытно, что хотя MsV не достигает необходимого размера для фагоцитоза, этот вирус все еще способен успешно реплицироваться в Acanthamoeba , что позволяет предположить, что может существовать другой механизм взаимодействия между MsV и его хозяином, функционирующий для запуска вирусного цикла.
В поисках ответов о взаимодействиях марсельлевируса и хозяина в 2016 году Арантес и его сотрудники провели подробное исследование цикла репликации MsV и неожиданно обнаружили, что марсельлевирус способен производить и выделять гигантские везикулы, которые могут содержать> 1000 вирусных частиц. Везикулы различались по размеру (от 300 до 1000 нм) и количеству мембран. Иммунофлуоресценция и иммуноблоттинг, нацеленные на эндоплазматический ретикулум (ER), комплекс Гольджи и эндосомы, показали, что мембраны везикул происходят из ER, в то время как внутренняя мембрана MsV, по-видимому, происходит из амебной эндосомы [51, 52].
Иммунофлуоресценция и иммуноблоттинг, нацеленные на эндоплазматический ретикулум (ER), комплекс Гольджи и эндосомы, показали, что мембраны везикул происходят из ER, в то время как внутренняя мембрана MsV, по-видимому, происходит из амебной эндосомы [51, 52].
Остались вопросы относительно того, допускают ли гигантские пузырьки фагоцитоз. Это побудило к исследованиям, демонстрирующим, что такие гигантские пузырьки MsV способны запускать процесс фагоцитоза в результате своего большого размера, что делает возможным распознавание (Fig. 1b). Этот новый механизм проникновения вируса подчеркивает замечательную адаптацию марсельлевируса к образу жизни амебы, поскольку фагоцитоз является одним из основных физиологических процессов, связанных с питанием амебы. Примечательно, что помимо входа, опосредованного фагоцитозом, индуцированным гигантскими везикулами, проникновение MsV может также происходить за счет фагоцитоза агрегированных частиц и зависимого от закисления эндоцитоза отдельных частиц [51].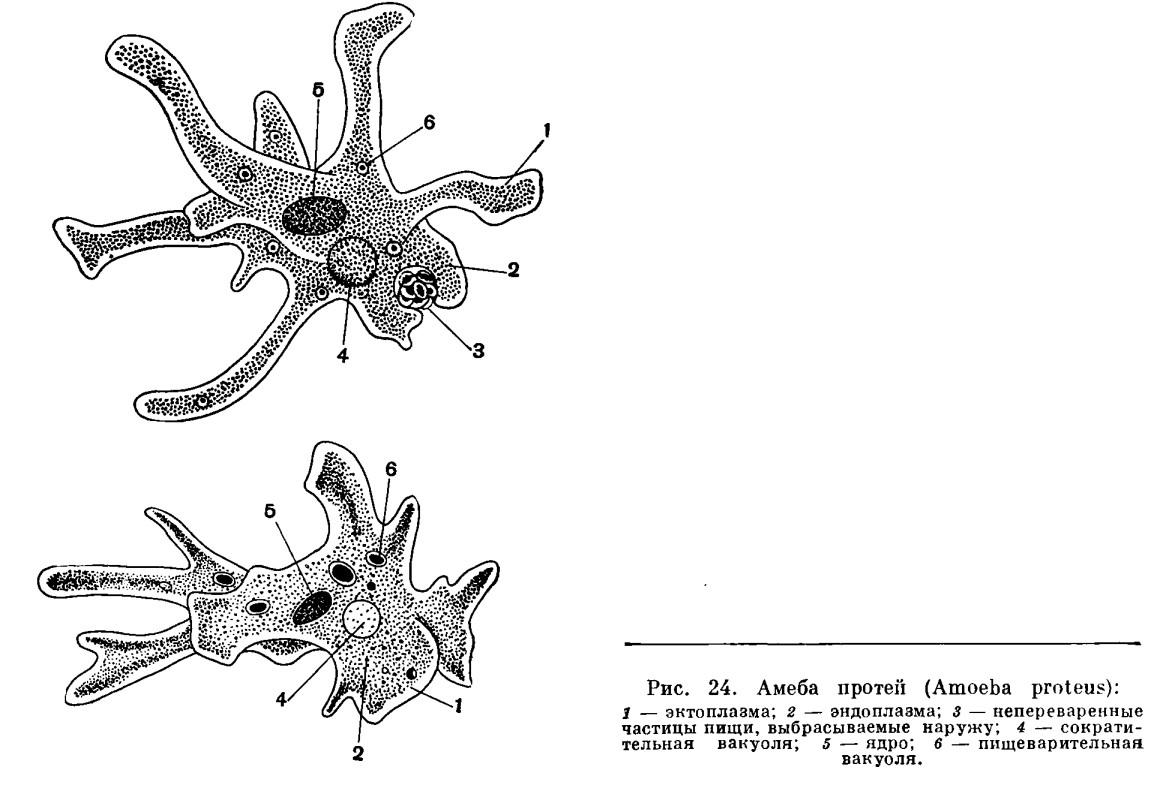 Эта работа показала, что эти гигантские инфекционные пузырьки являются одними из основных способов, с помощью которых MsV успешно инициирует свой цикл репликации, выявляя взаимодействие хозяин-вирус, которое ранее не было описано для ДНК-вирусов.
Эта работа показала, что эти гигантские инфекционные пузырьки являются одними из основных способов, с помощью которых MsV успешно инициирует свой цикл репликации, выявляя взаимодействие хозяин-вирус, которое ранее не было описано для ДНК-вирусов.
В дополнение к тому факту, что многие подходы продемонстрировали роль везикул в биологии MsV и поддержании этих вирусов в природе, было также показано, что гигантские везикулы могут содержать одну или несколько мембран. Следовательно, было предсказано, что количество мембран внутри везикул может влиять на проникновение MsV в амебу-хозяин.Было высказано предположение, что везикулы, содержащие только одну мембрану, сливаются с мембраной фагосомы и высвобождают свои частицы внутри цитоплазмы амебы, тогда как внешняя мембрана сливается с фагосомой, а внутренний пузырь высвобождается в тех случаях, когда везикулы содержат несколько мембран [51]. Исследователям потребуются дальнейшие исследования, чтобы полностью выяснить процесс удаления покрытия, применяемый частицами марсельлевируса.
Поскольку было высказано предположение, что частицы MsV могут высвобождаться из амебы-хозяина внутри везикул, была проверена гипотеза о том, что везикулы могут создавать адаптивное преимущество для MsV.Было продемонстрировано, что распространение некоторых РНК-вирусов везикулами является актом, используемым для ухода от иммунной системы хозяина, обеспечивая адаптивное преимущество [53, 54]. Хотя наличие адаптивной иммунной системы у амебы-хозяина MsV не было доказано, мы не можем исключить возможность того, что вирус способен использовать везикулы аналогичным образом, тем более что марсельлевирус уже был связан с людьми, у которых есть сложная иммунная система. Однако по этой теме необходимо провести дополнительные исследования [55,56,57].Учитывая, что MsV часто выделяют из образцов окружающей среды, было высказано предположение, что везикулы могут иметь значение для поддержания этого вируса в окружающей среде. Это происходит потому, что везикулы инициируют цикл репликации вируса быстрее, чем отдельные частицы. Кроме того, когда гигантские везикулы и изолированные частицы MsV подвергались экстремальному нагреву (70 ° C), было замечено, что везикулы придали вирусу более длительную термостойкость, чем та, которая существует для одиночных вирусных частиц.Таким образом, гигантские везикулы могут придавать устойчивость MsV к факторам окружающей среды в дополнение к повышению эффективности инфекции, облегчая распространение вируса на другие восприимчивые клетки и обеспечивая фагоцитоз вируса (рис. 1b). Наконец, появилась возможность того, что инфекция через везикулы эволюционировала как мощный механизм, способствующий репликативному успеху этого вируса в его естественных хозяевах и / или его выживанию в окружающей среде.
Кроме того, когда гигантские везикулы и изолированные частицы MsV подвергались экстремальному нагреву (70 ° C), было замечено, что везикулы придали вирусу более длительную термостойкость, чем та, которая существует для одиночных вирусных частиц.Таким образом, гигантские везикулы могут придавать устойчивость MsV к факторам окружающей среды в дополнение к повышению эффективности инфекции, облегчая распространение вируса на другие восприимчивые клетки и обеспечивая фагоцитоз вируса (рис. 1b). Наконец, появилась возможность того, что инфекция через везикулы эволюционировала как мощный механизм, способствующий репликативному успеху этого вируса в его естественных хозяевах и / или его выживанию в окружающей среде.
Тупанвирус: неожиданная структурная и геномная сложность
Среди множества новых гигантских вирусов, обнаруженных в последние годы, тупанвирус привлек наше внимание не только из-за его геномных и структурных характеристик, которые отличают его от всех других описанных вирусов, но также из-за его способности устанавливать взаимодействия, которые никогда не наблюдались среди гигантских вирусов. Тупанвирусы были изолированы в Бразилии в районе содового озера Пантанал и в глубоких океанических отложениях, собранных на глубине 3000 м в районе Кампус-дус-Гойтаказес. Размеры частиц тупанвируса варьируются от 1,2 мкм до 2,5 мкм, и они состоят из капсида размером ~ 450 нм, покрытого фибриллами с вершиной, измененной в форме морской звезды [14]. Среди его наиболее примечательных морфологических особенностей — наличие длинного хвоста, прикрепленного к капсиду, размером ~ 550 нм [14]. Тупанвирусы имеют один из самых крупных геномов среди представителей мимивирусов, который состоит из линейной двухцепочечной ДНК размером ~ 1,5 млн п.н., кодирующей более 1250 генов.Наиболее неожиданными оказались гены в геноме тупанвируса, связанные с аппаратом трансляции, включая 20 аминоацил тРНК синтетаз и 70 тРНК, в дополнение к другим факторам, связанным с трансляцией и созреванием тРНК / мРНК и модификацией рибосомных белков [14]. . Как будто всех новинок, связанных с открытием тупанвируса, было недостаточно, было показано, что, в отличие от других гигантских вирусов, тупанвирус способен заражать широкий круг хозяев.
Тупанвирусы были изолированы в Бразилии в районе содового озера Пантанал и в глубоких океанических отложениях, собранных на глубине 3000 м в районе Кампус-дус-Гойтаказес. Размеры частиц тупанвируса варьируются от 1,2 мкм до 2,5 мкм, и они состоят из капсида размером ~ 450 нм, покрытого фибриллами с вершиной, измененной в форме морской звезды [14]. Среди его наиболее примечательных морфологических особенностей — наличие длинного хвоста, прикрепленного к капсиду, размером ~ 550 нм [14]. Тупанвирусы имеют один из самых крупных геномов среди представителей мимивирусов, который состоит из линейной двухцепочечной ДНК размером ~ 1,5 млн п.н., кодирующей более 1250 генов.Наиболее неожиданными оказались гены в геноме тупанвируса, связанные с аппаратом трансляции, включая 20 аминоацил тРНК синтетаз и 70 тРНК, в дополнение к другим факторам, связанным с трансляцией и созреванием тРНК / мРНК и модификацией рибосомных белков [14]. . Как будто всех новинок, связанных с открытием тупанвируса, было недостаточно, было показано, что, в отличие от других гигантских вирусов, тупанвирус способен заражать широкий круг хозяев. Кроме того, исследование взаимодействия между тупанвирусом и хозяином показало, что тупанвирус способен запускать рибосомное отключение хозяина [14].Недавнее исследование описало взаимодействие вирус-хозяин, при котором инфицированные тупанвирусом амебы были вынуждены объединяться с неинфицированными клетками, образуя группы, которые, по-видимому, были важны для приспособленности тупанвируса [58]. В следующих двух разделах мы рассмотрим эти взаимодействия, описанные для тупанвируса.
Кроме того, исследование взаимодействия между тупанвирусом и хозяином показало, что тупанвирус способен запускать рибосомное отключение хозяина [14].Недавнее исследование описало взаимодействие вирус-хозяин, при котором инфицированные тупанвирусом амебы были вынуждены объединяться с неинфицированными клетками, образуя группы, которые, по-видимому, были важны для приспособленности тупанвируса [58]. В следующих двух разделах мы рассмотрим эти взаимодействия, описанные для тупанвируса.
Широкий диапазон хозяев тупанвируса и выключение рибосомы хозяина
Отличительной особенностью тупанвирусов по сравнению с другими гигантскими вирусами является их широкий диапазон хозяев.В то время как большинство гигантских вирусов, таких как цедратвирус, марсельлевирусы, молливирус, пандоровирусы, мимивирус, фаустовирус и каумоебавирус, способны реплицироваться только в одном известном роде амеб, тупанвирусы способны инфицировать широкий круг хозяев, например A Castellanii, A. polyphaga, A.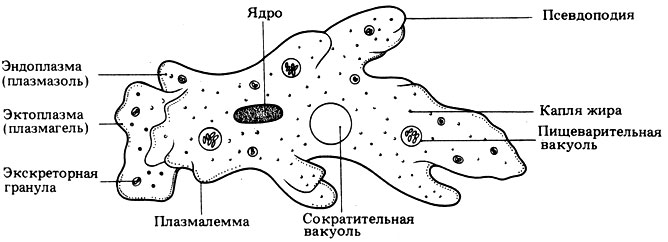 sp E4, A. griffini, V. vermiformis, Dyctiostelium discoideum и Willartia magna (рис. 2) [4,5,6, 8, 10, 11, 14]. Тупанвирусы проявляют CPE и репликацию генома, но в A.michelline и A. royreba . Кроме того, хотя тупанвирусы не способны реплицироваться в Tetrahymena hyperangularis, вирус успешно фагоцитируется, и содержимое, состоящее из компонентов хвоста и капсида, высвобождается в цитоплазму простейших. Это высвобождение запускает цитотоксический профиль, характеризующийся потерей подвижности, увеличением вакуолизации, большим количеством внеклеточных пузырьков, снижением скорости фагоцитоза и неожиданным отключением рибосом (рис.2в). Отсутствие рибосомных субъединиц при электрофорезном анализе предполагало наличие рибосомной деградации. Это отсутствие также наблюдалось у A. castellanii в экспериментах, в которых использовалась высокая множественность инфекции (MOI) (рис. 2c). Первым предполагаемым объяснением отсутствия рибосомных субъединиц был процесс рибофагии, процесс аутофагии, ответственный за деградацию рибосом в длительные периоды дефицита питательных веществ [59].
sp E4, A. griffini, V. vermiformis, Dyctiostelium discoideum и Willartia magna (рис. 2) [4,5,6, 8, 10, 11, 14]. Тупанвирусы проявляют CPE и репликацию генома, но в A.michelline и A. royreba . Кроме того, хотя тупанвирусы не способны реплицироваться в Tetrahymena hyperangularis, вирус успешно фагоцитируется, и содержимое, состоящее из компонентов хвоста и капсида, высвобождается в цитоплазму простейших. Это высвобождение запускает цитотоксический профиль, характеризующийся потерей подвижности, увеличением вакуолизации, большим количеством внеклеточных пузырьков, снижением скорости фагоцитоза и неожиданным отключением рибосом (рис.2в). Отсутствие рибосомных субъединиц при электрофорезном анализе предполагало наличие рибосомной деградации. Это отсутствие также наблюдалось у A. castellanii в экспериментах, в которых использовалась высокая множественность инфекции (MOI) (рис. 2c). Первым предполагаемым объяснением отсутствия рибосомных субъединиц был процесс рибофагии, процесс аутофагии, ответственный за деградацию рибосом в длительные периоды дефицита питательных веществ [59]. Анализ типичных маркеров рибофагии, таких как образование двойной мембраны, закисление аутофагосом и исследование генов, связанных с рибофагией, предположил, что процесс рибофагии не может быть объяснением отключения РНК, вызванного тупанвирусной инфекцией [14, 59].Тем не менее, отключение рибосом происходит в результате тупанвирусной инфекции, феномен, который остается необъяснимым. Исследования предоставили некоторые подсказки в поисках правдоподобного объяснения. Например, может присутствовать неизвестный фактор, такой как вирусный белок, переносимый частицей тупанвируса. Поскольку отключение рибосом не зависит от репликации тупанвируса, оно происходит в присутствии инактивированных ультрафиолетовым светом частиц, но не инактивированных под действием тепла частиц. Кроме того, было продемонстрировано, что тупанвирус индуцирует деградацию ядра хозяина, обеспечивая другой возможный механизм достижения этого ответа, поскольку ядрышко участвует в биогенезе рибосом [14, 60].
Анализ типичных маркеров рибофагии, таких как образование двойной мембраны, закисление аутофагосом и исследование генов, связанных с рибофагией, предположил, что процесс рибофагии не может быть объяснением отключения РНК, вызванного тупанвирусной инфекцией [14, 59].Тем не менее, отключение рибосом происходит в результате тупанвирусной инфекции, феномен, который остается необъяснимым. Исследования предоставили некоторые подсказки в поисках правдоподобного объяснения. Например, может присутствовать неизвестный фактор, такой как вирусный белок, переносимый частицей тупанвируса. Поскольку отключение рибосом не зависит от репликации тупанвируса, оно происходит в присутствии инактивированных ультрафиолетовым светом частиц, но не инактивированных под действием тепла частиц. Кроме того, было продемонстрировано, что тупанвирус индуцирует деградацию ядра хозяина, обеспечивая другой возможный механизм достижения этого ответа, поскольку ядрышко участвует в биогенезе рибосом [14, 60].
 2
2 Взаимодействия хозяин – тупанвирус . Инфекция A. castellanii тупанвирусом вызывает образование пучков (1). a Механические возмущения могут нарушить (2) сгустки, которые могут преобразоваться через несколько минут после механического разделения (3). b Незараженные A. castellanii , взаимодействующие с пучками (4) и переносимые ими (5). c Тупанвирус, вызывающий отключение рибосом у Tetrahymena hyperangularis и A.castellanii при высокой множественности инфекции (MOI) (6). Другие амебы, у которых тупанвирус может устанавливать взаимодействия, включают A. castellanii , A. polyphaga , A. sp E4 , A. griffini , V. vermiformis , Dyctiostelium discoideum , Представлены , A. michelline и A. royreba , что свидетельствует о широком диапазоне их хозяев. Вирусная фабрика: VF
Тупанвирус и его гигантские скопления: амеб, инфицированных «подобными зомби» тупанвирусом, заставляют агрегироваться в неинфицированные клетки.

Тупанвирусы демонстрируют ЦПЭ, который характеризуется скоплениями амеб, называемыми сгустками.Этот своеобразный CPE привел Оливейру и его сотрудников к исследованию возможных биологических факторов, участвующих в формировании пучков, вызванных тупанвирусом. Это исследование привело к характеристике тупанвируса нового типа взаимодействия вируса с хозяином. Чтобы исследовать взаимодействие между тупанвирусом и его хозяином в отношении образования пучков, первоначально авторы сосредоточились на характеристике CPE, запускаемого тупанвирусом у амебы A. castellanii [58].Было показано, что эффект начинается аналогично тому, как описано для других гигантских вирусов, таких как APMV , , у которых амеба становится округлой. Однако, в отличие от других гигантских вирусов, можно наблюдать образование ранних пучков, и они постепенно становятся больше, пока почти все клетки не объединятся в гигантские пучки [58].
Кроме того, иммунофлуоресцентный анализ и анализ с помощью электронной микроскопии показали, что группы образуются инфицированными и неинфицированными (или находящимися на другой стадии инфекции) клетками.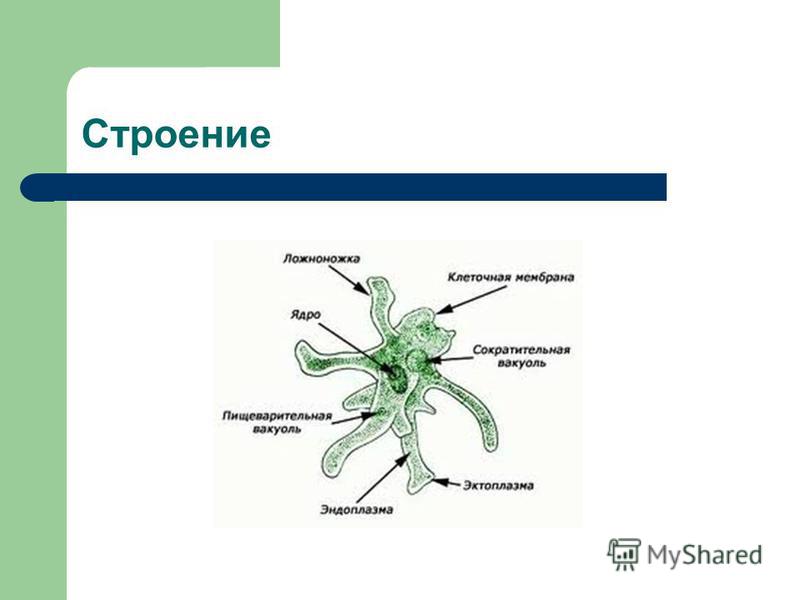 Еще одно интересное наблюдение, касающееся сгустков, заключается в том, что структуры легко дезагрегировать путем перемешивания или пипетирования. Однако было показано, что ранние сгустки способны к переформированию через несколько минут после механического разделения, в отличие от поздних сгустков (рис. 2а). Отсутствие переформирования сгустка указывает на то, что клетки уже мертвы. Это было подтверждено экспериментально, продемонстрировав, что амебы на этой стадии обладают почти полностью разрушенными плазматическими мембранами [58].
Еще одно интересное наблюдение, касающееся сгустков, заключается в том, что структуры легко дезагрегировать путем перемешивания или пипетирования. Однако было показано, что ранние сгустки способны к переформированию через несколько минут после механического разделения, в отличие от поздних сгустков (рис. 2а). Отсутствие переформирования сгустка указывает на то, что клетки уже мертвы. Это было подтверждено экспериментально, продемонстрировав, что амебы на этой стадии обладают почти полностью разрушенными плазматическими мембранами [58].
После первоначальной характеристики CPE был исследован возможный фактор, который может препятствовать образованию пучков и возможной биологической значимости пучков, вызванной тупанвирусной инфекцией.Было замечено, что во время своего цикла репликации тупанвирус способен экспрессировать ген, кодирующий маннозо-связывающий белок (MBP) [58]. Этот белок ранее был связан с адгезией у амеб A. castellanii , где было показано, что использование маннозы подавляло адгезию A.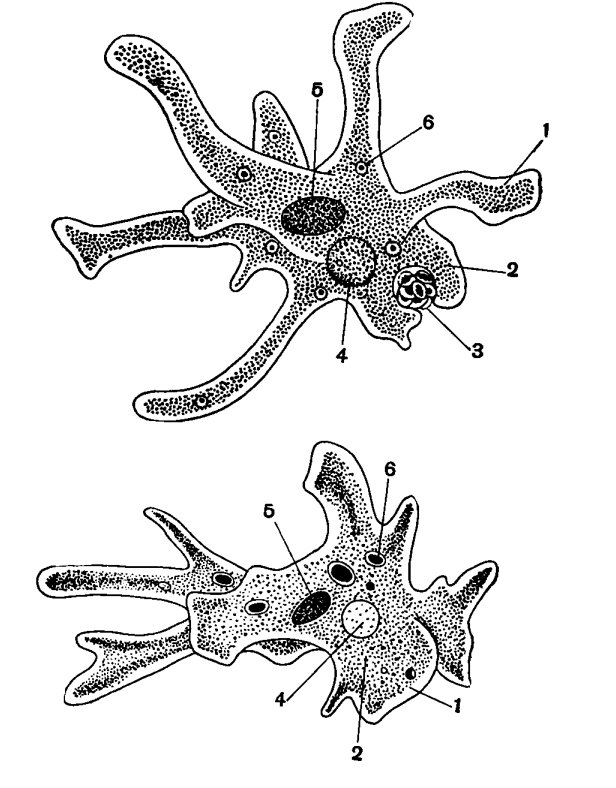 castellanii к поверхностям [61,62,63,64,65,66 ]. MBP содержит домен трехкратного внутреннего повтора, и предыдущее исследование смогло показать, что последовательность мотива QXDXNXVXY участвует в распознавании маннозы, подчеркивая важность аминокислот QDN / Y для взаимодействия MBP и маннозы [67].Основываясь на этих данных, мы исследовали влияние маннозы на образование пучков и его биологические последствия.
castellanii к поверхностям [61,62,63,64,65,66 ]. MBP содержит домен трехкратного внутреннего повтора, и предыдущее исследование смогло показать, что последовательность мотива QXDXNXVXY участвует в распознавании маннозы, подчеркивая важность аминокислот QDN / Y для взаимодействия MBP и маннозы [67].Основываясь на этих данных, мы исследовали влияние маннозы на образование пучков и его биологические последствия.
Первоначально анализ MBP на экспрессию генов показал, что на ранних стадиях тупанвирусной инфекции уровни экспрессии клеточных транскриптов MBP значительно увеличивались, предполагая, что экспрессия клеточного гена MBP, индуцированная тупанвирусом, происходит до образования пучка. Кроме того, наблюдалось постепенное увеличение (или накопление) мРНК MBP, кодируемых тупанвирусом.Взятые вместе, эти данные свидетельствуют о возможной значимости этого гена в цикле репликации вируса, поскольку экспрессия вирусных и клеточных генов MBP индуцируется во время тупанвирусной инфекции. Также наблюдалось, что свободная манноза отрицательно влияла на экспрессию как клеточного гена, так и гена тупанвируса MBP, и когда свободная манноза добавлялась в культуральную среду, происходило дозозависимое ингибирование образования пучков. Взятые вместе, эти данные показали, что образование амебных пучков коррелирует с экспрессией вирусных и клеточных генов рецепторов маннозы [58].
Также наблюдалось, что свободная манноза отрицательно влияла на экспрессию как клеточного гена, так и гена тупанвируса MBP, и когда свободная манноза добавлялась в культуральную среду, происходило дозозависимое ингибирование образования пучков. Взятые вместе, эти данные показали, что образование амебных пучков коррелирует с экспрессией вирусных и клеточных генов рецепторов маннозы [58].
Было высказано предположение, что экспрессия гена MBP, индуцированная тупанвирусом, может иметь важное значение для оптимизации образования пучков. Предыдущие исследования показали, что амеба MBP сама по себе является гликопротеином, содержащим маннозу, что указывает на то, что взаимодействие между амебами может происходить через взаимодействия между их поверхностными рецепторами MBP [65]. Это утверждение дополнительно подтверждается наблюдением, что ингибирование экспрессии MBP снижает потенциал для взаимодействия между амебами, влияя на формирование сгустков [58].Недавнее исследование показало, что тупанвирус вызывает агрегацию клеток у V. vermiformis , что позволяет предположить, что аналогичный механизм может иметь место во время инфекции у этого хозяина. Однако для подтверждения этой гипотезы потребуются дальнейшие исследования [22]. Было замечено, что пучки состоят из амеб на разных стадиях инфицирования, наблюдение, которое привело к исследованию того, могут ли пучки взаимодействовать с неинфицированными клетками. С помощью биологических анализов, а также сканирующей электронной микроскопии и иммунофлуоресцентного анализа было обнаружено, что, когда пучки амеб приводились в контакт с неинфицированными амебами, они могли взаимодействовать и захватывать неинфицированные клетки (рис.2б) [58].
vermiformis , что позволяет предположить, что аналогичный механизм может иметь место во время инфекции у этого хозяина. Однако для подтверждения этой гипотезы потребуются дальнейшие исследования [22]. Было замечено, что пучки состоят из амеб на разных стадиях инфицирования, наблюдение, которое привело к исследованию того, могут ли пучки взаимодействовать с неинфицированными клетками. С помощью биологических анализов, а также сканирующей электронной микроскопии и иммунофлуоресцентного анализа было обнаружено, что, когда пучки амеб приводились в контакт с неинфицированными амебами, они могли взаимодействовать и захватывать неинфицированные клетки (рис.2б) [58].
Взаимодействие с неинфицированными амебами, стимулируемое образованием пучков, может оптимизировать приспособленность вируса за счет повышения вероятности того, что вирусное потомство найдет новую клетку-хозяин. Выгоды от такой адаптации особенно важны, если учесть эффект разбавления, присутствующий в водной среде. Эта адаптация может сыграть интересную экологическую роль, поскольку хранение неинфицированных клеток-хозяев рядом с амебами, содержащими множество вирусных частиц, может облегчить встречи между вирусными частицами и клетками-хозяевами. Следовательно, инфицированные тупанвирусом клетки действуют как «зомби», прикрепляясь к неинфицированным клеткам и повышая шансы недавно образовавшегося вирусного потомства найти новую клетку-хозяин, в которой они могут размножаться.
Следовательно, инфицированные тупанвирусом клетки действуют как «зомби», прикрепляясь к неинфицированным клеткам и повышая шансы недавно образовавшегося вирусного потомства найти новую клетку-хозяин, в которой они могут размножаться.
Недавнее исследование описало новый противовирусный механизм, используемый амебой-хозяином V. vermiformis для избежания заражения faustovirus mariensis [68]. Faustovirus mariensis — это штамм, выделенный из проб воды в Бразилии.Геном вируса состоит из кольцевой двухцепочечной молекулы ДНК размером примерно 460 т.п.н., окруженной икосаэдрическим капсидом размером примерно 190 нм [68]. Первые штаммы фаустовирусов были выделены из V. vermiformis во Франции и Сенегале [8]. Как описано для других изолятов фаустовирусов, faustovirus mariensis инфицирует V. vermiformis , вызывая лизис клеток (рис. 3). Кроме того, было продемонстрировано, что faustovirus mariensis способен индуцировать образование бляшкообразующих единиц, а лизис клетки-хозяина является важным способом эффективного распространения частиц фаустовируса.
Faustovirus mariensis и Vermamoeba vermiformis взаимодействия . Faustovirus mariensis способен инфицировать трофозоитов V. vermiformis (1), а инфицированных клеток V. vermiformis могут быть лизированы (2). Однако инфицированные клетки выделяют факторы энцистментации (3), которые запускают инцистирование инфицированных (4) и неинфицированных соседних клеток (5), которые, в свою очередь, не будут инфицированы, поскольку faustovirus mariensis не может инфицировать цисты (6).Инфицированные трофозоиты превращаются в цисты, содержащие частицы фаустовируса и ФЖ на разных стадиях цикла репликации (4). Хотя цисты, не содержащие вирусных частиц или VF, способны эксцистировать (7), цисты, содержащие частицы фаустовируса и VF, не обладают способностью эксцистировать (8). Помимо вирусов, внутри кисты задерживаются VF (9), препятствуя распространению faustovirus mariensis. Вирусная фабрика: VF
Во время исследования цикла репликации faustovirus mariensis наблюдалось повышенное образование V. vermiformis , в отличие от цист, наблюдаемых у V. vermiformis , инфицированных другими гигантскими вирусами, такими как тупанвирус и орфеовирус. Любопытно, что частицы faustovirus mariensis, а также отдельные фазы его цикла репликации наблюдались внутри цитоплазмы цист V. vermiformis . Было продемонстрировано, что образование цист V. vermiformis во время инфицирования faustovirus mariensis происходит зависимым от MOI образом, причем при высоких MOI почти все V.vermiformis трофозоитов превратились в цисты. Кроме того, низкие MOI были связаны с репликацией вируса, в то время как более высокие MOI были связаны с более низкими темпами размножения вирусов. Эти наблюдения предполагали, что вирус был способен инфицировать клетку-хозяина, но не мог высвободить свое потомство, поскольку частицы и VF оставались внутри цист (рис. 3).
vermiformis , в отличие от цист, наблюдаемых у V. vermiformis , инфицированных другими гигантскими вирусами, такими как тупанвирус и орфеовирус. Любопытно, что частицы faustovirus mariensis, а также отдельные фазы его цикла репликации наблюдались внутри цитоплазмы цист V. vermiformis . Было продемонстрировано, что образование цист V. vermiformis во время инфицирования faustovirus mariensis происходит зависимым от MOI образом, причем при высоких MOI почти все V.vermiformis трофозоитов превратились в цисты. Кроме того, низкие MOI были связаны с репликацией вируса, в то время как более высокие MOI были связаны с более низкими темпами размножения вирусов. Эти наблюдения предполагали, что вирус был способен инфицировать клетку-хозяина, но не мог высвободить свое потомство, поскольку частицы и VF оставались внутри цист (рис. 3).
Как описано в разделе 1 этого обзора, экспрессия клеточных сериновых протеиназ связана с процессом энцистментации, а регуляция одного из этих ферментов мимивирусом связана с ингибированием процесса инцистирования в A. castellanii . Поскольку мимивирус может реплицироваться только в трофозоитах, но не в цистах, предотвращение инцистирования имеет решающее значение для репликации этого вируса. С другой стороны, Faustovirus mariensis не мог блокировать инцистацию V. vermiformis , и при высоком MOI трофозоиты превращались в цисты, и репликация вируса не наблюдалась. Кроме того, faustovirus mariensis индуцировал экспрессию сериновой протеиназы, присутствующей в V. vermiformis , что позволяет предположить, что этот вирус не может регулировать один из факторов, запускающих инцистирование V.Вермиформис . Наконец, было показано, что инокуляция свежих трофозоитов V. vermiformis с использованием супернатанта инфицированных культур V. vermiformis может индуцировать инцистирование дозозависимым образом, что позволяет предположить, что трофозоиты, инфицированные факторами высвобождения faustovirus mariensis, могут запускать инцистирование. (Рис. 3).
castellanii . Поскольку мимивирус может реплицироваться только в трофозоитах, но не в цистах, предотвращение инцистирования имеет решающее значение для репликации этого вируса. С другой стороны, Faustovirus mariensis не мог блокировать инцистацию V. vermiformis , и при высоком MOI трофозоиты превращались в цисты, и репликация вируса не наблюдалась. Кроме того, faustovirus mariensis индуцировал экспрессию сериновой протеиназы, присутствующей в V. vermiformis , что позволяет предположить, что этот вирус не может регулировать один из факторов, запускающих инцистирование V.Вермиформис . Наконец, было показано, что инокуляция свежих трофозоитов V. vermiformis с использованием супернатанта инфицированных культур V. vermiformis может индуцировать инцистирование дозозависимым образом, что позволяет предположить, что трофозоиты, инфицированные факторами высвобождения faustovirus mariensis, могут запускать инцистирование. (Рис. 3).
Высвобождение растворимых факторов уже было связано с процессом инцистирования у A. castellanii [35]. Кроме того, поиск природы факторов, участвующих в этом явлении, показал, что фактор (факторы) инцистментации, вероятно, не были белками, поскольку обработка протеиназой К или бромелайном не могла предотвратить инцистирование V.Вермиформис . Это было путем измерения различных неорганических факторов в супернатантах клеток, инфицированных faustovirus mariensis, по сравнению с гигантским вирусом, который не индуцирует энцистментацию (тупанвирус), что позволило предположить один из факторов, ответственных за индукцию энцистментации в эта система. Основываясь на этих выводах и предыдущем исследовании, показывающем, что Mg 2+ является фактором, запускающим инцистирование у A. castellanii , мы проверили потенциал Mg 2+ для запуска инцистментации V.vermiformis [68, 69]. Было замечено, что поступление ионов магния не только стимулировало инцистирование, но также способствовало постепенному увеличению концентрации Mg 2+ в супернатанте клеток, что может действовать как стимул инцистирования для соседних трофозоитов.
castellanii [35]. Кроме того, поиск природы факторов, участвующих в этом явлении, показал, что фактор (факторы) инцистментации, вероятно, не были белками, поскольку обработка протеиназой К или бромелайном не могла предотвратить инцистирование V.Вермиформис . Это было путем измерения различных неорганических факторов в супернатантах клеток, инфицированных faustovirus mariensis, по сравнению с гигантским вирусом, который не индуцирует энцистментацию (тупанвирус), что позволило предположить один из факторов, ответственных за индукцию энцистментации в эта система. Основываясь на этих выводах и предыдущем исследовании, показывающем, что Mg 2+ является фактором, запускающим инцистирование у A. castellanii , мы проверили потенциал Mg 2+ для запуска инцистментации V.vermiformis [68, 69]. Было замечено, что поступление ионов магния не только стимулировало инцистирование, но также способствовало постепенному увеличению концентрации Mg 2+ в супернатанте клеток, что может действовать как стимул инцистирования для соседних трофозоитов.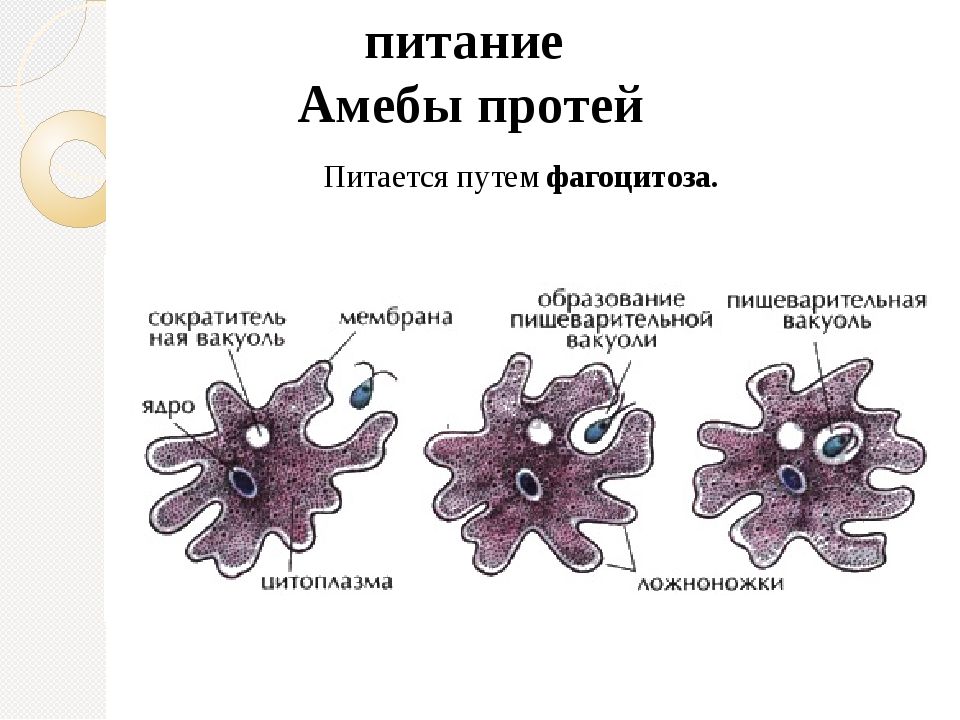 Мы также наблюдали, что этилендиаминтетрауксусная кислота (ЭДТА) (двухвалентный ингибитор катионов) влияет на активность фактора энцистмента, усиливая важность Mg 2+ в клеточной коммуникации в этом контексте [68].
Мы также наблюдали, что этилендиаминтетрауксусная кислота (ЭДТА) (двухвалентный ингибитор катионов) влияет на активность фактора энцистмента, усиливая важность Mg 2+ в клеточной коммуникации в этом контексте [68].
Хотя предыдущие исследования продемонстрировали, что внутриклеточные бактерии, такие как Salmonella enterica и Escherichia coli , способны выжить и воспользоваться преимуществами амебной энцистментации.Это было первое исследование, продемонстрировавшее захват вирусных частиц и VF внутри цист амеб [68, 70]. Кроме того, эволюционные проблемы, проистекающие из этого взаимодействия, кажутся уникальными, поскольку цисты амеб, содержащие бактерии, способны выделять возвращающиеся бактерии для размножения. Этого не наблюдается для цист амебы, содержащих фаустовирус. Исследование показало, что только цисты без faustovirus mariensis в своей цитоплазме способны эксцистировать. Таким образом, взаимодействие между faustovirus mariensis и энцистментом V. vermiformis был предложен как новый тип противовирусной стратегии, при котором распространение faustovirus mariensis затруднено (рис. 3). Аналогично, этот механизм был связан с системой противовирусного интерферона у позвоночных [68].
vermiformis был предложен как новый тип противовирусной стратегии, при котором распространение faustovirus mariensis затруднено (рис. 3). Аналогично, этот механизм был связан с системой противовирусного интерферона у позвоночных [68].
Еще один участник гигантских взаимодействий вирус-хозяин: вирофаг
Изучение гигантских вирусов стало еще более сложным из-за открытия небольших вирусов, способных их инфицировать, таких как вирофаг. Первый вирофаг, называемый спутником, имеет размер около 50 нм и примерно 18 т.п.н., с кольцевой двухцепочечной ДНК, и было обнаружено, что он связан со штаммом мимивируса [15].Вирофаги не могут размножаться без гигантских вирусов. Их репликация происходит в гигантской вирусной фабрике и может быть вредна для репликации вируса, что приводит к снижению лизиса амеб [15, 71] . С момента их открытия десятки новых вирофагов были выделены и классифицированы в новое вирусное семейство под названием Lavidaviridae [72,73,74,75,76,77,78,79,80]. Считается, что вирофаг может опосредовать латеральный перенос генов между гигантскими вирусами. Кроме того, было показано, что они способны интегрироваться в гигантские вирусы и геномы клеток-хозяев.Эти данные убедительно свидетельствуют о том, что амебы, вирофаги и гигантские вирусы, по-видимому, эволюционируют вместе друг с другом [15, 81, 82]. Открытие новых вирофагов привело к описанию некоторых интересных взаимодействий между вирофагами, гигантским вирусом и хозяевами. В 2014 году был выделен вирофаг, названный замилон, который, в отличие от вирофагов, описанных на сегодняшний день, не мог реплицироваться на фабриках мимивирусов линии A, а только на фабриках мимивирусов линий B и C [76]. Его специфичность к хозяину вызвала любопытство Левассера и сотрудников, которые изучали генетические основы этой специфичности хозяина [83].Было обнаружено, что штаммы мимивируса линии А, устойчивые к вирофагу замилон, содержат вставку повторяющейся последовательности замилона в его геном. Эти повторы были названы элементами устойчивости к вирофагам мимивирусов (MIMIVIRE).
Считается, что вирофаг может опосредовать латеральный перенос генов между гигантскими вирусами. Кроме того, было показано, что они способны интегрироваться в гигантские вирусы и геномы клеток-хозяев.Эти данные убедительно свидетельствуют о том, что амебы, вирофаги и гигантские вирусы, по-видимому, эволюционируют вместе друг с другом [15, 81, 82]. Открытие новых вирофагов привело к описанию некоторых интересных взаимодействий между вирофагами, гигантским вирусом и хозяевами. В 2014 году был выделен вирофаг, названный замилон, который, в отличие от вирофагов, описанных на сегодняшний день, не мог реплицироваться на фабриках мимивирусов линии A, а только на фабриках мимивирусов линий B и C [76]. Его специфичность к хозяину вызвала любопытство Левассера и сотрудников, которые изучали генетические основы этой специфичности хозяина [83].Было обнаружено, что штаммы мимивируса линии А, устойчивые к вирофагу замилон, содержат вставку повторяющейся последовательности замилона в его геном. Эти повторы были названы элементами устойчивости к вирофагам мимивирусов (MIMIVIRE). Анализируя окружающие последовательности, авторы заметили, что система MIMIVIRE представляет белки нуклеазы и геликазы, которые могут играть жизненно важную роль в деградации чужеродных нуклеиновых кислот, предполагая, что этот локус может быть связан с кластером коротких палиндромных повторов с регулярными интервалами (CRISPR ) -Cas система, хотя и не гомологична этой системе [84].Интересно, что подавление генов MIMIVIRE восстановило способность замилона инфицировать фабрики мимивируса линии A. В результате исследователи предположили, что система MIMIVIRE действует как вирусный защитный механизм против вирофагов [83]. Недавно дополнительные биологические демонстрации позволили дополнительно охарактеризовать защитный механизм системы MIMIVIRE. Было продемонстрировано, что ген мимивируса с неизвестной функцией, названный R349, один из компонентов системы MIMIVIRE, который содержит четыре повтора, гомологичных последовательности вирофага, выполняет ключевую функцию в механизме защиты системы MIMIVIRE.
Анализируя окружающие последовательности, авторы заметили, что система MIMIVIRE представляет белки нуклеазы и геликазы, которые могут играть жизненно важную роль в деградации чужеродных нуклеиновых кислот, предполагая, что этот локус может быть связан с кластером коротких палиндромных повторов с регулярными интервалами (CRISPR ) -Cas система, хотя и не гомологична этой системе [84].Интересно, что подавление генов MIMIVIRE восстановило способность замилона инфицировать фабрики мимивируса линии A. В результате исследователи предположили, что система MIMIVIRE действует как вирусный защитный механизм против вирофагов [83]. Недавно дополнительные биологические демонстрации позволили дополнительно охарактеризовать защитный механизм системы MIMIVIRE. Было продемонстрировано, что ген мимивируса с неизвестной функцией, названный R349, один из компонентов системы MIMIVIRE, который содержит четыре повтора, гомологичных последовательности вирофага, выполняет ключевую функцию в механизме защиты системы MIMIVIRE.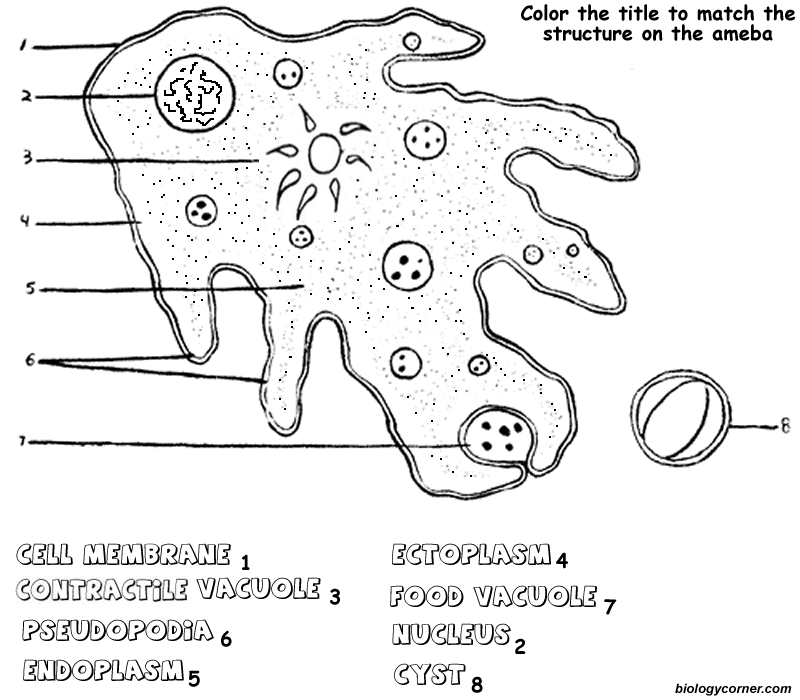 Делеция гена R349 в линии мимивируса A восстановила репликацию замилона. Кроме того, было обнаружено, что изолят мимивируса линии A, лишенный 3 из 4 повторов гена R349, был восприимчив к инфекции замилоном [85]. Принимая во внимание вышеизложенное, эти результаты усиливают роль MIMIVIRE как основанной на нуклеиновых кислотах системы защиты иммунитета от инфекции вирофагами, подтверждая важность гена R349 в системе MIMIVIRE. Это исследование выявило беспрецедентный тип взаимодействия вирус-хозяин и подтвердило, что амеба, вирофаги и гигантские вирусы-хозяева эволюционируют одновременно.Другое примечательное взаимодействие вирофага – гигантского вируса – хозяина — это взаимодействие, в котором участвует морской протист Cafeteria roenbergensis с гигантским вирусом C. roenbergensis и связанным с ним вирофагом, мавирусом. Вирус Cafeteria roenbergensis (CroV) удаленно связан с мимивирусами, инфицирующими фаготрофную бифлагеллату Cafeteria roenbergensis [72]. Мавирус был вторым обнаруженным вирофагом, выделенным из воды, собранной в Техасе, США [73].
Делеция гена R349 в линии мимивируса A восстановила репликацию замилона. Кроме того, было обнаружено, что изолят мимивируса линии A, лишенный 3 из 4 повторов гена R349, был восприимчив к инфекции замилоном [85]. Принимая во внимание вышеизложенное, эти результаты усиливают роль MIMIVIRE как основанной на нуклеиновых кислотах системы защиты иммунитета от инфекции вирофагами, подтверждая важность гена R349 в системе MIMIVIRE. Это исследование выявило беспрецедентный тип взаимодействия вирус-хозяин и подтвердило, что амеба, вирофаги и гигантские вирусы-хозяева эволюционируют одновременно.Другое примечательное взаимодействие вирофага – гигантского вируса – хозяина — это взаимодействие, в котором участвует морской протист Cafeteria roenbergensis с гигантским вирусом C. roenbergensis и связанным с ним вирофагом, мавирусом. Вирус Cafeteria roenbergensis (CroV) удаленно связан с мимивирусами, инфицирующими фаготрофную бифлагеллату Cafeteria roenbergensis [72]. Мавирус был вторым обнаруженным вирофагом, выделенным из воды, собранной в Техасе, США [73].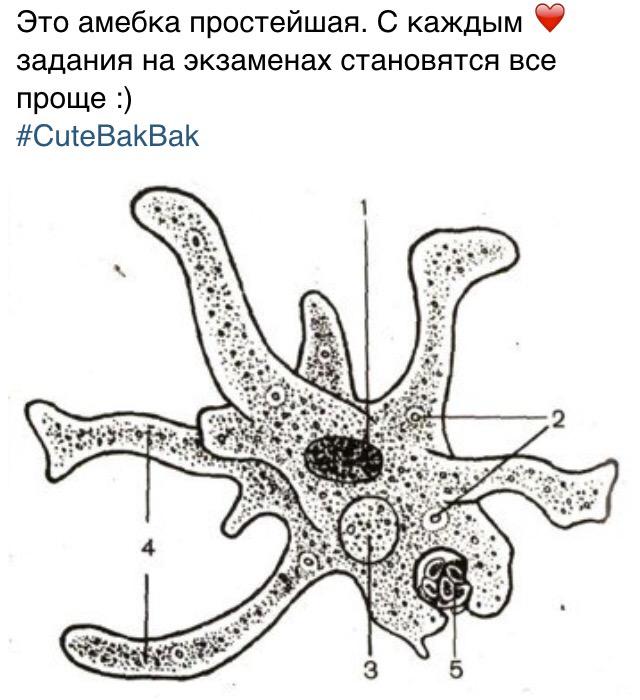 Вирофаг мавируса реплицируется на вирусной фабрике CroV; однако было замечено, что мавирус может проникать в C.roenbergensis независимо от CroV за счет эндоцитоза и способен ингибировать продукцию новых частиц CroV, увеличивая выживаемость хозяина C roenbergensis [73]. В 2016 году Фишер и Хакл обнаружили в результате совместного инфицирования популяции хозяина CroV и мавирусом, что вирофаг может интегрироваться в геном C. roenbergensis [86]. Они показали, что геном мавируса интегрирован в разные места генома, и хотя интегрированные гены вирофагов не экспрессируются конститутивно, они могут активироваться инфекцией CroV, вызывая продукцию инфекционных частиц мавируса и реактивируя этот вирофаг в клетке-хозяине.Хотя это ожидалось, реактивация мавируса не смогла заблокировать репликацию CroV, и, следовательно, C. roenbergensis , инфицированные CroV, все равно умерли, высвободив CroV и частицы мавируса. Несмотря на это, они наблюдали, что высвободившийся мавирус уменьшал распространение CroV в популяции протистов и его репликацию в другом цикле репликации, защищая соседние клетки от уничтожения гигантской вирусной инфекцией.
Вирофаг мавируса реплицируется на вирусной фабрике CroV; однако было замечено, что мавирус может проникать в C.roenbergensis независимо от CroV за счет эндоцитоза и способен ингибировать продукцию новых частиц CroV, увеличивая выживаемость хозяина C roenbergensis [73]. В 2016 году Фишер и Хакл обнаружили в результате совместного инфицирования популяции хозяина CroV и мавирусом, что вирофаг может интегрироваться в геном C. roenbergensis [86]. Они показали, что геном мавируса интегрирован в разные места генома, и хотя интегрированные гены вирофагов не экспрессируются конститутивно, они могут активироваться инфекцией CroV, вызывая продукцию инфекционных частиц мавируса и реактивируя этот вирофаг в клетке-хозяине.Хотя это ожидалось, реактивация мавируса не смогла заблокировать репликацию CroV, и, следовательно, C. roenbergensis , инфицированные CroV, все равно умерли, высвободив CroV и частицы мавируса. Несмотря на это, они наблюдали, что высвободившийся мавирус уменьшал распространение CroV в популяции протистов и его репликацию в другом цикле репликации, защищая соседние клетки от уничтожения гигантской вирусной инфекцией. Авторы связывают это взаимодействие вирофаг-гигантский вирус-хозяин как альтруистический защитный механизм хозяина, при котором хозяин умирает, высвобождая вирусные частицы, которые способны защищать соседнюю популяцию хозяина [86].Другая возможность состоит в том, что это взаимодействие действует как система адаптивного иммунитета CRISPR-Cas, в которой геном вирофага удерживается хозяином и используется для предотвращения последующих атак гигантского вируса. Вирусные элементы можно найти в геномах эукариот; однако мало что известно о том, как они действуют и их функциях [87]. Это исследование предоставило пример вирофага, который интегрируется в геном клетки, действуя как индуцибельная противовирусная система защиты. Было продемонстрировано, что зеленая водоросль, называемая Bigelowiella natans , содержит вирофаги, интегрированные в ее геном, что является еще одним возможным примером опосредованной вирофагами защиты хозяина [82].В дополнение к этим исследованиям интеграции вирофагов, некоторые особенности были обнаружены во взаимодействиях вирофаг-гигантский вирус-хозяин.
Авторы связывают это взаимодействие вирофаг-гигантский вирус-хозяин как альтруистический защитный механизм хозяина, при котором хозяин умирает, высвобождая вирусные частицы, которые способны защищать соседнюю популяцию хозяина [86].Другая возможность состоит в том, что это взаимодействие действует как система адаптивного иммунитета CRISPR-Cas, в которой геном вирофага удерживается хозяином и используется для предотвращения последующих атак гигантского вируса. Вирусные элементы можно найти в геномах эукариот; однако мало что известно о том, как они действуют и их функциях [87]. Это исследование предоставило пример вирофага, который интегрируется в геном клетки, действуя как индуцибельная противовирусная система защиты. Было продемонстрировано, что зеленая водоросль, называемая Bigelowiella natans , содержит вирофаги, интегрированные в ее геном, что является еще одним возможным примером опосредованной вирофагами защиты хозяина [82].В дополнение к этим исследованиям интеграции вирофагов, некоторые особенности были обнаружены во взаимодействиях вирофаг-гигантский вирус-хозяин. Среди них было исследование, показывающее, что совместное инфицирование вирофагом sputnik и марсельлевирусом влияет на репликативную способность марсельлевируса [88]. Используя метагеномный подход, было высказано предположение, что вирофаги снижают смертность, вызываемую гигантскими вирусами фототрофных водорослей, и с помощью математической модели было предложено, что помимо прямого вмешательства в размножение гигантских вирусов, инфекция вирофагами может выделять вирусы с пониженной репликативной способностью, способствующие защите популяции клеток-хозяев [74, 89].На основании этого и других исследований было высказано предположение, что вирофаги связаны с регуляцией популяции амеб и других простейших в окружающей среде [90]. В 2018 году был выделен вирофаг, который, как сообщается, связан со штаммом мимивируса, который инфицирует Saccamoeba spp., Со способностью вызывать значительное снижение (~ 70%) продукции вирусного капсида [91]. Растущее описание новых изолятов вирофагов и новых взаимодействий с ними выявило, что вирофаги, гигантские вирусы и их хозяин составляют сложный и беспрецедентный тип взаимодействия хозяин-вирус и что, вероятно, еще предстоит изучить множество взаимодействий.
Среди них было исследование, показывающее, что совместное инфицирование вирофагом sputnik и марсельлевирусом влияет на репликативную способность марсельлевируса [88]. Используя метагеномный подход, было высказано предположение, что вирофаги снижают смертность, вызываемую гигантскими вирусами фототрофных водорослей, и с помощью математической модели было предложено, что помимо прямого вмешательства в размножение гигантских вирусов, инфекция вирофагами может выделять вирусы с пониженной репликативной способностью, способствующие защите популяции клеток-хозяев [74, 89].На основании этого и других исследований было высказано предположение, что вирофаги связаны с регуляцией популяции амеб и других простейших в окружающей среде [90]. В 2018 году был выделен вирофаг, который, как сообщается, связан со штаммом мимивируса, который инфицирует Saccamoeba spp., Со способностью вызывать значительное снижение (~ 70%) продукции вирусного капсида [91]. Растущее описание новых изолятов вирофагов и новых взаимодействий с ними выявило, что вирофаги, гигантские вирусы и их хозяин составляют сложный и беспрецедентный тип взаимодействия хозяин-вирус и что, вероятно, еще предстоит изучить множество взаимодействий.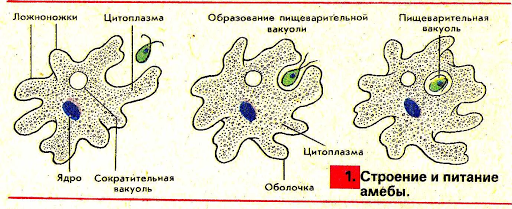
Новый червеобразный клещ с необычной обивкой
Эта причудливая конструкция не из магазина реквизита из научно-фантастического фильма, хотя она вполне может послужить источником вдохновения.
Рис. 5A от Bolton et al., 2014. Щелкните изображение, чтобы увидеть источник.
К чему, как вы могли догадаться, прикреплен этот когтеобразный придаток? Вы бы догадались. . . клещ? Например, та же группа паукообразных родственников паукообразных, которая принесла нам пылевого клеща, паутинного клеща (отрава садоводов) и галлового клеща, который превращает современное искусство в лист? Хорошо, может быть, вы догадались бы, потому что клещи также принесли нам чиггера; чесотка и чесоточные клещи; Varroa destructor , клещ-паразит, посеявший хаос среди медоносных пчел; и, конечно же, всеобщий фаворит: Demodex клещей, твари, которые резвятся, едят, какают и производят маленьких клещей в ваших ресницах, волосяных фолликулах и сальных железах.И я упоминал, что кузены клещей — клещи?
Но, тем не менее, вы не ожидаете такого замысловатого, научно-фантастического придатка от ЭТОГО конкретного клеща, потому что владелец этой клешни — почвенный клещ. Но в этом клеще есть что-то особенное, кроме его домашних раскопок. Потому что вот в чем дело. Ваш обычный клещ выглядит так:
Но в этом клеще есть что-то особенное, кроме его домашних раскопок. Потому что вот в чем дело. Ваш обычный клещ выглядит так:
Паутинный клещ садовой разновидности (ммм, буквально). CC-by-x.x Дж. Холопайнен. Щелкните изображение, чтобы просмотреть лицензию и источник.
А вот хозяин этой коварной лапы выглядит так:
Рис.8 из Bolton et al., 2014. Щелкните изображение, чтобы увидеть источник.
Это их лицо, кстати, справа. И это даже не взрослые. Это две разные стадии нимфы.
Взрослые в полный рост выглядят так:
Рис. 1 из Bolton et al., 2014. Щелкните изображение, чтобы увидеть источник.
Взрослые особи клещей имеют длину около 600 микрометров, что примерно в 12 раз больше их ширины. И это даже не предел для клещей этого типа. Другой вид из этой группы может стать таким же длинным и червивым.С другой стороны, учтите, что при длине в несколько сотен микрометров это сложное многоклеточное членистоногое примерно такого же размера, как некоторые крупные одноклеточные микробы, такие как амебы.
Этот клещ представляет собой новый вид — Osperalycus tenerphagus — , описанный и названный в прошлом месяце учеными из Университета штата Огайо и Службы сельскохозяйственных исследований Министерства сельского хозяйства США. Много загадок осталось об этом клеще; среди них то, что он ест. Одна вещь, которая не является загадкой, — это происхождение клещей.Их выловили из почвы в университетском городке и на плантации каштанов. И все же из старой скучной грязи появился червеобразный клещ с некоторыми необычайно красивыми деталями, и не только с этим когтем.
Этот монтаж ниже показывает текстуру поверхности этих клещей под растровым электронным микроскопом. Вверху слева кутикула расширена, открывая красивый ажурный сотовый узор на кутикуле между рядами гребней с лопастями (биологи довольно красочно называют палитрами).Справа кутикула сокращена. Два нижних изображения представляют собой вид под наклоном, увеличенный на плоскости и сжатый справа. Вы можете понять, почему они называют их палитрами.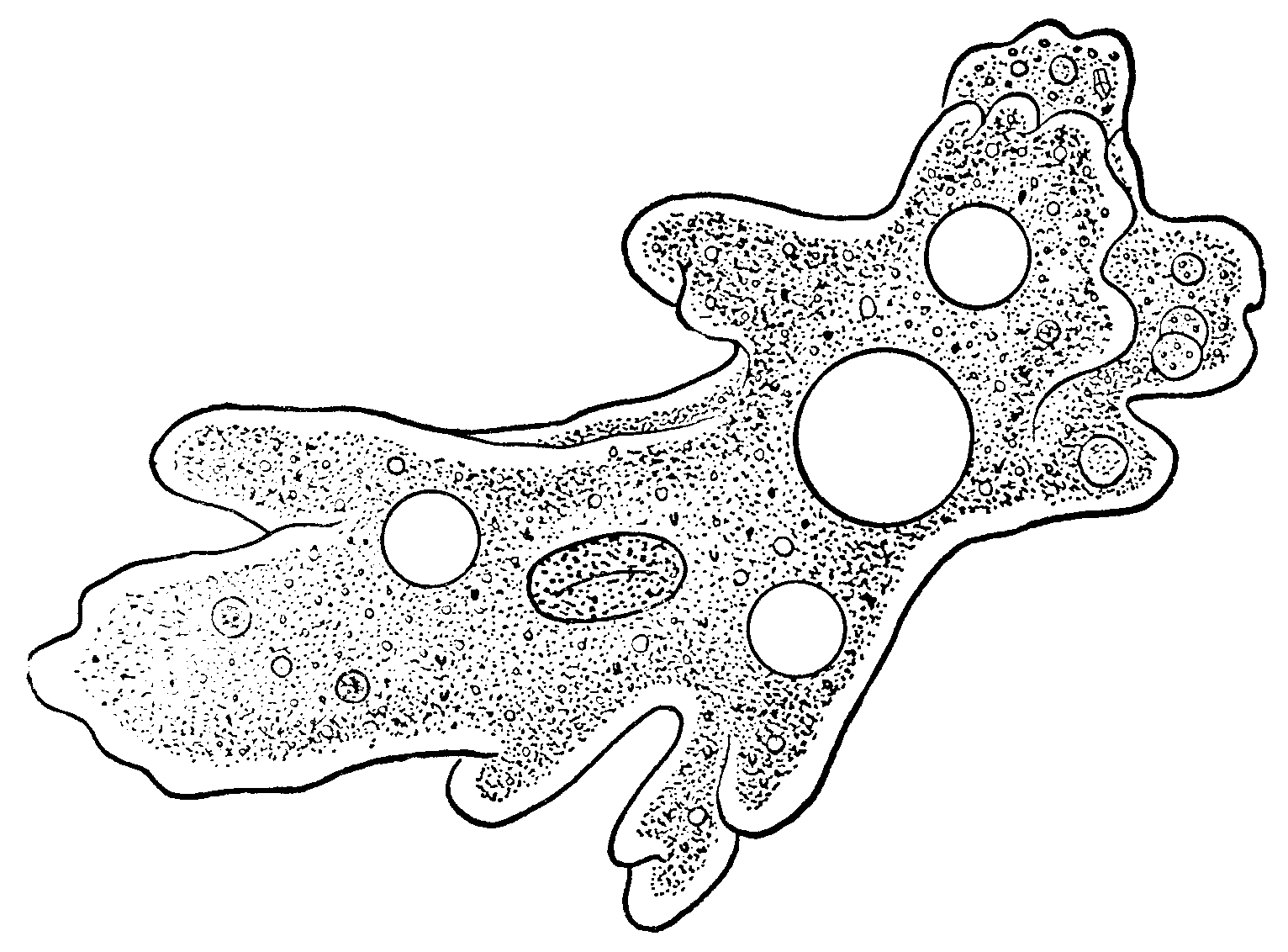
Рис. 3 из Bolton et al., 2014. Щелкните изображение, чтобы увидеть источник.
Вот увеличенная кутикула крупным планом.
Рис. 3A от Bolton et al., 2014. Щелкните изображение, чтобы увидеть источник.
А вот договорённо.
Рис. 3B от Bolton et al., 2014. Щелкните изображение, чтобы увидеть источник.
В чем может быть причина такой великолепной обивки? Ученые подозревают, что лопасти находятся там, где клещ встречается с дорогой, так сказать.Несмотря на то, что лопасти, кажется, указывают неверный путь для движения через перистальтику, как у дождевого червя или пищевода, когда вы глотаете (широкие стороны палитры совпадают с осью червя, и, кроме того, эти клещи не перемещаются перистальтика все равно), мол, клещ до сих пор как-то ими пользуется, как весла. Кутикула может расширяться и сжиматься неперистальтическим путем как за счет гидравлического давления тела, так и за счет мышечного слоя прямо под кожей. Используя эту подобную гармошке систему, эти клещи умудряются прокладывать себе путь через крошечные промежутки между частицами в почве, бороздя огромное и таинственное Море Грязи.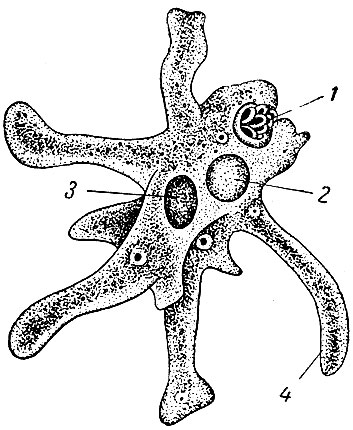
Ссылка
Bolton S.J., Klompen H., Bauchan G.R. И Очоа Р. (2014). Новый род и вид Nematalycidae (Acari: Endeostigmata), Journal of Natural History, 1-15. DOI: 10.1080 / 00222933.2013.859318
Интраамебное размножение индуцирует хемотаксис, колонизацию и образование биопленок для Legionella
Abstract
Legionella pneumophila , факультативная внутриклеточная бактерия, возбудитель легионеллеза.В окружающей среде эта патогенная бактерия колонизирует биопленки, а также амебы, которые обеспечивают богатую среду для репликации Legionella . При посеве на предварительно сформированные биопленки L. pneumophila смогла прижиться и выжить и была обнаружена только на поверхности биопленок. Различные фенотипы наблюдались, когда L. pneumophila , использовавшаяся для создания предварительно сформированных биопленок или для образования моновидовых биопленок, культивировалась в лабораторном культуральном бульоне или росла внутриклеточно внутри амебы.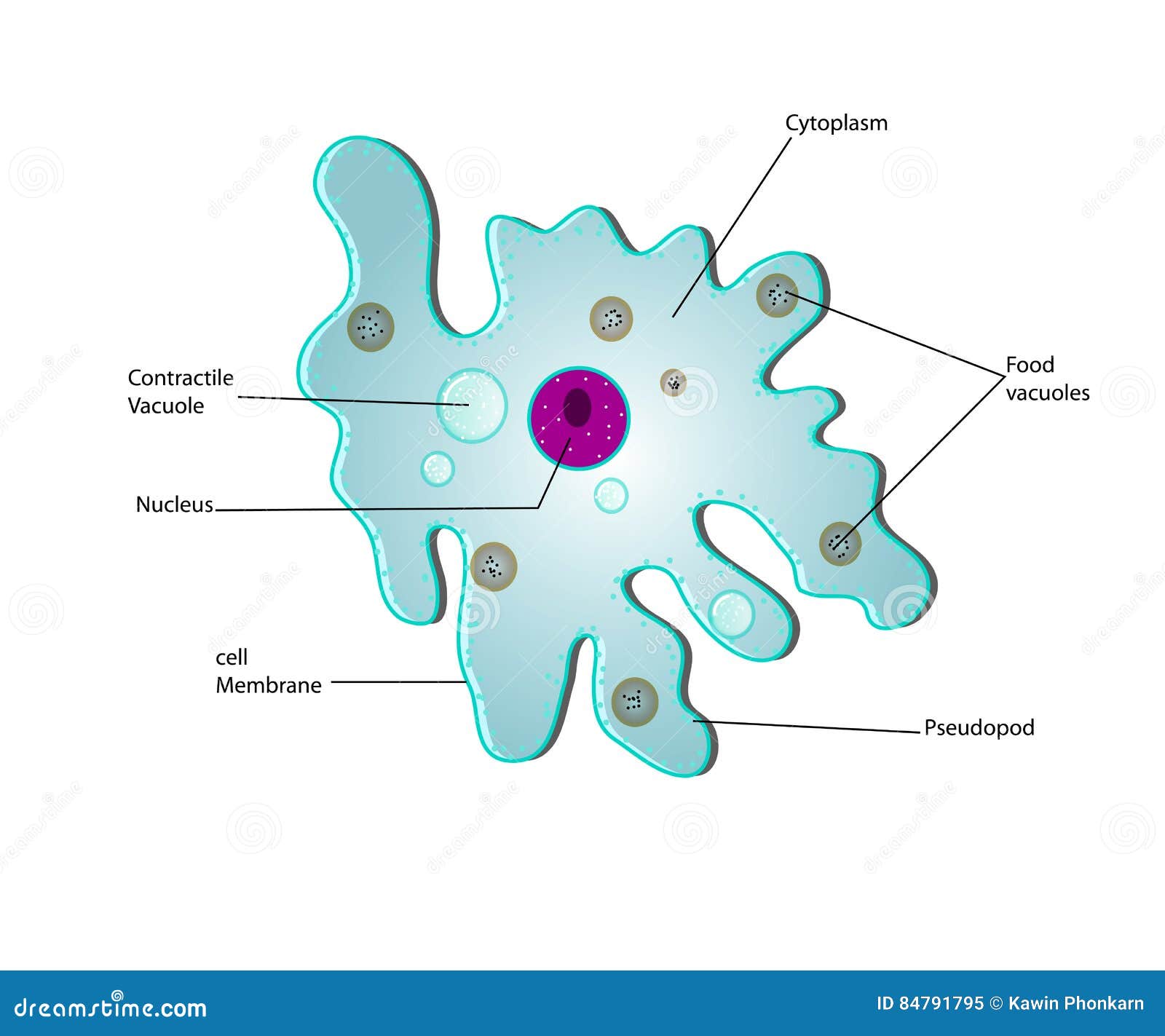 Действительно, бактерии, которые развивались внутри амебы, образовывали кластеры при осаждении на твердой поверхности. Более того, наши результаты демонстрируют, что размножение внутри амебы увеличивало способность L. pneumophila производить полисахариды и, следовательно, увеличивало его способность образовывать биопленки. Наконец, было показано, что кластеры, образованные L. pneumophila , вероятно, связаны с секрецией молекулярного агента хемотаксиса.
Действительно, бактерии, которые развивались внутри амебы, образовывали кластеры при осаждении на твердой поверхности. Более того, наши результаты демонстрируют, что размножение внутри амебы увеличивало способность L. pneumophila производить полисахариды и, следовательно, увеличивало его способность образовывать биопленки. Наконец, было показано, что кластеры, образованные L. pneumophila , вероятно, связаны с секрецией молекулярного агента хемотаксиса.
Образец цитирования: Bigot R, Bertaux J, Frere J, Berjeaud J-M (2013) Интра-размножение амебы вызывает хемотаксис и колонизацию и образование биопленок для Legionella .PLoS ONE 8 (10): e77875. https://doi.org/10.1371/journal.pone.0077875
Редактор: Юсеф Абу Квайк, Университет Луисвилля, Соединенные Штаты Америки
Поступила: 19 июля 2013 г .; Принята к печати: 13 сентября 2013 г .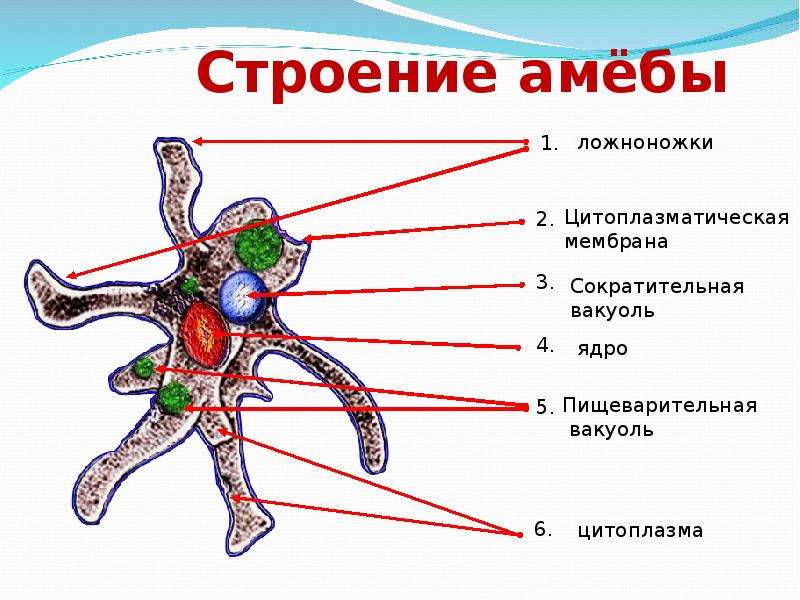 ; Опубликован: 24 октября 2013 г.
; Опубликован: 24 октября 2013 г.
Авторские права: © 2013 Bigot et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Министерство высшего образования признано за докторскую степень Р. Биго. финансирование. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Legionella — это факультативные внутриклеточные грамотрицательные бактерии, обнаруженные в естественной пресноводной среде, а также в искусственных водных системах [1]. Legionella pneumophila является основным возбудителем легионеллеза, за исключением Австралии, где Legionella longbeachae является основным возбудителем [2], [3]. Инфекция возникает из-за размножения в альвеолярных макрофагах после вдыхания человеком загрязненных аэрозолей, производимых многими инженерными системами водоснабжения, такими как кондиционирование воздуха, градирни, системы горячего водоснабжения, гидромассажные ванны и спа, растительные мистеры, насадки для душа и водопроводы стоматологической установки [4 ] — [8].
Инфекция возникает из-за размножения в альвеолярных макрофагах после вдыхания человеком загрязненных аэрозолей, производимых многими инженерными системами водоснабжения, такими как кондиционирование воздуха, градирни, системы горячего водоснабжения, гидромассажные ванны и спа, растительные мистеры, насадки для душа и водопроводы стоматологической установки [4 ] — [8].
Контроль л.pneumophil a в водопроводных сетях в основном основан на процессах дезактивации. Однако в настоящее время хорошо известно, что эта бактерия сопротивляется биоцидам из-за ее сидячего образа жизни в биопленках, а также из-за ее способности расти внутри амеб [9] — [11].
Легионелла виды . нуждаются в добавках аминокислот и поэтому разработали механизмы для усвоения этих питательных веществ за счет нахождения в биопленках, богатых питательными веществами [12] — [15]. L. pneumophila способна выживать и расти на мертвых биопленочных микробных клетках, таких как убитые нагреванием бактерии, амебы и дрожжи [16].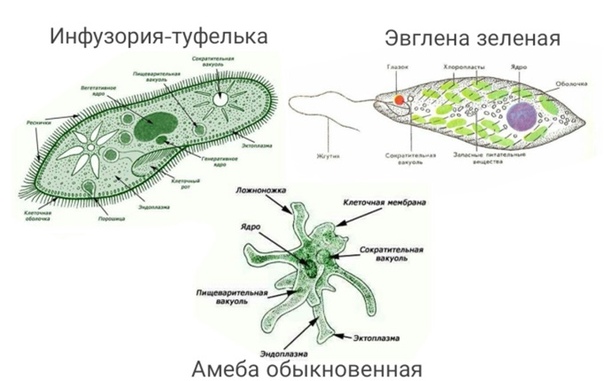 При развитии моновидовой биопленки Legionella в богатой питательной среде температура играет роль в толщине и структуре [17]. Биопленки являются основным источником заражения людей. Микробное образование сообществ биопленок обеспечивает защиту от физических или химических агентов. Таким образом, в многочисленных исследованиях [13], [14], [18] было продемонстрировано, что L. pneumophila , приготовленное из лабораторной культуральной среды, может внедряться в предварительно сформированную биопленку для бактерий.
При развитии моновидовой биопленки Legionella в богатой питательной среде температура играет роль в толщине и структуре [17]. Биопленки являются основным источником заражения людей. Микробное образование сообществ биопленок обеспечивает защиту от физических или химических агентов. Таким образом, в многочисленных исследованиях [13], [14], [18] было продемонстрировано, что L. pneumophila , приготовленное из лабораторной культуральной среды, может внедряться в предварительно сформированную биопленку для бактерий.
Амеба, такая как Acanthamoeba castellanii и инфузорий простейшие, способны поедать биопленочный материал [19]. В этих средах Legionella становится мишенью простейших хищников и развила способность паразитировать и жить в 20 видах амеб, трех видах реснитчатых простейших и одном виде слизистой плесени [20] — [22]. Многочисленные исследования показывают необходимость присутствия простейших для выживания и размножения L. pneumophila в водной среде [14], [23].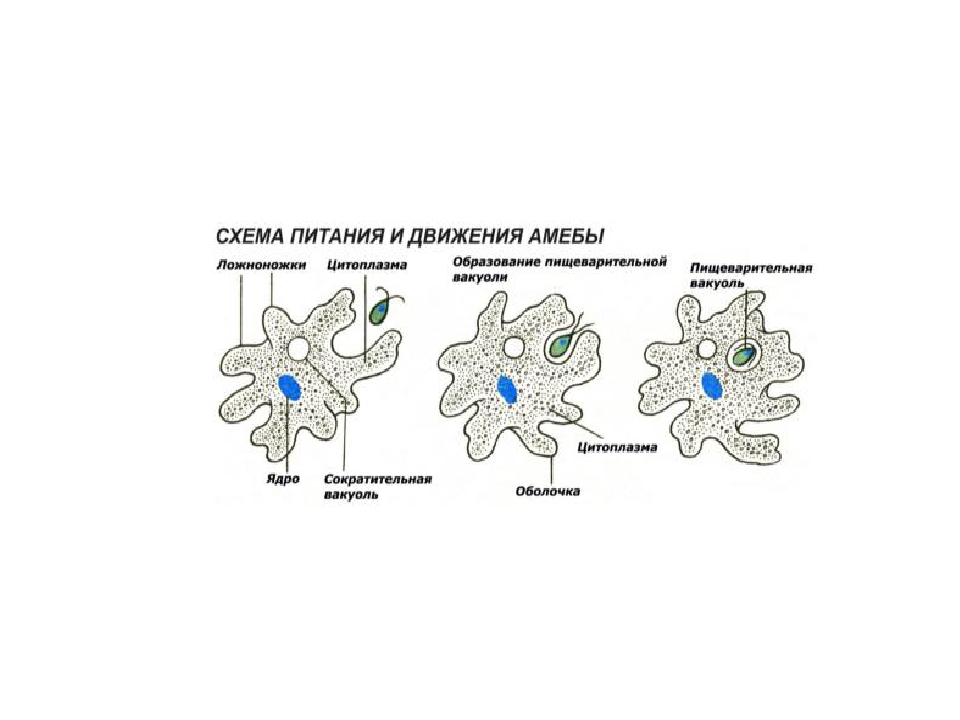 Исследование Declerck et al в 2007 году [24] показывает, что Acanthamoeba castellanii используется не только для внутриклеточной репликации, но и в качестве переносчика, подобного «троянскому коню» [12], а Neumeister et al [25] доказали, что внутриклеточная репликация в человеческих моноцитарных лейкоцитах увеличивается после заражения Acanthamoeba castellanii . Свободные простейшие не только выбирают признаки вирулентности, но также способствуют передаче Legionella spp человеку в интактных амебах или удаленных пузырьках [26].Способность Legionella spp сохраняться и колонизировать биопленку, а также паразитирование клеток амебы можно рассматривать как механизм выживания, но это может привести к серьезным последствиям для здоровья человека.
Исследование Declerck et al в 2007 году [24] показывает, что Acanthamoeba castellanii используется не только для внутриклеточной репликации, но и в качестве переносчика, подобного «троянскому коню» [12], а Neumeister et al [25] доказали, что внутриклеточная репликация в человеческих моноцитарных лейкоцитах увеличивается после заражения Acanthamoeba castellanii . Свободные простейшие не только выбирают признаки вирулентности, но также способствуют передаче Legionella spp человеку в интактных амебах или удаленных пузырьках [26].Способность Legionella spp сохраняться и колонизировать биопленку, а также паразитирование клеток амебы можно рассматривать как механизм выживания, но это может привести к серьезным последствиям для здоровья человека.
В текущем исследовании мы предоставляем информацию о применении Legionella на статических биопленках, состоящих из бактерий Legionella , отличных от , аналогичных бактериям, присутствующим в водных системах.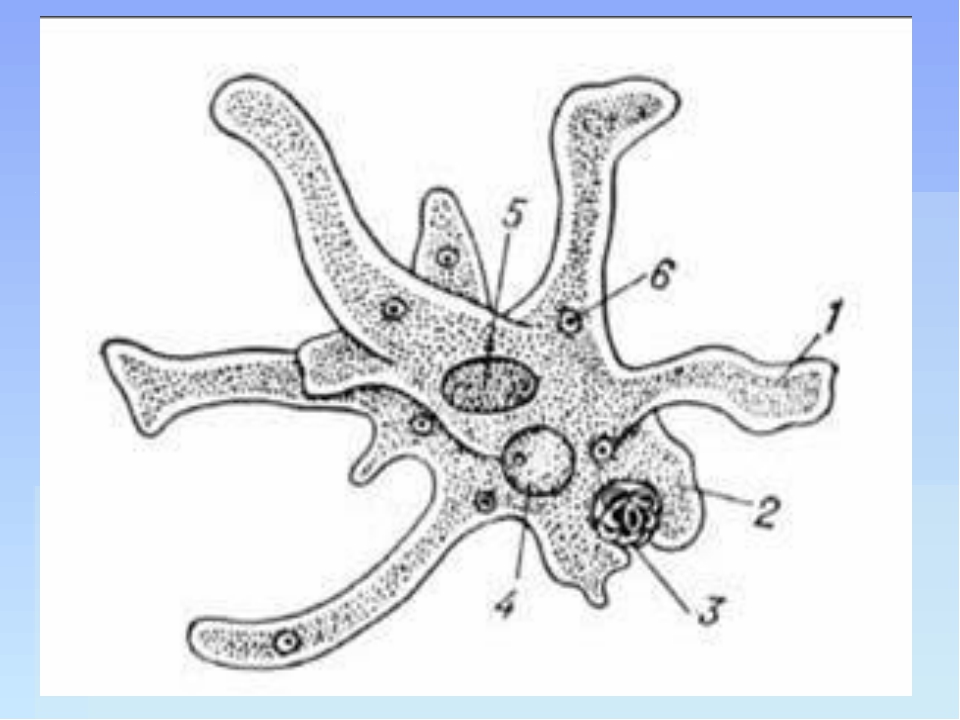 Мы сравнили поведение Legionella после культивирования в обычной среде, после заражения амеб или прохождения через мерцательные простейшие в условиях, близких к антропогенным водным сетям.
Мы сравнили поведение Legionella после культивирования в обычной среде, после заражения амеб или прохождения через мерцательные простейшие в условиях, близких к антропогенным водным сетям.
Экспериментальные процедуры
Штаммы и условия культивирования
Используемые штаммы Legionella — это L. pneumophila Lens (CIP 108286), клинический изолят, Paris (LG03), экологический изолят, и Legionella longbeachae (ATCC 33484). Плазмиду PSW001 или плазмиду pMMB207-KM14-GFPc [26], кодирующую белок DsRed и GFPMut2, использовали для трансформации бактерий. Legionella выращивали в среде BYE (забуференный дрожжевой экстракт) или BCYE (забуференный угольный дрожжевой экстракт) при 37 ° C с хлорамфениколом в концентрации 10 мкг / мл при необходимости.Эксперименты были проведены с L. pneumophila , экспрессирующим GFP или Ds-red, с аналогичными результатами.
Предварительно сформированные биопленки состояли из отобранных штаммов, обычно обнаруживаемых в антропогенных водных сетях [22].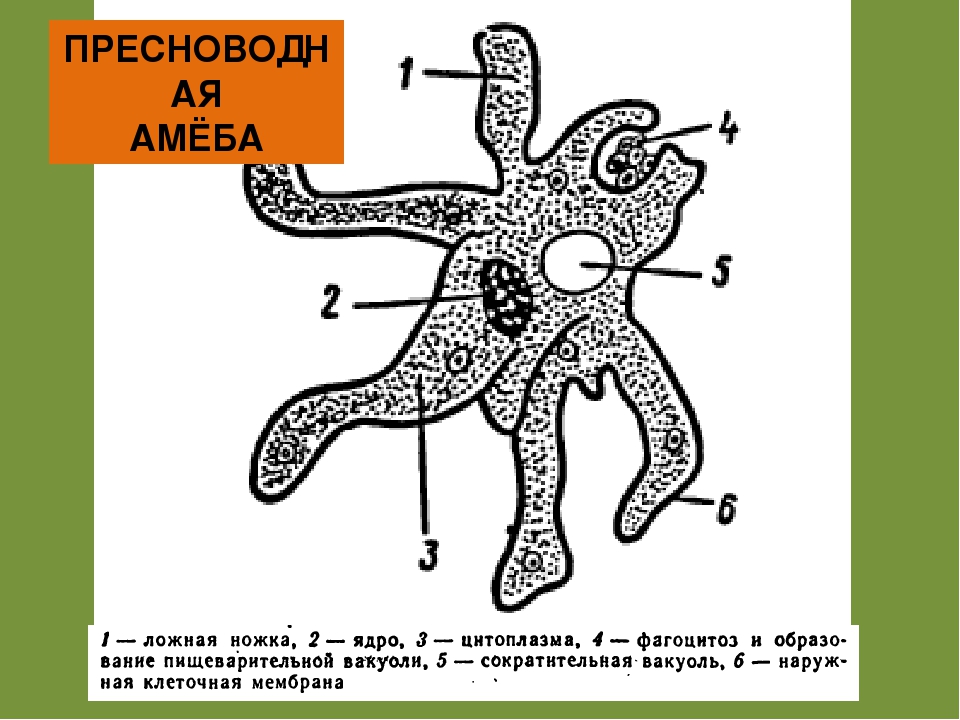 Бактериями, не относящимися к Legionella, были Aeromonas hydrophila (Библиотека микробиологического университета Гента, Бельгия (LMG 2844)), Escherichia coli (LMG 2092), Flavobacterium breve (LMG 4011) и Pseudomonas aeruginosa74 (LMG 124274). Эти штаммы выращивали в BHI (Brain Heart Infusion) при 37 ° C.
Бактериями, не относящимися к Legionella, были Aeromonas hydrophila (Библиотека микробиологического университета Гента, Бельгия (LMG 2844)), Escherichia coli (LMG 2092), Flavobacterium breve (LMG 4011) и Pseudomonas aeruginosa74 (LMG 124274). Эти штаммы выращивали в BHI (Brain Heart Infusion) при 37 ° C.
Acanthamoeba castellani 30254 [27] выращивали в среде PYG (Proteose Yeast Gluosis) [28] при 25 ° C, а Tetrahymena tropicalis культивировали в PCB (Plate count Broth) при комнатной температуре в темноте.
Препарат для внедрения
Legionella в биопленкуОписанный ниже препарат был реализован с тремя цитированными ранее штаммами Legionella .
«Средне выращенный» (MG)
Legionella , не нитчатое состояние. Legionella , выращенная в культуральной среде, продуцировала множество нитчатых клеток, часто более 40 мкм длиной, чего не происходит после их перехода в амебы или инфузории (данные не показаны). Легионелла нефиламентозная форма стационарной фазы выращивалась в соответствии с протоколом CNRL Lyon [10]. Затем бактерии суспендировали в стерильной минеральной воде (Evian). Поскольку хорошо известно, что истощение питательных веществ вызывает стационарную фазу у Legionella [29], [30], в этих условиях эти бактерии достигли стационарной формы и были названы бактериями «среднего роста».Флуоресценцию штаммов проверяли с помощью эпифлуоресцентной микроскопии.
Легионелла нефиламентозная форма стационарной фазы выращивалась в соответствии с протоколом CNRL Lyon [10]. Затем бактерии суспендировали в стерильной минеральной воде (Evian). Поскольку хорошо известно, что истощение питательных веществ вызывает стационарную фазу у Legionella [29], [30], в этих условиях эти бактерии достигли стационарной формы и были названы бактериями «среднего роста».Флуоресценцию штаммов проверяли с помощью эпифлуоресцентной микроскопии.
«Амёба выращенная» (AG)
Legionella . Амебы после 2 дней культивирования собирали и промывали буфером для амеб. Acanthamoeba помещали в контакт с Legionella после множественности заражения или MOI (множественность заражения) 0,1 и инкубировали при 30 ° C. Через 96 часов Legionella собирали центрифугированием при 10000 g в течение 10 минут.Осадок дважды промывали фильтрованной минеральной водой и ресуспендировали на вортексе. После центрифугирования препарату давали возможность выпасть в осадок в течение 10 мин и отбирали только верхнюю половину объема.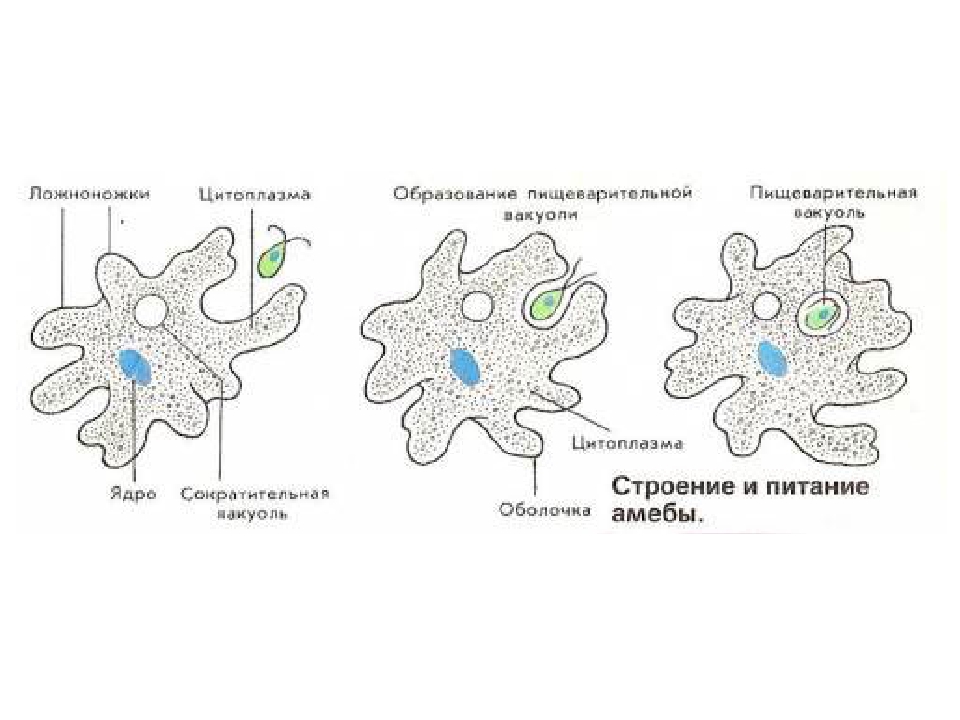 Отсутствие амебы и флуоресценцию Legionella проверяли с помощью эпифлуоресцентного микроскопа. В этих условиях эти бактерии были названы «Amoeba Growing» (AG).
Отсутствие амебы и флуоресценцию Legionella проверяли с помощью эпифлуоресцентного микроскопа. В этих условиях эти бактерии были названы «Amoeba Growing» (AG).
«Среднего роста»
Legionella , обработанная супернатантом AG (MG + Sur AG).После 24 часов инкубации при 37 ° C суспензию AG Legionella центрифугировали 5 минут при 10000 g и собирали бесклеточный супернатант. Супернатант (1 мл) добавляли к осадку из 1,10 8 клеток MG. После инкубации в течение 1 часа при 37 ° C суспензию Legionella центрифугировали при 4500 g в течение 15 минут и дважды промывали минеральной водой. Флуоресценцию Legionella проверяли с помощью эпифлуоресцентного микроскопа. В этих условиях эти бактерии были обозначены как «обработанные MG Legionella » (tMG).
«Ресничный взрослый» (CG)
Legionella . После 7 дней культивирования Tetrahymena tropicalis среду постепенно заменяли между центрифугированием трис-буфером Остерхаута [10].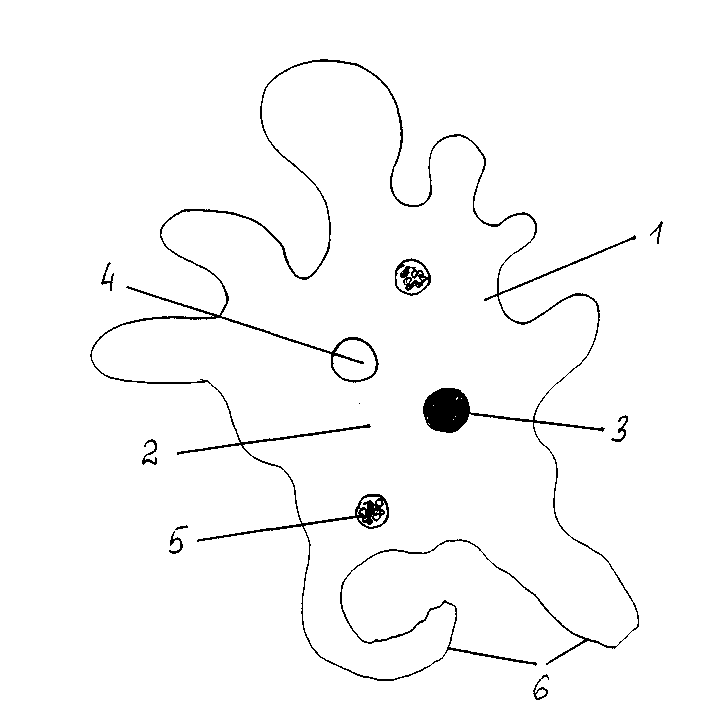 Legionella были добавлены с MOI 1000 бактерий на 1 простейшее. Через 96 часов суспензию центрифугировали и среду отбрасывали. Добавляли дистиллированную воду и оставляли на ночь в темноте. На следующий день воду удалили. Гранулы Legionella были разбиты с помощью шприцев 27 и 22 калибра.Разбитые гранулы и флуоресценцию Legionella контролировали с помощью эпифлуоресцентной микроскопии. В этих условиях эти бактерии и получили обозначение «Ciliate Grown» (CG).
Legionella были добавлены с MOI 1000 бактерий на 1 простейшее. Через 96 часов суспензию центрифугировали и среду отбрасывали. Добавляли дистиллированную воду и оставляли на ночь в темноте. На следующий день воду удалили. Гранулы Legionella были разбиты с помощью шприцев 27 и 22 калибра.Разбитые гранулы и флуоресценцию Legionella контролировали с помощью эпифлуоресцентной микроскопии. В этих условиях эти бактерии и получили обозначение «Ciliate Grown» (CG).
Алкианский синий тест
Лунки 6-луночных планшетов заполняли 2 мл стерильной минеральной воды. В каждую лунку инокулировали 2,10 9 Legionella и инкубировали 24 часа при 37 ° C без перемешивания. Супернатант удаляли и заменяли 1 мл Alcian blue 8G (Sigma-Aldrich) при 0.1% в дистиллированной воде. После 30 мин инкубации каждую лунку промывали трижды и добавляли 1 мл 33% уксусной кислоты. Поглощение измеряли при 595 нм.
Кристаллический фиолетовый тест
Первая часть теста была проведена как анализ альцианового синего.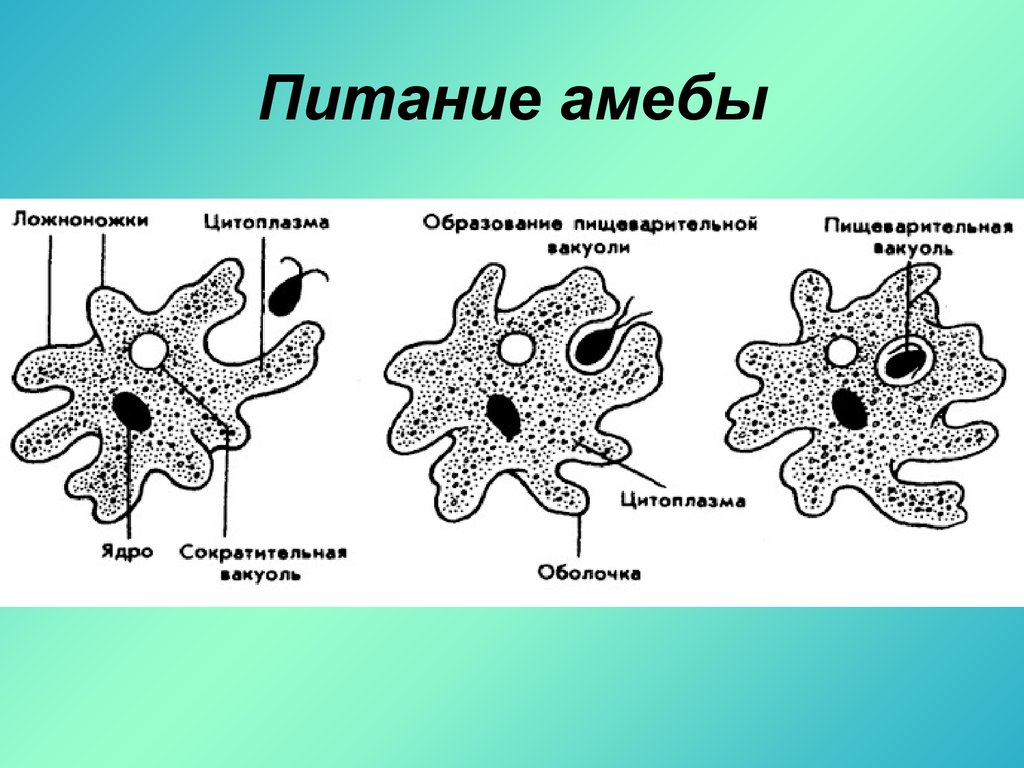 Супернатант лунок удаляли и заменяли 1 мл 0,3% Crystal Violet (Sigma-Aldrich) в дистиллированной воде. После 15 мин инкубации каждую лунку трижды промывали минеральной водой и добавляли 1 мл абсолютного этанола.Затем измеряли оптическую плотность при 595 нм.
Супернатант лунок удаляли и заменяли 1 мл 0,3% Crystal Violet (Sigma-Aldrich) в дистиллированной воде. После 15 мин инкубации каждую лунку трижды промывали минеральной водой и добавляли 1 мл абсолютного этанола.Затем измеряли оптическую плотность при 595 нм.
Legionella выращивали на BCYE в течение 72 часов и суспендировали путем удаления с чашек 50 мл стерильной бидистиллированной воды. Суспензию клеток центрифугировали в холодном роторе (4 ° C) при 5500 g в течение 10 мин. Супернатант отбрасывали, а осадок трижды промывали каждый раз половиной объема воды. Последний объем был добавлен, чтобы получить концентрацию 2.10 11 клеток / мл. Суспензию бактерий разливали в 50 мкл и переносили в холодную кювету для электропорации. После добавления 200 мкг плазмидной ДНК проводили электропорацию с использованием аппарата Gene Pulser. Один мл BYE добавляли после импульса и инкубировали при 37 ° C без перемешивания.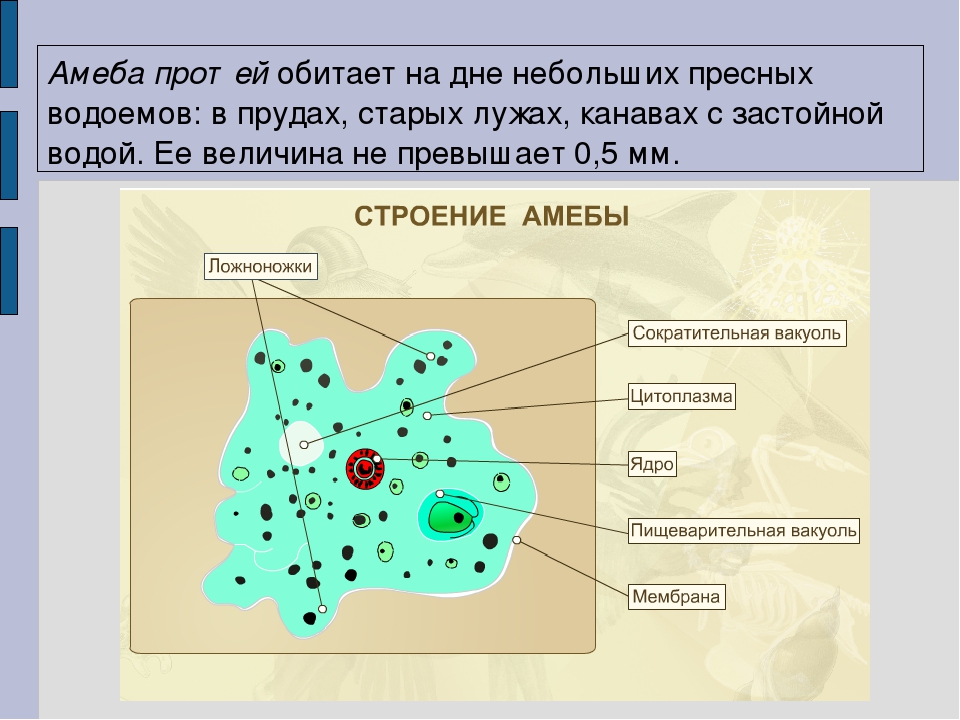 Через один час 100 мкл суспензии наносили на планшеты BCYE, содержащие хлорамфеникол. Трансформанты подтверждали наличием плазмидной ДНК с помощью электрофореза в 0,4% агарозных гелях.
Через один час 100 мкл суспензии наносили на планшеты BCYE, содержащие хлорамфеникол. Трансформанты подтверждали наличием плазмидной ДНК с помощью электрофореза в 0,4% агарозных гелях.
Микроскопия
Развитие биопленок.
Биопленки были изготовлены в 12-луночных планшетах со стеклянным дном, адаптированным для конфокальной микроскопии. В каждую лунку вносили 2 мл BHI, разведенного 1/100 минеральной водой (для достижения концентрации органического вещества, эквивалентной речной воде). В лунки инокулировали 5,10 6 бактерий каждого из четырех штаммов Legionella , отличных от , из предварительного культивирования в течение ночи. Планшеты инкубировали в течение 15 дней при 37 ° C, меняя среду каждые четыре дня.Затем среду удаляли и заменяли 2 мл фильтрованной минеральной воды. Затем биопленки засевали 1,10 7 клеток Legionella различных типов (MG, AG и CG) и планшеты инкубировали в течение 7 дней при 37 ° C. Микроскопические наблюдения проводились каждые 24 часа.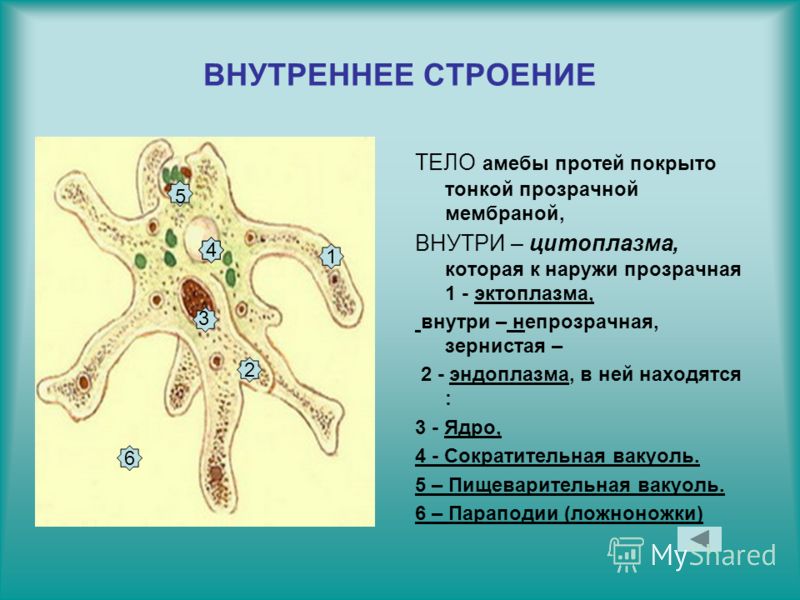
Окрашивание.
Лунки промыли минеральной водой для удаления неприлипающих Legionella . Для маркировки экзополисахаридной матрицы добавляли конъюгат конканавалина A AlexaFluor 350 (Invitrogen) в соответствии с рекомендациями производителя, и лунки инкубировали 20 минут при 37 ° C, а затем промывали минеральной водой.Draq 5 (Biostatus) был добавлен для окрашивания всех бактерий в соответствии с рекомендациями поставщика.
Наблюдение и обработка.
Наблюдения проводились на эпифлуоресцентном микроскопе Axio Observer A1 (Zeiss), оборудованном Apotome. Этот модуль позволяет структурированное освещение. Микроскоп оснащен ртутной лампой и фильтрами, специфичными для DAPI (Zeiss Filter Set 49), FITC (Zeiss Filter Set 44), Cy3 (Zeiss Filter Set 43) и Cy5 (Zeiss Filter Set 50), а также Plan Neofluar 1.25 масляный иммерсионный объектив (Zeiss). Изображения были получены с помощью программного обеспечения AxioVision и обработаны с помощью программного обеспечения Imasis7. 4.1 и Zen (Zeiss).
4.1 и Zen (Zeiss).
ПЦР.
Экстракции ДНК проводили с использованием набора High Pure PCR Template Kit (Roche) в соответствии с рекомендациями поставщика. Используемые праймеры перечислены в таблице 1. Условия ПЦР были следующими: этап начальной денатурации при 94 ° C в течение 5 минут, а затем 30 циклов при 94 ° C в течение 30 секунд, отжиг праймеров при 60 ° C в течение 30 секунд и полимераза. удлинение при 72 ° C в течение 60 сек.
Количественная ПЦР.
Экстракции ДНК проводили с использованием набора High Pure PCR Template Kit (Roche) в соответствии с рекомендациями поставщика. КПЦР выполняли с праймерами, специфичными для гена mip (mipA1, mipA2, описанные Jonas et al [31], с набором ДНК Light Cycler FastStart, SybrGreen Master и Light Cycler 32 лунки в соответствии с рекомендациями производителя.
Результаты
Внедрение
Legionella на многовидовые биопленки Ранее [32] было показано, что Legionella pneumophila способна колонизировать предварительно сформированные биопленки, состоящие из четырех водных бактерий Aeromonas hydrophila , Escherichia coli , Flavobacterium breve и Pseudomonas aeruginosa , обычно присутствующих в та же водная среда, что и L. pneumophila [12], [14], [18], [32] — [34]. Таким образом, мы приготовили биопленки, состоящие из этих бактерий, на стеклянной подложке, закрепленной под 12-луночным микропланшетом, и использовали среду BHI, разбавленную в 100 раз минеральной водой Evian. Действительно, недавно было показано [35], что минеральный состав этой воды особенно приспособлен для образования биопленок у L. pneumophila . Каждые 4 дня среду обновляли. Во всех испытанных условиях Legionella были описаны как высокомобильные [36], [37].
pneumophila [12], [14], [18], [32] — [34]. Таким образом, мы приготовили биопленки, состоящие из этих бактерий, на стеклянной подложке, закрепленной под 12-луночным микропланшетом, и использовали среду BHI, разбавленную в 100 раз минеральной водой Evian. Действительно, недавно было показано [35], что минеральный состав этой воды особенно приспособлен для образования биопленок у L. pneumophila . Каждые 4 дня среду обновляли. Во всех испытанных условиях Legionella были описаны как высокомобильные [36], [37].
Через 15 дней Ds-красные флуоресцентные клетки хрусталика L. pneumophila , приготовленные из культуральной среды BYE, названной «Medium Grown» (MG), или после выращивания в пределах Acathamoeba castelanii , «Amoeba Grown» (AG) или внутри реснитчатых простейшие, Tetrahymena tropicalis , «Ресничный рост» (CG) были добавлены к предварительно сформированным биопленкам, и среда была заменена стерильной минеральной водой (Evian). В течение одной недели MG L. pneumophila закрепился в предварительно сформированных биопленках в виде отдельных клеток, которые были глобально распространены по всей поверхности биопленки штаммов Legionella , отличных от (рисунок 1A).Поперечная визуализация (рис. 2) продемонстрировала, что ни одна из клеток L. pneumophila не была обнаружена внутри структуры биопленки, но все они были расположены на поверхности биопленки. Такие же результаты были получены с CG L. pneumophila, (рис. 1C). Аналогичным образом, AG L. pneumophila были обнаружены только на поверхности биопленки (рис. 1B) и никогда не были обнаружены глубже внутри структуры. Однако, в отличие от бактерий MG, AG L. pneumophila казались агрегированными, а не отдельными клетками.Такие же результаты были получены для L. pneumophila Paris и L. longbeachae (не показаны).
В течение одной недели MG L. pneumophila закрепился в предварительно сформированных биопленках в виде отдельных клеток, которые были глобально распространены по всей поверхности биопленки штаммов Legionella , отличных от (рисунок 1A).Поперечная визуализация (рис. 2) продемонстрировала, что ни одна из клеток L. pneumophila не была обнаружена внутри структуры биопленки, но все они были расположены на поверхности биопленки. Такие же результаты были получены с CG L. pneumophila, (рис. 1C). Аналогичным образом, AG L. pneumophila были обнаружены только на поверхности биопленки (рис. 1B) и никогда не были обнаружены глубже внутри структуры. Однако, в отличие от бактерий MG, AG L. pneumophila казались агрегированными, а не отдельными клетками.Такие же результаты были получены для L. pneumophila Paris и L. longbeachae (не показаны).
Рис. 1. Визуализация апотома через 7 дней после укоренения L. pneumophila Линза A) MG, B) AG и C) CG в биопленке, предварительно сформированной с помощью четырех штаммов, не относящихся к Legionella, в течение 15 дней из водных сетей.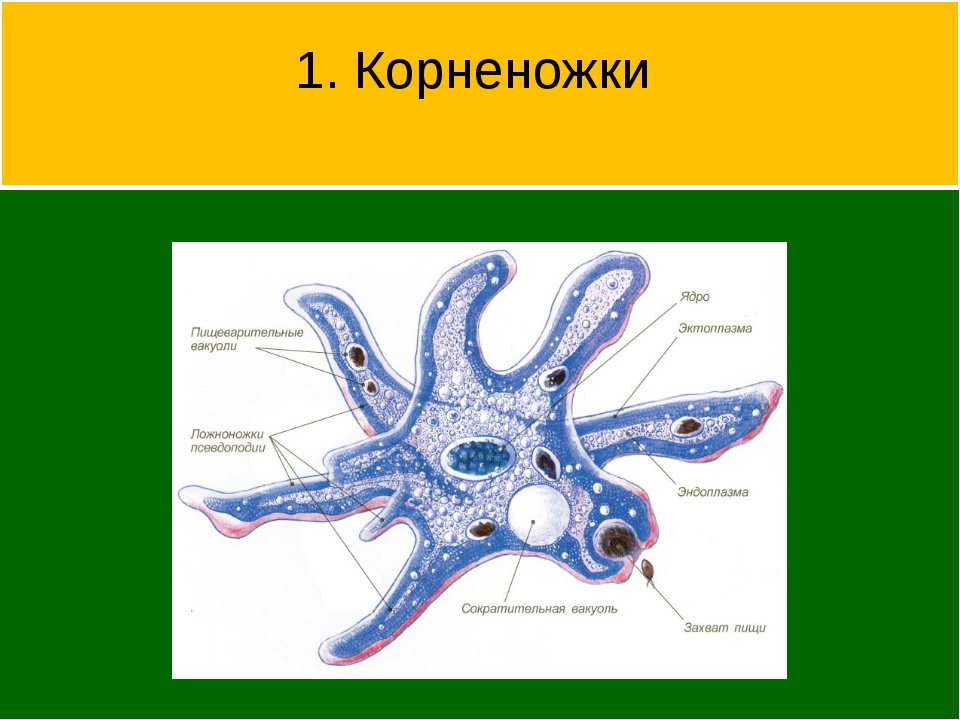
L. pneumophila , экспрессирующая маркер Ds-Red, проявляется в красном цвете, а бактерии Legionella , отличные от , отмечены с помощью окрашивания Draq5 зеленым цветом. Изображения представляют 3 независимых эксперимента.
https://doi.org/10.1371/journal.pone.0077875.g001
Рис. 2. Ортогональные виды изображений апотома, через 7 дней после укоренения L. pneumophila Линза A) MG и B) AG в биопленке. -образован с четырьмя штаммами, не относящимися к Legionella, в течение 15 дней из водопроводных сетей.
L. pneumophila , экспрессирующая маркер Ds-Red, проявляется в красном цвете, а бактерии Legionella , отличные от , отмечены с помощью окрашивания Draq5 зеленым цветом.
https: // doi.org / 10.1371 / journal.pone.0077875.g002
При инокулировании моновидовых биопленок, предварительно сформированных каждым из четырех штаммов Legionella , отличных от , MG и AG L. pneumophila имели такое же поведение, как и у мультивидов. биопленки, а именно отдельные клетки для MG Legionella и кластеры для AG Legionella (рис. 3). Эти результаты показывают, что ни один из четырех штаммов, составляющих предварительно сформированную биопленку, не может быть конкретно вовлечен в различия в укоренении, наблюдаемые для типов L.Ашхабад .
pneumophila имели такое же поведение, как и у мультивидов. биопленки, а именно отдельные клетки для MG Legionella и кластеры для AG Legionella (рис. 3). Эти результаты показывают, что ни один из четырех штаммов, составляющих предварительно сформированную биопленку, не может быть конкретно вовлечен в различия в укоренении, наблюдаемые для типов L.Ашхабад .
Рис. 3. Визуализация апотома через 7 дней после создания L. pneumophila Lens MG в биопленке, предварительно сформированной с каждым из четырех штаммов, не являющихся Legionella, в течение 15 дней из водных сетей.
Учреждение в A) Pseudomonas aeuginosa , B) Flavobacterium breve , C) Aeromonas hydrophila и D) Escherichia coli . L. pneumophila , экспрессирующая маркер Ds-Red, проявляется в красном цвете, а бактерии Legionella , отличные от , отмечены с помощью окрашивания Draq5 зеленым цветом.
https://doi. org/10.1371/journal.pone.0077875.g003
org/10.1371/journal.pone.0077875.g003
Образование моновидовой биопленки
L. pneumophilaЧтобы определить, зависели ли наблюдаемые фенотипы L. pneumophila в биопленке от существования предварительно сформированной биопленки, оба типа L. pneumophila , MG и AG, были непосредственно инокулированы на стеклянные поверхности, закрепленные на поверхности. дно лунок микропланшета. Клетки MG L. pneumophila (фиг. 4A) оказались рассредоточенными на поверхности стекла, и эта биопленка оказалась очень тонкой, около 8 мкм, с большими площадями, лишенными прикрепленных клеток.Напротив, биопленка, полученная из AG L. pneumophila (рис. 4B), казалась более толстой и представляла собой плотно упакованные бактерии, разделенные открытыми структурами.
Рисунок 4. Визуализация апотома через 7 дней развития биопленки на стеклянной поверхности линзы L. pneumophila A) MG C) AG и полисахаридов, продуцируемых B) MG и D) AG L.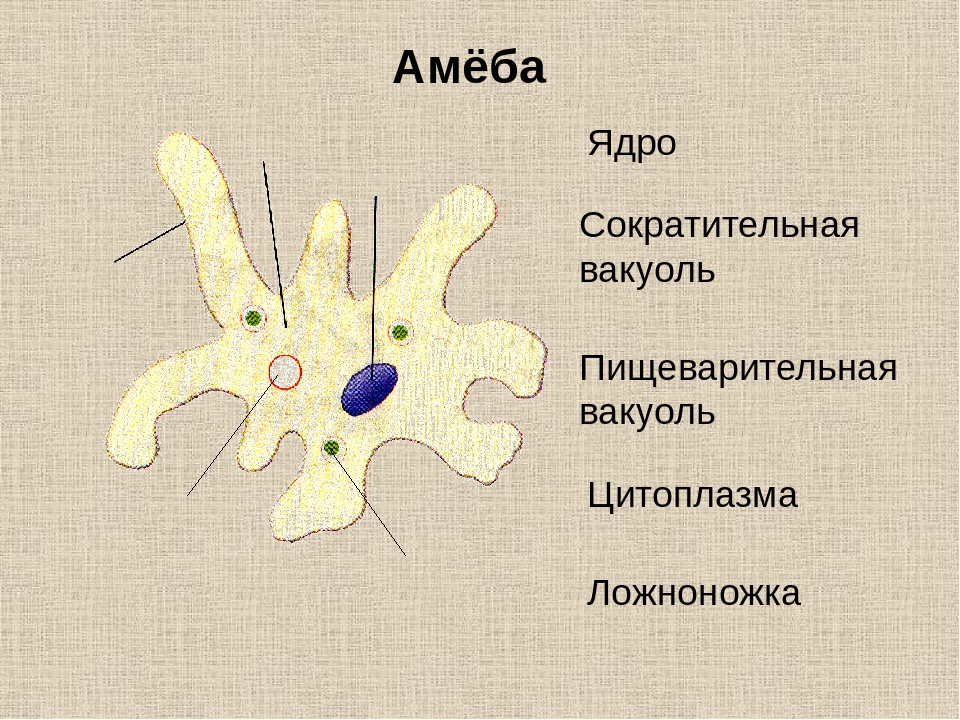 pneumophila Lens.
pneumophila Lens.
Легионелла зеленого цвета, а полисахариды синего цвета. Изображения представляют 6 независимых экспериментов.
https://doi.org/10.1371/journal.pone.0077875.g004
Более того, в то время как полисахариды были плохо обнаружены в биопленке MG L. pneumophila (рисунок 4A), этот тип макромолекул в изобилии присутствовал в AG Биопленка L. pneumophila (выделена синим цветом на рисунках 4B и 4C), предпочтительно обнаруживаемая вокруг скоплений бактерий.
Чтобы проверить, были ли обнаруженные полисахариды синтезированы заново L.pneumophila и не происходило из A. castelanii, количество полисахарида определяли с использованием Alcian Blue. Количество полисахарида было слишком низким для обнаружения в MG, а также в суспензиях AG L. pneumophila , используемых для засева лунок микропланшета (2,10 9 клеток), что указывает на то, что он был синтезирован бактериями во время образования биопленки.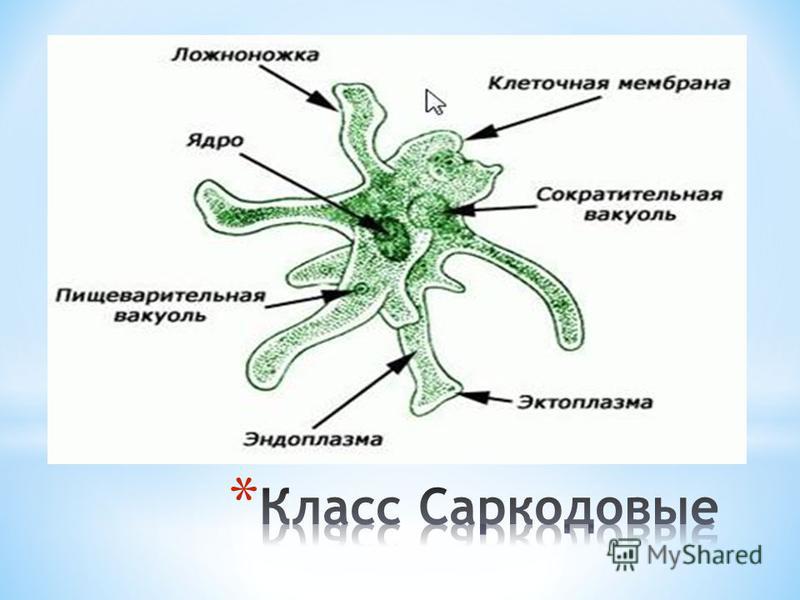 Более того, было обнаружено, что количество вновь синтезированного полисахарида через один день было в 2,78 раза выше для AG L.pneumophila , чем MG L. pneumophila (рис. 5), что подтвердило микроскопический анализ.
Более того, было обнаружено, что количество вновь синтезированного полисахарида через один день было в 2,78 раза выше для AG L.pneumophila , чем MG L. pneumophila (рис. 5), что подтвердило микроскопический анализ.
Рис. 5. Результаты теста альцианового синего после 24 9 MG и AG L. pneumophila Lens в минеральной воде Evian.
Планки погрешностей указывают стандартное отклонение от шести независимых экспериментов. Значение p меньше 0,0001, это различие считается чрезвычайно статистически значимым.
https://doi.org/10.1371/journal.pone.0077875.g005
L. pneumophila происхождение кластеров Мы предположили, что бактериальные кластеры, наблюдаемые для AG L. pneumophila , могут образовываться в клетке амебы до высвобождения бактерий в среду или путем агрегации только после высвобождения L. pneumophila на очень ранней стадии развития. образование биопленки. Суспензия AG L. pneumophila появлялась только в виде изолированных клеток (фиг. 6). Никаких бактериальных кластеров в этом эксперименте не наблюдалось, независимо от L.pneumophila , Lens (фиг.4), Paris (не показано) или L. longbeachae (не показано). Это указывает на то, что агрегация произошла после выхода из амебы.
pneumophila появлялась только в виде изолированных клеток (фиг. 6). Никаких бактериальных кластеров в этом эксперименте не наблюдалось, независимо от L.pneumophila , Lens (фиг.4), Paris (не показано) или L. longbeachae (не показано). Это указывает на то, что агрегация произошла после выхода из амебы.
Рисунок 6. Эпифлуоресцентная микроскопия, наблюдение за линзой L. pneumophila , экспрессирующей маркер ds-Red (красным), сразу после высвобождения амеб.
Изображение представляет 2 независимых эксперимента.
https://doi.org/10.1371/journal.pone.0077875.g006
Чтобы проверить, возникли ли кластеры в результате агрегации бактерий или размножения из одной клетки, GFP и Ds-Red, экспрессирующие AG L.pneumophila перед распределением по поверхности стекла перемешивали. Полученные кластеры (рис. 7) состояли из клеток обоих типов, зеленого и красного, что указывает на то, что они произошли в результате агрегации, а не деления клеток. Кроме того, мы наблюдали большое количество желтых пятен, соответствующих совместной локализации зеленых и красных клеток. Тот же эксперимент, проведенный с MG L. pneumophila , показал только изолированные зеленые и эритроциты, однородно распределенные по всей поверхности стекла (рис. 7).
Кроме того, мы наблюдали большое количество желтых пятен, соответствующих совместной локализации зеленых и красных клеток. Тот же эксперимент, проведенный с MG L. pneumophila , показал только изолированные зеленые и эритроциты, однородно распределенные по всей поверхности стекла (рис. 7).
Рис. 7. Визуализация апотома через 7 дней развития биопленки на стеклянной поверхности смеси A) AG L. pneumophila или B) MG L. pneumophila Lens, экспрессирующей маркер Ds-Red (красный) или GFP маркер (зеленый) и полисахариды (синий).
Изображения представляют 3 независимых эксперимента.
https://doi.org/10.1371/journal.pone.0077875.g007
Более того, отсутствие размножения L. pneumophila было подтверждено с помощью анализа кПЦР, поскольку количество MG и бактерий AG было одинаковым, после одной недели развития биопленки, чем в исходной суспензии (рисунок 8).Declerck et al (2005) показывают, что увеличение количества буфера амебы для L. pneumophila , отдельно или с теми же четырьмя штаммами, отличными от Legionella , было связано только с внутриклеточным размножением патогена человека [32].
pneumophila , отдельно или с теми же четырьмя штаммами, отличными от Legionella , было связано только с внутриклеточным размножением патогена человека [32].
Рисунок 8. Результаты кПЦР-амплификации гена mip из MG и AG. L. pneumophila . Линза, нанесенная на поверхность стекла в минеральной воде Evian при Т = 0 и Т = 7 дней.
Планки погрешностей указывают стандартное отклонение от трех независимых экспериментов.Значение p равно 0,5913 для линзы AG L. pneumophila и 0,2709 для линзы MG L. pneumophila . Это не считается статистически значимым (NS).
https://doi.org/10.1371/journal.pone.0077875.g008
Взятые вместе, эти результаты предполагают, что L. pneumophila , размножавшаяся внутри амебы, после выхода в окружающую среду проявляла молекулярную фактор, вызывающий взаимное притяжение бактерий.
Фактор хемотаксиса
Чтобы проверить нашу гипотезу о хемотаксисе, GFP, экспрессирующий MG L.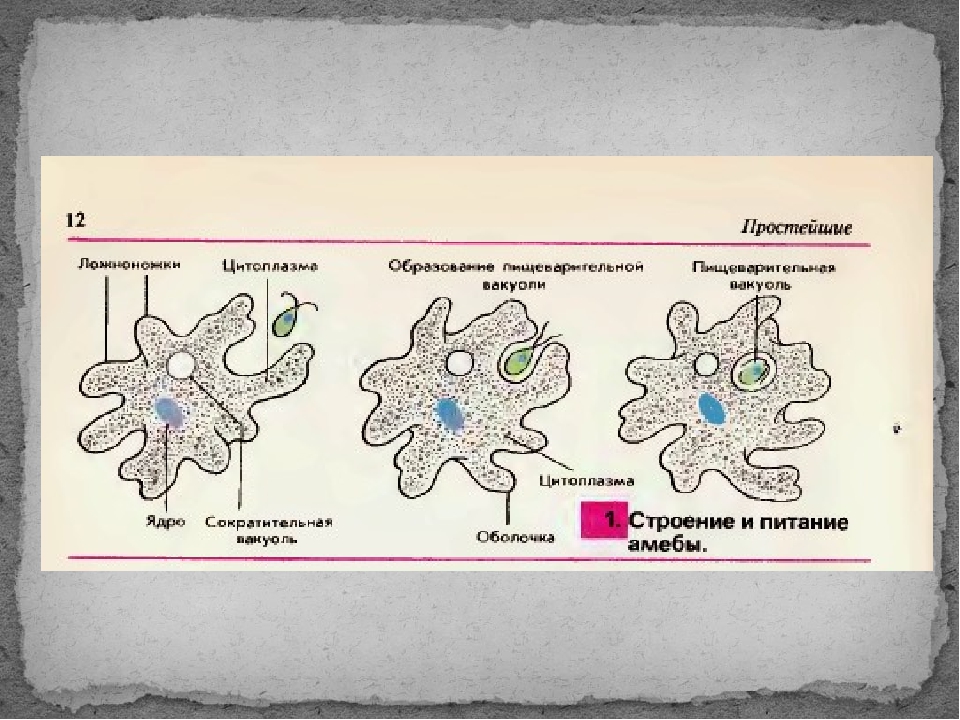 pneumophila , был добавлен к Ds-Red, экспрессирующему AG L. pneumophila перед инокуляцией стеклянной поверхности. Наблюдаемые скопления бактерий (фиг. 9) состояли из AG L. pneumophila , выделенного красным цветом, покрытого MG L. pneumophila , зеленого цвета. Этот результат показывает, что фактор «хемотаксиса», экспрессируемый бактериями AG, был способен привлечь MG L.Ашхабад . Интересно отметить, что эти «гибридные» кластеры были частично встроены во вновь синтезированные полисахариды (синим цветом, рисунок 9).
pneumophila , был добавлен к Ds-Red, экспрессирующему AG L. pneumophila перед инокуляцией стеклянной поверхности. Наблюдаемые скопления бактерий (фиг. 9) состояли из AG L. pneumophila , выделенного красным цветом, покрытого MG L. pneumophila , зеленого цвета. Этот результат показывает, что фактор «хемотаксиса», экспрессируемый бактериями AG, был способен привлечь MG L.Ашхабад . Интересно отметить, что эти «гибридные» кластеры были частично встроены во вновь синтезированные полисахариды (синим цветом, рисунок 9).
Рисунок 9. Визуализация апотома через 7 дней развития биопленки на стеклянной поверхности смеси L. pneumophila линзы AG, экспрессирующей маркер ds-Red (красный) и маркер GFP MG (зеленый).
Полисахариды отображаются синим цветом. Изображения представляют 3 независимых эксперимента. Шкала соответствует 10 мкм.
https://doi.org/10.1371/journal.pone.0077875.g009
Для подтверждения продуцирования фактора линзы MG Legionella pneumophila обрабатывали супернатантом AG Legionella, а затем инокулировали в чашки.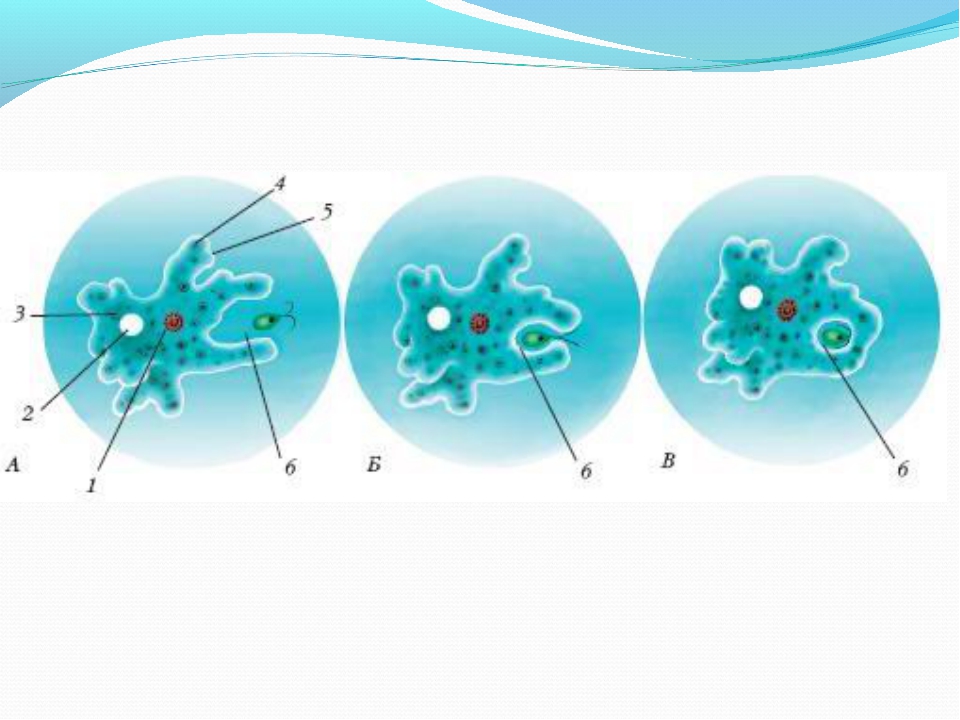 После 7 дней инкубации были видны агрегаты Legionella (фиг. 10) с присутствием большого количества экзо-полисахаридов. Эти Legionella приобрели ту же способность образовывать биопленку, что и AG Legionella , что позволяет предположить, что последняя секретировала соединение, которое может индуцировать фенотип AG.Более того, этот результат подтверждает, что наблюдаемые экзополисахариды продуцировались Legionella pneumophila , а не амебой.
После 7 дней инкубации были видны агрегаты Legionella (фиг. 10) с присутствием большого количества экзо-полисахаридов. Эти Legionella приобрели ту же способность образовывать биопленку, что и AG Legionella , что позволяет предположить, что последняя секретировала соединение, которое может индуцировать фенотип AG.Более того, этот результат подтверждает, что наблюдаемые экзополисахариды продуцировались Legionella pneumophila , а не амебой.
Рис. 10. Визуализация апотома через 7 дней развития биопленки на стеклянной поверхности A) L. pneumophila Линза, обработанная супернатантом линзы AG L. pneumophila или B) супернатантом AG L. longbeachae .
Бактерии показаны красным цветом, а полисахариды — синим. Изображения представляют 3 независимых эксперимента.
https://doi.org/10.1371/journal.pone.0077875.g010
Эти результаты предполагают наличие системы, аналогичной распознаванию кворума. Система зондирования кворума Legionella , названная lqs , была описана Спиригом и др. [38]. Было показано, что эта система отсутствует у Legionella longbeachae [33], [39] — [42]. Во-первых, был проведен ПЦР-анализ для проверки наличия различных генов lqs в линзе Legionella pneumophila , использованной в качестве положительного контроля, и Legionella longbeachae (ATCC 33484) (фигура 11).Результаты амплификации подтвердили отсутствие lqs A, R и S из Legionella longbeachae . Чтобы определить, соответствует ли обнаруженная здесь индукционная система системе lqs , мы провели эксперимент, в котором линзы MG L. pneumophila обрабатывали супернатантом AG L. longbeachae , затем суспендировали в минеральной воде и наносили на стекло. тарелка. После 7 дней инкубации наблюдались агрегаты Legionella , аналогичные тем, которые были получены с Legionella AG, и присутствие экзополисахаридов (фигура 10 B).
Система зондирования кворума Legionella , названная lqs , была описана Спиригом и др. [38]. Было показано, что эта система отсутствует у Legionella longbeachae [33], [39] — [42]. Во-первых, был проведен ПЦР-анализ для проверки наличия различных генов lqs в линзе Legionella pneumophila , использованной в качестве положительного контроля, и Legionella longbeachae (ATCC 33484) (фигура 11).Результаты амплификации подтвердили отсутствие lqs A, R и S из Legionella longbeachae . Чтобы определить, соответствует ли обнаруженная здесь индукционная система системе lqs , мы провели эксперимент, в котором линзы MG L. pneumophila обрабатывали супернатантом AG L. longbeachae , затем суспендировали в минеральной воде и наносили на стекло. тарелка. После 7 дней инкубации наблюдались агрегаты Legionella , аналогичные тем, которые были получены с Legionella AG, и присутствие экзополисахаридов (фигура 10 B).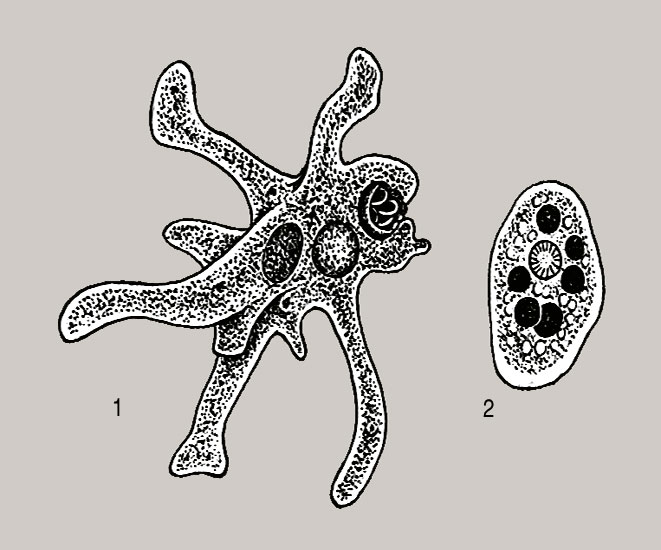 Таким образом, несмотря на отсутствие системы lqs в L. longbeachae , включая lqsA , кодирующую фермент, ответственный за синтез аутоиндуктора LAI-1, был индуцирован фенотип биопленки. Эти предварительные результаты предполагают существование другой системы распознавания кворума у Legionella внутри и между видами.
Таким образом, несмотря на отсутствие системы lqs в L. longbeachae , включая lqsA , кодирующую фермент, ответственный за синтез аутоиндуктора LAI-1, был индуцирован фенотип биопленки. Эти предварительные результаты предполагают существование другой системы распознавания кворума у Legionella внутри и между видами.
Обсуждение
В многочисленных исследованиях [13], [14], [18] было продемонстрировано, что L. pneumophila, , приготовленное из лабораторной культуральной среды, может внедряться в предварительно сформированную биопленку для бактерий.В первой части нашего исследования мы показали, что эта реализация также имела место для клеток Legionella , выпущенных из мерцательных простейших или амеб. И мы также показали, что Legionella оставалась стабильной через семь дней. Это может указывать на то, что Legionella не размножается в биопленке, как это было ранее предложено Мампелем и его коллегами [33], которые связали развитие L.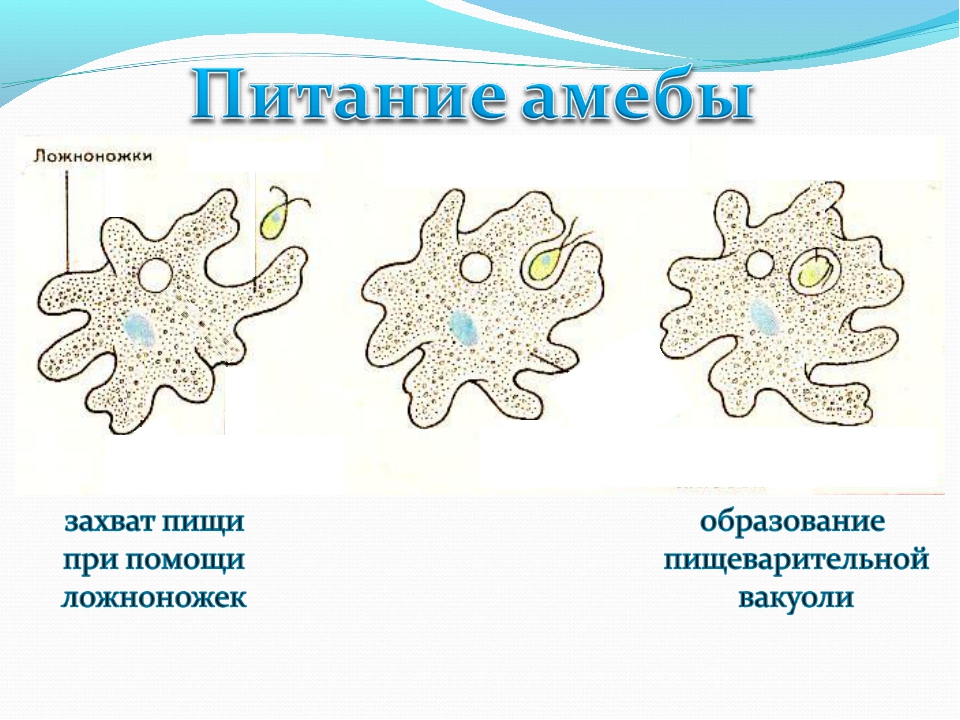 pneumophila в биопленке с адгезией планктонных бактерий, а не с клональной репликацией бактерий. сидячие клетки.Это согласуется с исследованием моновидовых биопленок Legionella Pecastaings и соавторов [43], которые продемонстрировали, что сидячая L. pneumophila способна расти в минимальной среде только при добавлении железа и цистеина, но не в ней. олиготрофная среда.
pneumophila в биопленке с адгезией планктонных бактерий, а не с клональной репликацией бактерий. сидячие клетки.Это согласуется с исследованием моновидовых биопленок Legionella Pecastaings и соавторов [43], которые продемонстрировали, что сидячая L. pneumophila способна расти в минимальной среде только при добавлении железа и цистеина, но не в ней. олиготрофная среда.
Каким бы ни было происхождение бактерий, в наших экспериментах клетки Legionella оказались расположенными на поверхности предварительно сформированной биопленки, что могло быть вполне нормальным, но также парадоксальным, учитывая, что матрица биопленки защищает бактерии от внешних стрессов.Это поверхностное расположение может быть связано с условиями наших экспериментов, поскольку наблюдения проводились всего через неделю после посева Legionella . Возможно, кинетика проникновения или захоронения Legionella в матрице биопленки требует большей продолжительности.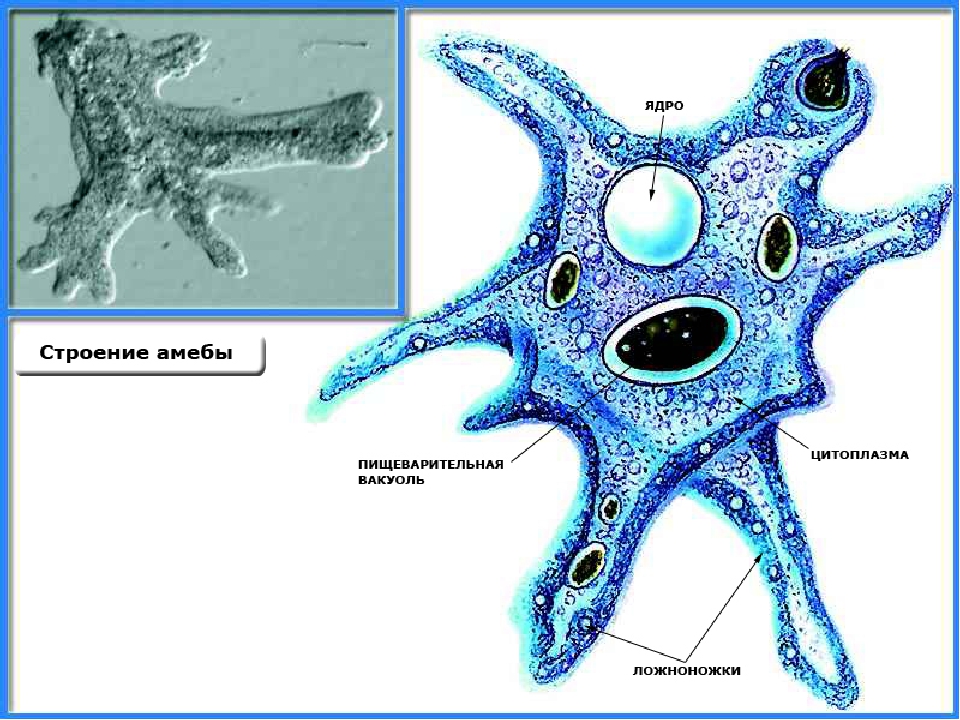 Однако можно также предположить, что это поверхностное расположение на биопленке является преимуществом с точки зрения способности Legionella расти на мертвых бактериях. В самом деле, вероятно, из-за своей потребности в L-цистеине, Legionella способна некротрофно питаться, таким образом, используя мертвые бактерии, простейшие или другую микрофлору для поддержания своего существования [16].В этих случаях Legionella pneumophila располагается на пограничном слое биопленки, что является преимуществом для этих привередливых организмов, позволяющих Legionella получить доступ к большему количеству питательных веществ [44]. Стресс, как и истощение питательных веществ, как в нашем эксперименте, был описан как способствующий принятию и привлечению новых членов в биопленку [45], [46]. С другой стороны, можно было бы предположить, что Legionella располагалась на поверхности биопленки, чтобы быть более доступной для выпаса амеб, а затем для последующего внутриамебного размножения.
Однако можно также предположить, что это поверхностное расположение на биопленке является преимуществом с точки зрения способности Legionella расти на мертвых бактериях. В самом деле, вероятно, из-за своей потребности в L-цистеине, Legionella способна некротрофно питаться, таким образом, используя мертвые бактерии, простейшие или другую микрофлору для поддержания своего существования [16].В этих случаях Legionella pneumophila располагается на пограничном слое биопленки, что является преимуществом для этих привередливых организмов, позволяющих Legionella получить доступ к большему количеству питательных веществ [44]. Стресс, как и истощение питательных веществ, как в нашем эксперименте, был описан как способствующий принятию и привлечению новых членов в биопленку [45], [46]. С другой стороны, можно было бы предположить, что Legionella располагалась на поверхности биопленки, чтобы быть более доступной для выпаса амеб, а затем для последующего внутриамебного размножения.
Другое важное наблюдение, которое мы сделали в этом исследовании, — это наличие агрегатов, конъюгированных с производством экзополисахаридов клетками «Amoeba Grown» (AG) Legionella , но не «Medium Grown» (MG). Более того, это поведение не связано с происхождением штамма, поскольку результаты, полученные с клиническим штаммом, L. pneumophila Lens, и штаммом, первоначально изолированным в окружающей среде, L. pneumophila Paris, а также L.longbeachae были такими же.
Сначала мы предположили, что эти бактериальные агрегаты соответствуют микроколониям, полученным после клонального размножения L. pneumophila после начальной адгезии на поверхности стекла или предварительно сформированной биопленки. Мы продемонстрировали, что агрегация зависит от взаимного притяжения бактерий, но только после того, как они выросли внутри амебы. Более того, это явно связано с фазой размножения, поскольку после пассажа в Tetrahymena tropicalis , где не наблюдали репликации, был получен фенотип, сходный с MG Legionella , а не AG. Можно предположить, что это скопление связано с производством молекулярного агента хемотаксиса, в частности, клетками Legionella , которые росли в амебе, и после их высвобождения в окружающую среду.
Можно предположить, что это скопление связано с производством молекулярного агента хемотаксиса, в частности, клетками Legionella , которые росли в амебе, и после их высвобождения в окружающую среду.
Мишенью этого притяжения могут быть сами бактериальные клетки, которые могут экспрессировать как фактор хемотаксиса, так и его предполагаемый специфический сенсор, причем последний индуцируется фактором, действующим как индуктор. В этом случае мы могли бы постулировать, что экспрессия сенсора уже индуцирована для бактерий AG, которые могут быстро собираться, тогда как MG Legionella экспрессирует сенсор с задержкой, когда индуцируется фактором хемотаксиса.Это могло бы затем объяснить, почему бактерии MG, по-видимому, покрывают поверхность кластеров AG, тогда как мы могли представить, что привлечение бактерий MG к клеткам AG привело к образованию двухцветных агрегатов, потому что оба типа клеток смешивались перед отложением. на стеклянной поверхности. Более того, фактор хемотатаксиса, по-видимому, зависит от внутриклеточной репликации, о чем свидетельствует его отсутствие в CG L.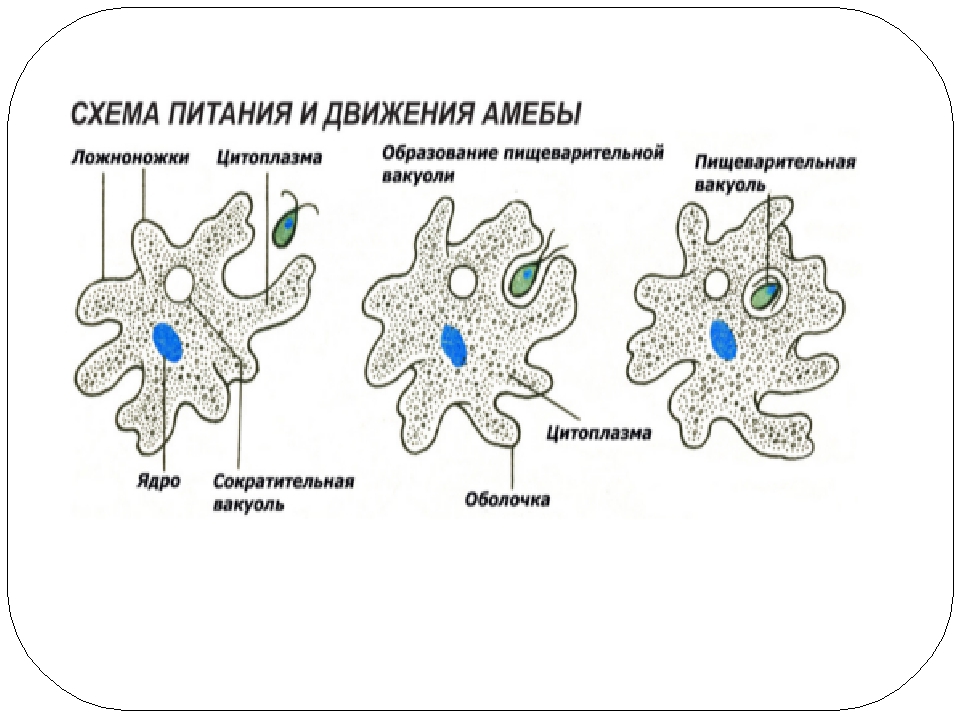 pneumophila .
pneumophila .
Система зондирования кворума L. pneumophila , включающая аутоиндуктор, LqsA, и датчик, LqsS, была описана ранее [40].Однако авторы показали, что гены, кодирующие такую систему, отсутствуют в геноме L. longbeachae [38]. Тем не менее, способность образовывать биопленку, приобретенную Legionella после ее внутриклеточного роста, наблюдалась в наших экспериментах с линзой MG L. pneumophila , обработанной супернатантом AG Legionella longbeachae , который не обладал генами lqs . Таким образом, фактор хемотаксиса отличается от фактора LAI-1. Тем не менее, с помощью этого исследования мы продемонстрировали существование новой системы распознавания кворума внутри и между видами.
Наконец, необходимо отметить, что AG L. pneumophila при прикреплении экспрессирует большие количества полисахаридов. Более того, поскольку клетки AG, но не клетки MG, продуцируют очень важные количества таких полисахаридов, это снова связано с пассажем внутри амебы.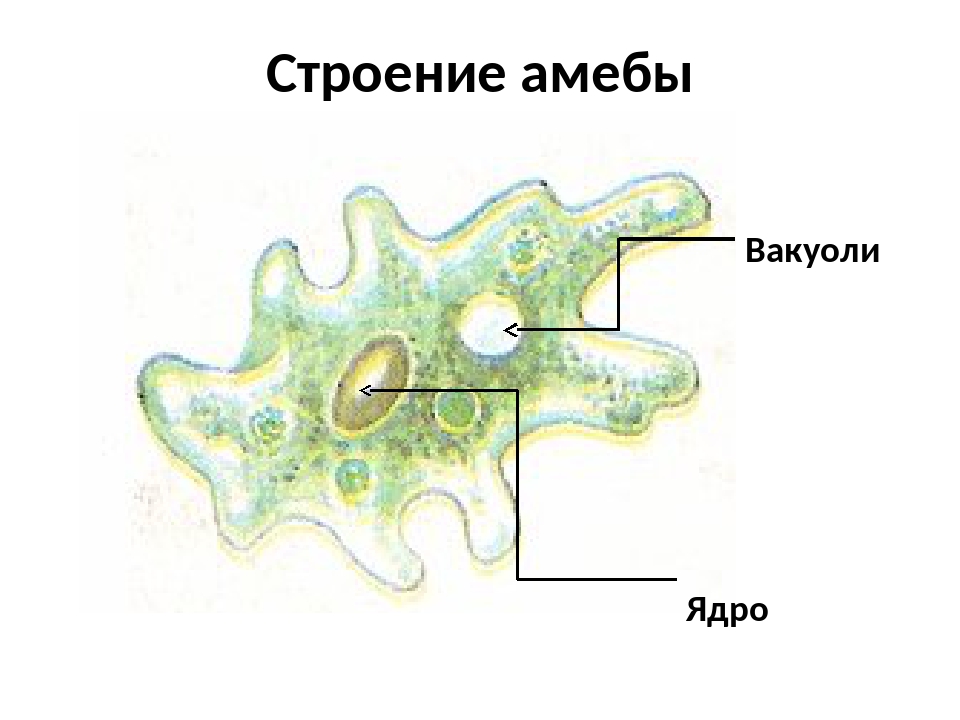 По нашему мнению, это явление разработано Legionella , выделенным из простейших, чтобы быстро защитить себя от внешних условий. Действительно, когда мы впервые попытались количественно определить L.pneumophila с использованием классического окрашивания кристаллическим фиолетовым (не показано), эти анализы всегда давали отрицательные результаты, тогда как количественная ПЦР, а также микроскопия демонстрировали присутствие биопленки. Таким образом, мы предположили, что полисахариды, в которые была встроена Legionella , могут улавливать кристаллический фиолетовый цвет, который не может окрашивать бактериальные клетки. Структура экзополисахарида должна быть охарактеризована. Однако, поскольку он был признан конканавалином A [47], [48] и Alcian Blue [49], [50], можно предположить, что он частично состоит из остатков глюкозы и / или маннозы.
По нашему мнению, это явление разработано Legionella , выделенным из простейших, чтобы быстро защитить себя от внешних условий. Действительно, когда мы впервые попытались количественно определить L.pneumophila с использованием классического окрашивания кристаллическим фиолетовым (не показано), эти анализы всегда давали отрицательные результаты, тогда как количественная ПЦР, а также микроскопия демонстрировали присутствие биопленки. Таким образом, мы предположили, что полисахариды, в которые была встроена Legionella , могут улавливать кристаллический фиолетовый цвет, который не может окрашивать бактериальные клетки. Структура экзополисахарида должна быть охарактеризована. Однако, поскольку он был признан конканавалином A [47], [48] и Alcian Blue [49], [50], можно предположить, что он частично состоит из остатков глюкозы и / или маннозы.
Чтобы подтвердить основную важность экзополисахарида Legionella в развитии биопленок, можно предложить охарактеризовать его, а затем провести поиск генов, кодирующих потенциальные гликозилтрансферазы, которые участвуют в производстве таких полимеров, путем скрининга генома L Пневмофила .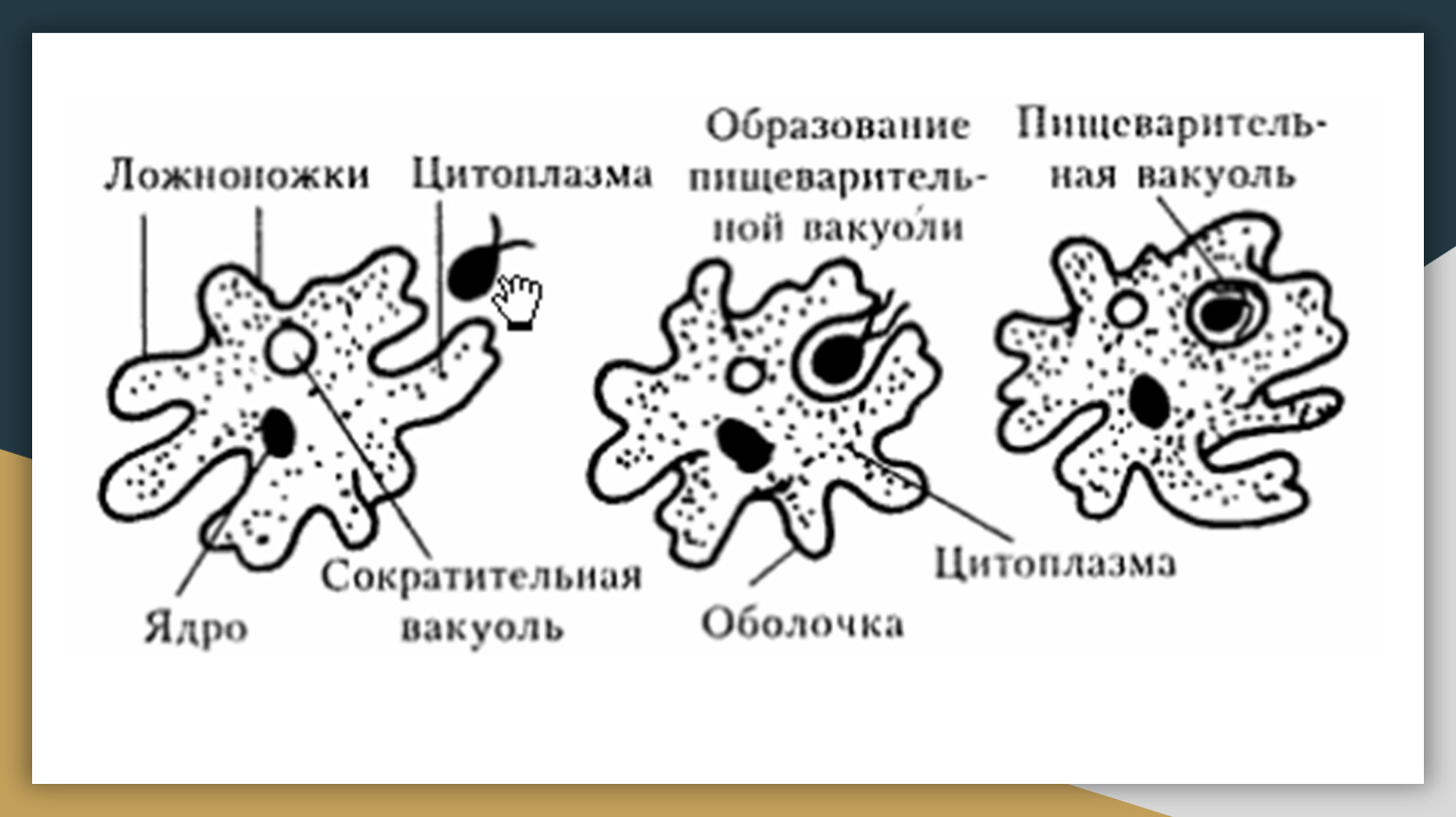 Более того, важно выделить и охарактеризовать возбудителя хемотаксиса, чтобы изучить его роль на различных стадиях развития биопленок и его гипотетические роли на стадиях внутриклеточной репликации или в способности вирулентности.
Более того, важно выделить и охарактеризовать возбудителя хемотаксиса, чтобы изучить его роль на различных стадиях развития биопленок и его гипотетические роли на стадиях внутриклеточной репликации или в способности вирулентности.
В заключение, мы разработали модель биопленки рядом с системой распределения воды с использованием Amoeba Grown Legionella , которые обладают более высокой способностью колонизировать или образовывать биопленки, в частности, за счет секреции экзополисахаридов. Мы предлагаем поощрять использование этой модели для тестирования или разработки процесса дезинфекции, а не традиционных моделей с использованием Legionella , полученной из культуральной среды.
Вклад авторов
Эксперимент задумал и спроектировал: RB JB JF JMB.Проведены эксперименты: РБ. Проанализированы данные: RB JB JF JMB. Предоставленные реагенты / материалы / инструменты для анализа: RB JB JF JMB. Написал статью: RB JB JF JMB.
Ссылки
- 1.
 Steinert M, Hentschel U, Hacker J (2002) Legionella pneumophila: водный микроб сбивается с пути. FEMS Microbiol Rev 26: 149–162.
Steinert M, Hentschel U, Hacker J (2002) Legionella pneumophila: водный микроб сбивается с пути. FEMS Microbiol Rev 26: 149–162. - 2. Asare R, Abu Kwaik Y (2007) Ранний перенос и внутриклеточная репликация Legionella longbeachaea в фагосоме, подобной поздней эндосоме, производной от ER.Cell Microbiol 9: 1571–1587.
- 3. Cazalet C, Gomez-Valero L, Rusniok C, Lomma M, Dervins-Ravault D, et al. (2010) Анализ генома и транскриптома Legionella longbeachae раскрывает уникальные стратегии, вызывающие болезнь легионеров. PLoS Genet 6: e1000851.
- 4. Атлас РМ (1999) Легионелла: от среды обитания до патологии болезней, обнаружения и борьбы. Environ Microbiol 1: 283–293.
- 5. Bhopal RS (1991) Эпиднадзор за болезнями и информация в бланках лабораторных запросов: на примере болезни легионеров.J Infect 22: 97–98.
- 6.
Bollin GE, Plouffe JF, Para MF, Hackman B (1985) Аэрозоли, содержащие Legionella pneumophila, образующиеся из душевых лейок и кранов с горячей водой.
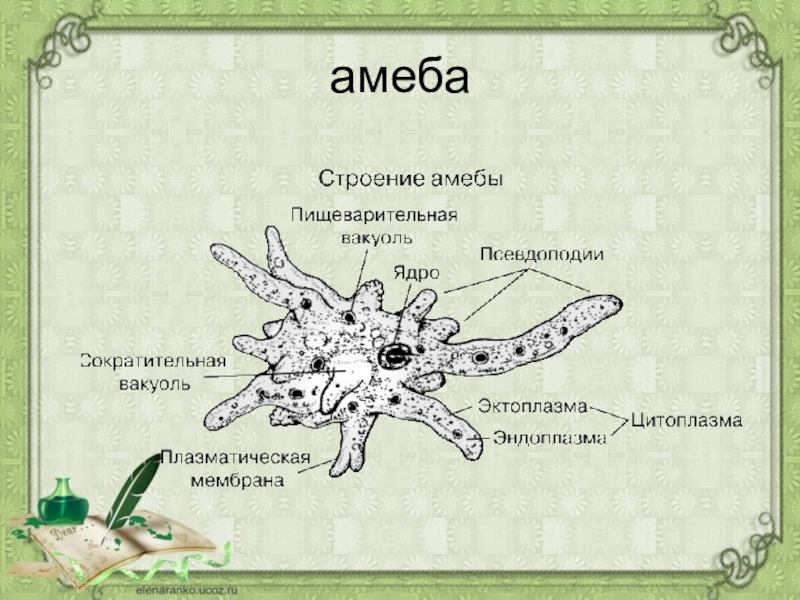 Appl Environ Microbiol 50: 1128–1131.
Appl Environ Microbiol 50: 1128–1131. - 7. Bollin GE, Plouffe JF, Para MF, Prior RB (1985) Разница в вирулентности экологических изолятов Legionella pneumophila. J Clin Microbiol 21: 674–677.
- 8. Ewann F, Hoffman PS (2006) Метаболизм цистеина в Legionella pneumophila: характеристика мутанта, использующего L-цистин.Appl Environ Microbiol 72: 3993–4000.
- 9. Ким Б. Р., Андерсон Дж. Э., Мюллер С. А., Гейнс В. А., Кендалл А. М. (2002) Обзор литературы — эффективность различных дезинфицирующих средств против легионеллы в водных системах. Water Res 36: 4433–4444.
- 10. Koubar M, Rodier MH, Garduno RA, Frere J (2011) Прохождение через Tetrahymena tropicalis повышает устойчивость к стрессу и инфекционность Legionella pneumophila. FEMS Microbiol Lett 325: 10–15.
- 11.
Томас V, Бушез Т., Николас V, Роберт С., Лорет Дж. Ф. и др.(2004) Амебы в домашних системах водоснабжения: устойчивость к дезинфекционным процедурам и их влияние на устойчивость Legionella.
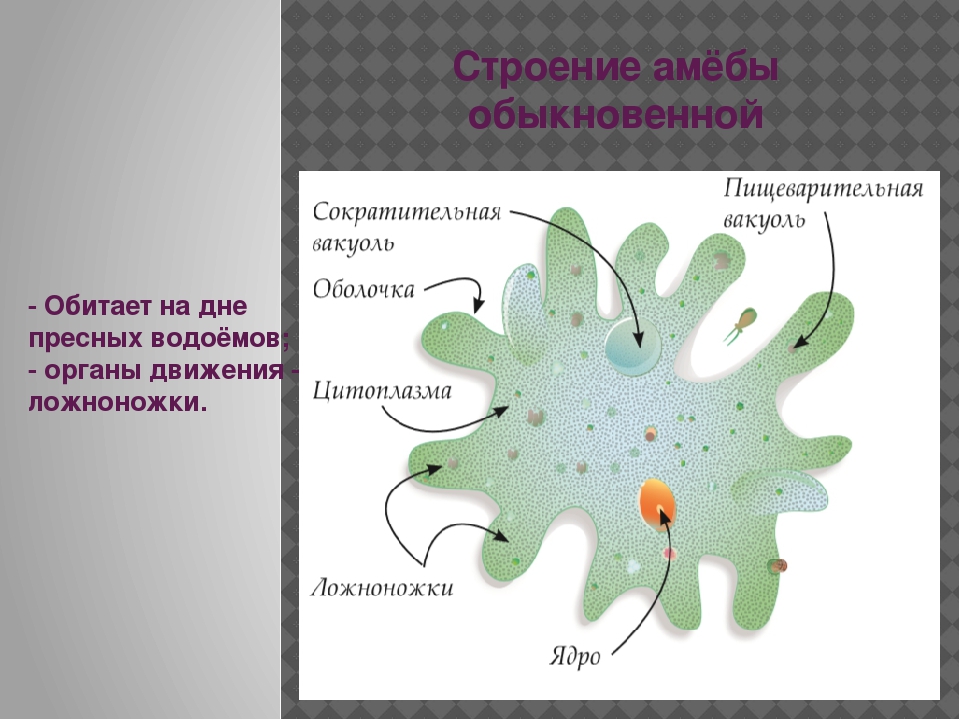 J Appl Microbiol 97: 950–963.
J Appl Microbiol 97: 950–963. - 12. Declerck P, Behets J, van Hoef V, Ollevier F (2007) Выявление Legionella spp. и некоторые из их хозяев-амеб в плавающих биопленках из антропогенной и естественной водной среды. Water Res 41: 3159–3167.
- 13. Declerck P, Behets J, van Hoef V, Ollevier F (2007) Репликация Legionella pneumophila в плавающих биопленках.Curr Microbiol 55: 435–440.
- 14. Мурга Р., Форстер Т.С., Браун Э., Пруклер Дж. М., Филдс Б.С. и др. (2001) Роль биопленок в выживании Legionella pneumophila в модельной системе питьевой воды. Микробиология 147: 3121–3126.
- 15. Роджерс Дж., Кивил К.В. (1992) Иммуномечение Legionella pneumophila с помощью иммуноголда и флуоресцеина в водной биопленке, визуализированное с помощью эпископической дифференциальной интерференционной контрастной микроскопии. Appl Environ Microbiol 58: 2326–2330.
- 16.
Temmerman R, Vervaeren H, Noseda B, Boon N, Verstraete W (2006) Некротрофический рост Legionella pneumophila.
 Appl Environ Microbiol 72: 4323–4328.
Appl Environ Microbiol 72: 4323–4328. - 17. Piao Z, Sze CC, Barysheva O, Iida K, Yoshida S (2006) Регулируемое температурой образование биопленок, похожих на мицелиальный мат, с помощью Legionella pneumophila. Appl Environ Microbiol 72: 1613–1622.
- 18. Vervaeren H, Temmerman R, Devos L, Boon N, Verstraete W (2006) Введение повышения Legionella pneumophila в модель стоячей воды путем термической обработки.FEMS Microbiol Ecol 58: 583–592.
- 19. Huws SA, McBain AJ, Gilbert P (2005) Выпас простейших и его влияние на динамику популяций в сообществах биопленок. J Appl Microbiol 98: 238–244.
- 20. Хагеле С., Колер Р., Меркерт Х., Шлейхер М., Хакер Дж. И др. (2000) Dictyostelium discoideum: новая модельная система хозяина для внутриклеточных патогенов рода Legionella. Cell Microbiol 2: 165–171.
- 21.
Кикухара Х., Огава М., Миямото Х., Никайдо Ю., Йошида С. (1994) Внутриклеточное размножение Legionella pneumophila у Tetrahymena thermophila.
 J UOEH 16: 263–275.
J UOEH 16: 263–275. - 22. Rowbotham TJ (1980) Предварительный отчет о патогенности Legionella pneumophila для пресноводных и почвенных амеб. Дж. Клин Патол 33: 1179–1183.
- 23. Kuiper MW, Wullings BA, Akkermans AD, Beumer RR, van der Kooij D (2004) Внутриклеточная пролиферация Legionella pneumophila у Hartmannella vermiformis в водных биопленках, выращенных на пластифицированном поливинилхлориде. Appl Environ Microbiol 70: 6826–6833.
- 24. Declerck P, Behets J, De Keersmaecker B, Ollevier F (2007) Опосредованное рецептором поглощение Legionella pneumophila Acanthamoeba castellanii и Naegleria lovaniensis.J Appl Microbiol 103: 2697–2703.
- 25. Ноймейстер Б., Райфф Г., Фейгл М., Дитц К., Нортофф Н. и др. (2000) Влияние Acanthamoeba castellanii на внутриклеточный рост различных видов Legionella в моноцитах человека. Appl Environ Microbiol 66: 914–919.
- 26.
Hilbi H, Hoffmann C, Harrison CF (2011) Legionella spp.
 на открытом воздухе: колонизация, общение и настойчивость. Environ Microbiol Rep 3: 286–296.
на открытом воздухе: колонизация, общение и настойчивость. Environ Microbiol Rep 3: 286–296. - 27. Дюпюи М., Мазуа С., Берн Ф., Боде С., Гаррек Н. и др.(2011) Эффективность дезинфицирующих средств для воды против Legionella pneumophila и Acanthamoeba. Water Res 45: 1087–1094.
- 28. Bellamy W, Takase M, Wakabayashi H, Kawase K, Tomita M (1992) Антибактериальный спектр лактоферрицина B, мощного бактерицидного пептида, полученного из N-концевой области бычьего лактоферрина. J Appl Bacteriol 73: 472–479.
- 29. Faulkner G, Berk SG, Garduno E, Ortiz-Jimenez MA, Garduno RA (2008) Прохождение через Tetrahymena tropicalis запускает быструю морфологическую дифференциацию Legionella pneumophila.J Bacteriol 190: 7728–7738.
- 30. Молофски А.Б., Суонсон М.С. (2004) Дифференцируйтесь, чтобы развиваться: уроки жизненного цикла Legionella pneumophila. Мол микробиол 53: 29–40.
- 31.
Джонас Д., Розенбаум А.
 , Вейрих С., Бхакди С. (1995) Иммуноферментный анализ для обнаружения ПЦР-амплифицированной ДНК легионелл в бронхоальвеолярной жидкости. J Clin Microbiol 33: 1247–1252.
, Вейрих С., Бхакди С. (1995) Иммуноферментный анализ для обнаружения ПЦР-амплифицированной ДНК легионелл в бронхоальвеолярной жидкости. J Clin Microbiol 33: 1247–1252. - 32. Declerck P, Behets J, Delaedt Y, Margineanu A, Lammertyn E, et al.(2005) Влияние бактерий, не относящихся к Legionella, на поглощение и внутриклеточную репликацию Legionella pneumophila у Acanthamoeba castellanii и Naegleria lovaniensis. Microb Ecol 50: 536–549.
- 33. Мампель Дж., Спириг Т., Вебер С.С., Хаагенсен Дж. А., Молин С. и др. (2006) Репликация планктона важна для образования биопленок Legionella pneumophila в сложной среде в статических и динамических условиях потока. Appl Environ Microbiol 72: 2885–2895.
- 34. Стоек Н.М., Дуткевич Дж. (2011) Сосуществование Legionella и других грамотрицательных бактерий в питьевой воде из различных сельских и городских источников.Энн Агрик Энвайрон Мед 18: 330–334.
- 35.
Koubar M, Rodier MH, Frere J (2013) Участие минералов в прикреплении Legionella pneumophila к поверхностям.
 Curr Microbiol 66: 437–442.
Curr Microbiol 66: 437–442. - 36. Бирн Б., Суонсон М.С. (1998) Экспрессия признаков вирулентности Legionella pneumophila в ответ на условия роста. Инфекция иммунной 66: 3029–3034.
- 37. Pruckler JM, Benson RF, Moyenuddin M, Martin WT, Fields BS (1995) Ассоциация экспрессии жгутика и внутриклеточного роста Legionella pneumophila.Инфекция иммунной 63: 4928–4932.
- 38. Спириг Т., Тиаден А., Кифер П., Бухризер С., Ворхольт Дж. А. и др. (2008) Аутоиндуктор-синтаза легионелл LqsA продуцирует сигнальную молекулу альфа-гидроксикетона. J Biol Chem 283: 18113–18123.
- 39. Кесслер А., Шелл Ю., Сахр Т., Тиаден А., Харрисон С. и др. (2013) Сенсорная киназа-сирота Legionella pneumophila LqsT регулирует компетентность и взаимодействия патоген-хозяин как компонент цепи LAI-1. Environ Microbiol 15: 646–662.
- 40.
Тиаден А., Спириг Т., Карранза П., Брюггеманн Х., Ридель К. и др. (2008) Синергетический вклад генов lqs Legionella pneumophila во взаимодействия патоген-хозяин.
 J Bacteriol 190: 7532–7547.
J Bacteriol 190: 7532–7547. - 41. Тиаден А., Спириг Т., Сар Т., Вальти М.А., Баук К. и др. (2010) Аутоиндуктор-синтаза LqsA и предполагаемая сенсорная киназа LqsS регулируют взаимодействия фагоцитов, внеклеточных филаментов и геномного острова Legionella pneumophila. Environ Microbiol 12: 1243–1259.
- 42. Тиаден А., Спириг Т., Вебер С.С., Брюггеманн Х., Босхард Р. и др. (2007) Регулятор ответа Legionella pneumophila LqsR способствует взаимодействиям с клетками-хозяевами как элемент регуляторной сети вирулентности, контролируемой RpoS и LetA. Cell Microbiol 9: 2903–2920.
- 43. Pecastaings S, Berge M, Dubourg KM, Roques C (2010) Sessile Legionella pneumophila способна расти на поверхности и генерировать структурированные моновидовые биопленки. Биообрастание 26: 809–819.
- 44.
Наделл С.Д., Буччи В., Дрешер К., Левин С.А., Басслер Б.Л. и др. (2013) Преодолевая сложность коллективов ячеек. Proc Biol Sci 280: 20122770.
- 45. Besemer K, Singer G, Limberger R, Chlup AK, Hochedlinger G, et al. (2007) Биофизический контроль за преемственностью сообществ в биопленках ручья. Appl Environ Microbiol 73: 4966–4974.
- 46. Cheng KJ, Costerton JW (1986) Микробная адгезия и колонизация в пищеварительном тракте.Soc Appl Bacteriol Symp Ser 13: 239–261.
- 47. Ibey BL, Beier HT, Rounds RM, Cote GL, Yadavalli VK и др. (2005) Анализ конкурентного связывания глюкозы на основе конъюгатов гликодендример-флуорофор. Anal Chem 77: 7039–7046.
- 48. Neu TR, Kuhlicke U, Lawrence JR (2002) Оценка флуорохромов для двухфотонной лазерной сканирующей микроскопии биопленок. Appl Environ Microbiol 68: 901–909.
- 49. Mead TJ, Yutzey KE (2009) Регулирование пути Notch дифференцировки и пролиферации хондроцитов во время развития аппендикулярного и осевого скелета.Proc Natl Acad Sci U S A 106: 14420–14425.
- 50.
Скотт Дж.
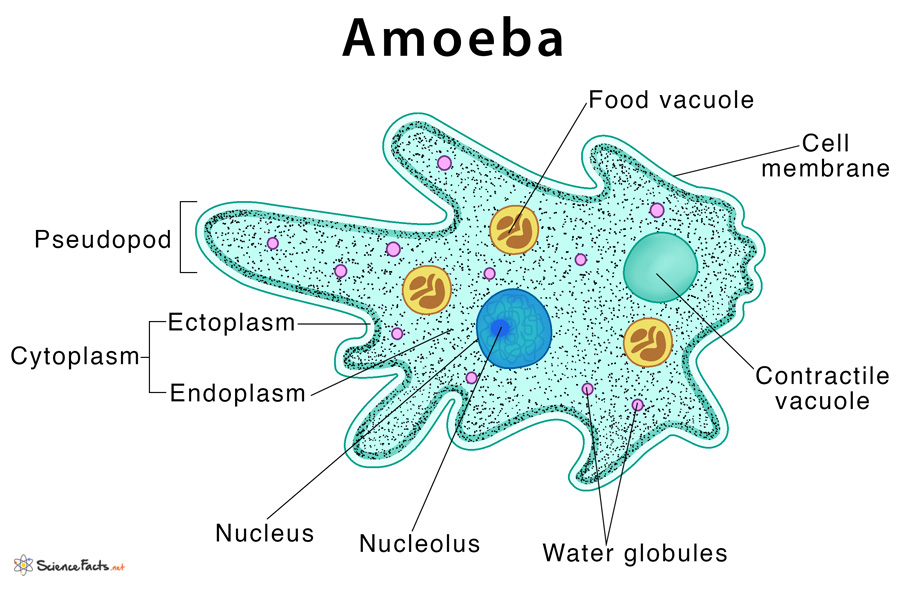 Э. (1996) Элсиан Блю. Теперь вы это видите, а теперь нет. Eur J Oral Sci 104: 2–9.
Э. (1996) Элсиан Блю. Теперь вы это видите, а теперь нет. Eur J Oral Sci 104: 2–9.
Амеба, поедающая мозги? Что такое амеба / амеба?
Недавние случаи смерти амеб, поедающих мозг, во Флориде, Луизиане и Вирджинии, возможно, заставили некоторых людей задуматься о том, о чем они не задумывались со времени последнего базового био-класса: что такое амеба в любом случае?
Так уж случилось, что на днях, убирая свой гараж, я обнаружил свои записи из колледжа 1978 года из класса под названием «Основы биологической организации», и, как назло, они содержали изображение амебы, ниже .
Хорошо, значит, не очень.
В примечаниях к рисунку поясняется, что амебы — это одноклеточные существа, которые передвигаются, вытягивая части себя в виде рукоподобных структур, называемых псевдоподиями («ложные ноги»). Внутренняя слизь клетки течет в руку, делая ее все длиннее и длиннее. Затем остальная капля как бы догоняет руку. Таким образом, амеба продвигается по леднику в том направлении, в котором она «желает» двигаться (например, продвигаясь по дну пруда или озера).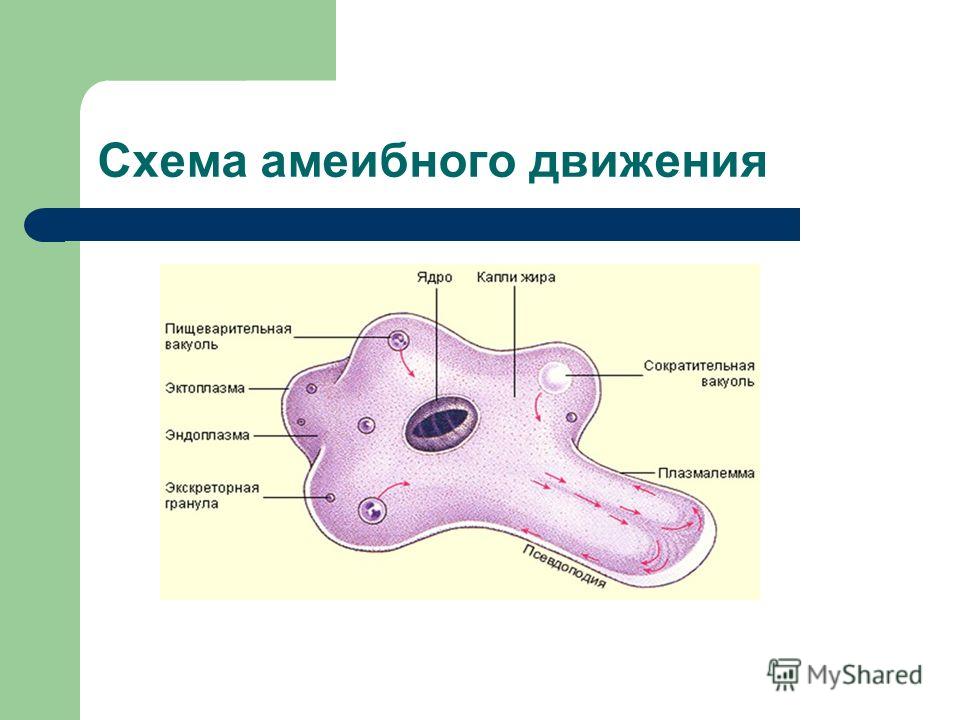
Еще факты об амебах:
Их трудно лечить лекарствами, потому что они гораздо больше похожи на человеческие клетки по структуре и внутреннему устройству, чем на бактерии.
Амеба, убивающая мозг, в новостях, Naegleria fowleri, была названа в честь австралийского патолога Малкольма Фаулера, который первым выделил ее еще в 1960-х годах у пациента, у которого был первичный амебный менингоэнцефалит, как тяжелый мозг. называется инфекция, вызванная существом. Это пресноводная амеба, которая попадает в организм по обонятельному нерву при попадании в нос, а оттуда в мозг.
Инфекции, подобные этой, чрезвычайно редки: в книге на веб-сайте Национального института здравоохранения указано около 175 зарегистрированных случаев первичного амебного менингоэнцефалита во всем мире по состоянию на 1995 год. )
«Совершенно очевидно, что количество заражений составляет лишь минутную долю от количества заражений», — говорится в книге. Другими словами, многие люди контактируют с этим существом, но никогда не заболевают.
Несколько видов другой группы амеб, Acanthamoeba, , вызывают инфекции кожи и легких у людей с ослабленной иммунной системой и могут распространяться на мозг.У здоровых людей они могут вызвать кератит Acanthamoeba, редкую, но серьезную инфекцию глаз, в случае плохо очищенных контактных линз.
Затем есть Entamoeba histolytica, , которые могут обитать в толстом кишечнике, не причиняя вреда, но, согласно MedlinePlus, – иногда он проникает в стенку толстой кишки, вызывая колит, острую дизентерию или длительную (хроническую) диарею. Инфекция также может передаваться через кровь в печень и, в редких случаях, в легкие, мозг или другие органы.
Есть и другие амебы, которые мы можем проглотить из воды, загрязненной сточными водами, например, под названием Entamoeba coli, , и хотя они не вредны, они указывают на то, что кто-то попал в сточные воды, как это делают безвредные бактерии группы кишечной палочки. .
Другие факты об амебах:
В отличие от бактерий, амебы не имеют твердой стены вокруг себя, и, как следствие, они бы лопнули от притока воды, если бы не «сократительная вакуоль» — см.