Простейшие паразитические
Простейшие — это организмы, состоящие из одной клетки, осуществляющей все функции живого организма. Среди них насчитывают примерно 15 тысяч видов различных форм: морские, пресноводные, почвенные и паразитические. Размножаются как делением, так и половым путем. Простейшие способны переживать неблагоприятные условия среды, преобразуясь в стадию цисты. Выделяют несколько типов: саркодовые (корненожки), жгутиковые, споровики и инфузории.[ …]
Простейшие — это организмы, состоящие из одной клетки (рис. 73), которой свойственны все функции живого организма. К простейшим относится около 15 ООО видов, среди которых морские и пресноводные животные, почвенные и паразитические формы. У самых мелких клеточных паразитов размеры клеток достигают 5 мкм. Увидеть простейших можно в микроскоп, где при большом увеличении хорошо заметны клеточные органеллы. Для многих простейших характерна стадия цисты. Клетка покрывается специальной защитной оболочкой, что позволяет ей переживать неблагоприятные условия.
Большинство простейших являются свободноживущими. Известны также простейшие, которые могут обитать в организме другого вида, не принося ему ущерба, а даже помогая ему. Например, некоторые жгутиконосцы, обитающие в кишечнике термитов, могут переваривать там целлюлозу и этим обеспечивают пищевые потребности термитов, поскольку последние самостоятельно не утилизируют это соединение. Однако значительная часть простейших ведет паразитический образ жизни, причем отдельные паразиты очень опасны для человека и животных. Человек является потенциальным хозяином около 26 видов простейших, из которых 2 вида могут обитать в полости рта, 12 видов — в кишечнике, 1 — в мочеполовом тракте, около 10 — в крови и других тканях.[ …]
Большинство червей ведут паразитический образ жизни, обитая либо на поверхности различных водных животных, либо поражая их внутренние органы. Ни одна группа водных животных и ряд групп растительных организмов не свободны от червей паразитов. Даже в простейших животных и водорослях поселяются черви. Паразитические черви приносят большой вред не только рыбам, но через них и человеку. Однако свободноживущие черви приносят и большую пользу, так как служат пищей для рыб. Некоторые из малощетинковых (ТиЫ11с с1ае) участвуют в круговороте веществ в водоеме, транспортируя органические вещества из глубоких слоев ила па его поверхность. Черви наряду с другими организмами слу-•жат хорошими индикаторами на условия существования в водоеме. Они используются исследователями при санитарно-биологической оценке поверхностных вод и при установлении процессов заиливания или размыва грунтов рек, имеющих большое значение при различного рода гидротехнических работах.[ …]
Ни одна группа водных животных и ряд групп растительных организмов не свободны от червей паразитов. Даже в простейших животных и водорослях поселяются черви. Паразитические черви приносят большой вред не только рыбам, но через них и человеку. Однако свободноживущие черви приносят и большую пользу, так как служат пищей для рыб. Некоторые из малощетинковых (ТиЫ11с с1ае) участвуют в круговороте веществ в водоеме, транспортируя органические вещества из глубоких слоев ила па его поверхность. Черви наряду с другими организмами слу-•жат хорошими индикаторами на условия существования в водоеме. Они используются исследователями при санитарно-биологической оценке поверхностных вод и при установлении процессов заиливания или размыва грунтов рек, имеющих большое значение при различного рода гидротехнических работах.[ …]
Однако имеются другие возможности паразитических воздействий (между вирулентностью и безвредностью). Два вида мучных хрущаков (Tribolium confusum и Т. castaneum) использовались в экспериментах по изучению роста популяций и взаимодействия между ними.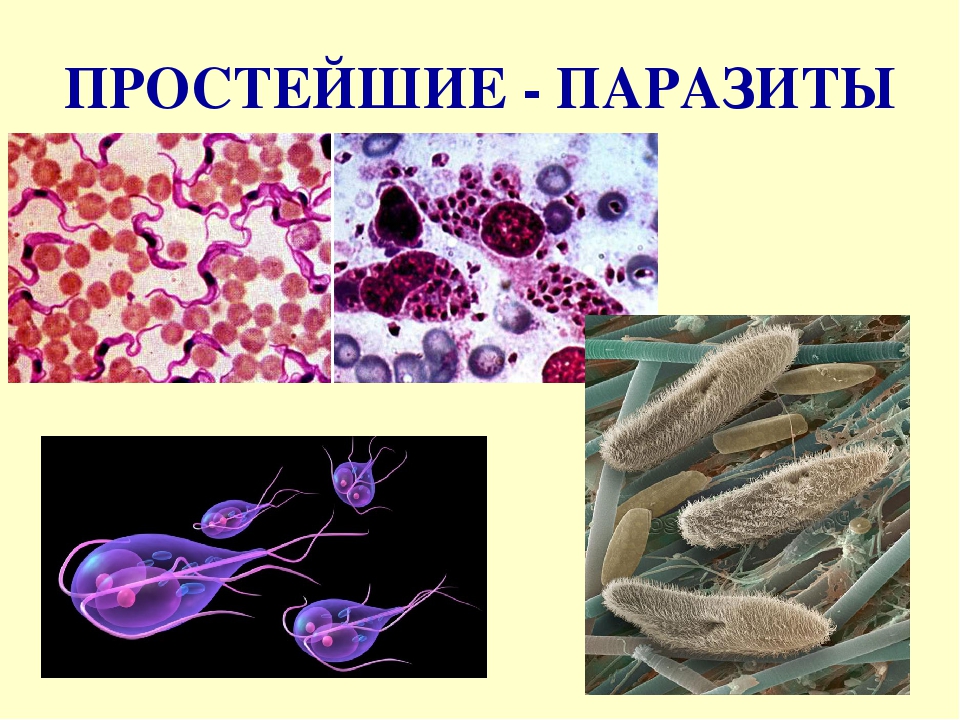 В опытах по изучению конкуренции Т. confusum обычно побеждал, а Т. castaneum исчезал, хотя в некоторых условиях окружающей среды Т. castaneum имел преимущества или же исходный результат был лишь делом случая. Однако в этих экспериментах Т. castaneum испытывал влияние паразита — простейшего Adelina, который мало влиял на Т. confusum. При конкуренции в культуре, из которой паразит был исключен, Т. castaneum чаще одерживал победу. Таким образом, в определенной среде паразит изменял в противоположном направлении конкурентные преимущества двух видов жуков. Т. castaneum был также культивирован в вариантах с паразитом и без него в культуре без участия Т. confusum. Средняя плотность Т. castaneum в культуре с паразитом была около половины той, которая достигалась в культуре без паразита. Очевидно, что присутствие или отсутствие паразита определяет разные отношения популяций жуков к допустимой численности К. Эффект воздействия паразитов назван «скрытым налогом» сообщества; в нашем случае скрытый налог значительно снизил жизненный стандарт популяции жука.
В опытах по изучению конкуренции Т. confusum обычно побеждал, а Т. castaneum исчезал, хотя в некоторых условиях окружающей среды Т. castaneum имел преимущества или же исходный результат был лишь делом случая. Однако в этих экспериментах Т. castaneum испытывал влияние паразита — простейшего Adelina, который мало влиял на Т. confusum. При конкуренции в культуре, из которой паразит был исключен, Т. castaneum чаще одерживал победу. Таким образом, в определенной среде паразит изменял в противоположном направлении конкурентные преимущества двух видов жуков. Т. castaneum был также культивирован в вариантах с паразитом и без него в культуре без участия Т. confusum. Средняя плотность Т. castaneum в культуре с паразитом была около половины той, которая достигалась в культуре без паразита. Очевидно, что присутствие или отсутствие паразита определяет разные отношения популяций жуков к допустимой численности К. Эффект воздействия паразитов назван «скрытым налогом» сообщества; в нашем случае скрытый налог значительно снизил жизненный стандарт популяции жука.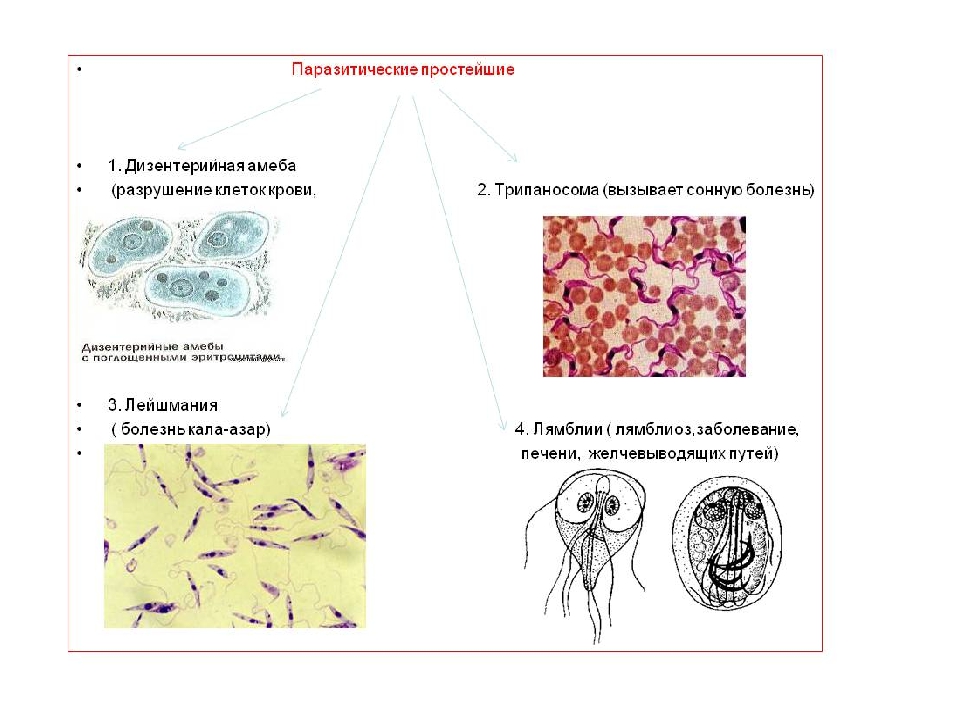
Микроспоридии — облигатные внутриклеточные паразитические простейшие, относящиеся к типу Microsporidia. У рыб паразитируют в основном представители семейства Glugeidae, рода Glugea и вызывают заболевание глюгеоз судака, волжской сельди, камбаловых и некоторых других рыб. У молоди рыб они вызывают заболевания, сопровождающиеся иногда гибелью, а у взрослых, паразитируя в тканях, приводят к порче товарного вида рыб.[ …]
Особую группу составляют сосущие инфузории (Suctoria), ведущие паразитический образ жизни. Вместо ресничек у них имеются особые, полые внутри щупальцы, с помощью которых они высасывают содержимое клеток. Питаются они другими простейшими. [ …]
[ …]
Наличие в слоевищах многих лишайников абсорбционных органов гриба хорошо доказывает паразитическую сущность отношений ми-кобионта к фикобионту. Но во многих случаях у лишайникового гриба все же не удается обнаружить особых абсорбционных органов, чаще всего у лишайников, фикобионт которых имеет тонкие оболочки клеток. В таких случаях уже внешний контакт гифы гриба и клетки водоросли может обеспечить обмен веществами между ни.ми. Так, например, обстоит дело у многих видов рода кладония. У этих лишайников отдельные клетки водорослей окружены со всех сторон тонкими тонкостенными гифами, иногда поделенными на мелкие клеточки. Эти гифы, которые носят название обволакивающих или к о н-т а к т н ы х, не проникают в протопласт клеток водоросли и не внедряются в их оболочку, а просто окружают клетки со всех сторон, так что каждая из них становится похожей на маленький шар, охваченный пальцами рук (рис. 289,2). Иногда гифы полностью оплетают водоросли в виде сплошпого покрова и при этом, сливаясь своими стенками, даже образуют клеточную псевдопаренхимную ткань.
Наконец, изящная работа Парка (Park, 1948), изучавшего влияние паразита на конкурентоспособность животных, показала, ito в лабораторных условиях паразитическое простейшее Adelina tribolii способно изменить исход конкуренции между двумя видами малых мучнистых хрущаков, Tribo-lium castaneum и Т. confusion, на противоположный.[ …]
Ответная спячка, напоминающая ответный покой семян растений, обнаруживается в жизненных циклах многих круглых червей (нематод), в особенности паразитических. Их покоящиеся цисты могут пребывать в состоянии приостановленной жизнедеятельности в течение многих лег и выходить из этого состояния лишь после поступления какого-либо особого сигнала, означающего, что в окружающей среде сложились благоприятные для развития условия (Sunderland, 1960). Таким сигналом может послужить заглатывание цисты хозяином, а если речь идет о нематодах, паразитирующих на высших растениях, — выделение растущим растением-хозяином в среду, окружающую цисту, каких-то веществ — стимуляторов «прорастания».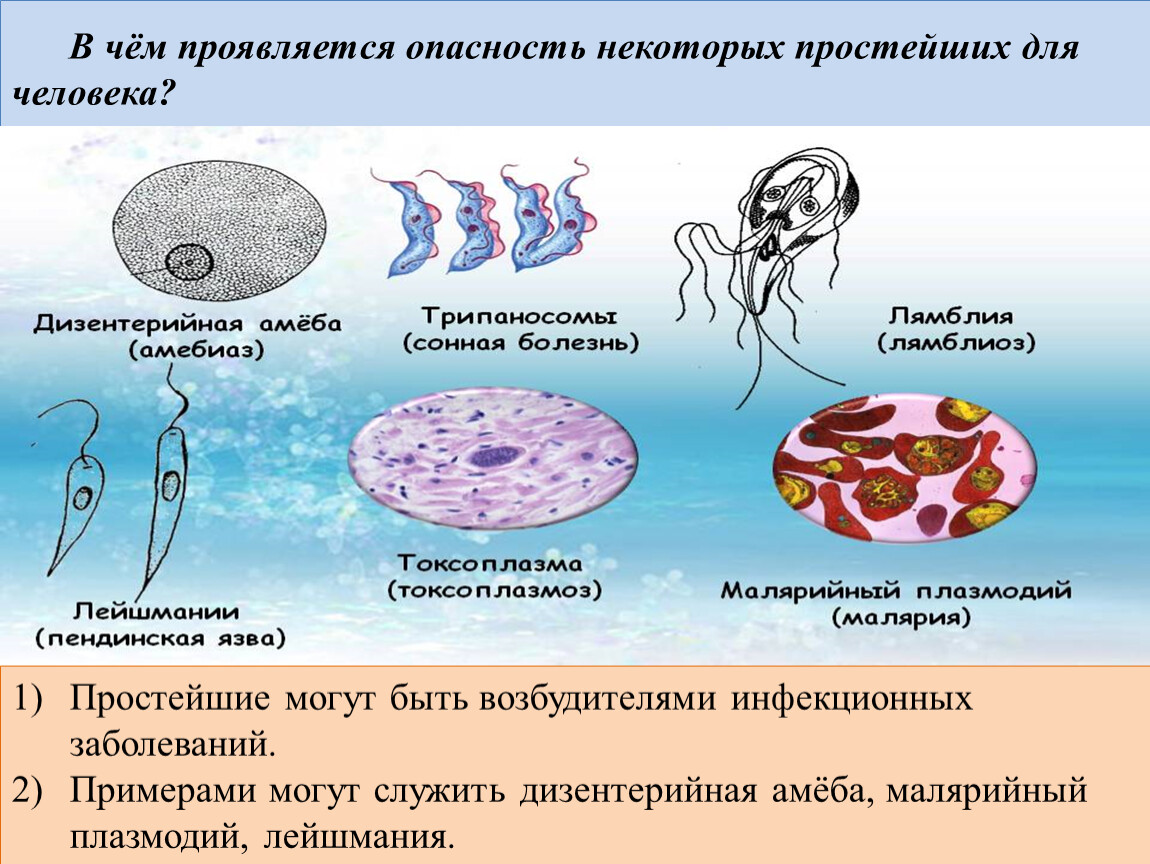
А. Общее влияние промышленных, бытовых и сельскохозяйственных сточных вод. Сточные воды оказывают многоплановое влияние на сообщества водорослей и простейших; снижают число имеющихся видов и количество особей данного вида, снижают скорость расселения водорослей и простейших, изменяют избирательность паразитического влияния на отдельные системы сообществ водорослей и простейших и др. Возможно, что большинство или даже все эти воздействия проявляются одновременно.[ …]
Паразитизм заключается в том, что микроорганизмы, способные к питанию живым органическим веществом, проникают в организм хозяина, развиваются в нем, вызывая нарушение обмена веществ. К паразитическим формам относятся бактериофаги, болезнетворные бактерии, вирусы, некоторые простейшие.[ …]
При большинстве инвазий важное значение в перезаражении рыб имеют ложе прудов и донные организмы (фито- и зообентос).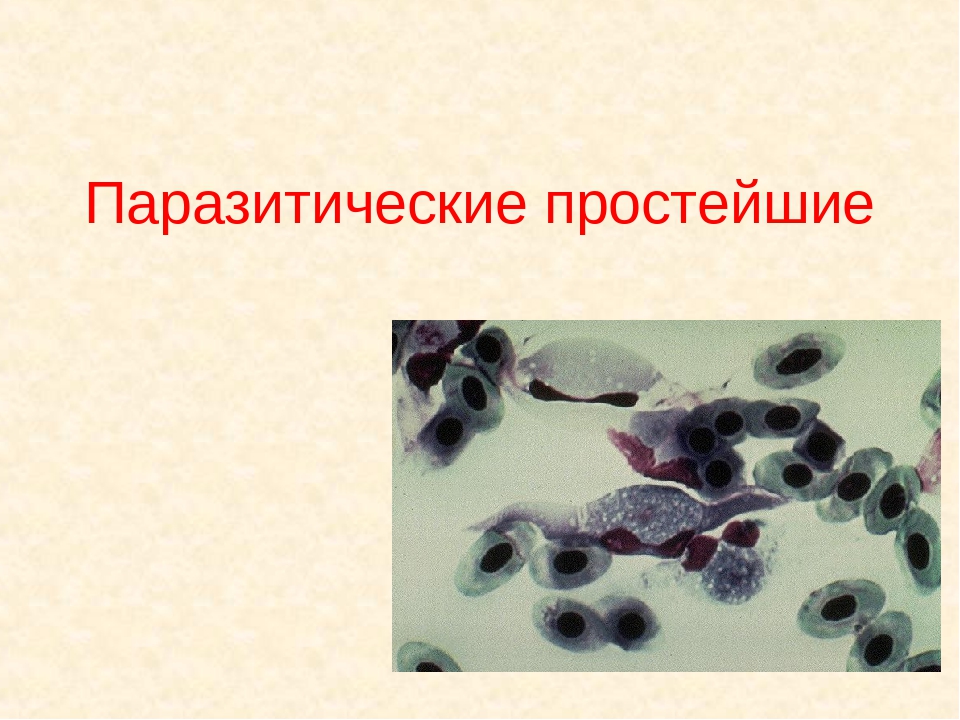 На дне водоемов скапливаются и длительно сохраняются яйца гельминтов и паразитических рачков, ооцисты споровиков, инци-стированные простейшие. Некоторые бентосные организмы, как, например, малощетинковые черви, являются промежуточными хозяевами гельминтов сем. гвоздичниковых. Остальные представители играют в основном роль резервуаров инвазий. При посадке рыб в зараженные пруды и благоприятных условиях (температуре и др.) паразиты попадают в организм рыб и обусловливают возникновение болезней.[ …]
На дне водоемов скапливаются и длительно сохраняются яйца гельминтов и паразитических рачков, ооцисты споровиков, инци-стированные простейшие. Некоторые бентосные организмы, как, например, малощетинковые черви, являются промежуточными хозяевами гельминтов сем. гвоздичниковых. Остальные представители играют в основном роль резервуаров инвазий. При посадке рыб в зараженные пруды и благоприятных условиях (температуре и др.) паразиты попадают в организм рыб и обусловливают возникновение болезней.[ …]
Паразитизм — взаимоотношения, при которых паразит не убивает своего хозяина, а длительное время использует его как среду обитания и источник пищи. К паразитам относятся: вирусы, патогенные бактерии, грибы, простейшие, паразитические черви и др.[ …]
Паразитизм — взаимоотношения, при которых паразит не убивает своего хозяина, а длительное время использует его как среду обитания и источник пищи. К паразитам относятся: вирусы, патогенные бактерии, грибы, простейшие, паразитические черви и др. Различают облигатных и факультативных паразитов. Облигатные паразиты ведут исключительно паразитический образ жизни и вне организма хозяина либо погибают, либо находятся в неактивном состоянии (вирусы). Факультативные паразиты ведут паразитический образ жизни, но в случае необходимости могут нормально жить во внешней среде, вне организма хозяина (патогенные грибы и бактерии).[ …]
Различают облигатных и факультативных паразитов. Облигатные паразиты ведут исключительно паразитический образ жизни и вне организма хозяина либо погибают, либо находятся в неактивном состоянии (вирусы). Факультативные паразиты ведут паразитический образ жизни, но в случае необходимости могут нормально жить во внешней среде, вне организма хозяина (патогенные грибы и бактерии).[ …]
Паразитизм представляет собой отношения, при которых один вид живет за счет ресурсов другого. Под ресурсами в данном случае понимается, что один организм служит для другого и источником пищи, и местом обитания. Самым простым примером являются гельминты — паразитические черви, обитающие в пищеварительных и выделительных системах животных, да и человека. В целом же к паразитам чаще всего относят простейших, бактерии, грибы, червей. В отличие от хищника паразит не убивает свою жертву, а достаточно длительное время живет за счет ее ресурсов. Паразитизм может быть временным и постоянным, иногда в процессе жизни возможна смена хозяев.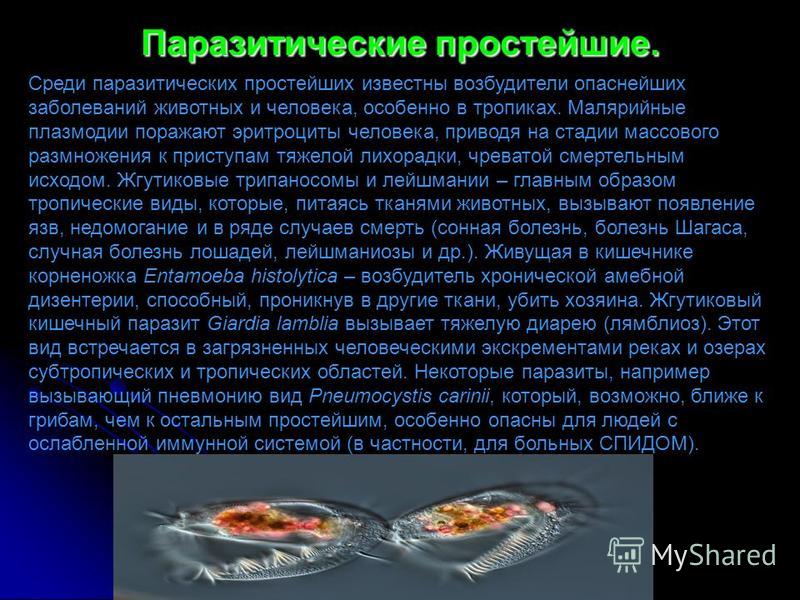
Одни инфузории плавают в воде, другие прикрепляются к водным растениям и другим предметам, третьи пойзают. Пищей большинству инфузорий служат бактерии и мелкие водоросли, но есть среди них и хищники, питающиеся другими простейшими, в том числе и инфузориями. Немало инфузорий ведет паразитической образ жизни в организмах человека, животных и рыб.[ …]
Многим инвазионным болезням рыб характерна сезонность. У пресноводных рыб наиболее богатая и разнообразная паразитофауна наблюдается в основном весной и летом. Повышение температуры воды в это время способствует размножению многих паразитических простейших, ракообразных, а также промежуточных хозяев гельминтов (циклопов, моллюсков и др.). Весенние вспышки протозойных болезней (ихтиофтириоза, костиоза), моногеноидозов часто связаны не только с температурой, но и с уплотненными посадками рыб, недостатком кормов, низкой резистентностью организма и т.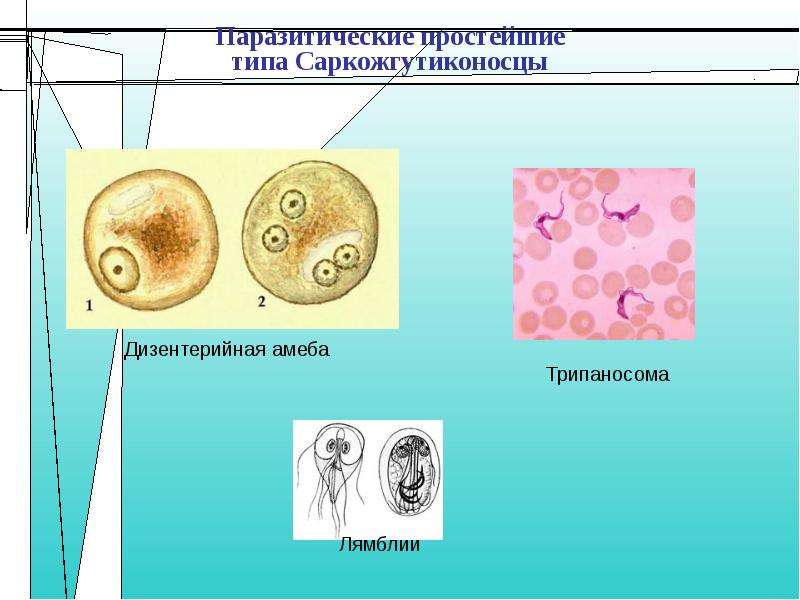 д.[ …]
д.[ …]
Инвазионные болезни рыб подразделяются на 5 групп: прото-зойные, гельминтозы, крустацеозы, болезни, вызываемые личинками двухстворчатых моллюсков и кишечнополостными. Перечисленные паразиты встречаются как у рыб в естественных и искусственных водоемах, так и у морских рыб.[ …]
Одни из них довольно широко распространены в природе, как гонатоботрис простой (Gonatobotrys simplex), паразитирующий на альтернариях, другие встречаются редко. Немногочисленность известных сейчас биотрофных дейтеромицетов объясняется прежде всего тем, что их довольно трудно обнаружить в природе и получить в культуре, где они растут только в присутствии хозяина или на средах специального состава.[ …]
Формы паразитизма и связанные с этим взаимные адаптации паразитов и их хозяев чрезвычайно многообразны. Различают эктопаразитизм, при котором паразит обитает на хозяине и связан с его покровами (клещи, блохи, вши и др.), и эндопаразитизм (паразит живет внутри тела хозяина, например паразитические черви и простейшие). Среди паразитических растений эктопаразиты отличаются тем, что тело располагается вне организма хозяина, и лишь органы питания (гаустории) проникают в его ткани. Таковы, например, мучнисторосяные грибы; из высших растений —повилика. Эндопаразиты (главным образом грибы) погружены в ткани хозяина, снаружи находятся лишь органы размножения. Естественно, во всех случаях связь с хозяином сильнее у эндопаразитов, а взаимоотношения с внешней («первичной») средой сложнее у эктопаразитов.[ …]
Среди паразитических растений эктопаразиты отличаются тем, что тело располагается вне организма хозяина, и лишь органы питания (гаустории) проникают в его ткани. Таковы, например, мучнисторосяные грибы; из высших растений —повилика. Эндопаразиты (главным образом грибы) погружены в ткани хозяина, снаружи находятся лишь органы размножения. Естественно, во всех случаях связь с хозяином сильнее у эндопаразитов, а взаимоотношения с внешней («первичной») средой сложнее у эктопаразитов.[ …]
КАТАГЕНЕЗ [от гр. kata — вниз и genes — рожденный] — термин, введенный А.Н. Северцовым для обозначения особого пути достижения биологического прогресса (расширения ареала, увеличения численности и т.д.), приводящего к упрощению организации образа жизни в результате приспособления к более простым условиям существования (напр., у паразитических или сидячих форм животных). Переход организмов в упрощенную среду обитания, к более пассивной жизни связан с крайней специализацией и сопровождается соответствующими морфофизиологическими перестройками (морфофизиологическим регрессом). Таким образом, К. подчеркивает дискуссион-ность понятия прогресса в живой природе.[ …]
Таким образом, К. подчеркивает дискуссион-ность понятия прогресса в живой природе.[ …]
Биотрофные дейтеромицеты контактного типа не растут на обычных питательных средах в отсутствие хозяина. Для их развития необходимы витамины и ростовой фактор микотро-феин, содержащийся в мицелии многих грибов.[ …]
Считают, что первыми возникли архебактерии. Примерно 3,5 млрд лет назад. Затем возникли истинные бактерии, а от них ответвились вирусы, цианобактерии, красные водоросли и зеленые жгутиковые. От последних ответвились водоросли (от которых позднее произошли, в свою очередь, высшие растения) и бесцветные ризофлагелляты, из которых развились диатомовые водоросли, плесневые грибы, губки и простейшие. Часть простейших стала паразитической.[ …]
В щуке оз. Б. Миассово отмечено 17 видов паразитов. Количество жаберных паразитов составляет 8 видов. Учитывая низкую численность щуки, эпизоотическая угроза может быть только локального характера. Ленточные паразиты представлены двумя видами, из которых Triaenophorus nodulosus чаще встречается, чем Diphyllobothrium latum. Щука подвержена экстенсивному заражению жаберным паразитом Ergasilus siebolcä и глазными паразитами Diplostomum commutatum и Tylodelphys clavata (см. табл. 56). Паразитические простейшие из группы (p. Apiosoma) и миксоспоридии (p. Henneguna) встречаются у отдельных экземпляров рыб с незначительной интенсивностью инвазии (1-3 экз.).[ …]
Щука подвержена экстенсивному заражению жаберным паразитом Ergasilus siebolcä и глазными паразитами Diplostomum commutatum и Tylodelphys clavata (см. табл. 56). Паразитические простейшие из группы (p. Apiosoma) и миксоспоридии (p. Henneguna) встречаются у отдельных экземпляров рыб с незначительной интенсивностью инвазии (1-3 экз.).[ …]
У биотрофных дейтеромицетов обнаружен своеобразный характер взаимодействия гиф паразита и хозяина. Это так называемые контактные микопаразиты. Они образуют абсорбтивные (питающие) гифы различного строения, устанавливающие контакт с клетками хозяина, не внедряясь в них. Механизм питания при таком контакте неизвестен. Предполагают, что в зоне контакта гиф паразита и хозяина повышается проницаемость цитоплазматической мембраны клеток последних и происходит поглощение их метаболитов клетками паразита.[ …]
Тип Споровики. Паразитические простейшие. Значение простейших
Тип
споровики включает около 2 тыс. видов простейших. Все представители данного
типа являются паразитами, что нашло отражение в упрощении строения
клетки. Паразитические простейшие – одноклеточные животные, которые
живут за счёт других организмов, называемых хозяевами. Свободно существовать в
окружающей среде вне хозяина споровики не могут.
видов простейших. Все представители данного
типа являются паразитами, что нашло отражение в упрощении строения
клетки. Паразитические простейшие – одноклеточные животные, которые
живут за счёт других организмов, называемых хозяевами. Свободно существовать в
окружающей среде вне хозяина споровики не могут.
Как и все паразитические простейшие, споровики не имеют сократительных вакуолей, у них отсутствуют какие-либо органоиды движения. Пищеварительных вакуолей у них тоже нет, поэтому питание происходит всей поверхностью тела. Другой характерной особенностью споровиков является сложный жизненный цикл со сменой хозяев. Хозяева паразитов – различные позвоночные и беспозвоночные животные (черви, насекомые, млекопитающие), человек.
Обитают споровики в органах пищеварения, выделения, размножения и в крови животных и человека.
Они
разрушают ткани хозяина, отравляют организм своими ядовитыми выделениями,
вызывают различные заболевания, которые зачастую могут приводить к гибели.
Для человека опасны споровики, которые являются возбудителями малярии. Это малярийный плазмодий. На определённых стадиях своего развития он паразитирует на эритроцитах – красных клетках крови человека. В организме человека развиваются плазмодии трёх видов, которые являются возбудителями самой распространённой трехдневной малярии, четырехдневной малярии и наиболее опасной тропической малярии. Все виды широко распространены в странах с тропическим, субтропическим климатом и экваториальным климатом. Малярийные комары живут в районах, где не бывает низких температур и выпадает много осадков.
Малярийный плазмодий имеет микроскопические размеры, распространяется малярийными комарами. Переносчиками паразита являются только самки, которым для развития яиц необходимо насосать крови. И, как говорилось ранее, у человека вызывает опасное заболевание – малярию.
Рассмотрим
жизненный цикл малярийного плазмодия.
В организме комара плазмодии размножаются в его кишечнике и скапливаются в слюнных железах.
При укусе вместе со слюной комара в кровь человека проникают малярийные плазмодии. Попав в кровяное русло, они разносятся по всему телу. В клетках крови они питаются, растут, размножаются, разрушают клетки крови человека, выделяют ядовитые вещества.
После разрушения эритроцита, плазмодии оказываются в крови, и у человека начинается приступ лихорадки – повышается температура, появляются озноб и слабость, мышечные и головные боли. В течение нескольких часов температура повышается до 40 °С. Продолжительность приступа невелика, и через 6 -8 часов температура снижается до нормальной. Прекращение симптомов происходит из-за того, что плазмодии не находятся долго в крови, а проникают в новые эритроциты. Приступы повторяются через каждые два-три дня, и это ведёт к истощению организма.
Малярийных
паразитов комар всасывает с кровью зараженного человека.
Всемирной организацией здравоохранения разработаны и реализованы меры борьбы с малярией:
Поэтому теперь от малярии умирает гораздо меньше людей, чем раньше.
К споровикам относится паразит грегарина. Грегарина является внеклеточным паразитом различных беспозвоночных, прежде всего насекомых. Тело этих простейших имеет продолговатую форму или реже округлую форму. На переднем конце тела грегарины имеют структуру с выростами и крючочками, позволяющую паразиту прикрепляться к стенке органа хозяина. Далее следует передний отдел и задний, несущий ядро.
Характерные признаки класса Споровики:
· внутриклеточные паразиты;
· отсутствуют органоиды движения;
· отсутствуют сократительная и пищеварительная вакуоли;
· постоянная форма тела;
· 1 ядро;
· гетеротрофный тип питания;
·
сложный
цикл развития.
Кроме споровиков к паразитическим простейшим относятся некоторые представители саркодовых, жгутиковых и инфузорий. Рассмотрим некоторых представителей данных групп.
К паразитическим саркодовым относится дизентерийная амёба. Она попадает в организм человека в виде цист, которые он заглатывает при несоблюдении правил гигиены (немытые руки, овощи, фрукты, сырая вода). В пищеварительном тракте человека оболочки цист растворяются. В кишечнике человека амебы питаются, размножаются и повреждают стенки кишечника, тем самым вызывая тяжелое заболевание амёбиаз. В народе амёбиаз называют «болезнью грязных рук».
К паразитическим жгутиковым относятся лямблия, трихомонада, трипаносома.
Лямблии
поражают
кишечник, печень и половые железы человека. Клетка лямблии похожа на
разрезанную пополам грушу, имеет 2 ядра и 8 жгутиков. Она попадает в организм человека
в виде цист. Заражение человека происходит при употреблении в пищу плохо
вымытых фруктов и овощей, при несоблюдении правил личной гигиены. Заражение
лямблиями вызывает заболевание лямблиоз, которое сопровождается
кишечными расстройствами.
Заражение человека происходит при употреблении в пищу плохо
вымытых фруктов и овощей, при несоблюдении правил личной гигиены. Заражение
лямблиями вызывает заболевание лямблиоз, которое сопровождается
кишечными расстройствами.
В организме человека паразитирует инфузория балантидий. Подробно с её строением вы знакомились при изучении темы «инфузории».
Значение простейших в природе и жизни человека
Рассмотрим значение простейших. Несмотря на малые размеры тела, простейшие имеют большое значение в природе и жизни человека.
· Они участвуют в круговороте веществ;
· Поедают бактерий, тем самым обеспечивают биологическую очистку водоёмов;
· служат пищей головастикам, малькам рыб и другим водным животным;
· В морях и океанах раковины фораминифер, оседая на дно, образуют горные породы и залежи известняка;
·
Являются
возбудителями паразитарных заболеваний человека и животных.
Простейшие паразитические — Справочник химика 21
Паразитизм заключается в том, что микроорганизмы, способные к питанию живым органическим веществом, проникают в организм хозяина, развиваются в нем, вызывая нарушение обмена веществ. К паразитическим формам относятся бактериофаги, болезнетворные бактерии, вирусы, некоторые простейшие. [c.226] Современный период химиотерапии (лечения болезней при помощи химических веществ) начался с работ Пауля Эрлиха (1854—1915). В начале текущего столетия было известно, что ряд органических соединений мышьяка обладает способностью убивать простейших —паразитические микроорганизмы, вызывающие многие тяжелые заболевания. Эрлих поставил перед собой задачу синтезировать большое число соединений мышьяка и попытаться найти такое, которое одновременно обладало бы токсичностью (являлось бы ядом) по отношению к простейшим, паразитирующим в человеческом теле, и не оказывало бы вредного действия на самого человека. Эрлих получил много соединений [c.422]
Эрлих получил много соединений [c.422]
Наряду с белками, полисахаридами и липидами, нуклеиновые кислоты являются необходимыми компонентами всех живых клеток, причем в их состав обычно входит как РНК, так и ДНК. Более того, нуклеиновые кислоты входят в состав более простых, паразитических форм жизни — вирусов. Частицы вирусов состоят часто лишь из белка и ДНК или РНК. [c.28]
Вирусы, бактерии, грибки, простейшие, паразитические черви — вот тот набор патогенов, с которыми потенциально возможна встреча человека и животных в течение жизни. [c.317]
Выращивание кристаллов, лежащих просто на дне кристаллизатора, без кристаллоносца, по целому ряду причин применяется редко. В числе таких причин — опасность растворения затравки в недосыщенном растворе, возможность ее соприкосновения с паразитическими кристаллами, затруднения в питании кристалла. Для того чтобы обеспечить наиболее благоприятные условия роста, приходится применять специальные держатели — кристаллоносцы, от устройства которых часто зависит успех опыта. [c.150]
[c.150]
Наиболее своеобразная особенность добавочных хромосом— это их вредное действие, а в некоторых случаях — просто отсутствие влияния. В тех случаях, когда вредный эффект совершенно несомненен, как, например, у ржи, полная элиминация добавочных хромосом из популяции предотвращается лишь их необычайной способностью удваивать свое число. Таким образом, создается впечатление, что в этих случаях добавочные хромосомы ведут паразитический образ жизни и борются лишь за свое собственное существование. Во всяком случае, до настоящего времени не удалось обнаружить какого-либо положительного влияния этих хромосом. [c.357]
Предполагают что протозойные болезни насекомых имеют намного большее распространение, чем это принято считать. Вероятно, интенсивное изучение этой группы организмов позволит вооружить специалистов по защите растений методами практического применения паразитических простейших в биологической борьбе с некоторыми вредителями.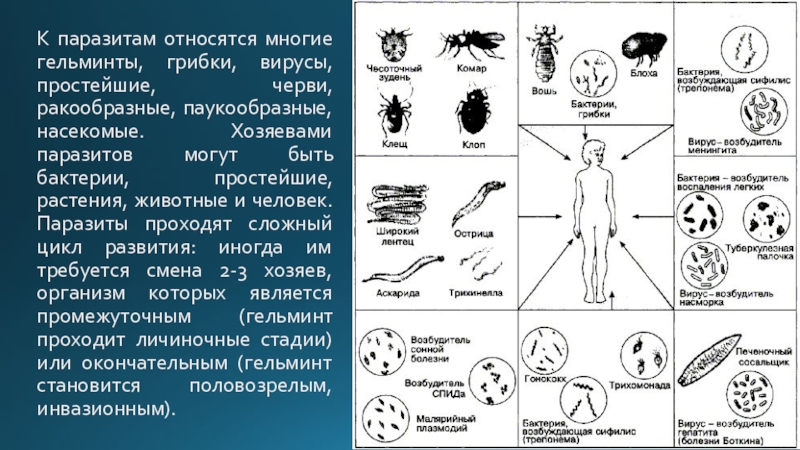 [c.238]
[c.238]
Смешанное кислое брожение встречается не только у бактерий. Так, трихомонады, паразитические жгутиковые, относящиеся к типу простейших, тоже способны в анаэробных условиях превращать пируват в ацетат, сукцинат, СО2 и Н2. У этих организмов нет митохондрий, но имеются напоминающие микротельца частицы, названные гидрогеносома-ми, способные превращать пируват в ацетат, СО2 и Нг [39]. Фермент, катализирующий расщепление пирувата, по-видимому, не содержит ли-поата и, возможно, близок по свойствам пируват ферредоксин—оксидо-редуктазе клостридий [уравнение (8-66)]. В гидрогеносомах находится также активная гидрогеназа. [c.351]
Несомненно, имеются штаммы простейших, развитие которых может происходить только в теле насекомого-хозяина. Паразит проникает в жировое тело и уничтожает его. После гибели хозяина паразит сразу же покидает его через кожный покров и быстро проникает в тело нового хозяина.
 При таком способе перехода сохраняются паразитические свойства простейшего. Культивирование таких штаммов на искусственной среде снижает их патогенность. [c.553]
При таком способе перехода сохраняются паразитические свойства простейшего. Культивирование таких штаммов на искусственной среде снижает их патогенность. [c.553]Паразиты бывают наружные, характерные для насекомых, ведущих скрытый образ жизни (в ходах деревьев, в свернутых листьях) и внутренние — яйцееды, которые развиваются в яйцах хозяина. Много паразитических насекомых в отряде перепончатокрылых (наездники), двукрылых (тахины). На насекомых паразитируют клещи и нематоды. Естественными врагами насекомых являются патогенные микроорганизмы (грибы, бактерии, вирусы и простейшие). Они вызывают различные массовые заболевания (эпизоотии) у насекомых. [c.40]
Наконец, возбудители болезней, или патогены, — это паразитические микроорганизмы (в данном случае грибы, бактерии, риккетсии, простейшие) и вирусы, которые вызывают у своих хозяев инфекционные заболевания, иногда смертельные. Их можно применять не только против членистоногих, но и против других организмов, однако большинство исследований в области так называемой микробиологической борьбы с вредителями проведено пока преимущественно на насекомых (см.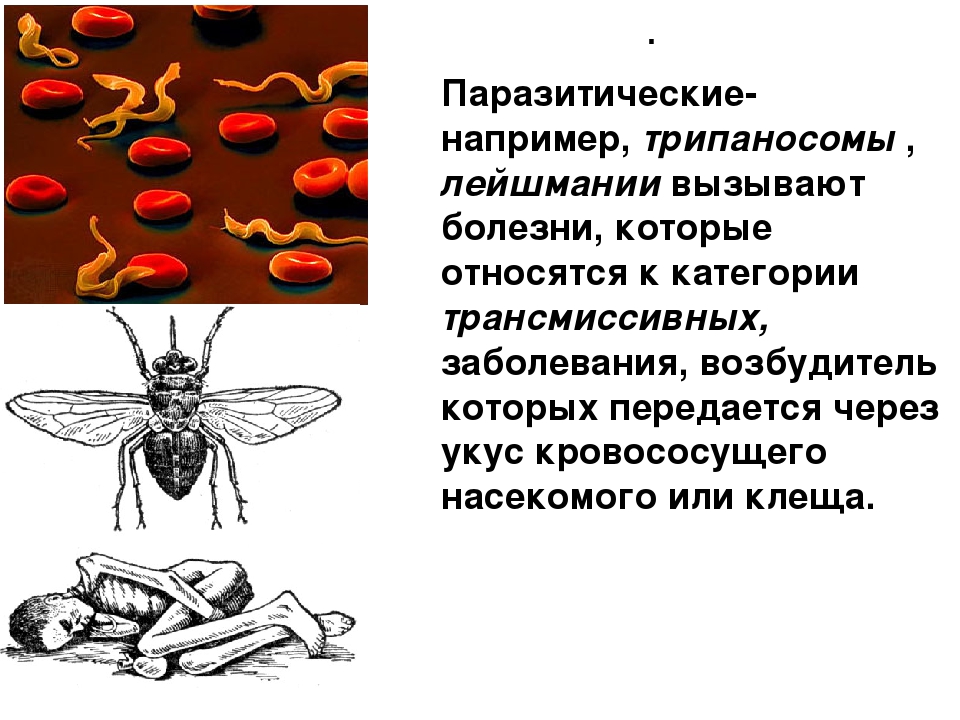 гл. 9—14). [c.45]
гл. 9—14). [c.45]
Конечно, кроме указанных нами недостатков методике взятия проб из полевых популяций насекомых для оценки значения паразитов присущи еще и другие. Нельзя также утверждать, что ни при каких обстоятельствах нельзя получить правильной оценки деятельности паразитов простым методом взятия проб. Цель этих замечаний состоит лишь в том, чтобы подчеркнуть необходимость осторожного использования полученных таким путем данных и чтобы оценка регуляторной способности любого вида энтомофагов не основывалась только на небольшом числе таких проб. Для правильного суждения о регуляторной способности паразитического вида необходимо полевое исследование его деятельности в разных условиях, которое позволяет оценить его эффективность гораздо лучше в общих выражениях, чем в сериях процентов заражения , хотя последние и могут быть полезны в связи с таким общим описанием. [c.319]
В отличие от позвоночных многие беспозвоночные животные приобрели способность к широкому использованию бескислородных местообитаний. Хорошо изучены три группы организмов, относящихся к этой категории черви (в особенности паразитические), литоральные двустворчатые моллюски и беспозвоночные, зарывающиеся в донные осадки. В этих группах представлен широкий спектр ограинзмов от облигатных анаэробов до факультативных анаэробов. Простое перечисление их местообитаний показывает, что здесь действуют совершенно иные (уже не физиологические, а экологические) факторы естественного отбора и что эксплуатативные механизмы стратегии, позволяющие приспособиться к постоянной аноксии, имеют здесь больше шансов на успех, чем компенсаторные , допускающие лишь временное пребывание в бескислородной среде. [c.60]
Хорошо изучены три группы организмов, относящихся к этой категории черви (в особенности паразитические), литоральные двустворчатые моллюски и беспозвоночные, зарывающиеся в донные осадки. В этих группах представлен широкий спектр ограинзмов от облигатных анаэробов до факультативных анаэробов. Простое перечисление их местообитаний показывает, что здесь действуют совершенно иные (уже не физиологические, а экологические) факторы естественного отбора и что эксплуатативные механизмы стратегии, позволяющие приспособиться к постоянной аноксии, имеют здесь больше шансов на успех, чем компенсаторные , допускающие лишь временное пребывание в бескислородной среде. [c.60]
Наиболее обычным естественным путем заражение насекомых микроспоридиями происходит через рот. Однако, помимо этого, некоторые из этих простейших передаются от поколения к поколению через яйцо, и известны примеры, когда они передавались от больных особей здоровым при помощи загрязненного яйцеклада паразитических перепончатокрылых. [c.412]
[c.412]
Как правило, передача патогенных организмов осуществляется -у насекомых через наружные отверстия, через покровы и путем наследственной передачи от родителей. Способы передачи могут быть и иными, как, например, при передаче в результате уколов паразитических насекомых, или укусов хищников, или каннибализма. Хотя передача через дыхательные пути является одним из наиболее обычных способов передачи болезней человека, нет или почти нет данных о том, что возбудители болезней насекомых передаются этим же путем. Наиболее обычным способом передачи различных патогенных организмов, помимо грибов, видимо, является передача через рот. Однако переход возбудителей от одного поколения хозяина к другому через яйца насекомых-хозяев, особенно когда речь идет о вирусах и простейших, у насекомых довольно распространен, как это было доказано в последние годы. [c.429]
Благодаря исследованиям последних лет расширились представления о спектре биологической активности полиеновых антибиотиков. Наряду с противогрибковой активностью у некоторых из них (лиеномицин, леворин, трихомицин и др.) обнаружено противоопухолевое, а также противовирусное действие (филипин, метиловый эфир амфотерицина В). Участились находки полиенов с высокой активностью в отношении паразитических простейших. Показана возможность использования полиенов для снижения уровня холестерина й крови. Получены данные, свидетельствующие о связи структуры полиеновых антибиотиков и их биологической активности. [c.197]
Наряду с противогрибковой активностью у некоторых из них (лиеномицин, леворин, трихомицин и др.) обнаружено противоопухолевое, а также противовирусное действие (филипин, метиловый эфир амфотерицина В). Участились находки полиенов с высокой активностью в отношении паразитических простейших. Показана возможность использования полиенов для снижения уровня холестерина й крови. Получены данные, свидетельствующие о связи структуры полиеновых антибиотиков и их биологической активности. [c.197]
Как правило, паразитические микроорганизмы можно разделить на две группы в соответствии с естественным методом проникновения в восприимчивых хозяев. Первая группа с контактным типом действия нормально заражает хозяина через покровы и включает энтомопатогенные грибы, а также некоторых энтомофильных нематод. Вторая группа, включающая бактерии, вирусы, простейших, риккетсии и многих нематод, содержит организмы, которые должны быть заглотаны насекомым для того, чтобы вызвать инфекцию. [c.461]
[c.461]
В цитоплазме много ДНК. Часть ее сосредоточена в митохондриях -энергетических станциях клетки, а у растений — в пластидах, осуществляющих фотосинтез, синтез крахмала, нигментов и др. эти органеллы цитоплазмы размножаются в клетке делением. Найдена ДНК также и вне таких органелл. Что она делает , какова ее роль в жизни клетки ДНК органелл участвует в их размножении или функционировании, несет информацию о некоторых важных белках, а остальной цитонлазмической ДНК могут быть приписаны разные функции от регуляции генетической изменчивости или синтеза белка до просто паразитического существования без всякой функции. [c.114]
Большинство червей ведут паразитический образ жизни, обитая либо на поверхности различных водных животных, либо поражая их внутренние органы. Ни одна группа водных животных и ряд групп растительных организмов не свободны от червей паразитов. Даже в простейших животных и водорослях поселяются черви. Паразитические черви приносят большой вред не только рыбам, но через них и человеку. Однако свободноживущие черви приносят и большую пользу, так как служат пищей для рыб. Некоторые из малощетинковых ТиЫ 1с1(1ае) участвуют в круговороте веществ в водоеме, транспортируя органические вещества из глубоких слоев ила иа его поверхность. Черви иаряду с другими организмами слу- жат хорошими индикаторами на условия существования в водоеме. Они используются исследователями при санитарно-биологической оценке поверхностных вод и при установлении процессов заиливания или размыва грунтов рек, имеющих большое значение при различного рода гидротехнических работах. [c.120]
Паразитические черви приносят большой вред не только рыбам, но через них и человеку. Однако свободноживущие черви приносят и большую пользу, так как служат пищей для рыб. Некоторые из малощетинковых ТиЫ 1с1(1ае) участвуют в круговороте веществ в водоеме, транспортируя органические вещества из глубоких слоев ила иа его поверхность. Черви иаряду с другими организмами слу- жат хорошими индикаторами на условия существования в водоеме. Они используются исследователями при санитарно-биологической оценке поверхностных вод и при установлении процессов заиливания или размыва грунтов рек, имеющих большое значение при различного рода гидротехнических работах. [c.120]
Некоторые свойства архебактерий, уникальные, сближающие их с эубактериями или эукариотами, суммированы в табл. 33. Ряд свойств архебактерий нельзя отнести ни к одной из перечисленных групп. Они у разных подгрупп различны и охватывают диапазон от типично эубактериальных до типично эукариотных. Обращает на себя внимание определенная эволюционная ограниченность этой группы прокариот. В ней отсутствуют патогенные, паразитические формы. Способность использовать органические вещества у больщинства ограничена простыми низкомолекулярными соединениями, что связывают с неспособностью синтезировать активные гидролитические ферменты. Клеточная организация архебактерий не обнаруживает той степени сложности, которая свойственна грамотрицательным эубактериям. Нет у архебактерий циклов развития, характерных для ряда эубактерий. [c.415]
В ней отсутствуют патогенные, паразитические формы. Способность использовать органические вещества у больщинства ограничена простыми низкомолекулярными соединениями, что связывают с неспособностью синтезировать активные гидролитические ферменты. Клеточная организация архебактерий не обнаруживает той степени сложности, которая свойственна грамотрицательным эубактериям. Нет у архебактерий циклов развития, характерных для ряда эубактерий. [c.415]
Одно из обычных затруднений, встречающихся в этом методе, — ползучесть раствора по стенкам кристаллизатора. Поднимаемый капиллярными силами раствор кристаллизуется на стенках и дает начало паразитическим кристаллам. Для борьбы с ползучестью применяется обмазывание стенок кристаллизатора выше уровня раствора инертным веществом — парафином, воском и т. д. Однако нельзя забывать, что при повышенной температуре эти вещества могут, давая пленку на поверхности раствора, существенно затормозить испарение. Ползучесть затормаживается, если кристаллизационный сосуд имеет наклонные внутрь стенки (заметим, что в этом случае переменна площадь испарения). Наблюдается связь между ползучестью и скоростью испарения. В связи с этим можно попытаться снизить скорость испарения. Ползучесть сильно зависит от кислотности раствора, что заметно проявляется, например, при кристаллизации КНОз. Поэтому можно также избавиться от ползучести, несколько меняя кислотность среды, если, конечно, это не отражается на качестве кристалла и не ведет к нежелательным химическим реакциям в растворе. Простой метод борьбы с ползучестью и связанным с ней запаразичиванием предложил И. В. Исаков [1973]. В крышке кристаллизатора делается отверстие с диаметром, существенно меньшим, чем диаметр кристаллизатора. В него плотно вставляется стеклянный цилиндр, нижний край которого должен находиться на высоте нескольких миллиметров над поверхностью раствора. Цилиндр сверху закрывается так же, как кристаллизатор в других случаях в этом методе. В пространстве вокруг цилиндра над раствором давление паров становится близким к давлению насыщения, испарение здесь затрудняется, и паразитические кристаллы не возникают.
Наблюдается связь между ползучестью и скоростью испарения. В связи с этим можно попытаться снизить скорость испарения. Ползучесть сильно зависит от кислотности раствора, что заметно проявляется, например, при кристаллизации КНОз. Поэтому можно также избавиться от ползучести, несколько меняя кислотность среды, если, конечно, это не отражается на качестве кристалла и не ведет к нежелательным химическим реакциям в растворе. Простой метод борьбы с ползучестью и связанным с ней запаразичиванием предложил И. В. Исаков [1973]. В крышке кристаллизатора делается отверстие с диаметром, существенно меньшим, чем диаметр кристаллизатора. В него плотно вставляется стеклянный цилиндр, нижний край которого должен находиться на высоте нескольких миллиметров над поверхностью раствора. Цилиндр сверху закрывается так же, как кристаллизатор в других случаях в этом методе. В пространстве вокруг цилиндра над раствором давление паров становится близким к давлению насыщения, испарение здесь затрудняется, и паразитические кристаллы не возникают. Единственная погрешность этого технического решения задачи — необходимость поддержания указанного расстояния между цилиндром и раствором, чего без усложнения конструкции не добиться. [c.86]
Единственная погрешность этого технического решения задачи — необходимость поддержания указанного расстояния между цилиндром и раствором, чего без усложнения конструкции не добиться. [c.86]
Некоторые инфекционные кишечные заболевания человека передаются через фекальные сточные воды. Патогенные, болезнетворные агенты, выделяемые с экскрементами больных людей, включают все главные категории простейших бактерии, вирусы, протозоа и паразитических червей. Вызываемые ими заболевания в большей степени распространены в тех местностях, где ие практикуется санитарная обработка фекальных масс перед их сбросом. Болезни, как известно, могут передаваться при непосредственном контакте с больными людьми,, через переносчиков болезней—насекомых (мух) или через загрязненную пищу и воду. Полный контроль за распространением болезней включает в себя реализацию программ здравоохранения, предусматри- [c.61]
Одни инфузории плавают в воде, другие прикрепляются к водным растениям и другим предметам, третьи пойзают. Пищей большинству инфузорий служат бактерии и мелкие водоросли, но есть среди них и хищники, питающиеся другими простейшими, в том числе и инфузориями. Немало инфузорий ведет паразитической образ жизни в организмах человека, животных и рыб. [c.41]
Пищей большинству инфузорий служат бактерии и мелкие водоросли, но есть среди них и хищники, питающиеся другими простейшими, в том числе и инфузориями. Немало инфузорий ведет паразитической образ жизни в организмах человека, животных и рыб. [c.41]
Можно различать функциональные типы симбиоза в зависимости от рода пользы, которую один или оба партнера извлекают из сожительства. Иногда тесная ассоциация улучшает питание, например благодаря тому, что один из партнеров фиксирует молекулярный азот, расщепляет целлюлозу, доставляет основные питательные вещества, витамины и т.п. Симбионт может выполнять сигнальную функцию, как в случае ассоциации светящихся бактерий и рыб. Возможна и защитная роль симбионта. Организм хозяина часто служит просто прибежищем для экто- и эндосимбиотических микроорганизмов иногда, однако, последние защищают хозяина от других-паразитических или патогенных — микробов (например, в кишечном тракте или на поверхности тела). [c.511]
А. Общее влияние промышленных, бытовых и сельскохозяйственных сточных вод. Сточные воды оказывают многоплановое влияние на сообщества водорослей и простейших снижают число имеющихся видов и количество особей данного вида, снижают скорость расселения водорослей и простейших, изменяют избирательность паразитического влияния на отдельные системы сообществ водорослей и простейших и др. Возможно, что большинство или даже все эти воздействия проявляются одно-вре.менио. [c.206]
Общее влияние промышленных, бытовых и сельскохозяйственных сточных вод. Сточные воды оказывают многоплановое влияние на сообщества водорослей и простейших снижают число имеющихся видов и количество особей данного вида, снижают скорость расселения водорослей и простейших, изменяют избирательность паразитического влияния на отдельные системы сообществ водорослей и простейших и др. Возможно, что большинство или даже все эти воздействия проявляются одно-вре.менио. [c.206]
Особую группу составляют сосущие инфузории (Su toria), ведущие паразитический образ жизни. Вместо ресничек у них имеются особые, полые внутри щупальцы, с помощью которых они высасывают содержимое клеток. Питаются они другими простейшими. [c.210]
Патология насекомых не ограничивается лишь описанием болезненных изменений в организме насекомых, она изучает возбудителей болезней, эпизоотологию и основные свойства и поведе-ние возбудителей болезней как в организме, так и вне организма хозяина. С другой стороны, патология яасекомых занимается только болезнями, вызываемыми микроорганизмами, простейшими и нематодами, в то время как патологические изменения в организме насекомых, вызываемые паразитическими членистоногими (энтомофагами) или неинфекционными причинами (инсектициды, пища, физические, химические или генетические факторы), обычно являются предметом изучения другах специальных отраслей. [c.10]
С другой стороны, патология яасекомых занимается только болезнями, вызываемыми микроорганизмами, простейшими и нематодами, в то время как патологические изменения в организме насекомых, вызываемые паразитическими членистоногими (энтомофагами) или неинфекционными причинами (инсектициды, пища, физические, химические или генетические факторы), обычно являются предметом изучения другах специальных отраслей. [c.10]
Связи простейших с насекомыми очень древние. Простейшие как физиологически примитивные организмы, а филогенетически значительно более древние господствовали в море и в пресных водах задолго до появления насекомых. Они проникали в тело насекомых с пищей, главным образом жидкой, и поселялись в их пищеварительном тракте. Таким путем образовалась группа простейших, живущих форетически в качестве спутников насекомых, питающихся веществами, содержащимися в их кишечном тракте. Часть из них приобрела настолько важные функции в кишечнике насекомых, что стала для видов и групп насекомых-хозяев совершенно обязательной, незаменимой. Жгутиковые простейшие в кишечнике термитов и других насекомых, питающихся древесиной, способствуют расщеплению целлюлозы и тем поставляют своим хозяевам белок за счет отмирающих особей. Некоторые виды простейших передвигаются по кишечному тракту в направлении, обратном перистальтике, и при поедании насекомыми пищи отрыгиваются наружу. Так специализировались жгутиковые. В иных случаях насекомые как переносчики инфекции включились в уже существующие циклы, но расширили круг организмов-хозяев, перенося инфекцию на новые виды, используемые для питания. В конечном итоге некоторые группы простейших приспособились к паразитическому образу жизни в насекомых, утратив некоторые органы движения, но взамен приобрели иные способности (образование покоящихся стадий, обеспечивающих перенос с одной особи на другую, способность паразитировать в тканях, увеличение коэффициента размножения). Таким образом в теле насекомых поселились форетические, симбионтные и в разной степени способные к паразитизму простейшие.
Жгутиковые простейшие в кишечнике термитов и других насекомых, питающихся древесиной, способствуют расщеплению целлюлозы и тем поставляют своим хозяевам белок за счет отмирающих особей. Некоторые виды простейших передвигаются по кишечному тракту в направлении, обратном перистальтике, и при поедании насекомыми пищи отрыгиваются наружу. Так специализировались жгутиковые. В иных случаях насекомые как переносчики инфекции включились в уже существующие циклы, но расширили круг организмов-хозяев, перенося инфекцию на новые виды, используемые для питания. В конечном итоге некоторые группы простейших приспособились к паразитическому образу жизни в насекомых, утратив некоторые органы движения, но взамен приобрели иные способности (образование покоящихся стадий, обеспечивающих перенос с одной особи на другую, способность паразитировать в тканях, увеличение коэффициента размножения). Таким образом в теле насекомых поселились форетические, симбионтные и в разной степени способные к паразитизму простейшие.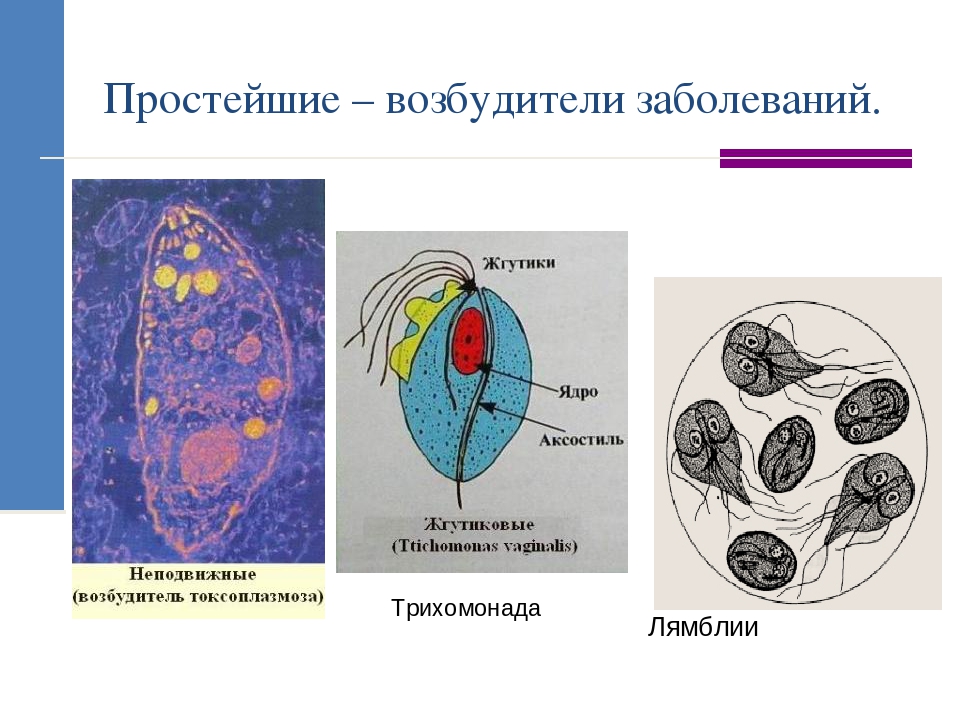 [c.386]
[c.386]
Сложные жизненные циклы паразитических простейших и червей характеризуются разнообразием и модификациями, которые, по-видимому, являются приспособлениями к различным и изменяющимся условиям обитания, где выживание было определяющим фактором [1974]. Жизненные циклы паразитических це-стод крайне сложны, но некоторые паразитические перепончатокрылые проходят в процессе развития ряд различных фаз, которые не менее своеобразны. Вместо описания типичных жизненных циклов на филогенетической или таксономической основе, как это сделано Клозеном [348] и Суитменом [1980], здесь описана биология энтомофагов с большей или меньшей [c.135]
Мандибулы у личинок хальцид обычно треугольной формы, с тонкой заостренной вершиной. У большинства видов мандибулы простые, но у ряда видов на каждом конце жевательного края находится ряд мелких зубцов. Мандибулы с двумя большими зубцами, одним близ середины и другим верхушечным, по-видимому, свойственны растительноядным видам.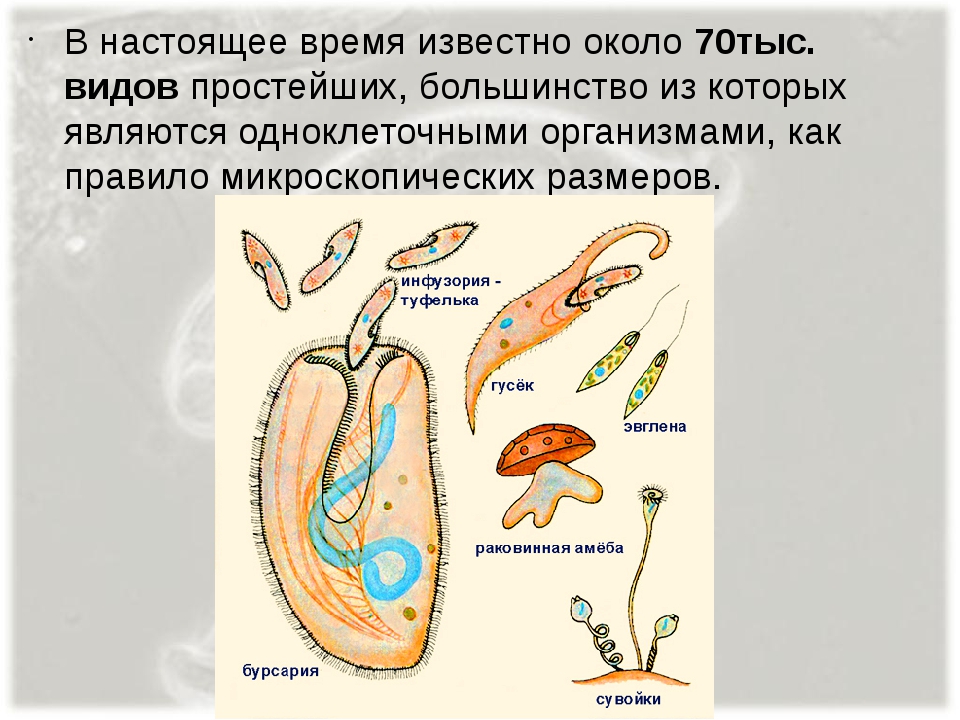 Паразитические виды из семейств, представители которых в основном ведут растительноядный образ жизни, могут иметь двузубчатые мандибулы, как, например, Eurytoma. Согласно Паркеру [1533], двураздельные мандибулы редко встречаются у hal idoidea. [c.154]
Паразитические виды из семейств, представители которых в основном ведут растительноядный образ жизни, могут иметь двузубчатые мандибулы, как, например, Eurytoma. Согласно Паркеру [1533], двураздельные мандибулы редко встречаются у hal idoidea. [c.154]
Паразитические простейшие. Простейшие — Справочник химика 21
Предполагают что протозойные болезни насекомых имеют намного большее распространение, чем это принято считать. Вероятно, интенсивное изучение этой группы организмов позволит вооружить специалистов по защите растений методами практического применения паразитических простейших в биологической борьбе с некоторыми вредителями. [c.238] Несомненно, имеются штаммы простейших, развитие которых может происходить только в теле насекомого-хозяина. Паразит проникает в жировое тело и уничтожает его. После гибели хозяина паразит сразу же покидает его через кожный покров и быстро проникает в тело нового хозяина. При таком способе перехода сохраняются паразитические свойства простейшего. Культивирование таких штаммов на искусственной среде снижает их патогенность. [c.553]
При таком способе перехода сохраняются паразитические свойства простейшего. Культивирование таких штаммов на искусственной среде снижает их патогенность. [c.553]
Среди 15 000 известных видов простейших около 1200 паразитирует на насекомых. Для большинства паразитических простейших насекомые являются промежуточными хозяевами и служат для их переноса на растения, животных и человека. С точки зрения патологии насекомых важны именно те виды простейших возбудителей, которые вызывают заметные нарушения в организме. [c.346]
Заражение насекомых. Для определения уровня зараженности и влияния паразитических простейших на насекомых, а также возможности использования их в микробиологической борьбе нужно проводить разнообразные испытания. Обычно насекомым дают натуральный или искусственный корм, зараженный простейшими. [c.354]
Следует изучить потенциальную способность различных насекомых к заражению паразитическими простейшими. Это даст возможность установить, какие именно из простейших нуждаются в массовом разведении и какие вредители являются лучшим объектом для борьбы. Эти исследования должны также касаться вопросов хранения спор или цист с сохранением их жизнеспособности и методов применения их в микробиологической борьбе. [c.357]
Это даст возможность установить, какие именно из простейших нуждаются в массовом разведении и какие вредители являются лучшим объектом для борьбы. Эти исследования должны также касаться вопросов хранения спор или цист с сохранением их жизнеспособности и методов применения их в микробиологической борьбе. [c.357]
Таким образом, в области практического применения микроспоридий сделаны первые и обнадеживающие шаги, свидетельствующие о перспективности утоп группы паразитических простейших для использования в биологической борьбе. [c.372]
Антитела к бактериальным токсинам, антигенам бактерий, вирусов, паразитических простейших, гельминтов и грибов. [c.16]
Какая из форм иммунного ответа будет эффективной, зависит в значительной мере от локализации инфекции и типа возбудителя. Наиболее существенно при этом, проникают микробы внутрь клеток организма-хозяина или нет. Для того чтобы ликвидировать внутриклеточную инфекцию — такую вызывают все вирусы, некоторые бактерии и ряд паразитических простейших — иммунная система должна распознать и разрушить инфицированные клетки. В случае внеклеточного размножения инфицирующего агента в тканях, жидкостях или полостях организма — это характерно для многих бактерий и более крупных возбудителей — иммунный ответ совершенно [c.1]
В случае внеклеточного размножения инфицирующего агента в тканях, жидкостях или полостях организма — это характерно для многих бактерий и более крупных возбудителей — иммунный ответ совершенно [c.1]
У некоторых организмов анабиоз наблюдается при значительном повышении или снижении температуры окружающей среды. Так, простейшие, дафнии, циклопы, насекомые могут вмерзать в лед, а при оттаивании обнаруживают все признаки жизии. У других организмов анабиоз проявляется при высушивании. Обитатели луж и болот — коловратки, низшие ракообразные, простейшие — при пересыхании водоемов также впадают в состояние скрытой жизни. Во время анабиоза некоторые из них покрываются плотной оболочкой. Многие паразитические простейшие в период пребывания во внешней среде также покрываются оболочкой и длительное время могут находиться в форме цисты, пока не попадут в нужный для них организм. Инцистированные инфузории оставались живыми до 6 лет. [c.455]
Современный период химиотерапии (лечения болезней при помощи химических веществ) начался с работ Пауля Эрлиха (1854—1915).
 В начале текущего столетия было известно, что ряд органических соединений мышьяка обладает способностью убивать простейших —паразитические микроорганизмы, вызывающие многие тяжелые заболевания. Эрлих поставил перед собой задачу синтезировать большое число соединений мышьяка и попытаться найти такое, которое одновременно обладало бы токсичностью (являлось бы ядом) по отношению к простейшим, паразитирующим в человеческом теле, и не оказывало бы вредного действия на самого человека. Эрлих получил много соединений [c.422]
В начале текущего столетия было известно, что ряд органических соединений мышьяка обладает способностью убивать простейших —паразитические микроорганизмы, вызывающие многие тяжелые заболевания. Эрлих поставил перед собой задачу синтезировать большое число соединений мышьяка и попытаться найти такое, которое одновременно обладало бы токсичностью (являлось бы ядом) по отношению к простейшим, паразитирующим в человеческом теле, и не оказывало бы вредного действия на самого человека. Эрлих получил много соединений [c.422] Выращивание кристаллов, лежащих просто на дне кристаллизатора, без кристаллоносца, по целому ряду причин применяется редко. В числе таких причин — опасность растворения затравки в недосыщенном растворе, возможность ее соприкосновения с паразитическими кристаллами, затруднения в питании кристалла. Для того чтобы обеспечить наиболее благоприятные условия роста, приходится применять специальные держатели — кристаллоносцы, от устройства которых часто зависит успех опыта. [c.150]
[c.150]
Благодаря исследованиям последних лет расширились представления о спектре биологической активности полиеновых антибиотиков. Наряду с противогрибковой активностью у некоторых из них (лиеномицин, леворин, трихомицин и др.) обнаружено противоопухолевое, а также противовирусное действие (филипин, метиловый эфир амфотерицина В). Участились находки полиенов с высокой активностью в отношении паразитических простейших. Показана возможность использования полиенов для снижения уровня холестерина й крови. Получены данные, свидетельствующие о связи структуры полиеновых антибиотиков и их биологической активности. [c.197]
Сложные жизненные циклы паразитических простейших и червей характеризуются разнообразием и модификациями, которые, по-видимому, являются приспособлениями к различным и изменяющимся условиям обитания, где выживание было определяющим фактором [1974]. Жизненные циклы паразитических це-стод крайне сложны, но некоторые паразитические перепончатокрылые проходят в процессе развития ряд различных фаз, которые не менее своеобразны.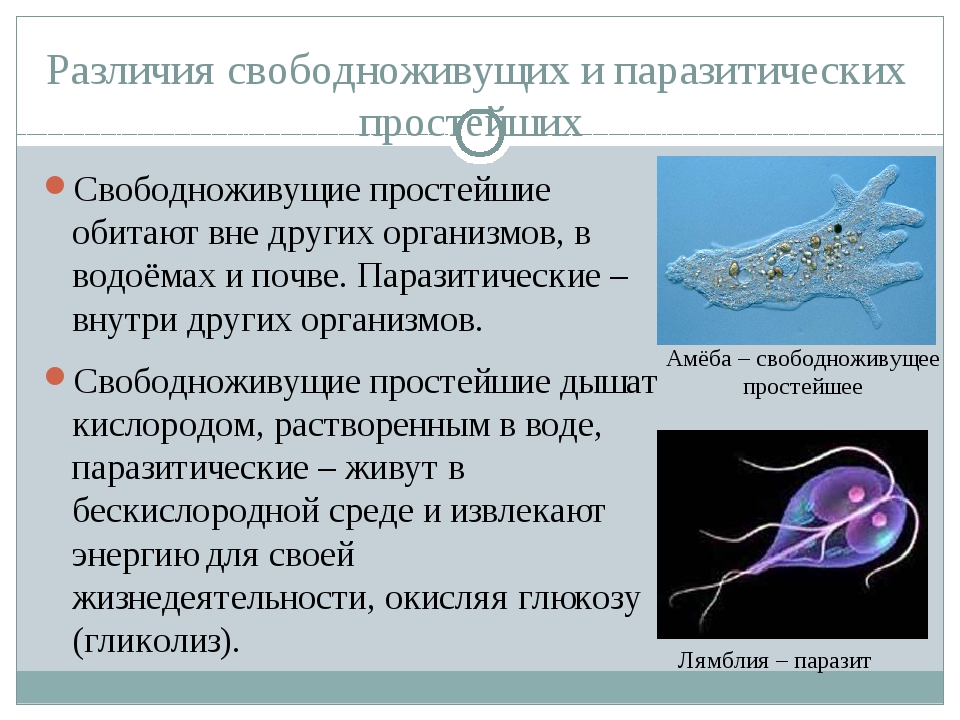 Вместо описания типичных жизненных циклов на филогенетической или таксономической основе, как это сделано Клозеном [348] и Суитменом [1980], здесь описана биология энтомофагов с большей или меньшей [c.135]
Вместо описания типичных жизненных циклов на филогенетической или таксономической основе, как это сделано Клозеном [348] и Суитменом [1980], здесь описана биология энтомофагов с большей или меньшей [c.135]
Согласно Танаде [1996], с теоретической точки зрения энтомопатогенные простейшие обладают значительной перспективой в микробиологической борьбе в связи с большим количеством паразитических видов, обнаруженных у насекомых. Однако вследствие трудностей производства и других проблем было сделано лишь немного попыток использования их в микробиологической борьбе, и в последние годы Вейзер [2252] в Чехословакии был главным поборником использования простейших против вред- [c.471]
Паразитические простейшие известны практически у каждого более подробно исследованного вида насекомого. Иногда один вид простейших инфицирует ряд носителей. В других случаях один хозяин имеет ряд возбудителей протозойной инфекции. Только в Средней Европе нам известно 28 000 видов насекомых, что составляет около 4% от общего количества встречающихся в мире. Если бы каждый вид насекомых имел свою инфекцию, пришлось бы хвдентифицировать 28 ООО видов инфекционных заболеваний. Следовательно, мы должны обращать внимание на каждый признак инфекции, а также искать и оценивать другие признаки. Однако основными показателями диагноза являются постоянные признаки, которые не подлежат вариабельности. Лишь экспериментальное заражение простейшими, разрабатываемое в последние 20 лет, показало вариабельность, которая наблюдается у отдельных видов, если их переносить на разных хозяев. Их изменения бывают иногда настолько необычными, что без знания взаимозависимостей они могут быть описаны вновь на новом хозяине. Тот, кто изучал сухие и влажные мазки и срезы из стадий определенного вида, наблюдал, какие различия создают три разных [c.284]
Если бы каждый вид насекомых имел свою инфекцию, пришлось бы хвдентифицировать 28 ООО видов инфекционных заболеваний. Следовательно, мы должны обращать внимание на каждый признак инфекции, а также искать и оценивать другие признаки. Однако основными показателями диагноза являются постоянные признаки, которые не подлежат вариабельности. Лишь экспериментальное заражение простейшими, разрабатываемое в последние 20 лет, показало вариабельность, которая наблюдается у отдельных видов, если их переносить на разных хозяев. Их изменения бывают иногда настолько необычными, что без знания взаимозависимостей они могут быть описаны вновь на новом хозяине. Тот, кто изучал сухие и влажные мазки и срезы из стадий определенного вида, наблюдал, какие различия создают три разных [c.284]
Интродукцию можно было бы осуществить так выпустить в природу зараженных в лаборатории насекомых, которые, разлетаясь, заражали бы насекомых местных популяций. Это осуществимо, когда, нанример, микроспоридии переносятся трансовариально. Зараженный самец мог бы заразить самку во время копуляции. Можно также интродуцировать полезные организмы, опрыскивая или опыливая растения спорами простейших, а также вводя мертвых или зараженных насекомых в биотопы с вредными насекомыми. В некоторых случаях можно использовать приманки, содержащие трофические или покоящиеся стадии паразитических простейших. [c.355]
Зараженный самец мог бы заразить самку во время копуляции. Можно также интродуцировать полезные организмы, опрыскивая или опыливая растения спорами простейших, а также вводя мертвых или зараженных насекомых в биотопы с вредными насекомыми. В некоторых случаях можно использовать приманки, содержащие трофические или покоящиеся стадии паразитических простейших. [c.355]
Возбудители малярии — паразитические простейшие из рода плазмодиев Plasmodium). Патогенны четыре вида, но большинство случаев связаны с двумя из них. P.vivax встречается в субтропиках и вызывает так называемую трехдневную лихорадку P.fal iparum распространен шире, дает больший процент летальных исходов и обусловливает тропическую малярию. Из многочисленных болезней, распространенных на африканском континенте, именно эта уносит максимальное число человеческих жизней. [c.211]
Паразитические простейшие и черви значительно крупнее бактерий и вирусов рис. 18.4) и соответственно обладают большим количеством и разнообразием антигенов.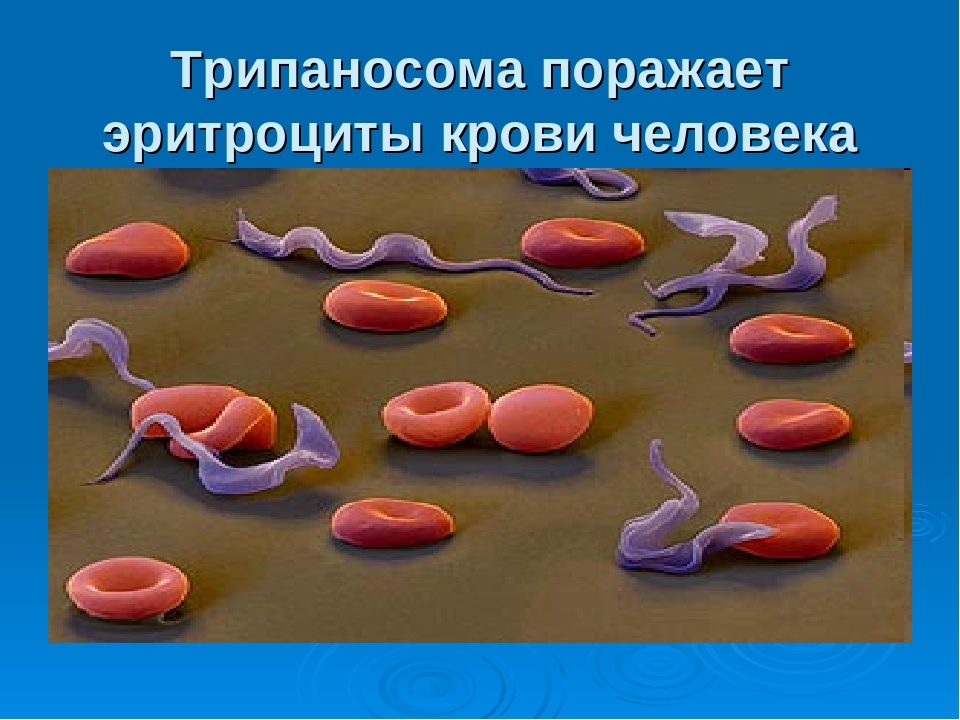 Для некоторых видов характерна смена поверхностных антигенов -антигенная изменчивость. Паразиты, имеюшие сложный жизненный цикл, могут экспрессировать некоторые антигены только на определенной стадии развития, вызывая соответствующий специфический иммунный ответ. Так, у малярийных паразитов белковая оболочка спорозоита (инфекционная, или расселительная, стадия, в виде которой плазмодий передается комарами и инфицирует организм-хозяин) вызывает образование специфичных антител, не реагирующих с паразитом на эритроцитарной стадии его цикла развития. Паразитический червь Т. spiralis на раз- [c.337]
Для некоторых видов характерна смена поверхностных антигенов -антигенная изменчивость. Паразиты, имеюшие сложный жизненный цикл, могут экспрессировать некоторые антигены только на определенной стадии развития, вызывая соответствующий специфический иммунный ответ. Так, у малярийных паразитов белковая оболочка спорозоита (инфекционная, или расселительная, стадия, в виде которой плазмодий передается комарами и инфицирует организм-хозяин) вызывает образование специфичных антител, не реагирующих с паразитом на эритроцитарной стадии его цикла развития. Паразитический червь Т. spiralis на раз- [c.337]
Из этого правила имеются некоторые исключения например, паразитическое простейшее Т. gondii способно не только заражать все содержащие ядро клетки млекопитающих и размножаться в них, но также инфицировать незрелые эритроциты млекопитающих, культивируемые клетки насекомых и ядерные эритроциты птиц и рыб. Сходным образом, свиной солитер способен заражать человека.
 [c.338]
[c.338]Для успешного внедрения и развития в организ-ме-хозяине паразитам необходимо избежать действия его защитных механизмов, поэтому паразитические простейшие и гельминты обладают способностью обходить их разнообразными способами. Некоторые из паразитов даже ис- [c.349]
Вместе с тем представление о катаморфозе как о специализации, связанной с упрощением организации — общей дегеперацней, нуждается в уточнении. Это положение трудно применимо к паразитическим простейшим. Переход к паразитизму у жгутиковых н инфузорий часто связан не с упрощением, а с усложнением организации, интерпретируемым как ароморфоз (Догель, 1954 Полянский, 1970, 1972). Подобная ситуация вполне объяснима именно для одноклеточных организмов, для которых химическая среда является основным комплексом факторов, требующих адаптации. Химизм же среды для паразитических форм несравненно сложнее, чем для свободно живущих, прежде всего благодаря большему разнообразию биологически активных веществ внутри организма-хозяина, чем в естественных водоемах или в почвенной воде. В этом своеобразии реакция адаптации простейших к условиям паразитизма состоит одно из выражений своеобразия организации простейших как клеток-организмов (Полянский, 1970, 1972). [c.201]
В этом своеобразии реакция адаптации простейших к условиям паразитизма состоит одно из выражений своеобразия организации простейших как клеток-организмов (Полянский, 1970, 1972). [c.201]
Антибиотики, продуцируемые высшими растениями,— фитонциды (от греч. phyton — растение и лат. aedere — убивать), открыты в 1928 г, советским ученым Б. П. Токиным. Они губительны для бактерий, грибов, простейших и некоторых других организмов. Большинство фитонцидов— летучие вещества, действующие иа расстоянии. Но некоторые малолетучие и нелетучие вещества, образуемые растениями, обладают теми же свойствами. Фитонциды играют существенную роль в биологической очистке воздуха. В сосновых р кедровых лесах воздух практически не содержит микробов. Мощные продуценты фитонцидов — лук и чеснок. Фитонциды нашли применение в медицине. Их используют при лечении гноящихся ран, дизентерии, некоторых заболеваниях, вызываемых паразитическими простейшими. [c.458]
Большинство червей ведут паразитический образ жизни, обитая либо на поверхности различных водных животных, либо поражая их внутренние органы. Ни одна группа водных животных и ряд групп растительных организмов не свободны от червей паразитов. Даже в простейших животных и водорослях поселяются черви. Паразитические черви приносят большой вред не только рыбам, но через них и человеку. Однако свободноживущие черви приносят и большую пользу, так как служат пищей для рыб. Некоторые из малощетинковых ТиЫ 1с1(1ае) участвуют в круговороте веществ в водоеме, транспортируя органические вещества из глубоких слоев ила иа его поверхность. Черви иаряду с другими организмами слу- жат хорошими индикаторами на условия существования в водоеме. Они используются исследователями при санитарно-биологической оценке поверхностных вод и при установлении процессов заиливания или размыва грунтов рек, имеющих большое значение при различного рода гидротехнических работах. [c.120]
Ни одна группа водных животных и ряд групп растительных организмов не свободны от червей паразитов. Даже в простейших животных и водорослях поселяются черви. Паразитические черви приносят большой вред не только рыбам, но через них и человеку. Однако свободноживущие черви приносят и большую пользу, так как служат пищей для рыб. Некоторые из малощетинковых ТиЫ 1с1(1ае) участвуют в круговороте веществ в водоеме, транспортируя органические вещества из глубоких слоев ила иа его поверхность. Черви иаряду с другими организмами слу- жат хорошими индикаторами на условия существования в водоеме. Они используются исследователями при санитарно-биологической оценке поверхностных вод и при установлении процессов заиливания или размыва грунтов рек, имеющих большое значение при различного рода гидротехнических работах. [c.120]
Смешанное кислое брожение встречается не только у бактерий. Так, трихомонады, паразитические жгутиковые, относящиеся к типу простейших, тоже способны в анаэробных условиях превращать пируват в ацетат, сукцинат, СО2 и Н2. У этих организмов нет митохондрий, но имеются напоминающие микротельца частицы, названные гидрогеносома-ми, способные превращать пируват в ацетат, СО2 и Нг [39]. Фермент, катализирующий расщепление пирувата, по-видимому, не содержит ли-поата и, возможно, близок по свойствам пируват ферредоксин—оксидо-редуктазе клостридий [уравнение (8-66)]. В гидрогеносомах находится также активная гидрогеназа. [c.351]
У этих организмов нет митохондрий, но имеются напоминающие микротельца частицы, названные гидрогеносома-ми, способные превращать пируват в ацетат, СО2 и Нг [39]. Фермент, катализирующий расщепление пирувата, по-видимому, не содержит ли-поата и, возможно, близок по свойствам пируват ферредоксин—оксидо-редуктазе клостридий [уравнение (8-66)]. В гидрогеносомах находится также активная гидрогеназа. [c.351]
Некоторые свойства архебактерий, уникальные, сближающие их с эубактериями или эукариотами, суммированы в табл. 33. Ряд свойств архебактерий нельзя отнести ни к одной из перечисленных групп. Они у разных подгрупп различны и охватывают диапазон от типично эубактериальных до типично эукариотных. Обращает на себя внимание определенная эволюционная ограниченность этой группы прокариот. В ней отсутствуют патогенные, паразитические формы. Способность использовать органические вещества у больщинства ограничена простыми низкомолекулярными соединениями, что связывают с неспособностью синтезировать активные гидролитические ферменты. Клеточная организация архебактерий не обнаруживает той степени сложности, которая свойственна грамотрицательным эубактериям. Нет у архебактерий циклов развития, характерных для ряда эубактерий. [c.415]
Клеточная организация архебактерий не обнаруживает той степени сложности, которая свойственна грамотрицательным эубактериям. Нет у архебактерий циклов развития, характерных для ряда эубактерий. [c.415]
Одно из обычных затруднений, встречающихся в этом методе, — ползучесть раствора по стенкам кристаллизатора. Поднимаемый капиллярными силами раствор кристаллизуется на стенках и дает начало паразитическим кристаллам. Для борьбы с ползучестью применяется обмазывание стенок кристаллизатора выше уровня раствора инертным веществом — парафином, воском и т. д. Однако нельзя забывать, что при повышенной температуре эти вещества могут, давая пленку на поверхности раствора, существенно затормозить испарение. Ползучесть затормаживается, если кристаллизационный сосуд имеет наклонные внутрь стенки (заметим, что в этом случае переменна площадь испарения). Наблюдается связь между ползучестью и скоростью испарения. В связи с этим можно попытаться снизить скорость испарения. Ползучесть сильно зависит от кислотности раствора, что заметно проявляется, например, при кристаллизации КНОз. Поэтому можно также избавиться от ползучести, несколько меняя кислотность среды, если, конечно, это не отражается на качестве кристалла и не ведет к нежелательным химическим реакциям в растворе. Простой метод борьбы с ползучестью и связанным с ней запаразичиванием предложил И. В. Исаков [1973]. В крышке кристаллизатора делается отверстие с диаметром, существенно меньшим, чем диаметр кристаллизатора. В него плотно вставляется стеклянный цилиндр, нижний край которого должен находиться на высоте нескольких миллиметров над поверхностью раствора. Цилиндр сверху закрывается так же, как кристаллизатор в других случаях в этом методе. В пространстве вокруг цилиндра над раствором давление паров становится близким к давлению насыщения, испарение здесь затрудняется, и паразитические кристаллы не возникают. Единственная погрешность этого технического решения задачи — необходимость поддержания указанного расстояния между цилиндром и раствором, чего без усложнения конструкции не добиться. [c.
Поэтому можно также избавиться от ползучести, несколько меняя кислотность среды, если, конечно, это не отражается на качестве кристалла и не ведет к нежелательным химическим реакциям в растворе. Простой метод борьбы с ползучестью и связанным с ней запаразичиванием предложил И. В. Исаков [1973]. В крышке кристаллизатора делается отверстие с диаметром, существенно меньшим, чем диаметр кристаллизатора. В него плотно вставляется стеклянный цилиндр, нижний край которого должен находиться на высоте нескольких миллиметров над поверхностью раствора. Цилиндр сверху закрывается так же, как кристаллизатор в других случаях в этом методе. В пространстве вокруг цилиндра над раствором давление паров становится близким к давлению насыщения, испарение здесь затрудняется, и паразитические кристаллы не возникают. Единственная погрешность этого технического решения задачи — необходимость поддержания указанного расстояния между цилиндром и раствором, чего без усложнения конструкции не добиться. [c. 86]
86]
Вирусы. Простейшие существа и серьёзные задачи для учёных — Краевой фонд науки
28 апреля 2020
Поделиться
Так уж повелось, что о многих вещах человек задумывается, когда появляется проблема. Объявили пандемию – и все стали чаще мыть руки, в общественных местах появились антисептики, а ручки дверей стали усиленно протирать. Вирусы были рядом с нами всегда. Но так ли хорошо мы их знаем и готовы ли защищаться от них не только в период пандемии? О том, кто или что такое вирусы, как они размножаются и почему их нужно не истреблять, а изучать, рассказывает эксперт Красноярского краевого фонда науки, заведующая кафедрой биофизики СФУ, профессор, доктор биологических наук Валентина Александровна Кратасюк.
-Валентина Александровна, человечество не первый раз сталкивается с вирусами. Что они собой представляют?
— Вирусы –это простейшие
существа. Настолько простые, что идет спор о том, живые ли это существа или
нет. Это связано, в первую очередь, с тем, что вирусы не могут размножаться вне живых клеток. У
вирусов нет собственного обмена веществ, а для синтеза своих молекул им
необходима клетка-хозяин. При
этом устроен вирус идеально для такого паразитического поведения. В отличие от
клеток живых организмов вирусы не имеют клеточной оболочки, органелл,
протоплазмы и других компонентов клетки.
Все вирусы состоят из двух основных типов молекул –наследственного
материала (РНК –рибонуклеиновая кислота или ДНК –дезоксирибонуклеиновая
кислота) и белковой оболочки. Жизненный цикл вируса состоит в том, что
нуклеиновая кислота проникает в клетку и, используя возможности клетки,
нарабатывает свою ДНК или РНК, а также
свои белки. Затем вирусные частицы самопроизвольно собираются в инфицированной
клетке, разрушая ее, и уже батальоны
вирусов продолжают свое черное дело.
Это связано, в первую очередь, с тем, что вирусы не могут размножаться вне живых клеток. У
вирусов нет собственного обмена веществ, а для синтеза своих молекул им
необходима клетка-хозяин. При
этом устроен вирус идеально для такого паразитического поведения. В отличие от
клеток живых организмов вирусы не имеют клеточной оболочки, органелл,
протоплазмы и других компонентов клетки.
Все вирусы состоят из двух основных типов молекул –наследственного
материала (РНК –рибонуклеиновая кислота или ДНК –дезоксирибонуклеиновая
кислота) и белковой оболочки. Жизненный цикл вируса состоит в том, что
нуклеиновая кислота проникает в клетку и, используя возможности клетки,
нарабатывает свою ДНК или РНК, а также
свои белки. Затем вирусные частицы самопроизвольно собираются в инфицированной
клетке, разрушая ее, и уже батальоны
вирусов продолжают свое черное дело.
— Действительно ли коронавирус опаснее других, известных человеку? И если да, то чем?
— Коронавирус
— это РНК-содержащий вирус, передающийся людям и животным.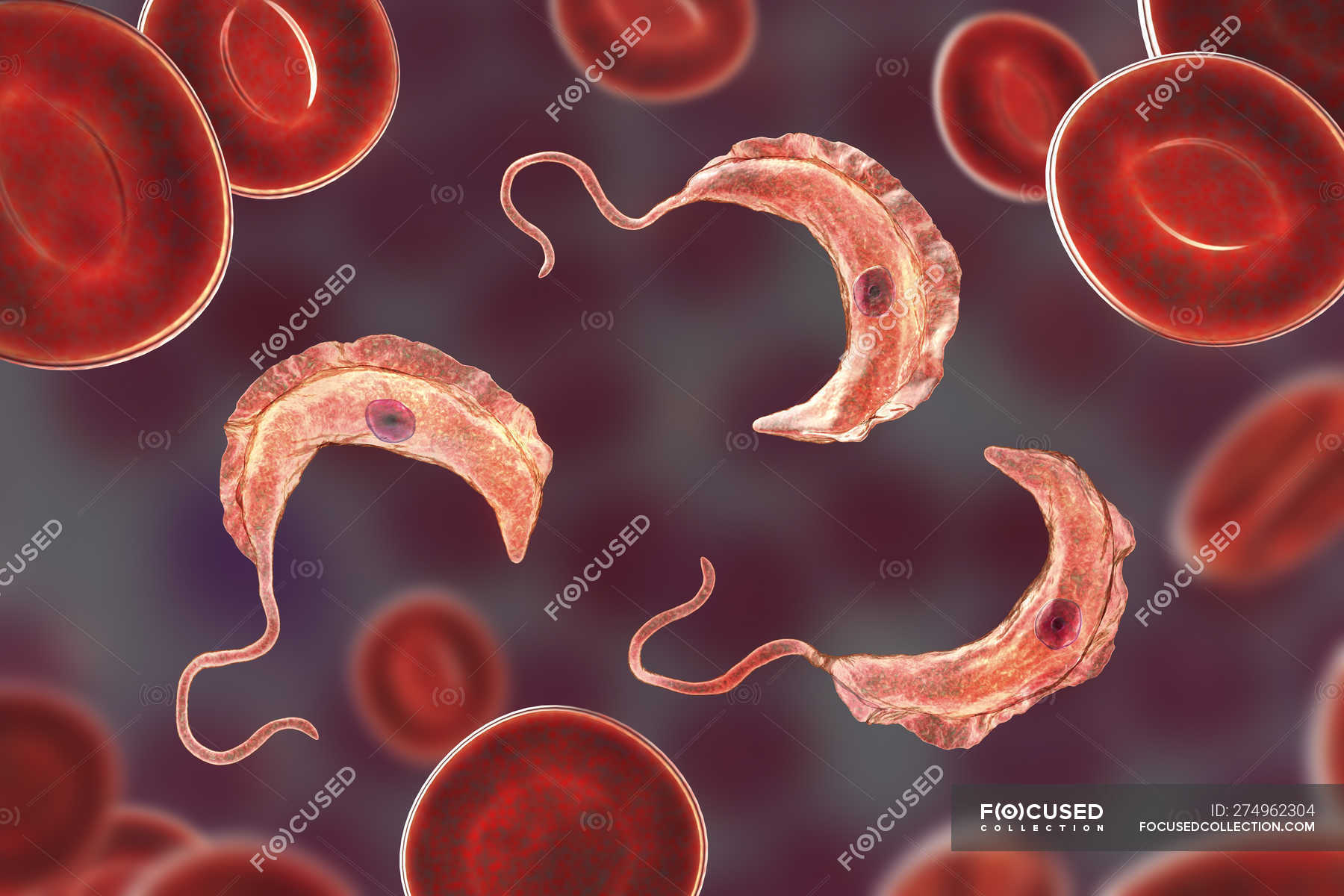 2019-nCoV — это
новый штамм коронавируса, который произошел от диких животных (предположительно
— от летучих мышей). Пути передачи: воздушно-капельный (вирус выделяется при
разговоре, чихании, кашле) и контактный (например, при касании грязными руками
лица, носа, глаз). 2019-nCoV в 2-3 раза менее заразен, чем корь, и в 2-3 раза
заразнее гриппа. Процент летальности — 2,3%.
2019-nCoV — это
новый штамм коронавируса, который произошел от диких животных (предположительно
— от летучих мышей). Пути передачи: воздушно-капельный (вирус выделяется при
разговоре, чихании, кашле) и контактный (например, при касании грязными руками
лица, носа, глаз). 2019-nCoV в 2-3 раза менее заразен, чем корь, и в 2-3 раза
заразнее гриппа. Процент летальности — 2,3%.
38 видов короновируса известны науке, но только 6 из них передаются человеку. Новый вирус отличается большей активностью. Это пневмотропный вирус, то есть он поражает легкие человека. Все вирусные инфекции одинаковы и поэтому затруднена точная диагностика. Наши новосибирские коллеги быстро разработали диагностический метод на короновирус. Честь им и хвала.
— Какие вирусы за историю человечества приводили к эпидемиям и какие из них удалось победить?
— Всем известны ежегодные эпидемии гриппа. В
1918-1920 годах была печально известная «испанка», вызванная вирусом
h2N1, от которой пострадало 20 — 40% населения Земли в Испании, Швейцарии,
Португалии, Сербии, Греции, Англии и других государствах. Можно также вспомнить
пандемию 1957 года («Азиатский грипп») и 1968 года («Гонконгский
грипп»). В 2001 году в Европе была
большая вспышка ящура, привезенного из Восточной или Юго-Восточной Азии через
продукты животного происхождения. В
2003-2005 годах вирус H5N1 вызвал сильнейшую в истории вспышку гриппа среди птиц,
которая привела и к гибели людей. Мы еще помним эпидемию атипичной пневмонии. И
все эти эпидемии удалось победить.
Можно также вспомнить
пандемию 1957 года («Азиатский грипп») и 1968 года («Гонконгский
грипп»). В 2001 году в Европе была
большая вспышка ящура, привезенного из Восточной или Юго-Восточной Азии через
продукты животного происхождения. В
2003-2005 годах вирус H5N1 вызвал сильнейшую в истории вспышку гриппа среди птиц,
которая привела и к гибели людей. Мы еще помним эпидемию атипичной пневмонии. И
все эти эпидемии удалось победить.
Следует еще отметить, что российская эпидемиологическая служба имеет большой опыт борьбы с инфекциями, который опирается на опыт эпидемиологов двух прошлых столетий. Сложность настоящей ситуации состоит в том, что очень сильно увеличилась миграция, и потому одним из важных средств защиты от заражения является изоляция и карантин.
— Есть ли какой-то общий алгоритм борьбы с вирусами?
Конечно. Нужно приостановить размножение вирусов, что можно сделать разными путями, например, с помощью ферментов, разрушающих их генетический материал и не позволяющих копировать РНК и ДНК. Так, для лечения энцефалита, вызванного РНК-овым вирусом, используют препараты рибонуклеазы наряду со специфическим гамма-глобулином. Для защиты от вирусов в России активно используют препараты интерферона. Но надо помнить, что это заместительная терапия. При инфицировании вирусом собственный интерферон появляется на 4-5 день заболевания, потому интерферон применяют для профилактики и лечения в первые 4-5 дней заболевания.
Так, для лечения энцефалита, вызванного РНК-овым вирусом, используют препараты рибонуклеазы наряду со специфическим гамма-глобулином. Для защиты от вирусов в России активно используют препараты интерферона. Но надо помнить, что это заместительная терапия. При инфицировании вирусом собственный интерферон появляется на 4-5 день заболевания, потому интерферон применяют для профилактики и лечения в первые 4-5 дней заболевания.
Сейчас продают большое количество иммуномоделирующих препаратов, таких как Кагоцел, которые имитируют проникновение вируса в организм и стимулируют иммунную систему, но они нужны в первую очередь для профилактики заболевания, а не для лечения.
Кстати, вирусы прекрасно истребляются спиртом, на чём основано действие антисептиков, и перекисью водорода, а также полезна рекомендация почаще мыть руки.
С новым коронавирусом оказалось важным сохранить молодость. Может, стоит подумать об этом?
— Каков механизм появления новых вирусов и можно ли как-то противостоять их появлению?
Как и все живые организмы,
вирусы эволюционизируют, то есть появляются новые вирусы, за счет мутаций в генетическом
материале. РНК–вирусы имеют маленький период
размножения и повышенную частоту мутаций (одна точечная мутация или более на
геном за один раунд репликации РНК вируса). Такая повышенная частота мутаций
позволяет вирусам быстро адаптироваться к изменениям в окружающей среде. Быстрое
мутирование вирусов также вызывает проблемы с разработкой действенных вакцин и
противовирусных препаратов, так как мутации устойчивости к новым лекарственным
препаратам возникают очень быстро. Потому и есть трудности в создании защиты от
ежегодных эпидемий гриппа. Появляется новый мутированный вирус, для истребления
которого может не пригодиться прошлогодняя вакцина. Эволюцию невозможно
остановить. Да и нужно ли истреблять вирусы? Например, свойство вирусов
проникать в клетки используется широко в генетической инженерии и молекулярной
биологии для создания рекомбинантных организмов.
РНК–вирусы имеют маленький период
размножения и повышенную частоту мутаций (одна точечная мутация или более на
геном за один раунд репликации РНК вируса). Такая повышенная частота мутаций
позволяет вирусам быстро адаптироваться к изменениям в окружающей среде. Быстрое
мутирование вирусов также вызывает проблемы с разработкой действенных вакцин и
противовирусных препаратов, так как мутации устойчивости к новым лекарственным
препаратам возникают очень быстро. Потому и есть трудности в создании защиты от
ежегодных эпидемий гриппа. Появляется новый мутированный вирус, для истребления
которого может не пригодиться прошлогодняя вакцина. Эволюцию невозможно
остановить. Да и нужно ли истреблять вирусы? Например, свойство вирусов
проникать в клетки используется широко в генетической инженерии и молекулярной
биологии для создания рекомбинантных организмов.
Поэтому вирусы нужно не истреблять, а изучать.
Оригинал
Простейшие паразиты человека (Реферат) — TopRef.ru
Комитет
здравохранения г.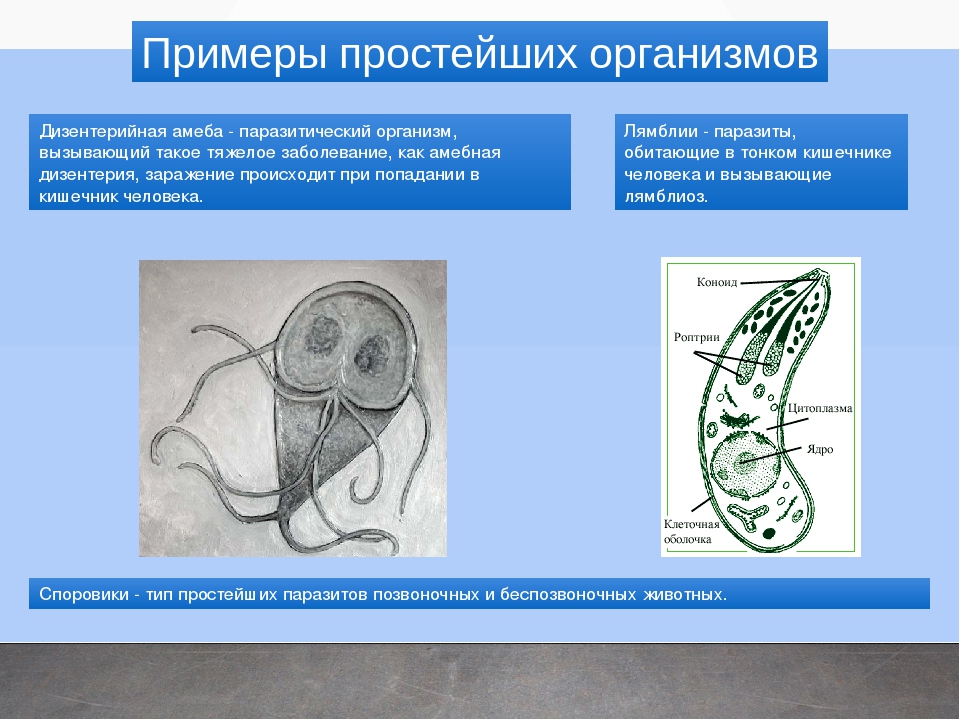 Москвы
Москвы
ММУ №30
Реферат по биологии
ПРОСТЕЙШИЕ-ПАРАЗИТЫ
ЧЕЛОВЕКА
студенток 15 группы
Гришиной И. и Корякиной Н.
Москва 2000г.
СОДЕРЖАНИЕ:
ПРОСТЕЙШИЕ . . . . . . . . . . . . . . . . . . . 3
ПАРАЗИТЫ . . . . . . . . . . . . . . . . . . . . . 4
КЛАСС ЖГУТИКОВЫЕ . . . . . . . . . . . . . . . 7
3.1. ПРЕДСТАВИТЕЛИ . . . . . . . . . . . . . 8
3.1.1. ЛЕЙШМАНИЯ . . . . . . . . . . . . 8
3.1.2. ЛЯМБЛИЯ . . . . . . . . . . . . . . 9
3.1.3. ТРИХОМОНАДА ВЛАГАЛИЩНАЯ 10
КЛАСС СПОРОВИКИ .
 . . . . . . . . . . . . . . . 11
. . . . . . . . . . . . . . . 11
4.1. МАЛЯРИЙНЫЙ ПЛАЗМОДИЙ . . . . . . 11
КЛАСС ИНФУЗОРИИ . . . . . . . . . . . . . . . . 13
5.1. БАЛАНТИДИЙ . . . . . . . . . . . . . . . . 14
КЛАСС САРКОДОВЫХ . . . . . . . . . . . . . . . 15
6.1. АМЕБА . . . . . . . . . . . . . . . . . . . 15
6.2. ДИЗЕНТЕРИЙНАЯ АМЕБА . . . . . . . . 16
ЗАКЛЮЧЕНИЕ . . . . . . . . . . . . . . . . . . . 17
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ . . 18
ПРОСТЕЙШИЕ
К типу простейших (Protozoa) относится свыше 15000 видов животных,
обитающих в морях, пресных водах, почве.
Помимо свободноживущих форм, известно
много паразити-ческих, которые вызывают
порой серьезные заболевания –
протозоонозы.
Тело простейших состоит только из одной клетки. Форма тела простейших разнообразна. Оно может быть постоянным, иметь лучевую, двустороннюю симметрию (жгутиковые, инфу-зории) или вообще не иметь постоянной формы (амеба). Раз-меры тела простейших обычно малы – от 2-4 мк до 1,5 мм, хотя некоторые крупные особи достигают 5 мм в длину, а ископае-мые раковинные корненожки имели в диаметре 3 см и более.
Тело простейших состоит из цитоплазмы и ядра. Цито-плазма ограничена наружней цитоплазмотической мембраной, в ней находятся органоиды — митохондрии, рибосомы, эндо-плазматическая сеть, аппарат Гольджи. У простейших одно или несколько ядер. Форма деления ядра – митоз. Имеется также половой процесс. Он заключается в образовании зиготы. Органоиды движения простейших – это жгутики, реснички, ложноножки; или их нет совсем. Большинство простейших, как и все прочие представители животного царства, гетеротрофны. Однако среди них имеются и автотрофные.
Особенность
простейших переносить неблагоприятные
условия окружающей среды –
состоит в способности инцис-тироваться,
т. е. образовывать цисту. При
образовании цисты органоиды движения
исчезают, объем животного уменьшается,
оно приобретает округлую форму, клетка
по-крывается плотной оболочкой. Животное
переходит в состоя-ние покоя и при
наступлении благоприятных условий
возвра-щается к активной жизни.
е. образовывать цисту. При
образовании цисты органоиды движения
исчезают, объем животного уменьшается,
оно приобретает округлую форму, клетка
по-крывается плотной оболочкой. Животное
переходит в состоя-ние покоя и при
наступлении благоприятных условий
возвра-щается к активной жизни.
Инцистирование является приспособлением, служащим не только для защиты, но и для распространения паразитов. Некоторые простейшие (споровики) образуют овоцисту и в процессе размножения — спороцисту.
Размножение простейших весьма разнообразно, от прос-того деления (бесполое размножение) до довольно сложного полового процесса – конъюгации и копуляции.
Среда обитания простейших разнообразна – это море, пресные воды, влажная почва.
Широкое
распространение получил паразитизм. Мно-гие виды паразитических простейших
вызывают тяжелые фор-мы заболеваний
человека, домашних и промысловых
животных, а также растений.
Это форма межвидовых взаимоотношений двух орга-низмов, при которых организм использует другой либо в качес-тве среды обитания, либо в качестве источника пищи. Пара-зитические организмы поражают все органы и ткани человека. Они обитают на наружних покровах (блохи, вши), в полостях тела – тканях (гельминты), в крови (малярийный плазмодий).
Организм хозяина для паразита является источником питания, местом обитания, защитой от врагов. Тело хозяина создает для паразитов благоприятный микроклимат, не под-верженный колебаниям, которые имеются в природе.
Паразиты могут быть временными, когда организм хозяина подвергается нападению на короткий срок или на время питания (клопы). Всесветное распространение имеет постельный клоп. Существует поцелуйный клоп: он обитает
в
тропиках. Это крупное насекомое (1,5–3
см в длину), веду-щее ночной образ жизни.
Заселяет тростниковые или камы-шовые
хижины. Нападая на человека,
клопы прокалывают кожу около глаз или
губы; напившись крови,
клоп выпускает на место укуса каплю
экскрементов, в которых
содержатся трипаносомы, возбудители
тяжелой болезни. К временным паразитам
относятся слепни, комары, блохи. Они
наносят организму хозяина ущерб,
что может привести к гибели.
К временным паразитам
относятся слепни, комары, блохи. Они
наносят организму хозяина ущерб,
что может привести к гибели.
Есть и постоянные паразиты; к ним относятся прос-тейшие – малярийный плазмодий, дизентерийная амеба, пло-ские черви (аскариды), членостоногие (вши), чесоточный зу-день. При постоянном паразитизме организм хозяина являет-ся единственным местом обитания для паразита. С течением времени отбор на сопротивляемость организма хозяина при-водит к тому, что вред от присутствия паразита становится менее ощутимым. Например: в крови африканских антилоп находяться жгутиковые простейшие, переносчиком которых является кровососущая муха ЦЦ. Антилопам жгутиковые простейшие вреда не приносят. Но если эти простейшие попадают в кровь человека, то развивается сонная болезнь (она приводит к смерти).
Паразиты
могут поселяться не только в крови, но
и в тка-нях и полостях тела. Например
личинки бычего цепня с недо-статочно
проваренном или прожаренном мясом
попадают в кишки человека, где они
превращаются во взрослую особь, длина
которой 9–10 метров. Цепни питаются
содержанием тонкого кишечника: они
всасывает питательные вещества всей
поверхностью тела, в результате лишая
хозяина части пищи. Ленточные черви
ведут паразитический образ жизни. Цикл
их развития сопровождается сменой
хозяев. Например, черви
длиной до 1 метра в половозрелом состоянии
парази-тируют в кишках рыбоядных птиц.
С пометом птиц яйца попа-дают в воду,
они проглатываются циклопом, в его теле
образу-ется личинка, она вступает в
следующую, личиночную,
стадию уже в полости тела пресноводных
рыб. На этой стадии ли-чинки достигают
крупных размеров и сильно снижает
жизне-способность организма хозяина,
вызвая даже массовую гибель рыбы.
Цепни питаются
содержанием тонкого кишечника: они
всасывает питательные вещества всей
поверхностью тела, в результате лишая
хозяина части пищи. Ленточные черви
ведут паразитический образ жизни. Цикл
их развития сопровождается сменой
хозяев. Например, черви
длиной до 1 метра в половозрелом состоянии
парази-тируют в кишках рыбоядных птиц.
С пометом птиц яйца попа-дают в воду,
они проглатываются циклопом, в его теле
образу-ется личинка, она вступает в
следующую, личиночную,
стадию уже в полости тела пресноводных
рыб. На этой стадии ли-чинки достигают
крупных размеров и сильно снижает
жизне-способность организма хозяина,
вызвая даже массовую гибель рыбы.
Паразитические отношения
встречаются и у растений. Широко
распространены паразитические бактерии
и грибы. Они поселяются на вегетативных
органах древесных и травя-нистых
растений, вызывая
заболевания. Грибы,
например, вызывают
появление корневой гнили. На многих
сельско-хозяйственных растениях
(подсолнух, конопля) паразитирует заразиха (бесхлорофильное растение
с бесцветными листья-ми). Существуют
полупаразиты, обладающие
фотосинтезом, содержат хлорофилл, а
растение хозяина используют как ис-точник
воды и минеральных солей. Полупаразиты
оказывают на растение иссушающее
действие.
Существуют
полупаразиты, обладающие
фотосинтезом, содержат хлорофилл, а
растение хозяина используют как ис-точник
воды и минеральных солей. Полупаразиты
оказывают на растение иссушающее
действие.
Изучение паразитов необходимо для предупреждения и лечения заболеваний человека. Паразитология изучает био-логию, экологию паразитов, методы диагностики, лечения и профилактики паразитов. Медицинская паразитология подраз-деляется на: протозоологию (простейшие), гельминтологию (паразитические черви) и арахноэнтомологию (паукообразные и насекомые).
Различают четыре основных класса простейших:
1 – жгутиковые (Flagellata, или Mastigophora);
2 – саркодовые (Sarcodina, или Rhizopoda);
3 – споровики (Sporozoa);
4 – инфузории (Infusoria, или Ciliata).
КЛАСС ЖГУТИКОВЫЕ
Около
1000 видов, преимущественно с вытянутым
овальным или грушевидном телом, состовляют
класс жгути-ковых (Flagellata или Mastigophora). Органеллы движения – жгутики,
которых у различных представителей
класса может быть от 1 до 8 и более. Жгутик – тонкий цитоплазматический вырост,
состоящий из тончайших фибрилл. Своим
основанием он прикреплен к базальному
тельцу или кинетопласту.
Жгутиковые движутся жгутом вперед,
создавая своим движе-нием вихревые
водовороты и как бы «ввинчивая» животное
Органеллы движения – жгутики,
которых у различных представителей
класса может быть от 1 до 8 и более. Жгутик – тонкий цитоплазматический вырост,
состоящий из тончайших фибрилл. Своим
основанием он прикреплен к базальному
тельцу или кинетопласту.
Жгутиковые движутся жгутом вперед,
создавая своим движе-нием вихревые
водовороты и как бы «ввинчивая» животное
в окружающую жидкую среду.
Способ питания: жгутиковых разделяют на имеющих хлорофилл и питающихся автотрофно, и на не имеющих хлоро-филла и питающихся, как прочие животные, гетеротрофным способом. Гетеротрофы на передней стороне тела имеют осо-бое углубление – цитостом, через который при движении жгутика пища вгоняется в пищеварительную вакуоль. Ряд форм жгутиковых питается осмотическим путем, всасывая всей поверхностью тела растворенные органические вещес-тва из окружающей среды.
Способы размножения: Размножение
происходит чаще всего путем деления
надвое: обычно одна особь дает начало
двум дочерним.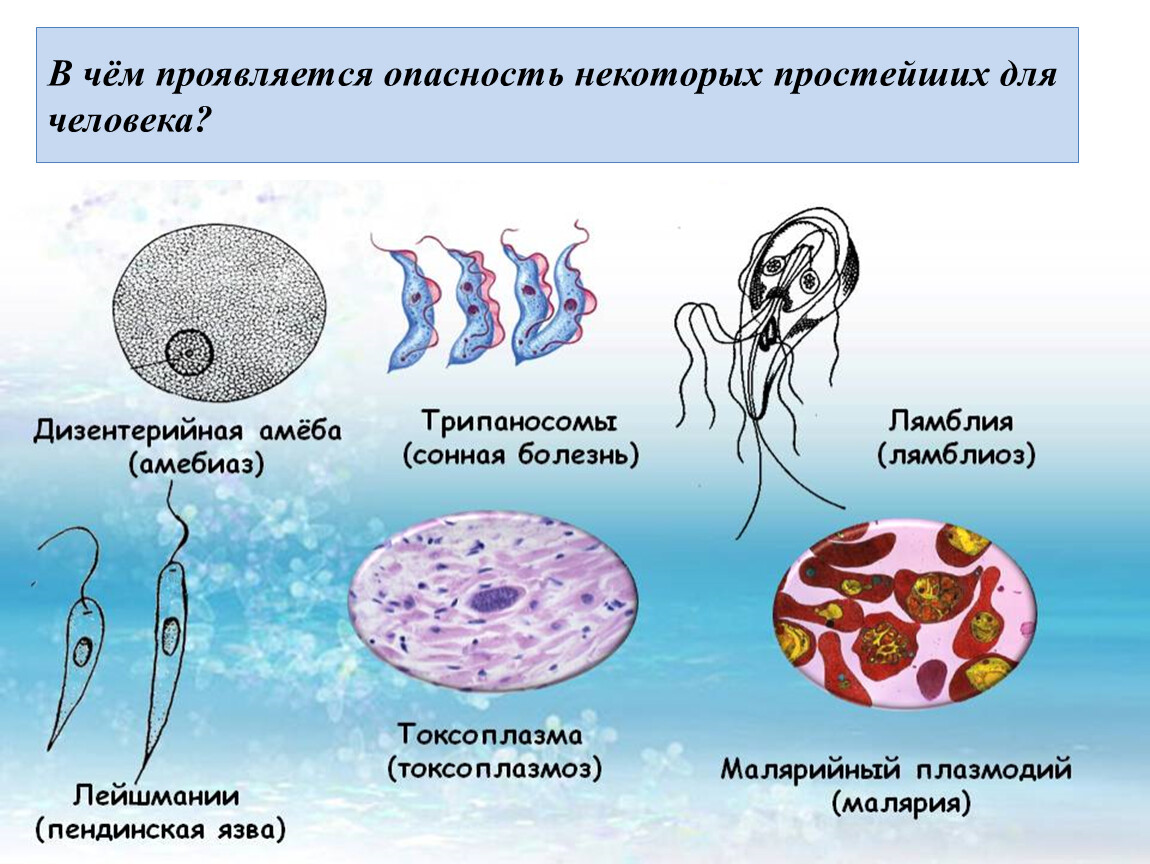 Иногда размножение
происходит очень быс-тро, с образованием
бесчисленного множества особей
(ноче-светки).
Иногда размножение
происходит очень быс-тро, с образованием
бесчисленного множества особей
(ноче-светки).
Среди жгутиковых встречаются колониальные формы, состоящие из различного числа индивидумов (от 8 до 10 000 особей и более) (вольвокс).
ПРЕДСТАВИТЕЛИ
ЛЕЙШМАНИЯ
Проверочная работа по биологии в 7 классе на тему: «Введение. Одноклеточные животные»
В2. Установите соответствие между болезнью, вызываемой паразитическим простейшим и особенностями протекания этой болезни:
В3. Какие четыре животных ведут дневной образ жизни?
А) летучая мышь Б) медведь
В) ящерица Г) пчела
Д) сова Е) волк
Ж) суслик З) филин
В4. Установите последовательность соподчинения таксонов у животных, начиная с наибольшей:
А) подцарство
Б) тип
В) царство
Г) класс
В5. Напишите вместо букв пропущенные в тексте понятия:
Инфузория-туфелька питается в основном __(А)__. Ресничками она создаёт ток воды и загоняет пищевые частицы в __(Б)__. Здесь вокруг пищевой частицы образуется __(В)__, которая затем перемещается по организму простейшего. В заднем конце тела инфузории-туфельки непереваренные остатки удаляются наружу через отверстие в мембране – __(Г)__.
Ресничками она создаёт ток воды и загоняет пищевые частицы в __(Б)__. Здесь вокруг пищевой частицы образуется __(В)__, которая затем перемещается по организму простейшего. В заднем конце тела инфузории-туфельки непереваренные остатки удаляются наружу через отверстие в мембране – __(Г)__.
Задания С
С1. Напишите определение понятию «Экологическая группа».
С2. Подробно опишите способ передвижения бодо.
С3. Рассмотрите рисунок «Строение амёбы протей». Определите и подпишите, что обозначено на нём буквами.
Критерии оценивания и ответы
Вариант 1.
заданияОтвет
Максимальный балл – 25 баллов
Задания А
А1
А
1
А2
Б
1
А3
А
1
А4
Г
1
А5
В
1
А6
В
1
Задания В
В1
1-Б, 2-Г
2 (1 – за один правильный ответ)
В2
А-1, Б-3, В-2
2
В3
А, Д, Е, З
2 (0,5 – за каждый правильный ответ)
В4
Б, В, Г, А
2 (0,5 – за каждую правильную букву на своём месте)
В5
А-кислород
Б-поверхность тела
В-сократительная вакуоль
Г-клеточный рот
2 (0,5 – за каждый правильный ответ)
Задания С
С1
Особь – самостоятельный организм, который питается, дышит, растёт, выделяет продукты обмена.
3 (1-2,5 – за неполное определение)
С2
Её цитоплазма постоянно перетекает от одного полюса клетки к другому. При этом по направлению потока цитоплазмы образуется выступ, который медленно вытягивается. Это формируется ложноножка, и амёба передвигается в том же направлении.
3 (1-2,5 – за неполное описание)
С3
А-реснички
Б-пищеварительная вакуоль
В-цитоплазма
Г-большое ядро
Д-клеточный рот
Е-порошица
3 (0,5 – за каждый правильный ответ)
Критерии выставления оценки:
ОценкаКоличество набранных баллов
«Отлично»
21-25 баллов
«Хорошо»
16-20 баллов
«Удовлетворительно»
10-15 баллов
«Неудовлетворительно»
0-9 баллов
Критерии оценивания и ответы
Вариант 2.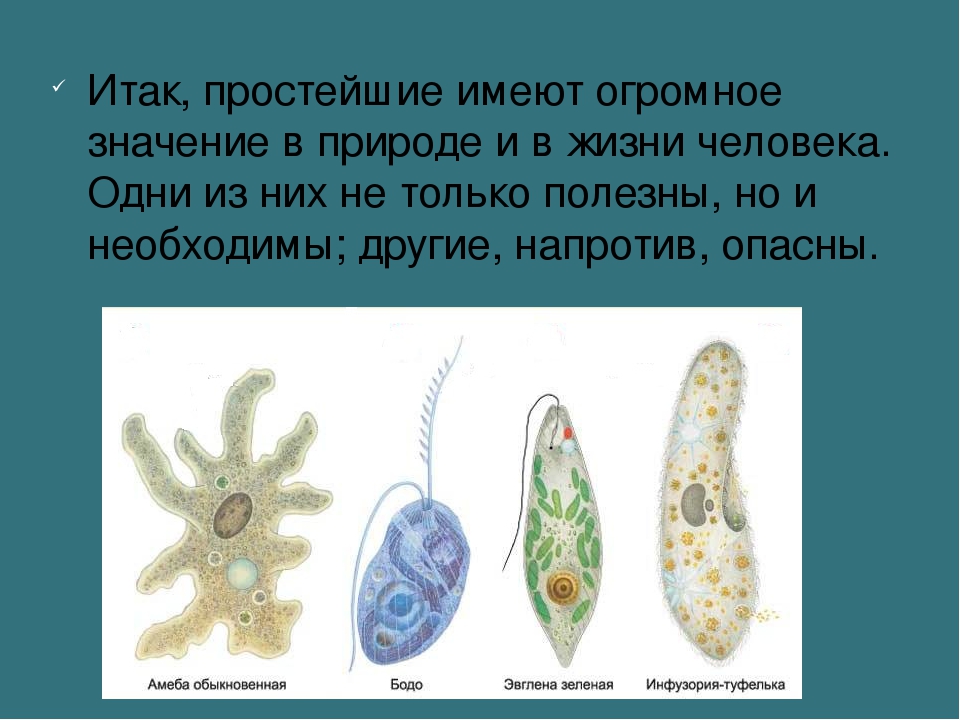
Ответ
Максимальный балл – 25 баллов
Задания А
А1
В
1
А2
Б
1
А3
Г
1
А4
Б
1
А5
А
1
А6
Б
1
Задания В
В1
1-А, 2-В
2 (1 – за один правильный ответ)
В2
А-1, Б-2, В-3
2
В3
Б, В, Г, Ж
2 (0,5 – за каждый правильный ответ)
В4
В, А, Б, Г
2 (0,5 – за каждую правильную букву на своём месте)
В5
А-бактерии
Б-клеточный рот
В-пищеварительная вакуоль
Г-порошица
2 (0,5 – за каждый правильный ответ)
Задания С
С1
Экологическая группа – объединение нескольких видов животных со сходным образом жизни и сходным местом обитания.
3 (1-2,5 – за неполное определение)
С2
На переднем конце тела – два жгутика. Один направлен вперёд. Когда этот жгутик быстро крутится, ввинчиваясь в воду, бодо движется вперёд. Второй жгутик направлен назад и служит рулём.
3 (1-2,5 – за неполное описание)
С3
А-пищеварительные вакуоли
Б-цитоплазма
В-ядро
Г-сократительная вакуоль
Д-ложноножки
Е-плазмалемма
3 (0,5 – за каждый правильный ответ)
Критерии выставления оценки:
ОценкаКоличество набранных баллов
«Отлично»
21-25 баллов
«Хорошо»
16-20 баллов
«Удовлетворительно»
10-15 баллов
«Неудовлетворительно»
0-9 баллов
Важные паразиты человека в тропиках · Границы для юных умов
Аннотация
Все живые существа на этой планете так или иначе взаимодействуют с другими живыми существами. Мы используем разные термины для описания взаимодействия между двумя разными видами. Если оба вида получают выгоду от взаимодействия друг с другом, то есть если каждый вид зависит от другого в своем благополучии, то отношения называются мутуализмом. Напротив, антагонизм — это термин, используемый для описания отношений, приносящих пользу только одному из видов и причиняющих вред другому.В этой статье мы обсуждаем особый тип антагонизма, называемый паразитизмом. Мы представим обзор разнообразия видов паразитов, обсудим их роль в основных тропических болезнях и подчеркнем важность изучения паразитов для медицины.
Мы используем разные термины для описания взаимодействия между двумя разными видами. Если оба вида получают выгоду от взаимодействия друг с другом, то есть если каждый вид зависит от другого в своем благополучии, то отношения называются мутуализмом. Напротив, антагонизм — это термин, используемый для описания отношений, приносящих пользу только одному из видов и причиняющих вред другому.В этой статье мы обсуждаем особый тип антагонизма, называемый паразитизмом. Мы представим обзор разнообразия видов паразитов, обсудим их роль в основных тропических болезнях и подчеркнем важность изучения паразитов для медицины.
Что такое паразит?
Слово « паразит » заставит большинство людей съежиться, вероятно, потому, что оно ассоциируется у них с маленькими червями, живущими внутри них. Это не совсем неправильно, как мы увидим позже.Однако в древнегреческом языке термин « parasitos » первоначально использовался для описания общественных деятелей, которые посещали общественные мероприятия и тратили деньги общины на еду и развлечения [1]. Со временем слово «паразит» стало обозначать любого человека, живущего за счет чужого богатства. Лишь в семнадцатом веке биолог Каролус Линней использовал термин «паразит» для описания ленточных червей. В настоящее время под паразитом понимается любой микроорганизм , приспособленный к жизни в другом организме или на нем, от которого паразит получает питательные вещества, причиняя вред другому организму.Это широкое определение включает вирусы и представителей шести царств жизни, а именно архей, бактерий, грибов, простейших, растений и животных (рис. 1). Однако в паразитологии, области биологии, изучающей паразитические организмы, термин «паразит» применяется только к простейшим (животным, состоящим из одной клетки), гельминтам (паразитические черви) и насекомым.
- Рисунок 1 – Различные группы паразитических организмов.
- Звездочка (*) показывает группы организмов, которые считаются паразитами в области паразитологии, которая является научным исследованием паразитов (Эти организмы не приведены в масштабе).
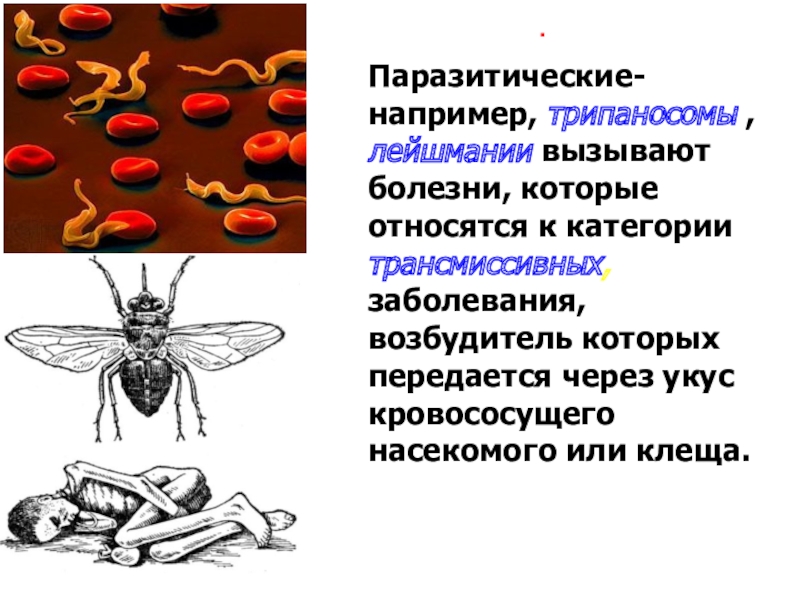
Паразиты сильно отличаются друг от друга
Паразитологи (ученые, изучающие паразитов) изучают очень разнообразную группу организмов. На самом деле количество различных видов паразитов настолько велико, что невозможно сосчитать их всех. Паразитов можно разделить на группы по многим признакам, включая их форму и размеры, их географическое положение, способы передвижения и организмы, в которых они живут. Некоторые паразиты состоят только из одной клетки (одноклеточные) и размером всего с несколько микрометров (одна тысячная метра).Например, форма банана Toxoplasma gondii имеет длину около 6 микрометров. Напротив, другие паразиты состоят из нескольких клеток (многоклеточных) и могут достигать 80 футов (25 м) в длину. Примером такого паразита является взрослый цепень.
Паразитические организмы встречаются почти везде, от тропических и субтропических регионов до холодных мест, таких как Антарктида. Тем не менее, каждому паразиту нужен организм, который обеспечивает пищу, убежище и место для размножения. Этот организм называется хозяином .В конечном итоге хозяин получает вред от взаимодействия с паразитом. Паразитов можно разделить на две группы в зависимости от того, где они живут в своих хозяевах. Паразиты, живущие вне хозяина, называются эктопаразитами (рис. 2А). Например, блоха — это паразит, который живет на кошках. Напротив, паразиты, которые живут внутри своих хозяев, известны как эндопаразиты (рис. 2В). Например, Wuchereria bancrofti — это червь, обитающий в лимфатической системе человека и вызывающий заболевание, известное как слоновость.Среди эндопаразитов некоторые могут жить внутри клеток-хозяев и называются внутриклеточными паразитами. Plasmodium falciparum является одним из таких паразитов, поскольку он живет и растет внутри эритроцитов больных малярией.
Этот организм называется хозяином .В конечном итоге хозяин получает вред от взаимодействия с паразитом. Паразитов можно разделить на две группы в зависимости от того, где они живут в своих хозяевах. Паразиты, живущие вне хозяина, называются эктопаразитами (рис. 2А). Например, блоха — это паразит, который живет на кошках. Напротив, паразиты, которые живут внутри своих хозяев, известны как эндопаразиты (рис. 2В). Например, Wuchereria bancrofti — это червь, обитающий в лимфатической системе человека и вызывающий заболевание, известное как слоновость.Среди эндопаразитов некоторые могут жить внутри клеток-хозяев и называются внутриклеточными паразитами. Plasmodium falciparum является одним из таких паразитов, поскольку он живет и растет внутри эритроцитов больных малярией.
- Рис. 2. Эктопаразиты и эндопаразиты.
- (A) Эктопаразиты живут снаружи и на теле хозяина. Примеры включают кошачью блоху Ctenocephalides felis, крабовую вошь , обитающую на коже человека.
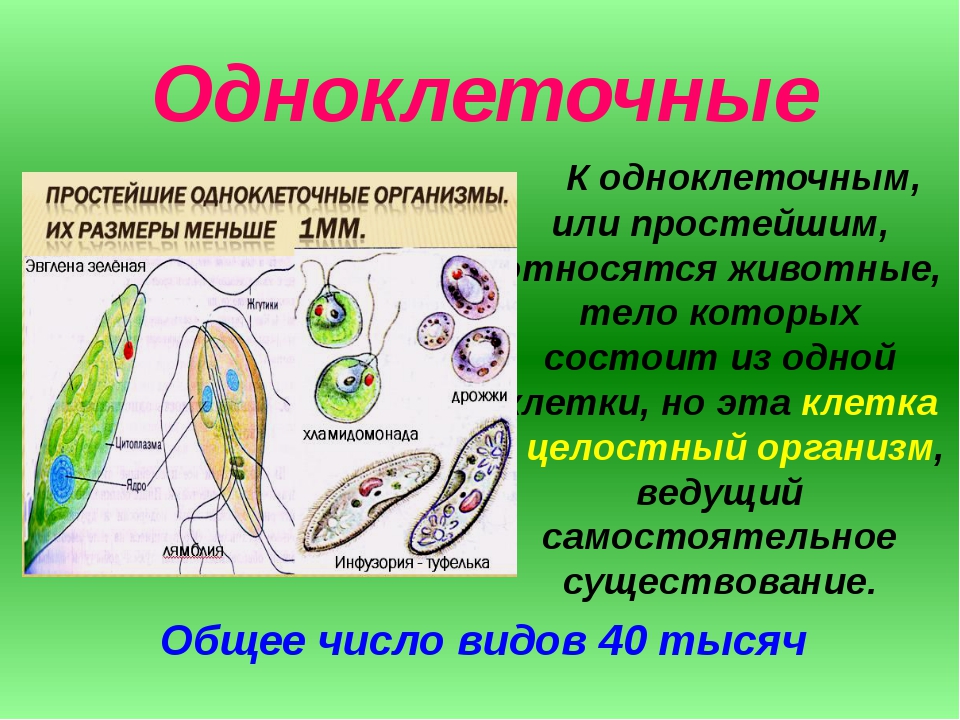 (B) Эндопаразиты живут внутри хозяина. Примеры включают Dirofilaria immitis , круглого червя, который живет внутри кошек и вызывает сердечные гельминты, анкилостомы в кишечнике человека, и Plasmodium falciparum , паразита, который живет внутри эритроцитов человека.
(B) Эндопаразиты живут внутри хозяина. Примеры включают Dirofilaria immitis , круглого червя, который живет внутри кошек и вызывает сердечные гельминты, анкилостомы в кишечнике человека, и Plasmodium falciparum , паразита, который живет внутри эритроцитов человека.
Паразиты также различаются по количеству носителей, необходимых им для выживания. В то время как некоторым паразитам нужен только один хозяин, другие паразиты используют несколько хозяев для завершения своего жизненного цикла. Хозяин, в котором паразит завершает свое половое размножение, называется окончательным хозяином .
Как паразиты выживают в своих хозяевах?
Паразитизм — это постоянная борьба за выживание между паразитом и его хозяином. Поскольку паразиты зависят от своего хозяина в плане пищи и крова, они не должны уничтожать хозяина, пока не будут готовы перейти к следующему хозяину. Между тем, хозяева должны защитить себя от вреда.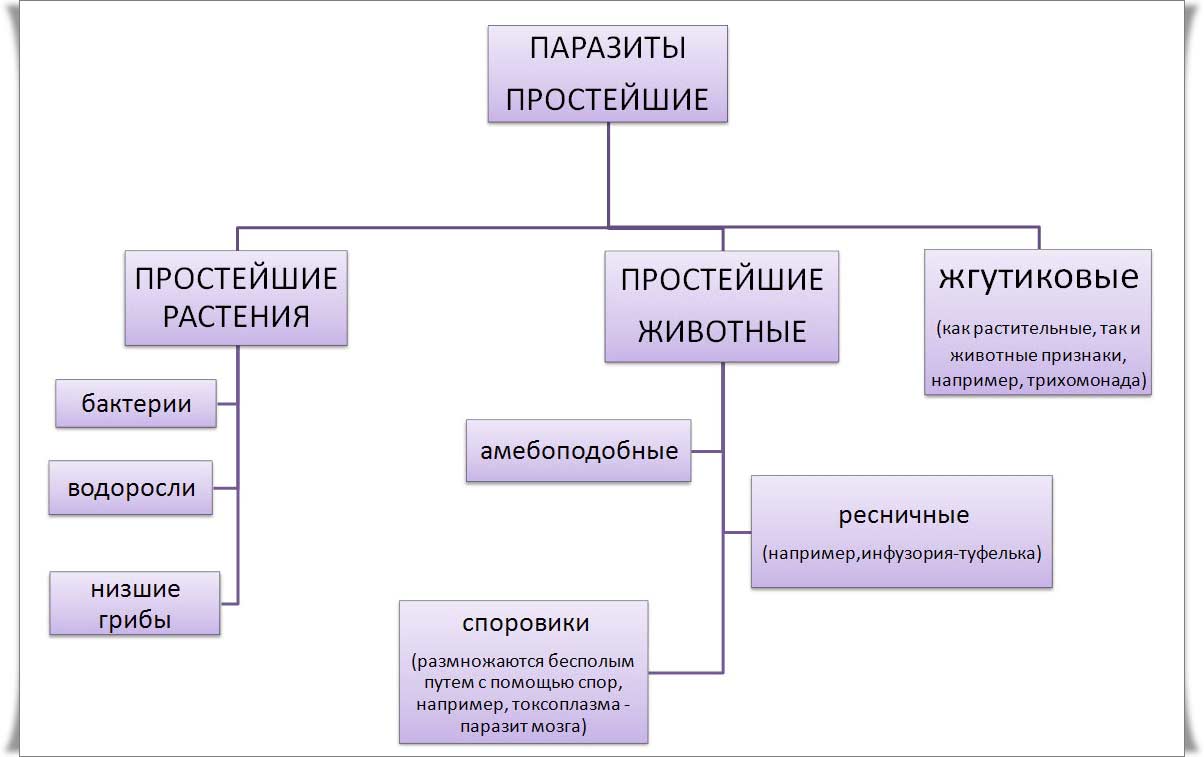 Чтобы защитить себя, хозяева постоянно бросают вызов паразитическим организмам, создавая неблагоприятные условия. Хозяин попытается лишить паразитов питательных веществ, фактически морив их голодом, или атакует паразитов своей сильной иммунной защитой.Чтобы жить в такой сложной среде, каждый паразит выработал разные стратегии выживания. За миллионы лет эволюции паразиты приобрели множество интересных особенностей, помогающих им приспосабливаться к конкретной среде [1]. Вот некоторые из них.
Чтобы защитить себя, хозяева постоянно бросают вызов паразитическим организмам, создавая неблагоприятные условия. Хозяин попытается лишить паразитов питательных веществ, фактически морив их голодом, или атакует паразитов своей сильной иммунной защитой.Чтобы жить в такой сложной среде, каждый паразит выработал разные стратегии выживания. За миллионы лет эволюции паразиты приобрели множество интересных особенностей, помогающих им приспосабливаться к конкретной среде [1]. Вот некоторые из них.
- Уклонение от атак хозяина
Каждый паразит постоянно сталкивается с проблемами защиты хозяина и другими неблагоприятными условиями, такими как лишение питательных веществ. Паразиты разработали уникальные способы реагирования на атаки своих хозяев.Например, Trypanosoma brucei и P. falciparum , вызывающие заболевания у людей, могут изменять свой внешний вид, переключая белки на своей поверхности и тем самым избегая распознавания иммунной системой хозяина. Другие паразиты приобрели способность напрямую убивать иммунные клетки человека.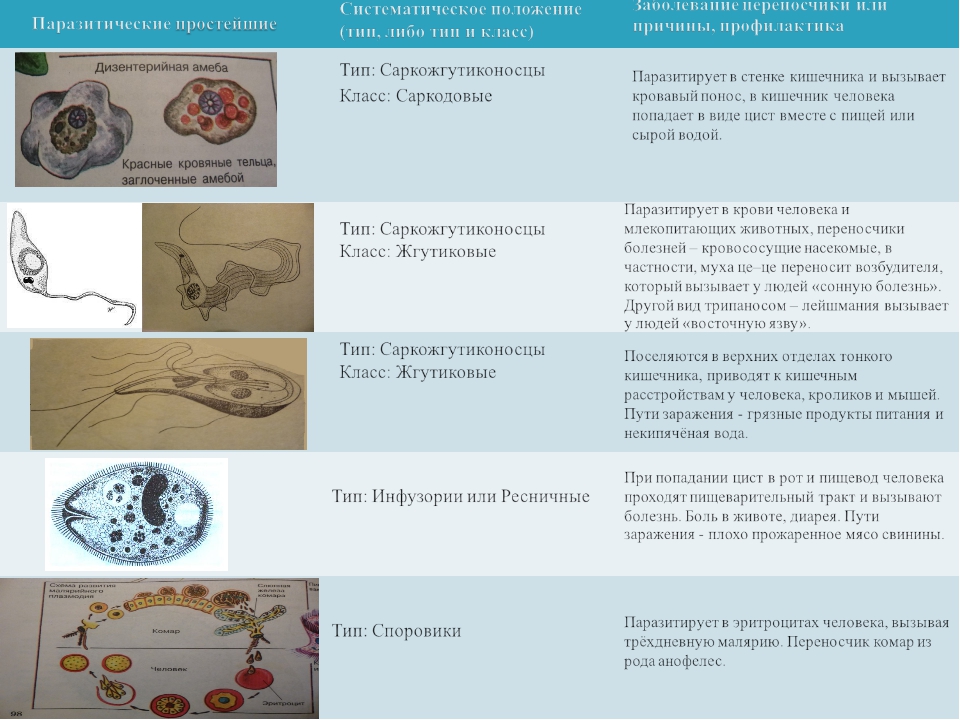
- Приобретение новых репродуктивных стратегий
Паразиты эволюционировали, чтобы жить и размножаться в среде одного конкретного хозяина. Это называется специализацией хоста.Хотя эта стратегия позволяет паразиту быть более успешным внутри этого конкретного хозяина, специализация хозяина также имеет свои ограничения, в том числе снижение шансов паразита найти себе пару. Паразитические организмы разработали различные способы решения этой проблемы. Для видов Schistosoma , как только самка и самец червя находят друг друга в хозяине, они остаются вместе навсегда, если поблизости не присутствует другой самец. Что касается ленточных червей, то они используют стратегию размножения, называемую гермафродитизмом .При гермафродитизме и мужские, и женские репродуктивные органы расположены на одном и том же черве, что избавляет от необходимости искать себе пару. - Ограничение ущерба для хозяина
Другая проблема со специализацией хозяина напрямую связана с самой природой паразитов. Они повреждают своего хозяина. Если паразит слишком разрушительен для своего хозяина, то хозяин может умереть до того, как паразит завершит свой жизненный цикл. Это может привести к гибели самого паразита или заставить паразита искать нового хозяина.Итак, с точки зрения паразитов важно ограничить наносимый ими вред, чтобы хозяин оставался в живых в течение длительного периода времени. Паразиты разработали стратегии для решения этой проблемы. Например, когда в хозяине присутствует много ленточных червей, эти черви будут расти только до небольшого размера, чтобы не подавлять и не разрушать хозяина. Но каждый червь будет увеличиваться, когда присутствует всего несколько червей, потому что конкуренция за ресурсы хоста меньше, и хост не так легко истощается.
Они повреждают своего хозяина. Если паразит слишком разрушительен для своего хозяина, то хозяин может умереть до того, как паразит завершит свой жизненный цикл. Это может привести к гибели самого паразита или заставить паразита искать нового хозяина.Итак, с точки зрения паразитов важно ограничить наносимый ими вред, чтобы хозяин оставался в живых в течение длительного периода времени. Паразиты разработали стратегии для решения этой проблемы. Например, когда в хозяине присутствует много ленточных червей, эти черви будут расти только до небольшого размера, чтобы не подавлять и не разрушать хозяина. Но каждый червь будет увеличиваться, когда присутствует всего несколько червей, потому что конкуренция за ресурсы хоста меньше, и хост не так легко истощается.
Вредное воздействие тропических паразитов на здоровье человека
Существует ряд паразитов, вызывающих заболевания у человека. Паразитарные заболевания наиболее распространены в развивающихся странах тропических и субтропических регионов мира (рис. 3). Эти места часто жаркие и влажные, условия, подходящие для роста многих паразитов. Кроме того, тропические страны часто страдают от бедности, плохих санитарных условий, неадекватных медицинских учреждений и низкого уровня образования.Эти факторы часто увеличивают передачу паразитарных заболеваний через насекомых, загрязненную воду или загрязненную почву и затрудняют их контроль или ликвидацию. Ниже мы опишем некоторые важные паразитарные заболевания в тропических регионах (таблица 1).
3). Эти места часто жаркие и влажные, условия, подходящие для роста многих паразитов. Кроме того, тропические страны часто страдают от бедности, плохих санитарных условий, неадекватных медицинских учреждений и низкого уровня образования.Эти факторы часто увеличивают передачу паразитарных заболеваний через насекомых, загрязненную воду или загрязненную почву и затрудняют их контроль или ликвидацию. Ниже мы опишем некоторые важные паразитарные заболевания в тропических регионах (таблица 1).
- Рисунок 3 – Распространение основных паразитарных болезней.
- Континенты показаны разными цветами. Вы можете увидеть ключ в правом верхнем углу. Точками обозначены паразитарные заболевания. Ключ от болезней находится в левом нижнем углу.Размер точек показывает, насколько распространено заболевание в регионе/континенте: чем больше точка, тем больше людей заражено этим заболеванием. На этом рисунке легко увидеть, что многие паразитарные заболевания встречаются в тропических регионах мира (не в масштабе).
- Таблица 1 – Сводка распространенных тропических паразитарных болезней.
- *От Центра по контролю и профилактике заболеваний на https://www.cdc.gov/parasites.
**Число новых случаев каждый год из-за острого характера заболевания.
Малярия
Малярия — одно из самых распространенных заболеваний в Африке и других тропических регионах, где ежегодно от нее умирают миллионы людей. P. falciparum является простейшим, ответственным за это заболевание. Самка комара Anopheles передает паразита, когда берет кровь у человека. P. falciparum инфицирует эритроциты, которые затем разрушаются или изменяются таким образом, что слипаются. Эти воздействия на эритроциты приводят к ухудшению кровоснабжения некоторых органов и тканей, что в конечном итоге может привести к смерти инфицированного человека.
Лейшманиоз
Лейшманиоз передается человеку самками москитов, которые кусают и выделяют в кровь организмы Leishmania . В отличие от P. falciparum, Leishmania предпочитает лейкоциты, особенно так называемые макрофаги . Обычно паразит вызывает легкое кожное заболевание. Однако иногда он может проникать и повреждать внутренние органы и вызывать более серьезные заболевания или даже смерть.
В отличие от P. falciparum, Leishmania предпочитает лейкоциты, особенно так называемые макрофаги . Обычно паразит вызывает легкое кожное заболевание. Однако иногда он может проникать и повреждать внутренние органы и вызывать более серьезные заболевания или даже смерть.Африканская сонная болезнь
Как следует из названия, африканская сонная болезнь широко распространена в Африке, где ежегодно от нее страдают около 10 000 человек.Это вызвано Trypanosoma brucei , простейшим, передающимся через укусы мух цеце. Заражение этим паразитом часто приводит к воспалению кровеносных сосудов во многих органах. Воспаление сердца может в конечном итоге привести к смерти от сердечной недостаточности, а воспаление головного мозга может вызвать судороги и чрезмерную сонливость. Из-за сонливости болезнь называют «сонной болезнью».
Болезнь Шагаса
Болезнь Шагаса вызывается другим членом трипаносомы, Trypanosoma cruzi .В отличие от африканской сонной болезни, болезнь Шагаса чаще встречается в Латинской Америке, где в настоящее время она поражает восемь миллионов человек.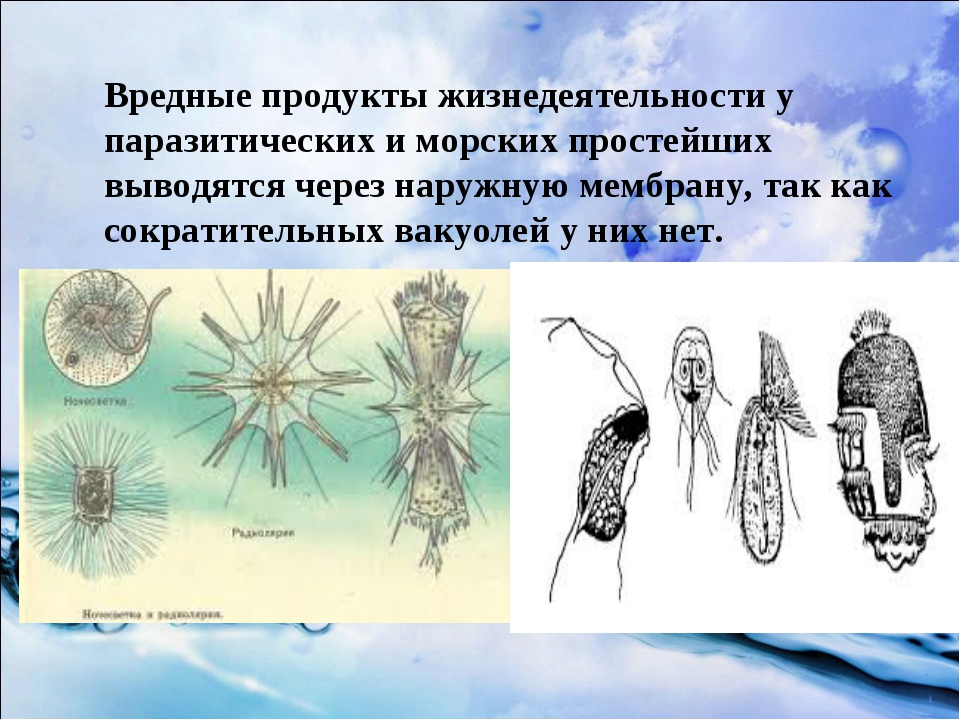 T. cruzi выделяется из фекалий целующегося клопа, укус которого на коже открывает для паразита вход в кровоток. Паразиты распространяются по всему телу, поражают различные органы и вызывают воспаление сердца и головного мозга.
T. cruzi выделяется из фекалий целующегося клопа, укус которого на коже открывает для паразита вход в кровоток. Паразиты распространяются по всему телу, поражают различные органы и вызывают воспаление сердца и головного мозга.
Шистосомоз
Также называемый бильгарциозом, шистосомоз в настоящее время поражает более 200 миллионов человек в Африке, Восточной Азии и Южной Америке.Шистосомоз вызывается плоскими червями под названием Schistosoma и передается через воду. Личинки червей в воде проникают через кожу, попадают в кровоток и, наконец, поселяются в кишечнике или мочевом пузыре. Там личинки червей созревают во взрослых особей и откладывают яйца, которые активируют иммунную систему человека и вызывают стойкое воспаление. Со временем постоянная иммунная активация может привести к раку.
Филяриоз
Филяриатоз, обычно называемый слоновостью, представляет собой заболевание, вызывающее значительное уродство тела.Он передается комарами и в настоящее время поражает около 120 миллионов человек. Личинки Wuchereria bancrofti , аскариды, вызывающей это заболевание, попадают в кровоток после укуса комара. Личинки быстро мигрируют в лимфатическую систему, где растут и созревают во взрослых особей. Когда круглые черви становятся большими, они препятствуют току жидкости через ткани, поэтому жидкости накапливаются в тканях и вызывают гротескные отеки конечностей и мошонки.
Личинки Wuchereria bancrofti , аскариды, вызывающей это заболевание, попадают в кровоток после укуса комара. Личинки быстро мигрируют в лимфатическую систему, где растут и созревают во взрослых особей. Когда круглые черви становятся большими, они препятствуют току жидкости через ткани, поэтому жидкости накапливаются в тканях и вызывают гротескные отеки конечностей и мошонки.
Речная слепота
Речная слепота, вызываемая другим круглым червем, Onchocerca volvulus , в настоящее время поражает 25 миллионов человек, в основном в Африке и Южной Америке. O. volvulus передается мошками, насекомыми, которые в основном живут вблизи рек и ручьев и размножаются в них. При введении в кожу человека O. volvulus может оставаться там и созревать. Присутствие этих червей в коже вызывает иммунный ответ и вызывает воспаление кожи.В других случаях паразиты мигрируют в глаза, где наносят серьезные повреждения, приводящие к слепоте. Речная слепота — очень распространенная причина слепоты в тропических странах.
Кишечные инфекции с круглыми червями
Анкилостомы, такие как Necator americanus , и аскариды, такие как Ascaris lumbricoides , являются обычными круглыми червями в регионах с плохой санитарией. Яйца A. lumbricoides заразны и могут попадать в пищу, содержащую зараженную почву, тогда как яйца анкилостомы должны вылупиться в личинках в почве, прежде чем они проникнут через кожу человека.Оба типа червей вызывают недоедание, потому что они часто живут внутри кишечника, где конкурируют с хозяином за питательные вещества. В тяжелых случаях анкилостомы вызывают анемию, потому что они сосут кровь своих хозяев. Недоедание и анемия у детей могут привести к проблемам с физическим и умственным развитием. Кроме того, A. lumbricoides также может вызывать закупорку кишечника, что приводит к сильным болям в животе у инфицированного человека.
Существуют ли скрытые преимущества паразитарных инфекций?
По определению, паразиты вредны для своих хозяев. Однако некоторые паразитарные инфекции могут оказывать защитное действие против других заболеваний, таких как аллергия и хроническое воспалительное заболевание кишечника (ВЗК) [1]. В частности, было показано, что длительные инфекции паразитическими червями уменьшают аллергию и симптомы ВЗК. Это связано с тем, что паразитические черви развили стратегии блокирования частей иммунной системы человека. Эти части иммунной системы, а именно эозинофилы и антитела IgE, также являются основными участниками аллергии, ВЗК и многих других воспалительных заболеваний.Так что, может быть, и неудивительно, что у людей, зараженных паразитическими червями, меньше аллергий и воспалительных заболеваний! Фактически, исследование, проведенное в Африке и Южной Америке, показало, что дегельминтизированные дети (без паразитарных инфекций) более подвержены аллергии.
Однако некоторые паразитарные инфекции могут оказывать защитное действие против других заболеваний, таких как аллергия и хроническое воспалительное заболевание кишечника (ВЗК) [1]. В частности, было показано, что длительные инфекции паразитическими червями уменьшают аллергию и симптомы ВЗК. Это связано с тем, что паразитические черви развили стратегии блокирования частей иммунной системы человека. Эти части иммунной системы, а именно эозинофилы и антитела IgE, также являются основными участниками аллергии, ВЗК и многих других воспалительных заболеваний.Так что, может быть, и неудивительно, что у людей, зараженных паразитическими червями, меньше аллергий и воспалительных заболеваний! Фактически, исследование, проведенное в Африке и Южной Америке, показало, что дегельминтизированные дети (без паразитарных инфекций) более подвержены аллергии.
Эти недавние открытия вдохновили многих ученых и врачей во всем мире на изучение того, как паразитарные инфекции могут быть действительно полезны для некоторых заболеваний человека. Цель состоит в том, чтобы использовать эти преимущества для разработки новых методов лечения воспалительных заболеваний.
Цель состоит в том, чтобы использовать эти преимущества для разработки новых методов лечения воспалительных заболеваний.
Заключение
Паразиты представляют собой разнообразную и сложную группу организмов, в которую входят простейшие, гельминты и насекомые. Паразиты имеют сложные и постоянно развивающиеся отношения со своими хозяевами, и эти отношения в конечном итоге вредны для хозяина. Некоторые паразитарные организмы вызывают серьезные заболевания у людей, особенно в тропических регионах с условиями, благоприятными для роста и передачи паразитов хозяевам. Благодаря научным достижениям в последние годы наше понимание паразитических организмов расширилось.Тем не менее, область паразитологии остается открытой и привлекательной для многих. Мы только поцарапали верхушку айсберга.
Глоссарий
Паразит : ↑ Микроорганизм, живущий внутри или на другом организме, от которого он получает питательные вещества и при этом наносит вред.
Микроорганизм : ↑ Организм, который слишком мал, чтобы его можно было увидеть невооруженным глазом.
Хозяин : ↑ Организм, дающий пищу и убежище паразитам.
Лимфатическая система : ↑ Система сосудов, отводящая лимфу (жидкость, скопившуюся в тканях) в кровеносную систему.
Окончательный хозяин : ↑ Хозяин, в котором паразит завершает половое размножение.
Гермафродитизм : ↑ Репродуктивная стратегия, при которой женские и мужские половые органы расположены у одного и того же человека.
Макрофаг : ↑ Тип лейкоцитов, которые убивают патогены, поглощая их, процесс, называемый фагоцитозом.
Эозинофилы : ↑ Тип лейкоцитов, привлекаемых для борьбы с гельминтами и играющих роль в аллергии.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Артикул
[1] ↑ Люциус Р., Лоос-Франк Б., Лейн Р. П., Пулен Р., Робертс, К., и Гренсис, Р. К. 2017. Биология паразитов . Вайнхайм: Wiley-VCH.
переносчиков простейших паразитов
переносчиков простейших паразитов Паразиты, обитающие в крови или внутренних органах хозяина, имеют логистические проблемы с точки зрения заражения нового хозяина. В отличие от фекально-оральной передачи, при которой инфекционные стадии выделяются в окружающую среду, потенциальные новые хозяева обычно не вступают в контакт с паразитом.(С точки зрения эволюции, передача при переливании крови была бы совсем недавним событием.) Передача от хищника к жертве — одна из стратегий, используемых простейшими, такими как Toxoplasma и Sarcocystis , для преодоления этих барьеров передачи.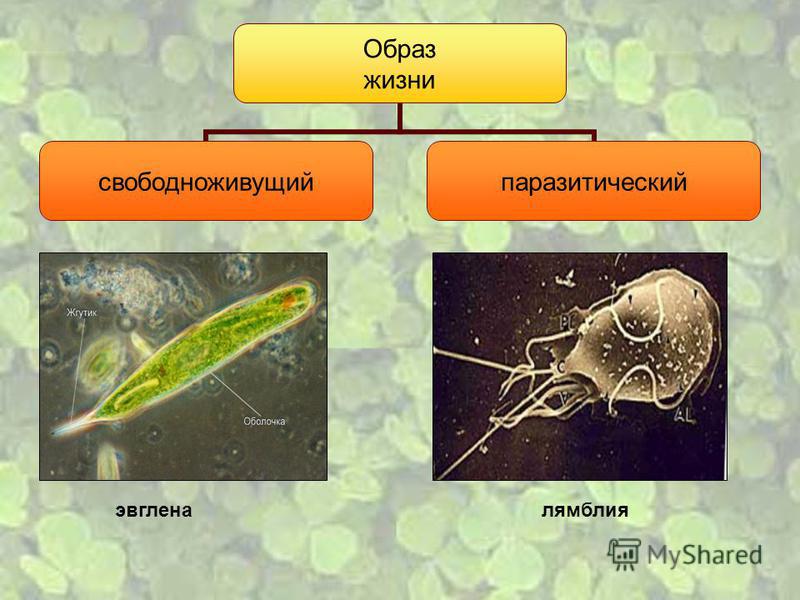 Как следует из названия, в передаче хищник-жертва участвуют два разных хозяина. Хищник заражается, поедая зараженную добычу. Это вызовет у хищника кишечную инфекцию и приведет к выделению инфекционных стадий с фекалиями.Жертва, как правило, травоядное, заражается, поедая инвазионные стадии, с которыми она сталкивается в окружающей среде. После проглатывания подходящей жертвой паразит проникает через эпителий кишечника и заражает внутренние органы или ткани хозяина, где он ждет, пока следующий хищник не проглотит его добычу. [Содержание страницы]
Как следует из названия, в передаче хищник-жертва участвуют два разных хозяина. Хищник заражается, поедая зараженную добычу. Это вызовет у хищника кишечную инфекцию и приведет к выделению инфекционных стадий с фекалиями.Жертва, как правило, травоядное, заражается, поедая инвазионные стадии, с которыми она сталкивается в окружающей среде. После проглатывания подходящей жертвой паразит проникает через эпителий кишечника и заражает внутренние органы или ткани хозяина, где он ждет, пока следующий хищник не проглотит его добычу. [Содержание страницы]
Передача вектора — это еще одна стратегия, используемая простейшими паразитами, обитающими в крови или внутренних тканях хозяина. Эта стратегия включает гематофоговных (т.е. питающихся кровью) членистоногих, служащих посредником между последовательными позвоночными хозяевами.Некоторые заболевания человека, вызываемые простейшими, передаются различными членистоногими-переносчиками (таблица). Переносчики представляют собой не просто «летающие шприцы», а представляют собой второго хозяина для простейшего паразита.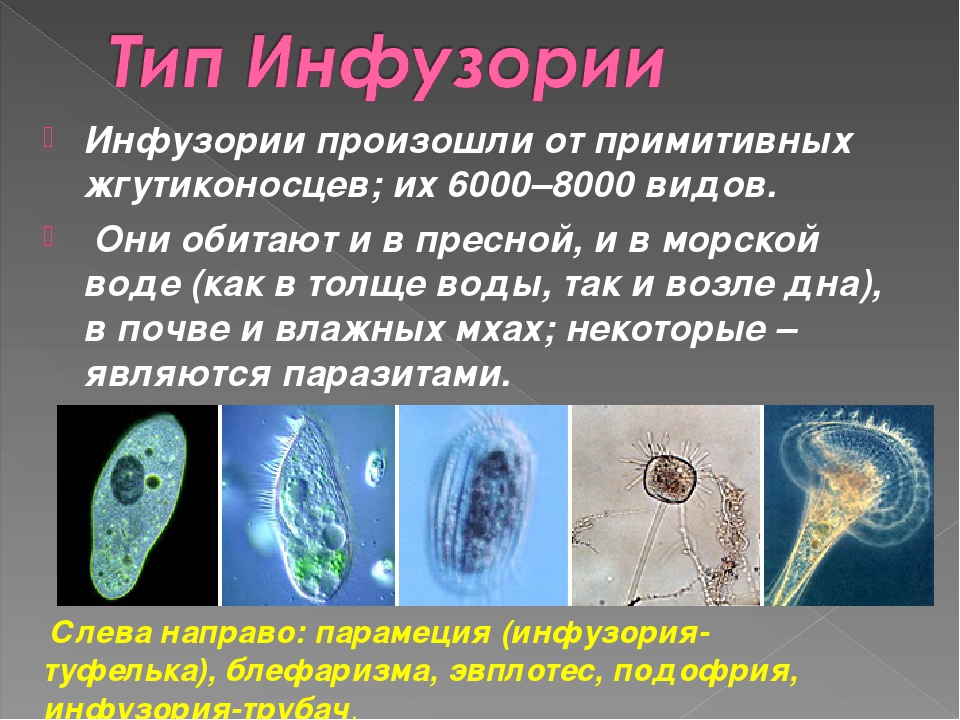 Таким образом, жизненный цикл болезней, передающихся переносчиками, также включает сложные взаимодействия между простейшими и переносчиками, аналогичные сложным взаимодействиям человека и простейших. Векторная передача, вероятно, эволюционировала несколько раз.
Таким образом, жизненный цикл болезней, передающихся переносчиками, также включает сложные взаимодействия между простейшими и переносчиками, аналогичные сложным взаимодействиям человека и простейших. Векторная передача, вероятно, эволюционировала несколько раз.
| Простейшие, передающиеся переносчиками | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||
Передача переносчиков также включает сложные взаимодействия между людьми и переносчиками.Это включает биологию взаимодействия человека и членистоногих, а также экологические соображения. Таким образом, передающиеся переносчиками паразиты демонстрируют сложные жизненные циклы, включающие взаимодействие между людьми, простейшими и членистоногими. Биология переносчиков и их взаимодействие с людьми обеспечивают возможные средства контроля передачи этих заболеваний.
Таким образом, передающиеся переносчиками паразиты демонстрируют сложные жизненные циклы, включающие взаимодействие между людьми, простейшими и членистоногими. Биология переносчиков и их взаимодействие с людьми обеспечивают возможные средства контроля передачи этих заболеваний.
Цетце и африканские трипаносомы
Род Glossina , общее название tsetse, включает не менее 30 видов или подвидов мух, обитающих в странах Африки к югу от Сахары.Взрослые особи цеце представляют собой желтых, коричневых или черных мух длиной 6–14 мм. Диагностическим признаком рода является «ячейка топора», обнаруженная в центре крыльев (рис.). Большинство видов попадают в одну из двух основных групп, представленных G. palpalis и G. morsitans . Группа palpalis связана с речной экологией и часто встречается вблизи ручьев, рек и озер в западной и центральной Африке. Группа morsitans чаще всего ассоциируется с лесными массивами саванны и засушливым кустарником в Восточной Африке.Группы palpalis и morsitans связаны с передачей Trypanosoma gambiense и T. rhodesiense соответственно. Различия в экологии и взаимодействии с резервуарами этих двух видов цеце способствуют различным проявлениям болезней, вызываемых двумя видами африканских трипаносом (см. таблицу в примечаниях об африканских трипаносомах).
Группа morsitans чаще всего ассоциируется с лесными массивами саванны и засушливым кустарником в Восточной Африке.Группы palpalis и morsitans связаны с передачей Trypanosoma gambiense и T. rhodesiense соответственно. Различия в экологии и взаимодействии с резервуарами этих двух видов цеце способствуют различным проявлениям болезней, вызываемых двумя видами африканских трипаносом (см. таблицу в примечаниях об африканских трипаносомах).
И самцы, и самки цеце являются прожорливыми едоками, и важные виды-переносчики, как правило, питаются крупными млекопитающими.Цеце означает «муха, губительная для крупного рогатого скота» на языке сечуана (поэтому цеце «муха» является излишним). Укус цеце болезненный, но обычно незначительный. Иногда образуется рубец, и некоторые люди становятся чувствительными к слюне. Тем не менее, цеце являются постоянными кормушками и могут сильно раздражать людей и животных. Цеце питаются «пулом» (т. е. тельмофагами), которые разрывают кожу своими ротовыми частями, а затем заглатывают кровь и лимфу, оттекающие в поверхностное поражение. Передача трипаносом происходит через слюну, которую впрыскивают в место укуса. Слюна содержит вещества, которые расширяют кровеносные сосуды и препятствуют свертыванию.
Передача трипаносом происходит через слюну, которую впрыскивают в место укуса. Слюна содержит вещества, которые расширяют кровеносные сосуды и препятствуют свертыванию.
Жизненный цикл африканских трипаносом включает чередование позвоночного хозяина и переносчика цеце. Трипомастиготы в кровотоке позвоночного хозяина поглощаются цеце и превращаются в проциклические трипомастиготы, которые размножаются в кишечнике цеце. Чтобы завершить жизненный цикл, эти проциклические формы должны попасть в слюнные железы.Точный механизм миграции паразита из кишечника цеце в слюнные железы неизвестен. Были предложены два пути: 1) классический путь, при котором паразит «отступает» через пищеварительную систему и мигрирует вверх по слюнному протоку, или 2) прямой путь, при котором паразит проникает через перитрофическую мембрану и эпителий кишечника, чтобы получить доступ к гемолимфа. Любой маршрут представляет собой барьеры и иллюстрирует сложные взаимодействия между простейшим паразитом и переносчиком (рис. ).
).
Схематическое изображение
взаимодействия трипаносома-цеце. Trypomasitgotes заняты
кровяной муки и проходят через пищевой канал (FC) и зоб (Cr). Кровь
пища заключена в перитрофическую мембрану (ПМ) желудочкового клапана
(PV) при попадании в среднюю кишку. Миграция проциклических трипомастигот
из средней кишки в слюнные железы (СЖ) включает два возможных пути
(обозначены стрелками): «классический» и «короткое замыкание».классический
маршрут включает миграцию к задней кишке (мальпигиевы трубы, МТ и
rectum, R) и выходит из перитрофической мембраны. Затем проциклический мигрирует
вперед через эктоперитрофическое пространство, выходит у желудочкового клапана,
проходит вверх по пищевому каналу и входит в слюнной проток (SD), чтобы получить доступ
к слюнным железам. Путь короткого замыкания предполагает прямое проникновение
перитрофической мембраны и кишечного эпителия (GE), чтобы получить доступ к
гемоцель. Из гемоцеля трипаносомы находят и проникают в слюнные железы.
железы. Из гемоцеля трипаносомы находят и проникают в слюнные железы.
железы. |
| Схема развития стадии, обнаруженные в слюнной железе цеце. Из Тетли и Викермана (1985) Дж. Клеточные науки. 74:1. |
Паразит превращается в эпимастиготную форму после достижения слюнной железы. Эпимасигота прикрепляется к эпителиальным клеткам слюнных желез своим жгутиком (fg) и подвергается дальнейшей репликации.Дифференцировка в метациклические трипомастиготы включает появление поверхностного слоя (sc) и изменения в митохондриях (mt), сопровождающие миграцию кинетопласта (kt) к заднему концу (рис.). Эти изменения в развитии являются необходимой подготовкой к заражению млекопитающего-хозяина. Зрелая метациклическая трипомастигота отделяется от эпителиальных клеток и остается в просвете слюнной железы до тех пор, пока не будет изгнана во время кормления цеце.
(Вернитесь к Жизненный цикл африканских трипаносом или перейдите к Стратегии контроля.)
Триатомины и
Trypanosoma cruziНесколько родов и видов триатомовых способны передавать Trypanosoma cruzi . Наиболее важными переносчиками являются: Triatoma infestans , Panstrongylus megistas и Rhodnius prolixus . Триатомины, как правило, крупные насекомые размером от 5 до 30 мм. В основном это насекомые Нового Света, обитающие от Аргентины до Соединенных Штатов. Жизненный цикл состоит из пяти нимфальных возрастов, за которыми следуют половозрелые взрослые особи.Крылья есть только у взрослых. Триатомины питаются кровью на протяжении всей своей жизни, и все стадии могут заразиться T. cruzi . Общие названия включают жуков-убийц, целующихся жуков (из-за их склонности кусать лицо) и жуков-коненозов (из-за их заостренных голов).
Большинство триатоминов не являются специфичными для хозяина и питаются широким кругом млекопитающих, а также птиц и рептилий. Передача T. cruzi часто связана с домашними видами, приспособившимися к обитанию в жилищах человека.Такие жилища, как правило, представляют собой хижины из глинобитных или соломенных крыш, которые обеспечивают множество укрытий для жуков. Клопы выходят ночью, чтобы питаться спящими людьми. Они питаются капиллярами, и время кормления варьируется от 3 до 30 минут. Взрослые особи могут потреблять до 0,25 мл крови за одно кормление, а в общей сложности триатомовые клопы могут потреблять 4-10 мл крови позвоночных в течение своей жизни. Укусы обычно безболезненны, несмотря на большой хоботок. Предполагается, что слюна содержит анестезию.Хотя кормление триатоминами вызывает небольшую боль, их укусы могут вызывать неприятные ощущения в месте кормления и вызывать реакцию гиперчувствительности.
Передача T. cruzi часто связана с домашними видами, приспособившимися к обитанию в жилищах человека.Такие жилища, как правило, представляют собой хижины из глинобитных или соломенных крыш, которые обеспечивают множество укрытий для жуков. Клопы выходят ночью, чтобы питаться спящими людьми. Они питаются капиллярами, и время кормления варьируется от 3 до 30 минут. Взрослые особи могут потреблять до 0,25 мл крови за одно кормление, а в общей сложности триатомовые клопы могут потреблять 4-10 мл крови позвоночных в течение своей жизни. Укусы обычно безболезненны, несмотря на большой хоботок. Предполагается, что слюна содержит анестезию.Хотя кормление триатоминами вызывает небольшую боль, их укусы могут вызывать неприятные ощущения в месте кормления и вызывать реакцию гиперчувствительности.
Триатомины заражаются при попадании в кровь трипомастигот с кровяной мукой. Трипомасиготы превращаются в эпимастиготы, которые представляют собой репликативную форму, встречающуюся в основном в средней кишке. Эпимастиготы разовьются в неделящиеся метациклические трипомастиготы. Метациклогенез происходит почти исключительно в прямой кишке и коррелирует с прикреплением к ректальному эпителию.Взаимодействия вектор-паразит важны для успешной репликации и дифференциации T. cruzi (см. также: Kollien and Schaub, The development of Trypanosoma cruzi in triatominea. Parasitol. Today 16:381; 2000). Инфекционные метациклические трипомастиготы. выводятся с калом. Этот тип передачи называется «задней кишкой» или «стеркорианией» и значительно менее эффективен, чем слюнная передача.
Эпимастиготы разовьются в неделящиеся метациклические трипомастиготы. Метациклогенез происходит почти исключительно в прямой кишке и коррелирует с прикреплением к ректальному эпителию.Взаимодействия вектор-паразит важны для успешной репликации и дифференциации T. cruzi (см. также: Kollien and Schaub, The development of Trypanosoma cruzi in triatominea. Parasitol. Today 16:381; 2000). Инфекционные метациклические трипомастиготы. выводятся с калом. Этот тип передачи называется «задней кишкой» или «стеркорианией» и значительно менее эффективен, чем слюнная передача.
(Перейдите к Жизненный цикл T. cruzi , экология передачи или стратегии контроля.)
Москиты и
Leishmania| Из Питера и Жиль (Цветной атлас тропической медицины и паразитологии) |
Москиты являются переносчиками Leishmania , а также некоторых бактериальных (бартонеллез) и вирусных (лихорадка москитов) болезней. Взрослые москиты имеют длину около 2 мм и характеризуются волосистым телом и крыльями (рисунок?). Роды москитов делятся на две группы: Phlebotomus и Sergentomyia , встречающиеся в Восточном полушарии (Европа, Азия, Африка, Австралия), и Lutzomyia , Brumptomyia и Warileya в Западном полушарии (т.е. Новый мир).Как правило, виды москитов Старого Света обитают в пустынных или полузасушливых экосистемах, а виды Нового Света обитают в лесах. Некоторые виды Старого Света будут размножаться в околодомовых условиях и проникать в жилища людей, тогда как передача болезней в Новом Свете связана с людьми, живущими или работающими рядом с лесом.
Взрослые москиты имеют длину около 2 мм и характеризуются волосистым телом и крыльями (рисунок?). Роды москитов делятся на две группы: Phlebotomus и Sergentomyia , встречающиеся в Восточном полушарии (Европа, Азия, Африка, Австралия), и Lutzomyia , Brumptomyia и Warileya в Западном полушарии (т.е. Новый мир).Как правило, виды москитов Старого Света обитают в пустынных или полузасушливых экосистемах, а виды Нового Света обитают в лесах. Некоторые виды Старого Света будут размножаться в околодомовых условиях и проникать в жилища людей, тогда как передача болезней в Новом Свете связана с людьми, живущими или работающими рядом с лесом.
Переносчиками лейшманиоза являются москиты Phlebotomus и Lutzomyia в Старом и Новом Свете соответственно.Пространственное распределение лейшманиоза и других заболеваний, передающихся москитами, имеет тенденцию быть неоднородным из-за ограниченной дальности полета москитов. Их полет часто описывают как «прыжки», характеризующиеся короткими очередями полетов, разделенными парой секунд отдыха. Москиты имеют небольшую дальность полета и обычно находятся в пределах десятка метров от места размножения.
Москиты имеют небольшую дальность полета и обычно находятся в пределах десятка метров от места размножения.
Как правило, кровью питаются только самки москитов, и они наиболее активно питаются в сумерках или ночью, или в условиях низкой освещенности, например, в тени.У них короткий ротовой аппарат, и они кормятся в бассейне. В месте укуса образуется папула розового цвета, окруженная эритематозным участком диаметром около 10-20 мм.
Зараженный амастиготами
макрофаги попадают в организм с кровяной мукой и превращаются в промастиготы.
(см. Leishmania Жизненный цикл).
Эти проциклические промастиготы прикрепляются к эпителию средней кишки мух и
копировать. Прикрепление опосредовано липофосфогликаном (LPG). LPG в изобилии
Гликоконъюгат, ассоциированный с клеточной поверхностью, состоит из трех основных доменов: гликолипида
мембранный якорь, дисахаридные повторы и небольшой колпачок (рисунок).LPG подвергается
биохимические изменения по мере созревания паразитов в метациклические промастиготы. То
количество дисахаридных повторов примерно удваивается, что приводит к удлинению
LPG и колпачок меняется с галактозы на
арабиноза. Считается, что изменение структуры шапки
быть связанным с отслоением от кишечного эпителия в том смысле, что прилипание
считается связанным со специфическими галактозными лектинами, обнаруженными в москитах.
кишечный эпителий. Удлинение LPG связано с увеличением комплемента.
резистентность, предполагающая дополнительную роль LPG с точки зрения инфекционности
позвоночный хозяин.(Обзор гликоконъюгатов Leishmania см.: Descoteaux
и Turco, Biochem.
Биофиз. Акта 1455:341; 1999г.)
То
количество дисахаридных повторов примерно удваивается, что приводит к удлинению
LPG и колпачок меняется с галактозы на
арабиноза. Считается, что изменение структуры шапки
быть связанным с отслоением от кишечного эпителия в том смысле, что прилипание
считается связанным со специфическими галактозными лектинами, обнаруженными в москитах.
кишечный эпителий. Удлинение LPG связано с увеличением комплемента.
резистентность, предполагающая дополнительную роль LPG с точки зрения инфекционности
позвоночный хозяин.(Обзор гликоконъюгатов Leishmania см.: Descoteaux
и Turco, Biochem.
Биофиз. Акта 1455:341; 1999г.)
В слюне москита также есть факторы, которые усиливают инфекционность Leishmania для позвоночного хозяина. Некоторые из этих соединений слюнных желез обладают иммунодепрессивной активностью в отношении лимфоцитов и макрофагов, что может объяснить их потенцирование.
(Вернитесь к Жизненный цикл Leishmania или перейдите к Стратегии управления. )
)
Клещи и
БабезииСтратегии управления
См. мероприятия по борьбе со специфическими болезнями:
ССЫЛКИ
Эти страницы разработаны и поддерживаются Марком Ф. Уизер, Тулейнский университет (© 2001). Последнее обновление 20 августа 2021 г. .
Влияние на исходы инфекций и заболеваний
Инфекции паразитическими простейшими обычно связаны с изменениями в структуре и составе комменсальных бактерий.Путем отдельного изучения внутриклеточных и внеклеточных форм паразитических простейших во время их развития у человека в этом разделе обзора раскрываются тесные отношения между хозяином, нативной бактериальной микробиотой и простейшими, которые влияют на исходы многих из этих важных с медицинской точки зрения инфекций.
Внутриклеточные паразитические простейшие
Паразитические простейшие, в основном внутриклеточные, специализируются на уклонении от иммунного ответа и манипулировании им.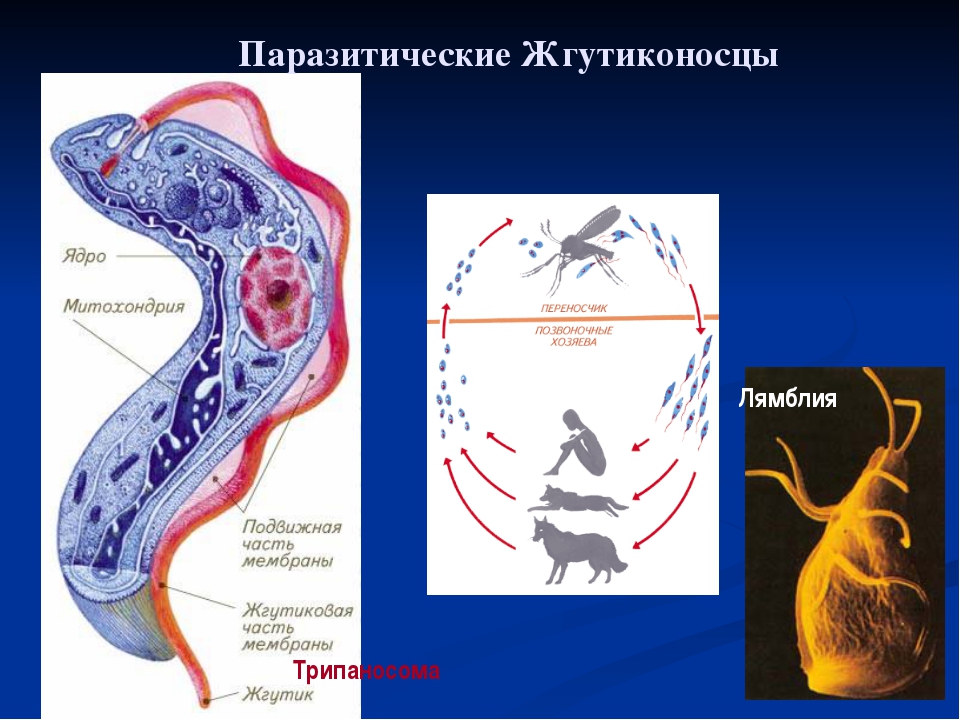 По этой причине эти инфекции часто приводят к иммунопатологиям, при которых течение заболевания будет зависеть от типа и уровня иммунного ответа.В этом сценарии потенциальное преимущество микробиоты человека заключается в обеспечении более эффективного иммунного ответа против инфекций [3]. Хотя такие корреляции были обнаружены, влияние микробиоты на иммунный ответ хозяина на протозойные инфекции было изучено только в нескольких примерах, как обсуждается ниже.
По этой причине эти инфекции часто приводят к иммунопатологиям, при которых течение заболевания будет зависеть от типа и уровня иммунного ответа.В этом сценарии потенциальное преимущество микробиоты человека заключается в обеспечении более эффективного иммунного ответа против инфекций [3]. Хотя такие корреляции были обнаружены, влияние микробиоты на иммунный ответ хозяина на протозойные инфекции было изучено только в нескольких примерах, как обсуждается ниже.
Apicomplexans (тип Apicomplexa) являются облигатными внутриклеточными паразитами, демонстрирующими необычный тип подвижности и ассоциированные органеллы, необходимые для инвазии клетки-хозяина.Они также содержат уникальную органеллу пластидного типа (апикопласт) и демонстрируют бесполый и половой способы размножения с образованием спор. Кокцидии представляют собой верхушечные паразиты, которые используют эпителиальные клетки кишечника позвоночных (включая человека) в качестве временной или конечной среды обитания. Воздействие кишечных микробов на заражение кокцидийными паразитами Cryptosporidium и Eimeria различно и неясно. У Cryptosporidium parvum , оппортунистического кишечного кокцидиозного паразита человека, у стерильных и иммунодефицитных мышей через несколько недель развиваются тяжелые инфекции, что резко контрастирует с теми же иммунодефицитными мышами, имеющими нормальную микробиоту [11].С другой стороны, некоторые виды Eimeria (кишечные кокцидиевые паразиты многих позвоночных) не могут заразить безмикробных животных по сравнению с животными, выращенными традиционным способом и колонизированными микробами [12,13].
У Cryptosporidium parvum , оппортунистического кишечного кокцидиозного паразита человека, у стерильных и иммунодефицитных мышей через несколько недель развиваются тяжелые инфекции, что резко контрастирует с теми же иммунодефицитными мышами, имеющими нормальную микробиоту [11].С другой стороны, некоторые виды Eimeria (кишечные кокцидиевые паразиты многих позвоночных) не могут заразить безмикробных животных по сравнению с животными, выращенными традиционным способом и колонизированными микробами [12,13].
Т . gondii является модельным организмом среди апикомплексных паразитов. Он вызывает токсоплазмоз, который, несмотря на клинически бессимптомное течение в подавляющем большинстве случаев, является наиболее распространенной паразитарной инфекцией человека во всем мире [14]. Очень удачный разворот T . gondii в человеческой популяции зависит от его необычной биологии и того, как люди реагируют на эту инфекцию, как описано ниже.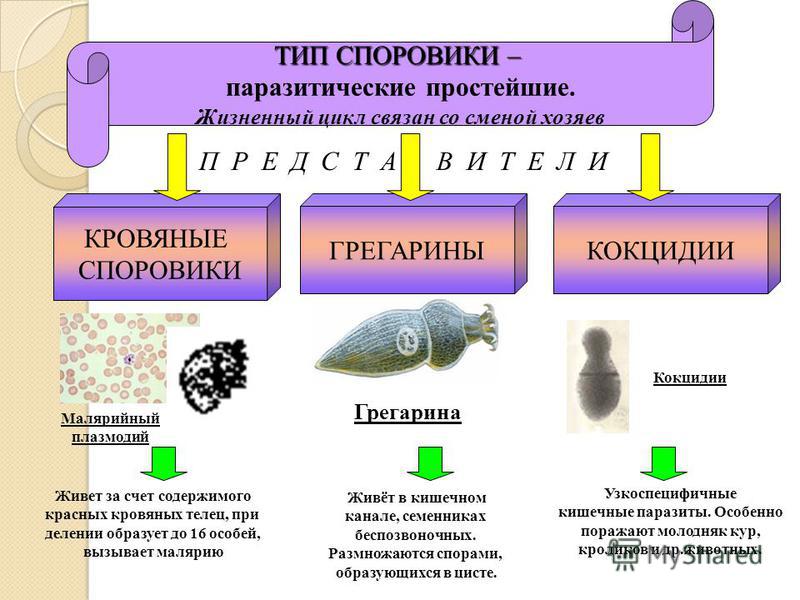 Как никакие другие внутриклеточные паразитические простейшие, T . gondii является чрезвычайно универсальным хозяином, способным внедряться и размножаться в любой ядерной клетке любого теплокровного животного. Кроме того, T . gondii легко передается человеку при проглатывании либо устойчивых к окружающей среде спор, выделяемых из кошачьих фекалий, либо псевдоцист, присутствующих в инфицированном мясе из различных источников.Наконец, что не менее важно, защитный и Th2-поляризованный адаптивный иммунный ответ обычно развивается у иммунокомпетентных лиц [15,16], и инфекции у человека в большинстве случаев становятся клинически бессимптомными. Кишечные комменсальные бактерии могут в значительной степени способствовать развитию этого защитного иммунного ответа и связанной с ним патологии [17], как обсуждается ниже (рис. 2).
Как никакие другие внутриклеточные паразитические простейшие, T . gondii является чрезвычайно универсальным хозяином, способным внедряться и размножаться в любой ядерной клетке любого теплокровного животного. Кроме того, T . gondii легко передается человеку при проглатывании либо устойчивых к окружающей среде спор, выделяемых из кошачьих фекалий, либо псевдоцист, присутствующих в инфицированном мясе из различных источников.Наконец, что не менее важно, защитный и Th2-поляризованный адаптивный иммунный ответ обычно развивается у иммунокомпетентных лиц [15,16], и инфекции у человека в большинстве случаев становятся клинически бессимптомными. Кишечные комменсальные бактерии могут в значительной степени способствовать развитию этого защитного иммунного ответа и связанной с ним патологии [17], как обсуждается ниже (рис. 2).
Рис. 2. Инициация врожденного иммунного ответа слизистой оболочки через дендритные клетки против инфекции Toxoplasma gondii у мышей.
Белок MyD88-адаптор толл-подобного рецептора (TLR) является ключевым элементом защитного ответа, основанного на продукции IL-12. Секреция IL-12 запускает эффективный клеточный иммунный ответ с продукцией INF-γ и активацией профиля Т-лимфоцитов Th2. (A) Этот врожденный ответ в основном зависит от TLR11, который образует эндолизосомальные димеры с TLR12, которые распознают профилин из T . гондии . Это распознавание играет центральную роль в иммунитете слизистых оболочек, запускающем выработку IL-12.(B) Однако в отсутствие TLR11 этот ответ по-прежнему минимально и в достаточной степени компенсируется косвенной стимуляцией, обеспечиваемой кишечными микробными комменсалами через TLR2, TLR4 и TLR9 [44]. В этом случае разрушение клеток, вызванное инфекцией, и дисбактериоз кишечника, по-видимому, вызывают потерю толерантности к кишечным комменсалам. Когда кишечная микробиота сильно снижается при длительном лечении антибиотиками, можно сделать следующие наблюдения: (C) мыши дикого типа, экспрессирующие TLR11, демонстрируют сниженный, но не отмененный ответ IL-12.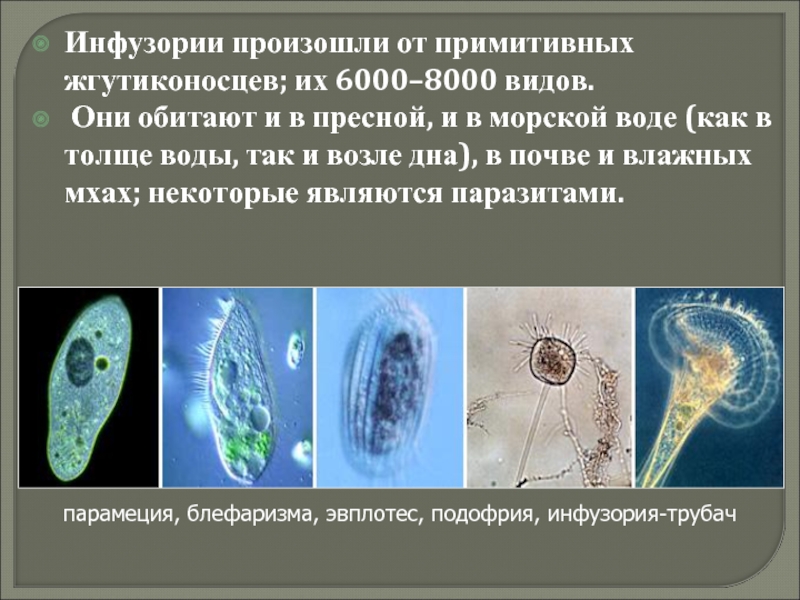 Эти животные все еще могут вырабатывать иммунитет Th2. (D) Мыши с нокаутом TLR11 неспособны вызывать ответы IL-12 против этого паразита, и иммунитет Th2 серьезно нарушен. В заключение, кишечные комменсалы служат естественными молекулярными адъювантами во время T . gondii инфекции.
Эти животные все еще могут вырабатывать иммунитет Th2. (D) Мыши с нокаутом TLR11 неспособны вызывать ответы IL-12 против этого паразита, и иммунитет Th2 серьезно нарушен. В заключение, кишечные комменсалы служат естественными молекулярными адъювантами во время T . gondii инфекции.
https://doi.org/10.1371/journal.pntd.0004176.g002
Когда T . gondii достигает кишечника человека с нативной и функциональной микробиотой, иммунный ответ инициируется на уровне слизистой оболочки кишечника путем активации толл-подобных рецепторов (TLR) в дендритных клетках (ДК) (рис. 2).Исследования in vitro указывают на участие различных TLR, таких как TLR2, TLR3, TLR4, TLR7 и TLR9, в ответ на T . gondii инфекции [18]. Однако эксперименты на мышах показывают, что распознавание T . Профилин gondii с помощью димера TLR11/12 играет ключевую роль в иммунном ответе против оральной инфекции (рис. 2А и 2С) [18,19]. Профилин является основным лигандом паразита, который активирует TLR11. Поскольку профилин является внутриклеточным белком, он либо высвобождается по неизвестному механизму, либо поглощается ДК, когда они фагоцитируют мертвых паразитов и остатки.Это распознавание активирует фактор транскрипции интерферон (INF) регуляторный фактор 8, что приводит к продукции интерлейкина 12 (IL-12) [20,21]. IL-12 способствует клеточному иммунитету с продукцией INF-γ естественными клетками-киллерами и дифференцировкой Т-лимфоцитов Th2. Как описано ниже, эти клетки и молекулы играют роль в иммунопатогенезе T . gondii инфекций, а также необходимы для инициации адаптивной фазы иммунного ответа [18].
Профилин является основным лигандом паразита, который активирует TLR11. Поскольку профилин является внутриклеточным белком, он либо высвобождается по неизвестному механизму, либо поглощается ДК, когда они фагоцитируют мертвых паразитов и остатки.Это распознавание активирует фактор транскрипции интерферон (INF) регуляторный фактор 8, что приводит к продукции интерлейкина 12 (IL-12) [20,21]. IL-12 способствует клеточному иммунитету с продукцией INF-γ естественными клетками-киллерами и дифференцировкой Т-лимфоцитов Th2. Как описано ниже, эти клетки и молекулы играют роль в иммунопатогенезе T . gondii инфекций, а также необходимы для инициации адаптивной фазы иммунного ответа [18].
Этот ответ IL-12 у мышей зависит от TLR-адаптера MyD88 и фактора миелоидной дифференцировки 88 [22].Эта молекула играет центральную роль в иммунном ответе против T . gondii оральная инфекция (рис. 2). У мышей с генетической аблацией MyD88 ответ IL-12 отсутствует, и эти мыши с нокаутом погибают в течение двух недель после оральной инфекции [23]. Молекулы адаптера TLR, такие как MyD88, могут реагировать на многие типы TLR. MyD88 инициирует различные внутриклеточные сигнальные пути, но результирующий баланс костимулирующих молекул зависит от контекста лигандов TLR [24].В контексте TLR11/12 он запускает высвобождение IFN-γ через путь NF-kB, который стимулирует макрофаги и CD8α — ДК, «запуская» иммунный ответ [18].
Молекулы адаптера TLR, такие как MyD88, могут реагировать на многие типы TLR. MyD88 инициирует различные внутриклеточные сигнальные пути, но результирующий баланс костимулирующих молекул зависит от контекста лигандов TLR [24].В контексте TLR11/12 он запускает высвобождение IFN-γ через путь NF-kB, который стимулирует макрофаги и CD8α — ДК, «запуская» иммунный ответ [18].
Важно отметить, что мыши TLR11 -/- не полностью нарушены в ответ на T . gondii , пока присутствуют кишечные симбиотические бактерии (рис. 2B и 2D). В присутствии кишечных комменсалов (рис. 2B) сохраняется частичная резистентность со сниженным, но существующим ответом IL-12, который достаточен для производства аналогичных количеств INF-γ по сравнению с мышами дикого типа.Следовательно, мышей TLR11 -/- выживают в острой фазе инфекции. Когда мышей TLR11 -/- лечили антибиотиками с целью уничтожения кишечных симбиотических бактерий, этот оставшийся защитный ответ IL-12 утрачивался (рис.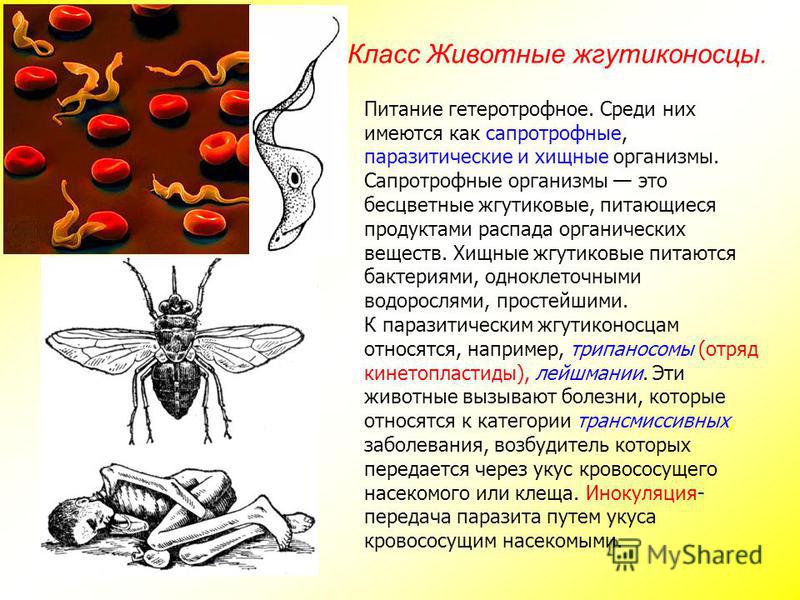 2D). Этот защитный ответ можно снять пероральным введением бактериального липополисахарида (ЛПС) [17]. Кроме того, мыши с нокаутом TLR указывают на участие TLR2, TLR4 и TLR9 в способности устанавливать минимально достаточный ответ INF-γ на паразита.Все эти TLR зависят от MyD88, но не отвечают на T . gondii инфекция per se. ЛПС, например, является бактериальным агонистом TLR4. Таким образом, кишечные комменсальные бактерии функционируют как естественный молекулярный адъювант при оральной инфекции с помощью T . gondii , обеспечивающий непрямую стимуляцию ДК слизистой оболочки. Естественное сообщество кишечных микробов, по-видимому, необходимо, поскольку Bacteroides , многочисленный род кишечных бактерий, не может обеспечить эту стимуляцию в одиночку [17].
2D). Этот защитный ответ можно снять пероральным введением бактериального липополисахарида (ЛПС) [17]. Кроме того, мыши с нокаутом TLR указывают на участие TLR2, TLR4 и TLR9 в способности устанавливать минимально достаточный ответ INF-γ на паразита.Все эти TLR зависят от MyD88, но не отвечают на T . gondii инфекция per se. ЛПС, например, является бактериальным агонистом TLR4. Таким образом, кишечные комменсальные бактерии функционируют как естественный молекулярный адъювант при оральной инфекции с помощью T . gondii , обеспечивающий непрямую стимуляцию ДК слизистой оболочки. Естественное сообщество кишечных микробов, по-видимому, необходимо, поскольку Bacteroides , многочисленный род кишечных бактерий, не может обеспечить эту стимуляцию в одиночку [17].
Повреждение эпителия в результате начальной репликации T . gondii внутри эпителиальных клеток кишечника, должно обеспечивать транслокацию люменных бактерий в собственную пластинку. Кроме того, T . gondii оральная инфекция приводит к дисбиозу кишечника (т. е. бактериальному дисбалансу) с нарушением регуляции или потерей клеток Панета [19]. Эти специализированные эпителиальные клетки кишечника продуцируют антимикробные пептиды, которые важны для поддержания бактериального гомеостаза в кишечнике. Т . Дисбиоз, индуцированный gondii-, характеризуется снижением бактериального разнообразия кишечника со сдвигом в сторону грамотрицательных бактерий, являющихся ключевым источником ЛПС [19]. Комменсальный флагеллин, вездесущий и основной белок бактериального жгутика, также может быть источником непрямой стимуляции Т-лимфоцитов [25]. В целом ДК, по-видимому, вызывают потерю иммунологической толерантности к кишечной бактериальной флоре.
Кроме того, T . gondii оральная инфекция приводит к дисбиозу кишечника (т. е. бактериальному дисбалансу) с нарушением регуляции или потерей клеток Панета [19]. Эти специализированные эпителиальные клетки кишечника продуцируют антимикробные пептиды, которые важны для поддержания бактериального гомеостаза в кишечнике. Т . Дисбиоз, индуцированный gondii-, характеризуется снижением бактериального разнообразия кишечника со сдвигом в сторону грамотрицательных бактерий, являющихся ключевым источником ЛПС [19]. Комменсальный флагеллин, вездесущий и основной белок бактериального жгутика, также может быть источником непрямой стимуляции Т-лимфоцитов [25]. В целом ДК, по-видимому, вызывают потерю иммунологической толерантности к кишечной бактериальной флоре.
Эта непрямая иммунологическая стимуляция может быть важна для иммунопатологии T .Инфекция gondii у мышей. В отсутствие TLR11 кишечные бактерии не только обеспечивают достаточный Th2-ответ, но и предотвращают развитие иммунопатологии токсоплазмоза у орально инфицированных мышей [17]. У людей отсутствует функциональный TLR11, который обнаружен как псевдоген, а эквивалентный сенсор TLR для профилина не обнаружен. Кроме того, неясно, может ли один TLR12 выполнять роль TLR11 [18]. Участие других TLR и TLR-независимый механизм распознавания паразитов при оральных инфекциях человека еще не ясны [18].Между тем, заманчиво предположить интересный эволюционный сценарий с участием хозяина, паразита и бактериальной микробиоты. Коэволюция T . gondii , люди и микробиота их кишечника оказали большое влияние друг на друга, способствуя выживанию как хозяина, так и паразита. Коэволюция этой триады привела к сохранению хозяина, который характеризуется общим отсутствием угрожающих жизни симптомов у инфицированных людей, и способствовала успешному распространению T . gondii в популяциях людей по всему миру.
У людей отсутствует функциональный TLR11, который обнаружен как псевдоген, а эквивалентный сенсор TLR для профилина не обнаружен. Кроме того, неясно, может ли один TLR12 выполнять роль TLR11 [18]. Участие других TLR и TLR-независимый механизм распознавания паразитов при оральных инфекциях человека еще не ясны [18].Между тем, заманчиво предположить интересный эволюционный сценарий с участием хозяина, паразита и бактериальной микробиоты. Коэволюция T . gondii , люди и микробиота их кишечника оказали большое влияние друг на друга, способствуя выживанию как хозяина, так и паразита. Коэволюция этой триады привела к сохранению хозяина, который характеризуется общим отсутствием угрожающих жизни симптомов у инфицированных людей, и способствовала успешному распространению T . gondii в популяциях людей по всему миру.
Внеклеточные паразитические простейшие
Некоторые паразитические простейшие человека являются исключительно внеклеточными. Примерами являются Entamoeba histolytica , Giardia lamblia и Trichomonas vaginalis . Живя вне клеток и тканей человека, эти паразиты должны физически взаимодействовать с нативной микробиотой слизистой оболочки. Поддерживая тесные отношения и отношения сотрудничества между собой и с хозяином, нативная бактериальная микробиота кишечника человека и слизистой оболочки влагалища может представлять собой естественный барьер для инвазии патогенов.В этом разделе представлены взаимодействия между внеклеточными паразитическими простейшими и микробиотой слизистой оболочки человека, их эффекты и механизмы.
Примерами являются Entamoeba histolytica , Giardia lamblia и Trichomonas vaginalis . Живя вне клеток и тканей человека, эти паразиты должны физически взаимодействовать с нативной микробиотой слизистой оболочки. Поддерживая тесные отношения и отношения сотрудничества между собой и с хозяином, нативная бактериальная микробиота кишечника человека и слизистой оболочки влагалища может представлять собой естественный барьер для инвазии патогенов.В этом разделе представлены взаимодействия между внеклеточными паразитическими простейшими и микробиотой слизистой оболочки человека, их эффекты и механизмы.
Е . histolytica представляет собой специфический для человека внеклеточный паразит, обнаруживаемый в просвете толстой кишки, месте, где у человека наблюдается наибольшая плотность бактериальной популяции. Тяжесть амеобиаза связана со способностью этого паразита покидать просвет кишечника и разрушать слизистую оболочку кишечника, способствуя развитию геморрагической дизентерии и диссеминации в другие органы, тяжелому состоянию, известному как инвазивный или внекишечный амеобиаз [26]. В ранних исследованиях вирулентность E . Было показано, что histolytica значительно усиливается кишечными бактериями в моделях животных с контролируемой микробиотой [27,28]. Дальнейшее понимание этой микробной взаимосвязи было получено в экспериментальных условиях in vitro и в лабораторных условиях [29,30].
В ранних исследованиях вирулентность E . Было показано, что histolytica значительно усиливается кишечными бактериями в моделях животных с контролируемой микробиотой [27,28]. Дальнейшее понимание этой микробной взаимосвязи было получено в экспериментальных условиях in vitro и в лабораторных условиях [29,30].
Модуляция E . histolytica вирулентность кишечных бактерий зависит от времени, вида или штамма бактерий и штамма паразита [31–35].Бактериальный штамм Escherichia coli серотипа O55 прочно связывается с поверхностным лектином Gal/GalNAc E . histolytica из-за естественного поверхностного углеводного состава, богатого галактозой и N-ацетилгалактозамином. Распознавание E . coli O55 по E . histolytica через Gal/GalNAc, центральный фактор вирулентности этой амебы, усиливает ее вирулентность в первый час, вероятно, в результате активации нижестоящих путей, запускаемых распознаванием Gal/GalNAc. Однако в течение первого месяца моноасенального культивирования происходит значительное снижение вирулентности, которое восстанавливается через три месяца дальнейшего совместного культивирования. Это влияние на вирулентность амебы наблюдалось на разных уровнях, таких как регуляция экспрессии Gal/GalNAc, фагоцитоз, протеолиз, адгезия и цитотоксичность. Взаимодействие между этим паразитом и эндогенными бактериями вызывает существенные изменения в экспрессии генов амебы, что позволяет предположить, что некоторые из этих бактерий могут также играть роль в питании, поддерживающем рост амеб [31,34].
Однако в течение первого месяца моноасенального культивирования происходит значительное снижение вирулентности, которое восстанавливается через три месяца дальнейшего совместного культивирования. Это влияние на вирулентность амебы наблюдалось на разных уровнях, таких как регуляция экспрессии Gal/GalNAc, фагоцитоз, протеолиз, адгезия и цитотоксичность. Взаимодействие между этим паразитом и эндогенными бактериями вызывает существенные изменения в экспрессии генов амебы, что позволяет предположить, что некоторые из этих бактерий могут также играть роль в питании, поддерживающем рост амеб [31,34].
Другие кишечные и некишечные патогенные бактерии, включая E . coli , Shigella dysenteriae и Staphylococcus aureus также способствуют существенным изменениям в обоих E . histolytica вирулентность и реакция хозяина. Значительное усиление вирулентных свойств E . histolytica наблюдалось увеличение экспрессии Gal/GalNAc, протеолиз, адгезия и цитотоксичность.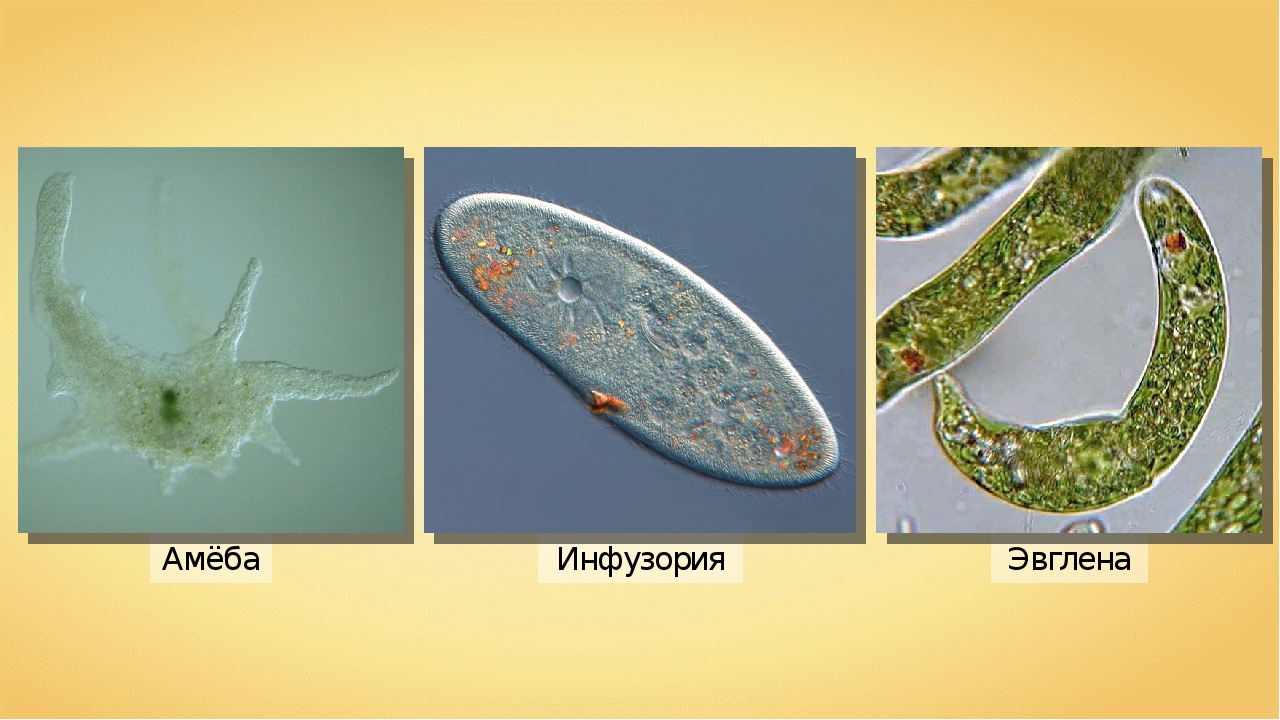 Примечательно, что это усиление вирулентности амебы наблюдалось только с этими патогенными бактериями, а не с непатогенными комменсалами E . кишечная палочка . Кроме того, Entamoeba dispar (кишечная непатогенная амеба, тесно связанная с E . histolytica ) не могла способствовать этим эффектам даже в сочетании с теми же патогенными бактериями. Важно отметить, что эти патогенные бактерии также изменили реакцию хозяина в отношении функции эпителиального барьера, хемоаттракции нейтрофилов и воспалительной реакции [32,35]. В целом вышеупомянутые исследования показывают, что синергетическое воздействие некоторых кишечных бактерий на реакцию хозяина и паразита может создать среду, более подходящую для инвазии паразита, что может способствовать развитию заболевания.Поскольку микробиом кишечника человека представляет собой сложную систему, включающую по крайней мере сотни видов бактерий, эти первоначальные наблюдения могут по-прежнему представлять собой чрезмерное упрощение того, что происходит при кишечных инфекциях на E .
Примечательно, что это усиление вирулентности амебы наблюдалось только с этими патогенными бактериями, а не с непатогенными комменсалами E . кишечная палочка . Кроме того, Entamoeba dispar (кишечная непатогенная амеба, тесно связанная с E . histolytica ) не могла способствовать этим эффектам даже в сочетании с теми же патогенными бактериями. Важно отметить, что эти патогенные бактерии также изменили реакцию хозяина в отношении функции эпителиального барьера, хемоаттракции нейтрофилов и воспалительной реакции [32,35]. В целом вышеупомянутые исследования показывают, что синергетическое воздействие некоторых кишечных бактерий на реакцию хозяина и паразита может создать среду, более подходящую для инвазии паразита, что может способствовать развитию заболевания.Поскольку микробиом кишечника человека представляет собой сложную систему, включающую по крайней мере сотни видов бактерий, эти первоначальные наблюдения могут по-прежнему представлять собой чрезмерное упрощение того, что происходит при кишечных инфекциях на E . histolytica в естественных условиях.
histolytica в естественных условиях.
Giardia lamblia — еще одно внеклеточное паразитическое простейшее, обнаруженное в просвете кишечника человека. Однако в отличие от E . гистолитика , G . lamblia не является инвазивным и обитает в тонком кишечнике, где микроорганизмы не так многочисленны [36]. Лица с G . Инфекция lamblia (например, лямблиоз) демонстрирует изменения в бактериальном составе верхних отделов пищеварительного тракта [37,38]. Бактериальная микробиота кишечника потенциально может влиять на исходы лямблиоза, но неясно, являются ли эти микробные изменения причиной или следствием. Хотя лактобациллы могут ингибировать G . lamblia пролиферации in vitro [39] или могут помочь в качестве пробиотического вмешательства в животных моделях [40–42], неясно, являются ли эти бактерии аутохтонными или коренными обитателями участка G . лямблии инфекция у человека. Интригующий отчет показал, что естественное сопротивление G . Инфекция lamblia между мышами сходного генетического происхождения, но происходящими от разных заводчиков, может передаваться между этими животными исключительно при совместном содержании животных в течение нескольких недель [43].Хотя лечение антибиотиками и частичная характеристика этих микробных сообществ предполагают защитную роль кишечной микробиоты, механизмы, лежащие в основе устойчивости к G . Инфекция lamblia у этих животных остается неуловимой. Существующие данные еще не проясняют роль микробиоты кишечника при лямблиозе.
Интригующий отчет показал, что естественное сопротивление G . Инфекция lamblia между мышами сходного генетического происхождения, но происходящими от разных заводчиков, может передаваться между этими животными исключительно при совместном содержании животных в течение нескольких недель [43].Хотя лечение антибиотиками и частичная характеристика этих микробных сообществ предполагают защитную роль кишечной микробиоты, механизмы, лежащие в основе устойчивости к G . Инфекция lamblia у этих животных остается неуловимой. Существующие данные еще не проясняют роль микробиоты кишечника при лямблиозе.
Т . vaginalis — единственное простейшее, паразитирующее в половых путях человека. Он вызывает трихомониаз, наиболее распространенную в мире инфекцию невирусной этиологии, передающуюся половым путем [2].Во влагалище женщин детородного возраста этот внеклеточный паразит вторгается в естественную среду обитания плотного и устойчивого сообщества бактерий. Вагинальный микробиом 396 бессимптомных женщин из Северной Америки недавно был охарактеризован по пяти типам состояния сообщества (рис. 1, круговая диаграмма). В четырех из них преобладают разные виды Lactobacillus — L . вкладыши , л . хрустящий , L . гассери и L . jensenii — с относительно высоким (и почти исключительным) обилием таксонов. За исключением L . iners , лактобактерии слабо представлены в пятом типе сообщества, который преимущественно состоит из анаэробных бактерий, таких как Atopobium vaginae , Prevotella bivia , Megasphaera sp., Sneathia sp., и sp. [9]. Одиннадцать случаев бессимптомного T . вагинальные инфекции (т.э., 2,8%) были обнаружены в этой группе женщин [44]. Наблюдаем за раздачей T . vaginalis среди этих типов бактериальных сообществ можно сделать два важных наблюдения.
Вагинальный микробиом 396 бессимптомных женщин из Северной Америки недавно был охарактеризован по пяти типам состояния сообщества (рис. 1, круговая диаграмма). В четырех из них преобладают разные виды Lactobacillus — L . вкладыши , л . хрустящий , L . гассери и L . jensenii — с относительно высоким (и почти исключительным) обилием таксонов. За исключением L . iners , лактобактерии слабо представлены в пятом типе сообщества, который преимущественно состоит из анаэробных бактерий, таких как Atopobium vaginae , Prevotella bivia , Megasphaera sp., Sneathia sp., и sp. [9]. Одиннадцать случаев бессимптомного T . вагинальные инфекции (т.э., 2,8%) были обнаружены в этой группе женщин [44]. Наблюдаем за раздачей T . vaginalis среди этих типов бактериальных сообществ можно сделать два важных наблюдения. Во-первых, во влагалище была низкая численность лактобацилл 73% от Т . vaginalis — инфицированные женщины (8/11), что согласуется с предыдущими клиническими отчетами [45]. Исключение, опять же, составил L . iners , который был обнаружен при обилии таксона >80% во влагалище 18% T . vaginalis — инфицированных женщин (2/11). Во-вторых, те Т . vaginalis инфекций с отсутствием лактобацилл (8/11) были связаны с пятым типом сообщества, содержащим в основном анаэробные бактерии. Такой микробный сдвиг с исключением лактобактерий и более высокой распространенностью этих анаэробов обычно связан с распространенным заболеванием, известным как бактериальный вагиноз (БВ). л . iners также были связаны с этим состоянием [46].
Во-первых, во влагалище была низкая численность лактобацилл 73% от Т . vaginalis — инфицированные женщины (8/11), что согласуется с предыдущими клиническими отчетами [45]. Исключение, опять же, составил L . iners , который был обнаружен при обилии таксона >80% во влагалище 18% T . vaginalis — инфицированных женщин (2/11). Во-вторых, те Т . vaginalis инфекций с отсутствием лактобацилл (8/11) были связаны с пятым типом сообщества, содержащим в основном анаэробные бактерии. Такой микробный сдвиг с исключением лактобактерий и более высокой распространенностью этих анаэробов обычно связан с распространенным заболеванием, известным как бактериальный вагиноз (БВ). л . iners также были связаны с этим состоянием [46].
Однако следует добавить предостережение.Во-первых, это представление бессимптомной популяции с относительно небольшим количеством T . vaginalis инфекций (11/396). Во-вторых, БВ является распространенным заболеванием среди афроамериканцев [47], и эта когорта была широко представлена в этом исследовании [9,44]. Могут потребоваться дополнительные метагеномные исследования с участием различных этнических групп, чтобы однозначно подтвердить существование строгой связи между T . vaginalis инфекции и специфического вагинального микробного сообщества.Если такая микробная ассоциация существует, можно сделать две гипотезы: (i) Lactobacilli и T . vaginalis являются конкурентами, антагонистически взаимодействующими в своей естественной среде; (ii) бактерии BV и T . vaginalis взаимодействуют совместно, и заболевание трихомониаз может быть результатом взаимодействия T . vaginalis с одним или несколькими типами бактерий BV.
Во-вторых, БВ является распространенным заболеванием среди афроамериканцев [47], и эта когорта была широко представлена в этом исследовании [9,44]. Могут потребоваться дополнительные метагеномные исследования с участием различных этнических групп, чтобы однозначно подтвердить существование строгой связи между T . vaginalis инфекции и специфического вагинального микробного сообщества.Если такая микробная ассоциация существует, можно сделать две гипотезы: (i) Lactobacilli и T . vaginalis являются конкурентами, антагонистически взаимодействующими в своей естественной среде; (ii) бактерии BV и T . vaginalis взаимодействуют совместно, и заболевание трихомониаз может быть результатом взаимодействия T . vaginalis с одним или несколькими типами бактерий BV.
Используя модели полимикробной инфекции в тканевой культуре, два недавних исследования подтверждают вышеизложенную гипотезу [48,49].Во-первых, T . Было обнаружено, что vaginalis снижает количество Lactobacillus acidophilus , L . jensenii и L . crispatus [48]. Во-вторых, T . Адгезия vaginalis к человеческим клеткам (ключевой аспект его вирулентности) значительно подавлялась L . gasseri штаммоспецифическим и контактно-зависимым образом [49]. Наконец, было обнаружено, что две распространенные BV-ассоциированные бактерии, Atopobium и Gardnerella , вызывают синергетическое усиление T . vaginalis -индуцированные хемокины [48]. Кроме того, клинические изоляты T . vaginalis часто содержат микоплазмы. Mycoplasma hominis , в частности, часто ассоциируется с усиленным воспалением при трихомониазе [50]. М . Было показано, что hominis усиливает провоспалительные реакции моноцитов человека на T . vaginalis инфекций in vitro синергическим образом [51].
Было обнаружено, что vaginalis снижает количество Lactobacillus acidophilus , L . jensenii и L . crispatus [48]. Во-вторых, T . Адгезия vaginalis к человеческим клеткам (ключевой аспект его вирулентности) значительно подавлялась L . gasseri штаммоспецифическим и контактно-зависимым образом [49]. Наконец, было обнаружено, что две распространенные BV-ассоциированные бактерии, Atopobium и Gardnerella , вызывают синергетическое усиление T . vaginalis -индуцированные хемокины [48]. Кроме того, клинические изоляты T . vaginalis часто содержат микоплазмы. Mycoplasma hominis , в частности, часто ассоциируется с усиленным воспалением при трихомониазе [50]. М . Было показано, что hominis усиливает провоспалительные реакции моноцитов человека на T . vaginalis инфекций in vitro синергическим образом [51].
В совокупности эти недавние исследования показывают, что микробные ассоциации такого рода могут значительно влиять на исходы трихомониаза, способствуя как росту ассоциированных патогенных бактерий, так и создавая воспалительную среду, более подходящую для развития заболевания.
Обзор некоторых простейших паразитов, вызывающих бесплодие у сельскохозяйственных животных
В статье рассматриваются некоторые простейшие паразиты, вызывающие бесплодие у домашнего скота, с особым акцентом на неоспороз, саркоцистоз, токсоплазмоз и трихомониаз. В нем освещаются передача, патогенез, клинические признаки, диагностика, профилактика, контроль и лечение отдельных паразитов. Делается вывод, что эти паразиты часто упускаются из виду при расследовании причин абортов у скота, и, тем не менее, они могут быть причиной некоторых бесплодий у этой группы животных, которые могут привести к серьезным экономическим потерям.
1. Введение
Бесплодие является основной причиной экономических потерь и главным препятствием для достижения оптимальной эффективности в системе животноводческого производства, главным образом в результате снижения производства молока в молочном секторе и увеличения количества выбраковок. Причины бесплодия могут быть многочисленными и сложными [1]. Они могут быть связаны с нарушением развития и созревания граафовых фолликулов, началом эструса, овуляцией, успешным коитусом, оплодотворением, имплантацией, а также развитием и рождением плода и его оболочек.Любое временное состояние, нарушающее этот распорядок, такое как болезненные состояния, недоедание, неадекватное управление стадом, наследственные и врожденные факторы, гормональные нарушения или изменения окружающей среды, делает животное бесплодным [2].
Причины бесплодия могут быть многочисленными и сложными [1]. Они могут быть связаны с нарушением развития и созревания граафовых фолликулов, началом эструса, овуляцией, успешным коитусом, оплодотворением, имплантацией, а также развитием и рождением плода и его оболочек.Любое временное состояние, нарушающее этот распорядок, такое как болезненные состояния, недоедание, неадекватное управление стадом, наследственные и врожденные факторы, гормональные нарушения или изменения окружающей среды, делает животное бесплодным [2].
Паразитарные инфекции обычно связаны с бедными и часто маргинализованными сообществами в странах с низким уровнем дохода [3]. Простейшие паразиты являются серьезной причиной абортов и бесплодия у домашних жвачных животных. Виды Toxoplasma gondii и Sarcocystis являются частой причиной массовых абортов у домашнего скота, и оба они имеют жизненный цикл с двумя хозяевами.Плотоядные окончательные хозяева распространяют инфекцию через свои фекалии, а домашние жвачные животные являются промежуточными хозяевами. Аналогичный, недавно обнаруженный простейший, Neospora spp., стал важной причиной репродуктивных заболеваний, особенно в качестве абортивного средства у крупного рогатого скота . Предполагается, что Neospora также имеет жизненный цикл с двумя хозяевами, хотя окончательный хозяин (хозяева) не был идентифицирован. Также сообщается, что передающийся половым путем Tritrichomonas fetus является важной причиной потери беременности у естественно разводимого крупного рогатого скота во всем мире [4].
Аналогичный, недавно обнаруженный простейший, Neospora spp., стал важной причиной репродуктивных заболеваний, особенно в качестве абортивного средства у крупного рогатого скота . Предполагается, что Neospora также имеет жизненный цикл с двумя хозяевами, хотя окончательный хозяин (хозяева) не был идентифицирован. Также сообщается, что передающийся половым путем Tritrichomonas fetus является важной причиной потери беременности у естественно разводимого крупного рогатого скота во всем мире [4].
2. Неоспороз
Neospora caninum является облигатным простейшим (кокцидийным) паразитом, родственным Toxoplasma gondii , и впервые был связан с нервно-мышечным заболеванием у собак в середине 1980-х годов [5]. Он распространен по всему миру и считается основной причиной бесплодия крупного рогатого скота, что приводит к значительным экономическим потерям [6, 7]. Сообщается, что паразит имеет широкий круг хозяев и поражает все основные виды домашнего скота, а также домашних животных и некоторые виды диких животных [8, 9]. Клинические инфекции также были зарегистрированы у лошадей, коз, овец и оленей. По сообщениям, прямые производственные потери и затраты на лечение инфекции N. caninum в Приморских провинциях Канады составляют € 1921 в год [6]. Кроме того, было подсчитано, что это приводит к среднегодовым затратам в размере 249 евро с максимальным значением 5604 евро для стада из 50 лактирующих коров [7]. Кроме того, общие ежегодные потери из-за инфекций/абортов, вызванных N. caninum , по оценкам, колеблются в среднем от 1 доллара США.1 миллион в новозеландской мясной промышленности до предполагаемого медианного общего воздействия в 546,3 миллиона долларов США в год на молочное население США [10].
Клинические инфекции также были зарегистрированы у лошадей, коз, овец и оленей. По сообщениям, прямые производственные потери и затраты на лечение инфекции N. caninum в Приморских провинциях Канады составляют € 1921 в год [6]. Кроме того, было подсчитано, что это приводит к среднегодовым затратам в размере 249 евро с максимальным значением 5604 евро для стада из 50 лактирующих коров [7]. Кроме того, общие ежегодные потери из-за инфекций/абортов, вызванных N. caninum , по оценкам, колеблются в среднем от 1 доллара США.1 миллион в новозеландской мясной промышленности до предполагаемого медианного общего воздействия в 546,3 миллиона долларов США в год на молочное население США [10].
Инфекция у крупного рогатого скота была впервые признана в 1988 году как причина абортов и бесплодия у крупного рогатого скота, а в настоящее время признана важной причиной репродуктивных проблем и абортов у крупного рогатого скота во всем мире [11]. Экономическое значение этой инфекции в животноводстве заключается в снижении продуктивности пораженных животных в плане потерь воспроизводства, снижения молочной продуктивности, преждевременного отъема телят и потери живой массы [12].
2.1. Передача и патогенез
Собака является как окончательным, так и промежуточным хозяином паразита [13]. В то время как собаки действуют как окончательные хозяева N. caninum и могут распространять инфекцию с фекалиями, их роль в горизонтальной передаче болезни обычно не считается такой важной, как вертикальная врожденная передача от матери к теленку на терминальных стадиях беременности. или постнатально через молоко [11, 14, 15]. Горизонтальной передачи от коровы к корове не происходит [16].Собаки могут выделять инфекционные ооцисты в течение переменного периода времени после заражения, и поскольку ооцисты очень устойчивы к суровым условиям окружающей среды, неясно, как долго они выживают в окружающей среде [17]. Промежуточные хозяева (крупный рогатый скот) заглатывают ооцисты, которые обнаруживаются в загрязненных пищевых продуктах и воде [18, 19]. Инфекция распространяется (в виде тахизоитов) на другие ткани коровы, например, на нервные клетки, макрофаги, фибробласты, эндотелиальные клетки сосудов, гепатоциты, а при беременности — на плаценту, где происходит повреждение плаценты или передача вертикально через плаценту к может возникнуть плод.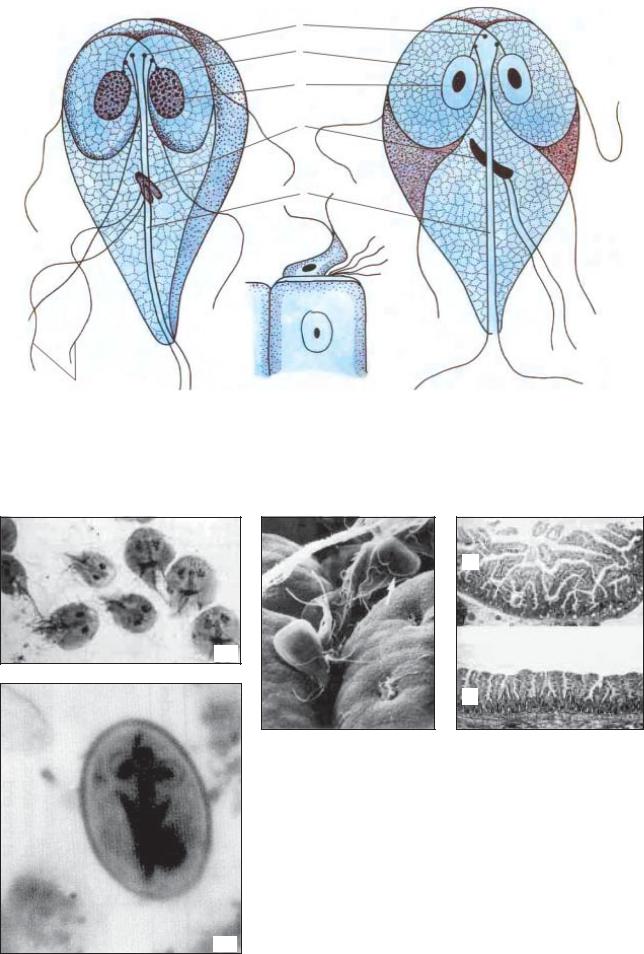 Аборт может быть результатом как первичного повреждения, так и иммуноопосредованной воспалительной реакции коровы [20]. В результате сформированного иммунного ответа тахизоиты могут трансформироваться в брадизоиты (медленно делящаяся «спящая» стадия или тканевая киста). Они остаются латентными до тех пор, пока иммунная система коровы не будет подавлена, после чего инфекция может рецидивировать [11]. Брадизоиты в тканевых цистах могут потребляться собаками и затем завершать жизненный цикл паразита.
Аборт может быть результатом как первичного повреждения, так и иммуноопосредованной воспалительной реакции коровы [20]. В результате сформированного иммунного ответа тахизоиты могут трансформироваться в брадизоиты (медленно делящаяся «спящая» стадия или тканевая киста). Они остаются латентными до тех пор, пока иммунная система коровы не будет подавлена, после чего инфекция может рецидивировать [11]. Брадизоиты в тканевых цистах могут потребляться собаками и затем завершать жизненный цикл паразита.
2.2. Клинические признаки
Инфекция, вызванная N.caninum встречается часто, но редко приводит к клиническому заболеванию [15]. Однако это может привести к аборту, который может произойти на любом сроке беременности, но чаще всего происходит между 3 и 9 месяцами беременности (особенно между 5 и 6 месяцами) с умеренным гниением (аутолизом) плода. Иммунологически компетентный плод может родиться живым, но врожденно инфицированным, хотя может иметь место мертворождение. Таким образом, плоды могут быть резорбированы, мумифицированы, аутолизированы, мертворожденными, родиться живыми с клиническими признаками или родиться клинически нормальными, но хронически инфицированными и могут проявлять нервные симптомы [21].Такие животные могут оставаться недоедающими, что приводит к повышенной смертности, гидроцефалии, экзофтальму, недостаточному весу и затруднению роста [22]. Врожденно инфицированные телки могут подвергаться риску аборта, особенно в первую беременность, и продолжать передавать инфекцию своему потомству, в то время как горизонтально инфицированные телки могут передавать или не передавать инфекцию своим потомкам [4].
Таким образом, плоды могут быть резорбированы, мумифицированы, аутолизированы, мертворожденными, родиться живыми с клиническими признаками или родиться клинически нормальными, но хронически инфицированными и могут проявлять нервные симптомы [21].Такие животные могут оставаться недоедающими, что приводит к повышенной смертности, гидроцефалии, экзофтальму, недостаточному весу и затруднению роста [22]. Врожденно инфицированные телки могут подвергаться риску аборта, особенно в первую беременность, и продолжать передавать инфекцию своему потомству, в то время как горизонтально инфицированные телки могут передавать или не передавать инфекцию своим потомкам [4].
2.3. Диагностика
Клинические признаки мало помогают в диагностике неоспороза. Диагноз может быть поставлен путем сочетания серологии, например, иммунофлуоресцентных тестов на антитела (IFAT) и твердофазного иммуноферментного анализа (ELISA), с иммуногистохимией и гистопатологией абортированного плода [23].Наиболее многообещающими образцами для диагностики неоспороза являются образцы из сердца, печени, плаценты и биологических жидкостей или сыворотки крови; исследование нескольких тканей дает более высокую скорость диагностики; мозг плода является наиболее последовательно пораженным органом и имеет наиболее характерное поражение.![]() Полимеразная цепная реакция (ПЦР) также является важным инструментом диагностики неоспороза, эффективность которого зависит от лаборатории, стадии аутолиза плода и процедур отбора проб [22, 23].
Полимеразная цепная реакция (ПЦР) также является важным инструментом диагностики неоспороза, эффективность которого зависит от лаборатории, стадии аутолиза плода и процедур отбора проб [22, 23].
2.4. Профилактика/контроль
В стадах, свободных от N. caninum , основной целью является предотвращение заноса инфекции с помощью стандартных мер биобезопасности [11], тогда как в N. caninum -инфицированных стадах программы контроля основаны на уменьшении вертикальной передачи в стаде за счет уменьшения количества серопозитивного крупного рогатого скота и/или снижения риска горизонтальной передачи N. caninum , главным образом путем контроля популяции окончательных хозяев как источника контаминации ооцистами [24, 25]. ].
2.5. Лечение
Безопасного и эффективного лечения неоспороза крупного рогатого скота не существует. Медикаментозная терапия обычно не рекомендуется, потому что она обычно является профилактической, включающей длительное введение, что может привести к неприемлемым остаткам молока и мяса и проблемам отмены [15, 26].
3. Саркоцистоз
Саркоцистоз – это заболевание птиц и млекопитающих, вызываемое несколькими видами одноклеточных кокцидийных простейших из группы Sarcocystis .Греческое слово sarco относится к плоти или мышцам, а саркоцист буквально относится к кисте в мышце. Sarcocystis представляет собой род кокцидийных простейших паразитов, который ассоциируется с наличием мышечных кист, обычно хорошо заметных, в поперечнополосатых мышцах промежуточного вида-хозяина [27]. Стадия мышечной кисты у промежуточного хозяина относительно доброкачественная. Однако ранние стадии развития в других тканях промежуточного хозяина могут оказаться фатальными.Виды Sarcocystis иногда вызывают аборты у крупного рогатого скота [28]. Сообщалось о трех видах мышц крупного рогатого скота; это Sarcocystis cruzi с псовыми в качестве окончательных хозяев, Sarcocystis hirsuta с кошачьими в качестве окончательных хозяев и Sarcocystis hominis с приматами в качестве окончательных хозяев [29, 30]. Аборты обычно спорадические, но могут происходить и в виде «штормов». Sarcocystis распространяется плотоядными животными (дикими и домашними), а крупный рогатый скот заражается при проглатывании кормов или кормов, загрязненных фекалиями плотоядных.Аборты происходят на любом сроке беременности. Инфекция, вызванная Sarcocystis , приводит к экономическим потерям в результате потери веса, анорексии, снижения производства молока, анемии и прострации, часто заканчивающихся смертью [31].
Аборты обычно спорадические, но могут происходить и в виде «штормов». Sarcocystis распространяется плотоядными животными (дикими и домашними), а крупный рогатый скот заражается при проглатывании кормов или кормов, загрязненных фекалиями плотоядных.Аборты происходят на любом сроке беременности. Инфекция, вызванная Sarcocystis , приводит к экономическим потерям в результате потери веса, анорексии, снижения производства молока, анемии и прострации, часто заканчивающихся смертью [31].
3.1. Передача и патогенез
Sarcocystis spp. обычно развиваются в циклах с двумя хозяевами, состоящими из промежуточного хозяина (жертвы) и окончательного хозяина (хищника). Были продемонстрированы видоспецифичные циклы жертва-хищник, например, пастушья собака ( S.cruzi ), крупного рогатого скота ( S. hirsuta ) и опоссум-пситтацин ( S. falcatula ) [26]. Окончательные хозяева, являющиеся плотоядными, заражаются при питании жертвами, ткани которых содержат инцистированные простейшие Sarcocystis , и впоследствии выделяют инфекционные спороцисты с фекалиями. Промежуточный хозяин проглатывает спороцисты, которые развиваются в саркоцисты в мышцах хозяина [32].
Промежуточный хозяин проглатывает спороцисты, которые развиваются в саркоцисты в мышцах хозяина [32].
3.2. Клинические признаки
Большинство животных, инфицированных Sarcocystis spp.протекают бессимптомно, и паразиты обнаруживаются в основном как случайная находка при вскрытии. Однако иногда сообщают о клинических случаях, особенно у промежуточного хозяина, но часто они зависят от количества проглоченных спороцист и вида Sarcocystis , заразившего инфекцию. Клинические признаки, зарегистрированные у сильно зараженного крупного рогатого скота, включают лихорадку, анорексию, истощение, снижение молочной продуктивности, диарею, мышечные спазмы, слабость, повышенную возбудимость, пневмонию, кровотечения, анемию, желтуху, прострацию и смерть.Эти признаки могут длиться от нескольких дней до нескольких недель. Когда беременные млекопитающие проглатывают спороцисты, у них может произойти аборт или родиться мертворожденный плод. Окончательные хозяева обычно не проявляют никаких клинических признаков саркоцистоза [33].
3.3. Диагностика
Диагноз обычно ставится посмертно путем исследования скелетных мышц. Кисты имеют цвет от желтовато-коричневого до белого, напоминают параллельные зерна риса, которые можно наблюдать по всей мышечной ткани молочной железы и других мышц, включая сердце.Пораженная ткань часто издает скрипучий звук при разрезании ножом. У некоторых видов кисты могут быть видны невооруженным глазом (утки, мыши, кролики и овцы), но у большинства видов требуется микроскопическое исследование, которое включает пептическое пищеварение, сдавливание мышц, методы выдавливания и непрямое флуоресцентное антитело. тест Предсмертный диагноз может быть поставлен с использованием теста кожной чувствительности или тестов связывания комплемента [34].
3.4. Профилактика/Контроль
Собаки и другие хищники не должны иметь доступа к сырому мясу, субпродуктам или мертвым животным, так как они могут содержать цисты саркоцистоза .Нельзя допускать собак и кошек в помещения, где содержатся корма для скота или животные [26, 33]. Сообщалось, что хорошая санитария важна для борьбы с этим заболеванием у домашних и содержащихся в неволе животных. Замораживание мяса перед приготовлением также может помочь убить микроорганизмы. Осужденные туши в результате саркоцистоза следует утилизировать путем глубокого захоронения, чтобы избежать их потребления животными-падальщиками.
Сообщалось, что хорошая санитария важна для борьбы с этим заболеванием у домашних и содержащихся в неволе животных. Замораживание мяса перед приготовлением также может помочь убить микроорганизмы. Осужденные туши в результате саркоцистоза следует утилизировать путем глубокого захоронения, чтобы избежать их потребления животными-падальщиками.
3.5. Лечение
Эффективного лечения крупного рогатого скота, инфицированного Sarcocystis spp., не существует.Тем не менее, антикокцидиальные препараты, такие как ампролиум и салиномицин, использовались для предотвращения тяжелых заболеваний и гибели экспериментально инфицированных телят [35, 36]. Кроме того, могут быть назначены противовоспалительные препараты или витамин Е, а также может потребоваться поддерживающая терапия [37].
4. Токсоплазмоз
Toxoplasma gondii – системный кокцидий, универсальный паразит, простейшее, представитель подотряда Eimeriina [30]. Это тканевое простейшее, заражающее человека и теплокровных животных. Он имеет три жизненные стадии, а именно, тахизоиты, брадизоиты и ооцисты, содержащие спорозоиты, и имеет зоонозное значение во всем мире [38, 39]. Первичная инфекция у беременных животных способна установить плацентарную и внутриутробную инфекцию, что может привести к гибели и рассасыванию плода, аборту или мертворождению [38]. Окончательным хозяином этого паразита является кошка, поэтому у нее не выработалась резистентность к паразиту [40]. У окончательного хозяина T. gondii организм проходит как половой, так и бесполый жизненные циклы.Другие млекопитающие и птицы являются промежуточными хозяевами, у которых T. gondii проходит только бесполый жизненный цикл [41]. Заражение этим паразитом связано с различными проблемами психического здоровья и головного мозга у людей, включая шизофрению, невроз и рак головного мозга [42].
Он имеет три жизненные стадии, а именно, тахизоиты, брадизоиты и ооцисты, содержащие спорозоиты, и имеет зоонозное значение во всем мире [38, 39]. Первичная инфекция у беременных животных способна установить плацентарную и внутриутробную инфекцию, что может привести к гибели и рассасыванию плода, аборту или мертворождению [38]. Окончательным хозяином этого паразита является кошка, поэтому у нее не выработалась резистентность к паразиту [40]. У окончательного хозяина T. gondii организм проходит как половой, так и бесполый жизненные циклы.Другие млекопитающие и птицы являются промежуточными хозяевами, у которых T. gondii проходит только бесполый жизненный цикл [41]. Заражение этим паразитом связано с различными проблемами психического здоровья и головного мозга у людей, включая шизофрению, невроз и рак головного мозга [42].
4.1. Передача и патогенез
Половой цикл начинается, когда восприимчивая кошка проглатывает ооцисты или тканевые цисты. В последнем случае брадизоиты эксцистируют из ткани, проникают в эпителиальные клетки тонкой кишки и диссеминируют в другие ткани, такие как поперечнополосатые мышцы и головной мозг, где инцистируются и становятся устойчивыми к атакам иммунной системы хозяина [41, 42]. Источником токсоплазмоза человека являются брадизоиты в тканях животных. В энтероэпителиальных клетках кошки ооцисты подвергаются гаметогонии, и гаметоциты высвобождаются в просвет кишечника и выходят с фекалиями. Спорообразование происходит во внешней среде в течение 1–5 дней, при этом каждая ооциста содержит 8 инфекционных спорозоитов. Через четыре дня после проглатывания тканевых цист кошка способна выделять с фекалиями миллионы ооцист, которые в зависимости от климатических условий могут сохраняться в окружающей среде в течение 12–18 месяцев и служат важным источником инфекции для пасущихся животных [43]. , 44].Ооцисты могут выделяться в меньшем количестве в течение нескольких дней или вообще не выделяться через 20 дней после того, как кошка проглотит ооцисты или тахизоиты [41].
Источником токсоплазмоза человека являются брадизоиты в тканях животных. В энтероэпителиальных клетках кошки ооцисты подвергаются гаметогонии, и гаметоциты высвобождаются в просвет кишечника и выходят с фекалиями. Спорообразование происходит во внешней среде в течение 1–5 дней, при этом каждая ооциста содержит 8 инфекционных спорозоитов. Через четыре дня после проглатывания тканевых цист кошка способна выделять с фекалиями миллионы ооцист, которые в зависимости от климатических условий могут сохраняться в окружающей среде в течение 12–18 месяцев и служат важным источником инфекции для пасущихся животных [43]. , 44].Ооцисты могут выделяться в меньшем количестве в течение нескольких дней или вообще не выделяться через 20 дней после того, как кошка проглотит ооцисты или тахизоиты [41].
4.2. Клинические признаки
Клинические признаки развиваются в результате воспаления в инфицированных тканях. Течение болезни сильно различается между видами животных и между возрастными группами, являясь в большей степени проблемой молодняка.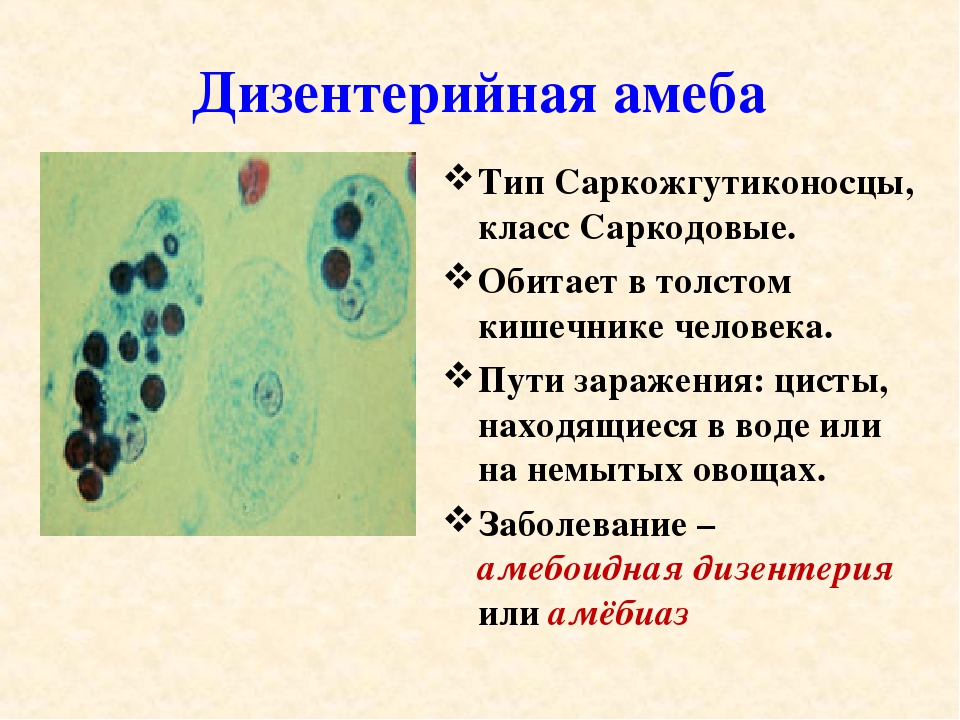 Если репликация организма ослаблена иммунным ответом, могут развиваться тканевые кисты, содержащие более медленно делящиеся брадизоиты.Позже брадизоиты могут реактивироваться в условиях иммуносупрессии, чтобы быстро делиться в виде тахизоитов, что может привести к клиническому заболеванию. Брадизоиты могут сохраняться в пораженных тканях в течение всей жизни хозяина. Заражение овец на ранних сроках беременности может привести к гибели и резорбции эмбриона из-за незрелости иммунной системы плода. Заражение в середине беременности может привести либо к гибели плода с последующей мумификацией, либо к задержке развития плода из-за нарушения питания плаценты и инфекции плода.Характерными поражениями на инфицированной плаценте являются белые пятна, видимые невооруженным глазом из-за участков некроза, что приводит к нарушению функции плаценты [45]. Инфицирование на поздних сроках беременности может привести к аборту только что павших ягнят или рождению слабых ягнят с высокой неонатальной смертностью [43].
Если репликация организма ослаблена иммунным ответом, могут развиваться тканевые кисты, содержащие более медленно делящиеся брадизоиты.Позже брадизоиты могут реактивироваться в условиях иммуносупрессии, чтобы быстро делиться в виде тахизоитов, что может привести к клиническому заболеванию. Брадизоиты могут сохраняться в пораженных тканях в течение всей жизни хозяина. Заражение овец на ранних сроках беременности может привести к гибели и резорбции эмбриона из-за незрелости иммунной системы плода. Заражение в середине беременности может привести либо к гибели плода с последующей мумификацией, либо к задержке развития плода из-за нарушения питания плаценты и инфекции плода.Характерными поражениями на инфицированной плаценте являются белые пятна, видимые невооруженным глазом из-за участков некроза, что приводит к нарушению функции плаценты [45]. Инфицирование на поздних сроках беременности может привести к аборту только что павших ягнят или рождению слабых ягнят с высокой неонатальной смертностью [43].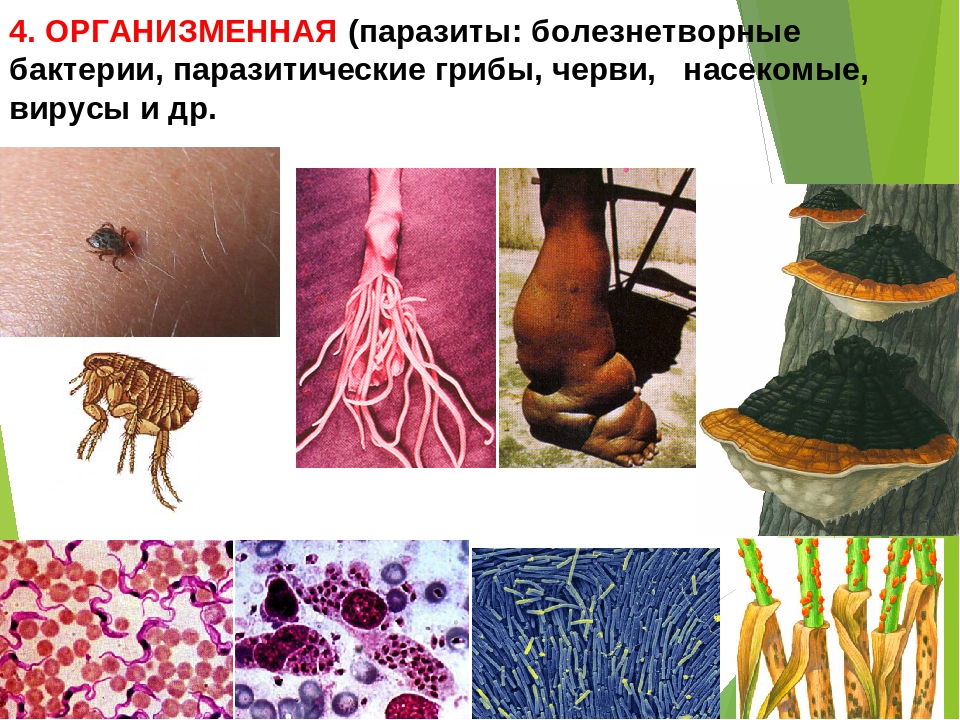
4.3. Профилактика/Контроль
Должны быть приняты меры по ограничению размножения кошек и недопущению их доступа к кормам для скота и пастбищам. Кокцидиостатический препарат декохинат можно скармливать беременным овцам в качестве вспомогательного средства для предотвращения абортов из-за токсоплазмоза.Несмотря на современные знания в области иммунологии, патологии и генетики, связанные с паразитом, безопасной вакцины для предотвращения инфекции как у людей, так и у животных не существует [46]. Однако для вакцинации овец использовалась живая аттенуированная вакцина, содержащая штаммы S48 (Toxovax). Вакцину следует вводить как минимум за три недели до спаривания. Одной дозы вакцины достаточно для защиты овец в течение 18 месяцев [47]. Т-263 штамм T. gondii, штамм ME-49 и облученные 60Co тахизоиты штамма Beverley T.gondii использовались для контроля выделения ооцист у кошек [48–50].
4.4. Лечение
Перед лицом шторма поздних абортов для снижения потерь можно использовать инъекционные или пероральные сульфаниламидные антибиотики, также сообщалось, что комбинация сульфаметазина и пириметамина дает хорошие результаты.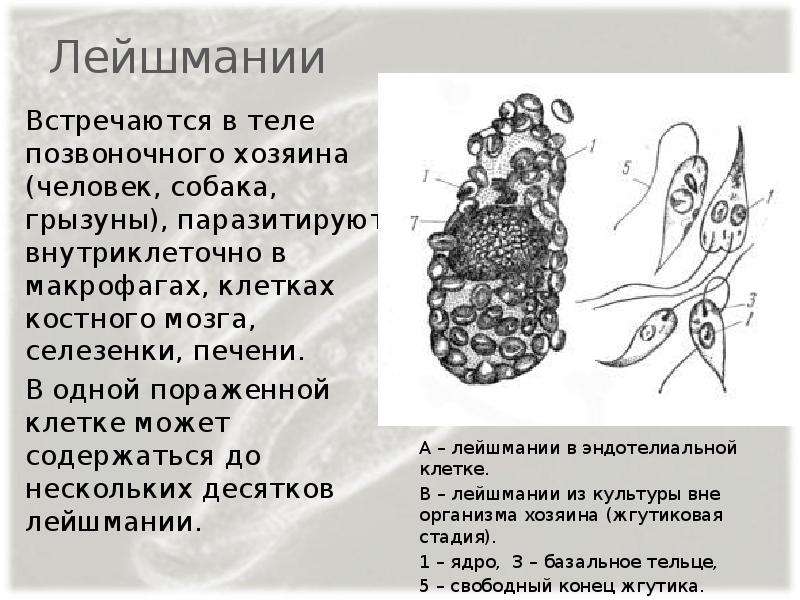
5. Трихомониаз
Трихомониаз – венерическая болезнь крупного рогатого скота, характеризующаяся прежде всего преждевременной потерей стельности и, иногда, абортом и пиометрой, приводящей к значительному бесплодию.Он распространен во всем мире и, как сообщается, является третьей по частоте причиной абортов у крупного рогатого скота (после бруцеллеза и лептоспироза) [51]. Возбудитель, Tritrichomonas fetus , представляет собой жгутиковый простейший паразит, передающийся от инфицированных бессимптомных быков телкам или коровам во время полового акта [52]. Сообщалось об инфекции у собак [53] и у кошек как о причине толстокишечной диареи [54, 55]. Кроме того, сообщалось, что Tritrichomonas suis является желудочно-кишечным комменсалом свиней [53].
5.1. Этиология и патогенез
Паразит имеет характерные три передних жгутика примерно такой же длины, как и тело паразита, и ундулирующую мембрану [4]. Молодые быки менее склонны к устойчивым носителям, чем быки старшего возраста, потому что крипты покровов полового члена и слизистой препуциальной оболочки менее развиты у молодых, чем у старых животных [26]. Паразит колонизирует матку, шейку матки и влагалище, но меньше выживает в вульве; он не препятствует оплодотворению, но вызывает раннюю гибель эмбриона, приводя к неравномерному длительному возвращению эструса [4].
Паразит колонизирует матку, шейку матки и влагалище, но меньше выживает в вульве; он не препятствует оплодотворению, но вызывает раннюю гибель эмбриона, приводя к неравномерному длительному возвращению эструса [4].
5.2. Клинические признаки
Ни корова, ни бык не проявляют себя больными в любое время, когда они заражены этим микроорганизмом [56]. Тем не менее, наблюдается заметная субфертильность, продолжительный возврат к эструсу и длительные интервалы отела. Отмечается наличие пиометры и абортов на ранних сроках беременности (1–6 нед). В ряде случаев, несмотря на инфекцию, беременность не прерывается абортом и рождается нормальный доношенный теленок [55]. У инфицированных коров или телок могут быть выделения из матки в течение нескольких месяцев [26].Абортированный плод обычно свежий и паразиты быстро исчезают из вагинальных выделений после аборта (обычно в течение 7 дней) [4].
5.3. Диагноз
Диагноз подтверждается выявлением T. fetus микроорганизмов из образцов, полученных из половых путей самок крупного рогатого скота, препуциального материала быков или абортированных плодов и тканей плаценты [57].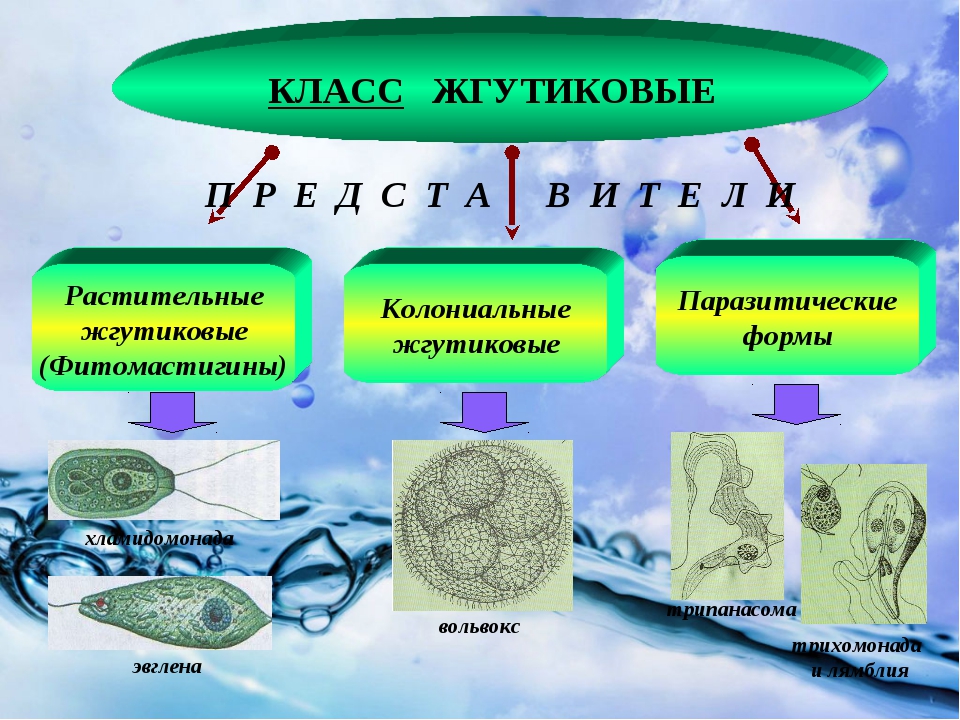 Другие диагностические процедуры включают культуру организма, полимеразную цепную реакцию (ПЦР) и иммунологические тесты [58–60].
Другие диагностические процедуры включают культуру организма, полимеразную цепную реакцию (ПЦР) и иммунологические тесты [58–60].
5.4. Профилактика/Контроль
Трихомониаз является «самоизлечивающимся» заболеванием у нестельных коров с инволюцией матки. После полового отдыха в течение 3 или 5 циклов у многих коров вырабатывается некоторый иммунитет, и их плодовитость улучшается. Однако после заражения самцы становятся постоянными носителями возбудителя; поэтому для разведения следует использовать только чистых быков или сперму, а коров с аномальными половыми путями следует выбраковывать [52]. Быки-носители могут повторно заразить пролеченных, выздоровевших и восприимчивых самок, поэтому их следует выбраковывать.
5.5. Лечение
Не существует утвержденного химиотерапевтического средства для лечения трихомониаза крупного рогатого скота [60].
Наиболее серьезным фактором, препятствующим эффективному животноводству и прибыльности стада, является невынашивание беременности, возможной причиной которого могут быть паразитарные инфекции. Однако эти инфекции часто плохо учитываются при постановке диагноза. Это может привести к неточной диагностике причины бесплодия. Однако максимизация репродуктивной эффективности является главной целью управления производством и не может быть поставлена под угрозу для успеха и финансовой прибыльности предприятий.Поэтому при таких исследованиях следует иметь в виду паразитарные инфекции.
Однако эти инфекции часто плохо учитываются при постановке диагноза. Это может привести к неточной диагностике причины бесплодия. Однако максимизация репродуктивной эффективности является главной целью управления производством и не может быть поставлена под угрозу для успеха и финансовой прибыльности предприятий.Поэтому при таких исследованиях следует иметь в виду паразитарные инфекции.
Анализ паразитических простейших на уровне одной клетки с использованием микрожидкостной импедансной цитометрии
Диэлектрические свойства
Простейшая электрическая модель, описывающая свойства клетки, — это так называемая модель с одной оболочкой, как показано на рис. 2(a). . Как правило, биологические клетки являются изолирующими на низких частотах (кГц) из-за наличия липидной клеточной мембраны, но становятся все более проводящими на более высоких частотах (МГц) из-за емкостной связи через мембрану 25, 34, 40 .Таким образом, для жизнеспособной клетки импеданс на низких частотах (<1 МГц) измеряет объем клетки, а на средних частотах (0,5–10 МГц) измеряет емкость мембраны, которая отражает инвагинацию и свертка мембраны. На более высоких частотах электрическое поле емкостно связано с мембраной, а сигнал импеданса отражает свойства цитоплазмы и любого ядра, которое может присутствовать. На рисунке 2(b) показан конкретный случай ооцисты, содержащей четыре спорозоита, содержащих ядра, и различные органеллы.По аналогии с типичной клеткой на низких частотах можно измерить только объем интактных ооцист. В режиме МГц импеданс ооцисты сначала становится функцией емкости внешней стенки (обычно на частотах 1–10 МГц), прежде чем проводимость внутренней части сильно повлияет на отклик на высоких частотах (> 10 МГц) 27 . Следовательно, в промежуточном диапазоне частот жизнеспособные ооцисты эквивалентного размера могут демонстрировать различия в своем импедансе из-за различий в составе и/или структуре внешней и внутренней стенки.По мере дальнейшего увеличения частоты сигнала, т. е. ., >30 МГц, на импеданс дополнительно влияют спорозоиты и ядра 27 .
На более высоких частотах электрическое поле емкостно связано с мембраной, а сигнал импеданса отражает свойства цитоплазмы и любого ядра, которое может присутствовать. На рисунке 2(b) показан конкретный случай ооцисты, содержащей четыре спорозоита, содержащих ядра, и различные органеллы.По аналогии с типичной клеткой на низких частотах можно измерить только объем интактных ооцист. В режиме МГц импеданс ооцисты сначала становится функцией емкости внешней стенки (обычно на частотах 1–10 МГц), прежде чем проводимость внутренней части сильно повлияет на отклик на высоких частотах (> 10 МГц) 27 . Следовательно, в промежуточном диапазоне частот жизнеспособные ооцисты эквивалентного размера могут демонстрировать различия в своем импедансе из-за различий в составе и/или структуре внешней и внутренней стенки.По мере дальнейшего увеличения частоты сигнала, т. е. ., >30 МГц, на импеданс дополнительно влияют спорозоиты и ядра 27 .
Иллюстрация частотно-зависимого диэлектрического отклика однослойной частицы или ооцисты C. parvum . ( a ) Упрощенная модель с одной оболочкой часто используется для аппроксимации диэлектрических свойств клеток/частиц. Клетка/частица, окруженная оболочкой (мембраной), испытывает однократную диэлектрическую дисперсию в диапазоне частот 1–10 МГц (называемую β-релаксацией).( b ) Для более сложных биологических структур, таких как ооциста C. parvum , упрощенная модель с одной оболочкой не может точно рассчитать диэлектрические свойства компонентов ооцисты. Например, ооцисты C. parvum , вероятно, испытывают множественные релаксации из-за поляризации последовательных оболочек по мере увеличения частоты. Отметим, что частотное окно для этих релаксаций зависит от проводимости взвешенной среды.
parvum . ( a ) Упрощенная модель с одной оболочкой часто используется для аппроксимации диэлектрических свойств клеток/частиц. Клетка/частица, окруженная оболочкой (мембраной), испытывает однократную диэлектрическую дисперсию в диапазоне частот 1–10 МГц (называемую β-релаксацией).( b ) Для более сложных биологических структур, таких как ооциста C. parvum , упрощенная модель с одной оболочкой не может точно рассчитать диэлектрические свойства компонентов ооцисты. Например, ооцисты C. parvum , вероятно, испытывают множественные релаксации из-за поляризации последовательных оболочек по мере увеличения частоты. Отметим, что частотное окно для этих релаксаций зависит от проводимости взвешенной среды.
Разрушение избирательно проницаемой мембраны биологической клетки обычно измеряют с помощью красителя жизнеспособности, такого как йодистый пропидий (PI).При попадании в клетки с нарушенными мембранами PI связывается с ДНК, интеркалируя между основаниями, что значительно увеличивает флуоресценцию. Если скомпрометированная клеточная мембрана проницаема для PI, ионы смогут свободно проходить через нее (, т.е. , клетка электрически негерметична, рис. 3), что проявляется в изменении низкочастотного импеданса 34 . Следовательно, нежизнеспособные клетки могут казаться меньше в электрическом, но не в оптическом объеме. Нежизнеспособные клетки становятся неспособными регулировать перенос ионов и поддерживать осмотическое давление так же эффективно, как жизнеспособные клетки 34, 41 , как, например, в случае C.parvum , схематически показана на рис. 3а. Способствующим фактором способности жизнеспособных ооцист сохраняться в окружающей среде в течение длительного времени является их строгая регуляция переноса ионов. После инактивации ооцисты больше не регулируют перенос ионов так же эффективно, как жизнеспособные ооцисты. Таким образом, внутренний состав инактивированной ооцисты может быть нарушен. Например, микроскопические изображения необработанных (рис.
Если скомпрометированная клеточная мембрана проницаема для PI, ионы смогут свободно проходить через нее (, т.е. , клетка электрически негерметична, рис. 3), что проявляется в изменении низкочастотного импеданса 34 . Следовательно, нежизнеспособные клетки могут казаться меньше в электрическом, но не в оптическом объеме. Нежизнеспособные клетки становятся неспособными регулировать перенос ионов и поддерживать осмотическое давление так же эффективно, как жизнеспособные клетки 34, 41 , как, например, в случае C.parvum , схематически показана на рис. 3а. Способствующим фактором способности жизнеспособных ооцист сохраняться в окружающей среде в течение длительного времени является их строгая регуляция переноса ионов. После инактивации ооцисты больше не регулируют перенос ионов так же эффективно, как жизнеспособные ооцисты. Таким образом, внутренний состав инактивированной ооцисты может быть нарушен. Например, микроскопические изображения необработанных (рис. 3b) и инактивированных нагреванием (рис. 3c) C. parvum показывают, что внутренние компоненты в ооцистах, инактивированных нагреванием, выглядят менее гранулированными, что может указывать на изменение их внутреннего состава. .Следовательно, суспендируя ооцисты в неизоосмотических условиях, можно вызвать изменение ионного состава ооцисты и, следовательно, изменить ее промежуточный и/или высокочастотный импеданс.
3b) и инактивированных нагреванием (рис. 3c) C. parvum показывают, что внутренние компоненты в ооцистах, инактивированных нагреванием, выглядят менее гранулированными, что может указывать на изменение их внутреннего состава. .Следовательно, суспендируя ооцисты в неизоосмотических условиях, можно вызвать изменение ионного состава ооцисты и, следовательно, изменить ее промежуточный и/или высокочастотный импеданс.
Диаграмма, показывающая структуру как необработанных (живых), так и термоинактивированных (нежизнеспособных) ооцист C. parvum . ( a ) Схема, показывающая гипотетический эффект тепловой инактивации на ооцисты, взвешенные в PBS. Ооциста C. parvum обычно состоит из трехслойной внешней стенки, которая содержит четыре голых спорозоита и окруженное мембраной остаточное тело.При инактивации на направление переноса ионов влияет проводимость/осмоляльность буфера. ( b ) Микроскопические изображения необработанных и ( c ) термоинактивированных ооцист (в PBS), полученные с помощью масляной иммерсии (100x) ДИК-микроскопии.
Анализ импеданса паразитов
На рисунке 4 показаны экспериментальные данные импеданса для четырех различных необработанных популяций C. parvum , суспендированных в 0,5 × PBS (σ м = 0,76 См м −1 ), при3 МГц. Была выбрана высокая эталонная частота, чтобы можно было исследовать внутренние свойства ооцист 31, 34 . Величина импеданса (| Z | ) нанесена по оси x , а фаза импеданса (ΦZ) по оси y , где каждая точка данных представляет собой одну ооцисту, а ее цвет отражает плотность данных. Рисунок 45x PBS проводимости σ м = 0,76 См м -1 . Каждая точка данных представляет собой одну ооцисту, а цвет представляет плотность данных. Первые 3000 обнаруженных событий нанесены на график в каждом подмножестве рисунка, а популяции ооцист и раковин аннотированы в соответствии с анализом, описанным в разделе моделирования. ( a ) Ооцисты телят (штамм Айова), измеренные в течение 1 месяца после размножения ооцист. ( b ) Ооцисты, размножаемые мышами (штамм Айова), используемые в течение 1–2 месяцев. (c) Различные образцы ооцист телят (штамм Айова), использованные в течение 1–2 месяцев.( d ) C. parvum (штамм Моредун) от телят, измерено в течение 2–3 месяцев.
( b ) Ооцисты, размножаемые мышами (штамм Айова), используемые в течение 1–2 месяцев. (c) Различные образцы ооцист телят (штамм Айова), использованные в течение 1–2 месяцев.( d ) C. parvum (штамм Моредун) от телят, измерено в течение 2–3 месяцев.
При старении в окружающей среде, например, ., воздействии естественного стресса, такого как ультрафиолетовое излучение и колебания температуры, или, альтернативно, при транспортировке и обработке образцов при использовании в лабораторных условиях некоторые ооцисты могут разрушаться, деформироваться или даже эксцистироваться 42 . В этих случаях инфекционные спорозоиты могут быть потеряны, и, следовательно, ооцисты становятся «пустыми оболочками» или «призраками».Пустые скорлупы обычно обнаруживаются в пробах питьевой воды из окружающей среды 43 , и данные импеданса на рис. 4 показывают наличие таких поврежденных/эксцистированных ооцист. Как показано в следующем разделе, оболочки появляются в виде отдельного кластера ниже основной популяции ооцист и имеют меньшую величину импеданса (поскольку они электрически негерметичны) и фазу в среднем. Подграфики на рис. 4a–d расположены в порядке возрастания возраста. Интересно, что самый молодой (а) и самый старый (d) образцов C. parvum имеют наименьшее и наибольшее количество раковин соответственно (% раковин в a = 6, b = 6, c = 8 и d = 41), что означает, что количество раковин увеличивается с возрастом окружающей среды.
Подграфики на рис. 4a–d расположены в порядке возрастания возраста. Интересно, что самый молодой (а) и самый старый (d) образцов C. parvum имеют наименьшее и наибольшее количество раковин соответственно (% раковин в a = 6, b = 6, c = 8 и d = 41), что означает, что количество раковин увеличивается с возрастом окружающей среды.
Моделирование импеданса
Как правило, диэлектрическое поведение биологических клеток в суспензии определяется теорией смесей Максвелла (MMT) 44 , которая описывает связь между комплексным импедансом суспензии, свойствами клеток, суспендирующей средой и объемная доля 45 . Оболочечные модели, основанные на ММТ, использовались для моделирования диэлектрических свойств ячеек 45,46,47 . Модели с одиночной оболочкой описывают клетки только с мембраной и без внутренней части (см.2), а модели двойной оболочки применяются для более сложных клеток с внутренними органеллами. Зависимое от частоты поведение этих моделей может быть представлено в терминах релаксации Дебая 48 . Одиночные оболочки имеют одну релаксацию, а двойные оболочки имеют две (первая связана с клеточной мембраной, а вторая с внутренними органеллами, рис. 2б) 27, 45 . Таким образом, целостность и сложность клетки можно вывести, подгоняя данные к этим моделям.
Одиночные оболочки имеют одну релаксацию, а двойные оболочки имеют две (первая связана с клеточной мембраной, а вторая с внутренними органеллами, рис. 2б) 27, 45 . Таким образом, целостность и сложность клетки можно вывести, подгоняя данные к этим моделям.
Частотно-зависимый импеданс для средней совокупности необработанных и термоинактивированных C.parvum ооцист измеряли в диапазоне от 250 кГц до 50 МГц с проводимостью буфера σ м = 0,76 См м -1 — см. рис. 5. Каждая точка данных представляет собой среднее значение 1000 ооцист на частоту зонда. Рисунок 5 1 . Среднее значение действительной (\(\Re \)(Z)) и мнимой (\(\Im \)(Z)) частей импеданса для оболочек (( a ) и ( b )) и ооцист (( c ) и ( d )), соответственно, нанесены (звездочки).Затем два набора данных были смоделированы с использованием одиночной подгонки оболочки (SSF) для оболочек (( a ) и ( b )) и двойной подгонки оболочки (DSF) для ооцист ( (c), и ( г) ) и нанесены поверх данных (сплошные линии).
Данные импеданса для пустых оболочек в необработанных и инактивированных нагреванием суспензиях C. parvum были смоделированы путем подгонки данных к одной релаксации Дебая, представляющей одиночную подгонку оболочки (SSF) — рис.5а,б. Как и ожидалось, простая структура оболочки ооцисты, в которой отсутствуют спорозоиты или другие органеллы, хорошо подходит для однократной релаксации. Кроме того, термоинактивация суспензии приводит к физическому разрушению мембраны, что приводит к явному снижению величины низкочастотного импеданса (рис. 5а). Основная популяция ооцист не может быть приспособлена к одной модели оболочки (см. Дополнительный рисунок S2), что означает, что эта модель не полностью отражает тонкости структуры ооцисты.Однако модель с двойной оболочкой обеспечивает хорошее соответствие, как показано на рис. 5c, d, , т.е. . Она правильно представляет релаксацию мембраны ооцисты (~ 1–10 МГц), за которой следует релаксация внутреннего содержимого (> 10 МГц). Кроме того, как видно для оболочек, тепловая инактивация и последующее разрушение внешней стенки вызывают небольшое падение импеданса на низких частотах (рис. 5c). Таким образом, простая модель подтверждает, что две популяции (рис. 4) правильно идентифицированы и что раковины C. parvum могут быть исключены из будущего анализа ооцист.
Кроме того, как видно для оболочек, тепловая инактивация и последующее разрушение внешней стенки вызывают небольшое падение импеданса на низких частотах (рис. 5c). Таким образом, простая модель подтверждает, что две популяции (рис. 4) правильно идентифицированы и что раковины C. parvum могут быть исключены из будущего анализа ооцист.
Оптимальная проводимость суспензии
Показан средний импеданс всех необработанных и термоинактивированных популяций C. parvum , взвешенных в буфере с проводимостью (σ м = 1,51 См м −1 ). б. С увеличением проводимости буфера частота релаксации внешней стенки, как и ожидалось, смещается в сторону более высоких частот. На рисунке 6 также показано, что диэлектрические свойства необработанного и термоинактивированного C. parvum различаются, особенно на более высоких частотах (см.6в,д), где на сигнал влияют свойства внутренней части ооцисты. Как правило, внутренняя часть ооцисты C. parvum состоит из четырех (содержащих ядра) спорозоитов – инфекционных агентов ооцисты – и окруженного мембраной остаточного тела.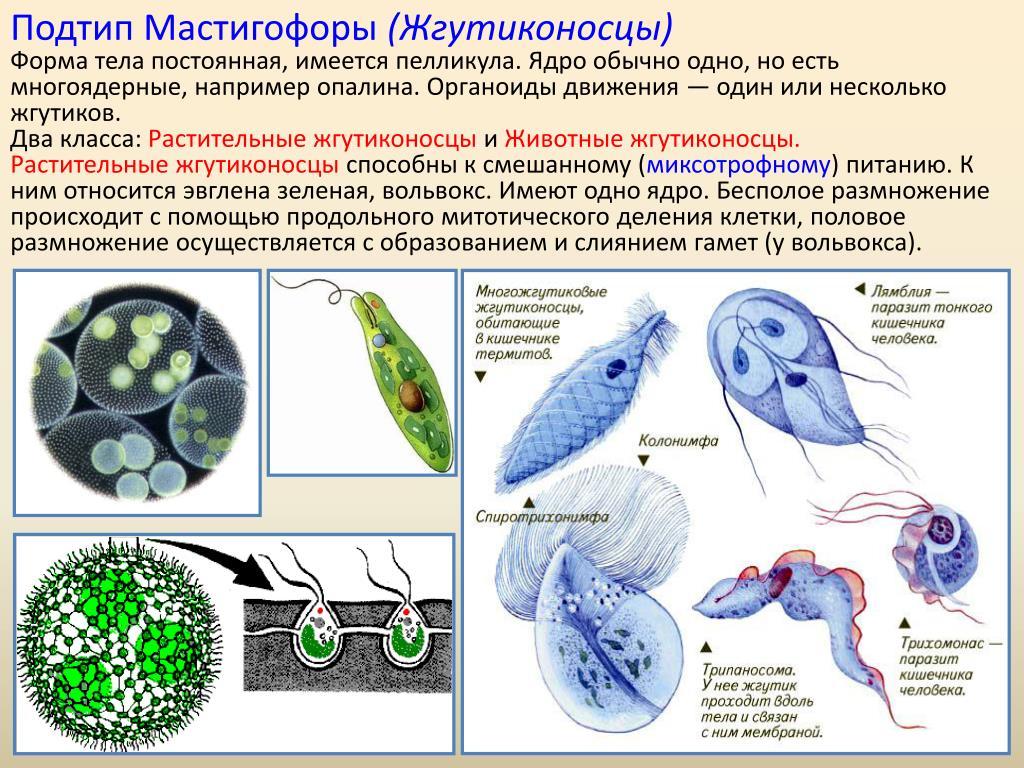 Остаточное тело содержит большое липидное тело, многочисленные гранулы амилопектина, кристаллическое белковое включение, рибосомы и цитомембраны 4 . Для инактивированного нагреванием C. parvum целостность и/или состав внутренней жидкости и внутренних органелл предположительно были нарушены, а разница осмоляльности между внутренней частью ооцисты и суспендирующей средой была больше в 1xPBS, чем в 0.5x буфер PBS (σ м = 0,76 S m −1 ) – см. рис. 5c, d. Таким образом, разница в высокочастотном импедансе популяций паразитов была больше у повторно суспендированных в PBS (рис. 6). Эти данные свидетельствуют о том, что паразиты подвергались воздействию гиперосмотических условий при взвешивании в PBS. Данные на рис. 6a,b также указывают на отсутствие различий ни в величине, ни в фазе, независимо от штамма или источника ооцист C. parvum .
Остаточное тело содержит большое липидное тело, многочисленные гранулы амилопектина, кристаллическое белковое включение, рибосомы и цитомембраны 4 . Для инактивированного нагреванием C. parvum целостность и/или состав внутренней жидкости и внутренних органелл предположительно были нарушены, а разница осмоляльности между внутренней частью ооцисты и суспендирующей средой была больше в 1xPBS, чем в 0.5x буфер PBS (σ м = 0,76 S m −1 ) – см. рис. 5c, d. Таким образом, разница в высокочастотном импедансе популяций паразитов была больше у повторно суспендированных в PBS (рис. 6). Эти данные свидетельствуют о том, что паразиты подвергались воздействию гиперосмотических условий при взвешивании в PBS. Данные на рис. 6a,b также указывают на отсутствие различий ни в величине, ни в фазе, независимо от штамма или источника ооцист C. parvum .
Полное сопротивление C.парвум в PBS.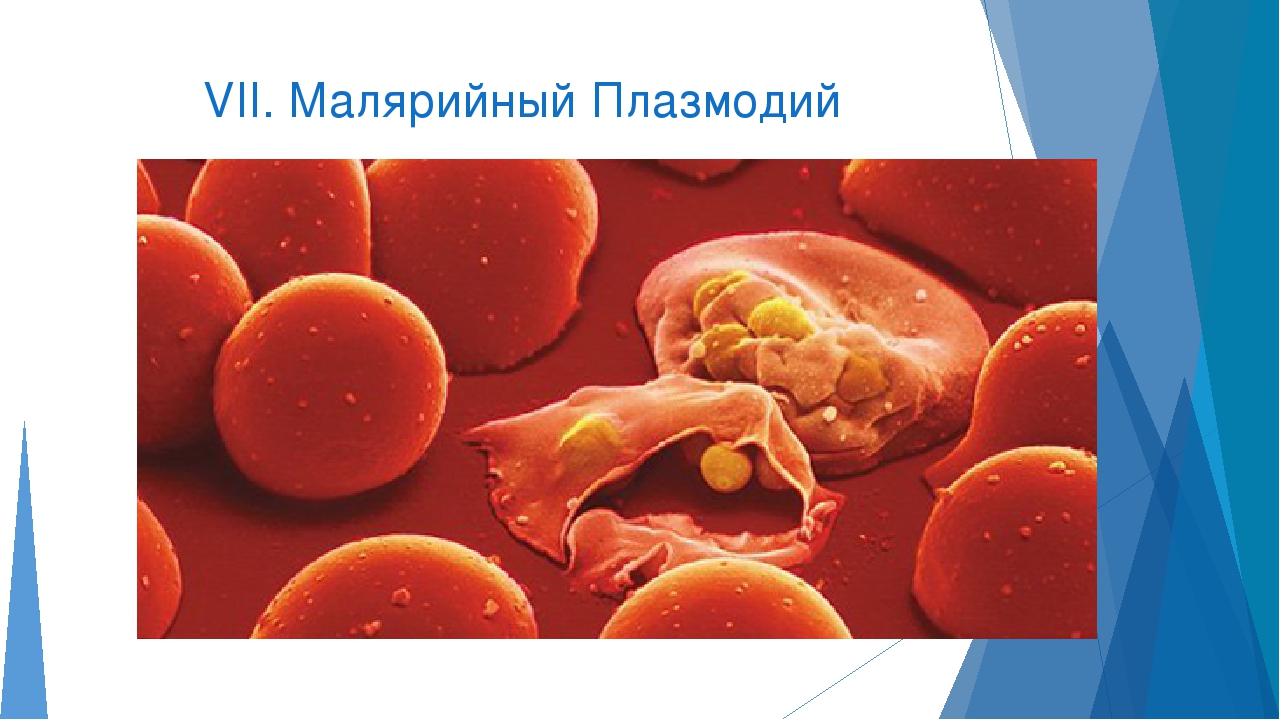 ( a ) Величина импеданса и ( b ) фаза необработанного (красный) и термоинактивированного (синий) C. parvum в зависимости от частоты; данные представляют собой среднее ± значение стандартного отклонения для всех четырех образцов C. parvum . Низкочастотный, промежуточный и высокочастотный импеданс необработанного и термоинактивированного C. parvum нанесены на график вместе при ( c ) 250 кГц, ( d ) 2,5 МГц и (e) 25 МГц. Аннотированные эллипсы достоверности содержат 50% каждой совокупности, а цвет каждой точки данных представляет нормализованную близость каждого события к соответствующему среднему значению совокупности.Необработанные и термоинактивированные суспензии, содержащие ооцисты из всех четырех исходных образцов, измеряли отдельно.
( a ) Величина импеданса и ( b ) фаза необработанного (красный) и термоинактивированного (синий) C. parvum в зависимости от частоты; данные представляют собой среднее ± значение стандартного отклонения для всех четырех образцов C. parvum . Низкочастотный, промежуточный и высокочастотный импеданс необработанного и термоинактивированного C. parvum нанесены на график вместе при ( c ) 250 кГц, ( d ) 2,5 МГц и (e) 25 МГц. Аннотированные эллипсы достоверности содержат 50% каждой совокупности, а цвет каждой точки данных представляет нормализованную близость каждого события к соответствующему среднему значению совокупности.Необработанные и термоинактивированные суспензии, содержащие ооцисты из всех четырех исходных образцов, измеряли отдельно.
Суспензия популяций ооцист в гиперосмотическом буфере с высокой электропроводностью (5x PBS; σ м = 7,10 См м −1 ) вызывала наибольшую разницу в импедансе необработанных и инактивированных нагреванием C. parvum . На рисунке 7 показан низкочастотный, промежуточный и высокочастотный импеданс C. parvum в 5x PBS.Высокочастотный импеданс позволяет четко различать популяции паразитов, и эта разница усиливается за счет увеличения проводимости взвешенной среды. Зеленая линия указывает линию равновероятностного отклонения между популяциями (, т.е. , где обнаруженное событие имеет равные шансы принадлежать к любой популяции) и является оценкой достоверности различия между необработанными и инактивированными нагреванием C. парвум . Например, на частоте 50 МГц, где была достигнута самая четкая дискриминация (рис.7c), 91% событий справа от границы равной вероятности были от необработанной популяции C. parvum , а 92% событий слева были от инактивированной нагреванием популяции C. parvum . Таким образом, МИК позволила идентифицировать необработанный или термоинактивированный C. parvum с достоверностью более 90% в этих экспериментальных условиях. Данные, содержащиеся в таблице S2, показывают достоверность идентификации, достигнутую для каждого отдельного образца, и демонстрируют, что возраст образца и/или жизнеспособность образца отрицательно влияют на уровень дискриминации.
Рисунок 7График рассеяния импеданса для C. parvum в 5x PBS. Данные импеданса на низких, промежуточных и высоких частотах для необработанного и термоинактивированного C. parvum нанесены на график вместе при ( a ) 500 кГц, ( b ) 5 МГц и ( c ) 50 МГц. Аннотированные эллипсы достоверности содержат ~ 50% необработанных или инактивированных нагреванием популяций (1000 событий для каждой популяции). Зеленая линия указывает на границу равной вероятности между двумя популяциями.Цвет каждой точки данных представляет нормализованную близость события к соответствующему среднему значению генеральной совокупности.
Анализ видов
Сопротивление патогенов, которые обычно выделяют с помощью EPA 1623.1, измеряли для оценки пригодности MIC для различения передающихся через воду паразитов на уровне видов и родов. В частности, образцы, содержащие C. parvum (CP), C. muris (CM) и G. lamblia (GL), взвешенные в PBS (σ m = 1.61 См м -1 ). Чтобы правильно ввести и охарактеризовать импеданс каждой популяции, образцы сначала измерялись независимо — дополнительный рисунок S3. Кубический корень из величины низкочастотного импеданса пропорционален диаметру частиц 28, 34 . Используя эти данные, средний диаметр паразитов был определен как CP = 4,3 ± 0,3 мкм, CM = 5,9 ± 0,4 мкм и GL = 9,3 ± 0,4 мкм, что хорошо коррелирует с размерами, полученными с помощью оптической визуализации 49, 50
Разницу в импедансе между популяциями можно визуализировать несколькими способами, но наиболее четкое различие получается из графика рассеяния высокочастотной фазы (на 18,3 МГц) по сравнению с величиной низкочастотного импеданса (на 250 кГц), как показано на рис. 8. Эти данные эффективно отображают изменения внутренней структуры/состава в зависимости от размера . На рисунке показаны данные для 1000 событий, полученные путем измерения выборки, содержащей все различные популяции.Используя те же ворота, что и на рисунках 5 и 6, можно было идентифицировать CP с достоверностью 98 %, CM с достоверностью 93 % и GL с достоверностью более 99 %. Эти результаты показывают, что анализ импеданса позволяет различать эти патогены с высокой степенью достоверности, особенно по сравнению с обычной проточной цитометрией (рис. 8b).
Рисунок 8Импеданс против оптического обнаружения паразитов. ( a ) Диаграмма рассеяния фазы на частоте 18,3 МГц по сравнению с величиной импеданса на частоте 250 кГц для всех видов паразитов, измеренных вместе в смешанной выборке.Аннотированные эллипсы достоверности содержат ~ 50% каждой совокупности. Зеленые линии указывают границы, определяющие равновероятностное отклонение между соседними популяциями. Цвет каждой точки данных представляет нормализованную близость события к соответствующему среднему значению генеральной совокупности. ( b ) Данные обычной проточной цитометрии (SSC против FSC) для всех видов паразитов в PBS. Индивидуальные данные оптического рассеяния для каждой популяции нанесены вместе. В общей сложности 1000 событий нанесены как на ( a ), так и на ( b ).
По оценкам, два вида C. parvum и C. hominis ответственны за более чем 90% случаев криптоспоридиоза у людей 51 . Однако другие виды ( C. meleagridis , C. canis, C. cuniculus и C. felis ) также связаны с инфицированием человека и считаются «основными патогенными для человека видами» 49, 52 . С точки зрения размеров ооцист все эти «основные» виды демонстрируют сходство и обычно описываются как эллиптические ооцисты в диапазоне размеров 4.0–5,0 × 5,0–5,5 мкм 49 . Наши результаты показывают, что MIC может быть в состоянии отличить ооцисты такого размера с высокой степенью достоверности от других видов Cryptosporidium , которые не находятся в этом диапазоне размеров и которые представляют небольшой риск для здоровья человека или вообще не представляют его (как мы выяснили). продемонстрировано с C. parvum и C. muris ). К таким видам относятся (но не ограничиваются ими) более крупные C. andersoni , C. baileyi и C. muris , а также более мелкие C.сяой и C. ryanae 49 , которые были выявлены среди видов с низким уровнем риска, загрязняющих питьевую воду в Великобритании в течение одного года 53 . Однако необходим анализ отдельных видов, имеющих сходные размеры, чтобы оценить, могут ли межвидовые вариации стенки ооцисты и внутренней структуры/состава способствовать различению таких ооцист на основе импеданса.
Роль внеклеточных везикул в Plasmodium и других простейших паразитах — Mantel — 2014 — Клеточная микробиология
Введение
Прямые и косвенные клеточные взаимодействия происходят на многих уровнях как в одноклеточных, так и в многоклеточных системах.До недавнего времени предполагалось, что непрямые клеточные взаимодействия облегчаются секрецией и переносом растворимых факторов. Первоначально считавшиеся клеточным мусором, внеклеточные везикулы мембранного происхождения (EVs) стали ключевыми игроками для горизонтальной передачи информации между клетками без прямого клеточного контакта. ЭВ представляют собой небольшие везикулы, состоящие из двойного липидного слоя, размером от 0,1 до 1 мкм. Они содержат цитозоль и имеют внеклеточный листок плазматической мембраны на внешней поверхности.Многие типы клеток млекопитающих секретируют везикулы в состоянии покоя или при активации (rev. Thery et al. ., 2002a; Raposo and Stoorvogel, 2013). ЭВ экспрессируют специфические для типа клеток белки, липиды, информационную РНК и микроРНК, которые важны для их функции. Что еще более удивительно, эти молекулы функциональны и могут передавать сигналы в клетки-реципиенты. Например, EV из тучных клеток содержат мРНК, которые могут быть транскрибированы в белки в клетке-реципиенте (Valadi et al. ., 2007).Из большинства исследований следует, что содержание груза в электромобилях варьируется в зависимости от исходной клетки, что свидетельствует об избирательном механизме загрузки.
Различные типы везикул можно идентифицировать на основе их размеров, биогенеза и клеточного происхождения. Обычно ВВ подразделяют на экзосомы, микровезикулы (МВ) и апоптотические тельца. Экзосомы и МВ представляют собой небольшие везикулы размером менее 1 мкм, тогда как апоптотические тельца крупнее 1 мкм и менее структурированы (Raposo and Stoorvogel, 2013).Апоптотические тельца высвобождаются во время запрограммированной гибели клеток (Hristov et al ., 2004), и они несут на себе целые органеллы (Taylor et al ., 2008). Кроме того, некоторые раковые клетки выделяют онкосомы, которые представляют собой везикулы большего размера, чем обычные МВ (Di Vizio et al. ., 2009; Morello et al. ., 2013). ЭВ образуются либо на плазматической мембране, либо в просвете различных субклеточных органелл. Хотя их биогенез и функции могут различаться, не всегда возможно полностью отличить экзосомы от МВ.Следовательно, во многих исследованиях анализируемые ВВ могут состоять из смеси экзосом и ВВ. ЭВ участвуют в регуляции многих процессов в физиологических условиях, таких как иммунный надзор и восстановление тканей. Однако они также связаны с образованием и прогрессированием опухолей, а также с патологией и распространением вирусных заболеваний, таких как ВИЧ и вирус Эпштейна-Барра (EBV).
Появляется все больше данных о высвобождении конкретных популяций ЭВ в контексте некоторых основных паразитарных патогенов человека, в том числе вызывающих малярию, лейшманиоз и болезнь Шагаса.Все эти заболевания передаются членистоногими переносчиками, и паразиты претерпевают множественные трансформации в жизненном цикле, циклически меняясь между бесполым и половым размножением. Такие сложные стратегии жизненного цикла требуют быстрой адаптации к изменяющейся среде, и паразиты разработали различные стратегии, чтобы реагировать на эти изменения и сохранять устойчивость в организме человека. ЭВ, по-видимому, играют заметную роль во взаимодействии хозяина-паразита, чтобы регулировать иммунный ответ хозяина и обеспечивать механизмы восприятия в популяции паразита.
В этом обзоре мы сначала представим различные типы везикул, а затем обсудим их биогенез и функцию у простейших паразитов.
Классификация и биогенез ЭВ
Экзосомы
Экзосомы были идентифицированы 30 лет назад при изучении транспорта трансферриновых рецепторов в ретикулоцитах. Рецептор трансферрина опосредует внутриклеточное поглощение железа, необходимого для синтеза гемоглобина.Во время созревания ретикулоциты теряют свои внутренние компартменты, и этот процесс сопровождается экстенсивным ремоделированием мембраны и потерей рецептора трансферрина (Pan et al. ., 1983). Трансмиссионная электронная микроскопия показала, что созревающие ретикулоциты содержат большие мешочки, заполненные небольшими окруженными мембраной везикулами почти одинакового размера (30–100 нм) в своей цитоплазме. Обмен трансферриновых рецепторов отслеживали с использованием меченого трансферрина, демонстрируя накопление трансферрина на небольших пузырьках внутри мультивезикулярных телец (MVB).Дополнительные исследования показали, что MVBs могут сливаться с плазматической мембраной и высвобождать свои внутренние везикулы в виде экзосом во внеклеточный компартмент (Harding et al ., 1983).
Как правило, экзосомы формируются в эндолизосомной сети, мембранном компартменте, который сортирует различные внутрипросветные везикулы в поздней эндосоме (также называемой мультивезикулярным тельцем) для деградации груза в лизосомы или для секреции в виде экзосом во внеклеточную среду (рис.1). Экзосомы несут специфические белковые маркеры эндосомального пути и белки, участвующие в формировании везикул, такие как тетраспанины (мультимембранные связующие белки), шапероны, такие как HSP70, и члены семейства Rab GTPase (Ostrowski et al. ., 2010). Генерация экзосом инициируется в ранних эндосомах при эндоцитозе внеклеточного материала на плазматической мембране путем образования внутрипросветных пузырьков, что приводит к образованию MVB. Экзосомы высвобождаются, когда MVB сливаются с плазматической мембраной (Roxrud et al ., 2010).
Обзор биогенеза и функций ЭВ.
A. Экзосомы и биогенез МВ. Экзосомы происходят из мультивезикулярных телец (MVB). Генерация экзосом инициируется за счет внутреннего отпочкования ранних эндосом, что приводит к образованию MVB (1). Экзосомы высвобождаются, когда MVB сливаются с внешней клеточной мембраной, чтобы высвободить свой груз. Белки ESCRT в сочетании с дополнительными факторами, такими как синтенин и синдекан, опосредуют биогенез MVB и сортировку специфического груза в MVB.Белки Rab регулируют созревание и слияние MVB с плазматической мембраной (2). Микровезикулы (МВ) отпочковываются непосредственно от плазматической мембраны и выделяются в окружающую среду (3). Для их формирования также необходимы специфические факторы, такие как ARF-6, VPS4 и белок плазматической мембраны ARRDC1.
B. Функция EV. ЭВ состоят из двойного липидного слоя и экспрессируют на своей поверхности специфические рецепторы, отражающие их клеточное происхождение (например, тетраспанины, интегрины). Экзосомы можно идентифицировать по наличию специфических компонентов ESCRT, таких как TSG101 и Alix.ЭВ содержат различные биологически активные молекулы, включая белки, липиды, ДНК и РНК (включая микроРНК, связанные с Argonaute-2 [Ago2]).
Путь ESCRT (эндосомальный сортировочный комплекс, необходимый для транспорта) состоит из трех комплексов (ESCRT-I, ESCRT-II, ESCRT-III) и является ключевым медиатором биогенеза MVB, регулируя почкование мембран на клеточных поверхностях и на уровне поздних эндосомы (Raposo and Stoorvogel, 2013). После завершения формирования МВБ ЭСКРТ отделяется от оболочки МВБ и способствует транспортировке нового груза.ESCRT функционирует в первую очередь для сортировки грузовых белков, таких как активированные рецепторы к MVB, до их деградации в лизосомах, но некоторый груз также нацелен на экзосомы (Henne et al ., 2011; 2012; Raposo and Stoorvogel, 2013). В самом деле, идентификация компонентов ESCRT Tsg101 и Alix с помощью протеомики в препаратах экзосом убедительно указывает на их роль в биогенезе MVB и образовании экзосом (Thery et al. ., 2002a). TSG101 (ген 101 предрасположенности к опухоли) является компонентом комплекса ESCRT-I, и Alix (Booth et al ., 2006) представляет собой цитозольный белок в клетках млекопитающих, который первоначально был идентифицирован на основании его связи с проапоптотическим сигнальным механизмом в качестве белка, связывающего ESCRT-III (Missotten et al ., 1999). Недавние исследования сортировки синдекана в экзосомы пролили некоторый свет на механизмы, лежащие в основе нацеливания белков на экзосомы. Синтенин представляет собой растворимый белок, рекрутируемый на плазматической мембране путем связывания с цитозольным доменом синдеканов, которые являются трансмембранными корецепторами клеточной поверхности для молекул адгезии и факторов роста (Grootjans et al ., 1997). Синтенин взаимодействует через специфические мотивы на своем неструктурированном N-конце непосредственно с компонентом ESCRT Alix. Т.о., цитозольный адаптор синтенин соединяет синдеканы с ESCRT и направляет белки к экзосомам (Baietti et al. ., 2012). Некоторые внутриклеточные патогены, такие как ретровирусы, захватывают механизм ESCRT, связываясь с одним и тем же мотивом, чтобы способствовать почкованию и выходу вируса (Gould et al. ., 2003).
Альтернативный путь биогенеза экзосом не зависит от ESCRT и опосредуется липидозависимым механизмом.Экзосомы и липидные рафты имеют очень сходный липидный состав и обогащены холестерином и сфинголипидами, включая заметное обогащение церамидами по сравнению с концентрацией в плазматической мембране. Церамиды имеют небольшую головную группу и группируются в микродомены, способствующие почкованию (Gulbins and Kolesnick, 2003; Matsuo et al. ., 2004). Обработка клеток нейтральным ингибитором сфингомиелиназы приводит к уменьшению высвобождения экзосом (Trajkovic et al. ., 2008).
Микровезикулы
В отличие от экзосом, МВ отпочковываются и отделяются непосредственно от плазматической мембраны.Термины эктосомы и микрочастицы иногда используются для обозначения МВ, особенно в контексте эритроцитов. Принято считать, что их размер находится в диапазоне от 0,1 до 1 мкм, поэтому размеры МВ и экзосом перекрываются, и основное различие между двумя типами везикул заключается в их биогенезе. MV формируются в результате динамического взаимодействия между сокращением белков цитоскелета и перераспределением фосфолипидов. Фосфолипиды и белки распределяются по плазматической мембране неравномерно и образуют микродомены, подобные липидным рафтам.Несколько ферментов аминофосфолипидного транслоказного типа активно поддерживают это асимметричное распределение (Bevers et al. ., 1999). Такие «флиппазы» и «флоппазы» представляют собой транслоказы, которые переносят фосфолипиды с наружного листка мембраны на внутренний листок и наоборот (Leventis, Grinstein, 2010). Транслокация фосфатидил-серина на листок наружной мембраны запускает почкование мембраны и, следовательно, образование MV (van der Heyde et al ., 2011). Совсем недавно были идентифицированы другие важные регуляторы образования МВ.Например, сверхэкспрессия GTP-связывающего белка ADP-рибозилирования фактора 6 (ARF-6) приводит к увеличению секреции MV (рис. 1). Активация ARF-6 приводит к сокращению структур цитоскелета за счет актин-миозиновых взаимодействий в зависимости от фосфолипазы D и последующему образованию MV (Muralidharan-Chari et al. ., 2009).
Специфическое взаимодействие компонента ESCRT-I TSG101 с белком плазматической мембраны ARRDC1 (белок 1, содержащий домен arrestin) управляет почкованием MV.Это взаимодействие приводит к перемещению TSG101 из эндосом на плазматическую мембрану и обеспечивает высвобождение MV, содержащих TSG101 и ARRDC1. Формирование MV требует VPS4 ATPase и усиливается лигазой E3 WWP2, которая взаимодействует с ARRDC1 и убиквитинирует его (Nabhan et al. ., 2012).
Множественные функции электромобилей в физиологических и патогенных процессах
Разнообразие ВВ и множественные способы доставки информации отражаются в различных функциях ВВ в физиологических и патогенных процессах.Большинство EVs, описанных до сих пор, либо вовлечены в иммунную регуляцию, либо в формирование и/или прогрессирование опухоли.
В зависимости от состояния иммунных клеток ВВ могут вызывать адаптивные реакции или ингибировать воспаление. Например, экзосомы, высвобождаемые антигенпрезентирующими дендритными клетками (ДК) (Thery et al ., 2002b) и В-клетками (Raposo et al ., 1996), несут на своей поверхности иммуностимулирующие молекулы, включая MHC-I и MHC-II и костимулирующие молекулы CD86 и CD80 (Thery et al ., 2002а). Экзосомы, высвобождаемые из DCs, которые были импульсированы опухолевыми пептидами, могут запускать антиген-специфическую активацию Т-клеток и индуцировать противоопухолевый цитотоксический Т-клеточный ответ in vivo . Опухоли секретируют EV, которые могут переносить антигены в дендритные клетки, чтобы способствовать перекрестным защитным противоопухолевым эффектам и индукции цитотоксических Т-клеточных ответов (Wolfers et al. ., 2001). Экзосомы, происходящие из DC, также могут индуцировать активацию наивных CD4 T-клеток (Thery et al ., 2002b).Аналогичные стратегии иммунизации использовались при паразитарных заболеваниях (Aline et al. ., 2004; Schnitzer et al. ., 2010).
В некоторых случаях внутриклеточные патогены могут изменять состав и функцию экзосом, высвобождаемых из инфицированных клеток. Например, макрофаги, инфицированные Mycobacterium avium , высвобождают провоспалительные экзосомы, содержащие гликопептидолипиды (GPL) (Bhatnagar and Schorey, 2007). Когда наивные макрофаги подвергаются воздействию таких экзосом, они выделяют провоспалительные цитокины, тогда как экзосомы из неинфицированных макрофагов не оказывают стимулирующего действия.Аналогичные эффекты наблюдаются у M.tuberculosis и Salmonella typhimurium (Bhatnagar et al. ., 2007). В более общем плане можно выделить три типа ВВ в контексте инфекции: (i) ВВ, секретируемые свободноживущими патогенами, (II) ВВ, секретируемые клетками млекопитающих, инфицированными патогенами, и (III) ВВ, секретируемые эффекторными клетками, которые были стимулированы непосредственно патогенами или через их EV. В то время как внутриклеточные патогены могут воспользоваться механизмом EV хозяина, свободноживущие формы должны создавать свои собственные везикулы.Инфекции простейшими паразитами могут сильно изменить состав и функцию ВВ (например, Hassani and Olivier, 2013; Mantel et al ., 2013). Некоторые инфекционные состояния приводят к повышению концентрации ЭВ в жидкостях организма пациентов, что позволяет предположить, что ЭВ играют роль в физиологической регуляции и исходе заболевания. Действительно, EV могут опосредовать взаимодействия хозяин-паразит и паразит-паразит. В частности, они предоставляют патогенам средства уклонения от иммунной системы хозяина, облегчают распространение факторов вирулентности и обеспечивают межклеточную связь между паразитами на больших расстояниях.
Известная роль ЭВ в контексте инфекций, вызванных простейшими паразитами, будет обсуждаться в следующих параграфах.
ВВ при малярии: иммуномодуляция и сотовая связь
Plasmodium falciparum передается человеку-хозяину после того, как самка комара Anopheles вводит паразитов в подкожную клетчатку во время еды с кровью. Инъецированные спорозоиты мигрируют в печень, где внедряются в гепатоциты.Внутри гепатоцита каждый спорозоит развивается в несколько тысяч мерозоитов, которые высвобождаются в кровоток при выходе из гепатоцитов и внедряются в эритроциты (эритроциты). Во время развития стадии крови паразиты кольцевой стадии развиваются в репликативные шизонтные формы, которые выделяют множество инвазивных дочерних мерозоитов. Паразиты на стадии крови связаны со всеми патологиями и осложнениями, наблюдаемыми при симптоматической и тяжелой малярии (Miller et al ., 2002). Подмножество паразитов на стадии крови вступает в половой цикл, превращаясь в мужские и женские гаметоциты у человека-хозяина перед дальнейшим развитием и половой рекомбинацией у комара.
Несколько исследований на людях показали, что циркулирующие ВВ из различных клеточных источников повышены во время инфекции видами Plasmodium , и их уровни в плазме связаны с тяжестью заболевания. Например, повышенные уровни EV эндотелиальных клеток были измерены в плазме больных детей, инфицированных P. falciparum в Малави, по сравнению со здоровыми контролями (Combes et al ., 2004). В исследовании пациентов, инфицированных P. vivax в Бразилии, уровень ЭВ в эритроцитах, тромбоцитах, лейкоцитах и моноцитах был повышен на уровне, сходном с таковым у пациентов с карциномой яичника (известное состояние, вызывающее ЭВ) (Campos et al ., 2010). В другом исследовании уровни ЭВ, происходящих из эритроцитов, непосредственно сравнивали у пациентов, инфицированных P. vivax , P. malariae или P. falciparum , продемонстрировав самые высокие уровни у пациентов с тяжелой малярией, инфицированных P. falciparum ( Pankoui Mfonkeu et al ., 2010). Хотя эти исследования не демонстрируют причинно-следственной связи между повышенным уровнем EV и тяжестью заболевания, эксперименты in vitro и исследования на мышиной модели предполагают, что EV, полученные из тромбоцитов и эндотелиальных клеток, способствуют общему воспалительному состоянию (Grau and Chimini, 2005; Coltel ). и др. ., 2006; Wassmer и др. ., 2006; Купер и др. , 2010). Интересно, что воспалительные реакции также активируют экспрессию рецепторов на эндотелиальных клетках и тем самым увеличивают секвестрацию паразитов. Модель мышей с нокаутом (KO) ABCA1 (ATP-binding-cassette transporter 1) была использована для исследования влияния EV на тяжелую малярию. ABCA1 способствует микровезикуляции мембраны, а нокаутированные мыши ABCA1 имеют дефект высвобождения EV (Hamon et al , 2000; Yakushi et al ., 2000). Важно отметить, что они устойчивы к тяжелой малярии, вызванной инфекцией P. berghei ANKA, вероятно, из-за значительного уменьшения воспаления, и вместо этого они в конечном итоге умирают от тяжелой анемии (Combes et al ., 2005; Pankoui Mfonkeu et al ., 2010). ; Линг и др. ., 2011). Модель мышиной малярии также подтверждает провоспалительные свойства ЭВ, полученных из эритроцитов, поскольку те, которые были очищены от инфицированных мышей, сильно индуцируют активацию макрофагов TLR-зависимым образом in vitro (Couper et al ., 2010). Недавно мы показали на примере P. falciparum , что ЭВ, полученные из супернатанта инфицированных эритроцитов, быстро интернализуются макрофагами и вызывают сильные провоспалительные и противовоспалительные цитокиновые реакции (Mantel et al ., 2013).
Зрелые эритроциты лишены каких-либо внутренних мембран, включая механизмы экзоцитоза и эндоцитоза, поэтому непонятно, как инфицированные эритроциты могут высвобождать ВВ. Ультраструктурные исследования впервые показали, что малярийные паразиты сильно изменяют среду эритроцитов хозяина (Luse and Miller, 1971), предполагая, что паразиты создают свою собственную белковую сеть для импорта питательных веществ и экспорта факторов вирулентности (Lauer et al ., 1997). Действительно, более поздние исследования выявили сотни белков, которые экспортируются через мембрану паразита и окружающую мембрану паразитофорной вакуоли в клетку-хозяина (Hiller et al ., 2004; Marti et al ., 2004; Sargeant et al ., 2006). Подмножество этих экспортируемых белков откладывается на поверхности эритроцитов, включая белки-переносчики растворенных веществ паразита Clag3 и основной фактор вирулентности PfEMP1 (Leech et al ., 1984; Su et al ., 1995; Nguitragool et al ., 2011). Перенос белка на поверхность инфицированных эритроцитов осуществляется через индуцированные паразитами мембранные платформы, называемые щелями Маурера, которые прикреплены к цитоскелету хозяина (например, Knuepfer et al ., 2005; Spycher et al ., 2006). Небольшие везикулы, прикрепленные к актиновым филаментам, перемещаются между щелями Маурера и мембранами эритроцитов, и эти структуры теряются у пациентов с серповидноклеточной мутацией гемоглобина (Cyrklaff et al )., 2011), предполагая потенциальный механизм защиты от тяжелой формы малярии.
Недавно мы продемонстрировали высвобождение ЭВ из эритроцитов, инфицированных P. falciparum , с помощью живой визуализации, что подтверждает ранние сообщения об этом явлении с помощью электронной микроскопии (Luse and Miller, 1971). Такие EV могут быть эффективно выделены из культуры in vitro , и их мембранная природа была продемонстрирована с помощью атомно-силовой микроскопии и электронной микроскопии (Mantel et al ., 2013; Регев-Рудзки и др. ., 2013). Протеомный анализ ЭВ, полученных из инфицированных эритроцитов, выявил обогащение белками липидного рафта хозяина, такими как стоматин, а также маркерами микровезикул ARF-6 и VPS4 (Mantel et al ., 2013), что позволяет предположить, что может быть задействован минимальный механизм хозяина. в биогенезе ЭВ. Также был идентифицирован ряд белков паразитов, в частности белки из структур расщелины Маурера (Mantel et al , 2013), а делеция специфического компонента расщелины Маурера ингибирует продукцию и поглощение EV (Regev-Rudzki et al ., 2013). Количественные и кинетические эксперименты по высвобождению ЭВ показали, что инфицированные эритроциты продуцируют примерно в 10 раз больше ЭВ, чем неинфицированные эритроциты, и что подавляющее большинство ЭВ высвобождается незадолго до выхода паразита (Mantel et al ., 2013). Этот временной интервал совпадает со временем наблюдаемого исчезновения щелей Маурера в недавнем покадровом анализе развития паразита (Gruring et al ., 2011).
Неожиданно мы обнаружили, что инфицированные эритроциты также способны интернализовать ЭВ и переносить их в цитозоль паразита, что указывает на их потенциальное участие в межклеточных коммуникациях между паразитами.Наличие дополнительных мембран, окружающих такие интернализированные EV, предполагает, что в инфицированных эритроцитах должен действовать какой-то вид фагоцитарного или эндоцитарного процесса (Mantel et al ., 2013). Учитывая кажущееся отсутствие таких процессов в зрелых эритроцитах, такие пути, вероятно, обеспечиваются паразитом. Важно отметить, что связывание/интернализация ЭВ в инфицированных эритроцитах поддается титру и коррелирует с повышенным образованием стадий передачи малярии (т., 2013). ЭВ, полученные из трансгенных паразитов, могут переносить ДНК, кодирующую маркер лекарственной устойчивости, между отдельными паразитами, тем самым распространяя лекарственную устойчивость в популяции паразитов (Regev-Rudzki et al. ., 2013). Резистентные паразиты вступают в стадию передачи, что еще раз указывает на существование клеточного пути коммуникации у малярийных паразитов. Данные этих двух исследований подтверждают предыдущие наблюдения о том, что среда, кондиционированная паразитами (из которой были получены EV для вышеупомянутых экспериментов), может индуцировать образование гаметоцитов (Dyer and Day, 2003; Fivelman et al )., 2007), и они обеспечивают обоснование для целенаправленного исследования этого нового пути клеточной коммуникации. В целом текущие данные свидетельствуют о том, что паразитов P. falciparum разработали уникальный механизм клеточной коммуникации через EV, чтобы определять плотность своей популяции во время инфекции и соответственно регулировать баланс между вирулентностью (бесполой рост) и передачей (производство гаметоцитов).
EV в
L eishmania : иммуномодуляция посредством регуляции микроРНК хозяинаПаразиты Leishmania являются возбудителями висцерального и кожного лейшманиоза, заболеваний, передающихся млекопитающим москитами Phlebotomus (Старый Свет) и Lutzomyia (Новый Свет).При укусе своих хозяев инфицированные москиты извергают в кожу внеклеточные «метациклические» формы промастигот. После фагоцитоза макрофагами жгутиковые промастиготы трансформируются в неподвижную форму амастиготы в фаголизосоме клетки-хозяина. Амастиготы реплицируются и заражают дополнительные макрофаги. Инфицированные макрофаги, которые поглощаются москитами, выделяют амастиготные формы в среднюю кишку, где они трансформируются в «проциклические» промастиготные формы.
Паразиты Leishmania способны обеспечить выживание и размножение внутри своего хозяина путем изменения сигнальных путей, участвующих в способности убивать патогены или активировать адаптивную иммунную систему.Протеомный анализ супернатанта инфицированных культур макрофагов выявил более 150 секретируемых антигенов Leishmania (Silverman et al. ., 2008). Многие известные экзосомальные белки млекопитающих, а также ортологи компонентов ESCRT-III Leishmania присутствовали в этом супернатанте, что свидетельствует о системе секреции на основе экзосом (Silverman et al. ., 2008). Действительно, ультраструктурный анализ очищенного материала из супернатантов подтвердил везикулярную структуру секретируемого материала.В настоящее время неясно, как амастиготы вызывают образование экзосом в инфицированных макрофагах и как эти экзосомы пересекают окружающие фаголизосомы и в конечном итоге секретируются в супернатант.
Важным этапом в процессе уклонения от иммунного ответа является активация протеинтирозинфосфатазы хозяина SHP-1 (Shio et al ., 2012). Протеомика экзосом, высвобождаемых из инфицированных макрофагов, идентифицировала факторы, участвующие в уклонении от иммунитета, такие как белки паразита GP63 и лейшманолизин.GP63 представляет собой металлопротеазу цинка, которая интернализуется макрофагами. После интернализации он расщепляет и активирует протеинтирозинфосфатазы хозяина, чтобы предотвратить индуцированную INF-гамма передачу сигналов, тем самым блокируя провоспалительный цитокиновый ответ против инфекции Leishmania (Gomez et al ., 2009). Кроме того, GP63 нацелен на клетки печени через экзосомы, где он ингибирует фермент Dicer1, процессирующий pre-miRNA, чтобы блокировать образование рибонуклеопротеинового комплекса miRNA.Действительно, уровни экспрессии miR-122 в печени снижаются при инфекциях Leishmania , что приводит к изменению экспрессии генов, участвующих в метаболизме липидов (Ghosh et al. ., 2011). Висцеральный лейшманиоз вызывается накоплением инфицированных макрофагов в печени и селезенке и вызывает аномальные липидные профили. Восстановление уровня экспрессии miR-122 и Dicer1 повышало уровень холестерина в сыворотке и снижало паразитарную нагрузку (Ghosh et al ., 2013).
Свободноживущие промастиготные формы также выделяют везикулы из плазматической мембраны и через MVB из жгутикового кармана (Silverman et al ., 2008), инвагинация в плазматической мембране, где выходит жгутик, и основное место секреции белка у паразита. Протеомный анализ предположил, что EV, высвобождаемые из MVB, являются экзосомами, что продемонстрировано большим перекрыванием с ортологами из компонентов экзосом человека (Silverman et al. ., 2010aa). Очищенные везикулы из промастигот L.donovani модулируют цитокиновый ответ моноцитов человека, индуцируя IL-10 и подавляя TNF-альфа (Silverman et al ., 2010bb). DC, подвергшиеся воздействию таких EV, неспособны индуцировать дифференцировку наивных T-клеток в Th2-клетки (Silverman et al ., 2010bb). Протеомный анализ EV, высвобождаемых клеточной линией мышиных макрофагов, подвергшихся воздействию промастиготных форм L. mexicana со стационарной фазой или LPS, показал, что большинство белков-хозяев были общими для двух популяций экзосом. GP63 был единственным белком паразита, идентифицированным в EV, высвобождаемом из подвергшихся воздействию паразита макрофагов. Эти EVs были способны индуцировать фосфорилирование сигнальных белков и транслокацию факторов транскрипции в ядро, указывая на активный перенос GP63 в клетки-реципиенты (Hassani and Olivier, 2013).Вместе эти данные свидетельствуют о том, что как внутриклеточные, так и свободноживущие стадии паразита могут высвобождать EV, а также запускать другие клетки для высвобождения EV, чтобы регулировать иммунные реакции хозяина.
EVs в
T rypanosoma cruzi : роль в хроническом заболевании?Трипаносомы представляют собой жгутиковые паразитические простейшие, которые включают ряд важных с медицинской точки зрения паразитов. Trypanosoma cruzi поражает животных и людей в Америке и является этиологическим агентом болезни Шагаса.После проникновения в организм человека трипомастиготы T. cruzi вторгаются в макрофаги, которые переносят патоген в другие участки тела. После инвазии трипомастиготы дифференцируются в амастиготные формы. Амастиготы размножаются и дифференцируются обратно в трипомастиготы, которые выделяются в кровоток. Они могут либо инфицировать другие клетки, либо передаваться вектору, клопу Triatoma , для дальнейшей дифференциации в эпимастиготные формы.
Кардиомиопатии — осложнения, наблюдаемые при хронической болезни Шагаса.Во время этой фазы воспалительные поражения не связаны напрямую с присутствием паразита (Rassi et al ., 2001) и вместо этого считаются результатом аутоиммунной реакции. Также было высказано предположение, что секреция антигенов T. cruzi и последующая адсорбция неинфицированными клетками может привести к повреждению клеток из-за иммунного ответа, направленного на паразита (Pinho et al ., 2002). Действительно, трипомастиготные формы секретируют антигены, присутствующие в сыворотке T.cruzi — инфицированных животных (Dzbenski, 1974) и от людей в острой и хронической фазах болезни Шагаса (Araujo et al ., 1981). Как только формы трипомастиготы исчезают из кровотока и проникают в клетки-хозяева, антигены больше не обнаруживаются в циркуляции. Антигены присутствуют в везикулах на мембране паразита и в жгутиковом кармане перед секрецией на стадии трипомастиготы (Goncalves et al ., 1991), что предполагает высвобождение через EV. Аналогичным образом в мышиной системе антигены могут быть интернализованы в клетки-реципиенты, и эти клетки могут быть мишенями ответов паразит-специфических антител (Pinho et al ., 2002). Инъекция ЭВ мышам BALB/C перед заражением T. cruzi приводит к усилению паразитемии, а также к тяжелой сердечной патологии и интенсивному воспалению, что указывает на потенциальную роль ЭВ в повышении вирулентности (Trocoli Torrecilhas et al ., 2009). Помимо продукции собственных ВВ, трипомастиготы T. cruzi могут индуцировать продукцию ВВ из других клеток, в частности из моноцитов. Такие EV могут связываться с трипоматиготами, защищая их от лизиса системой комплемента (Cestari et al ., 2012).
Недавнее исследование специально сравнило происхождение и состав EV, происходящих от трипомастиготных форм у людей, с таковыми от эпимастигот, присутствующих в москитной мухе-переносчике (Bayer-Santos et al ., 2013). Обе формы высвобождают EV из плазматической мембраны и из MVB, локализованных в жгутиковом кармане. В результате фракционирования были получены очищенные препараты обоих типов везикул каждой стадии развития паразита для протеомного анализа (Bayer-Santos et al ., 2013). Эти данные демонстрируют присутствие множественных антигенов паразитов, а также белков других классов, включая ядерные белки, в EV, подтверждая идею о том, что T. cruzi модулирует клетки-хозяева через EV во время инфекции. Вместе с дифференциальной плотностью данные также предполагают, что EV, происходящие из плазматической мембраны, являются микровезикулами, тогда как те, которые высвобождаются через MVB в жгутиковом кармане, являются экзосомами. В целом, текущие данные свидетельствуют о том, что, как и паразиты Leishmania , T.cruzi продуцирует экзосомоподобные частицы на свободноживущих и внутриклеточных стадиях, а также запускает другие клетки для производства EV, чтобы модулировать иммунный ответ хозяина.
EVs в
T Richomonas : регулируют адгезию эпителиальных клетокТрихомониаз — венерическое заболевание, вызываемое жгутиковым простейшим паразитом Trichomonas vaginalis . Паразит колонизирует мочеполовой тракт человека, где он остается внеклеточным и прикрепляется к эпителиальным клеткам (Swygard et al ., 2004). Передача от человека к человеку происходит напрямую, так как паразит не образует экологически устойчивых форм кисты.
Трихомониаз связан с вагинитом, цервицитом, уретритом, воспалительными заболеваниями органов малого таза и неблагоприятными исходами родов. Недавняя работа продемонстрировала, что T. vaginalis секретирует EV, которые модулируют экспрессию цитокинов IL-6 и IL-8 в эктоцервикальных клетках. Кроме того, предварительная обработка EV может увеличить цитоадгезию паразитов к эпителиальным клеткам за счет активации рецепторов (Twu et al )., 2013). Интересно, что EV из высокоцитоадгезивных штаммов индуцируют сильное связывание, тогда как экзосомы из слабо адгезивных штаммов оказывают лишь незначительное влияние на связывание. Эти данные свидетельствуют о том, что ЭВ содержат штаммоспецифические факторы, ответственные за дифференциальный фенотип связывания. Протеомика очищенных препаратов EV идентифицировала поверхностных белков T. vaginalis и более чем на 70% перекрывается с маркерами экзосом млекопитающих, что позволяет предположить, что EV T. vaginalis на самом деле являются экзосомами.Общие белки включают компоненты механизма ESCRT, а также гомологи тетраспанина. Экзосомы T. vaginalis также содержат виды малых РНК с пока неизвестной функцией.
Заключительные замечания
Внеклеточные везикулы были идентифицированы во многих линиях эукариотического царства и также высвобождаются как грамотрицательными, так и некоторыми грамположительными бактериями, демонстрируя их существование в качестве древних механизмов обмена информацией.Наличие компонентов ESCRT в ранних линиях эукариот (Williams and Urbe, 2007) и идентификация ESCRT в экзосомах, высвобождаемых из T. vaginalis и Leishmania , также подтверждает идею о том, что образование экзосом является высококонсервативным механизмом у эукариот. Свободноживущие стадии Leishmania sp. и T. cruzi , которые оба принадлежат к типу Kinetoplastid, высвобождают экзосомы из MVBs в жгутиковом кармане. Сходным образом экзосомы T.vaginalis высвобождаются через MVB, что снова указывает на консервативные механизмы биогенеза и высвобождения экзосом у эукариот.Интересно, что компоненты ESCRT I и II были утрачены у чисто внутриклеточных простейших паразитов родов Plasmodium и Toxoplasma , которые оба принадлежат к типу Apicomplexan. Отсутствие маркеров ESCRT паразита или хозяина и присутствие хозяина VPS4 и ARF-6 в EV, высвобождаемых из инфицированных P. falciparum эритроцитов, предполагает, что они на самом деле являются микровезикулами.
Недавние исследования начали проливать свет на различные функции, связанные с высвобождением экзосом и микровезикул некоторыми из этих простейших паразитов и клеток, которые они заражают (рис.2). Наличие компонентов паразитарного происхождения (белок, липид, РНК, ДНК) в EV делает их высокоиммуногенными, подчеркивая общую функцию EV в иммуномодуляции для всех изученных до сих пор паразитов. Во-вторых, паразиты могут манипулировать своим окружением, активируя другие типы клеток (косвенно или напрямую), чтобы стимулировать фенотипы паразитов, такие как прикрепление к эпителиальным или эндотелиальным клеткам, как показано для T. vaginalis и малярийных паразитов соответственно. В-третьих, паразиты могут общаться друг с другом с целью регулирования формирования стадии передачи, как мы недавно продемонстрировали на примере P.фальципарум . Такие механизмы коммуникации и восприятия, вероятно, более широко распространены среди простейших, поскольку популяции часто синхронно переключаются между состояниями, что напоминает ощущение кворума у бактериальных видов. В последние годы область EV млекопитающих предоставила множество инструментов, которые теперь можно применять для систематического изучения увлекательной биологии этих везикул в контексте взаимодействия паразитов-хозяев.
ЭВ у паразитов.
A. P lasmodium sp. Р . falciparum -инфицированные эритроциты выделяют EV, которые содержат несколько компонентов расщелины Маурера (MC). Один компонент MC, PTP2, необходим для высвобождения и поглощения EV клетками-реципиентами. ЭВ фагоцитируются и индуцируют секрецию цитокинов макрофагами. ЭВ также могут интернализоваться инфицированными эритроцитами и запускать дифференцировку паразита в клетке-реципиенте в гаметоциты.
Б. L Эйшмания sp. При заражении человека свободноживущие формы промастигот и внутриклеточные амастиготы выделяют ВВ, содержащие антиген паразита GP63. GP63 индуцирует SHP-1 хозяина, который подавляет иммунный ответ. ЭВ также могут переноситься в гепатоциты, где GP63 расщепляет DICER1, ингибируя созревание регулятора липидов miR-122, способствуя росту паразита.
C. T Richomonas vaginalis . Паразит секретирует EV, которые могут сливаться с клетками-хозяевами и индуцировать секрецию IL-6 и IL-8, активируя экспрессию рецепторов на поверхности эпителиальных клеток и, следовательно, индуцируя прикрепление паразита.
D. T rypanosoma cruzi . Свободноживущие формы трипомастиготы выделяют везикулы, содержащие T . cruzi антигены. Когда фибробласты и кардиомиоциты адсорбируют ВВ, они становятся мишенями гуморального иммунного ответа, ответственного за повреждение тканей. Трипомастиготные формы также вызывают высвобождение EV из моноцитов, и эти моноцитарные EV связываются с трипомастиготами и защищают их от лизиса комплемента путем связывания и нейтрализации С3-конвертазы.
Благодарности
Авторы благодарят Дипали Равель за критическое прочтение рукописи. Работа в лаборатории Марти финансируется за счет грантов 5R01AI077558 и 1R21AI105328 Национальных институтов здравоохранения.
Каталожные номера
- Алин, Ф., Bout, D., Amigorena, S., Roingeard, P., и Dimier-Poisson, I. (2004) Toxoplasma gondii Экзосомы, полученные из дендритных клеток, индуцируют защитный иммунный ответ против T. gondii инфекционное заболевание. Infect Immun 72: 4127–4137.
- Araujo, FG, Chiari, E., and Dias, JC (1981) Демонстрация антигена Trypanosoma cruzi в сыворотке пациентов с болезнью Шагаса. Ланцет 1: 246– 249.
- Баетти, М.Ф., Чжан, З., Мортье, Э., Мельхиор, А., Дегест, Г., Гираертс, А., и др. . (2012) Syndecan-syntenin-ALIX регулирует биогенез экзосом. Nat Cell Biol 14: 677–685.
- Байер-Сантос, Э., Агилар-Бонавидес, К., Родригес С.П., Кордеро Э.М., Маркес А.Ф., Варела-Рамирес А., и др. . (2013)Протеомный анализ секретома Trypanosoma cruzi : характеристика двух популяций внеклеточных везикул и растворимых белков. J Proteome Res 12: 883–897.
- Беверс, Э.М., Комфуриус, П., Деккерс, Д.В., и Звал, Р.Ф. (1999)Транслокация липидов через плазматическую мембрану клеток млекопитающих. Биохим Биофиз Acta 1439: 317–330.
- Бхатнагар С. и Шори Дж. С. (2007) Экзосомы, высвобождаемые из инфицированных макрофагов, содержат гликопептидолипидов Mycobacterium avium и являются провоспалительными. J Biol Chem 282: 25779–25789.
- Бхатнагар, С., Шинагава К., Кастеллино Ф.Дж. и Шори Дж.С. (2007) Экзосомы, высвобождаемые из макрофагов, инфицированных внутриклеточными патогенами, стимулируют провоспалительную реакцию in vitro и in vivo . Кровь 110: 3234– 3244.
- Бут, А.М., Фанг, Ю., Фэллон, Дж.К., Ян, Дж.М., Хилдрет, Дж.Е., и Гулд, С.Дж. (2006)Экзосомы и HIV Gag отпочковываются от эндосомоподобных доменов плазматической мембраны Т-клеток. J Cell Biol 172: 923–935.
- Кампос Ф.М., Франклин Б.С., Тейшейра-Карвальо А., Филью А.Л., де Паула С.К., Фонтес С.Дж., и др. . (2010)Увеличенные микрочастицы плазмы во время острой инфекции Plasmodium vivax . Малар J 9: 327.
- Честари, И., Анса-Аддо, Э., Деолиндо, П., Инал, Дж.М., и Рамирес, М.И. (2012) Trypanosoma cruzi уклонение от иммунитета, опосредованное микровезикулами, происходящими из клеток-хозяев. J Immunol 188: 1942–1952.
- Колтел Н., Комбес В., Вассмер С.К., Чимини Г. и Грау Г.Е. (2006)Везикуляция клеток и иммунопатология: последствия церебральной малярии. Микробы заражают 8: 2305–2316.
- Комбс, В., Тейлор, Т.Е., Юхан-Ваг, И., Меге, Дж.Л., Мвенечанья, Дж., Тембо, М., и др. . (2004) Циркулирующие эндотелиальные микрочастицы у малавийских детей с тяжелой малярией falciparum, осложненной комой. JAMA 291: 2542–2544.
- Комбс, В., Coltel, N., Alibert, M., van Eck, M., Raymond, C., Juhan-Vague, I., et al . (2005) Делеция гена ABCA1 защищает от церебральной малярии: потенциальная патогенная роль микрочастиц в невропатологии. Am J Pathol 166: 295–302.
- Couper, K.N., Barnes, T., Hafalla, J.C., Combes, V., Ryffel, B., Secher, T., et al . (2010) Микрочастицы плазмы, полученные от паразитов, вносят значительный вклад в воспаление, вызванное малярийной инфекцией, за счет мощной стимуляции макрофагов. PLoS Pathog 6: e1000744.
- Cyrklaff, M., Sanchez, CP, Kilian, N., Bisseye, C., Simpore, J., Frischknecht, F., and Lanzer, M. (2011) Гемоглобины S и C препятствуют ремоделированию актина в Plasmodium falciparum -инфицированные эритроциты. Наука 334: 1283–1286.
- Ди Визио, Д., Kim, J., Hager, M.H., Morello, M., Yang, W., Lafargue, C.J., и др. . (2009)Формирование онкосом при раке предстательной железы: ассоциация с областью частой хромосомной делеции при метастатическом заболевании. Рак Res 69: 5601– 5609.
- Дайер М. и Дэй К.П. (2003) Регуляция скорости бесполого роста и приверженности к половому развитию с помощью диффузионных факторов из in vitro культур Plasmodium falciparum . Am J Trop Med Hyg 68: 403–409.
- Дзбенски, Т.Х. (1974) Экзоантигены Trypanosoma cruzi in vivo . Тропенмед Паразитол 25: 485–491.
- Fivelman, Q.L., McRobert, L., Sharp, S., Taylor, C.J., Saeed, M., Swales, C.A., et al .(2007)Улучшенное синхронное производство Plasmodium falciparum гаметоцитов in vitro . Mol Biochem Parasitol 154: 119–123.
- Гош, Дж., Лал, К.С., Пандей, К., Дас, В.Н., Дас, П., Ройчаудхури, К., и Рой, С. (2011) Висцеральный лейшманиоз человека: снижение уровня холестерина в сыворотке как функция селезеночного паразита нагрузка. Энн Троп Мед Паразитол 105: 267–271.
- Гош Дж., Боуз М., Рой С. и Бхаттачарья С.Н. (2013) Leishmania donovani нацеливается на Dicer1, чтобы подавлять миР-122, снижать уровень холестерина в сыворотке и способствовать инфицированию мышиной печени. Микроб-хозяин клетки 13: 277–288.
- Гомес М.А., Контрерас И., Halle, M., Tremblay, ML, McMaster, RW, and Olivier, M. (2009) Leishmania GP63 изменяет передачу сигналов хозяина посредством активируемых расщеплением протеинтирозинфосфатаз. Научный сигнал 2: ra58.
- Гонсалвес М.Ф., Умедзава Э.С., Кацин А.М., де Соуза В., Алвес М.Дж., Зингалес Б. и Колли В. (1991) Trypanosoma cruzi : выделение поверхностных антигенов в виде мембранных везикул. Эксп Паразитол 72: 43–53.
- Гулд, С.Дж., Бут, А.М., и Хилдрет, Дж.Э. (2003) Гипотеза троянской экзосомы. Proc Natl Acad Sci USA 100: 10592–10597.
- Грау, Г.Э., и Чимини, Г. (2005) Иммунопатологические последствия потери генов поглощения: случай ABCA1. J Soc Biol 199: 199–206.
- Грутянс Дж.Дж., Циммерманн П., Рекманс Г., Сметс А., Дегест Г., Дурр Дж. и Дэвид Г. (1997) Синтенин, белок PDZ, который связывает синдекановые цитоплазматические домены. Proc Natl Acad Sci USA 94: 13683–13688.
- Груринг, С., Heiber, A., Kruse, F., Ungefehr, J., Gilberger, T.W., and Spielmann, T. (2011) Развитие и модификации клеток-хозяев Plasmodium falciparum стадий крови в четырех измерениях. Нац Коммуна 2:165.
- Гулбинс Э. и Колесник Р. (2003) Церамид Raft в молекулярной медицине. Онкоген 22: 7070–7077.
- Хамон, Ю., Broccardo, C., Chambenoit, O., Luciani, M.F., Toti, F., Chaslin, S., и др. . (2000) ABC1 способствует поглощению апоптотических клеток и трансбислойному перераспределению фосфатидилсерина. Nat Cell Biol 2: 399–406.
- Harding, C., Heuser, J., and Stahl, P. (1983) Рецептор-опосредованный эндоцитоз трансферрина и рециркуляция рецептора трансферрина в ретикулоцитах крысы. J Cell Biol 97: 329–339.
- Хассани К. и Оливье М. (2013) Иммуномодулирующее воздействие экзосом макрофагов, индуцированных лейшманиями: сравнительный протеомный и функциональный анализ. PLoS Negl Trop Dis 7: e2185.
- Хенне, В.М., Бучкович, Н.Дж., и Эмр, С.D. (2011) Путь ESCRT. Dev Cell 21: 77–91.
- Хенне В.М., Бучкович Н.Дж., Чжао Ю. и Эмр С.Д. (2012)Комплекс эндосомальной сортировки ESCRT-II обеспечивает сборку и архитектуру спиралей ESCRT-III. Сотовый 151: 356–371.
- ван дер Хейде, Х.К., Грамалья И., Комбс В., Джордж Т.С. и Грау Г.Е. (2011)Проточный цитометрический анализ микрочастиц. Методы Мол Биол 699: 337–354.
- Хиллер, Н.Л., Бхаттачарджи, С., ван Оой, К., Лиолиос, К., Харрисон, Т., Лопес-Эстрано, К., и Халдар, К. (2004) Нацеленный на хозяина сигнал в белках вирулентности выявляет секретом при малярийной инфекции. Наука 306: 1934–1937.
- Христов М., Эрл В., Линдер С. и Вебер П.К. (2004) Апоптотические тельца из эндотелиальных клеток увеличивают количество и инициируют дифференцировку человеческих эндотелиальных клеток-предшественников in vitro . Кровь 104: 2761– 2766.
- Кнюпфер, Э., Руг, М., Клонис, Н., Tilley, L., and Cowman, A.F. (2005) Перенос основного фактора вирулентности на поверхность трансфицированных эритроцитов, инфицированных P. falciparum . Кровь 105: 4078– 4087.
- Лауэр, С.А., Ратод, П.К., Гори, Н., и Халдар, К. (1997) Мембранная сеть для импорта питательных веществ в эритроциты, инфицированные малярийным паразитом. Наука 276: 1122–1125.
- Пиявка, Дж. Х., Барнуэлл, Дж. В., Миллер, Л. Х., и Ховард, Р. Дж. (1984) Идентификация штаммоспецифического малярийного антигена, экспонированного на поверхности эритроцитов, инфицированных Plasmodium falciparum . J Exp Med 159: 1567–1575.
- Левентис, П.А., и Гринштейн, С.(2010) Распределение и функция фосфатидилсерина в клеточных мембранах. Annu Rev Biophys 39: 407–427.
- Линг, З.Л., Комбес, В., Грау, Г.Э., и Кинг, Нью-Джерси (2011)Микрочастицы как иммунные регуляторы при инфекционных заболеваниях – мнение. Фронт Иммунол 2:67.
- Лусе, С.А. и Миллер Л.Х. (1971) Plasmodium falciparum малярия. Ультраструктура паразитированных эритроцитов в сосудах сердца. Am J Trop Med Hyg 20: 655–660.
- Мантель П.Ю., Хоанг А.Н., Голдовиц И., Поташникова Д., Хамза Б., Воробьев И., и др. . (2013)Малярийно-инфицированные микровезикулы, полученные из эритроцитов, опосредуют клеточную связь внутри популяции паразита и с иммунной системой хозяина. Микроб-хозяин клетки 13: 521–534.
- Марти, М., Гуд, Р.Т., Руг, М., Кнупфер, Э., и Кауман, А.Ф. (2004) Нацеливание на вирулентность малярии и ремоделирование белков в эритроците хозяина. Наука 306: 1930–1933.
- Мацуо Х., Шевалье Дж., Майран Н., Ле Блан, И., Фергюсон, К., Фор, Дж., и др. . (2004)Роль LBPA и Alix в формировании мультивезикулярных липосом и организации эндосом. Наука 303: 531–534.
- Миллер Л.Х., Барух Д.И., Марш К. и Думбо О.К. (2002) Патогенные основы малярии. Природа 415: 673–679.
- Миссоттен, М., Николс, А., Ригер, К., и Садул, Р. (1999) Аликс, новый мышиный белок, подвергающийся кальций-зависимому взаимодействию с белком гена 2, связанного с апоптозом (ALG-2). Гибель клеток Различие 6: 124–129.
- Морелло М., Минчиакки В.Р., де Кандиа П., Ян Дж., Посадас Э., Ким Х., и др. . (2013)Большие онкосомы опосредуют межклеточный перенос функциональных микроРНК. Клеточный цикл 12: 3526–3536.
- Муралидхаран-Чари, В., Клэнси, Дж., Плоу, К., Ромао, М., Чаврие, П., Рапозо, Г., и Д’Суза-Шори, К. (2009) ARF6-регулируемое выделение опухоли микровезикулы клеточной плазматической мембраны. Curr Biol 19: 1875–1885.
- Набхан, Дж.Ф., Ху, Р., О, Р.С., Коэн, С.Н., и Лу, К. (2012) Формирование и высвобождение микровезикул, опосредованных белком 1 (ARMM), содержащих домен аррестина, на плазматической мембране путем рекрутирования белка TSG101. Proc Natl Acad Sci USA 109: 4146–4151.
- Нгитрагул, В., Бохари, А.А., Пиллаи, А.Д., Раявара, К., Шарма, П., Турпин, Б., и др. . (2011) Гены clag3 малярийного паразита определяют опосредованное каналами поглощение питательных веществ инфицированными эритроцитами. Сотовый 145: 665–677.
- Островски М., Кармо Н.Б., Крумейх С., Фангет И., Рапозо Г., Савина А., и др. . (2010) Rab27a и Rab27b контролируют разные этапы пути секреции экзосом. Nat Cell Biol 12: 19–30.
- Пан, Б.Т., Блостайн, Р.и Джонстон Р.М. (1983) Потеря рецептора трансферрина во время созревания ретикулоцитов овцы in vitro . Иммунологический подход. Biochem J 210: 37–47.
- Pankoui Mfonkeu, JB, Gouado, I., Fotso Kuate, H., Zambou, O., Amvam Zollo, PH, Grau, GE, and Combes, V. (2010) Повышенные клеточно-специфические микрочастицы являются биологическим маркером церебральных дисфункций. при тяжелой малярии человека. PLoS ONE 5: e13415.
- Pinho, RT, Vannier-Santos, MA, Alves, CR, Marino, AP, Castello Branco, LR, and Lannes-Vieira, J. (2002) Влияние Trypanosoma cruzi , высвобождающих антигены, связывающиеся с неинфицированными клетками, на анти- Распознавание паразитных антител и экспрессия компонентов внеклеточного матрикса. Acta Trop 83: 103–115.
- Рапозо, Г.и Stoorvogel, W. (2013) Внеклеточные везикулы: экзосомы, микровезикулы и др. J Cell Biol 200: 373–383.
- Raposo, G., Nijman, H.W., Stoorvogel, W., Liejendekker, R., Harding, C.V., Melief, CJ, and Geuze, HJ (1996) В-лимфоциты секретируют антигенпрезентирующие везикулы. J Exp Med 183: 1161–1172.
- Расси, А., Jr, Rassi, SG, and Rassi, A. (2001) Внезапная смерть при болезни Шагаса. Бюстгальтеры Arq Cardiol 76: 75–96.
- Регев-Рудзки, Н., Уилсон, Д.В., Карвальо, Т.Г., Сискелла, X., Коулман, Б.М., Руг, М., и др. . (2013)Связь между клетками между малярийными эритроцитами через экзосомоподобные везикулы. Мобильный 153: 1120–1133.
- Роксруд, И., Stenmark, H., and Malerod, L. (2010) ESCRT & Co. Biol Cell 102: 293–318.
- Сарджант, Т.Дж., Марти, М., Калер, Э., Карлтон, Дж.М., Симпсон, К., Спид, Т.П., и Кауман, А.Ф. (2006) Линейно-специфическое расширение белков, экспортируемых в эритроциты малярийными паразитами. Геном Биол 7: R12.
- Шнитцер, Дж.К., Берзель С., Фахардо-Мозер М., Ремер К.А. и Молл Х. (2010)Фрагменты нагруженных антигеном дендритных клеток (ДК) и экзосомы, полученные из ДК, индуцируют защитный иммунитет против Leishmania major. Вакцина 28: 5785– 5793.
- Шио М.Т., Хассани К., Иснард А., Ральф Б., Контрерас И., Гомес М.А., и др. . (2012)Передача сигналов клетки-хозяина и механизмы уклонения от лейшманиоза. J Trop Med 2012: 819512.
- Сильверман, Дж. М., Чан, С. К., Робинсон, Д. П., Двайер, Д. М., Нандан, Д., Фостер, Л. Дж., и Райнер, Н. Э. (2008)Протеомный анализ секретома Leishmania donovani . Геном Биол 9: R35.
- Сильверман, Дж.M., Clos, J., de’Oliveira, C.C., Shirvani, O., Fang, Y., Wang, C., и др. . (2010a) Путь секреции, основанный на экзосомах, отвечает за экспорт белка из Leishmania и связь с макрофагами. J Cell Sci 123: 842–852.
- Сильверман Дж.М., Клос Дж., Хоракова Э., Ван А.Ю., Визгигл М., Келли И., и др. . (2010b) Экзосомы Leishmania модулируют врожденные и адаптивные иммунные ответы, воздействуя на моноциты и дендритные клетки. J Иммунол 185: 5011– 5022.
- Spycher, C., Rug, M., Klonis, N., Ferguson, DJ, Cowman, AF, Beck, HP, and Tilley, L. (2006) Происхождение и распространение в расщелинах Маурера Plasmodium falciparum -инфицированных эритроциты. Mol Cell Biol 26: 4074–4085.
- Су, Х.Z., Heatwole, V.M., Wertheimer, S.P., Guinet, F., Herrfeldt, J.A., Peterson, D.S., et al . (1995) Большое разнообразное семейство генов var кодирует белки, участвующие в цитоадгерентности и антигенной изменчивости эритроцитов, инфицированных Plasmodium falciparum . Сотовый 82: 89–100.
- Свайгард, Х., Сена, А.С., Хоббс, М.М., и Коэн, М.С. (2004) Трихомониаз: клинические проявления, диагностика и лечение. Sex Transm Infect 80: 91–95.
- Тейлор, Р.К., Каллен, С.П., и Мартин, С.Дж. (2008) Апоптоз: контролируемое разрушение на клеточном уровне. Nat Rev Mol Cell Biol 9: 231–241.
- Тери С., Зитвогель Л. и Амигорена С. (2002a) Экзосомы: состав, биогенез и функция. Nat Rev Immunol 2: 569–579.
- Тери С., Дубан Л., Сегура Э., Верон П., Ланц О. и Амигорена С. (2002b) Косвенная активация наивных CD4+ Т-клеток экзосомами, происходящими из дендритных клеток. Нат Иммунол 3: 1156–1162.
- Трайкович, К., Хсу, К., Кьянтиа, С., Rajendran, L., Wenzel, D., Wieland, F., et al . (2008)Ceramide запускает отпочкование экзосомных везикул в мультивезикулярные эндосомы. Наука 319: 1244–1247.
- Trocoli Torrecilhas, A.C., Tonelli, R.R., Pavanelli, W.R., da Silva, J.S., Schumacher, R.I., de Souza, W., et al . (2009) Trypanosoma cruzi : везикулы, выделяемые паразитом, усиливают паразитарное поражение сердца и вызывают интенсивную воспалительную реакцию. Микробы заражают 11: 29–39.
- Twu, O., de Miguel, N., Lustig, G., Stevens, GC, Vashisht, A.A., Wohlschlegel, JA, and Johnson, PJ (2013) Экзосомы Trichomonas vaginalis доставляют груз клеткам-хозяевам и опосредуют взаимодействия хостратиопаразитов. PLoS Pathog 9: e1003482.
- Валади, Х., Экстром К., Боссиос А., Сьостранд М., Ли Дж.Дж. и Лотвалл Дж.О. (2007) Опосредованный экзосомами перенос мРНК и микроРНК представляет собой новый механизм генетического обмена между клетками. Nat Cell Biol 9: 654–659.
- Вассмер, С.С., Комбес, В., Кандал, Ф.Дж., Юхан-Ваг, И., и Грау, Г.Е. (2006) Тромбоциты потенцируют изменения эндотелия головного мозга, вызванные Plasmodium falciparum . Infect Immun 74: 645–653.
- Уильямс, Р.Л., и Урбе, С. (2007) Новая форма оборудования ESCRT. Nat Rev Mol Cell Biol 8: 355–368.
- Вольферс, Дж., Лозье, А., Рапозо, Г., Реньо, А., Тери, К., Мазурье, К., и др. . (2001)Экзосомы, полученные из опухоли, являются источником общих антигенов отторжения опухоли для перекрестного примирования ЦТЛ. Nat Med 7: 297–303.
- Якуши Т., Масуда К., Нарита С., Мацуяма С. и Токуда Х. (2000) Новый транспортер ABC, опосредующий отсоединение липидно-модифицированных белков от мембран. Nat Cell Biol 2: 212–218.
Gale Apps — Технические трудности
Технические трудности
Приложение, к которому вы пытаетесь получить доступ, в настоящее время недоступно.Приносим свои извинения за доставленные неудобства. Повторите попытку через несколько секунд.
Если проблемы с доступом сохраняются, обратитесь за помощью в наш отдел технической поддержки по телефону 1-800-877-4253. Еще раз спасибо, что выбрали Gale, обучающую компанию Cengage.
org.springframework.remoting.RemoteAccessException: невозможно получить доступ к удаленной службе [authorizationService@theBLISAuthorizationService]; вложенным исключением является Ice.Неизвестное исключение unknown = «java.lang.IndexOutOfBoundsException: индекс 0 выходит за границы для длины 0 в java.base/jdk.internal.util.Preconditions.outOfBounds(Preconditions.java:64) в java.base/jdk.internal.util.Preconditions.outOfBoundsCheckIndex(Preconditions.java:70) в java.base/jdk.internal.util.Preconditions.checkIndex(Preconditions.java:248) в java.base/java.util.Objects.checkIndex(Objects.java:372) на Яве.база/java.util.ArrayList.get(ArrayList.java:458) в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.populateSessionProperties(LazyUserSessionDataLoaderStoredProcedure.java:60) в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.reQuery(LazyUserSessionDataLoaderStoredProcedure.java:53) в com.gale.blis.data.model.session.UserGroupEntitlementsManager.reinitializeUserGroupEntitlements(UserGroupEntitlementsManager.ява:30) в com.gale.blis.data.model.session.UserGroupSessionManager.getUserGroupEntitlements(UserGroupSessionManager.java:17) в com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getProductSubscriptionCriteria(CrossSearchProductContentModuleFetcher.java:244) на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getSubscribedCrossSearchProductsForUser(CrossSearchProductContentModuleFetcher.ява:71) на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getAvailableContentModulesForProduct(CrossSearchProductContentModuleFetcher.java:52) на com.gale.blis.api.authorize.strategy.productentry.strategy.AbstractProductEntryAuthorizer.getContentModules(AbstractProductEntryAuthorizer.java:130) на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.isAuthorized(CrossSearchProductEntryAuthorizer.ява:82) на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.authorizeProductEntry(CrossSearchProductEntryAuthorizer.java:44) на com.gale.blis.api.authorize.strategy.ProductEntryAuthorizer.authorize(ProductEntryAuthorizer.java:31) в com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody0(BLISAuthorizationServiceImpl.java:57) на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody1$advice(BLISAuthorizationServiceImpl.ява: 61) на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize(BLISAuthorizationServiceImpl.java:1) на com.gale.blis.auth._AuthorizationServiceDisp._iceD_authorize(_AuthorizationServiceDisp.java:141) в com.gale.blis.auth._AuthorizationServiceDisp._iceDispatch(_AuthorizationServiceDisp.java:359) в IceInternal.Incoming.invoke(Incoming.java:209) в Ice.ConnectionI.invokeAll(ConnectionI.java:2800) на льду.ConnectionI.dispatch(ConnectionI.java:1385) в Ice.ConnectionI.message(ConnectionI.java:1296) в IceInternal.ThreadPool.run(ThreadPool.java:396) в IceInternal.ThreadPool.access$500(ThreadPool.java:7) в IceInternal.ThreadPool$EventHandlerThread.run(ThreadPool.java:765) в java.base/java.lang.Thread.run(Thread.java:834) » org.springframework.remoting.ice.IceClientInterceptor.convertIceAccessException(IceClientInterceptor.java:365) org.springframework.remoting.ice.IceClientInterceptor.invoke(IceClientInterceptor.java:327) org.springframework.remoting.ice.MonitoringIceProxyFactoryBean.invoke(MonitoringIceProxyFactoryBean.java:71) org.springframework.aop.framework.ReflectiveMethodInvocation.proceed(ReflectiveMethodInvocation.java:186) org.springframework.aop.framework.JdkDynamicAopProxy.invoke(JdkDynamicAopProxy.java:212) com.sun.proxy.$Proxy130.authorize(Неизвестный источник) com.gale.auth.service.BlisService.getAuthorizationResponse(BlisService.java:61) com.gale.apps.service.impl.MetadataResolverService.resolveMetadata(MetadataResolverService.java:65) com.gale.apps.controllers.DiscoveryController.resolveDocument(DiscoveryController.java:57) ком.gale.apps.controllers.DocumentController.redirectToDocument(DocumentController.java:22) jdk.internal.reflect.GeneratedMethodAccessor305.invoke (неизвестный источник) java.base/jdk.internal.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.base/java.lang.reflect.Method.invoke(Method.java:566) org.springframework.web.method.support.InvocableHandlerMethod.doInvoke(InvocableHandlerMethod.ява: 215) org.springframework.web.method.support.InvocableHandlerMethod.invokeForRequest(InvocableHandlerMethod.java:142) org.springframework.web.servlet.mvc.method.annotation.ServletInvocableHandlerMethod.invokeAndHandle(ServletInvocableHandlerMethod.java:102) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.invokeHandlerMethod (RequestMappingHandlerAdapter.java:895) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.handleInternal (RequestMappingHandlerAdapter.java:800) org.springframework.web.servlet.mvc.method.AbstractHandlerMethodAdapter.handle(AbstractHandlerMethodAdapter.java:87) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:1038) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:942) орг.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:998) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:890) javax.servlet.http.HttpServlet.service(HttpServlet.java:626) org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:875) javax.servlet.http.HttpServlet.service(HttpServlet.java:733) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:227) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:53) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.apache.catalina.filters.HttpHeaderSecurityFilter.doFilter(HttpHeaderSecurityFilter.java:126) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.servlet.resource.ResourceUrlEncodingFilter.doFilter(ResourceUrlEncodingFilter.java:63) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:130) org.springframework.boot.web.servlet.support.ErrorPageFilter.access$000(ErrorPageFilter.java:66) org.springframework.boot.web.servlet.support.ErrorPageFilter$1.doFilterInternal(ErrorPageFilter.java:105) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:123) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.springframework.boot.actuate.web.trace.servlet.HttpTraceFilter.doFilterInternal(HttpTraceFilter.java:90) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) орг.springframework.web.filter.RequestContextFilter.doFilterInternal (RequestContextFilter.java: 99) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.FormContentFilter.doFilterInternal (FormContentFilter.java: 92) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.HiddenHttpMethodFilter.doFilterInternal (HiddenHttpMethodFilter.ява:93) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:154) орг.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:122) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.doFilterInternal(WebMvcMetricsFilter.java:107) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) орг.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:200) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.core.StandardWrapperValve.invoke(StandardWrapperValve.java:202) org.apache.catalina.core.StandardContextValve.invoke(StandardContextValve.java:97) org.apache.catalina.authenticator.AuthenticatorBase.invoke(AuthenticatorBase.java:542) org.apache.catalina.core.StandardHostValve.invoke(StandardHostValve.java:143) org.apache.каталина.клапаны.ErrorReportValve.invoke(ErrorReportValve.java:92) org.apache.catalina.valves.AbstractAccessLogValve.invoke(AbstractAccessLogValve.java:687) org.apache.catalina.core.StandardEngineValve.invoke(StandardEngineValve.java:78) org.apache.catalina.connector.CoyoteAdapter.service(CoyoteAdapter.java:357) org.apache.coyote.http11.Http11Processor.service(Http11Processor.java:374) орг.apache.койот.AbstractProcessorLight.process(AbstractProcessorLight.java:65) org.apache.coyote.AbstractProtocol$ConnectionHandler.process(AbstractProtocol.java:893) org.apache.tomcat.util.net.NioEndpoint$SocketProcessor.doRun(NioEndpoint.java:1707) org.apache.tomcat.util.net.SocketProcessorBase.run(SocketProcessorBase.java:49) java.base/java.util.concurrent.ThreadPoolExecutor.runWorker(ThreadPoolExecutor.java:1128) Ява.base/java.util.concurrent.ThreadPoolExecutor$Worker.run(ThreadPoolExecutor.java:628) org.apache.tomcat.util.threads.TaskThread$WrappingRunnable.run(TaskThread.java:61) java.base/java.lang.Thread.run(Thread.java:834)
.
 д.
д.