Мир дикой природы на wwlife.ru
Оглавление |
|
1. |
|
2. |
|
3. |
|
4. |
|
5. |
|
6. |
|
7. |
|
8. |
|
5. Питание и обмен веществ у простейших
По способам и характеру питания, по типу обмена веществ простейшие обнару-живают большое разнообразие.
Рис. 5.1 Последовательные стадии заглатывание пищи амебой (Amoeba terricola).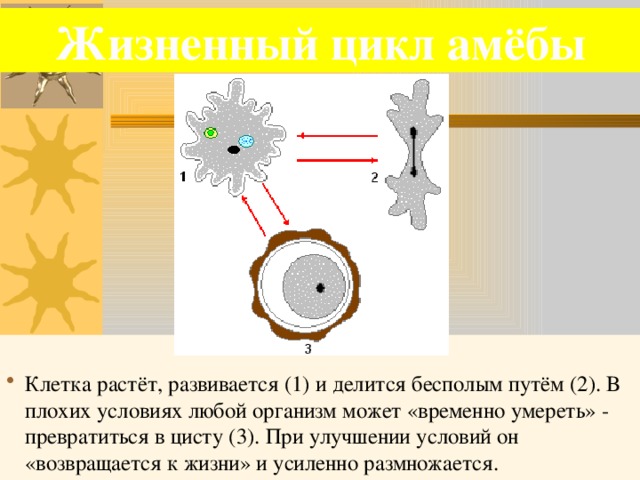
Рис. 5.2 Питание инфузории туфельки. 1 — пищеварительные вакуоли; 2 -ротовое отверстие; 3 — порошица; 4 — реснички; 5 — сократительная вакуоль.. Но наряду с ними в пределах того же класса жгутиконосцев имеются бесцветные (лишенные хлорофилла) организмы, неспособные к фотосинтезу и обладающие гетеротрофным (животным) типом обмена веществ, т. е. питающиеся за счет готовых органических веществ. Способы животного питания простейших, так же как и характер их пищи, очень разнообразны. Наиболее просто устроенные простейшие не обладают специальными органоидами захвата пищи. У амеб, например, псевдоподии служат не только для движения, но вместе с тем и для захвата оформленных частиц пищи (рис. 5.1). У инфузорий для захвата пищи служит ротовое отверстие (рис. 5.2). С последним обычно связаны разнообразные структуры — околоротовые мерцательные перепонки (мембранеллы), способствующие направлению пищевых частиц к ротовому отверстию и далее в особую трубку, ведущую в эндоплазму — клеточную глотку.
5.1). У инфузорий для захвата пищи служит ротовое отверстие (рис. 5.2). С последним обычно связаны разнообразные структуры — околоротовые мерцательные перепонки (мембранеллы), способствующие направлению пищевых частиц к ротовому отверстию и далее в особую трубку, ведущую в эндоплазму — клеточную глотку.
Пища простейших очень разнообразна. Одни питаются мельчайшими организмами, например бактериями, другие — одноклеточными водорослями, некоторые являются хищниками, пожирающими других простейших, и т. п. Непереваренные остатки пищи выбрасываются наружу — у саркодовых на любом участке тела, у инфузорий через особое отверстие в пелликуле (порошица 3 рис. 5.2).
У пресноводных и у части морских простейших имеется особый органоид, связанный с регуляцией осмотического давления в клетке простейшего и с выделением. Это сократительная вакуоля 5 (рис.5.2). Она представляет собой периодически появляющийся в цитоплазме пузырек, наполняющийся жидкостью и опорожняющийся наружу.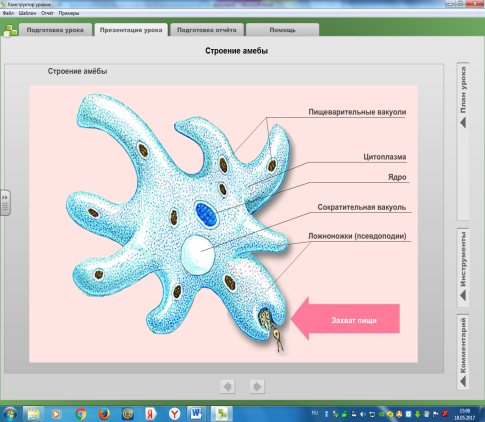 Сократительная вакуоля регулирует количество воды в цитоплазме, поступающей из окружающей среды благодаря разности осмотических давлений. У паразитических простейших и у многих морских форм, живущих в среде с повышенным осмотическим давлением, сократительные вакуоли отсутствуют.
Сократительная вакуоля регулирует количество воды в цитоплазме, поступающей из окружающей среды благодаря разности осмотических давлений. У паразитических простейших и у многих морских форм, живущих в среде с повышенным осмотическим давлением, сократительные вакуоли отсутствуют.
Особых органоидов дыхания у простейших нет, они поглощают кислород и выделяют углекислоту всей поверхностью тела.
6. Раздрожимость
Как и все живые существа, простейшие обладают раздражимостью, т. е. способностью отвечать той или иной реакцией на факторы, действующие извне. Простейшие реагируют на механические, химические, термические, световые, электрические и иные раздражения. Реакции простейших на внешние раздражения часто выражаются в изменении направления движения и носят название таксис. Таксисы могут быть положительными, если движение осуществляется в направлении раздражителя, и отрицательными, если оно осуществляется в противоположную сторону.
Рис. 6.1 Инфузория Urocentrum turbo. Базальные зерна ресничек и система эктоплазматических волоконец (фибрилл), выявлякмые методом импрегнации серебром. Реакции многоклеточных животных на раздражения осуществляются под воздействием нервной системы. Многие исследователи пытались обнаружить и у простейших (т. е. в пределах клетки) аналоги нервной системы. Американские ученые, например, описывали у многих инфузорий наличие особого нервного центра (так называемого  В настоящее время, ученые, изучающих тонкие фибриллярные структуры, придерживаются иного мнения об их функциональной роли в клетке простейшего. Экспериментальных доказательств нервной роли фибриллярных структур не получено. Напротив, имеются опытные данные, которые дают возможность предполагать, что у простейших волна возбуждения распространяется непосредственно по наружному слою цитоплазмы — эктоплазме. Что же касается различного рода фибриллярных структур, то они имеют опорное (скелетное) значение и способствуют сохранению формы тела простейшего.
В настоящее время, ученые, изучающих тонкие фибриллярные структуры, придерживаются иного мнения об их функциональной роли в клетке простейшего. Экспериментальных доказательств нервной роли фибриллярных структур не получено. Напротив, имеются опытные данные, которые дают возможность предполагать, что у простейших волна возбуждения распространяется непосредственно по наружному слою цитоплазмы — эктоплазме. Что же касается различного рода фибриллярных структур, то они имеют опорное (скелетное) значение и способствуют сохранению формы тела простейшего.
7. Ядра простейших и их размножение
Как и всякая клетка, простейшие имеют ядро. В ядрах простейших, так же как и в ядрах многоклеточных, имеется оболочка, ядерный сок (кариолимфа), хроматин (хромосомы) и ядрышки. Однако по размерам и строению ядра разные простейшие весьма разнообразны (рис. 7.1). Эти различия обусловлены соотношением структурных компонентов ядра: количеством ядерного сока, количеством и размерами ядрышек (нуклеол), степенью сохранения строения хромосом в интерфазном ядре и т.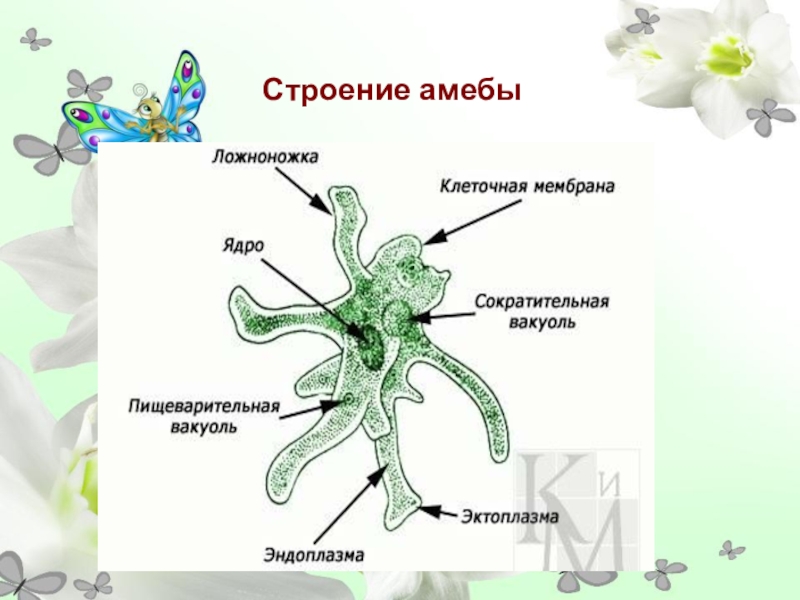
Рис. 7.1 Ядра различных простейших: А — микронуклеус инфузории Paramecium aurelia; Б — жгутиконосец Trypanosoma brucei, В — амеба Amoeba sphaeronuclei; Г — панцирный жгутиконосец Ceratium fuscus; Д — радиолярия Aulacantha scolymantha: Е — макрогаметд кокциди Aggregate eberthi; Ж — макронуклеус инфузории Epidinium ecaudatum. У большинства простейших имеется одно ядро. Однако встречаются и многоядерные виды простейших.
У некоторых простейших, а именно у инфузорий и немногих корненожек — фораминифер, наблюдается интересное явление дуализма (двойственности) ядерного аппарата. Оно сводится к тому, что в теле простейшего имеются два ядра двух категорий, различающиеся как по своему строению, так и по физиологической роли в клетке. У инфузорий, например, имеется два типа ядер: большое, богатое хроматином ядро — макронуклеус и маленькое ядро — микронуклеус. Первое связано с выполнением вегетативных функций в клетке, второе — с половым процессом.
7.2 Бесполое размножение амебы Простейшим, как и всем организмам, свойственно размножение. Существуют две основные формы размножения простейших: бесполое и половое. В основе того и другого лежит процесс деления клетки.
При бесполом размножении (рис. 7.2) число особей возрастает в результате деления. Например, амеба при бесполом размножении делится на две амебы путем перетяжки тела. Процесс этот начинается с ядра, а затем захватывает цитоплазму. Иногда бесполое размножение приобретает характер множественного деления. При этом ядро предварительно делится несколько раз и простейшее становится многоядерным. Вслед за этим цитоплазма распадается на число отдельностей, соответствующих количеству ядер. В результате организм простейшего сразу дает начало значительному количеству мелких особей. Так происходит, например, бесполое размножение малярийного плазмодия — возбудителя малярии человека.
Половое размножение простейших характеризуется тем, что собственно размножению (увеличению числа особей) предшествует половой процесс, характерным признаком которого является слияние двух половых клеток (гамет) или двух половых ядер, ведущее к образованию одной клетки — зиготы, дающей начало новому поколению. Формы полового процесса и полового размножения у простейших в высшей степени разнообразны.
Формы полового процесса и полового размножения у простейших в высшей степени разнообразны.
Многие виды простейших имеют не одну, а несколько форм размножения, которые могут закономерно чередоваться друг с другом. В результате получается сложным цикл развития, отдельные этапы которого могут протекать в разных условиях среды. Особенной сложностью отличаются циклы развития у паразитических простейших в классе споровиков.
8.
Роль простейших в природе Практическое значение простейших для человека велико. В особенности это относится к паразитам. До настоящего времени в тропических зонах земного шара широко распространена малярия — тяжелое заболевание, поражающее ежегодно десятки миллионов человек в Индии и других тропических частях Азии, в Африке и других странах. Возбудитель этого заболевания относится к классу споровиков типа простейших (рис. 8.1). Тяжелым заболеванием человека в Центральной Африке является сонная болезнь, вызываемая паразитом из класса жгутиконосцев.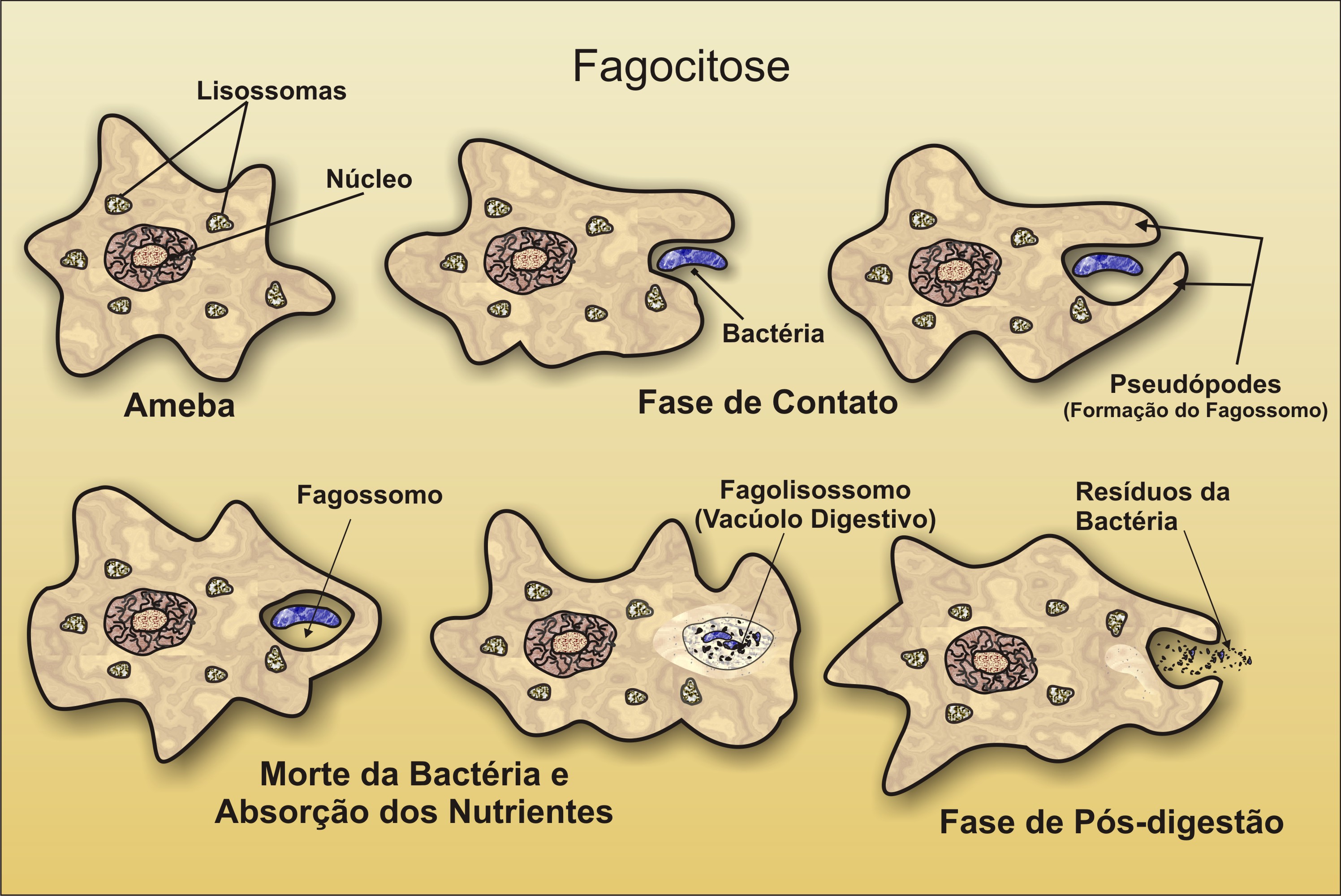 Большой ущерб наносят животноводству заболевания домашних животных, вызываемые простейшими. Сюда относятся различные пироплазмозы, кокцидиозы, трипанозомозы и многие другие.
Большой ущерб наносят животноводству заболевания домашних животных, вызываемые простейшими. Сюда относятся различные пироплазмозы, кокцидиозы, трипанозомозы и многие другие.
Рис. 8.1. Различные разновидности споровиков Имеется ряд простейших паразитов из отряда
Рис. 8.2 Различные виды Фораминифер. Некоторый практический интерес представляют и свободноживущие простейшие. Разные виды их приурочены к определенному комплексу внешних условий, в частности к различному химическому составу воды.
Определенные виды простейших живут при разной степени загрязненности пресных вод органическими веществами. Поэтому по видовому составу простейших можно судить о свойствах воды водоема. Эти особенности простейших используют для санитарно-гигиенических целей при так называемом биологическом анализе воды.
Тип простейших в геологическом отношении является весьма древним. В ископаемом состоянии хорошо сохранились те виды простейших, которые обладали минеральным скелетом (фораминиферы рис. 8.2., радиолярии). Ископаемые остатки их известны начиная с самых древних нижне-кембрийских отложений.
Морские простейшие — корненожки и радиолярии — играли и играют весьма существенную роль в образовании морских осадочных пород. В течение многих миллионов и десятков миллионов лет микроскопически мелкие минеральные скелеты простейших после отмирания животных опускались на дно, образуя здесь мощные морские отложения. При изменении рельефа земной коры, при горнообразовательных процессах в прошлые геологические эпохи, морское дно становилось сушей. Морские осадки превращались в осадочные горные породы. Многие из них, как, например, некоторые известняки, меловые отложения и др., в значительной своей части состоят из остатков скелетов морских простейших.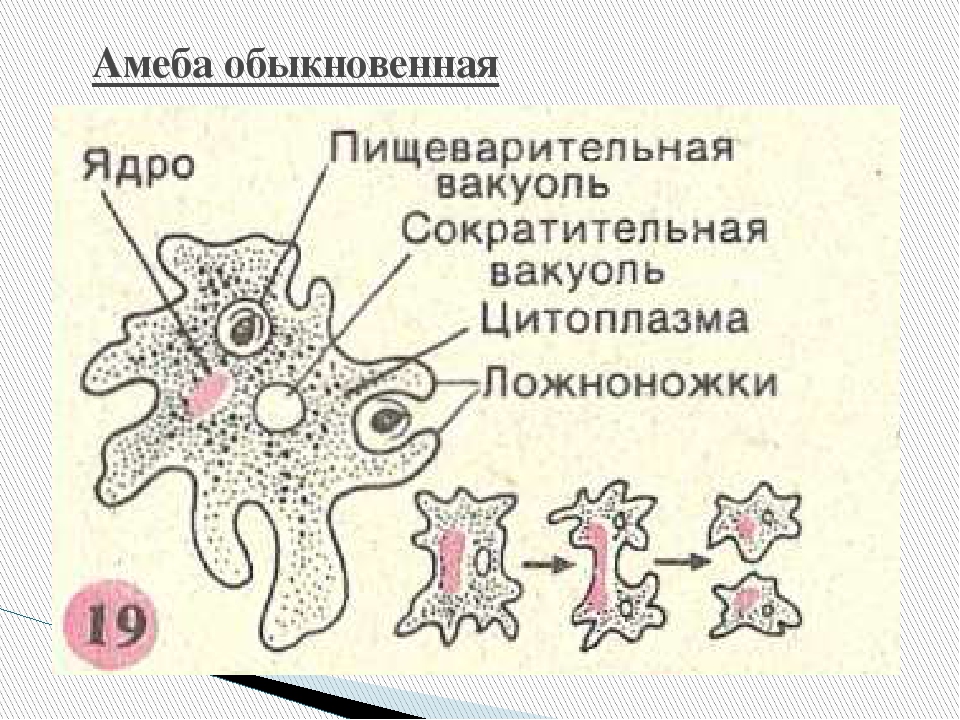 В силу этого изучение палеонтологических остатков простейших играет большую роль в определении возраста разных слоев земной коры и, следовательно, имеет существенное значение при геологической разведке, в частности при разведке полезных ископаемых.
В силу этого изучение палеонтологических остатков простейших играет большую роль в определении возраста разных слоев земной коры и, следовательно, имеет существенное значение при геологической разведке, в частности при разведке полезных ископаемых.
| Источники: | 1. | Жизнь животных. Т.1. стр.65 |
Официальный сайт приемной комиссии УГЛТУ. Используется плагин FooTable
Официальный сайт приемной комиссии УГЛТУ. Используется плагин FooTable — jQueryПравила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
>Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Правила приема, утвержденные организацией самостоятельно ПОСМОТРЕТЬ
Previous NextПамятка абитуриенту Преимущества УГЛТУ
Уральский государственный лесотехнический университет предлагает следующие образовательные программы высшего образования – программы бакалавриата, программы специалитета, программы магистратуры и аспирантуры
Уральский государственный лесотехнический университет предлагает следующие образовательные программы высшего образования – программы бакалавриата, программы специалитета, программы магистратуры и аспирантуры
Приказ (приказы) о зачислении размещаются на сайте приёмной комиссии УГЛТУ, в разделе Документы
ПосмотретьЭтапы энергетического обмена – Российский учебник
Живой организм построен из клеток.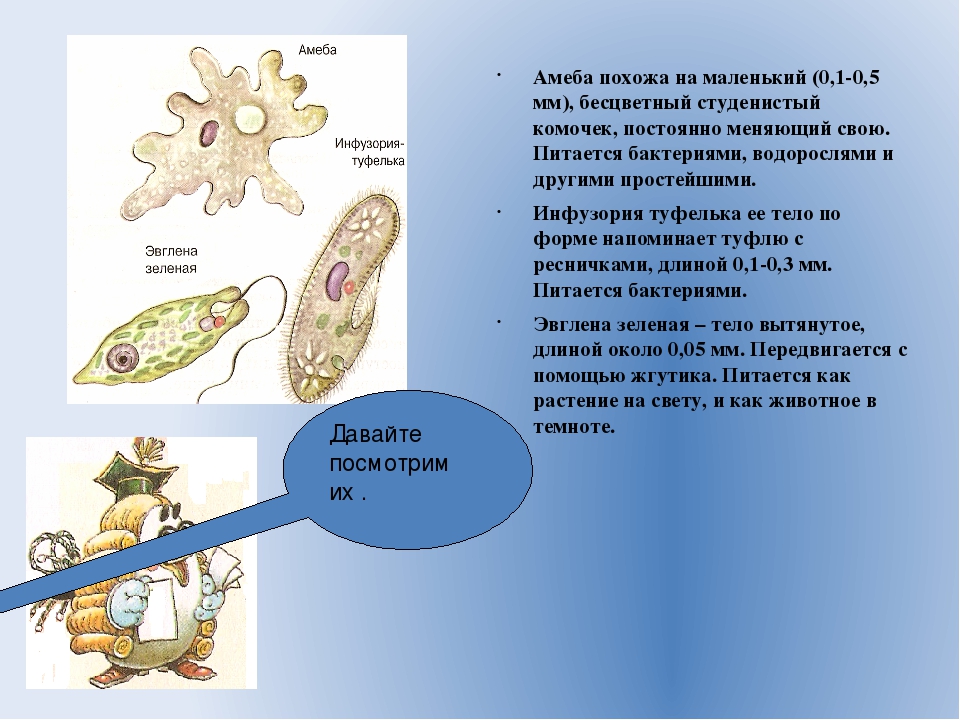 А некоторые, например, амеба или инфузория, состоят из одной клетки. Сложные многоклеточные особи представлены сочетаниями клеток, которые образуют различные системы организма: дыхательную или пищеварительную. Весь организм пронизан клетками нервной ткани, которые обеспечивают регуляцию и управление макроорганизмом.
А некоторые, например, амеба или инфузория, состоят из одной клетки. Сложные многоклеточные особи представлены сочетаниями клеток, которые образуют различные системы организма: дыхательную или пищеварительную. Весь организм пронизан клетками нервной ткани, которые обеспечивают регуляцию и управление макроорганизмом.
Живая клетка от неживой отличается тем, что в ней постоянно и непрерывно протекает два разнонаправленных процесса:
- синтез, или строительство новых органелл (пластический обмен или ассимиляция)
- катаболизм, или разрушение питательных элементов с образованием энергии (энергетический обмен или диссимиляция)
В живых особях баланс между ассимиляцией и диссимиляцией поддерживается не всегда. Если наблюдать за жизнью организма, можно заметить, что сначала тело становится больше по размерам, крепче и выносливее. Чем старше становится организм, тем меньше заметен рост, а в старости начинают преобладать процессы распада, организм не успевает восстанавливаться и погибает.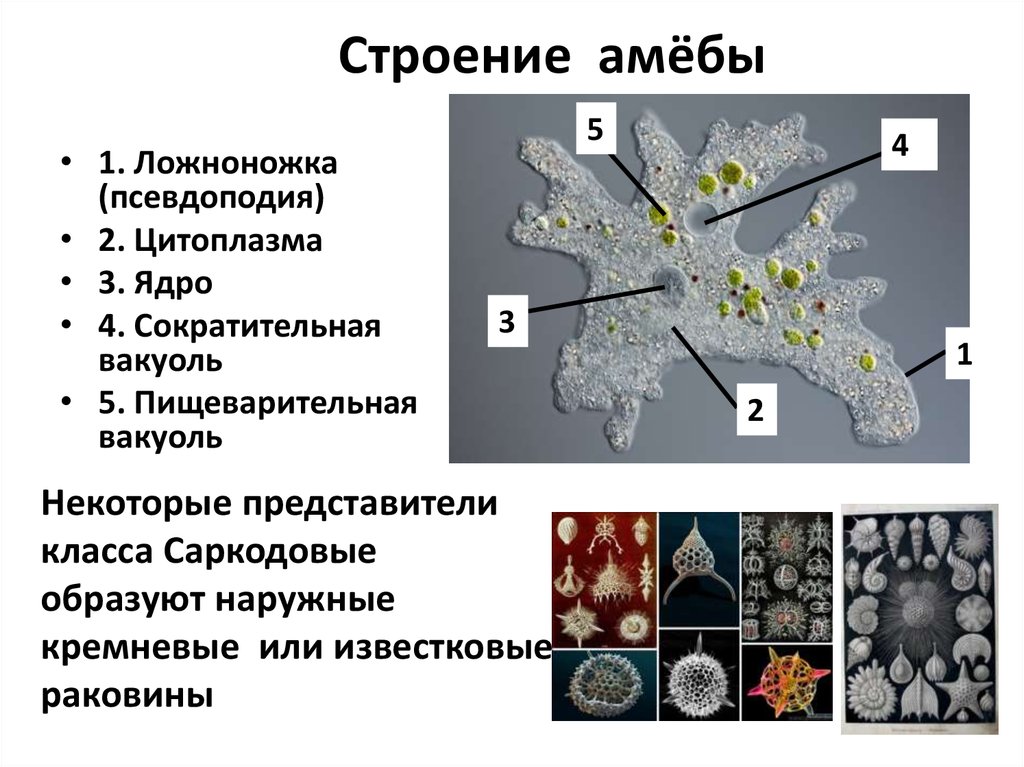
Чтобы машина ехала, ей нужен бензин. А бензин делают из нефти. Чтобы макроорганизм существовал, ему нужна энергия. В учебниках биологии часто можно встретить фразу глюкоза — ресурс энергии для клетки. Это так. Но глюкоза — как нефть для автомобиля. Поэтому сначала глюкозу нужно превратить в бензин. И таким бензином для клетки будет молекула АТФ.
Молекула АТФ известна миру довольно давно. Через десять лет, в 2029 году отпразднует сто лет со дня открытия вещество, благодаря которому в живой клетке поддерживается упорядоченность структур и она может противостоять хаосу и растущей энтропии (почему так происходит, подробно рассказано на странице 30 учебника «Естествознание 11 класс» под редакцией Титова С.А.).
В 1929 году, практически одновременно, сотрудники Института биологии кайзера Вильгельма в Берлине Карл Ломан и Отто Мейергоф и ученые Гарвардской Медицинской школы Сайрус Фиске и Йеллапрагад Суббарао в Гарвардской Медицинской школе опубликовали работы, в которых описали молекулу АТФ.
В 30 годах ХХ века в лаборатории Мейергофа появился молодой ученый, Фриц Липман, который заинтересовался энергетическими аспектами клеточного метаболизма, и в 1941 году талантливый биохимик доказал, что АТФ – основной двигатель энергетических реакций в живой клетке. А в 1953 году его вклад в физиологию совместно с Х. Кребсом был удостоен Нобелевской премии.
АТФ — аденозинтрифосфат, нуклеотид, глобальный ресурс энергии для сложных реакций обмена веществ, происходящих в клетках организма. Схематично молекула АТФ представлена на странице 99 учебника «Естествознание 11 класс» под редакцией Титова С.А..
Вся суть энергетического обмена сводится к решению задачи, как энергию из сложных молекул пищи превратить в молекулу АТФ. В процессе эволюции эта задача была решена.
Так как же булочка из Макдональдса превращается в энергию макроэргических связей АТФ?
В энергетическом обмене выделяют несколько процессов, разделенных не только временем, но и протекающих в различных частях клетки:
- Подготовительный этап
- Гликолиз
- Кислородное окисление
Естествознание. 10 класс. Учебник
10 класс. Учебник
Учебник отличаются качественным современным оформлением, в нём приводятся многочисленные слайды и микрофотографии. Выполняя проблемные, поисковые и исследовательские задания, школьники не только активно усваивают материал, но и учатся мыслить, искать и анализировать информацию из разных источников, в том числе из интернета. Особое внимание уделяется практическим заданиям: ученикам предлагается проводить опыты, конструировать модели, разрабатывать проекты.
КупитьПодготовительный этап у человека и других многоклеточных макроорганизмов начинается в ротовой полости, продолжается в желудочно-кишечном тракте и представляет собой многоступенчатый процесс распада сложных полимеров белков, жиров и углеводов пищи до мономеров.
Из курса химии помним, что во время разрыва связей элементов выделяется энергия. Для образования аденозинтрифосфата этой энергии недостаточно, и она вся уходит во внешнюю среду.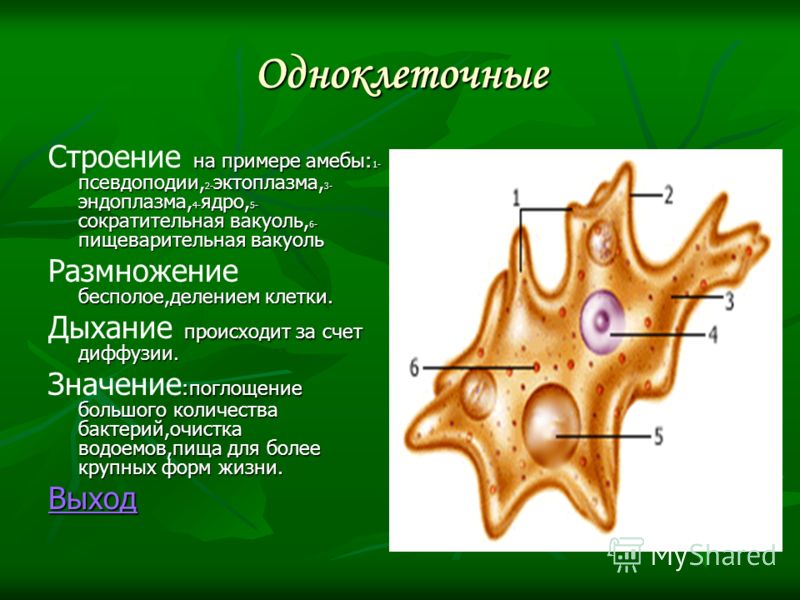
Что же происходит у простых одноклеточных организмов, у которых нет ротиков и животиков? Пища, захваченная одноклеточным организмом, попадает в пищеварительную вакуоль или лизосому, где при помощи ферментов-катализаторов, способствующих пищеварению, протекает начальный этап диссимиляции.
Подготовленные во время предварительного этапа вещества переходят во второй бескислородный этап энергетического обмена, который называется гликолиз.
Два греческих слова (гликос – «сладкий» и лизис – «расщеплять») дали название второй бескислородной фазе энергетического обмена — глико́лизу.
Гликолиз является цепочкой из 10 биохимических превращений, итогом которых является трансформация стабильной молекулы глюкозы в трехуглеродные молекулы пирувата, – или пировиноградной кислоты.
Что ещё почитать?
«Подождите, – могут сказать дотошные ученики, – глюкоза у нас находится в пищеварительной системе. А процессы метаболизма идут в клетках по всему организму, например, на кончике носа или задней лапе. Как же попадает глюкоза в цитоплазму клетки во всем организме?».
А процессы метаболизма идут в клетках по всему организму, например, на кончике носа или задней лапе. Как же попадает глюкоза в цитоплазму клетки во всем организме?».Глюкоза всасывается в желудочно-кишечном тракте, попадает в кровоток, током крови разносится ко всем тканям и клеткам организма, и благодаря белку-переносчику инсулину попадает в клетку.
Цитоплазма отдельной клетки – место осуществления реакций гликолиза. Энергии при этом выделяется совсем немного. Ее хватает лишь на формирование 2-х молекул АТФ. Казалось бы, энергия получена, и процесс может остановиться. Так и происходит у некоторых бактерий. Но никакому нормальному многоклеточному организму таких запасов АТФ не хватит. В пировиноградной кислоте остался еще достаточный запас энергии, которую тоже хотелось бы использовать макроорганизму.
Естествознание. 11 класс. Учебник
Учебник отличаются качественным современным оформлением, в нём приводятся многочисленные слайды и микрофотографии. Выполняя проблемные, поисковые и исследовательские задания, школьники не только активно усваивают материал, но и учатся мыслить, искать и анализировать информацию из разных источников, в том числе из интернета. Особое внимание уделяется практическим заданиям: ученикам предлагается проводить опыты, конструировать модели, разрабатывать проекты.
КупитьУ многоклеточных тел пируват переходит в третью фазу диссимиляции — клеточное дыхание в митохондриях. Дыханием процесс называется, поскольку в ходе химических реакций в митохондриях происходит потребление кислорода и выделение углекислого газа в цитоплазму клетки, а дальше, с помощью кровообращения и дыхания, – во внешнюю среду.
Клеточное дыхание представлено двумя этапами:
- цикл Кребса, протекающий в матриксе митохондрий
- окислительное фосфорилирование, протекающее на кристах митохондрий при участии ферментов дыхательной цепи
Итогом кислородного этапа энергетического обмена является выделение количества энергии, достаточного для образования 36 молекул АТФ, воды и СО2. При этом нужно помнить, что аденозинтрифосфат содержит три остатка фосфата, а макроэргических связей образуется только две. Суммарное уравнение биохимических реакций, протекающих в третьей фазе диссимиляции, можно записать так:
2C3H4O3+6O2+36H3PO4+36АДФ=6CO2+42H2O+36АТФ
В итоге этих реакций происходит накопление огромного количества энергии — 36 молекул аденозинтрифосфата против 2-х, что запасаются в процессе гликолиза. Однако поскольку эта фаза требует кислорода для своих реакций, в бескислородной среде процесс протекать не может.
При дефиците кислорода пируват окисляется до лактата. Именно ему принадлежит ощущение приятной боли после хорошей тренировки. У хорошо тренированных людей с активным кровоснабжением и хорошо развитой сетью капилляров нужно затратить большую физическую нагрузку перед тем, как начнет накапливаться молочная кислота.
Вспомним, что еще 2 молекулы аденозинтрифосфата накапливаются на этапе гликолиза. Таким образом, при распаде одной молекулы глюкозы образуется 38 молекул АТФ.
На портале LECTA В параграфе 22 учебника «Естествознание 11 класс» под редакцией Титова С.А. внимательные ученики найдут ответ на вопрос, почему цианистый калий – любимое средство убийц в детективных романах.
ТестВыделение. Обмен веществ | Биология
Выделение — процесс, обеспечивающий выведение из организма образующихся в процессе жизнедеятельности вредных веществ, избытка воды и солей. В совокупности с процессами дыхания и питания он обеспечивает обмен веществ —основу жизнедеятельности любого организма.
Выделение у растений
Процесс выделения вред, них веществ у одноклеточных водорослей происходит с помощью сократительных вакуолей. Вместе с этими веществами выделяется и избыток воды. Это предохраняет цитоплазму от разжижения, а клетку — от разбухания.
Многоклеточные водоросли и наземные растения выделяют продукты распада всей поверхностью тела. Однако многие продукты жизнедеятельности накапливаются в вакуолях и выводятся через особые образования — железки, волоски и нектарники. В этих случаях выделяемые растениями вещества выполняют дополнительные функции: привлекают насекомых-опылителей, защищают растения от болезнетворных грибов и микроорганизмов, отпугивают травоядных животных.
Листопадные растения освобождаются от накопившихся вредных веществ, сбрасывая листья.
Выделения у животных
У многие одноклеточных животных, обитающих в водной среде (амеба), как и у одноклеточных водорослей вредные вещества из организма выводятся через сократительные вакуоли. У кишечнополостных животных (гидра, медузы) продукты обмена выделяются так же, как у водорослей — всей поверхностью тела. У многих ракообразных и паукообразных вредные вещества откладываются в тканях покровов, которые сбрасываются во время линьки.
У большинства животных есть специальные органы выделения. Наиболее примитивная выделительная система у плоских червей. Она представлена тонкими извилистыми канальцами. Один конец канальца начинается в теле животного, а другой открывается наружу выделительной порой.
У дождевого червя некоторые продукты жизнедеятельности выделяются в полость тела. Сюда выходят воронки — расширение канальцев. В них поступает полостная жидкость с ненужными организму веществами.
У животных с более сложным строением (рыбы, змеи, птицы, звери) главный орган выделения вредных веществ — почки. Это парный орган. Почек в организме две.
Обмен веществ
Известно, что вещества, попадающие в клетки из внешней среды, не остаются неизменными. В каждой клетке идет образование более сложных веществ из менее сложных. Одновременно с этим происходят процессы распада сложных веществ на более простые. Часть простых веществ выделяется обратно в окружающую среду, а часть служит материалом для образования новых веществ. Взаимосвязанные процессы поглощения, создания, разрушения, передвижения и выделения составляют обмен веществ. Это главный признак живых организмов. С прекращением обмена веществ живой организм умирает. Обмен веществ всегда связан с превращением энергии — ее накоплением в сложных веществах и выделением в процессе их распада. Обмен веществ, происходящий внутри каждого организма, обеспечивает взаимосвязь организмов со средой обитания и является основой для биологического круговорота веществ и энергии.
Метаболизм | Биология для майоров II
Результаты обучения
- Опишите метаболическое разнообразие простейших
Протисты питаются разными способами и могут быть аэробными или анаэробными. Те, которые накапливают энергию посредством фотосинтеза, принадлежат к группе фотоавтотрофов и характеризуются наличием хлоропластов. Другие протисты являются гетеротрофными и потребляют органические материалы (например, другие организмы) для получения питания.Амебы и некоторые другие виды гетеротрофных протистов поглощают частицы в процессе, называемом фагоцитоз , при котором клеточная мембрана захватывает частицу пищи и приносит ее внутрь, отщипывая внутриклеточный мембранный мешок или везикулу, называемую пищевой вакуолью (рис. 1). У некоторых протистов пищевые вакуоли могут образовываться где угодно на поверхности тела, тогда как у других они могут ограничиваться основанием специализированной структуры питания. Везикула, содержащая проглоченную частицу, фагосому, затем сливается с лизосомой, содержащей гидролитические ферменты, с образованием фаголизосомы , а частица пищи распадается на небольшие молекулы, которые могут диффундировать в цитоплазму и использоваться в клеточном метаболизме.Непереваренные остатки в конечном итоге выводятся из клетки посредством экзоцитоза .
Рис. 1. Стадии фагоцитоза включают поглощение пищевой частицы, переваривание частицы с использованием гидролитических ферментов, содержащихся в лизосоме, и изгнание непереваренных материалов из клетки.
Подтипы гетеротрофов, называемые сапробиями, поглощают питательные вещества из мертвых организмов или их органических отходов. Некоторые простейшие могут функционировать как миксотрофы , получая питание фотоавтотрофными или гетеротрофными путями, в зависимости от наличия солнечного света или органических питательных веществ.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Амеба протей — microbewiki
Классификация
Домен; Эукариоты
Королевство; Амебозоа
Тип; Tubulinea
класс; Лобода
Заказать; Tubulinea
семейство; Амебы
Род; Амеба
Виды; Протей [5]
Виды
Амеба протей
Описание и значение
Amoeba proteus получила свое название благодаря двум греческим словам; Амеба означает изменение, а протей означает Бог Моря.Греческое значение описывает этот микроб как Морской Бог Протей, который имеет постоянно меняющуюся форму. Его способность изменять форму происходит от псевдоподий, которые часто встречаются у эукариотических микробов. Псевдоподии дают микробу возможность расширяться и сжиматься в любую возможную форму. Это расширение и сжатие происходит из-за обратимой сборки актиновых субъединиц в микрофиламенты. Сокращение вызвано взаимодействием волокон около конца клетки с миозином. А расширение вызвано тем, что актин снова собирается в свое тело.Так передвигается амеба протей. [2]
Помимо псевдоподий, Amoeba proteus может быть описана как одноклеточная, бесцветная или прозрачная. Средний размер Amoeba proteus варьируется от 0,2 до 0,3 мм в диаметре, но были обнаружены более крупные формы диаметром до 0,5 мм, видимые глазу. [3] Amoeba proteus предпочитает жить в чистых прудах с насыщенной кислородом пресной водой. Он встречается в крупных экосистемах с пищевыми перепонками, в которых много водорослей и растений.Поскольку он неблагоприятен для света, он укрывается под чем-нибудь, что дает тень, обычно под лилиями. [2]
Выловить Amoeba proteus довольно легко, поскольку она тяготеет к продуктам из пшеницы. Если оставить банку с рисом, приготовленным около 1 минуты, это привлечет этот микроб и даже создаст для него репродуктивную среду. Всего за несколько дней в банке будет поймано много Amoeba proteus и появится их нерест. Выращивать этот микроб тоже довольно просто. Это можно сделать, создав среду, похожую на пруд, с листьями, пресной чистой водой, грязью и несколькими зернами пшеницы.Амеба была получена в лаборатории в различных формах, таких как органический ил от гниющей растительности, а также на нижней поверхности лилий. [2]
Структура генома
Геном Amoeba proteus очень большой и содержит более 290 миллиардов пар оснований в его геноме, из которых 34% составляют G-C. Его длина составляет 3 869 нуклеотидов, и он имеет форму круга с тремя белками. [1] Amoeba proteus считается полиплоидией, потому что у нее более 500 хромосом в одном ядре.[3] Вот пример того, как выглядит полиплоидия. [7]
Структура, метаболизм и жизненный цикл клетки
В дополнение к своему названию, Amoeba proteus имеет аморфную природу и постоянно меняет свою форму и форму из-за способности организма образовывать псевдоподии. Это «временные проекции» цитоплазмы, которые позволяют организму быть мобильными и используются для получения и усвоения потребностей организма в питательных веществах. [3]
Эукариотическая по своей природе Amoeba proteus имеет многочисленные мембраносвязанные клеточные органеллы, необходимые для поддержания жизни.Интересны пищевые вакуоли, расположенные в эндоплазме. Эти структуры не проницаемы и образуются только тогда, когда организм потребляет пищу, а затем исчезают. [5]
Amoeba proteus — это свободноживущий хемоорганический гетеротроф, энергия которого получена из химических источников, таких как сахар, жирные кислоты и глицерин. Органические субстраты действуют как доноры электронов, а углерод получают из органических веществ. Рацион Amoeba proteus всеяден по своей природе и состоит из множества других более мелких микроорганизмов, таких как бактерии, диатомовые водоросли и другие водные растения.[5]
Amoeba proteus использует аэробное дыхание. Кислород диффундирует через его поверхностную мембрану и посредством передачи энергии обеспечивает организм энергией. Отходы выводятся путем диффузии. К ним относятся углекислый газ, образующийся при дыхании, и другие азотсодержащие отходы. [3]
Amoeba proteus размножается бесполым путем и имеет несколько механизмов для этого, в зависимости от окружающей среды: 1. Бинарное деление — наиболее распространенный метод размножения, 2. Споруляция — неблагоприятные обстоятельства, существующие в окружающей среде.Encystment / Multiple Fission — неблагоприятные обстоятельства, существующие в окружающей среде, 4. Конъюгация и 5. Регенерация. [3]
Экология и патогенез
Amoeba proteus обитает в пресноводных водных средах, таких как пруды, ручьи, лужи или влажные среды, в которых преобладают почва или растения. [3] Хотя многие виды Amoeba могут действовать как патогены, Amoeba proteus не является патогенным и не способна вызывать заболевания у других организмов. Напротив, потребление более мелких организмов в качестве источника пищи определяет хищную природу.Amoeba proteus может служить хозяином для патогенной инфекции. [6]
Список литературы
[1] «Альфа Proteobacterium Endosymbiont плазмиды PAP3.9 Amoeba Proteus, полная последовательность». Интернет. 24 апреля 2011 г.
[2] «Амеба протей». Амеба протей. Средняя школа Лэнгстона. Интернет. 10 апреля 2011 г.
[3] Bhamrah, H.S. & Кавита Джунджа. Введение в простейшие. Нью-Дели, Индия: Anmol Publications Pvt, 2001.
[4] Буш, Альберт. Паратизм; Разнообразие и экология паразитов животных. Кембридж, Соединенное Королевство: Синдикат прессы Кембриджского университета, 2001.
[5] Buzzle. Классификация амеб. [Онлайн] Доступно по адресу http://www.buzzle.com/articles/classification-of-amoeba-ameba.html, 24 апреля 2011 г.
[6] Hentschel, Ute.«Общие молекулярные механизмы симбиоза и патогенеза». Тенденции в микробиологии Том 8. Выпуск 5 (1 мая 2000 г.): Страницы: 226-231.
[7] «Портал полиплоидии». Главная страница — Портал полиплоидии. Интернет. 24 апреля 2011 г.
Автор
Страница, созданная Жюлем Патри и Меган Робб, студенткой профессора Джея Леннона из Университета штата Мичиган.
Амеба протей — microbewiki
Классификация
Домен; Эукариоты
Королевство; Амебозоа
Тип; Tubulinea
класс; Лобода
Заказать; Tubulinea
семейство; Амебы
Род; Амеба
Виды; Протей [5]
Виды
Амеба протей
Описание и значение
Amoeba proteus получила свое название благодаря двум греческим словам; Амеба означает изменение, а протей означает Бог Моря.Греческое значение описывает этот микроб как Морской Бог Протей, который имеет постоянно меняющуюся форму. Его способность изменять форму происходит от псевдоподий, которые часто встречаются у эукариотических микробов. Псевдоподии дают микробу возможность расширяться и сжиматься в любую возможную форму. Это расширение и сжатие происходит из-за обратимой сборки актиновых субъединиц в микрофиламенты. Сокращение вызвано взаимодействием волокон около конца клетки с миозином. А расширение вызвано тем, что актин снова собирается в свое тело.Так передвигается амеба протей. [2]
Помимо псевдоподий, Amoeba proteus может быть описана как одноклеточная, бесцветная или прозрачная. Средний размер Amoeba proteus варьируется от 0,2 до 0,3 мм в диаметре, но были обнаружены более крупные формы диаметром до 0,5 мм, видимые глазу. [3] Amoeba proteus предпочитает жить в чистых прудах с насыщенной кислородом пресной водой. Он встречается в крупных экосистемах с пищевыми перепонками, в которых много водорослей и растений.Поскольку он неблагоприятен для света, он укрывается под чем-нибудь, что дает тень, обычно под лилиями. [2]
Выловить Amoeba proteus довольно легко, поскольку она тяготеет к продуктам из пшеницы. Если оставить банку с рисом, приготовленным около 1 минуты, это привлечет этот микроб и даже создаст для него репродуктивную среду. Всего за несколько дней в банке будет поймано много Amoeba proteus и появится их нерест. Выращивать этот микроб тоже довольно просто. Это можно сделать, создав среду, похожую на пруд, с листьями, пресной чистой водой, грязью и несколькими зернами пшеницы.Амеба была получена в лаборатории в различных формах, таких как органический ил от гниющей растительности, а также на нижней поверхности лилий. [2]
Структура генома
Геном Amoeba proteus очень большой и содержит более 290 миллиардов пар оснований в его геноме, из которых 34% составляют G-C. Его длина составляет 3 869 нуклеотидов, и он имеет форму круга с тремя белками. [1] Amoeba proteus считается полиплоидией, потому что у нее более 500 хромосом в одном ядре.[3] Вот пример того, как выглядит полиплоидия. [7]
Структура, метаболизм и жизненный цикл клетки
В дополнение к своему названию, Amoeba proteus имеет аморфную природу и постоянно меняет свою форму и форму из-за способности организма образовывать псевдоподии. Это «временные проекции» цитоплазмы, которые позволяют организму быть мобильными и используются для получения и усвоения потребностей организма в питательных веществах. [3]
Эукариотическая по своей природе Amoeba proteus имеет многочисленные мембраносвязанные клеточные органеллы, необходимые для поддержания жизни.Интересны пищевые вакуоли, расположенные в эндоплазме. Эти структуры не проницаемы и образуются только тогда, когда организм потребляет пищу, а затем исчезают. [5]
Amoeba proteus — это свободноживущий хемоорганический гетеротроф, энергия которого получена из химических источников, таких как сахар, жирные кислоты и глицерин. Органические субстраты действуют как доноры электронов, а углерод получают из органических веществ. Рацион Amoeba proteus всеяден по своей природе и состоит из множества других более мелких микроорганизмов, таких как бактерии, диатомовые водоросли и другие водные растения.[5]
Amoeba proteus использует аэробное дыхание. Кислород диффундирует через его поверхностную мембрану и посредством передачи энергии обеспечивает организм энергией. Отходы выводятся путем диффузии. К ним относятся углекислый газ, образующийся при дыхании, и другие азотсодержащие отходы. [3]
Amoeba proteus размножается бесполым путем и имеет несколько механизмов для этого, в зависимости от окружающей среды: 1. Бинарное деление — наиболее распространенный метод размножения, 2. Споруляция — неблагоприятные обстоятельства, существующие в окружающей среде.Encystment / Multiple Fission — неблагоприятные обстоятельства, существующие в окружающей среде, 4. Конъюгация и 5. Регенерация. [3]
Экология и патогенез
Amoeba proteus обитает в пресноводных водных средах, таких как пруды, ручьи, лужи или влажные среды, в которых преобладают почва или растения. [3] Хотя многие виды Amoeba могут действовать как патогены, Amoeba proteus не является патогенным и не способна вызывать заболевания у других организмов. Напротив, потребление более мелких организмов в качестве источника пищи определяет хищную природу.Amoeba proteus может служить хозяином для патогенной инфекции. [6]
Список литературы
[1] «Альфа Proteobacterium Endosymbiont плазмиды PAP3.9 Amoeba Proteus, полная последовательность». Интернет. 24 апреля 2011 г.
[2] «Амеба протей». Амеба протей. Средняя школа Лэнгстона. Интернет. 10 апреля 2011 г.
[3] Bhamrah, H.S. & Кавита Джунджа. Введение в простейшие. Нью-Дели, Индия: Anmol Publications Pvt, 2001.
[4] Буш, Альберт. Паратизм; Разнообразие и экология паразитов животных. Кембридж, Соединенное Королевство: Синдикат прессы Кембриджского университета, 2001.
[5] Buzzle. Классификация амеб. [Онлайн] Доступно по адресу http://www.buzzle.com/articles/classification-of-amoeba-ameba.html, 24 апреля 2011 г.
[6] Hentschel, Ute.«Общие молекулярные механизмы симбиоза и патогенеза». Тенденции в микробиологии Том 8. Выпуск 5 (1 мая 2000 г.): Страницы: 226-231.
[7] «Портал полиплоидии». Главная страница — Портал полиплоидии. Интернет. 24 апреля 2011 г.
Автор
Страница, созданная Жюлем Патри и Меган Робб, студенткой профессора Джея Леннона из Университета штата Мичиган.
Оценка общего метаболизма Amoeba proteus, измеренная микрокалориметрическим методом
Бандманн, У., Монти, М., Вадсё, И., 1975: Микрокалориметрические измерения производства тепла в цельной крови и клетках крови нормальных людей. Сканд. J. Clin. Лаборатория. Вкладывать деньги. 35 , 121–127.
PubMed Google Scholar
Бизер А. Э., 1980: Микрокалориметрия. Лондон-Нью-Йорк: Academic Press.
Google Scholar
Brachet, J., 1955: Исследование биохимических взаимодействий между моей и цитоплазмой одноклеточных организмов.Биохим. биофиз. Acta 18 , 247–268.
PubMed Google Scholar
Чапман-Андресен, К., 1965: индукция пиноцитоза у амеб . Arch. Биол. (Льеж) 76 , 189–207.
Google Scholar
-, 1967: Влияние метаболических ингибиторов на пиноцитоз у амеб . Протоплазма 63 , 103–105.
PubMed Google Scholar
-, 1971: Биология крупных амеб .Аня. Rev. Microbiol. 25 , 27–48.
Google Scholar
Кларк, А. М., 1942: Некоторые эффекты удаления ядра из амебы . Austr. J. exp. Биол. мед. Sci. 20 , 241–247.
Google Scholar
Эсманн, В., 1964: Влияние концентрации клеток на метаболизм нормальных и диабетических лейкоцитов in vitro . Метаболизм 13 , 354–360.
PubMed Google Scholar
Фагер, Б., Монти, М., 1984: проспективное исследование метаболизма тромбоцитов при ревматической болезни сердца. Europ. J. Cardiol. 5 , 55–61.
Google Scholar
Фелдт, Р., Анкерст, Дж., Монти, М., Вадсо, И., 1982: Производство тепла в различных популяциях клеток крови человека, подвергшихся воздействию иммунных комплексов in vitro ; важность Fc-частей иммуноглобулинов и влияние активного комплемента.Иммунология 46 , 189–197.
PubMed Google Scholar
Гайтон, А. К., 1981: Учебник медицинской физиологии, 882. Филадельфия: В. Б. Сондерс.
Google Scholar
Хедесков, К., Эсманн, В., 1966: Дыхание и гликоз нормальных лимфоцитов человека. Кровь 28 , 163–174.
PubMed Google Scholar
Ханссон, С.Э., Йоханссон, Г., Йозефссон, Дж. О., 1968: Поглощение кислорода во время пиноцитоза у Amoeba proteus . Acta Physiol. Сканд. 73 , 491–500.
PubMed Google Scholar
Джонс, М. В., 1979: Биохимическая термодинамика. Амстердам: Эльзевир.
Google Scholar
Йозефссон, Дж. О., Йоханссон, П., Ханссон, С. Е., 1972: Лекарства и гормоны как модификаторы пиноцитоза, индуцированного ионами натрия в Amoeba proteus .Acta Pharmacol. Toxicol. 31 , доп. 82
Google Scholar
Левин, К., 1973 a: Определение выработки тепла эритроцитами у здоровых людей и пациентов с анемией с помощью проточной микрокалориметрии. Сканд. J. Clin. Лаборатория. Вкладывать деньги. 32 , 55–65.
PubMed Google Scholar
-, 1973 b: Модифицированный проточный микрокалориметр, адаптированный для изучения фагоцитоза человеческих лейкоцитов.Сканд. J. Clin. Лаборатория. Вкладывать деньги. 32 , 67–73.
PubMed Google Scholar
Ljungholm, K., Wadsö, I., Kjellén, L., 1978: Микрокалориметрическое измерение нормальных и инфицированных аденовирусом клеток HeLa. Acta Path. Microbiol. Сканд. № 86 , 121–124.
Google Scholar
Ллойд, Д., Филлипс, К. А., Стэтхэм, М., 1978: Колебания дыхания, уровней адениновых нуклеотидов и тепловыделение в синхронных культурах Tetrahymena pyriformis ST, полученных путем непрерывного отбора в потоке.J. gen. Microbiol. 106 , 19–26.
Google Scholar
Монти, М., Вадсё, И., 1973: Микрокалориметрические измерения производства тепла в эритроцитах человека. Нормальные субъекты и пациенты с анемией. Сканд. J. Clin. Лаборатория. Вкладывать деньги. 32 , 47–54.
PubMed Google Scholar
— -, 1977: Микрокалориметрические исследования метаболизма тромбоцитов человека в состоянии покоя.Влияние pH, температуры, концентрации клеток, способов приготовления и хранения. Сканд. J. Haematol. 19 , 111–115.
PubMed Google Scholar
-, Fäldt, R., Ankerst, J., Wadsö, I., 1980: Новый подход к обнаружению комплексов антиген-антитело с помощью микрокалориметрических измерений производства тепла в клетках крови. J. Immunol. Методы 37 , 29–37.
PubMed Google Scholar
Ньюэлл, Р.D., 1980: Идентификация и характеристика микроорганизмов с помощью микрокалориметрии (Beezer, A.E., ed.), Стр. 163–186 (биологическая микрокалориметрия). Лондон: Academic Press.
Google Scholar
Тифенбруннер, Ф., 1977: Микрокалориметрические исследования водных биотопов (Лампрехт, И., Шааршмидт, Б., ред.), Стр. 305–324 (применение калориметрии в науках о жизни, 6.2). Берлин: Вальтер де Грюйтер.
Google Scholar
Вадсё, И., 1974: Микрокалориметр для биологических наук. Инструменты науки 21 , 18–21.
Google Scholar
Секвенирование генома выявляет метаболическую и клеточную взаимозависимость в симбиозе амеба-кинетопластид
Грелль, К. Г. и Бенвиц, Г. Ultrastruktur mariner Amöben I. Paramoeba eilhardi Schaudinn. Archiv für Protistenkunde 112 , 119–137 (1970).
Google Scholar
Перкинс Ф. О. и Кастанья М. Ультраструктура Nebenkörper или «вторичного ядра» паразитической амебы Paramoeba perniciosa (Amoebida, Paramoebidae). Журнал патологии беспозвоночных 17 , 186–193 (1971).
CAS Статья PubMed Google Scholar
Пейдж, Ф.C. Paramoeba: распространенный морской род. Hydrobiologia 41 , 183–188 (1973).
Артикул Google Scholar
Олланд, А. Идентификация паразитов (Nebenkern) Яницкина пигментифера à у симбионта (Perkinsiella amoebae nov gen — nov sp.) Очевидная aux flagellés Kinetoplastidiés. Protistologica 16 , 613–625 (1980).
Google Scholar
Dyková, I., Fiala, I., Lom, J. & Lukeš, J. Perkinsiella, амебоподобные эндосимбионты Neoparamoeba spp., Родственники кинетопластид Ichthyobodo. Европейский журнал протистологии 39 , 37–52 (2003).
Артикул Google Scholar
Lukeš, J. et al. . Сеть кинетопластов ДНК: эволюция невероятной структуры. Эукариотическая клетка 1 , 495–502 (2002).
Артикул PubMed PubMed Central Google Scholar
Симпсон А.Г., Стивенс Дж. Р. и Лукеш Дж. Эволюция и разнообразие кинетопластидных жгутиконосцев. Тенденции в паразитологии 22 , 168–174 (2006).
CAS Статья PubMed Google Scholar
Барретт, М. П. и др. . Трипаносомозы. Ланцет 362 , 1469–1480 (2003).
Артикул PubMed Google Scholar
Эль-Сайед, Н. М. и др. . Сравнительная геномика паразитических простейших трипаносоматид. Наука 309 , 404–409 (2005).
объявлений CAS Статья PubMed Google Scholar
Каллахан, Х. А., Литакер, Р. В. и Нога, Э. Дж. Молекулярная таксономия подотряда Bodonina (отряд Kinetoplastida), включая важных паразитов рыб. Ichthyobodo necator. Журнал эукариотической микробиологии 49 , 119–128 (2002).
CAS Статья PubMed Google Scholar
Лукес Дж., Скалицкий Т., Тайк Дж., Вотипка Дж. И Юрченко В. Эволюция паразитизма у кинетопластидных жгутиконосцев. Молекулярная и биохимическая паразитология 195 , 115–122, (2014).
CAS Статья PubMed Google Scholar
Морейра Д., Лопес-Гарсия П. и Викерман К. Обновленный взгляд на филогению кинетопластид с использованием экологических последовательностей и более близкой внешней группы: предложение по новой классификации класса Kinetoplastea. Международный журнал систематической и эволюционной микробиологии 54 , 1861–1875 (2004).
CAS Статья PubMed Google Scholar
Тодал, Дж. А. и др. . Ichthyobodo necator (Kinetoplastida) — комплекс видов-братьев. Болезни водных организмов 58 , 9–16, (2004).
Артикул PubMed Google Scholar
Стюарт, К., Аллен, Т. Э., Хайдманн, С.& Зейверт, С. Д. Редактирование РНК в кинетопластических простейших. Обзоры по микробиологии и молекулярной биологии 61 , 105–120 (1997).
CAS PubMed PubMed Central Google Scholar
Caraguel, C.G. и др. . Микрогетерогенность и коэволюция: исследование характеристик последовательности рДНК в Neoparamoeba pemaquidensis и его прокинетопластидном эндосимбионте. Журнал эукариотической микробиологии 54 , 418–426 (2007).
CAS Статья PubMed Google Scholar
Дыкова И., Фиала И. и Пецкова Х. Neoparamoeba spp. и их эукариотические эндосимбионты, подобные Perkinsela amoebae (Hollande, 1980): коэволюция продемонстрирована филогенезом гена SSU рРНК. Европейский журнал протистологии 44 , 269–277 (2008).
Артикул PubMed Google Scholar
Sibbald, S.J. и др. . Разнообразие и эволюция Paramoeba spp. и их кинетопластидные эндосимбионты. Журнал микробиологии эукариот . https://doi.org/10.1111/jeu.12394 (2017).
PubMed Google Scholar
Килинг П. Дж. Число, скорость и влияние пластидных эндосимбиозов в эволюции эукариот. Годовой обзор биологии растений 64 , 583–607, (2013).
CAS Статья PubMed Google Scholar
Ли, Л. Э. и др. . Высокий урожай и быстрый рост Neoparamoeba pemaquidensis при совместном культивировании с клеточной линией RTgill-W1, полученной из жабр радужной форели. Журнал болезней рыб 29 , 467–480 (2006).
CAS Статья PubMed Google Scholar
Митчелл, С. О. и Роджер, Х. Д. Обзор инфекционных заболеваний жабр у морских лососевых рыб. Журнал болезней рыб 34 , 411–432, (2011).
CAS Статья PubMed Google Scholar
Янг, Н.Д., Дыкова, И., Снеквик, К., Новак, Б.F. & Morrison, R. N. Neoparamoeba perurans — это космополитический этиологический агент амебной болезни жабр. Болезни водных организмов 78 , 217–223, (2008).
Артикул PubMed Google Scholar
Crosbie, P. B. B., Bridle, A. R., Cadoret, K. & Nowak, B. In vitro , культивированный Neoparamoeba perurans вызывает амебную болезнь жабр у атлантического лосося и соответствует постулатам Коха. Международный журнал паразитологии 42 , 511–515 (2012).
CAS Статья PubMed Google Scholar
Wu, S., Zhu, Z., Fu, L., Niu, B. & Li, W. WebMGA: настраиваемый веб-сервер для быстрого анализа метагеномных последовательностей. BMC Genomics 12 , 444, (2011).
Артикул PubMed PubMed Central Google Scholar
Дэвид В. и др. . Потеря генов и подверженное ошибкам редактирование РНК в митохондрии Perkinsela , эндосимбиотической кинетопластиды. мБио 6 , e01498–01415 (2015).
CAS PubMed PubMed Central Google Scholar
Джексон А. П. и др. . Филогеномика кинетопластид выявляет эволюционные инновации, связанные с истоками паразитизма. Современная биология 26 , 161–172, (2016).
CAS Статья PubMed PubMed Central Google Scholar
Porcel, Б. М. и др. . Оптимизированный геном Phytomonas spp. по отношению к патогенным кинетопластидам человека обнаруживает паразита, адаптированного для растений. PLoS Генетика 10 , e1004007, (2014).
Артикул PubMed PubMed Central Google Scholar
Berriman, M. et al. . Геном африканской трипаносомы Trypanosoma brucei . Наука 309 , 416–422 (2005).
объявлений CAS Статья PubMed Google Scholar
Ivens, A.C. et al. .Геном кинетопластидного паразита. Leishmania major. Наука 309 , 436–442 (2005).
объявлений PubMed Google Scholar
Кунин Э. В. и др. . Исчерпывающая эволюционная классификация белков, закодированных в полных геномах эукариот. Биология генома 5 , R7, (2004).
Артикул PubMed PubMed Central Google Scholar
Стюарт, К. Д. и Майлер, П. Дж. В Геномика и эволюция микробных эукариот (ред. Кац, Л. А. и Бхаттачарья, Д.), гл. 10, 155–168 (Oxford University Press., 2006).
Гаврилюк Р. М. и др. . Морфологическая идентификация и одноклеточная геномика морских дипломатид. Современная биология 26 , 3053–3059, (2016).
CAS Статья PubMed Google Scholar
Филд, М. К. и Кэррингтон, М. Трипаносомный жгутиковый карман. Обзоры природы Микробиология 7 , 775–786, (2009).
CAS Статья PubMed Google Scholar
Gluenz, E. et al. . За пределами 9 + 0: неканонические структуры аксонем характеризуют сенсорные реснички от протистов до людей. Журнал FASEB 24 , 3117–3121, (2010).
CAS Статья PubMed PubMed Central Google Scholar
Langousis, G. & Hill, K. L. Подвижность и др.: Жгутик Trypanosoma brucei . Обзоры природы Микробиология 12 , 505–518, (2014).
CAS Статья PubMed PubMed Central Google Scholar
Молла-Герман, А. и др. . Ресничный карман: эндоцитарный мембранный домен в основании первичных и подвижных ресничек. Журнал клеточных наук 123 , 1785–1795, (2010).
CAS Статья PubMed Google Scholar
Broadhead, R. et al. . Подвижность жгутиков необходима для жизнеспособности трипаносомы кровотока. Природа 440 , 224–227, (2006).
объявлений CAS Статья PubMed Google Scholar
Дин, С., Морейра-Лейте, Ф., Варга, В., Гулл, К. Протеом переходной зоны ресничек выявляет компартментализацию и дифференциальную динамику комплексов цилиопатии. Труды Национальной академии наук США 20 , E5135–43, (2016).
CAS Статья Google Scholar
Ходжес, М. Э., Шойманн, Н., Викстед, Б., Лэнгдейл, Дж. А. и Галл, К. Реконструкция истории эволюции центриоли на основе белковых компонентов. Журнал клеточных наук 123 , 1407–1413, (2010).
CAS Статья PubMed PubMed Central Google Scholar
Сцур, Б., Хаанстра, Дж. Р., Гуальдрон-Лопес, М. и Михельс, П. А. Эволюция, динамика и специализированные функции гликозом в метаболизме и развитии трипаносоматид. Текущее мнение в области микробиологии 22 , 79–87, (2014).
CAS Статья PubMed Google Scholar
Page, F. C. Два новых вида Paramoeba из штата Мэн. Журнал протозоологии 17 , 421–427 (1970).
Артикул Google Scholar
Тиммис, Дж. Н., Эйлифф, М. А., Хуанг, С. Ю. и Мартин, В. Перенос эндосимбиотических генов: геномы органелл формируют эукариотические хромосомы. Природа Обзоры Генетика 5 , 123–135 (2004).
CAS Статья PubMed Google Scholar
Fairlamb, A. H. & Cerami, A. Метаболизм и функции трипанотиона в Kinetoplastida. Ежегодный обзор микробиологии 46 , 695–729, (1992).
CAS Статья PubMed Google Scholar
Cenci, U. et al. . Эволюция гемового пути у кинетопластидных протистов. BMC Эволюционная биология 16 , 109, (2016).
Артикул PubMed PubMed Central Google Scholar
Peacock, L. et al. . Идентификация стадии жизненного цикла мейоза Trypanosoma brucei мухи цеце. Труды Национальной академии наук США 108 , 3671–3676, (2011).
объявлений CAS Статья Google Scholar
Дин, А. Д. и др. . Контроль над хозяевами и торговля питательными веществами в фотосинтетическом симбиозе. Журнал теоретической биологии 405 , 82–93, (2016).
MathSciNet CAS Статья PubMed МАТЕМАТИКА Google Scholar
Кодама, Ю. и Фудзишима, М. Деление клеток и плотность симбиотиков Chlorella variabilis инфузории Paramecium bursaria контролируется условиями питания хозяина на ранней стадии инфицирования. Экологическая микробиология 14 , 2800–2811, (2012).
Артикул PubMed Google Scholar
Лоу, К. Д., Минтер, Э. Дж., Камерон, Д. Д., Брокхерст, М.А. Проливая свет на эксплуататорский контроль хозяина при фотосинтетическом эндосимбиозе. Современная биология 26 , 207–211, (2016).
CAS Статья PubMed Google Scholar
Стивенс, Дж. Р. Филогенетика кинетопластид, с особым упором на эволюцию паразитических трипаносом. Паразит 15 , 226–232 (2008).
CAS Статья PubMed Google Scholar
Беннетт Г. М. и Моран Н. А. Наследственный симбиоз: преимущества и опасности эволюционной кроличьей норы. Труды Национальной академии наук США 112 , 10169–10176, (2015).
объявлений CAS Статья Google Scholar
McCutcheon, J.П. и Моран, Н. А. Чрезвычайное сокращение генома у симбиотических бактерий. Обзоры природы Микробиология 10 , 13–26 (2011).
PubMed Google Scholar
Dyková, I. et al. . Neoparamoeba branchiphila n. sp. и родственные виды из рода Neoparamoeba Page, 1987: морфологическая и молекулярная характеристика выбранных штаммов. Journal of Fish Diseases 28, 49–64 (2005).
Лейн, К. Э. и Арчибальд, Дж. М. Новая архитектура нуклеоморфа генома у рода криптомонад Hemiselmis . Журнал эукариотической микробиологии 53 , 515–521 (2006).
CAS Статья PubMed Google Scholar
Boisvert, S., Raymond, F., Godzaridis, E., Laviolette, F. & Corbeil, J. Ray Meta: масштабируемая сборка и профилирование метагенома de novo. Биология генома 13 , R122, (2012).
Артикул PubMed PubMed Central Google Scholar
Чихи, Р. и Медведев, П. Информированный и автоматический выбор размера k-мер для сборки генома. Биоинформатика 30 , 31–37, (2014).
CAS Статья PubMed Google Scholar
Боетцер, М., Хенкель, К. В., Янсен, Х. Дж., Батлер, Д. и Пировано, В. Строительные леса предварительно собранные контиги с использованием SSPACE. Биоинформатика 27 , 578–579 (2010).
Артикул PubMed Google Scholar
Grabherr, M. G. et al. . Сборка полноразмерного транскриптома из данных RNA-Seq без эталонного генома. Природа Биотехнологии 29 , 644–652, (2011).
CAS Статья PubMed PubMed Central Google Scholar
Li, H. & Durbin, R. Быстрое и точное выравнивание в режиме длительного чтения с помощью преобразования Барроуза-Уиллера. Биоинформатика 26 , 589–595, (2010).
Артикул PubMed PubMed Central Google Scholar
Tanifuji, G. et al. .Геномная характеристика Neoparamoeba pemaquidensis (Amoebozoa) и его кинетопластидного эндосимбионта. Эукариотическая клетка 10 , 1143–1146, (2011).
CAS Статья PubMed PubMed Central Google Scholar
Станке М. и Ваак С. Генное предсказание со скрытой марковской моделью и новой подмоделью интрона. Биоинформатика 19 (Дополнение 2), ii215–225 (2003).
Артикул PubMed Google Scholar
Хаас, Б. Дж. и др. . Улучшение аннотации генома Arabidopsis с использованием сборок максимального выравнивания транскриптов. Исследование нуклеиновых кислот 31 , 5654–5666 (2003).
CAS Статья PubMed PubMed Central Google Scholar
Эммс, Д. М. и Келли, С. OrthoFinder: устранение фундаментальных предубеждений при сравнении полных геномов значительно повышает точность вывода ортогрупп. Биология генома 16 , 157, (2015).
Артикул PubMed PubMed Central Google Scholar
Тер-Ованесян В., Ломсадзе А., Чернов Ю. О. и Бородовский М. Прогнозирование генов в новых геномах грибов с использованием алгоритма ab initio с обучением без учителя. Исследование генома 18 , 1979–1990, (2008).
CAS Статья PubMed PubMed Central Google Scholar
Abeel, T., Van Parys, T., Saeys, Y., Galagan, J. & Van de Peer, Y. GenomeView: браузер генома нового поколения. Исследование нуклеиновых кислот 40 , e12, (2012).
CAS Статья PubMed Google Scholar
Aslett, M. и др. . TriTrypDB: функциональный геномный ресурс для Trypanosomatidae. Исследование нуклеиновых кислот 38 , Д457–462, (2010).
CAS Статья PubMed Google Scholar
Fiebig, M., Gluenz, E., Carrington, M. & Kelly, S. Картограф SLaP: веб-сервер для идентификации и количественной оценки добавления сплайсированных лидеров и использования сайтов полиаденилирования в кинетопластидных геномах. Молекулярная и биохимическая паразитология 196 , 71–74, (2014).
CAS Статья PubMed PubMed Central Google Scholar
Прайс, М. Н., Дехал, П. С. и Аркин, А. П. FastTree 2 — деревья приблизительно максимального правдоподобия для больших выравниваний. PLoS Один 5 , e9490, (2010).
объявлений Статья PubMed PubMed Central Google Scholar
Маруяма, С., Эвли, Р. Дж. И Арчибальд, Дж. М. Тритриммер: метод уменьшения размера филогенетических наборов данных. BMC Research Notes 6 , 145, (2013).
Артикул PubMed PubMed Central Google Scholar
Капелла-Гутьеррес, С., Силла-Мартинес, Дж. М. и Габалдон, Т. trimAl: инструмент для автоматического выравнивания выравнивания в крупномасштабных филогенетических анализах. Биоинформатика 25 , 1972–1973, (2009).
CAS Статья PubMed PubMed Central Google Scholar
Стаматакис, А. RAxML-VI-HPC: Филогенетический анализ на основе максимального правдоподобия с тысячами таксонов и смешанных моделей. Биоинформатика 22 , 2688–2690 (2006).
CAS Статья PubMed Google Scholar
Lartillot, N. & Philippe, H. Модель байесовской смеси для межсайтовых неоднородностей в процессе замены аминокислот. Молекулярная биология и эволюция 21 , 1095–1109 (2004).
CAS Статья PubMed Google Scholar
Масло, Ф. и др. . Сравнительная протеомика двух стадий жизненного цикла меченного стабильным изотопом Trypanosoma brucei обнаруживает новые компоненты механизма адаптации паразита-хозяина.Молекулярный и клеточный. Протеомика 12 , 172–179, (2013).
Артикул Google Scholar
Gunasekera, K., Wuthrich, D., Braga-Lagache, S., Heller, M. & Ochsenreiter, T. Ремоделирование протеома во время развития от крови до формы насекомого Trypanosoma brucei количественно определено SILAC и масс-спектрометрии. BMC Genomics 13 , 556, (2012).
CAS Статья PubMed PubMed Central Google Scholar
Niemann, M. et al. . Протеом митохондриальной внешней мембраны Trypanosoma brucei обнаруживает новые факторы, необходимые для поддержания морфологии митохондрий. Молекулярная и клеточная протеомика 12 , 515–528, (2013).
CAS Статья PubMed Google Scholar
Урбаниак, М. Д., Гутер, М. Л., Фергюсон, М. А. Сравнительный протеомный анализ SILAC Trypanosoma brucei кровотока и стадий проциклического жизненного цикла. PLoS Один 7 , e36619, (2012).
объявлений CAS Статья PubMed PubMed Central Google Scholar
Эдгар Р.С. МЫШЦЫ: множественное выравнивание последовательностей с высокой точностью и высокой пропускной способностью. Исследование нуклеиновых кислот 32 , 1792–1797, (2004).
CAS Статья PubMed PubMed Central Google Scholar
Джонсон, Л. С., Эдди, С. Р. и Португали, Э. Эвристика скорости скрытой модели Маркова и итерационная процедура поиска HMM. BMC Биоинформатика 11 , 431, (2010).
Артикул PubMed PubMed Central Google Scholar
Гутер, М. Л., Урбаниак, М. Д., Тавендейл, А., Прескотт, А. и Фергюсон, М. А. Высоконадежный протеом гликозомы для проциклической формы Trypanosoma brucei путем обогащения эпитоп-меткой органелл и протеомики SILAC. Журнал протеомных исследований 13 , 2796–2806, (2014).
CAS Статья PubMed PubMed Central Google Scholar
Джамдхад, М.Д. и др. . Комплексный протеомный анализ гликозом из Leishmania donovani . OMICS 19 , 157–170, (2015).
CAS Статья PubMed PubMed Central Google Scholar
Канехиса, М., Сато, Ю., Кавашима, М., Фурумичи, М. и Танабе, М. KEGG в качестве справочного ресурса для аннотации генов и белков. Нуклеиновые кислоты Res 44 , Д457–462, (2016).
CAS Статья PubMed Google Scholar
Sant’Anna, C. et al. . Субклеточная протеомика резервосом Trypanosoma cruzi . Протеомика 9 , 1782–1794, (2009).
Артикул PubMed PubMed Central Google Scholar
Хуанг, Г. и др. . Протеомный анализ ацидокальцисомы, органеллы, сохраненной от бактерий до клеток человека. Патогены PLoS 10 , e1004555, (2014).
Артикул PubMed PubMed Central Google Scholar
Герман, М., Гиллис, С., Михельс, П. А. и Ригден, Д. Дж. Аутофагия и родственные процессы у трипаносоматид: выводы из геномного и биоинформатического анализа. Аутофагия 2 , 107–118 (2006).
CAS Статья PubMed Google Scholar
Thiery, J. P. Mise en évidence des polysaccharides sur coupes fines en microscopie électronique. Журнал микроскопии 6, , 987–1018 (1967).
CAS Google Scholar
Поиск
- Где угодно
Поиск Поиск
Расширенный поиск- Войти | регистр
- Подписка / продление
- Учреждения
- Индивидуальные подписки
- Индивидуальное продление
- Библиотекари
- платежей Пакет для Чикаго
- Полный охват и содержание
- Файлы KBART и RSS-каналы
- Разрешения и перепечатки
- Инициатива Чикаго для развивающихся стран
- Даты отправки и претензии
- Часто задаваемые вопросы библиотекарей
- Агенты
- 30
- , заказы
- и платежи
- Полный пакет Chicago
- Полный охват и содержание
- Даты отправки и претензии
- Часто задаваемые вопросы агента
- Партнеры по издательству
- О нас
- Публикуйте с нами
- Недавно приобретенные журналы
- 6 tners
- Новости прессы
- Подпишитесь на уведомления eTOC
- Пресс-релизы
- СМИ
- Книги издательства Чикагского университета
- Распределительный центр в Чикаго
- Чикагский университет
- Положения и условия
- Заявление о публикационной этике
- Уведомление о конфиденциальности
- Доступность Chicago Journals
- Доступность университета
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
- Свяжитесь с нами
- Медиа и рекламные запросы
- Открытый доступ в Чикаго
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
Метаболизм мио-инозита, вызываемый Legionella pneumophila, способствует заражению амеб и макрофагов
РЕЗЮМЕ
Legionella pneumophila — естественный паразит амеб из окружающей среды и возбудитель тяжелой пневмонии, называемой болезнью легионеров.Факультативный внутриклеточный патоген использует двусторонний метаболизм, при котором аминокислота серин служит основным источником энергии, а глицерин и глюкоза в основном используются для анаболических процессов. Геном L. pneumophila содержит кластер от lpg1653 до lpg1649 , предположительно участвующих в метаболизме обильного углеводного myo -инозитола (называемого здесь инозитолом). Для оценки метаболизма инозита L. pneumophila мы сконструировали определенные мутантные штаммы, лишенные lpg1653 или lpg1652 , которые, как предполагается, кодируют переносчик инозита IolT или инозитол-2-дегидрогеназу IolG, соответственно.Мутантные штаммы не нарушали рост в сложной или определенной минимальной среде, и инозит не стимулировал внеклеточный рост. Однако при коинфекции Acanthamoeba castellanii мутанты были вытеснены родительским штаммом, что указывает на то, что внутриклеточный метаболизм инозитола дает патогену преимущество в приспособляемости. Действительно, инозит, добавленный к амебам или макрофагам, инфицированным L. pneumophila, стимулировал внутриклеточный рост родительского штамма, но не мутанта Δ iolT или Δ iolG , и стимуляция роста инозитом восстанавливалась путем комплементации мутантных штаммов.Для экспрессии промотора P iol и бактериального поглощения инозита потребовался альтернативный сигма-фактор RpoS, ключевой регулятор вирулентности L. pneumophila. Наконец, родительский штамм и мутантные бактерии Δ iolG , но не мутантный штамм Δ iolT , накапливали [U- 14 C 6 ] инозит, что указывает на то, что IolT действительно функционирует как переносчик инозита. Взятые вместе, внутриклеточные L. pneumophila метаболизируют инозит через продукты гена iol , тем самым способствуя росту и вирулентности патогена.
ВАЖНОСТЬ Экологическая бактерия Legionella pneumophila является возбудителем тяжелой пневмонии, называемой болезнью легионеров. Условно-патогенный микроорганизм реплицируется в фагоцитах простейших и млекопитающих в уникальной вакуоли. Считается, что аминокислоты представляют собой основной источник углерода и энергии для L. pneumophila. Однако исследования генома, транскриптома и протеома показывают, что патоген не только использует аминокислоты в качестве источников углерода, но и обладает более широкими метаболическими возможностями.В этом исследовании мы проанализировали метаболизм инозита во внеклеточном и внутриклеточном росте L. pneumophila. Используя генетические, биохимические и клеточно-биологические подходы, мы обнаружили, что L. pneumophila накапливает и метаболизирует инозит через продукты гена iol , тем самым способствуя внутриклеточному росту, вирулентности и приспособленности патогена. Наше исследование значительно способствует пониманию внутриклеточной ниши патогена человека.
ВВЕДЕНИЕ
L egionella pneumophila — это грамотрицательная повсеместная экологическая бактерия, которая выживает в сложных многовидовых биопленках в природных или искусственных источниках воды (1–3).Однако преимущественно Legionella spp. паразитируют на свободноживущих простейших и растут внутри этих одноклеточных бактериоядных (4, 5). При вдыхании аэрозолей, содержащих бактерии, L. pneumophila достигает легких, где условно-патогенный микроорганизм инфицируется и размножается в альвеолярных макрофагах (6). Рост амеб эволюционно предшествует и, по-видимому, механически отражает рост макрофагов, что является предпосылкой для возникновения молниеносной пневмонии, называемой болезнью легионеров (6).
Ключевой фактор вирулентности, регулирующий внутриклеточную репликацию L.pneumophila — это система секреции Icm / Dot типа IV (T4SS), состоящая из 25 генных продуктов icm или dot , большинство из которых являются функционально важными. Этот T4SS доставляет в клетку-хозяина более 300 различных «эффекторных белков», многие из которых нацелены и разрушают центральные клеточные процессы, создавая разрешающую репликацию эндоплазматическую сеть (ER), производную Legionella-содержащую вакуоль (LCV) (7-10). . Следовательно, штамм L. pneumophila, лишенный, например, icmT , не образует разрешающего репликацию LCV и является дефектным для внутриклеточного роста.Важнейшим регуляторным элементом внутриклеточного роста L. pneumophila является RpoS. Альтернативный сигма-фактор контролирует переключение с репликативной авирулентной фазы на стационарную вирулентную фазу L. pneumophila (11-13), а также регулирует систему Lqs, воспринимающую кворум Legionella (14, 15).
В то время как образование LCV является предметом обширных текущих исследований, внутриклеточный метаболизм L. pneumophila и его влияние на бактериальную вирулентность остаются довольно неизведанной областью (16, 17).L. pneumophila — облигатный аэроб, который в первую очередь полагается на определенные аминокислоты как источники углерода и энергии и является ауксотрофным по отношению к нескольким другим аминокислотам, включая аргинин, цистеин, изолейцин, лейцин, метионин, серин и треонин (18–21). Исследования профилей изотопологов со стабильными изотопами [ 13 C] показали, что серин является основным источником углерода и энергии для L. pneumophila и легко метаболизируется бактериями (22).
Геномы штаммов L. pneumophila показали, что бактерия также обладает полными путями метаболизма углеводов (23-25), и использование этих соединений уже указывалось в более ранних исследованиях (21, 26).Более поздние исследования физиологии и профилирования изотопологов установили, что глюкоза и глицерин метаболизируются L. pneumophila во внеклеточных и внутриклеточных условиях (22, 27, 28). L. pneumophila использует двухсторонний метаболизм, при котором аминокислоты, такие как серин, предпочтительно катаболизируются и служат основным поставщиком энергии, в то время как глицерин и углеводы, такие как глюкоза, преимущественно используются для анаболических процессов (28). Двусторонняя метаболическая стратегия также используется другими внутриклеточными патогенами, такими как Listeria monocytogenes (29) или Mycobacterium tuberculosis (30, 31), и может быть адаптацией к внутриклеточному образу жизни, обеспечивая бактерии множеством различных источников углерода.
Углевод мио -инозит (здесь именуемый инозитолом) обычно встречается во многих почвенных и водных экосистемах и существует в моно- или полифосфорилированных формах (1-6 фосфатных групп) (32). Наиболее распространенной формой фосфорилированного инозита является гексакисфосфат инозита, также известный как фитат или фитиновая кислота. Фитат составляет более 80% органического фосфата в почве (32), служит основным хранилищем фосфора в растениях и семенах (33, 34) и является мощным хелатором микроэлементов, содержащих ионы двухвалентных металлов, тем самым ограничивая их биодоступность ( 35).L. pneumophila продуцирует Icm / Dot T4SS-транслоцированную фитазу LppA, которая, по-видимому, участвует в детоксикации бактериостатического фитата в амебах (36).
Ряд бактерий могут внеклеточно расти на инозите как единственном источнике углерода и энергии. К ним относятся Bacillus subtilis (37), Lactobacillus casei (38), Salmonella enterica (39) и Sinorhizobium meliloti (40). Молекулярная генетика катаболизма бактериального инозита лучше всего изучена у B. subtilis, у которого два оперона, iolABCDEFGHIJ и iolRS , а также орфанный ген iolT , участвуют в деградации инозита (37).IolT и IolF были идентифицированы как переносчики инозита суперсемейства основных фасилитаторов, но только мутанты, лишенные iolT , обнаруживают основные дефекты роста (41). Другим центральным компонентом катаболизма инозита у B. subtilis является белок-регулятор IolR, который положительно регулирует экспрессию всех генов iol в присутствии инозита (42).
Хотя генетическая организация и установка генов iol может различаться у разных организмов (рис. 1A), основные реакции законсервированы и включают семь этапов (рис.1Б) (37, 39). После импорта инозита транспортером IolT полиол окисляется на первой стадии до 2-кето- myo -инозитола, что катализируется инозитол-2-дегидрогеназой IolG. После нескольких дополнительных стадий, включая расщепление гексанового кольца и фосфорилирование, конечные продукты дигидроксиацетонфосфат и ацетил-кофермент А (КоА) направляются в центральный клеточный метаболизм.
Рис. 1.Оперон L. pneumophila iol и путь катаболизма myo -инозита.(A) Кластер генов от lpg1653 до lpg1649 L. pneumophila образует оперон иол , который содержит пять генов, которые, как предполагается, участвуют в метаболизме мио -инозитола. Гены кодируют предполагаемый переносчик инозита IolT и ферменты катаболизма инозита IolG, IolCB, IolD и IolE. Для сравнения показано расположение генов B. subtilisiol. (B) Для катаболизма инозитол поглощается транспортером IolT и окисляется до 2-кето- myo -инозитола, катализируемого инозитол-2-дегидрогеназой IolG.Дегидратаза IolE производит 3,5 / 4-тригидроксициклогексан-1,2-дион, который линеаризуется до 5-дезоксиглюконата, катализируемого гидролазой IolD. IolB и IolC катализируют изомеризацию и фосфорилирование, давая 2-дезокси-5-кето-d-глюконат и центральный промежуточный продукт 2-дезокси-5-кето-d-глюконат-6-фосфат, соответственно, которые у B. subtilis и S .. enterica расщепляются бисфосфатальдолазой IolJ, давая дигидроксиацетонфосфат и малонатный полуальдегид. Малонатный полуальдегид превращается в ацетил-КоА декарбоксилированием малонат-полуальдегиддегидрогеназы IolA.Схема адаптирована из Yoshida et al. (37) и Крегер и Фукс (39). TCA, цикл трикарбоновых кислот.
В этом исследовании мы показываем, что мутантные штаммы L. pneumophila, лишенные lpg1653 ( iolT ) или lpg1652 ( iolG ), вытесняются родительским штаммом при коинфекции Acanthamoeba castellanii и, в зависимости от присутствия iolT и iolG , инозит, добавленный к амебам или макрофагам, инфицированным L. pneumophila, способствует внутриклеточному росту бактерий.Более того, было обнаружено, что IolT функционирует как переносчик инозита, а для экспрессии промотора P iol , а также бактериального поглощения инозита необходим альтернативный сигма-фактор RpoS. Таким образом, наши результаты показывают, что внутриклеточный метаболизм инозита способствует росту и вирулентности L. pneumophila.
МАТЕРИАЛЫ И МЕТОДЫ
Бактерии, клетки и условия роста Л. pneumophila (Таблица 1) культивировали в аэробных условиях при 37 ° C в бульоне дрожжевого экстракта (AYE) с буфером N — (2-ацетамидо) -2-аминоэтансульфоновой кислоты (ACES) или выращивали на экстракте древесных дрожжей (CYE) чашки с агаром, дополненные хлорамфениколом (Cm; 5 мкг мл -1 ) или канамицином (Km; 50 мкг мл -1 в бульоне или 10 мкг мл -1 в чашках с агаром), если необходимо.В качестве альтернативы L. pneumophila культивировали при 37 ° C в среде с определенным химическим составом (CDM) (22), модифицированной из Ristroph et al. (19), или минимально заданная среда (MDM) (28). CDM и MDM получали растворением компонентов в 950 мл бидистиллированной воды (ddH 2 O). PH доводили до 6,3 (CDM) или 6,5 (MDM) с помощью КОН, добавляли растворенный пирофосфат Fe и доводили до 1 литра. Escherichia coli TOP10 использовали для клонирования и выращивали в среде LB при 37 ° C, содержащей 30 мкг мл -1 Cm или 50 мкг мл -1 Km, если необходимо.
ТАБЛИЦА 1Штаммы и плазмиды, использованные в этом исследовании
Для анализов внеклеточного роста L. pneumophila JR32 или мутантные штаммы ресуспендировали из чашек с агаром CYE в CDM с начальной оптической плотностью 0,1 при 600 нм (OD 600 ). С этой целью 3-миллилитровые культуры готовили в 13-миллилитровых пластиковых пробирках (Sarstedt, Nümbrecht, Германия) для каждого штамма в трех экземплярах и инкубировали при 37 ° C на вращающемся колесе в течение 15-18 часов до тех пор, пока культуры не достигли OD . 600 от 0,5 до 0.8. Культуры разбавляли до OD 600 0,1 в 3 мл CDM или MDM и добавляли 10 мМ инозитола, где указано. Затем бактерии инкубировали при 37 ° C на вращающемся колесе в течение 48 часов и оценивали оптическую плотность.
Acanthamoeba castellanii (ATCC 30234, лабораторная коллекция) выращивали в среде с пептонными дрожжами и глюкозой (PYG) при 23 ° C. Dictyostelium discoideum Ax3 (Zhou et al. [43], лабораторная коллекция) выращивали аксенически в среде HL5 при 23 ° C. Мышиные макрофаги RAW 264.7 (ATCC TIB-71, лабораторный сбор) культивировали в среде RPMI 1640 (Gibco), содержащей 10% инактивированной нагреванием фетальной телячьей сыворотки (FBS) и 2 мМ глутамина в 37 ° C / 5% CO 2 .
Конструирование векторов для аллельного обмена, экспрессии генов и анализов репортера зеленого флуоресцентного белка. Для анализа последовательностей домашняя страница Legionella Института Пастера (http://genolist.pasteur.fr/LegioList/index.html) и NCBI база данных (http://www.ncbi.nlm.nih.gov/). Аллельный обменный вектор pCM003 (таблица 1) был сконструирован с использованием 0,5-0,8 т.п.н. 5′- и 0,5-0,8 т.п.н. 3′-фланкирующих областей iolT и кассеты устойчивости к Km, а аллельный вектор pCM022 был сконструирован с использованием 0.От 5 до 0,8 т.п.н. 5′- и от 0,5 до 0,8 т.п.н. 3′-фланкирующих областей iolG и кассеты устойчивости к Km. Для фланкирующих областей iolT , пара праймеров iolT -LB-XbaI-fo и iolT -LB-SalI-re и пара праймеров iolT -RB-SalI-fo и iolT -RB-XbaI -re (см. Таблицу S1 в дополнительном материале). Для фланкирующих областей iolG , пара праймеров iolG -LB-XbaI-fo и iolG -LB-SalI-re и пара праймеров iolG -RB-SalI-fo и iolG -RB-XbaI -re использовались.Амплифицированные продукты ПЦР этих фланкирующих областей расщепляли с использованием рестрикционных ферментов SalI и XbaI. Плазмиду pUC4K переваривали SalI, получая фрагмент размером 1,4 т.п.н., содержащий кассету устойчивости к Km. Самоубийственный вектор pLAW344 расщепляли рестрикционным ферментом XbaI. Соответствующие фланкирующие области и кассета устойчивости к Km были клонированы в pLAW344 посредством четырехстороннего лигирования, трансформированы в E.coli TOP10 и отобраны для кассеты устойчивости к Km. Плазмиды анализировали рестрикционным расщеплением и секвенировали.
Для комплементации мутанта Δ iolT или штамма Δ iolG были сконструированы векторы pCM020 и pCM023 с использованием пары праймеров iolT -BamHI-fo-comp и iolT -SalI-re-comp или iolG -BamHI-fo-comp и iolG -SalI-re-comp. Продукты ПЦР клонировали в вектор pCR033 с использованием BamHI и SalI. Для конструирования плазмиды pCM004 была использована нестабильная форма зеленого флуоресцентного белка (GFP), GFP (ASV) (44).С этой целью плазмиду pJBA132 расщепляли с использованием XbaI и HindIII, получая фрагмент размером 0,75 т.п.н., содержащий gfp (ASV), который был клонирован в плазмиду pMMB207C. Промоторную область длиной 400 п.н. iolT амплифицировали с использованием праймеров iolT -400 п.о.-SacI-fo и iolT -400 п.о.-XbaI-re. Продукт ПЦР клонировали в pCM004 с использованием SacI / XbaI, получая плазмиду pCM007.
Конструирование штаммов мутантных хромосомных делеций. Для создания делеционных мутантных штаммов CM02 (Δ iolT ) или CM03 (Δ iolG ), iolT или iolG были удалены в хромосоме L.pneumophila JR32, как описано ранее (14, 45). С этой целью штамм JR32 трансформировали pCM003 или pCM022 электропорацией и высевали на чашки с агаром CYE, содержащие 10 мкг мл -1 Km. Планшеты инкубировали при 30 ° C в течение 5 дней, отбирали устойчивые к канамицину (Km r ) колонии и выращивали в течение ночи в 96-луночных планшетах в бульоне AYE с 50 мкг мл -1 Km. Затем культуры помещали на чашки CYE-Km, CYE-Km – 2% сахарозы и CYE-Cm параллельно и выращивали при 30 ° C для отбора на чувствительность к хлорамфениколу (Cm s ) / Km r / сахароза. -резистентные (Suc r ) колонии.Мутанты с двойным кроссовером были подтверждены с помощью ПЦР и секвенированы.
Внутриклеточная репликация L. pneumophila. Внутриклеточная репликация L. pneumophila оценивалась согласно ранее опубликованным данным (46). Вкратце, A. castellanii или D. discoideum amoebae выращивали в среде PYG или HL5, соответственно, до ~ 80% слияния, и 4 × 10 4 клеток на лунку высевали в 96-луночные планшеты. Планшеты инкубировали в течение ночи при 23 ° C для репликации амеб. Среду PYG или HL5 заменяли средой LoFlo (ForMedium).Штаммы L. pneumophila, несущие плазмиду pNT28 (конститутивная продукция GFP), выращивали в AYE-Cm (5 мкг мл -1 ) до OD 600 из 3 и использовали для заражения амеб (множественность инфекции [MOI], 10 до 20). Инфекции синхронизировали центрифугированием при 500 × g в течение 10 мин, и планшеты инкубировали при 30 ° C. Инозитол в концентрации от 10 до 20 мМ добавляли либо одновременно с инфицированием, либо через 2 или 4 часа после заражения в некоторые лунки, и флуоресценцию GFP измеряли на спектрофотометре планшета через определенные интервалы.
Для определения КОЕ макрофаги A. castellanii или RAW 264,7 высевали по 5 × 10 4 клеток на лунку в 96-луночные планшеты. Для этого клетки суспендировали в Ас-буфере [4 мМ MgSO 4 · 7H 2 O, 0,4 мМ CaCl 2 , 3,4 мМ дигидрат цитрата натрия, 0,05 мМ Fe (NH 4 ) 2 (SO 4 ) 2 · 6H 2 O, 0,05 мМ Na 2 HPO 4 · 7H 2 O, 2,5 мМ KH 2 PO 4 , 0.05 мМ NH 4 Cl (pH 6,5)] или среды RPMI 1640 соответственно, и планшеты инкубировали при 23 ° C (амебы) или 37 ° C / 5% CO 2 (макрофаги) в течение 1 часа, чтобы адгезия клеток. L. pneumophila выращивали в течение 21 ч в AYE, как указано выше. Для экспериментов по комплементации мутант Δ iolT или мутантный штамм Δ iolG , продуцирующий плазмиду iolT (pCM020) или iolG (pCM023) под контролем промотора P tac , культивировали с 1 мМ изопропил-β-d-тиогалактопиранозид (IPTG).Фагоциты инфицировали L. pneumophila (MOI, 0,1) центрифугированием при 500 × g в течение 10 мин. В ходе инфицирования инфицированные клетки затем выдерживали при 30 ° C (амебы) или 37 ° C / 5% CO 2 (макрофаги) сначала в течение 1 ч, а затем промывали буфером Ac или средой RPMI 1640 и далее инкубировали. В определенные лунки через 4 часа после инфицирования добавляли инозитол в концентрации 20 мМ. Через 48 часов (макрофаги) или 72 часа (амебы) клетки лизировали 0,8% сапонином и соответствующие разведения высевали на чашки с агаром CYE для определения КОЕ.
Конкурентные анализы A. castellanii. Конкурентные анализы амеб выполняли, как описано ранее (47). Вкратце, L. pneumophila JR32 и мутантные штаммы, подлежащие тестированию, ресуспендировали из чашек CYE в бульоне AYE до исходного значения OD 914 , равного 0,1, и инкубировали при 37 ° C до тех пор, пока культуры не достигли OD 914 , равного 3. Перед заражением. , 5 × 10 4 Amoebae A. castellanii высевали в 96-луночный планшет в Ac-буфере. Планшет инкубировали не менее 1 ч при 30 ° C.Затем A. castellanii инфицировали в соотношении 1: 1 L. pneumophila JR32 и мутантным штаммом Δ iolT или штаммом Δ iolG (MOI, 0,01 каждый). Заражение синхронизировали центрифугированием при 500 × g в течение 10 мин, и планшет инкубировали при 37 ° C в течение 1 ч. Буфер Ac заменяли, и планшет дополнительно инкубировали при 37 ° C. Через 3 дня свежие амебы высевали в новый 96-луночный планшет (5 × 10 4 клеток на лунку в 200 мкл буфера Ас) и инкубировали при 30 ° C в течение 1 часа.Собирали супернатант со старого 96-луночного планшета, а оставшиеся в лунках клетки лизировали 0,8% сапонином. Супернатант и лизат объединяли, разбавляли 1: 1000 и использовали для заражения свежих амеб (50 мкл на лунку). Аликвоты комбинированного супернатанта и лизата высевали параллельно на чашки с агаром CYE и на чашки, содержащие Km (10 мкг мл -1 ) для определения КОЕ и различения между JR32 и Km-устойчивыми мутантными бактериями. Свежеинфицированный 96-луночный планшет дополнительно инкубировали при 37 ° C в течение еще 3 дней, а затем повторяли лизис и повторное заражение.
Эксперименты по поглощению 2-NBDG и (иммуно) флуоресценции. Всего 2,5 × 10 5 клеток D. discoideum в 0,5 мл среды HL5 высевали на стерильные покровные стекла, покрытые поли-L-лизином, в 24-луночном корпусе. планшет и инкубировали в течение ночи при 23 ° C, так что на каждом покровном стекле присутствовало около 5 × 10 5 клеток. Амебы были инфицированы L. pneumophila JR32, мутантом Δ iolT , мутантом Δ iolG , мутантом Δ icmT или мутантом Δ rpoS , несущим плазмиду pSW001 (конститутивная продукция DsRed) при MOI 10.Заражение синхронизировали центрифугированием при 500 × g в течение 10 мин. Клетки инкубировали в течение 1 ч при 25 ° C, супернатант удаляли и 0,5 мл фосфатного буфера Соренсена с CaCl 2 (SorC; 15 мМ KH 2 PO 4 , 2 мМ Na 2 HPO 4 , 50 мкМ CaCl 2 [pH 6,0]) добавляли на лунку. Затем добавляли 20 мкМ 2-дезокси-2 [(7-нитро-2,1,3-бензоксадиазол-4-ил) амино] -d-глюкозы (2-NBDG; Sigma-Aldrich), флуоресцентного аналога глюкозы. , и клетки дополнительно инкубировали при 25 ° C в течение 30 мин.Клетки промывали SorC, а затем покровные стекла помещали на предметные стекла с использованием монтажной среды Vectashield (Vector Laboratories) с добавлением 1 мкг мл -1 DAPI (4 ‘, 6-диамидино-2-фенилиндол) для окрашивания ДНК. Образцы анализировали с помощью конфокального микроскопа Leica TCS SP5 (HCX PLAPO CS, объектив 63 × / 1,4–0,60, масло).
Для гомогенизации инфицированных клеток для иммунофлуоресцентной микроскопии 8,5 × 10 5 D. discoideum amoebae на лунку засевали в 6-луночный планшет, выращивали в течение ночи и инфицировали L.pneumophila (MOI, 10; 3 лунки на штамм). Заражение проводили при 25 ° C в течение 1 ч, клетки промывали SorC и добавляли 20 мкМ 2-NBDG. Затем амеб инкубировали в течение 30 мин при 25 ° C, промывали SorC, суспендировали в буфере для гомогенизации (20 мМ HEPES, 250 мМ сахароза, 0,5 мМ EGTA [pH 7,2]) и лизировали девятью пассажами через гомогенизатор клеток (исключение размер 8 мкм; Isobiotec) хранят на льду. Гомогенат центрифугировали на покровных стеклах, покрытых поли-1-лизином, с последующим окрашиванием антителами против LCV-связанных L.pneumophila эффекторный SidC (48). Для этого покровные стекла инкубировали с блокирующим раствором (5% FBS в SorC) в течение 1 часа и инкубировали с 30 мкл аффинно очищенной антисыворотки против SidC (разведенной 1: 100 в блокирующем растворе) в течение 1 часа при комнатной температуре. Покровные стекла трижды промывали SorC и 30 мкл соответствующих вторичных антител (разведенных 1: 200 в блокирующем растворе), связанных с DyLight650 (ослиный анти-кроличий IgG; Abcam) или родамином (бычий анти-кроличий IgG; Санта-Крус) добавляли и инкубировали 30 мин.Покровные стекла промывали SorC и помещали на предметные стекла с помощью Vectashield.
Транспорт [ 14 C] инозита L. pneumophila. L. pneumophila JR32, мутант Δ iolT или мутант Δ iolG выращивали в среде AYE до OD 914 , равного 2,8. Для комплементации мутанта Δ iolT мутантный штамм, несущий плазмиду pCM020, выращивали в бульоне AYE-Cm с 1 мМ IPTG, чтобы обеспечить экспрессию iolT . К культурам добавляли 10 мМ инозита с 1% разведением 1:10 [U- 14 C 6 ] инозитола (удельная активность 300 мКи / ммоль; American Radiolabeled Chemicals).Далее бактерии инкубировали при 37 ° C с осторожным встряхиванием, и образцы объемом 200 мкл отбирали через 0, 10, 20, 30, 60 и 90 минут. Образцы фильтровали через дисковые фильтры из ацетата целлюлозы (размер пор 0,25 мкм; Roth), и фильтры трижды промывали фосфатно-солевым буфером (PBS). Связанную с фильтром радиоактивность определяли в жидкостном сцинтилляционном счетчике (1450 MicroBeta TriLux; PerkinElmer) со сцинтилляционной смесью EcoLume (MP Biomedicals). В другой экспериментальной установке Л.pneumophila JR32 или мутант Δ rpoS выращивали в среде AYE. Были взяты образцы объемом двести микролитров при OD 914 0,5, 1,0, 2,0 и 3,0. Клетки инкубировали с 10 мМ инозита с добавлением 1% разбавленного 1:10 [U- 14 C 6 ] инозита в течение 20 минут, фильтровали, промывали и измеряли, как описано выше.
Для определения радиоактивности, связанной с белками, L. pneumophila JR32, мутант Δ iolT или мутант Δ iolG выращивали в среде AYE до OD 600 из 2.0. К культурам добавляли 10 мМ инозита с 1% разведением 1:10 [U- 14 C 6 ] инозитола и затем инкубировали при 37 ° C при осторожном встряхивании. Образцы объемом двести микролитров отбирали через 0, 2, 4, 6 и 8 часов, смешивали с 1 мл 50% трихлоруксусной кислоты и инкубировали на льду в течение 1 часа. Образцы фильтровали через фильтрующие диски из нитрата целлюлозы (размер пор 0,45 мкм; Roth) и фильтры трижды промывали PBS. Связанную с фильтром радиоактивность определяли в жидкостном сцинтилляционном счетчике с помощью сцинтилляционной смеси EcoLume.
Репортерные анализы GFP. Л. pneumophila JR32, мутант Δ rpoS или различные lqs мутантных штаммов, несущих плазмиду pCM007, выращивали в течение ночи в бульоне AYE-Cm до OD 914 от 1,5 до 2,0. Бактерии разбавляли в бульоне AYE-Cm до исходной OD 600 0,1 в 96-луночном черном планшете с прозрачным дном (PerkinElmer) и в некоторые лунки добавляли 10 мМ инозитола или 6 мМ серина. Планшет инкубировали в инкубаторе со встряхиванием при 37 ° C и 600 об / мин в течение 24 часов.Каждый час оптическую плотность и флуоресценцию GFP измеряли с помощью планшетного спектрофотометра (Optima FLUOstar; BMG Labtech).
РЕЗУЛЬТАТЫ
Предполагаемый кластер деградации инозита в геноме L. pneumophila. Геном L. pneumophila содержит группу генов, предположительно участвующих в метаболизме инозита (рис. 1). Кластер генов включает область размером 7 т.п.н. на хромосоме штамма L. pneumophila Philadelphia-1 и содержит пять генов, от lpg1653 до lpg1649 .Гены организованы в оперон, как это предсказано Базой данных для оперонов прокариот (DOOR 2 ) (http://csbl.bmb.uga.edu/DOOR/) (49) и базой данных прокариотических оперонов (http: / /operons.ibt.unam.mx/OperonPredictor/) с предсказанным промотором, названным P iol , в области 400 пар оснований между генами lpg1653 и lpg1654 . Сайт начала транскрипции и организация оперона (оперон 326) были экспериментально подтверждены с помощью глубокого секвенирования РНК (50).Оперон консервативен в нескольких штаммах L. pneumophila, включая Philadelphia-1 (от lpg1653 до lpg1649 ), Paris (от lpp1624 до lpp1620 ) и Lens, Corby и Alcoy (23-25), как а также у Legionella longbeachae (51, 52).
Белки, кодируемые в этом опероне, аннотированы как IolG (Lpg1652), myo -инозитол-2-дегидрогеназа; IolCB (Lpg1651), комбинированный белок 5-дегидро-2-дезоксиглюконокиназа-5-дезоксиглюкуронат-изомераза; IolD (Lpg1650), белок гидролазы катаболизма инозита; и IolE (Lpg1649), инозозодегидратаза (рис.1). Эти белки демонстрируют идентичность последовательностей от 30% до 50% с соответствующими белками B. subtilis и S. enterica. Первый ген в опероне от lpg1653 до lpg1649 аннотирован как кодирующий симпортер протона d-ксилозы и имеет 32% и 30% идентичность с генами, кодирующими белок транспортера инозита IolT B. subtilis и S. enterica. соответственно. Ферментами метаболизма инозита, по-видимому, отсутствующими у L. pneumophila, являются бисфосфатальдолаза IolJ и малонат-полуальдегиддегидрогеназа IolA.Более того, похоже, что в геноме L. pneumophila не кодируется гомолог главного регуляторного белка IolR, и, таким образом, оперон iol , вероятно, регулируется иначе, чем у B. subtilis (37) или S. enterica (39).
L. pneumophila, лишенная iolT или iolG , вытесняется родительским штаммом у амеб. Чтобы оценить роль предполагаемой деградации инозита iol генного кластера в метаболизме инозита и вирулентности L. pneumophila, мутантных штаммов CM02 и CM03 без lpg1653 ( iolT , предполагаемый переносчик инозита) или без lpg1652 ( iolG , инозит-2-дегидрогеназа) (Таблица 1).Рост этих мутантов контролировали в различных средах в присутствии или в отсутствие инозита. Родительский штамм L. pneumophila, мутант Δ iolT и мутантный штамм Δ iolG неразличимо рос в бульоне AYE (данные не показаны), минимальной среде CDM (см. Рис. S1 в дополнительном материале) и минимальной среде MDM. среды (фиг. 2A и B), а добавление 10 мМ инозита не повлияло на рост штаммов ни в одной тестируемой среде.
Рис. 2.L. pneumophila, лишенная iolT или iolG , вытесняется родительским штаммом амеб.Внеклеточный рост L. pneumophila JR32 и мутантных штаммов без (A) iolT (Δ iolT , lpg1653 ) или (B) iolG (Δ iolG , lpg1652 ) в MDM с 10 мМ инозитол оценивали по оптической плотности при 600 нм (OD 600 ) в указанные моменты времени. Для анализа конкуренции амеб A. castellanii инфицировали в соотношении 1: 1 (MOI, 0,01 каждый) L. pneumophila JR32 и мутантом Δ iolT (C) или JR32 и мутантом Δ iolG (D).Амебы лизировали через 3 дня после заражения, и гомогенат использовали для заражения свежих амеб. Количество бактерий определяли по КОЕ. Показаны среднее и стандартное отклонение (SD) трех повторов (критерий Стьюдента t ; C,> 6 дней, P <0,05; D,> 3 дней, P <0,01). Данные представляют результаты трех независимых экспериментов.
Затем мы проанализировали, влияют ли гены iol на взаимодействия L. pneumophila с A.castellanii с помощью конкурентного анализа амеб (47). При коинфекции A. castellanii в соотношении 1: 1 с родительским штаммом и мутантом Δ iolT (рис. 2C) или Δ iolG (рис. 2D), мутантные штаммы уступили место родительскому штамму в пределах 15 или 6 дней соответственно. Следовательно, мутантный штамм Δ iolG , по-видимому, имеет даже более сильный фенотип, чем мутант Δ iolT в конкурентном анализе амеб. Эти результаты показывают, что iolT и iolG имеют неизбыточную функцию для L.пневмофила-амеба и предполагают, что метаболизм инозита дает патогену преимущество в пригодности.
Инозитол способствует внутриклеточному росту L. pneumophila в зависимости от iolT или iolG . Экспрессия генов кластера iol повышается при внутриклеточном росте L. pneumophila в макрофагах человека (53), что позволяет предположить, что инозит играет роль во внутриклеточном росте L. pneumophila. Оценить влияние инозитола на внутриклеточный рост L.pneumophila у амеб, в качестве считывания мы использовали флуоресценцию GFP или КОЕ.
Добавление 20 мМ инозита к инфицированным L. pneumophila клеткам A. castellanii одновременно с инфекцией (рис. 3A), через 2 часа после заражения (рис. 3B) или через 4 часа после заражения (см. Рис. S2 в дополнительном материале) способствует внутриклеточному росту бактерий, о чем свидетельствуют повышенные уровни флуоресценции GFP. Инозитол не увеличивал скорость роста экспоненциально растущих бактерий, но приводил к увеличению числа клеток после 24 часов после инфицирования, что позволяет предположить, что субстрат можно использовать только на более поздних стадиях инфекции.Стимуляция роста зависела от iolT , поскольку добавление 20 мМ инозита к A. castellanii, инфицированному мутантом Δ iolT , не приводило к более высоким уровням флуоресценции GFP (фиг. 3A и B). Без добавления инозита мутант Δ iolT рос внутриклеточно по сравнению с родительским штаммом в используемых условиях. Наконец, L. pneumophila Δ icmT , лишенная функционального Icm / Dot T4SS, вообще не росла, т.е. флуоресценция GFP не увеличивалась на протяжении всего эксперимента (данные не показаны).
Рис. 3.Инозитол способствует внутриклеточному росту L. pneumophila в зависимости от iolT или iolG . A. castellanii инфицировали (MOI, 20) L. pneumophila JR32, мутантом Δ iolT или мутантом Δ iolG , несущим плазмиду pNT28 (конститутивная продукция GFP). Инозитол в концентрации от 20 до 50 мМ добавляли одновременно с инфекцией (A) или через 2 часа после инфицирования (B и E), и внутриклеточную репликацию определяли по флуоресценции. (C и F) A. castellanii или (D) мышиный RAW 264.7 макрофагов были инфицированы (MOI, 0,1) L. pneumophila JR32, мутантом Δ iolT или мутантом Δ iolG , не несущим плазмиду (C и D) или векторный контроль (pCR033), iolT (pCM020). , или iolG (pCM023) под контролем промотора P tac (F). Инозитол в концентрации 20 мМ добавляли через 4 часа после инфицирования, клетки лизировали через 3 дня (C и F) или 2 дня (D) после инфицирования и определяли КОЕ, высевая соответствующие разведения на чашки с агаром CYE.rfu, относительные единицы флуоресценции. Показаны среднее значение и стандартное отклонение трех повторов (критерий Стьюдента t ; *, P <0,05; A,> 28 ч, P <0,05; B,> 44 ч, P <0,01; E,> 29 h, P <0,05). Данные представляют результаты трех независимых экспериментов.
Используя КОЕ в качестве считываемых данных, добавление 20 мМ инозита к штамму L. pneumophila JR32, растущему в A. castellanii (фиг. 3C) или в мышиных макрофагах (фиг. 3D), также способствовало внутриклеточному росту.В этих условиях инозит давал примерно на 20-25% больше КОЕ в течение 2-3 дней эксперимента. Инозитол не влиял на внутриклеточный рост мутанта Δ iolT , и у мутантного штамма не нарушался внутриклеточный рост per se (фиг. 3C и D).
Внутриклеточный рост L. pneumophila в присутствии или в отсутствие инозита также тестировали с мутантным штаммом Δ iolG (фиг. 3E). Опять же, добавление инозита к A. castellanii, инфицированному штаммом JR32, приводило к повышенным уровням флуоресценции GFP.Однако L. pneumophila, лишенная iolG , показала небольшой внутриклеточный дефект роста, в отличие от мутанта Δ iolT . Следовательно, аналогично тесту конкуренции амеб (рис. 2C и D), анализ внутриклеточной репликации выявил более сильный фенотип для мутанта Δ iolG , чем для мутанта Δ iolT . По аналогии с мутантом Δ iolT , добавление до 50 мМ инозита к A. castellanii через 2 часа после инфицирования мутантом Δ iolG не привело к более высоким уровням флуоресценции GFP, что указывает на то, что iolG также требуется для роста стимуляция инозитом (рис.3E).
Наконец, мы проверили, дополняет ли iolT или iolG отсутствие ответа на инозит у соответствующих мутантных штаммов Δ iolT и Δ iolG (рис. 3F). Действительно, инозитол значительно увеличивал КОЕ, полученный для мутанта Δ iolT или мутанта Δ iolG , несущего плазмидный iolT или iolG под контролем промотора P tac . Таким образом, добавление инозита к L.Зараженные пневмофилой A. castellanii или макрофаги способствуют внутриклеточному росту бактерий, зависящему от генов iolT или iolG , и отсутствие ответа мутантных штаммов может быть дополнено предоставлением соответствующего гена на плазмиде. Таким образом, инозитол метаболизируется посредством генов иол внутриклеточной L. pneumophila в фагоцитах простейших и млекопитающих.
Транспорт углеводов в просвет LCV инфицированных амеб. Наблюдаемая стимуляция внутриклеточного роста L.pneumophila путем добавления инозита через несколько часов после заражения может быть результатом прямого метаболизма углеводов патогеном в LCV или косвенным эффектом, когда клетка-хозяин метаболизирует инозит, а затем бактерии используют более доступные метаболиты, такие как аминокислоты. Для осуществления прямого метаболизма инозита (или любого другого субстрата) соединение должно достичь просвета LCV после поступления извне в инфицированную клетку-хозяин. Чтобы проверить внутриклеточную судьбу инозита, мы использовали социальную почвенную амебу Dictyostelium discoideum, универсальную модель для оценки образования LCV и внутриклеточной репликации L.пневмофила. Подобно A. castellanii (рис. 3B и E), добавление 10 мМ инозита к D. discoideum, инфицированному L. pneumophila, через 2 часа после инфицирования способствовало внутриклеточному росту родительского штамма JR32, но не мутанта Δ iolT или Δ мутант iolG (рис. 4А). Таким образом, L. pneumophila, по-видимому, использует инозитол у D. discoideum и A. castellanii amoebae аналогичным образом.
Рис. 4Роль метаболизма инозита L. pneumophila в D. discoideum и накопление 2-NBDG в LCV.(A) D. discoideum amoebae были инфицированы (MOI, 10) L. pneumophila JR32, мутантом Δ iolT или мутантом Δ iolG , несущим плазмиду pNT28 (конститутивная продукция GFP). Инозитол в концентрации 20 мМ добавляли через 2 часа после инфицирования и определяли внутриклеточную репликацию по флуоресценции. Данные представляют собой средние значения и стандартное отклонение для трех повторов (тест Стьюдента t ; JR32 с инозитом или без него, P <0,05 через 32-47 ч; JR32 по сравнению с мутантом Δ iolT или мутантом Δ iolG , P <0.01 с 23 до 32 часов). (B) D. discoideum инфицировали (MOI, 10) L. pneumophila (Lpn) JR32, мутантом Δ iolT , мутантом Δ iolG , мутантом Δ icmT или мутантом Δ rpoS , несущим плазмиду pSW001 ( конститутивная продукция DsRed) в течение 1 ч. Инфицированные амебы промывали и инкубировали с 20 мкМ 2-NBDG в течение 30 мин. Впоследствии амебы снова промывали и фиксировали параформальдегидом (PFA), окрашивали DAPI и подвергали флуоресцентной микроскопии (B и C) или гомогенизировали с использованием шарикового гомогенизатора, фиксировали PFA на покрытых поли-l-лизином покровных стеклах. и окрашивали на LCV-связанные L.pneumophila эффекторный SidC (D). Масштабные линейки = 5 мкм. (C) Среднее и стандартное отклонение 2-NBDG-положительных LCV количественно определяли в трех независимых экспериментах, подсчитывая по меньшей мере 50 LCV на эксперимент.
Чтобы проверить, может ли экзогенно добавленный углеводный субстрат достичь LCV, мы использовали зеленый флуоресцентный аналог глюкозы, 2-дезокси-2 — [(7-нитро-2,1,3-бензоксадиазол-4-ил) амино] — d-глюкоза (2-NBDG). Клетки D. discoideum обрабатывали 2-NBDG через 1 час после заражения штаммами L. pneumophila, а накопление зонда в просвете LCV контролировали с помощью флуоресцентной микроскопии.Действительно, у D. discoideum, инфицированного штаммом JR32 L. pneumophila, продуцирующим DsRed, мутантом Δ iolT или мутантом Δ iolG 2-NBDG точечно локализовался внутри амеб, а флуоресцентный аналог глюкозы накапливался. в непосредственной близости от внутриклеточных бактерий, т. е. в просвете LCV (рис. 4B). Количественная оценка 2-NBDG-положительных патогенных вакуолей в интактных инфицированных амебах показала, что примерно 60% LCV, несущих штамм L. pneumophila JR32, мутант Δ iolT или мутант Δ iolG , были положительными по флуоресцентному аналогу глюкозы ( Инжир.4С). Напротив, значительно меньше 2-NBDG накапливалось вокруг мутантных бактерий, продуцирующих DsRed, без функционального Icm / Dot T4SS (Δ icmT мутант) или альтернативного сигма-фактора RpoS (Δ мутант rpoS ). У D. discoideum, инфицированного этими мутантными штаммами, только около 30% патогенных вакуолей были 2-NBDG-положительными. Мутантные штаммы Δ icmT и Δ rpoS являются дефектными для внутриклеточного роста и не образуют разрешающих репликацию LCV, а скорее локализуются в бактерицидных фаголизосомах.
Результаты, полученные с интактным инфицированным D. discoideum, были также подтверждены анализом LCV в гомогенатах амеб, инфицированных L. pneumophila JR32 (рис. 4D). Инфицированные клетки гомогенизировали после инкубации с 2-NBDG, тщательно промывали и затем окрашивали на SidC, эффекторный белок L. pneumophila, который специфически локализуется на мембранах LCV. При использовании этого подхода примерно 60% LCV были окрашены положительно на 2-NBDG, аналогично тому, что наблюдалось с интактными амебами, инфицированными L. pneumophila.Поскольку образцы промывали несколько раз в ходе экспериментов, наблюдаемая флуоресценция сохранялась внутри ограниченных мембранами отсеков, подтверждая, что 2-NBDG накапливается в просвете LCV инфицированных амеб. Взятые вместе, флуоресцентный аналог глюкозы 2-NBDG накапливается в разрешающем репликацию LCV, но не в бактерицидном отсеке. Результаты предполагают, что внутриклеточная L. pneumophila использует углеводы (глюкозу и инозитол), которые напрямую транспортируются из внеклеточной среды в просвет LCV и не метаболизируются ранее клеткой-хозяином.Это мнение также согласуется с выводом о том, что наблюдаемая стимуляция внутриклеточного роста инозитом требует наличия интактного пути деградации инозита.
L. pneumophila lpg1653 кодирует переносчик инозита. Поскольку инозитол способствует внутриклеточному росту L. pneumophila и, по-видимому, непосредственно метаболизируется, мы затем проанализировали, может ли L. pneumophila поглощать и использовать инозит. Несмотря на то, что инозитол не оказывал стимулирующего эффекта на рост в сложной среде или определенной минимальной среде (рис.2А и В; см. также рис. S1 в дополнительном материале), мы выбрали из соображений простоты анализ транспорта инозита внеклеточными бактериями. С этой целью бактерии выращивали до фазы постэкспоненциального роста в среде AYE и инкубировали с радиоактивно меченным [U- 14 C 6 ] инозитом. Обработанные бактерии центрифугировали на фильтрующих дисках из нитрата целлюлозы, промывали и определяли связанную с клетками радиоактивность на фильтрах с использованием жидкостного сцинтилляционного счетчика.
Действительно, Л.pneumophila штамм JR32 действительно поглощал [U- 14 C 6 ] инозит, а связанная с клетками радиоактивность достигала максимума через 30 мин и оставалась стабильной в течение по крайней мере 90 мин (фиг. 5A). Напротив, для мутантного штамма Δ iolT не измеряли радиоактивность, связанную с клетками. Этот дефект поглощения был дополнен экспрессией lpg1653 из плазмиды. Таким образом, lpg1653 был идентифицирован как ген транспортера инозита iolT , и соответствующий белок был назван IolT в отношении описанных транспортеров инозита из B.subtilis и S. enterica (37, 54). Аналогичные исследования поглощения инозита были выполнены с мутантным штаммом L. pneumophila Δ iolG . Подобно родительскому штамму (но в отличие от мутанта Δ iolT ), мутант Δ iolG накапливал [U- 14 C 6 ] инозит в течение 20-30 минут, а радиоактивность, связанная с клетками, оставалась стабильной. в течение не менее 90 мин (рис. 5В).
Рис. 5L. pneumophila lpg1653 кодирует переносчик инозита.(A и B) L. pneumophila JR32, мутант Δ iolT или мутант Δ iolT , несущий плазмиду pCM020 ( iolT под контролем P tac ) (A) или Δ iolG Мутант (B) выращивали до фазы постэкспоненциального роста, добавляли 10 мМ инозита, смешанного с 1% [U- 14 C 6 ] инозита, и клетки дополнительно инкубировали. Через 0, 10, 20, 30, 60 и 90 мин отбирали образцы, клетки вращали на дисках с фильтром из ацетата целлюлозы и измеряли радиоактивность, связанную с клетками, с использованием жидкостного сцинтилляционного счетчика.L. pneumophila JR32, мутант Δ iolT (C) или мутант Δ iolG (D) выращивали до фазы экспоненциального роста, 10 мМ инозитола, смешанного с 1% [U- 14 C 6 ] инозитол добавляли, и клетки дополнительно инкубировали. Через 0, 2, 4, 6 и 8 ч образцы отбирали и смешивали с 50% трихлоруксусной кислотой. Образцы инкубировали на льду в течение 1 ч, центрифугировали на фильтрующих дисках из нитрата целлюлозы, промывали и определяли радиоактивность, связанную с фильтром, с использованием жидкостного сцинтилляционного счетчика.Данные взяты из одного эксперимента и представляют результаты трех независимых экспериментов.
Чтобы проверить, катаболизируется ли инозит и включается ли в клеточное вещество L. pneumophila, бактерии, экспоненциально растущие в среде AYE, инкубировали с [U- 14 C 6 ] инозитолом в течение нескольких часов, и каждые 2 часа образцы подвергали анализу. взяты и смешаны с трихлоруксусной кислотой для осаждения белков. Затем образцы центрифугировали на фильтрующих дисках из нитрата целлюлозы, и включение радиоактивности в нерастворимую в кислоте фракцию измеряли с помощью жидкостного сцинтилляционного счетчика.Для родительского штамма JR32 радиоактивность неуклонно увеличивалась в течение 8-часового периода времени, что указывает на то, что инозит действительно использовался в качестве предшественника макромолекул, в то время как в нерастворимых в кислоте фракциях мутанта Δ iolT радиоактивность обнаружена не была (рис. 5C) или мутантный штамм Δ iolG (рис. 5D).
Таким образом, мы идентифицировали продукт гена lpg1653 ( iolT ) как переносчик инозита IolT, который способствует поглощению инозита L. pneumophila.Следовательно, iolT требуется для включения 14 C-метки в макромолекулы. Напротив, продукт гена iolG незаменим для транспорта инозита, но по-прежнему необходим для метаболизма инозита, что согласуется с его предполагаемой функцией как инозитол-2-дегидрогеназа.
Экспрессия P иол регулируется RpoS и доступностью серина. Предсказанный и экспериментально подтвержденный промотор оперона иол , P иол , локализуется в области 400 пар оснований между генами. lpg1653 и lpg1654 (рис.1). Никакого другого промотора в опероне иол не предвидится. Чтобы проверить экспрессию оперона в различных условиях, была сконструирована репортерная плазмида с нестабильным вариантом GFP (ASV) под контролем P иол (pCM007).
Экспрессию оперона иол оценивали в бульоне AYE по флуоресценции GFP культур L. pneumophila, разбавленных до исходного значения OD 600 , равного 0,1. При анализе штамма JR32 экспрессия P iol начала увеличиваться через 6 часов, достигла пика примерно через 13 часов и снова резко снизилась в течение 24-часового периода роста (рис.6А). Таким образом, самые высокие уровни экспрессии P иол наблюдались в фазе позднего экспоненциального роста L. pneumophila. Добавление 10 мМ инозита не изменяло экспрессию iol , и, следовательно, доступность инозита, по-видимому, не регулирует саморегуляцию деградации инозита. Интересно, однако, что добавление 6 мМ серина приводило к более высоким уровням экспрессии P иол и сдвигало максимальный уровень примерно с 13 до 16 часов роста (рис.6А).
Рис. 6. ЭкспрессияiolT регулируется RpoS и доступностью серина. Экспоненциально растущие культуры штамма L. pneumophila JR32 (A), мутанта Δ lqsR (B) или мутанта Δ rpoS (C), несущего плазмиду pCM007 [нестабильный GFP (ASV) под контролем P iol. ] разбавляли до исходной OD 600 0,1 в бульоне AYE. Бактерии выращивали при 37 ° C с 10 мМ инозитола или 6 мМ серина или без добавления дополнительных питательных веществ.Оптическую плотность при 600 нм и флуоресценцию GFP измеряли каждый час в течение 24 часов, и результаты наносили на график с относительными флуоресцентными единицами (rfu) в зависимости от OD 600 во времени. (D) L. pneumophila JR32 или мутант Δ rpoS выращивали до OD 914 0,5, 1,0, 2,0 и 3,0. В этих точках отбирали образцы, добавляли 10 мМ инозита, смешанного с 1% [U- 14 C 6 ] инозитола, и бактерии дополнительно инкубировали в течение 20 минут. Клетки центрифугировали на дисках фильтров из ацетата целлюлозы и промывали, и радиоактивность, связанную с фильтром, определяли в жидкостном сцинтилляционном счетчике.Показаны среднее значение и стандартное отклонение для трех повторов (тест Стьюдента t ; A и B [серин по сравнению с отсутствием],> 14 ч, P <0,05; D, OD 600 ,> 1,0, P <0,05) . Данные представляют результаты трех независимых экспериментов.
Затем мы проанализировали роль системы определения кворума Legionella (Lqs) для экспрессии P iol . Система Lqs продуцирует и отвечает на небольшую сигнальную молекулу 3-гидроксипентадекан-4-он, LAI-1 (55), и является компонентом регуляторной сети стационарной фазы L.pneumophila (14, 47, 56, 57). Чтобы оценить, регулирует ли система Lqs оперон иол , экспрессию P иол анализировали в мутантном штамме, лишенном регулятора ответа LqsR. По сравнению с исходным штаммом различий не обнаружено, и, опять же, инозит не влияет на экспрессию P iol , в то время как серин усиливает ее (фиг. 6B). Практически идентичные результаты были получены для мутантных штаммов L. pneumophila, лишенных lqsA , lqsS , lqsT или lqsS и lqsT (см.рис.S3 в дополнительном материале). Следовательно, экспрессия P iol не регулируется системой Lqs.
Альтернативный сигма-фактор RpoS является центральным регулятором внутриклеточной репликации и дифференцировки L. pneumophila (11, 12, 58) и регулирует многие гены в стационарной фазе роста (13, 59). Чтобы проверить, контролирует ли RpoS экспрессию оперона iol , репортерную конструкцию P iol анализировали на штамме L. pneumophila, лишенном rpoS .В мутанте Δ rpoS экспрессия иол была значительно снижена по сравнению с таковой в родительском штамме, что указывает на то, что P иол действительно регулируется RpoS (фиг. 6C). Инозит не влиял на экспрессию P iol в мутантном штамме Δ rpoS , аналогично тому, что наблюдалось у L. pneumophila JR32 или мутантного Δ lqsR . Однако, в отличие от этих штаммов, серин также не влиял на экспрессию P iol в мутанте Δ rpoS .
Регулирование оперона иола L. pneumophila с помощью RpoS было подтверждено в экспериментах по измерению поглощения [U- 14 C 6 ] инозитола на разных стадиях роста (фиг. 6D). При OD 914 0,5 (ранняя фаза экспоненциального роста) не было измерено связанной с клетками радиоактивности для штамма L. pneumophila JR32 или мутанта Δ rpoS , и, таким образом, штаммы не переносили и не накапливали инозит. Однако, в то время как для родительского штамма повышенная радиоактивность обнаруживалась при OD 600 из 1.0 (фаза экспоненциального роста), 2,0 (фаза позднего экспоненциального роста) и 3,0 (фаза стационарного роста), радиоактивность, связанная с клетками, не была измерена для мутанта Δ rpoS в любой момент времени (фиг. 6D) . Таким образом, эти результаты показывают, что альтернативный сигма-фактор RpoS регулирует фазу роста и серин-зависимую экспрессию оперона иол и захват инозитола. L. pneumophila транспортирует инозит уже на ранних стадиях роста, но самые высокие уровни транспорта и экспрессии P иол наблюдались в фазе позднего экспоненциального / постэкспоненциального роста.
ОБСУЖДЕНИЕ
В этом исследовании мы показываем, что L. pneumophila метаболизирует инозит, способствуя внутриклеточному росту и вирулентности. Хотя инозитол явно влиял на внутриклеточный рост бактерий, углевод не стимулировал внеклеточный рост L. pneumophila в нескольких различных используемых средах (AYE, CDM и MDM). AYE — это сложная среда, содержащая дрожжевой экстракт и неопределенные источники углерода. CDM и MDM не содержат углеводов или глицерина; тем не менее, обе среды содержат аминокислоты в миллимолярном диапазоне, которые, вероятно, служат источниками углерода для L.пневмофила. Поскольку серин положительно влияет на экспрессию кластера иол , катаболическая репрессия из-за этой аминокислоты (или, возможно, в целом), по-видимому, не объясняет наблюдаемое отсутствие стимуляции роста инозитом в этих средах.
В метаболизме инозита участвует транспортер инозита IolT, а также инозитол-2-дегидрогеназа IolG. Гены L. pneumophila, необходимые для катаболизма инозита, организованы в оперон от lpg1653 до lpg1649 .Все гены оперона обнаруживают высокое сходство с соответствующими генами катаболизма инозита у B. subtilis или S. enterica (37, 39). Однако ни один ген, кодирующий малонат-полуальдегиддегидрогеназу IolA и бисфосфатальдолазу IolJ, не обнаружен ни в опероне, ни где-либо еще в геноме L. pneumophila.
У L. pneumophila метилмалонат-полуальдегиддегидрогеназа MmsA (Lpg0129) может заменять IolA, как предсказано в Киотской энциклопедии генов и геномов (KEGG [http: // www.genome.jp/kegg/kegg2.html]). Тем не менее, MmsA использует метилмалонат в качестве субстрата, продуцирующего пропионил-КоА, в то время как IolA использует малонатный полуальдегид в качестве субстрата, продуцирующего ацетил-КоА. Интересно, что фермент B. subtilis, соответствующий MmsA, использует метилмалонат-полуальдегид или малонат-полуальдегид в качестве субстрата для реакций дегидрогеназы, продуцируя пропионил-КоА или ацетил-КоА соответственно (60, 61). Поскольку L. pneumophila и B. subtilis MmsA имеют 42% идентичности на аминокислотном уровне, фермент Legionella может также катализировать дегидрирование метилмалонат-полуальдегида, а также малонат-полуальдегида.
Труднее найти замену для IolJ, явно отсутствующую у L. pneumophila. IolJ катализирует альдолазную реакцию с 2-дезокси-5-кето-d-глюконат-6-фосфатом в качестве субстрата, давая дигидроксиацетонфосфат и малонатный полуальдегид. S. enterica также не содержит гомолога iolJ , но может расти на инозите в качестве единственного источника углерода и энергии (39), в отличие от L. pneumophila. Возможно, неидентифицированная альдолаза L. pneumophila может заменить IolJ.В качестве альтернативы L. pneumophila может использовать новый катаболический путь инозита, как показано для Thermotoga maritima (62). Однако это маловероятно, поскольку все другие белки, кодируемые кластером иол , напоминают ферменты, описанные в B. subtilis и S. enterica.
Метаболизм инозита у B. subtilis, S. enterica или L. casei регулируется IolR (37, 38, 54). В отсутствие инозита IolR связывается как репрессор с операторными последовательностями транспортера инозита ( iolT ) и генами метаболизма, а если инозитол доступен, катаболический интермедиат метаболизма инозита действует как дерепрессор IolR (37, 63). .L. pneumophila не содержит гомолога iolR , и, соответственно, добавление инозита не влияет на экспрессию iol . Однако экспрессия иол положительно регулируется аминокислотой серином. Серин может напрямую воздействовать на регуляторные белки, чтобы контролировать экспрессию генов, как показано для регуляции генов аргинином (64). Поскольку серин является основным источником углерода для L. pneumophila, аминокислота может косвенно регулировать экспрессию иол и других генов через связь с общим метаболическим состоянием бактерий, которое контролируется строгим регуляторным каскадом ответа и второй мессенджер гуанозин-3 ‘, 5’-бипирофосфат (ppGpp).
«Алармон» гуанозинтетрафосфата (ppGpp) контролирует переключение между репликативной / неподвижной и стационарной / трансмиссивной формами L. pneumophila в ответ на ограничение аминокислот или других питательных веществ (65, 66). Сигнал синтезируется двумя ферментами L. pneumophila, RelA и SpoT. RelA — это связанный с рибосомой фермент, который активируется, когда незаряженные тРНК накапливаются в рибосоме из-за низкого уровня аминокислот в клетке (67). SpoT взаимодействует с белком-носителем ацила (ACP) и активируется за счет снижения скорости биосинтеза жирных кислот или повышения уровня короткоцепочечных жирных кислот (68).Таким образом, фермент синтезирует ppGpp путем мониторинга биосинтеза жирных кислот. Кроме того, во время экспоненциального роста SpoT действует как гидролаза ppGpp, которая поддерживает низкую концентрацию алармона (67). В предыдущем исследовании мы показали, что метаболизм серина приводит к высокой скорости биосинтеза жирных кислот (28), и, таким образом, SpoT-зависимые клеточные уровни ppGpp, вероятно, снижаются в этих условиях.
Альтернативный сигма-фактор RpoS — еще один ключевой регулятор оперона iol в L.пневмофила. Мы показываем здесь, что в мутантном штамме Δ rpoS экспрессия иол снижена и нечувствительна к серину. В соответствии с этими результатами, iolG подавляется в L. pneumophila, лишенном rpoS , при внеклеточном росте в воде (69). Более того, RpoS положительно регулирует углеводный обмен во время внутриклеточного размножения L. pneumophila (13). Альтернативный сигма-фактор и строгий ответ (SpoT) связаны через петлю отрицательной обратной связи: во время экспоненциального роста концентрация ppGpp в клетке низкая из-за доступности питательных веществ и активности ppGpp гидролазы SpoT, что приводит к выражению генов метаболизма с помощью RpoS (69).Когда количество питательных веществ становится ограничивающим и концентрация ppGpp в клетке повышается, стабильность и активность RpoS изменяются, а профиль экспрессии переключается на признаки вирулентности и передачи (13, 59).
В фазе стационарного роста RpoS положительно регулирует множество генов, связанных с вирулентностью, включая те, которые кодируют эффекторные белки, транслоцированные Icm / Dot, малые регуляторные РНК и двухкомпонентные системы (13). Роль RpoS в регуляции вирулентности, а также метаболизма инозита согласуется с представлением о том, что инозитол используется L.пневмофила. Действительно, мутантные штаммы, лишенные iolT или iolG , имели серьезные недостатки в пригодности по сравнению с родительским штаммом, а инозитол стимулировал внутриклеточный рост, зависящий от IolT и IolG, в A. castellanii, D. discoideum и мышиных макрофагах. Кроме того, транскриптом L. pneumophila, растущего в макрофагах, предполагает, что инозитол используется бактериями в качестве источника углерода, поскольку экспрессия iolG и iolCB повышена более чем в 2 раза по сравнению с экспоненциально растущими бактериями (53). .
Инозитол, вероятно, метаболизируется непосредственно внутриклеточной L. pneumophila, находящейся в LCV. Это подтверждается следующими выводами: (i) инозит (а не «вторичный продукт») метаболизируется, поскольку стимуляция внутриклеточного роста углеводом зависит от iolT или iolG , (ii) инозитол достигает LCV после закрытие фагосом и образование патогенных вакуолей, поскольку соединение способствует росту при добавлении через несколько часов после заражения, (iii) флуоресцентный аналог глюкозы 2-NBDG накапливается в вакуолях, содержащих штамм JR32, но не мутантные бактерии icmT , и (iv) глицерин и глюкоза также достигают LCV во время внутриклеточного роста L.pneumophila у A. castellanii (28). Примечательно, что по сравнению с LCV, на 50% меньше вакуолей, содержащих icmT (или rpoS ) мутантных бактерий, накапливающих 2-NBDG, что указывает на то, что для транспорта углеводов требуется ремоделирование вакуолей с помощью функционального Icm / Dot T4SS. Мы использовали 2-NBDG в качестве суррогатного сахарного субстрата, поскольку флуоресцентный аналог инозита недоступен. Следовательно, этот подход может быть применим, если внеклеточные углеводы достигают просвета LCV посредством макропиноцитотических процессов, но не при вовлечении сахароспецифических трансмембранных транспортеров.
2-NBDG был использован для изучения поглощения и метаболизма глюкозы в различных организмах и предположительно транспортируется каноническими переносчиками глюкозы клетки (70). Таким образом, импорт в LCV может опосредоваться переносчиками клеток-хозяев, приобретенными путем слияния с эндосомными или секреторными везикулами. Действительно, транспортные белки семейства переносчиков растворенных веществ, включая переносчики аминокислот и глюкозы, были идентифицированы в протеоме очищенных LCV (71), а L. pneumophila использует переносчики аминокислот клетки-хозяина для своего питания (72).Альтернативно, 2-NBDG может достигать LCV посредством эндоцитозного поглощения, такого как макропиноцитоз и последующие процессы слияния мембран. D. discoideum amoebae поглощает материал жидкой фазы посредством макропиноцитоза (73) и, предположительно, также накапливает 2-NBDG посредством этого процесса. Для гетеротрофных растительных клеток было показано, что 2-NBDG и, следовательно, вероятно, глюкоза, инозитол или другие субстраты также могут захватываться эндоцитарными процессами и накапливаться в везикулах и вакуолях (74). Эндоцитарные события могут также объяснить (менее эффективное) накопление 2-NBDG в вакуолях, содержащих L.pneumophila, лишенная функционального Icm / Dot T4SS.
Icm / Dot-транслоцированные эффекторные белки также могут играть роль в приобретении инозита L. pneumophila во время внутриклеточного роста. LppA представляет собой цистеинфитазу, транслоцированную Icm / Dot T4SS, которая, по-видимому, детоксифицирует бактериостатический фитат в инфицированных амебах, продуцируя хелатор в миллимолярных количествах (36). Бактериальная фитаза LppA может способствовать внутриклеточной репликации не только за счет увеличения доступности питательных микроэлементов (железа) для L.pneumophila, но также путем производства из фитат-инозитолфосфатов или инозита, которые могут использоваться бактериями. Переносчики инозита из семейства 5 и семейства 2 переносчиков растворенных веществ способствуют захвату инозита в клетках млекопитающих (75) и, возможно, также в LCV. Бактериальный переносчик инозита IolT может затем импортировать инозит из просвета LCV в бактериальную клетку, где он метаболизируется.
В совокупности имеющиеся данные указывают на то, что инозит метаболизируется с помощью продуктов гена iol L.pneumophila во время внутриклеточного роста. Инозитол также поглощается и, предположительно, используется во внеклеточных условиях. Эти результаты расширяют доказанные метаболические возможности L. pneumophila за счет другого источника углеводного углерода. Дальнейшие исследования метаболизма инозита с помощью L. pneumophila выяснят его подробные механизмы и прояснят, вносит ли инозитол вклад в двусторонний метаболизм L. pneumophila и каким образом (28). Эти исследования прольют новый свет на питание Legionella spp., особенно внутри клеток-хозяев, и его влияние на вирулентность.
