Методическая разработка по биологии «Особенности строения и жизнедеятельности эвглены зелёной. Колониальные жгутиковые
Дата:
Предмет: биология.
Учитель: Логинова А. А.
Урок № 5.
Класс: 7-е.
Тема: «Особенности строения и жизнедеятельности эвглены зелёной. Колониальные жгутиковые»
Цель: Познакомить учащихся со строением и жизнедеятельностью зеленой эвглены, обосновав ее промежуточное положение между растительным и животным царствами; показать усложнение в строении организации колониальных форм жгутиковых, и значение жгутиконосцев в природе и жизнедеятельности человека.
Задачи:
Образовательные: раскрыть особенности строения и процессов жизнедеятельности эвглены зеленой;
Развивающие: формировать умения и навыки самостоятельной работы с учебником; выделять главное, формулировать выводы;
Воспитательные: воспитание
бережного отношения к природе. продолжать формирование здорового образа жизни.
Тип урока: урок изучения нового материала.
Оборудование: Учебник, презентация.
План урока:
I. Организационный момент.
II. Актуализация опорных знаний.
Давайте вспомним:
1) Что изучает биология?
2) Какие биологические науки вам известны?
3) Каких древних ученых-биологов вы знаете?
4) Какие организмы называют простейшими?
5) На какие группы делятся простейшие?
6) Каковы общие признаки внешнего строения одноклеточных?
III. Мотивация и целеполагание
Сегодня мы преступим к изучению одноклеточных животных и более подробно поговорим об эвглене зеленой.
IV. Изложение нового материала.
V. Физкультминутка
VI. Продолжение изложения материала.
Рассказ учителя с демонстрацией презентации.
VII. Повторение новой темы.
— тонкие вопросы
1.
2. С помощью чего она передвигается?
3. Что образует при наступлении неблагоприятных
условий?
— толстые вопросы
1. Почему эвглена и автотроф и гетеротроф?
2. Сравните способ питания амебы и эвглены зеленой.
3. Что общего у амебы и эвглены зеленой.
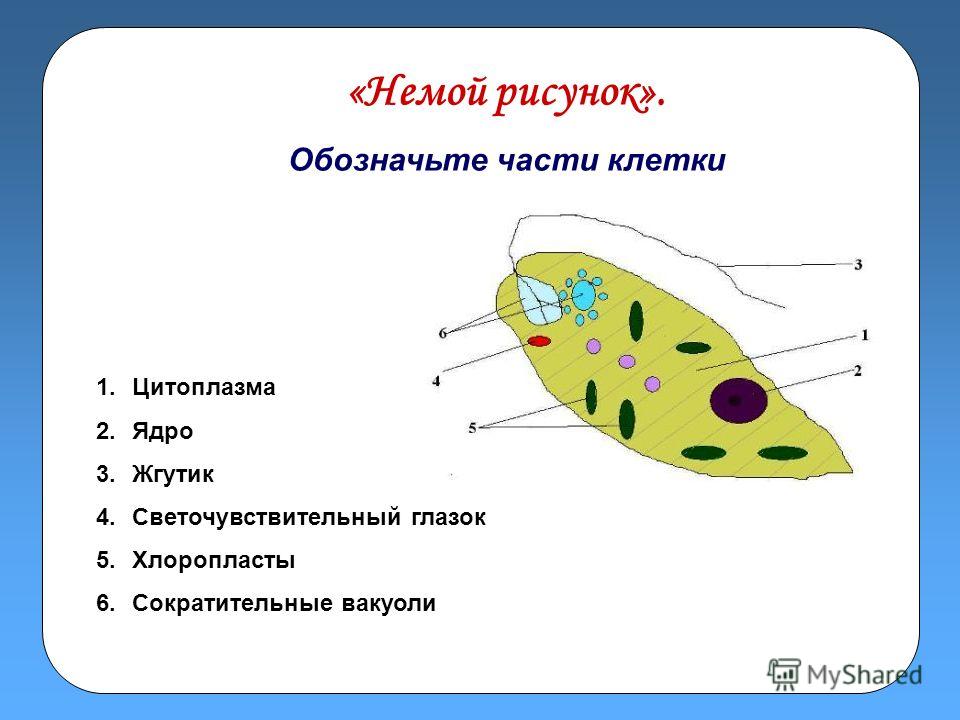
1) зарисовать строение эвглены зеленой и подписать органоиды клетки (рисунок выдан).
2) дифференцированные задания (индивидуальный подход к талантливым и одаренным детям). Карточки с заданиями прилагаются.
Ответы:
1) I.Саркодовые(Корненожки)–А,Г,Е,Ж.
II.Жгутиковые–Б,В,Д,З,И.
2) I. Амеба обыкновенная –
А, Б, В, Г, Д, И.
II. Эвглена зеленая – А, Б, В, Е, Ж, З, И.
VIII. Выставление оценок с комментированием.
IX. Домашнее задание.
I.
Организационный момент.
Вводная часть. Объявление темы и цели урока.
II. Актуализация опорных знаний
Давайте вспомним:
1) Что изучает биология?
2) Какие биологические науки вам известны?
3) Каких древних ученых-биологов вы знаете?
4) Какие организмы называют простейшими?
5) На какие группы делятся простейшие?
6) Каковы общие признаки внешнего строения одноклеточных?
III. Мотивация и целеполагание
Сегодня мы преступим к изучению одноклеточных животных и более подробно поговорим об эвглене зеленой.
IV. Изложение нового материала.
У активно передвигающихся
простейших — жгутиконосцев имеются специальные выросты на поверхности клетки,
называемые органоидами движения. Представители жгутиконосцев — одноклеточные
организмы, органоидами движения которых служат длинные выросты, называемые
жгутиками. Число жгутиков у разных видов разное — от одного до нескольких
сотен. Биологию жгутиконосцев можно рассмотреть на примере эвглены зеленой.
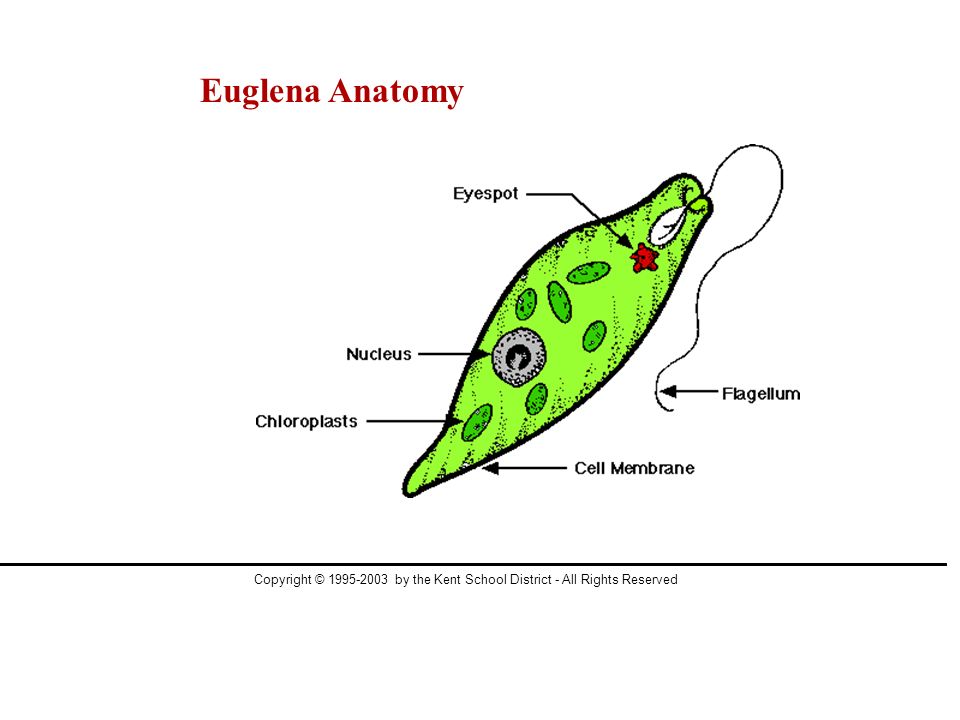
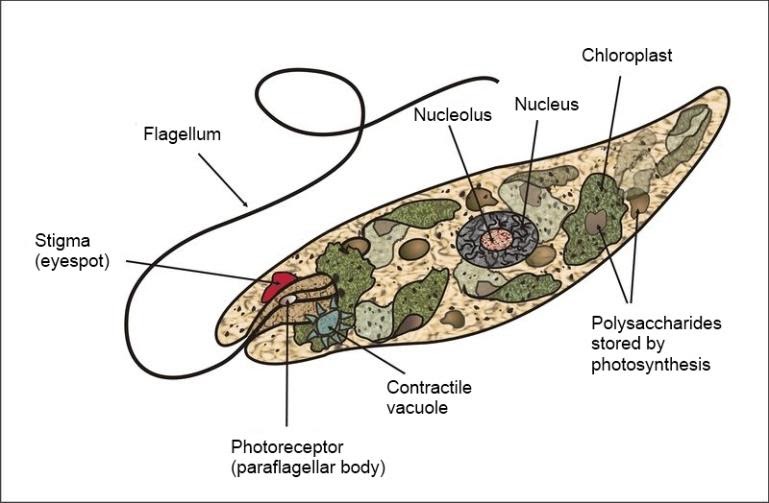
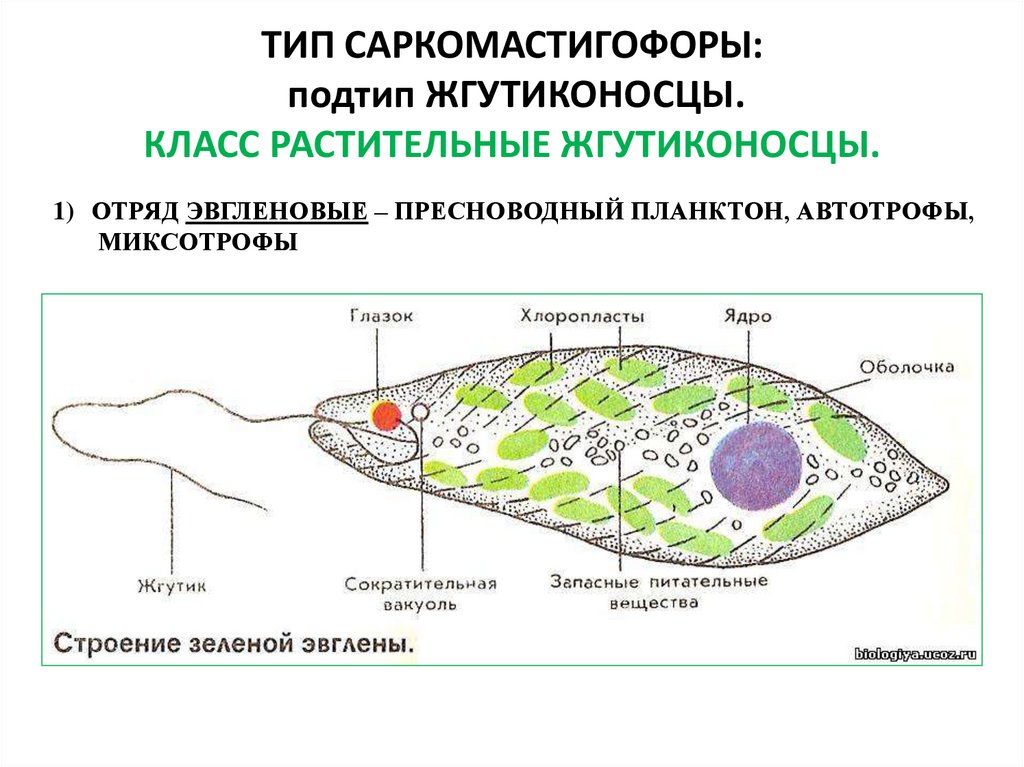
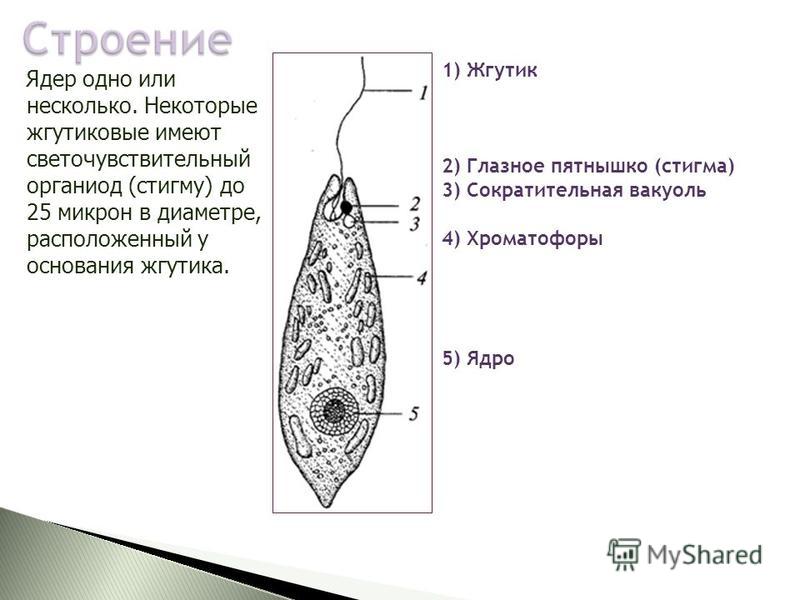
Среда обитания, строение и передвижение. Эвглена зеленая живет в сильно загрязненных небольших пресных водоемах и часто вызывает «цветение» воды. Тело эвглены покрыто тонкой и эластичной оболочкой — пелликулой, позволяющей сокращаться, вытягиваться и изгибаться. Благодаря пелликуле тело эвглены имеет постоянную веретеновидную форму (рис. 25). На переднем конце тела эвглены имеется один длинный жгутик. Он быстро вращается и тянет эвглену вперед. Во время движения тело эвглены медленно вращается вокруг своей оси в сторону, противоположную вращению жгутика. В основании жгутика находится плотное базальное тельце, которое служит опорой для жгутика. На переднем конце тела расположен клеточный рот и ярко-красный глазок. С его помощью эвглена различает изменения освещенности. В передней части тела расположена сократительная вакуоль, а в задней трети — ядро. В цитоплазме содержатся зеленые хлоропласты, несущие зеленый пигмент — хлорофилл, и пищеварительная вакуоль.
Рис. 25.
Строение эвглены зеленой: 1 — ядро; 2 — сократительная вакуоль; 3 — оболочка; 4
— клеточный рот: 5 — жгугик. 6 — глазок. 7 — базальное тельце; 8—хлоропласта
25.
Строение эвглены зеленой: 1 — ядро; 2 — сократительная вакуоль; 3 — оболочка; 4
— клеточный рот: 5 — жгугик. 6 — глазок. 7 — базальное тельце; 8—хлоропласта
Питание. Эвглена способна менять характер питания в зависимости от условий среды. На свету, благодаря способности к фотосинтезу, ей свойственно автотрофное питание — синтез органических веществ из неорганических. В темноте эвглена питается гетеротрофно — использует готовые органические вещества. Растворенные в воде питательные вещества она способна поглощать через пелликулу. Внутрь цитоплазмы впячивается тонкая трубочка, через которую в клетку всасывается жидкая пища. Вокруг нее образуется пищеварительная вакуоль. Кроме того, благодаря движению жгутика в клеточный рот затягиваются органические микрочастицы. Вокруг них образуются пищеварительные вакуоли, которые двигаются в цитоплазме (как и у амебы). Непереваренные остатки пищи выбрасываются у заднего конца тела.
Дыхание. Эвглена
дышит кислородом, растворенным в воде.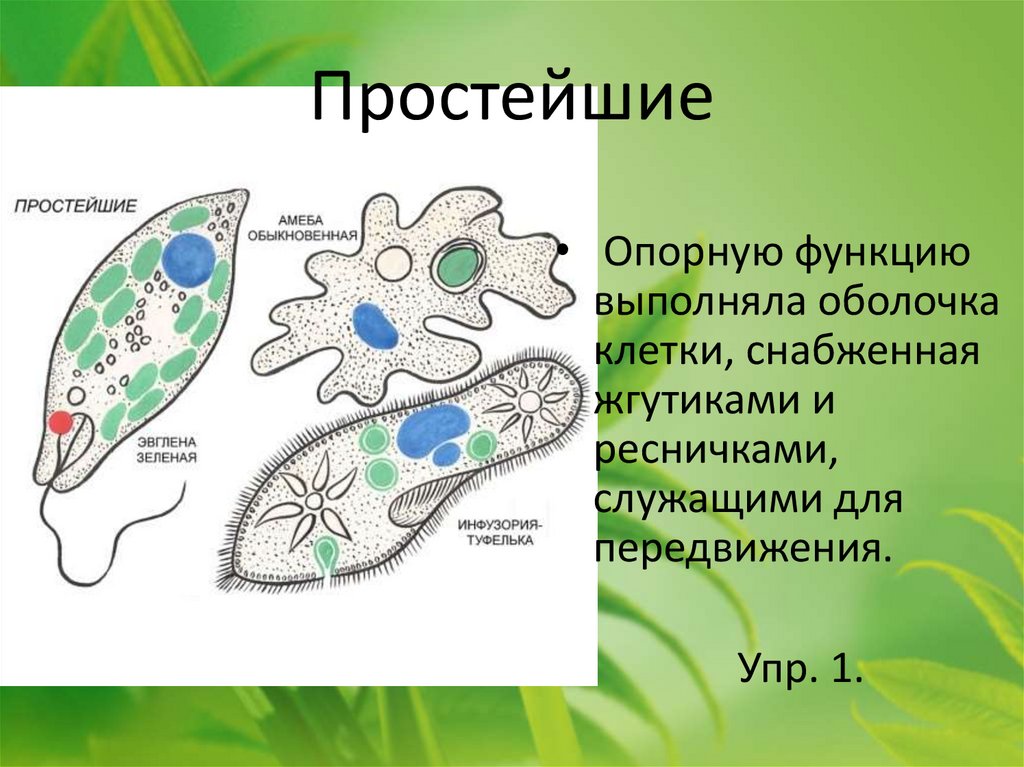 Газообмен происходит, как и у амебы,
через всю поверхность тела. Растворенный в воде кислород поступает в клетку,
где расходуется в процессе жизнедеятельности, наружу выделяется углекислый газ.
Газообмен происходит, как и у амебы,
через всю поверхность тела. Растворенный в воде кислород поступает в клетку,
где расходуется в процессе жизнедеятельности, наружу выделяется углекислый газ.
Выделение. В сократительную вакуоль собираются вредные вещества (продукты распада) и избыток воды, которые потом выталкиваются наружу.
Размножение. Размножается эвглена бесполым путем: клетка делится надвое вдоль продольной оси тела (рис. 26). Сначала разделяется ядро. Затем тело эвглены продольной перетяжкой делится на две примерно одинаковые части. Если в одну из дочерних клеток не попал какой-либо органоид (например, глазок или жгутик), то впоследствии он там образуется.
Рис. 26. Бесполое размножение эвглены
Эвглена
как организм, сочетающий в себе признаки животного и растения. С
одной стороны, эвглене свойственно автотрофнос питание благодаря наличию
хлорофилла, участвующего в фотосинтезе, что характерно для растений. С другой
стороны, как животное эвглена активно двигается, обладает гетеротрофным
питанием — поедает частицы органических веществ, мелких животных, одноклеточные
водоросли. Если эвглена зеленая длительное время находится в темноте, то
хлорофилл у нее исчезает и питается она только органическими веществами.
Если эвглена зеленая длительное время находится в темноте, то
хлорофилл у нее исчезает и питается она только органическими веществами.
Пример с эвгленой зеленой показывает, что граница между животными и растениями достаточно условна. Жгутиконосцы занимают как бы промежуточное положение между растительным и животным царствами. Из растительных жгутиконосцев, подобных эвглене, в древности могли образоваться животные жгутиконосцы.
V. Физкультминутка
Я иду и ты идешь — раз, два, три. (Шагаем на месте.)
Я пою и ты поешь — раз, два, три. (Хлопаем
в ладоши.)
Мы идем и мы поем — раз, два, три. (Прыжки на месте.)
Очень дружно мы живем — раз, два, три. (Шагаем на месте.)
VI. Продолжение изложения материала.
Рассказ учителя с демонстрацией презентации.
Колониальные
жгутиконосцы. Тела
колониальных жгутиконосцев состоят из многих клеток. Вольвокс представляет
собой крупную шарообразную колонию диаметром около 8 мм, на поверхности которой
В один слой располагаются клетки (рис.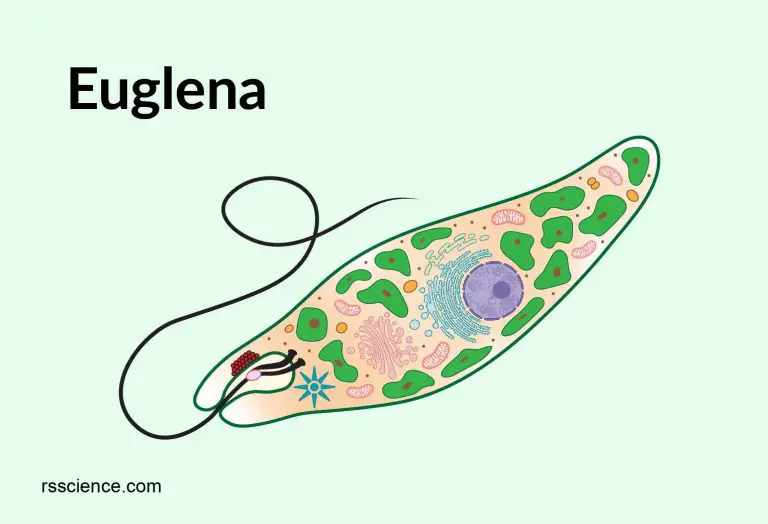
Рис. 27. Колониальные жгутиконосцы: 1 — гониум: 2 — вольвокс
При бесполом размножении у колониальных жгутиковых образуются дочерние колонии. У гониума (рис. 27, 1) каждая клетка колонии способна давать начало новой колонии, а у вольвокса в бесполом размножении могут участвовать лишь 8-10 клеток, они и образуют новые колонии.
Первые колонии возникают вследствие того, что после деления клетки не расходятся, а остаются вместе. Так, гониум образует колонию в виде пластинки, построенной из 16 клеток, расположенных в один слой. В шарообразной колонии эвдорины 32 клетки. Они имеют жгутики, обращенные наружу.
При
половом размножении вольвокса мужские половые клетки образуют 5-10 клеток,
женские — 25-30. Таким образом, в колонии вольвокса существуют различные типы
клеток, что характерно для многоклеточных животных.
Вольвокс может служить моделью, показывающей, как из одноклеточных организмов могли произойти многоклеточные.
Разнообразие жгутиконосцев.
К жгутиконосцам относят более 7000 видов. По характеру питания и обмена веществ их делят на растительных и животных. К жгутиконосцам относится бодо (рис. 28), обитающий в тех же местах, что и растительный жгутиконосец эвглена зеленая. Бодо движется в воде при помощи двух жгутиков, расположенных на переднем конце тела. Это животное не имеет хлорофилла, поэтому ему свойственно только гетеротрофное питание. Пищей ему служат бактерии, одноклеточные водоросли и микроскопические животные, которых бодо при помощи жгутиков подгоняет ко рту и заглатывает.
Рис. 94. Строение жгутиконосца бодо: 1 — клеточный рот; 2 — жгутики; 3 — мембрана; 4 — цитоплазма; 5 — ядро; 6 — митохондрия; 7 — пищеварительная вакуоль
Среди
жгутиконосцев много видов, паразитирующих в теле животных и человека. К таким
паразитическим жгутиконосцам относятся трипоносомы (рис. 29, 1). У них
веретеновидное тело, а ширина и длина тела обычно 1,4-2,4 х 15-40 мкм. В
отличие от других жгутиконосцев у них жгутик начинается от базального тельца,
расположенного в задней трети тела. Он идет вдоль тела, срастаясь с оболочкой и
образуя волнообразную перепонку. Перемещения трипаносом в крови хозяина
осуществляются благодаря энергичным волнообразным движениям этой перепонки.
Трипаносомы паразитируют в крови и спинно-мозговой жидкости позвоночных. Они
поглощают растворенные органические вещества всей поверхностью тела. У
трипаносом, как и у паразитических амеб, нет сократительных вакуолей. Некоторые
трипаносомы выделяют в кровь яды, разрушающие эритроциты. Заражение трипаносомами,
как правило, происходит через насекомых-переносчиков (муху цеце, клопов,
слепней). Трипаносомы — возбудители тяжелой сонной болезни, широко
распространенной в Экваториальной Африке (переносчик возбудителя — муха цеце),
а также наганы — болезни крупного рогатого скота.
29, 1). У них
веретеновидное тело, а ширина и длина тела обычно 1,4-2,4 х 15-40 мкм. В
отличие от других жгутиконосцев у них жгутик начинается от базального тельца,
расположенного в задней трети тела. Он идет вдоль тела, срастаясь с оболочкой и
образуя волнообразную перепонку. Перемещения трипаносом в крови хозяина
осуществляются благодаря энергичным волнообразным движениям этой перепонки.
Трипаносомы паразитируют в крови и спинно-мозговой жидкости позвоночных. Они
поглощают растворенные органические вещества всей поверхностью тела. У
трипаносом, как и у паразитических амеб, нет сократительных вакуолей. Некоторые
трипаносомы выделяют в кровь яды, разрушающие эритроциты. Заражение трипаносомами,
как правило, происходит через насекомых-переносчиков (муху цеце, клопов,
слепней). Трипаносомы — возбудители тяжелой сонной болезни, широко
распространенной в Экваториальной Африке (переносчик возбудителя — муха цеце),
а также наганы — болезни крупного рогатого скота.
Рис. 94. Болезнетворные простейшие: 1 — трипаносома; 2 — лямблия
Другие
паразитические жгутиконосцы — лейшмании. Они очень мелкие: длина их тела 2-4
мкм. Лейшмании — внутриклеточные паразиты некоторых млекопитающих и человека. Они
вызывают тяжелые поражения внутренних органов и кожи (лейшманиозы). Паразиты
передаются через укусы москитов. В организме человека паразит теряет жгутик, а
в теле москита его жгутик восстанавливается. Один из видов лейшмании,
распространенный в Южной Европе, Индии и Средней Азии, вызывает болезнь
человека кало-азар, при которой увеличиваются печень и селезенка. Болезнь
сопровождается непрерывной лихорадкой, малокровием, истощением и чаще всего
заканчивается смертельным исходом. Другой вид лейшмании вызывает болезнь кожи —
восточную, или пендинскую, язву, распространенную в Северной Африке, Южной
Европе и Южной Азии, Закавказье и Средней Азии.
Они очень мелкие: длина их тела 2-4
мкм. Лейшмании — внутриклеточные паразиты некоторых млекопитающих и человека. Они
вызывают тяжелые поражения внутренних органов и кожи (лейшманиозы). Паразиты
передаются через укусы москитов. В организме человека паразит теряет жгутик, а
в теле москита его жгутик восстанавливается. Один из видов лейшмании,
распространенный в Южной Европе, Индии и Средней Азии, вызывает болезнь
человека кало-азар, при которой увеличиваются печень и селезенка. Болезнь
сопровождается непрерывной лихорадкой, малокровием, истощением и чаще всего
заканчивается смертельным исходом. Другой вид лейшмании вызывает болезнь кожи —
восточную, или пендинскую, язву, распространенную в Северной Африке, Южной
Европе и Южной Азии, Закавказье и Средней Азии.
В
кишечнике млекопитающих (человека, кролика, мыши), земноводных и некоторых беспозвоночных
обитают лямблии Длина тела этих паразитов 0,008-0,03 мм. Тело лямблий
грушевидное и сплющенное. Вогнутая брюшная сторона образует присоску, которой
лямблии прикрепляются к эпителиальным клеткам кишечника хозяина. У них имеются
по четыре пары жгутиков и по два ядра. Лямблии обитают в верхних отделах
тонкого кишечника человека. Попадая в нижние отделы кишечника, лямблии образуют
цисты, которые выводятся во внешнюю среду и служат источником заражения новых
хозяев. Иногда заражение лямблиями происходит без болезненных симптомов. Однако
эти паразиты, проникая в желчный пузырь, вызывают его воспаление (холецистит).
Чаще эти паразиты встречаются у детей. Болезнь, вызываемая ими, называется
лямблиозом.
У них имеются
по четыре пары жгутиков и по два ядра. Лямблии обитают в верхних отделах
тонкого кишечника человека. Попадая в нижние отделы кишечника, лямблии образуют
цисты, которые выводятся во внешнюю среду и служат источником заражения новых
хозяев. Иногда заражение лямблиями происходит без болезненных симптомов. Однако
эти паразиты, проникая в желчный пузырь, вызывают его воспаление (холецистит).
Чаще эти паразиты встречаются у детей. Болезнь, вызываемая ими, называется
лямблиозом.
Жгутиконосцы — это простейшие, органоидами движения которых служат жгутики. Среди них есть одиночные и колониальные организмы. Животные жгутиконосцы питаются только гетеротрофно, а растительные жгутиконосцы на свету используют и автотрофный способ питания. У большинства жгутиконосцев размножение бесполое. Наибольшее число видов жгутиконосцев обитает в водоемах, они играют важную роль в круговороте веществ в природе. Среди них есть и паразиты.
VII. Повторение новой темы.
— тонкие вопросы
1. Где обитает эвглена зеленая.
Где обитает эвглена зеленая.
2. С помощью чего она передвигается?
3. Что образует при наступлении неблагоприятных
условий?
— толстые вопросы
1. Почему эвглена и автотроф и гетеротроф?
2. Сравните способ питания амебы и эвглены зеленой.
3. Что общего у амебы и эвглены зеленой.
1) зарисовать строение эвглены зеленой и подписать органоиды клетки (рисунок выдан).
2) дифференцированные задания (индивидуальный подход к талантливым и одаренным детям). Карточки с заданиями прилагаются.
Ответы:
1) I.Саркодовые(Корненожки)–А,Г,Е,Ж.
II.Жгутиковые–Б,В,Д,З,И.
2) I. Амеба обыкновенная –
А, Б, В, Г, Д, И.
II. Эвглена зеленая – А, Б, В, Е, Ж, З, И.
VIII. Выставление оценок с комментированием.
IX. Домашнее задание.
Выучить новые понятия и определения.
Прочитать и пересказывать
параграф 36 стр. 138- 140 ответить на вопросы в конце параграфа.
1 Вариант
Ф. И. класс__________________________________
Найдите соответствие. Из перечисленных признаков выпишите характерные для класса:
I.
Саркодовые (Корненожки) _________________________________________
II. Жгутиковые ________________________________________
A. Способность образовывать цитоплазматические выросты
Б. Наличие жгутиков
B. Передвижение за счет жгутиков
Г. Захват пищи с помощью ложноножек
Д. Захвату пищи способствуют жгутики
Е. Передвигаются с помощью псевдоподий
Ж. Гетеротрофное
питание
З. Питание и автотрофное, и гетеротрофное
И. Имеются колониальные формы.
2 Вариант
Ф. И. класс __________________________________
Найдите
соответствие. Из перечисленных органоидов выпишите
органоиды характерные для:
I. Амебы обыкновенной ____________________________________________
Амебы обыкновенной ____________________________________________
II. Эвглены зеленой ____________________________________________
A. Ядро
Б. Оболочка
B. Сократительная вакуоль
Г. Пищеварительная вакуоль
Д. Ложноножки
Е.
Жгутик
Ж. Светочувствительный глазок
3. Хлоропласты
И. Цитоплазма
Тестовый контроль знаний
Простейшие. Кишечнополостные.
Вариант 1.
1.Место образования пищеварительных вакуолей у инфузории:
А) клеточный рот б) клеточная глотка в) цитоплазма г) оболочка.
2. Органоид передвижения эвглены зеленой:
А) ложноножки б) реснички в) жгутик
3. Жидкая часть клетки амебы:
А) ядро б) цитоплазма в) оболочка г) пищеварительная вакуоль.
4. Органоиды эвглены зеленой, обеспечивающие её питание на свету:
А) сократительная вакуоль б) ядро в) хлоропласты г) глазок.
5. Пульсирующие вакуоли, находящиеся в цитоплазме простейших:
А) пищеварительные б) сократительные в) ядро
6. Размножение инфузории-туфельки в благоприятных условиях:
А) половое б) бесполое в) бесполое и половое.
7. Плотная оболочка, помогающая сохранить простейшее в неблагоприятных условиях:
А) мембрана б) циста в) кутикула.
8. Непостоянную форму тела имеет:
А) амеба б) эвглена зеленая в) инфузория-туфелька г) малярийный плазмодий.
9. Средой обитания дизентерийной амебы является:
А) вода б) земля в) кишечник г) печень.
10. Дыхание амебы происходит с помощью:
А) цитоплазмы б) оболочки в) ядра г) сократительной вакуоли.
11.Тело кишечнополостных животных состоит из
А) одного слоя клеток; Б)двух слоев клеток; В)трех слоев клеток; Г)слоевища.
12.У гидры щупальца расположены
А)вокруг ротового отверстия; Б)внутри кишечной полости;
В)на конечностях; Г)на подошве.
13. Какие клетки входят в состав эктодермы?
А)пищеварительно-мускульные; Б)железистые; В)промежуточные; Г) желудочные.
14. Чем дышит гидра?
А)легкими; Б)жабрами; В)дыхательной трубкой; Г)всем телом.
15.Какие клетки выделяют пищеварительный сок?
А)железистые; Б)пищеварительные; В)эпителиально-мускульные; Г)нервные.
16. Нервные клетки гидры образуют
А)эктодерму; Б)кишечную полость;
В)диффузную нервную систему; Г)щупальца вокруг рта.
17. Разные типы клеток гидры могут, формируются из
А)кишечной полости; Б)нервных клеток;
В)промежуточных клеток; Г) стрекательных клеток.
Б1. Верны ли следующие утверждения?
А. Медузы по типу питания являются хищниками.
Б. Коралловые рифы образованы колониями кишечнополостных животных.
1)верно только А; 2)верно только Б; 3)Верны оба суждения; 4) неверны оба суждения.
Б2. Установите последовательность этапов питания гидры
1)Добыча попадает через рот в кишечную полость.
2)Непереваренные остатки пищи удаляются через рот.
3)Гидра захватывает щупальцами добычу и парализует ее стрекательными клетками.
4)Пищевые частицы перевариваются в клетках энтодермы.
5)Пища начинает перевариваться в кишечной полости.
С1. Как называется прослойка между эктодермой и энтодермой?_________________
С2. Какие клетки у гидры служат средством нападения или защиты?________________
Простейшие. Кишечнополостные.
Вариант 2.
1.Заболевание человека, вызванное амебами:
А) малярия б) дизентерия в) лямблиоз г) сонная болезнь .
2. Органоид передвижения амебы:
А) ложноножки б) реснички в) жгутик
3. Часть клетки инфузории-туфельки, отвечающая за процесс размножения:
А) большое ядро б) малое ядро в) порошице г) оболочка .
4. Органоид эвглены зеленой, позволяющий ей чувствовать свет:
А) сократительная вакуоль б) ядро в) хлоропласты г) глазок.
5. Вакуоли, перемещающиеся с током цитоплазмы у инфузории:
А) пищеварительные б) сократительные в) ядро
6. Размножение инфузории-туфельки в неблагоприятных условиях:
Размножение инфузории-туфельки в неблагоприятных условиях:
А) половое б) бесполое в) бесполое и половое.
7. Автотрофное питание имеет:
А) амеба б) инфузория-туфелька в) эвглена зеленая г) малярийный плазмодий.
8. Постоянную форму тела имеет:
А) амеба обыкновенная б) дизентерийная амеба в) инфузория-туфелька.
9. Средой обитания эвглены зеленой является:
А) вода б) земля в) кишечник г) печень.
10. Выделение у амебы происходит с помощью:
А) цитоплазмы б) оболочки в) ядра г) сократительной вакуоли.
11. С помощью чего гидра прикрепляется к растениям и камням?
А)с помощью подошвы; Б)с помощью ложноножки;
В)с помощью жгутика; Г)с помощью мезоглеи.
12. Какие клетки входят в состав энтодермы?
А)стрекательные; Б)нервные; В)промежуточные; Г)железистые.
13. Какие клетки способны образовывать ложноножки?
А)железистые; Б)пищеварительно-мускульные; В)эпителиально-мускульные; Г)нервные.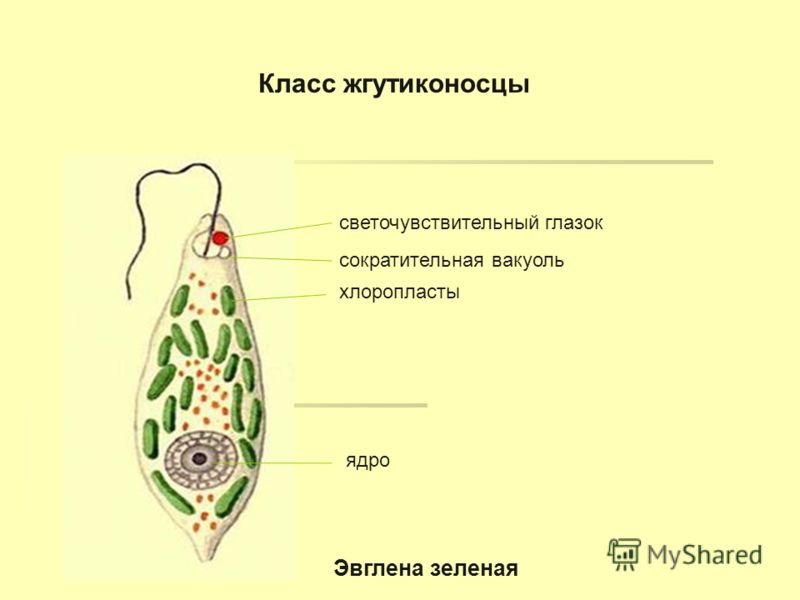
14. Какой процесс характерен для гидры?
А)акклиматизация; Б)спячка; В)регенерация; Г)оцепенение.
15.Для кишечнополостных животных характерна
А)асимметрия ; Б)лучевая симметрия;
В)двусторонняя симметрия; Г)центральная симметрия
16.Клетки внутреннего слоя гидры осуществляют
А)половое размножение; Б)захват добычи;
В)переваривание пищи; Г)перемещение в пространстве.
17. Пресноводный полип гидра осуществляет обездвиживание добычи с помощью
А)стрекательных клеток; Б)чувствительных клеток; В)энтодермы; Г)подошвы.
Б1. Верны ли следующие утверждения?
А. Кишечнополостные размножаются только половым способом.
Б. Среди кишечнополостных встречаются как свободноживущие организмы, так и животные, ведущие прикрепленный образ жизни.
1)Верно только А; 2) верно только Б; 3)верны оба суждения; 4)неверны оба суждения.
Б2. Установите последовательность этапов жизненного цикла гидры, начиная со взрослого животного.
1)Молодая гидра выходит из оболочек яйца; 2)Сперматозоид оплодотворяет яйцеклетку.
3)Взрослое животное продуцирует гаметы; 4)Из зиготы развивается яйцо.
С1. Какие клетки, характерные для эктодермы, содержаться в теле гидры в наибольшем количестве?___________________________________________
С2. Что такое почкование гидры?___________________________________
Урок биологии в 9-м классе «Органоиды клетки»
- Румянцева Елена Анатольевна, учитель биологии и химии
Разделы: Биология
Цель урока: развивать умения работать
с учебной литературой, развивать умения
выполнять лабораторные работы по приготовлению
микропрепаратов и изучению строения клетки,
реализовать системнодеятельностный подход в
изучении биологии при изучении понятия «клетка -
структурная и функциональная единица живых
существ», развивать творческое мышление
учащихся при выполнении нетрадиционного
домашнего задания, развивать умение работать в
группе единомышленников, распределять функции
при такой работе.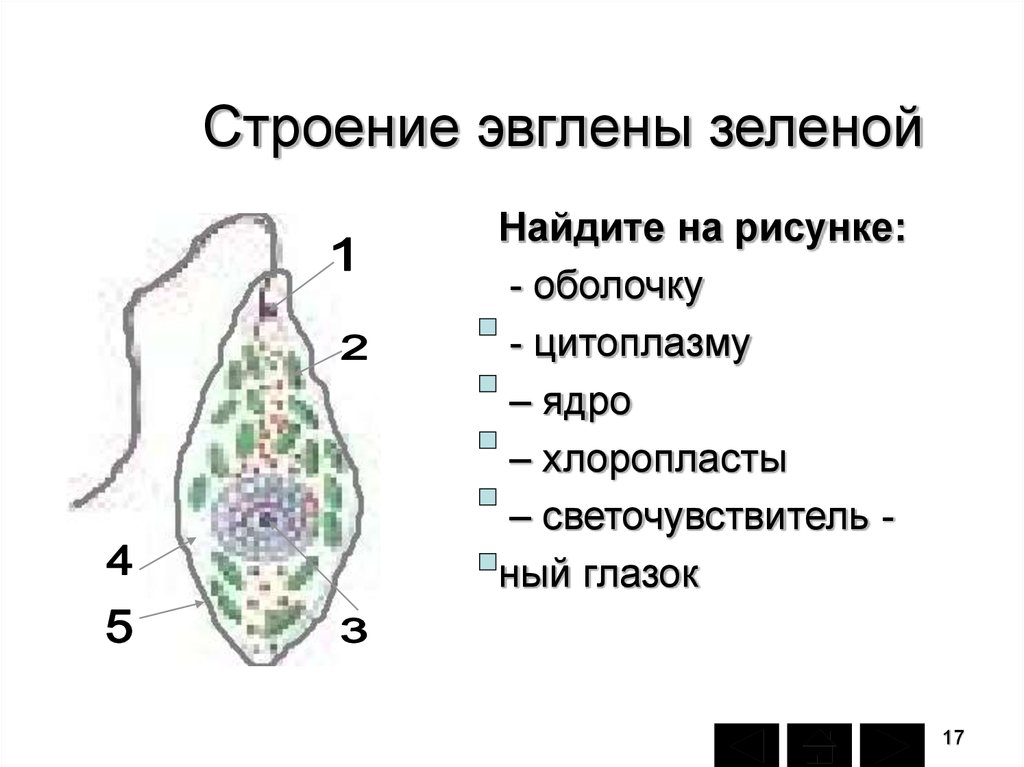
Повторение ранее изученного материала: ( учащиеся уже изучили материал о цитоплазме, мембране и ядре)
- Перечислите функции наружной мембраны клетки.
- Какими двумя способами вещества могут попадать внутрь клетки?
- Чем фагоцитоз отличается от пиноцитоза?
- Какой из этих двух процессов характерен для растительных клеток? Почему?
- Каковы функции ядра клетки?
- Какое строение имеет ядро?
- Что такое кариотип?
- Какой набор хромосом в соматических и половых клетках?
- Подсчитайте гаплоидный набор в половых клетках миноги, аскариды, домашней собаки, если диплоидные наборы у этих животных 174, 2, и 78 соответственно.
Изучение нового материала
1. Самостоятельная работа учащихся.
Учащиеся знакомятся с материалом параграфы 2,4;
2,5; 2. 6 . Оформляют таблицу:
6 . Оформляют таблицу:
| Органоиды клетки | Строение органоида | Функции органоидов | |
| Постоянные | ЭПС Рибосомы Комплекс Гольджи Лизосомы Митохондрии Пластиды Клеточный центр |
||
| Непостоянно встречающиеся | Жгутики Клеточные включения |
2. Обсуждение результатов самостоятельной работы учащихся, корректировка таблицы.
3. Выполнение учащимися лабораторной
работы по изучению некоторых органоидов клетки доступных
для рассмотрения в школьный световой микроскоп.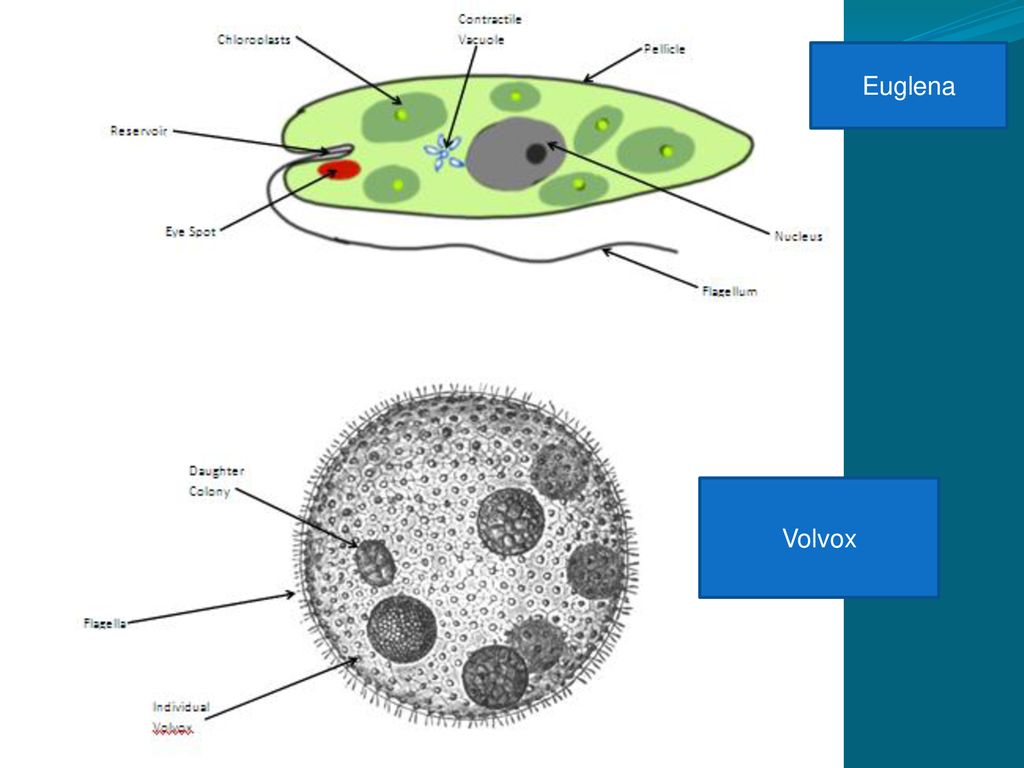
Оборудование к работе: предметные и покровные стекла, микроскоп, препаровальная игла, скальпель, стаканчик с водой и пипеткой, ткань для протирания стекол, лист комнатного растения -герани зональной, дримиопсиса, кливии или другого подходящего , кожица зрелого томата, готовые препараты » Срез зерновки злака», «Эвглена зеленая»
Ход работы
Учащиеся изготавливают препарат «Срез пластинки зеленого листа» и препарат «Срез кожицы зрелого томата» рассматривают, зарисовывают клетки с хлоропластами и хромопластами, указывают их на рисунках, рассматривают готовые препараты зерновки злака и эвглены зеленой, зарисовывают и отмечают на рисунке крахмальные зерна у зерновки злака и жгутики у эвглены зеленой.
В конце урока учащиеся получают групповые
домашние задания. Класс распределяется на группы
и каждая группа получает по 2 листочка бумаги на
которых написаны названия органоидов клетки и
каждой группе также вручаются памятки по
составлению синквейна.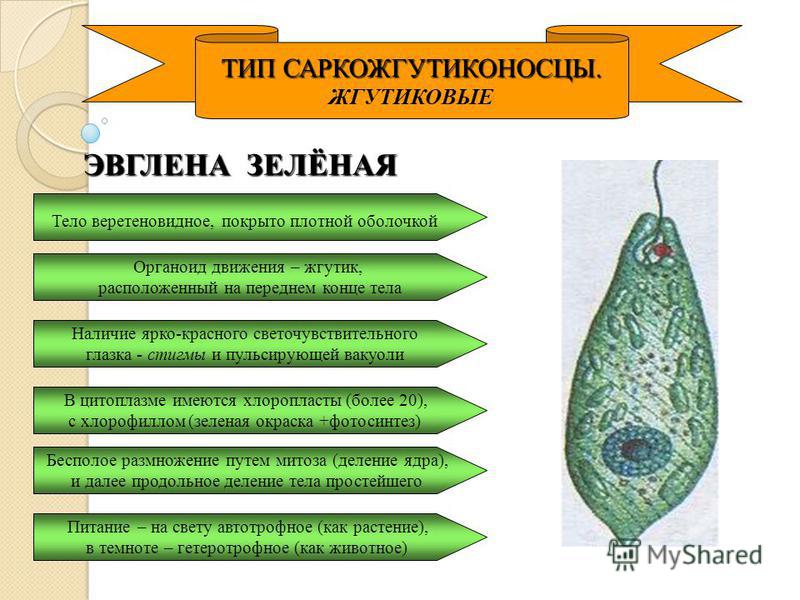 Синквейн
Синквейн
При подготовке домашнего задания группа должна приготовить рисунки выбранных органоидов, вырезать их из бумаги и составить синквейны по строению и функциям этих органоидов.
В начале следующего урока учащиеся представляют свои работы и монтируют на магнитной доске модель клетки. Составленные синквейны иллюстрируют представления учащихся о строении и функциях органоидов.
Приложение 1 Синквейны составленные учащимися
Приложение 2 Рисунки некоторых органоидов клетки, выполненных учащимися.
Примечание: Урок был проведен в классе, где
часть учащихся обладает хорошей мотивацией и
способностями, а часть детей , наоборот, очень
слабые — коррекционного вида обучения. Такие
классы не редкость в сельских школах. Хочется
отметить, что при работе в группах каждому
учащемуся нашлось дело, сообразно его
возможностям и способностями. И пусть наши
синквейны и модели слабоваты в художественном
отношении, но — это продукт деятельности
учащихся.
И пусть наши
синквейны и модели слабоваты в художественном
отношении, но — это продукт деятельности
учащихся.
Использованная литература.
- Каменский А. А., Криксунов Е. А., Пасечник В. В. «Биология. Введение в общую биологию и экологию» М. Дрофа. 2010.
- Ярцева С. В. «Реализация системно - деятельностного подхода в обучении биологии» журнал «Биология в школе» № 6 2010 год, стр 23 -25.
Педагогическое сообщество «Урок.рф»
| 12+ Свидетельство СМИ ЭЛ № ФС 77 — 70917 Лицензия на образовательную деятельность №0001058 | Пользовательское соглашение Контактная и правовая информация |
Педагогическое сообщество | Бесплатные всероссийские конкурсы | Бесплатные сертификаты | Нужна помощь? Инструкции для новых участников | Бесплатная онлайн-школа для 1-4 классов |
Всё для аттестацииПубликация в сборникеВебинарыЛэпбукиПрофтестыЗаказ рецензийНовости
ДОБРО ПОЖАЛОВАТЬ!
Педагогическое сообщество «УРОК.РФ» предназначено для работников школьного, дошкольного и дополнительного образования, а также для всех специалистов, занимающихся образовательной и воспитательной деятельностью.
Педагогическое сообщество «УРОК.РФ» – это сайт, созданный учителями для учителей!
Узнать больше о сайте
Новости
- Стартовала осенняя серия конкурсов педагогического мастерства от «Урок.
 РФ»
РФ» - Итоги всероссийских конкурсов детского творчества с подарками от Умной Вороны
- Завершена серия конкурсов, организованных совместно с онлайн-институтом Smart
- Стартовала регистрация в Весенней серии конкурсов педагогического мастерства
Все новостиАнонсы мероприятий
Новое
6
#Новость #Все учителя #Публикации
В рамках федерального проекта «Безопасность дорожного движения» национального проекта «Безопасные качественные дороги» ФГБУК «Всероссийский центр развития художественного творчества и гуманитарных технологий» при поддержке Минпросвещения России с 15 августа 2022 года организует набор слушателей на курс повышения квалификации для педагогических работников по совершенствованию компетенций, направленных на формирование у детей различных возрастных групп навыков безопасного поведения на дороге.
Администрация сайта «УРОК.РФ» (администратор) 1
4
#Новость #Все учителя #Публикации
Электронное пособие «Из века в век. История России в интерактивных схемах», выпущенное издательством «Русское слово» – это инновационный продукт, сочетающий технические достижения и передовые методики преподавания предмета. Пособие состоит из отдельных модулей, которые в перспективе будут охватывать весь курс истории России, изучаемый в основной школе с 6 по 9 класс.
Администрация сайта «УРОК.РФ» (администратор)0
Опубликовано в группе «Актуальное и полезное от партнёров»
13
#Новость #Все учителя #Публикации
В этой серии вы найдёте конкурсы на лучший образовательный текстовый квест и настольную игру, урок с применением пазл-метода и рабочих листов, а также конкурс на лучший сценарий постановки для детского театра. Традиционно регистрация, участие и выдача наградных документов в нашем сообществе – бесплатные!
Традиционно регистрация, участие и выдача наградных документов в нашем сообществе – бесплатные!
Администрация сайта «УРОК.РФ» (администратор)0
Опубликовано в группе «УРОК.РФ: официальная группа администрации»
12
#Новость #Все учителя #Публикации
Нам нравится, что вам нравится! Для всех участников урок.рф, мы открываем наши секретные коды подключения. Порадуйте своих учеников!
Александр Васенёв (администратор)3
Опубликовано в группе «УРОК.РФ: официальная группа администрации»
3
#Новость #Все учителя #Публикации
Система рецензирования на сайте УРОК.РФ полностью автоматизирована. Достаточно загрузить авторский материал и отправить заявку, остальное сделают наши методисты. Экспертная оценка осуществляется профильными экспертами. Это компетентные педагоги-практики со всей России и стран СНГ, преподаватели высших и средних учебных заведений, доценты и профессора, кандидаты и доктора наук, авторы учебников и актуальных методик, спикеры курсов повышения квалификации и вебинаров.
Экспертная оценка осуществляется профильными экспертами. Это компетентные педагоги-практики со всей России и стран СНГ, преподаватели высших и средних учебных заведений, доценты и профессора, кандидаты и доктора наук, авторы учебников и актуальных методик, спикеры курсов повышения квалификации и вебинаров.
Администрация сайта «УРОК.РФ» (администратор) 0
0
#Дошкольное образование #Статья #Публикации
О значимости хореографических занятий в ДОУ для воспитания и обучения дошкольников в качестве дополнительного образования.
Повитухина Ольга Сергеевна 0
0
#Школьное образование #Все учителя #Статья #Публикации #Математика #Геометрия #Алгебра #8 класс #7 класс #6 класс #5 класс
Основные механизмы реализации предметного содержания и достижения результатов освоения общеобразовательной дисциплины «Математика» включают в себя такие блоки: интенсивность подготовки; организация учебной деятельности в форме практической подготовки, включение прикладных модулей; применение технологий дистанционного и электронного обучения.
Алексютина Людмила Владимировна0
Опубликовано в группе «Распространение педагогического опыта (бесплатные вебинары, конференции,семинары)»
0
#Школьное образование #Учитель начальных классов #Презентация #Учебно-методические материалы #Литература #2 класс
Презентация подготовлена к УМК «Школа России» 2 класс. Содержит материал для актуализации знаний: речевая разминка. Материал для целеполагания: работа с загадкой. Материал по теме урока: словарная работа, вопросы по содержанию, восстановление последовательности, составление плана для пересказа, анализ каждой части сказки, пересказ по картинкам.
Власенко Марина Ивановна0
Опубликовано в группе «Учителя начальных классов»
1
#УМК Н. С. Борисова, А. А. Левандовского #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #История #11 класс
С. Борисова, А. А. Левандовского #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #История #11 класс
В рабочей тетраде для учеников размещены материалы, которые будут выполнять в ходе работы на уроке.
Эккардт Галина Анатольевна 0
7
#Образовательные фотографии #Дополнительное образование #Туристско-краеведческое #Воспитатель #Педагог дополнительного образования #Все учителя #Учебно-дидактические материалы #11 класс #10 класс #9 класс #8 класс #7 класс #6 класс #5 класс #4 класс #3 класс #2 класс
Авторские фотоснимки
Сингаевская Наталья Валерьевна5
Опубликовано в группе «КАК ПРЕКРАСЕН ЭТОТ МИР»
0
#Дошкольное образование #Воспитатель #Проектно-исследовательская работа #Публикации
Проект в средней группе
Гильзунова Алла Александровна0
Опубликовано в группе «Дошкольники»
0
#УМК Н.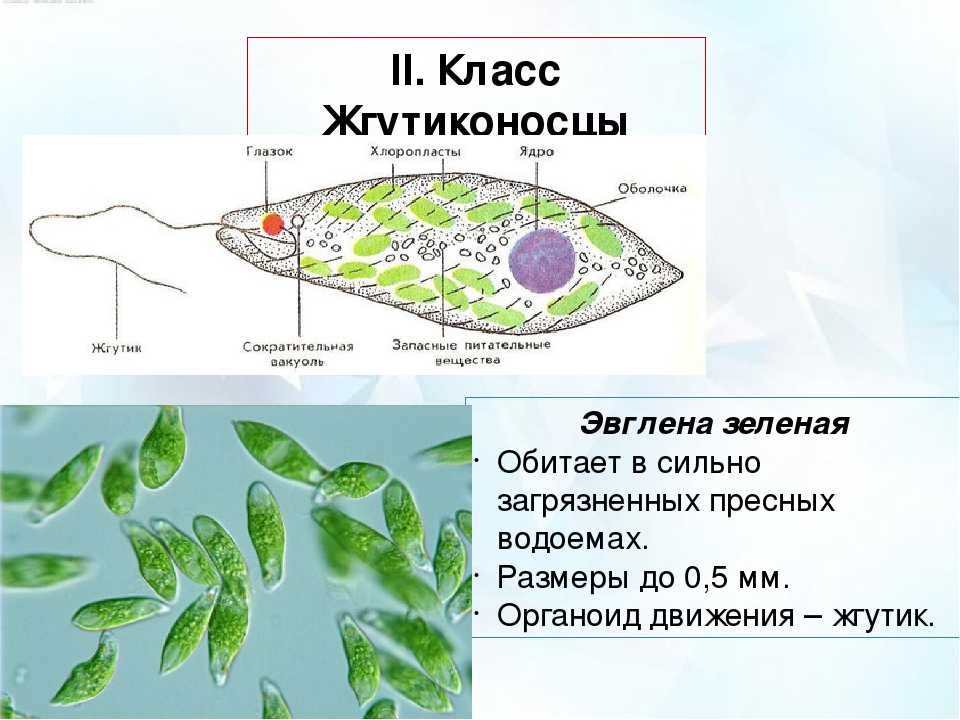 С. Борисова, А. А. Левандовского #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #История #11 класс
С. Борисова, А. А. Левандовского #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #История #11 класс
Материал урока истории предназначен для углубленного изучения предмета.
Эккардт Галина Анатольевна0
Опубликовано в группе «Учитель истории и обществознания. »
0
#Школьное образование #Учитель начальных классов #Презентация #Учебно-методические материалы #Русский язык #2 класс
Презентация подготовлена к УМК «Школа России» 2 класс. Содержит материал для составление сочинения по картине И.С. Остроухова «Золотая осень».
Власенко Марина Ивановна0
Опубликовано в группе «Учителя начальных классов»
0
#Школьное образование #Учитель начальных классов #Презентация #Учебно-методические материалы #Русский язык #2 класс
Презентация подготовлена к УМК «Школа России» 2 класс. Содержит материал для актуализации знаний: определение вида предложения. Материал для целеполагания: сравнение предложений. Материал по теме урока: словарная работа, выполнение упражнений.
Содержит материал для актуализации знаний: определение вида предложения. Материал для целеполагания: сравнение предложений. Материал по теме урока: словарная работа, выполнение упражнений.
Власенко Марина Ивановна0
Опубликовано в группе «Учителя начальных классов»
0
#Школьное образование #Классный руководитель #Организатор внеклассной и внешкольной работы #Классный час #Методические разработки #ФГОС #7 класс #6 класс #5 класс
Знакомство учащихся с историей создания славянской азбуки, с историей русского алфавита.
Невдах Лидия Викторовна 0
Эвглена зеленая и растение и животное как доказать
Эвглена Зелёная. Описание, особенности, строение и размножение Эвглены Зелёной
Животная клетка произошла от растительной.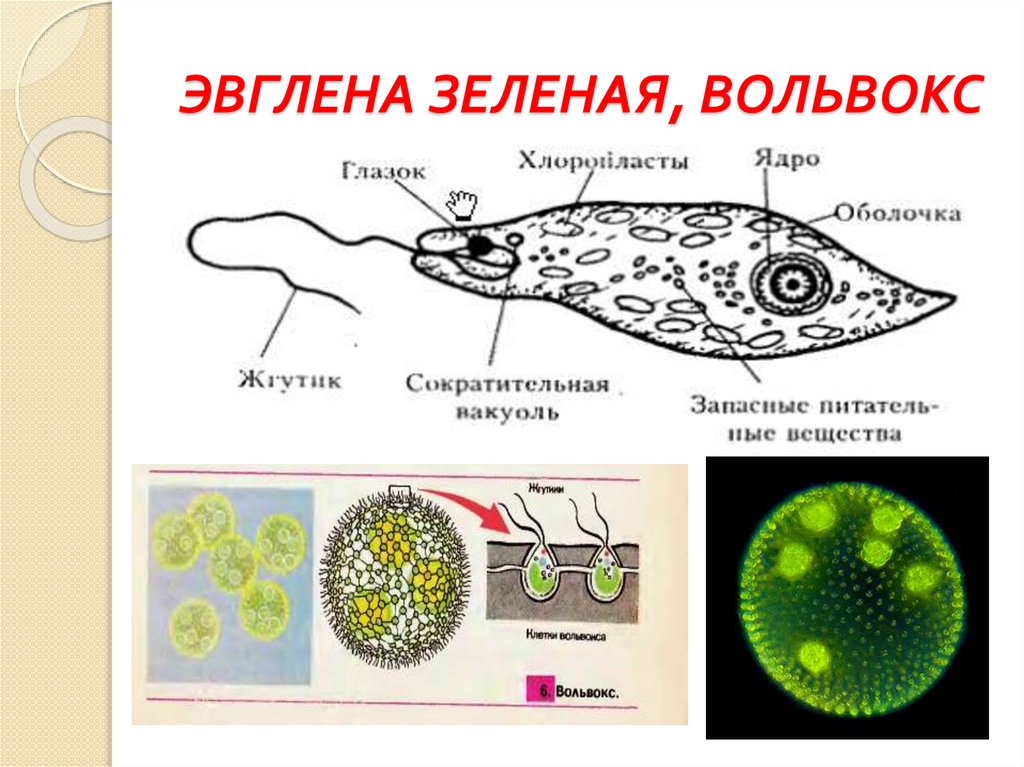 Это предположение ученых основано на наблюдениях за Эвгленой Зеленой. В этом одноклеточном сочетаются черты животного и растения. Поэтому Эвглена считается переходным этапом и подтверждением теории о единстве всего живого. Согласно этой теории, человек произошел не только от обезьяны, но и от растений. Отодвинем дарвинизм на второй план?
Это предположение ученых основано на наблюдениях за Эвгленой Зеленой. В этом одноклеточном сочетаются черты животного и растения. Поэтому Эвглена считается переходным этапом и подтверждением теории о единстве всего живого. Согласно этой теории, человек произошел не только от обезьяны, но и от растений. Отодвинем дарвинизм на второй план?
В существующей классификации Эвглена Зеленая относится к одноклеточным водорослям. Подобно прочим растениям, одноклеточное содержит хлорофилл. Соответственно, в признаки Эвглены Зеленой входит способность к фотосинтезу — преобразованию энергии света в химическую. Это типично для растений. Разглядеть её можно только под микроскопом, который можно приобрести в магазине микроскопов.
Строение Эвглены Зеленой предполагает наличие в клетке 20-ти хлоропластов. Именно в них и сосредоточен хлорофилл. Хлоропласты представляют собой зеленые пластины и бывают только у клеток, имеющих в центре ядро. Питание солнечным светом называется автотрофным. Таковым Эвглена пользуется днем.
Питание солнечным светом называется автотрофным. Таковым Эвглена пользуется днем.
Стремление одноклеточных к свету называется положительным фототаксисом. Ночью же водоросль гетеротрофна, то есть поглощает органику из воды. Вода должна быть пресной. Соответственно, встречается Эвглена в озерах, прудах, болотах, реках, предпочитая загрязненные. В водоемах с чистой водой водоросль малочисленна или вовсе отсутствует.
Обитая в загрязненных водоемах, Эвглена Зеленая может быть переносчиком трипаносом и лейшмании. Последняя является возбудителем ряда кожных заболеваний. Трипаносомы же провоцируют развитие африканской сонной болезни. Она поражает лимфатическую, нервную систему, приводит к лихорадке.
Любовью к стоячей воде с гнилостными остатками эвглена родственна амебе. Завестись героиня статьи может и в аквариуме. Достаточно на некоторое время забыть о фильтрации, смене воды в нем. При наличии в аквариуме Эвглены, вода зацветает. Поэтому аквариумисты считают одноклеточную водоросль своеобразным паразитом.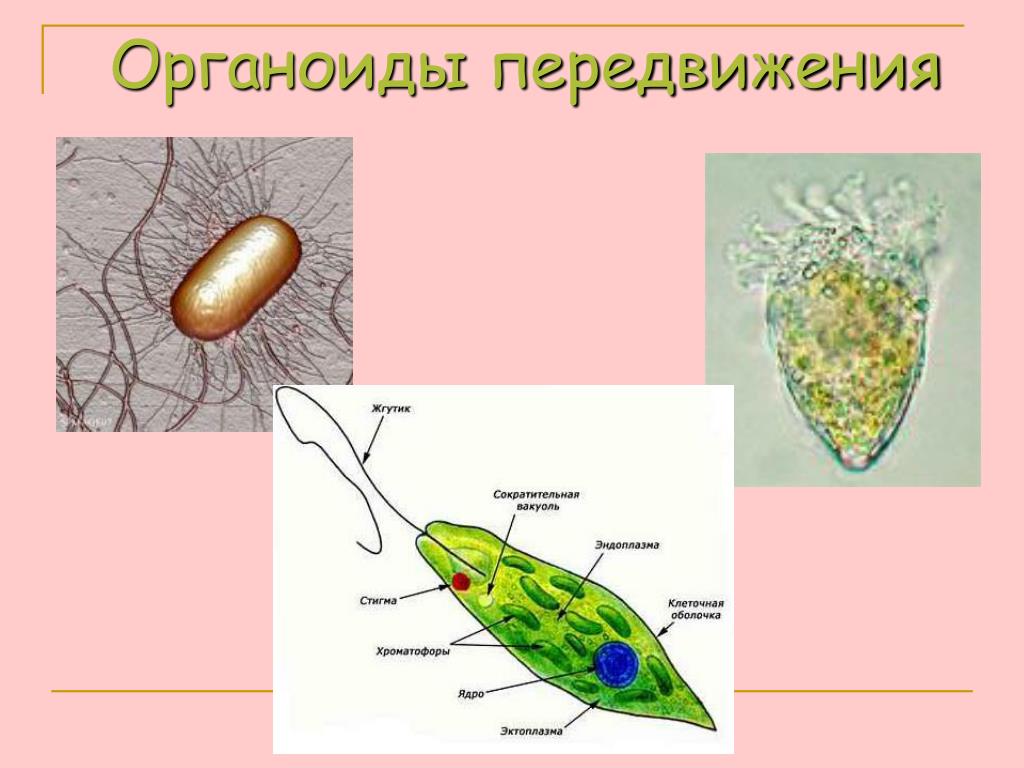
Приходится протравливать домашние водоемы химическими средствами, пересаживая при этом рыб в другие емкости. Однако, некоторые аквариумисты рассматривают героиню статьи в качестве корма для мальков. Последние воспринимают Эвглен в качестве животных, подмечая активное движение.
В качестве корма для мальков эвглен размножают в домашних условиях. Не ходить же все время на пруд. Размножаются простейшие быстро в любом блюдце с грязной водой. Главное, не убирать посуду с дневного света. Иначе, приостановится процесс фотосинтеза.
Гетеротрофное питание, к коему Эвглена прибегает ночью, — признак животных. Еще к животным чертам одноклеточного относится:
- Активное передвижение. Клетка Эвглены Зеленой имеет жгутик. Его вращательные движения обеспечивают мобильность водоросли. Перемещается она поступательно. Этим разнятся Эвглена Зеленая и Инфузория Туфелька. Последняя движется плавно, имея вместо одного жгутика множество ресничек. Они короче и изгибаются волнообразно.

- Пульсирующие вакуоли. Они подобны мышечным кольцам.
- Ротовую воронку. Как такового ротового отверстия у Эвглены нет. Однако, стремясь захватывать органическую пищу, одноклеточное как бы вжимает внутрь часть наружной мембраны. В этом отсеке задерживается пища.
Учитывая наличие у Зеленой Эвглены признаков как растений, так и животных, ученые спорят о принадлежности героини статьи к определенному царству. Большинство за причисление Эвглены к флоре. Животным одноклеточное считают примерно 15% ученых. Остальные видят в Эвглене промежуточный вид.
Признаки Эвглены Зеленой
У одноклеточного тело веретеновидной формы. У него жесткая оболочка. Длина тела приближена к 0,5 миллиметра. Перед тела Эвглены тупой. Здесь находится красный глазок. Он светочувствительный, позволяет одноклеточному находит «кормовые» места днем. За счет обилия глазков в местах скопления Эвглен, поверхность воды смотрится красноватой, бурой.
Еще на переднем конце тела клетки крепится жгутик.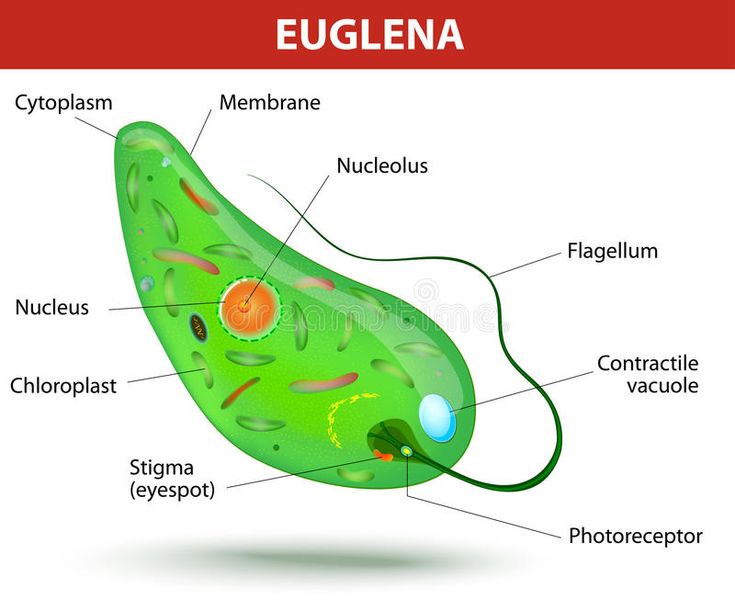 У новорожденных особей его может не быть, поскольку клетка делится надвое. Жгутик остается на одной из частей. На второй двигательный орган отрастает со временем. Задний конец тела растение Эвглена Зеленая имеет заостренный. Это помогает водоросли ввинчиваться в воду, улучшает обтекаемость, а значит, и скорость.
У новорожденных особей его может не быть, поскольку клетка делится надвое. Жгутик остается на одной из частей. На второй двигательный орган отрастает со временем. Задний конец тела растение Эвглена Зеленая имеет заостренный. Это помогает водоросли ввинчиваться в воду, улучшает обтекаемость, а значит, и скорость.
Героини статьи свойственна метаболия. Это способность менять форму тела. Хоть зачастую оно веретенообразное, может быть и:
- подобным кресту
- вальковатым
- шарообразным
- комковатым.
Какой бы формы не была Эвглена, ее жгутик не виден, если клетка живая. От глаз отросток скрыт за счет частоты движения. Человеческий глаз не может уловить его. Способствует тому и малый диаметр жгутика. Рассмотреть его можно под микроскопом.
Строение Эвглены
Если обобщить сказанное в первых главах, Эвглена Зеленая — животное или растений, состоящее из:
- Жгутика, наличие которого относит Эвглену к классу жгутиконосцев.
 У его представителей бывает от 1-го до 4-х отростков. Диаметр жгутика равен примерно 0,25 микрометра. Отросток покрыт плазматической мембраной ми сложен из микротрубок. Они движутся относительно друг друга. Это и вызывает общее движение жгутика. Крепится он к 2-м базальным телам. Они удерживают резвый жгутик в цитоплазме клетки.
У его представителей бывает от 1-го до 4-х отростков. Диаметр жгутика равен примерно 0,25 микрометра. Отросток покрыт плазматической мембраной ми сложен из микротрубок. Они движутся относительно друг друга. Это и вызывает общее движение жгутика. Крепится он к 2-м базальным телам. Они удерживают резвый жгутик в цитоплазме клетки. - Глазок. Иначе называется стигмой. Содержит зрительные волокна и линзоподобное образование. За счет них глазок и улавливает свет. Его линза отражает на жгутик. Получая импульс, тот начинает двигаться. Красный орган за счет окрашенных капель липида — жира. Расцвечен он каротиноидами, в частности, гематохромом. Каротиноидами именуют органические пигменты оранжево-красных тонов. Глазок окружен мембраной, подобной оболочке хлоропластов.
- Хроматофоры. Так называются пигментированные клетки и компоненты растений. Иначе говоря, речь о хлорофилле и содержащий его хлоропластов. Участвуя в фотосинтезе, они вырабатывают углеводы. Накапливаясь, последние могут перекрывать хроматофоры.
 Тогда Эвглена становится вместо зеленой белесой.
Тогда Эвглена становится вместо зеленой белесой. - Пелликула. Состоит из плоских мембранных пузырьков. Они слагают покровную пленку простейшего. Кстати, на латыни pillis — кожа.
- Сократительная вакуоль. Находится ниже основания жгутика. В латыни «вакуоль» означает «полый». Подобная мышечной, система сокращается, выталкивая из клетки излишки воды. За счет этого сохраняется постоянный объем Эвглены.
С помощью сократительной вакуоли не только происходит выталкивание продуктов обмена веществ, но и дыхание. В их системе схожи Эвглена Зеленая и Амеба. Основа основ клетки — ядро. Оно смещено к заднему концу тела водоросли, подвешено на хроматиновых нитях. Ядро — основа деления, которым размножается Эвглена Зеленая. Класс простейших характеризуется именно таким путем воспроизведения.
Жидкостным наполнением клетки Эвглены является цитоплазма. Ее основа — гиалоплазма. Она состоит из белков, полисахаридов и нуклеиновых кислот. Именно среди них откладываются крахмалоподобные вещества.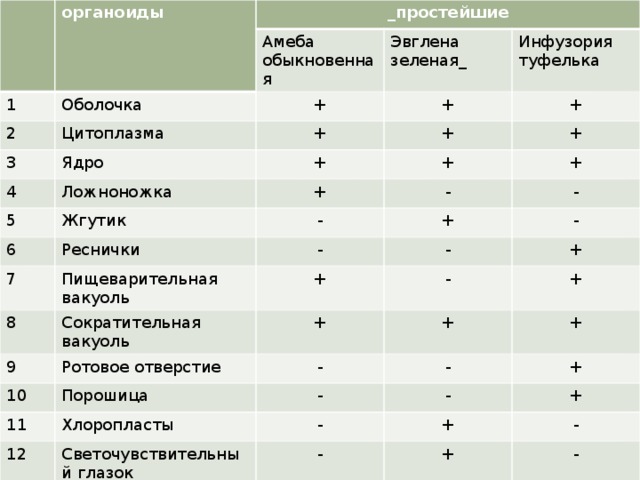 Компоненты буквально плавают в воде. Этот раствор и есть цитоплазма.
Компоненты буквально плавают в воде. Этот раствор и есть цитоплазма.
Процентный состав цитоплазмы непостоянен и лишен организации. Зрительно наполнение клетки бесцветно. Окраску Эвглене придает исключительно хлорофилл. Собственно, его скоплениями, ядром и оболочкой цитоплазма ограничена.
Питание
Питание Эвглены Зеленой не только наполовину автотрофное, а на половину гетеротрофное. В цитоплазме клетки накапливается взвесь крахмалоподобного вещества. Это питательный резерв на черный день. Смешенный тип питания именуется учеными миксотрофным. Если Эвглена попадает в скрытые от света водоемы, к примеру, пещерные, постепенно теряет хлорофилл.
Тогда одноклеточная водоросль больше начинает походить именно на простейшее животное, питаясь исключительно органикой. Это еще раз подтверждает возможность родства меж растениями и зверями. При наличии освещения героиня статьи не прибегает к «охоте» и малоподвижна. Зачем махать жгутиком, если пища в виде света сама падает на тебя? Активно двигаться Эвглена начинает исключительно в сумеречных условиях.
Обойтись ночь без еды водоросль не может, поскольку микроскопична. Делать достаточные запасы энергии попросту негде. Накопленное тут же расходуется на процессы жизнедеятельности. Если Эвглена голодает, испытывая как недостаток света, так и нехватку органики в воде, начинает расходовать крахмалоподобную субстанцию. Она называется парамил. Животные также используют откладываемый под кожей жир.
К резервному способу питания простейшее Эвглена Зеленая прибегает, как правило, в цисте. Это твердая оболочка, которую водоросль образует при сжатии. Капсула подобна пузырю. Собственно, понятие «циста» так и переводится с греческого.
Перед цистообразованием водоросль отбрасывает жгутик. Когда неблагоприятные условия сменяются стандартными, циста прорастает. Из капсулы может выйти одна Эвглена, или уже несколько. У каждой отрастает новый жгутик. Днем Эвглены устремляются к хорошо освещенным участкам водоема, держась у поверхности. Ночью одноклеточные распределяются по всей площади пруда или заводи реки.
Органоиды Эвглены Зеленой
Органоидами называют постоянные и специализированные структуры. Таковые есть как в клетках животных, так и растений. Есть альтернативный термин — органеллы.
Органоиды Эвглены Зеленой, по сути, перечислены в главе «Строение». Каждая органелла — жизненно важный элемент клетки, без которого та не сможет:
- размножаться
- осуществлять секрецию различных веществ
- синтезировать что-либо
- вырабатывать и преобразовывать энергию
- передавать и хранить генетический материал
Органеллы свойственны для эукариотических организмов. У таких обязательно есть ядро и оформленная внешняя мембрана. Эвглена Зеленая подходит под описание. Если обобщить, к органоидам эукариотов относятся: эндоплазматическая сеть, ядро, мембрана, центриоли, митохондрии, рибосомы, лизосомы и аппарат Гольджи. Как видно, набор органоидов Эвглены ограничен. Это указывает на примитивность одноклеточного.
Размножение и продолжительность жизни
Размножение Эвглены Зеленой, как говорилось, начинается с деления ядра.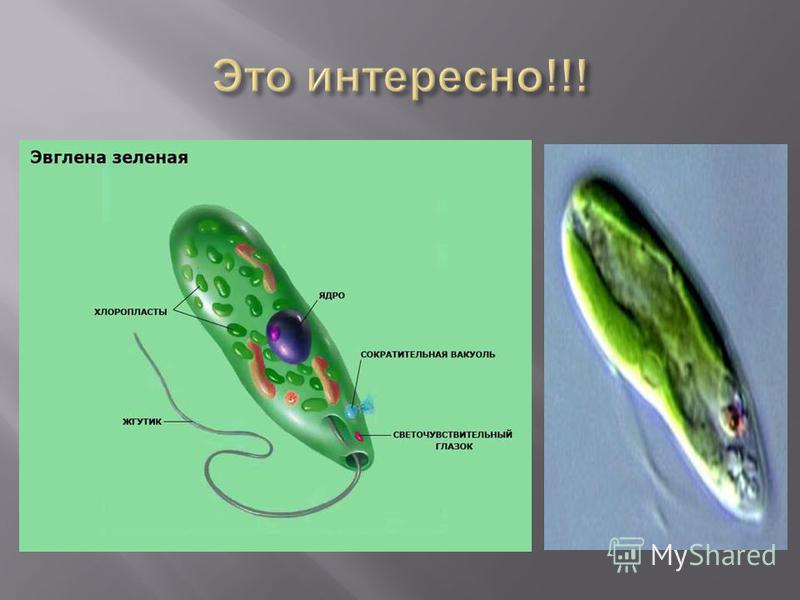 Два новых расходятся по разным сторонам клетки. Потом она начинает делиться в продольном направлении. Поперечное деление не возможно. Линия разрыва Эвглены Зеленой проходит меж двух ядер. Разделенная оболочка как бы замыкается на каждой половинке клетки. Получается две самостоятельных.
Два новых расходятся по разным сторонам клетки. Потом она начинает делиться в продольном направлении. Поперечное деление не возможно. Линия разрыва Эвглены Зеленой проходит меж двух ядер. Разделенная оболочка как бы замыкается на каждой половинке клетки. Получается две самостоятельных.
Пока происходит продольное деление, на «бесхвостой части» вырастает жгутик. Процесс может происходить не только в воде, но и снеге, на льду. Эвглена терпима к холоду. Поэтому на Урале, Камчатке, островах Арктики встречается цветущий снег. Правда, зачастую он алый или темный. Своеобразным пигментом служат родственницы героини статьи — Красная и Черная Эвглены.
Жизнь Эвглены Зеленой, по сути, бесконечная, поскольку одноклеточное размножается делением. Новая клетка — часть старой. Первая при этом продолжает «давать» потомство, сохраняясь сама.
Если говорит о сроке жизни конкретной клетки, сохраняющей целостность, речь о паре дней. Таков век большинства одноклеточных. Их жизнь столь же мала, как и размеры.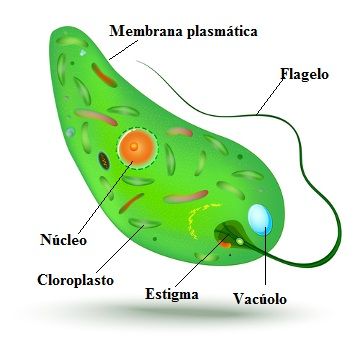 Кстати, слово «Эвглена» сложено из двух греческих — «эу» и «глене». Первое переводится как «хорошо», а второе — «блестящая точка». В воде водоросль, действительно, поблескивает.
Кстати, слово «Эвглена» сложено из двух греческих — «эу» и «глене». Первое переводится как «хорошо», а второе — «блестящая точка». В воде водоросль, действительно, поблескивает.
Наряду с другими простейшими, Эвглена Зеленая ходит в школьную программу. Одноклеточную водоросль изучают в 9-м классе. Учителя часто дают детям стандартную версию, согласно которой Эвглена — растение. Вопросы о нем встречаются в ЕГЭ по биологии.
Подготавливаться можно как по учебникам ботаники, так и зоологии. В обоих есть главы, посвященные Эвглене Зеленой. Поэтому некоторые учителя рассказывают детям о двойственности одноклеточного. Особенно часто углубленный курс дают в профильных биохимических классах. Ниже видео об Эвглене Зелёной, которая пугает инфузорий туфелек.
Источник
Загадочная эвглена – кто она – животное или растение? (3 фото)
Почему эвглена зеленая животное, тогда как одни ученые настаивают на том, что она представляет собой растение, а другие уверены в ее принадлежности к простейшим организмам?
Такие организмы как амеба или инфузория туфелька знакомы всем еще со школы. Несмотря на определенные различия, все простейшие организмы объединяют такие признаки как особенности строения и способ передвижения. Но при этом существуют и такие, которые нельзя четко классифицировать, поскольку они объединяют признаки как животных, так и растений.
Несмотря на определенные различия, все простейшие организмы объединяют такие признаки как особенности строения и способ передвижения. Но при этом существуют и такие, которые нельзя четко классифицировать, поскольку они объединяют признаки как животных, так и растений.
Что собой представляет эвглена зеленая?
Это одноклеточный организм размером всего 0,05 мм, поэтому невооруженным глазом разглядеть ее не получится. В составе присутствует хлорофилл, поэтому эвглена зеленая способна питаться с помощью процесса фотосинтеза. Но с наступлением темноты процесс питания не останавливается: эвглена начинает употреблять в пищу окружающую органику, что роднит ее с животными.
По форме этот организм вытянутый. На одном конце имеется жгутик, посредством которого она перемещается. Возле жгутика расположен клеточный рот для поедания органической пищи. Кстати, в процессе ее поглощения принимает участие и жгутик.
Место обитания этого организма – загрязненные пресные водоемы. Заболоченное озеро или болото с зеленоватой поверхностью – свидетельство активного размножения в нем эвглены зеленой.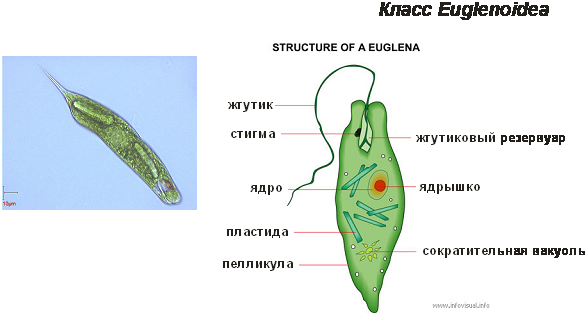 Организм может жить и в других водоемах, поскольку использует взаимозаменяемые способы питания – фотосинтез и употребление готовых органических веществ.
Организм может жить и в других водоемах, поскольку использует взаимозаменяемые способы питания – фотосинтез и употребление готовых органических веществ.
К какому царству относится эвглена зеленая?
Ученые классифицируют этот организм отчасти как животное, отчасти как растение. Но при этом официально она не относится ни к одному, ни к другому царству. Долгое время зоологи считали эвглену зеленую животным, а ботаники – растением. Двойная классификация привела к ошибкам и путанице.
Казалось бы, очевидно, что эвглена представляет собой растение. Но растения не способны к передвижению, их клетки должны быть покрыты целлюлозой (клетчаткой) и откладывать вещества в форме крахмала про запас.
Эвглена не соответствует ни одному из вышеперечисленных критериев. Она очень активно движется, используя жгутик. У этого организма отсутствует клеточная стенка, что позволяет клетке менять свою форму. И, наконец, у эвглены отсутствует крахмал, а запасы сахара она делает в виде парамилона. Это вещество – резервный полисахарид, производное глюкозы, близкое по составу крахмалу. Оно уникально и не обнаружено больше ни у какого другого организма за исключением Euglena viridis.
Это вещество – резервный полисахарид, производное глюкозы, близкое по составу крахмалу. Оно уникально и не обнаружено больше ни у какого другого организма за исключением Euglena viridis.
Спорные моменты заставляют выделить этот организм, а также все семейство эвгленовых в самостоятельное царство. Но в общепринятой официальной классификации она – простейший одноклеточный организм. Хотя не исключено, что в перспективе она будет дополнена и видоизменена.
Источник
Тайна эвглены зеленой: растение, животное или простой организм?
Повсюду нас окружают простейшие микроорганизмы. На слуху у большинства людей названия вроде «инфузория туфелька» или «амёба», но на самом деле одноклеточных микроорганизмов гораздо больше. Несмотря на те или иные различия, простейшие в основном похожи — как по модели питания, так и по строению, отличия, как правило, касаются только способа передвижения. Но есть один род микроорганизмов, который хоть и относят к простейшим, поскольку он состоит из одной клетки, но в то же время ему нельзя дать такую четкую классификацию. Ведь его представители отличаются тем, что сочетают в себе признаки РАСТЕНИЙ и ЖИВОТНЫХ. Это род эвглен.
Ведь его представители отличаются тем, что сочетают в себе признаки РАСТЕНИЙ и ЖИВОТНЫХ. Это род эвглен.
Что такое эвглена зеленая
Эвглена зеленая — одноклеточный организм, представитель простейших, из рода эвглен. Размер клетки около 0,05 мм, поэтому невооруженным глазом увидеть ее трудно.
Для примера можно взять самого яркого представителя рода эвглен — эвглена зеленая. Ее клетка содержит хлорофилл, прямо как у растений, поэтому она может питаться за счет процесса фотосинтеза. А в темноте эвглена зеленая питается как животное — пожирая органику вокруг себя. При этом она очень активно передвигается, еще один признак, который роднит ее с животными.
Фотосинтез — процесс образования в клетках углеводов из углекислоты и воды с помощью света, который поглощает хлорофилл растений.
Эвглена зеленая под микроскопом
Эвглена имеет вытянутое тельце, на конце которого находится жгутик, с помощью него организм и передвигается. Жгутик ввинчивается в воду, при этом сама клетка крутится в другую сторону. Рядом со жгутиком у нее расположен клеточный рот для поглощения органической пищи. Кстати, жгутик тоже принимает в этом участие.
Жгутик ввинчивается в воду, при этом сама клетка крутится в другую сторону. Рядом со жгутиком у нее расположен клеточный рот для поглощения органической пищи. Кстати, жгутик тоже принимает в этом участие.
Эвглена зеленая отличается тем, что плывет в сторону света. Для этого в передней части клетки находится светочувствительное образование — глазок, имеющий красный цвет.
Где обитает эвглена зеленая?
Средой обитания эвглены считаются загрязненные пресные водоемы. Наверняка вы задавались вопросом «почему вода в болоте зеленая?» — такой оттенок вода приобретает как раз при сильном размножении эвглены зеленой. В таких водоемах для нее достаточно органической пищи, к тому же так эвглена остается на свету и может питаться за счет фотосинтеза — как растение.
В этой воде большая концентрация эвглены зеленой
Представители рода эвглен широко распространены в природе, они населяют пресноводные бассейны, пруды и озера. Эвглена может использовать фотосинтез и потребление органики как взаимозаменяемые и очевидно эквивалентные источники углерода и энергии. Полового размножения у эвглены не обнаружено.
Полового размножения у эвглены не обнаружено.
Эвглена зеленая — растение или животное?
Среди ученых эвглена классифицируется частично как растение, частично как животное. В то же время официально она не относится ни к царству животных, ни к растениям. Согласно опросу в нашем Telegram-чате, многие считают, что это подвижное растение, но это не совсем так.
Эвглены принадлежат к группе одноклеточных организмов эвгленозои, которые содержат бесцветные и пигментированные организмы. Среди них есть осмотрофы, у которых нет органов для приема пищи и которые способны поглощать молекулы непосредственно из окружающей среды. Также сюда относятся паразиты и фаготрофы, которые охотятся и поглощают твердые частицы пищи, включая бактерии и другие одноклеточные организмы, живущие в этих средах.
Среди фаготрофов есть организмы, которые питаются бактериями, и эукариоты (клетки, содержащие ядра), которые питаются такими же эукариотами. Многие также способны к фотосинтезу.
Самая интересная часть эвглены — это глазное пятно. Глазное пятно на самом деле представляет собой глазок (стигма), очень чувствительный к свету. Это помогает эвглене находить солнечный свет для фотосинтеза.
Схема строения эвглены зеленой
На протяжении сотен лет зоологи считали эти удивительные организмы животными, а ботаники считали их растениями. Классификация в итоге привела к путанице, так как эвглена зеленая может есть пищу посредством гетеротрофии, как животные, а также посредством автотрофии, как растения. Поэтому она и зеленого цвета, так как содержит хлоропласты.
Чем отличаются растения от животных
Вроде бы эвглена зеленая — не что иное, как самое настоящее растение. Но чтобы точно отнести ее к растениям, нужно вспомнить отличительные черты этих организмов.
- Растения не способы активно перемещаться в пространстве.
- Клетка растения обязательно покрыта веществом, которое называется целлюлозой, или клетчаткой.
- Растительная клетка откладывает запасные вещества в виде крахмала.
Эвглена зеленая не попадает ни под один из этих критериев. Во-первых, она активно перемещается с помощью жгутика. Во-вторых, у эвглены нет клеточной стенки, ее тельце может менять свою форму. В-третьих, у эвглены нет крахмала, она запасает сахар в форме особого вещества – парамилона. Кстати, это уникальное вещество, которое не обнаружено больше ни у одного живого организма.
Получается, что единственное, чем эвглена зелёная похожа на растения — наличием хлорофилла. По этой же причине ее нельзя отнести к животным, поскольку ни одно животное не способно к фотосинтезу.
Эти спорные моменты заставляют выделить эвглену зеленую и все семейство эвглен в отдельное царство, отличное от растений и животных. Несмотря на это, в общепринятой классификации эвглена зеленая по-прежнему является простейшим (одноклеточным организмом). Но не исключено, что в ближайшем будущем эта классификация будет доработана.
Но не исключено, что в ближайшем будущем эта классификация будет доработана.
Источник
Эвглена зеленая и растение и животное как доказать
Эвглена зеленая – простейший одноклеточный организм, уникальный тем, что среди биологов до сих пор нет единодушного согласия, к какому царству она принадлежит, животных или растений. Дело в том, что эвглена зеленая сочетает в себе в равной мере признаки как растений, так и животных. Поскольку эвглена содержит в себе хлорофилл, то днем она питается от солнечного света благодаря процессу фотосинтеза, точь-в-точь как это делают все другие растения, но ночью, в темноте она преображается: при обилии органической пищи она может питаться гетеротрофно, то есть, как это делают все животные. Также эвглена зеленая способна передвигаться, опять же, как и все другие животные. Считается, что эвглена зеленая являет собой переходную форму от растений к животным, своим существованием она подтверждает теорию о единстве всего живого. А согласно этой теории человек произошел не только от обезьяны, но и от растений, так что и деревья и цветы наши далекие родичи, но вернемся к эвглене, какое ее строение, среда обитания, чем она питается, как размножается, читайте далее.
Эвглена зеленая: описание и характеристика. Как выглядит эвглена зеленая?
Тело эвглены зеленой состоит из двадцати хлоропластов, в которых и находится хлорофилл, участвующий в фотосинтезе. Хлоропласты представляют собой зеленые пластины, и в целом они присутствуют только у клеток с ядром в центре. И благодаря ним, эвглена зеленая и названа «зеленой», за счет хлоропластов и хлорофилла она действительно ярко-зеленого цвета.
Так выглядит эвглена зеленая, если смотреть на нее под микроскопом.
Если днем эвглена получает энергию за счет солнечного света благодаря процессу фотосинтеза, то ночью она питается органикой из воды. Сама вода при этом должна быть пресной. Поэтому эвглена водится в пресных водоемах: прудах, озерах, реках, болотах.
По внешнему виду эвглена схожа с водорослью, и была бы таковой одноклеточной водорослью, если бы не несколько нюансов. Во-первых, гетерофорное ночное питание эвглены характерно для животных, но не растений. Помимо этого есть и другие признаки принадлежности эвглены к животным:
- Способность к активному передвижению.
 Передвигается эвглена при помощи специального жгутика, его вращательные движения обеспечивают ее мобильность. Движется эвглена всегда поступательно, к слову в этом моменте она отличается от другого простейшего одноклеточного организма – инфузории туфельки, чьи движения всегда плавные за счет большого количества маленьких ресничек.
Передвигается эвглена при помощи специального жгутика, его вращательные движения обеспечивают ее мобильность. Движется эвглена всегда поступательно, к слову в этом моменте она отличается от другого простейшего одноклеточного организма – инфузории туфельки, чьи движения всегда плавные за счет большого количества маленьких ресничек. - Специальные пульсирующие вакуоли – еще один признак принадлежности эвглены к животному царству, своим строением они подобны мышечным волокнам, коими обладают животные, но не растения.
- Наличие ротовой воронки, еще одно свидетельство об эвглене как о животном. Но стоит заметить, что как такового ротового отверстия у эвглены все-таки нет. Просто в попытке захватить органическую пищу, эвглена как бы вжимает внутрь часть своей наружной мембраны. В созданном таким образом отсеке и задерживается пища.
По причине всех этих моментов в ученом сообществе до сих пор не единодушия о том, куда эвглена зеленая относится: к растениям или животным.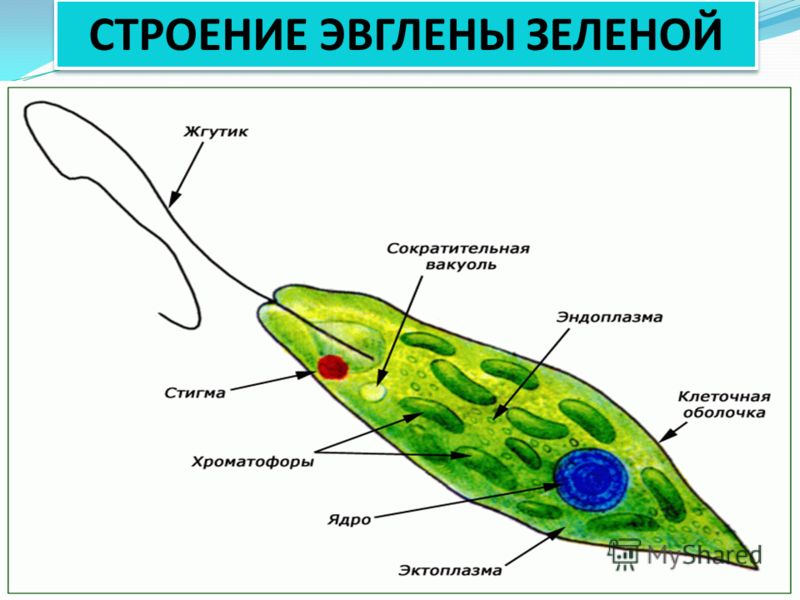 Большинство ученых все-таки причисляют ее к флоре, видя в ней одноклеточную водоросль, 15% биологов считают ее животным, остальные видят в ней промежуточный вид.
Большинство ученых все-таки причисляют ее к флоре, видя в ней одноклеточную водоросль, 15% биологов считают ее животным, остальные видят в ней промежуточный вид.
Признаки эвглены зеленой
Тело нашей героини веретеновидной формы с жесткой оболочкой. Длина тела эвглены в среднем составляет 0,5 мм. Передняя часть тела имеет тупую форму и обладает красным глазком. Глазок этот светочувствителен и позволяет своему обладателю находить «кормовые» места днем, другими словами «он ведет эвглену на свет», в любом водоеме эти микроорганизмы всегда собираются в самых светлых местах. К слову большое количество эвглен в том или ином водоеме делает поверхность воды красноватой, даже бурой. Столь необычный эффект от скопления эвглен наблюдал и описал в своих работах великий натуралист древности Аристотель в IV веке до н. е.
На переднем конце тела одноклеточного организма имеется жгутик. Причем у новорожденных организмов жгутик может отсутствовать, так как клетка делится на двое и жгутик остается только на одной из частей. На второй эвглене он отрастет со временем.
На второй эвглене он отрастет со временем.
Задний конец тела эвглены зеленой наоборот является заостренным, такая его форма улучшает обтекаемость, а значит и скорость.
Интересно, что для эвглены зеленой свойственна метаболия, то есть способность менять форму тела. Несмотря на то, что как правило эвглены веретенообразные, в разных обстоятельствах они могут принимать и другие формы, быть:
- подобными кресту,
- вальковатыми,
- шарообразными,
- комковатыми.
Но вне зависимости от формы тела эвглены зеленой жгутик ее будет невидимым, если клетка живая. А невидим он по той причине, что частота его движений настолько быстрая, что человеческий глаз попросту не способен его уловить.
Строение эвглены зеленой
Резюмируя все сказанное выше можно заключить, что эвглена зеленая это животное или растение, состоящее из:
- Жгутика, само наличие которого относит нашу героиню к классу жгутиконосцев. Диаметр жгутика составляет в среднем 0,25 микрометра, увидеть его можно только через мощный микроскоп.
 Отросток покрыт плазматической мембраной состоящей из микротрубочек, которые движутся относительно друг друга. Их движение и вызывает общее движение жгутика.
Отросток покрыт плазматической мембраной состоящей из микротрубочек, которые движутся относительно друг друга. Их движение и вызывает общее движение жгутика. - Глазка, также иногда его называют стигмой. Глазок состоит из зрительных волокон и линзоподобных образований. Благодаря последним он улавливает свет, который линза отражает на жгутик. Получив от нее импульс, жгутик в свою очередь начинает движение на свет. Красный цвет глазка эвглены обусловлен окрашенными каплями липида – жира. Сам глазок окружен мембраной.
- Хроматофор, это специальные пигментированные клетки и компоненты растений, отвечающие за его окраску, у эвглены они ярко-зеленые.
- Пепликулы, на латыни это слово значит «кожа». Пепликулы эвглены, состоящие из плоских мембранных пузырьков, образуют оболочку этого простейшего одноклеточного организма.
- Сократительной вакуоли, которая располагается чуть ниже основания жгутика. Эта сократительная вакуоль является своеобразным аналогом мышечной ткани.
 В строении эвглены она ответственна за выталкивание из клетки излишков воды, благодаря чему эвглена сохраняет свой постоянный объем.
В строении эвглены она ответственна за выталкивание из клетки излишков воды, благодаря чему эвглена сохраняет свой постоянный объем.
Вот так строение эвглены зеленой выглядит на рисунке.
Еще несколько слов о сократительной вакуоли, с ее помощью также осуществляется дыхание эвглены зеленой.
Среда обитания эвглены зеленой
Обитает эвглена только в пресных водоемах, причем особенно предпочитая те, где вода погрязнее. В водоемах с чистой водой эвглена либо малочисленна, либо и вовсе отсутствует. В этом отношении эвглена схожа с другими своими одноклеточными «коллегами»: амебами и инфузориями, которые также любят грязную воду.
Так как эвглены являются довольно таки устойчивыми к холоду, то помимо пресной воды они могут обитать в суровых условиях льда и снега.
Стоить заметить, что эвглена зеленая может быть опасной, так обитая в гнилостной воде она порой служит переносчиком трипаносом и лейшмании. Последняя является возбудителем некоторых кожных заболеваний. Трипаносомы же могут вызывать африканскую сонную болезнь, поражающую нервную и лимфатическую системы, что приводит к лихорадке.
Трипаносомы же могут вызывать африканскую сонную болезнь, поражающую нервную и лимфатическую системы, что приводит к лихорадке.
Если эвглена попадет в аквариумную воду, то такая вода зацветет, поэтому не без основания аквариумисты считают эвглену опасным паразитом и пытаются от нее избавиться. Избавиться от эвглены зеленой можно при помощи специальных химических средств (не забыв на это время перемесить рыбу в другое место). И, разумеется, не стоит забывать о регулярной замене воды и фильтрации, тогда вода в аквариуме будет свежей и чистой и эвглены в ней не заведутся.
Питание эвглены зеленой
Как мы писали выше, питание этого существа наполовину гетеротрофное, и наполовину автотрофное, то есть и за счет солнечной энергии и за счет органики. Такой необычный, смешанный тип питания, характерный исключительно для жизнедеятельности эвглены зеленой, биологи прозвали миксотрофным.
Днем эвглена находится под Солнцем, она не тороплива и малоподвижна, и правда, зачем ей двигаться и махать своим жгутиком, если «пища» в виде солнечных лучей сама падает на тебя.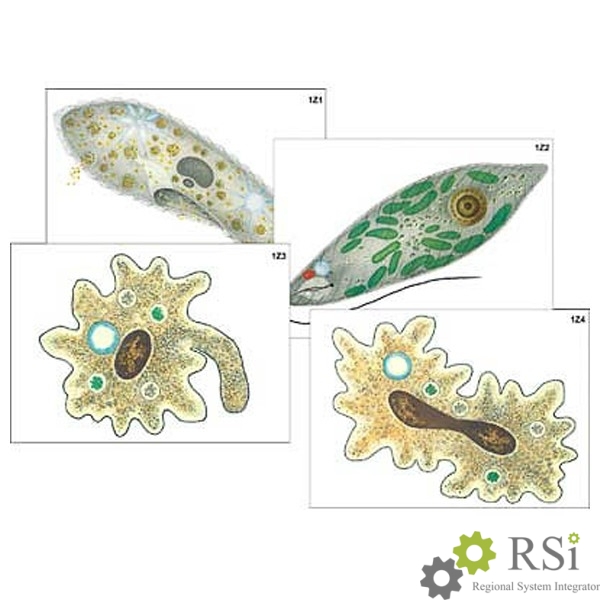 Но если эвглена оказывается в каком-нибудь скрытом от Солнца, темном водоеме, а также ночью, то она из растения, преображается в животное, ее жгутик начинает активно двигаться, перемещая свою хозяйку по водоему в поисках органической «еды».
Но если эвглена оказывается в каком-нибудь скрытом от Солнца, темном водоеме, а также ночью, то она из растения, преображается в животное, ее жгутик начинает активно двигаться, перемещая свою хозяйку по водоему в поисках органической «еды».
Поэтому если днем эвглены располагаются только в светлых частях водоема, причем обычно близко к поверхности воды, то ночью они расползаются по всему водоему.
Органоиды эвглены зеленой
Органоиды или органеллы – это постоянные или специализированные структуры каждой клетки, как животной, так и растительной. Что же касается органоидов эвглены зеленой, то они уже были перечислены выше, в разделе о строении эвглены. Каждый из этих органоидов или органелл жизненно важный элемент одноклеточного организма, без которого он не смог бы питаться, передвигаться, размножаться и вообще существовать.
Размножение эвглены зеленой
Хотели бы вы дорогой читатель жить вечно? Это философский вопрос, и возможно вы удивитесь, но в биологии есть пример «бесконечной жизни», и да, наша сегодняшняя героиня, эвглена и является этим примером. Продолжительность жизни эвглены зеленой, по сути, бесконечна! А все из-за способа ее размножения, который осуществляется исключительно посредством деления клетки. Так что эвглены, которые вы можете сегодня наблюдать в каком-нибудь зеленом пруду или болоте были созданы посредством деления от некой эвглены, живущей еще в эпоху динозавров, а то и раньше.
Продолжительность жизни эвглены зеленой, по сути, бесконечна! А все из-за способа ее размножения, который осуществляется исключительно посредством деления клетки. Так что эвглены, которые вы можете сегодня наблюдать в каком-нибудь зеленом пруду или болоте были созданы посредством деления от некой эвглены, живущей еще в эпоху динозавров, а то и раньше.
А вот то время, которое эвглена сохраняется неделимой, наоборот крайне мало, и составляет всего несколько дней. Дальше эвглена начинает делиться, потом опять делиться, и так до бесконечности.
Что же касается самого деления эвглены, то оно происходит в несколько этапов, все начинается с деления ядра клетки. Два новых ядрышка расходятся по разные стороны клетки, после чего уже сама клетка начинает делиться в продольном направлении. Поперечное деление не возможно.
Так деление эвглены выглядит схематически.
Разделенная оболочка замыкается на каждой половине клетки. Таким образом, из одной эвглены получается две.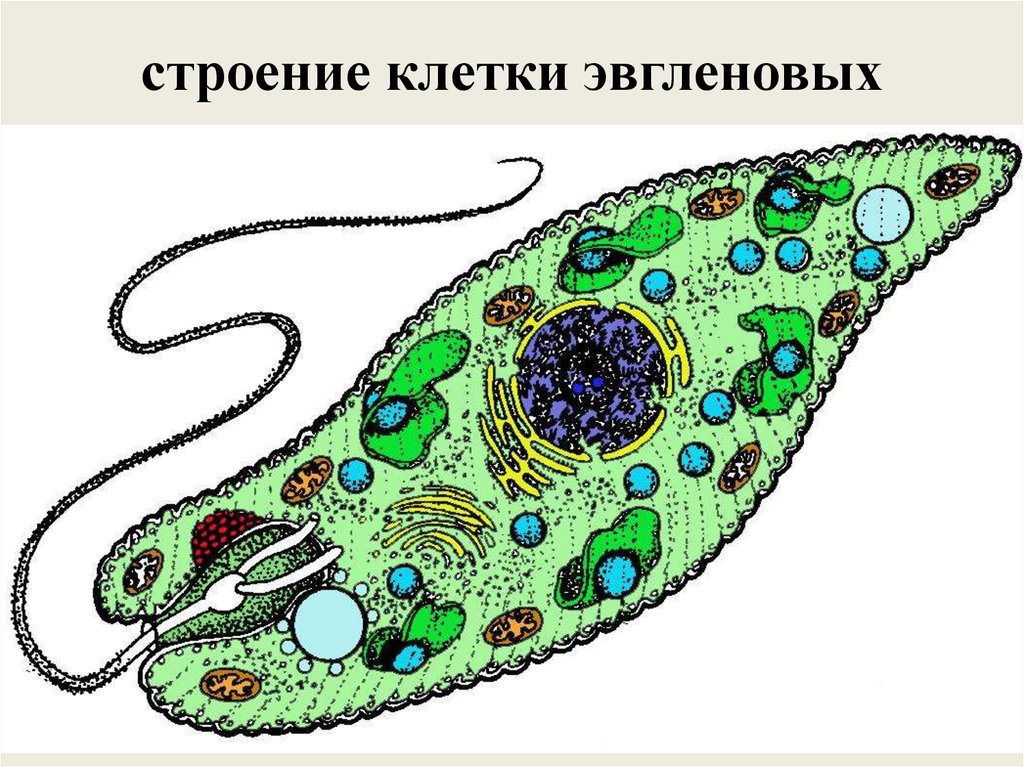 В благоприятной среде эти существа могут размножаться прямо таки в арифметической прогрессии.
В благоприятной среде эти существа могут размножаться прямо таки в арифметической прогрессии.
Источник
Эвглена зеленая — растение или животное?
Эвглена зеленая – это одноклеточное животное, встречающееся в пресных застоявшихся водоемах, болотах, канавах, лужах. Окраска этого организма обусловлена содержанием большого количества хлоропластов в цитоплазме. Поэтому и кажется, что вода «зацветает», когда в ней чрезмерно разводится эвглена зеленая.
Строение ее немного сложнее, если сравнивать с амебой. Обе они имеют протоплазму и ядро. Однако эвглена зеленая снаружи еще покрыта слоем пелликулы – эластичной оболочки. Организм имеет форму, напоминающую веретено, тупое с одного конца и удлиненное – с другого. Из углубления на переднем крае выходит небольшой жгутик. Там же расположен ярко-красный «глазок», реагирующий на свет и тем самым помогающий клетке выбирать направление движения. Рядом с ним находится вакуоля. Благодаря уплотненной наружной оболочке форма животного существенно не меняется, оно может лишь слегка, в определенных границах, сжиматься и выпрямляться. Такое строение эвглены зеленой обуславливает и способ перемещения. Совершая жгутиком вращательные движения, это микроскопическое существо довольно быстро плавает. Встречаются разновидности, которые совершают телом волнообразные колебания и таким образом плывут. Почему так происходит, пока не ясно. У биологов есть два предположения на этот счет. С одной стороны, возможно, имеется связь между органеллами эвглены и белковыми нитями, которые находятся под пелликулой и могут сокращаться. А с другой стороны, такой тип движения может вызываться слизью, выделяемой клеткой.
Такое строение эвглены зеленой обуславливает и способ перемещения. Совершая жгутиком вращательные движения, это микроскопическое существо довольно быстро плавает. Встречаются разновидности, которые совершают телом волнообразные колебания и таким образом плывут. Почему так происходит, пока не ясно. У биологов есть два предположения на этот счет. С одной стороны, возможно, имеется связь между органеллами эвглены и белковыми нитями, которые находятся под пелликулой и могут сокращаться. А с другой стороны, такой тип движения может вызываться слизью, выделяемой клеткой.
Питаться эвглена зеленая может и как животное, и как растение. Способ, который она выбирает, зависит от освещения. В ее протоплазме содержится более двадцати овальных телец – хроматофор. Они, как уже говорилось, и окрашивают клетку в зеленый цвет. Днем, используя хлорофилл, содержащийся в хроматофорах, эвглена зеленая способна участвовать в фотосинтезе, усваивая необходимый ей углерод так же, как и растения – из углекислого газа.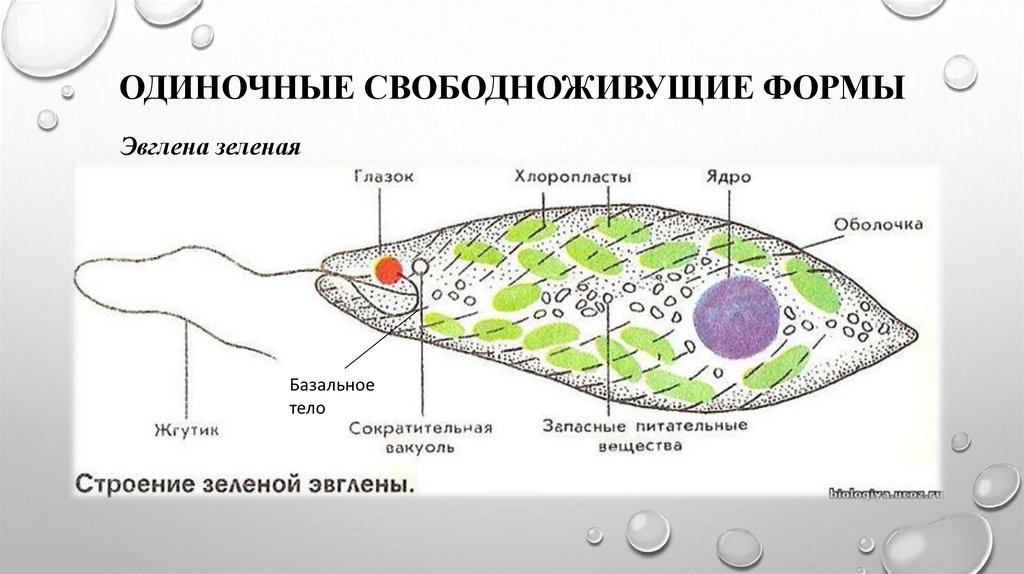 При этом в ее теле из неорганических веществ образуется питательное вещество, напоминающее крахмал и откладывающееся в виде зерен в цитоплазме. Ночью эта клетка может питаться так же, как и животное. Она способна с помощью вакуолей сразу перерабатывать органические вещества, которых в водоемах вдоволь в уже растворенном виде. Так делает и амеба. И чем запущеннее водоем, тем этих веществ больше. Если эвглена зеленая находится в темноте долгое время, хлорофилл из хроматофор исчезает. Соответственно, пропадает и окраска у клетки, она полностью обесцвечивается.
При этом в ее теле из неорганических веществ образуется питательное вещество, напоминающее крахмал и откладывающееся в виде зерен в цитоплазме. Ночью эта клетка может питаться так же, как и животное. Она способна с помощью вакуолей сразу перерабатывать органические вещества, которых в водоемах вдоволь в уже растворенном виде. Так делает и амеба. И чем запущеннее водоем, тем этих веществ больше. Если эвглена зеленая находится в темноте долгое время, хлорофилл из хроматофор исчезает. Соответственно, пропадает и окраска у клетки, она полностью обесцвечивается.
Существуют виды, которым вообще несвойственен фотосинтез, они могут питаться исключительно как животные. У них даже развивается своеобразный ротовой аппарат для заглатывания микроскопических частиц пищи.
Возможность выбора этим организмом способа питания еще раз указывает ученым на то, что животные и растения имеют одно происхождение.
Размножается эвглена зеленая продольным делением самой клетки: вслед за протоплазмой распадается на две половинки и ядро.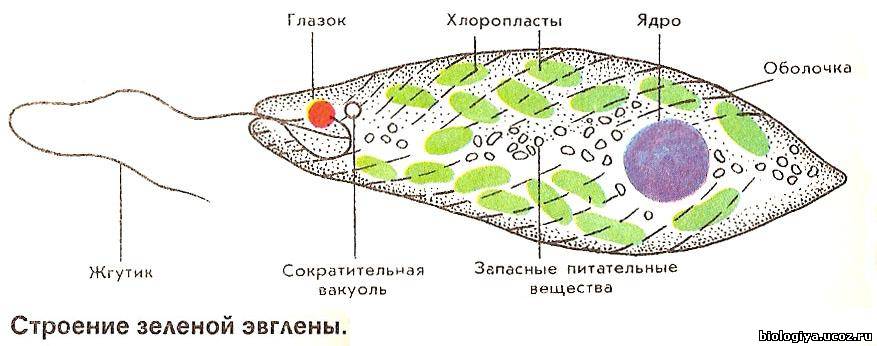 У каждой появившейся особи вырастает новый жгутик. При благоприятных условиях эвглены зеленой разводится настолько много, что и вода тоже становится соответствующего цвета. Есть такие виды этих одноклеточных организмов, которые, эволюционируя, замечательно приспособились жить даже на морозе. В результате такой адаптации во времена их массового размножения снег окрашивается не только в зеленый цвет, а и в красный, желтый и даже в голубой.
У каждой появившейся особи вырастает новый жгутик. При благоприятных условиях эвглены зеленой разводится настолько много, что и вода тоже становится соответствующего цвета. Есть такие виды этих одноклеточных организмов, которые, эволюционируя, замечательно приспособились жить даже на морозе. В результате такой адаптации во времена их массового размножения снег окрашивается не только в зеленый цвет, а и в красный, желтый и даже в голубой.
Также существуют эвглены, клетки которых насыщены каротином. Они окрашивают водоемы в красный или бурый цвет. Когда реки, лужи, болота т. п. высыхают или замерзают, эвглена зеленая теряет жгутик, округляется, покрывается толстой оболочкой – на время трансформируется в цисту. В таком виде она может дожидаться благоприятных условий на прежнем месте или переноситься вместе с пылью.
Источник
Простейшие одноклеточные | Дистанционные уроки
11-Ноя-2013 | комментария 2 | Лолита Окольнова
Загадочная группа микроскопических одноклеточных организмов, рассматриваемая как подцарство царства Животные, а иногда выделяемая в отдельное царство.
автор статьи — Саид Лутфуллин
Впервые люди узнали о существовании простейших в VII веке из открытия голландского натуралиста Антони ван Левенгука, именно он первым удостоился наблюдать их в капле воды, в изобретенный им же микроскоп.
За многие годы развития биологии, с появлением электронной микроскопии и генетики эта группа организмов все больше изучалась и систематика ее претерпевала значительные изменения.
Сегодня их все чаще определяют в отдельное царство, так как среди простейших одноклеточных есть организмы, обладающие признаками, отличными от признаков животных. Например, способностью к фотосинтезу, характерной для растений, обладает Эвглена зеленая. Или, к примеру, тип Лабиринтулы — раньше относили к грибам.
Среди простейших множество всевозможных паразитов, включая паразитов человека, вызывающих опасные заболевания.
Клетка простейшего одноклеточного организма имеет организацию, общую для клеток эукариот.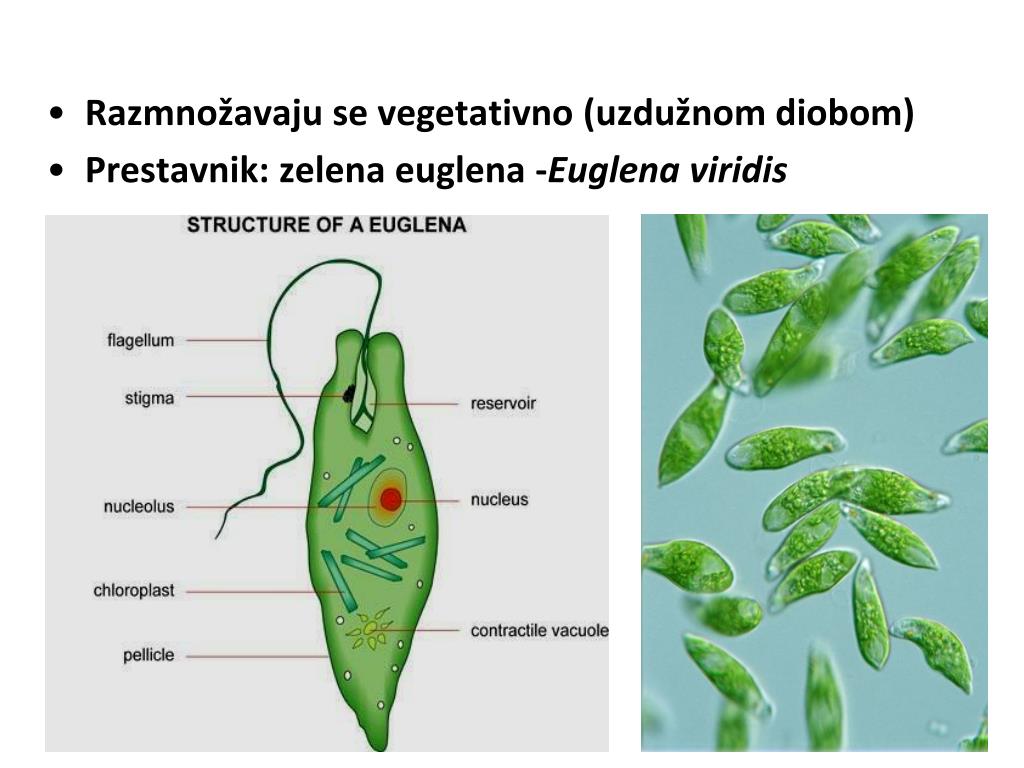 Но так же у большинства простейших имеются специфические органоиды:
Но так же у большинства простейших имеются специфические органоиды:
- сократительные вакуоли, служащие для удаления излишка жидкости и поддержания нужного осмотического давления;
- разнообразные органоиды движения: жгутики, реснички и псевдоподии (ложноножки). Ложноножки, как видно из названия, настоящими органеллами не являются, они представляют всего лишь выпячивания клетки.
Подцарство (или царство) Простейшие одноклеточные представлено 7 основными типами:
Рассмотрим типы более подробно
Тип Саркомастигофоры
Подразделяется на три подтипа: Жгутиковые, Опалины, Саркодовые.
Жгутиковые — группа организмов, как видно из названия для них характерны общие органоиды движения — жгутики.
Места обитания: пресные воды, моря, почвы. Встречаются жгутиковые, обитающие в многоклеточных организмах. Для жгутиковых характерно сохранение постоянной форме тела, благодаря пелликуле, или панцирю.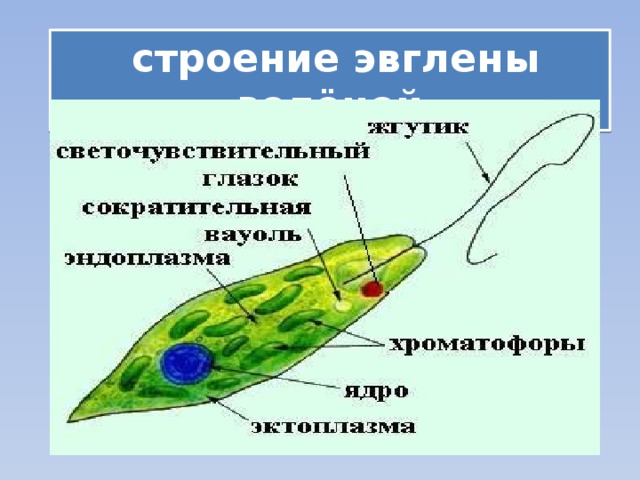
Размножаются в основном бесполым путем: продольным делением надвое.
Типы питания гетеротрофный, автотрофный, миксотрофный.
Строение рассмотрим на примере Эвглены зеленой.
- Для нее характерен миксотрофный (смешанный) тип питания.
- Имеются специальные органоиды — хлорофиллсодержищие хроматофоры, в которых происходит процесс фотосинтеза, аналогичный фотосинтезу растений.
- В связи со способностью к фотосинтезу у Эвглены зеленой имеется светочувствительный органоид — стигма, его еще иногда называют светочувствительным глазком.
- Удаление излишков жидкости происходит благодаря работе сократительной вакуоли.
- Среди жгутиковых встречаются паразиты.
Например, трипаносомы — опасные паразиты человека и животных, вызывающие тяжелые заболевания.
Некоторые виды трипаносом вызывают сонную болезнь. Переносчиком Африканского трипаносомоза (так по-научному называется эта болезнь) является муха цеце.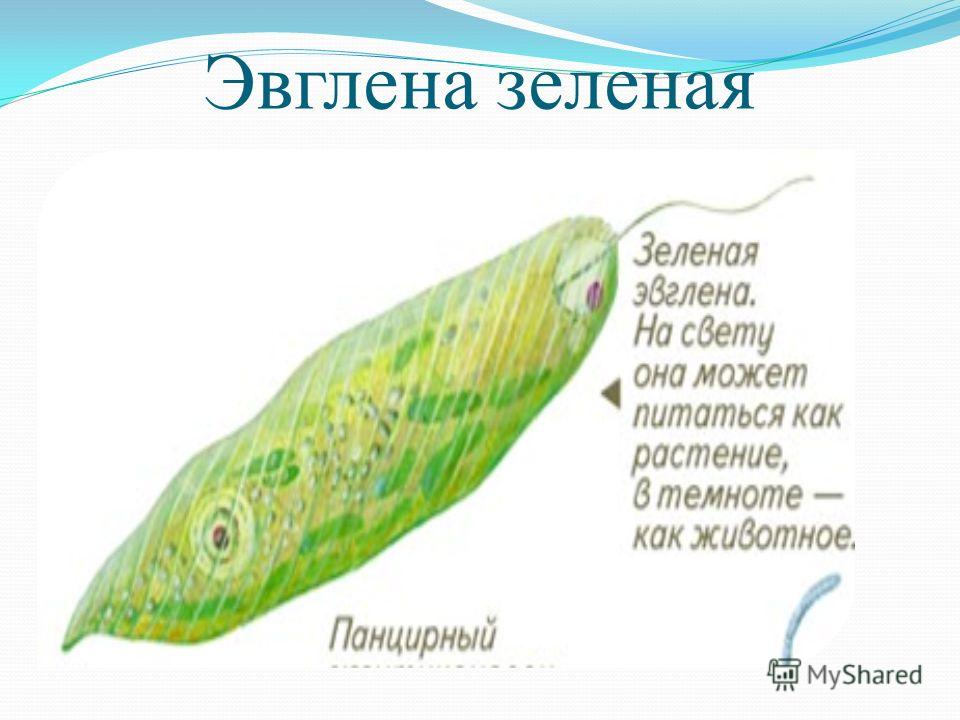 Это кровососущее насекомое.
Это кровососущее насекомое.
Путь передачи такой: муха цеце кусает зараженного животного, у него в крови полно паразитов, вызывающих болезнь. Муха пьет эту кровь и паразиты вместе с кровью попадают в кишечник насекомого. Там паразиты размножаются и постепенно переходят к слюнным железам и слюнным протокам. При укусе здорового животного паразиты попадают к нему в кровь.
Сначала трипаносомы — простейшие одноклеточные организмы размножаются в месте укуса, потом проникают в кровь. Наблюдается лихорадка, увеличиваются лимфатические узлы. Затем паразиты проникают в нервную систему. И начинается самое «веселое»: сильные головные боли, спутанность сознания, сонливость, и как следствие — кома. Без нужного лечения, почти сто процентный смертельный исход. «Не ходите, дети, в Африку гулять», а то заболеете сонной болезнью и умрете.
Трипаносомы. Плавают и вызывают опасную болезнь.
Из кишечных паразитов широко распространены лямблии.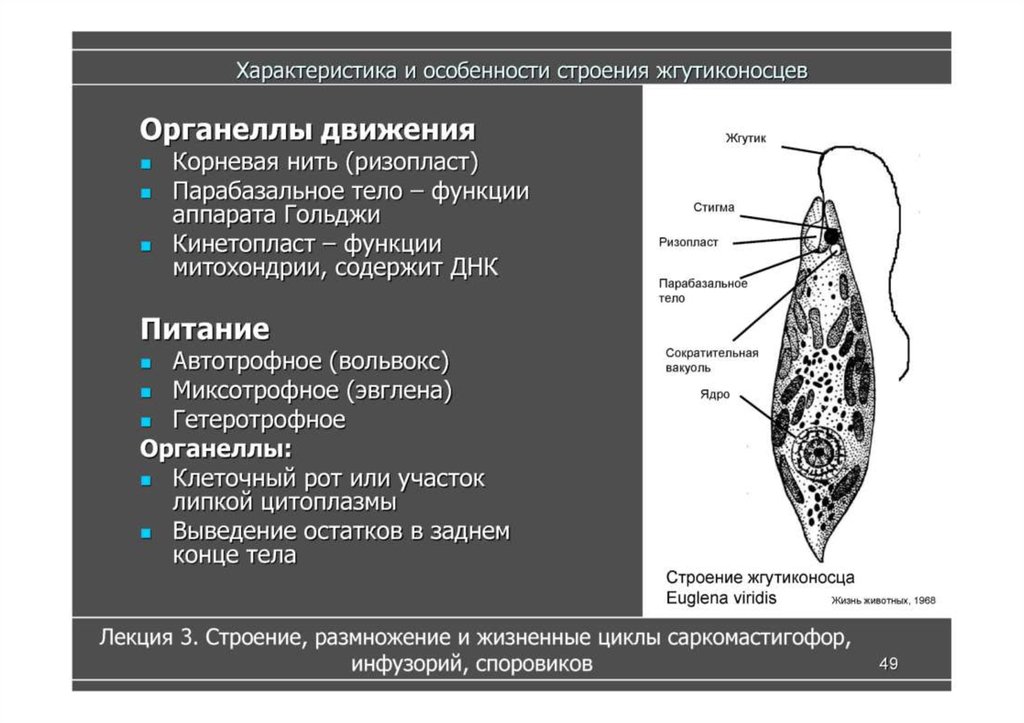 Чтобы не заболеть лямблиозом нужно мыть руки, овощи и фрукты. И не пить сырую воду и воду из «сомнительных» источников.
Чтобы не заболеть лямблиозом нужно мыть руки, овощи и фрукты. И не пить сырую воду и воду из «сомнительных» источников.
Лямблия. Похожа на грушу. Мнемоническое правило: лямблия в форме груши, по этому чтобы ей не заразиться, надо мыть грушу.
Опалины — группа паразитических простейших. (Опалина лягушачья — опалина, паразитирующая в кишечнике лягушки)
Саркодовые — простейшие, не имеющие постоянной формы тела.
Органоиды движения — псевдоподии (ложноножки). Раньше саркодовых и жгутиковых относили к двум разным типам, противопоставляя их органоиды движения: псевдоподии и жгутики. Но оказалось, что на некоторых этапах развития у саркодовых имеются жгутики, а некоторые организмы обладают признаками как жгутиковых, так и саркодовых.
Саркодовые преимущественно свободноживущие простейшие, но встречаются так же паразиты.
Подтип саркодовые включает классы: Корненожки, Радиолярии (Лучевики), Солнечники.
Корненожки. Этот класс включает отряды: Амебы, раковинные амебы, фораминиферы.
Этот класс включает отряды: Амебы, раковинные амебы, фораминиферы.
- Амебы питаются фагоцитозом. Вокруг захваченного кусочка пищи образуется пищеварительная вакуоль.
- Размножаются делением надвое.
- Если Эвглена зеленая двигается в сторону света (так как он ей нужен для фотосинтеза), то Амеба обыкновенная — наоборот — движется от света. Так же амеба избегает других раздражителей.
Обычно рассматривают такой опыт: в каплю воды с амебой с одной стороны кладут кристаллик соли, и можно наблюдать движение амебы в обратную сторону.
Если амеба попадает в неблагоприятные условия, то она образует цисту, т. е. инцистируется: образует вокруг себя плотную оболочку, оставляя внутри малое количество цитоплазмы и набор нужных органоидов. В таком виде легче пережить тяжелое время.
- Среди амеб есть паразитические формы. Например, дизентерийная амеба. Питается эритроцитами. Вызывающее амебную дизентерию (амебный колит).
 Эти амебы питаются клетками кишечника, образуя тем самым язвы. На кульминационной стадии развития дизентерийная амеба может начать захватывать эритроциты.
Эти амебы питаются клетками кишечника, образуя тем самым язвы. На кульминационной стадии развития дизентерийная амеба может начать захватывать эритроциты.
Раковинные амебы. Они имеют схожее строение с амебами, только имеют раковину, с отверстием (устье) из которого «выглядывают» псевдоподии. Все раковинные амебы свободноживущие, обитают в пресных водах. Так как раковина не может разделиться надвое, деление происходит по-особому: образуется дочерняя особь, но она не сразу отделяется от материнской. Вокруг дочерней образуется новая раковина. Потом амебы разъединяются.
Фораминиферы — один из самых многочисленных отрядов простейших одноклеточных — корненожек. Входят в состав морского планктона. У фораминифер, как и у раковинных амеб, есть раковина.
Радиолярии очень интересные микроорганизмы, входят в состав морского планктона. Для них характерно наличие внутреннего скелета. У радиолярий наибольшее количество хромосом из всех живых существ.
Радиолярии, Фораминиферы и раковинные амебы, умирая, оставляют после себя раковины и внутренние скелеты. Скопление всего этого добра образует залежи известняка, мела, кварца и прочего.
Солнечники — немногочисленная группа простейших. Свое название получили из-за схожести внешнего вида псевдоподий с лучами солнца. Такие псевдоподии называются аксоподиями.
Тип Инфузории
— наиболее высокоорганизованный тип одноклеточных простейших. Обитают в морской, пресной водах. Встречаются паразиты.
Характерные особенности:
- постоянная форма тела, благодаря наличию пелликулы;
- для некоторых инфузорий характерны специфические защитные органеллы;
- ядерный дуализм, т. е. наличие двух ядер: полиплоидного макронуклеуса (вегетативного ядра) и диплоидного микронуклеуса (генеративного ядра). Такая ситауция с ядрами необходима для осуществления полового процесса: конъюгации.
 А непосредственно размножение только бесполое: продольным делением надвое.
А непосредственно размножение только бесполое: продольным делением надвое. - Органеллы передвижения — реснички. Строение ресничек такое же, как у жгутиков.
Строение рассмотрим на примере Инфузории-туфельки. Это — классика, это знать надо.
Инфузория-туфелька — хищник. Питается бактериями. Жертва захватывается специализированными ресничками и направляется в клеточный рот, затем следует клеточная глотка, затем пищеварительная вакуоль. Не переваренные остатки выбрасываются через порошицу во внешнюю среду.
В пищеварительной системе жвачных животных обитают симбиотические инфузории, помогающие переваривать клетчатку:
Инфузория-трубач
Сувойки — инфузории ведущие прикрепленный образ жизни.
Тип Апикомплексы
включает в себя исключительно паразитических простейших. Органеллы движения только у гамет. Включает два класса: перкинсеи и споровики.
Среди апикомплексов большое число паразитов человека.
Например, простейшие рода Плазмодии вызывают опасное заболевание — малярию.
Переносчиком малярийного плазмодия является малярийный комар. При укусе возбудители передаются хозяину. Плазмодии — внутриклеточные паразиты, паразитируют в эритроцитах. Поэтому одним из симптомов малярии помимо лихорадки: анемия. А что самое страшное: человек для малярийного плазмодия является промежуточным хозяином, то есть плазмодию грубо говоря «наплевать» на человека, если основного хозяина паразиты стремятся сохранить: им еще жить в нем надо и невыгодно, если он умер раньше времени. То промежуточные хозяева нужны только для определенного этапа жизни. И без разницы выживет он или нет.
Род Токсоплазмы вызывают заболевания животных — токсоплазмозы. Они паразитируют в кошках. Поэтому следует поаккуратнее контактировать с этими созданиями.
Тип Лабиринтулы
— простейшие одноклеточные свободноживущие колониальные простейшие, обитающие на морских водорослях. Ранее относили к грибам. Название такое получили потому, что колония действительно напоминает лабиринт.
Ранее относили к грибам. Название такое получили потому, что колония действительно напоминает лабиринт.
Тип Асцетоспоридии
— простейшие одноклеточные паразиты морских моллюсков.
Тип Миксоспоридии
— паразиты рыб и многощетинковых червей. Раньше их относили к Апикомплексам, так как Миксоспоридии тоже образуют споры. Но оказалось это «разные» споры.
Тип Микроспоридии
— паразитические простейшие одноклеточные. Некоторые виды паразитируют в пчелах, что вредит пчеловодству.
Итак, мы рассмотрели типы царства (подцарства) Простейших одноклеточных организмов. Чтобы все знания закрепились, давайте посмотрим на систематику:
Не смотря на свои небольшие размеры, простейшие одноклеточные имеют огромное значение:
- простейшие входят в пищевые цепи;
- образуют планктон;
- выполняют роль сапрофитов, поглощая разлагающиеся останки;
- простейшие очищают водоемы не только от гниющих остатков, но и от бактерий;
- участвуют в образовании почв и залежей мела и известняка.

- являются хорошими индикаторами чистоты воды.
- автотрофные и миксотрофные простейшие, вместе с растениями выполняют очень важную миссию — пополнение атмосферы кислородом.
- Подписка на рассылку
(Правила комментирования)
Центральные метаболические пути эвглены и их субклеточное расположение
1. Эйникер-Ламас М., Мезиан Г.А., Фернандес Т.Б., Сильва Ф.Л.С., Герра Ф., Миранда К., Аттиас М., Оливейра М.М. Euglena gracilis как модель для изучения токсичности и накопления Cu 2+ и Zn 2+ в эукариотических клетках. Окружающая среда. Загрязн. 2002; 120: 779–786. doi: 10.1016/S0269-7491(02)00170-7. [PubMed] [CrossRef] [Google Scholar]
2. Китаока С., Накано Ю., Миятаке К., Йокота А. Ферменты и их функциональное расположение. В: Buetow D.E., изд. Биология Эвглены. Том 4. Academic Press Limited; Лондон, Великобритания: 1989. стр. 2–119. [Google Scholar]
стр. 2–119. [Google Scholar]
3. Уолкен Дж.Дж. Эвглена: экспериментальный организм для биохимических и биофизических исследований. Институт микробиологии, Рутгерс; Нью-Брансуик, Нью-Джерси, США: 1961. с. 173. [Google Scholar]
4. Сато С. Апикомплексановая пластида и ее эволюция. Клетка. Мол. Жизнь наук. 2011;68:1285–1296. doi: 10.1007/s00018-011-0646-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
5. Эбенезер Т.Е., Золтнер М., Баррелл А., Ненарокова А., Новак Ванклова А.М.Г., Прасад Б., Соукал П., Сантана-Молина С. ., O’Neill E., Nankissoor N.N., et al. Транскриптом, протеом и проект генома Эвглена тонкая . БМС Биол. 2019;17:11.:11. doi: 10.1186/s12915-019-0626-8. [PMC бесплатная статья] [PubMed] [CrossRef] [Google Scholar]
6. Linton E.W., Karnkowska-Ishikawa A., Kim J.I., Shin W., Bennett M.S., Kwiatowski J., Zakryś B., Triemer R.E. Реконструкция эволюционных взаимоотношений эвгленоидов с использованием трех генов: ядерных SSU и LSU и последовательностей рДНК SSU хлоропластов и описания Euglenaria gen. ноябрь (Euglenophyta) Протист. 2010; 161: 603–619. doi: 10.1016/j.protis.2010.02.002. [PubMed] [CrossRef] [Академия Google]
ноябрь (Euglenophyta) Протист. 2010; 161: 603–619. doi: 10.1016/j.protis.2010.02.002. [PubMed] [CrossRef] [Академия Google]
7. Ахмадинежад Н., Даган Т., Мартин В. История генома симбиотического гибрида Euglena gracilis . Ген. 2007; 402:35–39. doi: 10.1016/j.gene.2007.07.023. [PubMed] [CrossRef] [Google Scholar]
8. Parfrey L.W., Lahr D.J.G., Knoll AH, Katz L.A. Оценка времени ранней эукариотической диверсификации с помощью мультигенных молекулярных часов. проц. Натл. акад. науч. США. 2011;108:13624–13629. doi: 10.1073/pnas.1110633108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Маруяма С., Сузаки Т., Вебер А.П., Арчибальд Дж.М., Нодзаки Х. Перенос генов от эукариот к эукариотам приводит к мозаицизму генома у эвгленид. БМС Эвол. биол. 2011;11:105. дои: 10.1186/1471-2148-11-105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Martin W., Somerville C.C., Loiseaux-de Goer S. Молекулярная филогения пластидного происхождения и эволюции водорослей. Дж. Мол. Эвол. 1992; 35: 385–404. doi: 10.1007/BF00171817. [CrossRef] [Google Scholar]
Дж. Мол. Эвол. 1992; 35: 385–404. doi: 10.1007/BF00171817. [CrossRef] [Google Scholar]
11. O’Neill E.C., Trick M., Henrissat B., Field R.A. Эвглена во времени: Эволюция, контроль центральных метаболических процессов и многодоменных белков в биохимии углеводов и натуральных продуктов. Перспектива наук. 2015; 6: 84–93. doi: 10.1016/j.pisc.2015.07.002. [CrossRef] [Google Scholar]
12. Gissibl A., Sun A., Care A., Nevalainen H., Sunna A. Биопродукты из Euglena gracilis : Синтез и применение. Фронт. биоинж. Биотехнолог. 2019;7:108. doi: 10.3389/fbioe.2019.00108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Махапатра Д.М., Чанакья Х.Н., Рамачандра Т.В. Euglena sp. в качестве подходящего источника липидов для потенциального использования в качестве биотоплива и устойчивой очистки сточных вод. Дж. Заявл. Фикол. 2013; 25:855–865. doi: 10.1007/s10811-013-9979-5. [CrossRef] [Google Scholar]
14. Крюгер Н.Дж., Рэтклифф Р. Г. Потоки через метаболические сети растений: измерения, прогнозы, идеи и проблемы. Биохим. Дж. 2015; 465: 27–38. doi: 10.1042/BJ20140984. [PubMed] [CrossRef] [Академия Google]
Г. Потоки через метаболические сети растений: измерения, прогнозы, идеи и проблемы. Биохим. Дж. 2015; 465: 27–38. doi: 10.1042/BJ20140984. [PubMed] [CrossRef] [Академия Google]
15. Jackson C., Knoll A.H., Chan C.X., Verbruggen H. Филогеномика пластид с широкой выборкой таксонов дополнительно проясняет различное эволюционное происхождение и время появления вторичных зеленых пластид. науч. Отчет 2018; 8:1523. doi: 10.1038/s41598-017-18805-w. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. O’Neill E.C., Trick M., Hill L., Rejzek M., Dusi R.G., Hamilton C.J., Zimba P.V., Henrissat B., Field Р.А. Транскриптом Euglena gracilis обнаруживает неожиданные метаболические способности в биохимии углеводов и натуральных продуктов. Мол. Биосис. 2015;11:2808–2820. дои: 10.1039/C5MB00319A. [PubMed] [CrossRef] [Google Scholar]
17. Йошида Ю., Томияма Т., Марута Т., Томита М., Исикава Т., Аракава К. Сборка de novo и сравнительный анализ транскриптома Euglena gracilis в реакция на анаэробные условия. БМС Геном. 2016;17:182. doi: 10.1186/s12864-016-2540-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
БМС Геном. 2016;17:182. doi: 10.1186/s12864-016-2540-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. O’Neill E.C., Saalbach G., Field R.A. Глава пятая — открытие генов для синтетической биологии: изучение новых возможностей биосинтеза натуральных продуктов эукариотических микроводорослей. Методы Энзимол. 2016;576:99–120. [PubMed] [Google Scholar]
19. Prigent S., Frioux C., Dittami S.M., Thiele S., Larhlimi A., Collet G., Gutknecht F., Got J., Eveillard D., Bourdon J., и другие. Meneco, инструмент для заполнения пробелов на основе топологии, применимый к деградировавшим метаболическим сетям всего генома. PLoS-компьютер. биол. 2017;13:e1005276. doi: 10.1371/journal.pcbi.1005276. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Халлик Р.Б., Хонг Л., Драгер Р.Г., Фавро М.Р., Монфор А., Орсат Б., Шпильманн А., Штутц Э. Полная последовательность Euglena gracilis ДНК хлоропластов. Нуклеиновые Кислоты Res. 1993; 21:3537–3544. doi: 10.1093/нар/21.15.3537. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1093/нар/21.15.3537. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Turmel M., Gagnon M.-C., O’Kelly C.J., Otis C., Lemieux C. Геномы хлоропластов зеленых водорослей Pyramimonas , Monomastix и Pycnococcus проливают новый свет на эволюционную историю празинофитов и происхождение вторичных хлоропластов эвгленид. Мол. биол. Эвол. 2009 г.;26:631–648. doi: 10.1093/molbev/msn285. [PubMed] [CrossRef] [Google Scholar]
22. Martin W., Herrmann R.G. Перенос генов из органелл в ядро: сколько, что происходит и почему? Завод Физиол. 1998; 118:9–17. doi: 10.1104/стр.118.1.9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
23. Геймер С., Беликова А., Леген Дж., Славикова С., Херрманн Р.Г., Крайчович Дж. Транскриптомный анализ пластиды Euglena gracilis хромосома. Курс. Жене. 2009 г.;55:425–438. doi: 10.1007/s00294-009-0256-8. [PubMed] [CrossRef] [Google Scholar]
24. Миллер М.Э., Юргенсон Дж.Э., Рирдон Э. М., Прайс К.А. Трансляция пластид в органелло и in vitro во время индуцированного светом развития у Euglena . Дж. Биол. хим. 1983; 258:14478–14484. [PubMed] [Google Scholar]
М., Прайс К.А. Трансляция пластид в органелло и in vitro во время индуцированного светом развития у Euglena . Дж. Биол. хим. 1983; 258:14478–14484. [PubMed] [Google Scholar]
25. Бахварофф Т.Р., Санчес Пуэрта М.В., Делвич К.Ф. Отношения пластид, содержащих хлорофилл с, основаны на анализе набора мультигенных данных со всеми четырьмя линиями хромальвеолатов. Мол. биол. Эвол. 2005; 22:1772–1782. дои: 10.1093/молбев/msi172. [PubMed] [CrossRef] [Google Scholar]
26. Юн Х.С., Хакетт Дж.Д., Бхаттачарья Д. Единое происхождение пластид, содержащих перидинин и фукоксантин, у динофлагеллят посредством третичного эндосимбиоза. проц. Натл. акад. науч. США. 2002;99:11724. doi: 10.1073/pnas.172234799. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Bolte K., Bullmann L., Hempel F., Bozarth A., Zauner S., Maier U.-G. Направление белков во вторичные пластиды. Дж. Эукариот. микробиол. 2009 г.;56:9–15. doi: 10.1111/j.1550-7408.2008.00370.x. [PubMed] [CrossRef] [Google Scholar]
28. Horton P., Park K.-J., Obayashi T., Fujita N., Harada H., Adams-Collier C.J., Nakai K. WoLF PSORT: локализация белка предсказатель. Нуклеиновые Кислоты Res. 2007; 35:W585–W587. doi: 10.1093/nar/gkm259. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Horton P., Park K.-J., Obayashi T., Fujita N., Harada H., Adams-Collier C.J., Nakai K. WoLF PSORT: локализация белка предсказатель. Нуклеиновые Кислоты Res. 2007; 35:W585–W587. doi: 10.1093/nar/gkm259. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
29. Эмануэльссон О., Брунак С., фон Хейне Г., Нильсен Х. Поиск белков в клетке с использованием TargetP, SignalP и связанных инструментов. Нац. протокол 2007; 2:953–971. doi: 10.1038/nprot.2007.131. [PubMed] [CrossRef] [Google Scholar]
30. Новак Ванцлова А.М.Г., Золтнер М., Келли С., Соукал П., Захонова К., Фюсси З., Эбенезер Т.Е., Лакова Добакова Е., Элиаш М., Лукеш Дж. и др. Протеом вторичной пластиды Euglena gracilis раскрывает метаболические причуды и красочную историю. bioRxiv. 2019: 573709. дои: 10.1101/573709. [CrossRef] [Google Scholar]
31. Durnford D.G., Gray M.W. Анализ белков-мишеней для пластид Euglena gracilis выявил различные классы транзитных последовательностей. Эукариот. Клетка. 2006;5:2079–2091. doi: 10.1128/EC.00222-06. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2006;5:2079–2091. doi: 10.1128/EC.00222-06. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Эмануэльссон О., Нильсен Х., Брунак С., фон Хейне Г. Предсказание субклеточной локализации белков на основе их n-концевой аминокислотной последовательности. Дж. Мол. биол. 2000; 300:1005–1016. doi: 10.1006/jmbi.2000.3903. [PubMed] [CrossRef] [Google Scholar]
33. Гиббс С.П. Хлоропласты Euglena , возможно, произошли от симбиотических зеленых водорослей. Можно. Дж. Бот. 1978; 56: 2883–2889. дои: 10.1139/b78-345. [CrossRef] [Google Scholar]
34. Захонова К., Фюсси З., Бирчак Э., Новак Ванцлова А.М.Г., Климеш В., Вестег М., Крайчович Ю., Оборник М., Элиаш М. Особенности пластиды бесцветной водоросли Euglena longa и фотосинтезирующих эвгленофитов, обнаруженных с помощью транскриптомного анализа. науч. Отчет 2018; 8:17012. doi: 10.1038/s41598-018-35389-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Славикова С. , Вакула Р., Фанг З., Эхара Т., Осафунэ Т., Шварцбах С.Д. Гомологичная и гетерологичная реконструкция Гольджи для транспорта хлоропластов и импорта белка в сложные хлоропласты Эвглена . Дж. Клеточные науки. 2005; 118:1651–1661. doi: 10.1242/jcs.02277. [PubMed] [CrossRef] [Google Scholar]
, Вакула Р., Фанг З., Эхара Т., Осафунэ Т., Шварцбах С.Д. Гомологичная и гетерологичная реконструкция Гольджи для транспорта хлоропластов и импорта белка в сложные хлоропласты Эвглена . Дж. Клеточные науки. 2005; 118:1651–1661. doi: 10.1242/jcs.02277. [PubMed] [CrossRef] [Google Scholar]
36. Maier U.G., Zauner S., Hempel F. Импорт белков в сложные пластиды: клеточная организация повышенной сложности. Евро. Дж. Клеточная биология. 2015;94:340–348. doi: 10.1016/j.ejcb.2015.05.008. [PubMed] [CrossRef] [Google Scholar]
37. Смайли Р.М. Образование и функция растворимых белков в глоропластах. Можно. Дж. Бот. 1963; 41: 123–154. дои: 10.1139/b63-011. [Перекрестная ссылка] [Академия Google]
38. Бегин-Хейк Н. Локализация ферментов промежуточного метаболизма в Astasia и Euglena . Биохим. Дж. 1973; 134:607. doi: 10.1042/bj1340607. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Докерти А., Мерретт М. Дж. Выделение и ферментативная характеристика пропластидов Euglena . Завод Физиол. 1979; 63: 468–473. doi: 10.1104/стр.63.3.468. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Завод Физиол. 1979; 63: 468–473. doi: 10.1104/стр.63.3.468. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
40. Graves J.R., Lynn B. Влияние различных субстратов на поглощение глюкозы и активность гексокиназы в Эвглена тонкая . Дж. Протозол. 1971; 18: 543–546. doi: 10.1111/j.1550-7408.1971.tb03369.x. [PubMed] [CrossRef] [Google Scholar]
41. Bäumer D., Preisfeld A., Ruppel H.G. Выделение и характеристика парамилонсинтазы из Euglena gracilis (euglenophyceae) J. Phycol. 2001; 37: 38–46. doi: 10.1046/j.1529-8817.2001.037001038.x. [CrossRef] [Google Scholar]
42. Lucchini G. Контроль фосфорилирования глюкозы в Euglena gracilis I. Частичная характеристика глюкокиназы. Биохим. Биофиз. Акта. 1971;242:365–370. doi: 10.1016/0005-2744(71)-2. [PubMed] [CrossRef] [Google Scholar]
43. Бегин-Хейк Н. Кислородная токсичность и углеродная депривация у Astasia longa . Можно. Дж. Биохим. 1970; 48: 251–258. doi: 10. 1139/o70-045. [PubMed] [CrossRef] [Google Scholar]
1139/o70-045. [PubMed] [CrossRef] [Google Scholar]
44. Miyatake K., Enomoto T., Kitaoka S. Обнаружение и субклеточное распределение пирофосфата: D-фруктозо-6-фосфатфосфотрансфераза (PFP) в Euglena gracilis . Агр. биол. хим. 1984; 48: 2857–2859.. doi: 10.1271/bbb1961.48.2857. [CrossRef] [Google Scholar]
45. Уиллард Дж. М., Гиббс М. Очистка и характеристика фруктозодифосфатальдолазы из Anacystis is nidulans и Saprospira Thermalis . Биохим. Биофиз. Акта. 1968; 151: 438–448. doi: 10.1016/0005-2744(68)-5. [PubMed] [CrossRef] [Google Scholar]
46. Mo Y., Harris B.G., Gracy R.W. Триозофосфатизомеразы и альдолазы из выращенных на свету и в темноте Euglena gracilis . Арка Биохим. Биофиз. 1973; 157: 580–587. doi: 10.1016/0003-9861(73)-2. [PubMed] [CrossRef] [Google Scholar]
47. Лацко Э., Гиббс М. Ферментативная активность цикла восстановления углерода у некоторых фотосинтезирующих организмов. Завод Физиол. 1969;44:295. doi: 10.1104/стр.44.2.295. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1104/стр.44.2.295. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Grissom F.E., Kahn J.S. Глицеральдегид-3-фосфатдегидрогеназы из Euglena gracilis : очистка и физико-химическая характеристика. Арка Биохим. Биофиз. 1975;171:444–458. doi: 10.1016/0003-9861(75)
-3. [PubMed] [CrossRef] [Google Scholar]49. Bukowiecki A.C., Anderson L.E. Множественные формы альдолазы и триозофосфатизомеразы у различных видов растений. Растениевод. лат. 1974; 3: 381–386. doi: 10.1016/0304-4211(74)
-4. [CrossRef] [Google Scholar]50. Forsee W.T., Kahn J.S. Фиксация углекислого газа изолированными хлоропластами Euglena gracilis : I. Выделение функционально интактных хлоропластов и их характеристика. Арка Биохим. Биофиз. 1972;150:296–301. doi: 10.1016/0003-9861(72)
-0. [PubMed] [CrossRef] [Google Scholar]
51. Аммон Р., Фридрих Г. Поведение ферментов в Euglena gracilis . Акта Биол. Мед. нем. 1967; 19: 659–672. [PubMed] [Google Scholar]
52. Hannaert V., Brinkmann H., Nowitzki U., Lee J.A., Albert M.-A., Sensen C.W., Gaasterland T., Miklós M., Michels P., Martin W. Энолаза из Trypanosoma brucei , из амитохондриального простейшего Mastigamoeba balamuthi , а также из хлоропласта и цитозоля Euglena gracilis : кусочки эволюционной головоломки эукариотического гликолитического пути. Мол. биол. Эвол. 2000;17:989–1000. doi: 10.1093/oxfordjournals.molbev.a026395. [PubMed] [CrossRef] [Google Scholar]
Hannaert V., Brinkmann H., Nowitzki U., Lee J.A., Albert M.-A., Sensen C.W., Gaasterland T., Miklós M., Michels P., Martin W. Энолаза из Trypanosoma brucei , из амитохондриального простейшего Mastigamoeba balamuthi , а также из хлоропласта и цитозоля Euglena gracilis : кусочки эволюционной головоломки эукариотического гликолитического пути. Мол. биол. Эвол. 2000;17:989–1000. doi: 10.1093/oxfordjournals.molbev.a026395. [PubMed] [CrossRef] [Google Scholar]
53. Ohmann E. Регуляция пируват-киназы в Euglena gracilis . Арка микробиол. 1969; 67: 273–292. doi: 10.1007/BF00411262. [PubMed] [CrossRef] [Google Scholar]
54. Огава Т., Кимура А., Сакуяма Х., Тамой М., Исикава Т., Шигеока С. Идентификация и характеристика цитозольной фруктозо-1,6-бисфосфатазы в Эвглена тонкая . Бионауч. Биотехнолог. Биохим. 2015; 79:1957–1964. doi: 10.1080/09168451.2015.1069694. [PubMed] [CrossRef] [Google Scholar]
55. Ховенкамп-Оббема Р. Влияние хлорамфеникола на развитие пропластид у Euglena gracilis : II. Синтез каротиноидов. Z. Pflanzenphysiol. 1974; 73: 439–447. doi: 10.1016/S0044-328X(74)80113-3. [CrossRef] [Google Scholar]
Влияние хлорамфеникола на развитие пропластид у Euglena gracilis : II. Синтез каротиноидов. Z. Pflanzenphysiol. 1974; 73: 439–447. doi: 10.1016/S0044-328X(74)80113-3. [CrossRef] [Google Scholar]
56. Кемпнер Э.С., Миллер Дж.Х. Молекулярная биология Euglena gracilis : IV. Стратификация клеток центрифугированием. Эксп. Сотовый рез. 1968; 51: 141–149. doi: 10.1016/0014-4827(68)
-X. [PubMed] [CrossRef] [Google Scholar]
57. Ohmann E., Rindt K.P., Borriss R. Глюкозо-6-фосфат-дегидрогеназа в аутотрофных микроорганизмах i. Регуляция синтеза глюкозо-6-фосфатдегидрогеназы в Euglena gracilis и Rhodopseudomonas spheroides в культуре. З. Аллг. микробиол. 1969; 9: 557–564. doi: 10.1002/jobm.36300
. [PubMed] [CrossRef] [Google Scholar] 58. Hovenkamp-Obbema R., Moorman A., Stegwee D. Аминолаевулинатдегидратаза в зеленеющих клетках Euglena gracilis . Z. Pflanzenphysiol. 1974; 72: 277–286. doi: 10.1016/S0044-328X(74)80069-3. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
59. Forsee W.T., Kahn J.S. Фиксация углекислого газа изолированными хлоропластами Euglena gracilis : II. Ингибирование фиксации CO 2 с помощью AMP. Арка Биохим. Биофиз. 1972; 150: 302–309.. doi: 10.1016/0003-9861(72)-2. [PubMed] [CrossRef] [Google Scholar]
60. Ma YAN, Jakowitsch J., Deusch O., Henze K., Martin W., Löffelhardt W. Транскетолаза из Cyanophora paradoxa : импорт in vitro в цианеллы и горох хлоропласты и сложная история гена часто, но не всегда, переносятся в контексте вторичного эндосимбиоза. Дж. Эукариот. микробиол. 2009; 56: 568–576. doi: 10.1111/j.1550-7408.2009.00437.x. [PubMed] [CrossRef] [Академия Google]
61. Stern J.R., Hegre C.S. Индуцибельный D-яблочный фермент в Escherichia coli . Природа. 1966; 212:1611. doi: 10.1038/2121611a0. [PubMed] [CrossRef] [Google Scholar]
62. Пик М.Дж., Пик Дж.Г., Тинг И.П. Изоферменты малатдегидрогеназы и их регуляция у Euglena gracilis Z. Biochim. Биофиз. Акта. 1972; 284:1–15. doi: 10.1016/0005-2744(72)-3. [PubMed] [CrossRef] [Google Scholar]
Biochim. Биофиз. Акта. 1972; 284:1–15. doi: 10.1016/0005-2744(72)-3. [PubMed] [CrossRef] [Google Scholar]
63. Пик М.Дж., Пик Дж.Г., Тинг И.П. Индуцированное светом снижение удельной активности фермента малата в Euglena gracilis Z. Biochem. Биофиз. Рез. коммун. 1972; 48: 1074–1078. doi: 10.1016/0006-291X(72)
-2. [PubMed] [CrossRef] [Google Scholar]
64. Кодд Г. А., Мерретт М. Дж. Регуляция метаболизма гликолята в синхронизированных по делению культурах Euglena . Завод Физиол. 1971; 47: 640–643. doi: 10.1104/стр.47.5.640. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
65. Laval-Martin D., Farineau J., Pineau B., Calvayrac R. Эволюция ферментов, участвующих в углеродном обмене (фосфоенолпируват и рибулозо-бисфосфаткарбоксилазы). , фосфоенолпируваткарбоксикиназа) во время индуцированного светом позеленения Euglena gracilis штаммы Z и ZR. Планта. 1981; 151: 157–167. doi: 10.1007/BF00387818. [PubMed] [CrossRef] [Google Scholar]
66. Briand J., Calvayrac R., Laval-Martin D., Farineau J. Эволюция карбоксилирующих ферментов, участвующих в синтезе парамилона (фосфоенолпируваткарбоксилаза и карбоксикиназа) в гетеротрофно выращенном Euglena грацилис . Планта. 1981; 151: 168–175. doi: 10.1007/BF00387819. [PubMed] [CrossRef] [Google Scholar]
Briand J., Calvayrac R., Laval-Martin D., Farineau J. Эволюция карбоксилирующих ферментов, участвующих в синтезе парамилона (фосфоенолпируваткарбоксилаза и карбоксикиназа) в гетеротрофно выращенном Euglena грацилис . Планта. 1981; 151: 168–175. doi: 10.1007/BF00387819. [PubMed] [CrossRef] [Google Scholar]
67. Ohmann E., Plhák F. Reinigung und eigenschaften von phoenolpyruvat-carboxylase aus Эвглена тонкая . Евро. Дж. Биохим. 1969; 10: 43–55. doi: 10.1111/j.1432-1033.1969.tb00653.x. [PubMed] [CrossRef] [Google Scholar]
68. Miyatake K., Ito T., Kitaoka S. Субклеточное расположение и некоторые свойства фосфоенолпируваткарбоксикиназы (PEPCK) в Euglena gracilis . Агр. биол. хим. 1984; 48: 2139–2141. doi: 10.1271/bbb1961.48.2139. [CrossRef] [Google Scholar]
69. Yokota A., Hosotani K., Kitaoka S. Механизм регуляции метаболизма при фотоассимиляции пропионата в Euglena gracilis z. Арка Биохим. Биофиз. 1982; 213: 530–537. doi: 10. 1016/0003-9861(82)-X. [PubMed] [CrossRef] [Google Scholar]
1016/0003-9861(82)-X. [PubMed] [CrossRef] [Google Scholar]
70. Наказава М., Хаяси Р., Такенака С., Инуи Х., Исикава Т., Уэда М., Сакамото Т., Накано Ю., Миятакэ К. Физиологические функции пируват:НАДФ+ оксидоредуктазы и 2-оксоглутаратдекарбоксилазы в Euglena gracilis в аэробных и анаэробных условиях. Бионауч. Биотехнолог. Биохим. 2017; 81: 1386–1393. дои: 10.1080/09168451.2017.1318696. [PubMed] [CrossRef] [Google Scholar]
71. Инуи Х., Оно К., Миятаке К., Накано Ю., Китаока С. Очистка и характеристика пирувата: НАДФ + оксидоредуктазы в Euglena gracilis . Дж. Биол. хим. 1987; 262:9130–9135. [PubMed] [Google Scholar]
72. Rotte C., Stejskal F., Zhu G., Keithly J.S., Martin W. Пируват:НАДФ-оксидоредуктаза из митохондрии Euglena gracilis и из апикомплексана Cryptosporidium parvum : Биохимический реликт, связывающий метаболизм пирувата у митохондриальных и амитохондриальных простейших. Мол. биол. Эвол. 2001; 18: 710–720. doi: 10.1093/oxfordjournals.molbev.a003853. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1093/oxfordjournals.molbev.a003853. [PubMed] [CrossRef] [Google Scholar]
73. Hoffmeister M., van der Klei A., Rotte C., van Grinsven K.W.A., van Hellemond J.J., Henze K., Tielens A.G.M., Martin W. Euglena gracilis Соотношение родохинон:убихинон и митохондриальный протеом различаются в аэробных и анаэробных условиях. Дж. Биол. хим. 2004;279: 22422–22429. doi: 10.1074/jbc.M4000. [PubMed] [CrossRef] [Google Scholar]
74. Collins N., Merrett M.J. Ферменты-маркеры микротел при переходе от фототрофного к органотрофному росту у Euglena . Завод Физиол. 1975; 55: 1018–1022. doi: 10.1104/стр.55.6.1018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Graves L.B., Jr., Trelease R.N., Grill A., Becker W.M. Локализация ферментов глиоксилатного цикла в глиоксисомах Euglena . Дж. Протозол. 1972;19:527–532. doi: 10.1111/j.1550-7408.1972.tb03521.x. [PubMed] [CrossRef] [Google Scholar]
76. Кук Дж. Р., Карвер М. Частичная фоторепрессия глиоксилатного обхода в Euglena . Физиология клеток растений. 1966; 7: 377–383. [Google Scholar]
Частичная фоторепрессия глиоксилатного обхода в Euglena . Физиология клеток растений. 1966; 7: 377–383. [Google Scholar]
77. Кук Дж. Р., Генрих Б. Несбалансированный респираторный рост Euglena . Микробиология. 1968; 53: 237–251. doi: 10.1099/00221287-53-2-237. [PubMed] [CrossRef] [Google Scholar]
78. Collins N., Merrett M.J. Локализация ферментов гликолатного пути в Эвглена . Биохим. Дж. 1975; 148: 321–328. doi: 10.1042/bj1480321. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
79. Oda Y., Miyatake K., Nakano Y., Kitaoka S. Субклеточное расположение и некоторые свойства изоферментов изоцитратдегидрогеназы в Euglena gracilis . Агр. биол. хим. 1981; 45: 2619–2621. doi: 10.1271/bbb1961.45.2619. [CrossRef] [Google Scholar]
80. Shigeoka S., Onishi T., Maeda K., Nakano Y., Kitaoka S. Возникновение тиаминпирофосфат-зависимой 2-оксоглутаратдекарбоксилазы в митохондриях Эвглена тонкая . ФЭБС лат. 1986; 195:43–47. doi: 10.1016/0014-5793(86)80126-0. [CrossRef] [Google Scholar]
doi: 10.1016/0014-5793(86)80126-0. [CrossRef] [Google Scholar]
81. Shigeoka S., Nakano Y. Характеристика и молекулярные свойства 2-оксоглутаратдекарбоксилазы из Euglena gracilis . Арка Биохим. Биофиз. 1991; 288: 22–28. doi: 10.1016/0003-9861(91)
-K. [PubMed] [CrossRef] [Google Scholar]
82. Токунага М., Накано Ю., Китаока С. Разделение и свойства НАД-связанных и НАДФ-связанных изоферментов янтарно-полуальдегиддегидрогеназы в Эвглена тонкая . Биохим. Биофиз. Акта. 1976; 429: 55–62. doi: 10.1016/0005-2744(76)
-2. [PubMed] [CrossRef] [Google Scholar]83. Барри Д., Мерретт М.Дж. Изоферменты малатдегидрогеназы в культурах, синхронизированных делением Euglena . Завод Физиол. 1973; 51: 1127–1132. [PMC free article] [PubMed] [Google Scholar]
84. Isegawa Y., Nakano Y., Kitaoka S. Субмитохондриальное расположение и некоторые свойства NAD + — и NADP + -связанной малатдегидрогеназы в Эвглена . Агр. биол. хим. 1984; 48: 549–552. doi: 10.1271/bbb1961.48.549. [CrossRef] [Google Scholar]
Агр. биол. хим. 1984; 48: 549–552. doi: 10.1271/bbb1961.48.549. [CrossRef] [Google Scholar]
85. Миятаке К., Васио К., Йокота А., Накано Ю., Китаока С. Наличие двух NAD + -связанных изоферментов малатдегидрогеназы в Euglena gracilis . Агр. биол. хим. 1985; 49: 859–860. doi: 10.1271/bbb1961.49.859. [CrossRef] [Google Scholar]
86. Nakazawa M. Метаболизм С2 у эвглены . Доп. Эксп. Мед. биол. 2017; 979: 39–45. [PubMed] [Академия Google]
87. Грейвс Л.Б., Ханзели Л., Тререлиз Р.Н. Возникновение и тонкая структурная характеристика микротел у Euglena gracilis . Протоплазма. 1971; 72: 141–152. doi: 10.1007/BF01279047. [PubMed] [CrossRef] [Google Scholar]
88. Оно К., Кондо М., Осафунэ Т., Миятакэ К., Инуи Х., Китаока С., Нисимура М., Накано Ю. Наличие ферментов глиоксилатного цикла в митохондриях Euglena gracilis . Дж. Эукариот. микробиол. 2003; 50:92–96. doi: 10.1111/j.1550-7408.2003.tb00239.Икс. [PubMed] [CrossRef] [Google Scholar]
89. РодриГез-Завала Дж. С., Ортис-Крус М. А., Морено-Санчес Р. Характеристика альдегиддегидрогеназы из Euglena gracilis . Дж. Эукариот. микробиол. 2006; 53:36–42. doi: 10.1111/j.1550-7408.2005.00070.x. [PubMed] [CrossRef] [Google Scholar]
РодриГез-Завала Дж. С., Ортис-Крус М. А., Морено-Санчес Р. Характеристика альдегиддегидрогеназы из Euglena gracilis . Дж. Эукариот. микробиол. 2006; 53:36–42. doi: 10.1111/j.1550-7408.2005.00070.x. [PubMed] [CrossRef] [Google Scholar]
90. Йоваль-Санчес Б., Яссо-Чавес Р., Лира-Сильва Э., Морено-Санчес Р., Родригес-Завала Х.С. Новые ферменты метаболизма митохондриального спирта Euglena gracilis . Дж. Биоэнергия. биомембрана 2011;43:519–530. doi: 10.1007/s10863-011-9373-4. [PubMed] [CrossRef] [Google Scholar]
91. Ono K., Kawanaka Y., Izumi Y., Inui H., Miyatake K., Kitaoka S., Nakano Y. Митохондриальная алкогольдегидрогеназа из выращенного на этаноле Euglena грацилис . Дж. Биохим. 1995; 117:1178–1182. doi: 10.1093/oxfordjournals.jbchem.a124841. [PubMed] [CrossRef] [Google Scholar]
92. Graves L.B., Jr., Becker W.M. Бета-окисление в глиоксисомах Euglena . Дж. Протозол. 1974; 21: 771–774. дои: 10.1111/j.1550-7408.1974.tb03750. х. [PubMed] [CrossRef] [Google Scholar]
х. [PubMed] [CrossRef] [Google Scholar]
93. Туччи С., Вакула Р., Крайкович Дж., Прокш П., Мартин В. Изменчивость ферментации воскового эфира в натуральных и обесцвеченных штаммах Euglena gracilis в ответ на кислород и ингибитор элонгазы флуфенацет. Дж. Эукариот. микробиол. 2010;57:63–69. doi: 10.1111/j.1550-7408.2009.00452.x. [PubMed] [CrossRef] [Google Scholar]
94. Grimm P., Risse J.M., Cholewa D., Müller J.M., Beshay U., Friehs K., Flaschel E. Применимость Euglena gracilis для биоперерабатывающих заводов продемонстрировал производство α-токоферола и парамилона с последующим анаэробным сбраживанием. Дж. Биотехнология. 2015; 215:72–79. doi: 10.1016/j.jbiotec.2015.04.004. [PubMed] [CrossRef] [Google Scholar]
95. O’Neill E.C., Kuhaudomlarp S., Rejzek M., Fangel J.U., Alagesan K., Kolarich D., Willats W.G.T., Field R.A. Изучение гликанов Euglena gracilis . Биология. 2017;6:45. doi: 10.3390/biology6040045. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
96. Марешал Л.Р., Гольдемберг С.Х. Ламинарибиозофосфорилаза из Euglena gracilis . Биохим. Биофиз. Рез. коммун. 1963; 13: 106–107. doi: 10.1016/0006-291X(63)-4. [CrossRef] [Google Scholar]
Марешал Л.Р., Гольдемберг С.Х. Ламинарибиозофосфорилаза из Euglena gracilis . Биохим. Биофиз. Рез. коммун. 1963; 13: 106–107. doi: 10.1016/0006-291X(63)-4. [CrossRef] [Google Scholar]
97. Томос А.Д., Норткот Д.Х. Белково-глюкановый промежуточный продукт в процессе синтеза парамилона. Биохим. Дж. 1978; 174: 283–290. doi: 10.1042/bj1740283. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
98. Tanaka Y., Ogawa T., Maruta T., Yoshida Y., Arakawa K., Ishikawa T. Glucan synthase-like 2 незаменим для синтез парамилона в Эвглена тонкая . ФЭБС лат. 2017; 591:1360–1370. дои: 10.1002/1873-3468.12659. [PubMed] [CrossRef] [Google Scholar]
99. Calvayrac R., Laval-Martin D., Briand J., Farineau J. Синтез Paramylon с помощью Euglena gracilis , выращенных фотогетеротрофно при низком давлении O 2 . Планта. 1981; 153:6–13. doi: 10.1007/BF00385311. [PubMed] [CrossRef] [Google Scholar]
100. Briand J., Calvayrac R. Синтез парамилона у гетеротрофных и фотогетеротрофных Euglena (Euglenophyceae) J. Phycol. 1980; 16: 234–239. doi: 10.1111/j.1529-8817.1980.tb03024.x. [CrossRef] [Google Scholar]
Phycol. 1980; 16: 234–239. doi: 10.1111/j.1529-8817.1980.tb03024.x. [CrossRef] [Google Scholar]
101. Такэда Т., Накано Ю., Такахаши М., Конно Н., Сакамото Ю., Арашида Р., Марукава Ю., Йошида Э., Исикава Т., Судзуки К. Идентификация и ферментативная характеристика эндо-1,3-β-глюканазы из Euglena gracilis . Фитохимия. 2015;116:21–27. doi: 10.1016/j.phytochem.2015.05.010. [PubMed] [CrossRef] [Google Scholar]
102. Баррас Д.Р., Стоун Б.А. β-1,3-глюкангидролазы из Euglena gracilis : II. Очистка и свойства экзогидролазы β-1,3-глюкана. Биохим. Биофиз. Акта. 1969; 191: 342–353. doi: 10.1016/0005-2744(69)
-8. [PubMed] [CrossRef] [Google Scholar]103. Kuhaudomlarp S., Patron N.J., Henrissat B., Rejzek M., Saalbach G., Field R.A. Идентификация Euglena gracilis β-1,3-глюканфосфорилазы и создание нового семейства гликозидгидролаз (GH) Gh249. Дж. Биол. хим. 2018; 293:2865–2876. doi: 10.1074/jbc.RA117.000936. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
104. Такенака С., Кондо Т., Назери С., Тамура Ю., Токунага М., Цуяма С., Миятаке К., Накано Y. Накопление трегалозы в качестве совместимого растворенного вещества при осмотическом стрессе в Euglena gracilis Z. J. Eukaryot. микробиол. 1997; 44: 609–613. doi: 10.1111/j.1550-7408.1997.tb05967.x. [CrossRef] [Google Scholar]
Такенака С., Кондо Т., Назери С., Тамура Ю., Токунага М., Цуяма С., Миятаке К., Накано Y. Накопление трегалозы в качестве совместимого растворенного вещества при осмотическом стрессе в Euglena gracilis Z. J. Eukaryot. микробиол. 1997; 44: 609–613. doi: 10.1111/j.1550-7408.1997.tb05967.x. [CrossRef] [Google Scholar]
105. Поркья А.С., Фиол Д.Ф., Салерно Г.Л. Дифференциальный синтез сахарозы и трегалозы в клетках Euglena gracilis при росте и солевом стрессе. Растениевод. 1999;149:43–49. doi: 10.1016/S0168-9452(99)00142-9. [CrossRef] [Google Scholar]
106. Фиол Д.Ф., Салерно Г.Л. Синтез трегалозы у Euglena gracilis (euglenophyceae) происходит через ферментный комплекс. Дж. Фикол. 2005; 41:812–818. doi: 10.1111/j.1529-8817.2005.00098.x. [CrossRef] [Google Scholar]
107. Schluepmann H., Paul M. Метаболиты трегалозы в арабидопсисе — неуловимые, активные и центральные. Книга Арабидопсис. 2009;7:e0122. doi: 10.1199/таб.0122. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
108. Vandesteene L., Ramon M., Le Roy K., Van Dijck P., Rolland F. Единственная активная трегалозо-6-p-синтаза (TPS) и семейство предполагаемых регуляторных TPS-подобных белков в Arabidopsis. . Мол. Завод. 2010;3:406–419. doi: 10.1093/mp/ssp114. [PubMed] [CrossRef] [Google Scholar]
Vandesteene L., Ramon M., Le Roy K., Van Dijck P., Rolland F. Единственная активная трегалозо-6-p-синтаза (TPS) и семейство предполагаемых регуляторных TPS-подобных белков в Arabidopsis. . Мол. Завод. 2010;3:406–419. doi: 10.1093/mp/ssp114. [PubMed] [CrossRef] [Google Scholar]
109. Мюррей Д.Р., Джованелли Дж., Смилли Р.М. Фотоассимиляция гликолята, глицина и серина Euglena gracilis . Дж. Протозол. 1970; 17: 99–104. doi: 10.1111/j.1550-7408.1970.tb05165.x. [Перекрестная ссылка] [Академия Google]
110. Йокота А., Комура Х., Китаока С. Различная метаболическая судьба двух атомов углерода гликолята в Euglena gracilis Z. В: Sybesma C., редактор. Успехи в исследованиях фотосинтеза: материалы VI Международного конгресса по фотосинтезу, Брюссель, Бельгия, 1–6 августа 1983 г. Springer, Нидерланды; Дордрехт, Нидерланды: 1984. стр. 407–410. [Google Scholar]
111. Yokota A., Kawabata A., Kitaoka S. Механизм декарбоксилирования глиоксилата в гликолатном пути в Euglena gracilis Z. Физиол. 1983; 71: 772–776. doi: 10.1104/стр.71.4.772. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Физиол. 1983; 71: 772–776. doi: 10.1104/стр.71.4.772. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
112. Yokota A., Haga S., Kitaoka S. Очистка и некоторые свойства глиоксилатредуктазы (NADP + ) и ее функциональное расположение в митохондриях в Euglena gracilis Z. Biochem. Дж. 1985; 227: 211–216. doi: 10.1042/bj2270211. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
113. Хасан М.Т., Сунь А., Мирзаи М., Тео Дж., Хобба Г., Сунна А., Невалайнен Х. Комплексная оценка путей биосинтеза аскорбата, α-токоферола и свободных аминокислот у Euglena gracilis var. сахарофила. Алгал Рез. 2017;27:140–151. doi: 10.1016/j.algal.2017.08.029. [CrossRef] [Google Scholar]
114. Isegawa Y., Watanabe F., Kitaoka S., Nakano Y. Субклеточное распределение кобаламинозависимой метионинсинтазы в Euglena gracilis Z. Фитохимия. 1993; 35: 59–61. doi: 10.1016/S0031-9422(00)
-0. [CrossRef] [Google Scholar] 115. Сульцман Ф.М., Эдмундс Л. Н. Стойкие циркадные колебания активности ферментов в неделящихся культурах Euglena . Биохим. Биофиз. Рез. коммун. 1972; 47: 1338–1344. дои: 10.1016/0006-291Х(72)-7. [PubMed] [CrossRef] [Google Scholar]
Н. Стойкие циркадные колебания активности ферментов в неделящихся культурах Euglena . Биохим. Биофиз. Рез. коммун. 1972; 47: 1338–1344. дои: 10.1016/0006-291Х(72)-7. [PubMed] [CrossRef] [Google Scholar]
116. Edmunds L.N., Walther W.G., Sulzman F.M. На клеточном уровне. Дж. Междисциплинарный. Цикл Рез. 1972; 3: 107–108. doi: 10.1080/092209359306. [CrossRef] [Google Scholar]
117. Reinbothe C., Ortel B., Parthier B., Reinbothe S. Цитозольные и пластидные формы 5-энолпирувилшикимат-3-фосфатсинтазы в Euglena gracilis по-разному экспрессируются во время световой индуцированное развитие хлоропластов. Мол. Генерал Жене. 1994;245:616–622. doi: 10.1007/BF00282224. [PubMed] [CrossRef] [Google Scholar]
118. Ричардс Т.А., Дакс Дж.Б., Кэмпбелл С.А., Бланшар Дж.Л., Фостер П.Г., Маклеод Р., Робертс К.В. Эволюционное происхождение эукариотического пути шикимата: слияние генов, горизонтальный перенос генов, и эндосимбиотические замены. Эукариот. Клетка. 2006; 5:1517–1531. doi: 10.1128/EC.00106-06. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
2006; 5:1517–1531. doi: 10.1128/EC.00106-06. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
119. Oda Y., Nakano Y., Kitaoka S. Использование и токсичность экзогенных аминокислот в Эвглена тонкая . Микробиология. 1982; 128: 853–858. doi: 10.1099/00221287-128-4-853. [CrossRef] [Google Scholar]
120. Ода Ю., Накано Ю., Китаока С. Наличие и некоторые свойства двух треониндегидратаз у Euglena gracilis . Микробиология. 1983; 129: 57–61. doi: 10.1099/00221287-129-1-57. [CrossRef] [Google Scholar]
121. Парк Б.-С., Хиротани А., Накано Ю., Китаока С. Очистка и некоторые свойства аргининдезиминазы в Euglena gracilis З. Агр. биол. хим. 1984; 48: 483–489. [Google Scholar]
122. Кунин Е.В., Гальперин М.Ю. Эволюция центральных метаболических путей: площадка для неортологичного смещения генов. В: Кунин Е.В., Гальперин М.Ю., ред. Последовательность — эволюция — функция: вычислительные подходы в сравнительной геномике. Спрингер; Бостон, Массачусетс, США: 2003. стр. 295–355. [Google Scholar]
стр. 295–355. [Google Scholar]
123. Torruella G., Suga H., Riutort M., Pereto J., Ruiz-Trillo I. Эволюционная история путей биосинтеза лизина у эукариот. Дж. Мол. Эвол. 2009 г.;69:240–248. doi: 10.1007/s00239-009-9266-x. [PubMed] [CrossRef] [Google Scholar]
124. Xu H., Andi B., Qian J., West A.H., Cook P.F. α-аминоадипатный путь биосинтеза лизина в грибах. Клеточная биохимия. Биофиз. 2006; 46:43–64. doi: 10.1385/CBB:46:1:43. [PubMed] [CrossRef] [Google Scholar]
125. Creaser E.H., Varela-Torres R. Иммунологические сравнения гистидинолдегидрогеназ. Микробиология. 1971; 67: 85–90. doi: 10.1099/00221287-67-1-85. [PubMed] [CrossRef] [Академия Google]
126. Токунага М., Накано Ю., Китаока С. Субклеточная локализация ферментов ГАМК-шунта в штамме Euglena gracilis Z. J. Protozool. 1979; 26: 471–473. doi: 10.1111/j.1550-7408.1979.tb04655.x. [PubMed] [CrossRef] [Google Scholar]
127. Miyatake K., Kitaoka S. NADH-зависимая глутаматсинтаза в Euglena gracilis Z. Agric. биол. хим. 1981; 45: 1727–1729. [Google Scholar]
Agric. биол. хим. 1981; 45: 1727–1729. [Google Scholar]
128. Fayyaz-Chaudhary M., Javed Q., Merrett M.J. Влияние условий роста на NADPH-специфическую глутаматдегидрогеназную активность Эвглена тонкая . Новый Фитол. 1985; 101: 367–376. doi: 10.1111/j.1469-8137.1985.tb02843.x. [CrossRef] [Google Scholar]
129. Шемин Д., Риттенберг Д. Использование глицина для синтеза порфирина. Дж. Биол. хим. 1945; 159: 567–568. [Google Scholar]
130. Beale S.I., Castelfranco P.A. Биосинтез дельта-аминолевулиновой кислоты в высших растениях.1. Накопление дельта-аминолевулиновой кислоты в зеленеющих тканях растений. Физика растений 1974; 53: 291–296. дои: 10.1104/стр.53.2.291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
131. Иида К., Мимура И., Кадживара М. Оценка двух путей биосинтеза δ-аминолевулиновой кислоты в Euglena gracilis . Евро. Дж. Биохим. 2002; 269: 291–297. doi: 10.1046/j.0014-2956.2001.02651.x. [PubMed] [CrossRef] [Google Scholar]
132. Weinstein J.D., Beale S.I. Отдельные физиологические роли и субклеточные компартменты для двух путей биосинтеза тетрапиррола в Euglena gracilis . Дж. Биол. хим. 1983;258:6799–6807. [PubMed] [Google Scholar]
Weinstein J.D., Beale S.I. Отдельные физиологические роли и субклеточные компартменты для двух путей биосинтеза тетрапиррола в Euglena gracilis . Дж. Биол. хим. 1983;258:6799–6807. [PubMed] [Google Scholar]
133. Wolpert J.S., Ernst-Fonberg M.L. Мультиферментный комплекс для фиксации углекислого газа. Биохимия. 1975; 14: 1095–1102. doi: 10.1021/bi00677a001. [PubMed] [CrossRef] [Google Scholar]
134. Инуи Х., Миятаке К., Накано Ю., Китаока С. Ферментация воскового эфира в Euglena gracilis . ФЭБС лат. 1982; 150: 89–93. doi: 10.1016/0014-5793(82)81310-0. [CrossRef] [Google Scholar]
135. Kim D., Filtz M.R., Proteau P.J. Путь метилэритритолфосфата способствует биосинтезу каротиноидов, но не фитола в Эвглена тонкая . Дж. Нат. Произв. 2004; 67: 1067–1069. doi: 10.1021/np049892x. [PubMed] [CrossRef] [Google Scholar]
136. Ferro M., Salvi D., Riviere-Rolland H., Vermat T., Seigneurin-Berny D., Grunwald D., Garin J., Joyard J., Ролланд Н. Интегральные мембранные белки оболочки хлоропластов: идентификация и субклеточная локализация новых переносчиков. проц. Натл. акад. науч. США. 2002;99:11487–11492. doi: 10.1073/pnas.1723
Интегральные мембранные белки оболочки хлоропластов: идентификация и субклеточная локализация новых переносчиков. проц. Натл. акад. науч. США. 2002;99:11487–11492. doi: 10.1073/pnas.1723
137. O’Neill E. Исследование фосфорилаз для синтеза углеводных полимеров. Университет Восточной Англии; Норидж, Великобритания: 2013. [Google Scholar]
Lab 3 — Euglena — 7B Science Labs
Lab 3 — Euglena
понять их анатомию.
Рабочий лист
Загрузите копию лабораторного листа для этого упражнения.
| lab_3_-_euglena_observations.pdf |
Часть первая. Исходная информация
Скопируйте приведенную ниже информацию в раздел справочной информации на рабочем листе.
Сегодня вы увидите еще одного протиста. В предыдущих лабораторных работах (онлайн или в классе) вы наблюдали тип или простейшее, называемое простейшим. Теперь вы понаблюдаете за видом простейших, называемых водорослями. Все водоросли являются растительноподобными протистами. Это потому, что они автотрофы — они используют фотосинтез для производства своей собственной пищи.
Теперь вы понаблюдаете за видом простейших, называемых водорослями. Все водоросли являются растительноподобными протистами. Это потому, что они автотрофы — они используют фотосинтез для производства своей собственной пищи.
Водоросль, которую вы увидите сегодня, называется эвглена. Это разновидность эвгленоида. Эвглена является примером водорослей, потому что ее клетка содержит хлоропласты, которые позволяют ей осуществлять фотосинтез. Однако ученые заметили, что эвглена также может быть гетеротрофом; они также могут есть, чтобы получить энергию!
Euglena также имеют приспособления, которые помогают им выжить. Например, у них есть жгутики, которые позволяют им двигаться, пленка, придающая им форму, и глазное пятно, которое помогает определить местонахождение света. На самом деле, если вы поместите эвглену в контейнер, поместите ее у солнечного окна и накроете половину контейнера, эвглена переместится на солнечную сторону!
Часть вторая. Структуры клеток
Скопируйте приведенную ниже информацию в свой рабочий лист. Строение эвглены сходно с другими изученными нами простейшими. На внешней стороне эвглены находится пленка. Напомним, что пленка представляет собой жесткое, но гибкое покрытие, придающее организму его форму. Под пленкой вы найдете клеточную мембрану. Вы также найдете жгутик, длинную хлыстообразную структуру, используемую для движения.
Строение эвглены сходно с другими изученными нами простейшими. На внешней стороне эвглены находится пленка. Напомним, что пленка представляет собой жесткое, но гибкое покрытие, придающее организму его форму. Под пленкой вы найдете клеточную мембрану. Вы также найдете жгутик, длинную хлыстообразную структуру, используемую для движения.
Внутри эвглены мы найдем несколько знакомых органелл. Во-первых, вы должны иметь возможность наблюдать за ядром. В отличие от парамеция, эвглена имеет только одно ядро. Он контролирует функции клетки. Кроме того, вы должны иметь возможность наблюдать сократительные вакуоли. Напомним, что сократительная вакуоль собирает и выталкивает из клетки избыток воды. Другой распространенной органеллой является хлоропласт. Эти зеленые структуры позволяют эвглене осуществлять фотосинтез.
Теперь давайте узнаем о некоторых новых органеллах. Во-первых, вы должны быть в состоянии наблюдать красное пятно. Это называется глазным пятном (также известным как клеймо). Это помогает эвглене обнаруживать источники света. Он работает, блокируя некоторые источники света, чтобы эвглена могла определить, в каком направлении исходит самый яркий источник. Во-вторых, вы заметите длинные стержнеобразные детали. Их называют гранулами парамилона. Они похожи на пищевые вакуоли. Они хранят сахар, образующийся в процессе фотосинтеза. Иногда они появляются в виде пятен на хлоропластах или рядом с ними.
Это помогает эвглене обнаруживать источники света. Он работает, блокируя некоторые источники света, чтобы эвглена могла определить, в каком направлении исходит самый яркий источник. Во-вторых, вы заметите длинные стержнеобразные детали. Их называют гранулами парамилона. Они похожи на пищевые вакуоли. Они хранят сахар, образующийся в процессе фотосинтеза. Иногда они появляются в виде пятен на хлоропластах или рядом с ними.
p.p1 {поле: 0.0px 0.0px 0.0px 0.0px; высота строки: 18,0 пикселей; шрифт: 12.0px Cambria; цвет: #333233}
span.s1 {межбуквенный интервал: 0,0 пикселей}
Прежде чем двигаться дальше, посмотрите видеоролики, чтобы узнать, сколько деталей вы сможете идентифицировать.
Видео 1 | Видео 2 |
Часть третья. Обозначение диаграммы
Обозначьте приведенную ниже диаграмму следующими частями: хлоропласт, сократительная вакуоль, жгутик, ядро, гранула парамилона, пленка и глазное пятно (рыльце)
Пустая маркированная диаграмма эвглены .
Часть четвертая — Отражение
Ответьте на следующие вопросы.
1. К какой группе простейших относится эвглена?
2. Эвглены содержат хлоропласты. Когда свет ограничен, они могут поедать частицы для получения энергии. Эти организмы относятся к гетеротрофам или автотрофам?
3. Euglena не единственные организмы, имеющие жгутик. Зоофлагелляты — это простейшие, у которых также есть жгутики. Хотя эвглена и зоофлагелляты передвигаются с помощью жгутиков, почему эти организмы классифицируются по-разному?
4. Назовите две органеллы, которые вы могли найти у эвглены, но не смогли найти у зоофлагелляты.
Назовите две органеллы, которые вы могли найти у эвглены, но не смогли найти у зоофлагелляты.
5. Вы помещаете миллионы эвглен в контейнер и ставите его у окна. Весь контейнер ярко-зеленого цвета, так как эвглена свободно плавает. Вы накрываете половину контейнера, блокируете солнечный свет. В конце дня вы возвращаетесь к контейнеру и обнаруживаете, что все эвглены теперь на открытой стороне. Объясни, почему это произошло. Ваш ответ должен включать произведения: глазное пятно (рыльце), солнечный свет и фотосинтез.
Протеомные ответы адаптированных к темноте Euglena gracilis и обесцвеченных мутантов на световые стимулы
Введение
Euglena gracilis (E. gracilis) одноклеточная зеленая эукариотическая микроводоросль, относящаяся к группе эвгленовых (Excavata), широко распространена в водной среде. Клетки E. gracilis богаты питательными веществами со многими ценными продуктами, такими как парамилон, метионин, витамины и жирные кислоты, и стали новым видом популярного продукта на рынке (Mokrosnop, 2018; Gissibl et al. , 2019; Коттупарамбил и др., 2019). Эвглениды демонстрируют различные способы питания, включая автотрофию, гетеротрофию и миксотрофию с характеристиками как животных, так и растений (Torihara and Kishimoto, 2015).
, 2019; Коттупарамбил и др., 2019). Эвглениды демонстрируют различные способы питания, включая автотрофию, гетеротрофию и миксотрофию с характеристиками как животных, так и растений (Torihara and Kishimoto, 2015).
Следует отметить, что хлоропласты E. gracilis окружены тремя мембранами в результате вторичного эндосимбиоза. Предок E. gracilis известен как гетеротрофный вид животных и захватывает зеленые водоросли, что приводит к приобретению фотосинтетической способности путем вторичного эндосимбиоза. Ядерный геном E. gracilis содержит не только гены зеленых водорослей, но и хлоропласты, идентичные хлоропластам, обнаруженным у некоторых зеленых водорослей (Maruyama et al., 2011; Markunas, Triemer, 2016). Однако хлоропласты в E. gracilis кажутся бесполезными для выживания. Например, многие обработки, такие как мутагены, нагревание и давление, могут привести к обесцвечиванию E. gracilis и безвозвратной потере большей части, если не всех, их хлоропластных геномов, но с незначительным влиянием на их гетеротрофный рост (Heizmann et al. , 1976; Осафунэ и Шифф, 1983). Кроме того, обесцвеченные мутанты могут быть индуцированы обработкой аминогликозидами, такими как офлоксацин или стрептомицин (Shibata et al., 1954; Tamaki et al., 2020; Tomečková et al., 2020). В нашем предыдущем исследовании пять обесцвеченных мутантов 9Было получено 0003 штамма E. gracilis , обработанного офлоксацином, и исследовано 12 остаточных пластидных генов всего хлоропластного генома как у WT, так и у обесцвеченных мутантов. Один из обесцвеченных мутантов, названный B2, утратил способность к накоплению хлорофилла, что было связано с тем, что многие гены хлоропластов остались невыявленными на геномном и транскрипционном уровнях, например, psbE и psbK (Qin et al., 2020).
, 1976; Осафунэ и Шифф, 1983). Кроме того, обесцвеченные мутанты могут быть индуцированы обработкой аминогликозидами, такими как офлоксацин или стрептомицин (Shibata et al., 1954; Tamaki et al., 2020; Tomečková et al., 2020). В нашем предыдущем исследовании пять обесцвеченных мутантов 9Было получено 0003 штамма E. gracilis , обработанного офлоксацином, и исследовано 12 остаточных пластидных генов всего хлоропластного генома как у WT, так и у обесцвеченных мутантов. Один из обесцвеченных мутантов, названный B2, утратил способность к накоплению хлорофилла, что было связано с тем, что многие гены хлоропластов остались невыявленными на геномном и транскрипционном уровнях, например, psbE и psbK (Qin et al., 2020).
В темноте пластиды E. gracilis становятся плохо развитыми без зеленых пигментов и могут быть восстановлены в способные к фотосинтезу хлоропласты после восстановления воздействия света в течение 3 дней (Stern et al., 1964). Этот процесс хорошо изучен с 1960-х годов. Например, Стерн и др. (1964) обнаружили биосинтез пигмента в качественных и количественных показателях во время развития хлоропластов, а Эпштейн и Шифф (1961) с помощью электронной и флуоресцентной микроскопии зафиксировали изображения процесса превращения пропластид в зрелые хлоропласты за 72 часа. Развитие хлоропластов E. gracilis представляет собой процесс, жестко регулируемый по времени воздействием света. Эвглена имеет пониженное содержание хлоропластных генов фотосинтетической и нефотосинтетической активности по сравнению с наземными растениями. Геном хлоропластов E. gracilis был первым полностью секвенированным геномом хлоропластов (Hallick et al., 1993), включая 55 известных генов для компонентов хлоропластных 70S рибосом, тРНК и факторов трансляции; 27 генов компонентов тилакоидных мембран, хлоропластного АТФ-синтазного комплекса или СО 2 -фиксирующего фермента RUBISCO; пять ОРС, идентифицированных по сходству с другими ОРС хлоропластов; и 10 других ORF с неизвестной функцией.
Например, Стерн и др. (1964) обнаружили биосинтез пигмента в качественных и количественных показателях во время развития хлоропластов, а Эпштейн и Шифф (1961) с помощью электронной и флуоресцентной микроскопии зафиксировали изображения процесса превращения пропластид в зрелые хлоропласты за 72 часа. Развитие хлоропластов E. gracilis представляет собой процесс, жестко регулируемый по времени воздействием света. Эвглена имеет пониженное содержание хлоропластных генов фотосинтетической и нефотосинтетической активности по сравнению с наземными растениями. Геном хлоропластов E. gracilis был первым полностью секвенированным геномом хлоропластов (Hallick et al., 1993), включая 55 известных генов для компонентов хлоропластных 70S рибосом, тРНК и факторов трансляции; 27 генов компонентов тилакоидных мембран, хлоропластного АТФ-синтазного комплекса или СО 2 -фиксирующего фермента RUBISCO; пять ОРС, идентифицированных по сходству с другими ОРС хлоропластов; и 10 других ORF с неизвестной функцией. 9Ядра 0003 E. gracilis кодируют и регулируют более 90% белков в хлоропластах, таких как белки светособирающего комплекса (Koziol and Durnford, 2008). Критические временные точки развития хлоропластов включают время инициации в 12 часов и стабильное время в 72 часа для плохого развития органелл в темноте до созревания функциональных хлоропластов после воздействия света. Синтез хлорофилла E. gracilis индуцируется светом и демонстрирует 12-часовой лаг-период для быстрого синтеза реакционных центров фотосистемы I (PSI), в то время как примерно 18–24-часовой лаг-период регистрируется для триггера фотосистемы. II (PSII) реакционные центры (Stern et al., 1964; Yi et al., 1985), а скорость синтеза белков, родственных хлоропластам, почти стабильна после 72 часов воздействия света (Monroy et al., 1987).
9Ядра 0003 E. gracilis кодируют и регулируют более 90% белков в хлоропластах, таких как белки светособирающего комплекса (Koziol and Durnford, 2008). Критические временные точки развития хлоропластов включают время инициации в 12 часов и стабильное время в 72 часа для плохого развития органелл в темноте до созревания функциональных хлоропластов после воздействия света. Синтез хлорофилла E. gracilis индуцируется светом и демонстрирует 12-часовой лаг-период для быстрого синтеза реакционных центров фотосистемы I (PSI), в то время как примерно 18–24-часовой лаг-период регистрируется для триггера фотосистемы. II (PSII) реакционные центры (Stern et al., 1964; Yi et al., 1985), а скорость синтеза белков, родственных хлоропластам, почти стабильна после 72 часов воздействия света (Monroy et al., 1987).
Развитие хлоропластов и синтез белка, кодируемого ядром, индуцированные светом, контролируются на уровне трансляции, а не на уровне транскрипта (Schwartzbach, 2017), однако в нескольких сообщениях основное внимание уделяется развитию хлоропластов E. gracilis с помощью протеома, вероятно, из-за отсутствия качественно собранного генома. В этом исследовании мы использовали долговременно адаптированный к темноте WT и постоянно обесцвеченный мутант 9 офлоксацина.0003 E. gracilis B2 для сравнительного протеомного исследования. И WT, и B2 непрерывно культивировались в темноте в течение шести месяцев. Чтобы исследовать протеомные различия развития хлоропласта E. gracilis , клетки WT и B2 сравнивали при воздействии света в следующие критические моменты времени 0, 12 и 72 ч. Мы обнаружили, что оба штамма E. gracilis WT и B2 проявляли световую реакцию и световую регуляцию на уровне белка. Белки, связанные с фотосинтезом, со временем активизировались как у WT, так и у B2. Хотя случайная делеция пластидного генома у B2 предотвратила синтез хлорофилла, протеомные данные показали, что он может выполнять полную функцию фотосинтетической системы. Основная метаболическая активность по использованию углерода и энергии в WT повышалась, в то время как белки, связывающие ионы кальция, клеточный цикл и нефотосинтетическая фиксация углерода, подавлялись в B2.
gracilis с помощью протеома, вероятно, из-за отсутствия качественно собранного генома. В этом исследовании мы использовали долговременно адаптированный к темноте WT и постоянно обесцвеченный мутант 9 офлоксацина.0003 E. gracilis B2 для сравнительного протеомного исследования. И WT, и B2 непрерывно культивировались в темноте в течение шести месяцев. Чтобы исследовать протеомные различия развития хлоропласта E. gracilis , клетки WT и B2 сравнивали при воздействии света в следующие критические моменты времени 0, 12 и 72 ч. Мы обнаружили, что оба штамма E. gracilis WT и B2 проявляли световую реакцию и световую регуляцию на уровне белка. Белки, связанные с фотосинтезом, со временем активизировались как у WT, так и у B2. Хотя случайная делеция пластидного генома у B2 предотвратила синтез хлорофилла, протеомные данные показали, что он может выполнять полную функцию фотосинтетической системы. Основная метаболическая активность по использованию углерода и энергии в WT повышалась, в то время как белки, связывающие ионы кальция, клеточный цикл и нефотосинтетическая фиксация углерода, подавлялись в B2. Исследование дало новое понимание Развитие хлоропластов E. gracilis в процессе повторного озеленения и сравнение сходства и различий между WT и B2 на уровне протеома.
Исследование дало новое понимание Развитие хлоропластов E. gracilis в процессе повторного озеленения и сравнение сходства и различий между WT и B2 на уровне протеома.
Материалы и методы
Условия выращивания и отбор проб
Штамм E. gracilis Z (WT) и E. gracilis мутантный мутантный штамм Oflaxocin (B2) выращивали в среде EM с 1% этанола в темноте, которая , для подготовки, инокулировали в обновляющую среду каждые 10 дней в течение примерно 7 месяцев. WT был приобретен у CCAP (Culture Collection of Algae and Protozoa, United Kingdom), а получение B2 осуществлялось в соответствии с протоколом, описанным Qin et al. (2020). Для обработки светом клетки WT и B2 подвергались воздействию света интенсивностью приблизительно 50 мкмоль фотонов·м -2 ·с -1 в инкубаторе с подсветкой при 25°C без встряхивания. Начальная плотность клеток составляла 1×10 6 клеток/мл из темных культур в 250-мл коническую колбу, содержащую 100 мл, и суммарные клетки собирали центрифугированием при 500 g в течение 5 мин при 0, 12 и 72 ч после воздействия света с тремя дубликатами соответственно. Образцы хранили при температуре -80°C для экстракции белка.
Образцы хранили при температуре -80°C для экстракции белка.
Флуоресцентная визуализация
Для обнаружения E. gracilis хлоропластов, изображения просматривали и получали с помощью инвертированного флуоресцентного микроскопа Leica DMI 3000 B, эпифлуоресцентного микроскопа. Синий аргоновый лазер (488 нм) был выбран в качестве возбуждающего света, а автофлуоресцентный свет, излучаемый хлоропластами, собирался между 660 и 731 нм.
Экстракция и расщепление белков
Экстракцию белков проводили, как описано ранее (Coman et al., 2016). Вкратце, замороженные образцы оттаивали и добавляли приблизительно 400 мкл предварительно охлажденного ацетона при температуре -40°C для осаждения на 4 часа. Затем осадок каждого образца собирали центрифугированием при 6000 град.0003 г при 4°C в течение 10 мин и 300 мкл 80% ацетона добавляли для промывки осадка с помощью центрифуги при 6000 г в течение 10 мин. После повторения этого шага дважды добавляли 100 мкл HEPES-SDC (Sigma, США) для растворения белка и проводили ультразвуковую обработку на льду в течение 2 мин. Наконец, супернатант собирали после центрифугирования при 6000 g в течение 10 мин. Для переваривания к каждому образцу добавляли предварительно охлажденный ацетон в 5-кратном объеме, встряхивали на льду в течение 30 мин и белки осаждали при -20°C в течение 4 ч. Супернатант осторожно удалили после центрифугирования при 6000·9.0003 г при 4°C в течение 10 минут, добавляли 200 мкл предварительно охлажденного 80% ацетона и собирали осадок после центрифугирования при 6000 g . Затем для растворения белка добавляли 100 мкл 100 мМ HEPES-SDC (Sigma, США) и проводили ультразвуковую обработку на льду в течение 30 с. Растворенный белок расщепляли трипсином (2 мкг, Promega, США) в течение 2–4 ч при 42°C.
Наконец, супернатант собирали после центрифугирования при 6000 g в течение 10 мин. Для переваривания к каждому образцу добавляли предварительно охлажденный ацетон в 5-кратном объеме, встряхивали на льду в течение 30 мин и белки осаждали при -20°C в течение 4 ч. Супернатант осторожно удалили после центрифугирования при 6000·9.0003 г при 4°C в течение 10 минут, добавляли 200 мкл предварительно охлажденного 80% ацетона и собирали осадок после центрифугирования при 6000 g . Затем для растворения белка добавляли 100 мкл 100 мМ HEPES-SDC (Sigma, США) и проводили ультразвуковую обработку на льду в течение 30 с. Растворенный белок расщепляли трипсином (2 мкг, Promega, США) в течение 2–4 ч при 42°C.
Маркировка Tandem Mass Tag и анализ nanoLCMS/MS
К расщепленным образцам добавляли 15 мкл ТМТ (Thermo Scientific, США) и инкубировали при комнатной температуре в течение 1 ч, затем добавляли 2 мкл 5% гидроксиламина и инкубировали снова при комнатной температуре в течение 15 мин. Собранные фракции подвергали очистке SDC 2% трифторуксусной кислотой (TFA, Sigma, США) и обессоливанию пептидов рабочим раствором обессоливающего буфера ацетонитрила (ACN, ANPEL Laboratories Technologies, Китай). Пробы анализировали на колонке XBridge BEH C18 XP (Waters, США).
Собранные фракции подвергали очистке SDC 2% трифторуксусной кислотой (TFA, Sigma, США) и обессоливанию пептидов рабочим раствором обессоливающего буфера ацетонитрила (ACN, ANPEL Laboratories Technologies, Китай). Пробы анализировали на колонке XBridge BEH C18 XP (Waters, США).
Для анализа nanoLCMS/MS 1 мкг общего количества пептидов для каждого образца был проведен на nano-UPLC (EASYnLC1200), соединенном с прибором Q Exactive HFX Orbitrap (Thermo Fisher Scientific). Использовали колонку с обращенной фазой (внутренний диаметр 100 мкм × 15 см, Reprosil-Pur 120 C18-AQ, 1,9 мкм, Dr. Math). Подвижные фазы А представляли собой H 2 O с 0,1 % муравьиной кислоты (FA, Sigma, США), 2 % ACN, а фаза B — 80 % ACN, 0,1 % FA. Образцы разделяли с градиентом 90 мин при скорости потока 300 нл/мин в градиенте А, а градиент В: 2–5% в течение 2 мин, 5–22% в течение 68 мин, 22–45% в течение 16 мин. , 45–95 % в течение 2 мин., 95 % в течение 2 мин. Наконец, сбор данных в зависимости от данных (DDA) был выполнен в профильном и положительном режимах с помощью анализатора Orbitrap.
Анализ протеомных данных
После контроля качества данных был проведен поиск белковых последовательностей в их базах данных UniProt FASTA на уровне видов (UniProt-Euglenophyceae-107469-2021-03), и данные протеомики были переданы в Консорциум ProteomeXchange вместе с набором данных идентификатор PXD030414. Анализ временных рядов проводился с использованием пакета maSigPro (v1.54) (Conesa and Nueda, 2018). Дифференциально экспрессируемые белки (DEP) среди групп были отфильтрованы с 1) более чем одним уникальным пептидом, 2) кратностью более 1,5 или менее 0,67 и 3) p — значение меньше 0,05. Аннотации COG (кластер ортологичных групп белков) были получены с помощью eggNOG (v5.0.0) и eggNOG-mapper (v2) с использованием белковых последовательностей (Huerta-Cepas et al., 2019; Cantalapiedra et al., 2021). Аннотации GO (генная онтология) были извлечены из базы данных UniProt (20210419). Аннотации KEGG (Kyoto Encyclopedia of Genes and Genomes) были получены BlastKOALA и GhostKOALA (Kanehisa et al. , 2016), при этом аннотация использовалась только в том случае, если результат был одинаковым как минимум в двух базах данных. Обогащение GO и KEGG проводилось с использованием clusterProfiler (v3.10.1) с обогатитель функция. Графики Венна были созданы с использованием Venny (v2.1) (Yu et al., 2012; Oliveros, 2016). Все остальные рисунки были сгенерированы в R (v3.5.3) с использованием пакетов pheatmap (v1.0.12) и ggplot2 (v3.2.1).
, 2016), при этом аннотация использовалась только в том случае, если результат был одинаковым как минимум в двух базах данных. Обогащение GO и KEGG проводилось с использованием clusterProfiler (v3.10.1) с обогатитель функция. Графики Венна были созданы с использованием Venny (v2.1) (Yu et al., 2012; Oliveros, 2016). Все остальные рисунки были сгенерированы в R (v3.5.3) с использованием пакетов pheatmap (v1.0.12) и ggplot2 (v3.2.1).
Результаты
Развитие
E. gracilis Хлоропласты Как показано на рисунке 1, цвет WT, выросшего в конической колбе, меняется от белого до зеленого при воздействии света от 0 до 72 часов, при этом никаких изменений цвета не наблюдалось. наблюдается в культуральных флаконах B2 после 72 часов воздействия света. Явления также согласуются со световыми изображениями под микроскопом. Более того, интенсивность красной флуоресценции хлоропластов WT была в значительной степени связана со временем воздействия, в то время как для обесцвеченных мутантных клеток флуоресценция не видна. Интенсивность красной флуоресценции увеличивалась со временем у WT по сравнению с B2. Результаты показали, что функциональная целостность хлоропластов связана с воздействием света, демонстрируя зависимость от времени, и B2 потерял способность накапливать хлорофилл.
Интенсивность красной флуоресценции увеличивалась со временем у WT по сравнению с B2. Результаты показали, что функциональная целостность хлоропластов связана с воздействием света, демонстрируя зависимость от времени, и B2 потерял способность накапливать хлорофилл.
РИСУНОК 1 . Фотографии развития хлоропластов у дикого типа (WT) и обесцвеченного мутанта (B2) E. gracilis после восстановления светового воздействия. Две группы (WT и B2), которые включали изображения клеточных гранул и микроскопические изображения в видимом свете и флуоресцентном свете, были показаны в момент времени 0, 12 и 72 часа соответственно.
Обзор протеомных данных
В этом наборе данных после удаления ложных и потенциальных полипептидов было получено в общей сложности 1572 совпадающих пептида. График анализа основных компонентов (PCA) показал сходство между образцами. Разница между WT в 0 ч и WT в 12 ч была меньше, как и в B2. Однако через 72 ч их большее расхождение было показано во внутригрупповой и межгрупповой (рис. 2). Распределение значений оценки белка было показано на дополнительном рисунке S1.
2). Распределение значений оценки белка было показано на дополнительном рисунке S1.
РИСУНОК 2 . График анализа основных компонентов (PCA) протеомных образцов в WT и B2. На графике баллов образцы отличались символами разной формы и цвета.
Дифференциальные белки, определяемые временными последовательностями в WT и B2
Чтобы найти существенные различия профилей трансляции белков между экспериментальными группами во времени, был проведен анализ тенденций протеомных данных с использованием пакета maSigPro. 988 пептидов с дифференциальной экспрессией были отобраны и разделены на 9кластеры (дополнительная фигура S2), в то время как все несущественные пептиды были отнесены к кластеру 10. Белки, измененные в WT и B2 после легкого повторного озеленения, были проанализированы и сгруппированы по их паттернам экспрессии во временных рядах, как показано на рисунке 3. В WT , группы белков с повышающей регуляцией были в значительной степени обогащены кластерами 1-3, в то время как кластеры 3-9 регулировались с понижением. Кластер 1 у WT-72 ч был значительно активизирован. GO-аннотация кластера 1 показала, что обогащенные белки участвуют в фотосинтезе светособирающей, пластидной, хлоропластной тилакоидной мембраны (неотъемлемый компонент мембраны), активности связывания ионов железа, хлоропластной и протон-транспортирующей АТФ-синтазы и т. д. (рис. 4А). Модули KEGG или пути кластера 1 были в основном связаны с фотосинтезом, такими как белки антенны, метаболические пути, фиксация углерода в фотосинтезирующих организмах и биосинтез кофакторов (рис. 4B). Однако кластер 10 в целом подавлялся в WT через 72 часа, и они были структурными составляющими рибосомы, трансляции и ее пути, относящимися к рибосоме (рис. 4A, B). В B2 белки с активацией через 0, 12 и 72 ч находились в кластерах 8–9., 6-7 и 4-5 соответственно, в то время как отрицательная регуляция была обнаружена в кластерах 1, 2 и 3. При сравнении WT с B2 кластеры 1-3 регулировались положительно, а кластеры 4-9 подавлялись в кластерах 1, 2 и 3. WT и противоположные результаты были обнаружены в B2.
Кластер 1 у WT-72 ч был значительно активизирован. GO-аннотация кластера 1 показала, что обогащенные белки участвуют в фотосинтезе светособирающей, пластидной, хлоропластной тилакоидной мембраны (неотъемлемый компонент мембраны), активности связывания ионов железа, хлоропластной и протон-транспортирующей АТФ-синтазы и т. д. (рис. 4А). Модули KEGG или пути кластера 1 были в основном связаны с фотосинтезом, такими как белки антенны, метаболические пути, фиксация углерода в фотосинтезирующих организмах и биосинтез кофакторов (рис. 4B). Однако кластер 10 в целом подавлялся в WT через 72 часа, и они были структурными составляющими рибосомы, трансляции и ее пути, относящимися к рибосоме (рис. 4A, B). В B2 белки с активацией через 0, 12 и 72 ч находились в кластерах 8–9., 6-7 и 4-5 соответственно, в то время как отрицательная регуляция была обнаружена в кластерах 1, 2 и 3. При сравнении WT с B2 кластеры 1-3 регулировались положительно, а кластеры 4-9 подавлялись в кластерах 1, 2 и 3. WT и противоположные результаты были обнаружены в B2. GO-аннотация кластеров 2-5 включала АТФазную активность, связывание АТФ, цитоплазму, процессинг мРНК и т. д., а их KEGG был наиболее обогащен путями клеточного цикла в этих кластерах. Аннотация GO кластеров 6-9 относилась к белкам связывания GTP, гликолитического процесса, внутренней мембраны митохондрий, связывания NADP, цикла трикарбоновых кислот (TCA) и процесса метаболизма углеводов и т. д. (рис. 4A). Их пути KEGG были обогащены путями потока энергии, например, биосинтеза вторичных метаболитов, метаболизма жирных кислот, гликолиза и т. д. (рис. 4В). Из этих результатов видно, что 9Развитие хлоропластов 0003 E. gracilis было связано с моментом времени воздействия света, и оно отличалось от bleached мутанта, у которого отсутствовало несколько ключевых генов для функций хлоропластов.
GO-аннотация кластеров 2-5 включала АТФазную активность, связывание АТФ, цитоплазму, процессинг мРНК и т. д., а их KEGG был наиболее обогащен путями клеточного цикла в этих кластерах. Аннотация GO кластеров 6-9 относилась к белкам связывания GTP, гликолитического процесса, внутренней мембраны митохондрий, связывания NADP, цикла трикарбоновых кислот (TCA) и процесса метаболизма углеводов и т. д. (рис. 4A). Их пути KEGG были обогащены путями потока энергии, например, биосинтеза вторичных метаболитов, метаболизма жирных кислот, гликолиза и т. д. (рис. 4В). Из этих результатов видно, что 9Развитие хлоропластов 0003 E. gracilis было связано с моментом времени воздействия света, и оно отличалось от bleached мутанта, у которого отсутствовало несколько ключевых генов для функций хлоропластов.
РИСУНОК 3 . Тепловая карта профиля белка в WT и B2. Все белки можно сгруппировать в 10 групп на основании сходства их распределения.
РИСУНОК 4 . Аннотация GO и профиль путей KEGG дифференциальных белковых кластеров у WT и B2. (A) Аннотация GO дифференциальных белков в кластере. (B) Профиль путей KEGG дифференциальных белков в кластере. Ось абсцисс представляла собой название групп, а ордината представляла аннотацию GO или пути KEGG. Размер пузырьков рассчитывали по количеству совпадающих белков. p -значение отображалось на левой цветовой полосе.
Аннотация GO и профиль путей KEGG дифференциальных белковых кластеров у WT и B2. (A) Аннотация GO дифференциальных белков в кластере. (B) Профиль путей KEGG дифференциальных белков в кластере. Ось абсцисс представляла собой название групп, а ордината представляла аннотацию GO или пути KEGG. Размер пузырьков рассчитывали по количеству совпадающих белков. p -значение отображалось на левой цветовой полосе.
Дифференциально экспрессируемые белки среди групп
Дифференциально экспрессируемые белки среди образцов были идентифицированы t — тест и фильтрация с 1) более чем одним уникальным пептидом, 2) кратность более 1,5 или менее 0,67 и 3) p — значение менее 0,05. Количество общих значимых DEP у WT и B2 постепенно увеличивалось со временем воздействия света, и можно обнаружить, что DEP между 0 и 12 часами как для WT, так и для B2 было меньше, чем в других группах, что согласуется с результатом PCA. (Таблица 1). Эти дифференциальные белки были аннотированы для 26 ортологичных групп COG (дополнительная таблица S1). Таким образом, группы, которые демонстрировали гораздо больше DEP, были дополнительно проанализированы, включая аннотацию GO и пути KEGG.
Эти дифференциальные белки были аннотированы для 26 ортологичных групп COG (дополнительная таблица S1). Таким образом, группы, которые демонстрировали гораздо больше DEP, были дополнительно проанализированы, включая аннотацию GO и пути KEGG.
ТАБЛИЦА 1 . Динамика дифференцированно экспрессируемых белков у WT и B2.
Термины GO с повышающей и понижающей регуляцией в ответ на световые процедуры
Аннотацию GO к DEP можно разделить на три основные части в протеоме с точки зрения биологического процесса (BP), клеточного компонента (CC) и молекулярного функция (MF) (рис. 5). В период от 0 до 12 часов для WT не было DEP, в то время как многие DEP были обогащены онтологией BP, CC и MF по отношению к фотосинтезу, хлоропласту и мембране после воздействия света в течение 72 часов. Интересно, что белки MF, связывающие ионы кальция, были наиболее значительно дифференциально экспрессированы между 0, 12 и 72 часами в B2, и каталог связывания ионов кальция также был дифференциальной частью по сравнению с WT после воздействия света в течение 12 часов. Удивительно, но клетки фенотипа В2 белого цвета без развития хлоропластов содержали большое количество белков, связанных с хлоропластами и фотосинтезом, обнаруженных в этом исследовании. При сравнении WT с B2 между группами в 72 часа только фотосинтез светосбора был дифференциальным термином GO, предполагая, что 12 часов были критическим моментом времени для подготовки к накоплению большого количества хлорофилла (рис. 5). Кроме того, элементы GO, связанные со связыванием ионов кальция, подавлялись в течение 0 часов по сравнению с 12 часами B2, в то время как структурная составляющая рибосомы и трансляции повышались (таблица 2 и фигура 6). Аннотация GO о генах фотосинтеза, хлоропласта, неотъемлемого компонента мембраны, активности протон-транспортирующей АТФ-синтазы повышалась в образце WT и B2 в момент времени 72 против 0 ч и 72 против 12 ч с более высоким GeneRatio (процент от общего числа DEP, сопоставленных с соответствующими генами в данном сроке GO) оценивается соответственно, и эти гены также были активизированы в сравниваемых образцах между WT и B2 в момент времени 0, 12, 72 ч соответственно ( Рисунок 6).
Удивительно, но клетки фенотипа В2 белого цвета без развития хлоропластов содержали большое количество белков, связанных с хлоропластами и фотосинтезом, обнаруженных в этом исследовании. При сравнении WT с B2 между группами в 72 часа только фотосинтез светосбора был дифференциальным термином GO, предполагая, что 12 часов были критическим моментом времени для подготовки к накоплению большого количества хлорофилла (рис. 5). Кроме того, элементы GO, связанные со связыванием ионов кальция, подавлялись в течение 0 часов по сравнению с 12 часами B2, в то время как структурная составляющая рибосомы и трансляции повышались (таблица 2 и фигура 6). Аннотация GO о генах фотосинтеза, хлоропласта, неотъемлемого компонента мембраны, активности протон-транспортирующей АТФ-синтазы повышалась в образце WT и B2 в момент времени 72 против 0 ч и 72 против 12 ч с более высоким GeneRatio (процент от общего числа DEP, сопоставленных с соответствующими генами в данном сроке GO) оценивается соответственно, и эти гены также были активизированы в сравниваемых образцах между WT и B2 в момент времени 0, 12, 72 ч соответственно ( Рисунок 6).
РИСУНОК 5 . Элементы GO в категориях биологических процессов (BP), клеточных компонентов (CC) и молекулярных функций (MF) для дифференциальных генов. Ось абсцисс представляла собой название групп, а ордината представляла аннотацию GO. Размер пузырьков рассчитывали по количеству совпадающих белков. p -значение отображалось на левой цветовой полосе.
ТАБЛИЦА 2 . Белки с пониженной регуляцией связывания ионов кальция в B2.
РИСУНОК 6 . Категории GO с повышающей/понижающей регуляцией для WT и B2 во время развития хлоропластов. Количество совпадающих белков указано в скобках. Размер пузырьков представлял GeneRatio картографирования GO. p -значение отображалось на левой цветовой полосе.
Белки с повышенной и пониженной регуляцией, выявленные с помощью KEGG, реагируют на световую обработку.
Обогащение KEGG было выполнено для выяснения пораженных путей от слаборазвитых хлоропластов к хорошо развитым хлоропластам в клетках WT и неисследованных путей в B2. Можно ожидать, что большое количество белков будет способствовать физиологическому развитию E. gracilis хлоропласт. У WT белки для фиксации углерода в фотосинтезирующих организмах активировались, что указывает на усиление фотосинтеза с развитием хлоропластов (рис. 7 и таблица 3). В клетках B2 белки, участвующие во многих сигнальных путях, таких как кальциевый сигнальный путь и сигнальный путь цАМФ и т. д., которые связаны с циклом трикарбоновых кислот (ЦТК), клеточным циклом и нефотосинтезирующей фиксацией углерода, были снижены. регулируется в момент времени 72 против 0 ч (рис. 7; таблицы 2, 4). Для фотосинтеза ключевыми компонентами пути являются фотосистема I, фотосистема II, комплекс цитохрома b6/f, фотосинтетический транспорт электронов и АТФаза F-типа (рис. 8). В момент времени WT 72 ч против 0 ч белки, связанные с генами PsaA и PsaC , участвующие в фотосистеме I, были активированы, и в фотосистеме II было много активированных белков, картирование с генами psbA , psbD , psbB , 0 psbE 9, 00003 0psbE 9, псбФ, и псбО .
Можно ожидать, что большое количество белков будет способствовать физиологическому развитию E. gracilis хлоропласт. У WT белки для фиксации углерода в фотосинтезирующих организмах активировались, что указывает на усиление фотосинтеза с развитием хлоропластов (рис. 7 и таблица 3). В клетках B2 белки, участвующие во многих сигнальных путях, таких как кальциевый сигнальный путь и сигнальный путь цАМФ и т. д., которые связаны с циклом трикарбоновых кислот (ЦТК), клеточным циклом и нефотосинтезирующей фиксацией углерода, были снижены. регулируется в момент времени 72 против 0 ч (рис. 7; таблицы 2, 4). Для фотосинтеза ключевыми компонентами пути являются фотосистема I, фотосистема II, комплекс цитохрома b6/f, фотосинтетический транспорт электронов и АТФаза F-типа (рис. 8). В момент времени WT 72 ч против 0 ч белки, связанные с генами PsaA и PsaC , участвующие в фотосистеме I, были активированы, и в фотосистеме II было много активированных белков, картирование с генами psbA , psbD , psbB , 0 psbE 9, 00003 0psbE 9, псбФ, и псбО . Белки, картированные генами комплекса цитохрома b6/f ( petB и petA ), и парой белков, экспрессируемых генами АТФазы F-типа ( β , α и ɛ ) также были усилены. Интересно, что белки фотосинтеза в B2 имеют практически идентичные паттерны регуляции с WT во время светового воздействия. При сравнении группы WT и B2 после 72 ч воздействия света большинство дифференциально экспрессируемых белков не были обогащены в пути фотосинтеза, однако родственные белки, связанные с генами PsaC в фотосистеме I и ɛ F- АТФаза типа β F-типа регулировалась с понижением.
Белки, картированные генами комплекса цитохрома b6/f ( petB и petA ), и парой белков, экспрессируемых генами АТФазы F-типа ( β , α и ɛ ) также были усилены. Интересно, что белки фотосинтеза в B2 имеют практически идентичные паттерны регуляции с WT во время светового воздействия. При сравнении группы WT и B2 после 72 ч воздействия света большинство дифференциально экспрессируемых белков не были обогащены в пути фотосинтеза, однако родственные белки, связанные с генами PsaC в фотосистеме I и ɛ F- АТФаза типа β F-типа регулировалась с понижением.
РИСУНОК 7 . Пути KEGG с повышающей/понижающей регуляцией для WT и B2 во время развития хлоропластов. Количество совпадающих белков указано в скобках. Размер пузырьков представлял GeneRatio картирования путей KEGG. p -значение отображалось на левой цветовой полосе.
ТАБЛИЦА 3 . Активированные белки фиксации углерода у WT.
ТАБЛИЦА 4 . Белки с пониженной регуляцией в B2 в момент времени 72 против 0 ч.
РИСУНОК 8 . Сравнение WT и B2 на карте пути фотосинтеза KEGG после восстановления светового воздействия. Карта пути фотосинтеза KEGG доступна на веб-сайте http://www.kegg.jp/pathway/map00195. Зеленые прямоугольники обозначают гены кодируемых белков. Красные прямоугольники указывают гены кодируемых белков, которые регулируются вверх, а синие прямоугольники — подавляются.
Обсуждение
E. gracilis является одним из наиболее широко изученных модельных видов для развития хлоропластов из-за легкой потери и вторичного эндосимбиоза хлоропластов предком Euglena и зеленые водоросли (Zakryś et al., 2017). Процесс приобретения чужеродного хлоропласта для E. gracilis интегрирует новую органеллу в клетку, а также новые гены в ядерные геномы, которые были наделены новыми кодирующими белками и метаболическими путями. В последние десятилетия было проведено много исследований, связанных с хлоропластом E. gracilis . Например, в 1993 г. был полностью секвенирован хлоропластный геном E. gracilis , а размер пластидного генома составлял 143 т.п.н. и кодировался 97 белков и генов (Hallick et al., 1993). Новак Ванцлова и др. (2020) выявили метаболические особенности и яркую историю вторичной пластиды E. gracilis с помощью протеома. Однако хлоропласт необязателен для E. gracilis и легко выбрасывается в различных абиотических условиях, таких как антибиотики, тепло, ультрафиолетовый свет и т. д. (Gibor and Granick, 1962). Зеленые клетки E. gracilis , которые растут в темноте примерно в течение двух недель, могут временно стать бесцветными (Qin et al., 2020). По-видимому, наличие хлоропластов у 9Клетки 0003 E. gracilis расточительны в отсутствие света, а свет является решающим регулирующим фактором для развития их хлоропластов. Развитие хлоропластов у E. gracilis регулировалось скорее на уровне трансляции, чем на уровне транскрипции (Schwartzbach, 2017).
gracilis . Например, в 1993 г. был полностью секвенирован хлоропластный геном E. gracilis , а размер пластидного генома составлял 143 т.п.н. и кодировался 97 белков и генов (Hallick et al., 1993). Новак Ванцлова и др. (2020) выявили метаболические особенности и яркую историю вторичной пластиды E. gracilis с помощью протеома. Однако хлоропласт необязателен для E. gracilis и легко выбрасывается в различных абиотических условиях, таких как антибиотики, тепло, ультрафиолетовый свет и т. д. (Gibor and Granick, 1962). Зеленые клетки E. gracilis , которые растут в темноте примерно в течение двух недель, могут временно стать бесцветными (Qin et al., 2020). По-видимому, наличие хлоропластов у 9Клетки 0003 E. gracilis расточительны в отсутствие света, а свет является решающим регулирующим фактором для развития их хлоропластов. Развитие хлоропластов у E. gracilis регулировалось скорее на уровне трансляции, чем на уровне транскрипции (Schwartzbach, 2017). Таким образом, настоящее исследование было направлено на изучение взаимосвязи между развитием хлоропластов E. gracilis и световой обработкой от темноты протеомом с использованием как адаптированных к темноте клеток WT, так и клеток B2.
Таким образом, настоящее исследование было направлено на изучение взаимосвязи между развитием хлоропластов E. gracilis и световой обработкой от темноты протеомом с использованием как адаптированных к темноте клеток WT, так и клеток B2.
WT Клетки E. gracilis реагируют на свет и проявляют световую регуляцию с помощью сложного и сложного процесса (Schwartzbach and Shigeoka, 2017). В целом адаптированные к темноте хлоропласты WT существуют примерно в виде десяти небольших пропластид, лишенных внутренних мембран и содержащих несколько проламеллярных телец, и могут восстанавливаться после воздействия света (Ahn et al., 2018). Момента времени 72 ч достаточно, чтобы пропластиды превратились в зрелые функциональные хлоропласты, превратившись из лейкоцитов в зеленые клетки (рис. 1). Это также может быть подтверждено двумерным гель-электрофорезом для обнаружения белков пигмента хлоропластов по временным рядам в E. gracilis (Monroy et al., 1987). Очевидно, что белки, связанные с фотосинтезом, и светособирающие группы белков, наконец, могут активироваться у WT после воздействия света (рис. 4). Хотя в WT было проведено много исследований по изучению развития хлоропластов под воздействием света, в этом случае нет сообщений об обесцвеченных мутантах. Наиболее известным примером бесцветной эвглениды является E. longa , вид, очень близкий к E. gracilis 9.0004 . Он потерял большую часть фотосинтетических генов с спящими пластидами (Gockel, Hachtel, 2000). У B2 все еще есть остаточные хлоропласты и отсутствуют многие гены в пластидных геномах, но не все из них (Qin et al., 2020). Эти остаточные пластиды можно наблюдать с помощью просвечивающей электронной микроскопии (Kivic and Vesk, 1974). В качестве первого исследования мы обнаружили, что B2 также имел сходную реакцию на свет, но уровень дифференциальной экспрессии был относительно ниже, чем у WT (рис. 5). Это может объяснить, почему B2 все еще обладал светорегулируемыми свойствами в этом исследовании.
4). Хотя в WT было проведено много исследований по изучению развития хлоропластов под воздействием света, в этом случае нет сообщений об обесцвеченных мутантах. Наиболее известным примером бесцветной эвглениды является E. longa , вид, очень близкий к E. gracilis 9.0004 . Он потерял большую часть фотосинтетических генов с спящими пластидами (Gockel, Hachtel, 2000). У B2 все еще есть остаточные хлоропласты и отсутствуют многие гены в пластидных геномах, но не все из них (Qin et al., 2020). Эти остаточные пластиды можно наблюдать с помощью просвечивающей электронной микроскопии (Kivic and Vesk, 1974). В качестве первого исследования мы обнаружили, что B2 также имел сходную реакцию на свет, но уровень дифференциальной экспрессии был относительно ниже, чем у WT (рис. 5). Это может объяснить, почему B2 все еще обладал светорегулируемыми свойствами в этом исследовании.
Индуцированное светом развитие хлоропластов зависело от времени. У WT существовал 12-часовой лаг-период для активации системы фотосинтеза, в результате чего не было существенной разницы между WT 0 ч и WT 12 ч. В предыдущих исследованиях накопление хлорофилла демонстрировало 12-часовой лаг-период за счет фотоиндукции накопления LHCP (светособирающий хлорофилл a/b-связывающий белок фотосистемы) II (Schwartzbach et al., 1976; Bouet et al., 1986; Weiss et al. ., 1988). Мы обнаружили, что количество DEP было увеличено, а измененные белки в основном связаны с клеточным метаболизмом, таким как связывание АТФ, активность ГТФазы, цикл трикарбоновых кислот, метаболизм пирувата, метаболизм углерода и т. д., через 12 часов (рис. 3). , 4). Возможно, поскольку активность ферментов фотосинтетической системы была нарушена функциональной недостаточностью остаточного хлоропласта, В2-клетки могут действовать при световом воздействии, но не готовы к накоплению хлорофилла. Кроме того, подавление некоторых белков (связывание АТФ, связывание несвернутого белка и фолдинг белка) или других неизвестных функциональных белков, участвующих в накоплении хлорофилла, может привести к различным реакциям на воздействие света с течением времени в B2 (кластер 2 и 3 на рис.
В предыдущих исследованиях накопление хлорофилла демонстрировало 12-часовой лаг-период за счет фотоиндукции накопления LHCP (светособирающий хлорофилл a/b-связывающий белок фотосистемы) II (Schwartzbach et al., 1976; Bouet et al., 1986; Weiss et al. ., 1988). Мы обнаружили, что количество DEP было увеличено, а измененные белки в основном связаны с клеточным метаболизмом, таким как связывание АТФ, активность ГТФазы, цикл трикарбоновых кислот, метаболизм пирувата, метаболизм углерода и т. д., через 12 часов (рис. 3). , 4). Возможно, поскольку активность ферментов фотосинтетической системы была нарушена функциональной недостаточностью остаточного хлоропласта, В2-клетки могут действовать при световом воздействии, но не готовы к накоплению хлорофилла. Кроме того, подавление некоторых белков (связывание АТФ, связывание несвернутого белка и фолдинг белка) или других неизвестных функциональных белков, участвующих в накоплении хлорофилла, может привести к различным реакциям на воздействие света с течением времени в B2 (кластер 2 и 3 на рис. 4А). Таким образом, у B2 можно было ожидать значительно более низкую или другую светочувствительность протеома по сравнению с диким типом.
4А). Таким образом, у B2 можно было ожидать значительно более низкую или другую светочувствительность протеома по сравнению с диким типом.
Однако потеря многих хлоропластных генов у B2 (Qin et al., 2020), по-видимому, не повлияла на целостность кодируемых белков в системах фотосинтеза. Результаты пути фотосинтеза KEGG для фотосинтетического транспорта электронов (включая PSI, PSII, цитохром b6f (Cyt b6f ) и АТФ-синтазу) показали белки, соответствующие их экспрессируемым генам и путям (рис. 6, 7; таблица). 3). CO 2 фиксировался в ФС I за счет отрицательного окислительно-восстановительного потенциала, в то время как молекулярный кислород и H + были получены в ФСII путем окисления воды. Комплекс Cyt b6f обеспечивает путь для пластохинона и пластоцианина, что позволяет электронам быть челноком между PSI и PSII. В то же время АТФ-синтаза управлялась протонным градиентом (Bohne et al., 2016). Все компоненты функционального генома хлоропластов обеспечивают правильное функционирование фотосинтетической системы. При сравнении WT с B2 через 72 ч было обнаружено, что белки, связанные с геном PsaC в PSI был усилен (рис. 8). Хотя ген PsaC положительно реагировал легким повторным озеленением как у WT, так и у B2, скорость синтеза соответствующего белка была высокой у WT, а не у B2. Клетки WT подвергались гораздо более быстрому клеточному делению, чем B2, в тех же условиях роста из-за неполного хлоропластного генома B2 (Qin et al., 2020). АТФаза F-типа была собрана из пяти глобулярных белков, включая α , β , γ , δ и ɛ в целом (Yagi et al., 2007). Трудно было четко объяснить связь между одной частью глобулярного белка и его физиологической ролью. В Цинь и соавт. (2020), 50 генов, связанных с хлоропластами, были исследованы на наличие B2 (OflB2 в справочной статье) с помощью ПЦР, и 37 вовлеченных генов были потеряны, но все они были обнаружены у WT. Это указывало на то, что B2 сохранил только части хлоропластного генома. Действительно, результаты аннотации генов хлоропластов с помощью протеома показали, что все белки, связанные с фотосинтезом, идентифицированные в WT, также были обнаружены в B2, но эти белки в WT были значительно активизированы по сравнению с B2 (рис.
При сравнении WT с B2 через 72 ч было обнаружено, что белки, связанные с геном PsaC в PSI был усилен (рис. 8). Хотя ген PsaC положительно реагировал легким повторным озеленением как у WT, так и у B2, скорость синтеза соответствующего белка была высокой у WT, а не у B2. Клетки WT подвергались гораздо более быстрому клеточному делению, чем B2, в тех же условиях роста из-за неполного хлоропластного генома B2 (Qin et al., 2020). АТФаза F-типа была собрана из пяти глобулярных белков, включая α , β , γ , δ и ɛ в целом (Yagi et al., 2007). Трудно было четко объяснить связь между одной частью глобулярного белка и его физиологической ролью. В Цинь и соавт. (2020), 50 генов, связанных с хлоропластами, были исследованы на наличие B2 (OflB2 в справочной статье) с помощью ПЦР, и 37 вовлеченных генов были потеряны, но все они были обнаружены у WT. Это указывало на то, что B2 сохранил только части хлоропластного генома. Действительно, результаты аннотации генов хлоропластов с помощью протеома показали, что все белки, связанные с фотосинтезом, идентифицированные в WT, также были обнаружены в B2, но эти белки в WT были значительно активизированы по сравнению с B2 (рис. 6). Подразумевалось, что функциональные гены хлоропласта в B2 все еще сохранялись и правильно функционировали на белковом уровне. Однако соответствующий геном хлоропласта для B2 был случайно потерян (Qin et al., 2020). Потенциально это было связано с различными методами обнаружения между уровнем генома и уровнем протеома. Для выяснения этого явления потребуются дальнейшие исследования.
6). Подразумевалось, что функциональные гены хлоропласта в B2 все еще сохранялись и правильно функционировали на белковом уровне. Однако соответствующий геном хлоропласта для B2 был случайно потерян (Qin et al., 2020). Потенциально это было связано с различными методами обнаружения между уровнем генома и уровнем протеома. Для выяснения этого явления потребуются дальнейшие исследования.
Основная метаболическая активность, связанная с развитием хлоропластов у E. gracilis , была связана с использованием углерода и энергии для обеспечения пролиферации. В предыдущих исследованиях E. gracilis воспринимались как более разнообразный метаболический путь использования углерода. Например, соединения C2 глиоксилатного пути имеют три судьбы, включая регуляцию цикла трикарбоновых кислот и образование серина через глицин и формиат (Hasan et al., 2019).), а также в последние годы сообщалось о С5-пути синтеза аминолевулината и метаболизма аминокислот (Vanclová et al. , 2019) и т. д. большинство из них будет разрушено под действием света. Деградация парамилума будет производить ингибиторы и разобщители, которые блокируют развитие хлоропластов E. gracilis (Fong and Schiff, 1977; Klein et al., 1972). Как мы знаем, геномы хлоропластов кодируют многие важные белки фотосинтеза, необходимые для CO 2 крепление. Все эти белки или пути регулировались светом и участвовали в метаболической активности с положительной обратной связью для способностей фотосинтеза E. gracilis . Таким образом, при усилении деградационного действия ингибиторов дыхания способность фиксации СО 2 усиливалась за счет большего синтеза хлорофилла на свету. Кроме того, белки или пути, участвующие в связывании ионов кальция, клеточном цикле и нефотосинтетической фиксации углерода, подавлялись в B2 (таблицы 2, 4). Это может быть причиной неполного развития хлоропластов у B2. При сравнении WT и B2 скорость деления клеток, биомасса и подвижность клеток у WT были более эффективными, чем у B2 во время воздействия света (Qin et al.
, 2019) и т. д. большинство из них будет разрушено под действием света. Деградация парамилума будет производить ингибиторы и разобщители, которые блокируют развитие хлоропластов E. gracilis (Fong and Schiff, 1977; Klein et al., 1972). Как мы знаем, геномы хлоропластов кодируют многие важные белки фотосинтеза, необходимые для CO 2 крепление. Все эти белки или пути регулировались светом и участвовали в метаболической активности с положительной обратной связью для способностей фотосинтеза E. gracilis . Таким образом, при усилении деградационного действия ингибиторов дыхания способность фиксации СО 2 усиливалась за счет большего синтеза хлорофилла на свету. Кроме того, белки или пути, участвующие в связывании ионов кальция, клеточном цикле и нефотосинтетической фиксации углерода, подавлялись в B2 (таблицы 2, 4). Это может быть причиной неполного развития хлоропластов у B2. При сравнении WT и B2 скорость деления клеток, биомасса и подвижность клеток у WT были более эффективными, чем у B2 во время воздействия света (Qin et al. , 2020). Белок, связывающий кальций, регулирует множество различных белков-мишеней и играет важную роль в сигнальном пути растений (Pirayesh et al., 2021). Эти белки могут регулировать паттерн движения и подвижность жгутиков через сигнальный путь ионов кальция (Watanabe and Iseki, 2005). Понижающая регуляция белков ионов кальция может привести к нечувствительным реакциям фотодвижения для B2, что показало разницу с WT, как наблюдалось в исследовании (рис. 5). Деление хлоропластов происходит одновременно с делением ядра и требует высокого уровня синтеза пигмента и белка для поддержания фотосинтетической способности недавно разделенных хлоропластов. Понижающая регуляция белков или путей клеточного цикла может быть вызвана фотоиндуцированной остановкой клеточного цикла. Прогрессии клеточного цикла необходимы для фотоиндуцированных обязательств (Hagiwara et al., 2001). В исследовании предполагается нефотосинтетическая фиксация углерода. Многие белки, отнесенные к аконитатгидратазе, пирувату, фосфатдикиназы и изоцитратдегидрогеназе, были подавлены.
, 2020). Белок, связывающий кальций, регулирует множество различных белков-мишеней и играет важную роль в сигнальном пути растений (Pirayesh et al., 2021). Эти белки могут регулировать паттерн движения и подвижность жгутиков через сигнальный путь ионов кальция (Watanabe and Iseki, 2005). Понижающая регуляция белков ионов кальция может привести к нечувствительным реакциям фотодвижения для B2, что показало разницу с WT, как наблюдалось в исследовании (рис. 5). Деление хлоропластов происходит одновременно с делением ядра и требует высокого уровня синтеза пигмента и белка для поддержания фотосинтетической способности недавно разделенных хлоропластов. Понижающая регуляция белков или путей клеточного цикла может быть вызвана фотоиндуцированной остановкой клеточного цикла. Прогрессии клеточного цикла необходимы для фотоиндуцированных обязательств (Hagiwara et al., 2001). В исследовании предполагается нефотосинтетическая фиксация углерода. Многие белки, отнесенные к аконитатгидратазе, пирувату, фосфатдикиназы и изоцитратдегидрогеназе, были подавлены. Эти белки участвуют в углеродном обмене. Наиболее исполнительной функцией хлоропластов является фиксация углерода и предоставление триозофосфатов для биосинтеза аминокислот, углеводов и жирных кислот (Kamikawa et al., 2017; Hasan et al., 2019).). Потребуются дальнейшие исследования для проверки сложного механизма нефотосинтетической фиксации углерода у Euglena .
Эти белки участвуют в углеродном обмене. Наиболее исполнительной функцией хлоропластов является фиксация углерода и предоставление триозофосфатов для биосинтеза аминокислот, углеводов и жирных кислот (Kamikawa et al., 2017; Hasan et al., 2019).). Потребуются дальнейшие исследования для проверки сложного механизма нефотосинтетической фиксации углерода у Euglena .
Заявление о доступности данных
Наборы данных, представленные в этом исследовании, можно найти в онлайн-репозиториях. Протеомные данные масс-спектрометрии были переданы в Консорциум ProteomeXchange через партнерский репозиторий PRIDE с идентификатором набора данных PXD030414.
Вклад авторов
ZFC и JW задумали и разработали эксперименты. ZFC проводил эксперименты. JH и JZ помогали проводить эксперименты. ZXC обработал данные; ZFC написал рукопись. AL, JW, QL и HZ предложили помощь в этом проекте и/или отредактировали рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все утверждения, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Благодарности
Мы благодарим Центр инструментального анализа Шэньчжэньского университета за помощь в анализе с помощью инвертированного микроскопа. Эта работа была частично поддержана Национальной ключевой программой исследований и разработок Китая (2018YFA0
0; 2020YFA03; 2021YFA0
0) и Национальным фондом естественных наук Китая (41876188).
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www. frontiersin.org/articles/10.3389/fbioe.2022.843414/full#supplementary-material
frontiersin.org/articles/10.3389/fbioe.2022.843414/full#supplementary-material
Ссылки
Ан С.Ю., Басра И., Лю К. и Сахота П. (2018). Влияние темноты на длину хлоропластов Euglena Gracilis с течением времени. Экспедиция 8, 1–19.
Google Scholar
Боне А.-В., Швенкерт С., Гримм Б. и Никельсен Дж. (2016). Роль белков тетратрикопептидных повторов в биогенезе фотосинтетического аппарата. Междунар. Рев. ячейка Мол. биол. 324, 187–227. doi:10.1016/bs.ircmb.2016.01.005
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Буэ К., Шанц Р., Дюбертре Г., Пино Б. и Ледойгт Г. (1986). Трансляционная регуляция синтеза белка во время индуцированного светом развития хлоропластов у Euglena . Планта 167, 511–520. doi:10.1007/bf003
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
Канталапьедра С.П., Эрнандес-Плаза А., Летуник И., Борк П. и Уэрта-Сепас Дж. (2021). eggNOG-Mapper V2: Функциональная аннотация, назначение ортологии и предсказание домена в метагеномном масштабе. Мол. биол. Эвол. 38, 5825–5829. doi:10.1093/molbev/msab293
(2021). eggNOG-Mapper V2: Функциональная аннотация, назначение ортологии и предсказание домена в метагеномном масштабе. Мол. биол. Эвол. 38, 5825–5829. doi:10.1093/molbev/msab293
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коман К., Солари Ф. А., Хентшель А., Сикманн А., Захеди Р. П. и Арендс Р. (2016). Одновременная экстракция метаболитов, белков и липидов (SIMPLEX): комбинаторный мультимолекулярный подход к системной биологии. мол. Клеточная протеомика 15, 1435–1466. doi:10.1074/mcp.m115.053702
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Конеса, А., и Нуеда, М. (2018). MaSigPro: Значительные различия профилей экспрессии генов в данных экспрессии генов с течением времени. Пакет R версии 1.54.0. Доступно по адресу: http://bioinfo.cipf.es/.
Google Scholar
Эпштейн Х.Т. и Шифф Дж.А. (1961). Исследования развития хлоропластов у эвглены. 4. Электронная и флуоресцентная микроскопия пропластиды и ее превращение в зрелый хлоропласт. J. Протозоол. 8, 427–432. doi:10.1111/j.1550-7408.1961.tb01238.x
J. Протозоол. 8, 427–432. doi:10.1111/j.1550-7408.1961.tb01238.x
Полнотекстовая перекрестная ссылка | Google Scholar
Фонг Ф. и Шифф Дж. (1977). Митохондриальное дыхание и развитие хлоропластов у Euglena-Gracilis Var Bacillaris . Физиол растений. 59, 92.
Google Scholar
Гибор А. и Граник С. (1962). Пластидная система нормальной и отбеленной Euglena Gracilis*. J. Протозоол. 9, 327–334. doi:10.1111/j.1550-7408.1962.tb02628.x
Полный текст CrossRef | Академия Google
Гиссибл А., Сан А., Кэр А., Невалайнен Х. и Сунна А. (2019). Биопродукты из Euglena Gracilis : Синтез и применение. Фронт. биоинж. Биотехнолог. 7, 108. doi:10.3389/fbioe.2019.00108
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гокель Г. и Хахтель В. (2000). Полная карта генов пластидного генома нефотосинтетического эвгленоидного жгутиконосца Astasia Longa . Протист 151, 347–351. doi:10.1078/s1434-4610(04)70033-4
Протист 151, 347–351. doi:10.1078/s1434-4610(04)70033-4
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Хагивара С.-Ю., Такахаши М., Ямагиши А., Чжан Ю. и Гото К. (2001). Новые результаты, касающиеся фотоиндуцированной приверженности клеток G1-, S- и G2-фаз к переходам клеточного цикла в темноте и индуцированным темнотой арестам G1-, S- и G2-фаз у эвглены. Фотохим. Фотобиол. 74, 726–733. doi:10.1562/0031-8655(2001)074<0726:nfrpco>2.0.co;2
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Халлик, Р. Б., Хонг, Л., Драгер, Р. Г., Фавро, М. Р., Монфорт, А., Орсат, Б., и др. (1993). Полная последовательность ДНК хлоропластов Euglena gracilis . Нукл. Кислоты рез. 21, 3537–3544. doi:10.1093/nar/21.15.3537
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хасан М.Т., Сун А., Хативада Б., Маккуэйд Л., Мирзаи М., Тео Дж. и др. (2019). Сравнительное протеомное исследование центрального метаболизма углерода у Euglena Gracilis Выращивается в условиях преимущественно фототрофных, миксотрофных и гетеротрофных культур. Водорослевые рез. 43, 101638. doi:10.1016/j.algal.2019.101638
Водорослевые рез. 43, 101638. doi:10.1016/j.algal.2019.101638
CrossRef Full Text | Google Scholar
Хейцман П., Сальвадор Г. Ф. и Нигон В. (1976). Появление пластидиальных рРНК и пластидиальных структур у обесцвеченных мутантов Euglena Gracilis . Экспл. Сотовый рез. 99, 253–260. doi:10.1016/0014-4827(76)
-4
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Huerta-Cepas, J., Szklarczyk, D., Heller, D., Hernández-Plaza, A., Forslund, S.K., Cook, H., et al. (2019). eggNOG 5.0: иерархический, функционально и филогенетически аннотированный ортологический ресурс, основанный на 5090 организмах и 2502 вирусах. Рез. нуклеиновых кислот. 47, Д309–Д314. doi:10.1093/nar/gky1085
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Камикава Р., Муг Д., Заунер С., Танифудзи Г., Исида К.-И., Мияшита Х. и др. (2017). Нефотосинтезирующая диатомовая водоросль демонстрирует ранние этапы редуктивной эволюции в пластидах. Мол. биол. Эвол. 34, 2355–2366. doi:10.1093/molbev/msx172
Мол. биол. Эвол. 34, 2355–2366. doi:10.1093/molbev/msx172
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Канехиса М., Сато Ю. и Моришима К. (2016). BlastKOALA и GhostKOALA: инструменты KEGG для функциональной характеристики последовательностей генома и метагенома. Дж. Мол. биол. 428, 726–731. doi:10.1016/j.jmb.2015.11.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кивич П.А. и Веск М. (1974). Электронный микроскоп в поисках пластид в обесцвеченном Euglena Gracilis и Astasia Longa . Кан. Дж. Бот. 52, 695–699. doi:10.1139/b74-089
Полный текст CrossRef | Google Scholar
Кляйн С., Шифф Дж. А. и Холовинский А. В. (1972). События, связанные с ранним развитием хлоропластов эвглены. Биология развития. 28, 253–273. doi:10.1016/0012-1606(72)-x
Полнотекстовая перекрестная ссылка | Google Scholar
Коттупарамбил С., Танкамони Р. Л. и Агусти С. (2019 г.). Euglena как потенциальный природный источник метаболитов с добавленной стоимостью. Обзор. Водорослевые рез. 37, 154–159. doi:10.1016/j.algal.2018.11.024
Л. и Агусти С. (2019 г.). Euglena как потенциальный природный источник метаболитов с добавленной стоимостью. Обзор. Водорослевые рез. 37, 154–159. doi:10.1016/j.algal.2018.11.024
Полный текст CrossRef | Google Scholar
Козиол, А. Г., и Дернфорд, Д. Г. (2008). Euglena Светособирающие комплексы кодируются многообразными полипротеиновыми мРНК, которые развиваются согласованно. мол. биол. Эвол. 25, 92–100. doi:10.1093/molbev/msm232
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Маркунас, К.М., и Тример, Р.Е. (2016). Эволюционная история ферментов, участвующих в цикле Кальвина-Бенсона у эвгленид. Дж. Эукариот. микробиол. 63, 326–339. doi:10.1111/jeu.12282
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Маруяма С., Судзаки Т., Вебер А. П., Арчибальд Дж. М. и Нодзаки Х. (2011). Перенос генов от эукариот к эукариотам приводит к мозаицизму генома у эвгленид. BMC Evol. биол. 11, 105–111. дои: 10.1186/1471-2148-11-105
BMC Evol. биол. 11, 105–111. дои: 10.1186/1471-2148-11-105
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Мокросноп В. М. (2018). Производство запасного полисахарида парамилона в микроводорослях Euglena Gracilis Klebs ( Euglena , Euglenophyceae). Интер. Дж. Водоросли 20, 153–166. doi:10.1615/interjalgae.v20.i2.40
Полный текст CrossRef | Google Scholar
Монрой А.Ф., Маккарти С.А. и Шварцбах С.Д. (1987). Доказательства трансляционной регуляции биогенеза хлоропластов и митохондрий у Эвглена . Науки о растениях. 51, 61–76. doi:10.1016/0168-9452(87)
-4Полный текст CrossRef | Google Scholar
Новак Ванцлова А. М. Г., Золтнер М., Келли С., Соукал П., Захонова К., Фюсси З. и др. (2020). Метаболические причуды и красочная история вторичного пластида Euglena Gracilis . Новый Фитол. 225, 1578–1592. doi:10.1111/nph.16237
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Оливерос, Дж. (2016). Венни. Интерактивный инструмент для сравнения списков с диаграммами Венна. 2007–2015 гг. Доступно по адресу: https://bioinfogp.cnb.csic.es/tools/venny/index.html.
(2016). Венни. Интерактивный инструмент для сравнения списков с диаграммами Венна. 2007–2015 гг. Доступно по адресу: https://bioinfogp.cnb.csic.es/tools/venny/index.html.
Google Scholar
Осафун Т. и Шифф Дж. А. (1983). W10BSmL, мутант Euglena Gracilis Var. Bacillaris Отсутствие пластидов. Экспл. Сотовый рез. 148, 530–535. doi:10.1016/0014-4827(83)-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пираеш Н., Гиридхар М., Бен Хедер А., Воткнехт У. К. и Чигри Ф. (2021). Сигнализация органелларного кальция в растениях: обновление. Биохим. Биофиз. Акта Мол. Сотовое разрешение 1868, 118948. doi:10.1016/j.bbamcr.2021.118948
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цинь Х., Го К., Лю К., Ли Ф., Чжан Х., Чу З. и др. (2020). Возникновение и реакция на свет остаточных пластидных генов в обесцвеченном мутантном штамме Euglena Gracilis OflB2. Дж. Оушен. Лимнол. 38, 1858–1866 гг. doi:10.1007/s00343-019-9159-9
Дж. Оушен. Лимнол. 38, 1858–1866 гг. doi:10.1007/s00343-019-9159-9
CrossRef Full Text | Google Scholar
Schwartzbach, SD (2017). «Регламент фото и питания Euglena Organelle Development», в Euglena : Биохимия, клеточная и молекулярная биология . Редакторы С. Д. Шварцбах и С. Шигеока (Швейцария: Springer), 159–182. doi:10.1007/978-3-319-54910-1_9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шварцбах, С. Д., Шифф, Дж. А., и Кляйн, С. (1976). Биосинтетические события, необходимые для устранения задержки в синтезе хлорофилла в Euglena . Планта 131, 1–9. doi:10.1007/bf00387337
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
Шварцбах, С. Д., и Шигеока, С. (2017). Эвглена : Биохимия, клеточная и молекулярная биология . Швейцария: Спрингер.
Google Scholar
Шибата К., Бенсон А.А. и Кальвин М. (1954). Спектры поглощения взвесей живых микроорганизмов. Биохим. Биофиз. Acta 15, 461–470. doi:10.1016/0006-3002(54)
Биохим. Биофиз. Acta 15, 461–470. doi:10.1016/0006-3002(54)
-5
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Стерн А. И., Шифф Дж. А. и Эпштейн Х. Т. (1964). Исследования развития хлоропластов у Euglena . V. Биосинтез пигмента, фотосинтетическое выделение кислорода и фиксация углекислого газа во время развития хлоропластов. Физиол растений. 39, 220–226. doi:10.1104/pp.39.2.220
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тамаки С., Танно Ю., Като С., Одзаса К., Вакадзаки М., Сато М. и др. (2020). Накопление каротиноидов в аппарате глазного пятна, необходимом для фототаксиса, не зависит от развития хлоропластов у Эвглена Грацилис . Науки о растениях. 298, 110564. doi:10.1016/j.plantsci.2020.110564
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Томечкова Л., Томчала А., Оборник М. и Хэмпл В. (2020). Липидный состав средней пластидной мембраны Euglena Gracilis напоминает состав первичных пластидных оболочек. Физиол растений. 184, 2052–2063.
Физиол растений. 184, 2052–2063.
Реферат PubMed | Google Scholar
Торихара К. и Кисимото Н. (2015). Оценка характеристик роста Euglena Gracilis для производства биомассы микроводорослей с использованием сточных вод. Дж. Ват. Окружающая среда Тех. 13, 195–205. doi:10.2965/jwet.2015.195
Полный текст CrossRef | Google Scholar
Ванцлова А. М. Н., Золтнер М., Келли С., Соукал П., Захонова К., Фюсси З. и др. (2019). Протеом вторичной пластиды Euglena Gracilis Раскрывает метаболические причуды и красочную историю . bioRxiv, 573709.
Google Scholar
Ватанабе М. и Исеки М. (2005). «Открытие и характеристика фотоактивированной аденилатциклазы (PAC), нового флавопротеина рецептора синего света, из Euglena Gracilis », в Справочнике фотосенсорных рецепторов (Хобокен, Нью-Джерси: онлайн-библиотека Wiley), 447–460. doi:10.1002/352760510x.ch32
Полный текст CrossRef | Google Scholar
Вайс, К. , Ульне, Г., Шанц, М.-Л., и Шанц, Р. (1988). Фоторегуляция синтеза белков хлоропластной мембраны Euglena Gracilis . J. Физиол растений. 133, 521–528. doi:10.1016/s0176-1617(88)80001-4
, Ульне, Г., Шанц, М.-Л., и Шанц, Р. (1988). Фоторегуляция синтеза белков хлоропластной мембраны Euglena Gracilis . J. Физиол растений. 133, 521–528. doi:10.1016/s0176-1617(88)80001-4
Полный текст CrossRef | Академия Google
Яги Х., Кадзивара Н., Танака Х., Цукихара Т., Като-Ямада Ю., Йошида М. и др. (2007). Структуры термофильной субъединицы F1-АТФазы, предполагающие АТФ-регулируемое движение ее С-концевого домена в F1. Проц. Натл. акад. науч. 104, 11233–11238. doi:10.1073/pnas.0701045104
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Yi, LSH, Gilbert, CW, and Buetow, D.E. (1985). Временное появление хлорофилл-белковых комплексов и N,N-дициклогексилкарбодиимид-связывающего связывающего фактора 0?Субъединицы III в формировании тилакоидных мембран Euglena gracilis. J. Физиол растений. 118, 7–21. doi:10.1016/s0176-1617(85)80160-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ю Г. , Ван Л.-Г., Хан Ю. и Хе К.-Ю. (2012). ClusterProfiler: пакет R для сравнения биологических тем среди кластеров генов. OMICS: A J. Integr. биол. 16, 284–287. doi:10.1089/omi.2011.0118
, Ван Л.-Г., Хан Ю. и Хе К.-Ю. (2012). ClusterProfiler: пакет R для сравнения биологических тем среди кластеров генов. OMICS: A J. Integr. биол. 16, 284–287. doi:10.1089/omi.2011.0118
Полный текст CrossRef | Google Scholar
Закрысь Б., Милановский Р. и Карнковска А. (2017). «Эволюционное происхождение Euglena », в Euglena : Биохимия, клеточная и молекулярная биология . Редакторы С. Д. Шварцбах и С. Шигеока (Швейцария: Springer), 3–17.
Google Scholar
Эвглена зеленая со жгутиками и органеллами Векторное изображение
Эвглена зеленая со жгутиками и органеллами Векторное изображение- лицензионные векторы
- Органеллы Векторы
ЛицензияПодробнее
Стандарт Вы можете использовать вектор в личных и коммерческих целях. Расширенный
Вы можете использовать вектор на предметах для перепродажи и печати по требованию.
Расширенный
Вы можете использовать вектор на предметах для перепродажи и печати по требованию.Тип лицензии определяет, как вы можете использовать этот образ.
| Станд. | Расшир. | |
|---|---|---|
| Печатные/Редакционные | ||
| Графический дизайн | ||
| Веб-дизайн | ||
| Социальные сети | ||
| Редактировать и изменять | ||
| Многопользовательский | ||
| Предметы перепродажи | ||
| Печать по требованию |
Способы покупкиСравнить
Плата за изображение € 14,99 Кредиты € 1,00 Подписка € 0,69 Оплатить стандартные лицензии можно тремя способами. Цены евро евро .
Цены евро евро .
| Оплата с | Цена изображения |
|---|---|
| Плата за изображение € 14,99 Одноразовый платеж | |
| Предоплаченные кредиты € 1 Загружайте изображения по запросу (1 кредит = 1 евро). Минимальная покупка 30р. | |
| План подписки От 0,69 € Выберите месячный план. Неиспользованные загрузки автоматически переносятся на следующий месяц. | |
Способы покупкиСравнить
Плата за изображение € 39,99 Кредиты € 30,00Существует два способа оплаты расширенных лицензий. Цены евро евро .
| Оплата с | Стоимость изображения |
|---|---|
Плата за изображение € 39,99 Оплата разовая, регистрация не требуется. | |
| Предоплаченные кредиты € 30 Загружайте изображения по запросу (1 кредит = 1 евро). | |
Дополнительные услугиПодробнее
Настроить изображение Доступно только с оплатой за изображение € 85,00Нравится изображение, но нужны лишь некоторые модификации? Пусть наши талантливые художники сделают всю работу за вас!
Мы свяжем вас с дизайнером, который сможет внести изменения и отправить вам изображение в выбранном вами формате.
Примеры
- Изменить текст
- Изменить цвета
- Изменить размер до новых размеров
- Включить логотип или символ
- Добавьте название своей компании или компании
Включенные файлы
Подробности загрузки…
- Идентификатор изображения
- 32375211
- Цветовой режим
- RGB
- Художник
- ВарисВорон
Обогатите свой разум этими умопомрачительными фактами об Эвглене
Нравится? Поделись!
Euglena — это одноклеточные организмы, встречающиеся как в пресных, так и в соленых водах, где они процветают в количествах, достаточных для окрашивания верхней части этих водоемов. Предстоящие отрывки обязательно обогатят ваши знания об этом уникальном жгутиковом организме.
Предстоящие отрывки обязательно обогатят ваши знания об этом уникальном жгутиковом организме.
Эвглена — одноклеточный эукариотический организм. Он принадлежит к королевству Protista и является наиболее широко изученным представителем типа Euglenophyta/Euglenozoa. Его можно найти в пресноводных источниках, таких как тихая лужа или пруд, и даже в плавательном бассейне. Некоторые виды могут образовывать дыхательные пузырьки, которые предотвращают их высыхание. По сути, он служит источником пищи для морских тварей и рыб. Его можно описать как тип простейших, обладающий смешанными характеристиками как растений, так и животных. Он похож на растения, потому что может готовить себе пищу путем фотосинтеза.
Его сходство с животными заключается в том, что он может перемещаться из одного места в другое и питаться пищей, как животные, путем гетеротрофии. Он окружает пищевую частицу и потребляет ее путем фагоцитоза, действуя как гетеротроф. Известно, что существует три режима питания. Первый — это голозойный режим, который включает прием твердой видимой пищи. Второй — сапрозойный режим, который включает прием пищи в растворимой форме. Последняя является голофитной формой, в которой с помощью фотосинтеза простейшее способно синтезировать сложные органические соединения. Царство Protista также состоит из других форм жизни, таких как амебы и парамеции.
Первый — это голозойный режим, который включает прием твердой видимой пищи. Второй — сапрозойный режим, который включает прием пищи в растворимой форме. Последняя является голофитной формой, в которой с помощью фотосинтеза простейшее способно синтезировать сложные органические соединения. Царство Protista также состоит из других форм жизни, таких как амебы и парамеции.
Этот одноклеточный организм имеет ряд органелл для выполнения различных важных функций организма. Помимо этого, у него есть и другие биологические особенности, которые делают его своеобразным существом.
- Эвглена имеет овальную форму тела с круглой передней частью и конической задней частью. Внешняя часть его клеточной мембраны состоит из жесткой пленки, которая позволяет ему сохранять свою форму.
- Ярко-зеленый цвет тела этого организма обусловлен наличием хлоропластов внутри его клетки. Хлоропласты эвглены совершенно уникальны, потому что они окружены тремя мембранами, в то время как хлоропласты растений имеют только две мембраны.
 В отличие от растений, у этого организма отсутствует клеточная стенка из целлюлозы. Скорее, у него есть пленка, состоящая из белкового слоя, поддерживаемого микротрубочками. Он расположен полосами, закручивающими всю клетку по спирали. На самом деле его чудесная гибкость и способность к сокращению объясняются действием этих полосок пелликулы, скользящих одна по другой.
В отличие от растений, у этого организма отсутствует клеточная стенка из целлюлозы. Скорее, у него есть пленка, состоящая из белкового слоя, поддерживаемого микротрубочками. Он расположен полосами, закручивающими всю клетку по спирали. На самом деле его чудесная гибкость и способность к сокращению объясняются действием этих полосок пелликулы, скользящих одна по другой.
- Известно, что хлоропласты содержат пиреноиды, которые используются в синтезе парамилона. Этот парамилон, форма хранения энергии крахмала, помогает организму пережить длительные периоды лишения света. Наличие пиреноидов является наиболее отличительной чертой этого рода.
- Все эвгленоиды обладают двумя жгутиками, укорененными в базальных телах. Один жгутик очень короткий (не выступает из клетки), а другой представляет собой длинную хлыстообразную штуку, прикрепленную с правой стороны, ближе к передней части тела. Этот длинный жгутик работает как пропеллер и помогает ему передвигаться по воде.

- Центральную часть клетки занимает ядро фиолетового цвета. Он несет ДНК клетки и участвует в нескольких жизненно важных клеточных процессах. Ядрышко (множественное число ядрышек), присутствующее внутри ядра, можно идентифицировать по его розовому цвету. Внутренняя часть клетки заполнена светло-желтой вязкой жидкостью, известной как цитоплазма.
- Отличительной чертой Euglena является то, что она является как автотрофной, так и гетеротрофной. Другими словами, он может производить свою собственную пищу с помощью фотосинтеза, но он также потребляет пищу из окружающей среды, когда недостаточно солнечного света. В этом случае он перемещается в воде и поедает другие микроорганизмы, такие как амебы и парамеции.
- Когда еды мало или в условиях низкой влажности, Euglena образует вокруг себя защитную стену. В этот период он находится в состоянии покоя в виде покоящейся кисты, пока условия окружающей среды не улучшатся.
- Еще одна интересная физическая особенность — красное глазное пятно.
 Это пигментированная органелла, расположенная в передней части тела и очень чувствительная к свету. Эта адаптация чрезвычайно важна, так как помогает обнаруживать солнечный свет, необходимый для фотосинтеза. Как только солнечный свет отслеживается глазным пятном, организм может ориентировать свои движения в этом направлении — процесс, известный как фототаксис.
Это пигментированная органелла, расположенная в передней части тела и очень чувствительная к свету. Эта адаптация чрезвычайно важна, так как помогает обнаруживать солнечный свет, необходимый для фотосинтеза. Как только солнечный свет отслеживается глазным пятном, организм может ориентировать свои движения в этом направлении — процесс, известный как фототаксис.
- На заднем конце клетки находится звездчатая структура, называемая сократительной вакуолью оранжевого цвета. Помогает выведению лишней воды и шлаков из организма. В отсутствие этой органеллы она всосала бы достаточное количество воды за счет осмоса, что привело бы к взрыву клетки.
- Эти организмы размножаются в процессе деления клеток, известном как митоз. В ходе этого процесса клетка делится на две половины в продольном направлении, начиная с переднего конца клетки. Это также приводит к удвоению глотки, стигмы и жгутиковых отростков. Таким образом, из одной образуются две новые Эвглены. Благоприятные условия для процесса размножения – теплая температура воздуха и достаточное количество пищи.

После прочтения всех этих интересных фактов вы должны быть рады увидеть этих существ своими глазами. Однако они настолько малы, что их невозможно увидеть невооруженным глазом. Вы должны использовать микроскоп, чтобы увидеть их близко. Когда их миллионы собираются в одном месте на поверхности водоема, они выглядят как коврик. Это очень похоже на водоросли. Они помогают поддерживать баланс в окружающей среде, поглощая углекислый газ и выделяя кислород. Они содержат большое количество каротиноидного пигмента. Итак, если вы обнаружите, что вода в болотистой местности немного красноватая, вполне возможно, что это связано с присутствием Эвглены.
Без категорий
Получайте обновления прямо в папку «Входящие»
Подпишитесь, чтобы получать последние и лучшие статьи с нашего сайта автоматически каждую неделю (плюс-минус)… прямо в папку «Входящие».
Обновления блогаАдрес электронной почты *
Компоненты органелл и основы фотосинтеза
Опубликовано 18. 03.22 автором Sarah Boudreau
03.22 автором Sarah Boudreau
Откройте свой холодильник — все вкусные вещи, которые вы там видите, либо основаны на фотосинтезе, либо съели что-то, что основано на фотосинтезе. Во время фотосинтеза фотосинтезирующие организмы синтезируют молекулы сахара из солнечного света, воды и углекислого газа. Фотосинтез происходит в хлоропластах растительных клеток, поэтому они являются причиной того, что растения (и некоторые другие организмы) могут производить пищу самостоятельно
Фотосинтез важен не только для отдельных организмов, он важен для жизни на Земле. Фотосинтез является частью глобального углеродного цикла: проще говоря, фотосинтез превращает углекислый газ в органические молекулы, а дыхание превращает эти молекулы обратно в углекислый газ.
Спасибо хлоропластам за то, что они сделали так много! В сегодняшней статье давайте рассмотрим хлоропласт и процесс фотосинтеза.
Что такое хлоропласт?
Хлоропласт представляет собой разновидность пластиды; пластиды — органеллы с двойными мембранами, участвующие в синтезе и хранении пищи. Другие пластиды включают хромопласты (которые содержат пигменты, отличные от зеленого) и лейкопласты (которые не содержат пигментов).
Другие пластиды включают хромопласты (которые содержат пигменты, отличные от зеленого) и лейкопласты (которые не содержат пигментов).
Хлоропласты наполнены хлорофиллом, большим зеленым пигментом, который оставляет пятна на коленях ваших джинсов, если вы споткнетесь и упадете на газон. Большинство водорослей и группа простейших под названием Euglena также имеют хлоропласты, а некоторые бактерии (например, цианобактерии) имеют хлорофилл, но он не находится в органеллах.
Хлорофилл растений поглощает синий и красный свет и отражает зеленый. Двумя наиболее распространенными типами хлорофилла являются a и b. Хлорофилл а есть во всех хлоропластах, а количество других типов хлорофилла различается в зависимости от вида растения.
Изображение с сайта Visible Biology.
Интересно, что хлоропласты имеют собственную ДНК. Вероятно, это связано с тем, что, как и митохондрии, когда-то они существовали отдельно от клетки. Хлоропласты, скорее всего, были прокариотическими клетками, которые были окружены более крупными эукариотическими клетками и превратились в органеллы. Не случайно ДНК хлоропластов маленькая и круглая, как ДНК бактерий.
Не случайно ДНК хлоропластов маленькая и круглая, как ДНК бактерий.
В цитоплазме фотосинтезирующих клеток имеется множество хлоропластов: эти клетки могут иметь от одного до ста хлоропластов, которые делятся, чтобы воспроизвести себя.
Части хлоропласта
Хлоропласт имеет три мембранные системы: наружную мембрану, внутреннюю мембрану и тилакоидную систему.
Тилакоиды имеют форму диска и собирают фотоны от источника света (обычно солнца). Они состоят из тилакоидной мембраны, окружающей люмен . Просвет — это место, где во время фотосинтеза происходят такие процессы, как выделение кислорода, опосредованный пластоцианином перенос электронов и фотозащита. Белки в просвете участвуют во многих других процессах, включая оборот фотосинтетических белковых комплексов. Тилакоиды расположены стопками, называемыми гранами (единственная грана).
Просвет (выделен синим цветом). Изображение из Visible Biology.
Между внутренней оболочкой и граной лежит строма , густая, богатая белком жидкость. Именно здесь происходят светонезависимые реакции фотосинтеза, но об этом мы скоро услышим!
Основы фотосинтеза
Вкратце, для фотосинтеза требуются углекислый газ, вода и солнечный свет, при этом вырабатываются глюкоза и кислород.
Узнайте больше о том, что входит и что получается в результате фотосинтеза, с помощью этого кусочка видимой биологии.
В процессе фотосинтеза протекают два основных вида реакций: светозависимые и светонезависимые. Светозависимые реакции преобразуют свет в накопленную энергию, а светонезависимые реакции используют эту энергию для сборки глюкозы.
Светозависимые реакции преобразуют свет в накопленную энергию, а светонезависимые реакции используют эту энергию для сборки глюкозы.
Мы расскажем вам об обеих этих категориях.
Светозависимые реакции
Светозависимые реакции протекают в тилакоидной мембране. В этих реакциях организм поглощает солнечный свет, расщепляет молекулы воды, объединяет молекулы АТФ и НАДФН для хранения энергии и выделяет кислород.
Солнечный свет попадает на хлорофилл внутри тилакоидной мембраны, вызывая возбуждение электрона, который покидает молекулу хлорофилла. Когда электрон уходит, он создает вакуум на своем пути. Затем фотосистема II расщепляет молекулу воды, чтобы восстановить электрон. Фотосистемы представляют собой комплексы белков и пигментов — мы скоро услышим о фотосистеме I.
Фотосистема II (выделена синим цветом), молекулы воды расщепляются, а электроны движутся к фотосистеме I. Изображение из Visible Biology.
Когда молекула воды расщепляется, она участвует в создании АТФ: ее ионы водорода помогают ферменту АТФ-синтазе добавлять фосфатную группу к АДФ. Оставшийся атом кислорода соединяется с другим атомом кислорода, образуя O₂, и газообразный кислород высвобождается через отверстия в листьях.
Оставшийся атом кислорода соединяется с другим атомом кислорода, образуя O₂, и газообразный кислород высвобождается через отверстия в листьях.
Помните тот электрон, который покинул молекулу хлорофилла? Он движется вдоль мембраны тилакоидов, пока не достигнет фотосистемы I. Он соединяется с другим возбужденным электроном, и фермент добавляет его плюс атом водорода к НАДФ, создавая НАДФН, молекулу, запасающую энергию.
Да да! Светозависимые реакции превращают энергию солнечного света в химическую энергию.
Светонезависимые реакции (также известные как цикл Кальвина)
Светонезависимые реакции, с другой стороны, не нуждаются в свете напрямую. Светонезависимые реакции, также называемые циклом Кальвина, используют запасенную энергию светозависимых реакций для преобразования углерода из углекислого газа, чтобы его можно было использовать для создания углеводов, таких как глюкоза. Эти реакции происходят в строме.
Строма выделена синим цветом. Изображение из «Видимой биологии».
Изображение из «Видимой биологии».
Во время светонезависимых реакций фермент объединяет молекулу двуокиси углерода с молекулой, называемой рибулозобифосфатом (РБФ). Образовавшаяся 6-углеродная молекула распадается на две 3-углеродные молекулы. Затем каждой из этих 3-углеродных молекул (называемых 3-фосфоглицератом или 3-PGA) придается атом водорода, создавая глицеральдегид-3-фосфат, также известный как G3P.
G3P можно использовать для создания сахаров — объедините две молекулы G3P, и что вы получите? Глюкоза!
Цикл Кальвина производит двенадцать молекул G3P: две из них используются для получения глюкозы, а остальные десять перерабатываются в RuBP. Затем цикл может продолжаться, создавая все больше и больше глюкозы.
Растения используют глюкозу по-разному. Прежде всего, это источник энергии. Он также используется для производства целлюлозы, основного строительного материала растений. Глюкоза также может присоединяться к белкам и липидам, делая их более растворимыми.

 РФ
РФ