подцарство Одноклеточные животные. Свободноживущие одноклеточные Амеба протей, Эвглена зеленая, Инфузория туфелька
Тема: подцарство Одноклеточные
Цель: изучить разнообразие свободноживущих одноклеточных животных.
Контрольные вопросы темы:
· Общая характеристика подцарства Одноклеточные. Классификация (т.е. подразделение на типы) подцарства Одноклеточные.
· Систематическое положение, образ жизни, строение тела, размножение, значение в природе и для человека Амебы обыкновенной, Эвглены зеленой, Инфузории туфельки.
Домашнее задание: Составить таблицу «Свободноживущие одноклеточные»
Таблица — Свободноживущие одноклеточные.
| Среда обитания | Размеры тела | Форма тела | Органоиды передвижения | Питание | Дыхание | Выделение | Размножение | Роль в природе |
Амеба обыкновенная |
|
|
|
|
|
|
|
| |
Эвглена зеленая |
|
|
|
|
|
|
|
|
|
Инфузория-туфелька |
|
|
|
|
|
|
|
|
|
ОБЗОР СВОБОДНОЖИВУЩИХ ОДНОКЛЕТОЧНЫХ
В
подцарстве Одноклеточные выделяют пять типов животных: Тип Саркомастигофоры,
Тип Споровики, Тип Микроспоридии, Тип Книдоспоридии, Тип Инфузории. Свободноживущие виды встречаются среди представителей типов Саркомастигофоры и Инфузории.
Свободноживущие виды встречаются среди представителей типов Саркомастигофоры и Инфузории.
Амеба обыкновенная – вид Amoeba proteus (тип Саркомастигофоры, класс Саркодовые) обитает в воде в прудах, канавах с илистым дном. Похожа эта Амеба на крошечную капельку киселя, которая постоянно изменяет форму своего тела. Размеры ее тела достигают 0,2 — 0,7 мм.
Строение. Тело Амебы покрыто цитоплазматической мембраной, за которой идет слой прозрачной плотной эктоплазмы. Далее располагается полужидкая эндоплазма, составляющая основную массу амебы. В цитоплазме есть ядро. Цитоплазма находится в непрерывном движении, в результате которого возникают цитоплазматические выросты — псевдоподии, или ложноножки. Псевдоподии служат для передвижения и для поглощения частиц пищи.
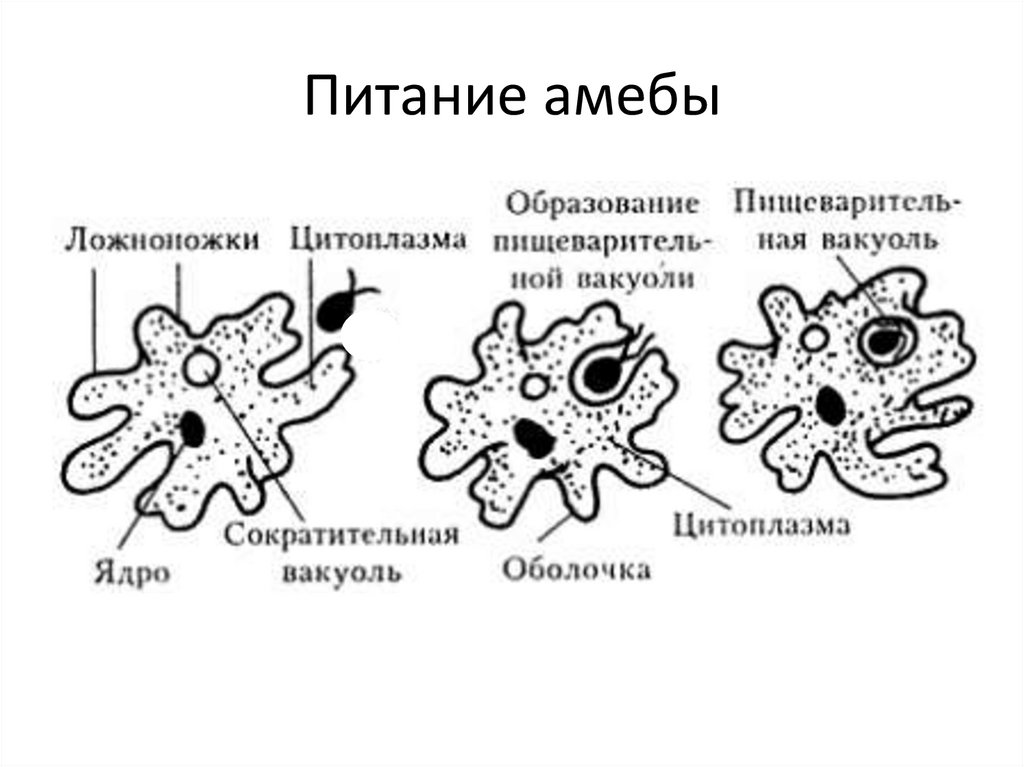
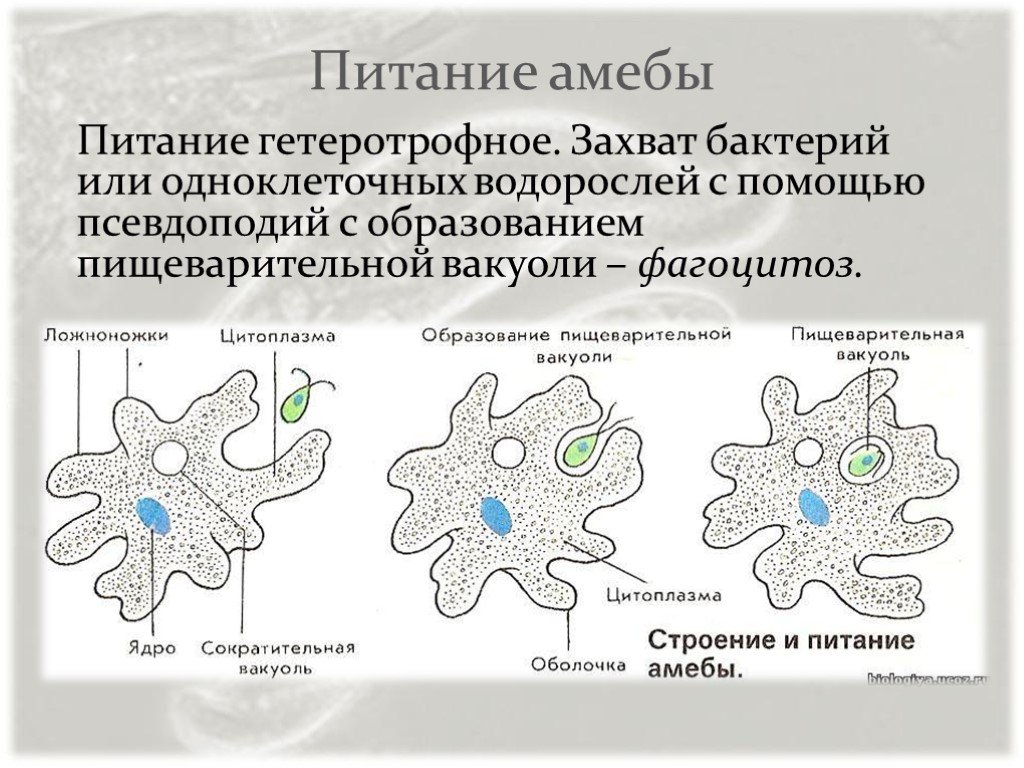
Питание. Амеба охватывает
пищевые частицы (бактерии, водоросли) ложноножками и втягивает их внутрь тела.
Вокруг бактерий образуются пищеварительные вакуоли.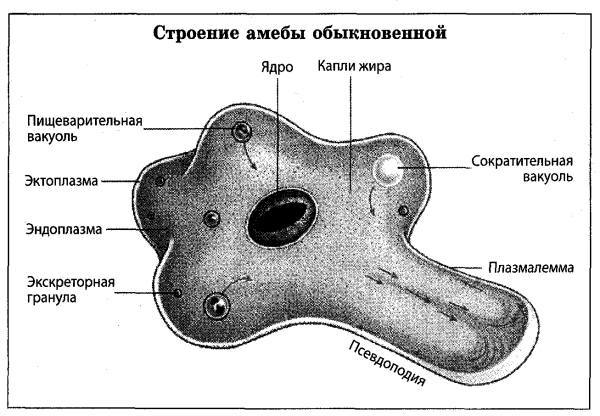 В них
благодаря ферментам происходит переваривание пищи. Вакуоли с не переваренными
остатками подходят к поверхности тела, и эти остатки выбрасываются наружу.
В них
благодаря ферментам происходит переваривание пищи. Вакуоли с не переваренными
остатками подходят к поверхности тела, и эти остатки выбрасываются наружу.
Выделение. Жидкие продукты жизнедеятельности выделяются через сократительную, или иначе пульсирующую вакуоль. Вода из окружающей среды постоянно поступает в тело Амебы осмотически через наружную мембрану. Концентрация веществ в теле Амебы выше, чем в пресной воде. Это создает разность осмотического давления внутри и вне тела простейшего. Сократительная вакуоль периодически удаляет избыток воды из тела Амебы. Промежуток между двумя пульсациями равен 1-5 мин. Сократительная вакуоль выполняет также функцию дыхания.
Дыхание. Амеба дышит растворенным в воде кислородом всей поверхностью тела. Насыщенная диоксидом углерода вода удаляется из организма через сократительную вакуоль.
Размножение. Амеба
размножается бесполым путем — делением тела (клетки) на двое.
Сначала втягиваются псевдоподии и Амеба округляется. Затем происходит деление
ядра митозом. На теле Амебы появляется перетяжка, которая
перешнуровывает его на две равные части. В каждую из них отходит по одному ядру.
Летом при благоприятных условиях в теплой воде Амеба размножается раз в сутки.
Затем происходит деление
ядра митозом. На теле Амебы появляется перетяжка, которая
перешнуровывает его на две равные части. В каждую из них отходит по одному ядру.
Летом при благоприятных условиях в теплой воде Амеба размножается раз в сутки.
При наступлении холодов осенью или при отсутствии пищи, или наступлении иных не благоприятных условий Амеба инцистируется — покрывается плотной защитной оболочкой и превращается в цисту. Цисты очень малы и легко разносятся ветром, что способствует расселению Амебы.
Значение в природе. Амеба обыкновенная является элементом разнообразия жизни на Земле. Она участвует в круговороте веществ в природе. Она является составной частью пищевых цепей: Амеба питается бактериями и детритом, ею питаются мальки рыб, гидры, какие-то черви, мелкие ракообразные.
Вопросы для самоконтроля
Назовите систематическое положение Амебы обыкновенной.
Где живет Амеба обыкновенная?
Какое строение имеет Амеба обыкновенная?
Чем покрыто тело Амебы обыкновенной?
С помощью чего передвигается Амеба обыкновенная?
Как питается Амеба обыкновенная?
Как происходит выделение продуктов жизнедеятельности у амебы?
Как размножается Амеба обыкновенная?
Каково значение Амебы обыкновенной в природе?
Рис.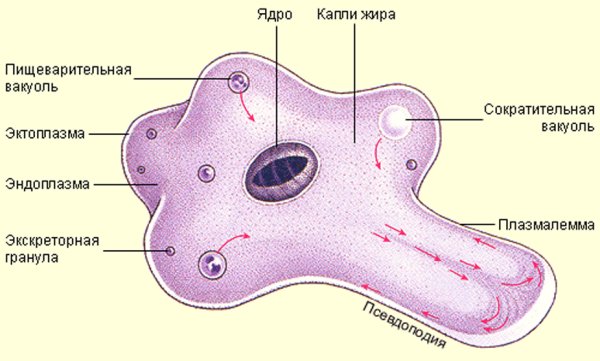 Амеба обыкновенная.
Амеба обыкновенная.
1 — пищеварительная вакуоль с «заглоченной» пищевой частицей; 2 — выделительная (сократительная) вакуоль; 3 — ядро; 4 — пищеварительная вакуоль; 5 — псевдоподии; 6 — эндоплазма; 7 — эктоплазма.
Рис. Питание и движение Амебы обыкновенной.
Рис. Размножение Амебы обыкновенной.
Рис. Циста Амебы обыкновенной (сильно увеличено).
А — циста; Б — выход амебы из цисты.
Эвглена зеленая – вид Euglena viridis (тип Саркомастигофоры, класс Жгутиковые, подкласс Растительные жгутиковые) обитает в пресных водах, канавах, болотах (в стоячей воде). Это очень своеобразный организм, находящийся на грани между растительным и животным мирами.
Строение.
Тело Эвглены длиной около 0,05 мм, имеет вытянутую веретенообразную форму. На
переднем конце тела Эвглены находится длинный и тонкий протоплазматический
вырост — жгутик, с помощью которого Эвглена осуществляет передвижение.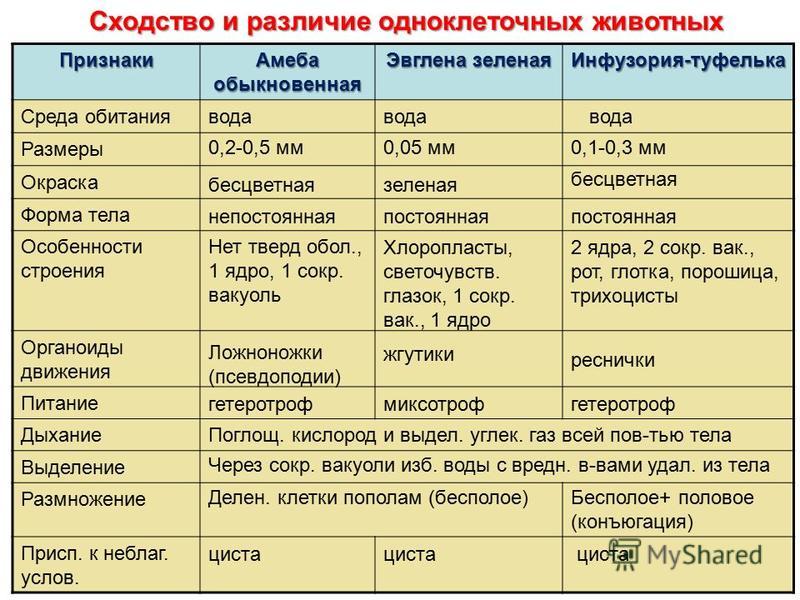 Жгутик производит винтообразные движения, как бы ввинчиваясь в воду. Действие
его можно сравнить с действием винта моторной лодки или парохода. Такое
движение более совершенно, чем передвижение с помощью ложноножек. Эвглена
передвигается значительно быстрее, чем Инфузория туфелька
или Амеба обыкновенная. Покрыто тело Эвглены цитоплазматической
мембраной, но наружный слой цитоплазмы Эвглены плотный, он образует
вокруг тела плотную оболочку —
Жгутик производит винтообразные движения, как бы ввинчиваясь в воду. Действие
его можно сравнить с действием винта моторной лодки или парохода. Такое
движение более совершенно, чем передвижение с помощью ложноножек. Эвглена
передвигается значительно быстрее, чем Инфузория туфелька
или Амеба обыкновенная. Покрыто тело Эвглены цитоплазматической
мембраной, но наружный слой цитоплазмы Эвглены плотный, он образует
вокруг тела плотную оболочку —
Питание.
Эвглена зеленая соединяет в себе черты растительных и животных организмов. В
цитоплазме находится большое количество хроматофоров, содержащих
хлорофилл. Благодаря присутствию хлорофилла Эвглена способна к фотосинтезу, как растение. На свету из углекислого газа и воды
с помощью хлорофилла Эвглена образует органические вещества.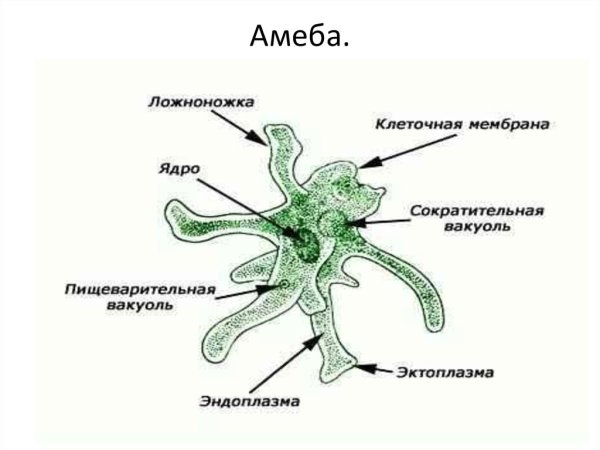 Это автотрофный тип питания. В темноте она питается готовыми органическими веществами, как
животное. Это гетеротрофный тип питания.
Таким образом, Эвглена зеленая имеет смешанный (миксотрофный) тип питания.
Это автотрофный тип питания. В темноте она питается готовыми органическими веществами, как
животное. Это гетеротрофный тип питания.
Таким образом, Эвглена зеленая имеет смешанный (миксотрофный) тип питания.
Двоякий способ питания Эвглены – чрезвычайно интересное явление. Оно указывает на общее происхождение растений и животных.
Выделение и дыхание. Выделительную функцию выполняет сократительная вакуоль. Она находится на переднем конце тела. Жидкие
продукты жизнедеятельности из сократительной вакуоли выводятся в резервуар, затем во внешнюю среду. Эвглена дышит всей поверхностью тела растворенным
в воде кислородом, а выделяет углекислый газ. Сбоку от резервуара располагается органелла ярко-красного цвета — светочувствительный глазок, или стигма. Эвглена проявляет положительный фототаксис, т.е. предпочитает хорошо освещенные участи водоема и активно сюда устремляется.
Размножение. Размножается Эвглена бесполым путем — продольным делением на двое.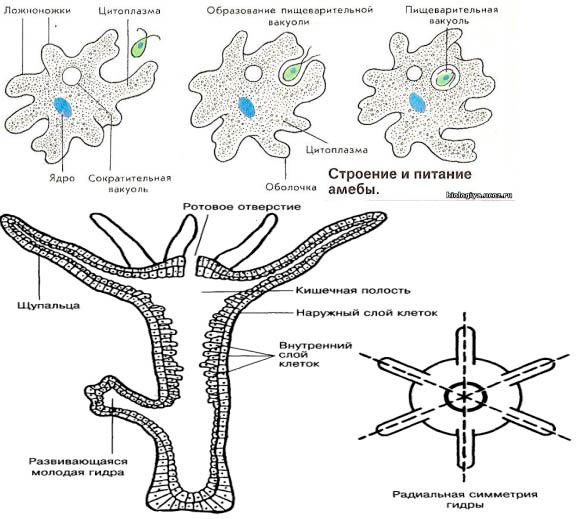 Сначала делятся ядро, хроматофоры, затем делится
цитоплазма. Жгутик отпадает или переходит к одной особи, а у другой он
образуется снова.
Сначала делятся ядро, хроматофоры, затем делится
цитоплазма. Жгутик отпадает или переходит к одной особи, а у другой он
образуется снова.
При не благоприятных условиях, например при высыхании водоёма, при наступлении холодов, при попадании в водоем каких-либо моющих или загрязняющих веществ эвглены, подобно Амёбам, образуют цисты. В таком виде они могут разноситься с пылью.
Значение в природе. Эвглена зеленая является элементом разнообразия жизни на Земле. Она участвует в круговороте веществ в природе. Она является составной частью пищевых цепей: Эвглена зеленая как водоросль продуцирует органическое вещество, ею питаются рыбы, гидры, какие-то мелкие черви, мелкие ракообразные. Вместе с Сине-зелеными Эвглена зеленая участвует в явлении «цветения» воды.
Вопросы для самоконтроля
Назовите систематическое положение Эвглены зеленой.
Где обитает Эвглена зеленая?
Какое строение имеет Эвглена зеленая?
Чем покрыто тело Эвглены зеленой?
С помощью чего передвигается Эвглена зеленая?
Как питается Эвглена зеленая?
Как происходят выделение и дыхание у Эвглены зеленой?
Как происходит размножение Эвглены зеленой?
Каково значение Эвглены зеленой в природе?
Рис. Строение
Эвглены зеленой.
Строение
Эвглены зеленой.
1 — жгутик; 2 — глазок; 3 — хроматофоры; 4 — ядро; 5 — пелликула; 6 — сократительная вакуоль; 7 — запасные питательные вещества.
Рис. Деление Эвглены зеленой.
Инфузория туфелька — Paramecium caudatum (тип Инфузории, класс Ресничные Инфузории) самый обычный обитатель стоячих вод, встречается также в пресноводных водоемах с очень слабым течением, содержащих разлагающийся органический материал. Из всех одноклеточных, Инфузория туфелька имеет наиболее сложную организацию.
Строение. Тело (клетка) Инфузории напоминает след человеческой туфельки
(отсюда название). Размеры тела 0,1-0,3
мм. Инфузория имеет постоянную форму, так как эктоплазма уплотнена и
образует пелликулу. В теле выделяют передний конец, он у нее
тупой, и задний, который несколько заострен. Она
передвигается с помощью ресничек,
плавая тупым концом вперед. Реснички покрывают все тело, расположены парами.
Ресничек у Инфузории более 15 тысяч. Располагаясь
продольными диагональными рядами, реснички, совершая биения, заставляют Инфузорию
вращаться и продвигаться вперед. Скорость движения — около 2 мм/c.
Реснички покрывают все тело, расположены парами.
Ресничек у Инфузории более 15 тысяч. Располагаясь
продольными диагональными рядами, реснички, совершая биения, заставляют Инфузорию
вращаться и продвигаться вперед. Скорость движения — около 2 мм/c.
Между ресничками в эктоплазме находятся отверстия, ведущие в особые камеры, называемые трихоцистами, это защитные образования. При раздражении трихоцисты выстреливают наружу, превращаясь в длинные нити, парализующие жертву. После использования одних трихоцист на их месте в эктоплазме развиваются новые.
Тело Инфузории покрыто пелликулой. Под пелликулой располагается цитоплазма. Наружный
слой цитоплазмы — эктоплазма — это прозрачный слой плотной цитоплазмы консистенции геля. Но основная
масса цитоплазмы Инфузории туфельки представлена эндоплазмой, имеющей
более жидкую консистенцию, чем эктоплазма. Именно в эндоплазме расположено
большинство органелл. На нижней поверхности Инфузории ближе к ее переднему
концу находится околоротовая воронка, на дне которой находится клеточный рот, или цитостом, или перистом.
В эндоплазме Инфузорий находятся два ядра. Большее из них – макронуклеус, или вегетативное ядро — полиплоидное; оно имеет более двух наборов хромосом и контролирует метаболические процессы, не связанные с
размножением. Микронуклеус, или генеративное ядро — диплоидное. Оно контролирует размножение и образование макронуклеусов при делении ядра.
Питание. На нижней стороне тела
у Инфузории есть околоротовая воронка,
на дне которой находится клеточный рот (перистом, цитостом), переходящий
в клеточную глотку. Как околоротовая воронка,
так и глотка могут быть выстланы ресничками, движения которых направляют к
цитостому поток воды, несущей с собой различные пищевые частицы, такие,
например, как бактерии, кусочки мертвого органического вещества. Вода с
бактериями через клеточный рот попадает в клеточную глотку, далее в эндоплазму,
где образуются пищеварительные вакуоли. Вакуоли передвигаются вдоль тела
инфузории. Первые стадии пищеварения протекают при кислой, последующие при
щелочной реакции. Не переваренные остатки пищи, оставшиеся внутри вакуоли, путем экзоцитоза удаляются наружу через порошицу — отверстие, расположенное неподалеку от заднего конца тела Инфузории.
Не переваренные остатки пищи, оставшиеся внутри вакуоли, путем экзоцитоза удаляются наружу через порошицу — отверстие, расположенное неподалеку от заднего конца тела Инфузории.
Выделение. В
цитоплазме (эндоплазме) Инфузории туфельки имеются также две сократительные вакуоли, местоположение
которых в клетке строго фиксировано: одна расположена в
передней части тела, другая — в задней. Эти вакуоли
отвечают за осморегуляцию, т. е. поддерживают в клетке определенную
концентрацию воды. Эти вакуоли также удаляют жидкие продукты жизнедеятельности. Жизнь в пресной воде осложняется тем, что в клетку
постоянно поступает вода в результате осмоса. Эта вода должна непрерывно
выводиться из клетки, чтобы не произошло ее разрыва. Каждая вакуоль
состоит из округлого резервуара и подходящих к нему в виде звезды (расходящихся
лучами) 5-7 приводящих канальцев. Жидкие продукты и вода из цитоплазмы
сначала поступают в приводящие канальцы; резервуар в это время сокращен.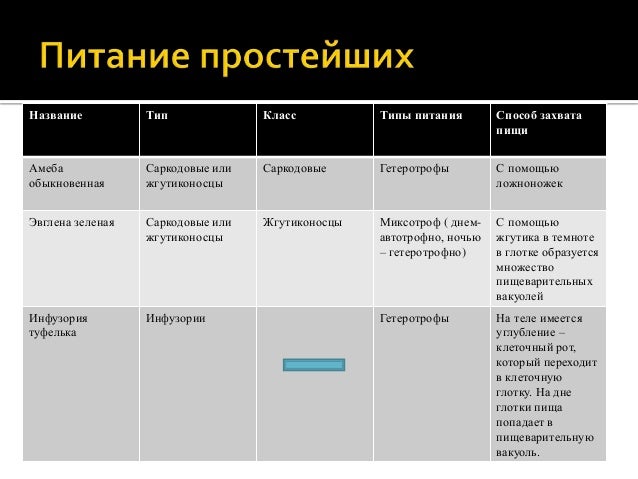 Затем
канальцы все сразу сокращаются и изливают содержимое в резервуар. После этого
через маленькое отверстие жидкость выбрасывается наружу при сокращении
резервуара. Канальцы в это время вновь наполняются. Две
вакуоли работают в противофазе (сокращаются поочередно), каждая при нормальных физиологических условиях
сокращается один раз в 10-15 с. За час вакуоли выбрасывают из клетки объём
воды, примерно равный объёму клетки.
Затем
канальцы все сразу сокращаются и изливают содержимое в резервуар. После этого
через маленькое отверстие жидкость выбрасывается наружу при сокращении
резервуара. Канальцы в это время вновь наполняются. Две
вакуоли работают в противофазе (сокращаются поочередно), каждая при нормальных физиологических условиях
сокращается один раз в 10-15 с. За час вакуоли выбрасывают из клетки объём
воды, примерно равный объёму клетки.
Дыхание. Инфузория туфелька дышит всей поверхностью клетки. Но она способна существовать также и за счёт гликолиза при низкой концентрации кислорода в воде. Продукты азотистого обмена также выводятся через поверхность клетки и частично через сократительную вакуоль.
Размножение. Инфузории
размножаются как бесполым, так и половым способами. Бесполое размножение осуществляется поперечным делением клетки на двое. Размножение
сопровождается делением макро- и микронуклеусов (в
основе деления ядер лежит митоз). Размножение
повторяется 1 — 2 раза в сутки.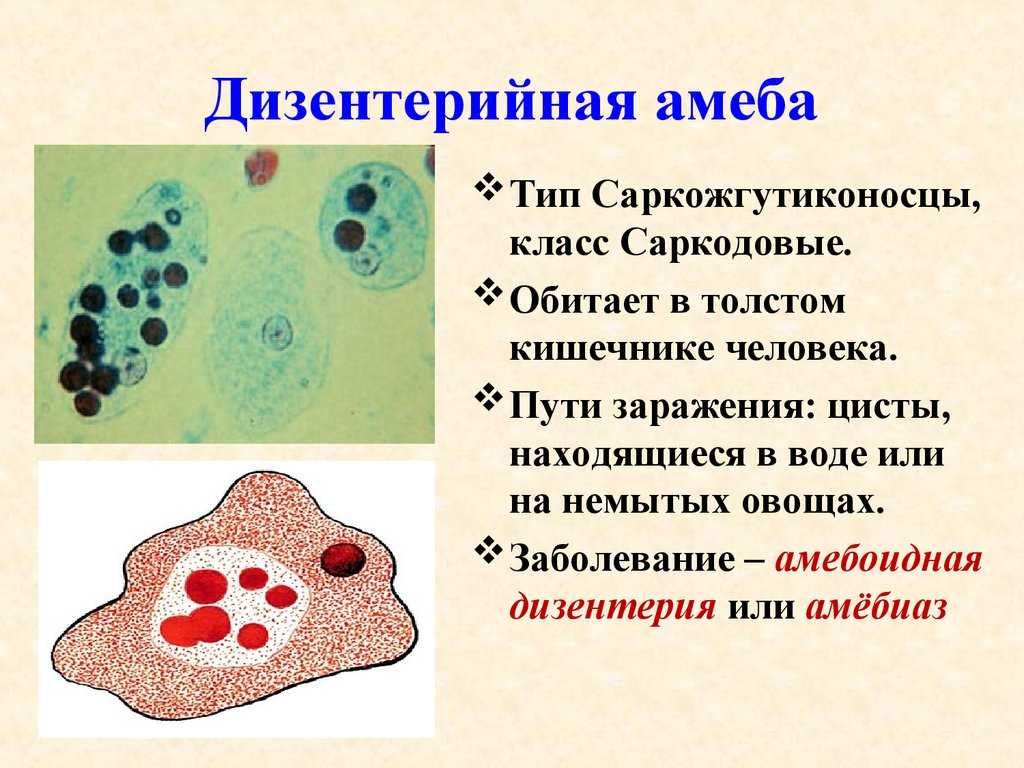 Бесполое размножение повторяется много
раз подряд.
Бесполое размножение повторяется много
раз подряд.
Время
от времени в жизненном цикле Инфузории происходит половое размножение,
которое протекает в форме конъюгации. Происходит это следующим образом.
Две инфузории подходят друг к другу брюшными сторонами, соединяются. Пелликула на
месте их соприкосновения растворяется. Между Инфузориями образуется
цитоплазматический мостик. Одновременно макронуклеус распадается, а микронуклеус
делится мейозом на 4 части (ядра). Три из них растворяются. Оставшееся ядро
делится на 2. Одно из них подвижно и соответствует мужскому (мигрирующему)
ядру, второе (женское) — стационарное ядро. По цитоплазматическому мостику Инфузории
обмениваются мигрирующими ядрами. Оба половых ядра (стационарное и мигрирующее)
сливаются, и таким образом, восстанавливается диплоидный набор хромосом. К
концу конъюгации каждая Инфузория имеет по одному ядру двойственного
происхождения — синкариону. Затем Инфузории расходятся,
восстанавливается макронуклеус. После конъюгации инфузории усиленно делятся
бесполым путем. Таким образом, при половом процессе
число Инфузорий не увеличивается, а
После конъюгации инфузории усиленно делятся
бесполым путем. Таким образом, при половом процессе
число Инфузорий не увеличивается, а
обновляются наследственные свойства ядер и возникают новые комбинации генетической информации, что с эволюционной точки зрения весьма прогрессивно.
При неблагоприятных условиях Инфузории, как и прочие простейшие (одноклеточные) образуют цисты.
Значение в природе. Инфузория туфелька является элементом биологического разнообразия на Земле. Она участвует в круговороте веществ в природе. Она является составной частью пищевых цепей: Инфузория питается бактериями и детритом, ею питаются мальки рыб, гидры, какие-то черви, мелкие ракообразные.
Вопросы для самоконтроля.
Назовите систематическое положение Инфузории туфельки.
Где обитает Инфузория туфелька?
Какое строение имеет Инфузория туфелька?
Чем покрыто тело Инфузории туфельки?
С помощью чего передвигается Инфузория туфелька?
Как питается Инфузория туфелька?
Как происходят выделение и дыхание у Инфузории туфельки?
Как происходит размножение Инфузории туфельки?
Каково значение Инфузории туфельки в природе?
Рис. Строение инфузории-туфельки.
Строение инфузории-туфельки.
1 -реснички; 2 — цитоплазма; 3 — большое ядро; 4 — малое ядро; 5 — пелликула; 6 — сократительная вакуоль; 7 -пищеварительная вакуоль; 8 – клеточный рот; 9 — порошица; 10 — трихоцисты.
Рис. Питание Инфузории туфельки.
1 — пищеварительные вакуоли; 2 -ротовое отверстие; 3 — порошица;
4 — реснички.
Рис. Бесполое размножение Инфузории-туфельки.
Одноклеточные организмы — что это, определение и ответ
Подцарство Простейшие (одноклеточные)
Подцарство Простейшие включает в себя животных, тело которых состоит из одной клетки. Клетка – целый организм, роль органов выполняют органоиды.
Разнообразие Простейших
Тип Жгутиковые
Тип Саркодовые
Тип Инфузории
Тип Споровики
I. Тип Жгутиковые
Тип Жгутиковые
Представитель: Эвглена Зеленая
Строение и описание жизнедеятельности:
Эвглена, как типичный представитель данного типа, осуществляет передвижение за счет движения (вращения) ЖГУТИКА
На переднем конце тела расположен клеточный рот и светочувствительный глазок (=стигма)
В передней части тела мы также можем увидеть сократительную вакуоль (органоид выделения жидких продуктов обмена)
В цитоплазме содержатся зеленые ХЛОРОПЛАСТЫ, несущие зеленый пигмент – хлорофилл
Питание = может питаться как готовыми органическими веществами, так и собственной органикой, синтезированной в процессе фотосинтеза
Есть плотная оболочка, форма тела постоянна (НЕ КЛЕТОЧНАЯ СТЕНКА)
Размножается простым делением надвое
Особенности данного организма:
Эвглена сочетает в себе признаки:
Эвглена зеленая
Лямблия, трипаносома
II.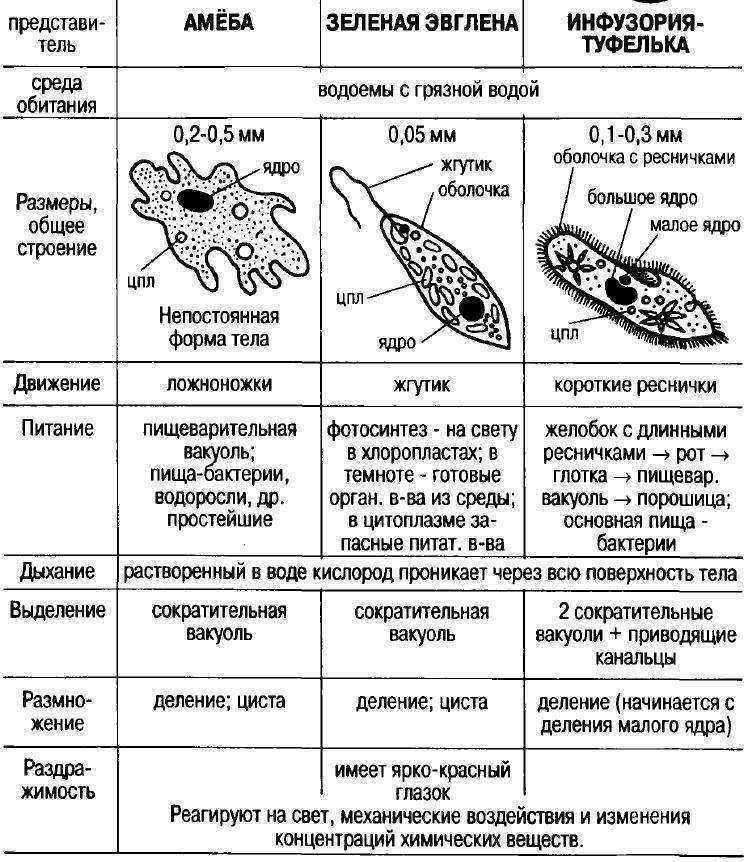 Тип Саркодовые
Тип Саркодовые
Представитель: Амеба Обыкновенная
Строение и описание жизнедеятельности:
Непостоянная форма тела из-за отсутствия плотной оболочки, способны образовывать ПСЕВДОПОДИИ, или ЛОЖНОНОЖКИ
При неблагоприятных условиях образует ЦИСТУ
Питается фагоцитозно, нет клеточного рта
Размножается простым делением надвое
Строение Амебы обыкновенной
Фораминиферы
Особенности:
обитатели моря;
подавляющее большинство фораминифер образует известковую раковину, служащую экзоскелетом. Через отверстие раковины во внешнюю среду могут выпячиваться ложноножки;
раковины фораминифер участвуют в образовании значительной части морских отложений (осадочных пород).
Разнообразие фораминифер
III. Тип Инфузории (Ресничные)
Тип Инфузории (Ресничные)
Представитель: Инфузория туфелька
Строение и описание жизнедеятельности:
Большое количество РЕСНИЧЕК
Есть клеточный рот, глотка
Удаление непереваренной пищи с помощью ПОРОШИЦЫ
Наличие двух сократительных вакуолей (2 «солнышка»)
КОНЪЮГАЦИЯ = половой процесс
Особенности данного организма:
1. Два ядра
| Макронуклеус (большое ядро) | Микронуклеус (маленькое ядро) |
|---|---|
Вегетативное ядро = Отвечает за все процессы жизнедеятельности, кроме полового процесса | Генеративное ядро = Отвечает за половой процесс |
Строение Инфузории-туфельки
2. Конъюгация – половой процесс одноклеточных животных, при котором те обмениваются своим наследственным материалом.
Конъюгация – половой процесс одноклеточных животных, при котором те обмениваются своим наследственным материалом.
Размножение (бесполое и половое)
Сближение двух инфузорий (МИ – микронуклеус; МА – макронуклеус) и образование между ними цитоплазматического мостика.
Первое деление микронуклеуса (как результат, образование двух ядер).
Второе деление микронуклеуса (как результат, образование четырех ядер).
Трое из четырёх образовавшихся микронуклеусов погибают. Также погибает макронуклеус.
Третье деление микронуклеуса (как результат, образование двух ядер).
Обмен ядрами (одно из двух образовавшихся ядер переходит к клетку другой инфузории).
Слияние двух новых микронуклеусов в одно ядро.
Деление ядра надвое.
Из двух имеющихся ядер, одно становится макронуклеусом, другое – микронуклеусом.
IV.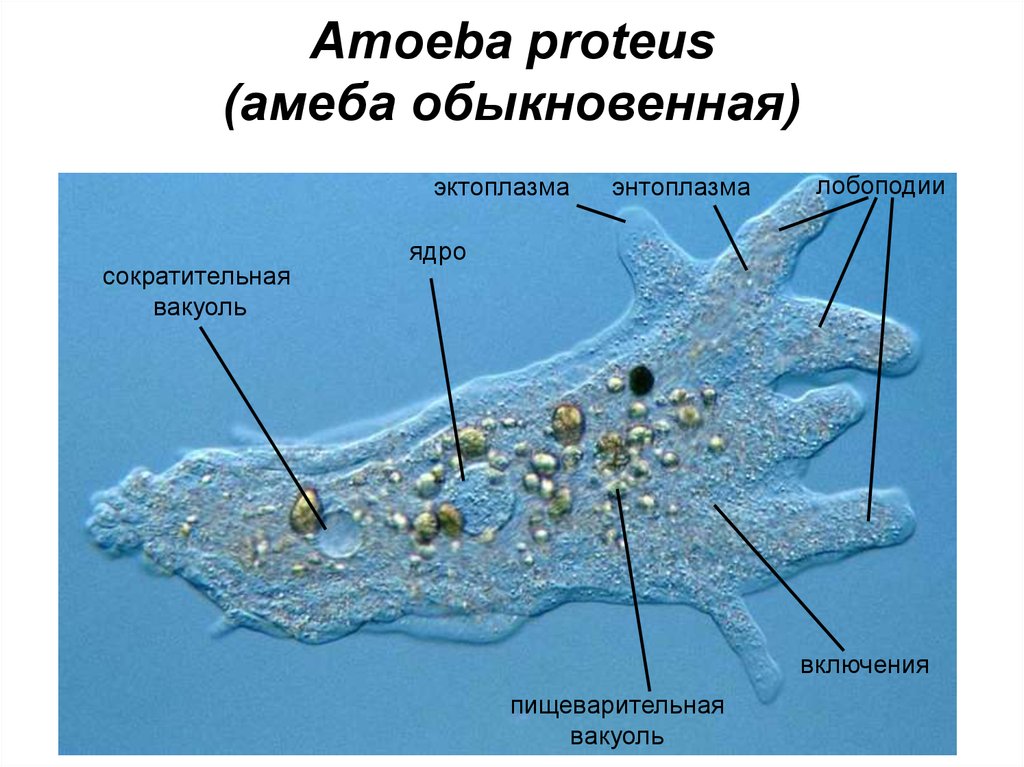 Тип Споровики
Тип Споровики
Представитель: Малярийный плазмодий
На экзамене вас будут много спрашивать про жизненный цикл малярийного плазмодия!
Основной хозяин = хозяин, в котором происходит ПОЛОВОЕ размножение
Промежуточный = БЕСПОЛОЕ
Малярийный плазмодий:
Основной хозяин = КОМАР!
Промежуточный хозяйн = ЧЕЛОВЕК!
Вызывает малярию:
Возбудитель = малярийный плазмодий
Переносчик = малярйный комар
Цикл развития малярийного плазмодия:
В организм человека возбудители малярии попадают вместе со слюной заражённого комара в виде тонких веретеновидных клеточек – так называемых спорозоитов
Кровеносная система разносит спорозоиты по всему телу, и часть их через печёночную артерию попадает в печень и там внедряется в печёночные клетки
В клетках печени паразиты разрастаются, а затем распадаются на мелкие дольки – мерозоиты, которые попадают в общее кровяное русло и уже в таком виде внедряются в красные кровяные тельца – эритроциты
Он заполняет собой весь объем поражённого им кровяного тельца, а затем дробится (шизогония = бесполое размножение) сразу на мелкие дольки – мерозоиты.
 Тогда кровяные тельца, в которых развивались паразиты, окончательно разрушаются, молодые мерозоиты попадают в кровяную жидкость, а затем проникают в новые кровяные тельца
Тогда кровяные тельца, в которых развивались паразиты, окончательно разрушаются, молодые мерозоиты попадают в кровяную жидкость, а затем проникают в новые кровяные тельцаЛихорадка
Укус комара, паразит попадает в кишечник, где происходит половое размножение.
Внедрение паразита в слюнные железы комара
Жизненный цикл малярийного плазмодия
Внимание! Лихорадка наступает по причине разрушения эритроцитов.
Токсоплазма
Токсоплазма – внутриклеточный паразит. Токсоплазмоз протекает достаточно легко, однако у лиц с иммунодефицитом и беременных женщин последствия могут быть фатальными (у беременных плод может погибнуть).
Токсоплазма
наблюдений за амёбами, питающимися инфузориями Frontonia | Журнал экспериментальной биологии
Skip Nav Destination
ИССЛЕДОВАТЕЛЬСКАЯ СТАТЬЯ|
01 апреля 1924 г.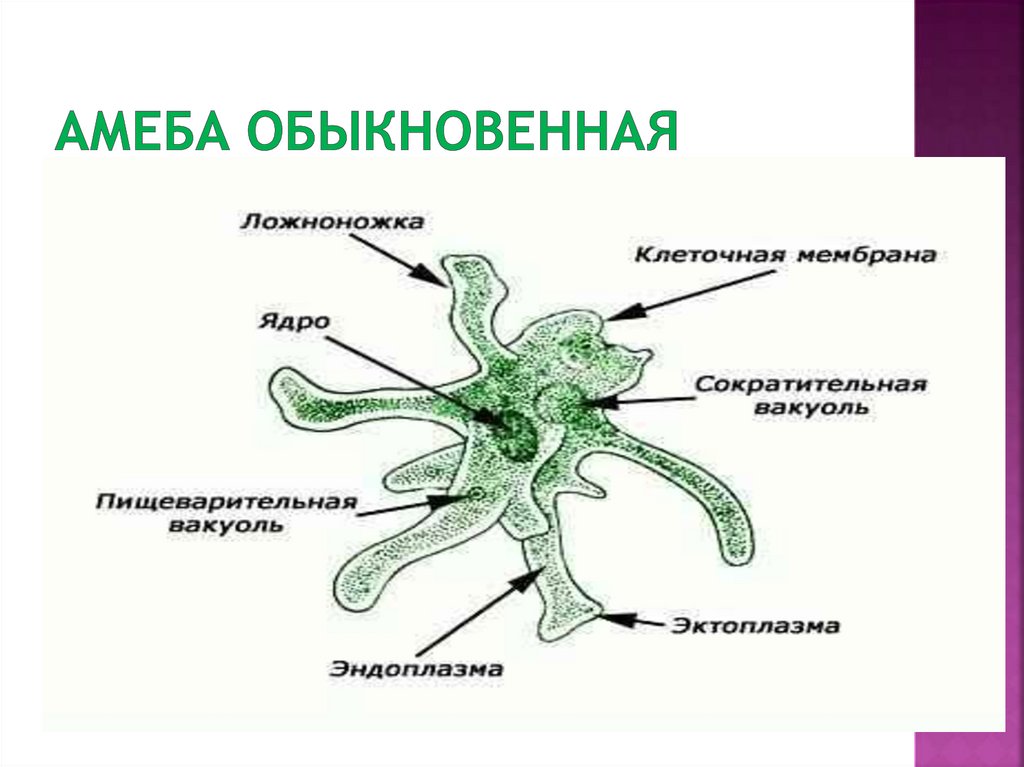
К. Дейл Бирс
Информация об авторе и статье
*
Поступила в редакцию 10 октября 1923 г. Автор признателен профессору С. О. Масту за многие ценные предложения в связи с этой работой.
Полученный: 10 октября 1923 г.
Номер в сети: 1477-9145
Номер для печати: 0022-0949
Copyright © 1924 Компания биологов, ООО
https://doi.org/10.1242/jeb.1.3.335
История статьи
Получено:
10 окт. 1923
- Разделенный экран
- Взгляды
- Содержание артикула
- Рисунки и таблицы
- Видео
- Аудио
- Дополнительные данные
- Экспертная оценка
- Значок версии статьи Версии
- Версия записи
01 апреля 1924 г.

- Версия записи
01 апреля 1924 г.
- Делиться
- Твиттер
- MailTo
- Инструменты
Получить разрешения
Иконка Цитировать Цитировать
- Поиск по сайту
Citation
C. Дейл Бирс; Наблюдения за амёбами, питающимися инфузориями Frontonia. J Exp Biol 1 апреля 1924 г.; 1 (3): 335–341. дои: https://doi.org/10.1242/jeb.1.3.335
Скачать файл цитаты:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
Расширенный поиск
Амеба иногда питается инфузорией Frontonia.

В наблюдаемых случаях кормления Frontonia не проглатывалась целиком, а разрезалась амебой пополам.
Половина Frontonia поглощена пищевой чашечкой амебы, ложноножки чашечки образуют кольцевидную перетяжку в средней части инфузории.
Псевдоподиальный воротничок или чашечка проходит дистально и давит на свободную половину Frontonia. Таким образом, половинки постоянно отталкиваются друг от друга до тех пор, пока ослабленная соединительная нить не будет разорвана и одновременно не будет поглощена половина Frontonia.
Способ отлова коловраток и парамеций амебой подробно описан Mast and Root (1916). В связи с питанием Paramecium они отметили, что, хотя в некоторых случаях амебы поглощали всю Paramecium, они снова демонстрировали более поразительную пищевую реакцию, заключающуюся в том, что они раскалывали Paramecium пополам посредством псевдоподиального давления и проглатывали только половину.
Эти авторы, используя тонкие стеклянные волокна для разрезания парамеций, смогли рассчитать силу, которую амеба должна была бы приложить, чтобы разрезать инфузорию.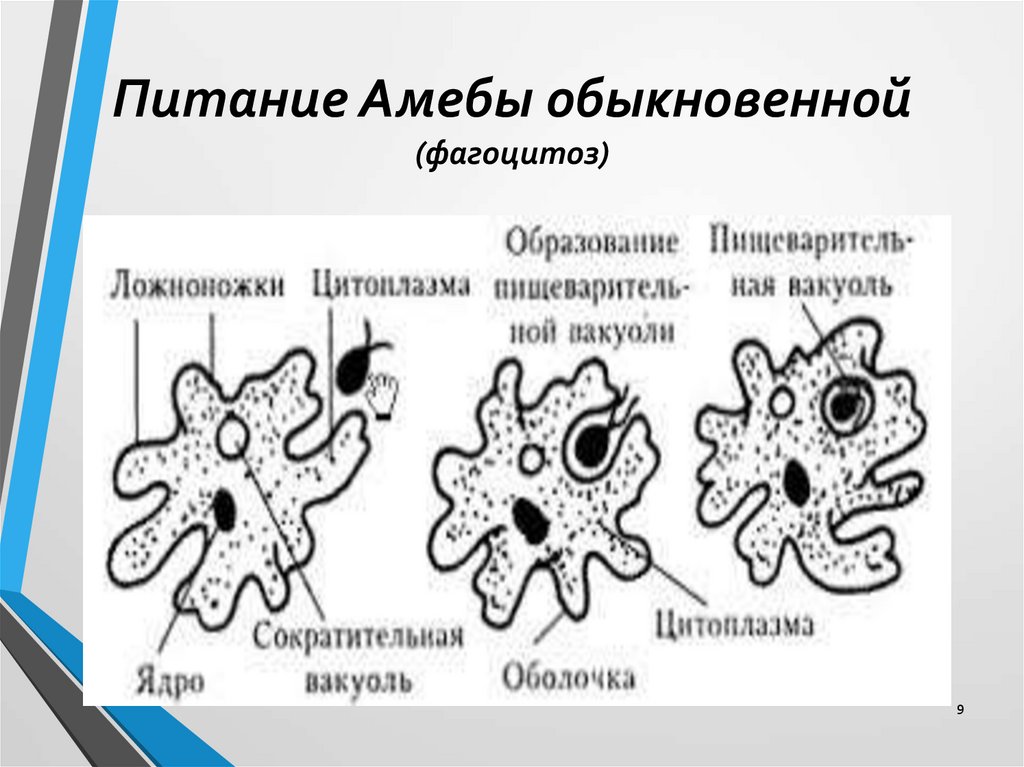 Их цель состояла в том, чтобы установить, могут ли простые изменения поверхностного натяжения амебного вещества создать достаточную силу, чтобы разрезать Paramecium. Для расщепления инфузории оказалось необходимым уменьшение поверхностного натяжения по крайней мере на 383 дин на сантиметр, тогда как, по всей вероятности, уменьшение должно было бы превышать 1118 дин на сантиметр. Поскольку поверхностное натяжение протоплазмы оценивается примерно в 50 дин на сантиметр, эти авторы пришли к выводу, что поверхностное натяжение является самым незначительным фактором в этой пищевой реакции амебы.
Их цель состояла в том, чтобы установить, могут ли простые изменения поверхностного натяжения амебного вещества создать достаточную силу, чтобы разрезать Paramecium. Для расщепления инфузории оказалось необходимым уменьшение поверхностного натяжения по крайней мере на 383 дин на сантиметр, тогда как, по всей вероятности, уменьшение должно было бы превышать 1118 дин на сантиметр. Поскольку поверхностное натяжение протоплазмы оценивается примерно в 50 дин на сантиметр, эти авторы пришли к выводу, что поверхностное натяжение является самым незначительным фактором в этой пищевой реакции амебы.
Наблюдения, записанные в настоящей статье, представляют интерес в той же связи и касаются факторов, участвующих в разрезании инфузории Frontonia надвое.
В одной из лабораторных культур в изобилии присутствовали как амебы, так и фронтонии. Амебы были крупного лопастного типа и, вне всякого сомнения, были Amoeba proteus , так как исследование некоторых из них выявило эктоплазматические гребни и двояковогнутое ядро, признаки, которые обычно считаются специфическими для .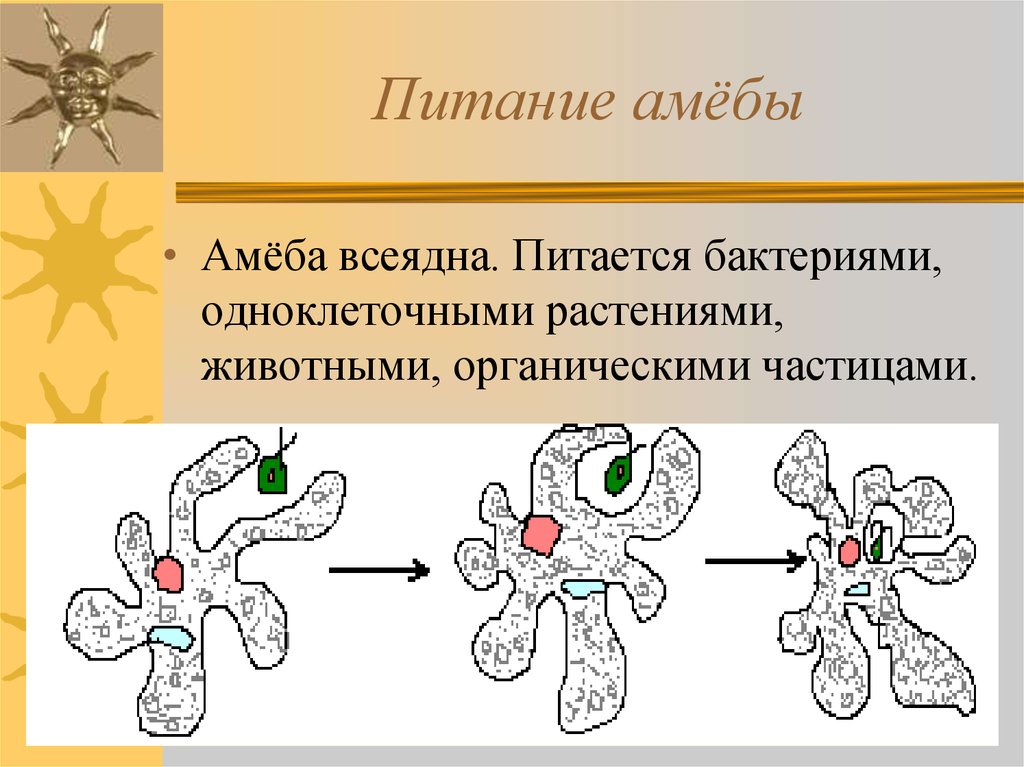 0026 А. протей . В длину Frontoniae составляли около 250 μ и соответствовали описанию F. leucas . Лишь изредка Frontoniae процветают в культурах, настоянных на сене, хотя в некоторых культурах, содержащих много бактериальной зооглей и разлагающихся органических веществ, они чувствуют себя очень хорошо. Много раз было замечено, что они питались этим органическим мусором. Из-за этой пищи они были отчетливо черными, а не гиалиновыми или зеленоватыми, как при питании в открытых водоемах водорослями и тому подобным. Более того, они были неизменно симметричны по форме и никогда не искажались содержащейся в них пищей.
0026 А. протей . В длину Frontoniae составляли около 250 μ и соответствовали описанию F. leucas . Лишь изредка Frontoniae процветают в культурах, настоянных на сене, хотя в некоторых культурах, содержащих много бактериальной зооглей и разлагающихся органических веществ, они чувствуют себя очень хорошо. Много раз было замечено, что они питались этим органическим мусором. Из-за этой пищи они были отчетливо черными, а не гиалиновыми или зеленоватыми, как при питании в открытых водоемах водорослями и тому подобным. Более того, они были неизменно симметричны по форме и никогда не искажались содержащейся в них пищей.
В одном случае при рассмотрении этой культуры в препаровальный бинокль была замечена амеба, частично поглотившая Frontonia (рис. 1, А). Посредством псевдоподиального давления амеба сжимала среднюю область фронтонии до тех пор, пока последняя не приняла форму гантели. Одна половина фронтонии была окружена ложноножками амебы, другая половина была свободна.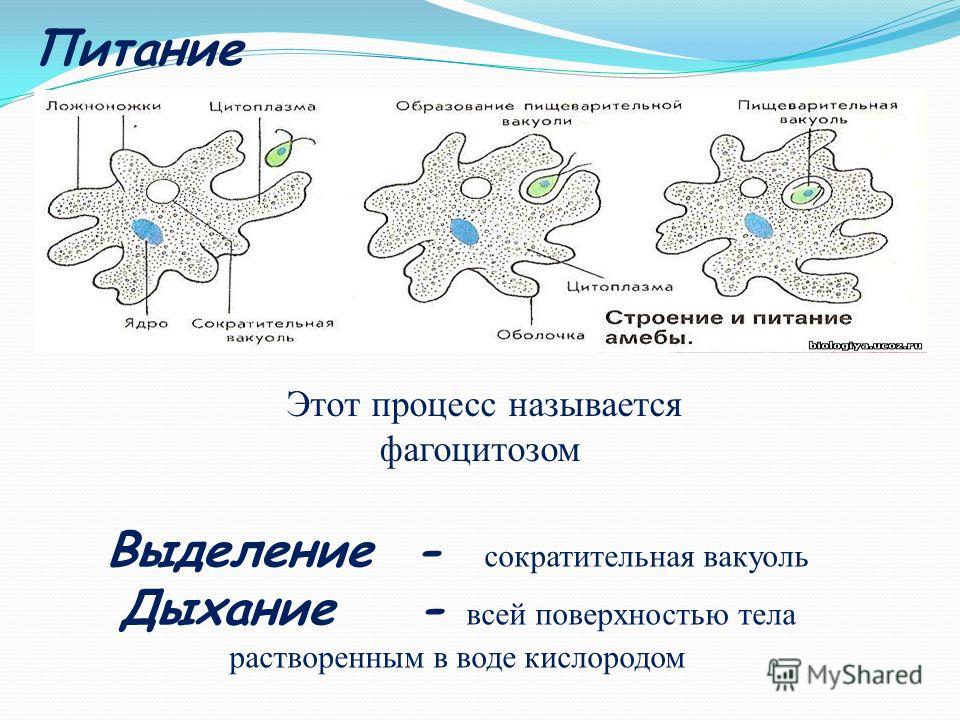 При первом наблюдении инфузория предпринимала отчаянные попытки убежать и таскала амебу то тут, то там по дну культуры.
При первом наблюдении инфузория предпринимала отчаянные попытки убежать и таскала амебу то тут, то там по дну культуры.
Рис. 1.
Посмотреть в большом размереЗагрузить слайд
Последовательные наброски от руки, показывающие, как амеба рассекает захваченную Фронтонию пополам и проглатывает одну половину. Стрелки указывают направление движения псевдоподиального воротника амебы. Зарисовки делались с интервалом примерно в полторы минуты: и — амеба, прикрепленная к субстрату; e , охватывает половину Фронтонии; f , свободная половина Фронтонии; и , средняя область Фронтонии, стянутая в форму нити, соединяющей половинки; p , псевдоподиальный воротник амебы; s , часть соединительной нити, присоединенная к свободной половине.
А . Средняя область фронтонии заметно сужена псевдоподиальным coHar или чашечкой амебы.
Б . Воротник амебной протоплазмы стекает в сторону свободной половины фронтонии, тем самым раздвигая половинки дальше друг от друга и растягивая сжатую соединительную часть.
CD . Давление псевдоподиального воротника сдавливает свободную половину инфузории, придавая ей сферическую форму, и растягивает тяж до тех пор, пока в одном чрезмерно суженном участке не появятся признаки разрыва.
Е . Нить разошлась; протоплазматический воротник амебы втягивается.
Ф . Эластичность свободной половины возвращает ей нормальную форму. Псевдоподиальный воротничок почти втянут.
Рис. 1.
Посмотреть в большом размереСкачать слайд
Последовательные наброски от руки, показывающие, как амеба рассекает захваченную Фронтонию пополам и проглатывает половину. Стрелки указывают направление движения псевдоподиального воротника амебы. Зарисовки делались с интервалом примерно в полторы минуты: и — амеба, прикрепленная к субстрату; e , охватывает половину Фронтонии; f , свободная половина Фронтонии; и , средняя область Фронтонии, стянутая в форму нити, соединяющей половинки; p , псевдоподиальный воротник амебы; s , часть соединительной нити, присоединенная к свободной половине.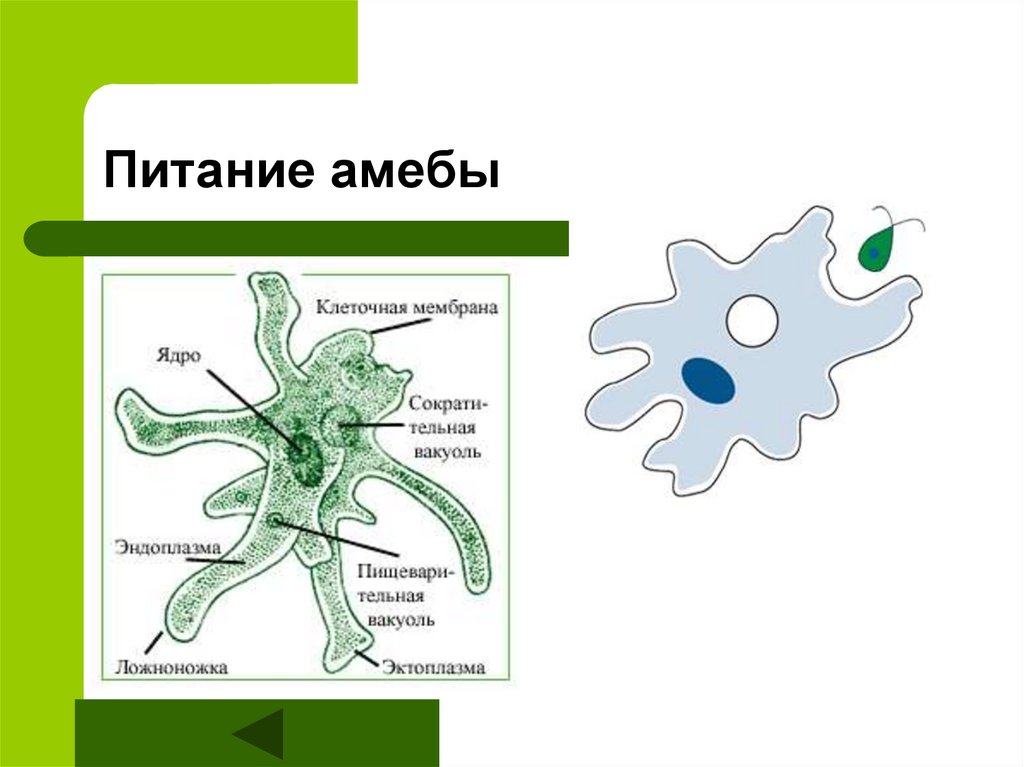
А . Средняя область фронтонии заметно сужена псевдоподиальным coHar или чашечкой амебы.
Б . Воротник амебной протоплазмы стекает в сторону свободной половины фронтонии, тем самым раздвигая половинки дальше друг от друга и растягивая сжатую соединительную часть.
CD . Давление псевдоподиального воротника сдавливает свободную половину инфузории, придавая ей сферическую форму, и растягивает тяж до тех пор, пока в одном чрезмерно суженном участке не появятся признаки разрыва.
Е . Нить разошлась; протоплазматический воротник амебы втягивается.
Ф . Эластичность свободной половины возвращает ей нормальную форму. Псевдоподиальный воротничок почти втянут.
Оба микроорганизма были немедленно перенесены на предметное стекло с большой каплей культуральной жидкости и исследованы под микроскопом. Несколько мгновений амебу увлекала активно двигающаяся инфузория. В течение этого промежутка времени имелась возможность отметить, что, по всей видимости, сужение в средней части фронтонии было результатом не давления двух противолежащих ложноножек амебы, а центростремительного давления, оказываемого сомкнутым воротником амебной протоплазмы. .
.
В дальнейшем амеба прикрепилась к предметному стеклу и продолжила процесс заглатывания (рис. 1, А). Казалось вероятным, что псевдоподиальное кольцо амебы продолжит центростремительное сжатие и сожмет захваченную Frontonia надвое, при этом проксимальный или поглощенный конец окажется одновременно заключенным в пищевую вакуоль, а дистальная или свободная половина выйдет наружу. Однако процесс расщепления заканчивался, когда сужение достигало такой степени, как показано на рис. 1, А, после чего способ действия амебы изменился. В то время как тело амебы, прочно прикрепленное к субстрату, крепко держалось за проксимальную половину инфузории, воротничок протоплазмы, все еще оказывавший достаточное центростремительное давление, чтобы сжать среднюю область фронтонии, начал течь в направлении свободный конец инфузории (рис. 1, Б), тем самым удлинив тяж, соединявший половинки, и заставив свободную половинку приблизиться к форме шара. По мере того, как протоплазматический воротник продолжал течь дистально, эта половина становилась почти сферической (рис. 1, С), в то время как соединительная нить постоянно становилась длиннее и показывала признаки разрыва в одной чрезмерно суженной области (рис. 1, D). Собственно, в этом суженном участке через мгновение и произошел разрыв нити (рис. 1, Д), ее отрыв и последующее разделение инфузории на половинки, что знаменовало собой завершение процесса заглатывания.
1, С), в то время как соединительная нить постоянно становилась длиннее и показывала признаки разрыва в одной чрезмерно суженной области (рис. 1, D). Собственно, в этом суженном участке через мгновение и произошел разрыв нити (рис. 1, Д), ее отрыв и последующее разделение инфузории на половинки, что знаменовало собой завершение процесса заглатывания.
После разделения половинок псевдоподиальный воротник амебы постепенно втягивался (рис. 1, Д и Е). При снятии давления со свободной половины фронтонии эта половина перестала быть шаровидной, а скорее приняла нормальную форму, хотя часть утонченного соединительного тяжа все еще оставалась прикрепленной к ней у основания (рис. 1, Д). и F ). По мере того как протоплазматический воротник продолжал втягиваться, эта свободная половина постепенно выскальзывала из углубления, в котором она удерживалась оттянутой частью, и некоторое время хаотично плавала (рис. 1, Д и Е). Половина, проглоченная амебой, образовывала большую, слегка неправильной формы пищевую вакуоль отчетливо черного цвета.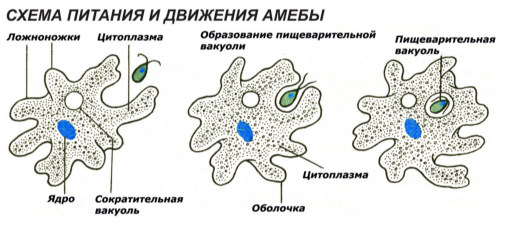 Процесс от момента прикрепления амебы до полного втягивания псевдоподиального воротничка занял около восьми минут.
Процесс от момента прикрепления амебы до полного втягивания псевдоподиального воротничка занял около восьми минут.
После этих наблюдений культуру снова исследовали, чтобы выяснить, питаются ли другие амебы Frontoniae. Хотя в то время не было отмечено никаких дополнительных случаев, было замечено несколько амеб, каждая из которых содержала большую черную пищевую вакуоль. Представляется очевидным, что эти вакуоли возникли в результате употребления в пищу Frontoniae, поскольку вакуоли, образующиеся при употреблении в пищу любого другого существа в культуре, будь то Paramecium, коловратки, жгутиковые или бактериальные зооглейки, всегда были намного светлее по цвету.
Эту культуру наблюдали часто, и хотя несколько раз отмечались характерные черные пищевые вакуоли, фактического повторения феномена кормления не наблюдалось в течение почти трех недель, когда при случайном осмотре была обнаружена амеба, прикрепленная к донцу. и удерживая захваченную Фронтонию, как и прежде. Были сделаны рисунки Camera Lucida, показывающие различные этапы процесса (рис.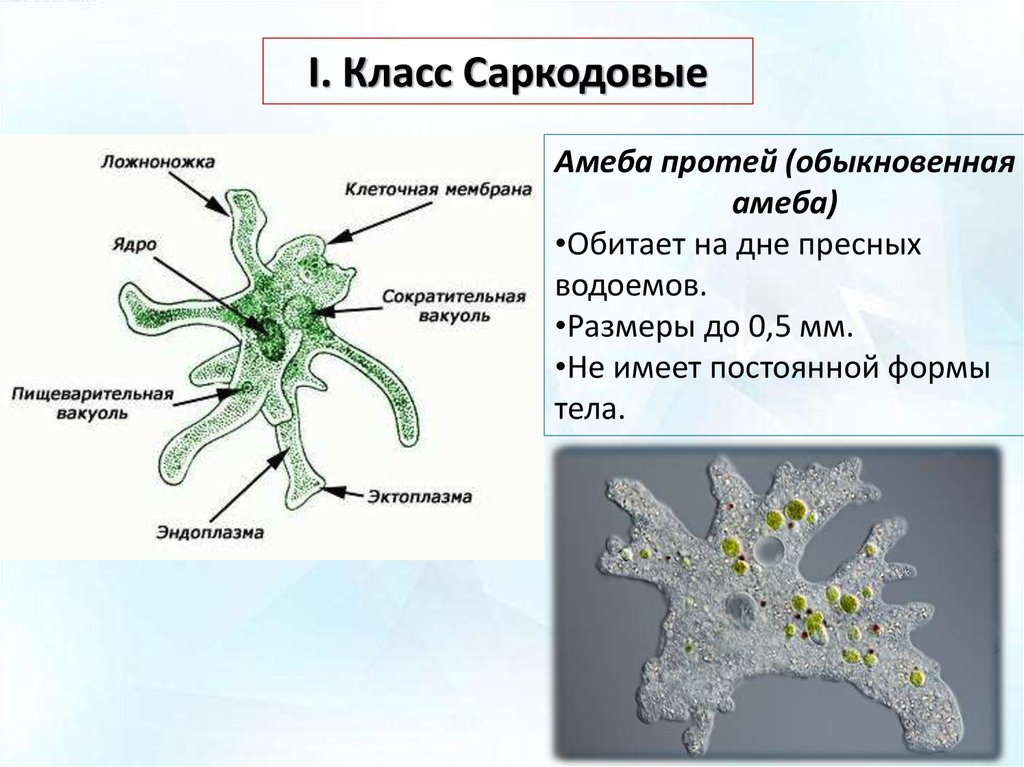 2, A-E). Эти рисунки во всех отношениях согласуются с набросками от руки (рис. 1, A-F), сделанными в первом примере, и ясно показывают, что благодаря продольному давлению, оказываемому псевдоподиальным воротником амебы, половинки фронтонии непрерывно отодвинуты дальше друг от друга, пока не произойдет разрыв соединительной части.
2, A-E). Эти рисунки во всех отношениях согласуются с набросками от руки (рис. 1, A-F), сделанными в первом примере, и ясно показывают, что благодаря продольному давлению, оказываемому псевдоподиальным воротником амебы, половинки фронтонии непрерывно отодвинуты дальше друг от друга, пока не произойдет разрыв соединительной части.
Рис. 2.
Посмотреть в большом размереСкачать слайд
Последовательные наброски камеры lucida для сравнения с набросками от руки на рис. 1, сделанный с интервалом в две минуты, показывающий второй случай, когда амеба разрезала Фронтонию пополам. В процессе Frontonia была растянута от длины 250 мкм (A) до длины 310 мкм ( C ). Маркировка как на рис. 1.
Рис. 2.
Посмотреть в большом размереСкачать слайд
Последовательные наброски камеры lucida для сравнения с набросками от руки на рис. 1, сделанный с интервалом в две минуты, показывающий второй случай, когда амеба разрезала Фронтонию пополам.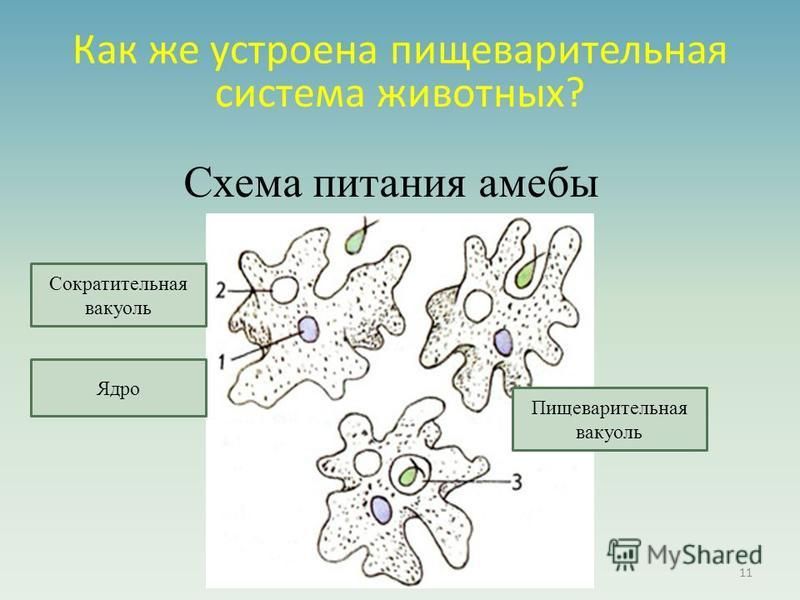 При этом Фронтония была растянута на 250 м.0026 мк (А) до длины 310 мк ( С ). Маркировка как на рис. 1.
При этом Фронтония была растянута на 250 м.0026 мк (А) до длины 310 мк ( С ). Маркировка как на рис. 1.
В обоих случаях псевдоподиальный воротник амебы имел отчетливо гиалиновый характер, содержал только мелкие гранулы и имел вид, вообще характерный для эктосарка.
Переваривание поглощенных половинок Фронтонии, похоже, происходило очень медленно. Первая амеба, выделенная после приема внутрь, сохраняла вакуоль почти четыре дня. Вторая амеба сохраняла свою вакуоль трое суток. Зеленый лес (1887 г.) и Мачта и корень (1916) отметили, что вакуоли, содержащие коловраток, могут сохраняться в течение трех дней с неполным перевариванием к концу этого времени.
Питание амёб на Фронтонии представляет особый интерес, если рассматривать его в свете теории поверхностного натяжения в ее общей интерпретации, i . и . идея о том, что разнообразная деятельность амебы вызвана исключительно изменениями поверхностного натяжения амебного вещества.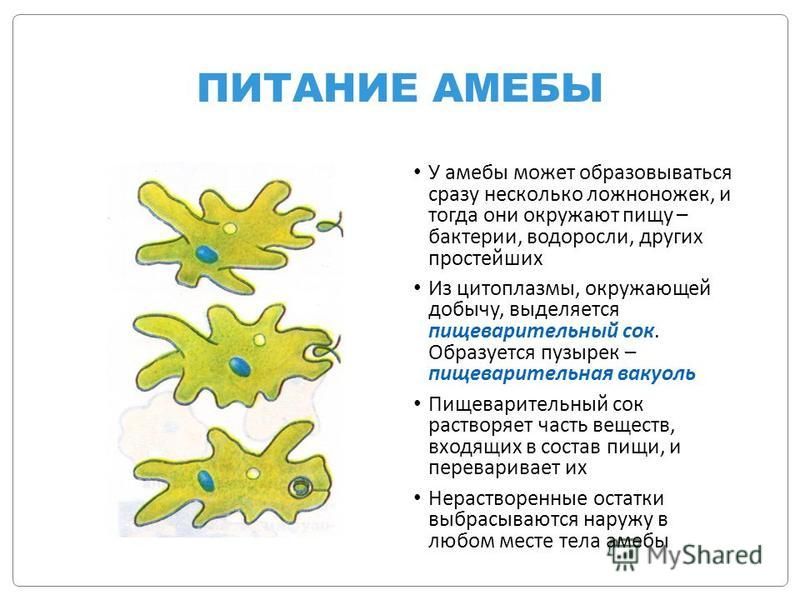
То, что поверхностное натяжение могло обеспечить достаточную силу, позволяющую амебе сжимать такой набухший организм, как Фронтония, кажется невозможным. Более того, поверхностное натяжение никоим образом не объясняет, каким образом амеба удерживает свою власть во Фронтонии, в то время как ее пленник таскает ее по развалинам культуры. Также не кажется разумным заключить, что сила, с которой протоплазматический воротничок в конечном итоге расщепляет фронтонию, могла быть результатом изменений поверхностного натяжения. Сила воротника амебной протоплазмы не только вытягивает соединительную часть на относительно большую длину, но при этом сдавливает дистальную половину инфузории в форму шара (рис. 1, В и Г; рис. 2, С). Важно напомнить, что при снятии давления эта половина все еще демонстрирует достаточную эластичность, чтобы частично или полностью вернуться к нормальной форме (рис. 1, F; рис. 2, E). Кроме того, в то время как амеба растягивает фронтонию, очевидно, что протоплазматический воротник оказывает заметное центростремительное давление, иначе средняя область фронтонии не сохранила бы форму вытянутого тяжа. В связи с этим следует обратить внимание на разнообразие форм, принимаемых поглощенной половиной, поскольку в каждом из сопровождающих наборов фигур форма этой половины различна. Ясно, что эти разные формы являются результатом различного давления, оказываемого амебой на поверхность поглощенной половины. Могло ли поверхностное натяжение создать достаточную силу, чтобы удерживать и, таким образом, сжимать поглощенную половину, весьма сомнительно.
В связи с этим следует обратить внимание на разнообразие форм, принимаемых поглощенной половиной, поскольку в каждом из сопровождающих наборов фигур форма этой половины различна. Ясно, что эти разные формы являются результатом различного давления, оказываемого амебой на поверхность поглощенной половины. Могло ли поверхностное натяжение создать достаточную силу, чтобы удерживать и, таким образом, сжимать поглощенную половину, весьма сомнительно.
Таким образом, процесс проглатывания половинки Фронтонии представляется настолько сложным, что теория поверхностного натяжения неадекватна для объяснения; механика процесса, без сомнения, включает в себя ряд взаимодействующих факторов, таких как сцепление, гелеобразование и давление солитации (Mast, 1923).
Greenwood
,
M.
(
1887
), «
О пищеварительном процессе у некоторых корненожек
3»,
2,0004 Журнал. физ.,
физ., 8
,
263
–
87
.
мачта
,
S. O.
и
Root
,
F. M.
(
1916
), «
Наблюдения на их кормлениях Amœba, и на карьерах, и устроительном фирмене, и устроительнических и упорных. по теории поверхностного натяжения
»,
Journ. Эксп. Зоол.,
21
,
33
–
49
.
https://doi.org/10.1002/jez.1400210103
Mast
,
S. O.
(
1923
), “
Mechanics of Locomotion in Amœba
,”
Proc. Нац. акад. наук,
Нац. акад. наук,
9
, №
7
,
258
–
61
.
https://doi.org/10.1073/pnas.9.7.258
Разнообразие и биогеография раковинных амеб
Эшмол П., Эшмол М. (2002) Острова Св. Елены и Вознесения: естественная история. Энтони Нельсон, Освестри, Великобритания
Google Scholar
Balik V, Song B (2000) Бентосные пресноводные раковинные амебы (Protozoa: Rhizopoda) из озера Дунтин, Китайская Народная Республика, с описанием нового вида из рода Колларипиксидия . Acta Protozool 39:149–156
Google Scholar
Beyens L, Chardez D (1995) Аннотированный список раковинных амеб, наблюдаемых в Арктике между 27 ° восточной долготы и 168 ° западной долготы. Арка Протистенка 146:219–233
Арка Протистенка 146:219–233
Google Scholar
Beyens L, Chardez D (1997) Новые таксоны раковинных амеб из полярных регионов. Acta Protozool 36:137–142
Google Scholar
Beyens L, Chardez D, Baere D et al (1995) Водная раковинная фауна в районе залива Стромнесс, Южная Джорджия. Antarct Sci 7:3–8
CrossRef
Google Scholar
Beyens L, Meisterfeld R (2002) Простейшие: раковинные амебы. В: Смол Дж. П., Биркс Дж. Б., Ласт В. М. и др. (ред.) Отслеживание изменений окружающей среды с использованием озерных отложений. Спрингер, Нидерланды, стр. 121–153
Перекрёстная ссылка
Google Scholar
Бобров А.А. (2001) Находка тропической группы раковинных амеб (Protozoa: Testacea) на Дальнем Востоке (Сихотэ-Алинский заповедник). Биол Булл 28:401–417
CrossRef
Google Scholar
Бобров А. , Мазей Ю. (2004) Морфологическая изменчивость раковинных амеб (Rhizopoda: Testacealobosea Testaceafilosea) в природных популяциях. Acta Protozool 43: 133–146
, Мазей Ю. (2004) Морфологическая изменчивость раковинных амеб (Rhizopoda: Testacealobosea Testaceafilosea) в природных популяциях. Acta Protozool 43: 133–146
Google Scholar
Бобров А.А., Зигерт Ч., Андреев А.А. и др. (2003) Раковины (Protozoa: Testacea) в четвертичных вечномерзлых отложениях Быковского полуострова, Арктическая Якутия. Биол Булл 30:191–206
CrossRef
Google Scholar
Бобров А.А., Андреев А.А., Ширрмейстер Л и др. (2004) Раковинные амебы (Protozoa: Testacealobosea и Testaceafilosea) как биоиндикаторы в позднечетвертичных отложениях полуострова Быковский, море Лаптевых, Россия. Палеогеогр Палеоосадок Палеоэколь 209:165–181
Перекрёстная ссылка
Google Scholar
Boeuf O, Gilbert D (1997) Присутствие Thécamoebiens du жанра Trinema au Pliocène superieur, découverte à Chilhac (Верхняя Луара, Франция). C r hebd Séanc Acad Sci, Paris 325:623–627
C r hebd Séanc Acad Sci, Paris 325:623–627
Google Scholar
Bonnet L (1969) Аспекты общего населения камаёбийской едафики д’Африк междутропикал. Pub Cult Co Diam Ang 81: 136–176
Google Scholar
Bonnet L (1977) «Жители непальских солей и биогеографический биогеографический источник». Bull Soc Hist nat Toulouse 113: 331–348
Google Scholar
Bonnet L (1978) Faunistique et biogeographie des Thécamoebiens IV: Thécamboebiens des sols du massif du Nimba (Кот-д’Ивуар). Bull Soc Hist nat Toulouse 114: 59–64
Google Scholar
Bonnet L (1980) Faunistique et biogéographie des Thécamoebiens. VI. Thécamoebiens де quelques sols де Филиппин. Bull Soc Hist nat Toulouse 116: 277–282
Google Scholar
Bonnet L (1981) Thecamoebiens (Rhizopoda Testacea). В: Trave J (ed) Biologie des sols, том 48. CNFRA, стр. 23–32
В: Trave J (ed) Biologie des sols, том 48. CNFRA, стр. 23–32
Google Scholar
Bonnet L (1983) Интересная биогеография и палеогеография Thécamoebiens des sols. Annls Stn limnol Besse 17:298–334
Google Scholar
Bonnet L, Gomez-Sanchez M-S (1994) Thécamoebiens édaphiques (Rhizopoda, Arcellinida) в географическом ограничении распространения в Астурии и на юго-западе Франции. Bull Soc Hist nat Toulouse 130: 7–14
Google Scholar
Бут Р. (2002) Раковинные амебы как палеоиндикаторы изменений поверхностной влажности на торфяниках Мичигана: современная экология и гидрологическая калибровка. Дж Палеолимнол 28:329–348
Перекрестная ссылка
Google Scholar
Cailleux A (1978) Географическое возмещение в отношении особей Текамебье. К Р Соц Биогеогр 472:29–39
Google Scholar
Кэш Дж. , Уэйлс Г.Х., Хопкинсон Дж. (1919) Британские пресноводные корненожки и гелиозоа. IV добавка к корненожкам. Общество Рэя, Лондон
, Уэйлс Г.Х., Хопкинсон Дж. (1919) Британские пресноводные корненожки и гелиозоа. IV добавка к корненожкам. Общество Рэя, Лондон
Google Scholar
Certes A (1891) Protozoaires. В: Mission Scientifique du Cap Horn 1882–1883, Zoology 6: 1–53
.
Google Scholar
Кавалер-Смит Т (2004) Только шесть царств жизни. Proc R Soc London 271:1251–1262
CrossRef
КАС
Google Scholar
Charman DJ (1997) Моделирование гидрологических взаимоотношений раковинных амеб (Protozoa: Rhizopoda) на новозеландских торфяниках. Дж. Рой Сок, Новая Зеландия 27: 465–483
Google Scholar
Корсетти Ф.А., Аврамик С.М., Пирс Д. (2003) Сложная микробиота из снежного кома земных времен: микрофоссилии из неопротерозойской формации Пик Кингстон, Долина Смерти, США. Proc Nat Acad Sci USA 100:4399–4404
CrossRef
пабмед
КАС
Google Scholar
Корсетти Ф. А., Олкотт А.Н., Бейкманс С. (2006) Биотическая реакция на неопротерозойский снежный ком Земли. Палеогеогр Палеоклим Палеоэкол 232:14–130
А., Олкотт А.Н., Бейкманс С. (2006) Биотическая реакция на неопротерозойский снежный ком Земли. Палеогеогр Палеоклим Палеоэкол 232:14–130
Перекрёстная ссылка
Google Scholar
Coupe SJ, Smith HG, Newman AP et al (2003) Биоразложение и микробное разнообразие в проницаемых покрытиях. Europ J Protistol 39:495–498
CrossRef
Google Scholar
Cowling AJ (1983) Респираторные исследования раковинных амеб из морской Антарктики. В: Лебрен П., Андре Х.М., де Медтс А. и др. (ред.) Новые тенденции в биологии почв. Proc 8th Int Coll Soil Zoology, Louvain-la-Neuve, Бельгия, стр. 627
Google Scholar
Decloitre L (1953) Recherches sue les Rhizopodes thécamoebiens de l’A O F. Mem Ins Fr Afr Noire 31:1–249
Google Scholar
Decloitre L (1964) Thecamoebiens de la XII ème Expedition Française Antarctique en Terre Adélie TAAF, Exp Pol Fr Paris
Google Scholar
Decloitre L (1965) Contribution à la faune du Congo (Браззавиль). Миссия A Dexarpentries et A Villiers III Rhizopodes Thécamoebiens. Bull Inst Fr Afr Noire 27: 165–184
Миссия A Dexarpentries et A Villiers III Rhizopodes Thécamoebiens. Bull Inst Fr Afr Noire 27: 165–184
Google Scholar
Decloitre L (1985) Французская камеобология. Ann Soc Sc Nat Arch Toulon et du Var 37: 117–122
Google Scholar
Deflandre G (1928) Жанр Arcella Эренберг. Арка Протистенка 64:152–287
Google Scholar
Deflandre G (1936) Монографический этюд в жанре Небела Лейди. Энн Протистол 5: 201–322
Google Scholar
Эстебан Г.Ф., Кларк К.Дж., Олмо Дж.Л. и др. (2006) Почвенные простейшие – Интенсивное исследование динамики популяций и структуры сообщества в горных пастбищах. Appl Soil Ecol 33:137–151
Перекрёстная ссылка
Google Scholar
Finlay BJ (2002) Глобальное распространение свободноживущих микробных видов эукариот. Science 296:1061–1063
Science 296:1061–1063
CrossRef
пабмед
КАС
Google Scholar
Финлей Б.Дж., Фенчел Т. (2004)Космополитические метапопуляции свободноживущих микробных эукариот. Protist 155:237–244
CrossRef
пабмед
Google Scholar
Финлей Б.Дж., Эстебан Г.Ф., Кларк К.Дж. и др. (2001) Биоразнообразие наземных простейших представляется однородным в локальном и глобальном пространственных масштабах. Protist 152:355–366
CrossRef
пабмед
КАС
Google Scholar
Foissner W (2006) Биогеография и распространение микроорганизмов: обзор, посвященный протистам. Acta Protozool 45:111–136
Google Scholar
Фойснер В., Шиллер В. (2001) Стабильность в течение 15 миллионов лет: исследование с помощью сканирующего электронного микроскопа миоценовых эвглифовых текамеб из Германии с описанием нового рода Scutiglypha . Eur J Protistol 37:167–180
Eur J Protistol 37:167–180
CrossRef
Google Scholar
Gautier-Lièvre L (1954) Жанры Nebela, Paraquadrula и Pseudonebela (Rhizopodes testacés) в Африке. Арх Протистенк 103: 241–370
Google Scholar
Gericke JMS (1932) На двух видах Nebela , обнаруженных в Южной Африке. Южная Африка J Sci Йоханнесбург 29: 624–626
Google Scholar
Gilbert D, Mitchell EAD, Amblard C et al (2003) Динамика популяции и пищевые предпочтения раковинной амебы Комплекс Nebela tincta major—bohemica—collaris (Protozoa) в Sphagnum торфяник. Acta Protozool 42:99–104
Google Scholar
Golemansky V (1963) Matériaux sur la faune rhizopodique de Guinnee. Thécamoebiens du Massif du Foutadjalon. Африканская речь, NS 1: 39–54
Google Scholar
Grospietsch T (1958) Beitrag zur Rhizopodenfauna Deutschlands: Die Thekamöben der Rhön. Hydrobiologia 10:305–322
Hydrobiologia 10:305–322
CrossRef
Google Scholar
Grospietsch T (1971) Beitrag zur Ökologie der Testaceen Rhizopoden von Marion Island. В: Зиндерен Баккер Э. М. Ван, Уинтерботтом Дж. М., Дайер Р. А. (ред.) Марион и острова Принца Эдуарда, отчет о южноафриканской биологической и геологической экспедиции 1965–1966 гг. AA Balkema, Кейптаун, стр. 411–423
Google Scholar
Хайнис Ф. (1914) Die Moosfauna Columbiens. В: Fuhrmann O, Mayor E (eds) Voyage d’exploration scientifique en Colombie. Mem Soc Neuchateloise Sci Nat 5: 675–730
Google Scholar
Hoogenraad HR, Groot AA de (1940) Moosbewohnende Thekamoebe Rhizopoden von Java und Sumatra. Треубия 17: 209–259
Google Scholar
Hoogenraad HR, Groot AA de (1979) Die geographische Verbreitung der Süßwasser Rhizopoden. Hydrobiol Bull (Амстердам) 13:152–171
Hydrobiol Bull (Амстердам) 13:152–171
CrossRef
Google Scholar
Jennings HS (1916) Наследственность, изменчивость и результаты отбора при однородительском размножении Difflugia corona . Генетика 1:407–534
PubMed
КАС
Google Scholar
Jung W (1936) Thecamöben ursprünglicher lebender deutscher Hochmoore. Абх Ландесмус Вестф 7: 1–87
Google Scholar
Jung W (1942a) Illustrierte Thekamöben – Bestimmungstabellan. I. Die Systematik der Nebelinen. Арка Протистенька 95:357–390
Google Scholar
Jung W (1942b) Südchilenische Thekamöben. Арка Протистенка 95:253–356
Google Scholar
Корганова Г.А. (1994) Раковинные амебы (Protozoa) в островных экосистемах. В кн.: Популяции животных островов юго-западной Океании. Наука, Москва, стр. 184–209
Наука, Москва, стр. 184–209
Google Scholar
Laminger H (1973a) Die Testaceen (Protozoa, Rhizopoda) einiger Hochgebirgsgewässer из Мексики, Коста-Рики и Гватемалы. Int Rev Ges Hydrobiol 58:273–305
CrossRef
Google Scholar
Laminger H (1973b) Die Testaceen in der Umgebung der Station Büschelbach (Spessart/BRD). Hydrobiologia 41:501–513
CrossRef
Google Scholar
Lara E, Heger TJ, Mitchell EAD et al (2007a) SSU рРНК обнаруживает последовательное увеличение сложности раковины раковинных амеб Euglyphid (Rhizaria: Euglyphida). Протист 158:229–237
Перекрестная ссылка
пабмед
КАС
Google Scholar
Lara E, Heger TJ, Ekelund F et al (2007b) Гены рибосомной РНК бросают вызов монофилии Nebela и Hyalosphenia (Arcellinida: Hyalospheniidae) (представлено)
Google Scholar
Laybourn J, Whymant L (1980) Влияние рациона на репродуктивную способность у Arcella vulgaris Эренберг (Саркодина: Тестацида). Экология 45:282–284
Экология 45:282–284
CrossRef
Google Scholar
Longet D, Burki F, Flakowski J et al (2004) Мультигенные доказательства тесных эволюционных отношений между Gromia и Foraminifera. Acta Protozool 43:303–311
CAS
Google Scholar
МакДауэлл Р.М. (2005) Биогеография Фолклендских островов: сходящиеся траектории в южной части Атлантического океана. Дж Биогеог 32:49–62
Перекрестная ссылка
Google Scholar
Meisterfeld R (2002a) Order Arcellinida Kent, 1880. В: Lee JJ, Leedale GE, Bradbury P (eds) иллюстрированное руководство по простейшим, 2-е изд. Аллен Пресс, Лоуренс, Канзас, стр. 827–860
.
Google Scholar
Meisterfeld R (2002b) Раковинные амебы с филоподиями. В: Ли Дж. Дж., Лидейл Г. Э., Брэдбери П. (ред.) Иллюстрированный справочник по простейшим, 2-е изд. Аллен Пресс, Лоуренс, Канзас, стр. 1054–1084
Аллен Пресс, Лоуренс, Канзас, стр. 1054–1084
Google Scholar
Мейстерфельд Р., Тан Л.В. (1998) Первые записи раковинных амеб из национального парка Маунт-Баффало, Виктория. Вик Натуральный 115: 231–238
Google Scholar
Mitchell EAD, Meisterfeld R (2005) Таксономическая путаница размывает полемику о космополитизме и локальном эндемизме свободноживущих протистов. Protist 156: 263–267
CrossRef
пабмед
Google Scholar
Mitchell EAD, Charman DJ, Warner BG (2007) Раковинные амебы (Protozoa) в экологических и палеоэкологических исследованиях водно-болотных угодий: прошлое, настоящее и будущее. Биодив Консерв (в печати)
Google Scholar
Nicholls KH (2003) Corythionella golemanski sp.n. новый пресноводный, нитевидный, раковинный корненожок. Acta Protozool 42:75–80
Acta Protozool 42:75–80
Google Scholar
Nicholls KH (2005) Cyclopyxis acmodata sp.n. и Arcella formosa n.sp.: два новых вида раковинных корненожек (Arcellinida, Protozoa) из угрожаемых водно-болотных угодий в Онтарио, Канада. Can Field Natur 119:403–411
Google Scholar
Николаев С.И., Митчелл Е.А.Д., Петров Н.Б. и др. (2005) Раковинные лопастные амебы (отряд Arcellinida Kent, 1880) наконец находят свой дом внутри Amoebozoa. Протист 156:191–202
Перекрёстная ссылка
пабмед
Google Scholar
Ogden CG (1984) Структура раковины некоторых раковинных амеб из Великобритании (Protozoa, Rhizopoda). J Nat Hist 18:341–361
CrossRef
Google Scholar
Огден К.Г., Хедли Р.Х. (1980) Атлас пресноводных раковинных амеб. Британский музей (естественной истории), OUP, Оксфорд
Google Scholar
Oye P van (1956) О фауне Thecamoeban Новой Зеландии с описанием четырех новых видов и биогеографическим обсуждением. Hydrobiologia 8:16–37
Hydrobiologia 8:16–37
CrossRef
Google Scholar
Oye P van (1960) К биогеографии Rhizopods и Desmids. Scientiae naturalis studia et opuscula in honorem septuagenarii W Weisbach, 61–78
Google Scholar
Penard E (1902) Faune rhizopodique du bassin du leman. Кюндиг, Женева
Google Scholar
Penard E (1903) Notification sur les Rhizopodes du Spitzbergen. Арка Протистенка 2:238–282
Google Scholar
Penard E (1938) Les infiniment petits dans leurs manifests vitals. Георг и Си, Женева
Google Scholar
Пойнар Г.О., Вагонер Б.М., Бауэр У.К. (1993) Наземные мягкотелые протисты и другие организмы в триасовом янтаре. Science 259:222–224
CrossRef
пабмед
Google Scholar
Портер С. М., Мейстерфельд Р., Нолл А.Х. (2003) Микрофоссилии в форме вазы из неопротерозойской группы чуаров, Гранд-Каньон: классификация, основанная на современных панцирных амебах. J Палеонтол 77: 409–429
М., Мейстерфельд Р., Нолл А.Х. (2003) Микрофоссилии в форме вазы из неопротерозойской группы чуаров, Гранд-Каньон: классификация, основанная на современных панцирных амебах. J Палеонтол 77: 409–429
CrossRef
Google Scholar
Рихтерс Ф. (1908) Beitrag zur Kenntnis der Moosfauna Australiens und der Inseln des Pazifischen Ozeans. Зул Ярб 26: 196–213
Google Scholar
Шмидт А.Р., Шенборн В., Шефер У. (2004) Разнообразные ископаемые амебы в немецком мезозойском янтаре. Палеонтология 47:185–197
CrossRef
Google Scholar
Schönborn W (1966) Beschalte Amöben (Testaceen). Цимсен, Виттенберг-Лютерштадт
Google Scholar
Schönborn W, Dörfelt H, Foissner W et al (1999) Окаменелый микроценоз в триасовом янтаре. J Eukaryot Microbiol 46:571–584
CrossRef
Google Scholar
Schroeter D (2001) Структура и функция пищевых цепей редуцентов лесов вдоль европейского трансекта север-юг с особым акцентом на раковинных амебах (Protozoa). Кандидатская диссертация, кафедра экологии животных, Гиссенский университет
Кандидатская диссертация, кафедра экологии животных, Гиссенский университет
Google Scholar
Smith HG (1973) Температурные отношения и биполярная биогеография рода инфузорий Colpoda . Bull Br Antarct Surv 37: 7–13
Google Scholar
Smith HG (1978) Распространение и экология наземных простейших субантарктических и морских антарктических островов. Научный представитель Br Antarct Surv 95:1–104
Google Scholar
Smith HG (1982) Наземная простейшая фауна Южной Георгии. Pol Biol 1:173–179
CrossRef
Google Scholar
Smith HG (1985) Колонизация вулканической тефры на острове Десепшн простейшими: долгосрочные тенденции. Bull Br Antarct Surv 66: 19–33
Google Scholar
Smith HG (1996) Разнообразие антарктических наземных простейших. Биодив Консерв 5:1379–1394
Биодив Консерв 5:1379–1394
Перекрестная ссылка
Google Scholar
Smith HG, Wilkinson DM (1987) Биогеография раковинных корненожек в южной умеренной и антарктической зонах. In: Trehen P (ed) 2 eme Colloque sur les экосистемы terrestres subantarctiques Paimpont, CNF R A 58:83–96
Google Scholar
Smith HG, Wilkinson DM (2007) Не все свободноживущие микроорганизмы имеют космополитическое распространение – пример Небела (Аподера) vas Цертес. J Biogeog 34:1822–1831
CrossRef
Google Scholar
Стаут Д.Д. (1969) Значение биогеографии в экологии почвенных обитателей простейших. В кн.: Успехи протозоологии, Тезисы докладов III международного конгресса протозоологов, Наука. Ленинград, стр. 212–213
Google Scholar
Тодоров М. (2001) Раковинные амебы (Protozoa: Rhizopoda) в почве и подстилке буковых лесов ( Fagus sylvatica L.) из Болгарии. Acta Zool Bulg 53:19–37
(2001) Раковинные амебы (Protozoa: Rhizopoda) в почве и подстилке буковых лесов ( Fagus sylvatica L.) из Болгарии. Acta Zool Bulg 53:19–37
Google Scholar
Тодоров М. (2002) Морфология, биометрия и экология Nebela bigibbosa Penard 1890 (Protozoa: Rhizopoda). Acta Protozool 41:239–244
Google Scholar
Тодоров М., Големанский В. (1999) Planhoogenraadia bonneti sp.n. и Centropyxis thailandica сп.н. (Rhizopoda: Testacea), два новых панцирных из Таиланда. Acta Protozool 38:255–261
Google Scholar
Tyler PA (1996) Эндемизм пресноводных водорослей с особой ссылкой на регион Австралии. Гидробиология 336:1–9
Google Scholar
Винке С., Греммен Н., Бейенс Л. и др. (2004) Живущая во мхах панцирная фауна острова Иль-де-ла-Поссессион. Пол Биол 27: 753–766
Пол Биол 27: 753–766
Перекрёстная ссылка
Google Scholar
Винке С., Ван дер Вийвер Б., Греммен Н. и др. (2006a) Живущая во мхах раковинная фауна залива Стрёмнесс (Южная Джорджия). Acta Protozool 45:65–75
Google Scholar
Винке С., Ван дер Вийвер Б., Нийс И. и др. (2006b) Изменения в структуре сообщества панцирных на небольших почвенных профилях. Acta Protozool 45:395–406
Google Scholar
Вучетич М.С. (1972) Tres nuevas teamebas muscicolas para la Argentina (Rhizopoda Testacea). Неотропика 18:126–128
Google Scholar
Vucetich MC (1978) Commentarios sobre le genero Certesella Loeblich & Tappan, 1961 y estudio de la estereo ultraestructura tecal de tres especies austroamericanas (Rhizopoda: Testaceolobosa). Obra del Centenario del Museo de la Plata 6: 305–313
Google Scholar
Вагонер Б. М. (1996) Бактерии и протисты из среднего мелового янтаря округа Элсворт, штат Канзас. Палеобиос 17:20–26
М. (1996) Бактерии и протисты из среднего мелового янтаря округа Элсворт, штат Канзас. Палеобиос 17:20–26
Google Scholar
Wanner M (1999) Обзор изменчивости раковинных амеб: методологические подходы, влияние окружающей среды и таксономические последствия. Acta Protozool 38:15–29
Google Scholar
Wanner M, Meisterfeld R (1994) Влияние некоторых факторов окружающей среды на морфологию раковин раковинных амеб (Rhizopoda, Protozoa). Евро J Протистол 30:91–195
Google Scholar
Ваннер М., Дунгер В. (2002) Первичная иммиграция и смена почвенных организмов на восстановленных участках открытой добычи угля в восточной Германии. Eur J Soil Biol 38:137–143
CrossRef
Google Scholar
Wanner M, Xylander WER (2005) Развитие биоразнообразия наземных раковинных амеб: существует ли вообще какая-либо последовательность? Biol Fertil Soils 41:428–438
CrossRef
Google Scholar
Уилкинсон Д. М. (1990) Ледниковые убежища в Южной Георгии? Протозойные свидетельства. Четвертичные новостиl 62:12–13
М. (1990) Ледниковые убежища в Южной Георгии? Протозойные свидетельства. Четвертичные новостиl 62:12–13
Google Scholar
Wilkinson DM (2001) Каков верхний предел размера для космополитического распространения свободноживущих микроорганизмов? Дж. Биогеография 28: 285–29.1
Перекрёстная ссылка
Google Scholar
Уилкинсон Д.М., Смит Х.Г. (2006) Первоначальный отчет о наземных простейших острова Вознесения. Acta Protozool 45:407–413
Google Scholar
Woodland WA, Charman DJ, Sims PC (1998) Количественные оценки уровня грунтовых вод и влажности почвы в голоценовых торфяниках по раковинным амебам. Голоцен 8: 261–273
CrossRef
Google Scholar
Wylezich C, Meisterfeld R, Michel R и др. (2001) Молекулярная филогения амеб. Зоология 104 (Приложение IV): 72
Google Scholar
Yang J, Beyens L, Shen Y et al (2004) Переописание Difflugia tuberspinifera Hu, Shen Gu et Gong 1997 (Protozoa: Rhizopoda: Arcellinida: Difflugiidae) из Китая.
 Нац. акад. наук,
Нац. акад. наук, Эшмол П., Эшмол М. (2002) Острова Св. Елены и Вознесения: естественная история. Энтони Нельсон, Освестри, Великобритания
Google Scholar
Balik V, Song B (2000) Бентосные пресноводные раковинные амебы (Protozoa: Rhizopoda) из озера Дунтин, Китайская Народная Республика, с описанием нового вида из рода Колларипиксидия . Acta Protozool 39:149–156
Google Scholar
Beyens L, Chardez D (1995) Аннотированный список раковинных амеб, наблюдаемых в Арктике между 27 ° восточной долготы и 168 ° западной долготы. Арка Протистенка 146:219–233
Арка Протистенка 146:219–233
Google Scholar
Beyens L, Chardez D (1997) Новые таксоны раковинных амеб из полярных регионов. Acta Protozool 36:137–142
Google Scholar
Beyens L, Chardez D, Baere D et al (1995) Водная раковинная фауна в районе залива Стромнесс, Южная Джорджия. Antarct Sci 7:3–8
CrossRef Google Scholar
Beyens L, Meisterfeld R (2002) Простейшие: раковинные амебы. В: Смол Дж. П., Биркс Дж. Б., Ласт В. М. и др. (ред.) Отслеживание изменений окружающей среды с использованием озерных отложений. Спрингер, Нидерланды, стр. 121–153
Перекрёстная ссылка Google Scholar
Бобров А.А. (2001) Находка тропической группы раковинных амеб (Protozoa: Testacea) на Дальнем Востоке (Сихотэ-Алинский заповедник). Биол Булл 28:401–417
CrossRef Google Scholar
Бобров А. , Мазей Ю. (2004) Морфологическая изменчивость раковинных амеб (Rhizopoda: Testacealobosea Testaceafilosea) в природных популяциях. Acta Protozool 43: 133–146
, Мазей Ю. (2004) Морфологическая изменчивость раковинных амеб (Rhizopoda: Testacealobosea Testaceafilosea) в природных популяциях. Acta Protozool 43: 133–146
Google Scholar
Бобров А.А., Зигерт Ч., Андреев А.А. и др. (2003) Раковины (Protozoa: Testacea) в четвертичных вечномерзлых отложениях Быковского полуострова, Арктическая Якутия. Биол Булл 30:191–206
CrossRef Google Scholar
Бобров А.А., Андреев А.А., Ширрмейстер Л и др. (2004) Раковинные амебы (Protozoa: Testacealobosea и Testaceafilosea) как биоиндикаторы в позднечетвертичных отложениях полуострова Быковский, море Лаптевых, Россия. Палеогеогр Палеоосадок Палеоэколь 209:165–181
Перекрёстная ссылка Google Scholar
Boeuf O, Gilbert D (1997) Присутствие Thécamoebiens du жанра Trinema au Pliocène superieur, découverte à Chilhac (Верхняя Луара, Франция). C r hebd Séanc Acad Sci, Paris 325:623–627
C r hebd Séanc Acad Sci, Paris 325:623–627
Google Scholar
Bonnet L (1969) Аспекты общего населения камаёбийской едафики д’Африк междутропикал. Pub Cult Co Diam Ang 81: 136–176
Google Scholar
Bonnet L (1977) «Жители непальских солей и биогеографический биогеографический источник». Bull Soc Hist nat Toulouse 113: 331–348
Google Scholar
Bonnet L (1978) Faunistique et biogeographie des Thécamoebiens IV: Thécamboebiens des sols du massif du Nimba (Кот-д’Ивуар). Bull Soc Hist nat Toulouse 114: 59–64
Google Scholar
Bonnet L (1980) Faunistique et biogéographie des Thécamoebiens. VI. Thécamoebiens де quelques sols де Филиппин. Bull Soc Hist nat Toulouse 116: 277–282
Google Scholar
Bonnet L (1981) Thecamoebiens (Rhizopoda Testacea). В: Trave J (ed) Biologie des sols, том 48. CNFRA, стр. 23–32
В: Trave J (ed) Biologie des sols, том 48. CNFRA, стр. 23–32
Google Scholar
Bonnet L (1983) Интересная биогеография и палеогеография Thécamoebiens des sols. Annls Stn limnol Besse 17:298–334
Google Scholar
Bonnet L, Gomez-Sanchez M-S (1994) Thécamoebiens édaphiques (Rhizopoda, Arcellinida) в географическом ограничении распространения в Астурии и на юго-западе Франции. Bull Soc Hist nat Toulouse 130: 7–14
Google Scholar
Бут Р. (2002) Раковинные амебы как палеоиндикаторы изменений поверхностной влажности на торфяниках Мичигана: современная экология и гидрологическая калибровка. Дж Палеолимнол 28:329–348
Перекрестная ссылка Google Scholar
Cailleux A (1978) Географическое возмещение в отношении особей Текамебье. К Р Соц Биогеогр 472:29–39
Google Scholar
Кэш Дж. , Уэйлс Г.Х., Хопкинсон Дж. (1919) Британские пресноводные корненожки и гелиозоа. IV добавка к корненожкам. Общество Рэя, Лондон
, Уэйлс Г.Х., Хопкинсон Дж. (1919) Британские пресноводные корненожки и гелиозоа. IV добавка к корненожкам. Общество Рэя, Лондон
Google Scholar
Certes A (1891) Protozoaires. В: Mission Scientifique du Cap Horn 1882–1883, Zoology 6: 1–53
. Google Scholar
Кавалер-Смит Т (2004) Только шесть царств жизни. Proc R Soc London 271:1251–1262
CrossRef КАС Google Scholar
Charman DJ (1997) Моделирование гидрологических взаимоотношений раковинных амеб (Protozoa: Rhizopoda) на новозеландских торфяниках. Дж. Рой Сок, Новая Зеландия 27: 465–483
Google Scholar
Корсетти Ф.А., Аврамик С.М., Пирс Д. (2003) Сложная микробиота из снежного кома земных времен: микрофоссилии из неопротерозойской формации Пик Кингстон, Долина Смерти, США. Proc Nat Acad Sci USA 100:4399–4404
CrossRef пабмед КАС Google Scholar
Корсетти Ф. А., Олкотт А.Н., Бейкманс С. (2006) Биотическая реакция на неопротерозойский снежный ком Земли. Палеогеогр Палеоклим Палеоэкол 232:14–130
А., Олкотт А.Н., Бейкманс С. (2006) Биотическая реакция на неопротерозойский снежный ком Земли. Палеогеогр Палеоклим Палеоэкол 232:14–130
Перекрёстная ссылка Google Scholar
Coupe SJ, Smith HG, Newman AP et al (2003) Биоразложение и микробное разнообразие в проницаемых покрытиях. Europ J Protistol 39:495–498
CrossRef Google Scholar
Cowling AJ (1983) Респираторные исследования раковинных амеб из морской Антарктики. В: Лебрен П., Андре Х.М., де Медтс А. и др. (ред.) Новые тенденции в биологии почв. Proc 8th Int Coll Soil Zoology, Louvain-la-Neuve, Бельгия, стр. 627
Google Scholar
Decloitre L (1953) Recherches sue les Rhizopodes thécamoebiens de l’A O F. Mem Ins Fr Afr Noire 31:1–249
Google Scholar
Decloitre L (1964) Thecamoebiens de la XII ème Expedition Française Antarctique en Terre Adélie TAAF, Exp Pol Fr Paris
Google Scholar
Decloitre L (1965) Contribution à la faune du Congo (Браззавиль). Миссия A Dexarpentries et A Villiers III Rhizopodes Thécamoebiens. Bull Inst Fr Afr Noire 27: 165–184
Миссия A Dexarpentries et A Villiers III Rhizopodes Thécamoebiens. Bull Inst Fr Afr Noire 27: 165–184
Google Scholar
Decloitre L (1985) Французская камеобология. Ann Soc Sc Nat Arch Toulon et du Var 37: 117–122
Google Scholar
Deflandre G (1928) Жанр Arcella Эренберг. Арка Протистенка 64:152–287
Google Scholar
Deflandre G (1936) Монографический этюд в жанре Небела Лейди. Энн Протистол 5: 201–322
Google Scholar
Эстебан Г.Ф., Кларк К.Дж., Олмо Дж.Л. и др. (2006) Почвенные простейшие – Интенсивное исследование динамики популяций и структуры сообщества в горных пастбищах. Appl Soil Ecol 33:137–151
Перекрёстная ссылка Google Scholar
Finlay BJ (2002) Глобальное распространение свободноживущих микробных видов эукариот. Science 296:1061–1063
Science 296:1061–1063
CrossRef пабмед КАС Google Scholar
Финлей Б.Дж., Фенчел Т. (2004)Космополитические метапопуляции свободноживущих микробных эукариот. Protist 155:237–244
CrossRef пабмед Google Scholar
Финлей Б.Дж., Эстебан Г.Ф., Кларк К.Дж. и др. (2001) Биоразнообразие наземных простейших представляется однородным в локальном и глобальном пространственных масштабах. Protist 152:355–366
CrossRef пабмед КАС Google Scholar
Foissner W (2006) Биогеография и распространение микроорганизмов: обзор, посвященный протистам. Acta Protozool 45:111–136
Google Scholar
Фойснер В., Шиллер В. (2001) Стабильность в течение 15 миллионов лет: исследование с помощью сканирующего электронного микроскопа миоценовых эвглифовых текамеб из Германии с описанием нового рода Scutiglypha . Eur J Protistol 37:167–180
Eur J Protistol 37:167–180
CrossRef Google Scholar
Gautier-Lièvre L (1954) Жанры Nebela, Paraquadrula и Pseudonebela (Rhizopodes testacés) в Африке. Арх Протистенк 103: 241–370
Google Scholar
Gericke JMS (1932) На двух видах Nebela , обнаруженных в Южной Африке. Южная Африка J Sci Йоханнесбург 29: 624–626
Google Scholar
Gilbert D, Mitchell EAD, Amblard C et al (2003) Динамика популяции и пищевые предпочтения раковинной амебы Комплекс Nebela tincta major—bohemica—collaris (Protozoa) в Sphagnum торфяник. Acta Protozool 42:99–104
Google Scholar
Golemansky V (1963) Matériaux sur la faune rhizopodique de Guinnee. Thécamoebiens du Massif du Foutadjalon. Африканская речь, NS 1: 39–54
Google Scholar
Grospietsch T (1958) Beitrag zur Rhizopodenfauna Deutschlands: Die Thekamöben der Rhön. Hydrobiologia 10:305–322
Hydrobiologia 10:305–322
CrossRef Google Scholar
Grospietsch T (1971) Beitrag zur Ökologie der Testaceen Rhizopoden von Marion Island. В: Зиндерен Баккер Э. М. Ван, Уинтерботтом Дж. М., Дайер Р. А. (ред.) Марион и острова Принца Эдуарда, отчет о южноафриканской биологической и геологической экспедиции 1965–1966 гг. AA Balkema, Кейптаун, стр. 411–423
Google Scholar
Хайнис Ф. (1914) Die Moosfauna Columbiens. В: Fuhrmann O, Mayor E (eds) Voyage d’exploration scientifique en Colombie. Mem Soc Neuchateloise Sci Nat 5: 675–730
Google Scholar
Hoogenraad HR, Groot AA de (1940) Moosbewohnende Thekamoebe Rhizopoden von Java und Sumatra. Треубия 17: 209–259
Google Scholar
Hoogenraad HR, Groot AA de (1979) Die geographische Verbreitung der Süßwasser Rhizopoden. Hydrobiol Bull (Амстердам) 13:152–171
Hydrobiol Bull (Амстердам) 13:152–171
CrossRef Google Scholar
Jennings HS (1916) Наследственность, изменчивость и результаты отбора при однородительском размножении Difflugia corona . Генетика 1:407–534
PubMed КАС Google Scholar
Jung W (1936) Thecamöben ursprünglicher lebender deutscher Hochmoore. Абх Ландесмус Вестф 7: 1–87
Google Scholar
Jung W (1942a) Illustrierte Thekamöben – Bestimmungstabellan. I. Die Systematik der Nebelinen. Арка Протистенька 95:357–390
Google Scholar
Jung W (1942b) Südchilenische Thekamöben. Арка Протистенка 95:253–356
Google Scholar
Корганова Г.А. (1994) Раковинные амебы (Protozoa) в островных экосистемах. В кн.: Популяции животных островов юго-западной Океании. Наука, Москва, стр. 184–209
Наука, Москва, стр. 184–209
Google Scholar
Laminger H (1973a) Die Testaceen (Protozoa, Rhizopoda) einiger Hochgebirgsgewässer из Мексики, Коста-Рики и Гватемалы. Int Rev Ges Hydrobiol 58:273–305
CrossRef Google Scholar
Laminger H (1973b) Die Testaceen in der Umgebung der Station Büschelbach (Spessart/BRD). Hydrobiologia 41:501–513
CrossRef Google Scholar
Lara E, Heger TJ, Mitchell EAD et al (2007a) SSU рРНК обнаруживает последовательное увеличение сложности раковины раковинных амеб Euglyphid (Rhizaria: Euglyphida). Протист 158:229–237
Перекрестная ссылка пабмед КАС Google Scholar
Lara E, Heger TJ, Ekelund F et al (2007b) Гены рибосомной РНК бросают вызов монофилии Nebela и Hyalosphenia (Arcellinida: Hyalospheniidae) (представлено)
Google Scholar
Laybourn J, Whymant L (1980) Влияние рациона на репродуктивную способность у Arcella vulgaris Эренберг (Саркодина: Тестацида). Экология 45:282–284
Экология 45:282–284
CrossRef Google Scholar
Longet D, Burki F, Flakowski J et al (2004) Мультигенные доказательства тесных эволюционных отношений между Gromia и Foraminifera. Acta Protozool 43:303–311
CAS Google Scholar
МакДауэлл Р.М. (2005) Биогеография Фолклендских островов: сходящиеся траектории в южной части Атлантического океана. Дж Биогеог 32:49–62
Перекрестная ссылка Google Scholar
Meisterfeld R (2002a) Order Arcellinida Kent, 1880. В: Lee JJ, Leedale GE, Bradbury P (eds) иллюстрированное руководство по простейшим, 2-е изд. Аллен Пресс, Лоуренс, Канзас, стр. 827–860
. Google Scholar
Meisterfeld R (2002b) Раковинные амебы с филоподиями. В: Ли Дж. Дж., Лидейл Г. Э., Брэдбери П. (ред.) Иллюстрированный справочник по простейшим, 2-е изд. Аллен Пресс, Лоуренс, Канзас, стр. 1054–1084
Аллен Пресс, Лоуренс, Канзас, стр. 1054–1084
Google Scholar
Мейстерфельд Р., Тан Л.В. (1998) Первые записи раковинных амеб из национального парка Маунт-Баффало, Виктория. Вик Натуральный 115: 231–238
Google Scholar
Mitchell EAD, Meisterfeld R (2005) Таксономическая путаница размывает полемику о космополитизме и локальном эндемизме свободноживущих протистов. Protist 156: 263–267
CrossRef пабмед Google Scholar
Mitchell EAD, Charman DJ, Warner BG (2007) Раковинные амебы (Protozoa) в экологических и палеоэкологических исследованиях водно-болотных угодий: прошлое, настоящее и будущее. Биодив Консерв (в печати)
Google Scholar
Nicholls KH (2003) Corythionella golemanski sp.n. новый пресноводный, нитевидный, раковинный корненожок. Acta Protozool 42:75–80
Acta Protozool 42:75–80
Google Scholar
Nicholls KH (2005) Cyclopyxis acmodata sp.n. и Arcella formosa n.sp.: два новых вида раковинных корненожек (Arcellinida, Protozoa) из угрожаемых водно-болотных угодий в Онтарио, Канада. Can Field Natur 119:403–411
Google Scholar
Николаев С.И., Митчелл Е.А.Д., Петров Н.Б. и др. (2005) Раковинные лопастные амебы (отряд Arcellinida Kent, 1880) наконец находят свой дом внутри Amoebozoa. Протист 156:191–202
Перекрёстная ссылка пабмед Google Scholar
Ogden CG (1984) Структура раковины некоторых раковинных амеб из Великобритании (Protozoa, Rhizopoda). J Nat Hist 18:341–361
CrossRef Google Scholar
Огден К.Г., Хедли Р.Х. (1980) Атлас пресноводных раковинных амеб. Британский музей (естественной истории), OUP, Оксфорд
Google Scholar
Oye P van (1956) О фауне Thecamoeban Новой Зеландии с описанием четырех новых видов и биогеографическим обсуждением. Hydrobiologia 8:16–37
Hydrobiologia 8:16–37
CrossRef Google Scholar
Oye P van (1960) К биогеографии Rhizopods и Desmids. Scientiae naturalis studia et opuscula in honorem septuagenarii W Weisbach, 61–78
Google Scholar
Penard E (1902) Faune rhizopodique du bassin du leman. Кюндиг, Женева
Google Scholar
Penard E (1903) Notification sur les Rhizopodes du Spitzbergen. Арка Протистенка 2:238–282
Google Scholar
Penard E (1938) Les infiniment petits dans leurs manifests vitals. Георг и Си, Женева
Google Scholar
Пойнар Г.О., Вагонер Б.М., Бауэр У.К. (1993) Наземные мягкотелые протисты и другие организмы в триасовом янтаре. Science 259:222–224
CrossRef пабмед Google Scholar
Портер С. М., Мейстерфельд Р., Нолл А.Х. (2003) Микрофоссилии в форме вазы из неопротерозойской группы чуаров, Гранд-Каньон: классификация, основанная на современных панцирных амебах. J Палеонтол 77: 409–429
М., Мейстерфельд Р., Нолл А.Х. (2003) Микрофоссилии в форме вазы из неопротерозойской группы чуаров, Гранд-Каньон: классификация, основанная на современных панцирных амебах. J Палеонтол 77: 409–429
CrossRef Google Scholar
Рихтерс Ф. (1908) Beitrag zur Kenntnis der Moosfauna Australiens und der Inseln des Pazifischen Ozeans. Зул Ярб 26: 196–213
Google Scholar
Шмидт А.Р., Шенборн В., Шефер У. (2004) Разнообразные ископаемые амебы в немецком мезозойском янтаре. Палеонтология 47:185–197
CrossRef Google Scholar
Schönborn W (1966) Beschalte Amöben (Testaceen). Цимсен, Виттенберг-Лютерштадт
Google Scholar
Schönborn W, Dörfelt H, Foissner W et al (1999) Окаменелый микроценоз в триасовом янтаре. J Eukaryot Microbiol 46:571–584
CrossRef Google Scholar
Schroeter D (2001) Структура и функция пищевых цепей редуцентов лесов вдоль европейского трансекта север-юг с особым акцентом на раковинных амебах (Protozoa). Кандидатская диссертация, кафедра экологии животных, Гиссенский университет
Кандидатская диссертация, кафедра экологии животных, Гиссенский университет
Google Scholar
Smith HG (1973) Температурные отношения и биполярная биогеография рода инфузорий Colpoda . Bull Br Antarct Surv 37: 7–13
Google Scholar
Smith HG (1978) Распространение и экология наземных простейших субантарктических и морских антарктических островов. Научный представитель Br Antarct Surv 95:1–104
Google Scholar
Smith HG (1982) Наземная простейшая фауна Южной Георгии. Pol Biol 1:173–179
CrossRef Google Scholar
Smith HG (1985) Колонизация вулканической тефры на острове Десепшн простейшими: долгосрочные тенденции. Bull Br Antarct Surv 66: 19–33
Google Scholar
Smith HG (1996) Разнообразие антарктических наземных простейших. Биодив Консерв 5:1379–1394
Биодив Консерв 5:1379–1394
Перекрестная ссылка Google Scholar
Smith HG, Wilkinson DM (1987) Биогеография раковинных корненожек в южной умеренной и антарктической зонах. In: Trehen P (ed) 2 eme Colloque sur les экосистемы terrestres subantarctiques Paimpont, CNF R A 58:83–96
Google Scholar
Smith HG, Wilkinson DM (2007) Не все свободноживущие микроорганизмы имеют космополитическое распространение – пример Небела (Аподера) vas Цертес. J Biogeog 34:1822–1831
CrossRef Google Scholar
Стаут Д.Д. (1969) Значение биогеографии в экологии почвенных обитателей простейших. В кн.: Успехи протозоологии, Тезисы докладов III международного конгресса протозоологов, Наука. Ленинград, стр. 212–213
Google Scholar
Тодоров М. (2001) Раковинные амебы (Protozoa: Rhizopoda) в почве и подстилке буковых лесов ( Fagus sylvatica L.) из Болгарии. Acta Zool Bulg 53:19–37
(2001) Раковинные амебы (Protozoa: Rhizopoda) в почве и подстилке буковых лесов ( Fagus sylvatica L.) из Болгарии. Acta Zool Bulg 53:19–37
Google Scholar
Тодоров М. (2002) Морфология, биометрия и экология Nebela bigibbosa Penard 1890 (Protozoa: Rhizopoda). Acta Protozool 41:239–244
Google Scholar
Тодоров М., Големанский В. (1999) Planhoogenraadia bonneti sp.n. и Centropyxis thailandica сп.н. (Rhizopoda: Testacea), два новых панцирных из Таиланда. Acta Protozool 38:255–261
Google Scholar
Tyler PA (1996) Эндемизм пресноводных водорослей с особой ссылкой на регион Австралии. Гидробиология 336:1–9
Google Scholar
Винке С., Греммен Н., Бейенс Л. и др. (2004) Живущая во мхах панцирная фауна острова Иль-де-ла-Поссессион. Пол Биол 27: 753–766
Пол Биол 27: 753–766
Перекрёстная ссылка Google Scholar
Винке С., Ван дер Вийвер Б., Греммен Н. и др. (2006a) Живущая во мхах раковинная фауна залива Стрёмнесс (Южная Джорджия). Acta Protozool 45:65–75
Google Scholar
Винке С., Ван дер Вийвер Б., Нийс И. и др. (2006b) Изменения в структуре сообщества панцирных на небольших почвенных профилях. Acta Protozool 45:395–406
Google Scholar
Вучетич М.С. (1972) Tres nuevas teamebas muscicolas para la Argentina (Rhizopoda Testacea). Неотропика 18:126–128
Google Scholar
Vucetich MC (1978) Commentarios sobre le genero Certesella Loeblich & Tappan, 1961 y estudio de la estereo ultraestructura tecal de tres especies austroamericanas (Rhizopoda: Testaceolobosa). Obra del Centenario del Museo de la Plata 6: 305–313
Google Scholar
Вагонер Б. М. (1996) Бактерии и протисты из среднего мелового янтаря округа Элсворт, штат Канзас. Палеобиос 17:20–26
М. (1996) Бактерии и протисты из среднего мелового янтаря округа Элсворт, штат Канзас. Палеобиос 17:20–26
Google Scholar
Wanner M (1999) Обзор изменчивости раковинных амеб: методологические подходы, влияние окружающей среды и таксономические последствия. Acta Protozool 38:15–29
Google Scholar
Wanner M, Meisterfeld R (1994) Влияние некоторых факторов окружающей среды на морфологию раковин раковинных амеб (Rhizopoda, Protozoa). Евро J Протистол 30:91–195
Google Scholar
Ваннер М., Дунгер В. (2002) Первичная иммиграция и смена почвенных организмов на восстановленных участках открытой добычи угля в восточной Германии. Eur J Soil Biol 38:137–143
CrossRef Google Scholar
Wanner M, Xylander WER (2005) Развитие биоразнообразия наземных раковинных амеб: существует ли вообще какая-либо последовательность? Biol Fertil Soils 41:428–438
CrossRef Google Scholar
Уилкинсон Д. М. (1990) Ледниковые убежища в Южной Георгии? Протозойные свидетельства. Четвертичные новостиl 62:12–13
М. (1990) Ледниковые убежища в Южной Георгии? Протозойные свидетельства. Четвертичные новостиl 62:12–13
Google Scholar
Wilkinson DM (2001) Каков верхний предел размера для космополитического распространения свободноживущих микроорганизмов? Дж. Биогеография 28: 285–29.1
Перекрёстная ссылка Google Scholar
Уилкинсон Д.М., Смит Х.Г. (2006) Первоначальный отчет о наземных простейших острова Вознесения. Acta Protozool 45:407–413
Google Scholar
Woodland WA, Charman DJ, Sims PC (1998) Количественные оценки уровня грунтовых вод и влажности почвы в голоценовых торфяниках по раковинным амебам. Голоцен 8: 261–273
CrossRef Google Scholar
Wylezich C, Meisterfeld R, Michel R и др. (2001) Молекулярная филогения амеб. Зоология 104 (Приложение IV): 72
Google Scholar
Yang J, Beyens L, Shen Y et al (2004) Переописание Difflugia tuberspinifera Hu, Shen Gu et Gong 1997 (Protozoa: Rhizopoda: Arcellinida: Difflugiidae) из Китая.

 Тогда кровяные тельца, в которых развивались паразиты, окончательно разрушаются, молодые мерозоиты попадают в кровяную жидкость, а затем проникают в новые кровяные тельца
Тогда кровяные тельца, в которых развивались паразиты, окончательно разрушаются, молодые мерозоиты попадают в кровяную жидкость, а затем проникают в новые кровяные тельца