Инфузория-туфелька — Биология — Презентации
Гетеротрофный протист
Инфузория туфелька
Среда обитания и внешнее строение
Простейшие этого многочисленного типа (свыше 7 тыс. видов) широко
распространены в природе. Они приспособились к обитанию в морской
и пресной воде, влажной почве. Немалое количество видов инфузорий
ведет паразитический образ жизни.
Названо животное так из-за сходства формы с дамской туфелькой. Длина
тела около 0,2-0,3 мм.
Движение
Инфузории отличные пловцы. Скорость передвижения инфузории-туфельки
составляет 2-2,5 мм/с. Она движется передним концом вперед, вращаясь
вдоль продольной оси тела вправо. За 1 с каждая ресничка совершает до 30
биений. Во время движение назад ресничка выпрямляется, а при движении
вперед – описывает полукруг. Согласованные движения групп ресничек
вызывают волнообразные колебания всех ресничек инфузории.
и быстрота движения туфельки не являются величинами постоянными и
неизменными. Изменение направления движения простейших под влиянием
Различных раздражителей называют таксисами .
Внутреннее строение
Внешняя оболочка
Снаружи тело туфельки покрыто эластичной двойной мембраной – пелликулой .
Цитоплазма делится на два слоя: наружный – эктоплазму , и внутренний –
эндоплазму . В состав эктоплазмы входит сложная сеть скелетных элементов,
названных кортексом . В нем закрепляются органоиды передвижения инфузории — реснички . В эктоплазме заметны небольшие палочковидные образования, расположенные перпендикулярно к поверхности пелликулы – трихоцисты (функции – защита и нападение)
Передняя часть
реснички
трихоцисты
пелликула
Задняя часть
Сократительная вакуоль
В передней и задней частях клетки располагается по одной сократительной вакуоли . Каждая имеет центральный резервуар и систему круговых приводящих каналов числом 5-7. вначале продукты распада поступают в приводящие каналы, а оттуда – в центральный резервуар. По мере наполнения он изливает свое содержимое во внешнюю среду. Частота пульсации сократительной вакуоли зависит от температуры и осмотического давления (при н. у. весь цикл длится 10-15 с.)
Каждая имеет центральный резервуар и систему круговых приводящих каналов числом 5-7. вначале продукты распада поступают в приводящие каналы, а оттуда – в центральный резервуар. По мере наполнения он изливает свое содержимое во внешнюю среду. Частота пульсации сократительной вакуоли зависит от температуры и осмотического давления (при н. у. весь цикл длится 10-15 с.)
Сократительная вакуоль
Ядерный аппарат
Ядерный аппарат инфузорий устроен не так, как у других простейших.
Он состоит из двух ядер: большого (макронуклеуса) и малого (микронуклеуса).
Такое явление называется ядерным дуализмом .
Макронуклеус – соматическое, или вегетативное ядро, регулирует все жизненные процессы инфузорий.
Микронуклеус – половое, или генеративное ядро, играет основную роль в половом процессе
макронуклеус
микронуклеус
Питание
Инфузория-туфелька – одно из самых прожорливых животных: она непрерывно
питается. Пищей являются бактерии и взвешенные в воде органические частицы.
Пищей являются бактерии и взвешенные в воде органические частицы.
Реснички создают непрерывный ток воды в направлении ротового отверстия ,
которое всегда открыто. Пищевые частицы далее заносятся в трубкообразную
глотку и скапливается у ее основания. Вместе с небольшим количеством воды
пищевые частицы втягиваются в цитоплазму, формируя пищеварительную
вакуоль . Пищеварительная вакуоль проделывает определенный путь, в это
время внутри вакуоли происходит переваривание пищи. Продукты переварива-
ния всасываются через стенку вакуоли в эндоплазму, непереваренные остатки
выбрасываются во внешнюю среду через порошицу .
Пищеварительные вакуоли
Ротовое отверстие
порошица
глотка
Дыхание
Всей поверхностью тела
О 2
СО 2
Бесполое размножение
Бесполое размножение происходит путем поперечного деления
Половой процесс
Периодически у инфузорий наблюдается половой процесс – конъюгация.
Две инфузории сближаются и соприкасаются своими брюшными сторонами
с образованием цитоплазматических мостиков. У обоих особей растворяется
содержимое макронуклеусов, а микронуклеусы делятся на 4 ядра, из которых
3 разрушаются, а последнее делится еще раз . Коньюгаты обмениваются
ядрами. Развивается новый макронуклеус. В процессе конъюгации количество особей не увеличивается, а происходит обмен генетической информацией. Это ведет к повышению наследственной изменчивости, наследственного многообразия, увеличиваются приспособительные возможности организма к условиям окружающей среды
Представители Ресничных
Балантидий паразитирует в толстом кишечнике человека и свиней,
вызывает воспаление толстого кишечника. Помимо кишечника человека
и свиней, балантидий может паразитировать в кишечнике крыс и
человекообразных обезьян.
Триходины являются эктопаразитами рыб и поражают кожные покровы,
плавники, жабры
Особенно многочисленны и разнообразны инфузории, населяющие кишечный
тракт копытных животных.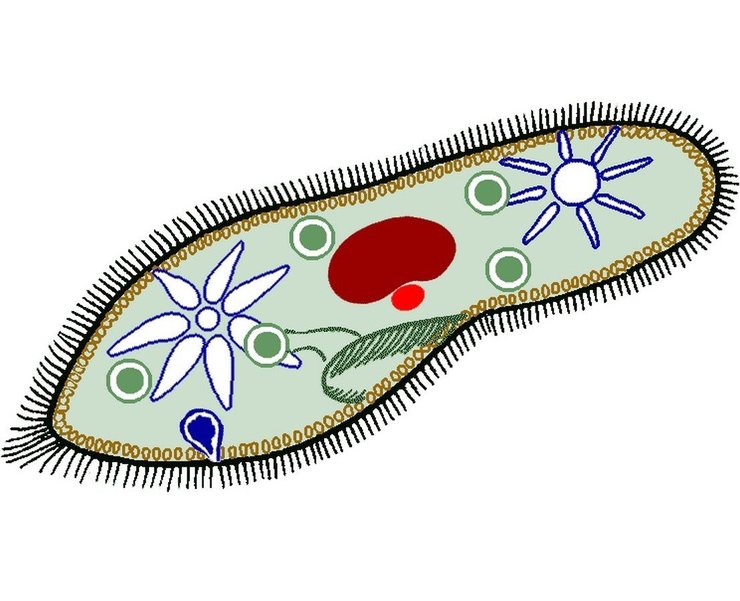 У жвачных (овцы, козы, олени, лоси) они в огромных
У жвачных (овцы, козы, олени, лоси) они в огромных
количествах населяют передние отделы желудка. (Помогают переваривать пищу)
В 1 см3 содержимого рубца количество инфузорий достигает 1 млн. иногда и
более
http:// LearningApps.org/display?v=p188tz0in01
Биологи изучили микробиом инфузорий — Индикатор
Группа ученых из Санкт-Петербургского государственного университета, Института клеточного и внутриклеточного симбиоза УрО РАН, университетов Пизы и Флоренции представила результаты исследования микробиома инфузорий-трубачей (Stentor coeruleus). Это одно из первых в мире исследований микробиомов одноклеточных эукариот, которое стало возможно благодаря метагеномному анализу. Научная работа опубликована в журнале Scientific Reports.
Микробиом — это совокупность микроорганизмов, населяющих общую экологическую нишу. Он существует и в природных биотопах (например, водоеме или участке лесной почвы), и у живых многоклеточных организмов-хозяев (человека, животного или растения).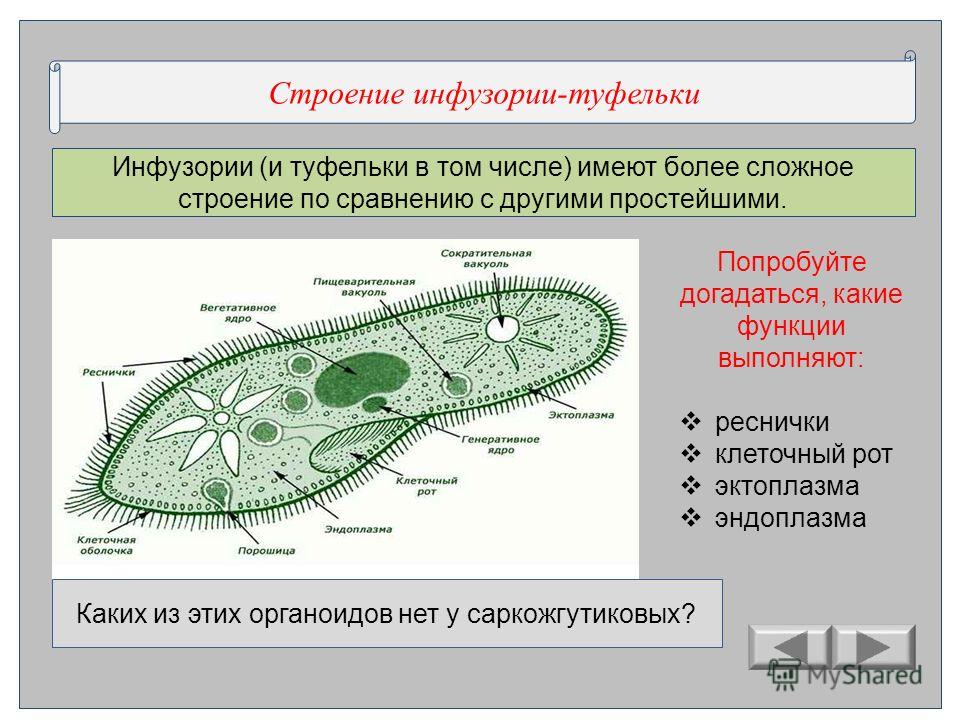 В состав микробиома могут входить бактерии, археи и одноклеточные эукариоты — протисты и грибы.
В состав микробиома могут входить бактерии, археи и одноклеточные эукариоты — протисты и грибы.
На протяжении трех лет ученые проводили анализ микробиомов двух видов инфузорий: туфелек (Paramecium, или парамеций) и трубачей (Stentor, или стенторов). Результаты исследования инфузорий-туфелек были опубликованы минувшей зимой. Новая публикация — следующий шаг на пути изучения микробиомов протистов.
«Исследования микробиомов человека и животных сейчас очень популярны, но микробиомы протистов только начинают изучать. Ранее вопрос о том, могут ли сами протисты обладать микробиомом, то есть выступать в качестве хозяев для сообщества прокариот, практически не затрагивался, поэтому наши результаты, по сути, формируют новое научное направление», — отмечает руководитель исследования, профессор кафедры микробиологии СПбГУ кандидат биологических наук Алексей Потехин.
Мысль о том, что у инфузорий может быть свой микробиом, возникла не случайно: ученым известно, что эти организмы погибают в стерильных условиях. Для поддержания их в жизнеспособном состоянии необходимо присутствие бактерий в среде. Однако охарактеризовать состав этих бактерий подробно, а также отделить «население» инфузории от обитателей водоема, из которого она была взята, было практически невозможно из-за отсутствия методов. Приблизиться к разгадке позволил метагеномный анализ, который раньше практически не применялся к протистам.
Для поддержания их в жизнеспособном состоянии необходимо присутствие бактерий в среде. Однако охарактеризовать состав этих бактерий подробно, а также отделить «население» инфузории от обитателей водоема, из которого она была взята, было практически невозможно из-за отсутствия методов. Приблизиться к разгадке позволил метагеномный анализ, который раньше практически не применялся к протистам.
«Этот подход позволяет выявить и прочитать все маркерные последовательности ДНК в образце, по которым можно затем идентифицировать их хозяев (для бактерий и архей это последовательность гена 16S рРНК). Благодаря метагеномному анализу и высокопроизводительному секвенированию в последние 10–15 лет колоссально выросли наши представления о разнообразии микроорганизмов в природе. Мы применили метагеномный анализ для выявления бактерий, ассоциированных с клетками широко распространенных пресноводных инфузорий — Stentor и Paramecium», — рассказывает ученый.
Исследователи выяснили, что состав микроорганизмов в среде обитания инфузорий, будь то природный водоем или лабораторная культура, всегда заметно отличается от совокупности бактерий, в значительном количестве обнаруживающихся в ассоциации с самими инфузориями. Разнообразие микроорганизмов в природных водоемах всегда богаче, чем в клетках инфузорий, однако ученым удалось обнаружить в них представителей десятков родов бактерий. Каждая клетка инфузории оказалась самостоятельной экологической нишей.
Разнообразие микроорганизмов в природных водоемах всегда богаче, чем в клетках инфузорий, однако ученым удалось обнаружить в них представителей десятков родов бактерий. Каждая клетка инфузории оказалась самостоятельной экологической нишей.
«Таким образом, у инфузорий действительно существует собственный микробиом», — подчеркивает Алексей Потехин.
Второй важный вывод, к которому пришли ученые, — микробиом стенторов отличается от микробиома парамеций, то есть разные инфузории, даже выделенные из одного водоема, сосуществуют с разными бактериями. Однако чтобы определить видовые особенности микробиомов, их стабильность и специфичность, понадобятся дальнейшие исследования.
И наконец, третье открытие, которое сделали биологи, — в микробиомах инфузорий, особенно трубачей, живут представители родов бактерий, в которых встречаются виды-комменсалы, оппортунисты и патогены человека и животных (например, Mycobacterium, Streptococcus и Neisseria). Метод исследования не позволяет точно определять виды (только роды), поэтому на данный момент нельзя утверждать, что инфузории являются переносчиками патогенных бактерий.
«В любом случае очевидно, что в сожительство с инфузориями вступают преимущественно такие бактерии, которые «умеют» жить в ассоциации с организмами-хозяевами. По всей видимости, эти бактерии, оказавшись вне хозяина, в водоеме, за неимением лучшего приспосабливаются к колонизации протистов — как-никак это крупные эукариотические клетки, сходные с клетками многоклеточных, и выжить некоторое время можно или у них внутри, или снаружи, в зависимости от тактики конкретной бактерии. Бактерии-сожители редко чувствуют себя в таких ассоциациях по-настоящему хорошо для быстрого размножения (их количества, как показал наш анализ, всегда невелики), но им достаточно комфортно для того, чтобы пережить трудные времена. Таким образом, инфузории (и, весьма вероятно, другие протисты) выступают в роли природного резервуара для бактерий, которые оказались вне предпочтительного для них многоклеточного хозяина», — заключает ученый.
просто и понятно о ее строении, питании, размножении
 Как выглядит инфузория туфелька?
Как выглядит инфузория туфелька?- Строение
Классификация
Жизнь на нашей планете отличается невероятным многообразием всевозможных живых организмов, имеющих подчас невероятно сложное строение. Все это многообразие жизни: от простейших насекомых и растений до нас, людей (пожалуй, самых «сложных организмов») состоит из клеток, этих маленьких кирпичиков живой материи. И если человек – венец биологической эволюции, то весьма любопытным будет рассмотреть ее начало: простейшие одноклеточные организмы, которые, по сути, на заре истории стали родоначальниками всего живого. Инфузория туфелька (наряду с
амебойи эвгленой зеленой) является одним из самых известных простых одноклеточных существ. Какое строение инфузории туфельки, среда обитания, как она питается и размножается, обо всем этом читайте далее.
Описание и характеристика.
 Как выглядит инфузория туфелька?
Как выглядит инфузория туфелька?На самом деле инфузория туфелька это вовсе не один простейший одноклеточный организм, за этим названием скрывается более 7 тысяч разных видов инфузорий. Всех их объединяет форма, которая чем-то напоминает подошву туфли, отсюда и «туфелька» в названии. (Впрочем, «туфелька» в названии прижилась только у нас, в английском языке «инфузория туфелька» значится под латинским названием «Paramecium caudatum», что переводится как «парамеция хвостатая»).
Также все инфузории обладают способностью к осморегуляции, то есть могут регулировать
давлениевнутренней среды своего организма. В этом деле им помогают две сократительные вакуоли, они сжимаются и разжимаются, таким образом, выталкивая излишки жидкости из тела инфузории.
Размеры инфузории туфельки составляют от 1 до 5 десятых миллиметра.
Фото инфузории туфельки.
Хотя инфузория туфелька и является простейшим одноклеточным существом, то есть все ее тело состоит только из одной клетки, тем не менее, она имеет способность самостоятельно дышать, питаться, размножаться, передвигаться. Иными словами, обладает всеми теми функциями и способностями, которые имеет всякое другое животное. Более того среди других простейших одноклеточных организмов именно инфузория туфелька является самой сложной. В частности среди ее
Иными словами, обладает всеми теми функциями и способностями, которые имеет всякое другое животное. Более того среди других простейших одноклеточных организмов именно инфузория туфелька является самой сложной. В частности среди ее
органоидов(элементов клетки) есть такие, которых нет у других ее одноклеточных «коллег»: амеб и эвглен.
Среди «передовых» органоидов инфузории можно отметить:

Обладая ртом, порошицей, пищеварительными вакуолями, инфузории практикуют голозойный тип питания, то есть захватывают органические частицы внутрь своего тела.
Так выглядит инфузория туфелька под
микроскопом.
Интересный факт: дыхание инфузории туфельки осуществляется не с помощью рта, а всем телом:
кислородчерез покровы клетки поступает в цитоплазму, где при его помощи происходит окисление органических веществ, превращение их в углекислый газ, воду и другие соединения.
Еще одной удивительной особенностью инфузории, которая ее делает «самой сложной из простейших» является наличие в ее клетке целых двух ядер. Одно из ядер большое, его зовут макронуклеусом, а второе маленькое соответственно зовется микронуклеусом. Оба ядра хранят одинаковую информацию, однако если большое ядро постоянно пребывает в работе и его информация постоянно эксплуатируется, а значит, может быть повреждена (подобно ходовым книгам в библиотеке). Если такое повреждение случается, то на этот случай как раз и предусмотрено второе маленькое ядро, служащее чем-то вроде резерва на случай сбоя основного ядра.
Как видите наша сегодняшняя героиня, инфузория туфелька, является самым совершенным среди простейших одноклеточных организмов.
Возможности изучения
Рассказ про инфузорию-туфельку можно услышать ещё в школе, но как именно исследователи изучали крохотный организм, знают не все. На самом деле в наблюдении за ним нет ничего сложно, кроме того, размер в десятые миллиметра является довольно большим для простейших. Всё это означает, что исследования можно провести даже в домашних условиях, но сначала для этого нужно развести культуру инфузорий.
Поскольку туфельки присутствуют во всех водоёмах, вода берётся из этих источников. Для чистоты эксперимента нужно взять три стеклянные ёмкости и в одну из них положить разлагающиеся веточки и листья, в другую — живые растения, в третью — ил со дна. Все материалы берутся из водоёма, оттуда же добывается и жидкость и заливается в банки.
Когда всё готово, нужно внимательно просмотреть содержимое ёмкости и убедиться, что в ней нет посторонних видимых глазом организмов, например, насекомых или личинок. Если они есть, их придётся выловить, в противном случае инфузории будут съедены. Подготовленная среда обитания ставится на окно, прикрывается стеклом и оставляется при комнатной температуре на несколько дней. При этом нужно следить, чтобы на ёмкость не попадали прямые солнечные лучи. Спустя двое суток банку следует встряхнуть и проверить, не появилось ли там каких-либо организмов. Это могут быть как туфельки, так и другие существа, но проверяется это просто. Нужно взять каплю воды у освещённой стенки сосуда ближе к поверхности, именно в этом месте будет концентрироваться большинство интересующих организмов. Затем каплю следует поместить на стекло и рассмотреть через микроскоп или хотя бы лупу.
Если они есть, их придётся выловить, в противном случае инфузории будут съедены. Подготовленная среда обитания ставится на окно, прикрывается стеклом и оставляется при комнатной температуре на несколько дней. При этом нужно следить, чтобы на ёмкость не попадали прямые солнечные лучи. Спустя двое суток банку следует встряхнуть и проверить, не появилось ли там каких-либо организмов. Это могут быть как туфельки, так и другие существа, но проверяется это просто. Нужно взять каплю воды у освещённой стенки сосуда ближе к поверхности, именно в этом месте будет концентрироваться большинство интересующих организмов. Затем каплю следует поместить на стекло и рассмотреть через микроскоп или хотя бы лупу.
Если при этом видны веретеновидные тела, перемещающиеся быстро и плавно и вращающиеся вокруг своей оси, значит, получилось развести туфелек. Если в капле присутствует кусочек зелени или бактериальная плёнка, сразу множество инфузорий будет скапливаться вокруг пищи.
Для ускорения процесса размножения инфузорий нужно поместить их в благоприятную среду
Отделить туфелек от других животных несложно. Обычно они двигаются намного быстрее остальных организмов, этим и нужно воспользоваться. Для этого каплю, в которой есть несколько типов существ, помещают на стекло и ставят в хорошо освещённое место. Рядом с ней приливают небольшое количество свежей воды и проводят зубочисткой линию от одной жидкости к другой так, чтобы получился тонкий водяной мостик, соединяющий две среды. Инфузории быстро пройдут расстояние и окажутся в новой капле.
Обычно они двигаются намного быстрее остальных организмов, этим и нужно воспользоваться. Для этого каплю, в которой есть несколько типов существ, помещают на стекло и ставят в хорошо освещённое место. Рядом с ней приливают небольшое количество свежей воды и проводят зубочисткой линию от одной жидкости к другой так, чтобы получился тонкий водяной мостик, соединяющий две среды. Инфузории быстро пройдут расстояние и окажутся в новой капле.
Бывает, что не удаётся рассмотреть ничего живого в воде, в таком случае можно добавить в ёмкость несколько капель кипячёного молока и подождать ещё два дня. Спустя это время можно ещё раз попытаться изучить развившиеся организмы.
Далее туфельки будут размножаться, ускорить этот процесс можно, создав им благоприятные условия. Для этого их помещают в одну из следующих сред:
- на высушенную банановую кожуру;
- на листья салата;
- в молоко;
- в настой сена.
Разведённые таким образом организмы могут использоваться для наблюдения за ними в исследовательских целях либо приносить практическую пользу.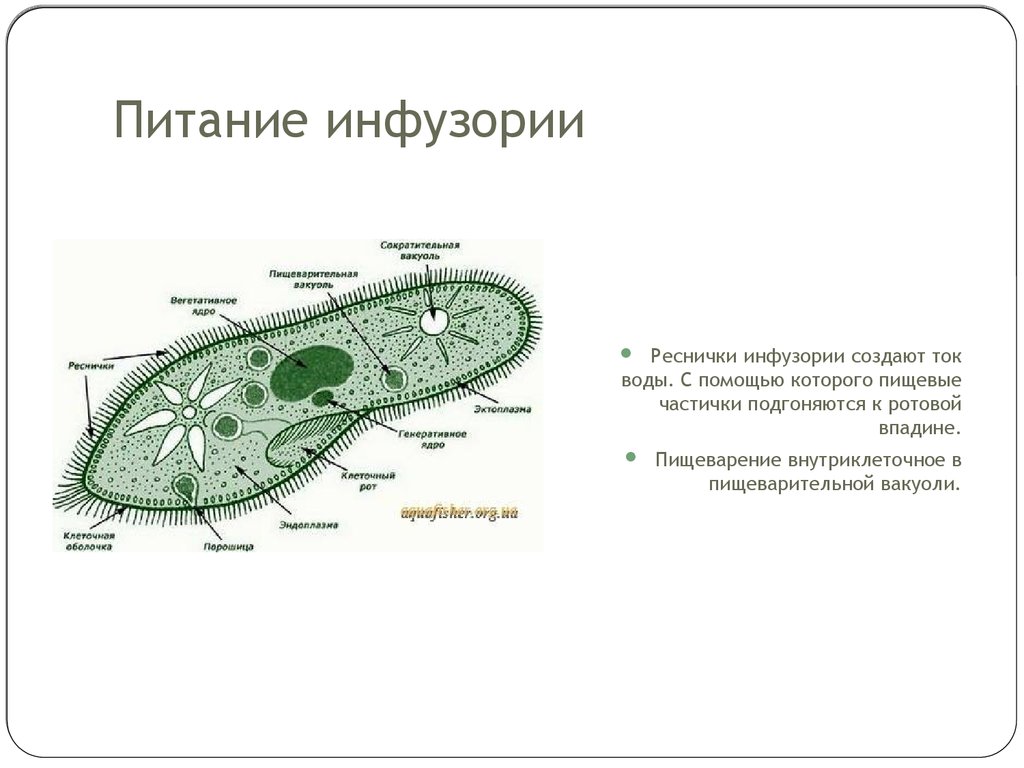 Поскольку инфузории — естественные санитары пресных вод, они могут дезинфицировать жидкость в аквариумах с рыбами, а также служить кормом для мальков.
Поскольку инфузории — естественные санитары пресных вод, они могут дезинфицировать жидкость в аквариумах с рыбами, а также служить кормом для мальков.
Таким образом, инфузории-туфельки — это удивительные организмы, обладающие уникальными особенностями (например, половым процессом без размножения), они могут быть изучены даже в домашних условиях.
Строение
Несмотря на внешнюю простоту строение инфузории отнюдь не простое. Снаружи она защищена тонкой эластичной оболочкой, которая также помогает телу инфузории сохранять постоянную форму. Защитные опорные волокна инфузории расположены в слое плотной цитоплазмы, которая прилегает к оболочке.
Помимо этого в цитоскелет инфузории входят различные микротрубочки, цистерны альвеолы, базальные тельца с ресничками, фибриллы и филамены и другие органоиды.
По причине наличия цитоскелета инфузория в отличие от амебы не может произвольно менять форму своего тела.
Схематический рисунок строения инфузории.
Чем питается
Данный вид организма причисляется к гетеротрофным организмам, поскольку он питается сформировавшимися органическими элементами, поступающими через естественную среду обитания.
Питается она бактериями с миниатюрными видами растений, которые располагаются в мутной и грязной воде. Делает инфузория это специализированными сократительными вакуолями. Место образования их цитоплазма.
Кормление происходит клеточным ртом небольшим углублением посередине организма. Через рот пища направляется в условный пищевод и движется в цитоплазму, поглощая пищу в своеобразной пищеварительной сократительной вакуоли.
Именно там еда расщепляется гидролитическими ферментами и попадает во все тело, насыщая одноклеточное полезными микроэлементами. То, что инфузория не переваривает, она выделяет через маленькое углубление сзади, именуемую порошицой.
Классификация
Также строение инфузории зависит от ее класса. Так различают два класса инфузории туфельки:
- ресничные инфузории,
- сосущие инфузории.

Далее подробно остановимся на них.
Ресничные инфузории
Названы так, поскольку их тело покрыто маленькими ресницами, которые также именуются цилиями. Длина ресницы составляет не более 0,1 микрометра. Ресницы могут, как распределятся равномерно по телу нашей простейшей красавицы, так и собираться в пучки, которые биологи называют «цирры». Сами ресницы представляют собой пучок фибрилл, которые являются нитевидными белками.
Каждая ресничная инфузория может иметь несколько тысяч таких вот ресниц. Передвижение инфузории также осуществляется при помощи ресниц.
Сосущие инфузории
Сосущие инфузории совсем не имеют не только ресничек, но и рта, глотки и пищеварительных вакуолей, столь характерных для их «волосатых» сородичей. Зато у них есть своеобразные щупальца, представляющие собой плазматические трубочки. Именно эти щупальца-трубочки у сосущих инфузорий выполняют функцию рта и глотки, так как захватывают и проводят питательные вещества в эндоплазму клетки.
Не имея ресниц сосущие инфузории не способны передвигаться. Впрочем, им это и не нужно, имея особую ножку-присоску, они прикрепляются к коже какого-нибудь краба или рыбы и на них живут. Сосущих инфузорий всего лишь несколько десятков видов, против тысячи видов их ресничных собратьев.
Значение в природе
Инфузория туфелька — значимое одноклеточное для природы и почвы. Она повышает уровень плодородия в почве, что помогает орошаемым землям на юге планеты получать богатый урожай.
Однако те одноклеточные, которые обитают в речных водоемах с большим количеством рыб, негативно влияют на них. Они вызывают у рыб заболевания и массовую гибель.
Вокруг этого одноклеточного собрано немало информации и интересных фактов. Из положительных свойств одноклеточного микроорганизма можно назвать то, что он хорошо очищает водоем. Уничтожает бактерии и микроскопические виды водорослей. Участвует в пищевой цепочке, поскольку считается пищей для других животных.
Интересно, что инфузория сегодня является также отличным кормом для аквариумных рыбок. Поэтому человек активно разводит их, чтобы кормить любимцев.
Поэтому человек активно разводит их, чтобы кормить любимцев.
Среда обитания
Инфузории туфельки обычно живут в мелких пресных водоемах со стоячей водой и гниющей органикой. Стоячая вода им необходима, чтобы не преодолевать силу течения, которая их снесет, поэтому инфузорий нет в реках. В мелких водоемах Солнце достаточно прогревает воду, и гниющая органика служит источником их пищи. К слову по насыщенности того или иного водоема инфузориями можно судить о степени его загрязнения, чем их больше, тем более грязный водоем.
А вот соленую воду инфузории не любят, поэтому их нет в морях и океанах.
Интересные факты
Инфузории-туфельки обладают способностью различать малейшие концентрации химических веществ в воде. С такой чувствительностью им легче находить колонии бактерий, то есть пищу. А в лаборатории эту суперспособность иногда используют для определения примесей в воде.Проводилась даже дегустация высушенной массы инфузорий. Оказалось, что на вкус они напоминают курицу или сухой творог. В белке инфузорий есть все необходимые аминокислоты. Его состав похож на казеин.Скопления инфузорий-туфелек можно увидеть невооруженным глазом, и это реально даже в домашних условиях. Достаточно положить маленький кусочек морковки в банку с водой и поставить ее в темное теплое место. Воду можно взять из природного водоема, но подойдет и водопроводная вода. Лучше всего брать воду с небольшим количеством ила из аквариума — там точно есть туфельки. Через пару дней в мути, которая окружает морковь, сначала можно будет при помощи микроскопа обнаружить инфузорий. А немного позже, когда уменьшится количество кислорода в воде, ближе к поверхности появятся скопления белых точек — это и есть скопления инфузорий.Инфузория-туфелька — удивительный Как выглядит этот микроорганизм и особенности его жизнедеятельности вы можете посмотреть в видео.
В белке инфузорий есть все необходимые аминокислоты. Его состав похож на казеин.Скопления инфузорий-туфелек можно увидеть невооруженным глазом, и это реально даже в домашних условиях. Достаточно положить маленький кусочек морковки в банку с водой и поставить ее в темное теплое место. Воду можно взять из природного водоема, но подойдет и водопроводная вода. Лучше всего брать воду с небольшим количеством ила из аквариума — там точно есть туфельки. Через пару дней в мути, которая окружает морковь, сначала можно будет при помощи микроскопа обнаружить инфузорий. А немного позже, когда уменьшится количество кислорода в воде, ближе к поверхности появятся скопления белых точек — это и есть скопления инфузорий.Инфузория-туфелька — удивительный Как выглядит этот микроорганизм и особенности его жизнедеятельности вы можете посмотреть в видео.
Питание
Чем питается инфузория туфелька? Питание инфузории зависит от ее класса. Так сосущие инфузории являются подлинными хищниками одноклеточного мира: источником их пищи служат другие более мелкие одноклеточные организмы, на свою беду проплывающие мимо. Своими щупальцами сосущие инфузории хватают других одноклеточных. Изначально жертва захватывается одним щупальцем, а потом «к столу» подходят и другие «собратья». Щупальца растворяют клеточную оболочку жертвы и поглощают ее внутрь.
Своими щупальцами сосущие инфузории хватают других одноклеточных. Изначально жертва захватывается одним щупальцем, а потом «к столу» подходят и другие «собратья». Щупальца растворяют клеточную оболочку жертвы и поглощают ее внутрь.
А вот ресничная инфузория в этом плане «вегетарианка», источником ее пищи обычно служат одноклеточные водоросли, которые захватываются ротовым углублениями, оттуда они попадают в пищевод, а потом к пищеварительным вакуолям. Переработанная пища выбрасывается через порошицу.
Интересный факт: во рту ресничной инфузории также имеются реснички, которые колышась, создают течение, чем увлекают частицы пищи в ротовую область.
Выделение
Остатки пищи, которые не были усвоены организмом, выбрасываются за его пределы через заднюю часть клетки. Порошица у инфузории - это особый участок ее тела, обеспечивающий утилизацию продуктов метаболизма, не представляющих питательной ценности.
После удаления остатков пищи происходит слияние пищеварительной вакуоли с внешней мембраной клетки.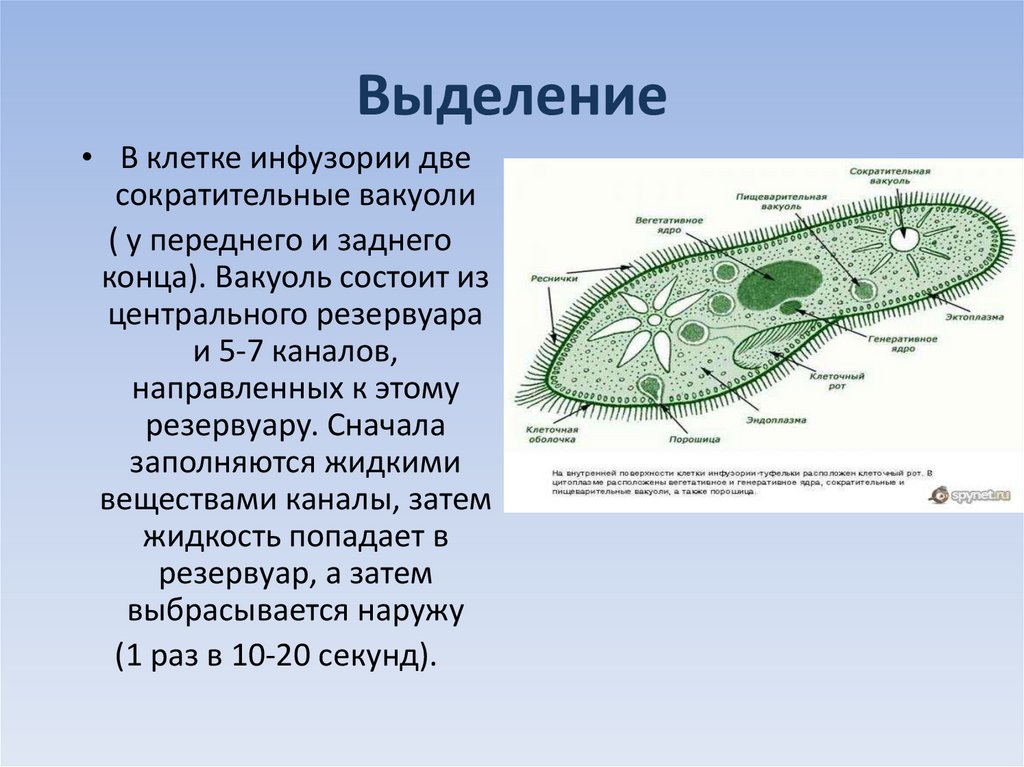 Выделительная система образует мелкие пузырьки, которые вместе с микротрубочками направляются к донной части клеточной глотки. Запускается процесс формирования новой пищеварительной вакуоли.
Выделительная система образует мелкие пузырьки, которые вместе с микротрубочками направляются к донной части клеточной глотки. Запускается процесс формирования новой пищеварительной вакуоли.
Размножение
Размножение инфузории может быть как половым, так и бесполым – посредством деления клетки.
- Половое размножение: при нем две инфузории сливаются боковыми поверхностями, при этом оболочки между слитыми поверхностями растворяются, и образуется своеобразный цитоплазматический мостик. Через этот мостик клетки обмениваются ядрами. Большие ядра при этом вовсе растворяются, а маленькие дважды делятся. Затем из полученных четырех ядер, три исчезает, а оставшееся ядро снова делится надвое. Обмен оставшимися ядрами происходит по цитоплазматическому мостику. Из полученного материала возникают вновь рожденные ядра, и большие, и маленькие. Затем инфузории расходятся друг с другом.
- Бесполое размножение инфузории посредством деления намного проще. При нем оба ядра клетки делятся на два, как и другие органоиды.
 Таким образом, из одной инфузории образуется две, каждая с полным набором необходимых органоидов.
Таким образом, из одной инфузории образуется две, каждая с полным набором необходимых органоидов.
Рекомендованная литература и полезные ссылки
- Ehrenberg C. G. Dritter Beitrag zur Erkenntniss grosser Organisation in der Richtung des kleinsten Raumes (нем.) // Abhandlungen der Koniglichen Akademie der Wissenschaften zu Berlin. Aus dem Jahre 1833 : magazin. — Leipzig, 1835. — S. 268—269, 323.
- Ehrenberg C. G. 502. Paramecium caudatum, geschwanztes Pantoffelthierchen // Die Infusionsthierchen als volkommene Organismen. — Leipzig, 1838. — P. 351—352.
- Полянский Ю. И. Подцарство Простейшие, или Одноклеточные (Protozoa) // Жизнь животных / под ред. Ю. И. Полянского, гл. ред. В. Е. Соколов. — 2-е изд. — М.: Просвещение, 1987. — Т. 1. Простейшие. Кишечнополостные. Черви. — С. 95—101. — 448 с.
- Warren, A. (2015). Paramecium caudatum Ehrenberg, 1833. In: Warren, A. (2015) World Ciliophora Database. — WoRMS — World Register of Marine Species
Видео
И в завершение образовательное видео по теме нашей статьи.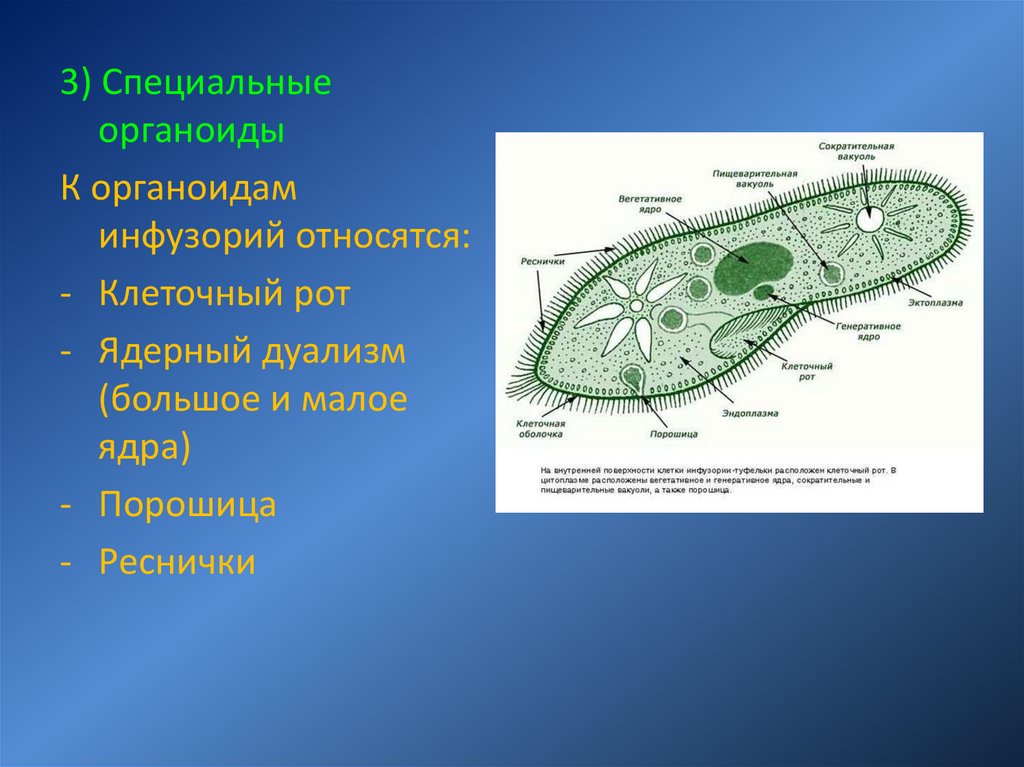
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском языке –
Paramecium Caudatum – the Most Complex of the Simplest.
Миграции
При ухудшении условий для жизнедеятельности инфузории могут перебраться на новое место обитания. Процесс состоит из нескольких этапов:
- Сотни тысяч туфелек собираются группками.
- Каждая собирается в правильный шарик.
- Многоклеточная особь переносится на новое место
- На новом месте распадается на отдельные существа.
Перемещаться инфузории могут ветром или «пассажирами» на птицах и животных. Для шарика, в виде которого инфузории путешествуют, ученые придумали название — циста.
Для шарика, в виде которого инфузории путешествуют, ученые придумали название — циста.
Инфузория туфелька, строение, как передвигается, размножение, чем питается, среда обитания, место образования пищеварительных вакуолей
Биология
12.11.21
9 мин.
Инфузория туфелька — самый известный одноклеточный организм, который встречается в пресных видах вод.
Оглавление:
- Инфузория туфелька — что это такое
- Внешнее строение
- Особенности процессов жизнедеятельности
- Среда обитания
- Как передвигается
- Размножение
- Чем питается
- Значение в природе
Что она собой представляет, какой у нее способ питания, кто она — автотроф или гетеротроф, какие имеет органоиды и каковы их функции, как дышит, каково внутреннее строение и сколько живет?
Об этом и многом другом расскажем далее.
Инфузория туфелька — что это такое
Инфузория paramecium caudatum или парамеция по систематике является простейшим видом одноклеточных микроскопических организмов, который смог получить наименование за сходство с обувной подошвой.
По размерам она достигает от десяти микрометров до четырех с половиной миллиметров, но подобные виды встретить можно редко.
Часто одноклеточное обитает в пресном и стоячем виде воды, но увидеть ее сложно. Если вы увидите движущееся большое скопление овальных пятен светлого оттенка — это и есть туфелька. Подробнее узнать, что такое инфузория, можно, взглянув на рисунок.
Внешнее строение
По внешнему строению этот представитель фауны обладает тонкой эластичной оболочкой, именуемой в природе мембраной. Она на всем цикле жизни способна фиксировать свою сформировавшуюся форму.
Это происходит благодаря наличию цитоплазменного слоя с развитыми опорными волокнами. Такие виды волокон располагаются тесным образом к поверхности оболочки. Для инфузории характерно два ядра, одно из которых ответственно за процесс пищеварения, а другое — за процесс размножения.
Для инфузории характерно два ядра, одно из которых ответственно за процесс пищеварения, а другое — за процесс размножения.
Вся поверхность инфузории с особыми ресничками несет ответственность за процесс передвижения. Этих ресничек больше 15 тыс. Их движения схожи с веслами. Перемещение происходит со скоростью 3 миллиметра в секунду. Инфузория передвигается с помощью волнообразных движений ресничек.
Особенности процессов жизнедеятельности
По строению и жизнедеятельности инфузории обладают одинаковой формой и размером, вне зависимости от того, в каких условиях они находятся. Однако их жизнедеятельность меняется в зависимости от температуры и света.
Инфузории чувствительно относятся к свету и изменениям температуры.
То же самое касается света. Чем ярче светит солнце, тем быстрее одноклеточный организм впадает в анабиоз. В этом заключаются особенности ее процесса жизнедеятельности.
В этом заключаются особенности ее процесса жизнедеятельности.
Среда обитания
Одноклеточная туфелька обитает в небольшом пресном виде воды, предпочтительно на водной глади, в которой разлагаются остатки природных микроорганизмов.
Подобная среда обитания позволяет туфельке стремительно двигаться и искать пищу во время своего движения.
Также в этой среде происходит и процесс деления. То, что она ведет неподвижный образ жизни, сказать нельзя, поскольку она вынуждена всегда искать себе пищу.
Как передвигается
Инфузория туфелька активно передвигается с помощью своих специальных ресничек, называемых в науке органеллами. На поверхности одного клеточного организма находится их порядка 15 тыс. Это можно увидеть под микроскопом, разглядывая модель одноклеточного.
Благодаря четко организованной деятельности органелл (они также называются трихоцистами), организм стремительно двигается подобно кораблю на веслах или маятнику. Движение получается быстрое, но плавное.
Органеллы быстро приподнимаются, а потом направляются в прежнее положение. За одну минуту таких движений происходит очень много. Инфузория двигается тупым кончиком вперед и поворачивает свое тело около оси.
Размножение
Процесс размножения инфузории зависит от погодных и температурных условий. Если температура комфортная — выше 15 градусов, то она делится пополам, начиная процесс деления с ядер.
Большое ядро и малое ядро она дробит, получая дочерние клетки.
Если температура ниже установленной отметки, и инфузория не получает достаточного питания, то она размножается половым путем, с помощью процесса конъюгации.
При этом половом процессе два клеточных организма приближаются друг другу, формируя цитоплазматический вид мостика и обмениваются генами.
В итоге новых клеток не появляется, но процесс важен, поскольку у инфузории обновляется наследственный материал. Он позволяет ей увеличить адаптацию к окружающей среде и сделать все, чтобы она:
- активно двигалась;
- гетеротрофно питалась;
- аэробно дышала;
- размножалась разными способами.

В целом, тип размножения половой и бесполый.
Чем питается
Данный вид организма причисляется к гетеротрофным организмам, поскольку он питается сформировавшимися органическими элементами, поступающими через естественную среду обитания.
Питается она бактериями с миниатюрными видами растений, которые располагаются в мутной и грязной воде. Делает инфузория это специализированными сократительными вакуолями. Место образования их цитоплазма.
Кормление происходит клеточным ртом — небольшим углублением посередине организма. Через рот пища направляется в условный пищевод и движется в цитоплазму, поглощая пищу в своеобразной пищеварительной сократительной вакуоли.
Именно там еда расщепляется гидролитическими ферментами и попадает во все тело, насыщая одноклеточное полезными микроэлементами. То, что инфузория не переваривает, она выделяет через маленькое углубление сзади, именуемую порошицой.
Значение в природе
Инфузория туфелька — значимое одноклеточное для природы и почвы. Она повышает уровень плодородия в почве, что помогает орошаемым землям на юге планеты получать богатый урожай.
Она повышает уровень плодородия в почве, что помогает орошаемым землям на юге планеты получать богатый урожай.
Однако те одноклеточные, которые обитают в речных водоемах с большим количеством рыб, негативно влияют на них. Они вызывают у рыб заболевания и массовую гибель.
Вокруг этого одноклеточного собрано немало информации и интересных фактов. Из положительных свойств одноклеточного микроорганизма можно назвать то, что он хорошо очищает водоем. Уничтожает бактерии и микроскопические виды водорослей. Участвует в пищевой цепочке, поскольку считается пищей для других животных.
Интересно, что инфузория сегодня является также отличным кормом для аквариумных рыбок. Поэтому человек активно разводит их, чтобы кормить любимцев.
РУБЦОВОЕ ПИЩЕВАРЕНИЕ КУРПНОГО РОГАТОГО СКОТА
У жвачных животных из всех сельскохозяйственных животных желудок самый сложный — многокамерный, разделенный на четыре отдела: рубец, сетку, книжку, первые три отдела называются преджелудками, последний- сычуг является истинным желудком.
Рубец -самый большой отдел желудка жвачных, его вместимость у крупного рогатого скота в зависимости от возраста составляет от 100 до 300 литров. Он занимает всю левую половину брюшной полости. Внутренняя ее оболочка желез не имеет, ее поверхность ороговевшая и представлена множеством сосочков, придающих шероховатость.
Сетка— представляет из себя небольшой округлый мешок. Внутренняя поверхность также не имеет желез. Слизистая оболочка представлена выступающими в виде пластинчатых складок высотой до 12 мм, образует ячейки, по внешнему виду напоминающие пчелиные соты. С рубцом, книжкой и пищеводом сетка сообщается пищеводным желобом в виде полузамкнутой трубы. Сетка у жвачных животных работает по принципу сортировального органа, пропуская в книжку только достаточно измельченный и разжиженный корм.
Отсутствие четкой границы между 1-ым отделом (рубец) и 2-ым отделом (сетка), а также свободное смешивание их содержимого позволяет объединить их в один отдел и назвать сетчатым желудком.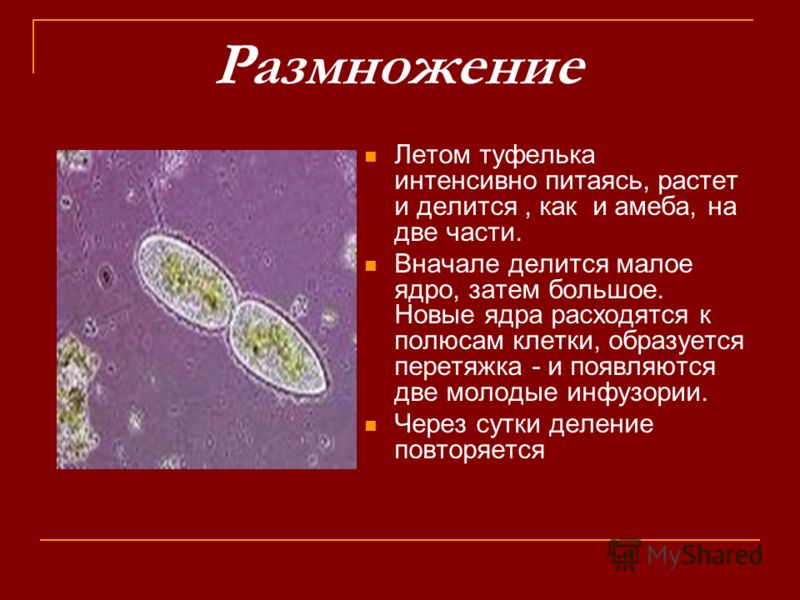 Сетчатый желудок занимает основную часть брюшной полости и является самым тяжелым внутренним органом. Это мускулистый орган, который вмещает в себя 2/3 всего содержимого желудочно-кишечного тракта коровы.
Сетчатый желудок занимает основную часть брюшной полости и является самым тяжелым внутренним органом. Это мускулистый орган, который вмещает в себя 2/3 всего содержимого желудочно-кишечного тракта коровы.
Около половины времени, необходимого для процесса переваривания, пища находится в сетчатом желудке (20 — 48 часов из общего количества 40 — 72 часа). Рубец разделяется сильными мышечными перегородками на краниальный, дорсальный и вентральный мешки. Эти мышцы сокращаются и расслабляются с периодичностью в 50 — 60 секунд.
Внутренние стенки сетчатого желудка выстланы огромным количеством пальцевидных сосочков, которые значительно увеличивают поверхность всасывания конечного продукта желудочной ферментации (летучие жирные кислоты и аммиак).
Строение сетчатого желудка обеспечивает задерживание волокнистой части пищи на время, необходимое для ее ферментации микроорганизмами. При одновременном сокращении рубца и сетки происходит смещение сетчато-рубцовой складки и продукт пищеварения выталкивается, освобождая сетку. При этом маленькие, т.е. более плотные частицы, проходят через отверстие соединяющее сетку с книжкой, тогда как большие, но менее плотные частицы поступают снова в вентральную часть рубца. Таким образом, движение сетки играет важную роль в просеивании и сортировке частиц пищи перед тем, как они покидают сетчатый желудок.
При этом маленькие, т.е. более плотные частицы, проходят через отверстие соединяющее сетку с книжкой, тогда как большие, но менее плотные частицы поступают снова в вентральную часть рубца. Таким образом, движение сетки играет важную роль в просеивании и сортировке частиц пищи перед тем, как они покидают сетчатый желудок.
Проглоченный животными пищевой корм попадет сначала в преддверие рубца, а потом в рубец, из которого, спустя некоторое время, вновь возвращается в ротовую полость для повторного пережевывания и тщательного смачивания слюной. Данный процесс у животных называется жвачкой. Отрыгивание пищевой массы из рубца в ротовую полость осуществляется по типу рвотного акта, при котором последовательно сокращаются сетка и диафрагма, при этом гортань у животного замыкается и открывается кардиальный сфинктер пищевода.
Книжка— лежит в правом подреберье, имеет округлую форму, с одной стороны она является продолжением сетки, с другой переходит в желудок. Книжка представляет собой слой мышечных пластин, перекрывающих друг друга. Слизистая оболочка книжки представлена складками (листочками), на концах которых располагаются короткие грубые сосочки. Пластинчатая структура книжки способствует всасыванию большого количества воды и минеральных веществ. Это предотвращает разбавление кислоты, выделяемой четвертым отделом желудка (сычугом), и обеспечивает повторное поступление минеральных веществ в слюну.
Слизистая оболочка книжки представлена складками (листочками), на концах которых располагаются короткие грубые сосочки. Пластинчатая структура книжки способствует всасыванию большого количества воды и минеральных веществ. Это предотвращает разбавление кислоты, выделяемой четвертым отделом желудка (сычугом), и обеспечивает повторное поступление минеральных веществ в слюну.
Книжка является дополнительным фильтром и измельчителем грубых кормов. Несмотря на то, что масса книжки довольно большая , она вмещает в себя только 5% от всего перевариваемого продукта. У взрослой коровы размер книжки приближается к размеру крупного арбуза.
Сычуг — является истинным желудком, имеет вытянутую форму в виде изогнутой груши, у основания — утолщенной узкий конец которого переходит в двенадцатиперстную кишку. Слизистая оболочка сычуга имеет железы. Также, как и у животных с моногастритным желудком, сычуг выделяет ферменты и соляную кислоту. Внутренние стенки сычуга выстланны множеством складок, что значительно увеличивает площадь поверхности выделяющей ферменты и соляную кислоту.
Сычуг условно разделяют на две области. Первая из них называется дном и является основным местом, где происходит выделение соляной кислоты и ферментов, активных в кислой среде.
Вторая область называется пилорической. Это место, где собирается перевариваемая масса. По мере накопления, через отверстие, соединяющее сычуг с двенадцатиперстной кишкой (привратник — pyllоrus), пищевая масса проталкивается дальше в двенадцатиперстную кишку в виде отдельных пилюлеобразных комков (болюсов).
Сычуг — является истинным желудком, имеет вытянутую форму в виде изогнутой груши, у основания — утолщенной узкий конец которого переходит в двенадцатиперстную кишку. Слизистая оболочка сычуга имеет железы. Также, как и у животных с моногастритным желудком, сычуг выделяет ферменты и соляную кислоту. Внутренние стенки сычуга выстланны множеством складок, что значительно увеличивает площадь поверхности выделяющей ферменты и соляную кислоту.
Сычуг условно разделяют на две области. Первая из них называется дном и является основным местом, где происходит выделение соляной кислоты и ферментов, активных в кислой среде.
Первая из них называется дном и является основным местом, где происходит выделение соляной кислоты и ферментов, активных в кислой среде.
Вторая область называется пилорической. Это место, где собирается перевариваемая масса. По мере накопления, через отверстие, соединяющее сычуг с двенадцатиперстной кишкой (привратник — pyllоrus), пищевая масса проталкивается дальше в двенадцатиперстную кишку в виде отдельных пилюлеобразных комков (болюсов).
Вход пищевода в сетчатый желудок и отверстие, соединяющее сетку с книжкой выход из сетчатого желудка, расположены сравнительно близко друг к другу. Эти отверстия соединены между собой желобом. В период, когда теленок питается молоком, этот желоб свертывается в трубку, по которой молоко поступает сразу же в сычуг, минуя сетчатый желудок, то есть пищеварение происходит по укороченному пути. Когда теленок вырастает из возраста молочного кормления, желоб открывается и перестает функционировать.
Роль процесса жевания
Основными функциями жевания в процессе пищеварения являются:
1. Перемешивание корма со слюной.
Перемешивание корма со слюной.
2. Дробление пищи на мелкие частицы.
3. Увеличение растворимости веществ, служащих основой питания для бактерий желудка.
4. Формирование пищевых комков, удобных для проглатывания – в форме болюсов.
Роль слюновыделения
Слюновыделение имеет несколько важнейших функций:
1. Оказывает сильное разбавляющее действие на кислоты, которые образуются в рубце в результате ферментации кормов микроорганизмами.
2. Способствует сильному увлажнению пищевых частиц, что значительно облегчает их свободное перемещение в рубец и обратно, для дополнительного дожевывания.
3. Поддерживает здоровую среду в сетчатом желудке (содержит большое количество натрия и других минеральных солей, углекислоты и фосфатов, которые ограничивают падение рН — т.е. увеличение кислотности.
4. С помощью слюны формируются пищевые комки (болюсы).
5. Слюна поставляет питательные вещества для бактерий рубца: азот в виде мочевины, а также минеральные соли, такие как натрий, хлор, фосфор и магнезия.
6. Слюна предохраняет от раздувания (тимпании), так как содержит в своем составе муцин, обладающий антивспенивающими свойствами.
Слюновыделение происходит со скоростью 120 мл/мин во время еды и около 150 мл/мин во время пережевывания жвачки. Когда корова перестает жевать, скорость выделения слюны падает до 60 мл/мин.
Интенсивность слюноотделения зависит от состава потребляемых кормов. Большее ее количество выделяется при потреблении грубых кормов в неизмельченном виде. Слюновыделение резко сокращается при приеме измельченных кормов или концентратов.
При отсутствии слюны кислотность сетчатого желудка увеличивается, что приводит к уменьшению активности микроорганизмов, потере аппетита и развитию ацидоза.
Роль жевания жвачки
При пережевывании жвачки пищевые комки (болюсы) из рубца срыгиваются в рот на дополнительное дожевывание. При жевании болюсы сдавливаются и выделяющаяся при этом жидкость и мелкие пищевые частицы немедленно проглатываются. Большие же пищевые частицы дожевываются в течение 50-60 секунд и после этого также проглатываются. Пережевывание жвачки является жизненно необходимой частью нормального пищеварительного процесса и усвоения волокнистых веществ. Основные функции пережевывания жвачки заключаются в следующем:
Большие же пищевые частицы дожевываются в течение 50-60 секунд и после этого также проглатываются. Пережевывание жвачки является жизненно необходимой частью нормального пищеварительного процесса и усвоения волокнистых веществ. Основные функции пережевывания жвачки заключаются в следующем:
При пережевывании жвачки происходит увеличение слюновыделения.
Под воздействием пережевывания происходит уменьшение размеров пищевых частиц и увеличение их плотности (от этих характеристик зависит время нахождения пищевых частиц в рубце).
Пережевывание жвачки помогает отделить пищевые частицы, готовые выйти из рубца, от тех, которым необходимо больше времени для их полной ферментации.
В результате пережевывания жвачки происходит размельчение волокнистых структур, что увеличивает поверхность воздействия на них микроорганизмов, а значит их перевариваемость.
Жвачка является необходимым условием для измельчения и дальнейшего переваривания грубых кормов. Она обычно начинается вскоре после окончания приема корма, когда он в рубце подвергается размягчению и разжижению. Чаще всего руминация наступает при полном покое животных, когда они лягут.
Чаще всего руминация наступает при полном покое животных, когда они лягут.
Жвачка у животных обычно начинается через 30−70 минут после еды и протекает в строго определенном для каждого вида животных ритме. В течение суток бывает 6-10 жвачных периодов, каждый из которых продолжается по 30-60 минут.
За 5 минут преджелудки сокращаются 8-14 раз. Продолжительность механической обработки пищевого кома в виде жвачки во рту — около одной минуты. Следующая порция пищевого корма поступает в рот спустя 3−10 секунд.
Жвачный период у животных продолжается в среднем 45−50 минут, затем у животных наступает период покоя, продолжающийся у различных животных разное время, затем снова наступает период жвачки.
Здоровая корова выполняет до 40-45 тысяч жевательных движений в день.
За сутки корова таким образом пережевывает около 60 кг пищевого содержимого рубца.
Существует хороший способ определения, достаточно ли волокнистых веществ содержится в рационе стада: если в любое время дня и ночи 1/3 поголовья скота жует, это значит, что рацион составлен правильно.
Роль рубцовой микрофлоры
Наукой доказано, что за счёт ферментов микрофлоры рубца удовлетворяется до 80% потребности жвачных в энергии, 30 — 50% — в белке, в значительной мере в макро- и микроэлементах и витаминах, переваривается от 50 до 70% сырой клетчатки рациона.
В преджелудках жвачных развиваются в основном анаэробные микроорганизмы: простейшие (инфузории) и бактерии.
Состав микрофлоры рубца жвачных животных варьирует в широких пределах в зависимости от вида корма: инфузории — от 200 тыс. до 2 млн. в 1 мл, бактерии — от 100 млн. до 10 млрд. в 1 мл. Видовой состав микроорганизмов также широк: бактерий – более 200 рас, простейших – более 20 видов.
Рост и размножение одних микроорганизмов сопровождаются автолизом и отмиранием других, поэтому в рубце всегда присутствуют живые, разрушающиеся и мертвые микроорганизмы.
Видовой состав зависит от того, какой корм превалирует в рационе. При смене рациона меняется и популяция микроорганизмов. Поэтому для жвачных важное значение имеет постепенный переход от одного рациона к другому.
Поэтому для жвачных важное значение имеет постепенный переход от одного рациона к другому.
Простейшие рубца относятся к подтипу инфузорий, классу ресничных инфузорий, состоящему из десятка родов и множества (около 100) видов. Они попадают в преджелудки, как и многие другие микроорганизмы, с кормом и очень быстро размножаются (до 4-5 поколений в день). В 1 г содержимого рубца находится до 1 млн. инфузорий, размеры их колеблются от 20 до 200 мкм.
Инфузории играют важную биологическую роль в рубцовом пищеварении. Они подвергают корм механической обработке, используют для своего питания трудноперевариваемую клетчатку и благодаря активному движению создают своеобразную микроциркуляцию среды. Внутри инфузорий можно увидеть мельчайшие частицы корма, съеденного животным. Инфузории разрыхляют, измельчают корм, в результате чего увеличивается его поверхность, он становится более доступным для действия бактериальных ферментов. Инфузории, переваривая белки, крахмал, сахара и частично клетчатку, накапливают в своем теле полисахариды. Белок их тела имеет высокую биологическую ценность.
Белок их тела имеет высокую биологическую ценность.
Из бактерий в преджелудках содержатся кокки, стрептококки, молочнокислые, целлюлозолитические и другие, которые попадают в рубец с кормом и водой и благодаря оптимальным условиям активно размножаются. Самые важные микроорганизмы рубца – целлюлозолитические. Эти бактерии расщепляют и переваривают клетчатку, что имеет большое значение для питания жвачных.
Амилолитические бактерии, в основном стрептококки, представлены в рубце многочисленной группой. Они находятся в рубце при даче различных рационов, их количество особенно возрастает при использовании зерновых, крахмалистых и сахаристых кормов.
Молочнокислые бактерии в преджелудках играют важную роль при сбраживании простых углеводов (глюкоза, мальтоза, галактоза, лактоза и сахароза). Молочнокислые бактерии имеют большое значение в молочном кормлении.
Между всеми видами микроорганизмов существует симбиотическая связь: активное размножение одних видов может стимулировать или тормозить размножение других. Так, развитие стрептококков сдерживает рост молочнокислых бактерий, и наоборот, активное размножение молочнокислых бактерий создает неблагоприятную среду для жизнедеятельности стрептококков.
Так, развитие стрептококков сдерживает рост молочнокислых бактерий, и наоборот, активное размножение молочнокислых бактерий создает неблагоприятную среду для жизнедеятельности стрептококков.
Обнаружена тесная связь между химическим составом и питательностью кормового субстрата, численностью микроорганизмов рубца и продуктивностью животных.
Субстраты с высоким содержанием азота, протеина, жира, БЭВ оказывают больший стимулирующий эффект на рост и размножение микрофлоры рубца по сравнению с субстратами с меньшим содержанием указанных показателей.
Оптимальным для размножения микроорганизмов рубца кормовым субстратам характерен уксуснокислый тип брожения и рН среды ближе к нейтральной — от 6,6 до 6,9.
Менее оптимальным кормовым субстратам свойственен пропионово-масляный тип брожения и более кислый рН среды — от 6,2 до 6,5. При этом большая дополнительная нагрузка по нейтрализации рубцового содержимого ложится на слюнные железы.
Таким образом, существует прямая зависимость между количеством бактерий и инфузорий в рубцовом содержимом и продуктивностью жвачных животных. Чем больше количество микроорганизмов в рубце, тем выше уровень продуктивности животных.
Чем больше количество микроорганизмов в рубце, тем выше уровень продуктивности животных.
Существует три взаимодействующие среды, в которых микробы размещены в рубце. Первая – это жидкая фаза, где свободно живущие микробные группы в жидкости рубца питаются растворимыми углеводами и протеином. Эта фаза составляет до 25 % микробной массы.
Вторая – это твердая фаза, где микробные группы, связанные или прикрепленные, с частицами корма переваривают нерастворимые полисахариды, такие как крахмал и волокно (клетчатку), а также менее растворимые протеины. Эта фаза может составлять до 70 % микробной массы.
В третей фазе 5 % микробов прикреплены к эпителиальным клеткам рубца или к простейшим. Кормовой рацион, скармливаемый молочной корове, влияет на количество и относительное соотношение различных микробных видов в рубце. Одна из наиболее часто встречающихся проблем в сельхозорганизациях, возникающих в управлении питанием, – это внезапные изменения в кормовых рационах жвачных животных с целью включения большего количества концентрированных кормов.
Роль желудочной ферментации
В рубце находится много различных видов бактерий и простейших. Грибковые также являются частью нормальной популяции микроорганизмов рубца. Тип кормов потребляемых коровой, определяет, какой вид бактерий доминирует в желудке, а те, в свою очередь определяют количество и пропорцию выделяемых летучих жирных кислот, которые используются коровой в качестве источника энергии.
Среда рубца является благоприятной для роста микроорганизмов. РН (кислотность) находится в пределах от 5,5 до 7,0; температура колеблется от 39° до 40°, что является оптимальным условием для многих ферментов. Кислород, который токсичен для многих видов бактерий, в рубце почти отсутствует. Имеется достаточно пищи, которая поступает болee или менее постоянно. Конечные продукты ферментации — летучие жирные кислоты и аммиак — всасываются стенками рубца.
Численность бактерий, находящихся в рубце, в течении дня изменяется прямо пропорционально количеству энергии, доступной для микробов, которая, в свою очередь, прямо пропорциональна количеству энергии, полученной через корма.
Ферментативные процессы в рубце дают корове следующие преимущества:
I. Возможность получения энергии из сложных углеводов, содержащихся в клетчатке и в волокнистых структурах растений.
II. Возможность компенсирования белковой и азотной недостаточности.
III. Микроорганизмы рубца обладают способностью использовать небелковый азот для образования белка собственных клеток, который затем используется животным для образования молочного белка.
IV. Синтез витаминов группы В и витамина К. В большинстве случаев, при нормальном функционировании рубца, организм коровы способен обеспечить собственные потребности в этих витаминах.
V. Нейтрализация некоторых токсических веществ в кормах.
Однако, наряду с положительными, существуют и отрицательные стороны желудочной ферментации. К таким относятся:
Ферментация углеводов сопровождается потерей энергии в виде выделяемых газов (метан, углекислый газ).
Белок высокой питательной ценности частично разрушается с возможной потерей азота в форме аммиака. Дело в том, что бактерии не способны (из-за недостатка энергии) использовать весь образовавшийся при ферментации белков аммиак для построения белка собственных клеток. Лишний аммиак всасывается через стенки рубца в кровь, а затем выделяется с мочой в виде мочевины.
Дело в том, что бактерии не способны (из-за недостатка энергии) использовать весь образовавшийся при ферментации белков аммиак для построения белка собственных клеток. Лишний аммиак всасывается через стенки рубца в кровь, а затем выделяется с мочой в виде мочевины.
Образование газов в рубцеВ процессе сбраживания корма в рубце, кроме летучих жирных кислот, образуются газы (углекислый газ, метан, водород, азот, сероводород) и очень незначительное количество кислорода.
Количество и состав образующихся в рубце газов непостоянны и зависят как от содержащихся в рационе кормов, возраста животнного, температуры внешней среды, так и от многих других причин.
По некоторым данным у крупных животных за сутки образуется до 1000 л газов при употреблении легкосбраживаемых и сочных кормов, особенно бобовых культур, что может привести к острому вздутию рубца (тимпании).
Образующиеся в рубце газы удаляются из организма, главным образом, при отрыгивании корма во время жвачки. Значительная их часть всасывается в рубце, переносится кровью в легкие, через которые удаляются с выдыхаемым воздухом.
Значительная их часть всасывается в рубце, переносится кровью в легкие, через которые удаляются с выдыхаемым воздухом.
В большей степени удаляется через легкие углекислый газ, и в меньшей метан. Некоторая часть газов используется микроорганизмами для дальнейших биохимических и синтетических процессов.
Механизм расщепления клетчатки
Клетчатка — сложный полисахарид. Она составляет основную массу корма у сельскохозяйственных животных. В растительных кормах ее содержится до 40-50%.
В пищеварительных соках животных нет ферментов, переваривающих клетчатку, однако в преджелудках жвачных расщепляется 60-70 % перевариваемой клетчатки под действием целлюлозолитических бактерий.
Клетчатка имеет большое физиологическое значение для жвачных не только как источник энергии, но и как фактор, обеспечивающий нормальную моторику преджелудков. Ферменты бактерий расщепляют клетчатку (сложный полисахарид) до более простых форм: вначале до дисахарида целлюбиозы, а затем до моносахарида глюкозы. Продукты расщепления клетчатки в рубце подвергаются различным видам брожений.
Продукты расщепления клетчатки в рубце подвергаются различным видам брожений.
Механизм расщепления крахмала
В рубце жвачных крахмал легко сбраживается с образованием летучих и нелетучих жирных кислот. Расщепляют крахмал бактерии и инфузории. Последние переваривают крахмал, захватывая его зерна. Бактерии воздействуют на крахмал с поверхности. Бактерии и инфузории, расщепляя крахмал, накапливают внутриклеточный полисахарид гликоген, а также амилопектин, который медленно и длительно сбраживается, что способствует сохранению постоянства биохимических условий в рубце и предупреждает возникновение интенсивного брожения при поступлении свежего корма.
Простые сахара (дисахариды и моносахариды) всегда содержатся в траве и других кормах, а также образуются в рубце как промежуточный продукт ферментации при расщеплении клетчатки и гемицеллюлозы.
При сбраживании сахаров появляются молочная, уксусная, пропионовая и масляная кислоты. Интенсивность бродильных процессов очень велика, за сутки в рубце образуется до 4 л летучих жирных кислот (ЛЖК).
Интенсивность бродильных процессов очень велика, за сутки в рубце образуется до 4 л летучих жирных кислот (ЛЖК).
Летучие жирные кислоты, образующиеся в рубце, почти полностью всасываются в преджелудках. В свободном состоянии они усваиваются лучше, чем их соли. Всосавшиеся ЛЖК используются организмом жвачных в качестве главного источника энергии и как исходные компоненты в различных ассимиляторных процессах: они служат одним из источников образования жира.
Механизм расщепления белков
В рубце жвачных под действием протеолитических ферментов микроорганизмов растительные белки корма расщепляются до пептидов, аминокислот, а затем до аммиака. Микроорганизмы рубца могут использовать не только белок, но и не белковые азотистые вещества.
В процессе жизнедеятельности микроорганизмы синтезируют белки своего тела. Из аммиака и продуктов расщепления углеводов корма микроорганизмы синтезируют более полноценный белок, в состав которого входят все заменимые и незаменимые аминокислоты.
Продвигаясь вместе с кормовой массой по пищеварительному тракту микроорганизмы перевариваются и используются организмом животного, доставляя ему более полноценный белок по сравнению с тем, который был получен с кормом. За счет микроорганизмов жвачные получают за сутки около 100 г полноценного белка.
В связи с этим бытует мнение, что жвачные менее чувствительны к недостатку аминокислот в рационе. Действительно, аминокислот, синтезируемых рубцовой микрофлорой, достаточно, чтобы удовлетворить потребность животных со средней и низкой продуктивностью при нормальных условиях кормления.
Но этого количества аминокислот не достаточно, чтобы обеспечить нормальный рост и развитие молодняка или высокую продуктивность коров. При этом степень синтеза различных аминокислот неодинакова.
Механизм расщепления жиров
Также в рубце жвачных происходит превращение липидов корма. В состав липидов входят: моно- и дигалактозилглицериды, фосфолипиды, триглицериды, стеролы, стерольные эфиры, воск и свободные жирные кислоты.
Бактерии рубца играют важную роль в метаболизме жира. Отмечено, что в кишечник поступает липидов больше, чем их содержится в корме. Это объясняется тем, что значительная часть липидов, поступающих в кишечник, приходится на липиды микроорганизмов, роль которых в гидрогенезации ненасыщенных жирных кислот, гидролизе липидов и их синтезе из нелипидных компонентов весьма велика.
Под действием бактериальных липаз жиры растений гидролизуются, при этом освобождаются ненасыщенные жирные кислоты, которые гидрогенизируются. При низкой скорости липолиза снижается интенсивность гидрогенезации.
Бактериальные липазы расщепляют стеролы, метиловые и этиловые эфиры, высокомолекулярных жирных кислот, галактозилглицеролы, лецитин и лизолецитин, а образовавшиеся в процессе гидролиза продукты разрушаются с выделением главным образом пропионовой кислоты.
Механизм синтеза витаминов
В процессе жизнедеятельности микроорганизмы рубца синтезируют и витамины группы В: рибофлавин (В2), тиамин (В1), никотиновую, (В5) фолиевую (В9), пантотеновую кислоты (В3), биотин (Н), пиридоксин (В6), цианокобаламин (В12), а также жирорастворимый витамин К (филлохинон).
Поэтому взрослые жвачные при сбалансированном кормлении не нуждаются в добавлении этих витаминов в рацион, но молодняк, у которого рубец еще не функционирует, должен получать их с кормом.
Установлена следующая закономерность синтеза витаминов. Если увеличивают количество витаминов в корме, то объем синтеза их в рубце уменьшается.
Синтез витаминов зависит также от наличия необходимых предшественников, например кобальта для синтеза цианокобаламина.
Явления, происходящие в рубце
В рубце — грубые корма длиной 1,5-3 см, при этом они задерживаются на плаву в верхней части (особенно трубчатые части), создают сплошное покрывало, именуемое «подстилкой», «матом», «плотом». Сильные мускулистые стенки рубца периодически встряхивают содержимое, тем самым верхняя часть сбивается в более плотную массу «мат», а все остальное перемешивается, что помогает мелким кусочкам «крекера» (частицы грубого корма) распадаться, становиться разбухшими от влаги, ферментироваться и падать в щи с продвижением к сетке. Роль «мата» в жизни коровы
Роль «мата» в жизни коровы
От того сформировала корова свой «мат» или нет, будет зависеть возникновение ацидоза рубца. В основном в хозяйствах роковую роль играют переизмельченные силоса из кукурузы и трав.
Важным свойством «мата» является способность задерживать концентрированные корма на своей поверхности и внутри для более продолжительной подготовки (набухания) под действием рубцовой жидкости и лучшей переваримости их в кишечнике. В случаях, когда вместе с кукурузным силосом проходят транзитом частички раздробленного зерна (обнаруживаются в фекалиях), это говорит о том, что у коровы не сформирован «мат», что у коровы ацидоз, что переваримость грубых кормов снизилась (с 67 до 40 % и менее), и что хозяйство несет невосполнимые экономические потери.
Незаменимым свойством «мата» (длинноволокнистой клетчатки) является и то, что только он единственный влияет на скорость освобождения содержимого желудка или прохождения его по пищеварительному тракту. От этого зависят обороты (пропускная способность) рубца. Все это основано на способности клетчатки, внутри пищеварительного тракта набухать, увеличивать вязкость и, тем самым, ускорять или замедлять прохождение его содержимого (химуса).
Все это основано на способности клетчатки, внутри пищеварительного тракта набухать, увеличивать вязкость и, тем самым, ускорять или замедлять прохождение его содержимого (химуса).
На набухание клетчатки оказывает влияние количество слюны, поступающей в рубец, и время нахождения клетчатки в рубце.
В тех сельхозорганизациях, где используются переизмельченные объемистые корма (а они тоже содержат достаточное количество клетчатки), время нахождения их в рубце коровы непродолжительное, кроме того, слюны выделяется в 2 раза меньше из-за ослабления жвачки. Следовательно, клетчатка не набухает, а значит, перестает выполнять роль регулятора скорости перемещения химуса. Как правило, при ацидозах фекалии становятся более жидкими. Сопутствующим фактором в этом случае является дополнительный вынос из организма питательных веществ и микроэлементов в силу быстрого прохождения по пищеварительному тракту переваренных питательных веществ других кормов рациона, что затрудняет их абсорбцию эпителием кишечника.
Однако при больших, превышающих физиологические нормы, дачах длинноволокнистой клетчатки происходит замедление освобождения ЖКТ. Количество оборотов рубца уменьшается, снижается потребление рациона, а следовательно, и продуктивность. Важно обратить Ваше внимание и на тот факт, что «мат» является благоприятной средой обитания бактерий и инфузорий, ферментирующих клетчатку.
Кислотность содержимого рубца
Кислотность рубца является одним из наиболее изменяющихся факторов, который может оказывать воздействие на микробную популяцию и уровни произведенных ЛЖК.
Бактерии, способные переваривать клетчатку, наиболее активны при кислотности в пределах 6,2 — 6,8. Бактерии, переваривающие крахмалы, предпочитают более кислую среду (pH – 5,4 — 6,2).
Количество определенных видов простейших может быть значительно снижено при кислотности 5,5. Чтобы приспособиться ко всем этим требованиям, обычная технология кормления должна поддерживать диапазон кислотности в пределах 6,2 — 6,7.
Главный вывод для практиков!
Необходимо всегда помнить, что в действительности «кормим» рубцовую микрофлору, поэтому следует выполнять ее требования. Кормовой рацион необходимо менять постепенно, чтобы у микроорганизмов было достаточно времени адаптироваться к другим условиям. Каждое изменение кормового рациона выгодно для одних и невыгодно для других микроорганизмов и всегда временно занижает образование питательных веществ, а тем самым, и молочную продуктивность. В этом месте хочется вспомнить те сельхозорганизации, которые меняют рацион несколько раз в день по так называемой системе: завтрак, обед и ужин, а не кормосмесь. Отсюда и условия для микроорганизмов рубца в течение суток меняются трехкратно.
ТЕСТ №6 ПРОСТЕЙШИЕ
Обновлено: 18.09.2022
А4. Какой тип бесполого размножения у инфузории-туфельки?
3) поперечное деление клетки
4) продольное деление клетки
А5. У какого простейшего переваривание пищи происходит в вакуолях?
У какого простейшего переваривание пищи происходит в вакуолях?
1) малярийный плазмодий
3) эвглена зелёная
4) амеба обыкновенная
А6. Споровики, в отличие от других простейших,
1) гетеротрофные организмы
2) имеют различные органоиды передвижения
3) имеют сложное строение клеток
4) исключительно паразиты
А7. К какому классу относится организм, изображённый на рисунке под номером 1 ?
2) Ресничные инфузории
4) Сосущие инфузории
А8. Какой критерий Не является главным при делении простейших на самостоятельные типы?
1) строение органоидов цитоплазмы
2) способ передвижения
4) строение ядра
А9. Саркожгутиконосцы — самые древние одноклеточные животные, так каку них
1) гетеротрофный тип питания
2) слабо развит внутренний скелет и отсутствуют органоиды специального назначения
3) встречаются колониальные формы
4) встречаются формы с наружным скелетом
BI. Выберите три верных ответа из шести. Запишите соответствующие буквы в алфавитном порядке.
Запишите соответствующие буквы в алфавитном порядке.
Какие характеристики относятся к простейшим?
А) тело состоит из одной или нескольких клеток
Г) одноклеточные, иногда образующие колонии
Д) как правило, микроскопических размеров
Е) эволюционно относительно молодые формы
В2. Установите соответствие между организмами разных групп простейших и их признаками.
А) непостоянная форма тела
Б) наличие раковин или внутренних скелетов
В) наличие двух ядер
Г) автотрофы, гетеротрофы, миксотрофы
Д) наличие органоидов специального назна-
ВЗ. Установите последовательность систематических единиц, начиная с наименьшей.
Ж) Амёба обыкновенная
: На задание Ci дайте краткий ответ, а на задание С2 — полный’:
Cl. Почему у морских и паразитических простейших сократительные вакуоли, как правило, отсутствуют или сокращаются очень редко?
С2. По каким признакам клетки одноклеточных организмов отличаются от клеток многоклеточных?
АI. Какое движение не характерно для простейших?
Какое движение не характерно для простейших?
А2. Инцистирование — это
1) тип полового процесса у водорослей, грибов, инфузорий
2) одна из форм бесполого размножения споровиков
3) образование временной плотной оболочки животным преимущественно при неблагоприятных условиях
4) движение микроорганизмов, направленное к раздражителю или от него
АЗ. Известняк и мел — это спрессованные
1) скелеты радиолярий
2) скелеты солнечников
3) раковины моллюсков
4) раковины фораминифер
А4. Каким образом простейшие переносят неблагоприятные условия?
1) в состоянии цисты
2) в состоянии споры
4) закапываясь в грунт
А5. У какого простейшего Нс образуются пищеварительные вакуоли?
1) амёба обыкновенная
3) малярийный плазмодий
А6. Чем отличаются сосущие инфузории от ресничных?
1) наличием двух ядер
2) отсутствием рта
3) отсутствием сократительной вакуоли
4) гетеротрофным типом питания
А7. К какому классу относится организм, изображённый на рисунке под номером 2?
К какому классу относится организм, изображённый на рисунке под номером 2?
1) Саркодовые 3) Жгутиковые
2) Ресничные инфузории 4) Сосущие инфузории
А8. Обыкновенную амёбу относят к подцарству Простейшие, потому что она
1) имеет мелкие размеры
2) обитает в водной среде
3) способна к передвижению
4) состоит из одной клетки
А9. Особенности строения клеток позволяют простейшим жить
1) в любых условиях
2) в водной и воздушной среде
3) только во влажной среде
4) только в пресных или солёных водоёмах
81. Выберите три верных ответа из шести. Запишите соответствующие буквы в алфавитном порядке.
A) клетка — целостный организм
Б) форма клеток большинства простейших имеет двустороннюю симметрию
B) клетка полифункциональна
Г) форма и строение клеток различны
Д) вакуоли простейших накапливают клеточный сок
Е) по способу питания все простейшие фитофаги
82. Основываясь на содержании понятий, установите соответствие между терминами и их переводом с латинского или греческого языков.
А)псевдоподии Б) планктон
В) фагоцитоз Г) циста Д) нуклеус
3) пожирать + клетка
83. Установите последовательность систематических единиц, начиная с наибольшей.
A) Трипаносома гамбийская
: На задание Cl дайте краткий ответ, а на задание С2 — полный «.
Cl. Что произошло бы с пресноводными простейшими при блокировании работы сократительной вакуоли?
С2. Почему одноклеточность накладывает ограничения на размеры организма? Как одноклеточные «обходят» эти ограничения?
Al. По типу питания простейшие —
4) миксотрофы и гетеротрофы
А2. Фагоцитоз — это
1) образование временной плотной оболочки животным преимущественно при неблагоприятных условиях
2) процесс активного захватывания и поглощения живых и неживых частиц одноклеточными организмами или особыми клетками многоклеточных организмов
3) захват клеточной поверхностью жидкости с содержащимися в ней веществами
4) одна из форм бесполого размножения споровиков
АЗ. Скелет радиолярий состоит из
Скелет радиолярий состоит из
I)извести 3) белка
А4. При конъюгации инфузорий-туфелек происходит обмен
4) подвижными ядрами, которые образуются при делении микронуклеуса
А5. Какое простейшее Не является паразитом?
2) трипаносома гамбийская
А6. Чемотличаются инфузории от амёб? 1) наличием ядра
3) способностью к передвижению
5) постоянной формой тела
А7. К какому классу относится организм, изображённый на рисунке под номером 3?
А8. Паразитический образ жизни амёбы дизентерийной привёл к 1) увеличению размеров ядра
2) уменьшению размеров ложноножек
3) увеличению размеров ложноножек
4) появлению клеточной оболочки
А9. Проследить геологическую историю простейших на миллионы лет назад возможно для
1)споровиков и ресничных
2) фораминифер и радиолярий
3) жгутиковых и споровиков
4) жгутиковых и ресничных
Что является основанием для подразделения простейших на типы?
Б) особенности строения ядра и цитоплазмы
82. Установите соответствие между разными группами корненожек и их особенностями строения.
Установите соответствие между разными группами корненожек и их особенностями строения.
Особенности строения
А) однокамерные раковины образованы органическим веществом, пропитаны солями
Б) многокамерные раковины пропитаны солями
В) внутренний скелет
Г) остатки организмов сформировали на дне морей мел и известняк
Д) остатки организмов на морском дне образуют глины
На задание Cl дайте краткий ответ, а на задание С2 — полный; ’,развернутый ответ. •
Cl. Какие особенности строения и жизнедеятельности простейших позволяют отнести их к царству Животные?
С2. Какова роль простейших в природе?
Al. Инфузории-туфельки по типу питания —
А2. Пиноцитоз — это
АЗ. Какой органоид отсутствует у эвглены зелёной?
2) целлюлозная клеточная стенка
4) сократительная вакуоль
А4. На какие внешние раздражители Не реагируют простейшие?
А5. У жгутиковых фототаксис
4) у пресноводных — отрицательный, у морских — положительный
А6. Чем отличаются ресничные инфузории от сосущих?
Чем отличаются ресничные инфузории от сосущих?
2) способом передвижения
А7. К какому классу относится организм, изображённый на рисунке под номером 4?
А8. Какие функции выполняют сократительные вакуоли?
3) поглощение воды из окружающей среды
4) удаление избытка воды с растворёнными продуктами жизнедеятельности
А9. Простейшие, как и водоросли, могут жить
3) только в пресных или солёных водоёмах
4) только во влажной среде
Чем отличаются животные, относящиеся к типу Инфузории?
А) органоиды движения — реснички
Б)два ядра в клетке.
В) пищеварительные органы: рот, глотка, пищевод
Ответы к тесту по биологии «Царство Животные. Простейшие» 4 варианта
Тест № 1 по теме:
Вариант 1.
1. Животные отличаются от растений:
а) способностью к дыханию
б) способностью приспосабливаться к условиям среды
+в) способом питания
г) способностью размножаться
2. Органоидами движения амебы являются:
а) жгутики
б) реснички
+в) ложноножки
г) щетинки
3. Процесс расщепления и переваривания пищи происходит:
Процесс расщепления и переваривания пищи происходит:
а) в сократительной вакуоли
+б) в пищеварительной вакуоли
в) вне вакуолей в цитоплазме
4. Порошица — это органоид:
а) выделения
б) размножения
+в) пищеварения
г) движения
5. Амебам свойственно размножение:
а) половое
+б) бесполое
в) оба способа
6. Эвглены переживают неблагоприятные условия в форме:
а) споры
+б) цисты
в) в обеих формах в зависимости от условий среды
7. Фотосинтез в хлоропластах эвглены идет:
а) в темноте
б) постоянно
+в) на свету
8. Какие простейшие животные могут питаться как растения и как животные:
а) саркодовые
+б) жгутиконосцы
в) инфузории
г) споровики
9) Из перечисленных организмов к жгутиконосцам относятся:
а) амеба протей
+б) трипаносома
в) инфузория — трубач
+г) эвглена зеленая
10) Свободноживущими простейшими являются:
+а) инфузории — сувойки
б) малярийный плазмодий
+в) фораминиферы
г) дизентерийная амеба
Вариант 2.
1) Какой из перечисленных органоидов отсутствует в клетках животных:
а) вакуоли
б) клеточная стенка
в) ядро
+г) хлоропласты
2. Инфузории передвигаются с помощью:
а) жгутиков
+б) ресничек
в) ложноножек
г) щетинок
3. Сократительная вакуоль — это органоид:
+а) выделения
б) размножения
в) пищеварения
г) движения
4. Один ученик считает, что зеленая эвглена — это растение, так как у нее есть хлоропласты, в которых происходит фотосинтез. Другой ученик относит зеленую эвглену к царству животных, так как она активно передвигается и питается готовыми органическими веществами. Рассудите спорщиков и выберите правильный ответ:
а) зеленая эвглена относится к особому царству
б) зеленая эвглена — животное
+в) зеленая эвглена занимает промежуточное положение между растениями и животными
г) зеленая эвглена — растение
5. Амебы переживают неблагоприятные условия среды в форме:
а) споры
+б) цисты
в) в обеих формах в зависимости от условий среды
6. Дыхание эвглены происходит:
Дыхание эвглены происходит:
+а) постоянно
б) только на свету
в) только в темноте
7. К какому классу относится эвглена зеленая:
а) саркодовые
+б) жгутиконосцы
в) инфузории
г) споровики
8. Человек заражается дизентерийной амёбой, проглотив:
а) яйца амебы
+б) цисты амебы
в) споры амёбы
9) Из перечисленных простейших к инфузориям относятся:
+а) сувойки
+б) трубачи
в) трипаносомы
г) солнечники
10. Осадочные породы образованы:
а) споровиками
б) жгутиконосцами
+в) саркодовыми
г) инфузориями
Вариант 3.
1. Эвглена зеленая передвигается с помощью:
+а) жгутиков
б) ресничек
в) ложноножек
г) щетинок
2. По сравнению с инфузориями у амеб отсутствует:
а) сократительная вакуоль
б) пищеварительная вакуоль
+в) малое ядро
г) цитоплазма
3. Эвглены питаются:
а) только автотрофно
б) только гетеротрофно
+в) используют оба способа
4. Инфузорням свойственно размножение:
Инфузорням свойственно размножение:
а) половое
+б) бесполое
в) оба способа
5. У малярийного плазмодия в цикле его развития хозяев:
а) 1
+б) 2
в) 3
6. Хлоропласты содержатся в клетках:
+а) эвглены зеленой
б) инфузории туфельки
в) амёбы протея
г) раковинной амёбы
7. Амебу, инфузорию, эвглену относят к одному подцарству потому, что у них:
+а) общий тип строения
б) сходный тип питания
в) одинаковые способы размножения
г) общая среда обитания
8) Из перечисленных организмов к саркодовым относятся:
а) инфузория — бурсария
+б) фораминифера
+в) солнечник
г) трипаносома
9) Какие из названных болезней вызываются простейшими:
+а) сонная болезнь
+б) дизентерия
в) холера
г) грипп
10. Наиболее сложное строение у:
а) амёбы
б) эвглены зеленой
+в) инфузории-туфельки
г) малярийного плазмодия
1. Кто из ученых впервые описал простейших:
а) Аристотель
б) Линней
+в) Левенгук
г) Ломоносов
2. Изучение зеленой эвглены позволяет сделать вывод о родстве растений и животных, так как она:
Изучение зеленой эвглены позволяет сделать вывод о родстве растений и животных, так как она:
а) имеет светочувствительный глазок
б) дышит всей поверхностью тела
+в) питается как растение и как животное
г) при дыхании поглощает кислород
3. Только паразитический образ жизни ведут следующие животные:
+а) саркодовые (корненожки)
б) жгутиконосцы
в) инфузории
г) споровики
4. Среди представителей саркодовых паразитический образ жизни ведет:
а) раковинная амеба
+б) дизентерийная амёба
в) фораминифера
г) солнечник
5. Цистой называется:
+а) состояние одноклеточных организмов, при котором образуется плотная оболочка
б) плотная оболочка клетки
в) название простейшего
г) название заболевания, вызванного простейшими
6. Какая группа простейших является наиболее сложноорганизованной:
+а) жгутиконосцы
б) инфузории
в) корненожки
г) споровики
7. Малярийный плазмодий распространяется:а) самостоятельно
+б) при помощи комара-анофелеса
в) при помощи комара-пискуна
г) при помощи мухи це-це
8. Малярийный плазмодий относится к:
Малярийный плазмодий относится к:
а) жгутиконосцам
+б) споровикам
в) саркодовым
г) инфузориям
9) Какие из перечисленных простейших не являются паразитами:
а) малярийный плазмодий
б) фораминифера
+в) вольвокс
г) лямблия
10) Строение какого животного опровергает утверждение, что все простейшие — это одноклеточные животные:
а) гониума
б) лямблии
в) вольвокса
+г) фораминиферы
Помогите пж завтра экзамен даю 100 б
Биология. Животные. 7 класс.
Вариант-1
Часть А.
А1. Самой крупной систематической единицей из перечисленных является:
1) тип 2) отряд 3) класс 4) род
А2. Семейства животных объединяются в:
1) царства 2) классы 3) роды 4) отряды
А3. Главным признаком, определяющим принадлежность особи к конкретному виду, является:
1) внешнее сходство с другими особями
2) общность занимаемой территории
3) сходный тип питания
4) отсутствие плодовитого потомства при скрещивании с другими особями
А4.
 Дизентерийную амебу, инфузорию-трубача и эвглену зеленую относят к одному подцарству,
Дизентерийную амебу, инфузорию-трубача и эвглену зеленую относят к одному подцарству, т. к. у них: 1) общий план строения 3) одинаковые способы размножения и образования цисты
2) сходный тип питания 4) общая среда обитания
А5. К свободноживущим червям из перечисленных относятся:
1) черная планария 2) эхинококк 3) печеночный сосальщик 4) бычий цепень
А6. Эвглена зеленая передвигается с помощью:
1) жгутиков 2) ресничек 3) ложноножек 4) щетинок
А7. Гидра восстанавливает потерянное в борьбе щупальце за счет деления клеток:
1) стрекательных 2) промежуточных 3) эпителиально-мускульных 4) нервных
А8. Пищеварительная система у кольчатых червей:
1) есть и разделена на отделы 2) есть, но не разделена на отделы
3) отсутствует 4) есть, но не имеет анального отверстия
А9. Трахеями и легочными мешками одновременно дышат:
1) пауки 2) жуки 3) пчелы 4) креветки
А10. Кто из насекомых проходит стадию куколки:
1) саранча 2) тля 3) бабочка 4)клоп
А11.
 Кожа ящерицы выполняют функцию:
Кожа ящерицы выполняют функцию: 1) дыхания 2) защиты от потерь воды 3) выделения 4) опоры
А12. Количество отделов в позвоночнике птиц равно:
1) шести 2) пяти 3) четырем 4) трем
А13. Оплодотворенная яйцеклетка называется:
1) гамета 2) зигота 3) сперматозоид 4) плод
А14. Нервная система в виде взаимосвязанных и взаимодействующих клеток впервые появилась у:
1) простейших 2) кишечнополостных 3) плоских червей 4) насекомых
А15. Кровеносная система впервые появилась у:
1) печеночного сосальщика 2) нереид и дождевых червей
3) аскарид и остриц 4) стрекоз и жуков
Часть В. В1. Выберите правильные утверждения. Приспособлениями птиц к полету можно считать:
А) Видоизмененные конечности Б) хорошее обоняние
В) Один круг кровообращения и легочное дыхание Г) Полые кости в скелете
Д) Наличие двенадцатиперстной и прямой кишки Е) Отсутствие мочевого пузыря
В2. Установите соответствие между признаками класса и классом животных:
Признаки класса
Классы
А) Кровеносная система замкнутая
Б) Тело покрыто слизистой кутикулой
В) Покровы из хитина
Г) Кровеносная система незамкнутая
Д) Дышат всем телом
Е) Дышат трахеями
1.
 Насекомые
Насекомые 2. Кольчатые черви
Помогите пж завтра экзамен даю 100 б
Биология. Животные. 7 класс.
Вариант-1
Часть А.
А1. Самой крупной систематической единицей из перечисленных является:
1) тип 2) отряд 3) класс 4) род
А2. Семейства животных объединяются в:
1) царства 2) классы 3) роды 4) отряды
А3. Главным признаком, определяющим принадлежность особи к конкретному виду, является:
1) внешнее сходство с другими особями
2) общность занимаемой территории
3) сходный тип питания
4) отсутствие плодовитого потомства при скрещивании с другими особями
А4. Дизентерийную амебу, инфузорию-трубача и эвглену зеленую относят к одному подцарству,
т. к. у них: 1) общий план строения 3) одинаковые способы размножения и образования цисты
2) сходный тип питания 4) общая среда обитания
А5. К свободноживущим червям из перечисленных относятся:
1) черная планария 2) эхинококк 3) печеночный сосальщик 4) бычий цепень
А6. Эвглена зеленая передвигается с помощью:
Эвглена зеленая передвигается с помощью:
1) жгутиков 2) ресничек 3) ложноножек 4) щетинок
А7. Гидра восстанавливает потерянное в борьбе щупальце за счет деления клеток:
1) стрекательных 2) промежуточных 3) эпителиально-мускульных 4) нервных
А8. Пищеварительная система у кольчатых червей:
1) есть и разделена на отделы 2) есть, но не разделена на отделы
3) отсутствует 4) есть, но не имеет анального отверстия
А9. Трахеями и легочными мешками одновременно дышат:
1) пауки 2) жуки 3) пчелы 4) креветки
А10. Кто из насекомых проходит стадию куколки:
1) саранча 2) тля 3) бабочка 4)клоп
А11. Кожа ящерицы выполняют функцию:
1) дыхания 2) защиты от потерь воды 3) выделения 4) опоры
А12. Количество отделов в позвоночнике птиц равно:
1) шести 2) пяти 3) четырем 4) трем
А13. Оплодотворенная яйцеклетка называется:
1) гамета 2) зигота 3) сперматозоид 4) плод
А14. Нервная система в виде взаимосвязанных и взаимодействующих клеток впервые появилась у:
1) простейших 2) кишечнополостных 3) плоских червей 4) насекомых
А15. Кровеносная система впервые появилась у:
Кровеносная система впервые появилась у:
1) печеночного сосальщика 2) нереид и дождевых червей
3) аскарид и остриц 4) стрекоз и жуков
Часть В. В1. Выберите правильные утверждения. Приспособлениями птиц к полету можно считать:
А) Видоизмененные конечности Б) хорошее обоняние
В) Один круг кровообращения и легочное дыхание Г) Полые кости в скелете
Д) Наличие двенадцатиперстной и прямой кишки Е) Отсутствие мочевого пузыря
В2. Установите соответствие между признаками класса и классом животных:
Признаки класса
Классы
А) Кровеносная система замкнутая
Б) Тело покрыто слизистой кутикулой
В) Покровы из хитина
Г) Кровеносная система незамкнутая
Д) Дышат всем телом
Е) Дышат трахеями
1. Насекомые
2. Кольчатые черви
Одноклеточные
Хламидомонада — одноклеточная зеленая водоросль грушевидной формы, живет в пресных стоячих водоемах, особенно если вода обогащена азотом. Имеет две сократительные вакуоли, чашеобразный хлоропласт (хроматофор), светочувствительный глазок, два жгутика. Плывет по направлению к свету. Бесполое размножение — путём митоза. Половое размножение: путём митоза образуются гаметы, толстостенная диплоидная зигота пережидает плохие условия. При ее прорастании происходит мейоз.
Плывет по направлению к свету. Бесполое размножение — путём митоза. Половое размножение: путём митоза образуются гаметы, толстостенная диплоидная зигота пережидает плохие условия. При ее прорастании происходит мейоз.
Эвглена зеленая имеет веретеновидную форму тела, один длинный жгутик, светочувствительный глазок. Двигается в сторону света, способна к фотосинтезу. При длительном отсутствии света становится бесцветной, при перемещении на свет хлоропласты восстанавливаются. Эвглена может поглощать жидкую пищу путем пиноцитоза. Живет в загрязненных органикой пресных водоемах, вызывает цветение воды. Миксотрофный тип питания эвглены доказывает, что между животными и растениями нет непреодолимой границы.
Амёба живет в пресных стоячих водоемах. Мембрана амебы образует выросты (ложноножки, псевдоподии), с помощью которых амеба передвигается и осуществляет фагоцитоз. Размножается только бесполым путем — делением клетки надвое (митозом). В неблагоприятных условиях амеба выделяет вокруг себя плотную защитную оболочку, образуется циста. Цисты переносятся ветром и водой — так происходит расселение амебы.
Цисты переносятся ветром и водой — так происходит расселение амебы.
Инфузория живет в пресных водоемах. Движется за счет ресничек, покрывающих тело. Имеет два ядра: большое (макронуклеус) образует РНК, малое (микронуклеус) участвует в половом процессе. Пищевые частицы (бактерии) согласованным биением ресничек направляются к клеточному рту, он ведет в клеточную глотку, на конце которой образуется пищеварительная вакуоль. Непереваренные частицы выбрасываются наружу через порошицу. Бесполое размножение — поперечное деление, половой процесс — конъюгация.
Малярийный плазмодий — паразит человека. Он проникает в эритроциты, там питается гемоглобином, размножается. При выходе плазмодиев из эритроцита в кровь попадают продукты распада, что приводит к высокой температуре (лихорадке) каждые 3 или 4 дня (в зависимости от вида плазмодия). Анемия, вызванная разрушением эритроцитов, и повторяющиеся лихорадки истощают больного малярией, он может умереть. Переносчиком плазмодия является комар из рода Анофелес.
Ещё паразитические простейшие: дизентерийная амеба, лямблия.
Сократительная вакуоль удаляет из клетки лишнюю воду, поступающая за счет осмоса (у инфузории — две штуки, с приводящими канальцами). Обычно отсутствует у растений и паразитов.
Еще можно почитать
Задания части 1
ХЛАМИДОМОНАДА
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Для организма, изображённого на рисунке, характерно(-ы):
1) исключительно бесполое размножение
2) светочувствительный глазок
3) хроматофор
4) митохондрии
5) клеточный рот
6) ложноножки
ХЛАМИДОМОНАДА КРОМЕ
Все приведённые ниже термины, кроме двух, используют для описания клетки, изображённой на рисунке. Определите два понятия, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) жгутики
2) клеточный рот
3) целлюлозная клеточная стенка
4) прокариот
5) светочувствительный глазок
ХЛАМИДОМОНАДА — АМЕБА
Установите соответствие между характеристиками и организмами: 1) хламидомонада, 2) амёба. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) осуществляет фагоцитоз
Б) по типу питания преимущественно фототроф
В) размножается и бесполым, и половым способами
Г) содержит одну сократительную вакуоль
Д) образует зооспоры при размножении
ХЛАМИДОМОНАДА — АМЕБА РИС
1. Установите соответствие между характеристиками и организмами, изображенными на рисунке. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) размножается при помощи зооспор
Б) питается за счет фагоцитоза
В) способен к фототаксису
Г) способен к образованию псевдоподий
Д) образует подвижные гаметы
Е) в жизненном цикле преобладает гаплоидное поколение
2. Установите соответствие между характеристиками и организмами, изображенными на рисунке. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) фотосинтез
Б) фагоцитоз
В) размножение зооспорами
Г) образование цисты
Д) гетеротрофное питание
ХЛАМИДОМОНАДА — ИНФУЗОРИЯ
1. Установите соответствие между признаками организма и видами организмов, обладающих этими признаками: 1) хламидомонада, 2) инфузория-туфелька. Запишите цифры 1 и 2 в правильном порядке.
Установите соответствие между признаками организма и видами организмов, обладающих этими признаками: 1) хламидомонада, 2) инфузория-туфелька. Запишите цифры 1 и 2 в правильном порядке.
А) имеются гаметы
Б) имеются реснички
В) имеются хлоропласты
Г) есть клеточная стенка
Д) в клетке два ядра
Е) есть два жгутика
2. Установите соответствие между характеристиками и организмами: 1) инфузория-туфелька, 2) хламидомонада. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) преобладание в жизненном цикле гаплоидного поколения
Б) обновление наследственного материала путём конъюгации
В) отсутствие оплодотворения
Г) образование множества гамет путём митоза
Д) образование зооспор
ХЛАМИДОМОНАДА — ИНФУЗОРИЯ РИС
Установите соответствие между характеристиками и организмами, обозначенными на рисунке цифрами 1, 2: запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) гетеротрофное питание
Б) способность к фагоцитозу
В) способность к фотосинтезу
Г) размножение зооспорами
Д) половой процесс путем конъюгации
Установите соответствие между характеристиками и группами водорослей: 1) бурые водоросли, 2) хламидомонадовые зелёные водоросли. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) доминирующее поколение в жизненном цикле гаплоидное
Б) обитают на глубине до 40-100 м
В) представителями являются саргас и ламинария
Г) могут вызывать цветение воды
Д) являются одноклеточными со жгутиками
ЭВГЛЕНА РИС.
1. Все перечисленные ниже признаки, кроме двух, используются для описания изображенной клетки. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) эукариотическая клетка
2) имеет пластиды
3) способна изменять форму
4) структура обозначенная знаком вопроса выполняет функцию выделения
5) содержит светочувствительный глазок
2. Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны. Для организма, изображённого на рисунке, характерно
1) большое и малое ядро
2) пластиды
3) миксотрофное питание
4) светочувствительный глазок
5) половое размножение
6) реснички
2. Какую функцию выполняет органоид у зелёной эвглены, обозначенный на рисунке вопросительным знаком?
Какую функцию выполняет органоид у зелёной эвглены, обозначенный на рисунке вопросительным знаком?
1) обеспечивает реакции на свет
2) контролирует обмен веществ
3) осуществляет автотрофное питание
4) выделяет продукты обмена
ЭВГЛЕНА — АМЕБА
Установите соответствие между признаком и одноклеточным организмом, для которого он характерен: 1) эвглена, 2) амёба.
А) форма тела постоянная
Б) передвигается при помощи образования ложноножек
В) поедает бактерии
Г) наличие хлоропластов в цитоплазме
Д) миксотрофный тип питания
Е) только бесполое размножение
ЭВГЛЕНА — КИШ.ПАЛОЧКА
Установите соответствие между характеристиками и организмами: 1) кишечная палочка, 2) эвглена зелёная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) имеет клеточную стенку из муреина
Б) содержит хлоропласты
В) может питаться фагоцитозом
Г) ДНК лежит в цитоплазме
Д) размножаясь, вызывает цветение воды
АМЕБА — ИНФУЗОРИЯ
1. Установите соответствие между признаками и животными, для которых они характерны: 1) амёба обыкновенная, 2) инфузория-туфелька. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
Установите соответствие между признаками и животными, для которых они характерны: 1) амёба обыкновенная, 2) инфузория-туфелька. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) сократительные вакуоли с приводящими канальцами
Б) непостоянная форма тела
В) наличие клеточной глотки
Г) выведение остатков пищи через порошицу
Д) движение с помощью ложноножек
Е) наличие полового процесса
2. Установите соответствие между характеристиками и животными: 1) Амёба обыкновенная, 2) Инфузория-туфелька. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) пищу захватывает ложноножками
Б) продукты обмена выводятся через две сократительные вакуоли
В) размножается только бесполым путём
Г) происходит обмен ядрами при половом процессе
Д) защищается с помощью трихоцист
Е) передвигается с помощью ресничек
ИНФУЗОРИЯ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие признаки характерны для указанного организма?
1) характерен половой процесс
2) образование споры при неблагоприятных условиях среды
3) наличие большого и малого ядер
4) хемотрофный тип питания
5) наличие сократительных вакуолей с приводящими канальцами
6) паразитический образ жизни
ИНФУЗОРИЯ КРОМЕ
Все приведенные ниже термины, кроме двух, используют для описания клетки, изображенной на рисунке. Определите два понятия, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
Определите два понятия, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) сократительная вакуоль
2) клеточный рот
3) муреиновая клеточная стенка
4) макронуклеус
5) хроматофор
ИНФУЗОРИЯ — БАКТЕРИЯ
1. Установите соответствие между признаком и организмом, для которого он характерен: 1) инфузория туфелька, 2) бацилла сибирской язвы. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) клетка не имеет ядерной мембраны
Б) образует споры вне организма хозяина
В) клетка содержит оформленное ядро
Г) не имеет аппарата Гольджи
Д) передвигается с помощью ресничек
Е) имеется пищеварительная вакуоль
ИНФУЗОРИЯ — ГИДРА
Установите соответствие между признаками и организмами: 1) пресноводная гидра, 2) инфузория-туфелька. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) наличие в клетке двух ядер
Б) передвижение с помощью ресничек
В) осуществление захвата пищи с помощью клеточного рта
Г) удаление избытка воды сократительными вакуолями
Д) наличие стрекательных клеток
Е) размножение почкованием
МАЛЯРИЙНЫЙ ПЛАЗМОДИЙ
1. Установите последовательность процессов в жизненном цикле малярийного плазмодия, начиная с передачи паразита в тело промежуточного хозяина. Запишите в таблицу соответствующую последовательность цифр.
Установите последовательность процессов в жизненном цикле малярийного плазмодия, начиная с передачи паразита в тело промежуточного хозяина. Запишите в таблицу соответствующую последовательность цифр.
1) поступление плазмодия в клетки печени
2) проникновение возбудителя в кровяное русло
3) укус человека незараженным комаром
4) множественное деление паразита в эритроцитах
5) половое размножение плазмодия в теле основного хозяина
2. Установите последовательность стадий в жизненном цикле малярийного плазмодия, начиная с образования гамет. Запишите соответствующую последовательность цифр.
1) размножение в эритроцитах
2) заражение человека
3) размножение в клетках печени человека
4) бесполое размножение в организме комара
5) образование зиготы
6) образование гамет
Проанализируйте таблицу «Одноклеточные животные». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) Автотрофное
2) 2 сократительные вакуоли
3) Сократительная вакуоль
4) Дыхание
5) Движение
6) Гетеротрофное
Выберите два одноклеточных организма.
1) Хламидомонада
2) Спирогира
3) Улотрикс
4) Вольвокс
5) Эвглена Зеленая
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие из организмов являются одноклеточными?
1) ламинария
2) эхинококк
3) трипаносома
4) актиния
5) малярийный плазмодий
6) инфузория балантидий
Установите соответствие между организмами и особенностями строения тела: 1) одноклеточные, 2) многоклеточные. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) хлорелла
Б) дрожжи
В) планария
Г) пеницилл
Д) медуза
Е) сенная палочка
Установите соответствие между простейшими животными и средами их обитания: 1) пресные водоемы, 2) живые организмы. Запишите цифры 1 и 2 в правильном порядке
А) эвглена зеленая
Б) амеба обыкновенная
В) амеба дизентерийная
Г) инфузория-туфелька
Д) малярийный плазмодий
Е) лямблия
Тема: Подцарство Простейшие (Protozoa)
**Тест 1. К классу Растительные жгутиконосцы относятся
К классу Растительные жгутиконосцы относятся
- эвглена зеленая
- амеба протей
- дизентерийная амеба
- вольвокс
- трипаносома
- лейшмания
- гониум
- пандорина
**Тест 2. К классу Животные жгутиконосцы относятся
**Тест 3. Из перечисленных органоидов имеются у эвглены и отсутствуют у амебы
- ядро
- сократительная вакуоль
- стигма
- хроматофоры
- жгутик
- пелликула
- аксостиль
- порошица
Тест 4. Эвглена зеленая размножается
- поперечным делением клетки надвое
- продольным делением клетки надвое
- путем шизогонии
- при благоприятных условиях — бесполым способом, при неблагоприятных — половым
Тест 5. Способностью к фотосинтезу обладает жгутиконосец, обозначенный на рисунке цифрой _______
Тест 6. Могут образовывать гаметы
- амебы
- вольвокс
- эвглены
- трипаносомы
Тест 7. Не является колонией жгутиконосцев
Не является колонией жгутиконосцев
- эвдорина
- пандорина
- глобигерина
- вольвокс
Тест 8. Возбудителем кожного лейшманиоза (пендинской язвы) являются
- мухи це-це
- трипаносомы
- москиты
- лейшмании
- трихомонады
Тест 9. Возбудителем сонной болезни являются
- мухи це-це
- лямблии
- трипаносомы
- москиты
- лейшмании
Тест 10. Схема жизненного цикла возбудителя висцерального лейшманиоза обозначена цифрой ______
Задание 6. Строение инфузории туфельки
Изучите рисунок и сделайте к нему подписи.
Задание 7. Характеристика типа Инфузории
Впишите пропущенные слова (или группы слов).
- Инфузория туфелька относится к типу (________________), классу (________________).
- Прохождение пищи у ресничных инфузорий осуществляется через (________________) и (________________).
- Органоиды защиты инфузории туфельки называются(________________).

- Инфузория туфелька имеет две сократительные вакуоли, каждая из которых состоит из (________________) и (________________).
- Трубач относится к типу (________________), классу (________________).
- В эндоплазме трубача вдоль тела располагаются длинный четковидный (________________) и рядом с ним несколько (________________).
- На переднем воронковидно расширенном конце тела трубача находится (________________).
- Балантидий относится к типу (________________), классу (________________).
- Балантидий паразитирует в (________________) человека и (________________).
- Как все инфузории, сувойки размножаются бесполым способом, который чередуется с (________________).
- Хромосомный набор микронуклеуса (________________), макронуклеуса (________________).
- Во время бесполого размножения микронуклеус делится (________________), макронуклеус (________________).
- В результате бесполого размножения сувоек образуются свободно плавающие (________________).

- Сосущие инфузории не имеют ресничек, (________________) и цитостома.
- Балантидий вызывает у человека тяжелое заболевание (________________).
Задание 8. Жизненный цикл малярийного плазмодия
8.1. Изучите рисунок и сделайте к нему подписи.
8.2. Впишите пропущенные слова (или группы слов).
- Малярийный плазмодий относится к типу (________________), классу (________________).
- Окончательным хозяином малярийного плазмодия является (________________).
- Промежуточным хозяином малярийного плазмодия является (________________).
- При укусе человека комаром вместе со слюной комара в ранку могут попасть (________________) малярийного плазмодия.
- Бесполое размножение малярийного комара в клетках печени человека называется (________________).
- Бесполое размножение малярийного комара в эритроцитах человека называется (________________).
- При трехдневной малярии интервал между приступами лихорадки составляет (________________) часов, при четырехдневной — (________________).

- Процесс формирования гамет у малярийного плазмодия начинается в организме (________________) и завершается в организме (________________).
- Обладающая подвижностью зигота малярийного плазмодия называется (________________).
- В организме человека могут паразитировать (________________) вида малярийных плазмодиев.
Задание 9. Характеристика подцарства Простейшие (Protozoa)
9.1. Установите соответствие между видом простейшего и его систематическим положением.
| Вид | Класс | Тип |
| 1. Токсоплазма | А. Солнечники | I. Инфузории |
| 2. Дизентерийная амеба | Б. Растительные жгутиконосцы | II. Апикомплексы |
| 3. Трихомонада | В. Животные жгутиконосцы | III. Саркомастигофоры |
| 4. Диффлюгия | Г. Споровики | |
| 5. Клатрулина | Д. Корненожки | |
| 6. Эвдорина | Е. Сосущие инфузории | |
7. Сувойка Сувойка | Ж. Ресничные инфузории |
9.2. Установите соответствие между видом простейшего и способом(ами), которым он размножается.
| Вид | Способ размножения |
| 1. Амеба протей | А. Поперечное деление материнской клетки надвое |
| 2. Эвглена зеленая | Б. Продольное деление материнской клетки надвое |
| 3. Вольвокс | В. Шизогония |
| 4. Лямблия | Г. Половое размножение типа конъюгации |
| 5. Трипаносома | Д. Половое размножение типа изогамии |
| 6. Трубач | Е. Половое размножение типа гетерогамии |
| 7. Малярийный плазмодий | Ж. Половое размножение типа овогамии |
9.3. Установите соответствие между видом простейшего и присутствующими у него органоидами.
| Вид | Органоид |
| 1. Инфузория-туфелька | А. Жгутики |
2. Трихомонада Трихомонада | Б. Реснички |
| 3. Балантидий | В. Ундулирующая мембрана |
| 4. Трипаносома | Г. Псевдоподии |
| 5. Амеба протей | Д. Трихоцисты |
| 6. Вольвокс | Е. Присасывательный диск |
| 7. Сувойка | Ж. Стигмы |
9.4. Установите соответствие между видом паразитического простейшего и способом, которым он попадает в организм человека.
| Вид | Способ заражения |
| 1. Дизентерийная амеба | А. Пероральный |
| 2. Возбудитель сонной болезни | Б. Трансмиссивный |
| 3. Возбудитель болезни Чагаса | В. Контактный |
| 4. Возбудитель кожного лейшманиоза | Г. Трансплацентарный |
| 5. Возбудитель висцерального лейшманиоза | |
| 6. Лямблия | |
| 7. Трихомонада | |
| 8. Балантидий | |
| 9. Малярийный плазмодий | |
10. Токсоплазма Токсоплазма |
Задание 10. Термины
Дайте определение терминам.
1. Гетеротрофные организмы. 2. Автотрофные организмы. 3. Миксотрофные организмы. 4 Органоиды. 5.Таксисы. 6. Инцистирование. 7. Трансмиссивное заболевание. 8.Конъюгация. 9. Шизогония. 10. Промежуточный хозяин. 11. Окончательный хозяин. 12. Инвазионные заболевания. 13. Планктон. 14. Бентос. 15.Эпибионты.
Задание 11. Характеристика типа Губки
11.1. Изучите рисунок и сделайте к нему подписи.
11.2. Впишите пропущенные слова (или группы слов).
- По способу питания губки являются (________________).
- Выделяют три типа строения губок: (________________), (________________) и (________________).
- Ток воды в асконоидной губке осуществляется по следующему пути: поры → (________________) → (________________) → оскулум.
- Ток воды в сиконоидной губке осуществляется по следующему пути: поры → (________________) → (________________) → (________________) → оскулум.

- Ток воды в лейконоидной губке осуществляется по следующему пути: поры → (________________) → (________________) → (________________) → (________________) → оскулум.
- Личинка большинства губок называется (________________).
- Туалетная губка относится к классу (________________).
- Губка корзинка Венеры относится к классу (________________).
- Губка кубок Нептуна относится к классу (________________).
- В пресных водоемах обитает губка (________________).
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания — обратитесь к врачу.
Читайте также:
- Кошачий коготь при туберкулезе
- Гельминтозы. БУ Нижневартовская городская поликлиника
- Пути передачи ВИЧ-инфекции
- Соссюрея или Горькуша
- Внимание! Владельцам КРС и МРС о необходимости вакцинации животных
Вода | Бесплатный полнотекстовый | Пространственное распределение сообществ инфузорий мелководного пойменного озера с анаэробной зоной
1.
 Введение
Введение Изменения водного режима и морфологии рек Европы в результате деятельности человека привели к утрате их естественных сезонных циклов и гидрологических характеристики [1,2,3,4,5]. Отсутствие затопления и хозяйственного освоения пойм не только сократило количество пойменных водоемов, но и изменило характеристики их экосистемы. Одним из последствий нарушения регулярной связи пойменных водоемов с руслом реки является деградация их биоразнообразия [6,7]. В пойменных озерах, давно утративших связь с руслом реки из-за его зарегулирования, формируется устойчивая стратификация, в придонных слоях воды наблюдается дефицит кислорода, при этом прогрессируют процессы заиления и обмеления. Следствием заиления и стратификации является развитие устойчивых анаэробных процессов в пойменных озерах, что приводит к дальнейшему снижению разнообразия [7,8,9].]. В то же время пойменные озера со стойкими анаэробными донными отложениями (сапропелем) становятся источником парниковых газов, в первую очередь СО 2 , метана, а также сероводорода [10,11,12,13]. В конечном итоге такие водоемы не только теряют свою важнейшую функцию поддержания биоразнообразия речной экосистемы, но и становятся дополнительным источником загрязнения атмосферы. Образование парниковых газов в основном связано с функционированием в таких водоемах микроорганизмов из анаэробных донных отложений, то есть сапропеля [13,14,15]. Сообщества реснитчатых простейших в таких озерах очень специфичны; в пресноводных экосистемах они представлены значительным числом видов, в том числе анаэробных [16,17,18]. На состав ассоциаций реснитчатых простейших в различных местообитаниях влияют химический состав воды, доступность питательных веществ [19].,20,21,22], и особенно по концентрации кислорода и ее динамике [23,24,25]. Реснитчатые простейшие играют важную роль в водной экосистеме как потребители бактерий, жгутиковых и перифитных водорослей, удерживая большинство бактерий в фазе экспоненциального роста [26,27].
В конечном итоге такие водоемы не только теряют свою важнейшую функцию поддержания биоразнообразия речной экосистемы, но и становятся дополнительным источником загрязнения атмосферы. Образование парниковых газов в основном связано с функционированием в таких водоемах микроорганизмов из анаэробных донных отложений, то есть сапропеля [13,14,15]. Сообщества реснитчатых простейших в таких озерах очень специфичны; в пресноводных экосистемах они представлены значительным числом видов, в том числе анаэробных [16,17,18]. На состав ассоциаций реснитчатых простейших в различных местообитаниях влияют химический состав воды, доступность питательных веществ [19].,20,21,22], и особенно по концентрации кислорода и ее динамике [23,24,25]. Реснитчатые простейшие играют важную роль в водной экосистеме как потребители бактерий, жгутиковых и перифитных водорослей, удерживая большинство бактерий в фазе экспоненциального роста [26,27].
В то же время мелководные озера со значительными анаэробными зонами обычно теряют значительную часть животных, не переносящих бескислородные или микрооксигенированные условия. Рыбы, как правило, нет, а разнообразие беспозвоночных крайне мало. В такой ситуации возникает проблема оценки качества водной среды. Обычно для оценки водной среды используют информацию о рыбах, макрофитах, фитобентосе, фитопланктоне и макробеспозвоночных [28]. В то же время большинство из вышеперечисленных групп не могут быть полноценно развиты в водоемах указанного типа, что ставит их за скобки при оценке качества водной среды в таких водоемах. Такие водоемы одновременно являются важным компонентом речных экосистем.
Рыбы, как правило, нет, а разнообразие беспозвоночных крайне мало. В такой ситуации возникает проблема оценки качества водной среды. Обычно для оценки водной среды используют информацию о рыбах, макрофитах, фитобентосе, фитопланктоне и макробеспозвоночных [28]. В то же время большинство из вышеперечисленных групп не могут быть полноценно развиты в водоемах указанного типа, что ставит их за скобки при оценке качества водной среды в таких водоемах. Такие водоемы одновременно являются важным компонентом речных экосистем.
Целью данной работы было описание результатов исследований пространственного распределения сообществ простейших инфузорий в условиях мелководного пойменного озера и связи этого распределения с градиентами кислорода, существующими в разных частях объема озера. Сделана попытка оценить качество среды по индикаторным видам инфузорий, реагирующим на содержание кислорода. В дальнейшем это может быть использовано для биоиндикации трофического состояния водоемов и стать полезным инструментом для уточнения оценки качества воды в водоемах различного типа, особенно со стабильными анаэробными условиями.
2. Материалы и методы
2.1. Район исследования
Пойменное озеро, расположенное на левом берегу реки Ворсклы в Сумской области (Украина) в районе г. Ахтырка, изучалось в течение года (рис. 1).
По происхождению озеро является фрагментом старого русла Ворсклы. Этот фрагмент русла существует как озеро уже более 70 лет. В середине 20 века в это озеро поступали сточные воды, что значительно повысило его трофический статус. В настоящее время озеро не получает стока, но его трофический статус остается высоким. В таблице 1 приведены морфометрические характеристики озера. Озеро находится на расстоянии около 200 м от основного русла реки. Летом не пересыхает, несмотря на небольшую глубину; в засушливые периоды глубина может уменьшаться до 1 м. Поверхность озера почти полностью покрыта «ковром ряски» толщиной 10–15 см из Lemna trisulca L. с небольшим количеством Lemna minor L. Некоторые физико-химические характеристики местообитаний в озере сведены в табл. 2.
2.
2.2. Местообитания
Несмотря на небольшую глубину, в озере наблюдается резкое разделение местообитаний по температурному и кислородному режимам.
Поверхностный ярус ряски устойчив большую часть года — с апреля по декабрь; зимой часть ряски опускается на дно, а часть вмерзает в лед. В этом слое температурно-кислородный режим характеризуется большей сезонной и суточной амплитудой по сравнению с нижележащими слоями. Содержание кислорода в дневное время может превышать 100% насыщения.
В толще воды содержание растворенного кислорода различается между слоем ряски и дном, но большую часть времени условия оставались микроаэробными. В период, когда озеро покрыто слоем ряски, содержание кислорода здесь составляет 0–2 мг/л. Здесь наблюдается увеличение содержания кислорода до и после установления ледяного покрова (в начале зимы и весны — в эти два сравнительно коротких промежутка водная поверхность свободна от покрова, образованного слоем ряски летом и летом). под слоем льда зимой). На период ледовитости аноксия охватывает всю толщу воды в озере.
под слоем льда зимой). На период ледовитости аноксия охватывает всю толщу воды в озере.
Слой сапропеля устойчиво удерживается со дна на высоте 1 м, где круглый год сохраняются стабильные анаэробные условия.
2.3. Сбор данных и обработка проб
Температуру и содержание O 2 измеряли с помощью портативного мультиметра HACH HQ40d. Измерения проводились на месте ступенчато от дна через каждые 0,2 м, что позволило установить зону разграничения бескислородного и бескислородного слоев воды.
Пробы для подсчета инфузорий отбирали в течение одного года с сентября по сентябрь один раз в месяц. В трех точках озера были отобраны пробы в каждом из типов местообитаний: растения, слой воды под растениями и донные отложения, т. е. сапропель. После обработки данные из этих трех точек отбора проб были усреднены (рис. 1). Пробы из водной толщи отбирали барометром Рутнера объемом 1 л. Пробы дна отбирали микробентометром [29].
Образцы сапропеля отбирали так, чтобы емкость была заполнена доверху и между крышкой и образцом не было воздушной прослойки. Образцы растений отбирали стеклянными цилиндрами. Цилиндр погружали в заросли Lemna trisulca, растения осторожно вдавливали внутрь цилиндра с помощью пинцета, после чего цилиндр закрывали с обеих сторон пробками [25]. В лаборатории образцы хранились в холодильнике при температуре +5 °С до и во время обработки. Емкости с анаэробными пробами открывали только при отборе проб на микроскопию. Пробы воды, содержащие растворенный кислород, и пробы растений хранили с открытой крышкой. Образцы были обработаны в течение нескольких часов после отбора.
Образцы растений отбирали стеклянными цилиндрами. Цилиндр погружали в заросли Lemna trisulca, растения осторожно вдавливали внутрь цилиндра с помощью пинцета, после чего цилиндр закрывали с обеих сторон пробками [25]. В лаборатории образцы хранились в холодильнике при температуре +5 °С до и во время обработки. Емкости с анаэробными пробами открывали только при отборе проб на микроскопию. Пробы воды, содержащие растворенный кислород, и пробы растений хранили с открытой крышкой. Образцы были обработаны в течение нескольких часов после отбора.
Пробы из кислородсодержащего слоя воды и сапропеля обрабатывали в счетной камере объемом 1 мл при увеличениях ×28 и ×56. Последовательно обрабатывали образцы объемом от пяти до семи мл. Образцы растений обрабатывали в два этапа. Сидячие формы инфузорий на поверхности 5 фрагментов Lemna trisulca и Lemna minor подсчитывали в фильтрованной воде в чашке Петри. Для подсчета свободноплавающих форм пробу перемешивали стеклянной палочкой в стакане и после перемешивания автоматической пипеткой отбирали 1 мл воды. Инфузорий учитывали в 5–7 пробах по 1 мл в счетной камере.
Инфузорий учитывали в 5–7 пробах по 1 мл в счетной камере.
Каждый раз перед началом количественных исследований изучали видовой состав реснитчатых простейших. В каждом местообитании были отобраны предварительные пробы и проведена прижизненная видовая идентификация с использованием микроскопа Olympus CX41 в проходящем свете, а также темнопольного и фазово-контрастного методов. Идентификацию реснитчатых простейших проводят по форме клеток, особенностям строения цилиарного аппарата, морфологии макронуклеуса, положению сократительных вакуолей, количеству пелликулярных полос (для Vorticella spp.) и ряду других признаков. Современные микроскопические методы предлагают хорошие возможности для идентификации видов. Для облегчения визуальной идентификации простейших помещали в раствор оксипролцеллюлозы, что значительно замедляет их движение и позволяет увидеть особенности их строения. Это замедление скорости движения позволяет хорошо рассмотреть основные детали строения и расположения цилиарного аппарата (рис. 2а), а также форму и положение макронуклеуса (рис. 2б). В случаях, когда макронуклеус не был виден в проходящем свете (рис. 3а), использовали метод фазового контраста (рис. 3б). В тех редких случаях, когда макронуклеусы не проявлялись, их окрашивали метиленовым зеленым, а с помощью техники окрашивания серебром выявляли инфрацилиатуру (цилиарный рисунок) и систему серебряных линий (выявляемые нитратом серебра линии, соединяющие базальные тельца и другие кортикальные органеллы) ( Рисунок 4а,б) [30]. Идентификация видов (морфовидов) проводилась на основе Foissner и Berger [18], Foissner et al. [31,32,33,34], Янковский [35], Каль [36,37,38,39], и другие.
2а), а также форму и положение макронуклеуса (рис. 2б). В случаях, когда макронуклеус не был виден в проходящем свете (рис. 3а), использовали метод фазового контраста (рис. 3б). В тех редких случаях, когда макронуклеусы не проявлялись, их окрашивали метиленовым зеленым, а с помощью техники окрашивания серебром выявляли инфрацилиатуру (цилиарный рисунок) и систему серебряных линий (выявляемые нитратом серебра линии, соединяющие базальные тельца и другие кортикальные органеллы) ( Рисунок 4а,б) [30]. Идентификация видов (морфовидов) проводилась на основе Foissner и Berger [18], Foissner et al. [31,32,33,34], Янковский [35], Каль [36,37,38,39], и другие.
Простейших подсчитывали под бинокулярной лупой Opta-Tech в модифицированной счетной камере Богорова, в которую помещали пробу объемом 1 мл. Из-за извилистой формы канавки камеры 1 мл пробы был распределен в восемь отсеков (рис. 5). При просмотре субпробы при малом увеличении (от ×28 до ×56) исследователь видит всю ширину борозды, а глубина резкости позволяет охватить весь объем субпробы в поле зрения. Последовательная обработка отдельных отсеков камеры позволяет избежать двойного учета.
Последовательная обработка отдельных отсеков камеры позволяет избежать двойного учета.
2.4. Статистический анализ
Данные по видам водных растений обработаны с использованием R 4.1.2 версии «Bird Hippie» [40] с пакетом tidyverse [41]; t-SNE [42,43] был выполнен с использованием пакета Rtsne [44], тогда как неметрическое многомерное масштабирование (NMDS) было выполнено с использованием функции metaMds из веганского пакета [45]. Поиск видов-индикаторов биотопов и кислородного режима проводили с помощью пакета indicspacies [46]. Метод сочетает относительную численность (специфичность) видов с относительной частотой встречаемости (достоверность) видов в различных местообитаниях. Значения индикатора распределяют виды по группам и дают им значения индикатора от 0 до 1. Индексы Шеннона и Симпсона были рассчитаны с использованием пакета BiodiversityR [47].
3. Результаты
В результате изучения реснитчатых простейших в пойменном озере обнаружено 111 видов из 81 рода, 24 отрядов и 11 классов по методу Lynn [48].
Среди морфологических групп – плавающих, ползающих и прикрепляющихся – преобладали плавающие формы – 63 вида. Ползучие формы были несколько менее разнообразны (26 видов), а наименьшее количество видов наблюдалось у прикрепленных форм (5 видов). Представители Armophorea из родов Caenomorpha, Ludio, Brachonella, Metopus и представители Plagiopylea из родов Plagiopyla, Discomorphella, Epalxella, Pelodinium, Saprodinium были выделены в особую морфогруппу – спиралевидные формы (17 видов).
В соответствии с разделением реснитчатых простейших на экологические (поведенческие) группы в озере выявлено 10 оксифильных видов, 11 эуриоксифильных видов, 28 микрооксифильных видов, 21 аноксифильный или анаэробный и 6 видов, достигающих более высокой плотности в условиях активного ила, чем в естественных местообитаниях — «виды активного ила» [25,49]. Для 35 зарегистрированных видов экологические приоритеты еще не определены.
В условиях бескислородных отложений за весь период исследований выявлено 47 видов инфузорий. Максимальное количество видов наблюдалось осенью (31 вид), минимальное – весной (13 видов). Зимой и летом отмечено 20 и 21 вид соответственно.
Максимальное количество видов наблюдалось осенью (31 вид), минимальное – весной (13 видов). Зимой и летом отмечено 20 и 21 вид соответственно.
В условиях свободной воды с микрокислородным режимом, граничащим с одной стороны с сапропелем, а с другой — с слоем ряски, всего выявлено 52 вида, максимальное количество (28 видов) осенью, минимальная численность весной (9 видов). Зимой и летом отмечено 23 и 18 видов соответственно.
Среди растений, в отличие от других местообитаний, число видов изменялось незначительно в течение всего вегетационного периода, с весны до осени (весна: 33 вида, лето: 30 видов, осень: 36 видов). Численность видов значительно уменьшилась зимой (12 видов), когда был разрушен ярус ряски и большая часть ряски опустилась на дно, а часть вмерзла в лед. Общее количество видов, выявленных в условиях яруса ряски за исследуемый период, составило 68.
На рис. 6 показан t-SNE, основанный на количественном представлении позиций изучаемых местообитаний. Образцы сапропеля образуют отдельную группу и не пересекаются с образцами из водной толщи и растительности.
На рис. 7 представлена t-SNE распределения инфузорий в градиенте содержания О 2 – от полного его отсутствия до гипераэробных условий, дающая картину расположения местообитаний. Как видно из диаграммы, четко выделяются два типа условий: анаэробные, наблюдаемые у сапропеля, и гипераэробные, среди растений. Аэробные и микроаэробные условия, наблюдаемые в слое воды между сапропелем и растениями, не выделяются в особую группу и позиционируются как промежуточная группа между сапропелем и растениями.
Таким образом, распределение видов реснитчатых в объеме озера дает достаточно хорошее представление о разделении гиперпространства водоема на зоны (рис. 6). Хорошо заметно, что зона микрооксигенации перекрывается зонами макрофитов и сапропеля. При этом перекрытие с растительной зоной больше, что можно объяснить наличием кислорода в слое воды под растениями. Положение образцов по кислородному режиму также не выделяет слой воды как отдельную группу. Точки, соответствующие воде, располагались в зоне между сапропелем и растениями (рис. 7).
7).
Распределение видов с разным экологическим приоритетом на диаграмме (рис. 8) выглядит довольно беспорядочно. Виды с разными экоморфологическими характеристиками не образуют отдельных групп, а образуют континуум в кислородном градиенте. Однако наблюдается тенденция к широкому расположению видов из группы микрооксифилов по всей диаграмме, тогда как эвриоксифилы и анаэробы располагаются в разных частях диаграммы.
Данные о численности более 100 видов инфузорий-простейших, часть из которых имеет неопределенные экологические приоритеты, могут давать недостаточно выраженное разделение выборок по типам местообитаний. Общепринято выделять виды-индикаторы, имеющие ярко выраженные предпочтения в отношении местообитаний и/или условий среды. С помощью пакета indicspecies были найдены виды, предпочтения которых соответствуют трем местообитаниям: сапропель, вода и водные растения, представленные в табл. 3. Как и следовало ожидать, индикаторы микрооксифильных условий оказались немногочисленными, так как это местообитание имеет довольно размытые границы. , судя по присутствующим в нем инфузориям. Однако сам факт их наличия важен, поскольку информирует о существовании характерных для него инфузорий простейших.
, судя по присутствующим в нем инфузориям. Однако сам факт их наличия важен, поскольку информирует о существовании характерных для него инфузорий простейших.
На рис. 9 показаны местообитания t-SNE на основе видов-индикаторов реснитчатых простейших. Как видно, индикаторы достаточно уверенно подтверждают наличие трех местообитаний; столб воды выглядит как связующее звено между сапропелем и растениями. Четкое разделение растений и сапропеля связано с контрастом содержания растворенного кислорода: его отсутствием в сапропеле и периодическим его перенасыщением в окружающей растения воде. Промежуточное положение проб воды также понятно, ведь и здесь лимитирующим фактором является O 2 , причем инфузории данного местообитания независимо от степени толерантности к содержанию кислорода дышат кислородом.
Анализ видового состава и плотности популяций инфузорий методом NMDS еще более отчетливо показывает разделение местообитаний. Как видно из рис. 10, в кислородном градиенте местообитания и виды располагались в виде трех достаточно обособленных групп. Первая группа слева расположена в бескислородной зоне, что видно по ее положению относительно изолиний концентрации кислорода. В районе с содержанием кислорода выше 8 мг/л преобладает группа видов и ареал обитания растений. Большинство видов, приоритетным местом обитания которых является кислородсодержащая водная толща, располагались в пределах концентраций O 2 2–5 мг/л. Таким образом, на рис. 10 представлена информация о предпочтениях видов как в отношении местообитаний, так и в отношении концентрации кислорода в воде.
Первая группа слева расположена в бескислородной зоне, что видно по ее положению относительно изолиний концентрации кислорода. В районе с содержанием кислорода выше 8 мг/л преобладает группа видов и ареал обитания растений. Большинство видов, приоритетным местом обитания которых является кислородсодержащая водная толща, располагались в пределах концентраций O 2 2–5 мг/л. Таким образом, на рис. 10 представлена информация о предпочтениях видов как в отношении местообитаний, так и в отношении концентрации кислорода в воде.
Рисунок 11 аналогичен предыдущему, с тем отличием, что он показывает только положение выбранных видов-индикаторов. Это позволяет более четко увидеть положение именно этих видов как по местообитаниям, так и по кислородному режиму. Следует отметить, что хотя условия в слое воды между растениями и сапропелем были преимущественно микроаэробными, при O 2 концентрации около 2 мг/л, виды-индикаторы этой среды обитания имеют более широкий диапазон толерантности к содержанию кислорода, от 2 до 5 мг/л.
4. Обсуждение
Одним из вероятных направлений развития событий при эвтрофикации водоемов, в первую очередь неподвижного типа, может быть образование анаэробных донных отложений – сапропеля и расслоение водоема по кислородному режиму. Одним из сценариев развития анаэробных процессов может быть описанная в данной статье ситуация. В то же время оценить качество воды по протоколам Водной рамочной директивы, опираясь на такие показатели, как макрофиты, фитопланктон и фитобентос, макробентос и рыбы [28], практически невозможно, и вопрос, как это реализовать остается открытым.
Одновременно в таких водоемах существует сложно организованное сообщество реснитчатых простейших и, что особенно важно, как в аэробных, так и в анаэробных условиях. Следовательно, разнообразие и количественное развитие реснитчатых простейших может быть важным индикатором не только наличия зон аноксии, но и с учетом всех присутствующих видов может входить в систему индикации. Однако следует признать, что простейшие являются хорошими индикаторами качества воды [31,32,33,34,50,51,52]. Однако до второй половины 20-го века анаэробный метаболизм не был так широко изучен, как сейчас [17,53,54]. По этой причине в сапробных системах не выделялись анаэробные виды [55,56]. В работах Фойсснера среди индикаторов полисапробной зоны упоминаются анаэробные виды [31,32,33,34]. Однако при таком подходе анаэробные виды оказываются индикаторами высоких уровней загрязнения, при этом их развитие связано не с загрязнением как таковым, а со стабильными анаэробными условиями, в которых реализуется другой тип биохимического процесса. Это делает оценку качества водной среды по кислородопотребляющим организмам, как показателям трофности, недостаточной и требует уточнения с учетом наличия анаэробных зон. Использование простейших в качестве индикаторов рассматривалось как весьма перспективное направление биоиндикации водных экосистем, поскольку простейшие представлены широчайшим разнообразием видов и сообществ, охватывающих весь спектр условий водоемов, в том числе и бескислородных зон.
Однако до второй половины 20-го века анаэробный метаболизм не был так широко изучен, как сейчас [17,53,54]. По этой причине в сапробных системах не выделялись анаэробные виды [55,56]. В работах Фойсснера среди индикаторов полисапробной зоны упоминаются анаэробные виды [31,32,33,34]. Однако при таком подходе анаэробные виды оказываются индикаторами высоких уровней загрязнения, при этом их развитие связано не с загрязнением как таковым, а со стабильными анаэробными условиями, в которых реализуется другой тип биохимического процесса. Это делает оценку качества водной среды по кислородопотребляющим организмам, как показателям трофности, недостаточной и требует уточнения с учетом наличия анаэробных зон. Использование простейших в качестве индикаторов рассматривалось как весьма перспективное направление биоиндикации водных экосистем, поскольку простейшие представлены широчайшим разнообразием видов и сообществ, охватывающих весь спектр условий водоемов, в том числе и бескислородных зон.
В исследуемом озере наблюдались необычно резкие различия между кислородсодержащей и бескислородной зонами, что было вызвано значительным объемом сапропелевого слоя. С учетом глубины озера, не превышающей 1,4 м, слой сапропеля составлял от 1 м до 1,1 м. В приповерхностном слое воды, занятом в основном подводными растениями ряски трехлопастной, содержание кислорода варьировало в значительных пределах, а днем его концентрация могла значительно превышать 100% физического насыщения. Слой воды между бескислородным слоем и слоем плавающих растений был незначительным, а содержание кислорода колебалось от 0 до 2 мг/л. Распределение простейших в этих условиях представляет значительный интерес, так как виды с разными экологическими предпочтениями вынуждены позиционировать себя в условиях контрастного распределения кислорода, однозначно определяя свои приоритеты. Прежде всего, следует отметить, что по количественному и качественному составу инфузорий объем озера был достоверно разделен на два местообитания: с растворенным кислородом, водным среди растений и бескислородным, сапропелевым.
С учетом глубины озера, не превышающей 1,4 м, слой сапропеля составлял от 1 м до 1,1 м. В приповерхностном слое воды, занятом в основном подводными растениями ряски трехлопастной, содержание кислорода варьировало в значительных пределах, а днем его концентрация могла значительно превышать 100% физического насыщения. Слой воды между бескислородным слоем и слоем плавающих растений был незначительным, а содержание кислорода колебалось от 0 до 2 мг/л. Распределение простейших в этих условиях представляет значительный интерес, так как виды с разными экологическими предпочтениями вынуждены позиционировать себя в условиях контрастного распределения кислорода, однозначно определяя свои приоритеты. Прежде всего, следует отметить, что по количественному и качественному составу инфузорий объем озера был достоверно разделен на два местообитания: с растворенным кислородом, водным среди растений и бескислородным, сапропелевым.
NMDS уверенно разделила местообитания на три четко выраженных участка, соответствующих сапропелю, растениям и водному слою между ними (рис. 10). Видно, что простейшие распадаются на два сообщества, которые группируются в анаэробных и аэробных условиях.
10). Видно, что простейшие распадаются на два сообщества, которые группируются в анаэробных и аэробных условиях.
В бескислородных условиях (сапропель) и среди растений кривые ранг-доминирование лучше всего описываются моделью закона Ципфа, что видно из значений информационного критерия Акаике (АИК) (рис. 12а,б). По данным Su 2018 [57], проанализировавшего около 20 000 распределений обилия видов (SAD) как в водных, так и в наземных экосистемах, общий характер распределения почти во всех случаях примерно соответствует закону Ципфа. Таким образом, САД в сапропеле и растениях соответствуют этой типичной схеме.
Количество видов, ориентированных на микроаэробные условия, ограничено. Специфика условий между ярусом ряски и сапропелем находит свое отражение и в характере САР (рис. 13). Здесь SAD лучше всего соответствует модели «упреждения», также известной как геометрическая серия или модель Мотомуры. Считается, что такой тип распределения характерен для маловидовых местообитаний, в которых виды существуют в нестабильных условиях. Это достаточно объективно отражает ситуацию в слое воды между плавающими растениями и сапропелем в рассматриваемом случае.
Это достаточно объективно отражает ситуацию в слое воды между плавающими растениями и сапропелем в рассматриваемом случае.
Наличие четко выраженных факторных предпочтений у многих видов позволило выделить ряд показателей, наличие которых отражает динамическую стабильность кислородного режима по вертикали озера. Как и следовало ожидать, минимальное количество видов-индикаторов выявлено для микроаэробных условий.
Развитие простейших в условиях гипертрофии озера и формирования анаэробных зон становится единственным перспективным показателем в плане оценки состояния водной среды, позволяющим выносить оценочные суждения о ситуации. Более того, с их помощью можно оценить степень развития анаэробных процессов и качество воды в аэробных слоях водоема по единой шкале, основанной на индикаторных видах простейших и их количественном развитии в континууме кислородных и бескислородных условий. .
Шкала на основе индикаторных видов простейших может быть дополнением к стандартной системе оценки качества водных сред, ориентированной на водоемы с аэробными условиями, так как простейшие, в отличие от мезо- и макроформ, присутствуют во всей пространство водоемов как непрерывный ряд экоморф. В условиях анаэробных зон, формирующихся в высокотрофных водоемах, использование простейших в качестве индикаторов становится наиболее адекватным решением задачи оценки качества водной среды по единому критерию. Таким образом, введение в систему оценки качества окружающей среды индикаторов простейших позволяет легко выявлять наличие в водоемах устойчивых анаэробных зон и оценивать их объем, что невозможно при использовании стандартных индикаторов-оксибионтов.
В условиях анаэробных зон, формирующихся в высокотрофных водоемах, использование простейших в качестве индикаторов становится наиболее адекватным решением задачи оценки качества водной среды по единому критерию. Таким образом, введение в систему оценки качества окружающей среды индикаторов простейших позволяет легко выявлять наличие в водоемах устойчивых анаэробных зон и оценивать их объем, что невозможно при использовании стандартных индикаторов-оксибионтов.
5. Выводы
В небольшом мелководном пойменном озере наблюдалось резкое разделение пространства на зоны с разным кислородным режимом, в которых хорошо структурированы и почти не перекрывающиеся сообщества реснитчатых простейших, сохраняющие свою самобытность во все сезоны году были сформированы. Распределение простейших в этих условиях представляет значительный интерес, так как виды с разными экологическими предпочтениями вынуждены существовать в условиях контрастного распределения кислорода, что однозначно выявляет их приоритеты. Наличие единичных сообществ реснитчатых простейших позволило идентифицировать виды-индикаторы кислородсодержащих и бескислородных условий. В анаэробных условиях наблюдается достаточно высокое разнообразие реснитчатых простейших, что делает их весьма перспективными индикаторами для районирования водоемов, в которых формируются устойчивые анаэробные зоны.
Наличие единичных сообществ реснитчатых простейших позволило идентифицировать виды-индикаторы кислородсодержащих и бескислородных условий. В анаэробных условиях наблюдается достаточно высокое разнообразие реснитчатых простейших, что делает их весьма перспективными индикаторами для районирования водоемов, в которых формируются устойчивые анаэробные зоны.
Вклад авторов
Концептуализация, Р.Б. и Г.Л.; методология, Р.Б. и Т.К.; программное обеспечение, YD, RB и E.Ł; валидация, Р.Б. и Г.Л.; формальный анализ, Р.Б., Э.Л. и Г.Л.; расследование, Р.Б. и Т.К.; ресурсы, Р.Б., Т.К. и Г.Л.; курирование данных, Р.Б., Т.К., Ю.Д., Дж.С.-К., Э.Л. и Г.Л.; написание – подготовка первоначального проекта, Р.Б., Т.К. и Ю.Д.; написание — рецензирование и редактирование, Р.Б., Т.К., Ю.Д., В.П., Дж.С.-К., Э.Л., Дж.З. и Г.Л.; визуализация, Р.Б., Ю.Д. и Т.К.; надзор, Р.Б. и Г.Л. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получило внешнего финансирования.
Заявление Институционального контрольного совета
Неприменимо.
Заявление об информированном согласии
Неприменимо.
Заявление о доступности данных
Данные содержатся в статье.
Благодарности
Авторы глубоко признательны анонимным рецензентам за ценные комментарии.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Акреман, М.; Данбар, М. Дж. Определение экологических требований к стоку рек — обзор. гидрол. Земля Сист. науч. 2004 , 8, 861–876. [Google Scholar] [CrossRef]
- Бабко Р.; Кузьмина Т. Влияние плотин на гидрологические параметры и структуру донных моллюсков: на примере бассейна Днепра. Экогидрол. гидробиол. 2009 , 9, 159–164. [Google Scholar] [CrossRef]
- Poff, NL; Циммерман, Дж.К.Х. Экологическая реакция на измененные режимы стока: обзор литературы для информирования науки и управления экологическими стоками.
 Свежий биол. 2010 , 55, 194–205. [Google Scholar] [CrossRef]
Свежий биол. 2010 , 55, 194–205. [Google Scholar] [CrossRef] - Беллетти, Б.; Ринальди, М .; Buijse, AD; Гернелл, AM; Моссельман, Э. Обзор методов оценки речной гидроморфологии. Окружающая среда. наук о Земле. 2015 , 73, 2079–2100. [Google Scholar] [CrossRef]
- Grizzetti, B.; Писточчи, А .; Ликете, К.; Удиас, А .; Бурауи, Ф.; Ван Де Бунд, В. Человеческое давление и экологический статус европейских рек. науч. Rep. 2017 , 7, 205. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Уорд, СП; Токнер, К.; Шимер, Ф. Биоразнообразие пойменных речных экосистем: экотоны и связность1. Регул. Реки Рез. Управление 1999 , 15, 125–139. [Google Scholar] [CrossRef]
- Weilhoefer, C.L.; Пан, Ю.; Эппард, С. Влияние паводковых вод рек на качество воды в пойменных заболоченных местах и сообщества диатомовых водорослей. Водно-болотные угодья 2008 , 28, 473–486.
 [Google Scholar] [CrossRef]
[Google Scholar] [CrossRef] - Робинсон, GGC; Герни, SE; Голдсборо, Л.Г. Первичная продуктивность донных и планктонных водорослей в степном водно-болотном угодье при регулируемых режимах уровня воды. Водно-болотные угодья 1997 , 17, 182–194. [Google Scholar] [CrossRef]
- Stromberg, JC; Фрай, Дж.; Паттен, Д. Т. Развитие болот после сильных наводнений на аллювиальной реке в засушливой местности. Водно-болотные угодья 1997 , 17, 292–300. [Google Scholar] [CrossRef]
- Коул, Дж. Дж.; Прери, Ю. Т.; Карако, Северная Каролина; Макдауэлл, WH; Транвик, Л.Дж.; Стригл, Р.Г.; Дуарте, CM; Кортелайнен, П.; Даунинг, Дж. А.; Мидделбург, Дж. Дж.; и другие. Включение глобального углеродного цикла: интеграция внутренних вод в наземный углеродный баланс. Экосистемы 2007 , 10, 172–185. [Google Scholar] [CrossRef][Зеленая версия]
- Tranvik, LJ; Даунинг, Дж. А.; Котнер, Дж. Б.
 ; Луазель, SA; Стригл, Р.Г.; Баллаторе, Т.Дж.; Диллон, П.; Финлей, К.; Фортино, К.; Нолл, Л.Б.; и другие. Озера и водохранилища как регуляторы круговорота углерода и климата. Лимнол. океаногр. 2009 , 54, 2298–2314. [Google Scholar] [CrossRef][Green Version]
; Луазель, SA; Стригл, Р.Г.; Баллаторе, Т.Дж.; Диллон, П.; Финлей, К.; Фортино, К.; Нолл, Л.Б.; и другие. Озера и водохранилища как регуляторы круговорота углерода и климата. Лимнол. океаногр. 2009 , 54, 2298–2314. [Google Scholar] [CrossRef][Green Version] - Bastviken, D.; Транвик, Л.Дж.; Даунинг, Дж. А.; Крилл, PM; Энрих-Праст, А. Выбросы метана из пресной воды компенсируют континентальный поглотитель углерода. Наука 2011 , 331, 50. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Grasset, C.; Мендонса, Р.; Вильямор Сауседо, Г.; Баствикен, Д.; Роланд, Ф .; Собек, С. Большое, но переменное образование метана в бескислородных пресноводных отложениях при добавлении аллохтонного и автохтонного органического вещества. Лимнол. океаногр. 2018 , 63, 1488–1501. [Google Scholar] [CrossRef] [PubMed]
- Собек, С.; Дуриш-Кайзер, Э.; Цурбрюгг, Р .; Вонгфун, Н.; Весселс, М.; Паше, Н .; Верли, Б.
 Эффективность захоронения органического углерода в озерных отложениях, контролируемая временем воздействия кислорода и источником отложений. Лимнол. океаногр. 2009 , 54, 2243–2254. [Google Scholar] [CrossRef][Зеленая версия]
Эффективность захоронения органического углерода в озерных отложениях, контролируемая временем воздействия кислорода и источником отложений. Лимнол. океаногр. 2009 , 54, 2243–2254. [Google Scholar] [CrossRef][Зеленая версия] - Собек С.; Делсонтро, Т .; Вонгфун, Н.; Верли, Б. Экстремальное захоронение органического углерода подпитывает интенсивное образование пузырей метана в резервуаре с умеренным климатом. Геофиз. Рез. лат. 2012 , 39, L01401. [Google Scholar] [CrossRef][Green Version]
- Финлей, Б. Анаэробный простейший с симбиотическими метаногенами, живущий на муниципальных свалках. ФЭМС микробиол. лат. 1991 , 85, 169–179. [Google Scholar] [CrossRef][Зеленая версия]
- Fenchel, T. Метаногенез в морских мелководных отложениях: количественная роль анаэробных простейших с эндосимбиотическими метаногенными бактериями. Офелия 1993 , 37, 67–82. [Google Scholar] [CrossRef] «> Фойсснер, В.; Бергер, Х. Удобный справочник по инфузориям (Protozoa, Ciliophora), обычно используемым гидробиологами в качестве биоиндикаторов в реках, озерах и сточных водах, с примечаниями по их экологии. Свежий биол. 1996 , 35, 375–482. [Академия Google] [CrossRef]
- Примц-Хабдия, Б.; Хабдия, И.; Пленкович-Морай, А. Отложение туфа и разрастание перифитона как факторы, влияющие на сообщество инфузорий на травертиновых барьерах в условиях различной скорости течения. Гидробиология 2001 , 457, 87–96. [Google Scholar] [CrossRef]
- Wickham, SA; Нагель, С.; Хиллебранд, Х. Контроль сообществ эпибентосных инфузорий травоядными и питательными веществами. Аква. микроб. Экол. 2004 , 35, 153–162. [Google Scholar] [CrossRef][Зеленая версия]
- Гонг, Дж.; Песня, В .; Уоррен, А. Колонизация перифитных инфузорий: годовой цикл и реакция на условия окружающей среды. Аква. микроб. Экол. 2005 , 39, 159–170.
 [Google Scholar] [CrossRef][Green Version]
[Google Scholar] [CrossRef][Green Version] - Mieczan, T. Перифитные инфузории в прибрежной зоне трех озер с разным трофическим статусом. Польский J. Ecol. 2005 , 53, 489–501. [Google Scholar]
- Fenchel, T.; Финли, Б. Кислород и пространственная структура микробных сообществ. биол. Откр. 2008 , 83, 553–569. [Google Scholar] [CrossRef] [PubMed]
- Fenchel, T. Protozoa и кислород. Акта Протозол. 2014 , 53, 3–12. [Google Scholar] [CrossRef]
- Бабко Р.; Кузьмина, Т .; Данко, Ю.; Шульцик-Чеплак, Дж.; Лагод, Г. Кислородные градиенты и структура сообществ инфузорий в пойменном озере. Вода 2020 , 12, 2084. [Google Scholar] [CrossRef]
- Сани, Массачусетс; Болдок, Б.М.; Бейкер, Дж.Х. Сообщества простейших в меловых ручьях. Гидробиология 1992 , 248, 53–64. [Google Scholar] [CrossRef]
- Примц-Хабдия, Б.
 ; Хабдия, И.; Раданович И. Сезонные изменения трофической структуры перифитных инфузорий в зависимости от режима стока. SIL Proc. 1922–2010 1998 , 26, 1116–1119. [Google Scholar] [CrossRef]
; Хабдия, И.; Раданович И. Сезонные изменения трофической структуры перифитных инфузорий в зависимости от режима стока. SIL Proc. 1922–2010 1998 , 26, 1116–1119. [Google Scholar] [CrossRef] - Европейский парламент, C. Директива 2000/60/EC Европейского парламента и Совета от 23 октября 2000 г., устанавливающая основу для действий Сообщества в области водной политики. Выключенный. Дж. Евр. парламент. 2000 , L327, 1–82. [Google Scholar]
- Бабко Р. Микробентометр для протистологических исследований. гидробиол. Дж. 1989 , 25, 78–80. (In Russian) [Google Scholar]
- Foissner, W. Основные методы световой и сканирующей электронной микроскопии для таксономических исследований реснитчатых простейших. Евро. Дж. Протистол. 1991 , 27, 313–330. [Google Scholar] [CrossRef]
- Фойсснер, В.; Блаттерер, Х .; Бергер, Х .; Кохманн, Ф. Таксономическая и экологическая ревизия Ciliaten des Saprobiensystems.
 Группа I: Cyrtophorida, Oligotrichida, Hypotrichida, Colpodea; Informationsberichte де Байер; Landesamtes für Wasserwirtschaft: Деггендорф, Германия, 1991; стр. 1–478.
Группа I: Cyrtophorida, Oligotrichida, Hypotrichida, Colpodea; Informationsberichte де Байер; Landesamtes für Wasserwirtschaft: Деггендорф, Германия, 1991; стр. 1–478. - Фойсснер, В.; Бергер, Х .; Кохманн, Ф. Таксономическая и экологическая ревизия Ciliaten des Saprobiensystems. Группа II: Peritrichida, Heterotrichida, Odontostomatida; Informationsberichte де Байер; Landesamtes für Wasserwirtschaft: Деггендорф, Германия, 1992 г.; стр. 1–502.
- Фойсснер, В.; Бергер, Х .; Кохманн, Ф. Таксономическая и экологическая ревизия Ciliaten des Saprobiensystems. Группа III: Hymenostomatida, Prostomatida, Nassulida; Informationsberichte де Байер; Landesamtes für Wasserwirtschaft: Деггендорф, Германия, 1994; стр. 1–548.
- Фойсснер, В.; Бергер, Х .; Блаттерер, Х .; Кохманн, Ф. Таксономическая и экологическая ревизия Ciliaten des Saprobiensystems. Группа IV: Gymnostomatea, Loxodes, Suctoria; Informationsberichte де Байер; Landesamtes für Wasserwirtschaft: Деггендорф, Германия, 1995 г.
 ; стр. 1–540.
; стр. 1–540. - Янковски, А.В. Морфология и эволюция Ciliophora. III. Диагнозы и филогенез 53 сапропелебионтов, в основном отряда Heterotrichida. Арка Протистенкд. 1964 , 107, 185–194. [Google Scholar]
- Kahl, A. Urtiere oder Protozoa I: Wimpertiere oder Ciliata (Infusoria) 1. Allgemeiner Teil und Prostomata. Tierwelt Dtl. 1930 , 18, 1–180. [Google Scholar]
- Kahl, A. Urtiere oder Protozoa I: Wimpertiere oder Ciliata (Infusoria) 2. Holotricha außer den im 1. Teil behandelten Prostomata. Tierwelt Dtl. 1931 , 21, 181–398. [Google Scholar]
- Kahl, A. Urtiere oder Protozoa I: Wimpertiere oder Ciliata (Infusoria) 3. Spirotricha. Tierwelt Dtl. 1932 , 25, 399–650. [Google Scholar]
- Kahl, A. Urtiere oder Protozoa I: Wimpertiere oder Ciliata (Infusoria) 4. Peritricha und Chonotricha. Tierwelt Dtl. 1935 , 30, 651–886.
 [Google Scholar]
[Google Scholar] - Team R Development Core. R: язык и среда для статистических вычислений; Проект R для статистических вычислений: Вена, Австрия, 2021 г.; Том 2, доступен в Интернете: https://www.R-project.org (по состоянию на 11 января 2022 г.).
- Уикхэм, Х.; Аверик, М .; Брайан, Дж.; Чанг, В .; Макгоуэн, Л.; Франсуа Р.; Гролемунд, Г.; Хейс, А .; Генри, Л.; Хестер, Дж.; и другие. Добро пожаловать в Tidyverse. J. Программное обеспечение с открытым исходным кодом. 2019 , 4, 1686. [Google Scholar] [CrossRef]
- Van Der Maaten, L.; Хинтон, Г.Э. Визуализация многомерных данных с использованием t-SNE. Дж. Мах. Учиться. Рез. 2008 , 9, 2579–2605. [Google Scholar]
- Van Der Maaten, L. Ускорение t-SNE с помощью древовидных алгоритмов. Дж. Мах. Учиться. Рез. 2015 , 15, 3221–3245. [Google Scholar]
- Krijthe, J.H. Rtsne: встраивание T-распределенного стохастического соседа с использованием реализации Barnes-Hut.
 2016. Доступно в Интернете: https://github.com/jkrijthe/Rtsne (по состоянию на 15 декабря 2021 г.).
2016. Доступно в Интернете: https://github.com/jkrijthe/Rtsne (по состоянию на 15 декабря 2021 г.). - Оксанен Ю.; Киндт, Р .; Лежандр, П.; О’Хара, Б.; Симпсон, Г.Л.; Solymos, PM; Стивенс, MHH; Вагнер, Х. Экологический пакет сообщества. Пакет R версии 2.4-2. Сообщество Экол. Упак. 2019 , 2.5–6, 190. [Google Scholar]
- Де Касерес, М.; Лежандр, П. Ассоциации между видами и группами участков: индексы и статистические выводы. Экология 2009 , 90, 3566–3574. [Google Scholar] [CrossRef]
- Киндт, Р.; Коу, Р. Анализ разнообразия деревьев; Руководство и программное обеспечение для общих статистических методов экологических исследований и исследований биоразнообразия; Всемирный центр агролесоводства: Найроби, Кения, 2005 г.; п. 196. [Google Scholar]
- Линн Д. Х. Ресничные простейшие: характеристика, классификация и справочник по литературе, 3-е изд.; Линн, Д.Х., изд.; Springer: Дордрехт, Нидерланды, 2008 г.
 ; ISBN 9781402082399. [Google Scholar]
; ISBN 9781402082399. [Google Scholar] - Бабко Р.В. Сообщества свободноживущих реснитчатых простейших (Chromista, Ciliophora) континентальных вод. Кандидат наук. Диссертация, Институт гидробиологии НАН Украины, Киев, Украина, 2019. (на украинском языке). [Google Scholar]
- Fenchel, T. Экология простейших; Серия Брока/Спрингера по современной биологии; Springer: Берлин/Гейдельберг, Германия, 19 лет87; ISBN 978-3-662-06819-9. [Google Scholar]
- Finlay, B.J.; Эстебан, Г.Ф. Пресноводные простейшие: биоразнообразие и экологическая функция. Биодайверы. Консерв. 1998 , 7, 1163–1186. [Google Scholar] [CrossRef]
- Лоуренс, младший; Сверхон, GDW; Вассенаар, Л.И.; Ной, Т.Р. Воздействие отдельных фармацевтических препаратов на сообщества речных биопленок. Можно. Дж. Микробиол. 2005 , 51, 655–669. [Google Scholar] [CrossRef] [PubMed]
- Finlay, BJ; Эстебан, Г.
 Ф.; Фенчел, Т. Разнообразие простейших: сходящиеся оценки глобального числа свободноживущих видов инфузорий. Протист 1998 , 149, 29–37. [Google Scholar] [CrossRef]
Ф.; Фенчел, Т. Разнообразие простейших: сходящиеся оценки глобального числа свободноживущих видов инфузорий. Протист 1998 , 149, 29–37. [Google Scholar] [CrossRef] - Finlay, BJ; Эстебан, Г.Ф.; Олмо, Дж. Л.; Тайлер, П.А. Глобальное распространение свободноживущих видов микробов. Экография 1999 , 22, 138–144. [Google Scholar] [CrossRef]
- Колквиц, Р.; Марссон, М. Ökologie der tierischen Saprobien. Beiträge zur Lehre фон дер биологических Gewässerbeurteilung. Междунар. Преподобный дер Gesamten Hydrobiol. и гидрогр. 1909 , 2, 126–152. [Google Scholar] [CrossRef][Зеленая версия]
- Сладечек В. Система анализа воды с биологической точки зрения. Арка Фуэр Гидробиол. Бейх. 1973 , 7, 114–137. [Google Scholar]
- Su, Q. Общая картина распределения обилия видов. PeerJ 2018 , 2018, e5928. [Google Scholar] [CrossRef]
Рисунок 1. Карта географического положения и конфигурации озера.
Рисунок 1. Карта географического положения и конфигурации озера.
Рисунок 2. Ламелла литонотуса в проходящем свете после задержки: ( а ) вентральные ряды ресничек; ( b ) макронуклеус.
Рисунок 2. Ламелла литонотуса в проходящем свете после задержки: ( а ) вентральные ряды ресничек; ( b ) макронуклеус.
Рисунок 3. ( a ) Vorticella octava в проходящем свете; ( b ) Vorticella convallaria — фазовый контраст.
Рисунок 3. ( a ) Vorticella octava в проходящем свете; ( b ) Vorticella convallaria — фазовый контраст.
Рисунок 4. ( a ) временный препарат, макронуклеус Vorticella convallaria, окрашенный метиленовым зеленым; ( b ) базальные тела Plagiocampa rouxi.
Рисунок 4. ( a ) временный препарат, макронуклеус Vorticella convallaria, окрашенный метиленовым зеленым; ( b ) базальные тела Plagiocampa rouxi.
Рисунок 5. Модифицированная камера Богорова для подсчета простейших, объем 1 мл.
Рисунок 5. Модифицированная камера Богорова для подсчета простейших, объем 1 мл.
Рисунок 6. t–SNE местообитаний по обилию реснитчатых простейших.
Рисунок 6. t–SNE местообитаний по обилию реснитчатых простейших.
Рисунок 7. t–SNE местообитаний по четырем уровням содержания растворенного кислорода (ана, анаэробный; микро, микроаэробный; аэро, аэробный; аэробный, гипераэробный) с наложением информации о соответствующих местообитаниях.
Рисунок 7. t–SNE местообитаний по четырем уровням содержания растворенного кислорода (ана, анаэробный; микро, микроаэробный; аэро, аэробный; аэробный, гипераэробный) с наложением информации о соответствующих местообитаниях.
Рисунок 8. t–SNE видов инфузорий, основанный на распределении местообитаний (сапропель, вода, растения). Экоморфы инфузорий: анаэробные; asl – группа «активный ил»; эуо, эуриоксифильный; мио, микрооксифильный; окси, оксифильный; unk, виды с неизвестными предпочтениями.
Рисунок 8. t–SNE видов инфузорий, основанный на распределении местообитаний (сапропель, вода, растения). Экоморфы инфузорий: анаэробные; asl – группа «активный ил»; эуо, эуриоксифильный; мио, микрооксифильный; окси, оксифильный; unk, виды с неизвестными предпочтениями.
Рисунок 9. t–SNE местообитаний, основанный на обилии видов-индикаторов.
Рисунок 9. t–SNE местообитаний, основанный на обилии видов-индикаторов.
Рисунок 10. NMDS местообитаний по численности инфузорий с наложенным кислородным градиентом (изолинии, ширина которых пропорциональна концентрации O 2 , указанной рядом с изолинией). Цветом отмечены площади, занятые образцами, принадлежащими к одному из трех местообитаний — сапропелю, воде и растениям.
Рис. 10. NMDS местообитаний по обилию инфузорий с наложенным кислородным градиентом (изолинии, ширина которых пропорциональна O 9Концентрация 0005 2 указана рядом с изолинией). Цветом отмечены площади, занятые образцами, принадлежащими к одному из трех местообитаний — сапропелю, воде и растениям.
Цветом отмечены площади, занятые образцами, принадлежащими к одному из трех местообитаний — сапропелю, воде и растениям.
Рисунок 11. NMDS местообитаний по обилию реснитчатых видов с наложенным кислородным градиентом (изолинии, ширина которых пропорциональна концентрации O 2 , указанной рядом с изолинией). Показаны только виды-индикаторы. Цветом отмечены площади, занимаемые образцами, принадлежащими к одному из трех местообитаний – сапропелю, воде и растениям.
Рисунок 11. NMDS местообитаний по обилию реснитчатых видов с наложенным кислородным градиентом (изолинии, ширина которых пропорциональна концентрации O 2 , указанной рядом с изолинией). Показаны только виды-индикаторы. Цветом отмечены площади, занимаемые образцами, принадлежащими к одному из трех местообитаний – сапропелю, воде и растениям.
Рисунок 12. Кривые ранг-изобилие доминирования с 5-ю моделями: сломанная палочка, вытеснение, логарифмическая норма, Ципф и Ципф-Мандельброт. ( а ) — анаэробные условия; ( b ) – аэробные условия (среди растений). AIC, информационный критерий Акаике.
( а ) — анаэробные условия; ( b ) – аэробные условия (среди растений). AIC, информационный критерий Акаике.
Рисунок 12. Кривые ранг-изобилие доминирования с 5-ю моделями: сломанная палочка, вытеснение, логарифмическая норма, Ципф и Ципф-Мандельброт. ( a ) — анаэробные условия; ( b ) – аэробные условия (среди растений). AIC, информационный критерий Акаике.
Рисунок 13. График ранг-изобилие доминирования для водных видов с 5 подходами модели: сломанная палочка, упреждение, логарифмическая нормальная, Ципф и Ципф-Мандельброт. AIC, информационный критерий Акаике.
Рис. 13. График ранг-изобилие доминирования для водных видов с 5 подходами модели: сломанная палочка, упреждение, логарифмическая нормальная, Ципф и Ципф-Мандельброт. AIC, информационный критерий Акаике.
Таблица 1. Морфологическая характеристика озера.
Таблица 1. Морфологическая характеристика озера.
| Параметры | Значения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Площадь, м 2 | 3,006 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Длина, M | 112,9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Максимальная ширина, M | 33,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Максимальная глубина, M | 11119 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
. Физико-химические характеристики биотопов в озере. T – температура и O – содержание растворенных веществ – минимальные и максимальные значения за сезон; PI — перманганатный индекс — среднее значение за сезон ± стандартное отклонение. Физико-химические характеристики биотопов в озере. T – температура и O – содержание растворенных веществ – минимальные и максимальные значения за сезон; PI — перманганатный индекс — среднее значение за сезон ± стандартное отклонение.Таблица 2. Физико-химические характеристики биотопов в озере. T – температура и O – содержание растворенных веществ – минимальные и максимальные значения за сезон; PI — перманганатный индекс — среднее значение за сезон ± стандартное отклонение.
Table 3. Список видов инфузорий-индикаторов местообитаний: сапропель, вода, растительный ярус. В столбце «stat» указано значение индикатора вида в долях единицы. Значение этого показателя равно квадратному корню из произведения параметров А и В. «А» — это оценка вероятности того, что если данный вид будет найден, то местообитание относится к этому типу. Таблица 3. Список видов инфузорий-индикаторов местообитаний: сапропель, вода, растительный ярус. В столбце «stat» указано значение индикатора вида в долях единицы. Значение этого показателя равно квадратному корню из произведения параметров А и В. «А» — это оценка вероятности того, что если данный вид будет найден, то местообитание относится к этому типу. «В» — вероятность нахождения вида в среде обитания этой группы.
© 2022 авторами. Лицензиат MDPI, Базель, Швейцария. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY) (https://creativecommons.org/licenses/by/4.0/). Поток генов способствует локальной адаптации при выборе среды обитания в микрокосмах инфузорийAbstract Предполагается, что локальная адаптация происходит при ограниченном потоке генов. Однако теория соответствия среды обитания предсказывает, что рассредоточение должно способствовать, а не мешать местной адаптации, когда особи избирательно рассредоточиваются по местам обитания, максимально повышая свою производительность. Классическая эволюционная теория предсказывает, что поток генов от умеренного до высокого в гетерогенной среде должен препятствовать местной адаптации и ограничивать видообразование путем гомогенизации локальных генофондов 1,2 . Напротив, недавняя теория показала, что рассредоточение, перемещение, потенциально приводящее к потоку генов 3 , может облегчить локальную адаптацию при выборе среды обитания 4,5,6,7,8 . Когда люди остаются в местах обитания, которые максимизируют их производительность, или рассредоточиваются по ним, результирующий поток генов будет включать неслучайное подмножество генотипов, адаптированных к местным условиям 9. Это предварительный просмотр содержимого подписки, доступ через ваше учреждение Соответствующие статьиСтатьи открытого доступа со ссылками на эту статью.
Варианты доступаПодписаться на журнал Получить полный доступ к журналу на 1 год 118,99 € всего 9,92 € за выпуск Подписаться Расчет налогов будет завершен во время оформления заказа. Купить статью Получите ограниченный по времени или полный доступ к статье на ReadCube. 32,00 $ Купить Все цены указаны НЕТТО. Рис. 1: Выбор среды обитания и тепловые характеристики. Рис. 2: Выбор среды обитания способствует адаптации к местным условиям на границе тепловой ниши.Ссылки
Болник, Д. И. и Носиль, П. Evolution 61 , 2229–2243 (2007). Артикул пабмед Google ученый Clobert, J., Le Galliard, J.-F., Cote, J., Meylan, S. & Massot, M. Ecol. лат. 12 , 197–209 (2009). Артикул пабмед Google ученый Дакворт Р. А., Бадяев А. В. Proc. Натл акад. науч. США 104 , 15017–15022 (2007 г.). Артикул пабмед ПабМед Центральный КАС Google ученый Трэвис, Дж. М. Дж. и др. Ойкос 122 , 1532–1540 (2013). Артикул Google ученый Скачать ссылки Благодарности Мы благодарим О. Ронсе за полезные комментарии. Это исследование было поддержано Национальным агентством исследований INDHET (ANR-12-BSV7-0023) для S.J. и J.C., ANR Netselect (ANR-10-JCJC-1704) для ASC и ARC (Actions de Recherche Concertées) 10-15/031, FSR-FNRS (Национальный фонд научных исследований) и UCL-FSR (Католический университет де Лувен) до С.Дж., Д.Л. и Н.С. (научный сотрудник FNRS Research). С.Дж. была награждена стипендией Move-In-Louvain Marie Curie Action. Д.Б., С. Информация о автореАвторы и принадлежности
Авторы
Обработчик: RePEc:adp:jofoaj:v:12:y:2020:i:2:p:37-45 как HTMLHTML с абстрактным простым текстомпростой текст с абстрактнымBibTeXRIS (EndNote, RefMan, ProCite)ReDIFJSON Скачать полный текст от издателяURL-адрес файла: https://juniperpublishers.com/ofoaj/pdf/OFOAJ.MS.ID.555833.pdfОграничение на скачивание: no URL-адрес файла: https://juniperpublishers.  com/ofoaj/OFOAJ.MS.ID.555833.php com/ofoaj/OFOAJ.MS.ID.555833.php Ограничение на скачивание: no URL-адрес файла: https: /libkey.io/10.19080/OFOAJ.2020.12.555833?utm_source=ideas Ссылка LibKey : если доступ ограничен и если ваша библиотека использует эту службу, LibKey перенаправит вас туда, где вы можете использовать свою библиотечную подписку для доступа к этому элементу. —> Подробнее об этом изделииКлючевые слова можжевеловые издательства: онкологические журналы; журналы онкологических исследований; статьи журнала онкологии; отчеты об онкологии и онкологических заболеваниях; онкологический журнал клинических и экспериментальных исследований рака; открытый доступ; журналы открытого доступа; Международный журнал онкологии; обзор издательства Juniper; Классификация JEL:СтатистикаДоступ и статистика загрузки Исправления Все материалы на этом сайте предоставлены соответствующими издателями и авторами. По техническим вопросам, касающимся этого элемента, или для исправления его авторов, названия, реферата, библиографической информации или информации для загрузки, обращайтесь: . Общие контактные данные провайдера: . Если вы создали этот элемент и еще не зарегистрированы в RePEc, мы рекомендуем вам сделать это здесь. Это позволяет связать ваш профиль с этим элементом. Это также позволяет вам принимать потенциальные ссылки на этот элемент, в отношении которых мы не уверены. У нас нет библиографических ссылок на этот элемент. Вы можете помочь добавить их, используя эту форму . Если вы знаете об отсутствующих элементах, ссылающихся на этот, вы можете помочь нам создать эти ссылки, добавив соответствующие ссылки таким же образом, как указано выше, для каждого ссылающегося элемента. По техническим вопросам относительно этого элемента или для исправления его авторов, названия, аннотации, библиографической информации или информации для загрузки обращайтесь: Роберт Томас (адрес электронной почты доступен ниже). Общие контактные данные провайдера: . Обратите внимание, что фильтрация исправлений может занять пару недель. различные услуги RePEc. ADW: Sycon ciliatum: ИНФОРМАЦИЯГеографический ареалSycon ciliatum — морские губки, встречающиеся по всему миру, обычно на мелководье, но редко на глубине более 150 метров. Они преобладают в регионах с умеренным климатом. (Грзимек, 1972; Ворхайде, 1998) Среда обитания Sycon ciliatum обитают в мелководных морских водах, от литорали до сублиторальных глубин. Физическое описание Sycon ciliata имеют кремово-желтый цвет и нежный вид. Их тела расположены по системе аскоидов, представляющих собой простую трубку без складок наружной стенки тела. Внутренние жгутиковые трубки отвечают за ток воды. Трубки расположены радиально и имеют отверстия, называемые апопилями. Апопилы открываются в центральную полость или спонгоцель. Спонгоцель ведет в оскулум, который имеет регулируемую диафрагму. Диафрагма окружена крупными спикулами. (Харрис, 1990; Уоллер и др., 1996; Уорхайде, 1998) Репродукция Размножение происходит в основном половым путем. Развитие личинки происходит внутри материнской губки. Материнская губка питает бластулу за счет трофических клеток, переходящих в бластулу. Затем бластула выворачивается наизнанку, так что жгутики выступают наружу. Получив амфибластулу с полой центральной полостью, личинки освобождаются, чтобы плавать в море. Как только личинки оседают, жгутики удаляются, и клетки образуют центральную массу. Поведение Sycon ciliatum может противостоять движению воды и изменениям приливов. Похожий на волосы покров кальцитовых спикул удерживает воду из-за капиллярного действия. Считается, что большие тонкие спикулы, окружающие диафрагму, помогают разделять потоки вдоха и выдоха. Они также могут препятствовать проникновению в спонгоцель мелких хищников, таких как амфиподы, силлиды и поликлады. (Харрис, 19 лет90) Пищевые привычкиSycon ciliatum получают пищу, фильтруя воду через хоаноциты. Вода поступает в подводящий канал. Канал выстлан пинакоцитами и сообщается с жгутиковыми камерами через маленькие отверстия — просопилы, открывающиеся во внутреннюю жгутиковую трубку, выстланную хоаноцитами. Пищевые частицы перевариваются внутриклеточно. Питательные вещества транспортируются от хоаноцитов к другим клеткам через амебоиды в мезогиле. (Харрис, 19 лет90) Экономическое значение для человека: положительное Хотя конкретно для Sycon ciliatum не сообщается, некоторые виды губок выделяют токсины, подавляющие рост окружающих особей. Экономическое значение для человека: отрицательный результатЭтот вид не оказывает негативного влияния на человека. Статус консервацииКак и все морские обитатели, Sycon ciliatum страдают от загрязнения воды, изменений температуры и уровня воды. Губки, такие как Sycon ciliatum, иногда поедаются голожаберными моллюсками, хитонами, морскими звездами, черепахами и некоторыми рыбами. 2000 лет назад губки считались растениями. Аристотель был первым, кто признал животную природу губок. Однако лишь немногим более 200 лет назад идея о том, что губки являются животными, получила широкое признание. («Энциклопедия жизни животных Ларусса», 1967; Банистер и Кэмпбелл, 1985) АвторыДейдра Шелин (автор), Юго-Западный университет, Стефани Фабрициус (редактор), Юго-Западный университет. ГлоссарийКаталожные номера1967. Энциклопедия жизни животных Ларусса. Нью-Йорк: McGraw-Hill Book Co., .Банистер, К., А. Кэмпбелл. 1985. Энциклопедия водной жизни. Нью-Йорк: Facts on File, Inc.. Бергквист, 1978. Губки. Лос-Анджелес: Издательство Калифорнийского университета. Гржимек, Б. 1972. Энциклопедия жизни животных Гржимека; Том. 1: Низшие животные. Нью-Йорк: Van Nostrand Reinhold Co., Харрис, В. 1990. Сидячие животные морского побережья. Нью-Йорк: Чепмен и Холл. Симпсон, Т. 1984. Уоллер Г., М. Берчетт, М. Дандо. 1996. SeaLife: Полное руководство по морской среде. Вашингтон, округ Колумбия: Smithsonian Institution Press. Ворхайде, Г. 1998. «Сайт Герта Ворхайде» (он-лайн). Доступ 25 февраля 2000 г. на http://members.xoom.com/gwoerhe/. Издательство Juniper | Журнал открытого доступаИнженерная группа Pharma Group Медицинская группа Группа здравоохранения Общие науки Микробиологическая группа PDF (портативный формат документов) — это формат файла, который захватил . База данных HTML представляет собой сборник документов Подробнее Электронные книгиИздатели Juniper с честью принимают написанные электронные книги Просмотреть еще Juniper Publishers Vision «Содействовать созданию, распространению и применению научных знаний на благо общества и улучшению жизни людей. Последние статьи1 2345678910Следующая Исследовательская статьяИсследовательская статьяОбзорная статьяИсследовательская статьяИсследовательская статьяИстория болезниИсследовательская статьяОвицидная активность химических дезинфицирующих средств и нематофагов Duddingtonia flagrans и Toxocara canis Каролина Перин Мотта, Каролина Магри Феррас, Филиппе Элиас де Фрейтас Соарес, Таис Шмидт Феррейра, Рафаэль де Соуза Стабенов, Джексон Виктор де Араужо*, Фернандо Луис Тобиас, Габриэль Аугусто Маркес Росси, Таис Феррейра Фейтоса, Габриэла Соррентино В. Достижения в области биотехнологии и микробиологииDOI:10.19080/AIBM.2022.17.555952 Мини-обзорИсследовательская статьяИсследовательская статьяОтзывыnsnssnn nrrnnнеен jsjjs msnsnsns Я очень горжусь тем, что являюсь главным редактором Журнала кардиологии и сердечно-сосудистой терапии, высококачественного онлайн-журнала, привлекательного графическим форматом и интересного, полезного… Подробнее Джузеппе ГуллачеУниверситет Флоренции, Италия Global Journal of Archeology & Anthropology — очень величественный журнал. И я очень, очень, очень рад, что мне дали возможность писать статьи для журнала. Я… Подробнее Лоуренс ТомасШкола Максвелла Сиракузский университет Мне посчастливилось участвовать в кейс-стади Juniper Online Journal, где выдающиеся исследователи поддерживают меня и поддерживают их работу. Мохаммед Низар БаттихиЦентральные лаборатории Баттихи, Иордания Мне нравится читать International Journal of Pulmonary and Respiratory Science, так как он объединяет представителей легочных дисциплин для обсуждения новых тенденций, результатов исследований и новых… Подробнее Kelly L ColwellГосударственный университет Янгстауна, США Наша работа была опубликована в журнале «Достижения в области стоматологии и гигиены полости рта» в 2017 году на тему «Управление вызовами реакции на лекарственные лихеноиды полости рта». Процесс публикации нашей ма… Подробнее Кобкан ТонгпрасомУниверситет Чулалонгкорн, Таиланд Существует множество онлайн-журналов, которые следует учитывать, когда один из авторов представляет рукопись. Достижениям в стоматологии и гигиене полости рта следует уделять первостепенное внимание из-за уровня их профессии. John E NathanАмериканский совет педиатрии Стоматология, США Я был действительно впечатлен качеством процесса публикации и высокой заметностью моей статьи, опубликованной в OAJT. Акопова Ольга В.Институт физиологии им. Богомольца, Украина Для исследователя и ученого важно иметь возможность делиться идеями и мыслями с другими профессионалами по всему миру. Журнал хирургии открытого доступа (OAJS) позволил мне узнать больше Уильям Джеймс КоббОксфордский университет, Великобритания Журнал медицины анестезии и интенсивной терапии (JAICM) — превосходный журнал, посвященный серьезным проблемам в отделениях анестезии и интенсивной терапии. Все опубликованные рукописи попадают в… Подробнее Gamal AgmyУниверситет Асьюта, Египет Elsholtzia ciliata (Thunb.) Hyl. http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by/4.0/ http://creativecommons. http://creativecommons.org/licenses/by/4.0/ http://creativecommons.org/licenses/by/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons.org/licenses/by-nc/4.0/ http://creativecommons. |

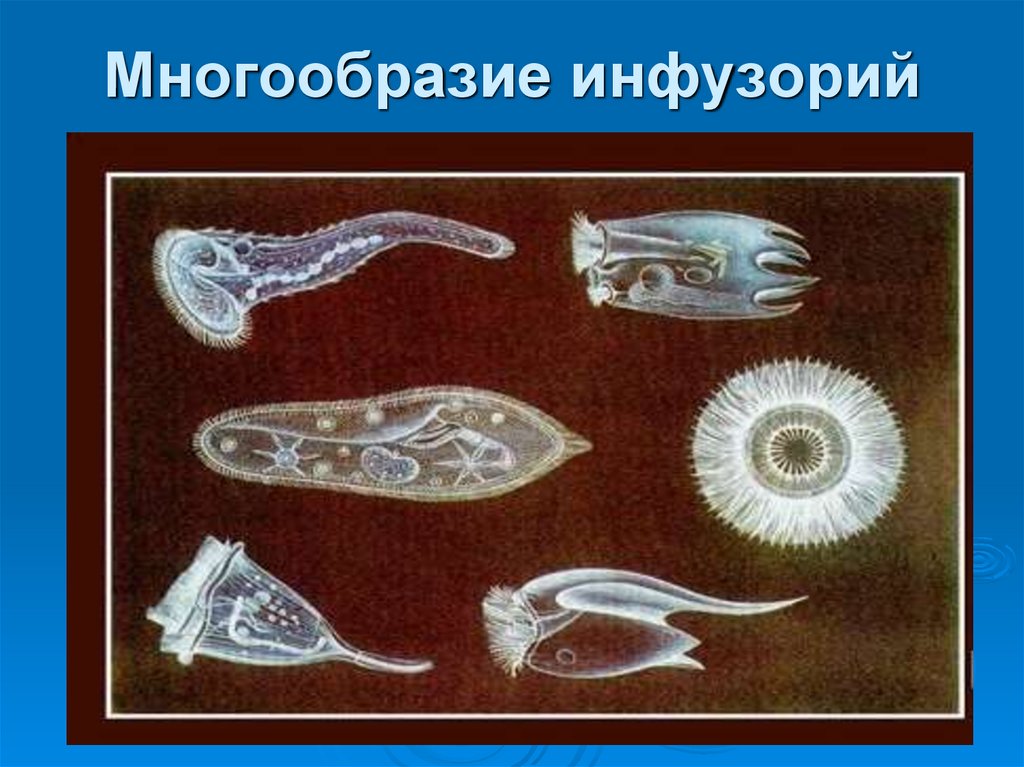
 Таким образом, из одной инфузории образуется две, каждая с полным набором необходимых органоидов.
Таким образом, из одной инфузории образуется две, каждая с полным набором необходимых органоидов.