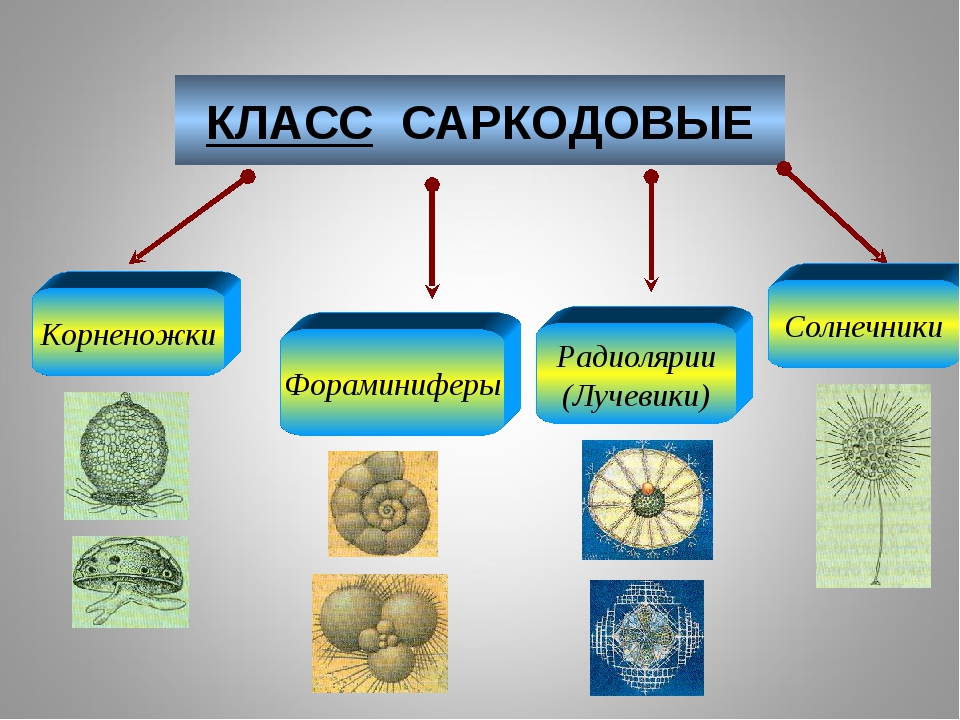
7 класс. Биология. Простейшие: Корненожки, радиолярии, солнечники, споровики.Жгутиконосцы, инфузории — Жгутиконосцы, инфузории
Комментарии преподавателяНа предыдущем уроке мы разговаривали о корненожках, радиоляриях, солнечниках и споровиках. Сегодня мы завершаем тему «Простейшие». Предметом рассмотрения станут жгутиконосцы и инфузории.
Жгутиконосцы. Общая характеристика
Жгутиконо́сцы – очень крупная и разнородная группа простейших. Объединяет их лишь одна общая черта – наличие жгутиков. Жгутики используются для передвижения или для создания токов воды, приносящих пищу. Среди жгутиконосцев много как свободноживущих форм, так и симбионтов, среди них есть одноклеточные и колониальные формы. До выделения простейших в самостоятельное царство ботаники включали жгутиконосцев в состав царства Растения как «одноклеточные водоросли».

Рис. 1. Колониальный 16-ти клеточный жгутиконосец
Некоторые жгутиконосцы, например эвглена и хламидомонада, способны совмещать растительный и животный типы питания. Их называют миксотрофами, или миксотрофными организмами. Большинство «растительных» жгутиконосцев ведёт свободный образ жизни в водной среде. В качестве примеров мы рассмотрим эвглену зелёную и хламидомонаду.
Эвглена зелёная
Рис. 2. Эвглена зелёная (Источник)
Клетка эвглены зелёной веретеновидной формы, с двумя жгутиками, один из которых короткий и незаметный (Рис. 2). Она зелёного цвета с красным светочувствительным глазком у переднего конца. Размножается путем продольного деления клетки. Иногда эвглена, размножаясь в огромных количествах, вызывает «цветение» воды. Способна как к гетеротрофному, так и к автотрофному типу питания за счёт наличия хлоропластов.
Хламидомонада
Рис. 3. Хламидомонада (Источник)
Хламидомона́да передвигается при помощи вращения сразу двух длинных жгутиков (Рис. 3). Обычно каждая клетка содержит две вакуоли, один крупный хлоропласт и имеет красный глазок. Глазок реагирует на свет. Хламидомонада движется по направлению к свету – это называется положительным фототаксисом. Хлоропласт занимает большую часть клетки, в нём на свету откладывается крахмал. Питание как автотрофное, так и гетеротрофное – хламидомонада, как и эвглена, является миксотрофом.
Трипаносомы
Рис. 4. Трипаносомы в компании эритроцитов (Источник)
Трипаносомы (Рис. 4) паразитируют на различных хозяевах и вызывают многие заболевания, среди которых наиболее известна сонная болезнь. Природными носителями трипаносом являются млекопитающие, переносчиками – насекомые. Например, сонная болезнь переносится мухой цеце. После её укуса паразиты проникают в кровь и лимфу, затем – в центральную нервную систему жертвы. У больного проявляются приступы усталости, затем нарушается цикл сна и бодрствования, из-за чего болезнь и получила своё название.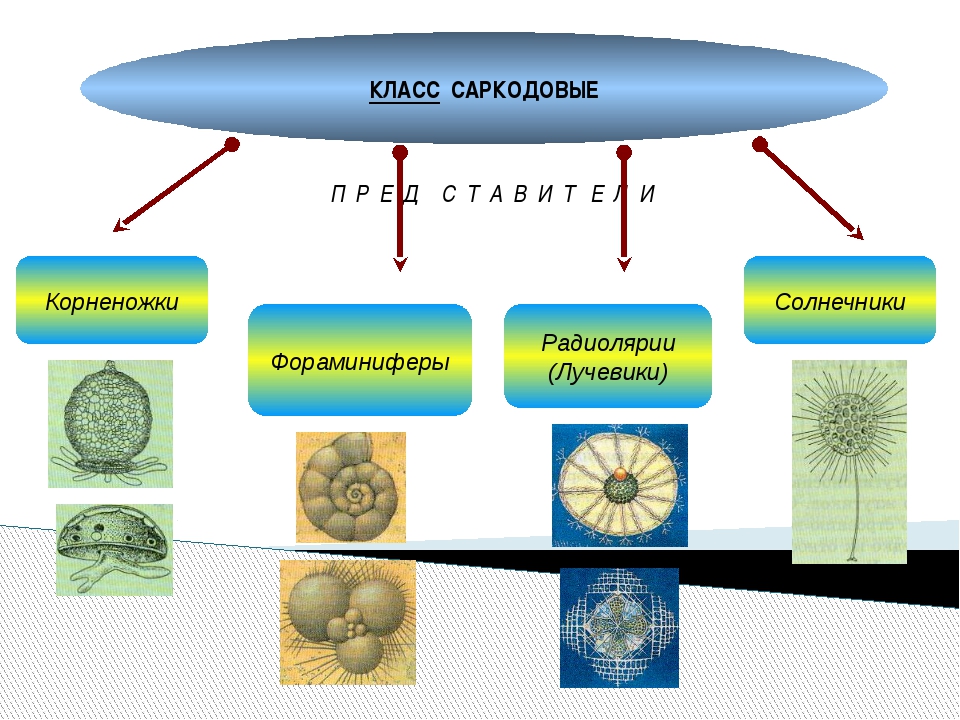
Ля́мблии
Рис. 5. Лямблии (Источник)
Ля́мблии (Рис. 5) паразитируют в тонком кишечнике человека и многих других млекопитающих, а также птиц. Болезнь, вызываемая ими, носит название лямблиоз. Большие количества лямблий, которые покрывают обширные поверхности кишечной стенки, нарушают работу кишечника. Они также оказывают сильное токсическое воздействие на организм. Лямблии – анаэробы, они способны жить без кислорода. Размножаются путем продольного деления надвое. Во внешнюю среду с фекалиями хозяина попадают цисты, проникающие в организм новых хозяев с зараженной водой или пищей.
Лейшмании
Лейшмании — род паразитических простейших, вызывающих лейшманиозы, в том числе «восточную язву». Естественным резервуаром разных видов служат млекопитающие и ящерицы.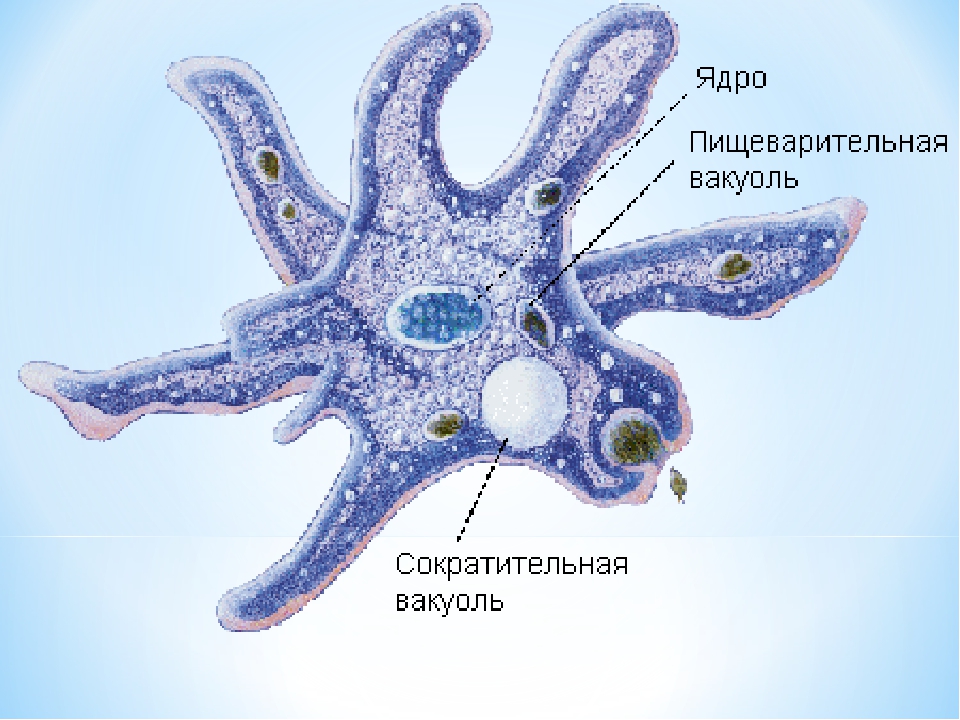 Переносчиками являются москиты. Москиты заражаются лейшманиями, когда пьют кровь заражённого млекопитающего. Паразиты вместе с проглатываемой кровью проникают в пищеварительный канал москита, где размножаются и блокируют просвет канала. Когда москит кусает очередную жертву, он вынужден отрыгнуть паразитов в ранку. У человека лейшмании могут вызывать кожные язвы или поражения внутренних органов. Лейшманиозами больны около 12 миллионов человек в 88 странах, в основном тропических.
Переносчиками являются москиты. Москиты заражаются лейшманиями, когда пьют кровь заражённого млекопитающего. Паразиты вместе с проглатываемой кровью проникают в пищеварительный канал москита, где размножаются и блокируют просвет канала. Когда москит кусает очередную жертву, он вынужден отрыгнуть паразитов в ранку. У человека лейшмании могут вызывать кожные язвы или поражения внутренних органов. Лейшманиозами больны около 12 миллионов человек в 88 странах, в основном тропических.
Инфузории. Общая характеристика
Рис. 6. Инфузории (Источник)
Инфузории – простейшие, клетки которых покрыты ресничками и имеют как минимум по 2 ядра (Рис. 6). Среди них есть свободноживущие, прикрепленные и паразитические формы. Живут в морях и пресных водоёмах, некоторые виды – в полостях между частичками почвы и во мхах.

Выделение у инфузорий происходит при помощи сократительных вакуолей и просто через поверхность клетки. Они выводят из клетки избыток воды и продукты обмена. В отличие от других простейших, инфузории обладают ядрами двух типов: маленькими микронуклеусами и большими макронуклеусами. Микронуклеус содержит полную наследственную информацию, это – «ядро для размножения». Макронуклеус содержит лишь копии активно используемых генов, он «ядро для жизни». Размножаются инфузории бесполым (поперечное деление надвое) и половым путями. Большинство инфузорий способно образовывать покоящиеся цисты в ответ на неблагоприятные условия, такие как недостаток пищи или высыхание. Всего известно более 7,5 тыс. видов инфузорий.
Инфузория туфелька
Рис. 7. Инфузория туфелька (Источник)
7. Инфузория туфелька (Источник)
Инфузория туфелька (Рис. 7) получила своё название за постоянную форму тела, напоминающую подошву туфли. Встречается она в пресных водах. Её размеры – обычно около 0,2–0,3 мм. На поверхности клетки расположены реснички. Их от 10 до 15 тысяч. Скорость движения инфузории – около 2 мм/c. У туфельки 2 сократительные вакуоли: в передней и задней части клетки. Каждая состоит из резервуара и отходящих от него радиальных каналов, по которым из цитоплазмы поступает жидкость. Имеется два разных по строению и функциям ядра – микронуклеус и макронуклеус.
Значение простейших
Несмотря на малые размеры тела, простейшие имеют громадное значение в природе и в жизни человека. Автотрофные простейшие вырабатывают органические вещества и выделяют кислород. Здесь особенно велика роль простейших морского планктона. Многие простейшие являются незаменимым кормом для различных животных. Простейшие очищают водоёмы, поедая детрит и бактерий. Большое количество простейших является паразитами и вызывает различные заболевания. Не меньше среди них и мутуалистов, иногда совершенно необходимых для выживания других организмов. Скелеты и раковинки погибших простейших могут формировать многометровые отложения на дне морей. Именно из таких отложений получились мел и некоторые известняки. Почти все основные группы свободнодвижущихся простейших представлены в почвенной фауне. Их численность в 1 г почвы может быть от 150 тыс. до 1 млн, т. е. на 1 га придется 150–1000 кг простейших, а на окультуренных почвах даже до 8,5 т на 1 га.
Многие простейшие являются незаменимым кормом для различных животных. Простейшие очищают водоёмы, поедая детрит и бактерий. Большое количество простейших является паразитами и вызывает различные заболевания. Не меньше среди них и мутуалистов, иногда совершенно необходимых для выживания других организмов. Скелеты и раковинки погибших простейших могут формировать многометровые отложения на дне морей. Именно из таких отложений получились мел и некоторые известняки. Почти все основные группы свободнодвижущихся простейших представлены в почвенной фауне. Их численность в 1 г почвы может быть от 150 тыс. до 1 млн, т. е. на 1 га придется 150–1000 кг простейших, а на окультуренных почвах даже до 8,5 т на 1 га.
источник конспекта — http://interneturok.ru/ru/school/biology/7-klass/bprostejshieb/zhgutikonostsy-infuzorii
источник видео — http://www.youtube.com/watch?v=Is78bkGal4M
источник видео — http://www. youtube.com/watch?v=P19rYPfLjmM
youtube.com/watch?v=P19rYPfLjmM
источник видео — http://www.youtube.com/watch?v=HKtaCt-3Y_8
источник видео — http://www.youtube.com/watch?v=yrsMQ1XkI9Y
источник видео — http://www.youtube.com/watch?v=xbFsoh4Cp58
источник видео — http://www.youtube.com/watch?v=Qqcsms_7Snw
источник видео — http://www.youtube.com/watch?v=URDRM-kk1AI
источник видео — http://www.youtube.com/watch?v=I9RD790RGiQ
источник видео — http://www.youtube.com/watch?v=vIx-7hP0I30
источник презентации — http://ppt4web.ru/biologija/prezentacija-po-teme-prostejjshie-klass.html
источник презентации — http://900igr.net/zip/biologija/Prostejshie.html
Тест «Простейшие» 7 класс
МКОУ Лискинская СОШ №4
«Биология»
Объяснять понятия на конкретных примерах: простейшие, корненожки, радиолярии, солнечники, споровики, циста, раковина, инфузории, колония, жгутиконосцы.
 Сравнивать простейших животных и растений. Объяснять значение простейших в природе и жизни человека
Сравнивать простейших животных и растений. Объяснять значение простейших в природе и жизни человека
(Брежнева Светлана Анатольевна, учитель биологии)
Базовый уровень
1.Задание: Отметьте правильный ответ
Особенность простейших:
микроскопическое строение
гетеротрофное питание
автотрофное питание
размножение делением
2.Задание: Отметьте правильный ответ
Особенность строения инфузории туфельки:
наличие двух ядер
гетеротрофное питание
автотрофное питание
реактивное движение
3.Задание: Отметьте правильный ответ
Особенность строения корненожки:
наличие псевдоподий
гетеротрофное питание
размножение делением
наличие двух ядер
4.Задание: Отметьте правильный ответ
Особенность строения жгутиконосцев:
светочувствительный глазок
псевдоподии
гетеротрофное питание
реснички
5. Задание: Отметьте правильный ответ
Задание: Отметьте правильный ответ
Особенность строения инфузории-туфельки:
клеточный рот
ядро
жгутики
псевдоподии
6.Задание: Отметьте правильный ответ
Особенность споровиков:
паразитизм
клеточное строение
размножение почкованием
микроскопическое строение
7.Задание: Отметьте правильный ответ
Особенность, проявляющаяся в строении инфузории-туфельки:
два ядра
множество жгутиков
короткие псевдоподии
наличие цисты
8.Задание: Отметьте правильный ответ
Особенность, проявляющаяся в строении эвглены зеленой:
наличие жгутика
две вакуоли
порошицы
клеточная глотка
9. Задание: Отметьте правильный ответ:
Ряд, в котором представлены простейшие:
амеба, эвглена зеленая, солнечники, жгутиконосцы
солнечники, гидра, инфузория, амеба
амеба, эвглена зеленая, солнечники, дафнии
эвглена зеленая, споровики, гидра, амеба, дафнии
10. Задание: Отметьте правильный ответ:
Задание: Отметьте правильный ответ:
Ряд, в котором представлены Саркодовые:
корненожки, радиолярии, солнечники
инфузория-туфелька, жгутиконосцы, солнечники
амеба, инфузория-туфелька, корненожки
корненожки, жгутиконосцы, радиолярии
Повышенный уровень
1. Задание: Отметьте правильный ответ
Причина, по которой простейшие образуют споры:
неблагоприятные условия среды обитания
нехватка кислорода
отсутствие света
наличие хищников
2. Задание: Отметьте правильный ответ
Ряд, в котором представлены органоиды специального назначения:
клеточный рот, светочувствительный глазок, порошица
вакуоль, оболочка, ядро
реснички, жгутики, ядро, клеточный рот
порошица. Ядро, вакуоль, цитоплазма
3.Задание: Отметьте правильный ответ
Ряд, в котором представлены представители Ресничных:
трубач, инфузория, сувойка
инфузории, солнечники, эвглена
сувойка, трубач, амеба
споровики, корненожки, солнечники
4. Задание: Установите соответствие
Задание: Установите соответствие
Соответствие между простейшим и способом передвижения:
5. Задание: Установите соответствиеСоответствие между простейшим и органоидом:
6. Задание: Установите соответствиеСоответствие между живым организмом и способом питания:
7. Задание: Установите соответствиеСоответствие между живым организмом и средой обитания:
8. Задание: Отметьте правильный ответРяд, в котором правильно представлены особенности простейших:
микроскопическое строение, органоиды специального назначения, спорообразование
автотрофное питание, водная среда обитания, жгутики, реснички
жгутики, реснички, ядро, спорообразование
ядро, спорообразование, жгутики, ложноножки
9. Задание: Отметьте правильный ответ
Ряд, в котором правильно представлено значение простейших в природе и жизни человека:
звено в цепи питания, переносчики заболеваний животных и человека
звено в цепи питания, образование органических веществ
фотосинтез, звено в цепи питания, источник энергии
источник энергии, фотосинтез, звено в цепи питания
10. Задание: Отметьте правильный ответ
Задание: Отметьте правильный ответ
Рая, в котором представлена последовательность стадий спорообразования простейших:
в определенном месте клетки цитоплазма, ядро, рибосомы концентрируются, уплотняются, покрываются мембраной, а затем плотной, многослойной оболочкой
обособляется часть цитоплазмы, покрывается многослойной оболочкой
покрывается плотной оболочкой большая часть простейшего, формируется спора
формируется спора, обособляется часть цитоплазмы, покрывается оболочкой
Различать на рисунках особенности строения и выделять существенные признаки жизнедеятельности отдельных представителей простейших
(Брежнева Светлана Анатольевна, учитель биологии)
Базовый уровень
1.Задание: Отметьте правильный ответ
Светочувствительный глазок эвглены зеленой представлен на рисунке под номером …
Правильные варианты ответа: 2, два
2.Задание: Отметьте правильный ответ
Хлоропласты эвглены зеленой представлен на рисунке под номером …
Правильный вариант ответа:3, три
3. Задание: Отметьте правильный ответ
Задание: Отметьте правильный ответ
Сократительная вакуоль эвглены зеленой представлен на рисунке под номером …
Правильный вариант ответа: 6, шесть
4.Задание: Отметьте правильный ответ
Запасные питательные вещества эвглены зеленой представлен на рисунке под номером …
Правильный вариант ответа:7, семь
5.Задание: Отметьте правильный ответ
Оболочка эвглены зеленой представлен на рисунке под номером …
Правильный вариант ответа: 5, пять
6.Задание: Отметьте правильный ответ
Ложноножки амебы представлены на рисунке под номером…
Правильный вариант ответа: 1, один
7.Задание: Отметьте правильный ответ
Ядро амебы представлены на рисунке под номером…
Правильный вариант ответа: 5, пять
8.Задание: Отметьте правильный ответ
Сократительная вакуоль амебы представлены на рисунке под номером…
Правильный вариант ответа: 4, четыре
9.Задание: Отметьте правильный ответ
Фагоцитоз амебы представлены на рисунке под номером…
Правильный вариант ответа: 3, три
10. Задание: Отметьте правильный ответ
Задание: Отметьте правильный ответ
Ядро амебы представлены на рисунке под номером…
Правильный вариант ответа: 5, пять
Повышенный уровень
1.Задание: Установите соответствие
Соответствие между простейшим и органоидом:
2.Задание: Установите соответствие
Соответствие между простейшим и органоидом:
3.Задание: Установите соответствиеСоответствие между простейшим и органоидом:
4.Задание: Установите соответствиеСоответствие между простейшим и органоидом
5.Задание: Установите соответствиеСоответствие между органоидом и номер, под которым он обозначен:
6.Задание: Установите соответствиеСоответствие между органоидом и номер, под которым он обозначен:
7.Задание: Установите соответствиеСоответствие между органоидом и номер, под которым он обозначен:
8.Задание: Установите соответствиеСоответствие между простейшим и способом его передвижения:
9.Задание: Установите соответствиеСоответствие между простейшим и органоидами специального назначения:
10. Задание: Установите соответствие
Задание: Установите соответствиеСоответствие между простейшим и способом передвижения и питания
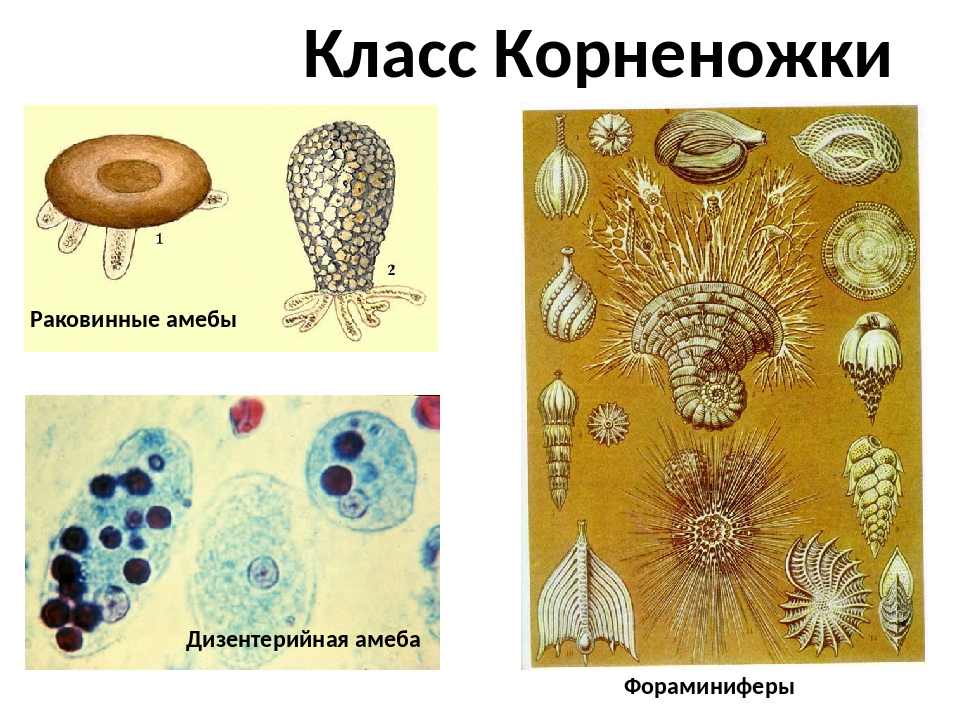
Фораминиферы и радиолярии (простейшие морей) | Биология. Реферат, доклад, сообщение, краткое содержание, лекция, шпаргалка, конспект, ГДЗ, тест
В морях встречаются фораминиферы и радиолярии.
| Рис. 48. Фораминиферы |
Фораминиферы (рис. 48) обитают преимущественно возле дна, встречаются и планктонные виды. Клетка фораминифер находится внутри раковины, к которой могут прилипать частицы песка, панцири диатомовых водорослей и т.д. У других видов в состав раковины входит карбонат кальция. Раковины имеют крупное отверстие — устье, а их стенки пронизаны многочисленными порами. Через эти отверстия выходят ложноножки, которые в некоторых местах сливаются между собой, образуя ловчую сеть. Захваченные с ее помощью частицы пищи направляются внутрь клетки, где перевариваются в пищеварительных вакуолях.
Захваченные с ее помощью частицы пищи направляются внутрь клетки, где перевариваются в пищеварительных вакуолях.
Из раковин фораминифер образуются значительные отложения известняка, толщиной в десятки и сотни метров. В результате горообразовательных процессов эти осадочные породы могут оказаться на суше. Такие горные системы, как Пиренеи, Альпы, Гималаи, состоят большей частью из фораминиферных известняков. Британские острова древние римляне называли Альбионом (от лат. альбус — белый) по цвету прибрежных известняковых скал. По видовому составу ископаемых фораминифер геологи определяют возраст горной породы, поскольку для каждого периода геологической истории Земли этот состав особый.
| Рис. 51. 2. Ночесветка |
В планктоне теплых морей, в том числе и Черного, обитает ночесветка (рис. 51. 2). Это довольно крупное (до 2 мм в диаметре) одноклеточное животное содержит в цитоплазме крупные заполненные жиром вакуоли, что облегчает пребывание в толще воды. При механическом раздражении клетки ночесветки начинают светиться ярким светом.
При механическом раздражении клетки ночесветки начинают светиться ярким светом.
Ископаемые организмы, с помощью которых определяют возраст осадочных пород, называют руководящими ископаемыми. Материал с сайта http://worldofschool.ru
| Рис. 49. Радиолярии |
Радиолярии — планктонные животные. В Азовском и Черном морях с низкой соленостью воды радиолярии, в отличие от фораминифер, не обитают. Большинство видов радиолярий имеют внутриклеточный скелет сложного строения, состоящий из диоксида кремния или других минеральных веществ (рис. 49). Их тоненькие ложноножки образуют вокруг клетки ловчую сеть. Из остатков радиолярий за сотни миллионов лет образовались особые осадочные породы — радиоляриты. Например, остров Барбадос в Карибском море состоит преимущественно из остатков радиолярий. К радиоляритам также относятся такие полудрагоценные камни, как яшма, опал, халцедон.
К радиоляритам также относятся такие полудрагоценные камни, как яшма, опал, халцедон.
В морях обитают: фораминиферы, имеющие раковину из карбоната кальция; радиолярии с внутриклеточным скелетом из неорганических веществ.
Морскими простейшими питаются различные морские животные; из раковин отмерших фораминифер формируются осадочные породы (известняк), из остатков радиолярий образуются радиоляриты; по видовому составу ископаемых фораминифер геологи определяют возраст осадочных пород.
На этой странице материал по темам:Простейшие животные фораминиферы
Губки морские животныерадиолярии фото
Фораминиферы карибского моря
Какова роль морских простейших в образовании осадочных пород
Кальций из среды обитания аккумулируют радиолярии губки
Какова роль морских простейших в образовании осадочных пород?
Дидактика.
 Простейшие — Биология — Тесты
Простейшие — Биология — Тесты7
Раздел 2. Животные Тема: Подцарство Простейшие (Protozoa) Задание 1. «Характеристика простейших»
Запишите номера вопросов и пропущенные слова (или группы слов):
Среды обитания простейших – (_), (_), (_) и (_).
Тело простейших представлено (_), но встречаются и (_).
Простейших насчитывается (_) видов.
К колониальным формам относятся (_), (_) и (_).
Количество ядер в клетках простейших – (_), (_) или (_).
Наружная мембрана может образовывать эластичную и прочную клеточную стенку – (_).
Наружный слой цитоплазмы – (_), внутренний – (_).
По типу питания простейшие делятся на (_) и (_).
Выделение и осморегуляция простейших осуществляется с помощью (_).

При неблагоприятных условиях многие простейшие образуют (_).
Бесполое размножение простейших осуществляется с помощью (_) или (_).
Половое размножение простейших осуществляется с помощью (_) или (_).
Ответная реакция на раздражение осуществляется с помощью (_).
Рассмотрите рисунок и дайте ответы на вопросы:
К какому типу, подтипу и классу относится амеба?
Что обозначено на рисунке цифрами 1 – 7?
Какие органоиды отвечают за движение амебы.
Какой органоид отвечает за пищеварение?
Как дышит амеба?
Какой органоид отвечает за выделение из клетки воды с растворенными в ней вредными веществами?
Как амеба может переносить неблагоприятные условия?
Как размножается амеба?
Какие саркодовые могут иметь внешний или внутренний скелет?
Какие саркодовые могут паразитировать в человеке?
 «Растительные жгутиконосцы»
«Растительные жгутиконосцы»Рассмотрите рисунок и дайте ответы на вопросы:
Что обозначено на рисунке цифрами 1 – 10?
Какими двумя способами питается эвглена?
К какому типу и классу относится эвглена?
Как размножается эвглена?
Что представляет собой вольвокс?
Какие клетки различаются в колонии вольвокса?
Как осуществляется бесполое размножение вольвокса?
Как осуществляется половое размножение вольвокса?
Рассмотрите рисунок и дайте ответы на вопросы:
А – сонная болезнь; Б – пендинская язва.
Каково систематическое положение животных жгутиконосцев?
Что обозначено на рисунке цифрами 1 – 6?
Кто является возбудителем и переносчиком сонной болезни (А)?
Кто является возбудителем и переносчиком кожного лейшманиоза (Б)?
Как происходит заражение лямблией и где она паразитирует (5)?
Какое заболевание у человека вызывает трихомонада влагалищная (6)?
Какие заболевания называются трансмиссивными?
 «Класс Жгутиконосцы»
«Класс Жгутиконосцы»Запишите номера тестов, против каждого – правильные варианты ответа
**Тест 1. Какие простейшие относятся к растительным жгутиконосцам?
Эвглена зеленая. 5. Трипаносома.
Амеба протей. 6. Лейшмания.
Дизентерийная амеба. 7. Гониум.
Вольвокс. 8. Пандорина.
**Тест 2. Какие простейшие относятся к животным жгутиконосцам?
Эвглена зеленая. 5. Трипаносома.
Амеба протей. 6. Лейшмания.
Дизентерийная амеба. 7. Гониум.
Вольвокс. 8. Пандорина.
**Тест 3. Какие органоиды характерны для эвглены, но отсутствуют у амебы?
Ядро. 5. Жгутик.
Сократительная вакуоль. 6. Пелликула.
Стигма. 7.
 Клеточный рот.
Клеточный рот.Хлоропласты. 8. Клеточная глотка.
Тест 4. Как дышит эвглена зеленая?
Клеточной глоткой.
Клеточными жабрами.
Клеточными легкими.
Всей поверхностью тела.
Тест 5. Как размножается эвглена зеленая?
Делением тела поперек.
Продольным делением тела.
Возможно и продольное и поперечное деление.
В благоприятных условиях – бесполое размножение, в неблагоприятных – половое.
Тест 6. У какого простейшего известно половое размножение?
У амебы.
У вольвокса.
У эвглены.
У простейших животных не известно половое размножение.

Тест 7. Какой признак сближает вольвокс с многоклеточными животными?
Таких признаков нет.
Число клеток в колонии вольвокса может достигать 60 тыс.
Наличие двух жгутиков в каждой клетке.
Различные типы зооидов – вегетативные и генеративные.
Тест 8. Какие животные жгутиконосцы вызывают болезнь кожи – пендинскую язву?
Мухи цеце.
Трипаносомы.
Москиты.
Лейшмании.
Тест 9. Какие животные жгутиконосцы вызывают сонную болезнь?
Мухи цеце.
Трипаносомы.
Москиты.
Лейшмании.
Рассмотрите рисунок и дайте ответы на вопросы:
Что обозначено на рисунке цифрами 1 – 8?
С помощью каких органоидов движется инфузория туфелька?
Через какой органоид инфузория туфелька поглощает питательные вещества?
Через какой органоид инфузория туфелька выводит непереваренные вещества?
Сколько сократительных вакуолей у инфузории туфельки?
Сколько ядер у инфузории туфельки?
Каков набор хромосом в ядрах инфузории туфельки?
К какому типу относится инфузория туфелька?
Задание 7.
 «Размножение
«Размножениеинфузории туфельки»
Рассмотрите рисунок и дайте ответы на вопросы:
Какие типы размножения инфузории туфельки изображены на рисунке?
Каковы особенности размножения инфузории, изображенной на рис. А?
Что происходит с инфузориями на этапах деления, обозначенных цифрами 1 – 9?
Рассмотрите рисунок и дайте ответы на вопросы:
Сделайте подписи к рисунку.
Кто является окончательным и промежуточным хозяином малярийного плазмодия?
Рассмотрите рисунок и дайте ответы на вопросы:
Какие простейшие обозначены на рисунке цифрами 1 – 10?
Каково систематическое положение этих простейших?
 «Зачет. Подцарство Простейшие (Protozoa)
«Зачет. Подцарство Простейшие (Protozoa)Запишите номера вопросов и дайте ответ одним предложением:
Каковы размеры инфузории-туфельки, амебы протея, эвглены зеленой?
С помощью каких органоидов пища захватывается инфузорией туфелькой?
Каков хромосомный набор макронуклеуса и микронуклеуса инфузории?
Какой тип деления характерен для микро и макронуклеусов?
За какие функции отвечает макронуклеус? Микронуклеус?
Каким образом удаляются непереваренные остатки пищи, и регулируется осмотическое давление инфузории?
Как называется процесс обмена генетическим материалом между инфузориями?
Как происходит бесполое размножение инфузории?
Какие органоиды передвижения и защиты имеются у инфузории?
Какая инфузория может паразитировать в толстом кишечнике человека?
Какие заболевания называются трансмиссивными?
На какой стадии развития происходит заражение человека малярийным плазмодием?
Как называется стадия развития малярийного плазмодия, происходящая в клетках печени?
Как называется стадия развития малярийного плазмодия, происходящая в эритроцитах?
С какой стадией жизненного цикла плазмодия связаны приступы лихорадки?
На какой стадии возбудитель может попасть в организм окончательного хозяина?
Где происходит спорогония?
 ««Важнейшие термины и понятия темы»
««Важнейшие термины и понятия темы»Дайте определение терминам или раскройте понятия (одним предложением, подчеркнув важнейшие особенности):
1. Миксотрофный тип питания. 2. Таксисы. 3. Инцистирование. 4. Трансмиссивное заболевание. 5. Конъюгация. 6. Шизогония. 7. Промежуточный хозяин. 8. Окончательный хозяин.
Ответы:
Задание 1. 1. Моря, пресные воды, влажная почва, живые организмы. 2. Одной клеткой; колониальные формы. 3. Около 40 тыс. видов. 4. Вольвокс, гониум, эвдорина, пандорина. 5. Одно, два или несколько. 6. Пелликулу. 7. Эктоплазма, более светлая и плотная; эндоплазма, более зернистая. 8. Гетеротрофов и миксотрофов. 9. Сократительных вакуолей. 10. Цисту. 11. Бинарного митотического деления; шизогонии, множественного деления. 12. Образования и слияния гамет; конъюгации. 13. Таксисов, движения в ответ на раздражение.
Задание 1. 1.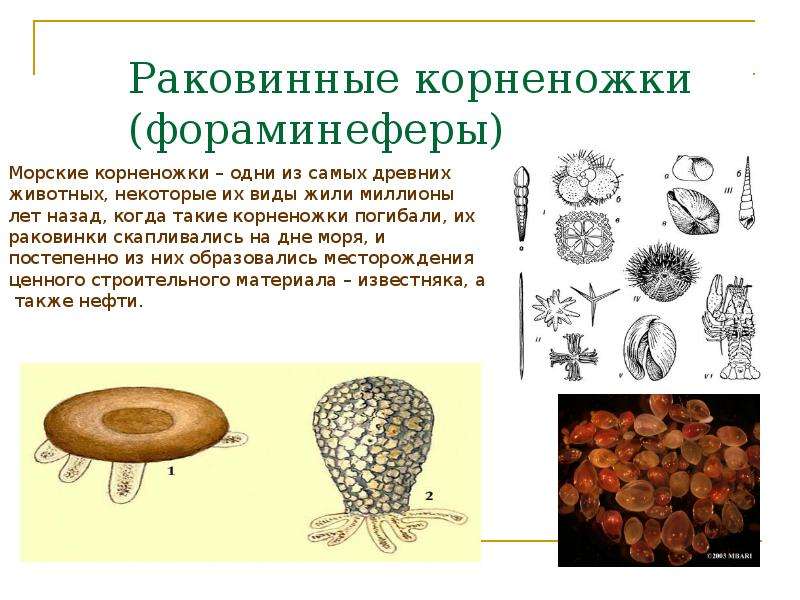 Тип Простейшие, подтип Корнежгутиковые, класс Саркодовые. 2. 1 – цитоплазматическая мембрана; 2 – эктоплазма; 3 – эндоплазма; 4 – ядро; 5 – захват пищевых частиц, фагоцитоз; 6 – сократительная вакуоль; 7 – пищеварительная вакуоль. 3. Ложноножки. 4. Пищеварительная вакуоль. 5. Всей поверхностью тела. 6. Сократительная вакуоль. 7. С помощью инцистирования. 8. Бесполое размножение, бинарное деление. 9. Раковинные амебы, фораминиферы, радиолярии, некоторые солнечники. 10. Дизентерийная амеба.
Тип Простейшие, подтип Корнежгутиковые, класс Саркодовые. 2. 1 – цитоплазматическая мембрана; 2 – эктоплазма; 3 – эндоплазма; 4 – ядро; 5 – захват пищевых частиц, фагоцитоз; 6 – сократительная вакуоль; 7 – пищеварительная вакуоль. 3. Ложноножки. 4. Пищеварительная вакуоль. 5. Всей поверхностью тела. 6. Сократительная вакуоль. 7. С помощью инцистирования. 8. Бесполое размножение, бинарное деление. 9. Раковинные амебы, фораминиферы, радиолярии, некоторые солнечники. 10. Дизентерийная амеба.
Задание 2. 1. Корнежгутиковые, Саркодовые. 2. Не превышают 0,5 мм. 3. Ложноножек. 4. Поверхность тела. 5. Сократительной вакуоли. 6. Цисту. 7. Бесполое, делением пополам. 8. Раздражимостью. 9. Раковинные амебы, фораминиферы, радиолярии. 10. Толстом кишечнике.
Задание 3. 1. 1 – пелликула; 2 – цитоплазма; 3 – ядро; 4 – хроматофоры; 5 – сократительная вакуоль; 6 – стигма; 7 – жгутик; 8 – колония вольвокса; 9 – дочерние колонии; 10 – отдельные особи, зооиды.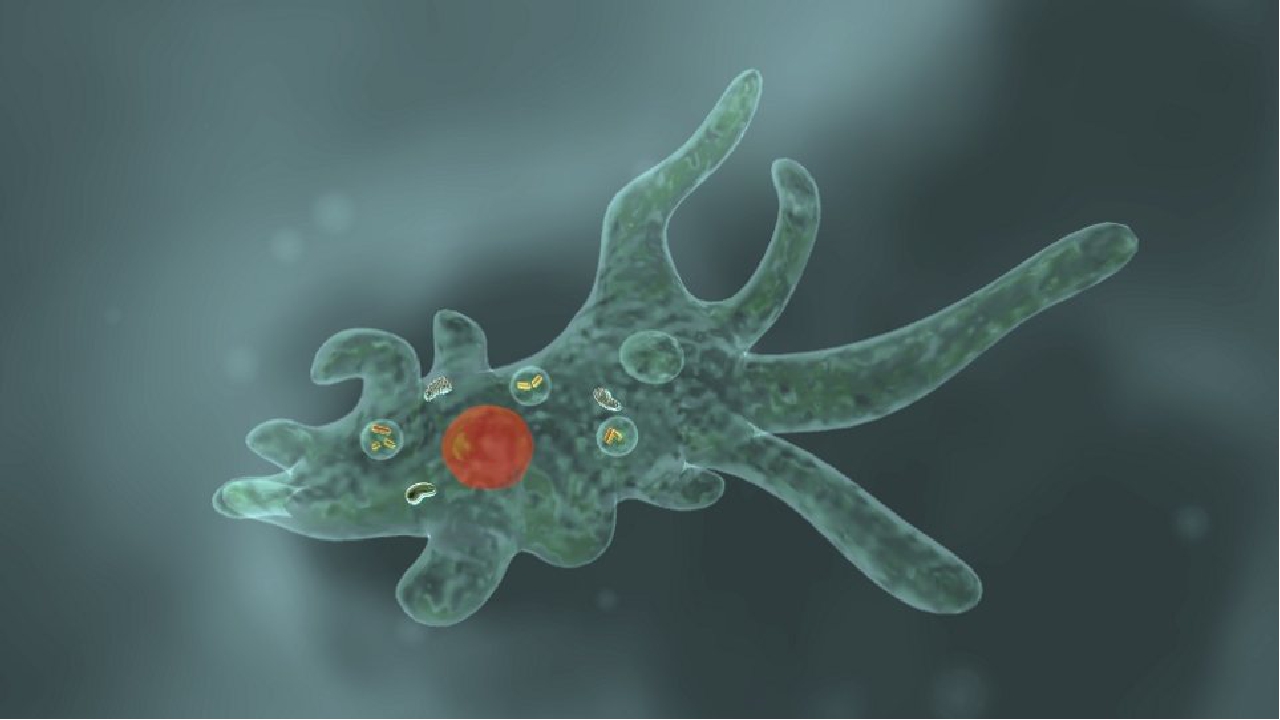 2. В темноте – готовыми органическими веществами, на свету за счет фотосинтеза. 3. Тип Корнежгутиковые, класс Жгутиковые. 4. Продольным делением пополам. 5. Колония растительных жгутиконосцев. 6. Вегетативные и генеративные зооиды. 7. Генеративные зооиды погружаются внутрь колонии и митотически делятся, образуя дочерние колонии. Материнская колония разрушается, а дочерние начинают самостоятельное существование. 8. Осенью генеративные зооиды образуют микро- и макрогаметы, которые, сливаясь, образуют зиготы. Зигота весной мейотически делится, гаплоидные зооиды образуют новую колонию.
2. В темноте – готовыми органическими веществами, на свету за счет фотосинтеза. 3. Тип Корнежгутиковые, класс Жгутиковые. 4. Продольным делением пополам. 5. Колония растительных жгутиконосцев. 6. Вегетативные и генеративные зооиды. 7. Генеративные зооиды погружаются внутрь колонии и митотически делятся, образуя дочерние колонии. Материнская колония разрушается, а дочерние начинают самостоятельное существование. 8. Осенью генеративные зооиды образуют микро- и макрогаметы, которые, сливаясь, образуют зиготы. Зигота весной мейотически делится, гаплоидные зооиды образуют новую колонию.
Задание 4. 1. Подцарство Простейшие, тип Корнежгутиковые, подтип Жгутиконосцы, класс Животные жгутиконосцы. 2. 1 – трипаносома; 2 – муха цеце; 3 – лейшмании; 4 – москит; 5 лямблия кишечная; 6 – трихомонада влагалищная. 3. Возбудитель трипаносома, переносчик – муха цеце. 4. Возбудитель лейшмании, переносчик – москиты. 5. Перорально, цистами. Паразитирует в тонком кишечнике. 6. Воспаление женских и мужских половых органов. 7. Передающиеся через укус кровососущего насекомого или клеща.
7. Передающиеся через укус кровососущего насекомого или клеща.
Задание 5. **Тест 1: 1, 4, 7, 8. **Тест 2: 2, 3, 5, 6. **Тест 3: 3, 4, 5, 6, 7, 8. Тест 4: 4. Тест 5: 2. Тест 6: 2. Тест 7: 4. Тест 8: 4. Тест 9: 2.
Задание 6. 1 – клеточный рот. 2 – клеточная глотка. 3 – образование пищеварительной вакуоли. 4 – удаление непереваренных остатков через порошицу. 5 – макронуклеус. 6 – микронуклеус. 7 – сократительная вакуоль. 8 – приводящие канальцы. 9 – реснички. 10 – пищеварительная вакуоль. 2. С помощью ресничек. 3. Клеточный рот. 4. Через порошицу. 5. Две. 6. Два. 7. Маконуклеус полиполидный, микронуклеус – диплоидный. 8. Тип Инфузории.
Задание 7. 1. А – бесполое деление. Б – половое размножение. 2. Поперечное деление пополам, причем макронуклеус делится амитозом, микронуклеус – митотически. 3. 1 – конъюгация; 2 – разрушение макронуклеусов, мейоз микронуклеусов; 3 – разрушение трех образовавшихся гаплоидных ядер; 4 – митоз оставшегося ядра и обмен мужскими ядрами; 5 – слияние мужских и женских ядер; 6 – три митотических деления, образование четырех микронуклеусов и четырех макронуклеусов; 7 – разрушение трех микронуклеусов; 8 – деление эксконъюгантов на две особи с двумя макронуклеусами и микронуклеусом; 9 – митоз микронуклеусов и образование восьми особей.
Задание 8. 1. 1 – спорозоиты; 2 – шизогония в клетках печени; 3 – выход мерозоитов и заражение эритроцитов; 4 – эритроцитарная шизогония; 5 – образование гамонтов; 6 – образование микро- и макрогамет; 7 – копуляция гамет; 8 – превращение оокинеты в ооцисту; 8 – ооциста распадается с выходом спорозоитов (до 10 тыс.). 2. Окончательный – комар, промежуточный – человек.
Задание 9.
1. 1 – инфузория туфелька; 2 – эвглена зеленая; 3 – трипаносома; 4 – лямблия; 5 – опалина; 6 – радиолярия; 7 – амеба протей; 8 – дизентерийная амеба; 9 – трихомонада; 10 – вольвокс. 2. К типу Саркожгутиконосцы, классу Саркодовые: радиолярия, амеба протей, дизентерийная амеба. К типу Саркожгутиконосцы, классу Жгутиконосцы: эвглена зеленая, трипаносома, лямблия, вольвокс. К типу Инфузории: инфузория туфелька, опалина
Задание 10. 1. Инфузория туфелька – 0,1-0,3 мм, амеба протей до 0,5 мм, эвглена зеленая – 0,05 мм.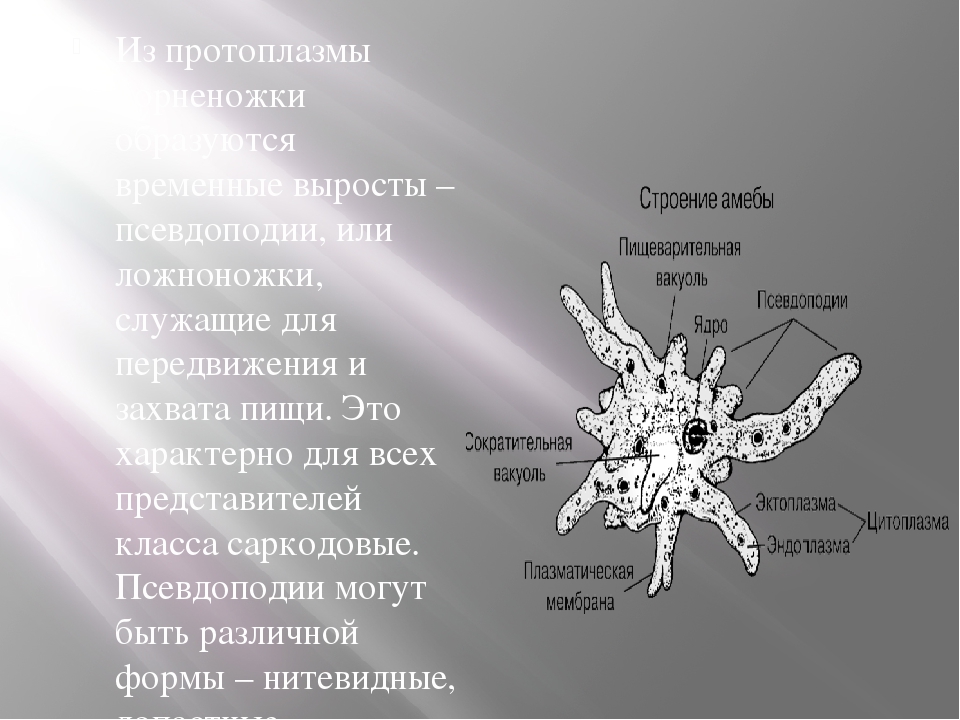 2. Клеточным ртом, клеточной глоткой. 3. Макронуклеус полиплоидный, микронуклеус диплоидный. 4. Микронуклеус – митоз, макронуклеус – амитоз. 5. Макронуклеус – обмен веществ, микронуклеус – размножение. 6. Непереваренные остатки выводятся через порошицу, осмотическое давление регулируется сократительными вакуолями. 7. Конъюгацией. 8. Поперечным делением пополам. 9. Органоиды передвижения – реснички, защиты – трихоцисты. 10. Инфузория балантидий. 11. Передающиеся кровососущими насекомыми или клещами. 12. На стадии спорозоитов. 13. Тканевая шизогония. 14. Эритроцитарная шизогония. 15. Во время выхода мерозоитов из разрушенных эритроцитов. 16. На стадии гамонтов. 17. В спороцистах под эпителием желудка комара.
2. Клеточным ртом, клеточной глоткой. 3. Макронуклеус полиплоидный, микронуклеус диплоидный. 4. Микронуклеус – митоз, макронуклеус – амитоз. 5. Макронуклеус – обмен веществ, микронуклеус – размножение. 6. Непереваренные остатки выводятся через порошицу, осмотическое давление регулируется сократительными вакуолями. 7. Конъюгацией. 8. Поперечным делением пополам. 9. Органоиды передвижения – реснички, защиты – трихоцисты. 10. Инфузория балантидий. 11. Передающиеся кровососущими насекомыми или клещами. 12. На стадии спорозоитов. 13. Тканевая шизогония. 14. Эритроцитарная шизогония. 15. Во время выхода мерозоитов из разрушенных эритроцитов. 16. На стадии гамонтов. 17. В спороцистах под эпителием желудка комара.
Задание 11.
1. Смешанный тип питания – автотрофный и гетеротрофный. 2. Двигательные реакции в ответ на односторонне действующий стимул. Свойственны свободно передвигающимся организмам. 3. Способ переживания неблагоприятных условий, простейшее округляется, покрывается защитными оболочками.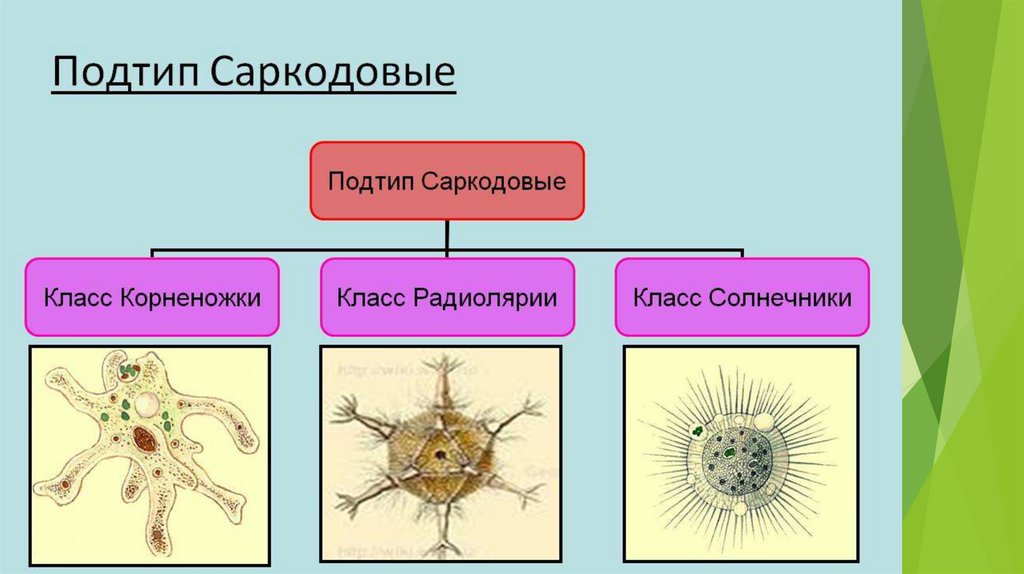 В таком состоянии способен длительной время сохранять жизнеспособность даже в воздушной среде. 4. Заболевание, передающееся кровососущими животными. 5. Половой процесс, передача наследственной информации. 6. Множественное деление ядра клетки, сопровождается образованием соответствующего число мерозоитов. 7. Организм, в котором происходит питание, и только бесполое размножение паразита. 8. Организм, в котором происходит половое размножение паразита.
В таком состоянии способен длительной время сохранять жизнеспособность даже в воздушной среде. 4. Заболевание, передающееся кровососущими животными. 5. Половой процесс, передача наследственной информации. 6. Множественное деление ядра клетки, сопровождается образованием соответствующего число мерозоитов. 7. Организм, в котором происходит питание, и только бесполое размножение паразита. 8. Организм, в котором происходит половое размножение паразита.
Сроооооооочно!!!!Пожалуйста помогите!!!Корненожки, радиолярии, солнечники, жгутиконосцы,инфузория: среда и места обитания,дыхани
Пепсин — расщепляет белки до аминокислот, полипептидов, олигопептидов[2].Реннин — (у детей до 1 года) помогает переварить молочные продукты. После одного года химозин пропадает, его функции будет выполнять соляная кислота.Париетальные клетки желудка также секретируют внутренний фактор Касла, необходимый для всасывания витамина B12.
Тонкая кишка[править | править вики-текст]Основная статья: Тонкая кишка человекаЧерез пилорический сфинктер пища попадает в тонкую кишку. Первый отдел тонкой кишки —двенадцатиперстная кишка, где происходит смешивание пищи с желчью, которая обеспечивает эмульгированиежиров ферментами поджелудочной железы и тонкой кишки, расщепляющими углеводы (мальтоза, лактоза,сахароза), белки (трипсин и химотрипсин). В тонкой кишке происходит основной объём всасывания питательных веществ и витаминов через кишечную стенку.
Первый отдел тонкой кишки —двенадцатиперстная кишка, где происходит смешивание пищи с желчью, которая обеспечивает эмульгированиежиров ферментами поджелудочной железы и тонкой кишки, расщепляющими углеводы (мальтоза, лактоза,сахароза), белки (трипсин и химотрипсин). В тонкой кишке происходит основной объём всасывания питательных веществ и витаминов через кишечную стенку.
После прохождения тонкой кишки пища попадает в толстую кишку, состоящую из слепой, ободочной, сигмовидной и прямой кишок. Здесь происходит всасывание воды и электролитов, здесь же происходит и формирование каловых масс.
Регуляция пищеварения[править | править вики-текст]Дополнительные сведения: Вегетативная нервная системаПищеварение у человека является психофизиологическим процессом. Это означает, что на последовательность и скорость реакций влияют гуморальные способности желудочно-кишечного тракта, качество пищи и состояния вегетативной нервной системы.
Гуморальные способности, влияющие на пищеварение, обуславливаются гормонами, которые вырабатываются клетками слизистой оболочки, желудка и тонкого кишечника. Основными пищеварительными гормонами являются гастрин, секретин и холецистокинин, они выделяются в кровеносную систему желудочно-кишечного тракта и способствуют выработке пищеварительных соков и продвижению пищи.
Усваиваемость зависит от качества пищи[3]:
значительное содержание клетчатки (в том числе растворимой) способно существенно уменьшить всасывание;некоторые микроэлементы, содержащиеся в пище, влияют на процессы всасывания веществ в тонком кишечнике[4];жиры различной природы всасывают по-разному. Насыщенные животные жиры всасываются и преобразуются в человеческий жир гораздо легче, чем полиненасыщенные растительные жиры, которые практически не участвуют в образовании человеческого жира;всасывание кишечником углеводов, жиров и белков несколько меняется в зависимости от времени суток и времени года;всасывание меняется также в зависимости от химического состава продуктов, которые поступили в кишечник раньше.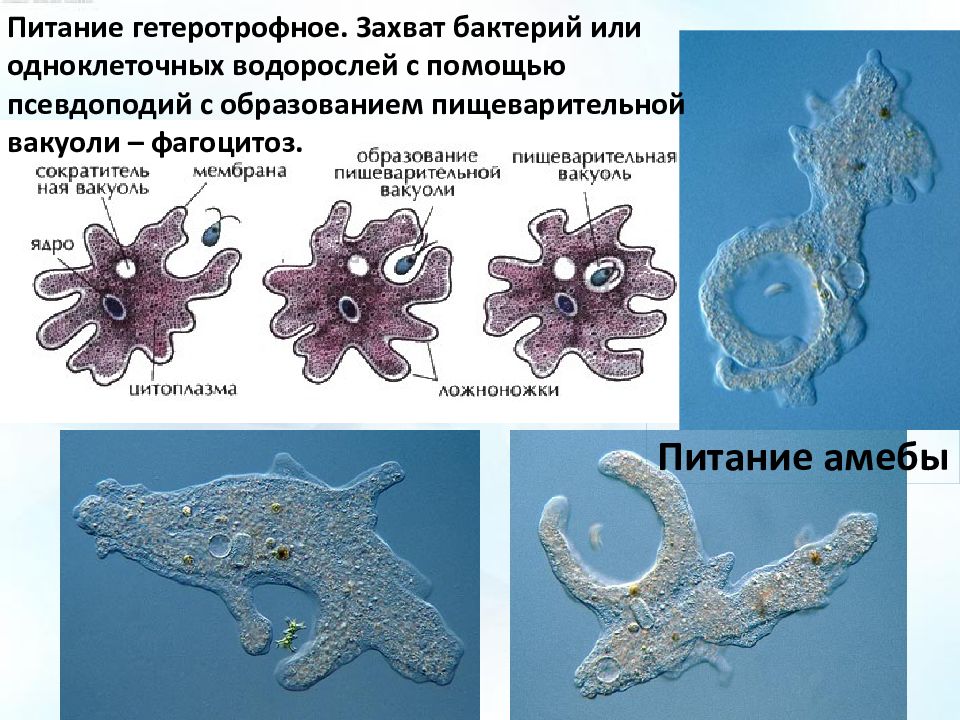
Регуляция пищеварения обеспечивается также вегетативной нервной системой. Парасимпатическая часть стимулирует секрецию и перистальтику, в то время как симпатическая часть подавляет.
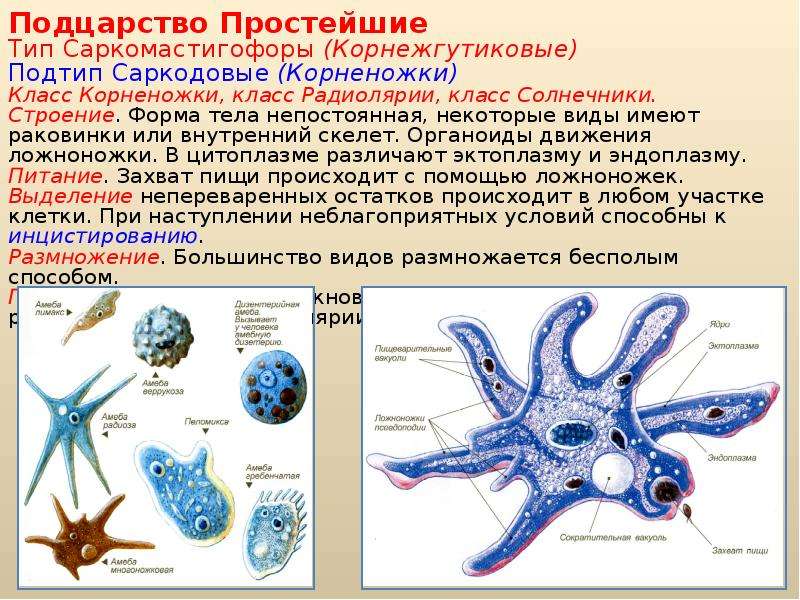
Подцарство одноклеточные. Части клетки. Корненожки
ВСПОМНИТЕ
Вопрос 1. Какие систематические единицы используют в классификации организмов?
В классификации организмов используют такие систематические единицы как вид, род, семейство, отряд, класс, тип и царство.
Вопрос 2. Из каких частей состоит клетка?
Живое содержимое клетки — протопласт — отделено от окружающей среды плазматической мембраной, или плазмалеммой. Внутри клетка заполнена цитоплазмой, в которой расположены различные органоиды и клеточные включения, а также генетический материал в виде молекулы ДНК. Каждый из органоидов клетки выполняет свою особую функцию, а в совокупности все они определяют жизнедеятельность клетки в целом.
Вопрос 1. Каких животных относят к подцарству Одноклеточные? Назовите их общие признаки.
Подцарство Одноклеточные объединяет одноклеточные подвижные организмы, питающиеся готовыми органическими веществами. Для обозначения одноклеточных животных часто используют удобный, исторически сложившийся термин «простейшие».
Размеры одноклеточных животных составляют в среднем от 0,1—0,5 мм. Обитают одноклеточные животные в морской и пресной воде, влажной почве, в других организмах. Внешне они очень разнообразны. Известны десятки тысяч видов современных одноклеточных животных.
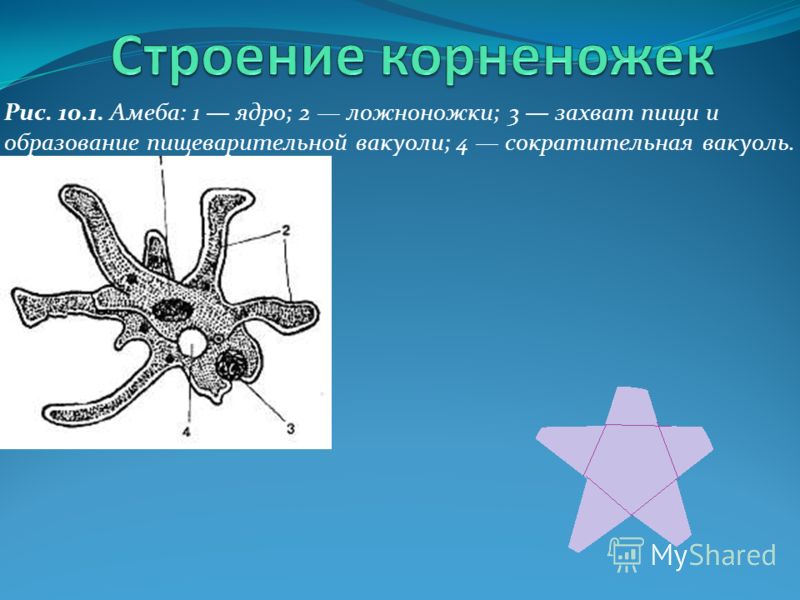
Вопрос 2. Каких животных объединяют в группу Корненожки? Составите план ответа об особенностях амёбы.
Одноклеточных животных, которые не имеют постоянной формы тела объединяют в группу Корненожки. Наиболее известные представители корненожек — амёбы, что в переводе с греческого означает «изменение».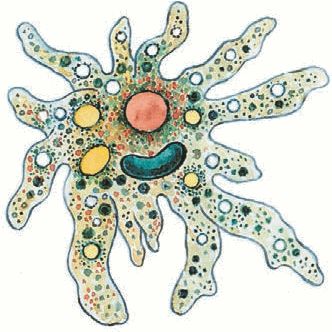
Вопрос 3. Какое движение называют амёбоидным?
Если под микроскопом наблюдать за амёбой в капле воды, то можно увидеть, как её зернистая цитоплазма постоянно перетекает от одного полюса клетки к другому. При этом по направлению потока цитоплазмы образуется выступ, который медленно вытягивается. Это формируется ложноножка, и амёба перетекает в том же направлении. Такой тип движения называют амёбоидным движением.
1. Сравните одноклеточных животных с бактериями, одноклеточными водорослями и грибами. Составьте таблицу «Сходство и различия одноклеточных организмов».
Сходство и различие одноклеточных организмов
2. Используя интернет-источники, научно-популярные журналы, газеты, книги, текст учебника, подготовьте сообщение о разнообразии одноклеточных животных.
Одноклеточные организмы выполняют те же функции, что многоклеточные: питаются, двигаются и размножаются.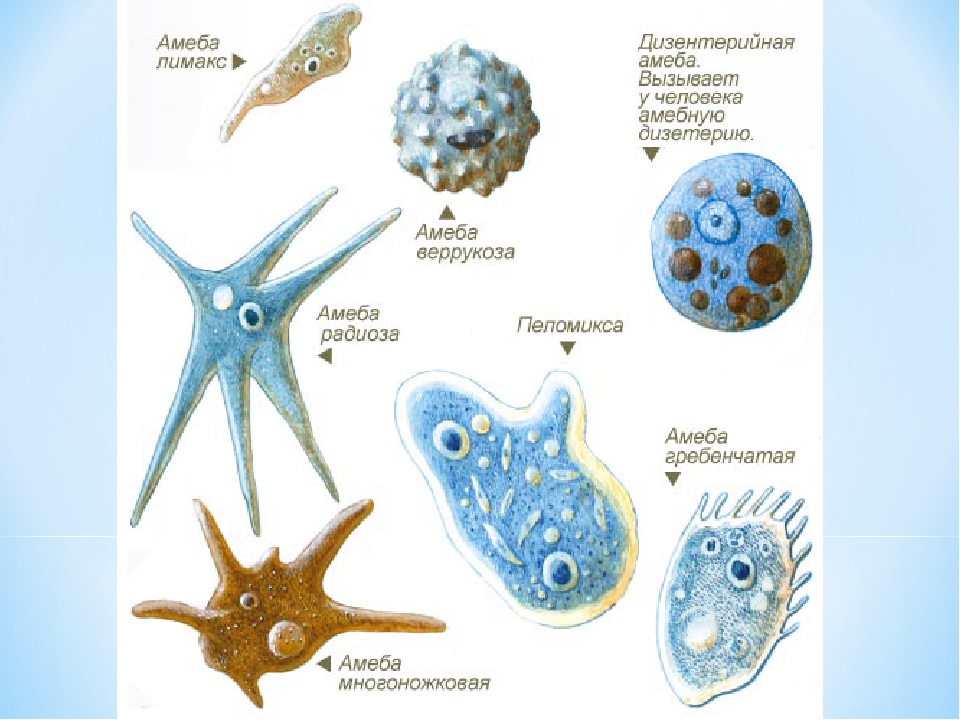 Их клетки должны быть «мастером на все руки», чтобы делать все это, что другие животных делают особые органы. Поэтому одноклеточные животные настолько непохожи на остальных, что их выделяют в отдельные Подцарство простейших.
Их клетки должны быть «мастером на все руки», чтобы делать все это, что другие животных делают особые органы. Поэтому одноклеточные животные настолько непохожи на остальных, что их выделяют в отдельные Подцарство простейших.
К типу простейшие относится свыше 15000 видов животных, обитающих в морях, пресных водах, почве. Помимо свободноживущих форм, известно много паразитических, которые вызывают порой серьезные заболевания – протозоонозы.
Тело простейших состоит только из одной клетки. Форма тела простейших разнообразна. Оно может быть постоянным, иметь лучевую, двустороннюю симметрию (жгутиковые, инфузории) или вообще не иметь постоянной формы (амеба). Размеры тела простейших обычно малы – от 2-4 мк до 1,5 мм, хотя некоторые крупные особи достигают 5 мм в длину, а ископаемые раковинные корненожки имели в диаметре 3 см и более.
Тело простейших состоит из цитоплазмы и ядра. Цитоплазма ограничена наружной цитоплазматической мембраной, в ней находятся органоиды — митохондрии, рибосомы, эндо-плазматическая сеть, аппарат Гольджи. У простейших одно или несколько ядер. Форма деления ядра – митоз. Имеется также половой процесс. Он заключается в образовании зиготы. Органоиды движения простейших – это жгутики, реснички, ложноножки; или их нет совсем. Большинство простейших, как и все прочие представители животного царства, гетеротрофные. Однако среди них имеются и автотрофные.
У простейших одно или несколько ядер. Форма деления ядра – митоз. Имеется также половой процесс. Он заключается в образовании зиготы. Органоиды движения простейших – это жгутики, реснички, ложноножки; или их нет совсем. Большинство простейших, как и все прочие представители животного царства, гетеротрофные. Однако среди них имеются и автотрофные.
Особенность простейших переносить неблагоприятные условия окружающей среды – состоит в способности инцистироваться , т.е. образовывать цисту. При образовании цисты органоиды движения исчезают, объем животного уменьшается, оно приобретает округлую форму, клетка покрывается плотной оболочкой. Животное переходит в состояние покоя и при наступлении благоприятных условий возвращается к активной жизни.
Размножение простейших весьма разнообразно, от простого деления (бесполое размножение) до довольно сложного полового процесса – конъюгации и копуляции.
Среда обитания простейших разнообразна – это море, пресные воды, влажная почва.
Четыре основных класса простейших
1 – жгутиковые;
2 – саркодовые;
3 – споровики;
4 – инфузории.
1. Около 1000 видов, преимущественно с вытянутым овальным или грушевидном телом, составляют класс жгутиковых. Органеллы движения – жгутики, которых у различных представителей класса может быть от 1 до 8 и более. Жгутик – тонкий цитоплазматический вырост, состоящий из тончайших фибрилл. Своим основанием он прикреплен к базальному тельцу или кинетопласту . Жгутиковые движутся жгутом вперед, создавая своим движением вихревые водовороты и как бы «ввинчивая» животное в окружающую жидкую среду.
Способ питания : жгутиковых разделяют на имеющих хлорофилл и питающихся автотрофно, и на не имеющих хлорофилла и питающихся, как прочие животные, гетеротрофным способом. Гетеротрофы на передней стороне тела имеют особое углубление – цитостом , через который при движении жгутика пища вгоняется в пищеварительную вакуоль. Ряд форм жгутиковых питается осмотическим путем, всасывая всей поверхностью тела, растворенные органические вещества из окружающей среды.
Ряд форм жгутиковых питается осмотическим путем, всасывая всей поверхностью тела, растворенные органические вещества из окружающей среды.
2. Представители класса саркодовых, или корненожек, двигаются при помощи ложноножек – псевдоподий.
Класс включает разнообразных водных одноклеточных: амеб, солнечников, лучевиков. Среди амеб, кроме форм, не имеющих скелета или раковинки, встречаются виды, имеющие домик.
Большинство саркодовых являются обитателями морей, имеются также пресноводные, живущие в почве.
Саркодовые характеризуются непостоянной формой тела. Дыхание осуществляется всей его поверхностью. Питание – гетеротрофное. Размножение – бесполое, существует также половой процесс.
3. Представители класса Споровики характеризуются тем, что в цикле своего развития образуют стадию спор .Все споровики являются паразитами человека и животных. Они паразитируют в разных тканях и клетках. Лихорадка, малокровие, желтуха – типичные признаки заболевания споровиками.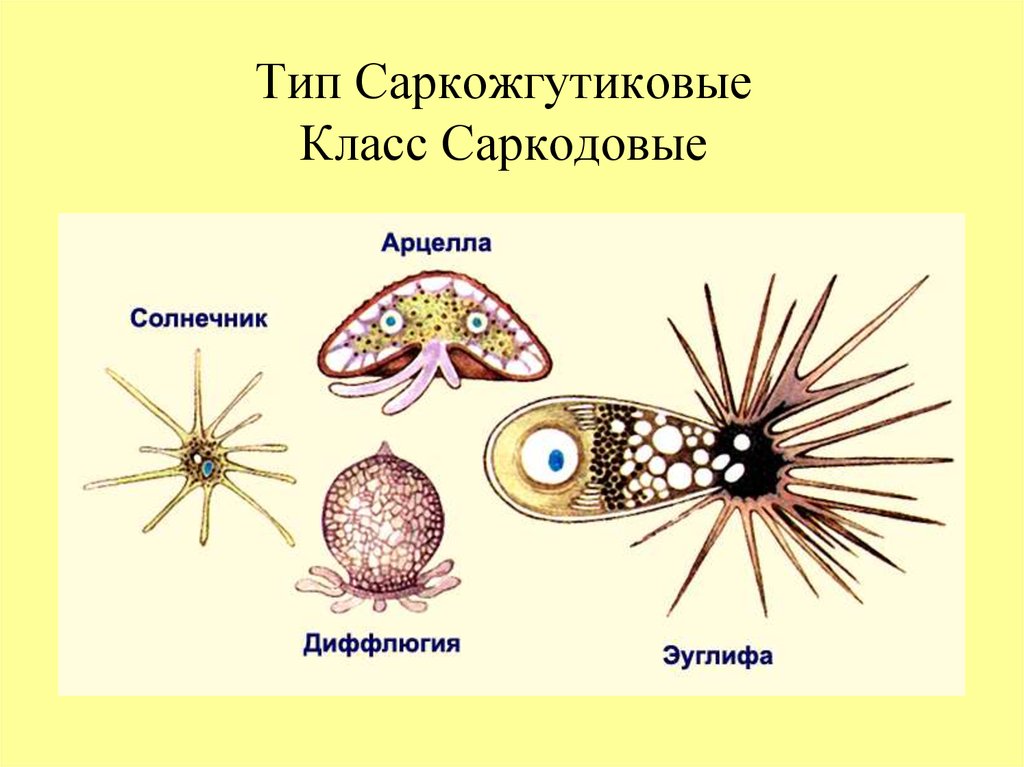 Пироплазмы, бабезии относятся к отряду кровяных споровиков, поражая эритроциты млекопитающих (коров, лошадей, собак и др. домашних животных). Переносчики болезней – клещи. Кроме кровяных есть еще два отряда споровиков — кокцидии и грегарины .
Пироплазмы, бабезии относятся к отряду кровяных споровиков, поражая эритроциты млекопитающих (коров, лошадей, собак и др. домашних животных). Переносчики болезней – клещи. Кроме кровяных есть еще два отряда споровиков — кокцидии и грегарины .
Кокцидии паразитируют как в беспозвоночных, так и в позвоночных животных – млекопитающих, рыбах, птицах. Кокцидия токсоплазмоз вызывает болезнь человека токсоплазмоз. Им можно заразиться от любого представителя семейства кошачьих.
Грегарины паразиты только беспозвоночных, в основном – насекомых и, как правило, поселяются в кишечнике. Взрослые грегарины внешне похожи на червей. Они бывают как мелкие (10 микрон), так и весьма крупные, видимые невооруженным глазом – до 1,6 мм.
4. Представители класса Инфузорий имеют органеллы передвижения – реснички, обычно в большом числе. Так, у инфузории-туфельки число ресничек более 2000. Реснички (как и жгутики) представляют собой специальные сложно устроенные цитоплазматические выросты. Тело инфузорий покрыто оболочкой, пронизанной мельчайшими порами, через которые выходят реснички.
Тело инфузорий покрыто оболочкой, пронизанной мельчайшими порами, через которые выходят реснички.
В тип инфузорий объединяют наиболее высоко организованных простейших. Они – вершина достижений, совершенных эволюцией в этом Подцарстве. Инфузории ведут свободно плавающий или прикрепленный образ жизни. Обитают как в пресных, так и в соленых водах. Среди инфузорий много симбионитов и мало паразитических форм.
Достаточно среди инфузорий и паразитов беспозвоночных и позвоночных животных (включая человека). Очень много паразитических в особом отделе желудка жвачных копытных – в рубце.
У всех инфузорий не менее двух ядер. Большое ядро регулирует все жизненные процессы. Маленькое ядро играет основную роль в половом процессе.
Пища в тело животного попадает через клеточный “рот”, куда она загоняется движением ресничек; на дне глотки образуются пищеварительные вакуоли . Непереваренные остатки выводятся наружу.
Простейшие-строители горных пород : Почти 600 миллионов лет назад произошла «скелетная революция».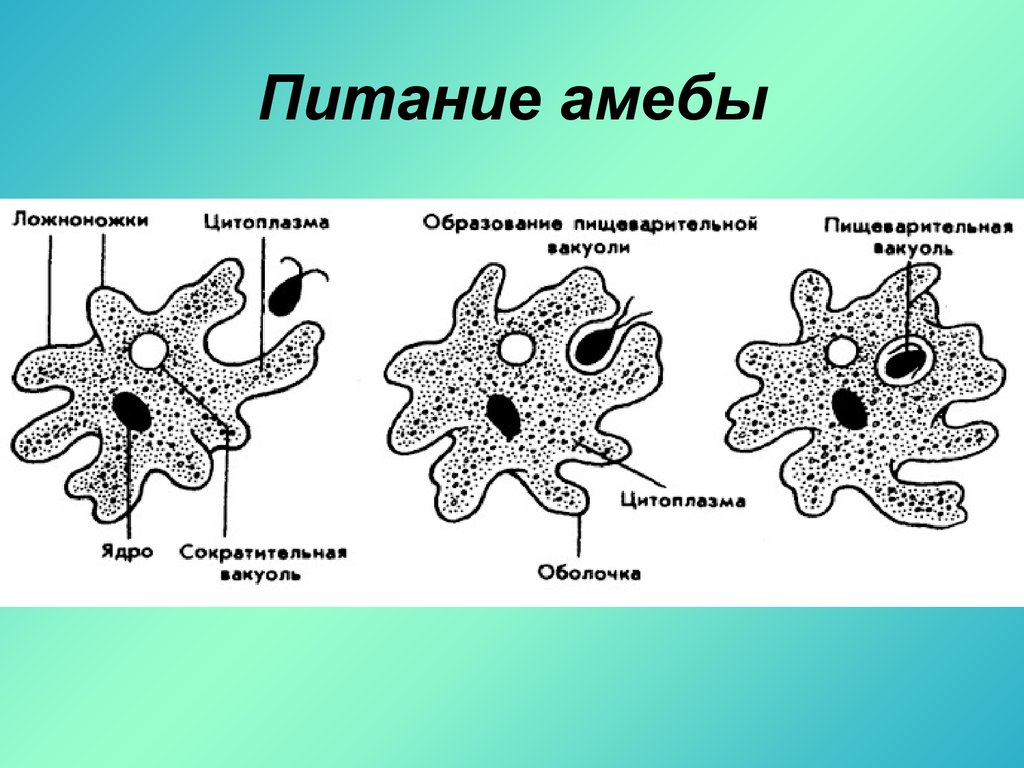 Большинство живых организмов «оделось» скелетами, защитивших их от врагов. С тех пор бесчисленное поколение простейших гибли, их раковины откладывались на дне морей, километровые толщи осадков спрессовались под собственной тяжестью, превращаясь в мел и известняк. Движение земной коры поднимали осадочные породы на поверхность, сооружая из них горы. Вода вымывала минеральные вещества обратно в море, где они снова использовались для построения раковин. Так, благодаря простейшим, совершался круговорот минеральных элементов в биосфере на протяжении её истории.
Большинство живых организмов «оделось» скелетами, защитивших их от врагов. С тех пор бесчисленное поколение простейших гибли, их раковины откладывались на дне морей, километровые толщи осадков спрессовались под собственной тяжестью, превращаясь в мел и известняк. Движение земной коры поднимали осадочные породы на поверхность, сооружая из них горы. Вода вымывала минеральные вещества обратно в море, где они снова использовались для построения раковин. Так, благодаря простейшим, совершался круговорот минеральных элементов в биосфере на протяжении её истории.
Простейшие-важное звено водных экосистем : Пищевые цепи в водных экосистемах начинают с микроскопических водорослей. Вторым звеном в них обычно являются планктонные простейшие – первые потребители зелёной продукции. Затем они становятся основой питания животноядных обитателей водных экосистем _ рачков, мальков рыб и всех последующих потребителей. Когда остатки мёртвых растений и животных, опускающих на дно, их подбирают донные простейшие.
Немало простейших населяет и каждой миллиметр почвы, насыщенной грунтовой влагой. Вместе с другими обитателями они поддерживают плодородие почв.
Без простейших не могут существовать растительноядные животные : Ирония судьбы: растительноядные животные сами не в состоянии переваривать целлюлозу (клетчатку) — основу растительных тканей! За них это делают простейшие, заселяющей их пищевой тракт с первых дней жизни. Кишечник термита, слепая кишка зайца и желудок коровы оборудованы специальными складами для размещения этих сожителей. Хозяин усваивает лишь результат их пищеварения, а заодно и самих простейших.
ПОДУМАЙТЕ!
Почему в современном животном мире одноклеточные животные являются многообразной и процветающей группой?
Одноклеточные животные освоили все среды жизни, они неприхотливы к условиям окружающей среды, имеют большую скорость размножения. Все эти преимущества позволили им стать многообразной и процветающей группой на Земле.
keepslide.com — Удивительные невидимки Учебный проект… | Facebook
Удивительные невидимки
Учебный проект ученика 7 класса Мишкина А.Руководитель: учитель биологии Валяева В.П.
Проблема:почему в процессе эволюции, примитивные одноклеточные животные не были вытеснены более высокоорганизованнымимногоклеточными животными.
Цель:выяснить благодаря каким чертам организации и особенностям жизнедеятельности простейшие остаются процветающей группой животных
Задачи:как внешние и внутренние особенности строения простейших связаны со средой обитаниякак размножаются простейшиекак переносят неблагоприятные условия
Систематика простейших
Простейшие
Тип Инфузории
Тип Споровики
Тип Саркожгутиконосцы
Саркодовые
Жгутиковые
Корненожки
Радиолярии
Солнечники
Все простейшие обитают во влажной среде, это может быть водоем, влажная почва, организм человека или животных
Среда обитания
.
Для жизни в воде у них имеются органоиды движения.
ложноножки
жгутики
реснички
Особенности строения и жизнедеятельностипростейших
Большинство простейших, как и другие представители царства Животные, по типу питания являются гетеротрофами.Некоторые имеют миксотрофный тип питания, например, эвглена зеленая на свету питается как растение,а в темноте как животное.Дышат простейшие всей поверхностью тела, поглощая кислород из воды; Выделение продуктов обмена веществ у простейших осуществляется с помощью сократительных вакуолей, важной функцией этих вакуолей является и удаление из клетки избытков воды.
Сократительнаявакуоль
Класс Корненожки
Амеба
ложноножка
ядро
сократительная вакуоль
пищеварительная вакуоль
Класс инфузории
Инфузория туфелька
Инфузория трубач
Инфузория — туфелька
Сувойка
Многообразие инфузорий
Класс жгутиконосцы
хлоропласты
светочувствительный глазок
ядро
сократительная вакуоль
Эвглена зеленая
Перенесение неблагоприятных условий
С наступлением неблагоприятных условий клетки простейших теряют воду, сжимаются, покрываются плотной оболочкой.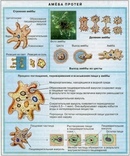 Образуется циста. В состоянии цисты простейшие могут долго сохранить свою жизнеспособность.
Образуется циста. В состоянии цисты простейшие могут долго сохранить свою жизнеспособность.
Выход амебы из цисты
Выжить в окружающей среде одноклеточным способствуют их маленькие размеры
Некоторые простейшие образуют раковину, выполняющую защитную функцию
Арцелла – в раковине блюдцеобразной формы.
Диффлюгия
Арцелла
РазмножениеПростейшим свойственно бесполое размножение. Сначала делится ядро, а затем цитоплазма. Из одной клетки получается две новые.
Спасибо за внимание!!!
Лямблия – паразитическое простейшее классаЖгутиковые. Встречается в тонком кишечнике человека.
Анализ развития корневища Oryza longistaminata, вида дикого риса | Физиология растений и клетки
Аннотация
Вегетативное размножение — это форма бесполого размножения растений. У широкого круга растений появляются корневища, модифицированные стебли, которые растут под землей горизонтально, как средство вегетативного размножения. У корневищных видов, несмотря на их различные модели развития, и корневища, и надземные побеги происходят из пазушных почек.Следовательно, представляет интерес понять основы зарождения и развития корневища. Oryza longistaminata , дикий вид риса, развивает корневища. Мы проанализировали зарождение почек и рост корневищ O. longistaminata , используя различные методы морфологического наблюдения. Мы показываем, что в отличие от почек надземных побегов, которые содержат только несколько листьев, почки корневища образуют несколько листьев и изгибаются, чтобы расти под прямым углом к исходному корневищу. Корневища сохраняются в ювенильной фазе независимо от фазы развития надземного побега.Удлинение стебля и репродуктивный переход тесно связаны в надземных побегах, но не связаны в корневище. Наши результаты показывают, что программы развития действуют независимо в корневищах и надземных побегах. Временная модификация путей развития, общих для корневищ и надземных побегов, может быть источником пластичности развития.
У корневищных видов, несмотря на их различные модели развития, и корневища, и надземные побеги происходят из пазушных почек.Следовательно, представляет интерес понять основы зарождения и развития корневища. Oryza longistaminata , дикий вид риса, развивает корневища. Мы проанализировали зарождение почек и рост корневищ O. longistaminata , используя различные методы морфологического наблюдения. Мы показываем, что в отличие от почек надземных побегов, которые содержат только несколько листьев, почки корневища образуют несколько листьев и изгибаются, чтобы расти под прямым углом к исходному корневищу. Корневища сохраняются в ювенильной фазе независимо от фазы развития надземного побега.Удлинение стебля и репродуктивный переход тесно связаны в надземных побегах, но не связаны в корневище. Наши результаты показывают, что программы развития действуют независимо в корневищах и надземных побегах. Временная модификация путей развития, общих для корневищ и надземных побегов, может быть источником пластичности развития.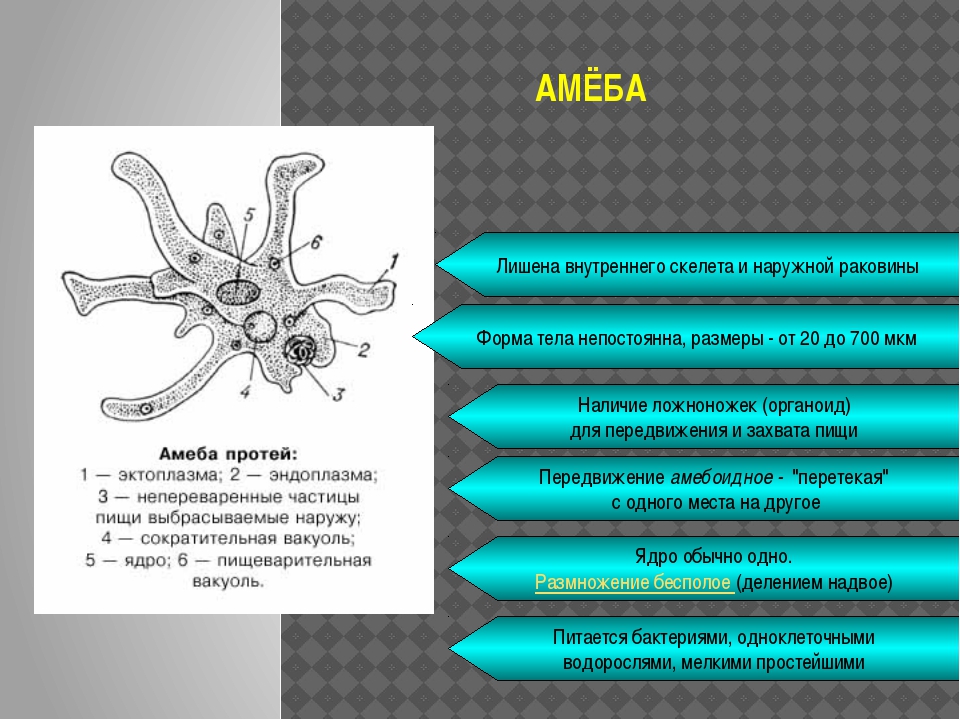 Более того, для развития корневища, по-видимому, необходимо создание новых систем развития.
Более того, для развития корневища, по-видимому, необходимо создание новых систем развития.
Введение
Корневища — это модифицированные стебли, которые растут горизонтально под землей.Из-за их большого преимущества для энергичного бесполого размножения корневища наблюдаются у различных видов многолетних растений (Wang et al. 2010, Navarro et al. 2011, Lee et al. 2013, Zhang et al. 2014, Yang et al. 2015). Один интересный аспект развития корневища состоит в том, что новые почки на корневищах могут расти под землей как новое корневище или появляться над землей и расти как надземный побег. Эта среда произрастания корневищных видов позволяет им быстро и широко расширять свою территорию. Более того, корневища могут выжить под землей, когда условия роста нежелательны, а побеги могут быстро прорасти, когда условия становятся подходящими для роста.Они также важны с точки зрения растениеводства. Корневища собирают как урожай картофеля, имбиря, лотоса и многих других культур (Navarro et al.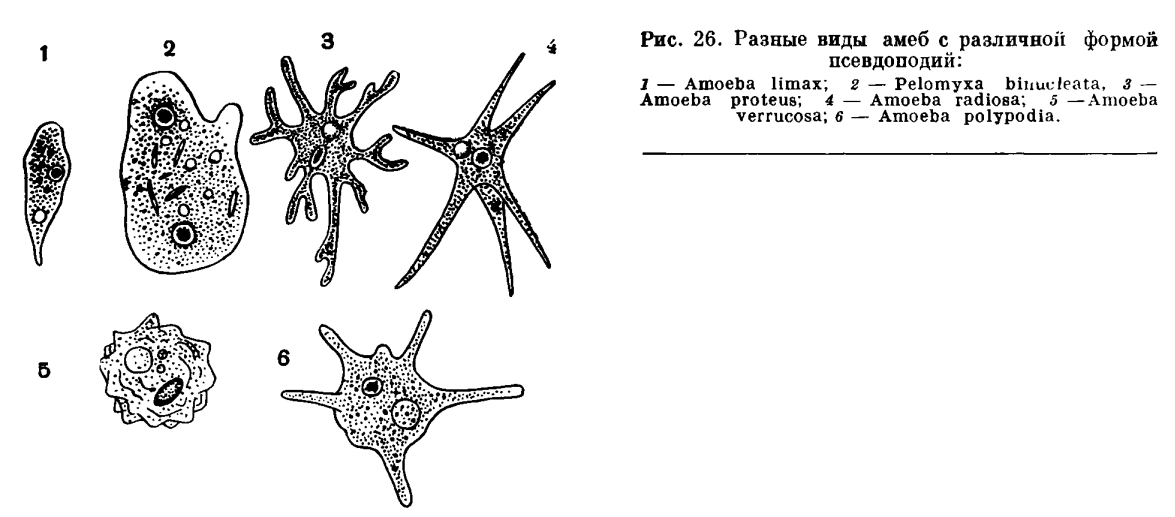 2011, Yang et al. 2015). С другой стороны, корневищные виды часто являются ядовитыми сорняками, вторгающимися в обширные регионы из-за их интенсивного роста (Hu et al. 2003, Yun et al. 2014).
2011, Yang et al. 2015). С другой стороны, корневищные виды часто являются ядовитыми сорняками, вторгающимися в обширные регионы из-за их интенсивного роста (Hu et al. 2003, Yun et al. 2014).
Морфогенез у растений длится всю жизнь. Новые стволовые клетки, образующиеся в пазухах листьев, образуют пазушную почку и растут как вторичные побеги. Повторяющееся образование пазушных почек и их рост определяют сложную структуру растений.Идентичность и характер роста каждой пазушной почки определяются в соответствии с внутренними и внешними сигналами. У корневищных видов почки корневища и надземные побеги образуются из пазушных почек. В противоположность прогрессу в нашем понимании молекулярных механизмов, лежащих в основе спецификации идентичности пазушных зачатков и детерминации роста, мало что известно об инициации и развитии корневых зачатков. Более того, неизвестно, как две отдельные системы, почки корневища и надземные пазушные почки регулируются у одного растения.
Ряд регионов локусов количественных признаков (QTL), ответственных за развитие корневищ или связанных с ними, был зарегистрирован у нескольких видов корневищ (Jang et al.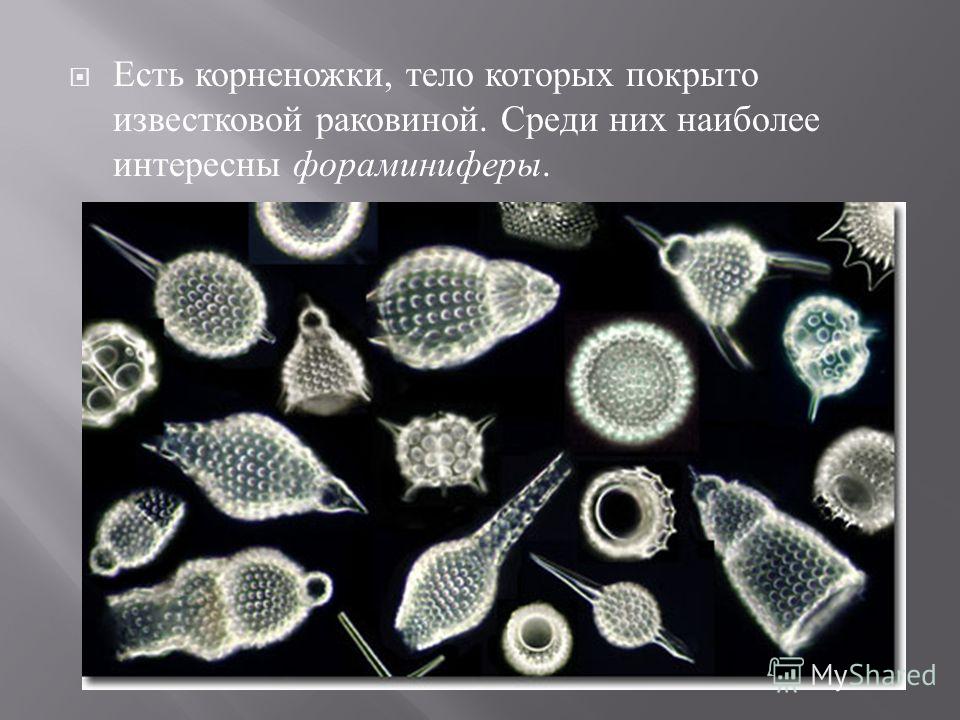 2006, Washburn et al. 2013, Yun et al. 2014). Более того, крупномасштабные анализы, такие как анализ транскриптома и анализ протеома, были выполнены у корневищных видов (Hu et al. 2011, Barbier et al. 2015, Teichmann and Muhr 2015). Хотя эти исследования внесли значительный вклад в улучшение нашего понимания развития корневища на молекулярном уровне, об изоляции генов, критических для развития корневища, не сообщалось.Сложность паттернов развития у корневищных видов может быть препятствием при анализе развития корневища. Кроме того, низкая плодовитость семян у корневищных видов, которые эволюционировали для бесполого размножения, препятствует применению генетических подходов. Кроме того, отсутствие модельных видов корневищ является серьезной проблемой для молекулярно-генетического анализа развития корневища.
2006, Washburn et al. 2013, Yun et al. 2014). Более того, крупномасштабные анализы, такие как анализ транскриптома и анализ протеома, были выполнены у корневищных видов (Hu et al. 2011, Barbier et al. 2015, Teichmann and Muhr 2015). Хотя эти исследования внесли значительный вклад в улучшение нашего понимания развития корневища на молекулярном уровне, об изоляции генов, критических для развития корневища, не сообщалось.Сложность паттернов развития у корневищных видов может быть препятствием при анализе развития корневища. Кроме того, низкая плодовитость семян у корневищных видов, которые эволюционировали для бесполого размножения, препятствует применению генетических подходов. Кроме того, отсутствие модельных видов корневищ является серьезной проблемой для молекулярно-генетического анализа развития корневища.
Oryza longistaminata , дикий вид риса, возникший в средней Африке, развивает корневища и активно размножается. Oryza longistaminata , содержащий геном AA, который совпадает с геномом Oryza sativa , может быть скрещен с O.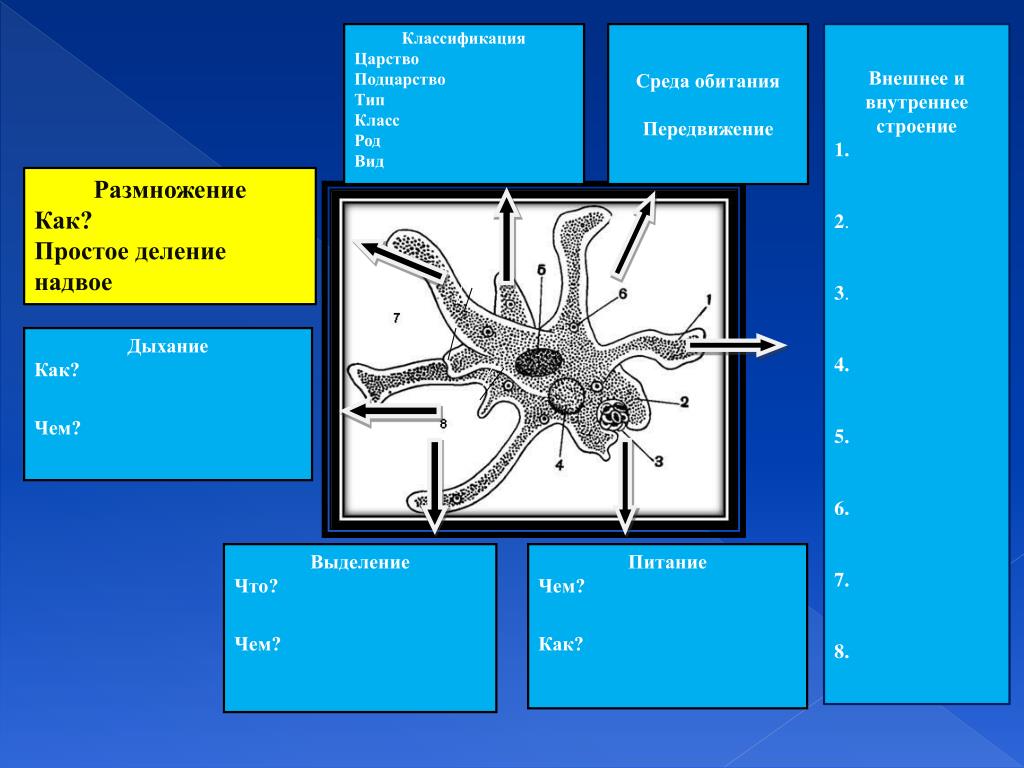 sativa и завязать плодородные семена, и поэтому считается одним из идеальных материалов для изучения механизмов контроля развитие корневища у видов трав (He et al. 2014). В этом исследовании мы провели подробное наблюдение за морфологией, ростом и развитием корневища. Наши находки показывают, что общие модули развития используются как в корневище, так и в надземном побеге, но модификация временной регуляции модулей может быть источником пластичности развития, наблюдаемой в корневище.Кроме того, мы демонстрируем, что инновации новых систем развития были приняты, чтобы установить процесс развития корневища.
sativa и завязать плодородные семена, и поэтому считается одним из идеальных материалов для изучения механизмов контроля развитие корневища у видов трав (He et al. 2014). В этом исследовании мы провели подробное наблюдение за морфологией, ростом и развитием корневища. Наши находки показывают, что общие модули развития используются как в корневище, так и в надземном побеге, но модификация временной регуляции модулей может быть источником пластичности развития, наблюдаемой в корневище.Кроме того, мы демонстрируем, что инновации новых систем развития были приняты, чтобы установить процесс развития корневища.
Результаты
Корневища удлиняются во время вегетативной фазы
Oryza longistaminata развивает корневища под землей и демонстрирует типичный рисунок роста риса на уровне земли (рис. 1а). В данном исследовании надземный побег и стебель O. longistaminata названы соответственно воздушным побегом и воздушным стеблем, а подземный стебель — корневищем. И воздушный стебель, и корневище образовывали пазушную почку в каждом узле (рис. 1б). Пазушная почка на надземном стебле O. longistaminata вырастает в виде надземного побега, называемого побегом, который на вегетативной стадии постоянно образует листья. Воздушный стебель не показал значительного удлинения во время вегетативной фазы, а удлинение произошло после перехода в репродуктивную фазу, когда образовалась метелка, как в случае O. sativa (рис. 1в, г). Пазушные почки на корневище выросли, образуя новое корневище.В отличие от надземного стебля корневище удлинялось, когда надземные побеги находились на вегетативной стадии (рис. 1б). Это указывает на то, что воздушное удлинение стебля и удлинение корневища контролируются независимо, т.е. в одном растении из O. longistaminata действуют две системы удлинения стебля — система, зависимая от фазы развития, и система, независимая от фазы развития. Гибберелловая кислота является решающим фактором удлинения стебля (Kusaba et al.
И воздушный стебель, и корневище образовывали пазушную почку в каждом узле (рис. 1б). Пазушная почка на надземном стебле O. longistaminata вырастает в виде надземного побега, называемого побегом, который на вегетативной стадии постоянно образует листья. Воздушный стебель не показал значительного удлинения во время вегетативной фазы, а удлинение произошло после перехода в репродуктивную фазу, когда образовалась метелка, как в случае O. sativa (рис. 1в, г). Пазушные почки на корневище выросли, образуя новое корневище.В отличие от надземного стебля корневище удлинялось, когда надземные побеги находились на вегетативной стадии (рис. 1б). Это указывает на то, что воздушное удлинение стебля и удлинение корневища контролируются независимо, т.е. в одном растении из O. longistaminata действуют две системы удлинения стебля — система, зависимая от фазы развития, и система, независимая от фазы развития. Гибберелловая кислота является решающим фактором удлинения стебля (Kusaba et al. 1998, Carrera et al. 2000, Magome et al.2013). В частности, для быстрого удлинения стебля перед колошением риса необходимо накопление активных гиббереллинов, таких как GA 4 и GA 1 , продуцируемых GA20-оксидазой (GA20ox) (Magome et al. 2013). Мы проанализировали экспрессию трех генов GA20ox в O. longistaminata. Как описано ранее, экспрессия GA20ox1 и GA20ox2 была низкой в неразвитом стебле во время вегетативной фазы и увеличивалась после перехода в репродуктивную фазу в O.sativa (рис. 1д, е). В надземном стебле O. longistaminata экспрессия GA20ox1 и GA20ox2 также была низкой в вегетативной фазе и увеличивалась в репродуктивной фазе (рис. 1g, h). Экспрессия GA20ox1 в корневище была низкой. в то время как GA20ox2 сильно экспрессируется в корневищах, независимо от стадии развития (Fig. 1h). Мы не обнаружили значительной экспрессии гена GA20ox3 у O.
1998, Carrera et al. 2000, Magome et al.2013). В частности, для быстрого удлинения стебля перед колошением риса необходимо накопление активных гиббереллинов, таких как GA 4 и GA 1 , продуцируемых GA20-оксидазой (GA20ox) (Magome et al. 2013). Мы проанализировали экспрессию трех генов GA20ox в O. longistaminata. Как описано ранее, экспрессия GA20ox1 и GA20ox2 была низкой в неразвитом стебле во время вегетативной фазы и увеличивалась после перехода в репродуктивную фазу в O.sativa (рис. 1д, е). В надземном стебле O. longistaminata экспрессия GA20ox1 и GA20ox2 также была низкой в вегетативной фазе и увеличивалась в репродуктивной фазе (рис. 1g, h). Экспрессия GA20ox1 в корневище была низкой. в то время как GA20ox2 сильно экспрессируется в корневищах, независимо от стадии развития (Fig. 1h). Мы не обнаружили значительной экспрессии гена GA20ox3 у O. sativa и O.longistaminata (данные не представлены).
sativa и O.longistaminata (данные не представлены).
Рис. 1
Морфология и развитие O. longistaminata. (а) Побеги и корневища O. longistaminata. Корневища растут под землей, а побеги растут над землей. Пунктирная линия указывает на поверхность земли. Почву удалили. Масштабная линейка = 10 см. (б) Пазушные почки на корневищах и надземных побегах. Пазушная почка (стрелка) формируется на узле корневища, имеющем несколько узлов. Первые несколько бутонов на надземном побеге похожи на почки корневища (правая панель).Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Стрельба из апикальных меристем (SAM) побегов O. sativa (c) и O. longistaminata (d). SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O.sativa (д, е) и О. longistaminata (г, з). Значения представлены относительно уровня экспрессии в стебле ( O. sativa ) и надземном стебле ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
(e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O.sativa (д, е) и О. longistaminata (г, з). Значения представлены относительно уровня экспрессии в стебле ( O. sativa ) и надземном стебле ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Рис. 1
Морфология и развитие O. longistaminata. (а) Побеги и корневища O.longistaminata. Корневища растут под землей, а побеги растут над землей. Пунктирная линия указывает на поверхность земли. Почву удалили. Масштабная линейка = 10 см. (б) Пазушные почки на корневищах и надземных побегах. Пазушная почка (стрелка) формируется на узле корневища, имеющем несколько узлов. Первые несколько бутонов на надземном побеге похожи на почки корневища (правая панель). Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Апикальные меристемы побегов (SAM) O.sativa (в) и O. longistaminata (г) побеги. SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O. sativa (e, f) и O. longistaminata (g, h). Значения представлены относительно уровня экспрессии в стебле ( O.sativa ) и надземный стебель ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Апикальные меристемы побегов (SAM) O.sativa (в) и O. longistaminata (г) побеги. SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O. sativa (e, f) и O. longistaminata (g, h). Значения представлены относительно уровня экспрессии в стебле ( O.sativa ) и надземный стебель ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Почки корневища быстро меняют направление после зарождения
Морфология пазушных почек на корневищах сходна с таковыми на молодых надземных стеблях (рис.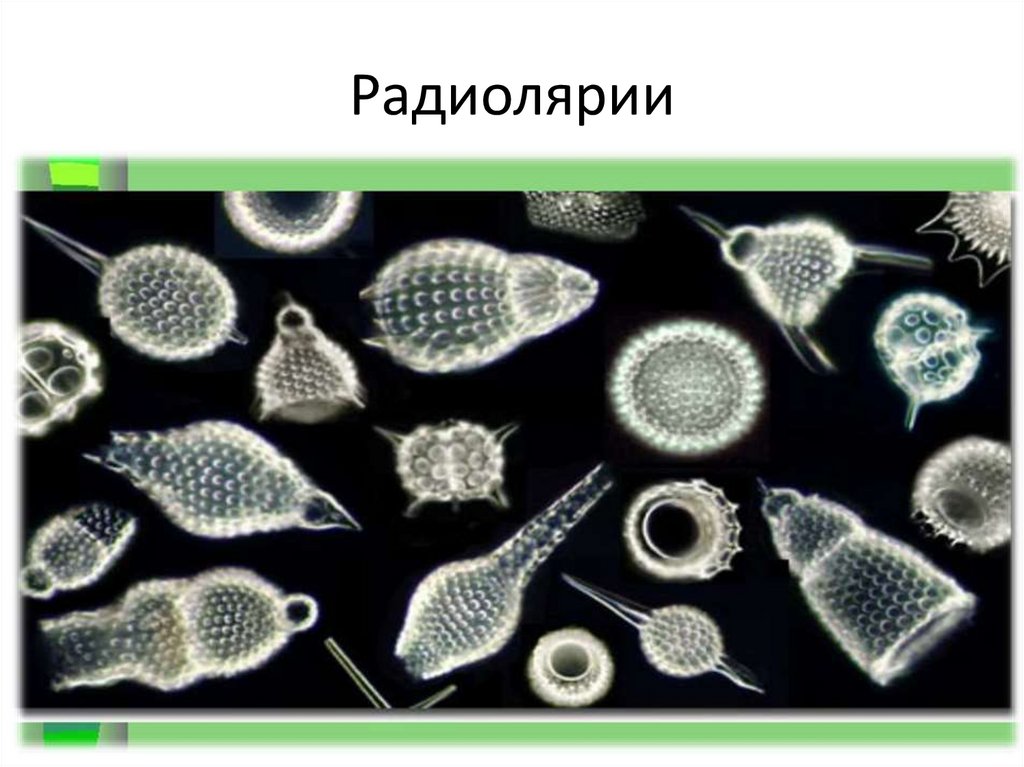 2а, б). Они маленькие, плоские и прикрепляются к надземному стеблю или корневищу.Уникальная морфология почек корневища становится очевидной вскоре после начала роста почек (рис. 2c). Перед удлинением пазушные почки на корневище стали более округлыми, чем на надземном стебле (Fig. 2c; Supplementary Fig. S1c – e). Подмышечные почки на корневище затем увеличиваются в размерах и становятся более объемными в начале роста (рис. 2d). Кроме того, изменился угол наклона зачатка корневища, что сопровождалось выходом кончика зачатка из его центра (рис. 2г). Затем почки выросли под прямым углом к исходному корневищу и удлинились (рис.2д). Более детальное изучение ранних стадий разрастания почек корневища показало, что в почках быстро увеличивалось количество листьев при изменении угла наклона (рис. 2f – k, 3).
2а, б). Они маленькие, плоские и прикрепляются к надземному стеблю или корневищу.Уникальная морфология почек корневища становится очевидной вскоре после начала роста почек (рис. 2c). Перед удлинением пазушные почки на корневище стали более округлыми, чем на надземном стебле (Fig. 2c; Supplementary Fig. S1c – e). Подмышечные почки на корневище затем увеличиваются в размерах и становятся более объемными в начале роста (рис. 2d). Кроме того, изменился угол наклона зачатка корневища, что сопровождалось выходом кончика зачатка из его центра (рис. 2г). Затем почки выросли под прямым углом к исходному корневищу и удлинились (рис.2д). Более детальное изучение ранних стадий разрастания почек корневища показало, что в почках быстро увеличивалось количество листьев при изменении угла наклона (рис. 2f – k, 3).
Рис. 2
Характеристика почек корневища у O. longistaminata. (а – д) Пазушные почки на надземном побеге (а) и корневище (б – д). Пазушная почка на корневище похожа на почку на надземном побеге, когда они зарождаются (b), затем она становится более округлой (c), увеличивается в размерах и начинает расти (d) и удлиняться (e).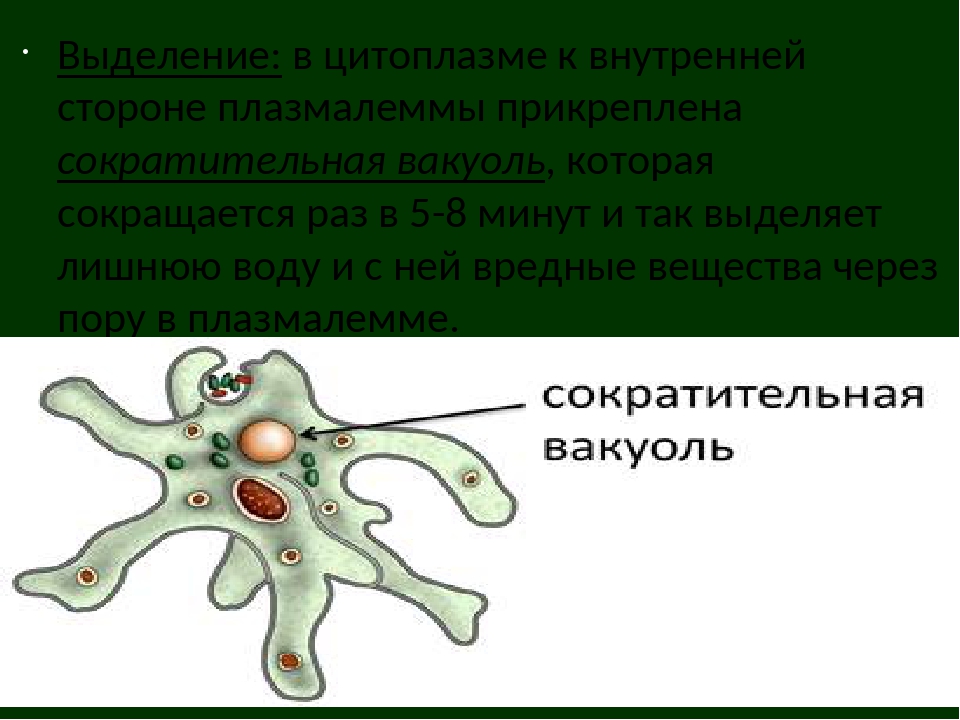 Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Рис. 2
Характеристика почек корневища у O. longistaminata. (а – д) Пазушные почки на надземном побеге (а) и корневище (б – д). Пазушная почка на корневище похожа на почку на надземном побеге, когда они зарождаются (b), затем она становится более округлой (c), увеличивается в размерах и начинает расти (d) и удлиняться (e).Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Масштабные линейки = 200 мкм.
Рис. 3
Зарождение пазушных почек на корневище. (a – e) Изображения пазушных зачатков на стебле (a) и корневище (b – e), полученные с помощью сканирующего электронного микроскопа.Масштабные линейки = 100 мкм. (е) Корреляция между количеством листьев в бутоне и углом наклона бутона. Желтыми и зелеными точками обозначены бутоны на корневищах и надземных побегах соответственно.
Рис. 3
Зарождение пазушных почек на корневище. (a – e) Изображения пазушных зачатков на стебле (a) и корневище (b – e), полученные с помощью сканирующего электронного микроскопа. Масштабные линейки = 100 мкм. (е) Корреляция между количеством листьев в бутоне и углом наклона бутона. Желтыми и зелеными точками обозначены бутоны на корневищах и надземных побегах соответственно.
Чтобы подтвердить, что эти процессы, которые наблюдались в разных почках, происходят последовательно в одной почке, мы наблюдали развитие одной почки с помощью техники магнитно-резонансной томографии (МРТ) (Moriwaki et al . 2014). В этом эксперименте кусок корневища, содержащий почку, вырезали и инкубировали в стеклянной пробирке в магнитном поле и непрерывно наблюдали в течение> 65 часов. Это показало, что бутон начинает изгибаться сразу после начала роста бутона.Быстрое увеличение количества листьев и увеличение размера всей почки происходило одновременно с изменением угла наклона почки (Рис. 4a – g; Дополнительный Рис. S1; Дополнительные Видео S1, S2). Интересно, что когда корневище было вырезано и выращено в условиях освещения, корневище стало зеленым, а почки на корневище выросли как новые воздушные побеги (рис. 5a, b). Напротив, некоторые почки на надземных побегах, прилегающих к границе между надземным побегом и корневищем, выросли как новые корневища, когда они содержались в темноте (рис.5в, г).
2014). В этом эксперименте кусок корневища, содержащий почку, вырезали и инкубировали в стеклянной пробирке в магнитном поле и непрерывно наблюдали в течение> 65 часов. Это показало, что бутон начинает изгибаться сразу после начала роста бутона.Быстрое увеличение количества листьев и увеличение размера всей почки происходило одновременно с изменением угла наклона почки (Рис. 4a – g; Дополнительный Рис. S1; Дополнительные Видео S1, S2). Интересно, что когда корневище было вырезано и выращено в условиях освещения, корневище стало зеленым, а почки на корневище выросли как новые воздушные побеги (рис. 5a, b). Напротив, некоторые почки на надземных побегах, прилегающих к границе между надземным побегом и корневищем, выросли как новые корневища, когда они содержались в темноте (рис.5в, г).
Рис. 4
Последовательная магнитно-резонансная томография (МРТ) развивающейся подмышечной зачатка. Область, обозначенная пунктирной линией на (a), показана на (b – g). Стрелки в (а) и (б) указывают бутон. Цифры указывают время инкубации. Размеры пикселей составляли 50 × 50 × 10 мкм 3 для (a) и (b) и 25 × 25 × 100 мкм 3 для (c – g), соответственно. Масштабная линейка = 1 мм. Подробные изображения МРТ доступны на дополнительном рис.S1, видео S1 и дополнительные данные.
Рис. 4
Последовательная магнитно-резонансная томография (МРТ) развивающейся подмышечной зачатка. Область, обозначенная пунктирной линией на (a), показана на (b – g). Стрелки в (а) и (б) указывают бутон. Цифры указывают время инкубации. Размеры пикселей составляли 50 × 50 × 10 мкм 3 для (a) и (b) и 25 × 25 × 100 мкм 3 для (c – g), соответственно. Масштабная линейка = 1 мм. Подробные изображения МРТ доступны на дополнительном рис.S1, видео S1 и дополнительные данные.
Рис. 5
Легкая зависимость роста почек корневища. (а, б) Участок корневища, содержащий пазушные почки и корни, выращенный в условиях освещения. Белыми стрелками обозначены пазушные почки. Когда сегмент корневища выращивали в световых условиях в течение 2 недель, пазушные почки выросли в виде новых воздушных побегов, а стебель корневища стал зеленым, напоминая воздушный стебель. Масштабная линейка = 5 см. (c, d) Отрезок корневища, содержащий пазушные почки и корни, выросшие в темноте.Когда почка выращивалась в темноте в течение 2 дней, пазушная почка расширилась, стала новым корневищем и стала белой, напоминая корневище. Масштабная линейка = 1 см.
Рис. 5
Легкая зависимость роста почек корневища. (а, б) Участок корневища, содержащий пазушные почки и корни, выращенный в условиях освещения. Белыми стрелками обозначены пазушные почки. Когда сегмент корневища выращивали в световых условиях в течение 2 недель, пазушные почки выросли в виде новых воздушных побегов, а стебель корневища стал зеленым, напоминая воздушный стебель.Масштабная линейка = 5 см. (c, d) Отрезок корневища, содержащий пазушные почки и корни, выросшие в темноте. Когда почка выращивалась в темноте в течение 2 дней, пазушная почка расширилась, стала новым корневищем и стала белой, напоминая корневище. Масштабная линейка = 1 см.
Корневища сохраняются в ювенильной фазе
Морфология листьев, переходящих в почки корневища, отличается от морфологии листьев надземных побегов. Листья травяных видов состоят из двух частей: пластинки, сформированной в дистальном положении, и влагалища, сформированного в проксимальном положении (рис.6а). Отношение листовой пластинки к листовой оболочке изменяется в зависимости от стадии развития и, таким образом, используется как индикатор фазы роста во время вегетативной фазы (рис. 6b). Первый лист риса ( O. sativa ) состоит только из листовой оболочки. Листовая пластинка наблюдается со второго листа (рис. 6б). С третьего листа листовая пластинка занимает почти половину всего листа. Листья на корневище, называемые чешуйчатыми, мелкие и рудиментарные (рис. 6в). Чешуйчатые листья в основном состоят из листового влагалища, напоминающего первый лист O.sativa (рис. 7a – f; дополнительный рис. S2). Эти наблюдения показывают, что корневище сохраняется в ювенильной фазе. Когда почки на корневище появляются над землей и начинают расти как надземные побеги, соотношение лезвия к влагалищу во вновь зародившихся листьях постепенно увеличивается, указывая на фазовый переход в развитии (рис. 6d, e). В пазушных почках O. sativa листовая пластинка дифференцируется в инициирующих зачатках листьев на стадиях P3 – P4 (рис. 6f). Напротив, несколько листовых зачатков дифференцировались в пазушную почку на корневище, и никаких признаков дифференцировки пластинок обнаружено не было (рис.6г).
Рис. 6
Характеристика листьев корневища. (а) Саженец O. sativa. Показаны первая (1) и вторая (2) створки. Первый лист состоит только из листового влагалища. Второй лист состоит из листового влагалища (желтого) и листовой пластинки (белого цвета) в проксимальном и дистальном положениях. Масштабная линейка = 1 см. (б) Первые четыре листа O. sativa. Оболочка и пластинка показаны желтыми и белыми линиями соответственно.(c) Чешуйчатые листья на корневище O. longistaminata. На вставке показано увеличенное изображение кончика шкалы. Lb — листовая пластинка; Ls, листовая оболочка. Масштабная линейка = 1 см. (г) Первые пять листьев надземного побега O. longistaminata . Оболочка листа и пластинка листа обозначены желтыми и белыми линиями соответственно. Ранние листья содержат только листовое влагалище. Более поздние листья (четвертый и пятый) содержат листовую пластинку. Цифры указывают порядок листьев. Масштабная линейка = 1 см.(e) Соотношение влагалища и пластинки листа. Показано отношение длины полотна к общей длине полотна. Планки погрешностей показывают стандартное отклонение трех репликаций. Os, Oryza sativa ; Ol, Oryza longistaminata. (е, ж) Продольные срезы пазушных почек надземного отростка (е) и корневища (г) O. longistaminata. P1 – P6 указывают на относительную стадию роста зачатков листа. P1 — самый молодой зачаток. В надземном побеге границу между листовой пластинкой и влагалищем можно наблюдать на листе стадии P3 (звездочка).Почка корневища содержит несколько листьев, состоящих из листовых влагалищ (g). Масштабные линейки = 100 мкм.
Рис. 6
Характеристика листьев корневища. (а) Саженец O. sativa. Показаны первая (1) и вторая (2) створки. Первый лист состоит только из листового влагалища. Второй лист состоит из листового влагалища (желтого) и листовой пластинки (белого цвета) в проксимальном и дистальном положениях. Масштабная линейка = 1 см. (б) Первые четыре листа O. sativa. Оболочка и пластинка показаны желтыми и белыми линиями соответственно.(c) Чешуйчатые листья на корневище O. longistaminata. На вставке показано увеличенное изображение кончика шкалы. Lb — листовая пластинка; Ls, листовая оболочка. Масштабная линейка = 1 см. (г) Первые пять листьев надземного побега O. longistaminata . Оболочка листа и пластинка листа обозначены желтыми и белыми линиями соответственно. Ранние листья содержат только листовое влагалище. Более поздние листья (четвертый и пятый) содержат листовую пластинку. Цифры указывают порядок листьев. Масштабная линейка = 1 см.(e) Соотношение влагалища и пластинки листа. Показано отношение длины полотна к общей длине полотна. Планки погрешностей показывают стандартное отклонение трех репликаций. Os, Oryza sativa ; Ol, Oryza longistaminata. (е, ж) Продольные срезы пазушных почек надземного отростка (е) и корневища (г) O. longistaminata. P1 – P6 указывают на относительную стадию роста зачатков листа. P1 — самый молодой зачаток. В надземном побеге границу между листовой пластинкой и влагалищем можно наблюдать на листе стадии P3 (звездочка).Почка корневища содержит несколько листьев, состоящих из листовых влагалищ (g). Масштабные линейки = 100 мкм.
Рис. 7
Морфология эпидермиса чешуйчатых листьев на корневище. (a – d) Адаксиальный эпидермис. (e – h) Абаксиальный эпидермис. Эпидермис чешуйчатых листьев O. longistaminata (а, д), влагалища первого листа O. sativa (б, е), влагалища второго листа O. sativa (в, г ) и листовой пластинки второго листа О.sativa (д, з). Эпидермальные клетки чешуйчатых листьев не похожи на клетки листовых пластинок, но похожи на клетки влагалища листьев O. sativa. Шкала шкалы = 100 мкм.
Рис. 7
Морфология эпидермиса чешуйчатых листьев на корневище. (a – d) Адаксиальный эпидермис. (e – h) Абаксиальный эпидермис. Эпидермис чешуйчатых листьев O. longistaminata (а, д), влагалища первого листа O. sativa (б, е), влагалища второго листа O. sativa (в, г ) и листовой пластинки второго листа О.sativa (д, з). Эпидермальные клетки чешуйчатых листьев не похожи на клетки листовых пластинок, но похожи на клетки влагалища листьев O. sativa. Шкала шкалы = 100 мкм.
Фаза развития контролируется независимо под землей и над землей
Переход к репродуктивной фазе у O. longistaminata вызван воздействием коротких дней. На верхушке каждого надземного побега образуется метелка, как у побегов O.sativa (рис. 8а, б). Примечательно, что в то время как фазовый переход развития происходил в надземных побегах, фаза развития корневищ сохранялась на вегетативной стадии (Рис. 8c-e). Когда листья удаляли с надземного побега перед колошением, на верхушке не удлиненного стебля наблюдали зарождающееся соцветие (рис. 8d). Напротив, апикальная меристема побега (SAM) на вершине корневища сохранялась на вегетативной стадии (рис. 8e). Чтобы дополнительно подтвердить, что фаза корневища вегетативная, мы использовали PANICLE PHYTOMER2 ( PAP2 ) в качестве молекулярного маркера репродуктивной фазы. PAP2 , кодирующий OsMADS34, является одним из самых ранних генов, индуцированных в SAM после фазового перехода (Kobayashi et al. 2010, Kobayashi et al. 2012). PAP2 экспрессируется в верхушке побега надземного побега после перехода, тогда как PAP2 не обнаруживается в вершине побега корневища (рис. 8f). Затем мы исследовали экспрессию Hd3a , ортолога риса Arabidopis FT , кодирующего флориген (Tamaki et al. 2007, Taoka et al. 2011). Hd3a Экспрессия не обнаруживалась в листовой пластинке и листовой оболочке надземного побега, а также в чешуйчатом листе корневища на вегетативной стадии (рис.8г). После перехода к репродуктивной стадии экспрессия Hd3a обнаруживается в листовой пластинке, но не в оболочке листа у надземных побегов, как сообщалось ранее (Tamaki et al. 2007). В чешуйчатом листе экспрессия Hd3a также не определялась.
Рис. 8
Oryza longistaminata Растение в репродуктивной стадии. (а, б) Фенотипы побегов основной колонны O. sativa (а) и O. longistaminata (б) на репродуктивной стадии после колошения.Стебель удлиняется после перехода, и на его вершине образуется метелка (P) у O. sativa и O. longistaminata. Звездочки обозначают узлы. П, метелка. Масштабная линейка = 5 см. (c) Увеличенное изображение области, обведенной квадратом на (b). После цветения образуется несколько корневищ. Звезды, узлы; наконечники стрел, корневище или удлиненные почки корневища. Масштабная линейка = 5 см. (d, e) Выстрелите верхушки надземного побега (d) и корневища (e). Дифференциация метелки начинается на вершине надземного стебля, в то время как SAM сохраняется на вегетативной стадии на вершине корневища.IM — меристема соцветия; ВМ, вегетативная меристема. Масштабная линейка = 1 мм. (f) Уровни экспрессии PAP2. Уровни экспрессии PAP2 в пластинках листьев (Lb) O. longistaminata , в SAM на репродуктивной фазе и в SAM корневища. PAP2 экспрессируется относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (g) Уровни экспрессии Hd3a. Уровни экспрессии Hd3a в листовых пластинах (Lb), оболочках листьев (Ls) и чешуйчатых листьях (Sl) из O.longistaminata в вегетативной фазе (veg) и репродуктивной фазе (rep). Hd3a Экспрессия выражена относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (з) Схема роста побегов у O. sativa (слева) и O. longistaminata (справа). У O. sativa листья с высоким соотношением листовой оболочки к листовой пластинке образуются во время фазы молоди, которая является относительно короткой. SAM развивается в метелку, а стебель удлиняется после перехода в репродуктивную фазу.Характер роста надземной части O. longistaminata аналогичен таковому у O. sativa. С другой стороны, корневища, растущие под землей, демонстрируют уникальный характер роста. Фаза развития корневища сохраняется на ранней ювенильной фазе, а апикальная меристема корневища сохраняется как вегетативная меристема, в то время как корневище удлиняется, независимо от фазы развития надземных частей. Почки корневища дают несколько листовых зачатков, увеличиваясь в размерах и меняя угол наклона.
Рис. 8
Oryza longistaminata Растение в репродуктивной стадии. (а, б) Фенотипы побегов основной колонны O. sativa (а) и O. longistaminata (б) на репродуктивной стадии после колошения. Стебель удлиняется после перехода, и на его вершине образуется метелка (P) у O. sativa и O. longistaminata. Звездочки обозначают узлы. П, метелка. Масштабная линейка = 5 см. (c) Увеличенное изображение области, обведенной квадратом на (b).После цветения образуется несколько корневищ. Звезды, узлы; наконечники стрел, корневище или удлиненные почки корневища. Масштабная линейка = 5 см. (d, e) Выстрелите верхушки надземного побега (d) и корневища (e). Дифференциация метелки начинается на вершине надземного стебля, в то время как SAM сохраняется на вегетативной стадии на вершине корневища. IM — меристема соцветия; ВМ, вегетативная меристема. Масштабная линейка = 1 мм. (f) Уровни экспрессии PAP2. Уровни экспрессии PAP2 в пластинках листьев (фунты) O.longistaminata , в SAM на репродуктивной фазе и в SAM корневища. PAP2 экспрессируется относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (g) Уровни экспрессии Hd3a. Уровни экспрессии Hd3a в листовых пластинах (Lb), оболочках листьев (Ls) и чешуйчатых листьях (Sl) O. longistaminata на вегетативной фазе (veg) и репродуктивной фазе (rep). Hd3a Экспрессия выражена относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (з) Схема роста побегов у O. sativa (слева) и O. longistaminata (справа). У O. sativa листья с высоким соотношением листовой оболочки к листовой пластинке образуются во время фазы молоди, которая является относительно короткой. SAM развивается в метелку, а стебель удлиняется после перехода в репродуктивную фазу. Характер роста надземной части O. longistaminata аналогичен таковому у O.сатива. С другой стороны, корневища, растущие под землей, демонстрируют уникальный характер роста. Фаза развития корневища сохраняется на ранней ювенильной фазе, а апикальная меристема корневища сохраняется как вегетативная меристема, в то время как корневище удлиняется, независимо от фазы развития надземных частей. Почки корневища дают несколько листовых зачатков, увеличиваясь в размерах и меняя угол наклона.
Обсуждение
Время развития имеет решающее значение для всех организмов в формировании архитектуры своего тела (Geuten et al . 2013). Модуляция времени развития часто работает как сильная движущая сила для создания морфологической пластичности и эволюции. Наш анализ показывает, что временной сдвиг в процессах развития критически важен для создания сложной модели развития O. longistaminata . Мы предполагаем, что гетерохронная модификация процессов развития является ключом к созданию уникальной системы развития корневища.
Наши результаты ясно показывают, что время развития регулируется независимо между наземной и подземной частями в O.longistaminata (рис. 8h). У риса ювенильная фаза, которая характеризуется высоким соотношением листовой оболочки и листовой пластинки, относительно короткая, и только первые несколько листьев проявляют эту ювенильную характеристику (Itoh et al. 2005). Напротив, листья на корневищах состоят исключительно из влагалища, напоминая первый лист на надземных побегах у O. longistaminata и O. sativa . Это означает, что корневища сохраняются в ювенильной фазе, и фазовая прогрессия сильно подавляется.Несмотря на это, корневища имеют удлиненную форму. При нормальном росте риса удлинение стебля происходит только после перехода в репродуктивную фазу (Itoh et al. 2005). У томата пазушные почки выросли до клубнеподобных органов, когда LONELY GUY ( LOG ), ген биосинтеза цитокининов, экспрессировался эктопически. Формирование эктопических клубней усиливается за счет экспрессии miR156 , позитивного регулятора ювенильной фазы (Eviatar-Ribak et al. 2013). Это означает, что эффект эктопической экспрессии LOG был модифицирован фазой роста почек.Это также указывает на то, что на развитие и характер роста пазушных почек влияют фазы развития почек.
САМ корневищ постоянно поддерживается на вегетативной фазе независимо от фазы развития надземных частей. Это подразумевает существование системы, которая блокирует SAM от входа в репродуктивную фазу. У риса изменение репродуктивной фазы обеспечивается флоригеном, который переносится от листьев к SAM. Флориген кодируется двумя генами риса: Hd3a и RFT (Tamaki et al.2007, Комия и др. 2008 г.). Экспрессия Hd3a и RFT в листьях индуцируется в условиях короткого дня. Интересно, что экспрессия Hd3a и RFT происходит только в пластинке листа и исключается из оболочки листа даже в условиях короткого дня (Tamaki et al. 2007, Komiya et al. 2008). Следовательно, отсутствие индукции Hd3a и RFT в чешуйчатых листьях корневищ, содержащих только листовую оболочку, может препятствовать переходу SAM корневища в репродуктивную стадию.Однако нельзя исключить возможность переноса белков флоригена от воздушных листьев к корневищу. В столоне, корневище картофеля, апикальная область расширяется в клубни экологически независимым образом (Nicolas et al. 2015). Формирование клубней картофеля контролируется белками, относящимися к флоригенам, которые переносятся из надземных частей растения. Несмотря на индукцию клубнеобразования, SAM в верхней части столона не поражается и остается в вегетативной стадии. Это говорит о том, что существует регуляторная сеть, контролирующая тонкую пространственную настройку временного развития картофельного столона.Понимание молекулярной основы для тонкой настройки пространственной регуляции прогрессии времени развития у O. longistaminata является важной задачей на будущее.
У многих видов растений стебли растут горизонтально. Горизонтальные стебли растут над землей, на поверхности почвы, чуть ниже земли или под землей. Строго говоря, корневища — это стебли, которые растут под землей, а остальные называются столонами или побегами. Одно сходство между этими корневищными растениями состоит в том, что в одном растении действуют две различные системы роста стебля, а именно вертикальный и горизонтальный рост.Горизонтальный рост стеблей в дополнение к нормальному вертикальному росту благоприятен для быстрого расширения территории и, следовательно, является разумной адаптивной стратегией. Здесь мы показали, что почки корневища O. longistaminata меняют угол наклона, чтобы расти горизонтально. Будет интересно узнать, сохраняется ли этот признак у других видов с горизонтальными стеблями. Более того, раскрытие молекулярных и физиологических механизмов этого процесса необходимо для улучшения нашего понимания корневищ.Быстрый прогресс геномных технологий позволил провести молекулярно-генетический анализ видов растений с уникальными и интересными средами роста, такими как развитие корневищ (Cheng et al. 2013, Koo et al. 2013, Yun et al. 2014, Zhang et al. др. 2014 г., Барбье и др. 2015 г., Сальвато и др. 2015 г., Тейхманн и Мур 2015 г., Янг и др. 2015 г.). Действительно, в настоящее время создаются модельные корневищные виды, такие как Brachypodium , Sorghum и Oryza , как описано здесь.Эти исследования предоставят основную информацию, необходимую для дальнейшего понимания молекулярных основ развития корневища.
Материалы и методы
Растительные материалы
Штаммы риса O. longistaminata (IRGC10404) и O. sativa L. cv. Nipponbare использовались. Растения выращивали в почве при естественном освещении в теплице. Для наблюдения за пазушными почек листья удаляли вручную, а фотографии делали под микроскопом (Leica MC120HD) и анализировали с использованием бесплатного программного обеспечения ImageJ (NIH).
Сканирующая электронная микроскопия
Подмышечные почки стебля и корневища фиксировали в 2,5% глутаровом альдегиде в течение ночи при 4 ° C и обезвоживали в серии растворов этанола, затем конечный раствор этанола заменяли 3-метилбутилацетатом. Затем образцы сушили, покрывали платиной и наблюдали под растровым электронным микроскопом (Hitachi S-4000) при ускоряющем напряжении 5 кВ.
Гистологический анализ
Верхушки побегов стебля и корневища фиксировали с помощью FAA (5% формалин, 5% уксусная кислота, 45% этанол и 45% воды) в течение ночи при 4 ° C и обезвоживали в серии растворов этанола, затем заливали в Paraplast plus. (Маккормик).Были сделаны поперечные срезы толщиной 10 мкм и окрашены гематоксилином. После ополаскивания в воде окрашенные срезы обезвоживали в серии градуированных этанолов, заменяли на hist-clear ® и закрепляли с помощью Multi Mount (Matsunami Glass Ind. Ltd.).
Магнитно-резонансная томография
Пазушные зачатки корневища O. longistaminata наблюдались с использованием сверхпроводящей магнитной системы с вертикальным отверстием 4,7 Тл 89 –1 мм.Для визуализации часть стебля, включая бутон, вырезали (длиной 3 см), заканчивали влажной ватой и помещали в пробирку для образца (диаметром 10 мм). Использовалась самодельная радиочастотная катушка соленоида диаметром 12 мм. Были построены катушки плоского градиента с зазорами 26–31 мм, и выход по току для градиентов x , y и z составил 46,2, 37,8 и 69,0 мТл м –1 A –1 , соответственно.
ОТ-ПЦР в реальном времени
Суммарную РНКэкстрагировали с использованием мини-набора для выделения растительной РНК (Agilent Technologies).После обработки ДНКазой I кДНК первой цепи синтезировали с использованием обратной транскриптазы SuperScript III (Invitrogen). Для амплификации транскриптов использовали следующие наборы праймеров: прямой и обратный праймеры для Hd3a , 5′-GCTAACGATGATCCCGAT-3 ‘и 5′-CCTGCAATGTATAGCATGC-3’; для PAP2 , 5′-AGCAGCTCCACTGGCTACAAATGA-3 ‘и 5′-AGGTCGCAGAGTTCATCAAG-3’; для GA20ox1 , 5′-CCTTCTCCGACTGGCTTAAT-3 ‘и 5′-GATGGATGGATGGATAATAGG-3’; для GA20ox2 , 5′-GGGAGGGTGTACCAGAAGTACTG-3 ‘и 5′-GGCTCAGCTCCAGGAGTTCC-3’; для GA20ox3 , F5′-GGAGGTGTACCAGGAGTACTGCGA-3 ‘и 5′-GTAGTGGTTCAGCCGCATC-3′; и для убиквитина 5’-AGAAGGAGTCCACGCTCCACC-3 ‘и 5′-GCCGGGCCATATAACCTTGACTT-3’.ПЦР выполняли с SYBR green I, используя Light Cycler® 480 System II (Roche Applied Science).
Финансирование
Эта работа была поддержана Японским агентством науки и технологий (JST) [Основные исследования эволюционной науки и технологии (CREST), M.A. и J.K.]; Министерство образования, культуры, спорта, науки и технологий Японии [Гранты от А.Ю. (268
) и Ю. (15K04719)].
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Список литературы
(
2015
)Готово, стойко, вперед! Сахарный удар запускает гонку по разветвлению
.Curr. Opin. Plant Biol.
25
:39
—45
.(
2000
)Изменения в экспрессии гена GA 20-оксидазы сильно влияют на длину стебля, индукцию клубней и урожайность клубней растений картофеля
.Plant J.
22
:247
—256
.(
2013
)Полногеномный анализ дифференциально экспрессируемых генов, имеющих отношение к образованию корневища в корне лотоса ( Nelumbo nucifera Gaertn)
.PLoS One
8
:e67116
.(
2013
)Фермент, активирующий цитокинин, способствует образованию клубней у томатов
.Curr. Биол.
23
:1057
—1064
.(
2013
)Гетерохронные гены в эволюции и развитии растений
.Фронт. Plant Sci.
381
:1
—11
.и другие. .(
2014
)Общесистемное сравнение тканей красного риса ( Oryza longistaminata ) позволяет идентифицировать гены и белки, специфичные для корневищ, которые являются мишенями для улучшения выращиваемого риса
.BMC Plant Biol.
14
:46
.и другие. . (
2003
)Конвергентная эволюция многолетних растений риса и сорго
.Proc. Natl. Акад. Sci. США
10
:4050
—4054
.и другие. . (
2011
)Идентификация ризом-специфичных генов с помощью анализа дифференциальной экспрессии в масштабе всего генома в Oryza longistaminata
.BMC Plant Biol.
24
:11
.и другие. . (
2005
)Развитие растений риса: от зиготы до колоска
.Physiol растительных клеток.
46
:23
—47
.(
2006
)Функциональная классификация, геномная организация, предположительно цис-действующие регуляторные элементы и взаимосвязь с локусами количественных признаков генов сорго с экспрессией, обогащенной корневищами
.Plant Physiol.
142
:1148
—1159
.(
2010
)PANICLE PHYTOMER2 ( PAP2 ), кодирующий белок MADS-box подсемейства SEPALLATA, положительно контролирует идентичность меристемы колосков в рисе
.Physiol растительных клеток.
51
:47
—57
.и другие. . (
2012
)Идентичность меристемы соцветия у риса определяется перекрывающимися функциями трех AP1 / FUL -подобных генов MADS-бокса и PAP2 , гена SEPALLATA MADS box
.Plant Cell
24
:1848
—1859
.(
2008
)Hd3a и RFT1 необходимы для цветения риса
.Девелопмент
135
:767
—774
.и другие. . (
2013
)Метки последовательности, экспрессируемые имбирем и куркумой, идентифицируют сигнатурные гены, определяющие идентичность и развитие корневища, а также биосинтез куркуминоидов, гингеролов и терпеноидов
.BMC Plant Biol.
15
:13: 27
.(
1998
)Снижение содержания GA1, вызванное сверхэкспрессией OSh2 , сопровождается подавлением экспрессии гена GA 20-оксидазы
.Plant Physiol.
117
:1179
—1184
.(
2013
)ЦВЕТОЧНИК Гены T контролируют образование луковиц и цветение
.Nat. Commun.
4
:2884
.и другие. . (
2013
)CYP714B1 и CYP714B2 кодируют 13-оксидазы гиббереллина, которые снижают активность гиббереллина в рисе
.Proc. Natl. Акад. Sci. США
110
:1947
—1952
.(
2014
)Визуализация и количественная оценка сосудистой структуры плодов с помощью магнитно-резонансной микровизуализации
.заявл. Magn. Резон.
45
:517
—525
.и другие. . (
2011
)Контроль за цветением и формированием запасающих органов картофеля с помощью FLOWERING LOCUS T
.Природа
478
:119
—122
.(
2015
)Недавно появившийся альтернативный сайт сплайсинга в гене BRANCHED1a контролирует архитектуру растения картофеля
.Curr. Биол.
25
:1799
—1809
.и другие. . (
2015
)Сравнительный протеомный анализ развивающихся корневищ древнего сосудистого растения Equisetum hyemale и различных видов однодольных
.J. Proteome Res.
14
:1779
—1791
.(
2007
)Белок Hd3a является мобильным сигналом цветения риса
.Наука
18
:1033
—1036
.и другие. . (
2011
)Белки 14-3-3 действуют как внутриклеточные рецепторы для риса Hd3a florigen
.Природа
31
:332
—335
.(
2015
)Формирование архитектуры предприятия
.Фронт. Plant Sci.
6
:233
.и другие. . (
2010
)Идентификация генов, связанных с развитием почек корневища бамбука
.J. Exp. Бот.
61
:551
—561
.(
2013
)Целевое картирование областей локусов количественных признаков для ризоматичности в хромосоме SBI-01 и анализ перезимовки в популяции Sorghum bicolor × S. propinquum
.Мол. Порода.
31
:153
—162
.и другие. . (
2015
)Транскриптомный анализ регуляции образования корневищ лотоса умеренного и тропического климата ( Nelumbo nucifera )
.Sci. Реп.
5
:13059
.(
2014
)Генетический контроль корневищ и геномная локализация QTL основного эффекта роста у многолетней дикой ржи
.Мол. Genet. Геномика.
289
:383
—397
.и другие. . (
2014
)Глубокое секвенирование транскриптома корневища и надземных побегов Sorghum propinquum
.Завод Мол. Биол.
84
:315
—327
.Сокращения
© Автор 2016.Опубликовано Oxford University Press от имени Японского общества физиологов растений. Все права защищены. Для получения разрешения обращайтесь по электронной почте: [email protected]
Анализ развития корневища Oryza longistaminata, вида дикого риса | Физиология растений и клетки
Аннотация
Вегетативное размножение — это форма бесполого размножения растений. У широкого круга растений появляются корневища, модифицированные стебли, которые растут под землей горизонтально, как средство вегетативного размножения.У корневищных видов, несмотря на их различные модели развития, и корневища, и надземные побеги происходят из пазушных почек. Следовательно, представляет интерес понять основы зарождения и развития корневища. Oryza longistaminata , дикий вид риса, развивает корневища. Мы проанализировали зарождение почек и рост корневищ O. longistaminata , используя различные методы морфологического наблюдения. Мы показываем, что в отличие от почек надземных побегов, которые содержат только несколько листьев, почки корневища образуют несколько листьев и изгибаются, чтобы расти под прямым углом к исходному корневищу.Корневища сохраняются в ювенильной фазе независимо от фазы развития надземного побега. Удлинение стебля и репродуктивный переход тесно связаны в надземных побегах, но не связаны в корневище. Наши результаты показывают, что программы развития действуют независимо в корневищах и надземных побегах. Временная модификация путей развития, общих для корневищ и надземных побегов, может быть источником пластичности развития. Более того, для развития корневища, по-видимому, необходимо создание новых систем развития.
Введение
Корневища — это модифицированные стебли, которые растут горизонтально под землей. Из-за их большого преимущества для энергичного бесполого размножения корневища наблюдаются у различных видов многолетних растений (Wang et al. 2010, Navarro et al. 2011, Lee et al. 2013, Zhang et al. 2014, Yang et al. 2015). Один интересный аспект развития корневища состоит в том, что новые почки на корневищах могут расти под землей как новое корневище или появляться над землей и расти как надземный побег.Эта среда произрастания корневищных видов позволяет им быстро и широко расширять свою территорию. Более того, корневища могут выжить под землей, когда условия роста нежелательны, а побеги могут быстро прорасти, когда условия становятся подходящими для роста. Они также важны с точки зрения растениеводства. Корневища собирают как урожай картофеля, имбиря, лотоса и многих других культур (Navarro et al. 2011, Yang et al. 2015). С другой стороны, корневищные виды часто являются ядовитыми сорняками, вторгающимися в обширные регионы из-за их интенсивного роста (Hu et al.2003, Юн и др. 2014).
Морфогенез у растений длится всю жизнь. Новые стволовые клетки, образующиеся в пазухах листьев, образуют пазушную почку и растут как вторичные побеги. Повторяющееся образование пазушных почек и их рост определяют сложную структуру растений. Идентичность и характер роста каждой пазушной почки определяются в соответствии с внутренними и внешними сигналами. У корневищных видов почки корневища и надземные побеги образуются из пазушных почек. В противоположность прогрессу в нашем понимании молекулярных механизмов, лежащих в основе спецификации идентичности пазушных зачатков и детерминации роста, мало что известно об инициации и развитии корневых зачатков.Более того, неизвестно, как две отдельные системы, почки корневища и надземные пазушные почки регулируются у одного растения.
Ряд регионов локусов количественных признаков (QTL), ответственных за развитие корневищ или связанных с ними, был зарегистрирован у нескольких видов корневищ (Jang et al. 2006, Washburn et al. 2013, Yun et al. 2014). Более того, крупномасштабные анализы, такие как анализ транскриптома и анализ протеома, были выполнены на корневищных видах (Hu et al.2011, Barbier et al.2015, Тайхманн и Мур 2015). Хотя эти исследования внесли значительный вклад в улучшение нашего понимания развития корневища на молекулярном уровне, об изоляции генов, критических для развития корневища, не сообщалось. Сложность паттернов развития у корневищных видов может быть препятствием при анализе развития корневища. Кроме того, низкая плодовитость семян у корневищных видов, которые эволюционировали для бесполого размножения, препятствует применению генетических подходов.Кроме того, отсутствие модельных видов корневищ является серьезной проблемой для молекулярно-генетического анализа развития корневища.
Oryza longistaminata , дикий вид риса, возникший в средней Африке, развивает корневища и активно размножается. Oryza longistaminata , содержащий геном АА, который совпадает с геномом Oryza sativa , может быть скрещен с O. sativa и завязать плодородные семена, и поэтому считается одним из идеальных материалов для изучения механизмов контроля развитие корневища у видов трав (He et al.2014). В этом исследовании мы провели подробное наблюдение за морфологией, ростом и развитием корневища. Наши находки показывают, что общие модули развития используются как в корневище, так и в надземном побеге, но модификация временной регуляции модулей может быть источником пластичности развития, наблюдаемой в корневище. Кроме того, мы демонстрируем, что инновации новых систем развития были приняты, чтобы установить процесс развития корневища.
Результаты
Корневища удлиняются во время вегетативной фазы
Oryza longistaminata развивает корневища под землей и демонстрирует типичный рисунок роста риса на уровне земли (рис.1а). В данном исследовании надземный побег и стебель O. longistaminata названы соответственно воздушным побегом и воздушным стеблем, а подземный стебель — корневищем. И воздушный стебель, и корневище образовывали пазушную почку в каждом узле (рис. 1б). Пазушная почка на надземном стебле O. longistaminata вырастает в виде надземного побега, называемого побегом, который на вегетативной стадии постоянно образует листья. Воздушный стебель не показал значительного удлинения во время вегетативной фазы, а удлинение произошло после перехода в репродуктивную фазу, когда образовалась метелка, как в случае O.sativa (рис. 1в, г). Пазушные почки на корневище выросли, образуя новое корневище. В отличие от надземного стебля корневище удлинялось, когда надземные побеги находились на вегетативной стадии (рис. 1б). Это указывает на то, что воздушное удлинение стебля и удлинение корневища контролируются независимо, т.е. в одном растении из O. longistaminata действуют две системы удлинения стебля — система, зависимая от фазы развития, и система, независимая от фазы развития. Гибберелловая кислота является решающим фактором удлинения стебля (Kusaba et al.1998 г., Carrera et al. 2000, Magome et al. 2013). В частности, для быстрого удлинения стебля перед колошением риса необходимо накопление активных гиббереллинов, таких как GA 4 и GA 1 , продуцируемых GA20-оксидазой (GA20ox) (Magome et al. 2013). Мы проанализировали экспрессию трех генов GA20ox в O. longistaminata. Как описано ранее, экспрессия GA20ox1 и GA20ox2 была низкой в неразвитом стебле во время вегетативной фазы и увеличивалась после перехода в репродуктивную фазу в O.sativa (рис. 1д, е). В надземном стебле O. longistaminata экспрессия GA20ox1 и GA20ox2 также была низкой в вегетативной фазе и увеличивалась в репродуктивной фазе (рис. 1g, h). Экспрессия GA20ox1 в корневище была низкой. в то время как GA20ox2 сильно экспрессируется в корневищах, независимо от стадии развития (Fig. 1h). Мы не обнаружили значительной экспрессии гена GA20ox3 у O. sativa и O.longistaminata (данные не представлены).
Рис. 1
Морфология и развитие O. longistaminata. (а) Побеги и корневища O. longistaminata. Корневища растут под землей, а побеги растут над землей. Пунктирная линия указывает на поверхность земли. Почву удалили. Масштабная линейка = 10 см. (б) Пазушные почки на корневищах и надземных побегах. Пазушная почка (стрелка) формируется на узле корневища, имеющем несколько узлов. Первые несколько бутонов на надземном побеге похожи на почки корневища (правая панель).Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Стрельба из апикальных меристем (SAM) побегов O. sativa (c) и O. longistaminata (d). SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O.sativa (д, е) и О. longistaminata (г, з). Значения представлены относительно уровня экспрессии в стебле ( O. sativa ) и надземном стебле ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Рис. 1
Морфология и развитие O. longistaminata. (а) Побеги и корневища O.longistaminata. Корневища растут под землей, а побеги растут над землей. Пунктирная линия указывает на поверхность земли. Почву удалили. Масштабная линейка = 10 см. (б) Пазушные почки на корневищах и надземных побегах. Пазушная почка (стрелка) формируется на узле корневища, имеющем несколько узлов. Первые несколько бутонов на надземном побеге похожи на почки корневища (правая панель). Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Апикальные меристемы побегов (SAM) O.sativa (в) и O. longistaminata (г) побеги. SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O. sativa (e, f) и O. longistaminata (g, h). Значения представлены относительно уровня экспрессии в стебле ( O.sativa ) и надземный стебель ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Почки корневища быстро меняют направление после зарождения
Морфология пазушных почек на корневищах сходна с таковыми на молодых надземных стеблях (рис. 2а, б). Они маленькие, плоские и прикрепляются к надземному стеблю или корневищу.Уникальная морфология почек корневища становится очевидной вскоре после начала роста почек (рис. 2c). Перед удлинением пазушные почки на корневище стали более округлыми, чем на надземном стебле (Fig. 2c; Supplementary Fig. S1c – e). Подмышечные почки на корневище затем увеличиваются в размерах и становятся более объемными в начале роста (рис. 2d). Кроме того, изменился угол наклона зачатка корневища, что сопровождалось выходом кончика зачатка из его центра (рис. 2г). Затем почки выросли под прямым углом к исходному корневищу и удлинились (рис.2д). Более детальное изучение ранних стадий разрастания почек корневища показало, что в почках быстро увеличивалось количество листьев при изменении угла наклона (рис. 2f – k, 3).
Рис. 2
Характеристика почек корневища у O. longistaminata. (а – д) Пазушные почки на надземном побеге (а) и корневище (б – д). Пазушная почка на корневище похожа на почку на надземном побеге, когда они зарождаются (b), затем она становится более округлой (c), увеличивается в размерах и начинает расти (d) и удлиняться (e).Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Рис. 2
Характеристика почек корневища у O. longistaminata. (а – д) Пазушные почки на надземном побеге (а) и корневище (б – д). Пазушная почка на корневище похожа на почку на надземном побеге, когда они зарождаются (b), затем она становится более округлой (c), увеличивается в размерах и начинает расти (d) и удлиняться (e).Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Рис. 3
Зарождение пазушных почек на корневище. (a – e) Изображения пазушных зачатков на стебле (a) и корневище (b – e), полученные с помощью сканирующего электронного микроскопа.Масштабные линейки = 100 мкм. (е) Корреляция между количеством листьев в бутоне и углом наклона бутона. Желтыми и зелеными точками обозначены бутоны на корневищах и надземных побегах соответственно.
Рис. 3
Зарождение пазушных почек на корневище. (a – e) Изображения пазушных зачатков на стебле (a) и корневище (b – e), полученные с помощью сканирующего электронного микроскопа. Масштабные линейки = 100 мкм. (е) Корреляция между количеством листьев в бутоне и углом наклона бутона. Желтыми и зелеными точками обозначены бутоны на корневищах и надземных побегах соответственно.
Чтобы подтвердить, что эти процессы, которые наблюдались в разных почках, происходят последовательно в одной почке, мы наблюдали развитие одной почки с помощью техники магнитно-резонансной томографии (МРТ) (Moriwaki et al . 2014). В этом эксперименте кусок корневища, содержащий почку, вырезали и инкубировали в стеклянной пробирке в магнитном поле и непрерывно наблюдали в течение> 65 часов. Это показало, что бутон начинает изгибаться сразу после начала роста бутона.Быстрое увеличение количества листьев и увеличение размера всей почки происходило одновременно с изменением угла наклона почки (Рис. 4a – g; Дополнительный Рис. S1; Дополнительные Видео S1, S2). Интересно, что когда корневище было вырезано и выращено в условиях освещения, корневище стало зеленым, а почки на корневище выросли как новые воздушные побеги (рис. 5a, b). Напротив, некоторые почки на надземных побегах, прилегающих к границе между надземным побегом и корневищем, выросли как новые корневища, когда они содержались в темноте (рис.5в, г).
Рис. 4
Последовательная магнитно-резонансная томография (МРТ) развивающейся подмышечной зачатка. Область, обозначенная пунктирной линией на (a), показана на (b – g). Стрелки в (а) и (б) указывают бутон. Цифры указывают время инкубации. Размеры пикселей составляли 50 × 50 × 10 мкм 3 для (a) и (b) и 25 × 25 × 100 мкм 3 для (c – g), соответственно. Масштабная линейка = 1 мм. Подробные изображения МРТ доступны на дополнительном рис.S1, видео S1 и дополнительные данные.
Рис. 4
Последовательная магнитно-резонансная томография (МРТ) развивающейся подмышечной зачатка. Область, обозначенная пунктирной линией на (a), показана на (b – g). Стрелки в (а) и (б) указывают бутон. Цифры указывают время инкубации. Размеры пикселей составляли 50 × 50 × 10 мкм 3 для (a) и (b) и 25 × 25 × 100 мкм 3 для (c – g), соответственно. Масштабная линейка = 1 мм. Подробные изображения МРТ доступны на дополнительном рис.S1, видео S1 и дополнительные данные.
Рис. 5
Легкая зависимость роста почек корневища. (а, б) Участок корневища, содержащий пазушные почки и корни, выращенный в условиях освещения. Белыми стрелками обозначены пазушные почки. Когда сегмент корневища выращивали в световых условиях в течение 2 недель, пазушные почки выросли в виде новых воздушных побегов, а стебель корневища стал зеленым, напоминая воздушный стебель. Масштабная линейка = 5 см. (c, d) Отрезок корневища, содержащий пазушные почки и корни, выросшие в темноте.Когда почка выращивалась в темноте в течение 2 дней, пазушная почка расширилась, стала новым корневищем и стала белой, напоминая корневище. Масштабная линейка = 1 см.
Рис. 5
Легкая зависимость роста почек корневища. (а, б) Участок корневища, содержащий пазушные почки и корни, выращенный в условиях освещения. Белыми стрелками обозначены пазушные почки. Когда сегмент корневища выращивали в световых условиях в течение 2 недель, пазушные почки выросли в виде новых воздушных побегов, а стебель корневища стал зеленым, напоминая воздушный стебель.Масштабная линейка = 5 см. (c, d) Отрезок корневища, содержащий пазушные почки и корни, выросшие в темноте. Когда почка выращивалась в темноте в течение 2 дней, пазушная почка расширилась, стала новым корневищем и стала белой, напоминая корневище. Масштабная линейка = 1 см.
Корневища сохраняются в ювенильной фазе
Морфология листьев, переходящих в почки корневища, отличается от морфологии листьев надземных побегов. Листья травяных видов состоят из двух частей: пластинки, сформированной в дистальном положении, и влагалища, сформированного в проксимальном положении (рис.6а). Отношение листовой пластинки к листовой оболочке изменяется в зависимости от стадии развития и, таким образом, используется как индикатор фазы роста во время вегетативной фазы (рис. 6b). Первый лист риса ( O. sativa ) состоит только из листовой оболочки. Листовая пластинка наблюдается со второго листа (рис. 6б). С третьего листа листовая пластинка занимает почти половину всего листа. Листья на корневище, называемые чешуйчатыми, мелкие и рудиментарные (рис. 6в). Чешуйчатые листья в основном состоят из листового влагалища, напоминающего первый лист O.sativa (рис. 7a – f; дополнительный рис. S2). Эти наблюдения показывают, что корневище сохраняется в ювенильной фазе. Когда почки на корневище появляются над землей и начинают расти как надземные побеги, соотношение лезвия к влагалищу во вновь зародившихся листьях постепенно увеличивается, указывая на фазовый переход в развитии (рис. 6d, e). В пазушных почках O. sativa листовая пластинка дифференцируется в инициирующих зачатках листьев на стадиях P3 – P4 (рис. 6f). Напротив, несколько листовых зачатков дифференцировались в пазушную почку на корневище, и никаких признаков дифференцировки пластинок обнаружено не было (рис.6г).
Рис. 6
Характеристика листьев корневища. (а) Саженец O. sativa. Показаны первая (1) и вторая (2) створки. Первый лист состоит только из листового влагалища. Второй лист состоит из листового влагалища (желтого) и листовой пластинки (белого цвета) в проксимальном и дистальном положениях. Масштабная линейка = 1 см. (б) Первые четыре листа O. sativa. Оболочка и пластинка показаны желтыми и белыми линиями соответственно.(c) Чешуйчатые листья на корневище O. longistaminata. На вставке показано увеличенное изображение кончика шкалы. Lb — листовая пластинка; Ls, листовая оболочка. Масштабная линейка = 1 см. (г) Первые пять листьев надземного побега O. longistaminata . Оболочка листа и пластинка листа обозначены желтыми и белыми линиями соответственно. Ранние листья содержат только листовое влагалище. Более поздние листья (четвертый и пятый) содержат листовую пластинку. Цифры указывают порядок листьев. Масштабная линейка = 1 см.(e) Соотношение влагалища и пластинки листа. Показано отношение длины полотна к общей длине полотна. Планки погрешностей показывают стандартное отклонение трех репликаций. Os, Oryza sativa ; Ol, Oryza longistaminata. (е, ж) Продольные срезы пазушных почек надземного отростка (е) и корневища (г) O. longistaminata. P1 – P6 указывают на относительную стадию роста зачатков листа. P1 — самый молодой зачаток. В надземном побеге границу между листовой пластинкой и влагалищем можно наблюдать на листе стадии P3 (звездочка).Почка корневища содержит несколько листьев, состоящих из листовых влагалищ (g). Масштабные линейки = 100 мкм.
Рис. 6
Характеристика листьев корневища. (а) Саженец O. sativa. Показаны первая (1) и вторая (2) створки. Первый лист состоит только из листового влагалища. Второй лист состоит из листового влагалища (желтого) и листовой пластинки (белого цвета) в проксимальном и дистальном положениях. Масштабная линейка = 1 см. (б) Первые четыре листа O. sativa. Оболочка и пластинка показаны желтыми и белыми линиями соответственно.(c) Чешуйчатые листья на корневище O. longistaminata. На вставке показано увеличенное изображение кончика шкалы. Lb — листовая пластинка; Ls, листовая оболочка. Масштабная линейка = 1 см. (г) Первые пять листьев надземного побега O. longistaminata . Оболочка листа и пластинка листа обозначены желтыми и белыми линиями соответственно. Ранние листья содержат только листовое влагалище. Более поздние листья (четвертый и пятый) содержат листовую пластинку. Цифры указывают порядок листьев. Масштабная линейка = 1 см.(e) Соотношение влагалища и пластинки листа. Показано отношение длины полотна к общей длине полотна. Планки погрешностей показывают стандартное отклонение трех репликаций. Os, Oryza sativa ; Ol, Oryza longistaminata. (е, ж) Продольные срезы пазушных почек надземного отростка (е) и корневища (г) O. longistaminata. P1 – P6 указывают на относительную стадию роста зачатков листа. P1 — самый молодой зачаток. В надземном побеге границу между листовой пластинкой и влагалищем можно наблюдать на листе стадии P3 (звездочка).Почка корневища содержит несколько листьев, состоящих из листовых влагалищ (g). Масштабные линейки = 100 мкм.
Рис. 7
Морфология эпидермиса чешуйчатых листьев на корневище. (a – d) Адаксиальный эпидермис. (e – h) Абаксиальный эпидермис. Эпидермис чешуйчатых листьев O. longistaminata (а, д), влагалища первого листа O. sativa (б, е), влагалища второго листа O. sativa (в, г ) и листовой пластинки второго листа О.sativa (д, з). Эпидермальные клетки чешуйчатых листьев не похожи на клетки листовых пластинок, но похожи на клетки влагалища листьев O. sativa. Шкала шкалы = 100 мкм.
Рис. 7
Морфология эпидермиса чешуйчатых листьев на корневище. (a – d) Адаксиальный эпидермис. (e – h) Абаксиальный эпидермис. Эпидермис чешуйчатых листьев O. longistaminata (а, д), влагалища первого листа O. sativa (б, е), влагалища второго листа O. sativa (в, г ) и листовой пластинки второго листа О.sativa (д, з). Эпидермальные клетки чешуйчатых листьев не похожи на клетки листовых пластинок, но похожи на клетки влагалища листьев O. sativa. Шкала шкалы = 100 мкм.
Фаза развития контролируется независимо под землей и над землей
Переход к репродуктивной фазе у O. longistaminata вызван воздействием коротких дней. На верхушке каждого надземного побега образуется метелка, как у побегов O.sativa (рис. 8а, б). Примечательно, что в то время как фазовый переход развития происходил в надземных побегах, фаза развития корневищ сохранялась на вегетативной стадии (Рис. 8c-e). Когда листья удаляли с надземного побега перед колошением, на верхушке не удлиненного стебля наблюдали зарождающееся соцветие (рис. 8d). Напротив, апикальная меристема побега (SAM) на вершине корневища сохранялась на вегетативной стадии (рис. 8e). Чтобы дополнительно подтвердить, что фаза корневища вегетативная, мы использовали PANICLE PHYTOMER2 ( PAP2 ) в качестве молекулярного маркера репродуктивной фазы. PAP2 , кодирующий OsMADS34, является одним из самых ранних генов, индуцированных в SAM после фазового перехода (Kobayashi et al. 2010, Kobayashi et al. 2012). PAP2 экспрессируется в верхушке побега надземного побега после перехода, тогда как PAP2 не обнаруживается в вершине побега корневища (рис. 8f). Затем мы исследовали экспрессию Hd3a , ортолога риса Arabidopis FT , кодирующего флориген (Tamaki et al. 2007, Taoka et al. 2011). Hd3a Экспрессия не обнаруживалась в листовой пластинке и листовой оболочке надземного побега, а также в чешуйчатом листе корневища на вегетативной стадии (рис.8г). После перехода к репродуктивной стадии экспрессия Hd3a обнаруживается в листовой пластинке, но не в оболочке листа у надземных побегов, как сообщалось ранее (Tamaki et al. 2007). В чешуйчатом листе экспрессия Hd3a также не определялась.
Рис. 8
Oryza longistaminata Растение в репродуктивной стадии. (а, б) Фенотипы побегов основной колонны O. sativa (а) и O. longistaminata (б) на репродуктивной стадии после колошения.Стебель удлиняется после перехода, и на его вершине образуется метелка (P) у O. sativa и O. longistaminata. Звездочки обозначают узлы. П, метелка. Масштабная линейка = 5 см. (c) Увеличенное изображение области, обведенной квадратом на (b). После цветения образуется несколько корневищ. Звезды, узлы; наконечники стрел, корневище или удлиненные почки корневища. Масштабная линейка = 5 см. (d, e) Выстрелите верхушки надземного побега (d) и корневища (e). Дифференциация метелки начинается на вершине надземного стебля, в то время как SAM сохраняется на вегетативной стадии на вершине корневища.IM — меристема соцветия; ВМ, вегетативная меристема. Масштабная линейка = 1 мм. (f) Уровни экспрессии PAP2. Уровни экспрессии PAP2 в пластинках листьев (Lb) O. longistaminata , в SAM на репродуктивной фазе и в SAM корневища. PAP2 экспрессируется относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (g) Уровни экспрессии Hd3a. Уровни экспрессии Hd3a в листовых пластинах (Lb), оболочках листьев (Ls) и чешуйчатых листьях (Sl) из O.longistaminata в вегетативной фазе (veg) и репродуктивной фазе (rep). Hd3a Экспрессия выражена относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (з) Схема роста побегов у O. sativa (слева) и O. longistaminata (справа). У O. sativa листья с высоким соотношением листовой оболочки к листовой пластинке образуются во время фазы молоди, которая является относительно короткой. SAM развивается в метелку, а стебель удлиняется после перехода в репродуктивную фазу.Характер роста надземной части O. longistaminata аналогичен таковому у O. sativa. С другой стороны, корневища, растущие под землей, демонстрируют уникальный характер роста. Фаза развития корневища сохраняется на ранней ювенильной фазе, а апикальная меристема корневища сохраняется как вегетативная меристема, в то время как корневище удлиняется, независимо от фазы развития надземных частей. Почки корневища дают несколько листовых зачатков, увеличиваясь в размерах и меняя угол наклона.
Рис. 8
Oryza longistaminata Растение в репродуктивной стадии. (а, б) Фенотипы побегов основной колонны O. sativa (а) и O. longistaminata (б) на репродуктивной стадии после колошения. Стебель удлиняется после перехода, и на его вершине образуется метелка (P) у O. sativa и O. longistaminata. Звездочки обозначают узлы. П, метелка. Масштабная линейка = 5 см. (c) Увеличенное изображение области, обведенной квадратом на (b).После цветения образуется несколько корневищ. Звезды, узлы; наконечники стрел, корневище или удлиненные почки корневища. Масштабная линейка = 5 см. (d, e) Выстрелите верхушки надземного побега (d) и корневища (e). Дифференциация метелки начинается на вершине надземного стебля, в то время как SAM сохраняется на вегетативной стадии на вершине корневища. IM — меристема соцветия; ВМ, вегетативная меристема. Масштабная линейка = 1 мм. (f) Уровни экспрессии PAP2. Уровни экспрессии PAP2 в пластинках листьев (фунты) O.longistaminata , в SAM на репродуктивной фазе и в SAM корневища. PAP2 экспрессируется относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (g) Уровни экспрессии Hd3a. Уровни экспрессии Hd3a в листовых пластинах (Lb), оболочках листьев (Ls) и чешуйчатых листьях (Sl) O. longistaminata на вегетативной фазе (veg) и репродуктивной фазе (rep). Hd3a Экспрессия выражена относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (з) Схема роста побегов у O. sativa (слева) и O. longistaminata (справа). У O. sativa листья с высоким соотношением листовой оболочки к листовой пластинке образуются во время фазы молоди, которая является относительно короткой. SAM развивается в метелку, а стебель удлиняется после перехода в репродуктивную фазу. Характер роста надземной части O. longistaminata аналогичен таковому у O.сатива. С другой стороны, корневища, растущие под землей, демонстрируют уникальный характер роста. Фаза развития корневища сохраняется на ранней ювенильной фазе, а апикальная меристема корневища сохраняется как вегетативная меристема, в то время как корневище удлиняется, независимо от фазы развития надземных частей. Почки корневища дают несколько листовых зачатков, увеличиваясь в размерах и меняя угол наклона.
Обсуждение
Время развития имеет решающее значение для всех организмов в формировании архитектуры своего тела (Geuten et al . 2013). Модуляция времени развития часто работает как сильная движущая сила для создания морфологической пластичности и эволюции. Наш анализ показывает, что временной сдвиг в процессах развития критически важен для создания сложной модели развития O. longistaminata . Мы предполагаем, что гетерохронная модификация процессов развития является ключом к созданию уникальной системы развития корневища.
Наши результаты ясно показывают, что время развития регулируется независимо между наземной и подземной частями в O.longistaminata (рис. 8h). У риса ювенильная фаза, которая характеризуется высоким соотношением листовой оболочки и листовой пластинки, относительно короткая, и только первые несколько листьев проявляют эту ювенильную характеристику (Itoh et al. 2005). Напротив, листья на корневищах состоят исключительно из влагалища, напоминая первый лист на надземных побегах у O. longistaminata и O. sativa . Это означает, что корневища сохраняются в ювенильной фазе, и фазовая прогрессия сильно подавляется.Несмотря на это, корневища имеют удлиненную форму. При нормальном росте риса удлинение стебля происходит только после перехода в репродуктивную фазу (Itoh et al. 2005). У томата пазушные почки выросли до клубнеподобных органов, когда LONELY GUY ( LOG ), ген биосинтеза цитокининов, экспрессировался эктопически. Формирование эктопических клубней усиливается за счет экспрессии miR156 , позитивного регулятора ювенильной фазы (Eviatar-Ribak et al. 2013). Это означает, что эффект эктопической экспрессии LOG был модифицирован фазой роста почек.Это также указывает на то, что на развитие и характер роста пазушных почек влияют фазы развития почек.
САМ корневищ постоянно поддерживается на вегетативной фазе независимо от фазы развития надземных частей. Это подразумевает существование системы, которая блокирует SAM от входа в репродуктивную фазу. У риса изменение репродуктивной фазы обеспечивается флоригеном, который переносится от листьев к SAM. Флориген кодируется двумя генами риса: Hd3a и RFT (Tamaki et al.2007, Комия и др. 2008 г.). Экспрессия Hd3a и RFT в листьях индуцируется в условиях короткого дня. Интересно, что экспрессия Hd3a и RFT происходит только в пластинке листа и исключается из оболочки листа даже в условиях короткого дня (Tamaki et al. 2007, Komiya et al. 2008). Следовательно, отсутствие индукции Hd3a и RFT в чешуйчатых листьях корневищ, содержащих только листовую оболочку, может препятствовать переходу SAM корневища в репродуктивную стадию.Однако нельзя исключить возможность переноса белков флоригена от воздушных листьев к корневищу. В столоне, корневище картофеля, апикальная область расширяется в клубни экологически независимым образом (Nicolas et al. 2015). Формирование клубней картофеля контролируется белками, относящимися к флоригенам, которые переносятся из надземных частей растения. Несмотря на индукцию клубнеобразования, SAM в верхней части столона не поражается и остается в вегетативной стадии. Это говорит о том, что существует регуляторная сеть, контролирующая тонкую пространственную настройку временного развития картофельного столона.Понимание молекулярной основы для тонкой настройки пространственной регуляции прогрессии времени развития у O. longistaminata является важной задачей на будущее.
У многих видов растений стебли растут горизонтально. Горизонтальные стебли растут над землей, на поверхности почвы, чуть ниже земли или под землей. Строго говоря, корневища — это стебли, которые растут под землей, а остальные называются столонами или побегами. Одно сходство между этими корневищными растениями состоит в том, что в одном растении действуют две различные системы роста стебля, а именно вертикальный и горизонтальный рост.Горизонтальный рост стеблей в дополнение к нормальному вертикальному росту благоприятен для быстрого расширения территории и, следовательно, является разумной адаптивной стратегией. Здесь мы показали, что почки корневища O. longistaminata меняют угол наклона, чтобы расти горизонтально. Будет интересно узнать, сохраняется ли этот признак у других видов с горизонтальными стеблями. Более того, раскрытие молекулярных и физиологических механизмов этого процесса необходимо для улучшения нашего понимания корневищ.Быстрый прогресс геномных технологий позволил провести молекулярно-генетический анализ видов растений с уникальными и интересными средами роста, такими как развитие корневищ (Cheng et al. 2013, Koo et al. 2013, Yun et al. 2014, Zhang et al. др. 2014 г., Барбье и др. 2015 г., Сальвато и др. 2015 г., Тейхманн и Мур 2015 г., Янг и др. 2015 г.). Действительно, в настоящее время создаются модельные корневищные виды, такие как Brachypodium , Sorghum и Oryza , как описано здесь.Эти исследования предоставят основную информацию, необходимую для дальнейшего понимания молекулярных основ развития корневища.
Материалы и методы
Растительные материалы
Штаммы риса O. longistaminata (IRGC10404) и O. sativa L. cv. Nipponbare использовались. Растения выращивали в почве при естественном освещении в теплице. Для наблюдения за пазушными почек листья удаляли вручную, а фотографии делали под микроскопом (Leica MC120HD) и анализировали с использованием бесплатного программного обеспечения ImageJ (NIH).
Сканирующая электронная микроскопия
Подмышечные почки стебля и корневища фиксировали в 2,5% глутаровом альдегиде в течение ночи при 4 ° C и обезвоживали в серии растворов этанола, затем конечный раствор этанола заменяли 3-метилбутилацетатом. Затем образцы сушили, покрывали платиной и наблюдали под растровым электронным микроскопом (Hitachi S-4000) при ускоряющем напряжении 5 кВ.
Гистологический анализ
Верхушки побегов стебля и корневища фиксировали с помощью FAA (5% формалин, 5% уксусная кислота, 45% этанол и 45% воды) в течение ночи при 4 ° C и обезвоживали в серии растворов этанола, затем заливали в Paraplast plus. (Маккормик).Были сделаны поперечные срезы толщиной 10 мкм и окрашены гематоксилином. После ополаскивания в воде окрашенные срезы обезвоживали в серии градуированных этанолов, заменяли на hist-clear ® и закрепляли с помощью Multi Mount (Matsunami Glass Ind. Ltd.).
Магнитно-резонансная томография
Пазушные зачатки корневища O. longistaminata наблюдались с использованием сверхпроводящей магнитной системы с вертикальным отверстием 4,7 Тл 89 –1 мм.Для визуализации часть стебля, включая бутон, вырезали (длиной 3 см), заканчивали влажной ватой и помещали в пробирку для образца (диаметром 10 мм). Использовалась самодельная радиочастотная катушка соленоида диаметром 12 мм. Были построены катушки плоского градиента с зазорами 26–31 мм, и выход по току для градиентов x , y и z составил 46,2, 37,8 и 69,0 мТл м –1 A –1 , соответственно.
ОТ-ПЦР в реальном времени
Суммарную РНКэкстрагировали с использованием мини-набора для выделения растительной РНК (Agilent Technologies).После обработки ДНКазой I кДНК первой цепи синтезировали с использованием обратной транскриптазы SuperScript III (Invitrogen). Для амплификации транскриптов использовали следующие наборы праймеров: прямой и обратный праймеры для Hd3a , 5′-GCTAACGATGATCCCGAT-3 ‘и 5′-CCTGCAATGTATAGCATGC-3’; для PAP2 , 5′-AGCAGCTCCACTGGCTACAAATGA-3 ‘и 5′-AGGTCGCAGAGTTCATCAAG-3’; для GA20ox1 , 5′-CCTTCTCCGACTGGCTTAAT-3 ‘и 5′-GATGGATGGATGGATAATAGG-3’; для GA20ox2 , 5′-GGGAGGGTGTACCAGAAGTACTG-3 ‘и 5′-GGCTCAGCTCCAGGAGTTCC-3’; для GA20ox3 , F5′-GGAGGTGTACCAGGAGTACTGCGA-3 ‘и 5′-GTAGTGGTTCAGCCGCATC-3′; и для убиквитина 5’-AGAAGGAGTCCACGCTCCACC-3 ‘и 5′-GCCGGGCCATATAACCTTGACTT-3’.ПЦР выполняли с SYBR green I, используя Light Cycler® 480 System II (Roche Applied Science).
Финансирование
Эта работа была поддержана Японским агентством науки и технологий (JST) [Основные исследования эволюционной науки и технологии (CREST), M.A. и J.K.]; Министерство образования, культуры, спорта, науки и технологий Японии [Гранты от А.Ю. (268
) и Ю. (15K04719)].
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Список литературы
(
2015
)Готово, стойко, вперед! Сахарный удар запускает гонку по разветвлению
.Curr. Opin. Plant Biol.
25
:39
—45
.(
2000
)Изменения в экспрессии гена GA 20-оксидазы сильно влияют на длину стебля, индукцию клубней и урожайность клубней растений картофеля
.Plant J.
22
:247
—256
.(
2013
)Полногеномный анализ дифференциально экспрессируемых генов, имеющих отношение к образованию корневища в корне лотоса ( Nelumbo nucifera Gaertn)
.PLoS One
8
:e67116
.(
2013
)Фермент, активирующий цитокинин, способствует образованию клубней у томатов
.Curr. Биол.
23
:1057
—1064
.(
2013
)Гетерохронные гены в эволюции и развитии растений
.Фронт. Plant Sci.
381
:1
—11
.и другие. .(
2014
)Общесистемное сравнение тканей красного риса ( Oryza longistaminata ) позволяет идентифицировать гены и белки, специфичные для корневищ, которые являются мишенями для улучшения выращиваемого риса
.BMC Plant Biol.
14
:46
.и другие. . (
2003
)Конвергентная эволюция многолетних растений риса и сорго
.Proc. Natl. Акад. Sci. США
10
:4050
—4054
.и другие. . (
2011
)Идентификация ризом-специфичных генов с помощью анализа дифференциальной экспрессии в масштабе всего генома в Oryza longistaminata
.BMC Plant Biol.
24
:11
.и другие. . (
2005
)Развитие растений риса: от зиготы до колоска
.Physiol растительных клеток.
46
:23
—47
.(
2006
)Функциональная классификация, геномная организация, предположительно цис-действующие регуляторные элементы и взаимосвязь с локусами количественных признаков генов сорго с экспрессией, обогащенной корневищами
.Plant Physiol.
142
:1148
—1159
.(
2010
)PANICLE PHYTOMER2 ( PAP2 ), кодирующий белок MADS-box подсемейства SEPALLATA, положительно контролирует идентичность меристемы колосков в рисе
.Physiol растительных клеток.
51
:47
—57
.и другие. . (
2012
)Идентичность меристемы соцветия у риса определяется перекрывающимися функциями трех AP1 / FUL -подобных генов MADS-бокса и PAP2 , гена SEPALLATA MADS box
.Plant Cell
24
:1848
—1859
.(
2008
)Hd3a и RFT1 необходимы для цветения риса
.Девелопмент
135
:767
—774
.и другие. . (
2013
)Метки последовательности, экспрессируемые имбирем и куркумой, идентифицируют сигнатурные гены, определяющие идентичность и развитие корневища, а также биосинтез куркуминоидов, гингеролов и терпеноидов
.BMC Plant Biol.
15
:13: 27
.(
1998
)Снижение содержания GA1, вызванное сверхэкспрессией OSh2 , сопровождается подавлением экспрессии гена GA 20-оксидазы
.Plant Physiol.
117
:1179
—1184
.(
2013
)ЦВЕТОЧНИК Гены T контролируют образование луковиц и цветение
.Nat. Commun.
4
:2884
.и другие. . (
2013
)CYP714B1 и CYP714B2 кодируют 13-оксидазы гиббереллина, которые снижают активность гиббереллина в рисе
.Proc. Natl. Акад. Sci. США
110
:1947
—1952
.(
2014
)Визуализация и количественная оценка сосудистой структуры плодов с помощью магнитно-резонансной микровизуализации
.заявл. Magn. Резон.
45
:517
—525
.и другие. . (
2011
)Контроль за цветением и формированием запасающих органов картофеля с помощью FLOWERING LOCUS T
.Природа
478
:119
—122
.(
2015
)Недавно появившийся альтернативный сайт сплайсинга в гене BRANCHED1a контролирует архитектуру растения картофеля
.Curr. Биол.
25
:1799
—1809
.и другие. . (
2015
)Сравнительный протеомный анализ развивающихся корневищ древнего сосудистого растения Equisetum hyemale и различных видов однодольных
.J. Proteome Res.
14
:1779
—1791
.(
2007
)Белок Hd3a является мобильным сигналом цветения риса
.Наука
18
:1033
—1036
.и другие. . (
2011
)Белки 14-3-3 действуют как внутриклеточные рецепторы для риса Hd3a florigen
.Природа
31
:332
—335
.(
2015
)Формирование архитектуры предприятия
.Фронт. Plant Sci.
6
:233
.и другие. . (
2010
)Идентификация генов, связанных с развитием почек корневища бамбука
.J. Exp. Бот.
61
:551
—561
.(
2013
)Целевое картирование областей локусов количественных признаков для ризоматичности в хромосоме SBI-01 и анализ перезимовки в популяции Sorghum bicolor × S. propinquum
.Мол. Порода.
31
:153
—162
.и другие. . (
2015
)Транскриптомный анализ регуляции образования корневищ лотоса умеренного и тропического климата ( Nelumbo nucifera )
.Sci. Реп.
5
:13059
.(
2014
)Генетический контроль корневищ и геномная локализация QTL основного эффекта роста у многолетней дикой ржи
.Мол. Genet. Геномика.
289
:383
—397
.и другие. . (
2014
)Глубокое секвенирование транскриптома корневища и надземных побегов Sorghum propinquum
.Завод Мол. Биол.
84
:315
—327
.Сокращения
© Автор 2016.Опубликовано Oxford University Press от имени Японского общества физиологов растений. Все права защищены. Для получения разрешения обращайтесь по электронной почте: [email protected]
Анализ развития корневища Oryza longistaminata, вида дикого риса | Физиология растений и клетки
Аннотация
Вегетативное размножение — это форма бесполого размножения растений. У широкого круга растений появляются корневища, модифицированные стебли, которые растут под землей горизонтально, как средство вегетативного размножения.У корневищных видов, несмотря на их различные модели развития, и корневища, и надземные побеги происходят из пазушных почек. Следовательно, представляет интерес понять основы зарождения и развития корневища. Oryza longistaminata , дикий вид риса, развивает корневища. Мы проанализировали зарождение почек и рост корневищ O. longistaminata , используя различные методы морфологического наблюдения. Мы показываем, что в отличие от почек надземных побегов, которые содержат только несколько листьев, почки корневища образуют несколько листьев и изгибаются, чтобы расти под прямым углом к исходному корневищу.Корневища сохраняются в ювенильной фазе независимо от фазы развития надземного побега. Удлинение стебля и репродуктивный переход тесно связаны в надземных побегах, но не связаны в корневище. Наши результаты показывают, что программы развития действуют независимо в корневищах и надземных побегах. Временная модификация путей развития, общих для корневищ и надземных побегов, может быть источником пластичности развития. Более того, для развития корневища, по-видимому, необходимо создание новых систем развития.
Введение
Корневища — это модифицированные стебли, которые растут горизонтально под землей. Из-за их большого преимущества для энергичного бесполого размножения корневища наблюдаются у различных видов многолетних растений (Wang et al. 2010, Navarro et al. 2011, Lee et al. 2013, Zhang et al. 2014, Yang et al. 2015). Один интересный аспект развития корневища состоит в том, что новые почки на корневищах могут расти под землей как новое корневище или появляться над землей и расти как надземный побег.Эта среда произрастания корневищных видов позволяет им быстро и широко расширять свою территорию. Более того, корневища могут выжить под землей, когда условия роста нежелательны, а побеги могут быстро прорасти, когда условия становятся подходящими для роста. Они также важны с точки зрения растениеводства. Корневища собирают как урожай картофеля, имбиря, лотоса и многих других культур (Navarro et al. 2011, Yang et al. 2015). С другой стороны, корневищные виды часто являются ядовитыми сорняками, вторгающимися в обширные регионы из-за их интенсивного роста (Hu et al.2003, Юн и др. 2014).
Морфогенез у растений длится всю жизнь. Новые стволовые клетки, образующиеся в пазухах листьев, образуют пазушную почку и растут как вторичные побеги. Повторяющееся образование пазушных почек и их рост определяют сложную структуру растений. Идентичность и характер роста каждой пазушной почки определяются в соответствии с внутренними и внешними сигналами. У корневищных видов почки корневища и надземные побеги образуются из пазушных почек. В противоположность прогрессу в нашем понимании молекулярных механизмов, лежащих в основе спецификации идентичности пазушных зачатков и детерминации роста, мало что известно об инициации и развитии корневых зачатков.Более того, неизвестно, как две отдельные системы, почки корневища и надземные пазушные почки регулируются у одного растения.
Ряд регионов локусов количественных признаков (QTL), ответственных за развитие корневищ или связанных с ними, был зарегистрирован у нескольких видов корневищ (Jang et al. 2006, Washburn et al. 2013, Yun et al. 2014). Более того, крупномасштабные анализы, такие как анализ транскриптома и анализ протеома, были выполнены на корневищных видах (Hu et al.2011, Barbier et al.2015, Тайхманн и Мур 2015). Хотя эти исследования внесли значительный вклад в улучшение нашего понимания развития корневища на молекулярном уровне, об изоляции генов, критических для развития корневища, не сообщалось. Сложность паттернов развития у корневищных видов может быть препятствием при анализе развития корневища. Кроме того, низкая плодовитость семян у корневищных видов, которые эволюционировали для бесполого размножения, препятствует применению генетических подходов.Кроме того, отсутствие модельных видов корневищ является серьезной проблемой для молекулярно-генетического анализа развития корневища.
Oryza longistaminata , дикий вид риса, возникший в средней Африке, развивает корневища и активно размножается. Oryza longistaminata , содержащий геном АА, который совпадает с геномом Oryza sativa , может быть скрещен с O. sativa и завязать плодородные семена, и поэтому считается одним из идеальных материалов для изучения механизмов контроля развитие корневища у видов трав (He et al.2014). В этом исследовании мы провели подробное наблюдение за морфологией, ростом и развитием корневища. Наши находки показывают, что общие модули развития используются как в корневище, так и в надземном побеге, но модификация временной регуляции модулей может быть источником пластичности развития, наблюдаемой в корневище. Кроме того, мы демонстрируем, что инновации новых систем развития были приняты, чтобы установить процесс развития корневища.
Результаты
Корневища удлиняются во время вегетативной фазы
Oryza longistaminata развивает корневища под землей и демонстрирует типичный рисунок роста риса на уровне земли (рис.1а). В данном исследовании надземный побег и стебель O. longistaminata названы соответственно воздушным побегом и воздушным стеблем, а подземный стебель — корневищем. И воздушный стебель, и корневище образовывали пазушную почку в каждом узле (рис. 1б). Пазушная почка на надземном стебле O. longistaminata вырастает в виде надземного побега, называемого побегом, который на вегетативной стадии постоянно образует листья. Воздушный стебель не показал значительного удлинения во время вегетативной фазы, а удлинение произошло после перехода в репродуктивную фазу, когда образовалась метелка, как в случае O.sativa (рис. 1в, г). Пазушные почки на корневище выросли, образуя новое корневище. В отличие от надземного стебля корневище удлинялось, когда надземные побеги находились на вегетативной стадии (рис. 1б). Это указывает на то, что воздушное удлинение стебля и удлинение корневища контролируются независимо, т.е. в одном растении из O. longistaminata действуют две системы удлинения стебля — система, зависимая от фазы развития, и система, независимая от фазы развития. Гибберелловая кислота является решающим фактором удлинения стебля (Kusaba et al.1998 г., Carrera et al. 2000, Magome et al. 2013). В частности, для быстрого удлинения стебля перед колошением риса необходимо накопление активных гиббереллинов, таких как GA 4 и GA 1 , продуцируемых GA20-оксидазой (GA20ox) (Magome et al. 2013). Мы проанализировали экспрессию трех генов GA20ox в O. longistaminata. Как описано ранее, экспрессия GA20ox1 и GA20ox2 была низкой в неразвитом стебле во время вегетативной фазы и увеличивалась после перехода в репродуктивную фазу в O.sativa (рис. 1д, е). В надземном стебле O. longistaminata экспрессия GA20ox1 и GA20ox2 также была низкой в вегетативной фазе и увеличивалась в репродуктивной фазе (рис. 1g, h). Экспрессия GA20ox1 в корневище была низкой. в то время как GA20ox2 сильно экспрессируется в корневищах, независимо от стадии развития (Fig. 1h). Мы не обнаружили значительной экспрессии гена GA20ox3 у O. sativa и O.longistaminata (данные не представлены).
Рис. 1
Морфология и развитие O. longistaminata. (а) Побеги и корневища O. longistaminata. Корневища растут под землей, а побеги растут над землей. Пунктирная линия указывает на поверхность земли. Почву удалили. Масштабная линейка = 10 см. (б) Пазушные почки на корневищах и надземных побегах. Пазушная почка (стрелка) формируется на узле корневища, имеющем несколько узлов. Первые несколько бутонов на надземном побеге похожи на почки корневища (правая панель).Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Стрельба из апикальных меристем (SAM) побегов O. sativa (c) и O. longistaminata (d). SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O.sativa (д, е) и О. longistaminata (г, з). Значения представлены относительно уровня экспрессии в стебле ( O. sativa ) и надземном стебле ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Рис. 1
Морфология и развитие O. longistaminata. (а) Побеги и корневища O.longistaminata. Корневища растут под землей, а побеги растут над землей. Пунктирная линия указывает на поверхность земли. Почву удалили. Масштабная линейка = 10 см. (б) Пазушные почки на корневищах и надземных побегах. Пазушная почка (стрелка) формируется на узле корневища, имеющем несколько узлов. Первые несколько бутонов на надземном побеге похожи на почки корневища (правая панель). Междоузлия между узлами с пазушными зачатками удлиненные. Масштабные линейки = 10 см (левая панель), 5 см (правая панель). (c и d) Апикальные меристемы побегов (SAM) O.sativa (в) и O. longistaminata (г) побеги. SAM расположен у основания побега (квадрат на (b), относительно O. longistaminata. ). После удаления листьев наблюдается SAM на вегетативной фазе (VM). Масштабные линейки = 1 см (левая панель в c), 1 мм (правая панель в c, d). (e, f) Уровни экспрессии GA20ox1 и GA20ox2 , генов синтеза гиббереллина, в O. sativa (e, f) и O. longistaminata (g, h). Значения представлены относительно уровня экспрессии в стебле ( O.sativa ) и надземный стебель ( O. longistaminata ) на вегетативной стадии. Планки погрешностей показывают стандартное отклонение трех репликаций. St, стержень; Rh — корневище; As, воздушный стебель; вегетативный, вегетативный этап; реп, репродуктивная стадия.
Почки корневища быстро меняют направление после зарождения
Морфология пазушных почек на корневищах сходна с таковыми на молодых надземных стеблях (рис. 2а, б). Они маленькие, плоские и прикрепляются к надземному стеблю или корневищу.Уникальная морфология почек корневища становится очевидной вскоре после начала роста почек (рис. 2c). Перед удлинением пазушные почки на корневище стали более округлыми, чем на надземном стебле (Fig. 2c; Supplementary Fig. S1c – e). Подмышечные почки на корневище затем увеличиваются в размерах и становятся более объемными в начале роста (рис. 2d). Кроме того, изменился угол наклона зачатка корневища, что сопровождалось выходом кончика зачатка из его центра (рис. 2г). Затем почки выросли под прямым углом к исходному корневищу и удлинились (рис.2д). Более детальное изучение ранних стадий разрастания почек корневища показало, что в почках быстро увеличивалось количество листьев при изменении угла наклона (рис. 2f – k, 3).
Рис. 2
Характеристика почек корневища у O. longistaminata. (а – д) Пазушные почки на надземном побеге (а) и корневище (б – д). Пазушная почка на корневище похожа на почку на надземном побеге, когда они зарождаются (b), затем она становится более округлой (c), увеличивается в размерах и начинает расти (d) и удлиняться (e).Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Рис. 2
Характеристика почек корневища у O. longistaminata. (а – д) Пазушные почки на надземном побеге (а) и корневище (б – д). Пазушная почка на корневище похожа на почку на надземном побеге, когда они зарождаются (b), затем она становится более округлой (c), увеличивается в размерах и начинает расти (d) и удлиняться (e).Масштабные линейки = 1 см (a – d), 5 мм (e). (f – k) Продольные срезы пазушных почек на надземном побеге (f) и корневище (g – k). Показан последовательный рост почек (g – k). Оранжевые линии показывают углы между надземным стеблем или стеблями корневища и почками. Цифры указывают количество листьев, заложенных в пазушных почках. Масштабные линейки = 200 мкм.
Рис. 3
Зарождение пазушных почек на корневище. (a – e) Изображения пазушных зачатков на стебле (a) и корневище (b – e), полученные с помощью сканирующего электронного микроскопа.Масштабные линейки = 100 мкм. (е) Корреляция между количеством листьев в бутоне и углом наклона бутона. Желтыми и зелеными точками обозначены бутоны на корневищах и надземных побегах соответственно.
Рис. 3
Зарождение пазушных почек на корневище. (a – e) Изображения пазушных зачатков на стебле (a) и корневище (b – e), полученные с помощью сканирующего электронного микроскопа. Масштабные линейки = 100 мкм. (е) Корреляция между количеством листьев в бутоне и углом наклона бутона. Желтыми и зелеными точками обозначены бутоны на корневищах и надземных побегах соответственно.
Чтобы подтвердить, что эти процессы, которые наблюдались в разных почках, происходят последовательно в одной почке, мы наблюдали развитие одной почки с помощью техники магнитно-резонансной томографии (МРТ) (Moriwaki et al . 2014). В этом эксперименте кусок корневища, содержащий почку, вырезали и инкубировали в стеклянной пробирке в магнитном поле и непрерывно наблюдали в течение> 65 часов. Это показало, что бутон начинает изгибаться сразу после начала роста бутона.Быстрое увеличение количества листьев и увеличение размера всей почки происходило одновременно с изменением угла наклона почки (Рис. 4a – g; Дополнительный Рис. S1; Дополнительные Видео S1, S2). Интересно, что когда корневище было вырезано и выращено в условиях освещения, корневище стало зеленым, а почки на корневище выросли как новые воздушные побеги (рис. 5a, b). Напротив, некоторые почки на надземных побегах, прилегающих к границе между надземным побегом и корневищем, выросли как новые корневища, когда они содержались в темноте (рис.5в, г).
Рис. 4
Последовательная магнитно-резонансная томография (МРТ) развивающейся подмышечной зачатка. Область, обозначенная пунктирной линией на (a), показана на (b – g). Стрелки в (а) и (б) указывают бутон. Цифры указывают время инкубации. Размеры пикселей составляли 50 × 50 × 10 мкм 3 для (a) и (b) и 25 × 25 × 100 мкм 3 для (c – g), соответственно. Масштабная линейка = 1 мм. Подробные изображения МРТ доступны на дополнительном рис.S1, видео S1 и дополнительные данные.
Рис. 4
Последовательная магнитно-резонансная томография (МРТ) развивающейся подмышечной зачатка. Область, обозначенная пунктирной линией на (a), показана на (b – g). Стрелки в (а) и (б) указывают бутон. Цифры указывают время инкубации. Размеры пикселей составляли 50 × 50 × 10 мкм 3 для (a) и (b) и 25 × 25 × 100 мкм 3 для (c – g), соответственно. Масштабная линейка = 1 мм. Подробные изображения МРТ доступны на дополнительном рис.S1, видео S1 и дополнительные данные.
Рис. 5
Легкая зависимость роста почек корневища. (а, б) Участок корневища, содержащий пазушные почки и корни, выращенный в условиях освещения. Белыми стрелками обозначены пазушные почки. Когда сегмент корневища выращивали в световых условиях в течение 2 недель, пазушные почки выросли в виде новых воздушных побегов, а стебель корневища стал зеленым, напоминая воздушный стебель. Масштабная линейка = 5 см. (c, d) Отрезок корневища, содержащий пазушные почки и корни, выросшие в темноте.Когда почка выращивалась в темноте в течение 2 дней, пазушная почка расширилась, стала новым корневищем и стала белой, напоминая корневище. Масштабная линейка = 1 см.
Рис. 5
Легкая зависимость роста почек корневища. (а, б) Участок корневища, содержащий пазушные почки и корни, выращенный в условиях освещения. Белыми стрелками обозначены пазушные почки. Когда сегмент корневища выращивали в световых условиях в течение 2 недель, пазушные почки выросли в виде новых воздушных побегов, а стебель корневища стал зеленым, напоминая воздушный стебель.Масштабная линейка = 5 см. (c, d) Отрезок корневища, содержащий пазушные почки и корни, выросшие в темноте. Когда почка выращивалась в темноте в течение 2 дней, пазушная почка расширилась, стала новым корневищем и стала белой, напоминая корневище. Масштабная линейка = 1 см.
Корневища сохраняются в ювенильной фазе
Морфология листьев, переходящих в почки корневища, отличается от морфологии листьев надземных побегов. Листья травяных видов состоят из двух частей: пластинки, сформированной в дистальном положении, и влагалища, сформированного в проксимальном положении (рис.6а). Отношение листовой пластинки к листовой оболочке изменяется в зависимости от стадии развития и, таким образом, используется как индикатор фазы роста во время вегетативной фазы (рис. 6b). Первый лист риса ( O. sativa ) состоит только из листовой оболочки. Листовая пластинка наблюдается со второго листа (рис. 6б). С третьего листа листовая пластинка занимает почти половину всего листа. Листья на корневище, называемые чешуйчатыми, мелкие и рудиментарные (рис. 6в). Чешуйчатые листья в основном состоят из листового влагалища, напоминающего первый лист O.sativa (рис. 7a – f; дополнительный рис. S2). Эти наблюдения показывают, что корневище сохраняется в ювенильной фазе. Когда почки на корневище появляются над землей и начинают расти как надземные побеги, соотношение лезвия к влагалищу во вновь зародившихся листьях постепенно увеличивается, указывая на фазовый переход в развитии (рис. 6d, e). В пазушных почках O. sativa листовая пластинка дифференцируется в инициирующих зачатках листьев на стадиях P3 – P4 (рис. 6f). Напротив, несколько листовых зачатков дифференцировались в пазушную почку на корневище, и никаких признаков дифференцировки пластинок обнаружено не было (рис.6г).
Рис. 6
Характеристика листьев корневища. (а) Саженец O. sativa. Показаны первая (1) и вторая (2) створки. Первый лист состоит только из листового влагалища. Второй лист состоит из листового влагалища (желтого) и листовой пластинки (белого цвета) в проксимальном и дистальном положениях. Масштабная линейка = 1 см. (б) Первые четыре листа O. sativa. Оболочка и пластинка показаны желтыми и белыми линиями соответственно.(c) Чешуйчатые листья на корневище O. longistaminata. На вставке показано увеличенное изображение кончика шкалы. Lb — листовая пластинка; Ls, листовая оболочка. Масштабная линейка = 1 см. (г) Первые пять листьев надземного побега O. longistaminata . Оболочка листа и пластинка листа обозначены желтыми и белыми линиями соответственно. Ранние листья содержат только листовое влагалище. Более поздние листья (четвертый и пятый) содержат листовую пластинку. Цифры указывают порядок листьев. Масштабная линейка = 1 см.(e) Соотношение влагалища и пластинки листа. Показано отношение длины полотна к общей длине полотна. Планки погрешностей показывают стандартное отклонение трех репликаций. Os, Oryza sativa ; Ol, Oryza longistaminata. (е, ж) Продольные срезы пазушных почек надземного отростка (е) и корневища (г) O. longistaminata. P1 – P6 указывают на относительную стадию роста зачатков листа. P1 — самый молодой зачаток. В надземном побеге границу между листовой пластинкой и влагалищем можно наблюдать на листе стадии P3 (звездочка).Почка корневища содержит несколько листьев, состоящих из листовых влагалищ (g). Масштабные линейки = 100 мкм.
Рис. 6
Характеристика листьев корневища. (а) Саженец O. sativa. Показаны первая (1) и вторая (2) створки. Первый лист состоит только из листового влагалища. Второй лист состоит из листового влагалища (желтого) и листовой пластинки (белого цвета) в проксимальном и дистальном положениях. Масштабная линейка = 1 см. (б) Первые четыре листа O. sativa. Оболочка и пластинка показаны желтыми и белыми линиями соответственно.(c) Чешуйчатые листья на корневище O. longistaminata. На вставке показано увеличенное изображение кончика шкалы. Lb — листовая пластинка; Ls, листовая оболочка. Масштабная линейка = 1 см. (г) Первые пять листьев надземного побега O. longistaminata . Оболочка листа и пластинка листа обозначены желтыми и белыми линиями соответственно. Ранние листья содержат только листовое влагалище. Более поздние листья (четвертый и пятый) содержат листовую пластинку. Цифры указывают порядок листьев. Масштабная линейка = 1 см.(e) Соотношение влагалища и пластинки листа. Показано отношение длины полотна к общей длине полотна. Планки погрешностей показывают стандартное отклонение трех репликаций. Os, Oryza sativa ; Ol, Oryza longistaminata. (е, ж) Продольные срезы пазушных почек надземного отростка (е) и корневища (г) O. longistaminata. P1 – P6 указывают на относительную стадию роста зачатков листа. P1 — самый молодой зачаток. В надземном побеге границу между листовой пластинкой и влагалищем можно наблюдать на листе стадии P3 (звездочка).Почка корневища содержит несколько листьев, состоящих из листовых влагалищ (g). Масштабные линейки = 100 мкм.
Рис. 7
Морфология эпидермиса чешуйчатых листьев на корневище. (a – d) Адаксиальный эпидермис. (e – h) Абаксиальный эпидермис. Эпидермис чешуйчатых листьев O. longistaminata (а, д), влагалища первого листа O. sativa (б, е), влагалища второго листа O. sativa (в, г ) и листовой пластинки второго листа О.sativa (д, з). Эпидермальные клетки чешуйчатых листьев не похожи на клетки листовых пластинок, но похожи на клетки влагалища листьев O. sativa. Шкала шкалы = 100 мкм.
Рис. 7
Морфология эпидермиса чешуйчатых листьев на корневище. (a – d) Адаксиальный эпидермис. (e – h) Абаксиальный эпидермис. Эпидермис чешуйчатых листьев O. longistaminata (а, д), влагалища первого листа O. sativa (б, е), влагалища второго листа O. sativa (в, г ) и листовой пластинки второго листа О.sativa (д, з). Эпидермальные клетки чешуйчатых листьев не похожи на клетки листовых пластинок, но похожи на клетки влагалища листьев O. sativa. Шкала шкалы = 100 мкм.
Фаза развития контролируется независимо под землей и над землей
Переход к репродуктивной фазе у O. longistaminata вызван воздействием коротких дней. На верхушке каждого надземного побега образуется метелка, как у побегов O.sativa (рис. 8а, б). Примечательно, что в то время как фазовый переход развития происходил в надземных побегах, фаза развития корневищ сохранялась на вегетативной стадии (Рис. 8c-e). Когда листья удаляли с надземного побега перед колошением, на верхушке не удлиненного стебля наблюдали зарождающееся соцветие (рис. 8d). Напротив, апикальная меристема побега (SAM) на вершине корневища сохранялась на вегетативной стадии (рис. 8e). Чтобы дополнительно подтвердить, что фаза корневища вегетативная, мы использовали PANICLE PHYTOMER2 ( PAP2 ) в качестве молекулярного маркера репродуктивной фазы. PAP2 , кодирующий OsMADS34, является одним из самых ранних генов, индуцированных в SAM после фазового перехода (Kobayashi et al. 2010, Kobayashi et al. 2012). PAP2 экспрессируется в верхушке побега надземного побега после перехода, тогда как PAP2 не обнаруживается в вершине побега корневища (рис. 8f). Затем мы исследовали экспрессию Hd3a , ортолога риса Arabidopis FT , кодирующего флориген (Tamaki et al. 2007, Taoka et al. 2011). Hd3a Экспрессия не обнаруживалась в листовой пластинке и листовой оболочке надземного побега, а также в чешуйчатом листе корневища на вегетативной стадии (рис.8г). После перехода к репродуктивной стадии экспрессия Hd3a обнаруживается в листовой пластинке, но не в оболочке листа у надземных побегов, как сообщалось ранее (Tamaki et al. 2007). В чешуйчатом листе экспрессия Hd3a также не определялась.
Рис. 8
Oryza longistaminata Растение в репродуктивной стадии. (а, б) Фенотипы побегов основной колонны O. sativa (а) и O. longistaminata (б) на репродуктивной стадии после колошения.Стебель удлиняется после перехода, и на его вершине образуется метелка (P) у O. sativa и O. longistaminata. Звездочки обозначают узлы. П, метелка. Масштабная линейка = 5 см. (c) Увеличенное изображение области, обведенной квадратом на (b). После цветения образуется несколько корневищ. Звезды, узлы; наконечники стрел, корневище или удлиненные почки корневища. Масштабная линейка = 5 см. (d, e) Выстрелите верхушки надземного побега (d) и корневища (e). Дифференциация метелки начинается на вершине надземного стебля, в то время как SAM сохраняется на вегетативной стадии на вершине корневища.IM — меристема соцветия; ВМ, вегетативная меристема. Масштабная линейка = 1 мм. (f) Уровни экспрессии PAP2. Уровни экспрессии PAP2 в пластинках листьев (Lb) O. longistaminata , в SAM на репродуктивной фазе и в SAM корневища. PAP2 экспрессируется относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (g) Уровни экспрессии Hd3a. Уровни экспрессии Hd3a в листовых пластинах (Lb), оболочках листьев (Ls) и чешуйчатых листьях (Sl) из O.longistaminata в вегетативной фазе (veg) и репродуктивной фазе (rep). Hd3a Экспрессия выражена относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (з) Схема роста побегов у O. sativa (слева) и O. longistaminata (справа). У O. sativa листья с высоким соотношением листовой оболочки к листовой пластинке образуются во время фазы молоди, которая является относительно короткой. SAM развивается в метелку, а стебель удлиняется после перехода в репродуктивную фазу.Характер роста надземной части O. longistaminata аналогичен таковому у O. sativa. С другой стороны, корневища, растущие под землей, демонстрируют уникальный характер роста. Фаза развития корневища сохраняется на ранней ювенильной фазе, а апикальная меристема корневища сохраняется как вегетативная меристема, в то время как корневище удлиняется, независимо от фазы развития надземных частей. Почки корневища дают несколько листовых зачатков, увеличиваясь в размерах и меняя угол наклона.
Рис. 8
Oryza longistaminata Растение в репродуктивной стадии. (а, б) Фенотипы побегов основной колонны O. sativa (а) и O. longistaminata (б) на репродуктивной стадии после колошения. Стебель удлиняется после перехода, и на его вершине образуется метелка (P) у O. sativa и O. longistaminata. Звездочки обозначают узлы. П, метелка. Масштабная линейка = 5 см. (c) Увеличенное изображение области, обведенной квадратом на (b).После цветения образуется несколько корневищ. Звезды, узлы; наконечники стрел, корневище или удлиненные почки корневища. Масштабная линейка = 5 см. (d, e) Выстрелите верхушки надземного побега (d) и корневища (e). Дифференциация метелки начинается на вершине надземного стебля, в то время как SAM сохраняется на вегетативной стадии на вершине корневища. IM — меристема соцветия; ВМ, вегетативная меристема. Масштабная линейка = 1 мм. (f) Уровни экспрессии PAP2. Уровни экспрессии PAP2 в пластинках листьев (фунты) O.longistaminata , в SAM на репродуктивной фазе и в SAM корневища. PAP2 экспрессируется относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (g) Уровни экспрессии Hd3a. Уровни экспрессии Hd3a в листовых пластинах (Lb), оболочках листьев (Ls) и чешуйчатых листьях (Sl) O. longistaminata на вегетативной фазе (veg) и репродуктивной фазе (rep). Hd3a Экспрессия выражена относительно уровня экспрессии UBIQUITIN. Планки ошибок показывают стандартное отклонение трех повторений. (з) Схема роста побегов у O. sativa (слева) и O. longistaminata (справа). У O. sativa листья с высоким соотношением листовой оболочки к листовой пластинке образуются во время фазы молоди, которая является относительно короткой. SAM развивается в метелку, а стебель удлиняется после перехода в репродуктивную фазу. Характер роста надземной части O. longistaminata аналогичен таковому у O.сатива. С другой стороны, корневища, растущие под землей, демонстрируют уникальный характер роста. Фаза развития корневища сохраняется на ранней ювенильной фазе, а апикальная меристема корневища сохраняется как вегетативная меристема, в то время как корневище удлиняется, независимо от фазы развития надземных частей. Почки корневища дают несколько листовых зачатков, увеличиваясь в размерах и меняя угол наклона.
Обсуждение
Время развития имеет решающее значение для всех организмов в формировании архитектуры своего тела (Geuten et al . 2013). Модуляция времени развития часто работает как сильная движущая сила для создания морфологической пластичности и эволюции. Наш анализ показывает, что временной сдвиг в процессах развития критически важен для создания сложной модели развития O. longistaminata . Мы предполагаем, что гетерохронная модификация процессов развития является ключом к созданию уникальной системы развития корневища.
Наши результаты ясно показывают, что время развития регулируется независимо между наземной и подземной частями в O.longistaminata (рис. 8h). У риса ювенильная фаза, которая характеризуется высоким соотношением листовой оболочки и листовой пластинки, относительно короткая, и только первые несколько листьев проявляют эту ювенильную характеристику (Itoh et al. 2005). Напротив, листья на корневищах состоят исключительно из влагалища, напоминая первый лист на надземных побегах у O. longistaminata и O. sativa . Это означает, что корневища сохраняются в ювенильной фазе, и фазовая прогрессия сильно подавляется.Несмотря на это, корневища имеют удлиненную форму. При нормальном росте риса удлинение стебля происходит только после перехода в репродуктивную фазу (Itoh et al. 2005). У томата пазушные почки выросли до клубнеподобных органов, когда LONELY GUY ( LOG ), ген биосинтеза цитокининов, экспрессировался эктопически. Формирование эктопических клубней усиливается за счет экспрессии miR156 , позитивного регулятора ювенильной фазы (Eviatar-Ribak et al. 2013). Это означает, что эффект эктопической экспрессии LOG был модифицирован фазой роста почек.Это также указывает на то, что на развитие и характер роста пазушных почек влияют фазы развития почек.
САМ корневищ постоянно поддерживается на вегетативной фазе независимо от фазы развития надземных частей. Это подразумевает существование системы, которая блокирует SAM от входа в репродуктивную фазу. У риса изменение репродуктивной фазы обеспечивается флоригеном, который переносится от листьев к SAM. Флориген кодируется двумя генами риса: Hd3a и RFT (Tamaki et al.2007, Комия и др. 2008 г.). Экспрессия Hd3a и RFT в листьях индуцируется в условиях короткого дня. Интересно, что экспрессия Hd3a и RFT происходит только в пластинке листа и исключается из оболочки листа даже в условиях короткого дня (Tamaki et al. 2007, Komiya et al. 2008). Следовательно, отсутствие индукции Hd3a и RFT в чешуйчатых листьях корневищ, содержащих только листовую оболочку, может препятствовать переходу SAM корневища в репродуктивную стадию.Однако нельзя исключить возможность переноса белков флоригена от воздушных листьев к корневищу. В столоне, корневище картофеля, апикальная область расширяется в клубни экологически независимым образом (Nicolas et al. 2015). Формирование клубней картофеля контролируется белками, относящимися к флоригенам, которые переносятся из надземных частей растения. Несмотря на индукцию клубнеобразования, SAM в верхней части столона не поражается и остается в вегетативной стадии. Это говорит о том, что существует регуляторная сеть, контролирующая тонкую пространственную настройку временного развития картофельного столона.Понимание молекулярной основы для тонкой настройки пространственной регуляции прогрессии времени развития у O. longistaminata является важной задачей на будущее.
У многих видов растений стебли растут горизонтально. Горизонтальные стебли растут над землей, на поверхности почвы, чуть ниже земли или под землей. Строго говоря, корневища — это стебли, которые растут под землей, а остальные называются столонами или побегами. Одно сходство между этими корневищными растениями состоит в том, что в одном растении действуют две различные системы роста стебля, а именно вертикальный и горизонтальный рост.Горизонтальный рост стеблей в дополнение к нормальному вертикальному росту благоприятен для быстрого расширения территории и, следовательно, является разумной адаптивной стратегией. Здесь мы показали, что почки корневища O. longistaminata меняют угол наклона, чтобы расти горизонтально. Будет интересно узнать, сохраняется ли этот признак у других видов с горизонтальными стеблями. Более того, раскрытие молекулярных и физиологических механизмов этого процесса необходимо для улучшения нашего понимания корневищ.Быстрый прогресс геномных технологий позволил провести молекулярно-генетический анализ видов растений с уникальными и интересными средами роста, такими как развитие корневищ (Cheng et al. 2013, Koo et al. 2013, Yun et al. 2014, Zhang et al. др. 2014 г., Барбье и др. 2015 г., Сальвато и др. 2015 г., Тейхманн и Мур 2015 г., Янг и др. 2015 г.). Действительно, в настоящее время создаются модельные корневищные виды, такие как Brachypodium , Sorghum и Oryza , как описано здесь.Эти исследования предоставят основную информацию, необходимую для дальнейшего понимания молекулярных основ развития корневища.
Материалы и методы
Растительные материалы
Штаммы риса O. longistaminata (IRGC10404) и O. sativa L. cv. Nipponbare использовались. Растения выращивали в почве при естественном освещении в теплице. Для наблюдения за пазушными почек листья удаляли вручную, а фотографии делали под микроскопом (Leica MC120HD) и анализировали с использованием бесплатного программного обеспечения ImageJ (NIH).
Сканирующая электронная микроскопия
Подмышечные почки стебля и корневища фиксировали в 2,5% глутаровом альдегиде в течение ночи при 4 ° C и обезвоживали в серии растворов этанола, затем конечный раствор этанола заменяли 3-метилбутилацетатом. Затем образцы сушили, покрывали платиной и наблюдали под растровым электронным микроскопом (Hitachi S-4000) при ускоряющем напряжении 5 кВ.
Гистологический анализ
Верхушки побегов стебля и корневища фиксировали с помощью FAA (5% формалин, 5% уксусная кислота, 45% этанол и 45% воды) в течение ночи при 4 ° C и обезвоживали в серии растворов этанола, затем заливали в Paraplast plus. (Маккормик).Были сделаны поперечные срезы толщиной 10 мкм и окрашены гематоксилином. После ополаскивания в воде окрашенные срезы обезвоживали в серии градуированных этанолов, заменяли на hist-clear ® и закрепляли с помощью Multi Mount (Matsunami Glass Ind. Ltd.).
Магнитно-резонансная томография
Пазушные зачатки корневища O. longistaminata наблюдались с использованием сверхпроводящей магнитной системы с вертикальным отверстием 4,7 Тл 89 –1 мм.Для визуализации часть стебля, включая бутон, вырезали (длиной 3 см), заканчивали влажной ватой и помещали в пробирку для образца (диаметром 10 мм). Использовалась самодельная радиочастотная катушка соленоида диаметром 12 мм. Были построены катушки плоского градиента с зазорами 26–31 мм, и выход по току для градиентов x , y и z составил 46,2, 37,8 и 69,0 мТл м –1 A –1 , соответственно.
ОТ-ПЦР в реальном времени
Суммарную РНКэкстрагировали с использованием мини-набора для выделения растительной РНК (Agilent Technologies).После обработки ДНКазой I кДНК первой цепи синтезировали с использованием обратной транскриптазы SuperScript III (Invitrogen). Для амплификации транскриптов использовали следующие наборы праймеров: прямой и обратный праймеры для Hd3a , 5′-GCTAACGATGATCCCGAT-3 ‘и 5′-CCTGCAATGTATAGCATGC-3’; для PAP2 , 5′-AGCAGCTCCACTGGCTACAAATGA-3 ‘и 5′-AGGTCGCAGAGTTCATCAAG-3’; для GA20ox1 , 5′-CCTTCTCCGACTGGCTTAAT-3 ‘и 5′-GATGGATGGATGGATAATAGG-3’; для GA20ox2 , 5′-GGGAGGGTGTACCAGAAGTACTG-3 ‘и 5′-GGCTCAGCTCCAGGAGTTCC-3’; для GA20ox3 , F5′-GGAGGTGTACCAGGAGTACTGCGA-3 ‘и 5′-GTAGTGGTTCAGCCGCATC-3′; и для убиквитина 5’-AGAAGGAGTCCACGCTCCACC-3 ‘и 5′-GCCGGGCCATATAACCTTGACTT-3’.ПЦР выполняли с SYBR green I, используя Light Cycler® 480 System II (Roche Applied Science).
Финансирование
Эта работа была поддержана Японским агентством науки и технологий (JST) [Основные исследования эволюционной науки и технологии (CREST), M.A. и J.K.]; Министерство образования, культуры, спорта, науки и технологий Японии [Гранты от А.Ю. (268
) и Ю. (15K04719)].
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Список литературы
(
2015
)Готово, стойко, вперед! Сахарный удар запускает гонку по разветвлению
.Curr. Opin. Plant Biol.
25
:39
—45
.(
2000
)Изменения в экспрессии гена GA 20-оксидазы сильно влияют на длину стебля, индукцию клубней и урожайность клубней растений картофеля
.Plant J.
22
:247
—256
.(
2013
)Полногеномный анализ дифференциально экспрессируемых генов, имеющих отношение к образованию корневища в корне лотоса ( Nelumbo nucifera Gaertn)
.PLoS One
8
:e67116
.(
2013
)Фермент, активирующий цитокинин, способствует образованию клубней у томатов
.Curr. Биол.
23
:1057
—1064
.(
2013
)Гетерохронные гены в эволюции и развитии растений
.Фронт. Plant Sci.
381
:1
—11
.и другие. .(
2014
)Общесистемное сравнение тканей красного риса ( Oryza longistaminata ) позволяет идентифицировать гены и белки, специфичные для корневищ, которые являются мишенями для улучшения выращиваемого риса
.BMC Plant Biol.
14
:46
.и другие. . (
2003
)Конвергентная эволюция многолетних растений риса и сорго
.Proc. Natl. Акад. Sci. США
10
:4050
—4054
.и другие. . (
2011
)Идентификация ризом-специфичных генов с помощью анализа дифференциальной экспрессии в масштабе всего генома в Oryza longistaminata
.BMC Plant Biol.
24
:11
.и другие. . (
2005
)Развитие растений риса: от зиготы до колоска
.Physiol растительных клеток.
46
:23
—47
.(
2006
)Функциональная классификация, геномная организация, предположительно цис-действующие регуляторные элементы и взаимосвязь с локусами количественных признаков генов сорго с экспрессией, обогащенной корневищами
.Plant Physiol.
142
:1148
—1159
.(
2010
)PANICLE PHYTOMER2 ( PAP2 ), кодирующий белок MADS-box подсемейства SEPALLATA, положительно контролирует идентичность меристемы колосков в рисе
.Physiol растительных клеток.
51
:47
—57
.и другие. . (
2012
)Идентичность меристемы соцветия у риса определяется перекрывающимися функциями трех AP1 / FUL -подобных генов MADS-бокса и PAP2 , гена SEPALLATA MADS box
.Plant Cell
24
:1848
—1859
.(
2008
)Hd3a и RFT1 необходимы для цветения риса
.Девелопмент
135
:767
—774
.и другие. . (
2013
)Метки последовательности, экспрессируемые имбирем и куркумой, идентифицируют сигнатурные гены, определяющие идентичность и развитие корневища, а также биосинтез куркуминоидов, гингеролов и терпеноидов
.BMC Plant Biol.
15
:13: 27
.(
1998
)Снижение содержания GA1, вызванное сверхэкспрессией OSh2 , сопровождается подавлением экспрессии гена GA 20-оксидазы
.Plant Physiol.
117
:1179
—1184
.(
2013
)ЦВЕТОЧНИК Гены T контролируют образование луковиц и цветение
.Nat. Commun.
4
:2884
.и другие. . (
2013
)CYP714B1 и CYP714B2 кодируют 13-оксидазы гиббереллина, которые снижают активность гиббереллина в рисе
.Proc. Natl. Акад. Sci. США
110
:1947
—1952
.(
2014
)Визуализация и количественная оценка сосудистой структуры плодов с помощью магнитно-резонансной микровизуализации
.заявл. Magn. Резон.
45
:517
—525
.и другие. . (
2011
)Контроль за цветением и формированием запасающих органов картофеля с помощью FLOWERING LOCUS T
.Природа
478
:119
—122
.(
2015
)Недавно появившийся альтернативный сайт сплайсинга в гене BRANCHED1a контролирует архитектуру растения картофеля
.Curr. Биол.
25
:1799
—1809
.и другие. . (
2015
)Сравнительный протеомный анализ развивающихся корневищ древнего сосудистого растения Equisetum hyemale и различных видов однодольных
.J. Proteome Res.
14
:1779
—1791
.(
2007
)Белок Hd3a является мобильным сигналом цветения риса
.Наука
18
:1033
—1036
.и другие. . (
2011
)Белки 14-3-3 действуют как внутриклеточные рецепторы для риса Hd3a florigen
.Природа
31
:332
—335
.(
2015
)Формирование архитектуры предприятия
.Фронт. Plant Sci.
6
:233
.и другие. . (
2010
)Идентификация генов, связанных с развитием почек корневища бамбука
.J. Exp. Бот.
61
:551
—561
.(
2013
)Целевое картирование областей локусов количественных признаков для ризоматичности в хромосоме SBI-01 и анализ перезимовки в популяции Sorghum bicolor × S. propinquum
.Мол. Порода.
31
:153
—162
.и другие. . (
2015
)Транскриптомный анализ регуляции образования корневищ лотоса умеренного и тропического климата ( Nelumbo nucifera )
.Sci. Реп.
5
:13059
.(
2014
)Генетический контроль корневищ и геномная локализация QTL основного эффекта роста у многолетней дикой ржи
.Мол. Genet. Геномика.
289
:383
—397
.и другие. . (
2014
)Глубокое секвенирование транскриптома корневища и надземных побегов Sorghum propinquum
.Завод Мол. Биол.
84
:315
—327
.Сокращения
© Автор 2016.Опубликовано Oxford University Press от имени Японского общества физиологов растений. Все права защищены. Для получения разрешения обращайтесь по электронной почте: [email protected]
Адаптация к окружающей среде
Адаптация
Самая заметная адаптация папоротников — это наличие корневище. Корневище или стебель папоротника солодки развивается горизонтально под почвой, с растущим кончиком, который уступает место развитию новой вайи.Консистенция корневищ может варьироваться от древесной твердости до плюшевой мягкости текстура. Внутри корневища расположены сосуды. ткань, которая транспортирует необходимые минералы, воду и пищу в остальное растение при необходимости. Для получения дополнительной информации корневища щелкают здесь!
[Вверху] Удаленные корневища папоротника солодки, фото Криса Корригана
Еще одна примечательная адаптация растений папоротника — это их перисто-сложенные листья.Эта адаптация оказывается узнаваемой характеристикой папоротника. растения, а также один полезный. Сложив листья, папоротники увеличивают их общая площадь поверхности. В чем преимущество большего размера? Почему это хорошие характеристики? Чтобы ответить на этот вопрос, нужно оценить молекулярную аспект того, как организмы функционируют. Имея большую площадь поверхности за счет листья, (держатели важных хлоропластов / где световые реакции превращаются в свет в сахар), у растения гораздо больше шансов на выживание.Это увеличило площадь поверхности и производство сахара позволяют растению расти, когда окружающая среда позволяет это, позволяя папоротнику расти к источнику света одновременно увеличивая его общую массу.
Увеличение массы может означать жизнь или смерть для первичного производителя и фотоавтотрофный организм при охоте со стороны гетеротрофов. Другие приспособления были сделаны в папоротниках, некоторые с другими организмы. Чтобы проверить некоторые из эти поистине уникальные и невероятные взаимодействия, нажмите здесь!
Чтобы вернуться на главную страницу, щелкните здесь.
UWL Сайт
Хейли
Полномочия, 2013.
Convallaria majalis — многолетнее растение. Латынь нам помогает рассечь корни этого слова по отношению к растению. « на », означающее «до», и « annus », означающее год, дает нам кое-что. например, «через годы» для приблизительного перевода. Применяя наши знание латыни и растений (как у настоящих ученых), это означает что он будет расти более двух лет подряд, или на протяжении многих лет.
Корневища
Устойчивости этого растения может способствовать измененный корень.
структуры, которые образуются в период раннего цветения и плодоношения
времена года. Эта адаптация существует каждый год подряд.
после этого. Эти богатые питательными веществами структуры называются корневищами.
Корневища находятся около корней и часто не видны сверху.
земля в то время как
они развиваются. Это уникальная адаптация
что помогает растению расти в различных
среды обитания.Внутри корневища растение накапливает питательные вещества, чтобы молодой стебель мог вырасти и вырасти в сторону.
Солнечный свет. Одно и то же корневище может дать начало гораздо большему количеству стеблей.
чем тот, из которого он вырос, что позволило увеличить стебли над
земля. Эти корневища являются основным средством размножения внутри
растение, поэтому обязательно посмотрите на
страницу адаптации, чтобы понять их. Эта форма корневища обычно является той, в которой растение можно купить,
но в садоводстве его называют «пип».
Ягоды и семена
Однако большая часть жизненного цикла растения произошла до этого
точка уже. Начнем с фруктовой фазы разработки. В
ягоды, которые на самом деле являются завязями растения, содержат в себе семена,
зародыши растения.
Распространение плода и семян вместе с ним обычно не может
на большинстве растений возникают без помощи животных. Но мы знаем Ягоды Convallaria majalis смертельны, если
потребляется.Ну тогда — как эти семена разносятся? В
зрелые плоды отваливаются где-то рядом с растением, и семена
обычно устанавливают там. Корневища также способствуют распространению, так как
обсуждалось ранее. Хотя эта система кажется примитивной, она подходит для Convallaria majalis . Это растение
особенно стойкий и быстрорастущий. Часто он вырастает в
большие пятна, если оставить без присмотра. Иногда ландыш
считается сорняком из-за его быстро разрастающегося и инвазионного
тенденции.
Фрэнк Винсент, Wikimedia Commons, 2007.
Всхожесть
Как только семя окажется на земле, оно может прорасти.
Прорастание — это когда стебель растения и корни вырываются из
семена и начинают расти. Условия должны быть идеальными для растения
прорасти. Подобно людям, ложащимся спать, Homo sapiens должен обладать идеальным
количество света, нужная температура и все необходимые удобства.Теперь подумайте о семенах как о людях; они очень
в частности об их условиях. Convallaria majalis предпочитает
умеренно теплые температуры, богатая питательными веществами почва и полутень
чтобы прорасти. Эти условия несколько ограничивают
среды обитания растения, но все же позволяют
быть довольно широко распространенным.
Развитие
Convallaria majalis развивается и растет через
из теплых весенних месяцев и обычно достигает зрелости раньше
летом.Со зрелостью приходит
большая ответственность. Ну, они выращивают цветы …. но это прозвучало
хорошо право? Красивые цветы существуют не только для того, чтобы быть красивыми,
хотя они делают прекрасную работу.
Они являются домом для репродуктивных структур, которые будут
в конечном итоге создать плод. На этом веб-сайте подробно рассказывается об удобрениях растений и их жизни.
циклы.
Растения также обладают уникальной особенностью, называемой изменением поколения, которое представлено на верхней диаграмме цифрой n и 2n обозначений.Это изменение количества копий ДНК, присутствующая в клетках, имеет большое значение. Если ты незнаком с сменой поколений, изучите это образовательный ресурс.
Мораль истории любви к оплодотворению заключается в том, что пыльца из пыльник движется по пыльцевой трубке плодолия и удобряет отдельные семяпочки в яичнике. Много хитрых слов, но медведь со мной. Завязь внутри цветка созреет, пока цветок все еще на заводе.Примерно в конце летнего сезона, когда завязь близка к созреванию и больше не зависит от растения питательные вещества, ягоды отваливаются растения и обычно на землю внизу. Весь процесс начинается сам себя снова, завершая жизненный цикл.
Если вы действительно хотите знать, каково это — жить Convallaria majalis , продолжайте читать эту страницу сверху вниз Нижний. До конца твоей жизни…но не забывайте о тех корневища!
Теперь, когда вы прошли в Convallaria majalis ‘s метафорический обувь, вы должны, проверить некоторые интересные взаимодействия, которые он имеет с другими организмами.
Пластичность корневищ и клональный поиск пищи Calamagrostis Canadensis в ответ на неоднородность среды обитания в JSTOR
Abstract1 Был проведен тепличный эксперимент, в котором особи корневищной травы Calamagrostis canadensis выращивались в деревянных ящиках, заполненных почвой.Непосредственно рядом с каждым растением с одной стороны находилась контрольная зона (те же условия, в которых росло растение), в то время как непосредственно примыкающая с другой стороны была зона с одним из экспериментальных условий («тень», «холодная почва». , «прохладная почва + тень» или «прохладная почва + внутривидовая конкуренция»). Корневище каждого растения позволяли одновременно расти как на контрольной, так и на обработанной стороне. 2 Меньшее количество корневищ выросло в зону «холодная почва + конкуренция» по сравнению с количеством корневищ от того же растения, которое росло на контрольной стороне, а те, которые росли, были короче, демонстрировали меньшее ветвление, имели более короткие междоузлия и давали меньше побегов.Корневища, попадающие в зону «прохладной почвы» (с затенением или без), демонстрировали меньший рост по сравнению с корневищами того же человека, которые росли на контрольной стороне. 3 Calamagrostis canadensis, по-видимому, демонстрирует «оппортунистическую партизанскую» стратегию клонального поиска пищи. Получив возможность «выбирать» между различными микропредприятиями для расширения клонов, растения продемонстрировали преимущественное проникновение и использование благоприятных микроместообитаний (т. Е. Теплая почва, незатененная, свободная от конкуренции). 4 Для людей, столкнувшихся со значительной неоднородностью окружающей среды, пластичность роста и развития корневища позволяет в большей степени использовать более благоприятные микробытовые среды.Это может сыграть важную роль в сохранении этого вида в различных средах обитания бореальных лесов.
Информация о журналеJournal of Ecology публикует оригинальные исследования по всем аспектам экологии растений (включая водоросли) как водных, так и наземных экосистемы. Исследования растительных сообществ, популяций или отдельных видов принимаются, а также исследования взаимодействий между растениями и животными, грибки или бактерии, при условии, что они ориентированы на экологию растений.Статьи необходимо передавать сильные и экологические идеи, которые способствуют нашему пониманию экологических принципов и представленные исследования должны выходить за рамки тематических исследований. Принимаются как экспериментальные, так и теоретические исследования, так как являются описательными или историческими отчетами, хотя они должны давать представление о вопросы, представляющие общий интерес для экологов. Журнал не публикует статьи. касается исключительно культурных растений и сельскохозяйственных экосистем. Журнал издается шесть раз в год.Более подробная информация доступна на сайте www.journalofecology.org. JSTOR предоставляет цифровой архив печатной версии журнала Journal of Экология. Электронная версия журнала Экология. доступно по адресу http://www3.interscience.wiley.com/journal/118509661/home. Авторизованные пользователи могут иметь доступ к полному тексту статей на этом сайте.
Информация для издателяБританское экологическое общество — это гостеприимный и инклюзивный дом для всех, кто интересуется экологией.Общество было основано в 1913 году и насчитывает более 6000 членов по всему миру, объединяя людей в региональном, национальном и глобальном масштабах для продвижения экологической науки. Многие виды деятельности BES включают публикацию ряда научной литературы, в том числе семи всемирно известных журналов, организацию и спонсорство широкого спектра встреч, финансирование многочисленных схем грантов, образовательную работу и политическую работу.
30.2D: Модификации стержня — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Модификации стебля
Модификации стебля, наземные, подземные или воздушные, позволяют растениям выживать в определенных местах обитания и средах.
Задачи обучения
- Объясните причины модификации штанги
Ключевые точки
- Модифицированные стебли, растущие горизонтально под землей, являются либо корневищами, из которых растут вертикальные побеги, либо более мясистыми клубнелуковицами, хранящими пищу.
- Новые растения могут возникать из узлов столонов и побегов (надземный столон): стебли, идущие параллельно земле или чуть ниже поверхности.
- Картофель — это пример клубней: набухшие концы столонов, в которых может накапливаться крахмал.
- Модификация стебля, которая имеет увеличенные мясистые листья, выходящие из стебля или окружающие основание стебля, называется луковицей; он также используется для хранения продуктов.
- Воздушные модификации стеблей включают усики, шипы, луковицы и кладоды.
Ключевые термины
- столон : побег, который растет вдоль земли и дает корни в своих узлах; бегун
- клубень : мясистый утолщенный подземный стебель растения, обычно содержащий накопленный крахмал, например картофель или маранта
- кладода : зеленые ветви ограниченного роста, взявшие на себя функции фотосинтеза
- корневище : горизонтальный подземный стебель некоторых растений, который выпускает корни и побеги из своих узлов
- клубнелуковица : короткий вертикальный раздутый подземный стебель растения, служащий запасающим органом, позволяющим растению пережить зиму или другие неблагоприятные условия, такие как засуха
- луковица : корневая часть растения в форме луковицы, например тюльпан, из которой можно отрастить остальную часть растения.
- усик : тонкий, закручивающийся по спирали стебель, прикрепляющий растение к опоре
- шип : острый защитный шип растения
- луковица : бутон в форме луковицы на месте цветка или в пазухе листа
Модификации штока
Некоторые виды растений имеют модифицированные стебли, которые особенно подходят для конкретной среды обитания и окружающей среды.Корневище — это видоизмененный стебель, который растет горизонтально под землей; у него есть узлы и междоузлия. Вертикальные побеги могут возникать из почек на корневищах некоторых растений, например, имбиря и папоротников. Клубнелуковицы похожи на корневища, за исключением того, что они более округлые и мясистые (как у гладиолусов). Клубнелуковицы содержат запасенную пищу, позволяющую некоторым растениям пережить зиму. Столоны — это стебли, которые проходят почти параллельно земле или чуть ниже поверхности и могут давать ростки в узлах. Бегуны — это тип столона, который движется над землей и производит новые растения-клоны в узлах с разными интервалами: например, клубника.Клубни — это модифицированные стебли, которые могут накапливать крахмал, как это видно на картофеле. Клубни возникают как вздутые концы столонов и содержат множество придаточных или необычных почек (знакомых нам как «глазки» на картофеле). Луковица, которая функционирует как подземное хранилище, представляет собой модификацию стебля, которая имеет вид увеличенных мясистых листьев, выходящих из стебля или окружающих основание стебля, как видно на радужной оболочке.
Рисунок \ (\ PageIndex {1} \): Модификации стебля : Модификации стебля позволяют растениям процветать в различных средах.Показаны (a) корневища имбиря (Zingiber officinale), (b) клубнелуковица цветка падальщика (Amorphophallus titanum), (c) столоны родосской травы (Chloris gayana), (d) побеги клубники (Fragaria ananassa), (e) картофель (Solanum tuberosum) клубни и (е) луковицы красного лука (Allium).Модификации надземных стеблей, вегетативных почек и цветочных почек растений выполняют такие функции, как лазание, защита и синтез пищи для вегетативного размножения. Воздушные модификации стволов включают:
Рисунок \ (\ PageIndex {1} \): Воздушные модификации стеблей : Найдено на юго-востоке США, (а) лоза гречихи (Brunnichia ovata) — сорное растение, которое поднимается с помощью усиков.Этот показан взбирающимся на деревянный столб. (б) Шипы — это модифицированные ветви.- Щупальца — это тонкие, вьющиеся пряди, которые позволяют растению (например, гречихе) искать опору, карабкаясь по другим поверхностям. Они могут развиваться либо из пазушной почки, либо из конечной почки стебля.
- Шипы — это модифицированные ветви, выглядящие как твердые, древесные, острые выросты, которые защищают растение; распространенными примерами являются розы, апельсиновый ягод и трость дьявола.
- Луковицы — это пазушные почки, которые стали мясистыми и округлыми из-за хранения пищи.Они отделяются от растения, падают на землю и развиваются в новое растение.
- Cladodes — зеленые ветви ограниченного роста (обычно длиной в одно междоузлие), взявшие на себя функции фотосинтеза.
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
- Курирование и проверка. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
- Колледж OpenStax, Биология.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…ol11448/latest . Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 19 ноября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/?collection=col11448/latest . Лицензия : CC BY: Attribution
- черешка. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/petiole . Лицензия : CC BY-SA: Attribution-ShareAlike
- пазушная почка. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/axillary%20bud . Лицензия : CC BY-SA: Attribution-ShareAlike
- междоузлия. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/internode . Лицензия : CC BY-SA: Attribution-ShareAlike
- Безграничный. Источник : Безграничное обучение. Адрес: : www.boundless.com//physics/definition/node . Лицензия : CC BY-SA: Attribution-ShareAlike
- OpenStax College, Stems.19 ноября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/#fig-ch40_02_01 . Лицензия : CC BY: Attribution
- паренхима. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/parenchyma . Лицензия : CC BY-SA: Attribution-ShareAlike
- Флоэма. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/phloem . Лицензия : CC BY-SA: Attribution-ShareAlike
- трахеида. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/tracheid . Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/?collection=col11448/latest . Лицензия : CC BY: Attribution
- склереида. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/sclereid . Лицензия : CC BY-SA: Attribution-ShareAlike
- лигнин. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/lignin . Лицензия : CC BY-SA: Attribution-ShareAlike
- колленхима. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/collenchyma . Лицензия : CC BY-SA: Attribution-ShareAlike
- трихома. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/trichome . Лицензия : CC BY-SA: Attribution-ShareAlike
- кора головного мозга. Источник : Викисловарь. Адрес: : http://en.wiktionary.org/wiki/cortex . Лицензия : CC BY-SA: Attribution-ShareAlike
- склеренхима. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/sclerenchyma . Лицензия : CC BY-SA: Attribution-ShareAlike
- пробка. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/pith . Лицензия : CC BY-SA: Attribution-ShareAlike
- стома. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/stoma . Лицензия : CC BY-SA: Attribution-ShareAlike
- ксилема. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/xylem . Лицензия : CC BY-SA: Attribution-ShareAlike
- OpenStax College, Stems. 19 ноября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/#fig-ch40_02_01 . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_03.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest…0_02_05abc.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest…e_30_02_02.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_06.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…_02_04abcf.png . Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/?collection=col11448/latest . Лицензия : CC BY: Attribution
- суберин. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/suberin . Лицензия : CC BY-SA: Attribution-ShareAlike
- lenticel. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/lenticel . Лицензия : CC BY-SA: Attribution-ShareAlike
- перидерма. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/periderm . Лицензия : CC BY-SA: Attribution-ShareAlike
- OpenStax College, Stems.19 ноября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/#fig-ch40_02_01 . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_03.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest…0_02_05abc.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest/Figure_30_02_02.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest/Figure_30_02_06.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…_02_04abcf.png . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_08.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_09.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_07.jpg . Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/?collection=col11448/latest . Лицензия : CC BY: Attribution
- Модификация штанги воздушной. Источник : Википедия. Адрес: : http://en.Wikipedia.org/wiki/Aerial_stem_modification . Лицензия : CC BY-SA: Attribution-ShareAlike
- корневище. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/rhizome . Лицензия : CC BY-SA: Attribution-ShareAlike
- клубнелуковица. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/corm . Лицензия : CC BY-SA: Attribution-ShareAlike
- шип. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/thorn . Лицензия : CC BY-SA: Attribution-ShareAlike
- лампочка. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/bulb . Лицензия : CC BY-SA: Attribution-ShareAlike
- столонь. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/stolon . Лицензия : CC BY-SA: Attribution-ShareAlike
- усик. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/tendril . Лицензия : CC BY-SA: Attribution-ShareAlike
- луковица. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/bulbil . Лицензия : CC BY-SA: Attribution-ShareAlike
- Безграничный. Источник : Безграничное обучение. Адрес: : www.boundless.com//biology/definition/cladode . Лицензия : CC BY-SA: Attribution-ShareAlike
- клубень. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/tuber . Лицензия : CC BY-SA: Attribution-ShareAlike
- OpenStax College, Stems. 19 ноября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/#fig-ch40_02_01 . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest/Figure_30_02_03.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest/Figure_30_02_05abc.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest/Figure_30_02_02.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44702/latest/Figure_30_02_06.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest/Figure_30_02_04abcf.png . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_08.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_09.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…e_30_02_07.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems. 17 октября 2013 г. Предоставлено : OpenStax CNX. Адрес: : http://cnx.org/content/m44702/latest…2_10abcdef.jpg . Лицензия : CC BY: Attribution
- OpenStax College, Stems.

 Сравнивать простейших животных и растений. Объяснять значение простейших в природе и жизни человека
Сравнивать простейших животных и растений. Объяснять значение простейших в природе и жизни человека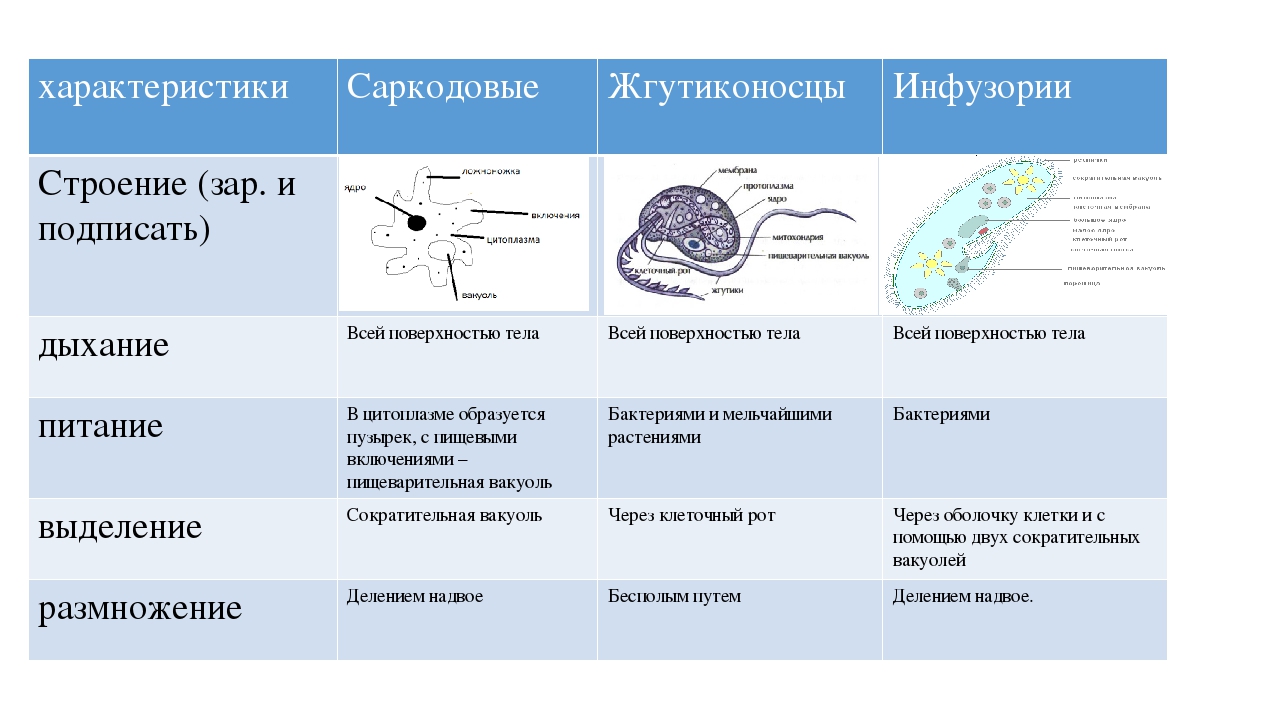
 Клеточный рот.
Клеточный рот.