Род паразитических простейших один из представителей которого вызывает сонную болезнь
Видеоурок познакомит с систематическими группами простейших, их характерными признаками и строением. Основные понятия урока: простейшие; корненожки; радиолярии; солнечники; споровики; циста; раковина.
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности
Конспект урока «Простейшие»
Кто же такие простейшие? Из названия можно догадаться, что это какие-то «простые» организмы. О том, простые они или нет, и что вообще из себя представляют простейшие, вы узнаете из нашего урока. Итак, давайте уже поскорее начнём…
Простейшие — это царство одноклеточных или колониальных эукариот, которые имеют гетеротрофный тип питания.
Вспомним, что эукариоты — это ядерные организмы, клетки которых содержат ядро. Значит, прокариоты безъядерные. И это важно знать, так как ядерные организмы более совершенны. Также в определении говорится о том, что прокариоты имеют гетеротрофный тип питания.
Также в определении говорится о том, что прокариоты имеют гетеротрофный тип питания.
Вспомним, что к органическим веществам относят: белки, липиды, углеводы, нуклеиновые кислоты и некоторые биологически активные вещества. А к неорганическим относят воду и минеральные вещества.
В сравнении с гетеротрофами, автотрофы, например, которые способны сами синтезировать органические вещества. Вспомним, кто относится к автотрофам. Это, в первую очередь, зелёные растения. Они способны создавать органические вещества из неорганических, используя световую энергию. Этот процесс называется фотосинтезом.
Вернёмся к простейшим. Среди них есть хищники, которые питаются одноклеточными или нитчатыми водорослями, микроскопическими грибами, а также другими видами простейших. Также микрофаги, способные питаться мельчайшими частицами, бактериями и детритом — мёртвым органическим веществом или разлагающимися остатками. Также среди простейших есть паразитические формы, которые существуют за счёт своих хозяев.
Некоторые простейшие способны и к фотосинтезу. Так, эвглена зелёная на свету способна к автотрофному способу питания, а в темноте — к гетеротрофному.
Простейшие, не имеющие постоянной формы тела, способны захватывать пищу всей его поверхностью с помощью фагоцитоза и пиноцитоза.
Фагоцитоз — это захват твёрдых частиц пищи, а пиноцитоз — захват капелек жидкости с помощью ложноножек.
Итак, узнав немного о простейших, мы можем сказать, что простейшие — это ядерные организмы, которые потребляют уже готовые органические вещества.
Большинство простейших — это одноклеточные организмы. Рассмотреть их можно только с помощью увеличительных приборов. Но эта клетка — целый организм, ведущий самостоятельное существование. Простейшим свойственны все жизненные функции: дыхание, питание, выделение, обмен веществ, раздражимость, движение, размножение.
Простейшие обитают в воде, влажной почве или в теле различных животных и человека.
Снаружи клетка покрыта цитоплазматической мембраной. Основные компоненты клетки одноклеточных — это ядро и цитоплазма.
Основные компоненты клетки одноклеточных — это ядро и цитоплазма.
В цитоплазме содержатся все органоиды, характерные для животной клетки, ― это митохондрии, рибосомы, лизосомы, комплекс Гольджи, эндоплазматическая сеть.
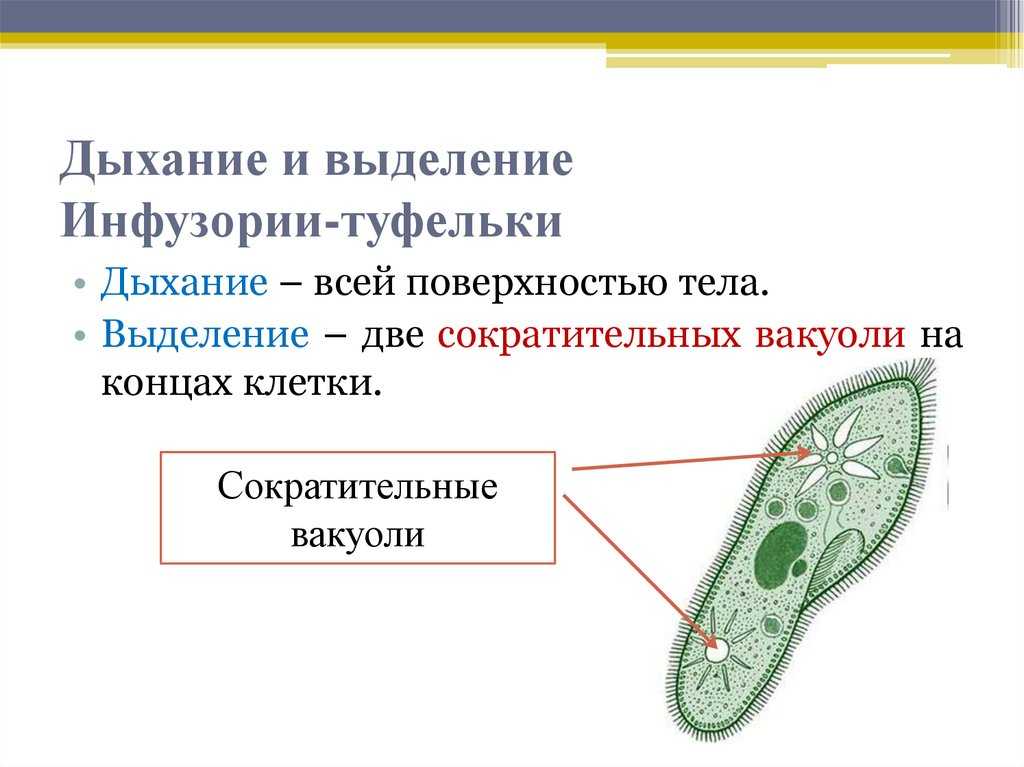
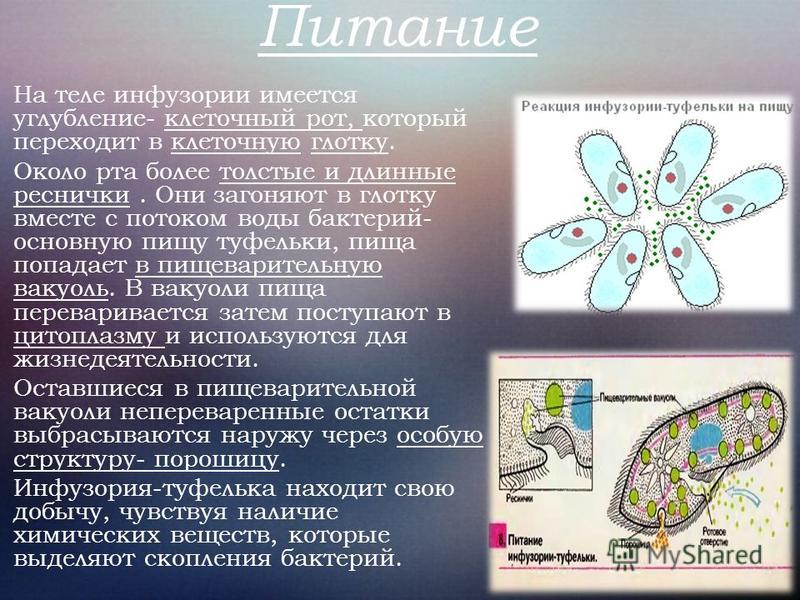
Кроме этого, у простейших имеются органоиды специального назначения. Функцию пищеварения, например, выполняет пищеварительная вакуоль, а функцию выделения — сократительные вакуоли. Дыхание одноклеточных простейших осуществляется всей поверхностью тела.
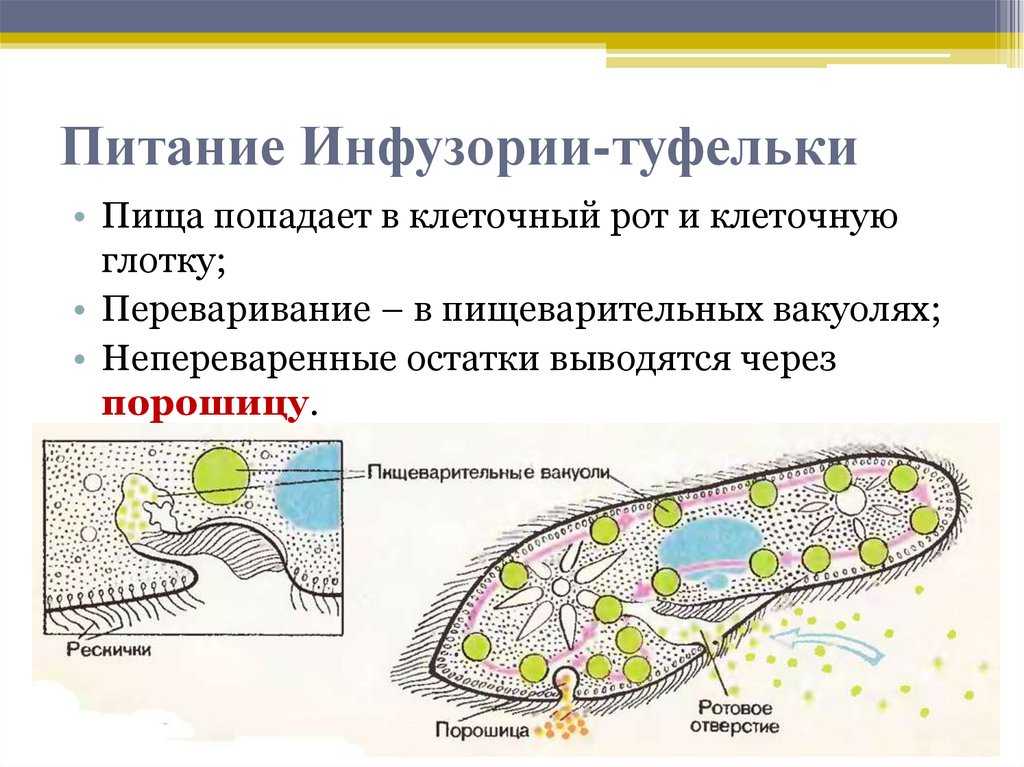
Одноклеточные с постоянной формой тела имеют клеточный рот, клеточную глотку, а также орган выделения — порошицу —отверстие, через которое выводятся непереваренные остатки пищи.
Органоидами движения у простейших могут быть ложноножки, жгутики, реснички.
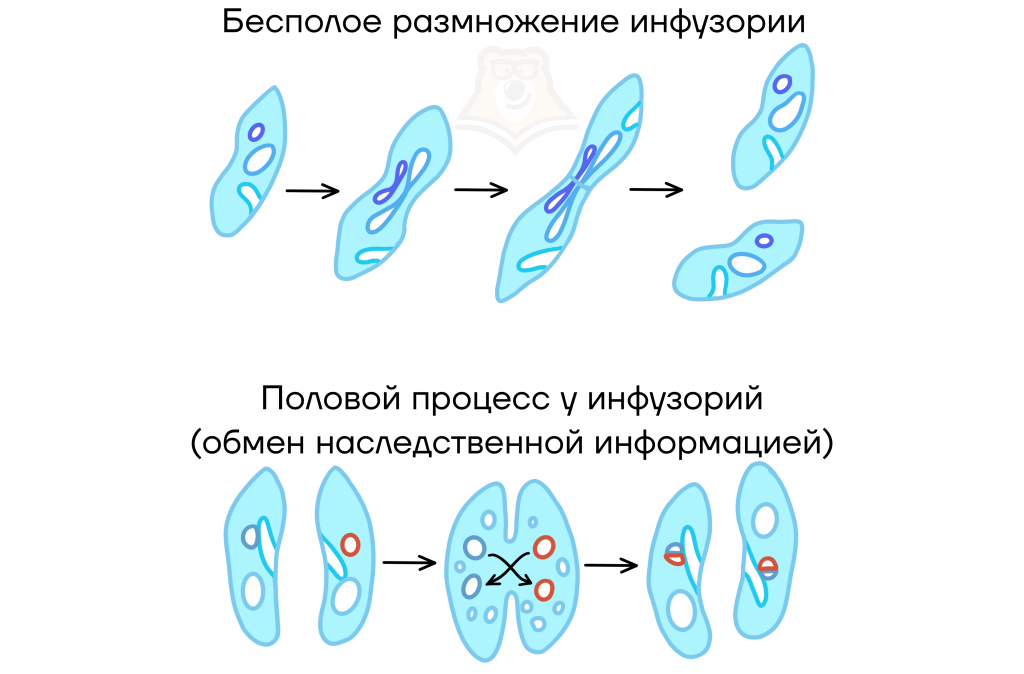
Размножение простейших происходит преимущественно бесполым способом. Сначала надвое делится ядро, затем делится цитоплазма.
А при половом размножении происходит слияние (копуляция) половых клеток гамет, мужской и женской особи, с образованием зиготы.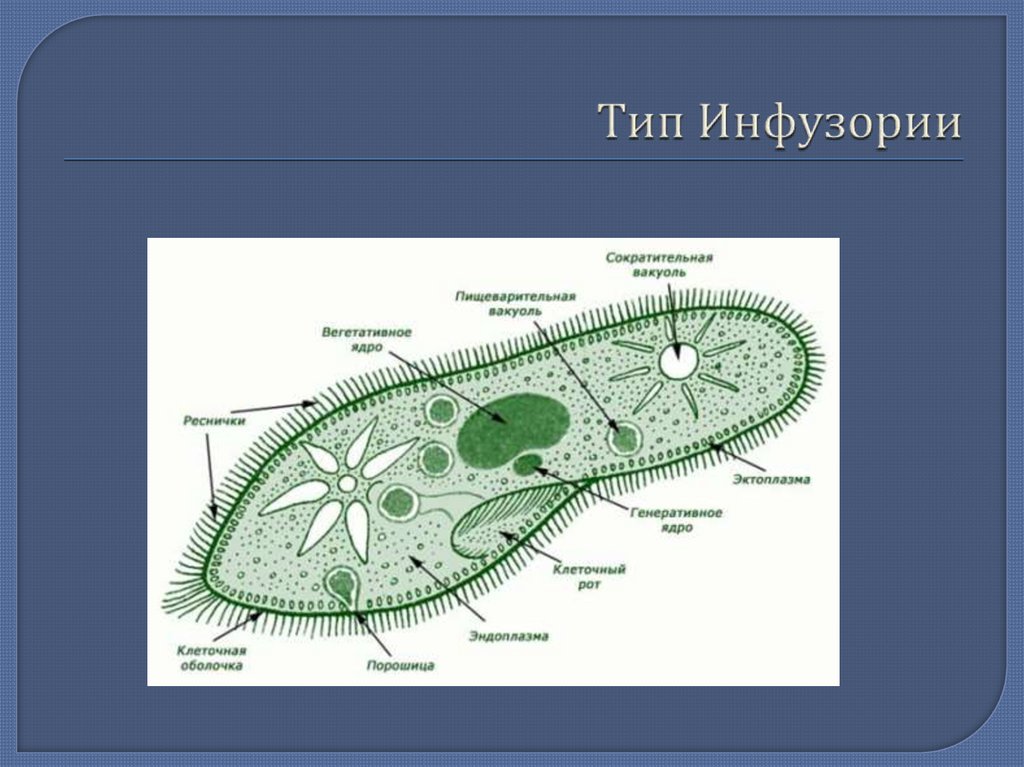
Простейшие с наступлением неблагоприятных условий способны образовывать цисту. В цистах процессы жизнедеятельности клетки практически прекращаются, но они могут оставаться жизнеспособными в течение десятков лет до наступления благоприятных условий.
При благоприятных условиях простейшее освобождается от оболочки и начинает вести подвижный образ жизни.
В 1676 году Антони ван Левенгук в микроскоп обнаружил группы одноклеточных организмов, не имеющих зелёной окраски. Их отнесли к типу простейшие. Считалось, что все животные этого типа состоят только из одной клетки.
В XXI веке систематики относят простейших к животноподобным протистам, не придавая этой группе таксономического значения и ранга. Протисты классифицируются как эукариотические организмы.
Простейших обычно классифицировали по способам передвижения, хотя данная характеристика не отражает реального родства.
Простейшие животные, которые относятся к типу Саркожгутиконосцы, устроены наиболее просто по сравнению с остальными типами, так как это наиболее древние простейшие. Данный тип представлен двумя классами: Саркодовые, или Корненожки и Жгутиковые. Сегодня на уроке мы познакомимся с классом Саркодовые, или как их ещё называют — Корненожки.
Данный тип представлен двумя классами: Саркодовые, или Корненожки и Жгутиковые. Сегодня на уроке мы познакомимся с классом Саркодовые, или как их ещё называют — Корненожки.
Корненожки — это одноклеточные организмы, передвигающиеся с помощью ложноножек — выпячиваний цитоплазмы, напоминающих корни растений. Корненожки обитают в морской и пресной воде, почве, и в других организмах.
К корненожкам относятся: хорошо известные амёбы, раковинные амёбы и фораминиферы.
Существуют корненожки, тело которых покрыто известковой раковиной. Среди них наиболее интересны фораминиферы, обитающие в водах Мирового океана во всех широтах и на всех глубинах. Раковинка выполняет защитную функцию, её стенки пронизаны мельчайшими порами, через которые наружу выходят псевдоподии. Внутри раковинок находятся цитоплазматические органеллы и одно ядро.
Из паразитических корненожек наиболее опасна амёба дизентерийная — паразит человека, вызывающий кишечное заболевание.
Познакомимся со строением корненожек на примере амёбы обыкновенной, которая является представителем данного класса. Амёба — одна из крупных свободноживущих простейших. Амёбу можно увидеть невооружённым глазом, она имеет размеры примерно 0,5 мм. Живёт она в пресных водоёмах. Тело амёбы имеет все характерные для ядерной клетки особенности строения.
Попробуем рассмотреть под микроскопом представителя животного мира — амёбу обыкновенную. Это проба, взятая в озере. Возьмём каплю воды с её дна и нанесём на предметное стекло.
Амёба обыкновенная — это маленький (0,2—0,5 мм), едва заметный простым глазом бесцветный студенистый организм, постоянно меняющий свою форму.
Амёба состоит из одной клетки, эта клетка — целый организм, ведущий самостоятельное существование.
Мы наблюдаем, как она при помощи своих ложноножек захватывает пищу.
Благодаря микроскопу невидимый глазу мир становится видимым.
К морским саркодовым, имеющим внутренний «скелет» относятся радиолярии, или лучевики, — это одноклеточные, реже колониальные, свободноживущие простейшие, имеющие минеральный скелет в виде удивительно красивых образований.
Причудливые выросты на раковинах радиолярий значительно увеличивают площадь поверхности тела, что способствует их передвижению в толще воды.
Радиолярии распространены преимущественно в тёплых морях.
Третий подкласс класса саркодовых — это солнечники (Heliozoa). Тело большинства солнечников напоминает «солнышко», но лишено минерального скелета. Солнечники внешне во многом похожи на радиолярий. Они имеют шаровидную форму тела с прямыми, расходящимися по радиусам псевдоподиями, напоминающими солнечные лучи.
Сюда относится всего несколько десятков видов простейших, часть которых обитает в пресной, часть в морской воде. Большинство солнечников — свободноплавающие в толще воды организмы, лишённые минерального скелета. Некоторые виды ведут прикреплённый к субстрату образ жизни.
Пищевые объекты солнечников разнообразны. Это могут быть различные простейшие (инфузории, жгутиконосцы), но также и мелкие многоклеточные животные (например, коловратки, мелкие ресничные черви). Если какое-либо мелкое животное или растение прикоснётся к псевдоподии — выросту цитоплазмы, то оно тотчас же прилипает к ней и очень скоро теряет способность двигаться.
Если какое-либо мелкое животное или растение прикоснётся к псевдоподии — выросту цитоплазмы, то оно тотчас же прилипает к ней и очень скоро теряет способность двигаться.
К простейшим относятся и одноклеточные организмы, ведущие полностью паразитический образ жизни, — это споровики. Во время своего цикла развития они образуют особые стадии размножения, состоящие из зародыша, в большинстве случаев окружённого плотной оболочкой. Эти образования называются спорами. Отсюда и название класса. В споре может быть и один, и несколько зародышей.
Обитают споровики в органах пищеварения, выделения, размножения, а также в крови животных и человека, например, как малярийный плазмодий. Споровики приносят большой вред, снижая продуктивность сельскохозяйственных животных и вызывая их гибель.
С 1861 по 1881 г. с помощью микроскопа удалось установить все фазы развития малярии в крови человека. В начале XX в. обнаружили и переносчика малярии — комара из рода Анофелес. С этого же времени начали активно бороться с переносчиками болезни, поэтому теперь от малярии умирает значительно меньше людей, чем раньше.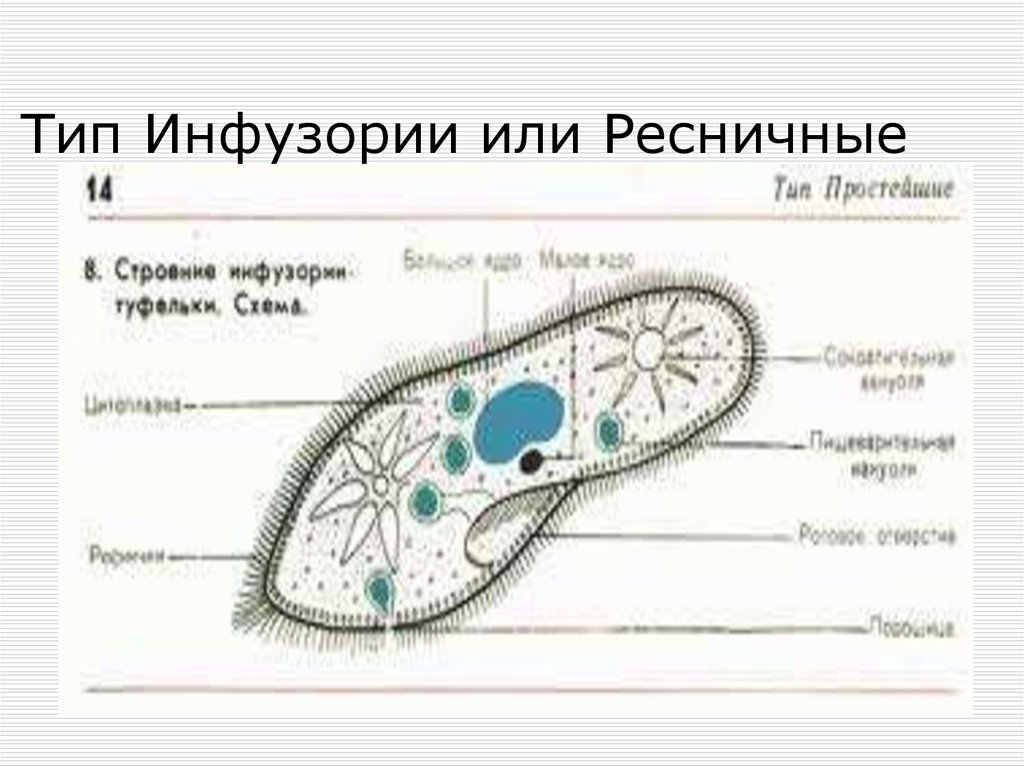 Однако и в настоящее время встречаются очаги малярии.
Однако и в настоящее время встречаются очаги малярии.
Простейшие жгутиконосцы имеют один, два или много жгутиков. Среди жгутиконосцев есть и такие организмы, которые по строению во многом схожи с одноклеточными водорослями. Некоторые учёные относят их к растительным жгутиконосцам. Все растительные жгутиконосцы ведут свободный образ жизни в водной среде.
Известны не только одноклеточные жгутиконосцы, но и колониальные виды, состоящие из 8, 16, 32 и даже 20 тыс. клеток. Каждая клетка колонии по своему строению очень напоминает одноклеточную зелёную водоросль хламидомонаду.
Все растительные жгутиконосцы могут фотосинтезировать, то есть сами синтезировать органические вещества и питаться как растения, поскольку в их клетках имеется зелёный пигмент — хлорофилл.
Некоторые из жгутиконосцев, например эвглена зелёная, на свету питаются как растения, а в темноте как животные — готовыми органическими веществами.
Другие жгутиконосцы не имеют хлоропластов. Среди них есть свободноживущие особи, но основные представители их перешли к паразитическому образу жизни (в растительных и животных организмах). Например, известны трихомонада кишечная и лямблия, которые паразитируют в кишечнике человека и животных.
Например, известны трихомонада кишечная и лямблия, которые паразитируют в кишечнике человека и животных.
Обычно у простейшего трихомонады имеется пять передних жгутиков, один из которых направлен назад. У некоторых особей обнаруживается лишь четыре или три передних жгутика. Кроме того, один жгутик идёт вдоль мембраны и выходит за её пределы, как свободный рулевой жгутик.
Род простейших класса жгутиковых — трипаносомы — паразитические одноклеточные организмы, которые обитают в крови человека и животных. Переносчиком трипонасом являются насекомые. В частности муха цеце является переносчиком трипонасомы — возбудителя сонной болезни. Вспышки этой болезни регулярно происходят в некоторых регионах Тропической Африки.
Паразитические простейшие лейшмании поражают преимущественно кожу, слизистые оболочки и внутренние органы. Переносчиками лейшманий являются москиты.
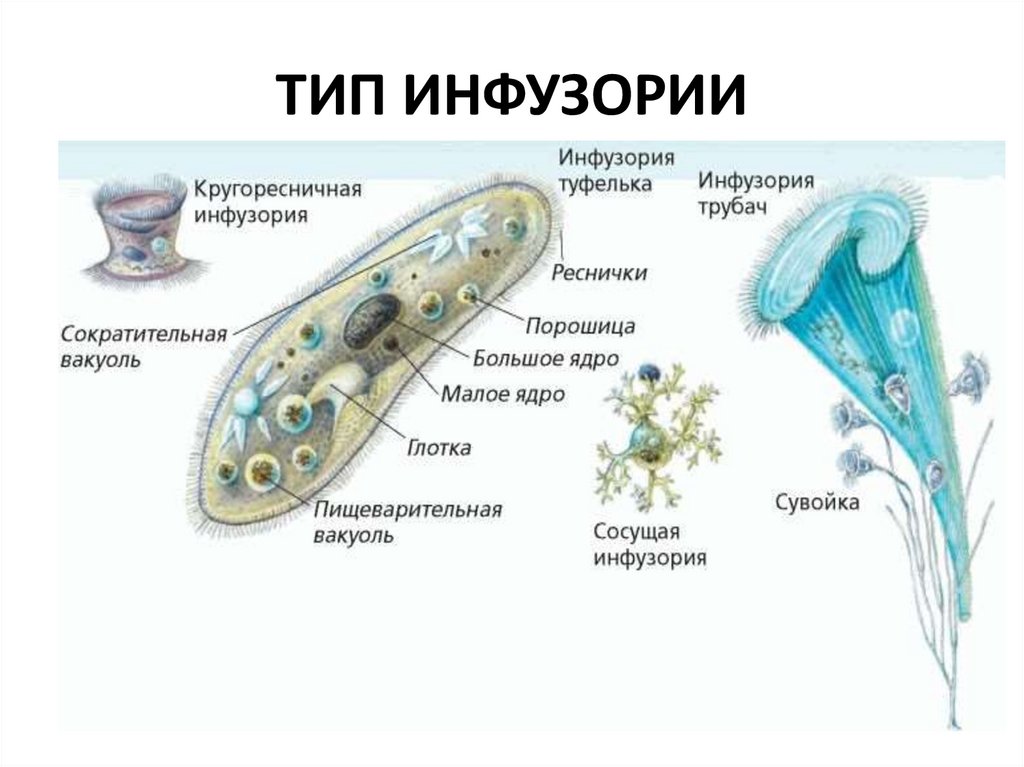
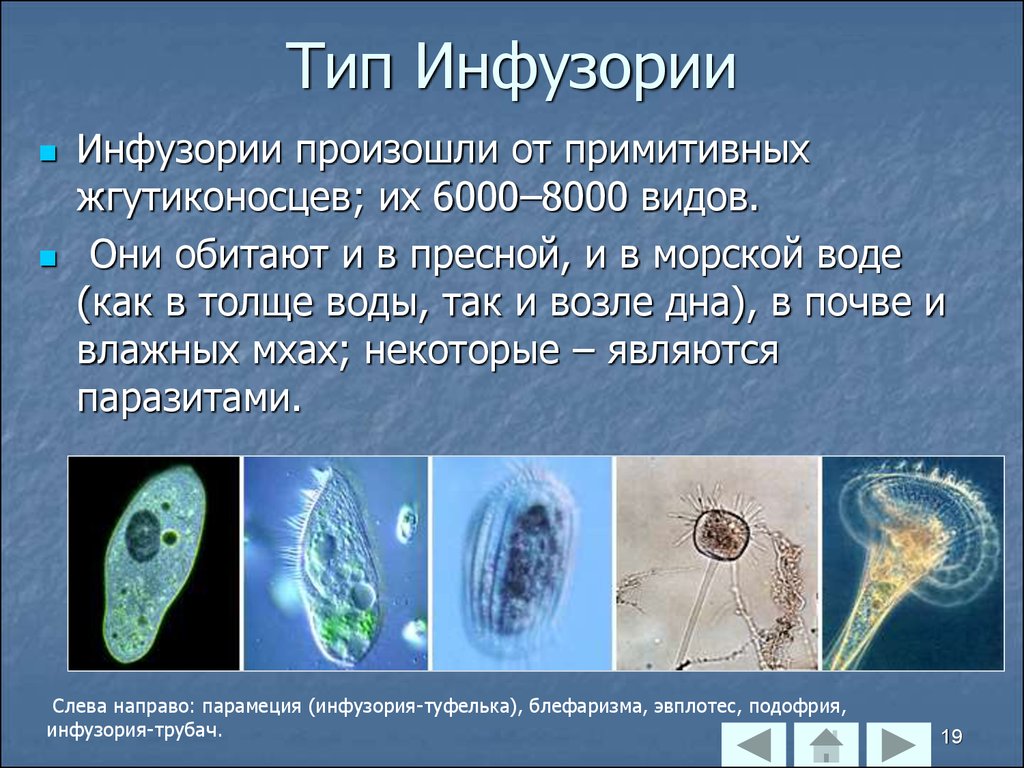
К наиболее сложноорганизованным простейшим относятся инфузории. Среди них есть подвижные и прикреплённые формы, одиночные и колониальные.
Известно более 7,5 тыс. видов инфузорий. Тело инфузорий имеет постоянную форму, у представителей многих видов, например у инфузории туфельки, имеются реснички, с помощью которых свободноживущие в водоёмах организмы довольно быстро передвигаются и обеспечивают себя питанием.
Характерным отличием инфузорий от других простейших является наличие в клетке не менее двух разных по величине ядер.
Относительная пищевая ценность инфузорий, простейших и водорослей в качестве корма для дафний
. 1990 март; 19(2):199-210.
дои: 10.1007/BF02012100.
АЕ Дебиасе 1 , Р. В. Сандерс, К. Г. Портер
принадлежность
- 1 Кафедра зоологии, Университет Джорджии, 30602, Афины, Джорджия, США.

- PMID: 24196312
- DOI: 10.1007/БФ02012100
AE Debiase et al. Микроб Экол. 1990 март
. 1990 март; 19(2):199-210.
дои: 10.1007/BF02012100.
Авторы
АЕ Дебиасе 1 , Р. В. Сандерс, К. Г. Портер
принадлежность
- 1 Кафедра зоологии, Университет Джорджии, 30602, Афины, Джорджия, США.
- PMID: 24196312
- DOI:
10.
 1007/БФ02012100
1007/БФ02012100
Абстрактный
Относительная важность автотрофных жгутиконосцев, десмидий, цианобактерий и инфузорий в качестве пищи для Daphnia magna была изучена с помощью когортных таблиц выживаемости. Каждой когорте давали один тип пищи в заданной концентрации, и между каждым типом проводились сравнения. Кормление водорослями включало три уровня молодых (в возрасте от 7 до 14 дней) Chlamydomonas reinhardi (Chlorophyta, Chlamydomonadacae) и два уровня стареющих (> 14 дней) C. reinhardi, два уровня Cryptomonas sp. (Chlorophyta, Cryptomonadacae), два уровня Staurastrum sp. (Chlorophyta, Desmidacae), четыре уровня молодых (в возрасте от 7 до 15 дней) или стареющих (в возрасте > 15 дней) Microcystis aeruginosa (Cyanophyta, Chlorococcacae) и лечение без пищи. Инфузории Cyclidium sp. и Paramecium caudatum также были представлены в концентрациях 1 или 10(2) клеток/мл, а также смеси C.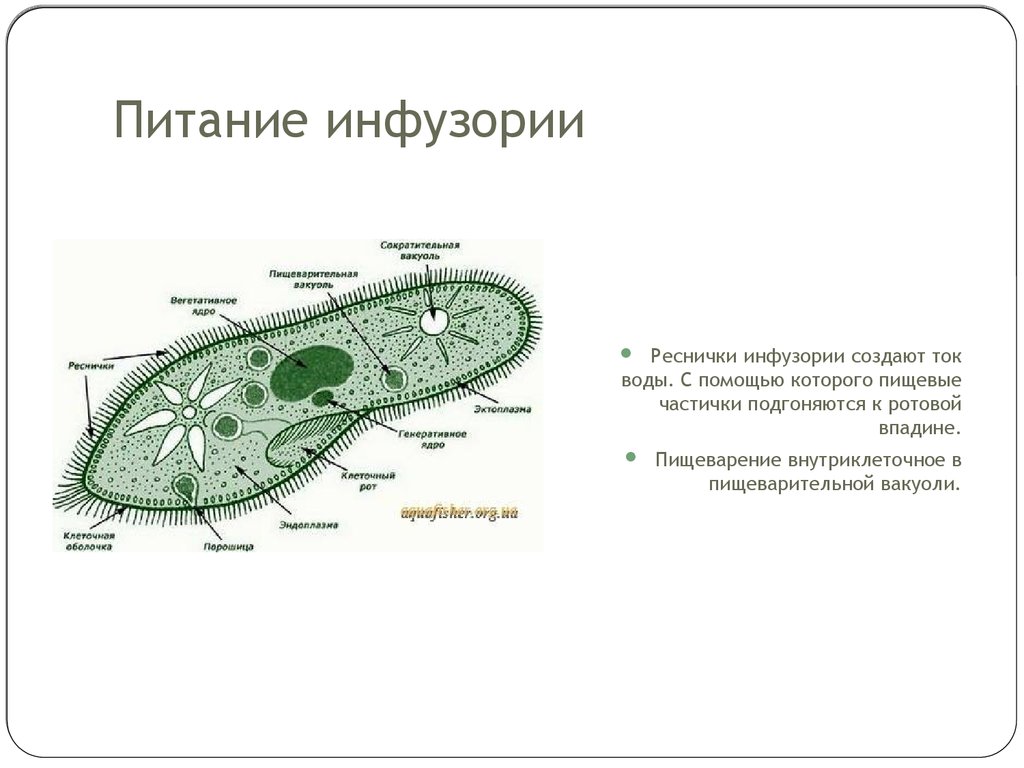
 Пищевая ценность инфузорий, измеренная по параметрам таблицы жизни, была переменной, причем некоторые из них были плохими источниками пищи. Таким образом, потенциал инфузорий как трофического звена между микробной продукцией и более высокими трофическими уровнями может варьироваться в зависимости от структуры сообщества инфузорий. Наши результаты показывают, что одних только инфузорий в качестве источника пищи недостаточно для поддержки роста популяции дафний.
Пищевая ценность инфузорий, измеренная по параметрам таблицы жизни, была переменной, причем некоторые из них были плохими источниками пищи. Таким образом, потенциал инфузорий как трофического звена между микробной продукцией и более высокими трофическими уровнями может варьироваться в зависимости от структуры сообщества инфузорий. Наши результаты показывают, что одних только инфузорий в качестве источника пищи недостаточно для поддержки роста популяции дафний.Похожие статьи
Жизненные характеристики дафний, подвергшихся воздействию растворенного микроцистина-LR и цианобактерии Microcystis aeruginosa с микроцистином и без него.
Люрлинг М., ван дер Гринтен Э. Люрлинг М. и др. Environ Toxicol Chem. 2003 июнь; 22 (6): 1281-7. Environ Toxicol Chem. 2003. PMID: 12785585
Реакция активности щелочной фосфатазы у дафний на плохое питание.
Вагнер Н.Д., Фрост ПК. Вагнер Н.Д. и соавт. Экология. 2012 г., сен; 170 (1): 1–10. doi: 10.1007/s00442-012-2277-0. Epub 2012, 12 февраля. Экология. 2012. PMID: 22327742
Выживание инфузорий простейших в условиях голодания и при низком бактериальном уровне.
Джексон К.М., Бергер Дж. Джексон К.М. и др. Микроб Экол. 1984 март; 10(1):47-59. DOI: 10.1007/BF02011594. Микроб Экол. 1984. PMID: 24221049
Пищевые и токсические ограничения фитопланктона из бразильского водоема для приспособленности видов кладоцер.
Ferrão-Filho ADS, Dias TM, Pereira UJ, Dos Santos JAA, Kozlowsky-Suzuki B. Ferrão-Filho ADS и др. Environ Sci Pollut Res Int.
 201926 мая (13): 12881-12893. doi: 10.1007/s11356-019-04851-6. Epub 2019 19 марта.
Environ Sci Pollut Res Int. 2019.
PMID: 30887454
201926 мая (13): 12881-12893. doi: 10.1007/s11356-019-04851-6. Epub 2019 19 марта.
Environ Sci Pollut Res Int. 2019.
PMID: 30887454Дополнение стеролами улучшает пищевые качества инфузории Daphnia magna.
Мартин-Кройцбург Д., Бек А., фон Элерт Э. Мартин-Кройцбург Д. и соавт. Протист. 2006 г., октябрь; 157 (4): 477–86. doi: 10.1016/j.protis.2006.07.001. Epub 2006 10 августа. Протист. 2006. PMID: 16904373
Посмотреть все похожие статьи
Рекомендации
- Микроб Экол. 1977 март; 4(1):27-40 — пабмед
- Appl Environ Microbiol.
 1984 октября; 48 (4): 755-7
—
пабмед
1984 октября; 48 (4): 755-7
—
пабмед
- Appl Environ Microbiol.
Преимущественное питание инфузориями Chilodonella и Tetrahymena spp. и влияние этих простейших на структуру и состав бактериальной биопленки
1. Абрамофф М. Д., Магелхаес П. Дж., Рам С. Дж. 2004. Обработка изображений с помощью ImageJ. Биофотоника Интернешнл. 11: 36–42 [Google Scholar]
2. Альмагор М., Рон А., Бар-Тана Дж. 1981. Хемотаксис у Tetrahymena thermophila. Селл Мотил. 1: 261–268 [Google Scholar]
3. Андерсен Дж. Б. и соавт. 1998. Новые нестабильные варианты зеленого флуоресцентного белка для изучения транзиторной экспрессии генов у бактерий. заявл. Окружающая среда. микробиол. 64: 2240–2246 [бесплатная статья PMC] [PubMed] [Google Scholar]
4.
Ayo B. , Latatu A., Artolozaga I., Jürgens K., Iriberri J. 2009. Факторы, влияющие на предпочтительную реакцию пресноводных инфузорий Uronema nigricans на бактериальную добычу. Дж. Эукариот. микробиол. 56: 188–193 [PubMed] [Google Scholar]
, Latatu A., Artolozaga I., Jürgens K., Iriberri J. 2009. Факторы, влияющие на предпочтительную реакцию пресноводных инфузорий Uronema nigricans на бактериальную добычу. Дж. Эукариот. микробиол. 56: 188–193 [PubMed] [Google Scholar]
5. Баттин Т.Дж., Каплан Л.А., Ньюболд Дж.Д., Хансен С.М.Е. 2003. Вклад микробных биопленок в экосистемные процессы в ручьевых мезокосмах. Nature 426: 439–442 [PubMed] [Google Scholar]
6. Бернингер У. Г., Финли Б. Дж., Кууппо-Лейникки П. 1991. Протозойный контроль численности бактерий в пресной воде. Лимнол. океаногр. 36: 139–147 [Google Scholar]
7. Бенигк Дж., Арндт Х. 2002. Бактериоядность гетеротрофных жгутиконосцев: структура сообщества и стратегии питания. Антони Ван Левенгук 81: 465–480 [PubMed] [Google Scholar]
8. Бёме А., Риссе-Буль У., Кюзель К. 2009. Протисты с разными режимами питания меняют морфологию биопленки. ФЭМС микробиол. Экол. 69: 158–169 [PubMed] [Google Scholar]
9.
Брекельс М. Н., Робертс Э. К.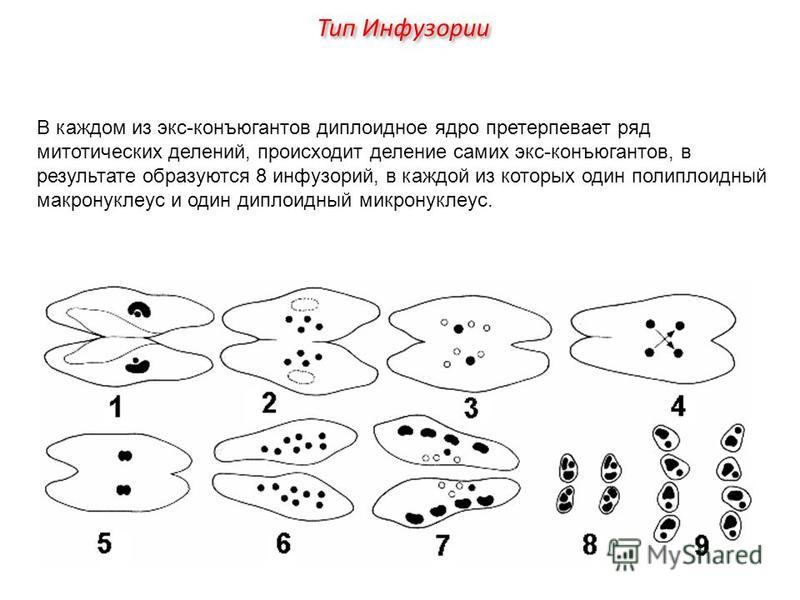
10. Корно Г., Юргенс К. 2006. Прямое и косвенное влияние хищничества протистов на размерную структуру популяции бактериального штамма с высокой фенотипической пластичностью. заявл. Окружающая среда. микробиол. 72: 78–86 [бесплатная статья PMC] [PubMed] [Google Scholar]
11. Костертон Дж. В. 2007. Праймер для биопленки. Спрингер-Верлаг, Берлин, Германия: [Google Scholar]
12. Daims H., Lücker S., Wagner M. 2006. daime , новая программа анализа изображений для микробной экологии и исследования биопленок. Окружающая среда. микробиол. 8: 200–213 [PubMed] [Google Scholar]
13. Дейнес П., Мац К., Юргенс К. 2009. Токсичность бактерий, продуцирующих виолацеин, скармливаемых бактериоядным пресноводным планктонам. Лимнол. океаногр. 54: 1343–1352 [Google Scholar]
14. Дофейд А., Лир Г., Стотт Р., Льюис Г. 2008. Молекулярная характеристика разнообразия инфузорий в речных биопленках. заявл. Окружающая среда. микробиол. 74: 1740–1747 [бесплатная статья PMC] [PubMed] [Google Scholar]
Дофейд А., Лир Г., Стотт Р., Льюис Г. 2008. Молекулярная характеристика разнообразия инфузорий в речных биопленках. заявл. Окружающая среда. микробиол. 74: 1740–1747 [бесплатная статья PMC] [PubMed] [Google Scholar]
15. Эйзенманн Х., Хармс Х., Мекенсток Р., Мейер Э.И., Цендер А.Дж.Б. 1998. Выпас Tetrahymena sp. на прикрепленных бактериях в перколяционных колонках под контролем гибридизации in situ с флуоресцентными олигонуклеотидными зондами. заявл. Окружающая среда. микробиол. 64: 1264–1269 [бесплатная статья PMC] [PubMed] [Google Scholar]
16. Эпштейн С.С., Шиарис М.П. 1992. Избирательный по размеру выпас прибрежного бактериопланктона естественными сообществами пигментированных жгутиконосцев, бесцветных жгутиконосцев и инфузорий. микроб. Экол. 23: 211–225 [PubMed] [Google Scholar]
17. Фенчел Т. 1987. Экология простейших: биология свободноживущих фаготрофных протистов. Спрингер-Верлаг, Берлин, Германия: [Google Scholar]
18.
Фенчел Т., Блэкберн Н. 1999.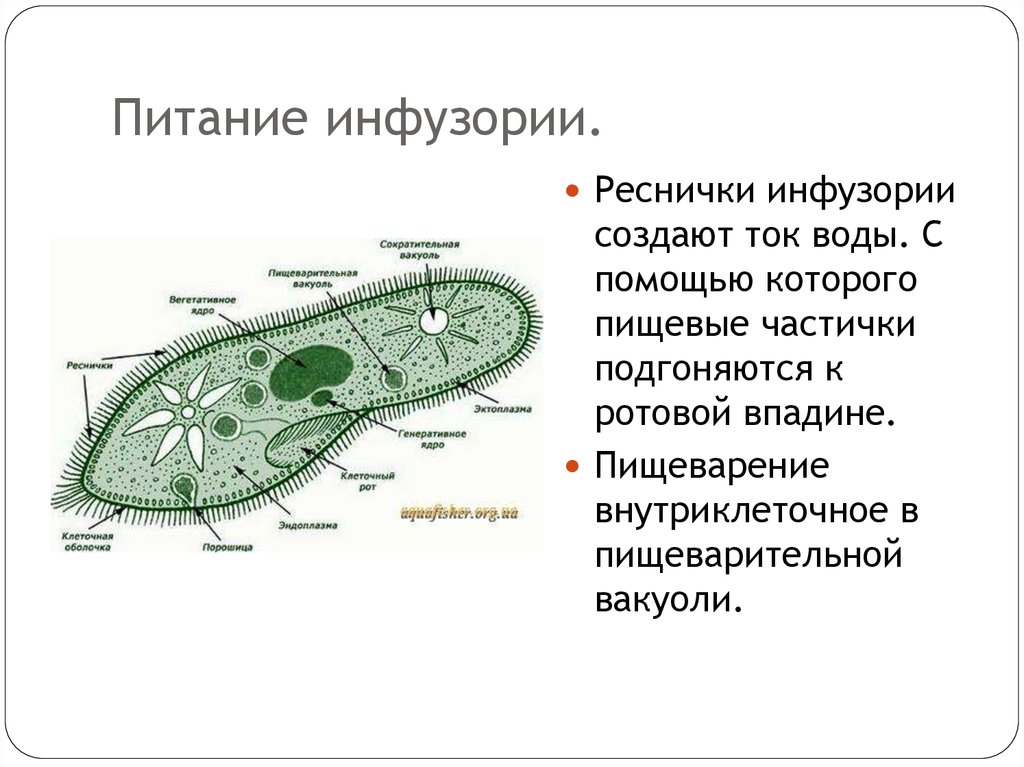 Подвижное хемосенсорное поведение фаготрофных протистов: механизмы и эффективность скопления на участках с едой. Protist 150: 325–336 [PubMed] [Google Scholar]
Подвижное хемосенсорное поведение фаготрофных протистов: механизмы и эффективность скопления на участках с едой. Protist 150: 325–336 [PubMed] [Google Scholar]
19. Фишер Х., Пуш М. 2001. Сравнение бактериальной продукции в отложениях, эпифитоне и пелагической зоне равнинной реки. Пресноводная биол. 46: 1335–1348 [Google Scholar]
20. Гримон Ф., Гримон П. А. Д. 2005. Род XXXIV. Серратия, п. 799–811 В Бреннер Д. Дж., Криг Н. Р., Стейли Дж. Т. (ред.) Руководство Бержи по систематической бактериологии, об. 2 Спрингер, Нью-Йорк, штат Нью-Йорк: [Google Scholar]
21. Грубер Д. Ф., Туорто С., Тагон Г. Л. 2009 г.. Фаза роста и элементная стехиометрия бактериальной добычи влияют на избирательность поедания инфузориями. Дж. Эукариот. микробиол. 56: 466–471 [PubMed] [Google Scholar]
22. Хан М.В., Хёфле М.Г. 2001. Выпас простейших и его влияние на популяции водных бактерий. ФЭМС микробиол. Экол. 35: 113–121 [PubMed] [Google Scholar]
23.
Hamels I.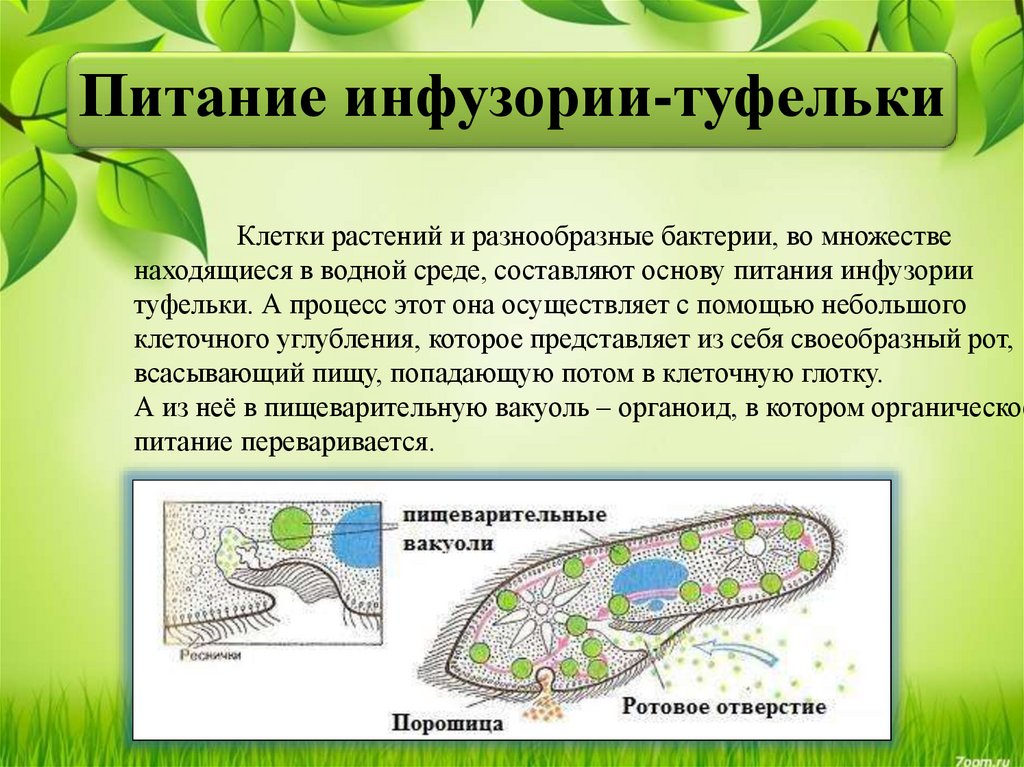 , Mussche H., Sabbe K., Muylaert K., Vyverman W. 2004. Доказательства постоянного и высокоспецифичного выбора активной пищи бентосными инфузориями в смешанных сообществах диатомовых водорослей. Лимнол. океаногр. 49: 58–68 [Google Scholar]
, Mussche H., Sabbe K., Muylaert K., Vyverman W. 2004. Доказательства постоянного и высокоспецифичного выбора активной пищи бентосными инфузориями в смешанных сообществах диатомовых водорослей. Лимнол. океаногр. 49: 58–68 [Google Scholar]
24. Хаусманн К. 2002. Приобретение пищи, прием пищи и переваривание пищи протистами. Япония. Дж. Протозол. 35: 85–95 [Google Scholar]
25. Huws S.A., McBain A.J., Gilbert P. 2005. Выпас простейших и его влияние на динамику популяций в биопленочных сообществах. Дж. Заявл. микробиол. 98: 238–244 [PubMed] [Google Scholar]
26. Езбера Й., Хорняк К., Шимек К. 2005. Отбор пищи бактериоядными простейшими: анализ содержания пищевых вакуолей с помощью флуоресцентной гибридизации in situ. ФЭМС микробиол. Экол. 52: 351–363 [PubMed] [Google Scholar]
27. Юргенс К., Мац К. 2002. Хищничество как фактор, формирующий фенотипический и генотипический состав планктонных бактерий. Антони Ван Левенгук 81: 413–434 [PubMed] [Google Scholar]
28. Камияма Т., Арима С. 2001. Характеристики питания двух видов тинтиннидных инфузорий фитопланктоном, включая вредные виды: влияние размера добычи на скорость поглощения и избирательность. Дж. Эксп. Мар биол. Экол. 257: 281–296 [PubMed] [Google Scholar]
Камияма Т., Арима С. 2001. Характеристики питания двух видов тинтиннидных инфузорий фитопланктоном, включая вредные виды: влияние размера добычи на скорость поглощения и избирательность. Дж. Эксп. Мар биол. Экол. 257: 281–296 [PubMed] [Google Scholar]
29. Koch B., Jensen L.E., Nybroe O. 2001. Набор векторов на основе Tn7 для вставки маркерного гена gfp или доставки клонированной ДНК в грамотрицательные бактерии в нейтральном хромосомном сайте. Дж. Микробиол. Методы 45: 187–19.5 [PubMed] [Google Scholar]
30. Кохидай Л., Чаба Г. 1996. Различные и селективные хемотаксические ответы Tetrahymena pyriformis на два семейства сигнальных молекул: лектины и пептидные гормоны. Акта микробиол. Иммунол. Висела. 43: 83–91 [PubMed] [Google Scholar]
31. Ламбертсен Л., Штернберг С., Молин С. 2004. Транспозоны Mini-Tn7 для сайт-специфического мечения бактерий флуоресцентными белками. Окружающая среда. микробиол. 6: 726–732 [PubMed] [Google Scholar]
32.
Лоуренс Дж. Р., Снайдер Р.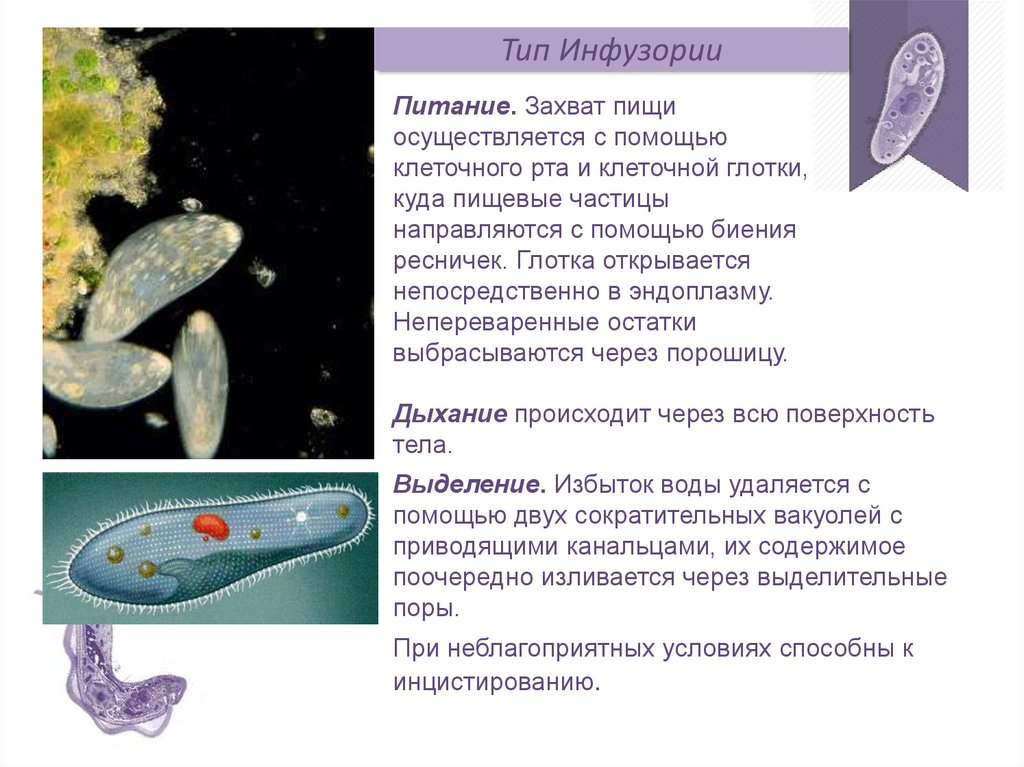 А. 1998. Пищевое поведение и последствия выпаса Euplotes sp. на прикрепленных бактериях. Может. Дж. Микробиол. 44: 623–629 [Google Scholar]
А. 1998. Пищевое поведение и последствия выпаса Euplotes sp. на прикрепленных бактериях. Может. Дж. Микробиол. 44: 623–629 [Google Scholar]
33. Lazazzera B.A. 2005. Уроки анализа ДНК-микрочипов: профиль генной экспрессии биопленок. Курс. мнение микробиол. 8: 222–227 [PubMed] [Google Scholar]
34. Лейк В., Линдемоз С. 2007. Хемокинез Tetrahymena в ответ на бактериальные олигопептиды. Дж. Эукариот. микробиол. 54: 271–274 [PubMed] [Google Scholar]
35. Левандовский М., Хаузер Д. К. Р. 1978. Хемосенсорные реакции плавающих водорослей и простейших. Междунар. Преподобный Цитол. 53: 145–210 [PubMed] [Google Scholar]
36. Martel CM 2006. Расположение добычи, распознавание и проглатывание фаготрофной морской динофлагеллятой Oxyrrhis marina. Дж. Эксп. Мар биол. Экол. 335: 210–220 [Google Scholar]
37.
Matz C., Bergfeld T., Rice S.A., Kjelleberg S. 2004. Микроколонии, определение кворума и цитотоксичность определяют выживание биопленок Pseudomonas aeruginosa, подвергшихся выпасу простейших.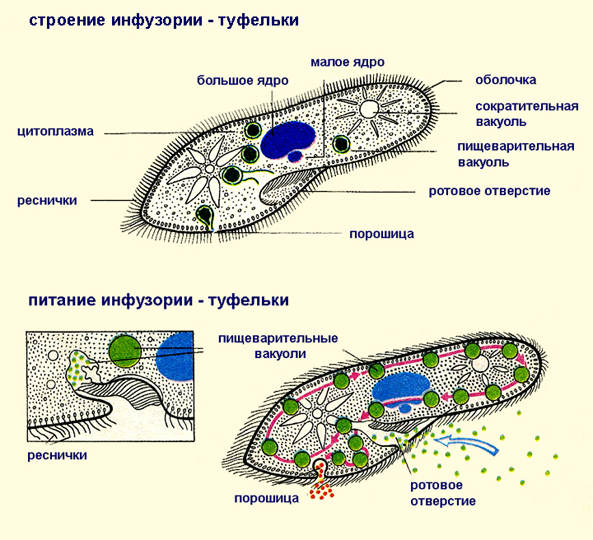 Окружающая среда. микробиол. 6: 218–226 [PubMed] [Google Scholar]
Окружающая среда. микробиол. 6: 218–226 [PubMed] [Google Scholar]
38. Мац К., Юргенс К. 2005. Высокая подвижность снижает смертность планктонных бактерий при выпасе. заявл. Окружающая среда. микробиол. 71: 921–929 [бесплатная статья PMC] [PubMed] [Google Scholar]
39. Мац К., Юргенс К. 2003. Взаимодействие ограничения питательных веществ и выпаса простейших определяет фенотипическую структуру бактериального сообщества. микроб. Экол. 45: 384–398 [PubMed] [Google Scholar]
40. Мац С. и др. 2008. Морские биопленочные бактерии уклоняются от эукариотического хищничества с помощью целенаправленной химической защиты. PLoS один 3(7): е2744. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Монгер Б.К., Лэндри М.Р., Браун С.Л. 1999. Отбор питания гетеротрофных морских нанофлагеллят на основе гидрофобности поверхности их добычи пикопланктона. Лимнол. океаногр. 44: 1917–1927 [Google Scholar]
42.
Montagnes D.J.S. и др. 2008. Избирательное пищевое поведение основных свободноживущих простейших: возможности для дальнейшего изучения.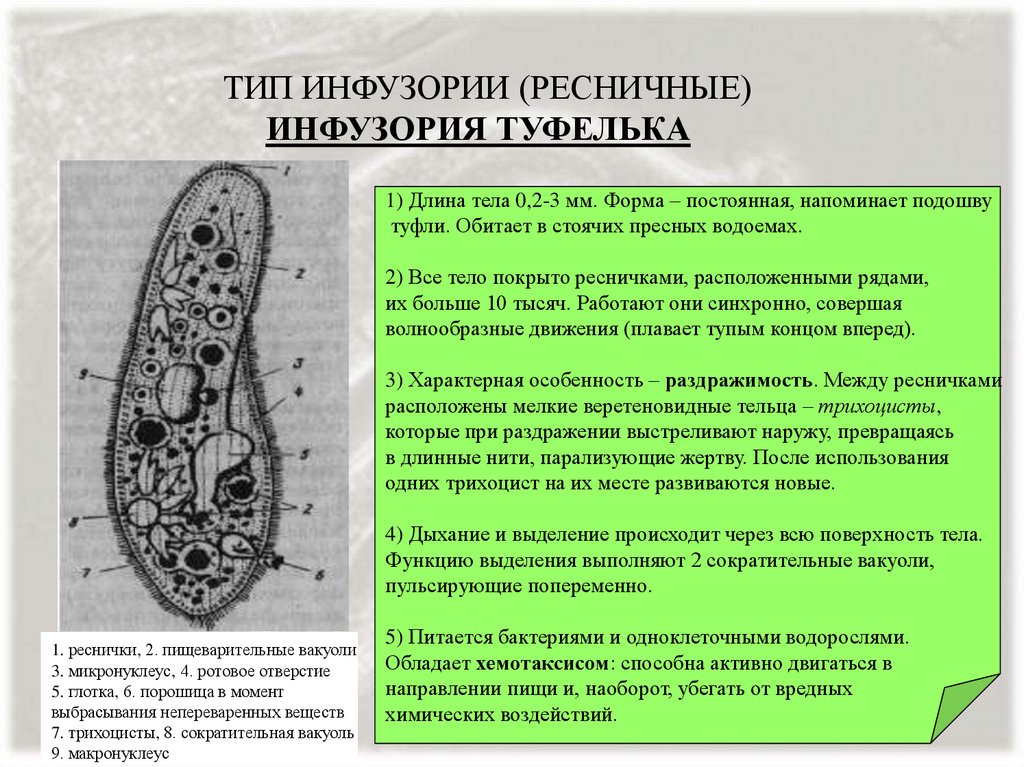 Аква. микроб. Экол. 53: 83–98 [Google Scholar]
Аква. микроб. Экол. 53: 83–98 [Google Scholar]
43. Мунс П. и др. 2006. Роль ощущения кворума и продукции противомикробных компонентов Serratia plymuthica в формировании биопленок, в том числе смешанных биопленок с Escherichia coli. заявл. Окружающая среда. микробиол. 72: 7294–7300 [бесплатная статья PMC] [PubMed] [Google Scholar]
44. О’Тул Г., Каплан Х. Б., Колтер Р. 2000. Формирование биопленки как микробное развитие. Анну. Преподобный Микробиолог. 54: 49–79 [PubMed] [Google Scholar]
45. Страница FC 1988. Новый ключ к пресноводным и почвенным гимнамёбам. Пресноводная биологическая ассоциация, Эмблсайд, Англия: [Google Scholar]
46. Парри Дж. Д. 2004. Выпас простейших пресноводных биопленок. Доп. заявл. микробиол. 54: 167–196 [PubMed] [Google Scholar]
47.
Парри Дж. Д., Холмс А. К., Анвин М. Е., Лейбурн-Парри Дж. 2007. Использование ультразвуковой визуализации для оценки влияния выпаса и движения простейших на топографию бактериальных биопленок.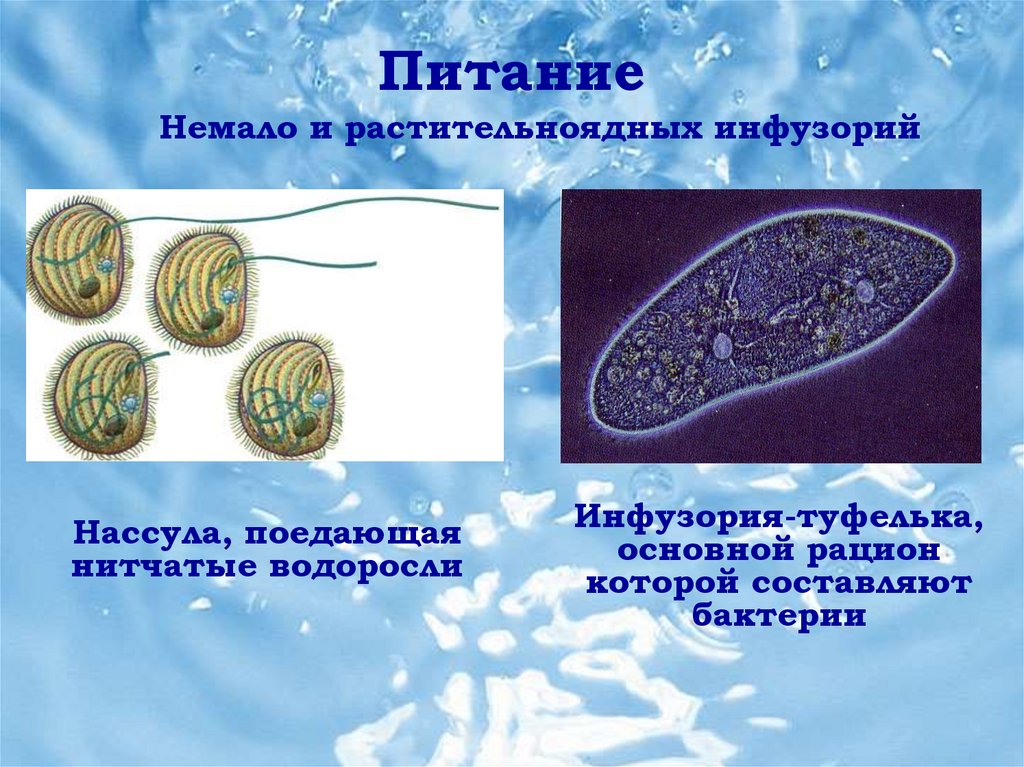 лат. заявл. микробиол. 45: 364–370 [PubMed] [Google Scholar]
лат. заявл. микробиол. 45: 364–370 [PubMed] [Google Scholar]
48. Педерсон К. 1990. Развитие биопленки на поверхностях из нержавеющей стали и ПВХ в питьевой воде. Вода Res. 24: 239–243 [Google Scholar]
49. Пернталер Дж. 2005. Поедание прокариот в толще воды и его экологические последствия. Нац. Преподобный Микробиолог. 3: 537–546 [PubMed] [Google Scholar]
50. Пош Т. и др. 2001. Избирательное питание Cyclidium glaucoma (Ciliophora, Scuticociliatida) по размеру и его влияние на структуру бактериального сообщества: исследование системы непрерывного культивирования. микроб. Экол. 42: 217–227 [PubMed] [Google Scholar]
51. Queck S.Y., Weitere M., Moreno A.M., Rice S.A., Kjelleberg S. 2006. Роль признаков развития, опосредованных определением кворума, в устойчивости биопленок Serratia marcescens к выпасу простейших. Окружающая среда. микробиол. 8: 1017–1025 [PubMed] [Google Scholar]
52.
Реш А., Розенштейн Р., Нерц С., Гётц Ф. 2005. Дифференциальный анализ экспрессии генов Staphylococcus aureus, культивируемых в условиях биопленки и планктона.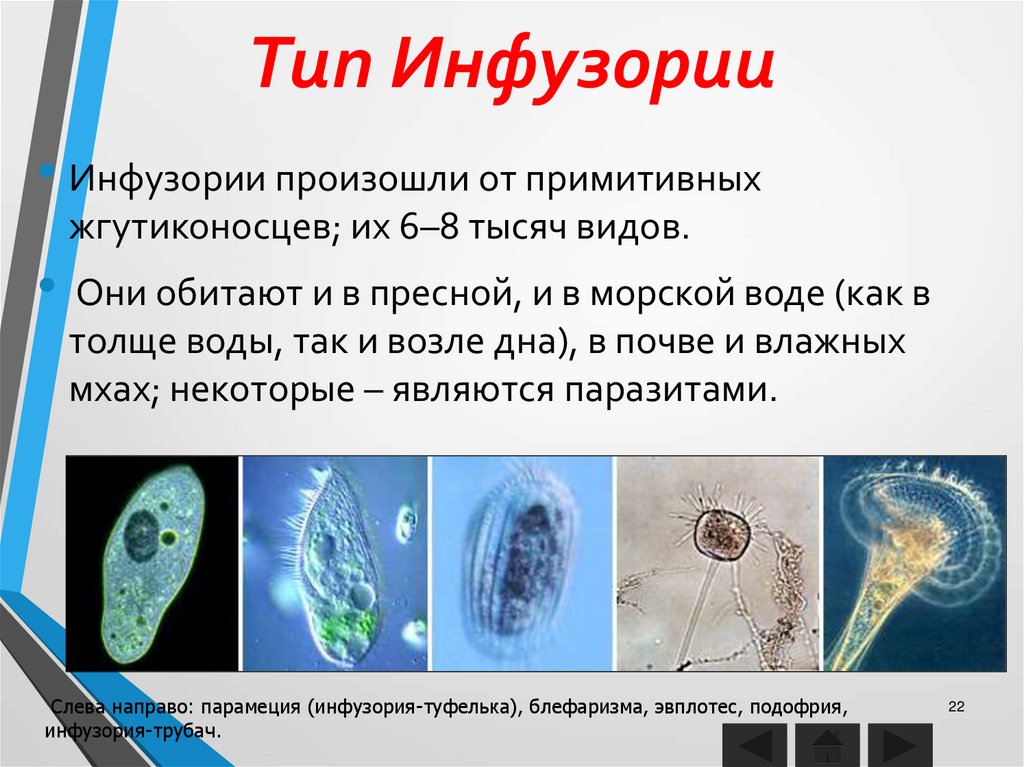 заявл. Окружающая среда. микробиол. 71: 2663–2676 [бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. Окружающая среда. микробиол. 71: 2663–2676 [бесплатная статья PMC] [PubMed] [Google Scholar]
53. Рибблетт С.Г., Палмер М.А., Коутс Д.В. 2005. Важность бактериоядных простейших в разложении ручьевой опавшей листвы. Пресноводная биол. 50: 516–526 [Google Scholar]
54. Риччи Н., Морелли А., Верни Ф. 1996. Хищничество Litonotus на Euplotes: двухэтапный процесс распознавания клеток. Акта Протозол. 35: 201–208 [Google Scholar]
55. Рисс-Буль У. и соавт. 2009. Отрыв и подвижность поверхностных инфузорий при повышенных скоростях потока. Аква. микроб. Экол. 55: 209–218 [Google Scholar]
56. Робертс Э. К., Легран К., Стейнке М., Вуттон Э. К. 19 февраль 2011 г., Дата публикации. Механизмы, лежащие в основе химических взаимодействий между хищными планктонными простейшими и их добычей. Дж. Планктон Рез. [Epub перед печатью] Дои: 10.1093/планк/fbr005 [Google Scholar]
57.
Шеннон С.П., Хшановски Т.Х., Гровер Дж.П. 2007. Качество корма для добычи влияет на скорость поглощения жгутиконосцев. микроб. Экол. 53: 66–73 [PubMed] [Google Scholar]
микроб. Экол. 53: 66–73 [PubMed] [Google Scholar]
58. Шерр Э.Б., Шерр Б.Ф. 1987. Высокие показатели потребления бактерий пелагическими инфузориями. Nature 325: 710–711 [Google Scholar]
59. Шерр Э. Б., Шерр Б. Ф. 2002. Значение хищничества протистов в пищевых сетях водных микробов. Антони Ван Левенгук 81:293–308 [PubMed] [Google Scholar]
60. Симе-Нгандо Т., Демерс С., Джунипер С.К. 1999. Простейшие бактериофаги во льду и толще воды лагуны с холодным умеренным климатом. микроб. Экол. 37: 95–106 [PubMed] [Google Scholar]
61. Сингх Б. Н. 1942. Токсическое действие некоторых продуктов метаболизма бактерий на почвенных простейших. Природа 149: 168 [Google Scholar]
62. Студли П., Зауэр К., Дэвис Д.Г., Костертон Дж.В. 2002. Биопленки как сложные дифференцированные сообщества. Анну. Преподобный Микробиолог. 56: 187–209[PubMed] [Google Scholar]
63.
Стром С., Вулф Г., Слайер А., Ламберт С., Клаф Дж. 2003. Химическая защита в микропланктоне II: ингибирование питания простейших бета-диметилсульфониопропионатом (ДМСП). Лимнол. океаногр. 48: 230–237 [Google Scholar]
Лимнол. океаногр. 48: 230–237 [Google Scholar]
64. Стром С.Л., Вулф Г.В., Брайт К.Дж. 2007. Реакция морских планктонных протистов на аминокислоты: торможение кормления и плавательное поведение инфузории Favella sp. Аква. микроб. Экол. 47: 107–121 [Google Scholar]
65. Thelaus J., Haecky P., Forsman M., Andersson A. 2008. Давление хищников на бактерии увеличивается по мере изменения продуктивности водной среды. Аква. микроб. Экол. 52: 45–55 [Google Scholar]
66. Турман Дж., Парри Дж. Д., Хилл П. Дж., Лейборн-Парри Дж. 2010. Фильтрующие инфузории Colpidium striatum и Tetrahymena pyriformis проявляют избирательное пищевое поведение в присутствии смешанной бактериальной добычи одинакового размера. Protist 161: 577–588 [PubMed] [Google Scholar]
67. Van Houten J. 1992. Хемосенсорная трансдукция у эукариотических микроорганизмов. Анну. Преподобный Физиол. 54: 639–663 [PubMed] [Google Scholar]
68.
Verity PG 1988. Хемосенсорное поведение морских планктонных инфузорий.