Подборка по базе: практическая работанавыков простейших медицинских манипуляций..d, Эволюция иммунной системы от простейших до хордовых. Говоркова 1, 2. Практика Построение простейших математических моделей.docx, Практически у всех живых существ от простейших до человека состо, ПР11 Решение простейших однокритериальных задач.docx, _$бораторная работа №2 (Исследование простейших цепей постоянног, Систематика простейших.pdf, Тематический блок №2 Биология Простейших. Саркомастигофора.pdf, 5fan_ru_Проектирование простейших цифровых электронных схем (1)., Контрольная Методика составления и проведения простейших самосто Инфузория, как вид простейших Тип Инфузории К типу Инфузории относят около 6000 видов простейших, органеллами движения которых служит большое количество ресничек. Для большинства инфузорий характерно присутствие двух ядер: крупного вегетативного — макронуклеуса — и более мелкого генеративного — микронуклеуса. Среди инфузорий есть свободноживущие обитатели пресных и морских водоемов и паразиты человека и животных. К свободноживущим инфузориям относят инфузорию туфельку . Размеры клетки 0,1-0,3 мм. Простейшее имеет постоянную форму, так как эктоплазма уплотнена и образует пелликулу. Тело инфузории покрыто ресничками. Их насчитывают от 10 до 15 тыс. В эктоплазме инфузории имеют защитные образоания — трихоцисты. При раздражении трихоцисты выстреливают наружу, превращаясь в длинные нити, парализующие жертву. После использования одних трихоцист на их месте в эктоплазме развиваются новые. К органеллам питания относят ротовое отверстие, расположенное на брюшной стороне и ведущее в клеточный рот, который переходит в клеточную глотку. Вода с бактериями через елнточный рот попадает в эндоплазму, где образуются пищеварительные вакуоли. Оставшиеся внутри вакуоли непереваренные остатки пищи удаляются наружу через порошицу — отверстие, расположенное неподалеку от заднего конца тела инфузории. У инфузории туфельки есть две сократительные вакуоли, расположенные в передней и задней частях тела. Каждая вакуоль состоит из округлого резервуара и подходящих к нему в виде звезды 5 — 7 канальцев. Жидкие продукты и вода из цитоплазмы сначала поступают в приводящие канальцы, затем канальцы все сразу сокращаются и изливают свое содержимое в резервуар, после чего последний сокращается и выбрасывает жидкость через отверстие наружу, а канальцы в это время вновь наполняются. Вакуоли сокращаются поочередно. Бесполое размножение инфузорий осуществляется путем поперечного деления и сопровождается делением макро- и микронуклеусов. Размножение повторяется 1 — 2 раза в сутки. Через несколько поколений в жизненном цикле инфузорий происходит половой процесс, который называют конъюгацией. В результате в каждой инфузории образуются мужское (мигрирующее) и женское (стационарное) ядра. Затем между особями происходит обмен мигрирующими ядрами с последующим слиянием стационарного и мигрирующего ядер, после чего особи расходятся. Вскоре в каждой из них ядро делится и впоследствии образуются микро- и макронуклеусы. Таким образом, при половом процессе число инфузорий не увеличивается, а обновляются наследственные свойства макронуклеуса и возникают новые комбинации генетической информации. У человека в просвете толстого кишечника может паразитировать инфузория балантидий — возбудитель балантидиаза. Клинически это тяжелое заболевание выражается в кровавом поносе, коликах, лихорадке и мышечной слабости. Диагноз ставят при нахождении балантидия в фекалиях. Профилактика та же, что и при других кишечных заболеваниях. Строение Наиболее типичный широко распространенный представитель ресничных — инфузория туфелька (Paramecium). Она обитает в стоячей воде, а также в пресноводных водоемах с очень слабым течением, содержащих разлагающийся органический материал. Сложность строения клетки у парамеции объясняется тем обстоятельством, что ей приходится выполнять все функции, присущие целому организму, а именно питание, осморегуляцию и передвижение. Тело парамеции имеет характерную форму: передний конец у нее тупой, а задний несколько заострен. Реснички инфузории туфельки расположены парами по всей поверхности клетки. Располагаясь продольными диагональными рядами, они, совершая биения, заставляют инфузорию вращаться и продвигаться вперед. Между ресничками находятся отверстия, ведущие в особые камеры, называемые трихоцистами. Из этих камер под влиянием определенных раздражителей могут выстреливать тонкие остроконечные нити, используемые, вероятно, для удержания добычи. Под пелликулой инфузории туфельки располагается эктоплазма — прозрачный слой плотной цитоплазмы консистенции геля. В эктоплазме находятся базальные тельца (идентичные центриолям), от которых отходят реснички, а между базальными тельцами имеется сеть тонких фибрилл, участвующих, по-видимому, в координировании биения ресничек. Основная масса цитоплазмы инфузории туфельки представлена эндоплазмой, имеющей более жидкую консистенцию, чем эктоплазма. Именно в эндоплазме расположено большинство органелл. На вентральной (нижней) поверхности туфельки ближе к ее переднему концу находится околоротовая воронка, на дне которой находится рот, или цитостом. Рот инфузории туфельки ведет в короткий канал — цитофаринкс, или глотку. Как околоротовая воронка, так и глотка могут быть выстланы ресничками, движения которых направляют к цитостому поток воды, несущей с собой различные пищевые частицы, такие, например, как бактерии. Вокруг попавших в цитоплазму путем эндоцитоза пищевых частиц образуется пищевая вакуоль. Эти вакуоли перемещаются по эндоплазме к так называемой порошице, через которую непереваренные остатки путем экзоцитоза выводятся наружу. В цитоплазме инфузории туфельки имеются также две сократительные вакуоли, местоположение которых в клетке строго фиксировано. Эти вакуоли отвечают за осморегуляцию, т. е. поддерживают в клетке определенный водный потенциал. Жизнь в пресной воде осложняется тем, что в клетку постоянно поступает вода в результате осмоса; эта вода должна непрерывно выводиться из клетки, чтобы предотвратить ее разрыв. Происходит это с помощью процесса активного транспорта, требующего затраты энергии. В клетке парамеции инфузории туфельки находятся два ядра. Большее из них — макронуклеус — полиплоидное; оно имеет более двух наборов хромосом и контролирует метаболические процессы, не связанные с размножением. Микронуклеус — диплоидное ядро. Оно контролирует размножение и образование макронуклеусов при делении ядра. Парамеция инфузории туфельки может размножаться и бесполым путем (поперечным делением надвое) и половым (путем конъюгации). Совершая ресничками волнообразные движения, туфелька передвигается (плывёт тупым концом вперёд). Ресничка движется в одной плоскости и совершает прямой (эффективный) удар в выпрямленном состоянии, а возвратный — в изогнутом. Каждая следующая ресничка в ряду совершает удар с небольшой задержкой по сравнению с предыдущей. Плывя в толще воды, туфелька вращается вокруг продольной оси. Дыхание, выделение, осморегуляция Туфелька дышит всей поверхностью клетки. Она способна существовать за счёт гликолиза при низкой концентрации кислорода в воде. Продукты азотистого обмена также выводятся через поверхность клетки и частично через сократительную вакуоль. Основная функция сократительных вакуолей осморегуляторная. Они выводят из клетки излишки воды, проникающие туда за счёт осмоса. Сначала набухают приводящие каналы, затем вода из них перекачивается в резервуар. При сокращении резервуара он отделяется от приоводящих каналов, а воды выбрасывается через пору. У туфельки есть бесполое и половое размножение (половой процесс). Бесполое размножение — поперечное деление в активном состоянии. Оно сопровождается сложными процессами регенерации. Например, одна из особей заново образует клеточный рот с околоротовой цилиатурой, каждая достраивает недостающую сократительную вакуоль, происходит размножение базальных телец и образование новых ресничек и т.п. Половой процесс, как и у других инфузорий, происходит в форме конъюгации. Туфельки, относящиеся к разным клонам, временно «склеиваются» ротовыми сторонами, и между клетками образуется цитоплазматический мостик. Затем макронуклеусы конъюгирующих инфузорий разрушаются, а микронуклеусы делятся путем мейоза. Из образовавшихся четырех гаплоидных ядер три погибают, а оставшаяся делится митозом. Сувойка Род простейших из подкласса кругоресничных инфузорий (Peritricha). Включает свыше 100 широко распространённых видов, живущих в морской и пресной воде. С. — сидячие животные, прикрепляются к субстрату (в отличие от других родов Peritricha) при помощи неветвящегося сократительного стебелька. Тело С., имеющее форму колокольчика, лишено ресничек. На расширенном переднем его конце (адоральная зона) расположен двойной ряд ресниц (обычно сливающихся в меморанеллы), закрученный влево (в отличие от спиральноресничных инфузорий, у которых адоральная зона мембранелл закручена вправо). Инфузория трубач Род простейших класса инфузорий подотряда разноресничных. Длина до 1 мм . Свыше 10 видов. Тело в форме воронки. На расширенном переднем конце мощно развитая зона околоротовых мембранелл, направляющих ток пищевых частиц к ротовому отверстию. Остальное тело покрыто продольными рядами мелких ресничек. Способны резко сокращаться, принимая шарообразную форму благодаря сократительным нитям — мионемам. Могут свободно плавать или прикрепляться к субстрату суженным задним концом. Обитают в морях и пресных водах. У некоторых видов в цитоплазме имеются многочисленные симбионты — одноклеточные водоросли. Инфузория-стилохония Есть такая инфузория — стилонихия. Под влиянием летучих фитонцидов лука она распадается на мельчайшие зернышки и даже растворяется. Такое явление микробиологи называют лизисом. Тело инфузории «исчезает». То же происходит с инфузорией, называемой «локсодес рострум». В течение 10—15 секунд все ее тело растворяется в окружающей жидкой среде! В совершенно тех же условиях другая инфузория — спиростомум терес — под влиянием тех же фитонцидов распадается на зернышки, но растворения всего тела не происходит. Эту смерть мы называем зернистым распадом. Некоторые простейшие под влиянием фитонцидов умирают, сохраняя свое строение, все свои основные структуры — ядро, реснички, благодаря которым происходит движение, и т. д. Более того, эти структуры становятся отчетливее — при умирании как бы закрепляется их строение. Микроорганизм умер, но он кажется нормальным. В таком состоянии микроб может находиться час, другой, третий и даже более суток. Затем уже начинает совершаться саморазложение очень сложное химическое явление распада белков и других соединений. |
Энциклопедия природы Самарской области (ч. 3)
Миксотрофы. Пелагостромбидиум обманчивый (Pelagostrombidium fallax).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Лимностромбидиум зелёный (Limnostrombidium viride).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Монодиниум Бальбиани (Monodinium balbianii).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Баланион планктонный (Balanion planctonicum).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Фронтония белая (Frontonia leucas).
с зоохлореллами и инфузорией Metopus sp.
в пищеварительной вакуоли.
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы.
Эуплотес диадалеос (Euplotes diadaleos).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы.
Пелаготрикс планктикола (Pelagothrix plancticola).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Циклидиум (Cyclidium sp.).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Псевдоблефаризма тонкая зелёная (Pseudoblepharisma tenue var. viride).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Окситриха (Oxytricha sp.).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы.
Кристигера (Cristigera sp.).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Колепс мохнатый (Coleps hirtus)
с зоохлореллами и без них.
Фото лаборатории экологии простейших (ИЭВБ), ув.
Циклидиум голубовато-зеленый (Cyclidium glaucoma).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Голостиха (Holosticha sp.).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Локсодес большой (Loxodes magnus).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Кодонелла кубковидная (Codonella cratera).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Хетоспира-гребец (Chaetospira remex
Фото лаборатории экологии простейших (ИЭВБ), ув.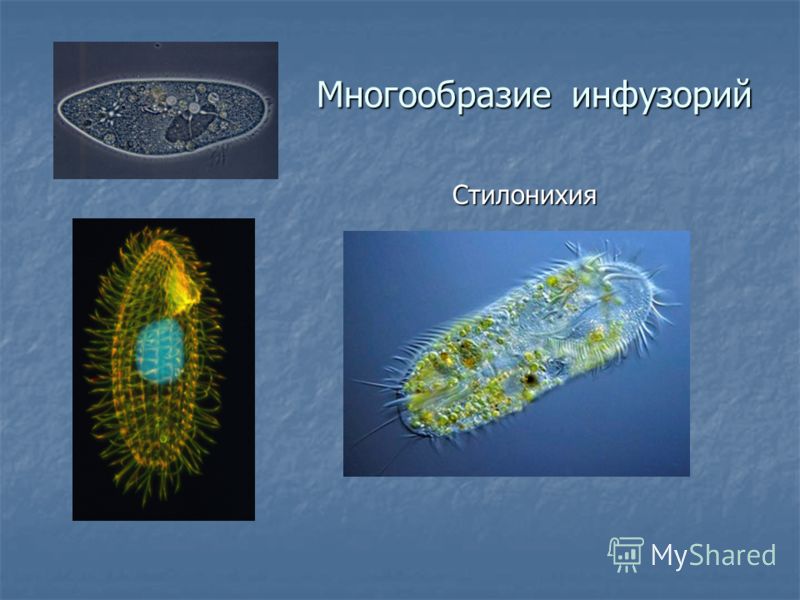
Разноресничные.
Трубач голубой (Stentor coeruleus).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Разноресничные. Фолликулины. Лаготия (Lagotia sp.).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Разноресничные.Фолликулина Болтона (Folliculina boltoni).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Пелагостромбидиум удивительный (Pelagostrombidium mirabile).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Римостромбидиум озёрный (Rimostrombidium lacustris).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Дидиниум хлореллоносный (Didinium chlorelligerum).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Тинтиннопсис цилиндрический (Tintinnopsis cylindrata).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Фронтония белая (Frontonia leucas).
Видны альвеолы.
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Гистиобалантиум плавающий (Histiobalantium natans).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы.
Пелагогальтерия зелёная (Pelagohalteria viridis).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Стихотриха секунда (Stichotricha secunda).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы.
Климакостомум зеленеющий (Climacostomum virens).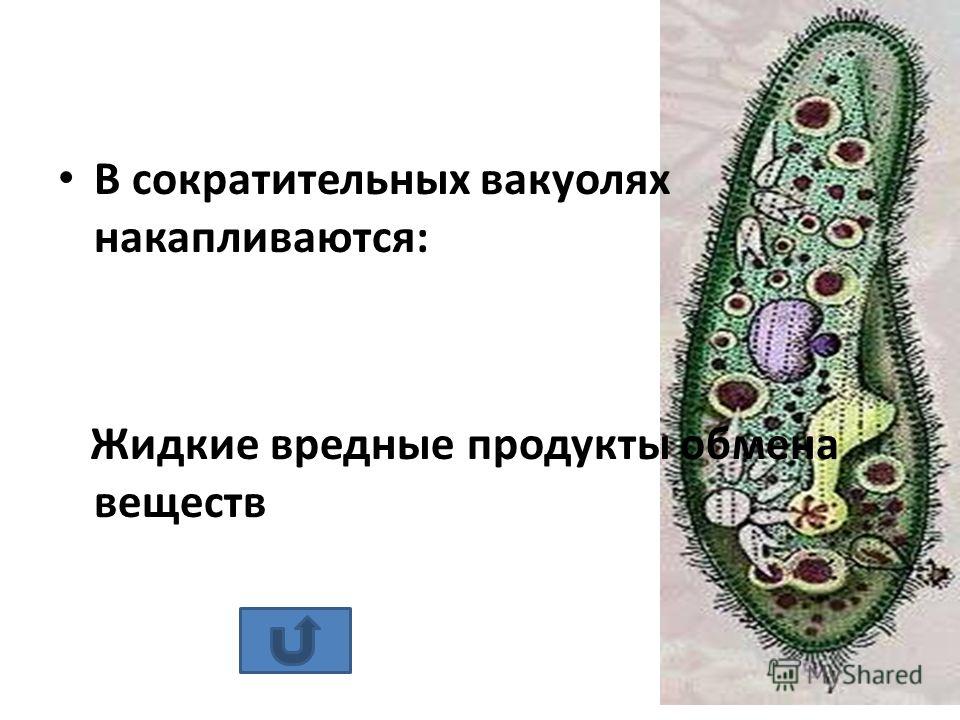
Фото лаборатории экологии простейших (ИЭВБ), ув
Миксотрофы. Кристигера (Cristigera sp.).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы.
Спиростромум зеленоватый (Spirostomum semivirescensis).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Колепс амфакантус (Coleps amphacanthus).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Миксотрофы. Дисематостома Бючли (Disematostoma butschlii).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Плагиокампа Ру (Plagyocampa rouxi).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Лембадион выпуклый (Lembadion bullinum).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Гастронавта мембраноносная (Gastronauta membranaceus).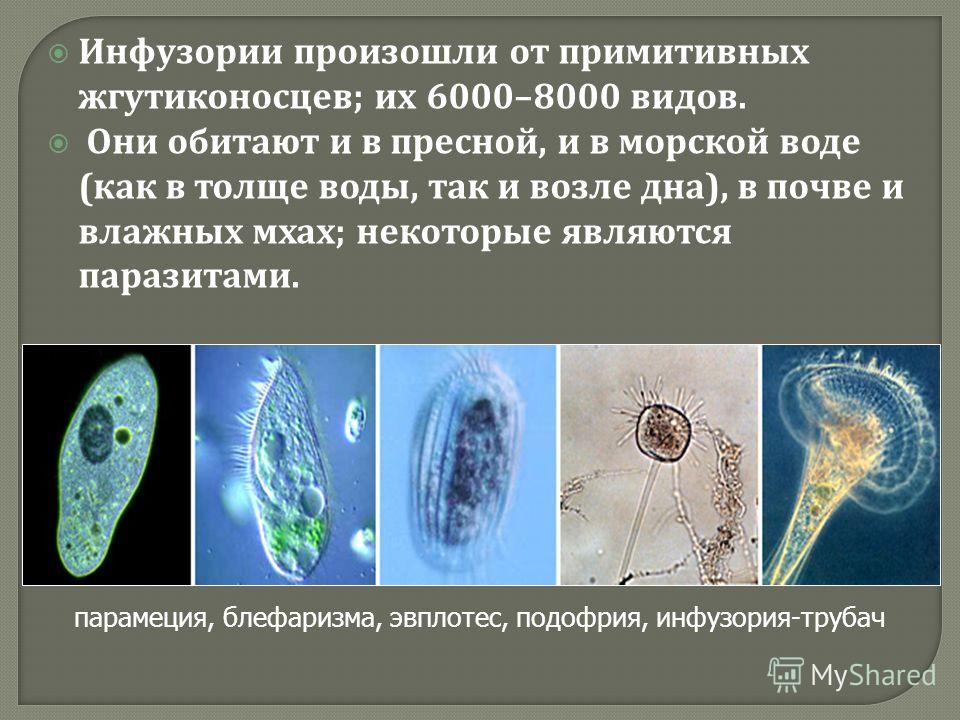
Фото лаборатории экологии простейших (ИЭВБ), ув.
Дексиотриха гранулёзная (Dexiotricha granulosa).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Разноресничные. Миксотрофы. Трубач аметистовый (Stentor amethystinus).
Фото лаборатории экологии простейших (ИЭВБ), ув.
Парадилептус слоновый (Paradileptus elephantinus).
Разноресничные.Фолликулина Болтона (Folliculina boltoni).
Фото А.М. Филатова (НТЦ ВАЗа), ув.
Подцарство Простейшие — Умскул Учебник
На этой странице вы узнаете- Что общего у колонии простейших и студенческого общежития?
- Почему привередливый плазмодий не хочет жить в теле человека с серповидно-клеточной анемией?
- Как организм, не имеющий органов слуха, зрения и осязания, понимает, в какую сторону ему нужно двигаться?
- Какую пользу болезнетворные протисты приносят экосистеме?
Часто, когда мы ленимся, мы говорим, что наше тело “будто амёба”.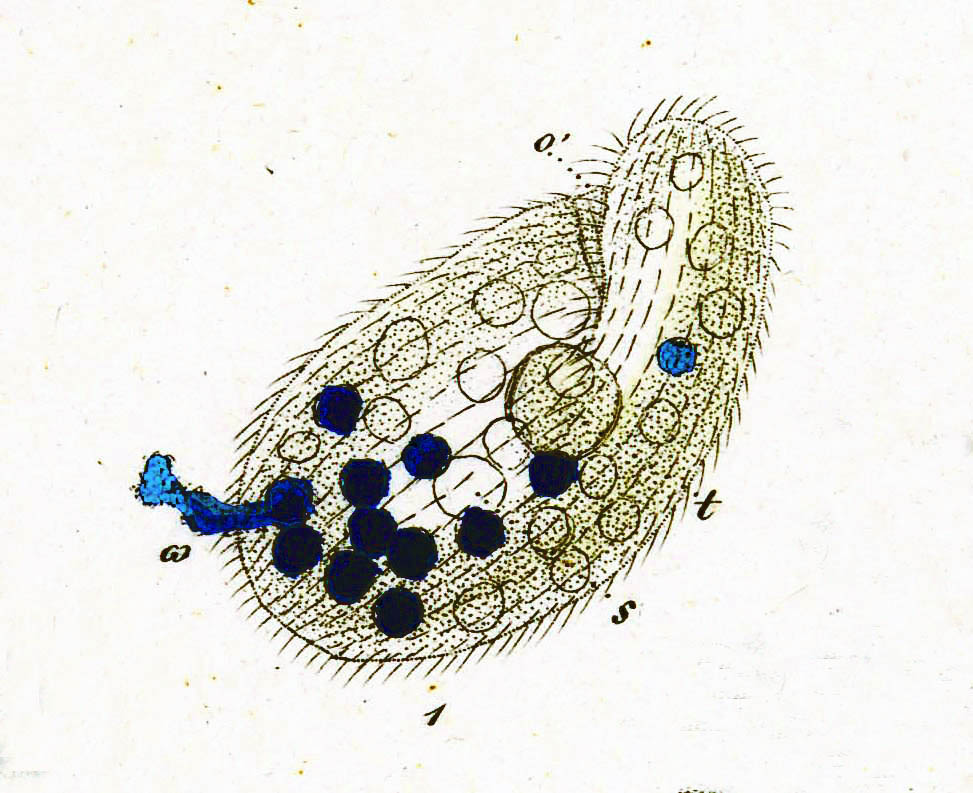 Откроем тайну: амёба вовсе не ленится, она активный охотник! Просто тело амёбы состоит всего из одной клеточки. Но представьте себе, как трудно управлять организмом, если он такой маленький! А как с этим справляются амёбы и другие простейшие животные, можно узнать в этой статье
Откроем тайну: амёба вовсе не ленится, она активный охотник! Просто тело амёбы состоит всего из одной клеточки. Но представьте себе, как трудно управлять организмом, если он такой маленький! А как с этим справляются амёбы и другие простейшие животные, можно узнать в этой статье
В настоящее время известно более 70 тыс. видов простейших. К подцарству относят одноклеточные организмы. В школьной программе простейшие считаются животными, но на самом деле они являются представителями даже не разных царств, а разных супергрупп!
Подцарство Простейшие состоит из трёх типов:
- Саркомастигофоры, или Саркожгутиковые;
- Апикомплексы, или Споровики: кокцидия, малярийный плазмодий, токсоплазма;
- Инфузории, или Ресничные:инфузория-туфелька, сувойка, балантидий.
В свою очередь тип Саркомастигофоры образован двумя классами:
- Жгутиконосцы: лямблия, эвглена зелёная, трипаносома, трихомонада, лейшмания;
- Саркодовые: (амёба обыкновенная, амёба дизентерийная.

Большая семья, но у всех простейших есть общие признаки. Давайте разберемся, что их объединяет.
Особенности обитанияПростейшие обитают в водной, почвенной и организменной средах, то есть во всех возможных, за исключением воздушной. На воздухе они не любят жить потому, что важнейшим условием жизни протистов является наличие влаги, при нехватке которой они переходят в цисту.
Циста – форма, переживающая неблагоприятные условия.
Циста имеет плотную оболочку, а все метаболические реакции в ней заторможены.
Выход амёбы из цистыОболочка цисты ー своеобразный скафандр, в котором клетка, как космонавт в открытом космосе, полностью защищена от воздействия внешних факторов. В скафандре космонавт может дышать, разговаривать, но расходовать ресурсы он должен очень экономно, иначе они закончатся! Поэтому в цисте все обменные процессы протекают замедленно, причем происходят только самые важные реакции, чтобы обеспечивать жизнь клетки.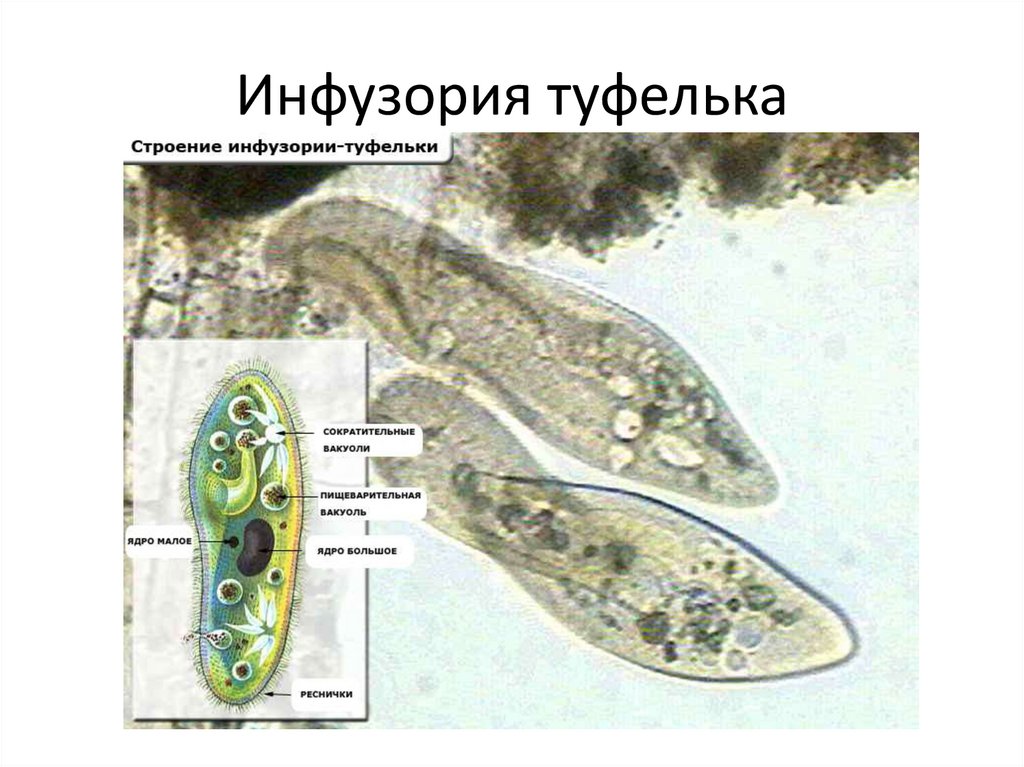
Существуют простейшие, которые могут образовывать колонии. По мнению многих учёных, такие колониальные организмы дали начало многоклеточным животным.
| Что общего у колонии простейших и студенческого общежития? Колония ー специфическая форма совместного проживания одноклеточных организмов. Клетки в колонии независимы друг от друга и могут существовать отдельно. Чтобы запомнить этот термин, будем ассоциировать его с общежитием. Колония состоит из множества особей, как и общежитие состоит из множества людей, взаимодействующих друг с другом. Однако каждая клетка колонии, как и каждый человек, может существовать и отдельно от этого сообщества. |
Экологическое значение
В цепях питания простейшие могут выполнять роль продуцентов или консументов.
Продуценты – организмы, синтезирующие органические вещества из простых неорганических соединений с помощью хемо- и фотосинтеза.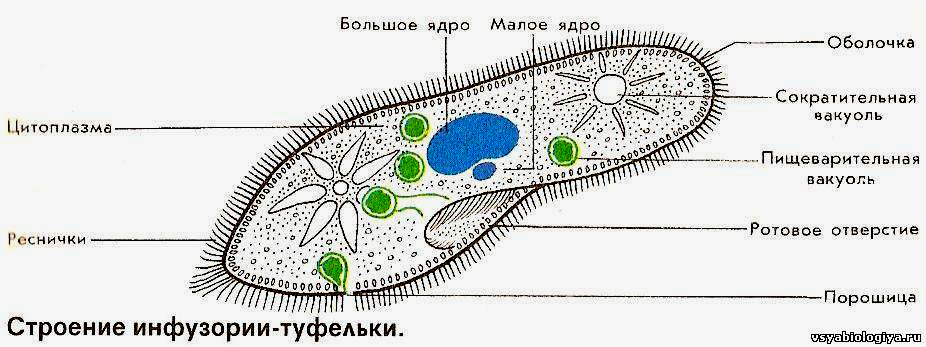
“Продуценты” и “продукты” – однокоренные слова, и они взаимосвязаны. Так и запомним: продуценты делают первичные “продукты питания” для других компонентов экосистемы.
Консументы – организмы, потребляющие органические вещества, созданные продуцентами.
То есть, они не могут сами приготовить себе обед, а вместо этого пользуются веществами, которые произвели продуценты. Здесь можно вспомнить, что в английском языке есть глагол “to consume” ー потреблять. Консументы как раз являются такими потребителями веществ от продуцентов.
Простейшие составляют часть зоопланктона и являются важной пищей для животных, живущих в водоёмах.
Но также простейшие могут и вредить. Некоторые одноклеточные животные паразитируют на других организмах (амёба дизентерийная, малярийный плазмодий). Они вызывают заболевания животных и растений.
| Какую пользу болезнетворные протисты приносят экосистеме? Паразиты являются возбудителями заболеваний, которые при отсутствии лечения могут привести к летальному исходу особи. Чаще всего эти болезни оказываются смертельными именно для организмов со слабым иммунитетом, плохо приспособленным к жизни. Поэтому можно сказать, что паразиты “вычищают” популяцию от наименее приспособленных животных или растений и повышают её устойчивость к факторам среды. Кроме того, паразитические инфекции способствуют уменьшению численности популяции, то есть предотвращают перенаселение территории определенным видом. |
У простейших одна клетка выполняет все функции целого организма. Ей приходится нелегко: в одиночку нужно и питаться, и размножаться, и выделять продукты обмена. Поэтому клетки протистов имеют сложное строение. Давайте рассмотрим их основные структуры.
Строение амёбы обыкновенной- Сократительная вакуоль
Пресноводные протисты имеют специальные структуры, отвечающие за осморегуляцию, – сократительные вакуоли.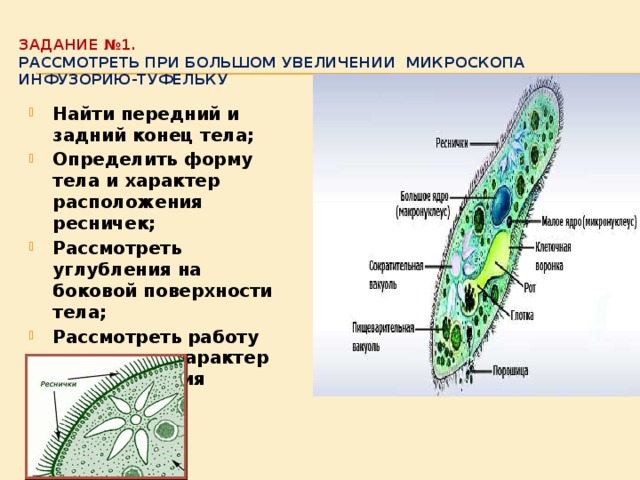 Они удаляют излишки воды из клетки.
Они удаляют излишки воды из клетки.
Найти сократительную вакуоль на изображении клетки инфузории очень легко: она будет напоминать солнышко. Органоид состоит из центральной полости, – своеобразного накопительного резервуара, – и лучистых канальцев, которые похожи на лучики солнца.
Однако, лучистые канальцы можно заметить на изображении не у всех простейших. Например, у амёбы сократительная вакуоль выглядит как небольшой пузырёк и внешне похожа на ядро. В таком случае органоид можно “узнать” по более округлой, чем у ядра, форме.
Сократительные вакуоли в клетке Инфузории-туфелькиКак работает сократительная вакуоль?
Сначала лучистые канальцы, расположенные вокруг вакуоли, накапливают воду и изливают ее в центральную полость. Вакуоль сокращается и избыток воды удаляется из клетки во внешнюю среду, таким образом, разрыв клетки предотвращается.
- Пищеварительная вакуоль
Для простейших характерно наличие пищеварительных вакуолей, в которых происходит расщепление питательных веществ, поглощенных клеткой.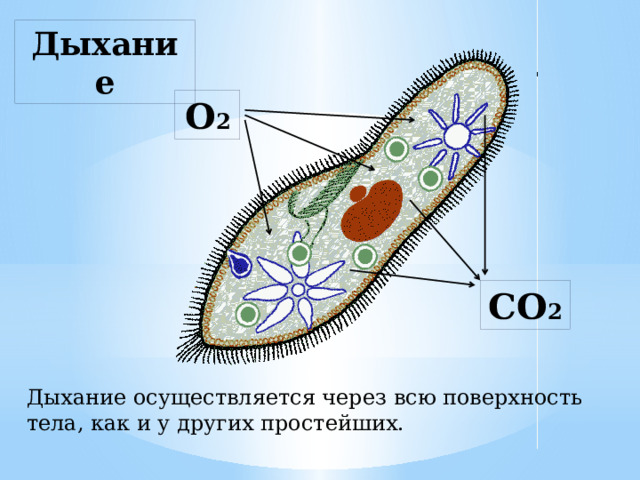 В этих вакуолях, как и в наших органах пищеварения, содержатся ферменты – реактивы, разлагающие пищу до простых органических соединений.
В этих вакуолях, как и в наших органах пищеварения, содержатся ферменты – реактивы, разлагающие пищу до простых органических соединений.
- Ядро
Представители типа Инфузории имеют 2 ядра. Одно из них (большое, макронуклеус) осуществляет контроль над процессами жизнедеятельности в клетке, а другое (малое, микронуклеус) необходимо для полового процесса.
Как запомнить, какое ядро инфузории за что отвечает?
Распределение обязанностей у ядер инфузории похоже на ответственность генерального директора и, например, финансового директора. Большое ядро, как гендиректор, будет руководить большим количеством процессов: это и питание, и транспорт веществ, и обменные процессы. У него много работы, поэтому ему нужно быть крупным, иначе не справится с обязанностями. Малое ядро, как финдиректор, занят одним делом: ему доверен только один процесс – размножение.
- Органоиды движения
Некоторые одноклеточные животные, например, амёба обыкновенная, передвигаются с помощью псевдоподий.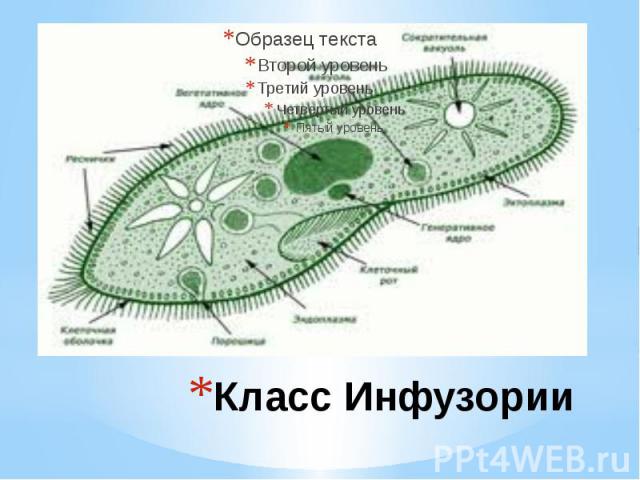 Другие простейшие (эвглена зелёная, лямблия) имеют жгутики, с помощью которых перемещаются в пространстве.
Другие простейшие (эвглена зелёная, лямблия) имеют жгутики, с помощью которых перемещаются в пространстве.
Псевдоподии (ложноножки) – выросты, образуемые цитоскелетом и используемые для передвижения клетки.
Что такое «цитоскелет», Вы сможете узнать в статье «Строение клетки».
ПитаниеДля простейших характерен гетеротрофный тип питания, однако некоторые из них миксотрофы (например, эвглена зелёная). Сейчас разберемся в их различиях.
Гетеротрофы в ходе питания поглощают органику, созданную другими организмами.
Миксотрофы – организмы, которые могут питаться автотрофно, то есть фотосинтезировать, а при недостаточном освещении переходить к поглощению уже готовой органики из среды.
Таким образом, их питание – “микс” из гетеротрофного и автотрофного типов. Это очень удобный механизм выживания, как у ноутбука: если нет зарядки от розетки, он переходит на энергию батареи.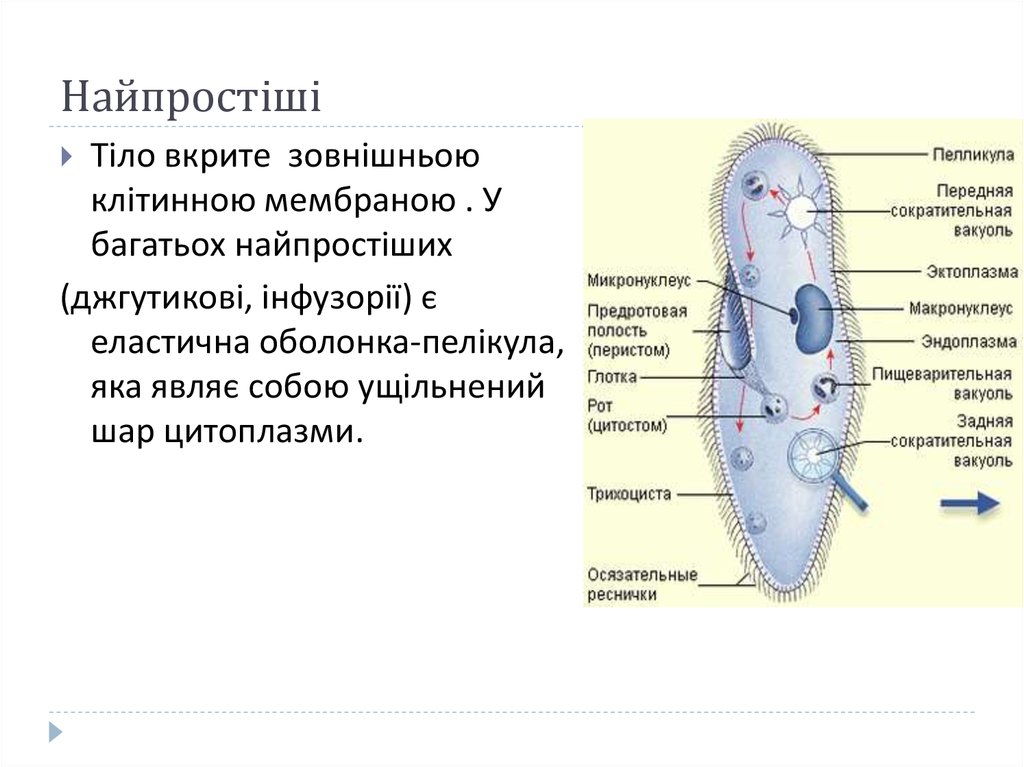
У миксотрофов есть особый светочувствительный органоид – стигма, или глазок, благодаря которому эвглены могут перемещаться в более освещенное место. Это явление называется положительный фототаксис.
| Как организм, не имеющий органов слуха, зрения и осязания, понимает, в какую сторону ему нужно двигаться? Помимо фототаксиса простейшие могут ориентироваться с помощью хемотаксиса. Хеморецепторы на поверхности клетки улавливают изменение pH среды, увеличение или уменьшение концентрации химических веществ. Эти рецепторы – глаза, уши и нос простейшего, именно они получают информацию о том, где “хорошо”, а где “плохо”. И тогда клетка движется в направлении от агрессивных веществ или к питательному субстрату. |
Простейшие-гетеротрофы могут поглощать жидкие компоненты среды (белки, липиды, растворенные углеводы) в виде капель. Такой способ питания называется пиноцитоз.
Такой способ питания называется пиноцитоз.
Также одноклеточные животные могут поглощать твердые частицы (бактерии, кусочки детрита) с помощью фагоцитоза. При таком питании мембрана клетки животного впячивается внутрь и образует фагоцитозный пузырёк, который впоследствии становится пищеварительной вакуолью.
Питание амёбы: 1 – фагоцитоз, 2 – пиноцитозРазмножение и половой процессДля простейших характерно бесполое размножение, которое может осуществляться с помощью митоза или шизогонии. Половое размножение свойственно представителям типа Апикомплексы, о которых мы говорили в начале статьи.
Шизогония – множественные деления без разрыва цитоплазматической мембраны.
При шизогонии клетка сначала становится многоядерной, а затем распадается на множество дочерних клеток соответственно количеству ядер.
Бесполое размножение трипаносомы: 1-3 – бинарное деление, 4-6 – шизогония
Половой процесс простейших| Как размножаются простейшие? Половой процесс нужен не для увеличения числа животных, а в первую очередь для повышения генетического разнообразия. |
Копуляция – слияние клеток и их генетического аппарата. При копуляции из 2 исходных клеток образуется одна.
Конъюгация – соединение двух особей с последующим обменом частями ядерного аппарата, полученными путем мейоза. При конъюгации 2 исходных клеток образуются 2.
| Почему половой процесс наступает при неблагоприятных условиях? В трудной жизненной ситуации мы всегда начинаем менять стратегию поведения, понимая, что наши прошлые привычки уже не работают. Точно так же ведёт себя и любое одноклеточное животное: если условия стали неблагоприятными, значит, нужно попробовать приспособиться к ним. Механизмами, которые приводят к появлению новых признаков, являются мейоз и слияние клеток, поэтому половой процесс происходит обычно при изменении условий среды. Но почему бы не использовать такую стратегию всегда, даже при неменяющихся условиях? Дело в том, что вновь приобретенные признаки могут оказаться и вредными… Не стоит рисковать и перетруждаться, если ты и так очень хорошо приспособлен! |
Амёба обыкновенная ー свободноживущее простейшее, представитель типа Саркомастигофоры, класса Саркодовые.
Особенность животного в том, что оно перемещается в пространстве с помощью псевдоподий (ложноножек).
Как работают ложноножки?
Помните цикл фильмов о трансформерах? Эти существа могли сначала быть машинами, А потом собираться в большого робота, который передвигался уже совсем по-другому. По такому же принципу происходит движение амёбы. При необходимости передвижения актиновые филаменты цитоскелета разбираются на мономеры и с током цитоплазмы движутся в нужном направлении, образуя своеобразное выпячивание клетки.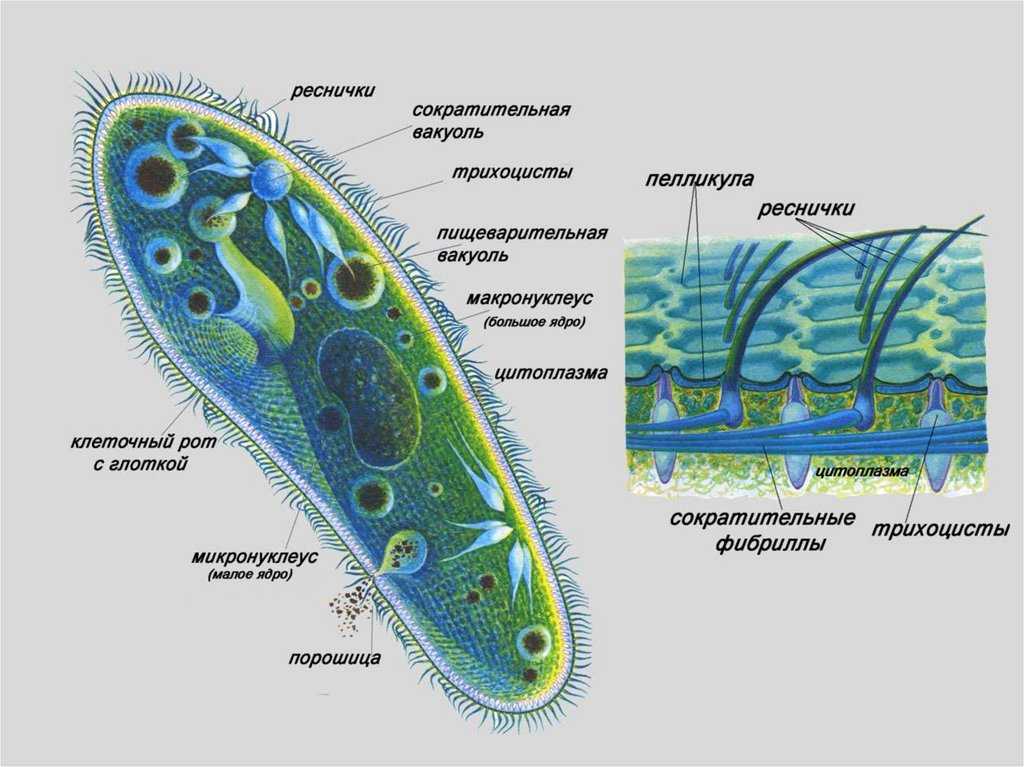 Затем мономеры актина снова собираются в цитоскелет, который поддерживает форму клетки.
Затем мономеры актина снова собираются в цитоскелет, который поддерживает форму клетки.
Инфузории ー тип простейших животных, представители которого имеют следующие отличительные признаки:
- наличие в клетке двух ядер (макро- и микронуклеусов),
- многочисленные реснички на поверхности клетки,
- половой процесс ー конъюгация.
Питание
Все инфузории являются хищниками. Движением ресничек они провоцируют ток воды с более мелкими живыми организмами: бактериями, другими простейшими животными, одноклеточными водорослями. При попадании пищи в глотку образуется пищеварительная вакуоль, где расщепляются питательные вещества. Непереваренные остатки пищи выводятся через порошицу.
Конъюгация
При конъюгации 2 инфузории сближаются, между ними образуются цитоплазматические мостики. Далее они обмениваются частями малого ядра и расходятся.
Далее они обмениваются частями малого ядра и расходятся.
Эвглена зеленая ー свободноживущее простейшее, представитель типа Саркомастигофоры, класса Жгутиковые.
По типу питания эвглена является миксотрофом. Она может питаться автотрофно благодаря наличию в клетке хлоропластов. Имеет жгутик для перемещения в пространстве, светочувствительный органоид ー стигму.
Строение эвглены зелёнойМалярийный плазмодийМалярийный плазмодий ー представитель типа Апикомплексы, вызывающий малярию. Это заболевание человека, при котором происходит разрушение эритроцитов.
Малярия сопровождается лихорадочными приступами, анемией, слабостью и может привести к летальному исходу.
Основным хозяином малярийного плазмодия является комар рода Anopheles, проживающий в тропиках. В пищеварительной системе комара происходит половое размножение паразита.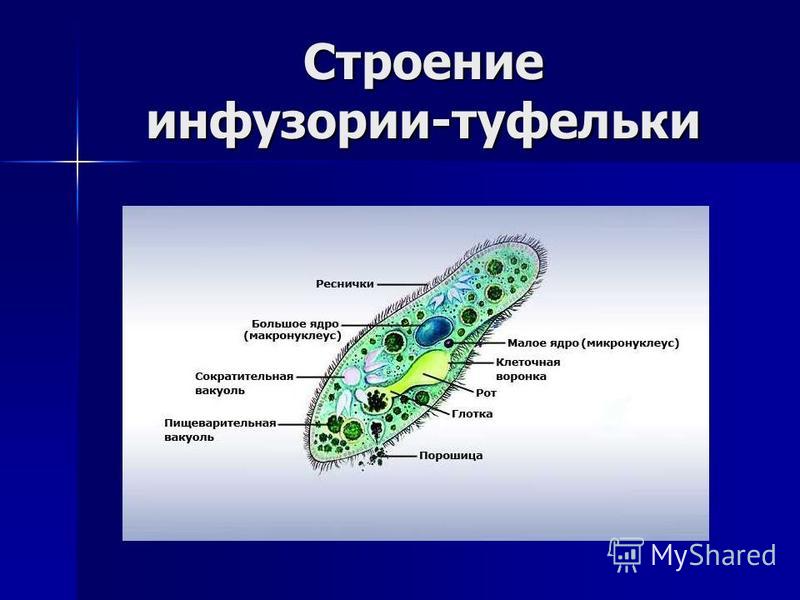
Промежуточный хозяин простейшего ー человек, в эритроцитах которого плазмодий размножается бесполым путем, шизогонией. В момент выхода шизонтов из клеток крови у человека сильно повышается температура, наблюдается лихорадочный приступ.
Зачем плазмодию второй хозяин?
Для апикомплексов характерны сложные жизненные циклы со сменой хозяев. Это позволяет паразитам избегать внутривидовой конкуренции: стадии питаются разной пищей и живут в разных организмах. Такая особенность позволяет паразитам быть практически неуловимыми! Если один из хозяев сможет противостоять заболеванию либо сменит условия обитания, это не помешает паразиту сбежать от него и житьи размножаться в другом хозяине.
Главное ー быстро поменять хозяина
| Почему привередливый плазмодий не хочет жить в человеке с серповидно-клеточной анемией? Малярийный плазмодий не атакует людей, страдающих серповидно-клеточной анемией. |
Главной мерой борьбы с малярией является осушение стоячих водоемов, так как личинки основного хозяина плазмодия ー комара ー живут в воде.
Термины- Осморегуляция – совокупность физиологических процессов, направленных на поддержание постоянного осмотического давления. Подробнее об осмосе можно прочитать в статье «Строение клетки Ч1».
- Зоопланктон – мелкие водные животные.
- Серповидно-клеточная анемия – заболевание, при котором эритроциты имеют форму серпа.
- Простейшие ー одноклеточные животные. Из-за того, что одна клетка выполняет все функции целого организма, они имеют сложное строение и высокоспециализированные органоиды.
- Протисты обитают в водной, почвенной и организменной средах, то есть во всех возможных, за исключением воздушной.

- В цепях питания миксотрофы-простейшие могут выполнять роль продуцентов, гетеротрофы – консументов.
- Для простейших характерен гетеротрофный тип питания, однако некоторые из них миксотрофы (эвглена зелёная).
- Размножаются в основном бесполым путём, половой процесс у инфузорий не считается размножением и происходит при наступлении неблагоприятных условий.
Задание №1.
У какого протиста есть способность к фототаксису?
- амёба дизентерийная
- амёба обыкновенная
- лямблия
- эвглена зеленая
Задание №2.
При серповидно-клеточной анемии человек устойчив к заражению
- вирусными заболеваниями
- бактериальной инфекцией
- лямблиозом
- малярией
- дизентерией
Задание №3.
Как называется половой процесс, характерный для представителей типа Инфузории?
- конъюгация
- шизогония
- митотическое деление
- гаметогамия
Задание №4.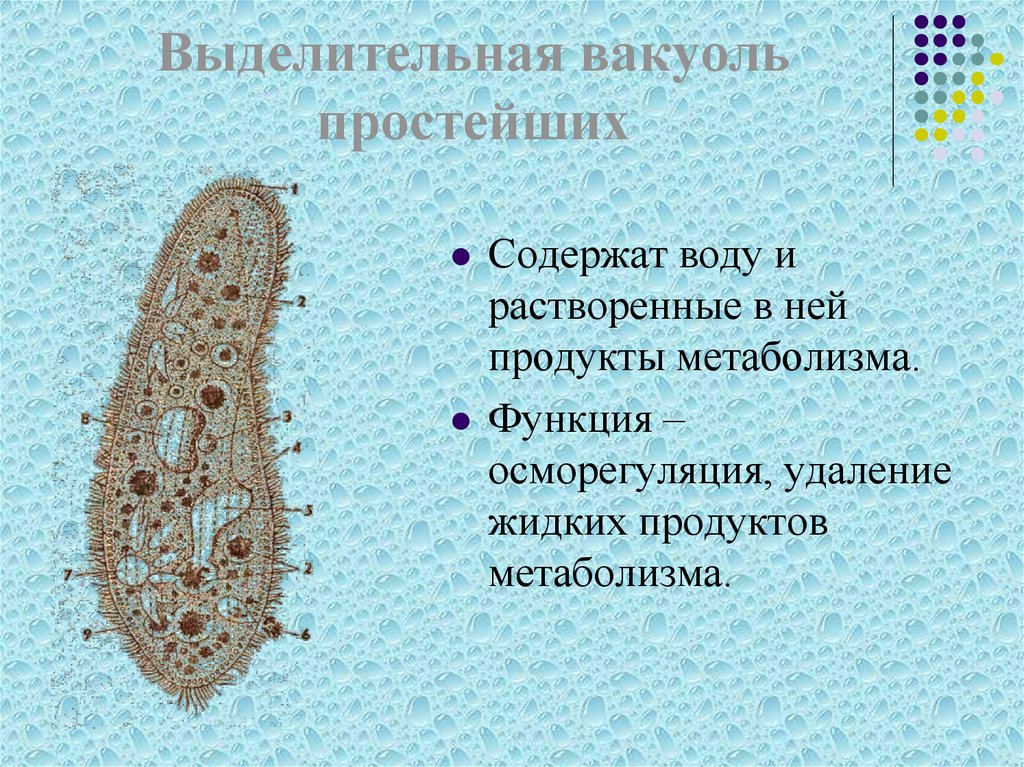
Сократительная вакуоль отвечает за
- переваривание питательных веществ
- осморегуляцию
- размножение
- хранение питательных веществ
Задание 5.
Из перечисленных ниже животных выберите представителя типа Апикомплексы.
- амёба кишечная
- трихомонада
- балантидий
- токсоплазма
Ответы: 1 – 4; 2 – 4; 3 – 1; 4 – 2; 5 – 4.
как проявляется более сложное, чем у других простейших, строение инфузории-туфельки в процессе питания и выделения — Спрашивалка
ТМ
Татьяна Могилевцева
- процесс
- питание
- выделение
- строение
- туфелька
- инфузория
Ек
Екатерина
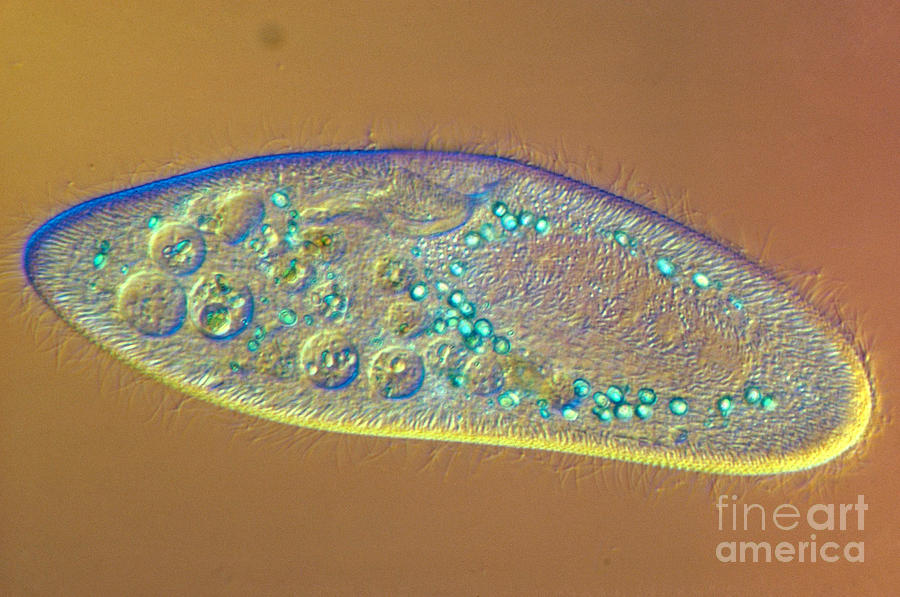
Инфузория-туфелька — представитель типа Инфузории. Она имеет наиболее сложную организацию. Места обитания инфузорий — водоемы с загрязненной стоячей водой. Длина ее тела составляет 0,1- 0,3 мм. Инфузория имеет постоянную форму тела в виде отпечатка стопы человека. Наружный слой эктоплазмы образует прочную эластичную пелликулу. Органоидами движения являются реснички — короткие плазматические выросты, покрывающие тело простейшего; число их достигает 10-15 тыс. В цитоплазме между ресничками располагаются особые защитные образования — трихоцисты. Примеханическом или химическом раздражении инфузории трихоцисты выстреливают длинную тонкую нить, которая внедряется в тело врага или жертвы и вводит ядовитое вещество, обладающие парализующим действием.
Она имеет наиболее сложную организацию. Места обитания инфузорий — водоемы с загрязненной стоячей водой. Длина ее тела составляет 0,1- 0,3 мм. Инфузория имеет постоянную форму тела в виде отпечатка стопы человека. Наружный слой эктоплазмы образует прочную эластичную пелликулу. Органоидами движения являются реснички — короткие плазматические выросты, покрывающие тело простейшего; число их достигает 10-15 тыс. В цитоплазме между ресничками располагаются особые защитные образования — трихоцисты. Примеханическом или химическом раздражении инфузории трихоцисты выстреливают длинную тонкую нить, которая внедряется в тело врага или жертвы и вводит ядовитое вещество, обладающие парализующим действием.
Строение инфузории туфельки:
1 — Реснички, 2 — Пищеварительные вакуоли, 3 — Макронуклеус, 4 — Микронуклеус, 5 — Сократительная вакуоль, 6 — Клеточный рот, 7 — Порошица
Для представителей типа характерным является сложный ядерный аппарат. У инфузории-туфельки вегетативное ядро, или макронуклеус, регулирует обменные процессы в клетке и является полиплоидным.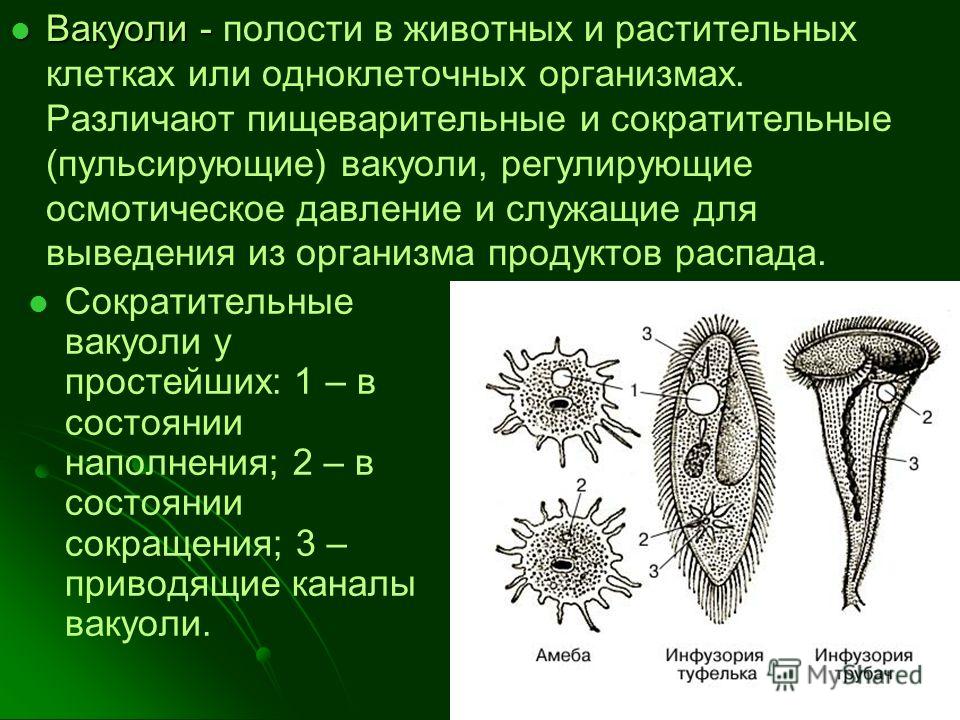 Генеративное ядро — микронуклеус — значительно меньших размеров, обычно диплоидное и отвечает за передачу наследственной информации при половом процессе и размножении. Питается инфузория бактериями, водорослями и одноклеточными животными, которые движением более крупных ресничек «загоняются» в углубление, называемое «клеточным ртом» . Далее пищевая частица проходит через «клеточную глотку» в цитоплазму, где вокруг нее формируется пищеварительная вакуоль. По мере продвижения пищеварительной вакуоли в эндоплазме под действием ферментов в ней происходит процесс переваривания пищи. Непереваренные остатки выбрасываются наружу через специальное отверстие — порошицу, которое расположено на заднем конце тела. Паразитические инфузории всасывают питательные вещества всей поверхностью тела (осмотическое питание) . Дыхание и выделение жидких продуктов обмена происходит так же, как и у всех простейших. Две сократительные вакуоли, расположенные на переднем и заднем концах тела, осуществляют осморегуляцию.
Генеративное ядро — микронуклеус — значительно меньших размеров, обычно диплоидное и отвечает за передачу наследственной информации при половом процессе и размножении. Питается инфузория бактериями, водорослями и одноклеточными животными, которые движением более крупных ресничек «загоняются» в углубление, называемое «клеточным ртом» . Далее пищевая частица проходит через «клеточную глотку» в цитоплазму, где вокруг нее формируется пищеварительная вакуоль. По мере продвижения пищеварительной вакуоли в эндоплазме под действием ферментов в ней происходит процесс переваривания пищи. Непереваренные остатки выбрасываются наружу через специальное отверстие — порошицу, которое расположено на заднем конце тела. Паразитические инфузории всасывают питательные вещества всей поверхностью тела (осмотическое питание) . Дыхание и выделение жидких продуктов обмена происходит так же, как и у всех простейших. Две сократительные вакуоли, расположенные на переднем и заднем концах тела, осуществляют осморегуляцию.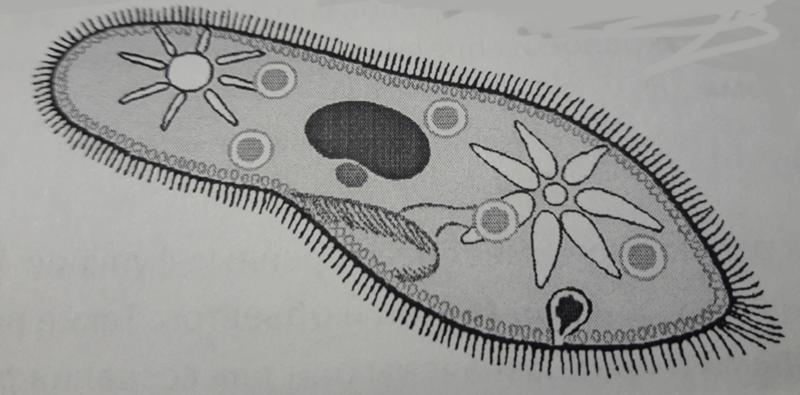
Размножается инфузория-туфелька бесполым способом — поперечным делением на две части. Начинается размножение с деления ядер. Микронуклеус проходит митотическое деление, а макронуклеус перешнуровкой делится пополам, но предварительно в нем происходит удвоение количества ДНК. Последним этапом процесса бесполого размножения является разделение цитоплазмы поперечной перетяжкой. Кроме того, для инфузории характерен половой процесс — конъюгация, во время которого происходит обмен генетической информацией. Половой процесс сопровождается перестройкой ядерного аппарата. Макронуклеус разрушается, а микронуклеус делится мейотически с образованием четырех ядер. Три из них отмирают, а оставшееся ядро делится еще раз митозом и образует женское и мужское гаплоидные ядра.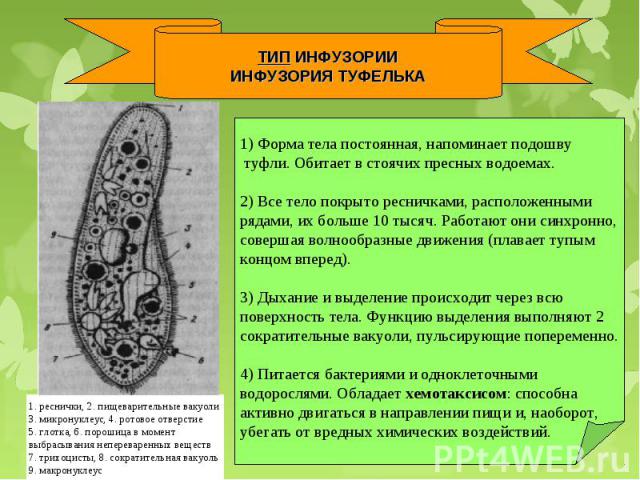
Ел
Елена
У Инфузории в процессе питания идет процесс очень похожий на пищеварение высших. То есть сначала щелочная а потом кислая обработка.
Так же питание происходит с помощью мембраннел, это околороточный реснички. Дальнейше пища идет по отделам. Клеточный рот ——> Перестом ——> Цитостом —-> Цитофаринскс ——> попав в глубь клетки кусочки пищи обволакивают ферментотивные пузыречки — Везикулы, которые образует в последствии Пищ.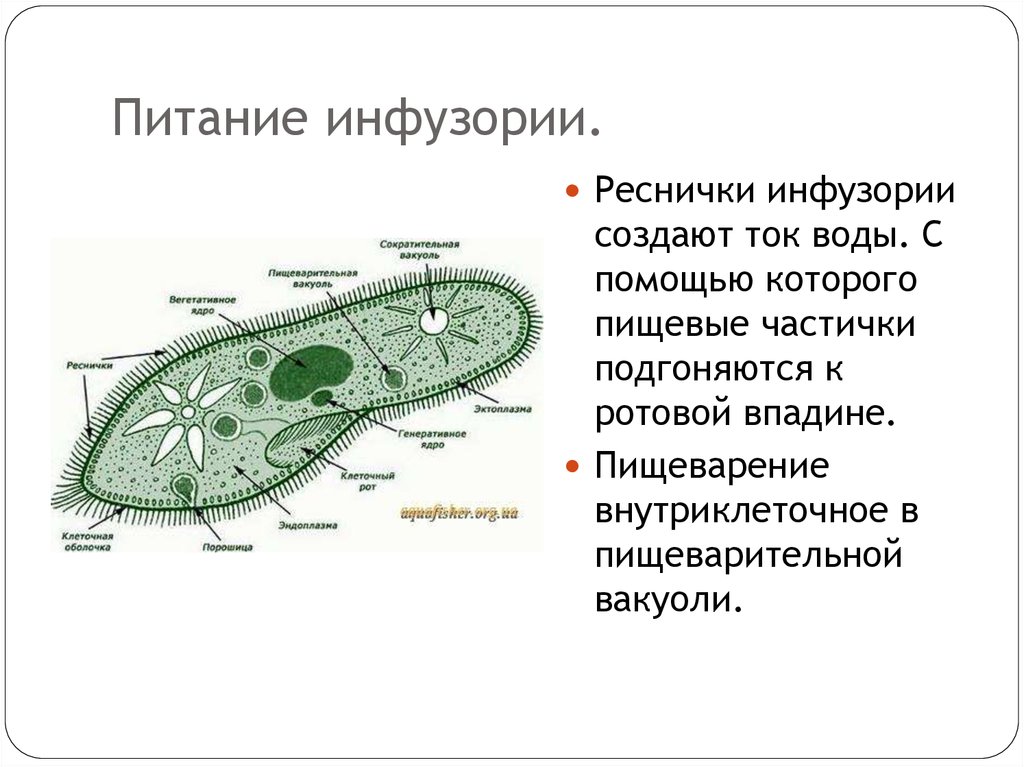 Вакуоль.
Вакуоль.
Выделиние осуществляется через порошицу. Свойственную только инфузориям.
Похожие вопросы
Скажите плиз движение, питание, выделение, дыхание, размножение, образование цист: Амёбы, Эвглены-зелёной, Инфузории-туфельки.
доказать, что инфузория туфелька самая высокоорганизованое простейшее?
Какие признаки докозывают более сложную организацию инфузории туфельки по сравнению с амёбой протей?
кто по способу питания : инфузория-туфелька? кто по способу питания : инфузория-туфелька
особенности строения и процессов жизнедеятельности инфузории-туфельки и пресноводной гидры
Напишите отличия пресноводной гидры от инфузории-туфельки. По строению тела, питанию, дыханию, выделение….
Как изменяется выделение воды у инфузории туфельки при увеличении солености воды?
отличается ли выделение у инфузории туфельки, амебы и эвглены?
способ питания у моллюсков гетеротрофный т к они относятся к животным? А Инфузория туфелька кто по способу питания?
каковы особенности полого и безполого размножение инфузории — туфельки?
Что делает сократительная вакуоль инфузории?
Содержание
- — Какую функцию выполняет сократительная вакуоль в Амебе?
- — Какую функцию кроме удаления продуктов обмена веществ выполняет сократительная вакуоль?
- — Какие бывают виды вакуолей и их функции?
- — Какая функция Скоротлива Вакуоля?
- — Для чего необходимо пищеварительная вакуоль в клетке амебы?
- — Почему сократительная вакуоль есть только у пресноводных простейших?
- — Какие органы выделения выводятся газообразные продукты обмена веществ?
- — Какие функции в организме выполняет выделительная система?
- — Что входит в выделительную систему человека?
- — Какие функции у цитоплазмы?
- — Как выглядит вакуоли?
- — Какие функции выполняет вакуоль?
- — Какие основные функции у сократительной вакуоли?
- — Что такое Травна Вакуоля?
- — Что такое пищевая вакуоль?
Сократи́тельная вакуо́ль — мембранный органоид, осуществляющий выброс излишков жидкости из цитоплазмы.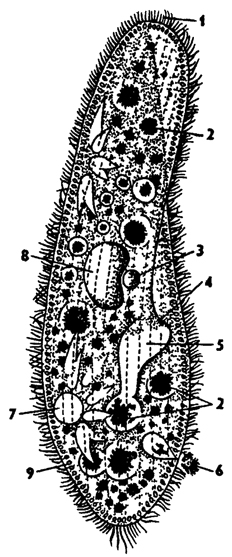 … Сократительные вакуоли распространены в первую очередь среди пресноводных протистов, таких как амёба протей и инфузория-туфелька, однако отмечены также и у морских форм.
… Сократительные вакуоли распространены в первую очередь среди пресноводных протистов, таких как амёба протей и инфузория-туфелька, однако отмечены также и у морских форм.
Какую функцию выполняет сократительная вакуоль в Амебе?
Основная функция сократительной вакуоли — регуляция осмотического давления внутри тела простейшего. Вода из окружающей среды проникает в тело амебы через наружную мембрану осмотически. … Подтверждением этой функции вакуоли служит распространение их преимущественно у пресноводных простейших.
Какую функцию кроме удаления продуктов обмена веществ выполняет сократительная вакуоль?
Кроме функции выделения накапливающихся в цитоплазме жидких продуктов метаболизма (обмена веществ), сократительная вакуоль освобождает простейшее от избытка воды, поступающей из окружающей среды в его тело. Т. е. … Кишечнополостные — не имеют специальных органов для выделения и осморегуляции.
Какие бывают виды вакуолей и их функции?
- у всех зеленых растений бывают вакуоли
- простейшие (амеба, инфузория) имеют сократительные и пищеварительные вакуоли
- переваривание пищи,
- удаление избытка воды и вредных веществ
- вакуоль
- ЭПС — это сеть каналов, пронизывающая всю цитоплазму.
 Она есть во всех клетках кроме клеток бактерий и эритроцитов.
Она есть во всех клетках кроме клеток бактерий и эритроцитов.
6 нояб. 2017 г.
Какая функция Скоротлива Вакуоля?
скоротлива вакуоля виконує видалення адлишку води з клітини(осморегуляція). травна вакуоля виконує функцію перетравлення та засвоєння їжі клітиною.
Для чего необходимо пищеварительная вакуоль в клетке амебы?
мембранные пузырьки в цитоплазме клетки, в которых происходит внутриклеточное пищеварение у простейших и губок. В ходе циклоза в пищеварительную вакуоль поступают ферменты, осуществляющие переваривание содержимого, реакция которого изменяется с кислой на щелочную. …
Почему сократительная вакуоль есть только у пресноводных простейших?
У пресноводных простейших внутри мембраны содержится больше соли, чем в воде, и вода постоянно стекает во внутрь, и для его фильтрации нужен сократительный вакуоль. В морях же нет такой проблемы, поскольку в воде содержатся большое количество растворимых солей, и простейшие берут лишь необходимое количество воды.
В морях же нет такой проблемы, поскольку в воде содержатся большое количество растворимых солей, и простейшие берут лишь необходимое количество воды.
Какие органы выделения выводятся газообразные продукты обмена веществ?
Вопрос 3. Через какие органы выделения выводятся газообразные продукты обмена веществ? Весь углекислый газ и немного воды удаляются через легкие в процессе дыхания.
Какие функции в организме выполняет выделительная система?
ВЫДЕЛИ́ТЕЛЬНАЯ СИСТЕ́МА (экскреторная система), совокупность органов, обеспечивающих выведение из организма животных и человека конечных продуктов обмена веществ, чужеродных и токсичных соединений, избытка органич. и неорганич. веществ, воды.
Что входит в выделительную систему человека?
мочевыделительная система
- две почки
- два мочеточника
- мочевой пузырь
- мочеиспускательный канал
Какие функции у цитоплазмы?
Цитоплазма постоянно движется, перетекает внутри живой клетки, перемещая вместе с собой различные вещества, включая и органоиды. … Важнейшая роль цитоплазмы — объединение всех клеточных структур (компонентов) и обеспечение их химического взаимодействия.
… Важнейшая роль цитоплазмы — объединение всех клеточных структур (компонентов) и обеспечение их химического взаимодействия.
Как выглядит вакуоли?
Вакуоль – один из важнейших органоидов клетки растений. Эти структуры выглядят как достаточно крупные полости или более мелкие пузырьки, формирующиеся из эндоплазматической сети. Они отграничены от цитоплазмы мембраной и заполнены жидкостью с растворенными органическими и неорганическими веществами.
Какие функции выполняет вакуоль?
В целом, список функций вакуолей включает в себя: накопление и хранение воды регуляция водно-солевого обмена поддержание тургорного давления
Какие основные функции у сократительной вакуоли?
Сократительная вакуоль у простейших, регулирует водный баланс клетки.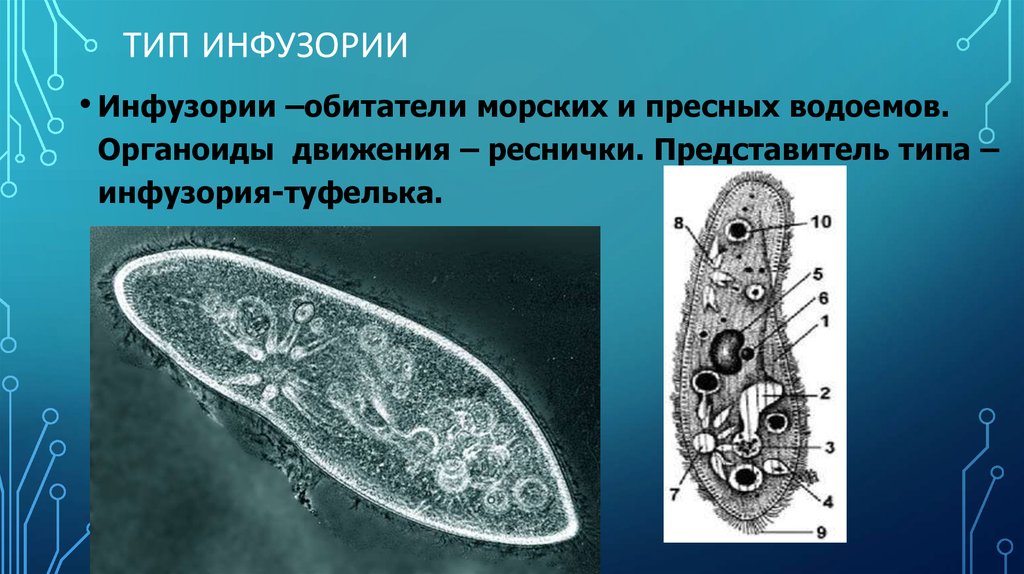 Как правило, концентрация химических веществ в окружающей среде значительно ниже той, что наблюдается в клетке. Изза разности осмотического давления вода в результате диффузии из внешней среды поступает в клетку.
Как правило, концентрация химических веществ в окружающей среде значительно ниже той, что наблюдается в клетке. Изза разности осмотического давления вода в результате диффузии из внешней среды поступает в клетку.
Что такое Травна Вакуоля?
травна вакуоля- органела клітини, яка забезпечує зберігання поживних речовин.
Что такое пищевая вакуоль?
Фагосома, или пищеварительная вакуоль, — вакуоль, образующаяся в процессе фагоцитоза, внутри которой находятся субстраты, подлежащие перевариванию. У простейших крупные частицы захватываются в фагоцитарные вакуоли, которые сливаются с лизосомами.
Интересные материалы:
В каком положении Носят противогаз?
В каком положении открыт кран на батарее?
В каком порядке читать Темную башню?
В каком порядке нужно смотреть фильмы про Ганнибала?
В каком порядке проходить миссии гта 5?
В каком приложении можно соединить музыку?
В каком продукте больше всего пробиотиков?
В каком разделе баланса отражается собственный капитал?
В каком разделе баланса отражаются материалы?
В каком регионе Днепр?
Сократительная вакуоль
Протист Парамеций аурелия со сократительными вакуолями
А сократительная вакуоль (резюме) представляет собой субклеточную структуру (органелла ) участвует в осморегуляция. Встречается преимущественно в протисты И в одноклеточный водоросли. Ранее он был известен как пульсирующий или же пульсирующая вакуоль.
Встречается преимущественно в протисты И в одноклеточный водоросли. Ранее он был известен как пульсирующий или же пульсирующая вакуоль.
Содержание
- 1 Обзор
- 2 Поток воды в CV
- 3 Нерешенные вопросы
- 4 Рекомендации
Обзор
Сократительная вакуоль — это специализированный тип вакуоль который регулирует количество воды внутри клетка. В пресная вода среды, концентрация из растворенные вещества является гипотонический, меньше снаружи, чем внутри клетки. В этих условиях осмос заставляет воду накапливаться в клетке из внешней среды. Сократительная вакуоль действует как часть защитного механизма, который предотвращает поглощение клеткой слишком большого количества воды и, возможно, лизать (разрыв) из-за чрезмерного внутреннего давления.
Сократительная вакуоль, как следует из названия, выталкивает воду из клетки, сокращаясь. Рост (скопление воды) и сокращение (вытеснение воды) сократительной вакуоли носят периодический характер. Один цикл занимает несколько секунд, в зависимости от вида и окружающей среды. осмолярность. Стадия, на которой вода поступает в ЦВ, называется диастола. Сжатие сократительной вакуоли и вытеснение воды из клетки называется систола.
Один цикл занимает несколько секунд, в зависимости от вида и окружающей среды. осмолярность. Стадия, на которой вода поступает в ЦВ, называется диастола. Сжатие сократительной вакуоли и вытеснение воды из клетки называется систола.
Вода всегда сначала течет извне ячейки в цитоплазма, и только затем перемещается из цитоплазмы в сократительную вакуоль для изгнания. Виды, которые обладают сократительной вакуолью, обычно всегда используют органеллы, даже в очень гипертонической (высокая концентрация растворенных веществ) средах, поскольку клетка имеет тенденцию корректировать свою цитоплазму, чтобы стать еще более гиперосмотической, чем среда. Количество воды, вытесненной из клетки, и скорость сокращения связаны с осмолярностью окружающей среды. В гиперосмотической среде будет вытеснено меньше воды и цикл сокращения будет длиннее.
Наиболее изученные сократительные вакуоли принадлежат протистам. Парамеций, Амеба, Диктиостелиум и Трипаносома, и в меньшей степени зеленая водоросль Хламидомонада. Не все виды, обладающие сократительной вакуолью, являются пресноводными. организмы; немного морской, почва микроорганизмы и паразиты также есть сократительная вакуоль. Сократительная вакуоль преобладает у видов, не имеющих клеточная стенка, но есть исключения (особенно Хламидомонада), которые действительно обладают клеточной стенкой. Через эволюция сократительная вакуоль обычно утрачивается в многоклеточный организмов, но он все еще существует на одноклеточной стадии нескольких многоклеточных грибы, а также в нескольких типах ячеек в губки (амебоциты, пинакоциты, и хоаноциты ).[1]
Не все виды, обладающие сократительной вакуолью, являются пресноводными. организмы; немного морской, почва микроорганизмы и паразиты также есть сократительная вакуоль. Сократительная вакуоль преобладает у видов, не имеющих клеточная стенка, но есть исключения (особенно Хламидомонада), которые действительно обладают клеточной стенкой. Через эволюция сократительная вакуоль обычно утрачивается в многоклеточный организмов, но он все еще существует на одноклеточной стадии нескольких многоклеточных грибы, а также в нескольких типах ячеек в губки (амебоциты, пинакоциты, и хоаноциты ).[1]
Количество сократительных вакуолей на клетку варьируется в зависимости от разновидность. Амеба Имеется, Dictyostelium discoideum, Парамеций аурелия и Хламидомонада Reinhardtii есть две, а гигантские амебы, такие как Хаос каролиненсис, есть много. Количество сократительных вакуолей у каждого вида в основном постоянно и поэтому используется для характеристики видов у животных.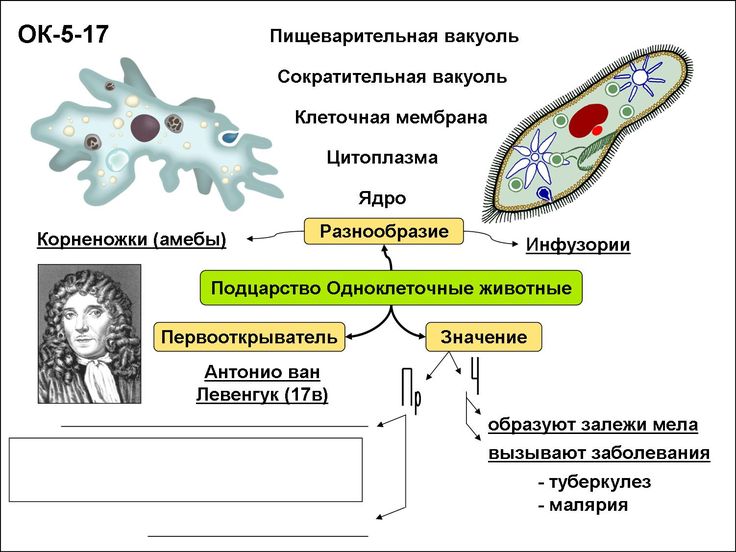 систематика. Сократительная вакуоль имеет несколько структур, прикрепленных к ней в большинстве клеток, таких как мембранные складки, трубочки, водотоки и малые пузырьки. Эти структуры получили название губчатый; сократительную вакуоль вместе со спонгиомом иногда называют «комплексом сократительной вакуоли» (CVC). Спонгиом выполняет несколько функций по транспортировке воды в сократительную вакуоль, а также к локализации и стыковке сократительной вакуоли внутри клетки.
систематика. Сократительная вакуоль имеет несколько структур, прикрепленных к ней в большинстве клеток, таких как мембранные складки, трубочки, водотоки и малые пузырьки. Эти структуры получили название губчатый; сократительную вакуоль вместе со спонгиомом иногда называют «комплексом сократительной вакуоли» (CVC). Спонгиом выполняет несколько функций по транспортировке воды в сократительную вакуоль, а также к локализации и стыковке сократительной вакуоли внутри клетки.
Парамеций и Амеба обладают большими сократительными вакуолями (средний диаметр 13 и 45 мкм соответственно), которые относительно удобны для выделения, манипуляции и анализа. Самые маленькие из известных сократительных вакуолей принадлежат к Хламидомонада, диаметром 1,5 мкм. В Парамеций, который имеет одну из самых сложных сократительных вакуолей, вакуоль окружена несколькими каналами, которые поглощают воду из цитоплазмы путем осмоса. После того, как каналы наполнятся водой, вода закачивается в вакуоль. Когда вакуоль заполнится, она вытесняет воду через поры в цитоплазме, которая может открываться и закрываться.[2] Другие протисты, такие как Амеба, имеют CV, которые перемещаются на поверхность клетки при заполнении и подвергаются экзоцитоз. В Амеба сократительные вакуоли собирают экскреторные отходы, такие как аммиак, от внутриклеточная жидкость обоими распространение и активный транспорт.
Когда вакуоль заполнится, она вытесняет воду через поры в цитоплазме, которая может открываться и закрываться.[2] Другие протисты, такие как Амеба, имеют CV, которые перемещаются на поверхность клетки при заполнении и подвергаются экзоцитоз. В Амеба сократительные вакуоли собирают экскреторные отходы, такие как аммиак, от внутриклеточная жидкость обоими распространение и активный транспорт.
Поток воды в CV
А Dictyostelium discoideum (слизистая плесень) ячейка с выраженной сократительной вакуолью на левой стороне
То, как вода поступает в CV, долгие годы оставалось загадкой, но несколько открытий, сделанных с 1990-х годов, улучшили понимание этой проблемы. Теоретически вода может пересечь мембрану ЦВ посредством осмоса, но только если внутренняя часть ЦВ гиперосмотична (более высокая концентрация растворенного вещества) по отношению к цитоплазме. Открытие протонные насосы в CV мембране[3] и прямое измерение концентраций ионов внутри CV с использованием микроэлектроды[4] привело к следующей модели: накачка протонов в ЦВ или из нее вызывает различные ионы для ввода резюме.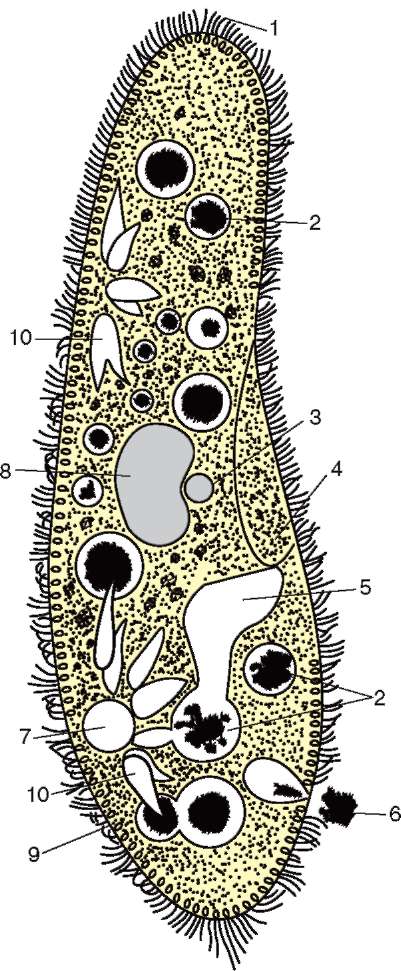 Например, некоторые протонные насосы работают как катиониты, в результате чего протон откачивается из CV, а катион закачивается одновременно в CV. В остальных случаях протоны, накачанные в ЦВ, увлекаются анионы с ними (карбонат, например), чтобы сбалансировать pH. Этот поток ионов в CV вызывает увеличение осмолярности CV, и в результате вода попадает в CV за счет осмоса. Было показано, что вода, по крайней мере, у некоторых видов попадает в CV через аквапорины.[5]
Например, некоторые протонные насосы работают как катиониты, в результате чего протон откачивается из CV, а катион закачивается одновременно в CV. В остальных случаях протоны, накачанные в ЦВ, увлекаются анионы с ними (карбонат, например), чтобы сбалансировать pH. Этот поток ионов в CV вызывает увеличение осмолярности CV, и в результате вода попадает в CV за счет осмоса. Было показано, что вода, по крайней мере, у некоторых видов попадает в CV через аквапорины.[5]
Ацидокальцисомы предполагалось, что они работают вместе с сократительной вакуолью в ответ на осмотический стресс. Они были обнаружены в окрестности вакуоли в Trypanosoma cruzi и было показано, что они сливаются с вакуолью, когда клетки подвергаются осмотическому стрессу. Предположительно ацидокальцисомы выводят свое ионное содержимое в сократительную вакуоль, тем самым увеличивая осмолярность вакуоли.[6]
Нерешенные вопросы
Эта секция возможно содержит оригинальные исследования. |
CV действительно не существует у высших организмов, но некоторые из его уникальных характеристик используются первыми в их собственных осморегуляторных механизмах. Таким образом, исследование CV может помочь нам понять, как осморегуляция работает у всех видов. Многие вопросы, связанные с резюме, остаются нерешенными по состоянию на 2010 год:
- Сокращение. Не до конца известно, что вызывает сокращение CV-мембраны и является ли это активным процессом, который стоит дорого. энергия или пассивный коллапс CV-мембраны. Доказательства причастности актин и миозин, заметная сократительная белки которые встречаются во многих клетках, неоднозначны.
- Состав мембраны. Хотя известно, что некоторые белки украшают CV-мембрану (V − H + −ATPases, аквапорины), полный список отсутствует.
 Рохлофф П., Монтальветти А., Докампо Р. (2004). «Ацидокальцисомы и сократительный комплекс вакуолей участвуют в осморегуляции у Trypanosoma cruzi». J Biol Chem. 279 (50): 52270–52281. Дои:10.1074 / jbc.M410372200. PMID 15466463.
Рохлофф П., Монтальветти А., Докампо Р. (2004). «Ацидокальцисомы и сократительный комплекс вакуолей участвуют в осморегуляции у Trypanosoma cruzi». J Biol Chem. 279 (50): 52270–52281. Дои:10.1074 / jbc.M410372200. PMID 15466463. - Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 14071
- Безграничный
- Безграничный
- Описать процесс обращения с отходами в микроорганизмах
- Сократительные вакуоли защищают клетку от поглощения слишком большого количества воды и потенциального взрыва при выделении лишней воды.
- Отходы, такие как аммиак, растворимы в воде; они выводятся из клетки вместе с избытком воды сократительными вакуолями.
- Сократительные вакуоли функционируют в периодическом цикле, расширяясь при сборе воды и сжимаясь при ее высвобождении.

- сократительная вакуоль : вакуоль, удаляющая отходы или избыток воды
- осморегуляция : гомеостатическая регуляция осмотического давления в организме для поддержания постоянного содержания воды
- осмолярность : Осмотическая концентрация раствора, обычно выражаемая в осмолях растворенного вещества на литр раствора.
- гипертонический : имеющий более высокое осмотическое давление, чем другой
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Безграничный
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги
- сократительная вакуоль
- 1 Ячеистая структура
- 2 Кормление
- 3 Специализированные сооружения
- 4 Классификация
- Класс Кариореликтеа
- Класс Heterotrichea (например, Stentor )
- Класс Spirotrichea
- Подкласс Choreotrichia (например, Tintinnidium )
- Подкласс Oligotrichia (например, Halteria )
- Подкласс Stichotrichia (например, Stylonychia )
- Подкласс Hypotrichia (например, Euplotes )
- Класс Litostomatea
- Подкласс Haptoria (например, Didinium )
- Подкласс Trichostomatia (например, Balantidium )
- Класс Phyllopharyngea
- Подкласс Филлофарингия
- Подкласс Rhynchodia
- Подкласс Chonotrichia
- Подкласс Suctoria (например, Podophrya )
- Класс Nassophorea
- Класс Colpoda (например, Colpoda )
- Класс Prostomatea (например, Coleps )
- Класс олигогименофореи
- Подкласс Peniculia (например, Paramecium )
- Подкласс Hymenostomatia (например, Tetrahymena )
- Подкласс Scuticociliatia
- Подкласс Peritrichia (например, Vorticella )
- Подкласс Астроматия
- Подкласс Апостоматия
- Класс Plagiopylea
- 555928
Последний
Самые читаемые
Самые цитируемые
41.7: Системы выделения – сократительные вакуоли в микроорганизмах
Цели обучения
Сократительная вакуоль (CV) представляет собой органеллу или субклеточную структуру, которая участвует в осморегуляции и удалении отходов.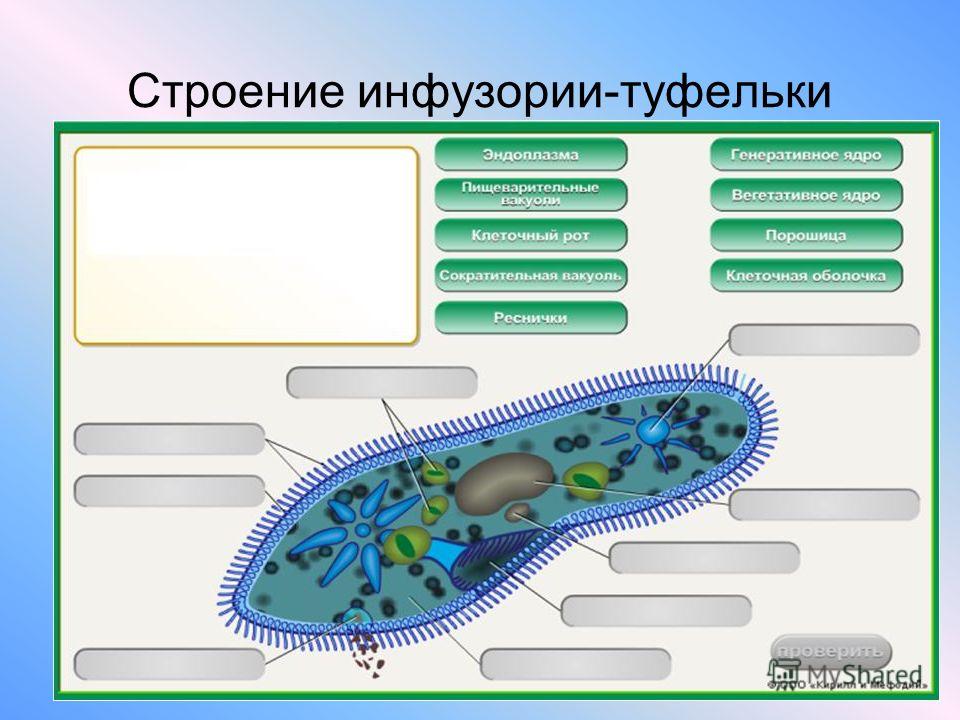 Ранее CV был известен как пульсирующая или пульсирующая вакуоль. CV не следует путать с вакуолями, которые хранят пищу или воду. CV встречается преимущественно у протистов и одноклеточных водорослей. В пресноводной среде концентрация растворенных веществ внутри клетки выше, чем вне клетки. В этих условиях вода поступает из окружающей среды в клетку путем осмоса. Таким образом, CV действует как защитный механизм против клеточной экспансии (и, возможно, взрыва) из-за слишком большого количества воды; он вытесняет лишнюю воду из клетки, сокращаясь. Однако не все виды, обладающие CV, являются пресноводными организмами; некоторые морские и почвенные микроорганизмы также имеют CV. CV преобладает у видов, не имеющих клеточной стенки, но есть и исключения. В процессе эволюции CV в основном был устранен у многоклеточных организмов; однако он все еще существует на одноклеточной стадии нескольких многоклеточных грибов и в нескольких типах клеток губок, включая амебоциты, пинакоциты и хоаноциты.
Ранее CV был известен как пульсирующая или пульсирующая вакуоль. CV не следует путать с вакуолями, которые хранят пищу или воду. CV встречается преимущественно у протистов и одноклеточных водорослей. В пресноводной среде концентрация растворенных веществ внутри клетки выше, чем вне клетки. В этих условиях вода поступает из окружающей среды в клетку путем осмоса. Таким образом, CV действует как защитный механизм против клеточной экспансии (и, возможно, взрыва) из-за слишком большого количества воды; он вытесняет лишнюю воду из клетки, сокращаясь. Однако не все виды, обладающие CV, являются пресноводными организмами; некоторые морские и почвенные микроорганизмы также имеют CV. CV преобладает у видов, не имеющих клеточной стенки, но есть и исключения. В процессе эволюции CV в основном был устранен у многоклеточных организмов; однако он все еще существует на одноклеточной стадии нескольких многоклеточных грибов и в нескольких типах клеток губок, включая амебоциты, пинакоциты и хоаноциты.
Фазы CV сбора воды (расширение) и выброса воды (сокращение) носят периодический характер. Один цикл занимает несколько секунд, в зависимости от вида и осмолярности окружающей среды. Стадия, на которой вода поступает в сердечный сосуд, называется диастолой. Сокращение сердечного сосуда и выброс воды из клетки называется систолой. Вода всегда поступает извне клетки в цитоплазму; и только потом из цитоплазмы в ЦВ. Виды, обладающие CV, всегда используют его, даже в очень гипертонической (высокой концентрации растворенных веществ) среде, поскольку клетка имеет тенденцию приспосабливать свою цитоплазму, чтобы она стала еще более гиперосмотической (гипертонической), чем окружающая среда. Количество воды, вытесняемой из клетки, и скорость сокращения связаны с осмолярностью окружающей среды. В гиперосмотической среде будет выделено меньше воды, а цикл сокращения будет длиннее.
Один цикл занимает несколько секунд, в зависимости от вида и осмолярности окружающей среды. Стадия, на которой вода поступает в сердечный сосуд, называется диастолой. Сокращение сердечного сосуда и выброс воды из клетки называется систолой. Вода всегда поступает извне клетки в цитоплазму; и только потом из цитоплазмы в ЦВ. Виды, обладающие CV, всегда используют его, даже в очень гипертонической (высокой концентрации растворенных веществ) среде, поскольку клетка имеет тенденцию приспосабливать свою цитоплазму, чтобы она стала еще более гиперосмотической (гипертонической), чем окружающая среда. Количество воды, вытесняемой из клетки, и скорость сокращения связаны с осмолярностью окружающей среды. В гиперосмотической среде будет выделено меньше воды, а цикл сокращения будет длиннее.
Количество CV на ячейку варьируется в зависимости от вида. У амебы есть один; Dictyostelium discoideum , Paramecium aurelia, и Chlamydomonas reinhardtii имеют два; и гигантские амебы, такие как Chaos carolinensis , имеют много.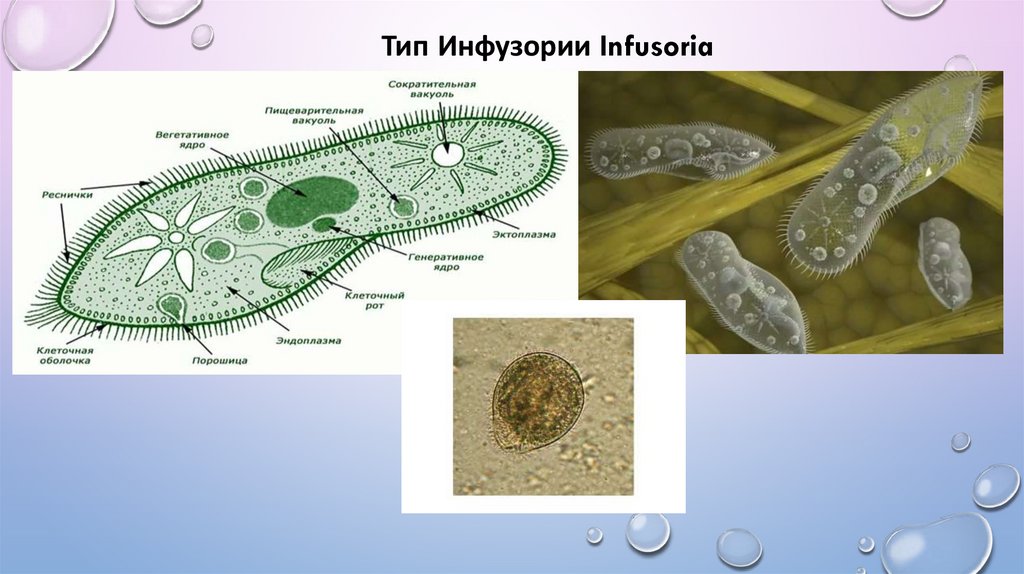 У некоторых одноклеточных эукариотических организмов (например, амебы) клеточные отходы, такие как аммиак и избыток воды, выделяются экзоцитозом, когда сократительные вакуоли сливаются с клеточной мембраной, выбрасывая отходы в окружающую среду. В Paramecium , который, предположительно, имеет наиболее сложный и высокоразвитый ЦВ, вакуоль окружена несколькими каналами, поглощающими воду путем осмоса из цитоплазмы. После заполнения каналов водой она закачивается в вакуоль. Когда вакуоль заполнена, она вытесняет воду через поры в цитоплазме, которые могут открываться и закрываться.
У некоторых одноклеточных эукариотических организмов (например, амебы) клеточные отходы, такие как аммиак и избыток воды, выделяются экзоцитозом, когда сократительные вакуоли сливаются с клеточной мембраной, выбрасывая отходы в окружающую среду. В Paramecium , который, предположительно, имеет наиболее сложный и высокоразвитый ЦВ, вакуоль окружена несколькими каналами, поглощающими воду путем осмоса из цитоплазмы. После заполнения каналов водой она закачивается в вакуоль. Когда вакуоль заполнена, она вытесняет воду через поры в цитоплазме, которые могут открываться и закрываться.
Ключевые моменты
Ключевые термины
Сократительная вакуоль как ключевой регулятор клеточного потока воды у Chlamydomonas reinhardtii
1. Patterson DJ.
1981.
Поведение комплекса сократительных вакуолей как диагностический признак свободноживущей амебы. Протистология
17: 243–248. [Академия Google]
Patterson DJ.
1981.
Поведение комплекса сократительных вакуолей как диагностический признак свободноживущей амебы. Протистология
17: 243–248. [Академия Google]
2. Аллен Р.Д. 2000. Сократительная вакуоль и ее мембранная динамика. Биоэссе 22:1035–1042. 10.1002/1521-1878(200011)22:11<1035::AID-BIES10>3.0.CO;2-A. [PubMed] [CrossRef] [Google Scholar]
3. Komsic-Buchmann K, Stephan LM, Becker B. 2012. Белок SEC6 необходим для сократительной функции вакуолей у Chlamydomonas reinhardtii. Дж. Клеточные науки. 125:2885–2895. 10.1242/jcs.099184. [PubMed] [CrossRef] [Google Scholar]
4. Платтнер Х. 2013. Сократительный комплекс вакуолей — его расширяющийся запас белков. Междунар. Рев. ячейка Мол. биол. 306: 371–416. 10.1016/В978-0-12-407694-5.00009-2. [PubMed] [CrossRef] [Google Scholar]
5. Komsic-Buchmann K, Becker B.
2013.
Сократительные вакуоли у зеленых водорослей – строение и функции, стр. 123–142. В Катсарос КХК. (ред.), Достижения в биологии клеток водорослей.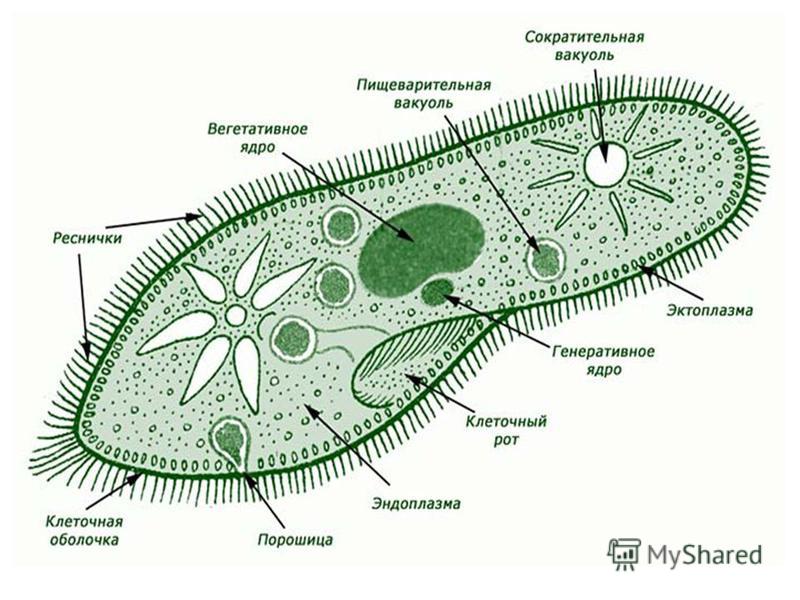 де Грюйтер, Берлин, Германия. [Google Scholar]
де Грюйтер, Берлин, Германия. [Google Scholar]
6. Ulrich PN, Jimenez V, Park M, Martins VP, Atwood J, Moles K, Collins D, Rohloff P, Tarleton R, Moreno SNJ, Orlando R, Docampo R. 2011. Идентификация сократительных белков вакуолей у Trypanosoma cruzi. PLoS Один 6:e18013. 10.1371/журнал.поне.0018013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Ян Б., Фукуда Н., Ван Хук А., Маттей М.А., Ма Т., Веркман А.С. 2000. Проницаемость аквапорина-1 для диоксида углерода измерена в эритроцитах и легких мышей с отсутствием аквапорина-1 и в реконструированных протеолипосомах. Дж. Биол. хим. 275: 2686–2692. 10.1074/jbc.275.4.2686. [PubMed] [CrossRef] [Google Scholar]
8. Zeidel ML, Ambudkar SV, Smith BL, Agre P. 1992. Восстановление функциональных водных каналов в липосомах, содержащих очищенный белок CHIP28 эритроцитов. Биохимия 31:7436–7440. 10.1021/bi00148a002. [PubMed] [CrossRef] [Академия Google]
9. Шомон Ф., Тайерман С.Д.
2014.
Аквапорины: строго регулируемые каналы, контролирующие водные отношения растений.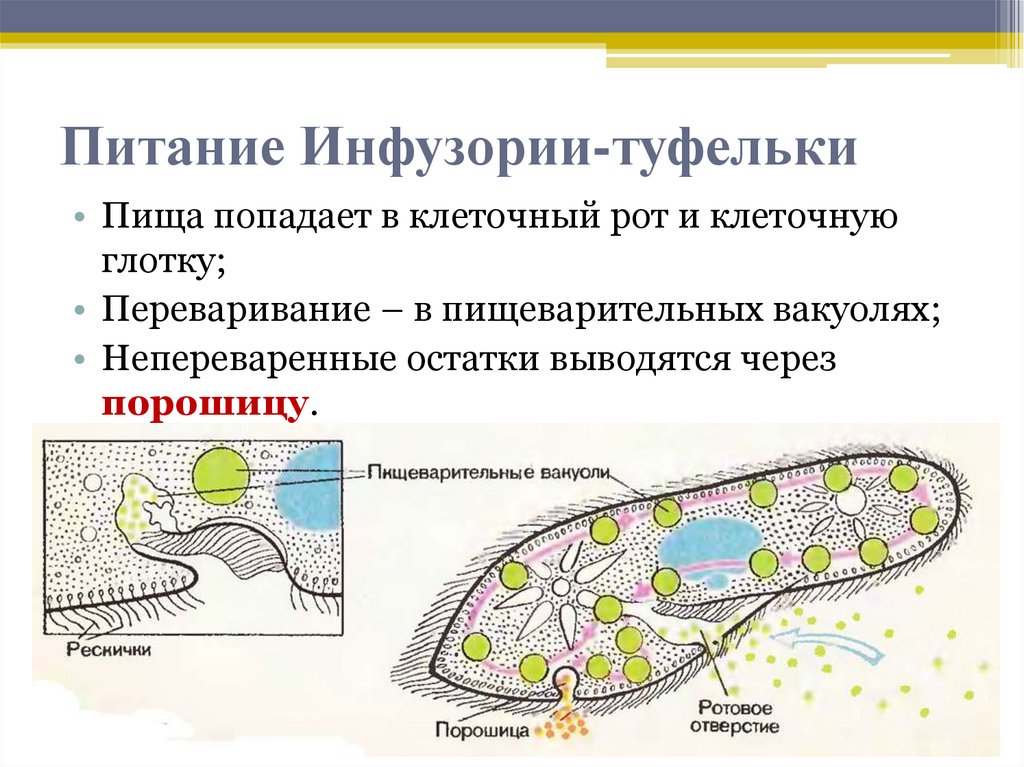 Завод Физиол.
164: 1600–1618. 10.1104/стр.113.233791. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Завод Физиол.
164: 1600–1618. 10.1104/стр.113.233791. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Нишихара Э., Йокота Э., Тадзаки А., Ории Х., Кацухара М., Катаока К., Игараши Х., Морияма Ю., Шиммен Т., Сонобе С. 2008. Наличие аквапорина и V-АТФазы на сократительной вакуоли Amoeba proteus. биол. Клетка 100: 179–188. 10.1042/BC20070091. [PubMed] [CrossRef] [Академия Google]
11. Фон Бюлов Дж., Мюллер-Люкс А., Кай Л., Бернхард Ф., Бейтц Э. 2012. Функциональная характеристика нового аквапорина из амеб Dictyostelium discoideum предполагает наличие уникального механизма ворот. Дж. Биол. хим. 287:7487–7494. 10.1074/jbc.M111.329102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Figarella K, Uzcategui NL, Zhou Y, LeFurgey A, Ouellette M, Bhattacharjee H, Mukhopadhyay R.
2007.
Биохимическая характеристика большого акваглицеропорина Leishmania LmAQP1: возможная роль в регуляции объема и осмотаксиса. Мол. микробиол.
65:1006–1017. 10.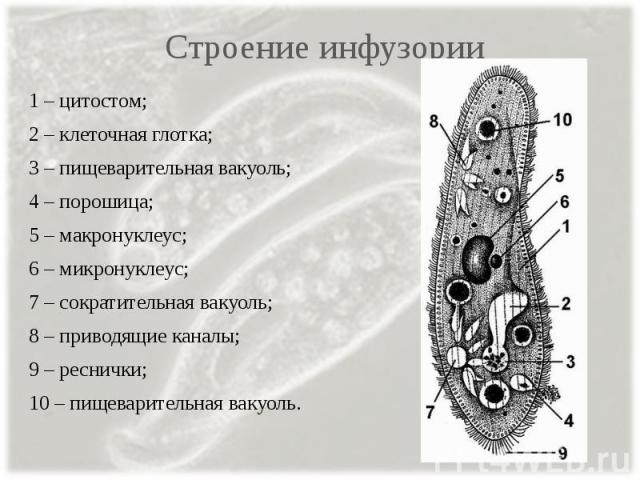 1111/j.1365-2958.2007.05845.х. [PubMed] [CrossRef] [Google Scholar]
1111/j.1365-2958.2007.05845.х. [PubMed] [CrossRef] [Google Scholar]
13. Монтальветти А., Рохлофф П., Докампо Р. 2004. Функциональный аквапорин локализуется вместе с вакуолярной протонной пирофосфатазой в ацидокальцисомах и комплексе сократительных вакуолей Trypanosoma cruzi. Дж. Биол. хим. 279:38673–38682. 10.1074/jbc.M406304200. [PubMed] [CrossRef] [Google Scholar]
14. Андерберг Х.И., Даниэльсон Дж.Х., Йохансон У. 2011. MIP водорослей, большое разнообразие и консервативные мотивы. БМС Эвол. биол. 11:110. 10.1186/1471-2148-11-110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Андерка М.И., Суга С., Фуруичи Т., Симогавара К., Муто С. 2004. Функциональная идентификация транспортной активности глицерина Chlamydomonas reinhardtii CrMIP1. Физиология клеток растений. 45:1313–1319. 10.1093/pcp/pch241. [PubMed] [CrossRef] [Google Scholar]
16. Блаби И.К., Блаби-Хаас К.Э., Турасс Н., Хом Э.Ф.Ю., Лопес Д., Аксой М., Гроссман А., Умен Дж., Датчер С. , Портер М., Кинг С., Витман Г.Б., Станке М., Харрис Э.Х., Гудштейн Д., Гримвуд Дж., Шмутц Дж., Валлон О., Мерчант С.С., Прочник С.
17
Июнь
2014.
Геномный проект Chlamydomonas: десятилетие спустя. Тенденции Растениевод.
10.1016/ж.трастения.2014.05.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Портер М., Кинг С., Витман Г.Б., Станке М., Харрис Э.Х., Гудштейн Д., Гримвуд Дж., Шмутц Дж., Валлон О., Мерчант С.С., Прочник С.
17
Июнь
2014.
Геномный проект Chlamydomonas: десятилетие спустя. Тенденции Растениевод.
10.1016/ж.трастения.2014.05.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Гроссман А.Р., Харрис Э.Е., Хаузер С., Лефевр П.А., Мартинес Д., Рохсар Д., Шрагер Дж., Силфлов К.Д., Стерн Д., Валлон О., Чжан З. 2003. Chlamydomonas reinhardtii на перекрестке геномики. Эукариот. Клетка 2: 1137–1150. 10.1128/ЕС.2.6.1137-1150.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Merchant SS, Prochnik SE, Vallon O, Harris EH, Karpowicz SJ, Witman GB, Terry A, Salamov A, Fritz-Laylin LK, Maréchal- Друар Л., Маршалл В.Ф., Ку Л.Х., Нельсон Д.Р., Сандерфут А.А., Спалдинг М.Х., Капитонов В.В., Рен К., Феррис П., Линдквист Э., Шапиро Х., Лукас С.М., Гримвуд Дж., Шмутц Дж., Кардол П., Черутти Х., Шанфро Г. , Чен С-Л, Коннат В., Крофт М.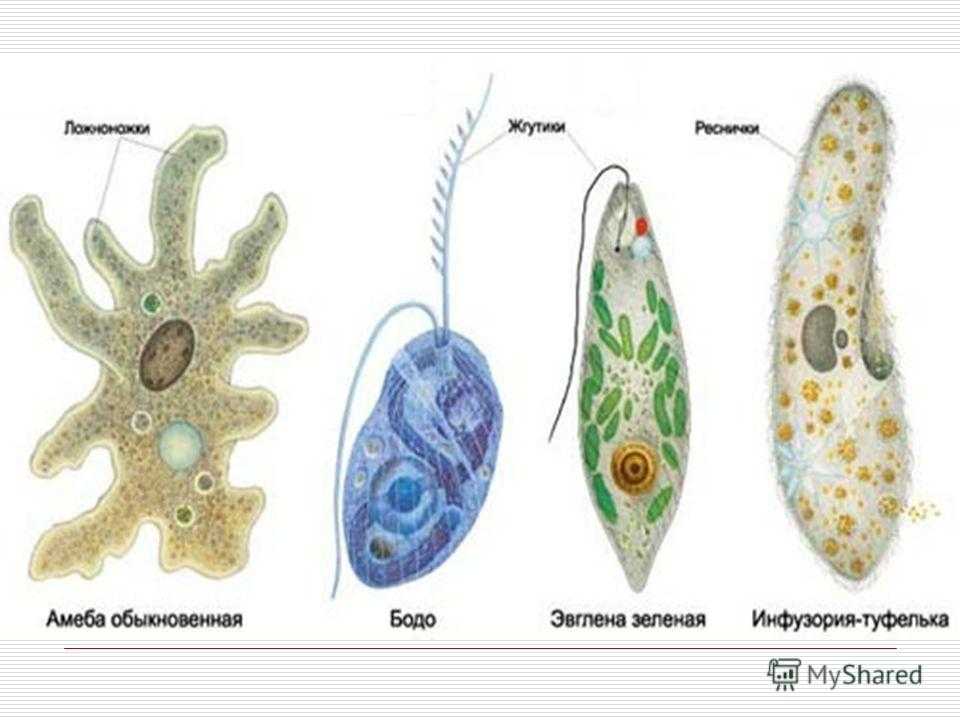 Т., Дент Р., Датчер С., Фернандес Э., Фукудзава Х., Гонсалес-Баллестер Д., Гонсалес-Хальфен Д., Холлманн А., Ханикенн М., Хипплер М., Инвуд В., Джаббари К., Каланон М., Курас Р., Лефевр П.А., Лемер С.Д., Лобанов А.В., Лор М., Мануэль А., Мейер И., Мец Л., Миттаг М., Миттельмайер Т., Морони Дж.В., Мозли Дж., Наполи С., Неделку А.М., Нийоги К., Новоселов С.В., Полсен И.Т. , Пазур Г., Пуртон С., Рал Дж.-П., Рианьо-Пачон Д.М., Рикхоф В., Римаркис Л., Шрода М., Стерн Д., Умен Дж., Уиллоуз Р., Уилсон Н., Циммер С.Л., Аллмер Дж., Балк Дж., Бисова К., Чен С-Дж. , Элиас М., Гендлер К., Хаузер С., Лэмб М.Р., Ледфорд Х., Лонг Дж.С., Минагава Дж., Пейдж MD, Pan J, Pootakham W, Roje S, Rose A, Stahlberg E, Terauchi AM, Yang P, Ball S, Bowler C, Dieckmann CL, Gladyshev VN, Green P, Jorgensen R, Mayfield S, Mueller-Roeber B, Rajamani С., Сайр Р.Т., Брокштейн П., Дубчак И., Гудстейн Д., Хорник Л., Хуан Ю.В., Джхавери Дж., Луо И., Мартинес Д., Нгау ВКА, Отиллар Б., Поляков А., Портер А., Шайковски Л., Вернер Г.
Т., Дент Р., Датчер С., Фернандес Э., Фукудзава Х., Гонсалес-Баллестер Д., Гонсалес-Хальфен Д., Холлманн А., Ханикенн М., Хипплер М., Инвуд В., Джаббари К., Каланон М., Курас Р., Лефевр П.А., Лемер С.Д., Лобанов А.В., Лор М., Мануэль А., Мейер И., Мец Л., Миттаг М., Миттельмайер Т., Морони Дж.В., Мозли Дж., Наполи С., Неделку А.М., Нийоги К., Новоселов С.В., Полсен И.Т. , Пазур Г., Пуртон С., Рал Дж.-П., Рианьо-Пачон Д.М., Рикхоф В., Римаркис Л., Шрода М., Стерн Д., Умен Дж., Уиллоуз Р., Уилсон Н., Циммер С.Л., Аллмер Дж., Балк Дж., Бисова К., Чен С-Дж. , Элиас М., Гендлер К., Хаузер С., Лэмб М.Р., Ледфорд Х., Лонг Дж.С., Минагава Дж., Пейдж MD, Pan J, Pootakham W, Roje S, Rose A, Stahlberg E, Terauchi AM, Yang P, Ball S, Bowler C, Dieckmann CL, Gladyshev VN, Green P, Jorgensen R, Mayfield S, Mueller-Roeber B, Rajamani С., Сайр Р.Т., Брокштейн П., Дубчак И., Гудстейн Д., Хорник Л., Хуан Ю.В., Джхавери Дж., Луо И., Мартинес Д., Нгау ВКА, Отиллар Б., Поляков А., Портер А., Шайковски Л., Вернер Г.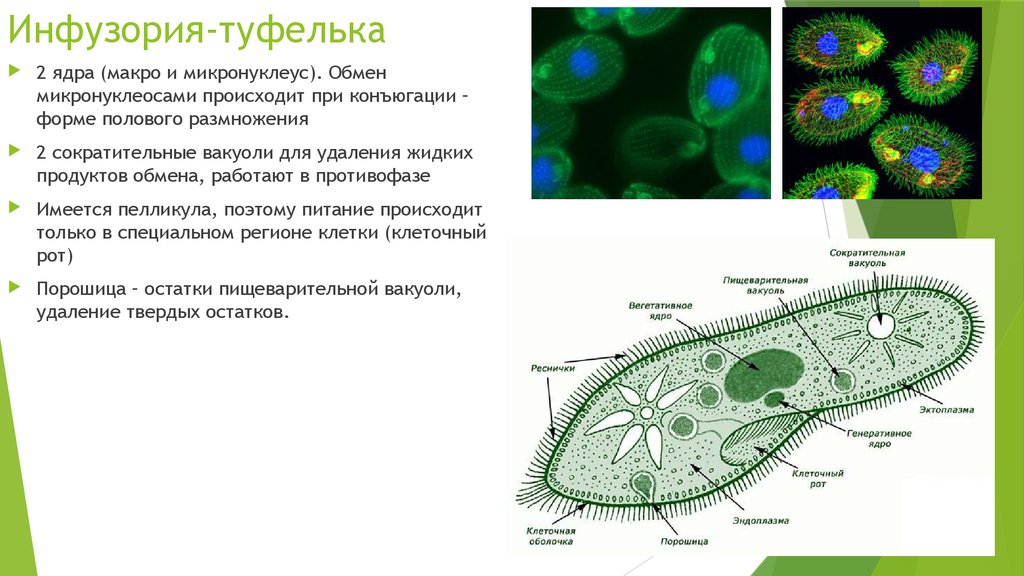 , Чжоу К., Григорьев И.В., Рохсар Д.С., Гроссман А.Р.
2007.
Геном Chlamydomonas раскрывает эволюцию ключевых функций животных и растений. Наука
318: 245–250. 10.1126/наука.1143609. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Чжоу К., Григорьев И.В., Рохсар Д.С., Гроссман А.Р.
2007.
Геном Chlamydomonas раскрывает эволюцию ключевых функций животных и растений. Наука
318: 245–250. 10.1126/наука.1143609. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Luykx P, Hoppenrath M, Robinson DG. 1997. Строение и поведение сократительных вакуолей у Chlamydomonas reinhardtii. протоплазма 198:73–84. 10.1007/BF01282133. [CrossRef] [Google Scholar]
20. Robinson DG, Hoppenrath M, Oberbeck K, Luykx P, Ratajczak R. 1998. Локализация пирофосфатазы и V-АТФазы у Chlamydomonas reinhardtii. Бот. Акта 111:108–122. 10.1111/j.1438-8677.1998.tb00685.x. [Перекрестная ссылка] [Академия Google]
21. Симогавара К., Фудзивара С., Гроссман А., Усуда Х. 1998. Высокоэффективная трансформация Chlamydomonas reinhardtii методом электропорации. Генетика 148: 1821–1828. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Neupert J, Karcher D, Bock R.
2009.
Генерация штаммов Chlamydomonas, которые эффективно экспрессируют ядерные трансгены.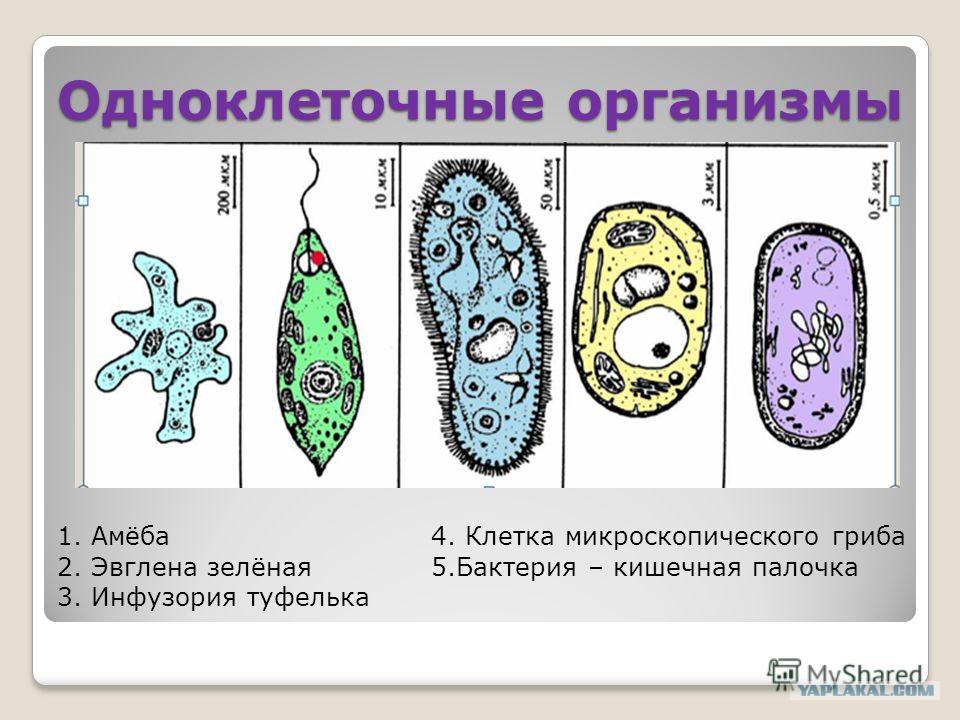 Завод J. Cell Mol. биол.
57:1140–1150. 10.1111/j.1365-313X.2008.03746.x. [PubMed] [CrossRef] [Google Scholar]
Завод J. Cell Mol. биол.
57:1140–1150. 10.1111/j.1365-313X.2008.03746.x. [PubMed] [CrossRef] [Google Scholar]
23. Buchanan BB, Gruissem W, Jones RL. 2000. Биохимия и молекулярная биология растений. Американское общество физиологов растений, Роквилл, Мэриленд. [Академия Google]
24. Тайз Л., Зейгер Э. 2006. Физиология растений, 4-е изд. Sinauer Associate, Inc., Сандерленд, Массачусетс. [Google Scholar]
25. Laemmli UK. 1970. Расщепление структурных белков при сборке головки бактериофага Т4. Природа 227:680–685. 10.1038/227680а0. [PubMed] [CrossRef] [Google Scholar]
26. Геймер С. 2009. Иммунозолотое мечение жгутиковых компонентов in situ. Методы клеточной биологии, 1-е изд. Эльзевир, Нью-Йорк, штат Нью-Йорк. [PubMed] [Google Scholar]
27. Арвидссон С., Квасьневский М., Риано-Пачон Д.М., Мюллер-Робер Б.
2008.
QuantPrime — гибкий инструмент для создания надежного высокопроизводительного праймера для количественной ПЦР. БМК Биоинформатика
9:465. 10.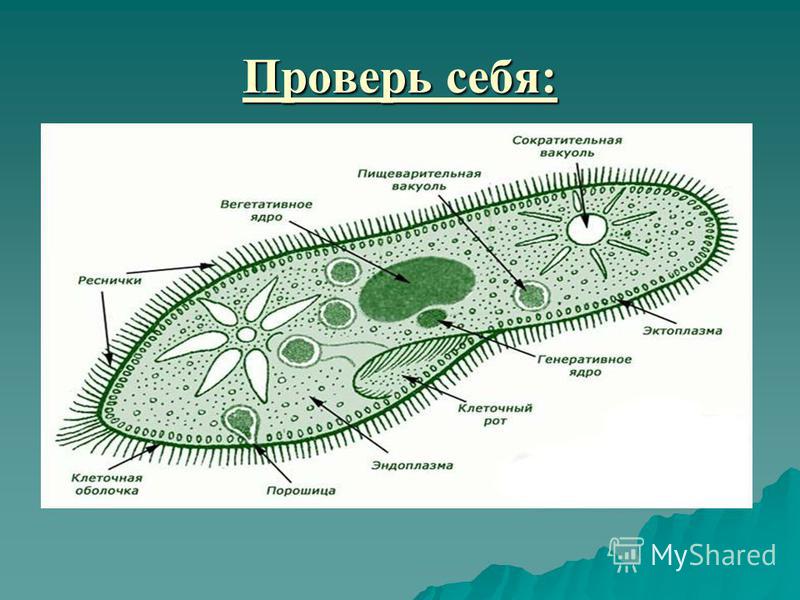 1186/1471-2105-9-465. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1186/1471-2105-9-465. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Untergasser A, Cutcutache I, Koressaar T, Ye J, Faircloth BC, Remm M, Rozen SG. 2012. Primer3 – новые возможности и интерфейсы. Нуклеиновые Кислоты Res. 40:e115. 10.1093/нар/гкс596. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Maurel C. 1997. Аквапорины и водопроницаемость растительных мембран. Анну. Преподобный Завод Физиол. Завод Мол. биол. 48:399–429. 10.1146/аннурев.арплант.48.1.399. [PubMed] [CrossRef] [Google Scholar]
30. Goodstein DM, Shu S, Howson R, Neupane R, Hayes RD, Fazo J, Mitros T, Dirks W, Hellsten U, Putnam N, Rokhsar DS. 2012. Phytozome: сравнительная платформа для геномики зеленых растений. Нуклеиновые Кислоты Res. 40:D1178–D1186. 10.1093/нар/гкр944. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Abascal F, Irisarri I, Zardoya R.
2014.
Разнообразие и эволюция мембранных внутренних белков. Биохим. Биофиз. Акта
1840: 1468–1481.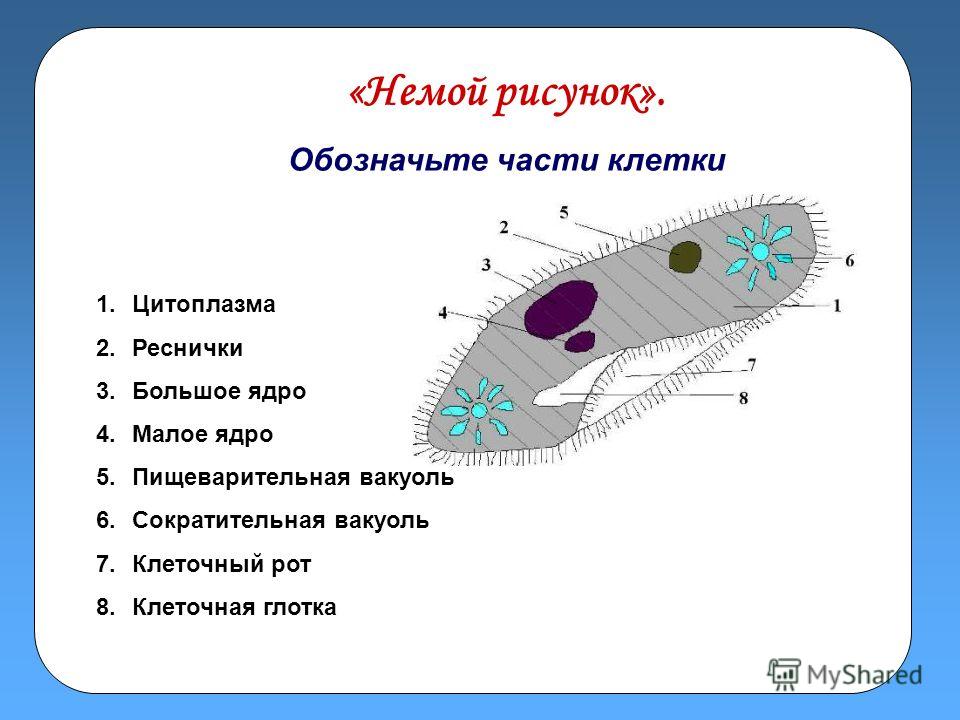 10.1016/j.bbagen.2013.12.001. [PubMed] [CrossRef] [Академия Google]
10.1016/j.bbagen.2013.12.001. [PubMed] [CrossRef] [Академия Google]
32. Исикава Ф., Суга С., Уэмура Т., Сато М.Х., Маэсима М. 2005. Аквапориновые SIP нового типа в основном локализованы на мембране ER и демонстрируют клеточно-специфическую экспрессию в Arabidopsis thaliana. ФЭБС лат. 579: 5814–5820. 10.1016/j.febslet.2005.09.076. [PubMed] [CrossRef] [Google Scholar]
33. Ning J, Otto TD, Pfander C, Schwach F, Brochet M, Bushell E, Goulding D, Sanders M, Lefebvre PA, Pei J, Grishin NV, Vanderlaan G, Биллкер О., Снелл В.Дж. 2013. Сравнительная геномика Chlamydomonas и Plasmodium идентифицирует древнее семейство белков ядерной оболочки, необходимое для полового размножения у простейших, грибов, растений и позвоночных. Гены Дев. 27:1198–1215. 10.1101/гад.212746.112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Ruiz FA, Marchesini N, Seufferheld M, Govindjee Docampo R.
2001.
Полифосфатные тельца Chlamydomonas reinhardtii обладают пирофосфатазой, перекачивающей протоны, и похожи на ацидокальцисомы.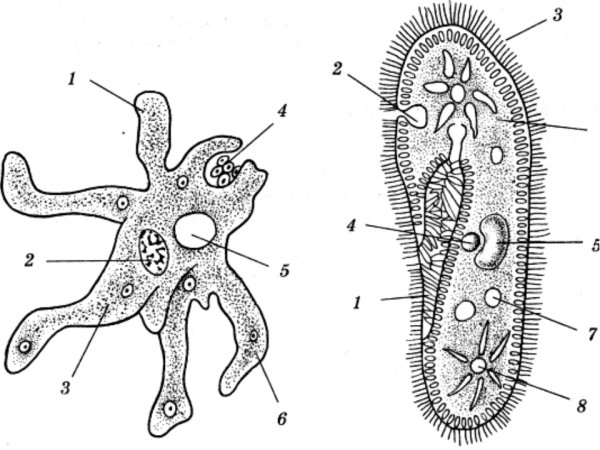 Дж. Биол. хим.
276:46196–46203. 10.1074/jbc.M105268200. [PubMed] [CrossRef] [Google Scholar]
Дж. Биол. хим.
276:46196–46203. 10.1074/jbc.M105268200. [PubMed] [CrossRef] [Google Scholar]
35. Weiss RL. 1983. Покрытые оболочкой везикулы в области сократительной вакуоли/маточной структуры Chlamydomonas. Дж. Ультраструктур. Рез. 85:33–44. 10.1016/S0022-5320(83)-4. [CrossRef] [Google Scholar]
36. Luykx P, Hopenrath M, Robinson DG. 1997. Осморегуляторные мутанты, влияющие на функцию сократительной вакуоли Chlamydomonas reinhardtii. протоплазма 200:99–111. 10.1007/BF01280738. [CrossRef] [Google Scholar]
37. Беккер Б., Хикиш А. 2005. Ингибирование сократительной функции вакуолей брефельдином А. Физиология клеток растений. 46:201–212. 10.1093/pcp/pci014. [PubMed] [CrossRef] [Google Scholar]
38. Бухманн К., Беккер Б. 2009 г.. Система сократительных вакуолей зеленой водоросли Mesostigma viride (Streptophyta). Протист 160:427–443. 10.1016/ж.протис.2009.01.002. [PubMed] [CrossRef] [Google Scholar]
39. Allen RD, Naitoh Y.
2002.
Осморегуляция и сократительные вакуоли простейших, стр.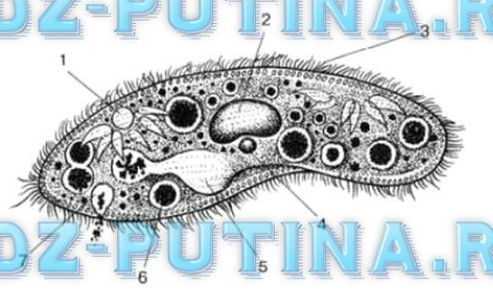 351–394. В Штейн В., Цойтен Т. (редактор), Молекулярные механизмы транспорта воды через биологические мембраны. Эльзевир, Нью-Йорк, штат Нью-Йорк. [Google Scholar]
351–394. В Штейн В., Цойтен Т. (редактор), Молекулярные механизмы транспорта воды через биологические мембраны. Эльзевир, Нью-Йорк, штат Нью-Йорк. [Google Scholar]
40. Ясуи М., Квон Т.Х., Кнеппер М.А., Нильсен С., Агре П. 1999. Аквапорин-6: белок водного канала внутриклеточных везикул в почечном эпителии. проц. Натл. акад. науч. США. 96: 5808–5813. 10.1073/пнас.96.10.5808. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Отто Б., Ухляйн Н., Сдорра С., Фишер М., Аяз М., Беластеги-Макадам X, Хеквольф М., Лахнит М., Педе Н., Прием Н. , Рейнхард А., Зигфарт С., Урбан М., Кальденхофф Р. 2010. Состав тетрамера аквапорина модифицирует функцию аквапоринов табака. Дж. Биол. хим. 285:31253–31260. 10.1074/jbc.M110.115881. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Йоханссон И., Карлссон М., Йохансон У., Ларссон С., Кьеллбом П.
2000.
Роль аквапоринов в водном балансе клетки и всего растения. Биохим. Биофиз. Акта
1465: 324–342.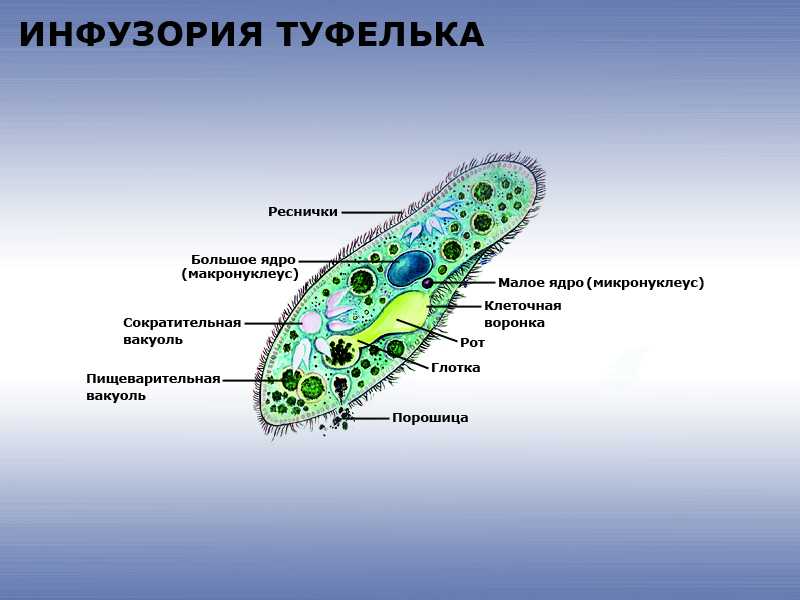 10.1016/С0005-2736(00)00147-4. [PubMed] [CrossRef] [Google Scholar]
10.1016/С0005-2736(00)00147-4. [PubMed] [CrossRef] [Google Scholar]
43. Веркман А.С., Митра А.К. 2000. Структура и функция аквапориновых водных каналов. Являюсь. Дж. Физиол. Почечная физиол. 278:F13–F28. [PubMed] [Google Scholar]
44. Marshall WF, Young KD, Swaffer M, Wood E, Nurse P, Kimura A, Frankel J, Wallingford J, Walbot V, Qu X, Roeder AHK. 2012. Что определяет размер клетки? БМС Биол. 10:101. 10.1186/1741-7007-10-101. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Педерсен С.Ф., Капус А., Хоффманн Э.К. 2011. Осмосенсорные механизмы в клеточной и системной регуляции объема. Варенье. соц. Нефрол. 22: 1587–1597. 10.1681/АСН.2010121284. [PubMed] [CrossRef] [Google Scholar]
46. Урао Т., Якубов Б., Сатох Р., Ямагучи-Шинозаки К., Секи М., Хираяма Т., Шинозаки К. 1999. Трансмембранная гистидинкиназа гибридного типа у арабидопсиса функционирует как осмосенсор. Растительная клетка 11: 1743–1754. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Инфузории — одна из важнейших групп протистов, распространенная почти везде, где есть вода — озера, пруды, океаны, реки и почвы, со многими эктосимбиотическими и эндосимбиотическими представителями, а также некоторыми облигатными и условно-патогенными паразитами. Дополнительные рекомендуемые знания
Ячеистая структура В отличие от других эукариот, инфузории имеют два разных типа ядер: маленькое диплоидное микроядро (репродукция) и большое полиплоидное макронуклеус (общая клеточная регуляция). За некоторыми исключениями, имеется отчетливый цитостом или рот, где происходит проглатывание. Пищевые вакуоли образуются в результате фагоцитоза и обычно следуют по определенному пути через клетку, поскольку их содержимое переваривается и расщепляется с помощью лизосом, поэтому вещества, содержащиеся в вакуоли, становятся достаточно маленькими, чтобы диффундировать через мембрану пищевой вакуоли в клетку. Кормление Большинство инфузорий питаются более мелкими организмами (гетеротрофными), такими как бактерии и водоросли, а детрит попадает в рот модифицированными ротовыми ресничками. Они обычно включают серию мембранелл слева от рта и пароральную мембрану справа от него, обе из которых возникают из поликинетид , групп многих ресничек вместе с ассоциированными структурами. Однако это значительно варьируется. Некоторые инфузории не имеют рта и питаются путем всасывания, в то время как другие являются хищниками и питаются другими простейшими и, в частности, другими инфузориями. Специализированные сооруженияУ некоторых форм имеются также поликинетиды тела, например, у спиротрихов, где они обычно образуют щетинки, называемые cirri . Чаще реснички тела располагаются в моно- и дикинетид , которые включают соответственно одну и две кинетосомы (базальные тельца), каждая из которых может поддерживать ресничку. Они организованы в ряды, называемые кинетиками , которые проходят от передней части клетки к задней. Тело и ротовые кинетиды составляют infraciliature , организация, уникальная для инфузорий и важная для их классификации, и включает различные фибриллы и микротрубочки, участвующие в координации ресничек. Инфракилиатура является одним из основных компонентов клеточной коры. Другим примером являются альвеолы , небольшие везикулы под клеточной мембраной, которые плотно прилегают к ней, образуя пелликулу, поддерживающую форму клетки, которая варьируется от гибкой и сократительной до жесткой. КлассификацияТип Цилиофора | |
Эта статья находится под лицензией GNU Free Documentation License.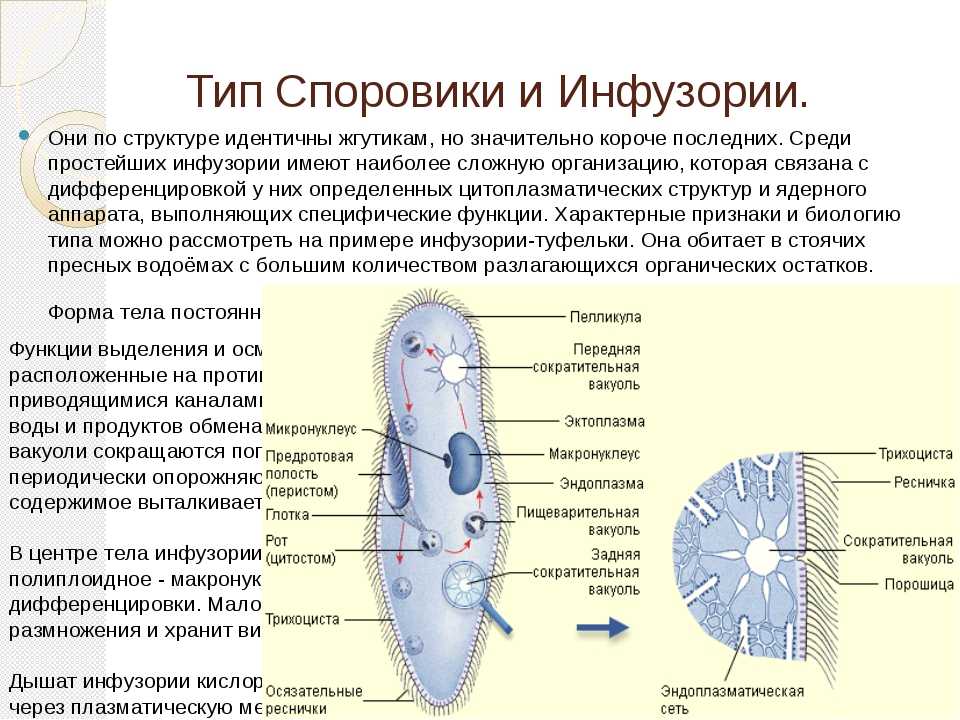 Он использует материал из статьи Википедии «Инфузория». Список авторов есть в Википедии. Он использует материал из статьи Википедии «Инфузория». Список авторов есть в Википедии. |
Ингибирование сократительной функции вакуолей по Брефельдину А | Физиология растений и клеток
Журнальная статья
Буркхард Беккер,
Буркхард Беккер
Ищите другие работы этого автора на:
Оксфордский академический
Google ученый
Анджела Хикиш
Анжела Хикиш
Ищите другие работы этого автора на:
Оксфордский академический
Google ученый
Физиология растений и клеток , том 46, выпуск 1, 15 января 2005 г., страницы 201–212, https://doi.org/10.1093/pcp/pci014
Опубликовано:
15 января 2005 г.
Фильтр поиска панели навигации Физиология растений и клетокЭтот выпускМолекулярная и клеточная биологияНауки о растениях и лесоводствоКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Физиология растений и клетокЭтот выпускМолекулярная и клеточная биологияНауки о растениях и лесоводствоКнигиЖурналыOxford Academic Термин поиска на микросайте
Advanced Search
Abstract
Брефельдин А (БФА) вызывает блокаду секреторной системы эукариотических клеток.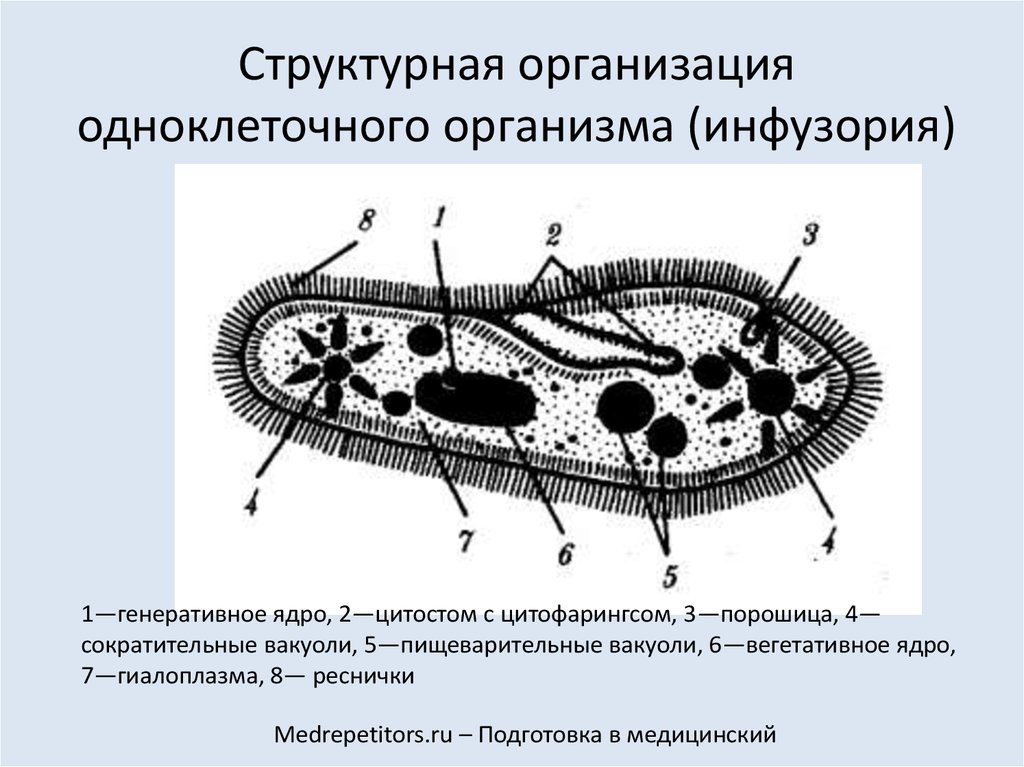 У чешуйчатых зеленых жгутиконосцев Scherffelia dubia BFA также влиял на функцию сократительных вакуолей (CVs). CV представляет собой осморегуляторную органеллу, которая периодически вытесняет жидкость из клетки у многих пресноводных простейших. Слияние CV-мембраны с плазматической мембраной, по-видимому, блокируется BFA у S. dubia. Два резюме из S. dubia набухают и, наконец, образуют большие центральные вакуоли (LCV). Индуцированное BFA образование LCV зависит от активности V-АТФазы и может быть обращено вспять гипертонической средой, что позволяет предположить, что накопление воды в LCV обусловлено осмосом. Мы предполагаем, что BFA-индуцированное образование LCV представляет собой длительную фазу диастолы. Нормальная фаза диастолы длится около 20 с, и ее трудно исследовать. Следовательно, BFA-индуцированное образование LCV у S. dubia представляет собой уникальную модельную систему для исследования фазы диастолы сердечно-сосудистого цикла.
У чешуйчатых зеленых жгутиконосцев Scherffelia dubia BFA также влиял на функцию сократительных вакуолей (CVs). CV представляет собой осморегуляторную органеллу, которая периодически вытесняет жидкость из клетки у многих пресноводных простейших. Слияние CV-мембраны с плазматической мембраной, по-видимому, блокируется BFA у S. dubia. Два резюме из S. dubia набухают и, наконец, образуют большие центральные вакуоли (LCV). Индуцированное BFA образование LCV зависит от активности V-АТФазы и может быть обращено вспять гипертонической средой, что позволяет предположить, что накопление воды в LCV обусловлено осмосом. Мы предполагаем, что BFA-индуцированное образование LCV представляет собой длительную фазу диастолы. Нормальная фаза диастолы длится около 20 с, и ее трудно исследовать. Следовательно, BFA-индуцированное образование LCV у S. dubia представляет собой уникальную модельную систему для исследования фазы диастолы сердечно-сосудистого цикла.
(Получено 29 марта 2004 г. ; принято 4 ноября 2004 г.)
; принято 4 ноября 2004 г.)
Введение
Сократительная вакуоль (CV) представляет собой замечательную органеллу, обнаруженную у многих простейших и некоторых пресноводных губок. CV представляют собой ограниченные мембраной вакуоли, которые медленно наполняются жидкостью (диастола) и периодически вытесняют жидкость (систола) из клетки и могут выполнять в первую очередь осморегуляторные функции (обзоры см. Patterson 1980, Hausmann and Patterson 1984, Allen 2000, Allen and Naitoh 2002). ). Среди зеленых водорослей CV были обнаружены у празинофитов и многих вольвоковых водорослей. CV отсутствуют в вегетативных клетках других зеленых водорослей, но могут появляться на определенных бесстеночных стадиях их жизненного цикла (Hausmann and Patterson 19).84). Морфология CV у зеленых водорослей была описана во многих публикациях, посвященных ультраструктуре зеленых жгутиковых или зооспор (обзор в Hausmann and Patterson 1984, Allen and Naitoh 2002). Количество ЦВ, обнаруживаемых в организме, как правило, постоянно и поэтому используется в качестве признака в систематике.
Экспериментальные данные свидетельствуют о том, что CVs имеют осморегуляторную функцию (Patterson 1980, Allen 2000, Allen and Naitoh 2002). Однако механизмы накопления и выделения жидкости до сих пор не ясны (Allen 2000, Allen and Naitoh 2002). Вакуолярный H 9Было обнаружено, что 0543 + -АТФаза связана с CV у Dictyostelium и Paramecium (Fok et al. 1993, Fok et al. 1995, Heuser et al. 1993), и было высказано предположение, что V-АТФаза катализирует первичную стадию преобразования энергии для перекачивания воды из цитоплазмы в CV (Nolta and Steck 1994). Однако нельзя полностью исключать существование водяных насосов, использующих АТФ (обсуждается в Allen and Naitoh 2002).
Кроме того, везикулярный транспорт важен для функции CV, так как rab-подобные GTPases были локализованы в CV Dictyostelium (Буш и др., 1994; Харрис и др., 2001). В соответствии с этим, электронная микроскопия (ЭМ) показала, что покрытые ямки связаны с мембранами CV у различных организмов (Patterson 1980).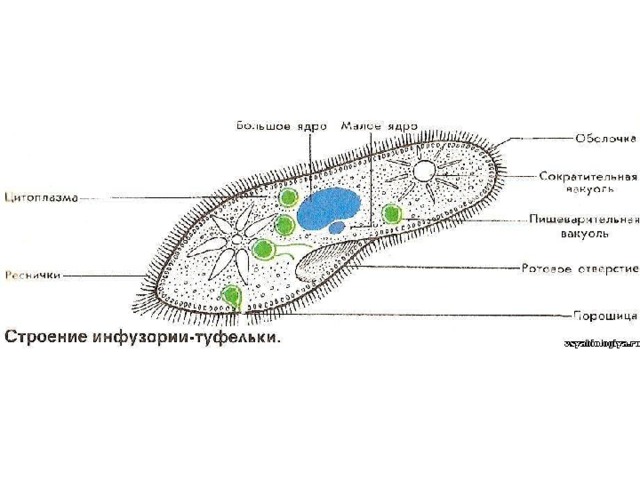
CV у зеленых водорослей состоит из заполненной жидкостью мембраносвязанной вакуоли и связанных с ней везикул с покрытием или везикулярных канальцевых мембран (Allen and Naitoh 2002, Hausmann and Patterson 1984). У многих водорослей CV многократно выделяют свое содержимое в дискретных точках клеточной поверхности. В некоторых исследованиях были обнаружены массивы мембранных частиц, связанные с этой областью плазматической мембраны (например, Weiss et al. 19).77). Структура и функция CV Chlamydomonas были исследованы достаточно подробно (например, Denning and Fulton 1989, Domozych and Nimmons 1992, Gruber and Rosario 1979, Luykx et al. 1997a, Luykx et al. 1997b, Robinson et al. 1998). Полный цикл сокращения занимает около 15 с в дистиллированной воде (Luykx et al., 1997b). На ранних стадиях диастолы CV Chlamydomonas состоял из многочисленных пузырьков диаметром около 70–120 нм. Эти везикулы сливались друг с другом, образуя большую вакуоль, которая росла за счет продолжающегося слияния маленьких везикул до тех пор, пока CV не достиг своего окончательного размера около 1,4 мкм (Luykx et al.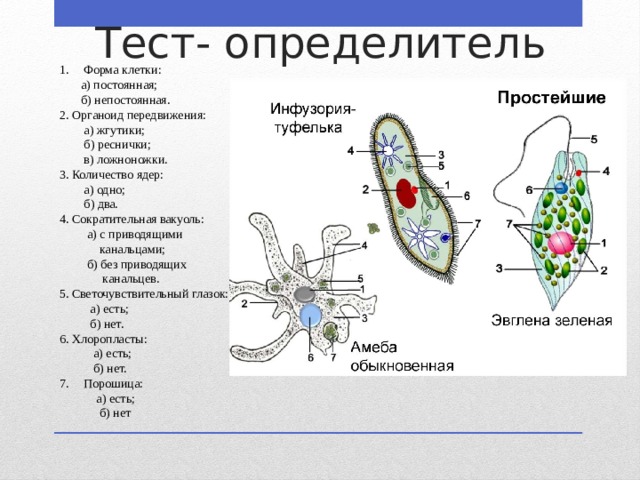 19).97б). Предполагается, что H + -насосная пирофосфатаза и V-АТФаза являются первичным источником энергии для поглощения воды у Chlamydomonas (Robinson et al. 1998). Согласно Робинсону и др. (1998), за поглощением протонов следует транспорт бикарбоната в ЦВ и осмотическое поглощение воды. Однако прямых доказательств этого механизма пока не представлено.
19).97б). Предполагается, что H + -насосная пирофосфатаза и V-АТФаза являются первичным источником энергии для поглощения воды у Chlamydomonas (Robinson et al. 1998). Согласно Робинсону и др. (1998), за поглощением протонов следует транспорт бикарбоната в ЦВ и осмотическое поглощение воды. Однако прямых доказательств этого механизма пока не представлено.
Празинофит Scherffelia dubia представляет собой четырехжгутиковое растение зеленого цвета с клеточным покрытием, состоящим из нескольких различных типов чешуек. Чешуйчатые празинофиты представляют собой предков, от которых произошли все остальные зеленые водоросли и наземные растения (Накаяма и др. 19).98, Чепмен и Уотерс, 2002). Жгутики покрыты тремя различными типами неминерализованных чешуек, называемых пятиугольными, человеческими (двойными, палочковидными) и волосяными чешуйками, в зависимости от их формы, выявленной с помощью сканирующей электронной микроскопии (СЭМ) и просвечивающей электронной микроскопии (ПЭМ). Мелконян и Прейзиг, 1986 г., Беккер и др., 1990 г.). Тело клетки покрыто клеточной стенкой, полученной онтогенетически из чешуек, которые сливаются внеклеточно, образуя клеточную стенку, называемую текой (McFadden et al. 1986, Melkonian and Preisig 19).86). Чешуйки состоят в основном из углеводов (Becker et al. 1991) и синтезируются в комплексе Гольджи (Melkonian et al. 1991, Becker et al. 1994). In vivo биогенез чешуи ограничивается клеточным делением. Однако биогенез жгутиковых чешуек можно индуцировать экспериментальной ампутацией жгутиков. После дефлагеллирования клетки регенерируют новые жгутики, включая их чешуйчатое покрытие. Используя эту экспериментальную систему, антероградный транспорт чешуи через комплекс Гольджи у S. dubia был подробно изучен (McFadden and Melkonian, 1986a, McFadden et al., 1986, Becker et al., 1995, Perasso et al., 2000), и результаты способствовали возрождению модели цистернальной прогрессии, которая теперь называется моделью цистернального созревания.
Мелконян и Прейзиг, 1986 г., Беккер и др., 1990 г.). Тело клетки покрыто клеточной стенкой, полученной онтогенетически из чешуек, которые сливаются внеклеточно, образуя клеточную стенку, называемую текой (McFadden et al. 1986, Melkonian and Preisig 19).86). Чешуйки состоят в основном из углеводов (Becker et al. 1991) и синтезируются в комплексе Гольджи (Melkonian et al. 1991, Becker et al. 1994). In vivo биогенез чешуи ограничивается клеточным делением. Однако биогенез жгутиковых чешуек можно индуцировать экспериментальной ампутацией жгутиков. После дефлагеллирования клетки регенерируют новые жгутики, включая их чешуйчатое покрытие. Используя эту экспериментальную систему, антероградный транспорт чешуи через комплекс Гольджи у S. dubia был подробно изучен (McFadden and Melkonian, 1986a, McFadden et al., 1986, Becker et al., 1995, Perasso et al., 2000), и результаты способствовали возрождению модели цистернальной прогрессии, которая теперь называется моделью цистернального созревания.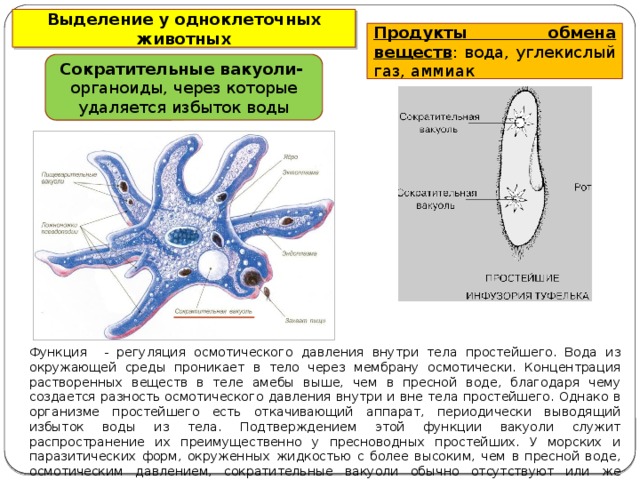 транспорт внутри Гольджи (Nebenführ 2003).
транспорт внутри Гольджи (Nebenführ 2003).
Грибковый макроциклический лактон брефельдин А (БФА) является широко используемым ингибитором секреции белка и функции Гольджи в клетках растений и млекопитающих (обзор в Nebenführ et al. 2002). Когда мы лечили клеток S. dubia с BFA, мы наблюдали, что BFA, как и ожидалось, влиял на структуру и функцию комплекса Гольджи и, что более удивительно, на функцию CV. Два CV набухли и, наконец, сформировали большие центральные вакуоли (LCV). Мы предполагаем, что BFA-индуцированное образование LCV у S. dubia представляет собой длительную фазу диастолы сердечно-сосудистого цикла. Таким образом, БЖК-зависимое образование больших вакуолей может дать уникальную возможность детально исследовать фазу диастолы сердечно-сосудистого цикла.
Результаты
Структура сократительной вакуоли у Scherffelia dubia
Когда клетки S. dubia наблюдали с помощью светового микроскопа (LM) в культуральной среде (5 мосМ), два CV были легко обнаружены вблизи переднего конца клетка по обеим сторонам жгутиковой борозды (см. световую микрофотографию клетки S. dubia на рис. 2А). Сокращения двух ЦВ имели тенденцию к чередованию со средним интервалом 22,3 ± 3,5 с ( n = 15, значение основано на видеозаписях отдельных клеток). Однако в некоторых случаях наблюдались значительно более короткие или более длинные интервалы сокращений (до 9с и до 30 с), что иногда приводило к почти одновременным циклам сокращения. Каждый CV достигал максимального размера 1,4 ± 0,1 мкм ( n = 15) в конце диастолы.
световую микрофотографию клетки S. dubia на рис. 2А). Сокращения двух ЦВ имели тенденцию к чередованию со средним интервалом 22,3 ± 3,5 с ( n = 15, значение основано на видеозаписях отдельных клеток). Однако в некоторых случаях наблюдались значительно более короткие или более длинные интервалы сокращений (до 9с и до 30 с), что иногда приводило к почти одновременным циклам сокращения. Каждый CV достигал максимального размера 1,4 ± 0,1 мкм ( n = 15) в конце диастолы.
Ультраструктуру CV исследовали в химически фиксированных клетках (подробное описание ультраструктуры S. dubia см. в Melkonian and Preisig 1986). В конце диастолы ЦВ состоял из одиночной вакуоли с гладкой мембраной (рис. 1А, Б). На этой стадии цикла CV мы никогда не наблюдали покрытых ямок на мембране CV. Иногда на внутренней поверхности ЦВ обнаруживались пятиугольные чешуйки (чешуйки подслоя, связанные с жгутиковой мембраной, см. рис. 1С, наконечники стрелок). Количество пентагональных чешуй внутри CV невелико в интерфазных клетках, когда клетки не синтезируют жгутиковые чешуи (табл.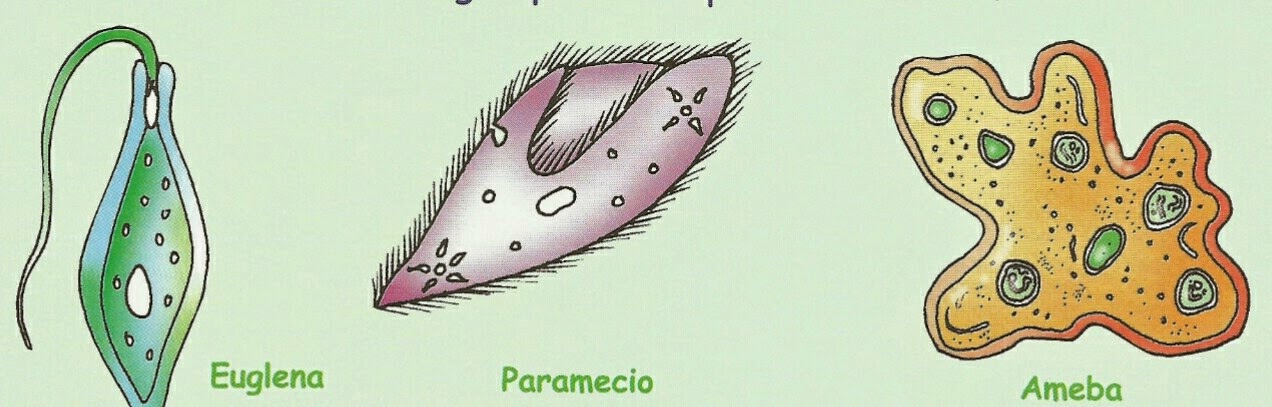 1). Напротив, в CV клеток, в которых биосинтез жгутиков (включая биогенез чешуек) был индуцирован экспериментальной ампутацией, мы наблюдали значительное количество пентагональных чешуек (табл. 1). Два других типа чешуи присутствуют на жгутиках S. dubia никогда не встречались в CV.
1). Напротив, в CV клеток, в которых биосинтез жгутиков (включая биогенез чешуек) был индуцирован экспериментальной ампутацией, мы наблюдали значительное количество пентагональных чешуек (табл. 1). Два других типа чешуи присутствуют на жгутиках S. dubia никогда не встречались в CV.
В дополнение к одиночной вакуоли, представляющей CV в конце диастолы, в области CV присутствует мембранозный ретикулум, содержащий многочисленные покрытые ямки (рис. 1, стрелки). В тангенциальных срезах покрытые ямки имеют сотовую структуру, типичную для ямок, покрытых клатрином (Melkonian and Preisig, 1986). Покрытые ямки часто содержат пятиугольные чешуйки (рис. 1, наконечники стрел). По этой причине мембранный ретикулум был назван Мелконяном и Прейзигом ретикулумом чешуи (SR) (19).86). В начале диастолы SR набухал (рис. 1D-I; обратите внимание на покрытые ямки, содержащие пятиугольные чешуйки, указанные стрелками) до того, как сформировалась большая круглая вакуоль (рис. 1A, B). Во время систолы (продолжительностью 1–2 с, по видеозаписи) ЦВ выбрасывал свое содержимое в жгутиковую борозду (рис. 1Л). Ни мелких вакуолей, как у Chlamydomonas (Luykx et al. 1997b), ни коллапсирующих крупных вакуолей в области CV обнаружено не было (рис. 1А, В). Единственной другой мембранной органеллой, наблюдаемой в области CV, была SR, что указывает на то, что SR может быть частью CV-комплекса Шерфелия . Однако непрерывность СР с круглой вакуолью на стадиях поздней диастолы никогда не наблюдалась, даже когда для исследования большей площади поверхности ЦВ использовались серийные срезы (данные не показаны).
1Л). Ни мелких вакуолей, как у Chlamydomonas (Luykx et al. 1997b), ни коллапсирующих крупных вакуолей в области CV обнаружено не было (рис. 1А, В). Единственной другой мембранной органеллой, наблюдаемой в области CV, была SR, что указывает на то, что SR может быть частью CV-комплекса Шерфелия . Однако непрерывность СР с круглой вакуолью на стадиях поздней диастолы никогда не наблюдалась, даже когда для исследования большей площади поверхности ЦВ использовались серийные срезы (данные не показаны).
Влияние BFA на сократительную вакуоль
При добавлении BFA к клеткам S. dubia два CV не смогли вытеснить жидкость и набухли (рис. 2B, 5 минут обработки BFA, видео 1 дополнительного материала) что сопровождается увеличением общего объема клетки, что свидетельствует о поглощении клеткой воды (см. видео 1 дополнительного материала). Примерно через 10 минут после добавления BFA клетки потеряли свои жгутики. Наконец, >90% клеток развили очевидный одиночный LCV (рис. 2C, видео 1 дополнительного материала). В течение 30 минут LCV достигла среднего диаметра 6,7 ± 1,3 мкм ( n = 20). Несколько клеток (максимум 10% клеточной популяции) оставались подвижными и совершенно не подвергались воздействию BFA, судя по LM.
2C, видео 1 дополнительного материала). В течение 30 минут LCV достигла среднего диаметра 6,7 ± 1,3 мкм ( n = 20). Несколько клеток (максимум 10% клеточной популяции) оставались подвижными и совершенно не подвергались воздействию BFA, судя по LM.
Образование LCV было полностью обратимым (проверено в течение 1 ч обработки BFA при 15 °C, данные не представлены). Индуцированное BFA образование LCV зависело от температуры. При 0°C (клетки, инкубированные с BFA на льду) LCV вообще не образовывались (рис. 2D), а в клетках, инкубированных с BFA при 15°C, образование LCV происходило значительно медленнее по сравнению с клетками, обработанными BFA при 25°C. °С (рис. 2Г).
Ультраструктура CV в обработанных БФА клетках S. dubia
Клетки дефлагеллировали и инкубировали в течение 20 минут при 20°C в культуральной среде перед добавлением БФА. Во время инкубации (без BFA) клетки начинали регенерировать новые жгутики и синтезировали новые жгутиковые чешуи (см.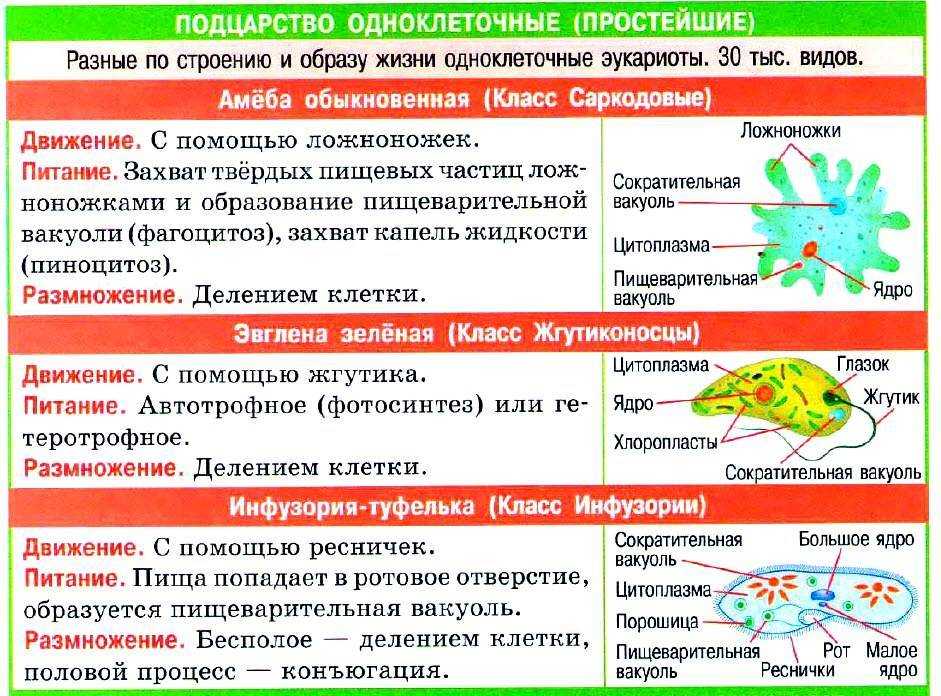 рис. 4А). Через 20 минут после удаления жгутиков все цистерны Гольджи содержат чешуйки, за исключением двух-трех цистерн cis -most (подробности см. ниже). Клетки химически фиксировали и обрабатывали для ЭМ перед добавлением BFA и через 5, 10, 15, 20 и 30 минут после добавления BFA. В качестве контроля через 20 минут после удаления жгутиков добавляли только метанол, а клетки фиксировали для ЭМ через 15 и 30 минут инкубации соответственно. Не влияет на ультраструктуру клеток S. dubia наблюдали в контрольных образцах (не показаны).
рис. 4А). Через 20 минут после удаления жгутиков все цистерны Гольджи содержат чешуйки, за исключением двух-трех цистерн cis -most (подробности см. ниже). Клетки химически фиксировали и обрабатывали для ЭМ перед добавлением BFA и через 5, 10, 15, 20 и 30 минут после добавления BFA. В качестве контроля через 20 минут после удаления жгутиков добавляли только метанол, а клетки фиксировали для ЭМ через 15 и 30 минут инкубации соответственно. Не влияет на ультраструктуру клеток S. dubia наблюдали в контрольных образцах (не показаны).
Клетки, зафиксированные через 5 мин после добавления БФА, содержали увеличенные CV неправильной геометрии (рис. 3A, B). В отличие от контрольных клеток, многочисленные покрытые ямки связаны с CV клеток, обработанных BFA (рис. 3C, стрелки). Через 10 минут после добавления BFA ЦВ были крупнее и имели более округлую геометрию (рис. 3D). Было замечено только несколько покрытых ямок, связанных с CV. ЭМ более поздних стадий показала либо один LCV (рис.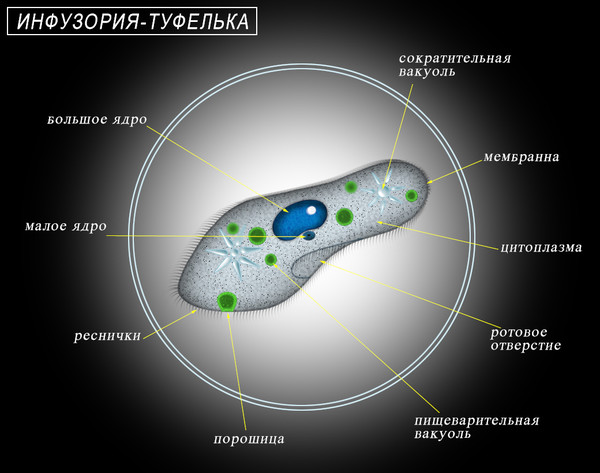 3E, 15 мин), что согласуется с наблюдениями LM, либо два LCV (рис. 3F, 30 мин). Вероятнее всего, в ячейках всегда было два LCV, которые не могли быть разрешены с помощью LM (см. также ниже). В клетках, обработанных BFA в течение >15 мин, наблюдались только остатки SR, что указывает на то, что SR в основном адсорбировался в LCV. Количество пятиугольных чешуек на мкм 2 мембраны LCV уменьшалась со временем инкубации BFA (таблица 1), что указывает на то, что источник мембраны для роста LCV имел более низкое содержание накипи, чем CV, и «разбавил» количество чешуек на мкм 2 мембраны в легкий коммерческий автомобиль. Сходные результаты были получены при обработке интерфазных клеток (без регенерации жгутиков) БФА.
3E, 15 мин), что согласуется с наблюдениями LM, либо два LCV (рис. 3F, 30 мин). Вероятнее всего, в ячейках всегда было два LCV, которые не могли быть разрешены с помощью LM (см. также ниже). В клетках, обработанных BFA в течение >15 мин, наблюдались только остатки SR, что указывает на то, что SR в основном адсорбировался в LCV. Количество пятиугольных чешуек на мкм 2 мембраны LCV уменьшалась со временем инкубации BFA (таблица 1), что указывает на то, что источник мембраны для роста LCV имел более низкое содержание накипи, чем CV, и «разбавил» количество чешуек на мкм 2 мембраны в легкий коммерческий автомобиль. Сходные результаты были получены при обработке интерфазных клеток (без регенерации жгутиков) БФА.
Ультраструктура комплекса Гольджи в клетках, обработанных БФА0044 С. Дубия
. В жгутиковых регенерирующих клетках S. dubia две стопки Гольджи содержали около 14 цистерн диаметром около 1,5 мкм (рис. 4А, таблица 2).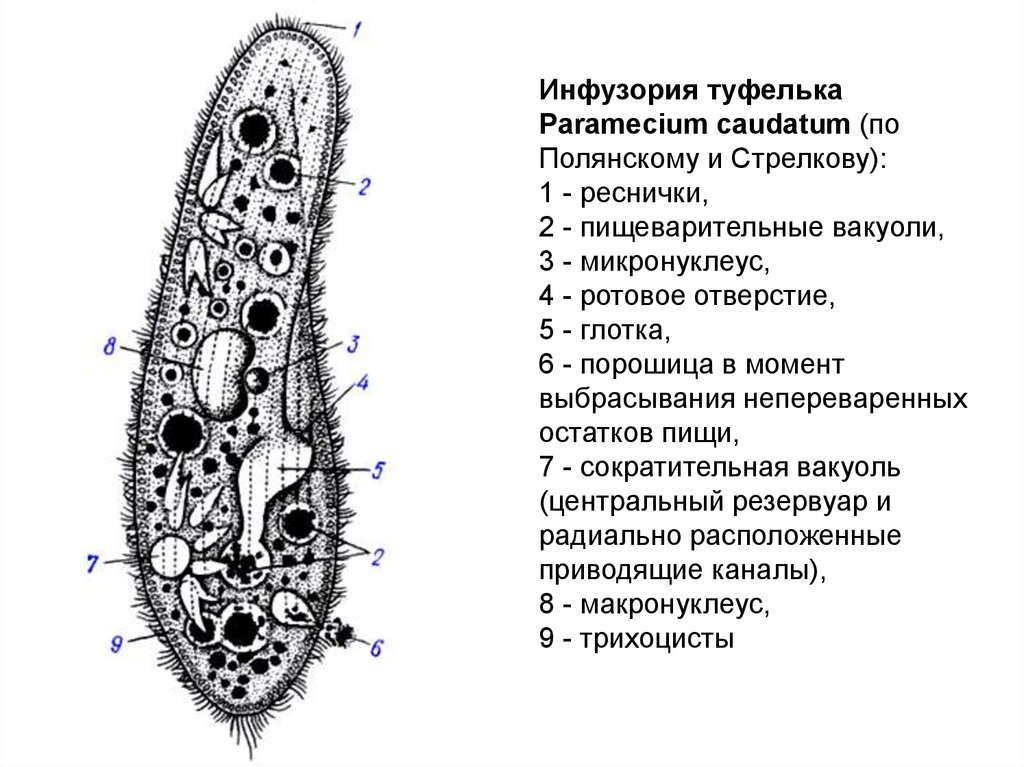 Цистерны были заполнены жгутиковыми чешуйками (наконечниками стрел), за исключением двух или трех цистерн cis -most, которые вообще лишены каких-либо чешуек (рис. 4А). Многочисленные переходные везикулы (скорее всего, COP1) можно увидеть на краю стопки (рис. 4А, маленькие стрелки, табл. 2). Секреторные везикулы, содержащие все три типа чешуек, транспортируют чешуйки на поверхность клетки (рис. 4А, стрелка). При добавлении БФА количество переходных везикул уменьшилось в течение 5 мин (таблица 2, рис. 4B), а количество цистерн уменьшилось с 14 до восьми в течение первых 10 мин (таблица 2, рис. 4B, C). Через 10 минут после добавления BFA все оставшиеся цистерны, включая cis — большинство цистерн содержало чешуйки (табл. 2, рис. 4В). На -цис--грани стопки скапливаются многочисленные мелкие вакуоли (диаметром 150 нм, стрелки). Никакого дальнейшего уменьшения количества цистерн не наблюдалось при более длительном времени инкубации BFA (например, стопка Гольджи на рис.
Цистерны были заполнены жгутиковыми чешуйками (наконечниками стрел), за исключением двух или трех цистерн cis -most, которые вообще лишены каких-либо чешуек (рис. 4А). Многочисленные переходные везикулы (скорее всего, COP1) можно увидеть на краю стопки (рис. 4А, маленькие стрелки, табл. 2). Секреторные везикулы, содержащие все три типа чешуек, транспортируют чешуйки на поверхность клетки (рис. 4А, стрелка). При добавлении БФА количество переходных везикул уменьшилось в течение 5 мин (таблица 2, рис. 4B), а количество цистерн уменьшилось с 14 до восьми в течение первых 10 мин (таблица 2, рис. 4B, C). Через 10 минут после добавления BFA все оставшиеся цистерны, включая cis — большинство цистерн содержало чешуйки (табл. 2, рис. 4В). На -цис--грани стопки скапливаются многочисленные мелкие вакуоли (диаметром 150 нм, стрелки). Никакого дальнейшего уменьшения количества цистерн не наблюдалось при более длительном времени инкубации BFA (например, стопка Гольджи на рис.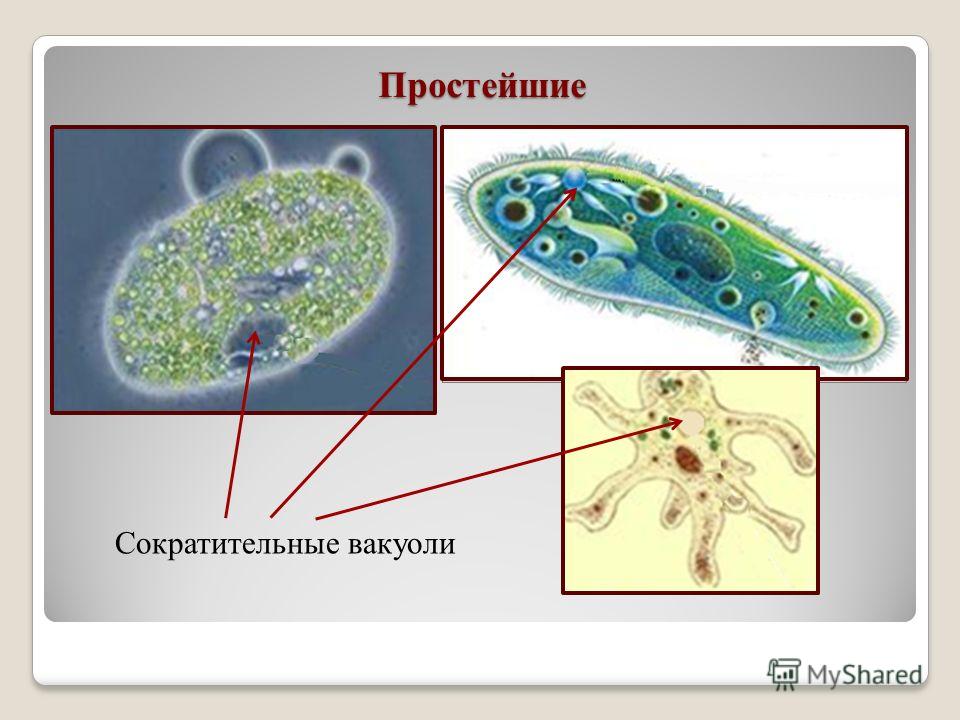 3D содержит семь цистерн после 15 минут обработки BFA). Однако через 15 минут на общую структуру клеток сильно повлиял растущий LCV (рис. 3D, E). Поэтому трудно исключить, что растущие LCV ингибировали дальнейшее влияние БФА на структуру комплекса Гольджи. До сих пор нам не удалось найти никаких условий, которые бы разделяли оба эффекта БФА и позволяли бы исследовать влияние БФА на структуру Гольджи, не влияя на ЦВ, и наоборот.
3D содержит семь цистерн после 15 минут обработки BFA). Однако через 15 минут на общую структуру клеток сильно повлиял растущий LCV (рис. 3D, E). Поэтому трудно исключить, что растущие LCV ингибировали дальнейшее влияние БФА на структуру комплекса Гольджи. До сих пор нам не удалось найти никаких условий, которые бы разделяли оба эффекта БФА и позволяли бы исследовать влияние БФА на структуру Гольджи, не влияя на ЦВ, и наоборот.V-АТФазная активность необходима для образования LCV
V-АТФазная активность необходима для функционирования CV у многих организмов (обобщено в Allen 2000, Allen and Naitoh 2002). Чтобы проверить, требуется ли также активность V-АТФазы для образования LCV, клетки обрабатывали BFA и/или специфическим ингибитором V-АТФазы конканамицином А (Конкан А). Конкан А оказался очень токсичным для S. dubia , и клетки погибли в течение 15 минут при обработке 1,5 мкМ (по оценке LM). Мы не смогли наблюдать какой-либо CV-активности в клетках, обработанных Concan A.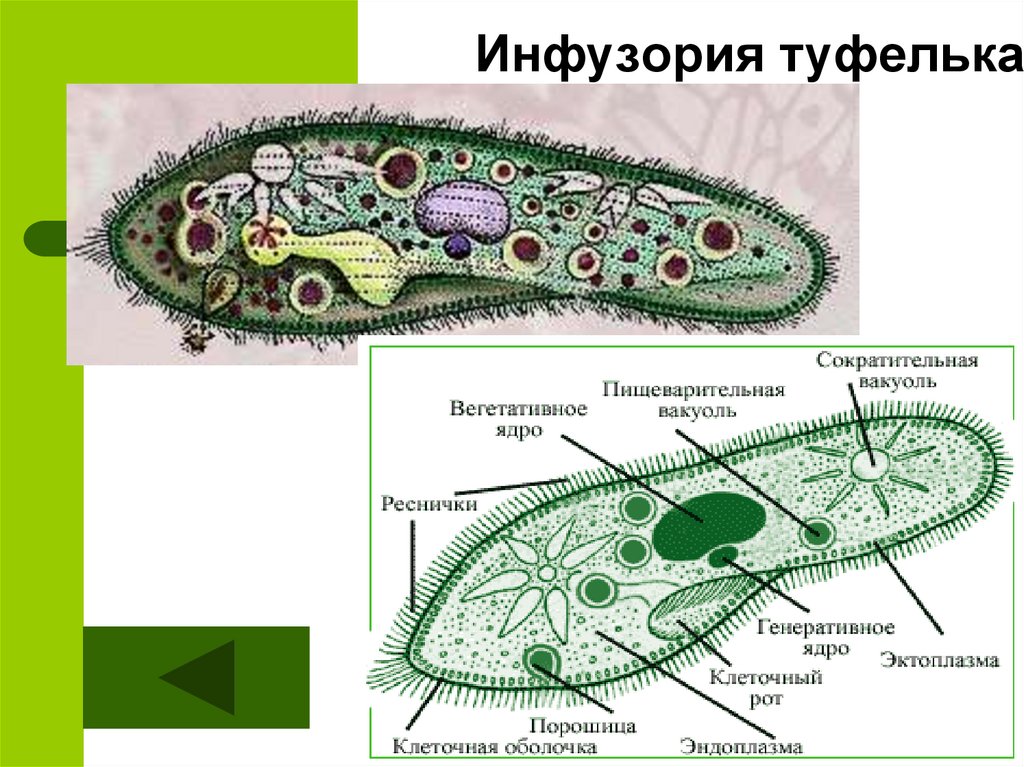 Из-за потери CV-активности клетки, обработанные Concan A, сначала набухли и, наконец, лопнули (не показано), что объясняет наблюдаемую токсичность Concan A. Клетки были жизнеспособны в присутствии Конкана А, когда в среду добавляли 100 мМ сахарозы (не показано). В этих условиях клетки оставались подвижными, хотя во многих клетках наблюдался плазмолиз (см. также ниже). ЭМ подтвердила световые микроскопические наблюдения. В клетках, обработанных Конканом А в течение 10 мин, не было обнаружено ни одного заполненного CV (рис. 5А), а структура стопок Гольджи была изменена (рис. 5). Количество цистерн увеличилось, транс -цистерны показали сильную вогнутую кривизну (рис. 5А). На многих срезах транс -цистерн выглядели как многослойные везикулярные структуры (рис. 5А, Б). Формирование переходных пузырьков на периферии стопок Гольджи не было затронуто (рис. 5С).
Из-за потери CV-активности клетки, обработанные Concan A, сначала набухли и, наконец, лопнули (не показано), что объясняет наблюдаемую токсичность Concan A. Клетки были жизнеспособны в присутствии Конкана А, когда в среду добавляли 100 мМ сахарозы (не показано). В этих условиях клетки оставались подвижными, хотя во многих клетках наблюдался плазмолиз (см. также ниже). ЭМ подтвердила световые микроскопические наблюдения. В клетках, обработанных Конканом А в течение 10 мин, не было обнаружено ни одного заполненного CV (рис. 5А), а структура стопок Гольджи была изменена (рис. 5). Количество цистерн увеличилось, транс -цистерны показали сильную вогнутую кривизну (рис. 5А). На многих срезах транс -цистерн выглядели как многослойные везикулярные структуры (рис. 5А, Б). Формирование переходных пузырьков на периферии стопок Гольджи не было затронуто (рис. 5С).
Когда клетки обрабатывали BFA и Concan A в течение 5 или 10 минут, LCV не образовывался (рис. 6A–D). Клетки потеряли свои жгутики, но общая структура клеток не пострадала (рис.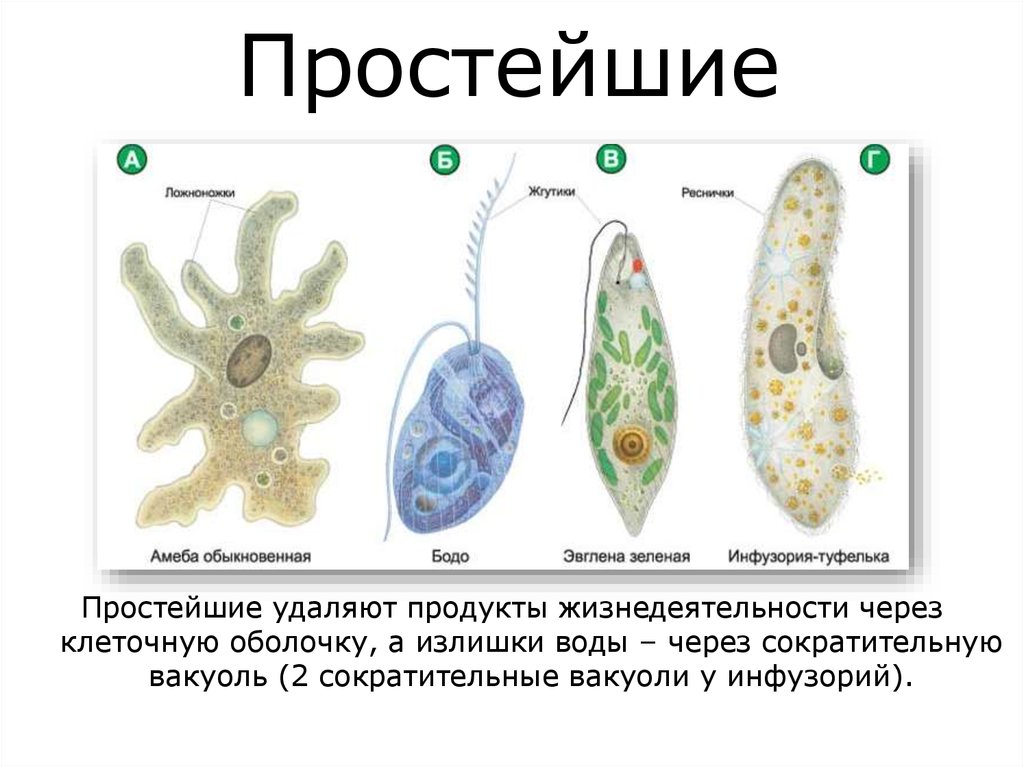 6Б, Г). Мы пришли к выводу, что активность V-АТФазы необходима для индуцированного BFA образования LCV, для функции CV и для поддержания структуры комплекса Гольджи в С. Дубия .
6Б, Г). Мы пришли к выводу, что активность V-АТФазы необходима для индуцированного BFA образования LCV, для функции CV и для поддержания структуры комплекса Гольджи в С. Дубия .
Необходимость активности V-АТФазы для функции CV и образования LCV побудила нас исследовать, являются ли CV и LCV кислыми органеллами. Контрольные клетки и клетки, обработанные BFA, инкубировали с нейтральным красным и наблюдали с помощью LM. Ни CV (фиг. 7A), ни LCV (фиг. 7 B) не были значительно окрашены нейтральным красным. Вместо этого многочисленные мелкие вакуоли в основном с перинуклеарным расположением накапливали нейтральный красный (рис. 7А, Б). Вакуоли, содержащие нейтральный красный, занимают в клетке то же положение, что и предполагаемые вакуоли, содержащие полифосфаты (сравните рис. 7А и С), описанные Мелконяном и Прейзигом (19).86).
Влияние осмолярности среды на образование LCV
Для исследования влияния внешней среды на образование LCV клетки S.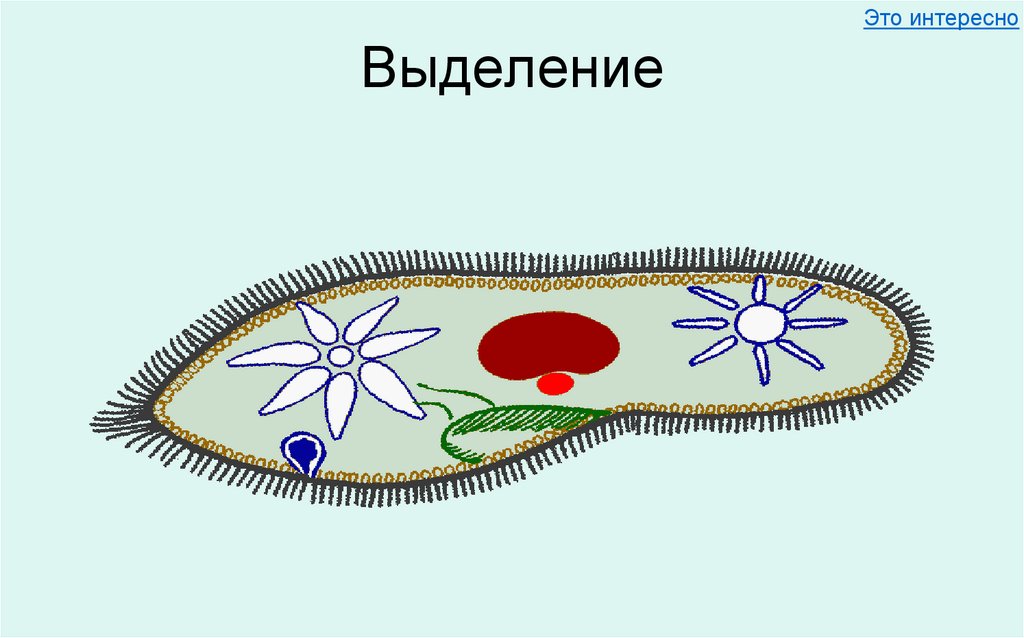 dubia предварительно инкубировали с сахарозой (60–160 мМ)- содержащую среду в течение 15 мин (фиг. 8А). Многие клетки (67 ± 8%, n = 12) демонстрировали плазмолиз при инкубации со 100 мМ сахарозы, что указывает на то, что осмолярность цитозоля обычно меньше 100 мкМ (рис. 8, стрелки). Поскольку это значение довольно низкое, мы напрямую определяли цитозольную осмолярность. Метод Стоунера и Данэма (1970), как описано Stock et al. (2001) (подробности см. в разделе «Материалы и методы»). Прямое измерение осмолярности цитозоля в осадке клеток дало среднее значение 93,1 ± 0,4 мОсмоль ( n = 3), что хорошо согласуется с данными плазмолиза.
dubia предварительно инкубировали с сахарозой (60–160 мМ)- содержащую среду в течение 15 мин (фиг. 8А). Многие клетки (67 ± 8%, n = 12) демонстрировали плазмолиз при инкубации со 100 мМ сахарозы, что указывает на то, что осмолярность цитозоля обычно меньше 100 мкМ (рис. 8, стрелки). Поскольку это значение довольно низкое, мы напрямую определяли цитозольную осмолярность. Метод Стоунера и Данэма (1970), как описано Stock et al. (2001) (подробности см. в разделе «Материалы и методы»). Прямое измерение осмолярности цитозоля в осадке клеток дало среднее значение 93,1 ± 0,4 мОсмоль ( n = 3), что хорошо согласуется с данными плазмолиза.
Затем к клеткам, инкубированным в течение 15 минут со 100 мМ сахарозой, добавляли BFA, и клетки инкубировали еще 30 минут с BFA перед фиксацией четырехокисью осмия. BFA-индуцированное образование LCV ингибировалось внешними концентрациями сахарозы (рис. 8B, C). Внешняя концентрация сахарозы 100 мМ ингибировала образование LCV до 90% (фиг. 8B), но многие клетки все еще отображали набухшие CV. При более высоких концентрациях сахарозы большинство клеток не демонстрировали набухших CV (фиг. 8C). Идентичные результаты были получены при использовании в качестве осмотика NaCl вместо сахарозы.
8B), но многие клетки все еще отображали набухшие CV. При более высоких концентрациях сахарозы большинство клеток не демонстрировали набухших CV (фиг. 8C). Идентичные результаты были получены при использовании в качестве осмотика NaCl вместо сахарозы.
Чтобы проверить, сохраняются ли LCV в гиперосмотических условиях, клетки S. dubia предварительно инкубировали с BFA в течение 30 мин, а затем инкубировали с BFA/сахарозой (100–200 мМ) еще в течение 30 мин перед фиксацией четырехокисью осмия. . После предварительной инкубации с BFA клетки показали типичные LCV (фиг. 8D). При добавлении сахарозы (120 мМ) LCV уменьшалась (сравните рис. 8D и E, видео 2 в дополнительном материале), а при более высоких концентрациях сахарозы клетки демонстрировали еще меньшие LCV, две вакуоли или вообще отсутствие вакуолей (рис. 8F). Таким образом, представленные результаты показывают, что вызванное BFA набухание CV может происходить в гиперосмотических условиях (рис. 8B) и что LCV сжимаются в условиях сильного гиперосмотизма (рис.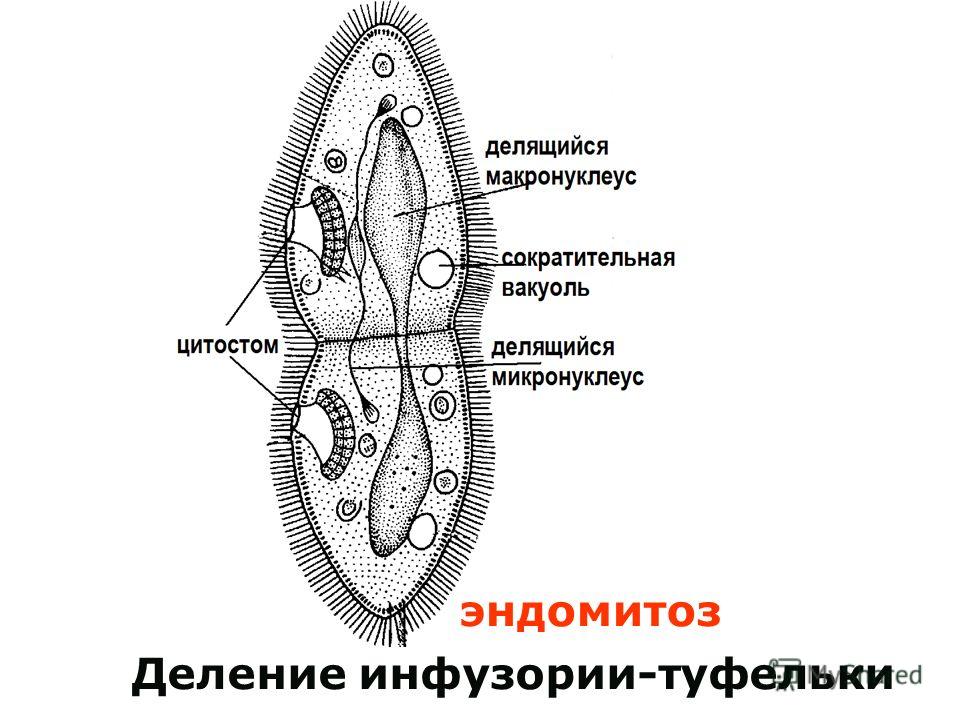 8D и E).
8D и E).
Влияние БФА на сократительные вакуоли других водорослей
Насколько нам известно, о влиянии БФА на ЦВ ранее не сообщалось. Поэтому мы исследовали, оказывает ли БФА (1 мкг мл –1) аналогичный эффект на другие празинофитные водоросли. У близкородственного рода Tetraselmis cordiformis , единственного известного пресноводного вида Tetraselmis , БФА также вызывала формирование LCV (рис. 9А, Б). У Pyramimonas tetrarhynchus клетки набухли (рис. 9).C, D) и, наконец, лопнул после добавления BFA, указывая на то, что BFA также влиял на функцию CV в Pyramimonas . Напротив, никакого влияния БФА на CV Chlamydomonas reinhardtii не наблюдалось, что согласуется с более ранними сообщениями (Robinson 1993).
На данный момент все испытанные пресноводные празинофиты принадлежат к линии хлорофитов в Viridiplantae. Поэтому мы также проверили действие БФА на Mesostigma viride , единственном известном чешуйчатом жгутиконосце в линии стрептофитов, которая включает харовые и наземные растения.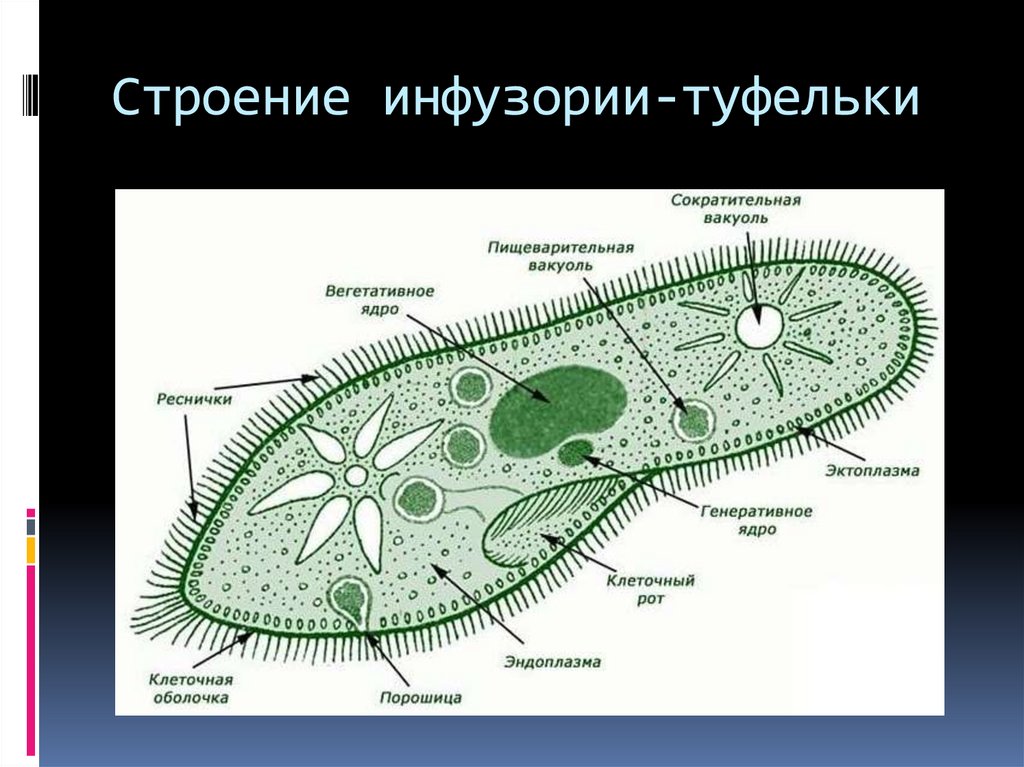 Клетки M. viride инкубировали с BFA в количестве 1 мкг мл –1 и наблюдали за живыми клетками с помощью LM. В течение нескольких минут клетки M. viride набухли и, наконец, лопнули при инкубации с BFA (фиг. 9E). Таким образом, оказалось, что у всех чешуйчатых зеленых пресноводных жгутиконосцев (празинофитов) функция CV чувствительна к БФА.
Клетки M. viride инкубировали с BFA в количестве 1 мкг мл –1 и наблюдали за живыми клетками с помощью LM. В течение нескольких минут клетки M. viride набухли и, наконец, лопнули при инкубации с BFA (фиг. 9E). Таким образом, оказалось, что у всех чешуйчатых зеленых пресноводных жгутиконосцев (празинофитов) функция CV чувствительна к БФА.
Обсуждение
В этом отчете мы анализируем функцию ЦВ у S. dubia с использованием исследований ЭМ и ингибиторов. Мы показываем, что обработка S. dubia с BFA индуцировал образование двух крупных вакуолей, которые выглядят как один LCV в световом микроскопе и характеризуют образование LCV в отношении температурной зависимости, потребности в активности V-АТФазы и влияния гипертонической среды.
Структура сократительной вакуоли
Данные ЭМ, представленные в этом исследовании, показывают, что у S. dubia большая круглая вакуоль, присутствующая в конце диастолы, развивается из SR. Имеются и другие аргументы в пользу участия СР в функции ЦВ. Во-первых, с помощью иммуноэлектронной микроскопии V-АТФаза была локализована только в SR и в меньшей степени в комплексе Гольджи (Grunow et al. 19).99). Примечательно, что круглая вакуоль CV, обнаруженная в фазе поздней диастолы, была лишена какой-либо маркировки (Grunow et al. 1999). Несколько линий доказательств указывают на то, что V-АТФаза необходима для функции CV в различных системах, включая S. dubia . Было обнаружено, что вакуолярная H + -АТФаза связана с CV у Dictyostelium и Paramecium (Fok et al. 1993, Fok et al. 1995, Heuser et al. 1993). CV Dictyostelium (Temesvari et al. 1996) и клетки S. dubia (это исследование) ингибировались ингибитором V-АТФазы Concan A, и клетки, обработанные Concan A, лопались в гипотонической среде (Temesvari et al. 1996, это исследование). Обработка клеток Paramecium конканамицином В, другим ингибитором V-АТФазы, также сильно ингибировала выход жидкости из сердечно-сосудистой системы (Fok et al.
Имеются и другие аргументы в пользу участия СР в функции ЦВ. Во-первых, с помощью иммуноэлектронной микроскопии V-АТФаза была локализована только в SR и в меньшей степени в комплексе Гольджи (Grunow et al. 19).99). Примечательно, что круглая вакуоль CV, обнаруженная в фазе поздней диастолы, была лишена какой-либо маркировки (Grunow et al. 1999). Несколько линий доказательств указывают на то, что V-АТФаза необходима для функции CV в различных системах, включая S. dubia . Было обнаружено, что вакуолярная H + -АТФаза связана с CV у Dictyostelium и Paramecium (Fok et al. 1993, Fok et al. 1995, Heuser et al. 1993). CV Dictyostelium (Temesvari et al. 1996) и клетки S. dubia (это исследование) ингибировались ингибитором V-АТФазы Concan A, и клетки, обработанные Concan A, лопались в гипотонической среде (Temesvari et al. 1996, это исследование). Обработка клеток Paramecium конканамицином В, другим ингибитором V-АТФазы, также сильно ингибировала выход жидкости из сердечно-сосудистой системы (Fok et al.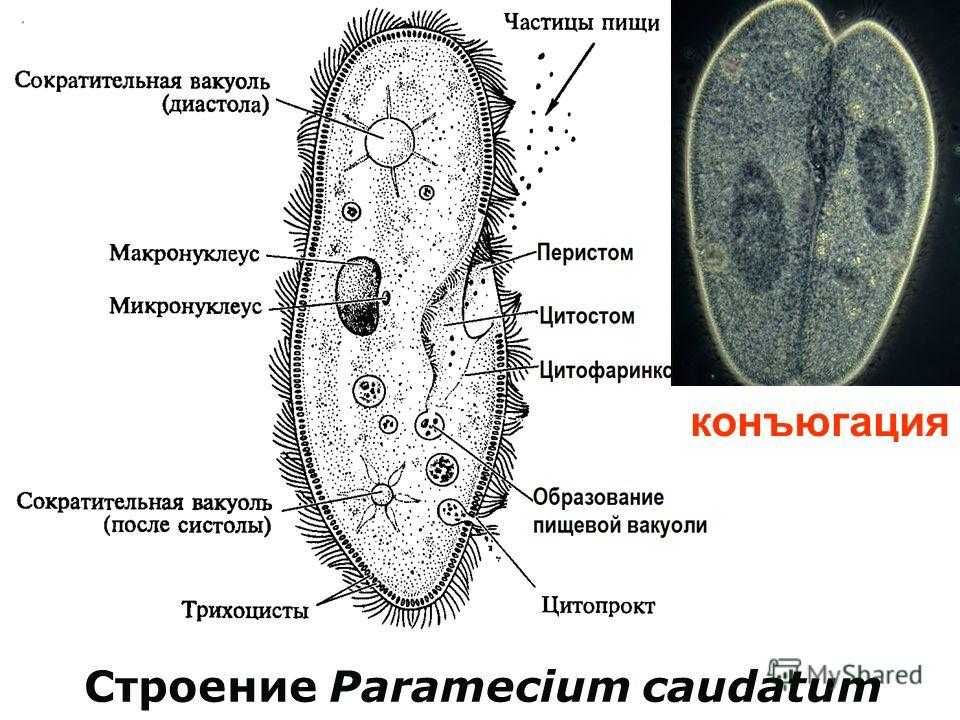 , 1995).
, 1995).
Во-вторых, у морских видов Tetraselmis не было обнаружено SR или подобной органеллы (Manton, Parke 1965, Domozych et al. 1981, Domozych 1987, Марин и др. 1996), которые тесно связаны с Scherffelia (Nakayama et al. 1998), и общая ультраструктура обоих родов очень похожа (Melkonian and Preisig 1986). Tetraselmis cordiformis является единственным известным пресноводным видом Tetraselmis , который также проявлял LCV при обработке клеток BFA. К сожалению, ультраструктура T. cordiformis изучена недостаточно, а опубликованные микрофотографии (Мелконян, 1982) не содержат информации о наличии или отсутствии СР или подобной структуры.
Механизм поглощения воды CV и LCV
Поскольку LCV происходят от CV, механизм поглощения воды обеими органеллами, вероятно, одинаков. Обычно рассматриваются две модели. Вода может поступать в CV и LCV путем осмоса, или водяные насосы, работающие под действием АТФ, могут перемещать воду через мембраны против осмотического градиента (обсуждается в Allen and Naitoh 2002).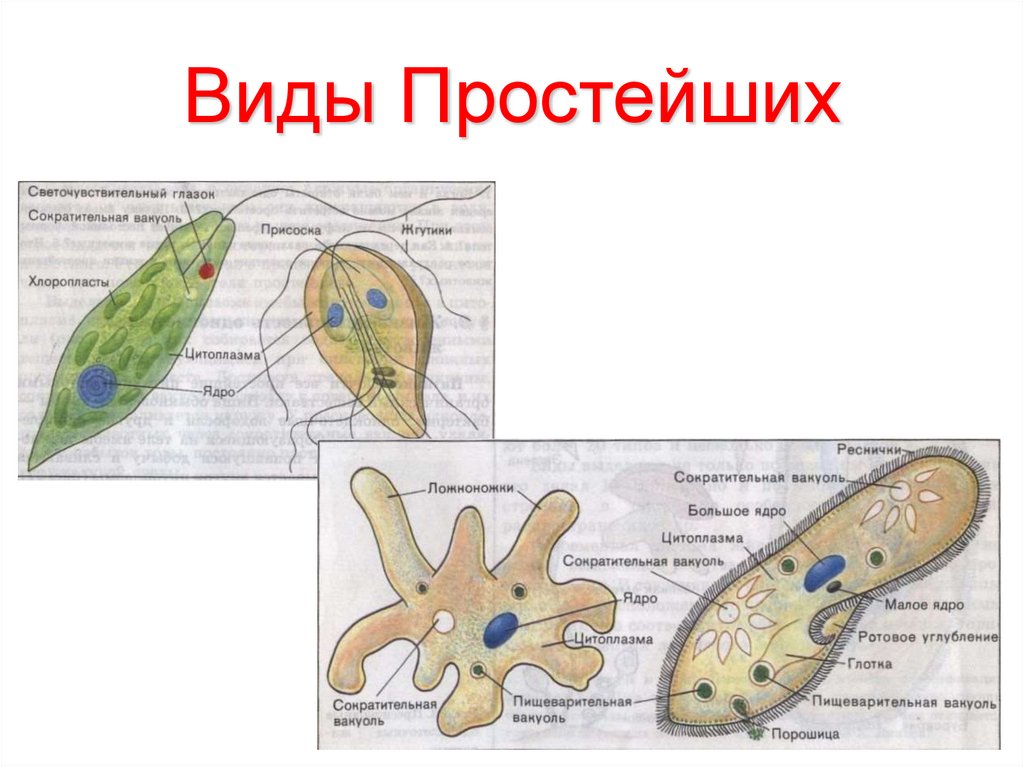 Было продемонстрировано существование водяных насосов (Zeuthen 1992). Однако участие водяных насосов с транспортом воды в ЦВ пока не доказано. Транспорт воды за счет осмоса требует более высокой осмолярности внутри CV, чем в цитозоле. К сожалению, состав жидкости CV неизвестен. Долгое время считалось, что CV вытесняет воду. Однако прямых данных о составе выделяемой жидкости мало (рассмотрено в Allen 2000, Allen and Naitoh 2002). Для резюме амебы Хаос-хаос , Riddick (1968) определил осмолярность 51 мОсмоль (цитозоль 117 мОсмоль), и аналогичные значения были найдены для Amoeba proteus (Schmidt-Nielsen and Schrauger 1963). Как уже указывалось Heuser et al. (1993), в этих условиях вода не должна скапливаться внутри CV, и поэтому потребуются водяные насосы. Недавние оценки осмолярности (на основе измерений активности Na + , K + Ca 2+ и Cl – ) CV и цитозоля Paramecium показал, что осмолярность CV была в 1,5 раза выше, чем осмолярность цитозоля в Paramecium , подтверждая гипотезу о том, что поглощение воды в CV управляется осмосом в Paramecium (Stock et al.
Было продемонстрировано существование водяных насосов (Zeuthen 1992). Однако участие водяных насосов с транспортом воды в ЦВ пока не доказано. Транспорт воды за счет осмоса требует более высокой осмолярности внутри CV, чем в цитозоле. К сожалению, состав жидкости CV неизвестен. Долгое время считалось, что CV вытесняет воду. Однако прямых данных о составе выделяемой жидкости мало (рассмотрено в Allen 2000, Allen and Naitoh 2002). Для резюме амебы Хаос-хаос , Riddick (1968) определил осмолярность 51 мОсмоль (цитозоль 117 мОсмоль), и аналогичные значения были найдены для Amoeba proteus (Schmidt-Nielsen and Schrauger 1963). Как уже указывалось Heuser et al. (1993), в этих условиях вода не должна скапливаться внутри CV, и поэтому потребуются водяные насосы. Недавние оценки осмолярности (на основе измерений активности Na + , K + Ca 2+ и Cl – ) CV и цитозоля Paramecium показал, что осмолярность CV была в 1,5 раза выше, чем осмолярность цитозоля в Paramecium , подтверждая гипотезу о том, что поглощение воды в CV управляется осмосом в Paramecium (Stock et al.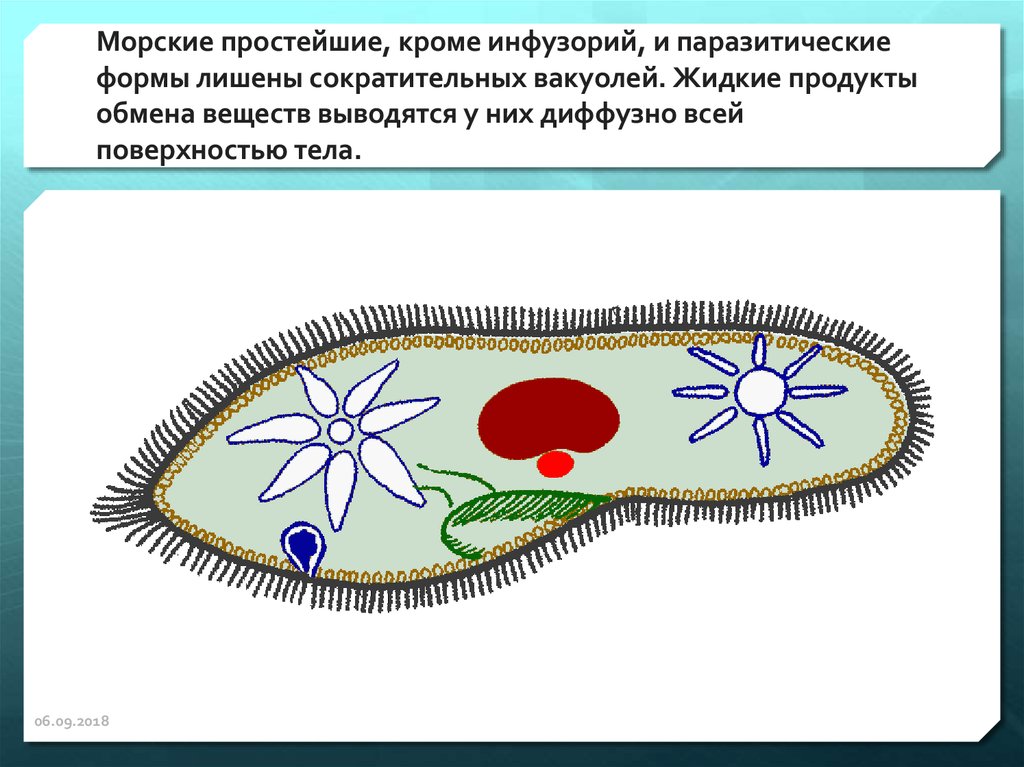 2002a, Stock et al. 2002a, Stock et al. и др. 2002b). В этом исследовании мы показали, что в сильных гиперосмотических условиях LCV сокращались, указывая на то, что вода в LCV следовала осмотическим градиентам, и подтверждая гипотезу о том, что поглощение воды в LCV и LCV также вызывалось осмосом в S. dubia , хотя этот эксперимент не может полностью исключить наличие водяных насосов.
2002a, Stock et al. 2002a, Stock et al. и др. 2002b). В этом исследовании мы показали, что в сильных гиперосмотических условиях LCV сокращались, указывая на то, что вода в LCV следовала осмотическим градиентам, и подтверждая гипотезу о том, что поглощение воды в LCV и LCV также вызывалось осмосом в S. dubia , хотя этот эксперимент не может полностью исключить наличие водяных насосов.
В совокупности полученные результаты подтверждают следующую модель функции CV у Scherffelia (рис. 10). В начале диастолы СР набухает из-за осмотического поглощения воды под действием V-АТФазы. В поздней диастоле оставшийся СР отключается от развивающейся круглой вакуоли, типичной для ЦВ в поздней диастоле, прежде чем ЦВ выбрасывает свое содержимое во время систолы в жгутиковую борозду. Независимо от того, включена ли вакуолярная мембрана в плазматическую мембрану и рециркулирована путем эндоцитоза, или она коллапсирует и отсоединяется от плазматической мембраны, нельзя решить на основании современных знаний.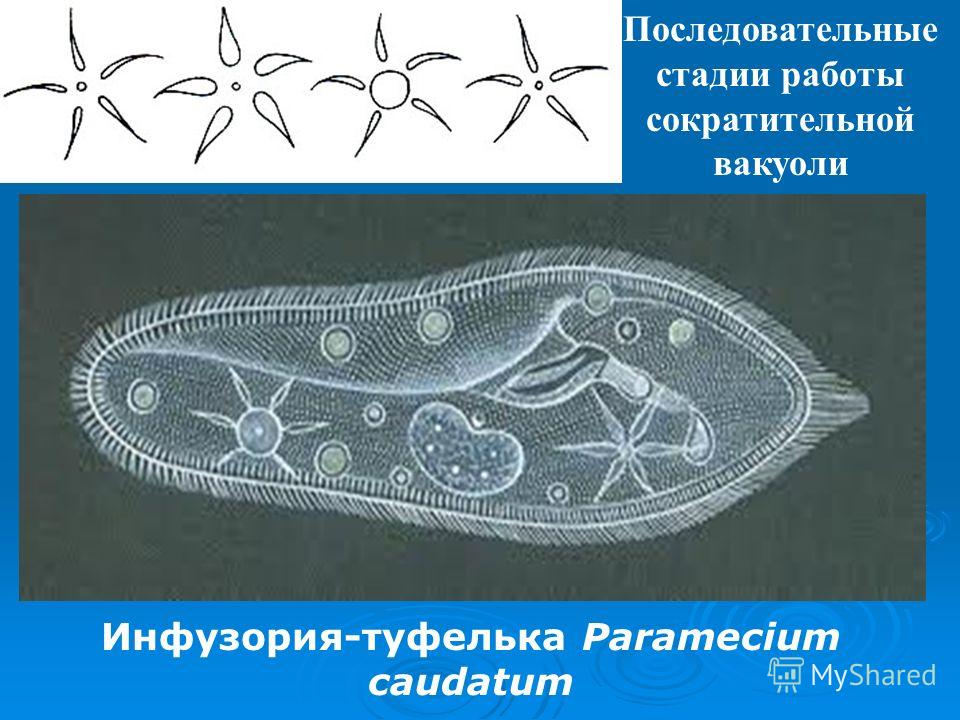 Однако до сих пор о коллапсе CV-мембраны не сообщалось в 9 случаях.0044 Scherffelia (Perasso et al. 2000, Melkonian and Preisig 1986, это исследование), поэтому последнее маловероятно.
Однако до сих пор о коллапсе CV-мембраны не сообщалось в 9 случаях.0044 Scherffelia (Perasso et al. 2000, Melkonian and Preisig 1986, это исследование), поэтому последнее маловероятно.
Структура CV S. dubia заметно отличается от единственного другого хорошо охарактеризованного CV зеленых водорослей: C. reinhardtii . У C. reinhardtii большая круглая вакуоль поздней диастолы развивается из множества более мелких вакуолей (Luykx et al. 1997b). Подобные вакуоли никогда не были обнаружены у S. dubia (Мелконян и Прейзиг, 1986; Перассо и др., 2000, это исследование). Другое важное различие между Chlamydomonas и Scherffelia заключается в том, что функция CV у Chlamydomonas не подавлялась BFA (Robinson 1993, это исследование). В этих различиях нет ничего удивительного, поскольку зеленые водоросли, скорее всего, эволюционировали в морской среде и несколько раз независимо вторгались в пресноводную среду обитания.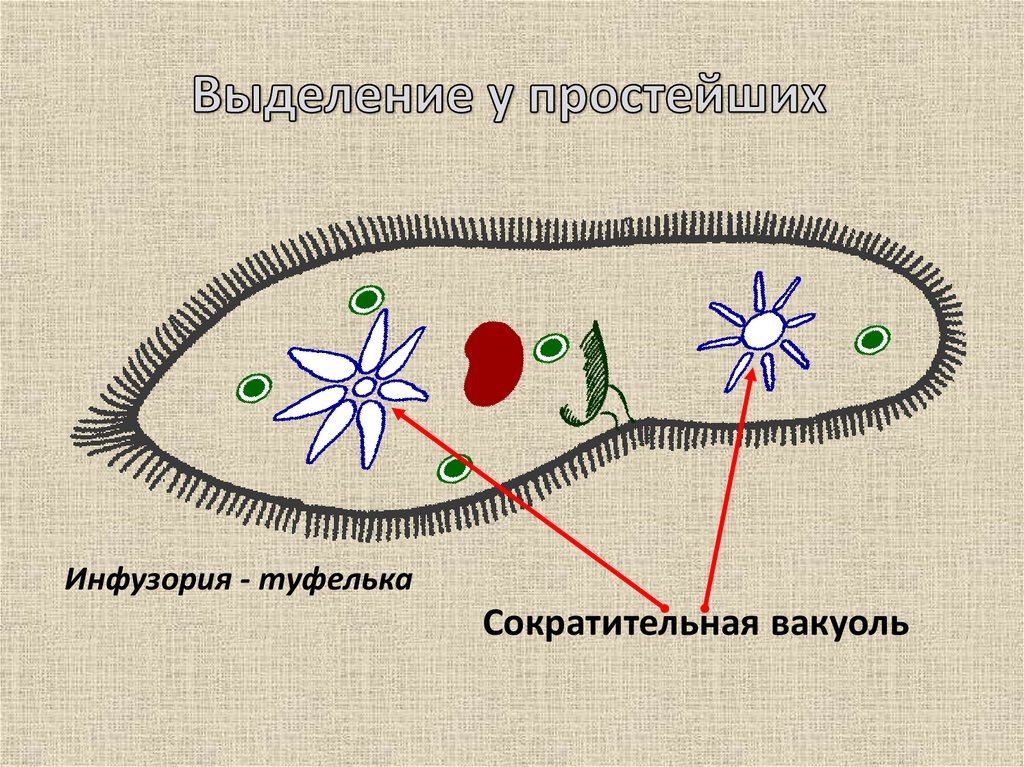
Молекулярная основа эффекта BFA
В настоящее время молекулярная основа вызываемого BFA образования LCV неизвестна. Хорошо известно, что в клетках млекопитающих BFA нацеливается на подмножество факторов обмена GTP типа sec7 (GEF), которые катализируют активацию малых GTPases, называемых ARFs (Jackson and Casanova 2000). ARF1 является наиболее изученным членом этого семейства белков. При связывании GTP ARF1 отвечает за образование везикул, покрытых COP1, в комплексе Гольджи, а также за образование везикул, покрытых клатрином/AP1, в транс — сеть Гольджи (TGN) (Scales et al. 2000, Spang 2002). Молекулярные мишени БФА были обнаружены в геноме Arabidopsis (Cox et al. 2004), и обычно предполагается, что первичный эффект БФА одинаков у растений и животных (недавний обзор см. Nebenführ et al. 2002). . Это исследование показало, что начальный эффект БФА на структуру комплекса Гольджи также сходен у S. dubia . Стеки Гольджи теряют периферические переходные пузырьки, и количество цистерн уменьшается, как и у наземных растений.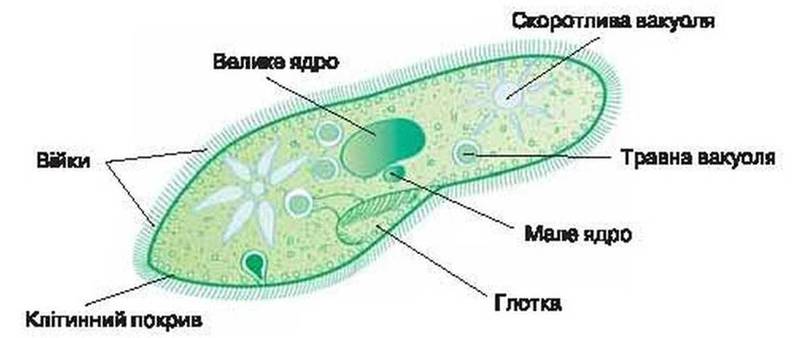 Созревание цистерн в течение первых минут, по-видимому, продолжалось, так как через 10 мин после добавления БФА все цистерны содержали чешуйки, тогда как в контрольных клетках первые две-три cis -большинство цистерн вообще были лишены чешуи. У S. dubia мы наблюдали второй эффект БФА. ЦВ набухали и не выбрасывали свое содержимое в среду. В этом исследовании мы представили доказательства того, что CV у Scherffelia развивается из SR. Поскольку нам не удалось проследить связь между СР и круглой вакуолью в фазе поздней диастолы, мы предполагаем, что во время ЦВ-цикла развивающаяся круглая вакуоль и СР разъединяются (рис. 10), что аналогично процессу поздней диастолы. шаги в отпочковывании пузырьков и которые могут регулироваться белком ARF. БФА может ингибировать этот процесс, что затем приводит к наблюдаемому набуханию вакуоли (рис. 10).
Созревание цистерн в течение первых минут, по-видимому, продолжалось, так как через 10 мин после добавления БФА все цистерны содержали чешуйки, тогда как в контрольных клетках первые две-три cis -большинство цистерн вообще были лишены чешуи. У S. dubia мы наблюдали второй эффект БФА. ЦВ набухали и не выбрасывали свое содержимое в среду. В этом исследовании мы представили доказательства того, что CV у Scherffelia развивается из SR. Поскольку нам не удалось проследить связь между СР и круглой вакуолью в фазе поздней диастолы, мы предполагаем, что во время ЦВ-цикла развивающаяся круглая вакуоль и СР разъединяются (рис. 10), что аналогично процессу поздней диастолы. шаги в отпочковывании пузырьков и которые могут регулироваться белком ARF. БФА может ингибировать этот процесс, что затем приводит к наблюдаемому набуханию вакуоли (рис. 10).
Помимо ингибирования ретроградного транспорта из Гольджи в эндоплазматический ретикулум, БЖК индуцирует у наземных растений образование производного Гольджи «конгломерата канальцев и пузырьков», называемого компартментом БЖК (Satiat-Jeunemaitre et al.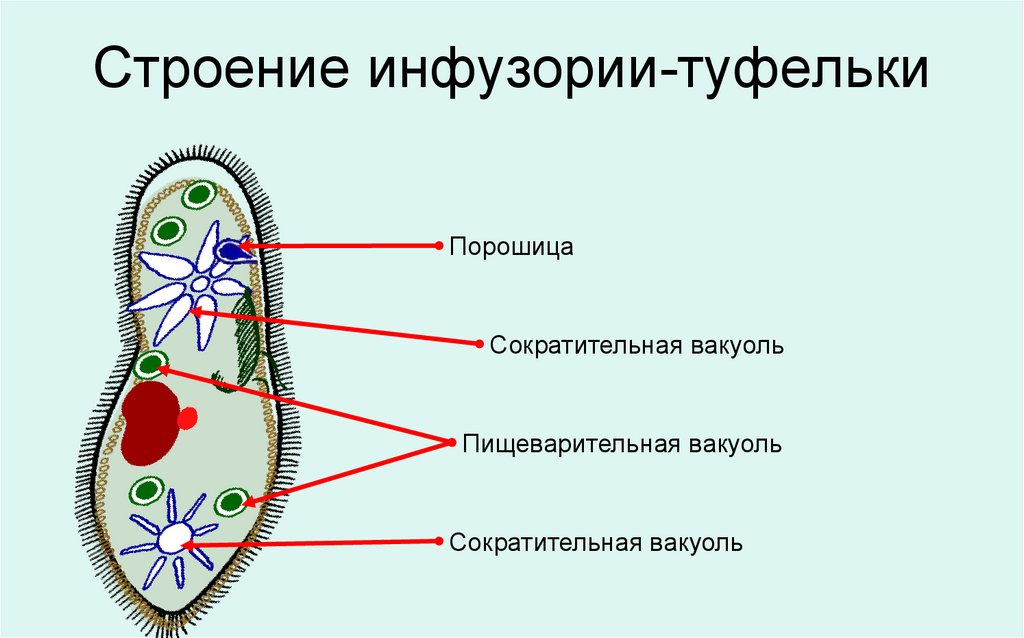 1996), который также включал эндоцитозные компартменты (rev. Nebenführ et al. 2002) и ингибировал эндоцитоз стирилового красителя в клетках BY-2 (Emans et al. 2002), что указывает на то, что и у наземных растений BFA действует на post-Golgi компартменты. В настоящее время неизвестно, имеет ли эффект BFA на эндоцитозный путь ту же молекулярную основу, что и эффект Гольджи. В этом контексте интересно, что мы недавно обнаружили в нашем проекте по секвенированию метки экспрессированной последовательности (EST) празинофита 9.0044 M. viride три различных кДНК белка ARF класса 1 в интерфазных клетках (A. Simon and B. Becker, неопубликованные). Функция CV у Mesostigma также ингибируется BFA (данное исследование). Поэтому представляется возможным, что может существовать специфический ARF, участвующий в регуляции функции CV у пресноводных празинофитовых водорослей.
1996), который также включал эндоцитозные компартменты (rev. Nebenführ et al. 2002) и ингибировал эндоцитоз стирилового красителя в клетках BY-2 (Emans et al. 2002), что указывает на то, что и у наземных растений BFA действует на post-Golgi компартменты. В настоящее время неизвестно, имеет ли эффект BFA на эндоцитозный путь ту же молекулярную основу, что и эффект Гольджи. В этом контексте интересно, что мы недавно обнаружили в нашем проекте по секвенированию метки экспрессированной последовательности (EST) празинофита 9.0044 M. viride три различных кДНК белка ARF класса 1 в интерфазных клетках (A. Simon and B. Becker, неопубликованные). Функция CV у Mesostigma также ингибируется BFA (данное исследование). Поэтому представляется возможным, что может существовать специфический ARF, участвующий в регуляции функции CV у пресноводных празинофитовых водорослей.
Должен ли быть отсоединен SR в качестве предпосылки для экзоцитоза во время цикла CV, или же BFA также непосредственно вмешивался в экзоцитоз CV, в настоящее время остается открытым вопросом.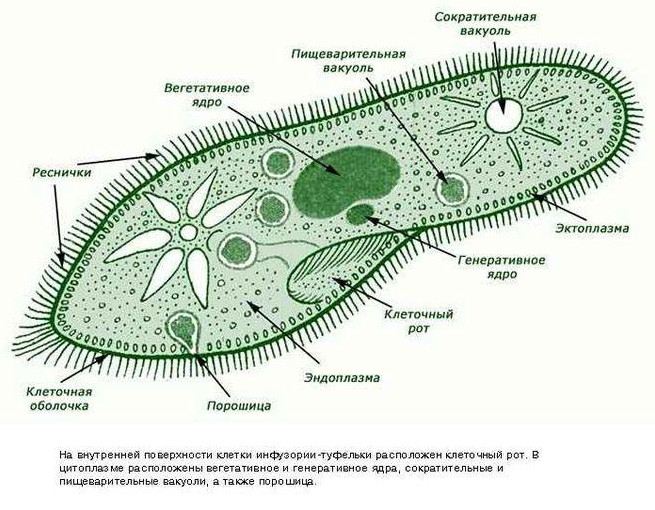 Другая возможность заключается в том, что COP1- и/или clathrin/AP1-опосредованный везикулярный транспорт необходим для правильного функционирования CV. В этом случае наблюдаемое влияние БФА на функцию сердечно-сосудистой системы будет косвенным. Однако последняя модель не может легко объяснить наблюдаемое потребление SR растущими LCV. Для решения этой проблемы потребуется дополнительная работа.
Другая возможность заключается в том, что COP1- и/или clathrin/AP1-опосредованный везикулярный транспорт необходим для правильного функционирования CV. В этом случае наблюдаемое влияние БФА на функцию сердечно-сосудистой системы будет косвенным. Однако последняя модель не может легко объяснить наблюдаемое потребление SR растущими LCV. Для решения этой проблемы потребуется дополнительная работа.
Несколько различных видов зеленых водорослей обрабатывались БЖК, но, насколько нам известно, о влиянии БЖК на CV ранее не сообщалось (например, Dairman et al., 1995, Salomon and Meindl, 1996, Haller and Fabry, 1998, Noguchi). и др., 1998 г., Домозич, 1999 г., Ногучи и Ватанабэ, 1999 г., Кэллоу и др., 2001 г.). Все исследованные виды либо являются морскими ( Enteromorpha ), либо не имеют CV ( Micrasterias , Closterium , Scenedesmus ), либо относятся к вольвокалевым водорослям (включая Chlamydomonas ), что объясняет, почему до сих пор не сообщалось о влиянии БФА на сердечно-сосудистую систему.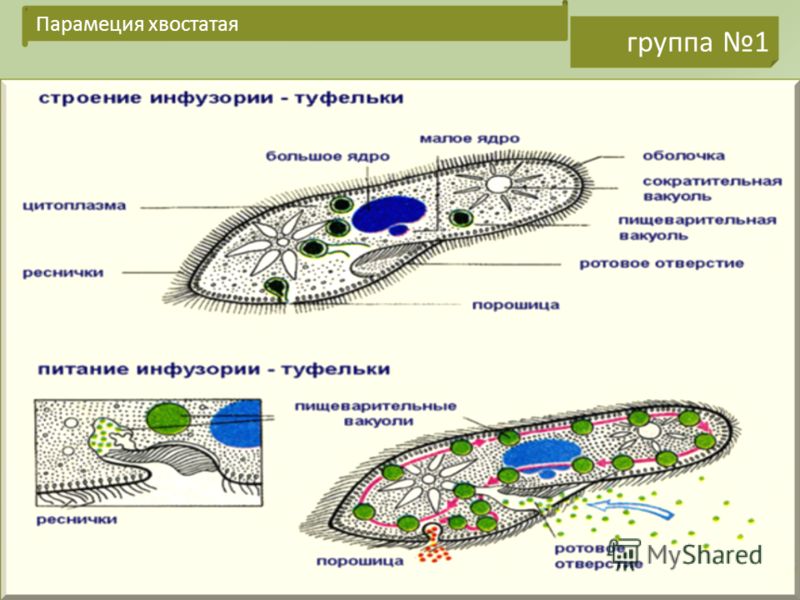 Поэтому был проведен краткий обзор влияния БФА на CV у зеленых жгутиконосцев. Все испытанные чешуйчатые зеленые жгутиконосцы показали влияние БФА на ЦВ. Однако только S. dubia и T. cordiformis развили LCV, тогда как у P. tetrarhynchus и M. viride образования LCV не наблюдалось. BFA влиял на функцию CV у обоих видов, клетки набухали и, наконец, лопались в гипотонической среде. Напротив, никакого влияния БФА на CV 9Наблюдалась 0044 Chlamydomonas (Robinson 1993, Haller and Fabry 1998, это исследование). Ингибирование функции CV с помощью BFA, по-видимому, является обычным явлением для празинофитов, которые представляют собой предков, от которых произошли все другие зеленые водоросли и наземные растения (Nakayama et al. 1998, Chapman and Waters 2002), но не у всех празинофитов развивается LCV. Кроме того, отсутствие какого-либо эффекта БФА у Chlamydomonas и других вольвокалевых водорослей (Dairman et al. 1995) указывает на то, что развитые хлорофитные водоросли могли утратить чувствительность CV к БФА.
Поэтому был проведен краткий обзор влияния БФА на CV у зеленых жгутиконосцев. Все испытанные чешуйчатые зеленые жгутиконосцы показали влияние БФА на ЦВ. Однако только S. dubia и T. cordiformis развили LCV, тогда как у P. tetrarhynchus и M. viride образования LCV не наблюдалось. BFA влиял на функцию CV у обоих видов, клетки набухали и, наконец, лопались в гипотонической среде. Напротив, никакого влияния БФА на CV 9Наблюдалась 0044 Chlamydomonas (Robinson 1993, Haller and Fabry 1998, это исследование). Ингибирование функции CV с помощью BFA, по-видимому, является обычным явлением для празинофитов, которые представляют собой предков, от которых произошли все другие зеленые водоросли и наземные растения (Nakayama et al. 1998, Chapman and Waters 2002), но не у всех празинофитов развивается LCV. Кроме того, отсутствие какого-либо эффекта БФА у Chlamydomonas и других вольвокалевых водорослей (Dairman et al. 1995) указывает на то, что развитые хлорофитные водоросли могли утратить чувствительность CV к БФА.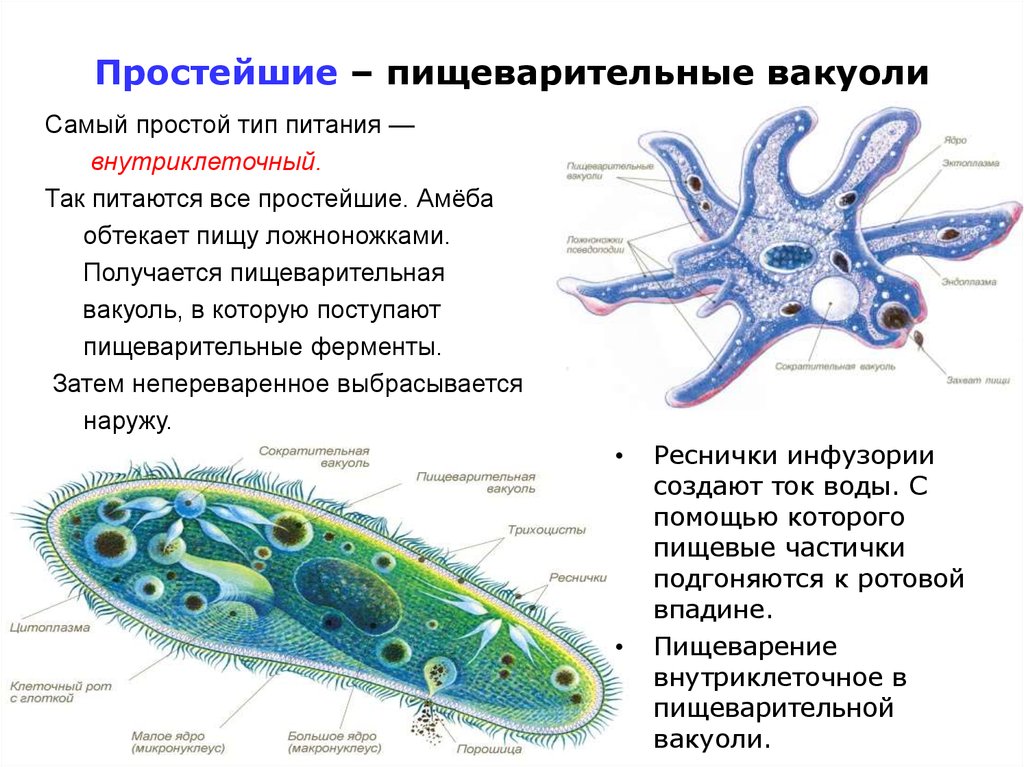
Подводя итог, можно сказать, что клетки S. dubia , обработанные BFA, не смогли завершить фазу ранней диастолы сердечно-сосудистого цикла. Клетки продолжают накапливать ионы в ЦВ, что приводит к дополнительному поглощению воды и набуханию ЦВ. Это в основном представляет собой удлиненную фазу диастолы. Нормальная фаза диастолы длится около 20 с, и поэтому ее трудно исследовать. Таким образом, мы заключаем, что индуцированное БФА образование LCV в S. dubia будет представлять собой уникальную модельную систему для исследования диастолической фазы сердечно-сосудистого цикла.
Материалы и методы
Штаммы и условия культивирования
Scherffelia dubia Pascher emend. Melkonian et Preisig (Melkonian and Preisig 1986) Штамм CCAC019 был получен из Коллекции культур водорослей Кельнского университета и культивирован, как описано ранее (Grunow et al. 1993). Mesostigma viride Lauterborn, Tetraselmis cordiformis (Carter) Stein и Pyramimonas tetrarhynchus Schmarda были любезно предоставлены доктором М. Мелконяном (Ботанический институт, Кельнский университет) и культивированы в 100-мл колбах Эрленмейера, содержащих 50 мл модифицированной Решение Вариса (Макфадден и Мелконян 1986b) при 15°C и цикле свет/темнота 14/10. Chlamydomonas reinhardtii штамм CC-3395 был любезно предоставлен доктором К.-Ф. Lechtreck (Ботанический институт, Кёльнский университет) и культивировали в среде ТАР при цикле свет/темнота 14/10 при 25°C.
Мелконяном (Ботанический институт, Кельнский университет) и культивированы в 100-мл колбах Эрленмейера, содержащих 50 мл модифицированной Решение Вариса (Макфадден и Мелконян 1986b) при 15°C и цикле свет/темнота 14/10. Chlamydomonas reinhardtii штамм CC-3395 был любезно предоставлен доктором К.-Ф. Lechtreck (Ботанический институт, Кёльнский университет) и культивировали в среде ТАР при цикле свет/темнота 14/10 при 25°C.
Обработка ингибитором
Исходный раствор (1 мг мл –1 ) BFA (ICN) готовили в метаноле. Клетки инкубировали с БФА в концентрации 1 мкг/мл 90 543–1 90 544 БФА, самая низкая концентрация ингибировала рост в С. Дубия . Concan A был подарком доктора Г. Тиля, Технический университет Дармштадта, Германия, и использовался в концентрации 1,5 мкМ (исходный раствор 15 мМ в МеОН). Обработку ингибитором проводили при 15°C, если не указано иное.
Световая микроскопия
Для прямых наблюдений ЛМ использовали 5 мкл клеточной суспензии на предметное стекло (покровное стекло 24×50 мм).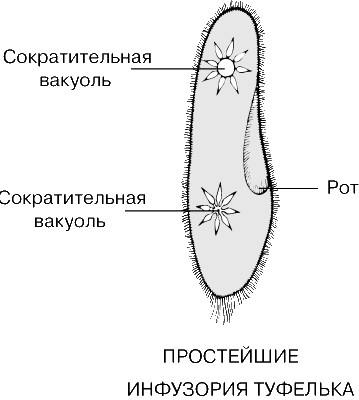 Такие препараты иммобилизуют большинство клеток и действуют не менее 15 минут без каких-либо существенных изменений сердечно-сосудистой активности. Наблюдения проводились либо на микроскопе Zeiss IM 35, оснащенном масляным иммерсионным объективом ×63 в режиме светлого поля или дифференциального интерференционного контраста, либо на микроскопе Nikon Eclipse 800 с масляным иммерсионным объективом ×60 или ×100 в режиме светлого поля или дифференциального интерференционного контраста. . Микроскоп Nikon оснащен камерой Spot CCD (Diagnostic Instruments, MI, США), и полученные микрофотографии анализировали с помощью программного обеспечения Metamorph (версия 4.5, Universal Imaging Corporation, PA, США).
Такие препараты иммобилизуют большинство клеток и действуют не менее 15 минут без каких-либо существенных изменений сердечно-сосудистой активности. Наблюдения проводились либо на микроскопе Zeiss IM 35, оснащенном масляным иммерсионным объективом ×63 в режиме светлого поля или дифференциального интерференционного контраста, либо на микроскопе Nikon Eclipse 800 с масляным иммерсионным объективом ×60 или ×100 в режиме светлого поля или дифференциального интерференционного контраста. . Микроскоп Nikon оснащен камерой Spot CCD (Diagnostic Instruments, MI, США), и полученные микрофотографии анализировали с помощью программного обеспечения Metamorph (версия 4.5, Universal Imaging Corporation, PA, США).
Электронная микроскопия
Образцы для ЭМ брали из интерфазных клеток и во время регенерации жгутиков до обработки БФА и в различные моменты времени после добавления БФА и фиксировали глутаровым альдегидом и четырехокисью осмия, как описано ранее (Perasso et al.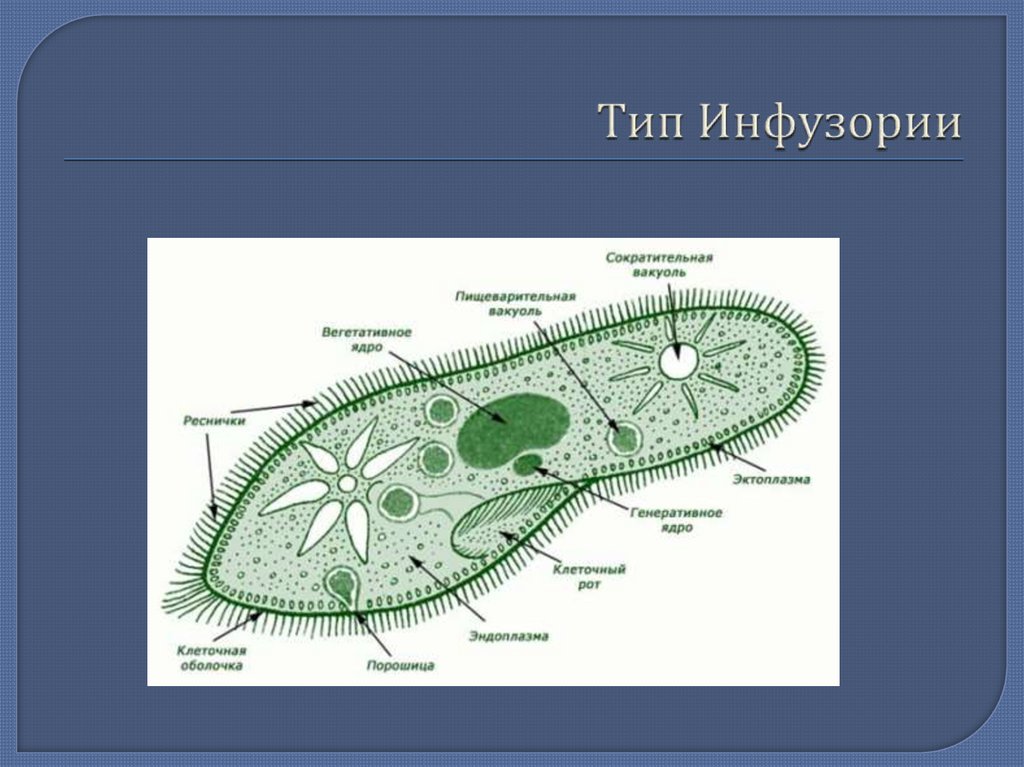 2000). Дальнейшая обработка образцов была стандартной (McFadden, Melkonian, 1986b). ЭМ-микрофотографии были получены с помощью электронного микроскопа Phillips CM10 (Эйндховен, Нидерланды).
2000). Дальнейшая обработка образцов была стандартной (McFadden, Melkonian, 1986b). ЭМ-микрофотографии были получены с помощью электронного микроскопа Phillips CM10 (Эйндховен, Нидерланды).
Количественный анализ количества пятиугольных чешуек на поверхности мембран CV/LCV
Количество пятиугольных чешуек и диаметр CV/LCV определяли на микрофотографиях. Был рассчитан периметр круглого профиля CV/LCV, а площадь мембраны CV/LCV на данном участке была оценена с использованием известной толщины сечения (70 нм). В тех случаях, когда встречался эллиптический профиль для CV/LCV, измерялись большой и малый радиусы, а периметр рассчитывался с использованием аппроксимационной формулы Рамнуджана для периметра эллипса.
Определение цитозольной осмолярности
Метод Stoner and Dunham (1970), описанный Stock et al. (2001). Клетки дважды промывали WEES-S (солевой раствор, содержащий только минеральные компоненты культуральной среды).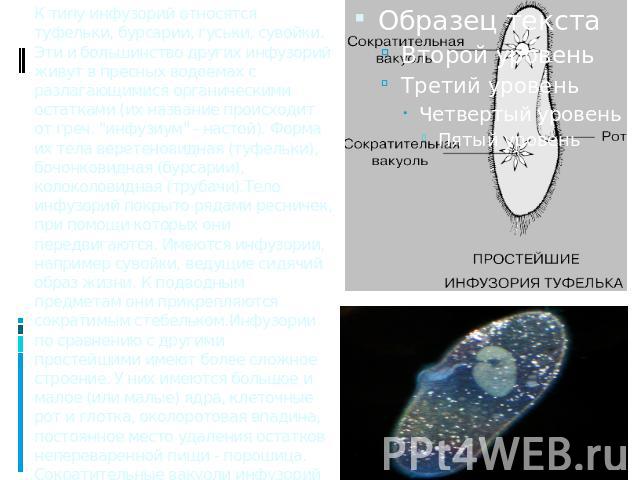 Клетки осаждали и определяли осмолярность осадка с помощью осмометра для определения точки замерзания (Osmomat 030, Gonotec, Berlin). Значение было скорректировано на объем, содержащий WEES-S во внеклеточном пространстве внутри осадка, который был определен, как описано Stock et al. (2001), за исключением того, что вместо конго красного использовался синий декстран (Amersham). Вкратце, клетки осаждали и измеряли объем осадка (15–50 мкл). Клетки ресуспендировали в 1 мл раствора голубого декстрана (0,5% в WEES-S) и снова осаждали. Супернатант осторожно удаляли, а клетки ресуспендировали в известном объеме WEES-S. Клетки осаждали и с помощью спектрофотометра определяли концентрацию синего декстрана в супернатанте. Объем внеклеточного пространства в осадке можно рассчитать по разведению декстранового синего (Stock et al. 2001).
Клетки осаждали и определяли осмолярность осадка с помощью осмометра для определения точки замерзания (Osmomat 030, Gonotec, Berlin). Значение было скорректировано на объем, содержащий WEES-S во внеклеточном пространстве внутри осадка, который был определен, как описано Stock et al. (2001), за исключением того, что вместо конго красного использовался синий декстран (Amersham). Вкратце, клетки осаждали и измеряли объем осадка (15–50 мкл). Клетки ресуспендировали в 1 мл раствора голубого декстрана (0,5% в WEES-S) и снова осаждали. Супернатант осторожно удаляли, а клетки ресуспендировали в известном объеме WEES-S. Клетки осаждали и с помощью спектрофотометра определяли концентрацию синего декстрана в супернатанте. Объем внеклеточного пространства в осадке можно рассчитать по разведению декстранового синего (Stock et al. 2001).
Дополнительные материалы
Дополнительные материалы, упомянутые в статье, доступны онлайн-подписчикам на сайте журнала www. pcp.oupjournals.org.
pcp.oupjournals.org.
Благодарности
Мы благодарим Lars Vierkotten и B. Wustman за помощь в электронной микроскопии и M. Melkonian за полезные обсуждения. Это исследование было поддержано Deutsche Forschungsgemeinschaft.
Открыть в новой вкладкеСкачать слайд
Рис. 1 Структура сократительной вакуоли в S. dubia по данным стандартной ПЭМ. (A) Продольный срез жгутиковой регенерирующей клетки S. dubia . (B) Большее увеличение области CV из другой клетки. (C) Более высокое увеличение желобка жгутика клетки, показанной на (A), показывает два растущих жгутика, покрытых чешуей. (D–I) Фаза ранней диастолы: ретикулум чешуи начал набухать. Микрофотографии в (D – G) и (H и I) представляют собой последовательные срезы одной и той же клетки соответственно. (K) Начало систолы: круглая вакуоль выбрасывает свое содержимое в желобок жгутика. Покрытые ямки отмечены стрелками, а пятиугольные чешуи отмечены наконечниками стрелок.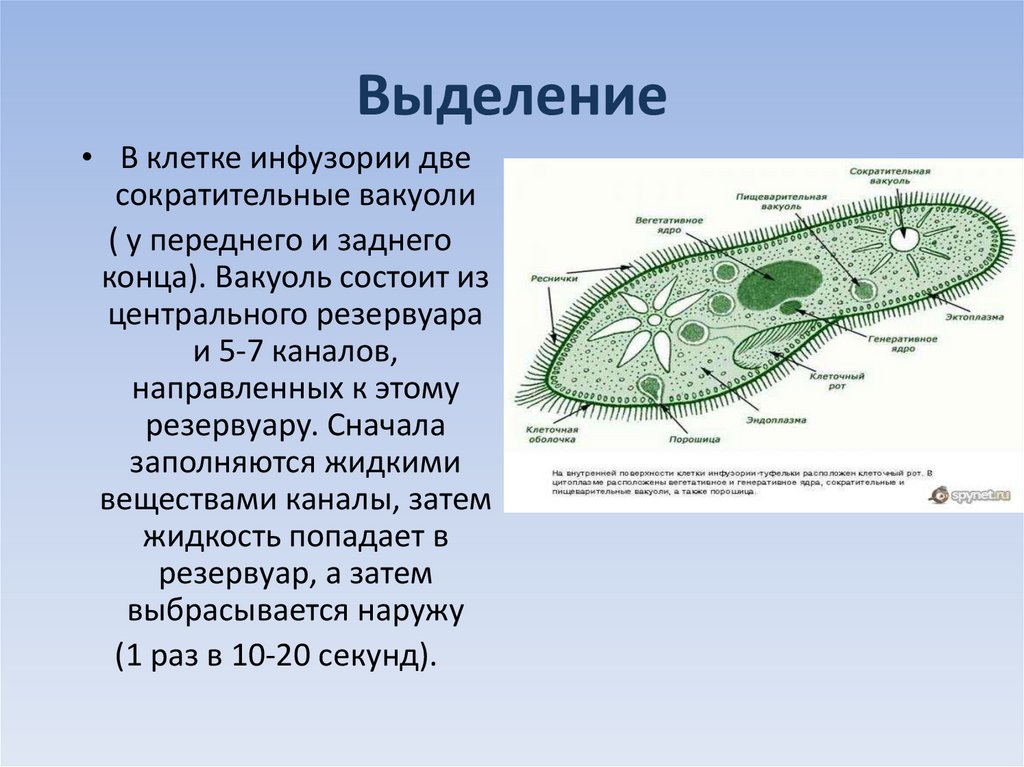 бб, базальное тело; в, хлоропласт; cv, сократительная вакуоль; cw, клеточная стенка; е, жгутик; г — стопка Гольджи; м, митохондрия; п, ядро; sr, чешуйчатый ретикулум. Бар = 0,5 мкм.
бб, базальное тело; в, хлоропласт; cv, сократительная вакуоль; cw, клеточная стенка; е, жгутик; г — стопка Гольджи; м, митохондрия; п, ядро; sr, чешуйчатый ретикулум. Бар = 0,5 мкм.
Открыть в новой вкладкеСкачать слайд
Рис. 2 BFA мешает работе CV. При добавлении BFA к клеткам S. dubia два CV набухают (B, 5 минут обработки BFA) и формируют большую центральную вакуоль (LCV) на более поздних стадиях (C, 10 минут обработки BFA). (A) Контрольные клетки, как видно в световой микроскоп. (D) Скорость образования LCV зависит от температуры среды.
Открыть в новой вкладкеСкачать слайд
Рис. 3 Электронно-микроскопический анализ BFA-индуцированного образования больших центральных вакуолей (LCV). Регенерацию жгутиков индуцировали путем экспериментальной ампутации, и клеткам давали возможность регенерировать жгутики в течение 20 минут перед добавлением BFA. Клетки обрабатывали в течение указанного времени BFA и обрабатывали для стандартной TEM.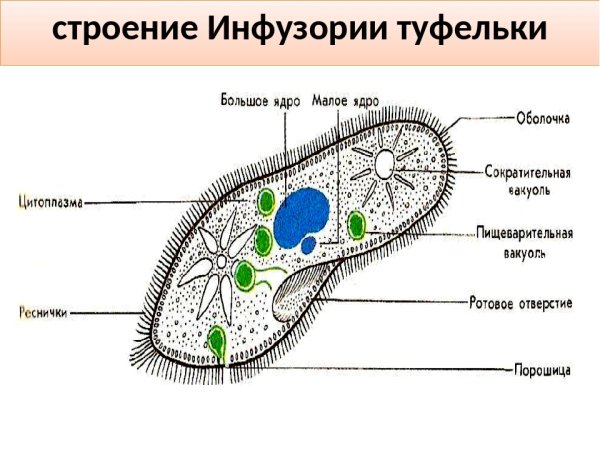 (A и B) После 5 минут обработки BFA. (A) Продольный разрез через клетку и (B) поперечное сечение клетки: CV был увеличен, имел неправильный вид и покрытые ямки (стрелки) связаны с увеличенным CV. (C) Через 10 минут обработки BFA: образуется круглая вакуоль. (D) После 15 минут обработки BFA. (E) Через 30 минут после обработки BFA. бб, базальное тело; в, хлоропласт; cv, сократительная вакуоль; г — стопка Гольджи; lcv, большая центральная вакуоль; п, ядро; v, предполагаемая полифосфатсодержащая вакуоль. Бар = 0,5 мкм.
(A и B) После 5 минут обработки BFA. (A) Продольный разрез через клетку и (B) поперечное сечение клетки: CV был увеличен, имел неправильный вид и покрытые ямки (стрелки) связаны с увеличенным CV. (C) Через 10 минут обработки BFA: образуется круглая вакуоль. (D) После 15 минут обработки BFA. (E) Через 30 минут после обработки BFA. бб, базальное тело; в, хлоропласт; cv, сократительная вакуоль; г — стопка Гольджи; lcv, большая центральная вакуоль; п, ядро; v, предполагаемая полифосфатсодержащая вакуоль. Бар = 0,5 мкм.
Открыть в новой вкладкеСкачать слайд
Рис. 4 BFA влияет на структуру комплекса Гольджи у S. dubia . Регенерацию жгутиков клеток S. dubia индуцировали путем экспериментальной ампутации, и клеткам давали регенерировать жгутики в течение 20 минут перед добавлением BFA. Клетки обрабатывали в течение указанного времени BFA и обрабатывали для стандартной TEM. (A) Клетки фиксировали через 20 мин после дефлагеллирования. Показан продольный разрез. Стек Гольджи заполнен шкалами (наконечниками стрел). По краю стопки видны многочисленные переходные пузырьки (маленькие стрелки). Все виды чешуек транспортируются в одних и тех же везикулах к жгутиковой поверхности (стрелка). (B) Клетки обрабатывали BFA в течение 5 минут перед их химической фиксацией и обработкой для ЭМ. Количество цистерн Гольджи уменьшено, видны только несколько переходных пузырьков. Стрелка указывает на везикулярный канальцевый элемент, который, по-видимому, покидает стопку. (C) После 10 минут обработки BFA. Количество цистерн еще больше уменьшилось, и все цистерны содержат чешуйки (наконечники стрел). Многочисленные везикулы диаметром 150 нм скапливаются на цис -грань стека (стрелки). бб, базальное тело; в, хлоропласт; г — стопка Гольджи; е, жгутик; lcv, большая центральная вакуоль; м, митохондрия; п, ядро; sr, чешуйчатый ретикулум. Бар = 1 мкм.
Стек Гольджи заполнен шкалами (наконечниками стрел). По краю стопки видны многочисленные переходные пузырьки (маленькие стрелки). Все виды чешуек транспортируются в одних и тех же везикулах к жгутиковой поверхности (стрелка). (B) Клетки обрабатывали BFA в течение 5 минут перед их химической фиксацией и обработкой для ЭМ. Количество цистерн Гольджи уменьшено, видны только несколько переходных пузырьков. Стрелка указывает на везикулярный канальцевый элемент, который, по-видимому, покидает стопку. (C) После 10 минут обработки BFA. Количество цистерн еще больше уменьшилось, и все цистерны содержат чешуйки (наконечники стрел). Многочисленные везикулы диаметром 150 нм скапливаются на цис -грань стека (стрелки). бб, базальное тело; в, хлоропласт; г — стопка Гольджи; е, жгутик; lcv, большая центральная вакуоль; м, митохондрия; п, ядро; sr, чешуйчатый ретикулум. Бар = 1 мкм.
Открыть в новой вкладкеСкачать слайд
Рис. 5 ТЭМ-анализ действия Конкана А на клетки S.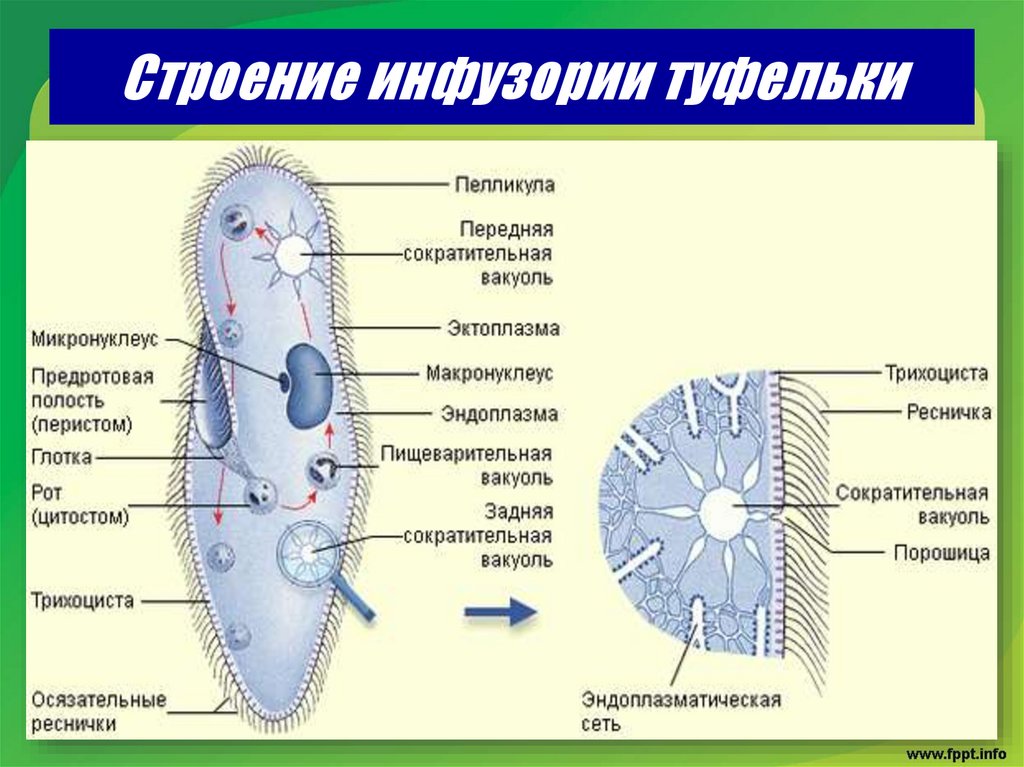 dubia . Клетки обрабатывали Concan A, химически фиксировали и обрабатывали для электронной микроскопии. (A и B) Продольные разрезы. (С) Поперечное сечение. Стрелки указывают на многочисленные переходные пузырьки, видимые на периферии стопки Гольджи. бб, базальное тело; в, хлоропласт; г — стопка Гольджи; е, жгутик; м, митохондрия; п, ядро; sr, чешуйчатый ретикулум. Бар = 1 мкм.
dubia . Клетки обрабатывали Concan A, химически фиксировали и обрабатывали для электронной микроскопии. (A и B) Продольные разрезы. (С) Поперечное сечение. Стрелки указывают на многочисленные переходные пузырьки, видимые на периферии стопки Гольджи. бб, базальное тело; в, хлоропласт; г — стопка Гольджи; е, жгутик; м, митохондрия; п, ядро; sr, чешуйчатый ретикулум. Бар = 1 мкм.
Открыть в новой вкладкеСкачать слайд
Рис. 6 Функция V-АТФазы необходима для образования LCV, индуцированного BFA. Клетки обрабатывали BFA или BFA и Concan A в течение 5 или 10 минут, фиксировали четырехокисью осмия и наблюдали с помощью светового микроскопа. (A) После 5 минут обработки BFA. (B) Через 5 минут после обработки BFA и Concan A. (C) После 10 минут обработки BFA. (D) После 10 минут обработки BFA и Concan A.
Открыть в новой вкладкеСкачать слайд
Рис. 7 CV и LCV не накапливают нейтральный красный. Окрашенные в нейтральный красный цвет живые клетки просматривали в светлопольном световом микроскопе.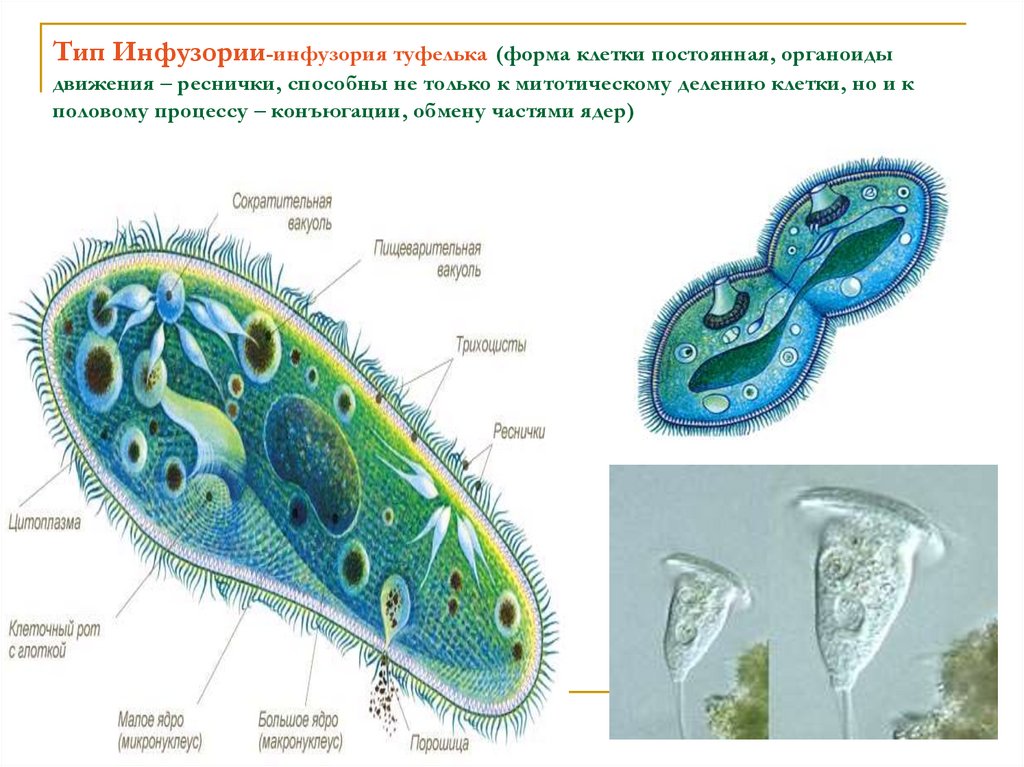 Ни CV (A), ни LCV (B) не являются достаточно кислыми для значительного накопления нейтрального красного. Многочисленные маленькие пузырьки могут быть окрашены нейтральным красным (А и В), которые, вероятно, идентичны предполагаемым полифосфатсодержащим вакуолям, окружающим ядро (сравните А и Е). (А) Контрольные клетки. (B) Клетки, обработанные BFA в течение 20 мин. (C) Электронная микрофотография контрольных клеток, обработанных для стандартной ПЭМ. Н, ядро; v, предполагаемая полифосфатсодержащая вакуоль. Бар = 0,5 мкм.
Ни CV (A), ни LCV (B) не являются достаточно кислыми для значительного накопления нейтрального красного. Многочисленные маленькие пузырьки могут быть окрашены нейтральным красным (А и В), которые, вероятно, идентичны предполагаемым полифосфатсодержащим вакуолям, окружающим ядро (сравните А и Е). (А) Контрольные клетки. (B) Клетки, обработанные BFA в течение 20 мин. (C) Электронная микрофотография контрольных клеток, обработанных для стандартной ПЭМ. Н, ядро; v, предполагаемая полифосфатсодержащая вакуоль. Бар = 0,5 мкм.
Открыть в новой вкладкеСкачать слайд
Рис. 8 BFA-индуцированное образование LCV может быть ингибировано (A–C) и обращено вспять (D–E) гипертонической средой. (A) Клетки обрабатывали сахарозой в течение 15 мин. Стрелки указывают клетки, демонстрирующие плазмолиз. (B и C) Клетки предварительно инкубировали с сахарозой (B, 100 мМ; C, 160 мМ) в течение 15 минут, а затем с сахарозой и BFA в течение 30 минут. (D) Клетки инкубировали с BFA в течение 30 мин.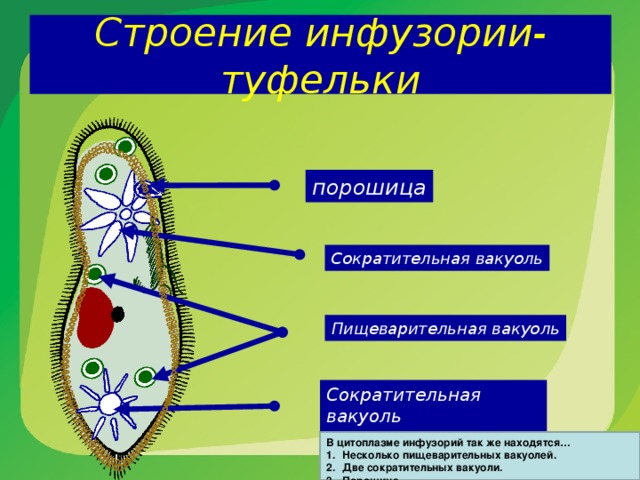 (E и F) Клетки предварительно инкубировали с BFA в течение 30 минут, а затем 30 минут инкубировали с BFA/сахарозой (E, 120 мМ сахарозы; F, 180 мМ сахарозы).
(E и F) Клетки предварительно инкубировали с BFA в течение 30 минут, а затем 30 минут инкубировали с BFA/сахарозой (E, 120 мМ сахарозы; F, 180 мМ сахарозы).
Открыть в новой вкладкеСкачать слайд
Рис. 9 БФА ингибирует CV у различных празинофитных водорослей. У T. cordiformis БФА также вызывал образование LCV (A и B). В P. tetrarhynchus клетки набухали и, наконец, лопались после добавления BFA, указывая на то, что BFA также мешал функции CV в P. tetrarhynchus (C и D). (E) BFA также влиял на функцию CV у M. viride . Отдельные кадры цейтраферного видео, показывающего отек двух 9Показаны клетки 0044 Mesostigma в присутствии BFA. Цифры относятся к времени, прошедшему с момента добавления BFA.
Открыть в новой вкладкеСкачать слайд
Рис. 10 Карикатура, показывающая изменения в структуре CV S. dubia во время цикла сокращения. Указаны этапы, наиболее вероятно ингибируемые BFA и Concan A.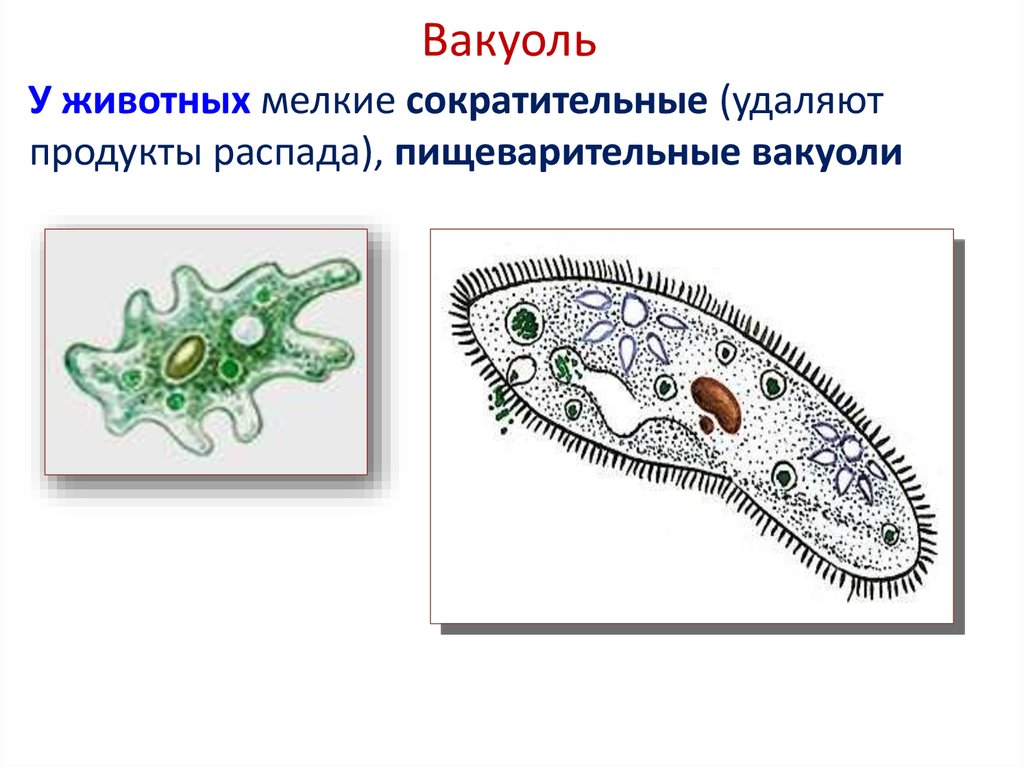 Нижняя панель показывает изменения, наблюдаемые в ультраструктуре ЦВ при обработке клеток БФА.
Нижняя панель показывает изменения, наблюдаемые в ультраструктуре ЦВ при обработке клеток БФА.
Таблица 1
Количество пятиугольных чешуек, наблюдаемых в сократительных вакуолях (интерфазные и жгутиковые регенерирующие клетки) и крупных центральных вакуолях (жгутиковые регенерирующие клетки, обработанные БФА).
| No. of CVs or LCVs analysed | No. of pentagonal scales observed | µm 2 membrane analysed | No. of scales per µm 2 CV or LCV membrane surface a | |
| Control cells | 14 | 2 | 3.18 | 0.6 ± 1.6 |
| Flagellar regenerating cells | 11 | 22 | 2.33 | 9.2 ± 6.5 |
| 5 min BFA b | 7 | 5,1 | 4,8 ± 3,0 | |
10 мин.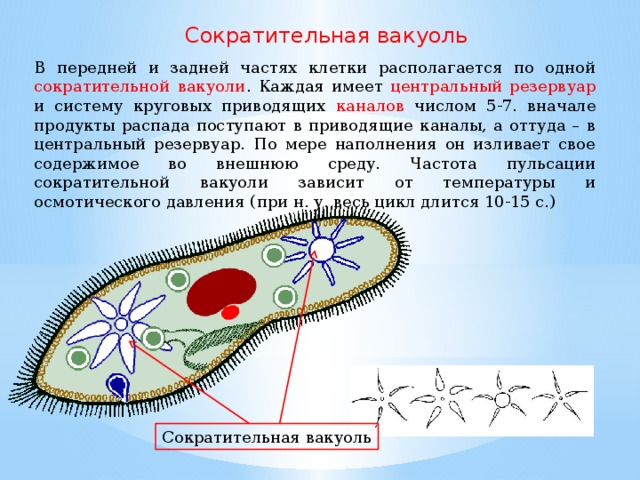 0285 0285 | 3.6 ± 2.4 | |||
| 15 min BFA b | 6 | 11 | 4.3 | 2.9 ± 2.0 |
| 20 min BFA b | 6 | 8 | 4.5 | 1.5 ± 2.3 |
| 30 min BFA b | 4 | 5 | 3.3 | 1.5 ± 1.1 |
| No. of CVs or LCVs analysed | No. of pentagonal scales observed | µm 2 membrane analysed | No. of scales per µm 2 CV or LCV membrane surface a | |
| Контрольные клетки | 14 | 2 | 3.18 | 0,6 ± 1,6 |
| Регенерирующие клетки | ||||
| .0261 9.2 ± 6.5 | ||||
| 5 min BFA b | 7 | 9 | 5.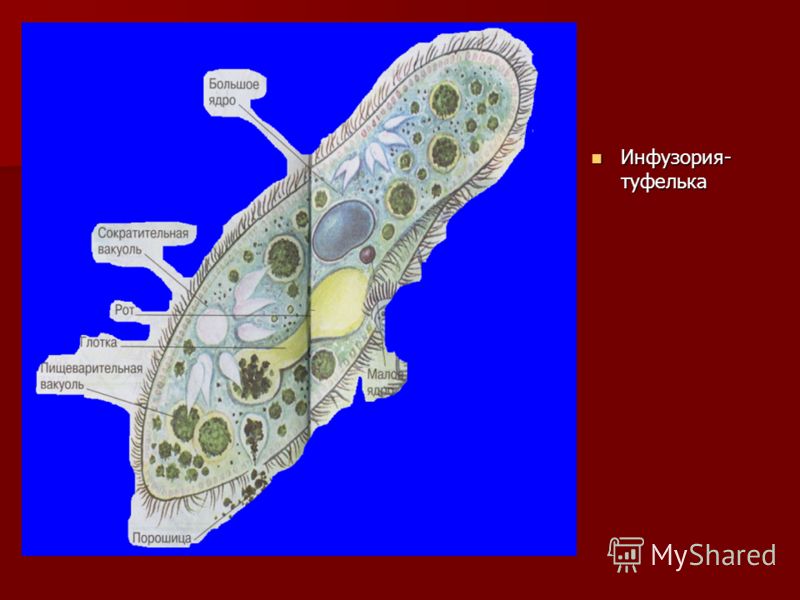 1 1 | 4.8 ± 3.0 |
| 10 min BFA b | 11 | 25 | 6,9 | 3,6 ± 2,4 |
| 15 мин.0045 | 6 | 8 | 4.5 | 1.5 ± 2.3 |
| 30 min BFA b | 4 | 5 | 3.3 | 1.5 ± 1.1 |
a Количество чешуек на мкм 2 поверхности мембраны рассчитывали для каждого CV. Приведены среднее число чешуек на мкм 2 поверхности мембраны и стандартное отклонение.
b БФА добавляли через 20 мин после экспериментального дефлагеллирования.
Открыть в новой вкладке
Таблица 1
Количество пятиугольных чешуек, наблюдаемых в сократительных вакуолях (интерфазные и жгутиковые регенерирующие клетки) и крупных центральных вакуолях (жгутиковые регенерирующие клетки, обработанные БФА).
| Количество проанализированных CV или LCV | Количество наблюдаемых пятиугольных чешуек | µm 2 membrane analysed | No. of scales per µm 2 CV or LCV membrane surface a | |
| Control cells | 14 | 2 | 3.18 | 0.6 ± 1.6 |
| Регенерирование жгутиков | 11 | 22 | 2,33 | 9,2 ± 6,5 |
| 5 MIN BFA 9944444444444415928 | ||||
| 5 мин. | 5.1 | 4.8 ± 3.0 | ||
| 10 min BFA b | 11 | 25 | 6.9 | 3.6 ± 2.4 |
| 15 min BFA b | 6 | 11 | 4.3 | 2.9 ± 2.0 |
| 20 min BFA b | 6 | 8 | 4. 5 5 | 1.5 ± 2.3 |
| 30 min BFA b | 4 | 5 | 3.3 | 1.5 ± 1.1 |
| No. of CVs or LCVs analysed | No. of pentagonal scales observed | µm 2 membrane analysed | No. of scales per µm 2 CV or LCV membrane surface a | ||||||||
| Control cells | 14 | 2 | 3.18 | 0.6 ± 1.6 | |||||||
| Flagellar regenerating cells | 11 | 22 | 2.33 | 9.2 ± 6.5 | |||||||
| 5 min BFA b | 7 | 9 | 5.1 | 4,8 ± 3,0 | |||||||
| 10 мин. BFA B | 11 | 25 | 6.9 | 3,61289918 | 91891818 6. 9 9 | 3,6 2 | .0044 b | 6 | 11 | 4.3 | 2.9 ± 2.0 |
| 20 min BFA b | 6 | 8 | 4.5 | 1.5 ± 2.3 | |||||||
| 30 min BFA b | 4 | 5 | 3.3 | 1.5 ± 1.1 |
a The number of scales per µm 2 of membrane surface was calculated for each CV. Среднее количество чешуек на мкм 2 поверхности мембраны и SD приведены.
b БФА добавляли через 20 мин после экспериментального дефлагеллирования.
Открыть в новой вкладке
Таблица 2
Влияние BFA на структуру комплекса Гольджи в S. Dubia
| Контрольные клетки | ||||||
| 11 | ||||||
| 11 | ||||||
| 11 | ||||||
| 1 | 0 | . | 24 | 17 | 15 | |
| No. of cisternae a | 14.3 ± 0.8 | 11.6 ± 1.1 | 8.3 ± 1.2 | |||
| No. of trans -cisternae containing Scales A | 11,3 ± 0,7 | 10,5 ± 1,1 | 8,0 ± 1,3 | |||
| № трансфер 44459595595595595955955955955955955955955955955955955955955955955955955955955959558 959595959595959595959595950400 40045959595959595959595959595959595459595459545959щена | .0285 | 0.7 ± 1.1 | 0 |
| Control cells | 5 min BFA | 10 min BFA | |
| No. of stacks analysed | 24 | 17 | 15 |
| Компания Cisternae A | 14,3 ± 0,8 | 11,6 ± 1,1 | 8,3 ± 1,2 | 8,3 ± 1,2 | 8,3 ± 1,2 | 8,3 ± 1,2 | 8,3 ± 1,2 | 11.3 ± 0.7 | 10.5 ± 1.1 | 8.0 ± 1.3 |
| No. of transition vesicles/stack a | 10.6 ± 3.3 | 0.7 ± 1.1 | 0 |
Клетки дефлагеллировали и им давали возможность регенерировать в течение 20 минут перед добавлением BFA. Клетки фиксировали и обрабатывали для ЭМ до и через 5 или 10 минут после добавления BFA.
и Анализировались только четкие поперечные сечения стопок Гольджи.
Открыть в новой вкладке
Таблица 2
Влияние BFA на структуру комплекса Гольджи в S. Dubia
| Контрольные клетки | ||||||
| 11 | ||||||
| 11 | ||||||
| 11 | ||||||
| 1 | 0 | . проанализировано стогов | 24 | 17 | 15 | |
| Количество цистерн a | 14. 3 ± 0.8 3 ± 0.8 | 11.6 ± 1.1 | 8.3 ± 1.2 | |||
| No. of trans -cisternae containing scales a | 11.3 ± 0.7 | 10.5 ± 1.1 | 8.0 ± 1.3 | |||
| No. of transition vesicles/stack a | 10.6 ± 3.3 | 0.7 ± 1.1 | 0 |
| Control cells | 5 min BFA | 10 min BFA | ||||||||||
| No. of stacks analysed | 24 | 17 | 15 | |||||||||
| No. of cisternae a | 14.3 ± 0.8 | 11.6 ± 1.1 | 8.3 ± 1.2 | |||||||||
| No. of trans -cisternae containing scales a | 11.3 ± 0.7 | 10.5 ± 1.1 | 8,0 ± 1,3 | |||||||||
| Компания переходных пузырьков/стек A | 10,6 ± 3,3 | 0,7 ± 1. 1 1 | 0 | 0,7 ± 1.1 | 0 | 0,7 ± 1.1 | 0 | 0,7 ± 1.1 | 0 | 0,7 ± 1,1 | 855555555555555555978 | 7. до того, как был добавлен BFA. Клетки фиксировали и обрабатывали для ЭМ до и через 5 или 10 минут после добавления BFA. a Анализировались только четкие поперечные сечения стопок Гольджи. Открыть в новой вкладке Сокращения1 Автор, ответственный за переписку: E-mail, [email protected]; Факс +49 221-4705181. СсылкиAllen, RD ( 2000 ) Сократительная вакуоль и ее мембранная динамика. Биоэссе 22 : 1035 –1042. Аллен Р. Д. и Найтох Ю. ( 2002 ) Осморегуляция и сократительные вакуоли простейших. Междунар. Преподобный Цитол. 215 : 351 –394. Беккер Б., Беккер Д., Камерлинг Дж. П. и Мелконян М. ( 1991 ) 2-кетосахарные кислоты в зеленых жгутиконосцах: химический маркер чешуи празинофитовых. J. Phycol. 27 : 498 –504. Becker, B., Bölinger, B. and Melkonian, M. ( 1995 ) Антероградный транспорт чешуек водорослей через комплекс Гольджи не опосредован везикулами. Trends Cell Biol. 5 : 305 –307. Беккер Б., Марин Б. и Мелконян М. ( 1994 ) Структура, состав и биогенез клеточных покрытий празинофитов. Протоплазма 181 : 233 –244. Беккер Д., Беккер Б., Сатир П. и Мелконян М. ( 1990 ) Выделение, очистка и характеристика жгутиковых чешуек зеленых жгутиконосцев Tetraselmis striata (Prasinophyceae). Протоплазма 156 : 103 –112. Буш, Дж., Нолта, К., Родригес-Пэрис, Дж., Кауфманн, Н., О’Халлоран, Т., Рускетти, Т., Темесвари, Л., Стек, Т. и Карделли, Дж. ( 1994 ) Rab4-подобная ГТФаза в Dictyostelium discoideum совместно локализуется с V-H + -АТФазами в ретикулярных мембранах сократительного комплекса вакуолей и в лизосомах. J. Cell Sci. 107 : 2801 –2812. Кэллоу, М.Э., Кроуфорд, С., Уэзерби, Р., Тейлор, К., Финли, Дж.А. и Кэллоу, Дж.А. ( 2001 ) Брефельдин А влияет на адгезию зооспор зеленой водоросли Enteromorpha . J. Расшир. Бот. 52 : 1409 –15. Чепмен Р.Л. и Уотерс Д.А. ( 2002 ) Зеленые водоросли и наземные растения – наконец-то ответ? J. Phycol. 38 : 237 –240. Кокс, Р., Мейсон-Геймер, Р.Дж., Джексон, К.Л. и Сегев, Н. ( 2004 ) Филогенетический анализ нуклеотидных обменников Arf, содержащих домен Sec7. Мол. биол. Сотовый 15 : 1487 –505. Дайрман М., Донофрио Н. и Домозич Д. С. ( 1995 ) Влияние брефельдина А на аппарат Гольджи жгутиконосцев зеленых водорослей, Gloeomonas kupfferi . J. Расшир. Бот. 46 : 181 –186. Деннинг, Г.М. и Фултон, А.Б. ( 1989 ) Электронная микроскопия мутанта сократительной вакуоли Chlamydomonas moewusii (Chlorophyta), дефектного на поздних стадиях диастолы. J. Phycol. 25 : 667 –672. Домозич Д.С. ( 1987 ) Экспериментальный анализ диктиосом зеленой водоросли Tetraselmis convolutae . J. Расшир. Бот. 38 : 1399 –1411. Домозыч Д.С. ( 1999 ) Нарушение аппарата Гольджи и секреторного механизма у десмид, Closterium acerosum , автор Брефельдин А. J. Exp. 50 : 1323 –1330. Домозич Д. С. и Ниммонс Т. Т. ( 1992 ) Сократительная вакуоль как эндоцитарная органелла жгутиконосцев хламидомонад Gloeomonas kupfferi (Volvocales, Chlorophyta). J. Phycol. 28 : 809 –816. Домозич Д.С., Стюарт К.Д. и Маттокс, К.Р. ( 1981 ) Развитие клеточной стенки у Tetraselmis : роль аппарата Гольджи и сборки внеклеточной стенки. J. Cell Sci. 52 : 351 –371. Эманс, Н., Циммерманн, С. и Фишер, Р. ( 2002 ) Поглощение флуоресцентного маркера растительными клетками чувствительно к брефельдину А и вортманнину. Растительная клетка 14 : 71 –86. Фок А.К., Айхара М.С., Исида М., Нолта К.В., Стек Т.Л. и Аллен, Р. Д. ( 1995 ) Колышки на декорированных канальцах комплекса сократительных вакуолей Paramecium — это протонные насосы. J. Cell Sci. 108 : 3163 –3170. Фок А.К., Кларк М., Ма Л. и Аллен Р. ( 1993 ) Вакуолярная H(+)-АТФаза Dictyostelium discoideum . Исследование моноклональных антител. J. Cell Sci. 106 : 1103 –1112. Грубер, Х.Е. и Росарио, Б. ( 1979 ) Ультраструктура аппарата Гольджи и сократительной вакуоли в Хламидомонада Рейнхарди . Цитология 44 : 505 –526. Грунов А., Беккер Б. и Мелконян М. ( 1993 ) Выделение и характеристика аппарата Гольджи жгутиковой чешуйчатой зеленой водоросли. Евро. Дж. Клеточная биология. 61 : 10 –20. Грунов А., Русинг М., Беккер Б. и Мелконян М. ( 1999 ) V-АТФаза является основным компонентом комплекса Гольджи в чешуйчатых зеленых жгутиконосцах Шерффелия дубиа . Протист 150 : 265 –81. Haller, K. and Fabry, S. ( 1998 ) Брефельдин А влияет на синтез и целостность эукариотического жгутика. Биохим. 242 : 597 –601. Harris, E., Yoshida, K., Cardelli, J. and Bush, J. ( 2001 ) Rab11-подобная ГТФаза связывается с сократительной вакуольной системой и регулирует ее структуру и функцию в Диктиостелиум . J. Cell Sci. 114 : 3035 –2658. Хаусманн, К. и Паттерсон, Д.Дж. ( 1984 ) Комплексы сократительных вакуолей у водорослей. In Компартменты в клетках водорослей и их взаимодействие. Под редакцией Визнера, В., Робинсона, Д.Г. и Старр, Р.К. стр. 140 –145. Springer-Verlag, Берлин. Хойзер, Дж., Чжу, К. и Кларк, М. ( 1993 ) Протонные насосы заселяют сократительные вакуоли Dictyostelium амеб. J. Cell Biol. 121 : 1311 –1327. Джексон, К.Л. и Казанова, Дж. Э. ( 2000 ) Включение ARF: семейство факторов обмена гуанин-нуклеотидов Sec7. Trends Cell Biol. 10 : 60 –67. Люйкс, П., Хоппенрат, М. и Робинсон, Д.Г. ( 1997 ) Осморегуляторные мутанты , влияющие на функцию сократительной вакуоли у Chlamydomonas reinhardtii . Протоплазма 200 : 99 –111. Люйкс, П., Хоппенрат, М. и Робинсон, Д.Г. ( 1997 ) Структура и поведение сократительных вакуолей у Chlamydomonas reinhardtii . Протоплазма 198 : 73 –84. Manton, I. и Parke, M. ( 1965 ) Наблюдения за тонкой структурой двух видов Platymonas с особым упором на жгутиковые чешуи и способ происхождения теки. J. Mar. Biol. доц. Великобритания 45 : 743 –754. Марин Б., Хоф-Эмден К. и Мелконян М. ( 1996 ) Наблюдения с помощью светового и электронного микроскопа на Tetraselmis desikacharyi сп.нов. (Chlorodendrales, Chlorophyta). Новая Хедвигия 112 : 461 –475. Макфадден, Г.И. и Мелконян, М. ( 1986 ) Активность аппарата Гольджи и мембранный поток во время биогенеза чешуи у зеленых жгутиковых Scherffelia dubia (Prasinophyceae).1. Жгутиковая регенерация. Протоплазма 130 : 186 –198. Макфадден, Г.И. и Мелконян М. ( 1986 ) Использование буфера HEPES для культуральных сред микроводорослей и фиксации для электронной микроскопии. Психология 25 : 551 –557. Макфадден Г. И., Прейзиг Х. Р. и Мелконян М. ( 1986 ) Активность аппарата Гольджи и мембранный поток во время биогенеза чешуи у зеленых жгутиконосцев Scherffelia dubia (Prasinophyceae). 2 . Ячейка стенка секреции и сборка. Протоплазма 131 : 174 –184. Мелконян М. ( 1982 ) Влияние двухвалентных катионов на жгутиковые чешуи зеленых жгутиковых Tetraselmis cordiformis . Протоплазма 111 : 221 –233. Мелконян М., Беккер Б. и Беккер Д. ( 1991 ) Образование накипи в водорослях. Дж. Электрон Микроск. Тех. 17 : 165 –178. Мелконян М. и Прейзиг Х. Р. ( 1986 ) Световое и электронно-микроскопическое исследование Scherffelia dubia , нового представителя чешуйчатых зеленых жгутиконосцев (Prasinophyceae). Норд. Дж. Бот. 6 : 235 –256. Накаяма Т., Марин Б., Кранц Х.Д., Сурек Б., Хусс В.А.Р., Иноуэ И. и Мелконян М. ( 1998 ) Базальное положение чешуйчатых зеленых жгутиконосцев среди зеленых водорослей (Chlorophyta) выявляется анализом кодируемых в ядре последовательностей SSU рРНК. Протист 149 : 367 –380. Небенфюр, А. ( 2003 ) Транспорт внутри Гольджи: эскалатор или ковшовая бригада? год. Заводская версия 9 : 76 –89. Небенфюр, А., Ритценталер, К. и Робинсон, Д.Г. ( 2002 ) Брефельдин А: расшифровка загадочного ингибитора секреции. Завод физиол. 130 : 1102 –1108. Noguchi, T. and Watanabe, H. ( 1999 ) Эффекты брефельдина А на транс -сеть Гольджи и тельца Гольджи в Botryococcus braunii неравномерны в течение клеточного цикла. Протоплазма 209 : 193 –206. Noguchi, T., Watanabe, H. and Suzuki, R. ( 1998 ) Влияние брефельдина А на аппарат Гольджи, ядерную оболочку и эндоплазматический ретикулум зеленой водоросли, Scenedesmus acutus . Протоплазма 201 : 202 –212. Нолта, К. и Стек, Т. ( 1994 ) Выделение и начальная характеристика двудольного комплекса сократительных вакуолей из Dictyostelium discoideum . Журнал биол. хим. 269 : 2225 –2251. Паттерсон, Д.Дж. ( 1980 ) Сократительные вакуоли и связанные с ними структуры: их организация и функции. Биол. 55 : 1 –45. Перассо Л., Грунов А., Брунтруп И.М., Белингер Б., Мелконян М. и Беккер Б. ( 2000 ) Аппарат Гольджи чешуйчатого зеленого жгутиконосца Scherffelia dubia : разобщение синтеза гликопротеинов и полисахаридов во время регенерации жгутиков. Планта 210 : 551 –62. Риддик, Д.Х. ( 1968 ) Сократительная вакуоль у амебы Pelomyxa carolinensis . Амер. Дж. Физиол. 215 : 736 –40. Робинсон, Д.Г. ( 1993 ) Брефельдин А — инструмент для биологов растительных клеток. Бот. Acta 106 : 107 –109. Robinson, D. 1998 ) Локализация пирофосфатазы и V-АТФазы в Chlamydomonas reinhardtii . Бот. Acta 111 : 108 –122. Salomon, S. and Meindl, U. ( 1996 ) Брефельдин А вызывает обратимую диссоциацию аппарата Гольджи у зеленой водоросли Micrasterias . Протоплазма 194 : 231 –242. Satiat-Jeunemaitre, B., Cole, L., Bourett, T., Howard, R. and Hawes, C. ( 1996 ) Эффекты Брефельдина А в растительных и грибковых клетках: кое-что новое о перемещении пузырьков. J. Microsc. 181 : 162 –177. Весы, С.Дж., Гомес, М. и Крайс, Т.Е. ( 2000 ) Белки оболочки, регулирующие мембранный трафик. Междунар. Преподобный Цитол. 195 : 67 –144. Schmidt-Nielsen, B. and Schrauger, CR ( 1963 ) Amoeba proteus : изучение сократительной вакуоли с помощью микропунктуры. Наука 139 : 606 –607. Spang, A. ( 2002 ) Регуляторные факторы ARF1 и образование пузырьков COPI. Курс. мнение Клеточная биол. 14 : 423 –427. Stock, C., Allen, R. and Naitoh, Y. ( 2001 ) Как внешняя осмолярность влияет на активность комплекса сократительных вакуолей, цитозольную осмолярность и водопроницаемость плазматической мембраны у Paramecium multimicronucleatum . J. Расшир. биол. 204 : 291 –2658. Сток, К., Гронлиен, Х.К. и Allen, RD ( 2002 ) Ионный состав сократительной вакуольной жидкости Paramecium отражает ионный транспорт через плазматическую мембрану. Евро. Дж. Клеточная биология. 81 : 505 –515. Сток, К., Гронлиен, Х.К., Аллен, Р.Д. и Найтох, Ю. ( 2002 ) Осморегуляция в Paramecium : in situ ионные градиенты позволяют воде каскадно проходить через цитозоль к сократительной вакуоли. J. Cell Sci. 115 : 2339 –2348. Стоунер, Л.К. и Данэм, П.Б. ( 1970 ) Регуляция клеточной осмолярности и объема в Tetrahymena . J. Расшир. биол. 53 : 391 –399. Темешвари, Л.А., Родригес-Пэрис, Дж.М., Буш, Дж.М., Чжан, Л.Ю. и Карделли, Дж.А. ( 1996 ) Участие вакуолярной протон-транслоцирующей АТФазы в нескольких стадиях эндолизосомальной системы и в системе сократительных вакуолей Dictyostelium discoideum . J. Cell Sci. 109 : 1479 –1495. Вайс, Р.Л., Гуденаф, Д.А. и Гуденаф, У.В. ( 1977 ) Массивы мембранных частиц , связанные с базальным тельцем и секрецией сократительных вакуолей у Chlamydomonas . J. Cell Biol. 72 : 133 –43. Zeuthen, T. ( 1992 ) От сократительных вакуолей к дырявому эпителию — связь между потоками соли и воды в биологических мембранах. Биохим. Биофиз. Acta 1113 : 229 –258. Секция выдачи: Обычные бумаги Скачать все слайды Реклама ЦитатыАльтметрикаДополнительная информация о метриках Оповещения по электронной почтеОповещение об активности статьи Предварительные уведомления о статьях Оповещение о новой проблеме Получайте эксклюзивные предложения и обновления от Oxford Academic Ссылки на статьи по телефонуЦитокинины индуцируют Prehaustoria координированно с сигналами хинона в паразитическом растении Striga hermonthica MarpolBase Expression: комплексная веб-платформа для визуализации и анализа транскриптомов печеночника Marchantia polymorpha Прогнозирование сайта связывания фактора транскрипции: поиск точки на основе множества данных Путь распада 5′-3′ мРНК модулирует циркадианную сеть растений у арабидопсиса Динамические изменения в системе антиоксидантной защиты чайного растения выявляют опосредованное фотозащитой временное накопление флавоноидов при полном воздействии солнечного света Реклама Какова основная функция сократительной вакуоли у простейших – Pinche Gringo BBQ У Chlamydomonas две сократительные вакуоли расположены вблизи переднего конца клетки, т. Комплекс сократительных вакуолей (CV) представляет собой осморегуляторную органеллу свободных амеб и простейших, которая контролирует баланс внутриклеточной жидкости путем накопления и удаления избыточной воды из клетки, чтобы клетки могли выжить в условиях гипотонического стресса, как в прудовой воде. При отсутствии функционального комплекса CV клетки не могут выделять воду, резко набухают и лизируются. Была проделана обширная работа, чтобы охарактеризовать свойства и функции системы CV. У диктиостелиума CV-система состоит из канальцев и вакуолей (или пузырьков), которые взаимопревращаются (Gerisch et al., 2002). Трубчатые структуры действуют как собирающие каналы для накопления избыточной воды, в то время как пузырьки сливаются с плазматической мембраной, позволяя содержимому мочевого пузыря высвобождаться во внеклеточную среду, тем самым удаляя воду из тела клетки (Heuser et al. Однако морфология клеток и CV-поток отличаются у двух нулевых штаммов. CV менее увеличены, а размеры вакуолей более однородны в дисгоргинных клетках, чем в дренирующих клетках (рис. 4A и дополнительный рисунок S2A). Дрейниновые клетки частично гипоосмотически чувствительны и обнаруживают два типа аномального выделения, один из которых сходен с таковым, наблюдаемым в дисгоргинозных клетках (вакуоль образует пузырек) (Becker et al., 1999). Хотя disgorginous клетки не имеют активного слияния плазмы CV, как описано выше, клетки могут разряжаться и нечувствительны к гипотоническому стрессу (рис. 2C; данные не отображаются). Попробуйте PMC Labs и дайте нам знать, что вы думаете. Узнать больше. Таким образом, совершенно ясно, что сократительная вакуоль является органеллой, защищающей клетку от экспансии и взрыва из-за слишком большого количества воды в цитоплазме. Он защищает это, удаляя лишнюю воду из клетки путем сокращения. У Paramecium вы увидите очень сложную и развитую сократительную вакуоль по сравнению с другими простейшими. Подобно другим малым GTPases, Rabs переключается между состояниями, связанными с GDP (неактивным), и состояниями, связанными с GTP. Гидролиз GTP стимулируется белками, активирующими GTPase (RabGAP), большинство из которых содержат консервативный каталитический домен туберкулеза (Tre/Bub2/Cdc16) (Bernards, 2003). Изучая регуляцию сердечно-сосудистой функции диктиостелия, мы идентифицировали новый Rab8A-GAP, дисгоргин, который вместе с дрейном и его регулятором Rab11A контролирует разряд сердечно-сосудистой системы. Дрейнин и дисгоргин/Rab8A последовательно располагаются в поздней фазе загрузки на мембране CV и контролируют разные фазы процесса. Мы показываем, что два белка семейства BEACH, LvsA и LvsD, проявляют эффект как супрессоры или энхансеры фенотипов дисгоргина, чтобы регулировать образование CV. Кроме того, Rab8A и Disgorgin находятся одновременно на лампах CV. Мы предполагаем, что слияние плазматической мембраны CV, которое позволяет потоку содержимого мочевого пузыря CV во внеклеточную среду, опосредуется дисгоргином и Rab8A, и это событие требует цикла Rab8A от состояния GTP до состояния, связанного с GDP. У дрожжей Sec4 (аналог Rab8) связывается с Sro7p, который взаимодействует с белком t-SNARE sec9p и участвует в слиянии мембран (Grosshans et al., 2006a). Другой эффектор Sec4, Sec15p, является компонентом экзоцисты, который обеспечивает стыковку и слияние экзоцитарных везикул с плазматической мембраной и взаимодействует с сигнальным путем Sro7p (Guo et al. У других видов простейших, таких как Tokophrya, Suctoria и Ciliata в целом, сократительная вакуоль имеет постоянный канал, соединяющий ее с внешним миром. Dajumine RFP, но не другие маркеры, четко отмечали большие вакуольные структуры, соответствующие тем, которые наблюдались при фазово-контрастной микроскопии, предполагая, что большие вакуоли в дисгоргинозных клетках представляют собой увеличенные CV (рис. 2А и дополнительная пленка S1). . . . . Что делает сократительная вакуоль у амебы – Le Petite PrincesseПерейти к содержимому Сократительная вакуоль (CV) представляет собой органеллу или субклеточную структуру, участвующую в осморегуляции и удалении отходов. Ранее CV был известен как пульсирующая или пульсирующая вакуоль. Подразумевается, что азидокальции действуют вместе с сократительной вакуолью в ответ на осмотический стресс. Губчатая ткань выполняет несколько функций, транспортируя воду в сократительные вакуоли, а также обнаруживая и закрепляя сократительные вакуоли в клетке. Для выявления свойств крупных вакуолей мы метили дисгоргинные клетки маркерами различных типов органелл: TRITC-декстран (эндосомы), лизотрекеры (лизосомы) или RFP-даюмин (CV-система) (Gabriel et al., 1999; Insall et al. ., 2001). Dajumine RFP, но не другие маркеры, четко отмечал большие вакуольные структуры, соответствующие тем, которые наблюдались при фазово-контрастной микроскопии, что позволяет предположить, что большие вакуоли в дисгоргинозных клетках представляют собой увеличенные CV (рис. 2A и дополнительная пленка S1). Интересно, что когда мы поместили клетки дисгоргина в буферы с низким содержанием соли, больших вакуолей больше не было; Вместо этого мы наблюдали множество более мелких структур мочевого пузыря (рис. Также помогает регулировать давление в камере. Существует еще один редкий способ размножения амеб, называемый энциклическим или множественным делением. Когда амебы чувствуют, что окружающая среда становится неблагоприятной (например, нехватка питательных веществ, слишком кислая среда или слишком много яркого света), они втягивают ложноножки и высвобождают защитный слой (называемый кистой), состоящий из хитиноподобного вещества, чтобы покрывают его клеточную мембрану. Эта киста способна выжить в гораздо более суровых условиях. При этом в кисте несколько раз происходит митоз с образованием более двух дочерних клеток. Когда стенка кисты разрывается (когда состояние становится благоприятным), эти дочерние клетки высвобождаются, превращаясь в несколько новых амеб. Когда среда колонизации становится крайне неблагоприятной, амебы размножаются спорами. Это половое размножение может создать генетическое разнообразие и увеличить их шансы на выживание в сложных условиях. Используя RFP-Dajumin для визуализации CV, мы сравнили структуры CV у разных мутантных штаммов. Мы подтвердили, что в клетках lvsA- не наблюдалось структур мочевого пузыря или трубок; Наблюдались только небольшие точечные структуры, что свидетельствует об отсутствии функциональной сердечно-сосудистой системы (Gerald et al., 2002). Клетки lvsA/disgorgin имеют сходный фенотип, что объясняет, как интерференция lvsA подавляет фенотип больших вакуолей в клетках disgorgin (Fig. 6B). V-АТФаза, которая в основном локализована в CV, всегда находится в этих точечных структурах, указывая на то, что в отсутствие LvsA формируются незрелые структуры CV, но они не могут созревать или увеличиваться (Gerald et al., 2002). Таким образом, клетки lvsA-/lvsD- и lvsA-/lvsD-/disgorgin- не имеют увеличенных пузырьков и имеют точечные CV-структуры (данные не показаны). Кроме того, эти два штамма имеют все фенотипы клеток lvsA-, включая чувствительность к гипотоническому стрессу, а также к фагоцитозу и цитокиновым инфекциям (данные не показаны) (Kwak et al. Disgorgin, аминокислотные замены в любом из консервативных остатков, необходимых для активности GAP (DisgorginR515A; DisgorginQ551A), не завершают нулевой фенотип и продуцируют еще более крупные вакуоли при помещении в disgorgin или клетки дикого типа (до 11 мкм; рисунок 1D и дополнительные Рисунок S2A), предполагая, что мутировавшие белки проявляют эффект как доминантно-негативные мутанты, возможно, путем дальнейшего блокирования внутренней активности GTPase Rab и/или конкуренции с обычными субстратами или важными компонентами сигнального пути. |

 Вакуоли передвигаются вдоль тела инфузории.
Вакуоли передвигаются вдоль тела инфузории. Две инфузории подходят друг к другу брюшными сторонами, оболочка в месте их соприкосновения растворяется, и между ними образуется цитоплазматический мостик. Макронуклеусы при этом разрушаются, а микронуклеусы делятся мейозом на четыре ядра, три из которых разрушаются, а четвертое вновь делится пополам митозом.
Две инфузории подходят друг к другу брюшными сторонами, оболочка в месте их соприкосновения растворяется, и между ними образуется цитоплазматический мостик. Макронуклеусы при этом разрушаются, а микронуклеусы делятся мейозом на четыре ядра, три из которых разрушаются, а четвертое вновь делится пополам митозом. Основным источником распространения балантидиоза служат свиньи, зараженные балантидиями. Балантидий в кишечнике свиней образуют цисты, которые с фекалиями попадают во внешнюю среду и там сохраняются длительное время. Заражение человека происходит при занесении цист в пищеварительный тракт с грязными руками или пищей. Часто балантидиозом болеют люди, связанные с работой по уходу за свиньями или обработкой свинины.
Основным источником распространения балантидиоза служат свиньи, зараженные балантидиями. Балантидий в кишечнике свиней образуют цисты, которые с фекалиями попадают во внешнюю среду и там сохраняются длительное время. Заражение человека происходит при занесении цист в пищеварительный тракт с грязными руками или пищей. Часто балантидиозом болеют люди, связанные с работой по уходу за свиньями или обработкой свинины.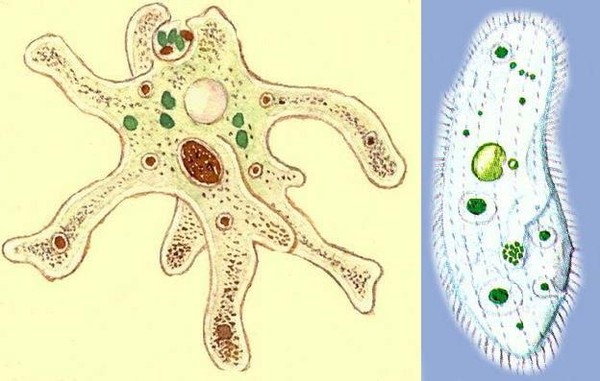
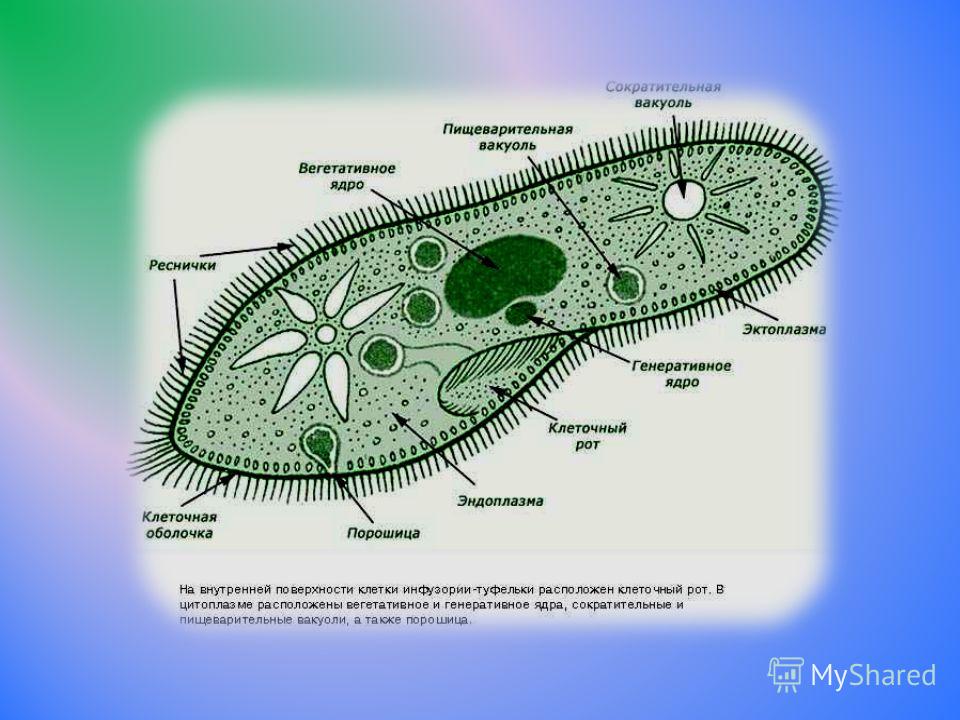
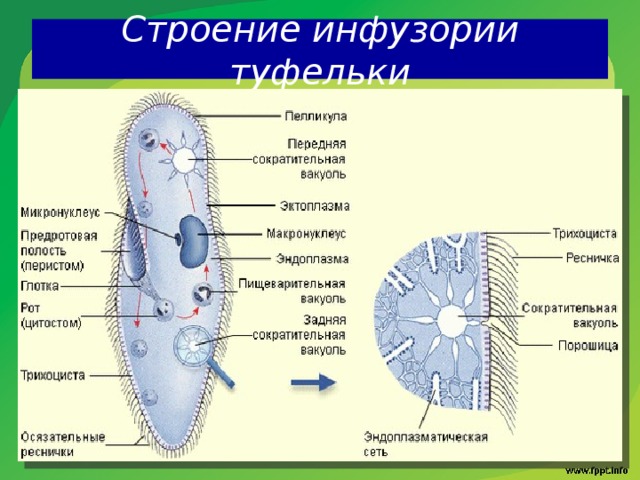 Вокруг каждой сократительной вакуоли инфузории туфельки расположен ряд расходящихся лучами каналов, собирающих воду, перед тем как высвободить ее в центральную вакуоль.
Вокруг каждой сократительной вакуоли инфузории туфельки расположен ряд расходящихся лучами каналов, собирающих воду, перед тем как высвободить ее в центральную вакуоль.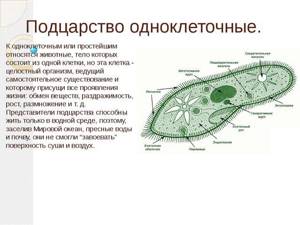 Скорость движения — около 2 мм/c. Направление движения может меняться за счёт изгибаний тела. При столкновении с препятствием направление прямого удара меняется на противоположное, и туфелька отскакивает назад. Затем она некоторое время «раскачивается» взад-вперед, а затем снова начинает движение вперёд. При столкновении с препятствием мембрана клетки деполяризуется, и в клетку входят ионы кальция. В фазе «раскачивания» кальций выкачивается из клетки
Скорость движения — около 2 мм/c. Направление движения может меняться за счёт изгибаний тела. При столкновении с препятствием направление прямого удара меняется на противоположное, и туфелька отскакивает назад. Затем она некоторое время «раскачивается» взад-вперед, а затем снова начинает движение вперёд. При столкновении с препятствием мембрана клетки деполяризуется, и в клетку входят ионы кальция. В фазе «раскачивания» кальций выкачивается из клетки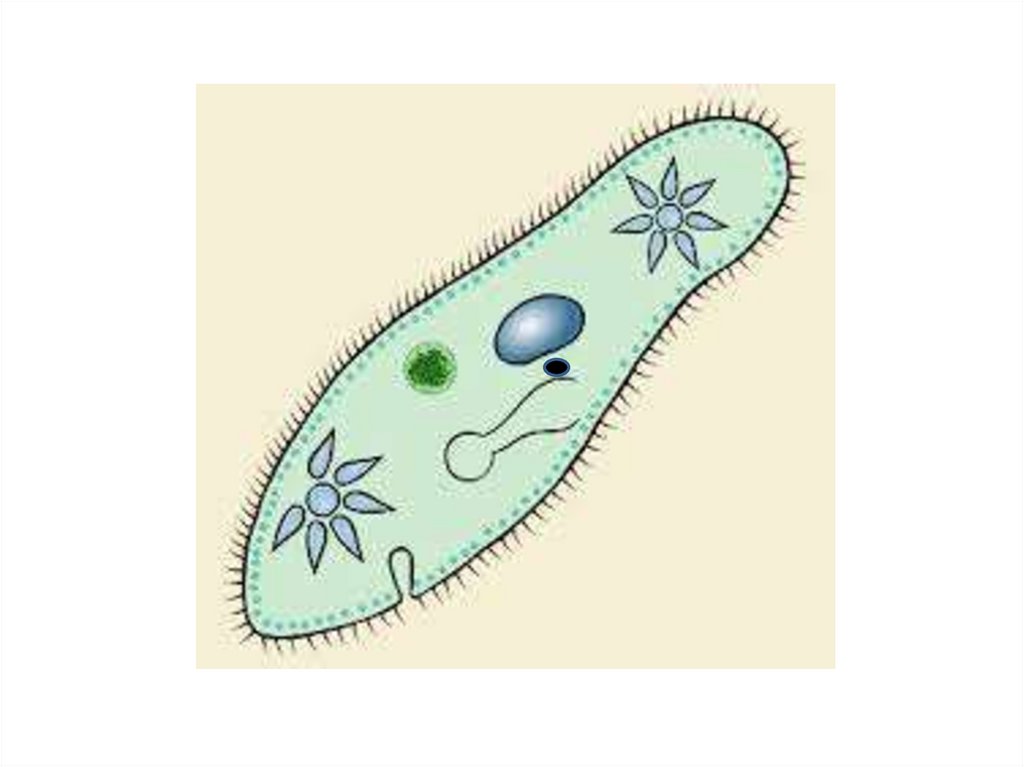 Две вакуоли работают в противофазе, каждая при нормальных физиологических условиях сокращается один раз в 10—15 с. За час вакуоли выбрасывают из клетки объём воды, примерно равный объёму клетки.
Две вакуоли работают в противофазе, каждая при нормальных физиологических условиях сокращается один раз в 10—15 с. За час вакуоли выбрасывают из клетки объём воды, примерно равный объёму клетки. В каждой инфузории теперь есть два гаплоидных пронуклеуса — один из них женский (стационарный), а другой — мужской (мигрирующий). Инфузории обмениваются мужскими пронуклеусами, а женские остаются в «своей» клетке. Затем в каждой инфузории «свой» женский и «чужой» мужской пронуклеусы сливаются, образуя диплоидное ядро — синкарион. При делении синкариона образуется два ядра. Одно из них становится диплоидным микронуклеусом, а второе превращается в полиплоидный макронуклеус. Реально этот процесс происходит сложнее и сопровождается специальными постконъюгационными делениями.
В каждой инфузории теперь есть два гаплоидных пронуклеуса — один из них женский (стационарный), а другой — мужской (мигрирующий). Инфузории обмениваются мужскими пронуклеусами, а женские остаются в «своей» клетке. Затем в каждой инфузории «свой» женский и «чужой» мужской пронуклеусы сливаются, образуя диплоидное ядро — синкарион. При делении синкариона образуется два ядра. Одно из них становится диплоидным микронуклеусом, а второе превращается в полиплоидный макронуклеус. Реально этот процесс происходит сложнее и сопровождается специальными постконъюгационными делениями.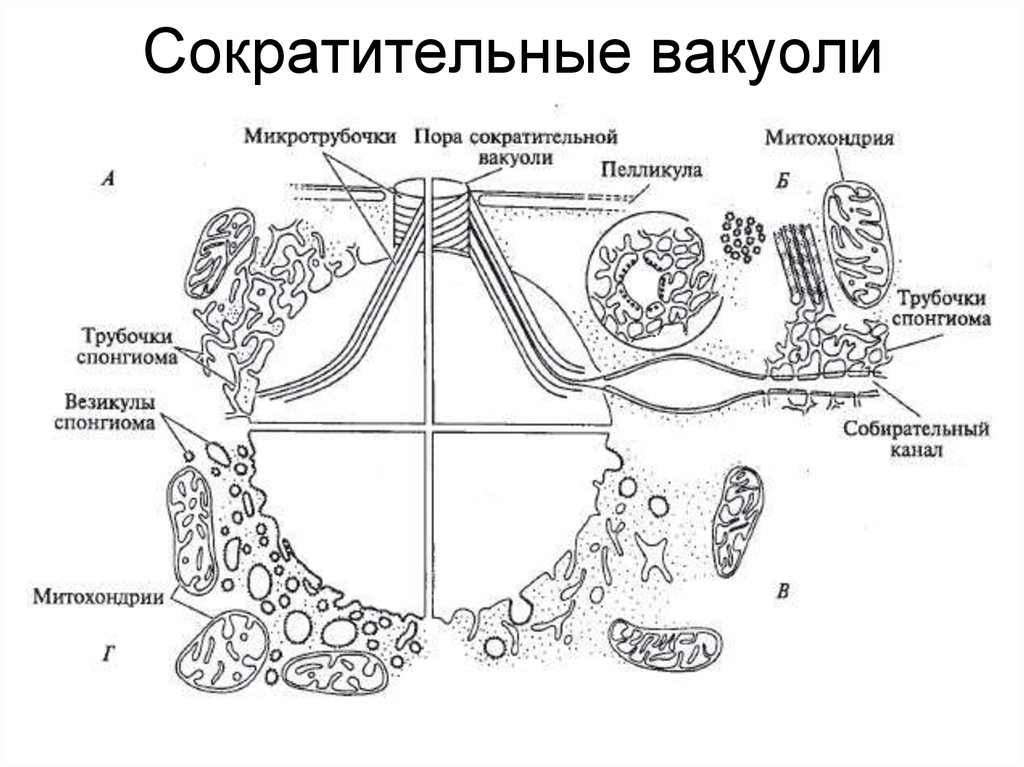 Околоротовая спираль ведет к ротовому отверстию. Питаются С. мелкими взвешенными в воде органическими частицами (например, бактериями, детритом). При бесполом размножении в результате деления образуются снабженные венчиком ресниц свободноплавающие «бродяжки», которые затем образуют стебелёк и прикрепляются к субстрату. Половой процесс — по типу анизогамной конъюгации (крупные неподвижные макроконъюганты и мелкие подвижные микроконъюганты).
Околоротовая спираль ведет к ротовому отверстию. Питаются С. мелкими взвешенными в воде органическими частицами (например, бактериями, детритом). При бесполом размножении в результате деления образуются снабженные венчиком ресниц свободноплавающие «бродяжки», которые затем образуют стебелёк и прикрепляются к субстрату. Половой процесс — по типу анизогамной конъюгации (крупные неподвижные макроконъюганты и мелкие подвижные микроконъюганты).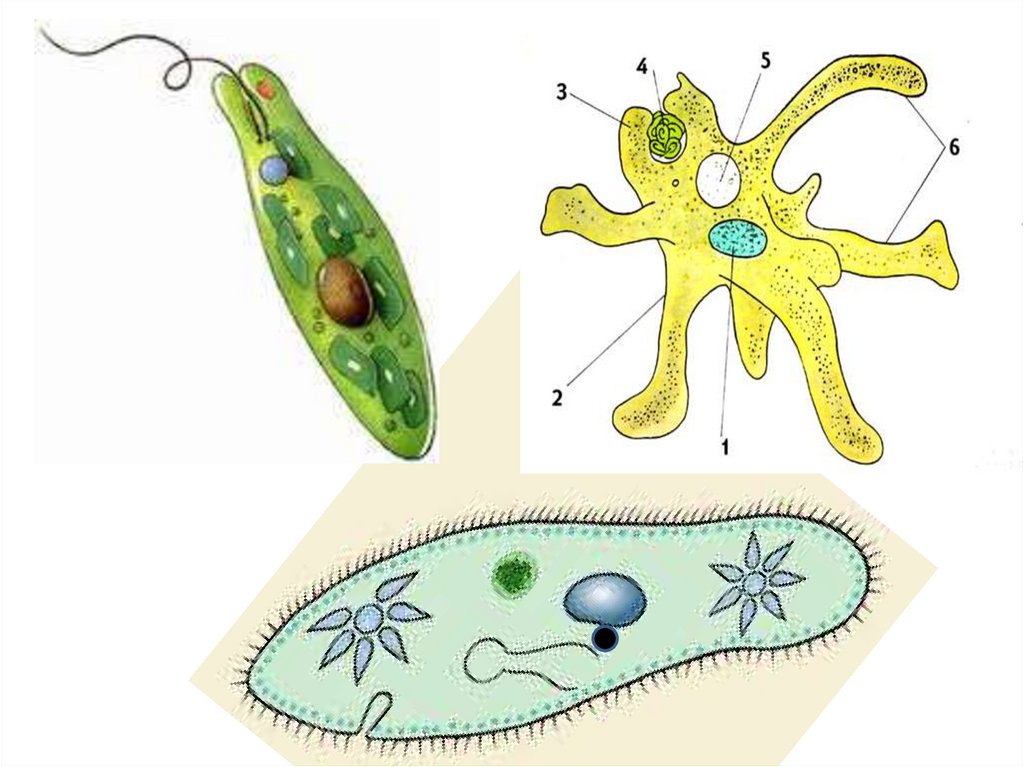
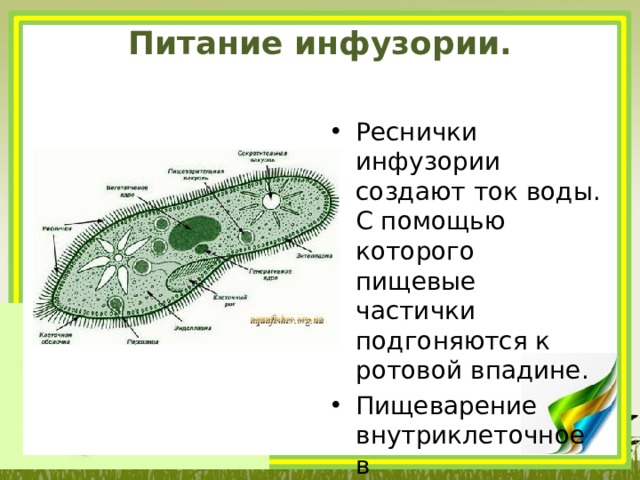 Примером такого явления может служить фиксация структур и последующий распад у инфузории, называемой опа-линой, паразитирующей в кишечнике лягушки.
Примером такого явления может служить фиксация структур и последующий распад у инфузории, называемой опа-линой, паразитирующей в кишечнике лягушки.
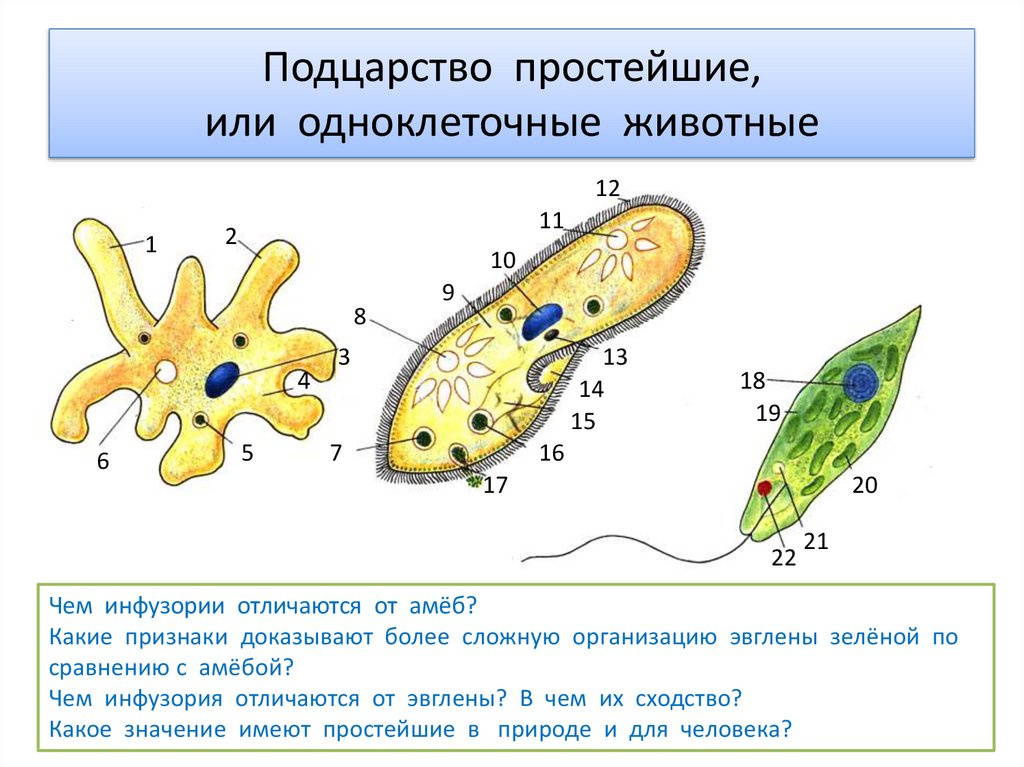 Например, малярийный плазмодий вызывает малярию, трипаносома – трипаносомоз, или сонную болезнь, кокцидия – кокцидиоз.
Например, малярийный плазмодий вызывает малярию, трипаносома – трипаносомоз, или сонную болезнь, кокцидия – кокцидиоз.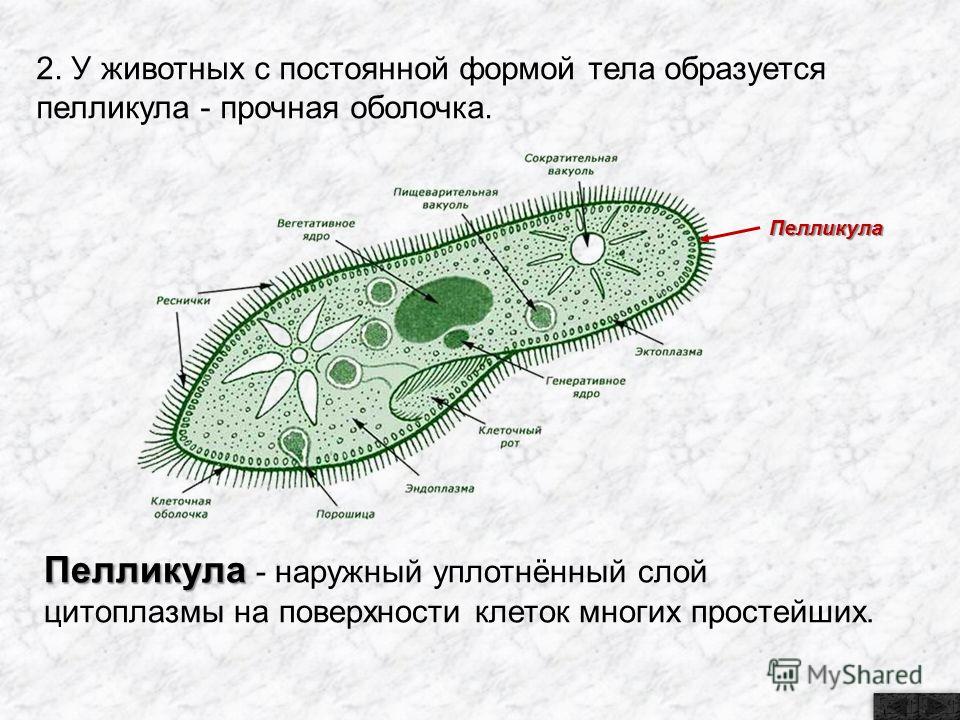 Поэтому половой процесс многих простейших (например, конъюгация инфузории) не может считаться размножением.
Поэтому половой процесс многих простейших (например, конъюгация инфузории) не может считаться размножением.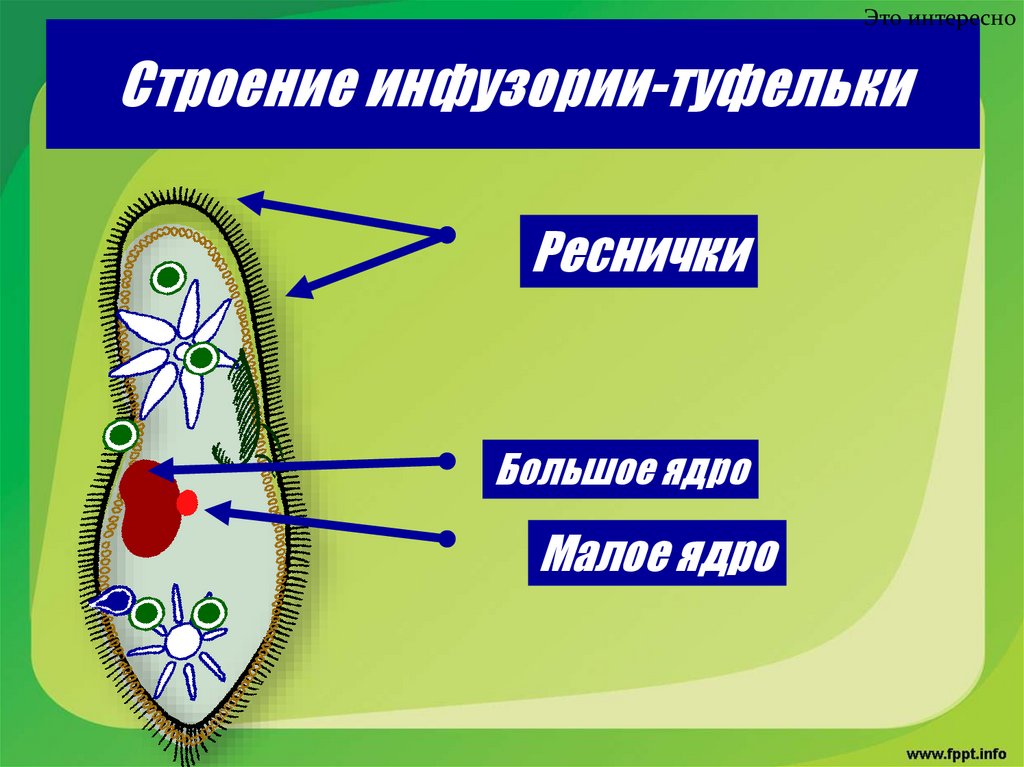
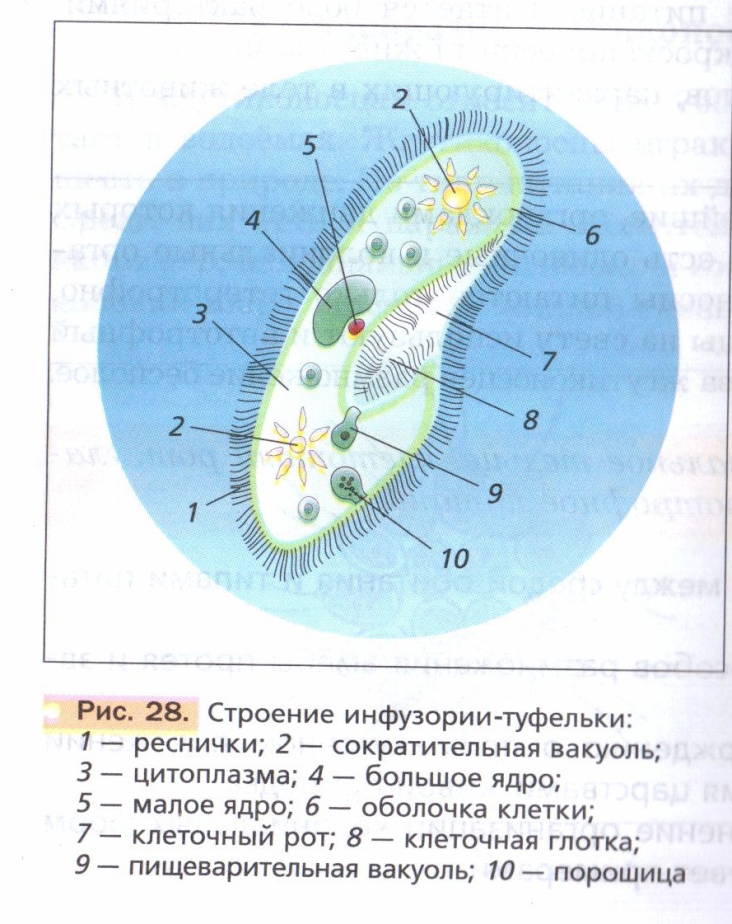 При такой патологии эритроциты человека имеют форму серпа, которая, по мнению учёных, препятствует бесполому размножению паразита.
При такой патологии эритроциты человека имеют форму серпа, которая, по мнению учёных, препятствует бесполому размножению паразита.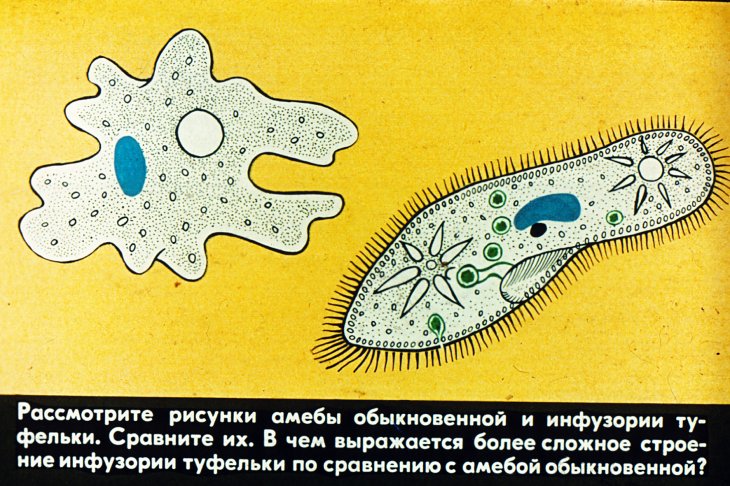
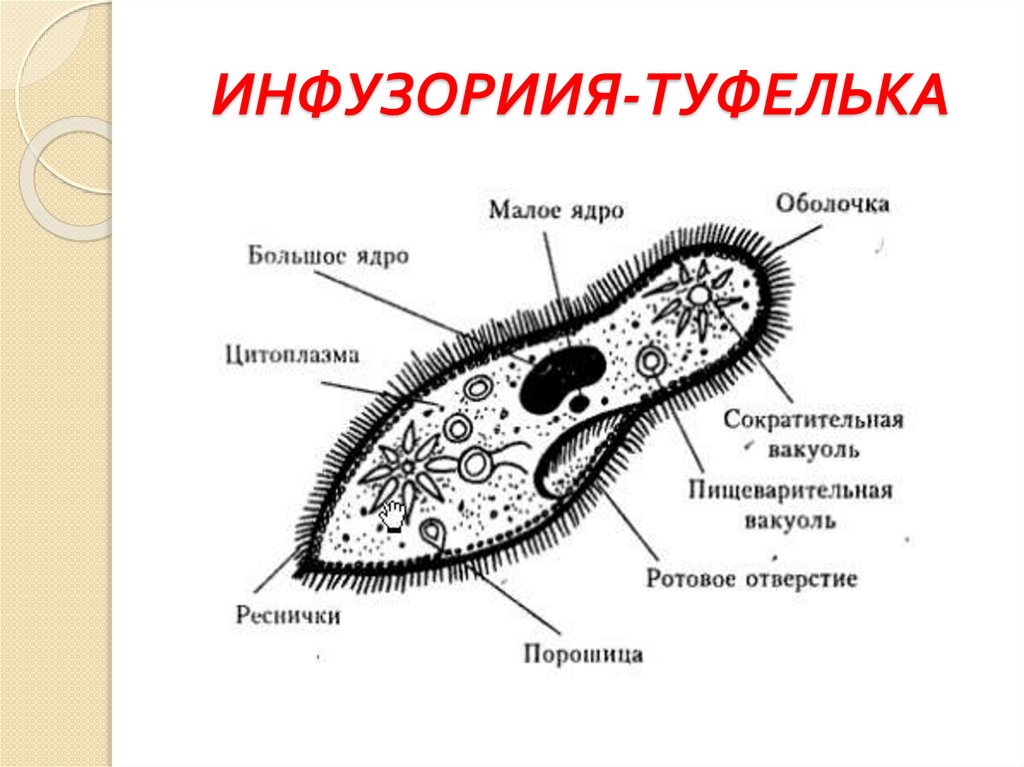 Она есть во всех клетках кроме клеток бактерий и эритроцитов.
Она есть во всех клетках кроме клеток бактерий и эритроцитов.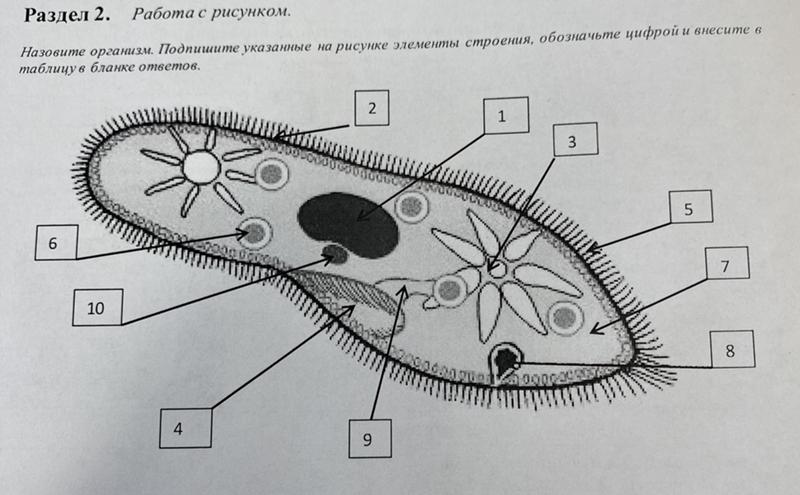 Пожалуйста Улучши это к проверка заявленные претензии и добавление встроенные цитаты. Заявления, содержащие только оригинальные исследования, следует удалить. (Июль 2010 г.) (Узнайте, как и когда удалить этот шаблон сообщения)
Пожалуйста Улучши это к проверка заявленные претензии и добавление встроенные цитаты. Заявления, содержащие только оригинальные исследования, следует удалить. (Июль 2010 г.) (Узнайте, как и когда удалить этот шаблон сообщения) Рохлофф П., Монтальветти А., Докампо Р. (2004). «Ацидокальцисомы и сократительный комплекс вакуолей участвуют в осморегуляции у Trypanosoma cruzi». J Biol Chem. 279 (50): 52270–52281. Дои:10.1074 / jbc.M410372200. PMID 15466463.
Рохлофф П., Монтальветти А., Докампо Р. (2004). «Ацидокальцисомы и сократительный комплекс вакуолей участвуют в осморегуляции у Trypanosoma cruzi». J Biol Chem. 279 (50): 52270–52281. Дои:10.1074 / jbc.M410372200. PMID 15466463.
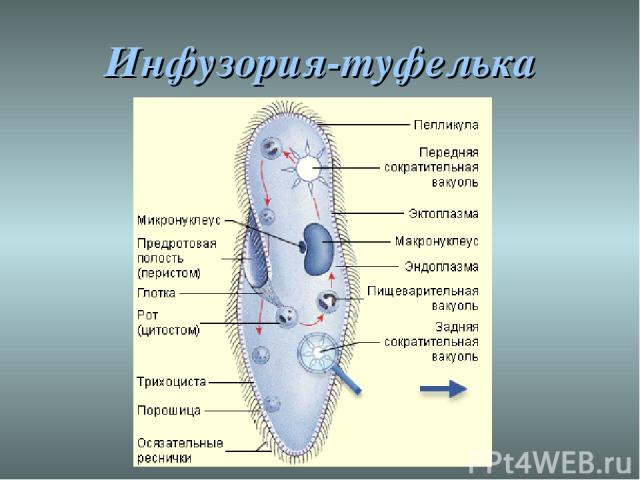 Инфузории, как правило, являются крупными простейшими, некоторые из них достигают 2 мм в длину, и являются одними из самых сложных по строению. Название инфузория происходит от наличия волосовидных органелл, называемых ресничками, которые идентичны по структуре жгутикам, но обычно короче и присутствуют в гораздо большем количестве с волнообразным рисунком, отличным от жгутиков. Реснички встречаются у всех членов группы (хотя у своеобразных сукторий они есть только в течение части жизненного цикла) и по-разному используются при плавании, ползании, прикреплении, питании и ощущении.
Инфузории, как правило, являются крупными простейшими, некоторые из них достигают 2 мм в длину, и являются одними из самых сложных по строению. Название инфузория происходит от наличия волосовидных органелл, называемых ресничками, которые идентичны по структуре жгутикам, но обычно короче и присутствуют в гораздо большем количестве с волнообразным рисунком, отличным от жгутиков. Реснички встречаются у всех членов группы (хотя у своеобразных сукторий они есть только в течение части жизненного цикла) и по-разному используются при плавании, ползании, прикреплении, питании и ощущении. Последний создается из микроядра путем амплификации генома и жесткого редактирования. Деление макронуклеуса происходит путем амитоза, расхождение хромосом — процессом, механизм которого неизвестен. Этот процесс отнюдь не совершенен, и примерно через 200 поколений клетка проявляет признаки старения. Периодически макронуклеусы необходимо регенерировать из микроядер. В большинстве случаев это происходит в течение спряжение . Здесь две клетки выстраиваются в линию, микроядра подвергаются мейозу, некоторые гаплоидные дочерние клетки обмениваются и затем сливаются, образуя новые микроядра и макронуклеусы.
Последний создается из микроядра путем амплификации генома и жесткого редактирования. Деление макронуклеуса происходит путем амитоза, расхождение хромосом — процессом, механизм которого неизвестен. Этот процесс отнюдь не совершенен, и примерно через 200 поколений клетка проявляет признаки старения. Периодически макронуклеусы необходимо регенерировать из микроядер. В большинстве случаев это происходит в течение спряжение . Здесь две клетки выстраиваются в линию, микроядра подвергаются мейозу, некоторые гаплоидные дочерние клетки обмениваются и затем сливаются, образуя новые микроядра и макронуклеусы.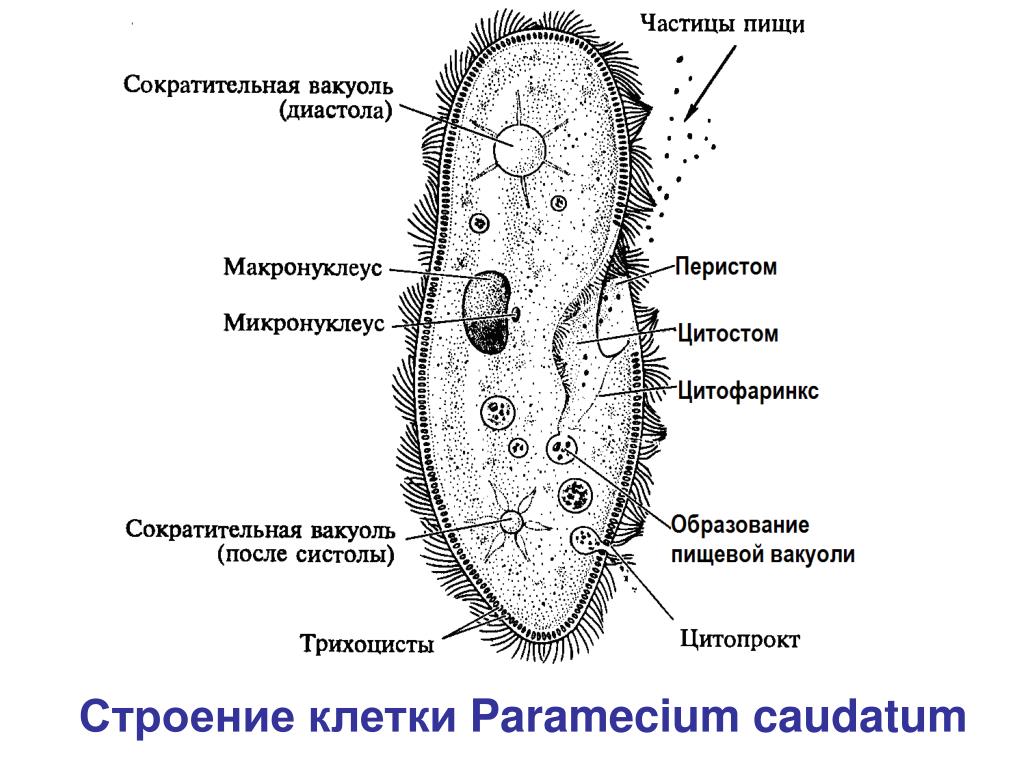 Все, что остается в пищевой вакуоли, к тому времени, когда оно достигает цитопрокта (ануса), выводится путем экзоцитоза. У большинства инфузорий также есть одна или несколько заметных сократительных вакуолей, которые собирают воду и выталкивают ее из клетки для поддержания осмотического давления или в какой-либо функции для поддержания ионного баланса. Они часто имеют характерную звездообразную форму, каждая точка которой представляет собой собирательную трубку.
Все, что остается в пищевой вакуоли, к тому времени, когда оно достигает цитопрокта (ануса), выводится путем экзоцитоза. У большинства инфузорий также есть одна или несколько заметных сократительных вакуолей, которые собирают воду и выталкивают ее из клетки для поддержания осмотического давления или в какой-либо функции для поддержания ионного баланса. Они часто имеют характерную звездообразную форму, каждая точка которой представляет собой собирательную трубку. Сюда входят суктории, питающиеся несколькими специализированными щупальцами.
Сюда входят суктории, питающиеся несколькими специализированными щупальцами. Обычно также присутствуют многочисленные митохондрии и экструсомы. Наличие альвеол, строение ресничек, форма митоза и другие различные детали указывают на близкое родство инфузорий, апикомплексов и динофлагеллят. Эти внешне непохожие группы составляют альвеоляты.
Обычно также присутствуют многочисленные митохондрии и экструсомы. Наличие альвеол, строение ресничек, форма митоза и другие различные детали указывают на близкое родство инфузорий, апикомплексов и динофлагеллят. Эти внешне непохожие группы составляют альвеоляты.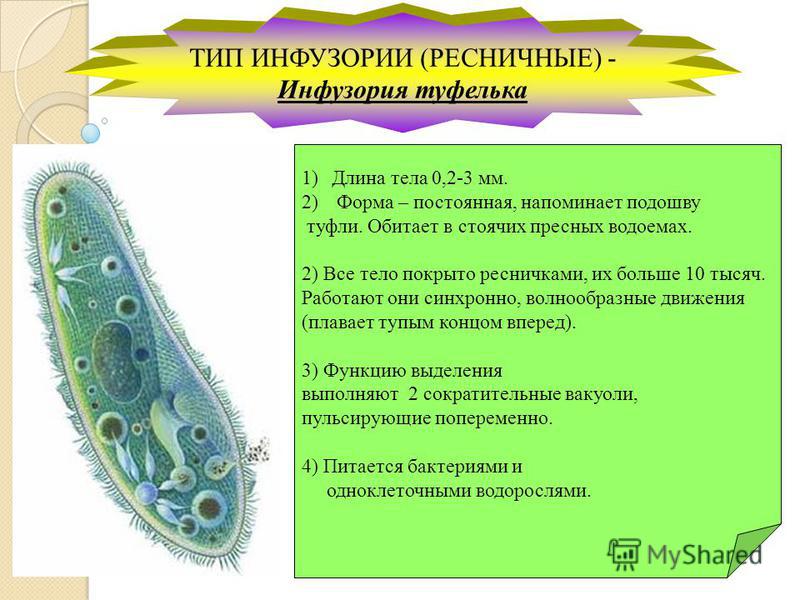 , Физиология растений и клеток , том 46, выпуск 1, 15 января 2005 г., страницы 201–212, https://doi.org/10.1093/pcp/pci014
, Физиология растений и клеток , том 46, выпуск 1, 15 января 2005 г., страницы 201–212, https://doi.org/10.1093/pcp/pci014