Инфузории-туфельки пали жертвой экологического неблагополучия
Свойства и качество воды зависят от состава и концентрации содержащихся в ней веществ.
Оценка качества воды водоемов и водотоков может быть проведена с использованием физико-химических и биологических методов. Биологические методы оценки — это характеристика состояния водной экосистемы по растительному и животному населению водоема.
Методы биоиндикации, позволяющие изучать влияние техногенных загрязнителей на растительные и животные организмы и неживую природу, являются наиболее доступными. Биоиндикация основана на тесной взаимосвязи живых организмов с условиями среды, в которой они обитают. Изменения этих условий, например повышение солености или рН воды, может привести к исчезновению определенных видов организмов, наиболее чувствительных к этим показателям и появлению других, для которых такая среда будет оптимальной. Различные виды живых существ показывают, чем загрязнена окружающая среда. Какой бы совершенной ни была современная аппаратура, она не может сравниться с ≪живыми приборами≫, реагирующими на те или иные изменения, отражающими воздействие всего комплекса факторов, включая сложные соединения различных ингредиентов.
Любая водная экосистема, находясь в равновесии с факторами внешней среды, имеет сложную систему подвижных биологических связей, которые нарушаются под воздействием антропогенных факторов. Прежде всего влияние антропогенных факторов, и в частности, загрязнения отражается на видовом составе водных сообществ и соотношении численности слагающих их видов. Биологический метод оценки состояния водоема позволяет решить задачи, разрешение которых с помощью гидрофизических и гидрохимических методов невозможно. Оценка степени загрязнения водоема по составу живых организмов позволяет быстро установить его санитарное состояние, определить степень и характер загрязнения и пути его распространения в водоеме, а также дать количественную характеристику протекания процессов естественного самоочищения.
Тест-объекты CHLORELLA VULGARIS BEIJER Классическим тест-объектом на загрязнители является одноклеточная зеленая водоросль хлорелла (Chlorella vulgaris Beij er). Ее преимущества для экспресс-анализа загрязнения агроценоза заключаются в коротком жизненном цикле и возможности проводить оценку по таким показателям, как пигментное секторирование, нарушение споруляции клеток и летальность.
Хлорелла — одноклеточная зеленая водоросль, встречается повсеместно — в почве, в составе фитопланктона рек, озер, прудов. Пигментная система водоросли чувствительна к присутствию токсикантов.
При наличии токсического загрязнения водоемов в пробе наблюдается угнетение роста водорослей. Загрязнение водоемов биогенными элементами вызывает стимуляцию роста хлореллы.
Метод, основанный на оценке численности живых особей и динамики ее фитомассы, дает в конечном счете представление о влиянии токсикантов на продолжительность жизни и плодовитость тестсистемы. Оценивается интенсивность роста биоиндикатора Ch.vulgaris в зависимости от концентрации токсиканта.
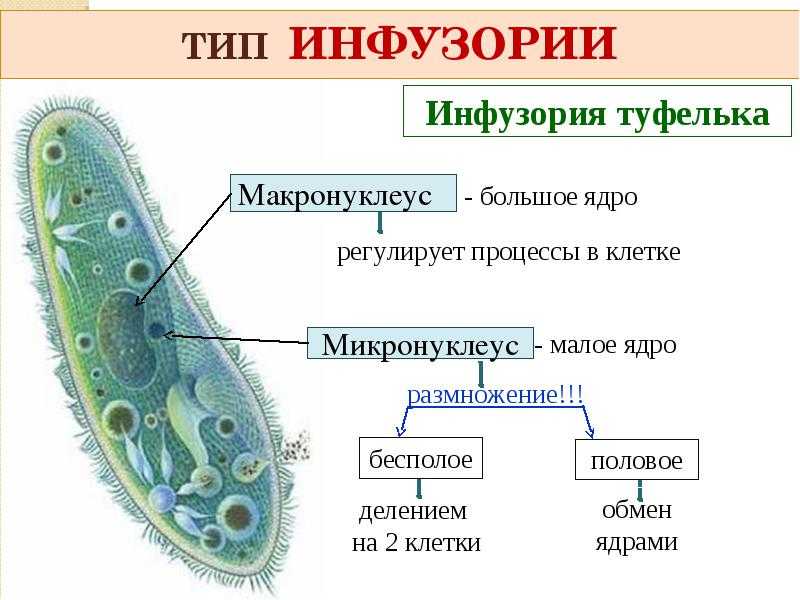
ПРОСТЕЙШИЕ PARAMECIUM CAUDATUM Инфузория-туфелька относится к подцарству простейших или одноклеточных животных (Protozoa), к многочисленному (свыше 7 тысяч видов) типу реснитчатых или инфузорий (Ciliopliora), к роду Para mecium, виду Paramecium caudatum.
Инфузория-туфелька широко распространена в природе.
Живет в пресных водоемах. По сравнению с другими группами простейших инфузории имеют наиболее сложное строение и отличаются разнообразием и сложностью функций.
По сравнению с другими группами простейших инфузории имеют наиболее сложное строение и отличаются разнообразием и сложностью функций.
Инфузория-туфелька — хорошо изученная лабораторная культура. Для нее определены оптимальные режимы выращивания и основные факторы, влияющие на скорость роста.
К таким факторам относятся в первую очередь количество и качество корма, температура, кислородный режим, рН среды, накопление продуктов метаболизма. Согласно литературным данным, лучшим кормом для Paramecium caudatum являются бактерии Bacillus subnhi, Aerobacter aerogenes, a также смесь бактерии и дрожжей Saccharomgces. Хорошие результаты получены при выращивании инфузории-туфелькина сухих пекарских дрожжах, лейкоцитарном масле.
Оптимальная температура для выращивания культуры Paramecium caudatum составляет 23–26 °C, оптимальный рН — 6.S–7,0. Кроме того, для нормальной жизнедеятель но сти культуре необходим кислород.
При выращивании в сосудах с большой поверхностью жидкости, например в чашках Петри или подобных емкостях, достаточно кислорода, поступающего через поверхность жидкости. При увеличении соотношения объема жидкости к ее поверхности ухудшается кислородный режим, культура без аэра ции развивается плохо.
При увеличении соотношения объема жидкости к ее поверхности ухудшается кислородный режим, культура без аэра ции развивается плохо.
На потребность культуры в кислороде влияют также температура выращивания и количество корма.
Метод анализа Метод биотестового анализа основан на способности инфузорий избегать неблагоприятных и опасных для жизнедеятельности зон и активно перемещаться по градиентам концентраций химических веществ в благоприятные зоны.
Метод позволяет оперативно определять острую токсичность водных проб и предназначен для контроля токсичности природных, сточных, питьевых вод, водных вытяжек из различных материалов и пищевых продуктов. Например, можно смотреть изменение подвижности за 15–30 мин; гибель отдельных клеток за 1–4 часа; снижение скорости размножения за 1–3 суток; гибель популяции за 4–30 суток. Гибель отдельных клеток — достаточно надежный показатель, но с его помощью невозможно выявить низкие концентрации токсикантов. Оценка скорости размножения — биотест с большей чувствительностью, по нему можно определять и небольшие концентрации вредных веществ.
Если сочетать все тесты, то результат получается надежный.
В большинстве методик биотестирования просто подсчитывают клетки до начала и в конце опыта.
Способность инфузории-туфельки воспринимать изменение разнообразных факторов среды и отвечать на них реакцией изменения подвижности, реакцией избегания обеспечивает организму большую вероятность выживания: организм может покинуть неблагоприятную зону или, наоборот, концентрироваться в зонах, благоприятных для жизни, например, в зонах скопления пищи.
Количество клеток инфузории-туфельки, переместившихся вдоль градиента концентрации химических веществ (хемотаксис), зависит как от природы вещества, так и от его концентрации, поэтому хемотаксис может служить количественной характеристикой степени воздействия неблагоприятных факторов на тест-объект, т. е. быть тестреакцией. Хемотаксическая реакция относится к поведенческим реакциям, которые более чувствительны и быстры, чем реакции биохимические и физиологические. Поэтому хемотаксис инфузории-туфельки к токсикантам может быть использован в биотестовом экспресс-анализе.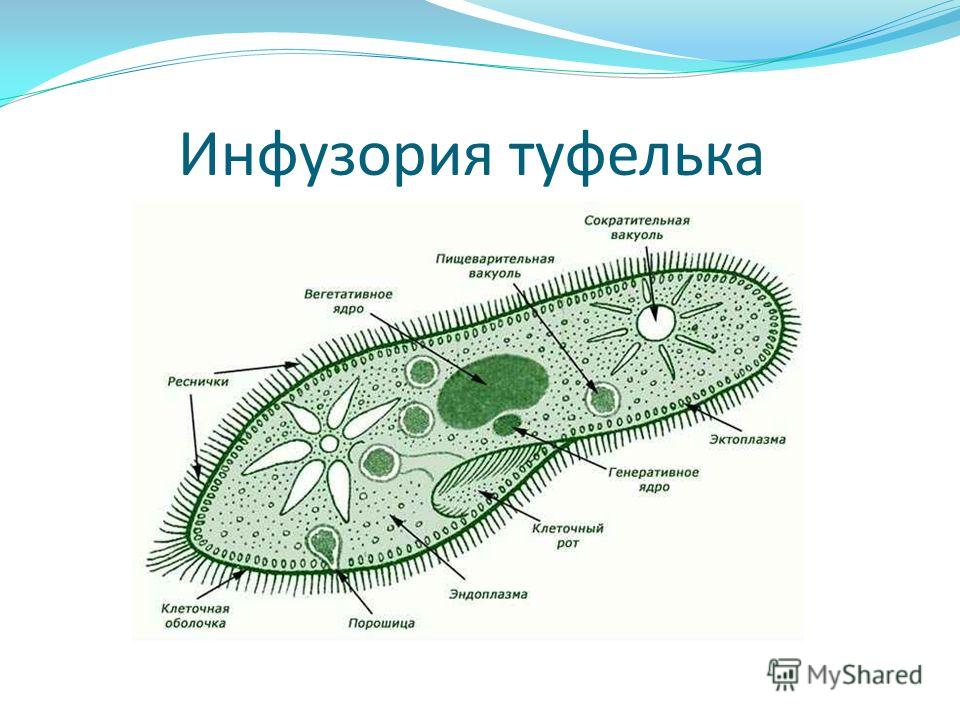
Методика работы Тест 1. Определение токсичности по изменению оптической плотности микроводорослей Ch. vulgaris.
Оптическая плотность (D) характеризует прозрачность раствора. Чем меньше водорослей, тем раствор прозрачнее, чем больше, тем мутнее.
Мы взяли пять образцов: Образец 1: чистая дистиллированная вода (контроль).
Образец 2: вода из первого стокового пруда Лебедянских прудов.
Образец 3: вода из лужи с тропинки рядом с въездом машин в школу.
Образец 4: вода из аквариума.
Образец 5: вода из лужи.
Молодую культуру водорослей мы заранее подготовили.
За 3 дня мы поместили водоросли в культиватор, создали в нем определенную температуру, световой режим и аэрацию. Через 3 дня хлорелла вышла на стадию активного деления и роста.
Эксперимент проводится на определенном количестве клеток, которые отражает оптическая плотность 0,125+0,005.
Плотность измеряется измерительным прибором ИПС-03.
Для эксперимента мы культуру профильтровали, отделив пену. Пена — это мертвые микроорганизмы. Для того чтобы довести культуру до D=0,125, нужно ее разбавить питательной средой. Образцы и контроль мы разлили в пенициллиновые флаконы (по 3 повтора для каждого образца).
Пена — это мертвые микроорганизмы. Для того чтобы довести культуру до D=0,125, нужно ее разбавить питательной средой. Образцы и контроль мы разлили в пенициллиновые флаконы (по 3 повтора для каждого образца).
К каждому образцу добавили 1 мл рабочей культуры водорослей и закрыли флаконы крышками с отверстием.
Далее мы пронумеровали образцы и поместили на 22 часа в барабан для выращивания в оптимальных для хлореллы условиях.
Тест 2. Определение токсичности водоема по изменению численности простейших Paramecium Caudatum (инфузории-туфельки).
Культуру инфузорий выращивают в термостатах при температуре 25 °С, кормят дрожжами. Для анализа берем 2,4 мл раствора. Из образца в каждую ячейку приливаем 0,6 мл. В капле под бинокулярным микроскопом подсчитать количество живых клеток.
Эксперимент проводят в планшетах, в 4 ячейках. Вносим культуру, затем приливаем раствор.
Биодиагностика водоемов Биодиагностика — это методы определения параметров природных объектов с помощью живых организмов, позволяющие выявить причины или факторы изменения состояния среды на основе видов — биоиндикаторов с узко специфичными реакциями и отношениями.
Методы биодиагностики делятся на две группы:
1. Биоиндикация — это методы диагностики, проводимые на объектах, находящихся в образцах, отобранных в естественных условиях. Это способ оценки антропогенной нагрузки по реакции на нее живых организмов и их сообществ.
2. Биотестирование — это измерение параметров на живых организмах, которые разводятся в лабораторных условиях. В этом случае используются в контролируемых условиях биологические объекты (тест-объекты) для выявления и оценки действия факторов (в том числе и токсических) окружающей среды на организм, его отдельную функцию или систему организмов.
Методы биоиндикации Физико-химические измерения позволяют оценить качество воды только на данный момент, так как результаты измерений верны только по отношению к определенному времени. Для получения достоверных результатов анализ следует проводить как можно быстрее, так как химический состав водоемов и физические характеристики очень сильно варьируют в зависимости от места сбора, погодных условий и времени года.
Присутствие индикаторных видов растений или животных позволяет более глубоко судить о качестве воды в водоеме.
Одним из основных объектов биоиндикации является планктон. Планктон — совокупность живых обитателей водоема, не способных активно передвигаться или медленно передвигающихся, но не противостоящих токам воды.
Фитопланктон — совокупность растительных организмов водоема, неспособных активно передвигаться, — важнейший компонент вод ных систем, активно участвует в формировании качества воды и является чутким показателем состояния водных экосистем и водоема в целом.
Подчеркивая всю важность биоиндикационных методов исследования, необходимо отметить, что биоиндикация предусматривает выявление уже состоявшегося или происходящего загрязнения окружающей среды по функциональным характеристикам особей и экологическим характеристикам сообществ организмов. Постепенные же изменения видового состава формируются в результате длительного отравления водоема, и явными они становятся в случае далеко идущих изменений.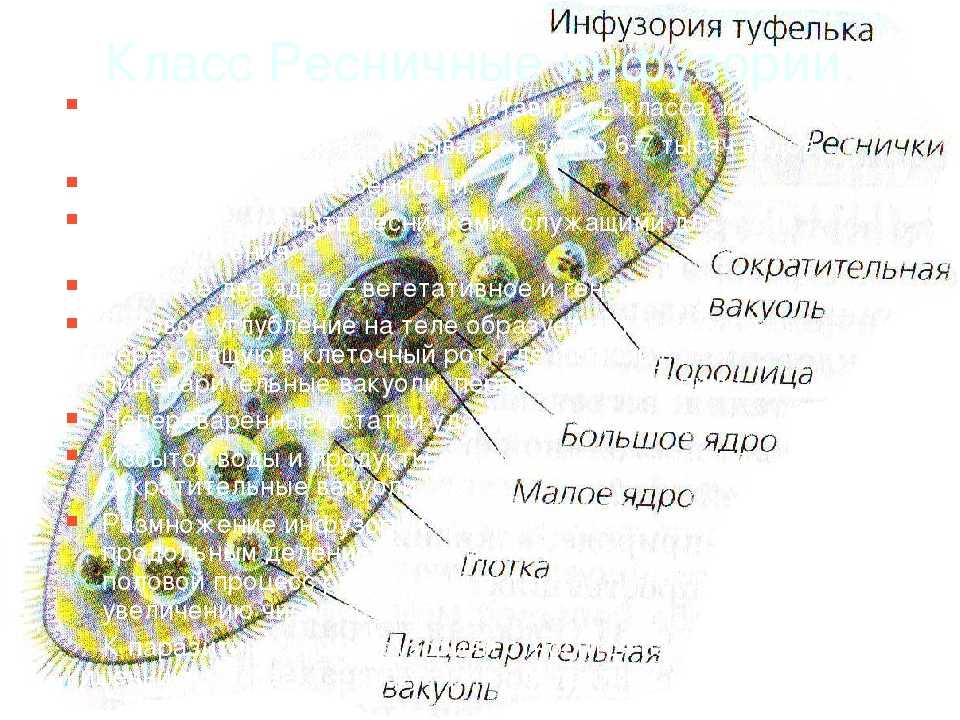
Таким образом, видовой состав живых организмов из загрязняемого водоема служит итоговой характеристикой токсикологических свойств водной среды за некоторый промежуток времени и не дает ее оценки на момент исследования.
При сбросе в водоем токсических веществ, содержащихся в промышленных сточных водах, происходит угнетение и обеднение фитопланктона.
При обогащении водоемов биогенными веществами, содержащимися, например, в бытовых стоках, значительно повышается продуктивность фитопланктона. При перегрузке водоемов биогенами возникает бурное развитие планктонных водорослей, окрашивающих воду в зеленый, сине-зеленый, золотистый, бурый или красный цвета (≪цветение≫ воды). ≪Цветение≫ воды наступает при наличии благоприятных внешних условий для развития одного, редко двухтрех видов. При разложении избыточной биомассы выделяется сероводород или другие токсичные вещества. Это может приводить к гибели зооценозов водоема и делает воду непригодной для питья.
Многие планктонные водоросли в процессе жизнедеятельности нередко выделяют токсичные вещества.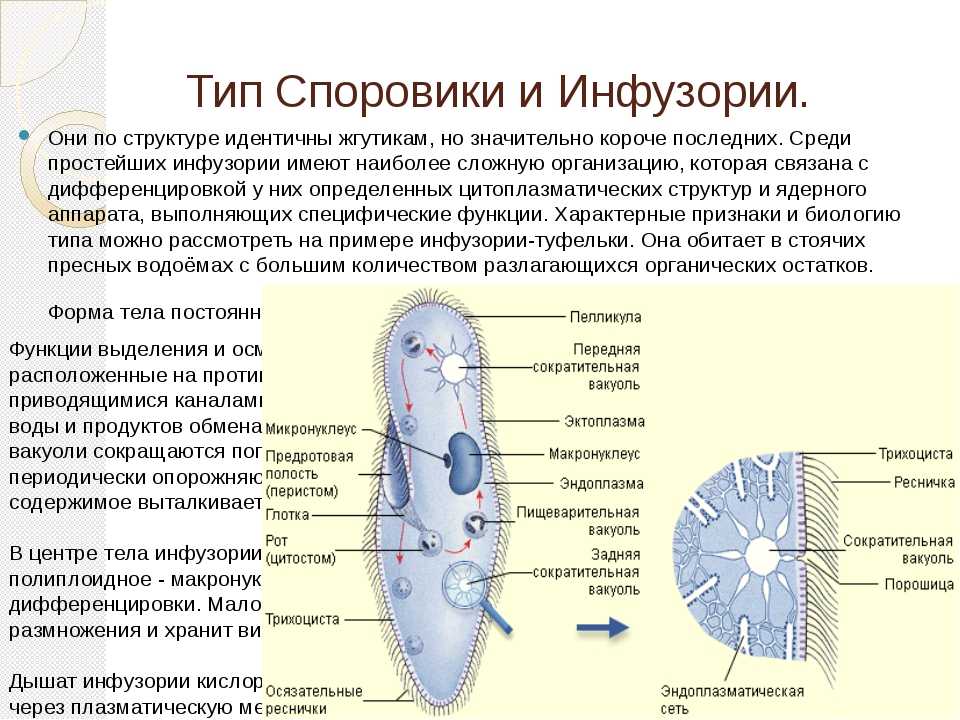 Увеличение в водоемах содержания биогенных веществ в результате хозяйственной деятельности человека, сопровождаемое чрезмерным развитием фитопланктона, называют антропогенным эвтрофированием водоемов.
Увеличение в водоемах содержания биогенных веществ в результате хозяйственной деятельности человека, сопровождаемое чрезмерным развитием фитопланктона, называют антропогенным эвтрофированием водоемов.
Каждая группа организмов в качестве биологического индикатора имеет свои преимущества и недостатки, которые определяют границы ее использования при решении задач биоиндикации.
Водорослям принадлежит ведущая роль в индикации изменения качества воды в результате эвтрофирования (заболачивания) водоема.
Зоопланктон также достаточно показателен как индикатор эвтрофирования и загрязнения (в частности, органического и нитратного) вод. Кроме этого, среди зоопланктона встречаются и представители патогенной фауны, ограничивающей использование водного объекта в целях водоснабжения.
Простейшие являются высокочувствительными индикаторами сапробного состояния водоемов. Сапробными (от греческого слова ≪сапрос≫ —гнилой) называют водоемы, загрязненные органическими стоками.
Зообентос —совокупность животных, обитающих на дне и в придонных слоях воды, служит хорошим индикатором загрязнения донных отложений и придонного слоя воды.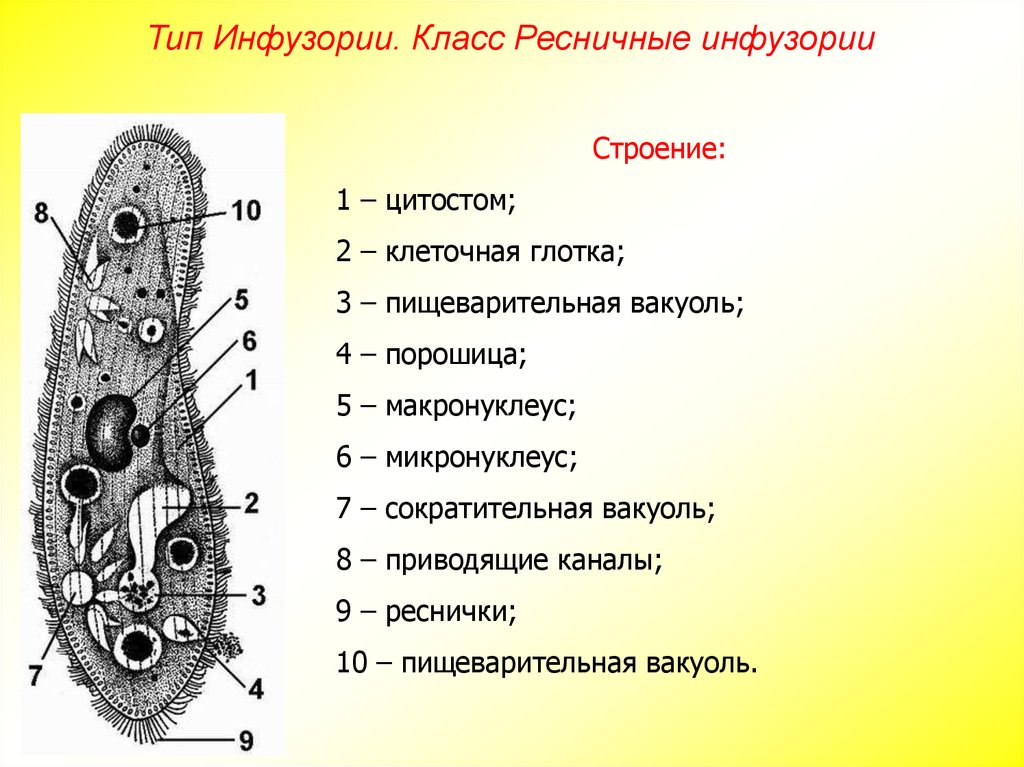 Наиболее достоверными индикаторами среди них служат легочные моллюски, особенно катушки и речные чашечки.
Наиболее достоверными индикаторами среди них служат легочные моллюски, особенно катушки и речные чашечки.
Положительные результаты дает также оценка качества воды по личинкам насекомых.
Свободно живущие личинки ручейников, а также поденок являются наиболее чувствительными организмами.
Значение макрофитов (высшая водная растительность) наиболее существенно при предварительном гидробиологическом осмотре водных объектов. При загрязнении водоемов изменяется видовой состав, биомасса и продукция макрофитов, возникают морфологические аномалии, происходит смена доминантных видов, обусловливающих особенности ценоза. Данные по ихтиофауне важны при оценке состояния водного объекта в целом и особенно при определении допустимых уровней загрязнения водных объектов, имеющих рыбохозяйственное значение.
В ыв од ы На основании проделанных исследований можно сделать следующие выводы. Тест на определение оптической плотности культуры хлореллы показал, что лужи и Лебедянский пруд содержат большое количество органических загрязнителей.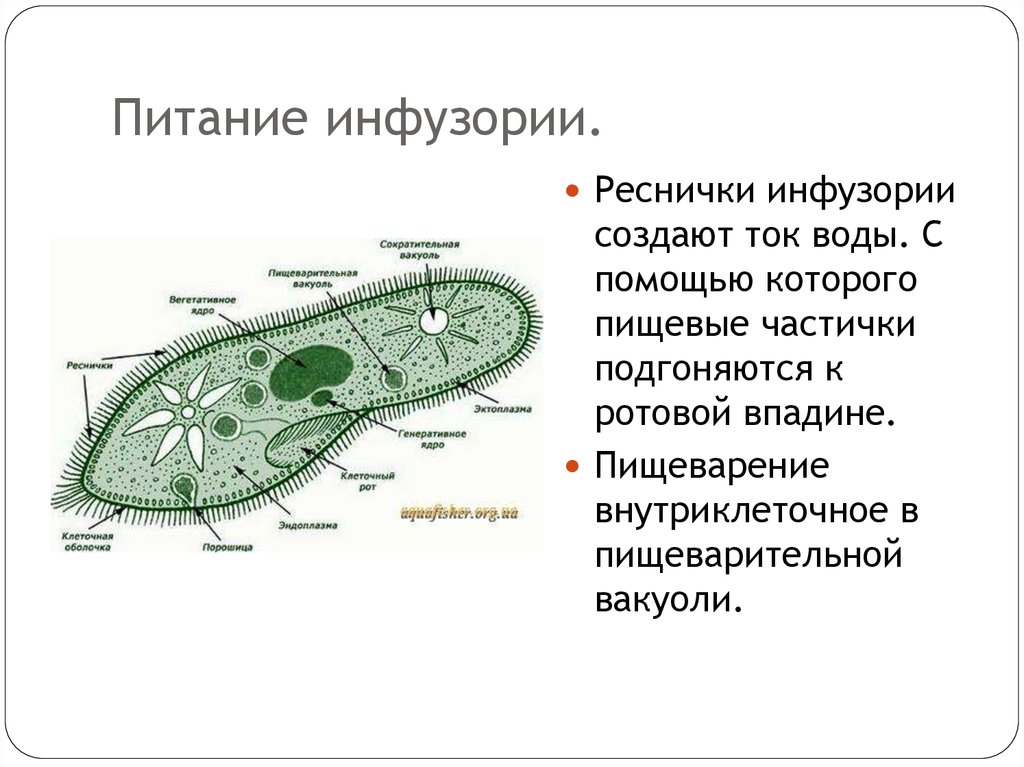 Гиперактивность хлореллы —это тоже показатель токсичности. Значит, в воде имеется повышенное содержание веществ —соединений фосфора и азота. Откуда же в водоемах берутся в таких количествах фосфор и другие биогенные элементы? Из плохо очищенных стоков, особенно коммунально-бытовых — фосфаты входят в состав многих моющих средств.
Гиперактивность хлореллы —это тоже показатель токсичности. Значит, в воде имеется повышенное содержание веществ —соединений фосфора и азота. Откуда же в водоемах берутся в таких количествах фосфор и другие биогенные элементы? Из плохо очищенных стоков, особенно коммунально-бытовых — фосфаты входят в состав многих моющих средств.
В лужах в первую очередь это разлитый бензин, продукты, образующиеся при разложении разных видов мусора. Лебедянский пруд расположен ниже уровня дороги, рядом с Большим Купавенским проездом, по которому проезжает большое количество автомобильного транспорта.
Вода смывает разлитый бензин с дорог в пруд, туда же стекают стоки практически со всего района Южное Измайлово. Таким образом, органические остатки фосфаты и азот, содержащийся в антигололедных реагентах на основе ацетата аммония, стимулируют развитие хлореллы.
В аквариуме мало кислорода или есть вещества, токсичные для водоросли хлореллы.
Инфузории-туфельки погибли в пробе воды из лужи и аквариума.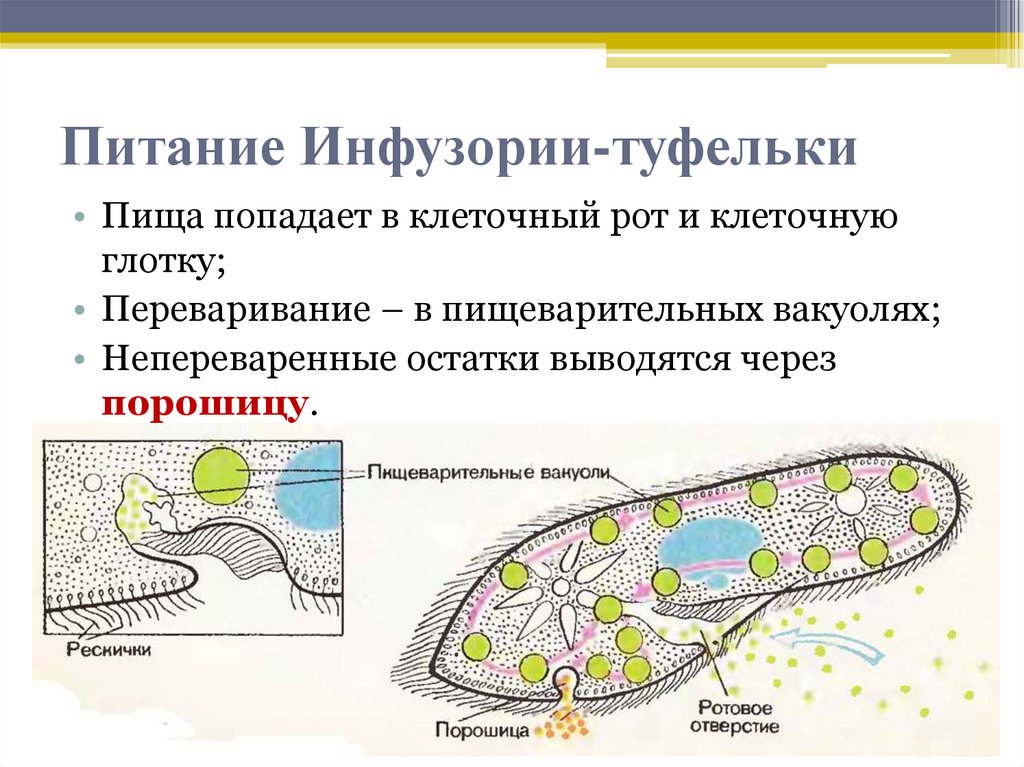 Вероятно, вода в лужах содержит избыток солей.
Вероятно, вода в лужах содержит избыток солей.
Вода в лужах всегда мутная.
Мутность воды может быть вызвана самыми разнообразными причинами —присутствием карбонатов, гидроксидов алюминия, высокомолекулярных органических примесей гумусового происхождения, появлением фитои изопланктона, а также окислением соединений железа и марганца кислородом воздуха. В лужах могут содержаться соединения кремния, свинца, мышьяка, натрия, цинка, сульфаты, хлориды, нитраты, органические соединения.
В хозяйственно-бытовых стоках определяют содержание жиров, эфироизвлекаемых веществ, общего фосфора и т. д.
Эти вещества, находясь на земной поверхности, растворяются и смешиваются с дождевой и талыми водами. На поверхность они могут попадать при строительстве зданий и площадок, из выхлопных труб машин, из промышленных и бытовых стоков.
Авторы: Юшкевич Алексей, 7 «Б»; Тевосян Артур, 7 «Б»; Лемани Полин, 9 «Б»
Руководители работы: кандидат биологических наук, учитель биологии Чернышова Ю.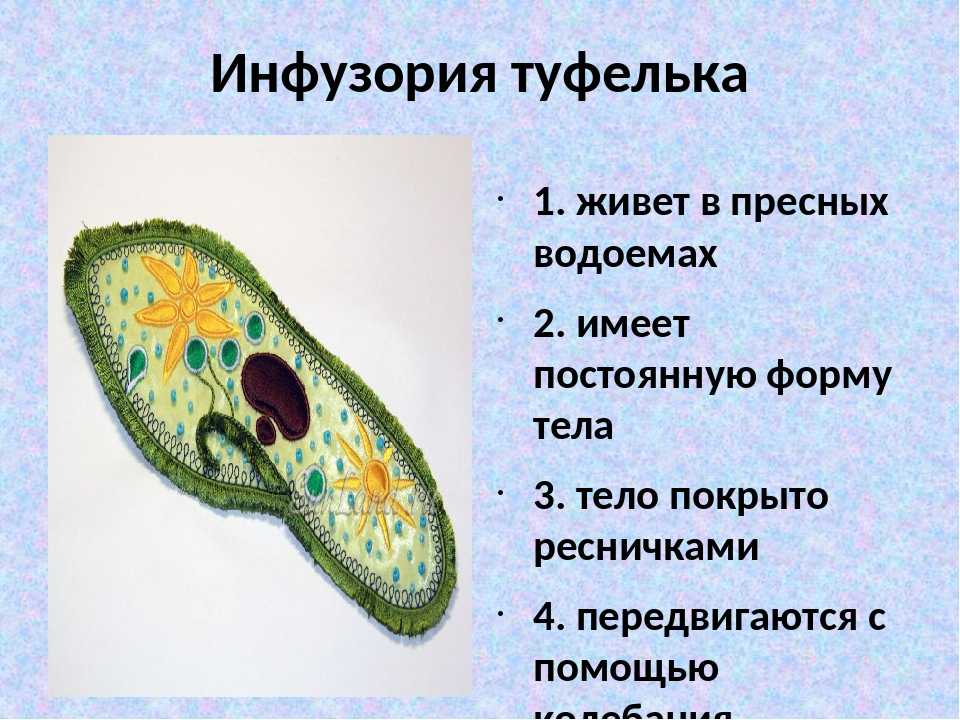 Н.; учитель биологии Алексеева Ю. Ю.; учитель географии Казакова К. С.
Н.; учитель биологии Алексеева Ю. Ю.; учитель географии Казакова К. С.
Авторы и руководители работы выражают благодарность преподавателю кафедры экологии Сельскохозяйственной академии имени К. А. Тимирязева Тимофееву Михаилу за предоставленную возможность проведения лабораторных исследований и помощь в работе.
Цель работы: изучение методики определения токсичности воды с помощью живых организмов с целью определения состояния водоемов Терлецкого и Измайловского лесопарков.
Задачи работы: определить токсичность 5 образцов воды, взятых в разных природных объектах посредством изменения оптической плотности воды, содержащей культуру хлореллы. Определить токсичность 5 образцов воды по изменению численности простейших — инфузории-туфельки. Применить полученные результаты для определения состояния водоемов Терлецкого и Измайловского лесопарков.
Стартовый корм для мальков — инфузория туфелька
Инфузория-туфелька относится к типу инфузорий (Infusoria), который насчитывает свыше 7 тысяч видов.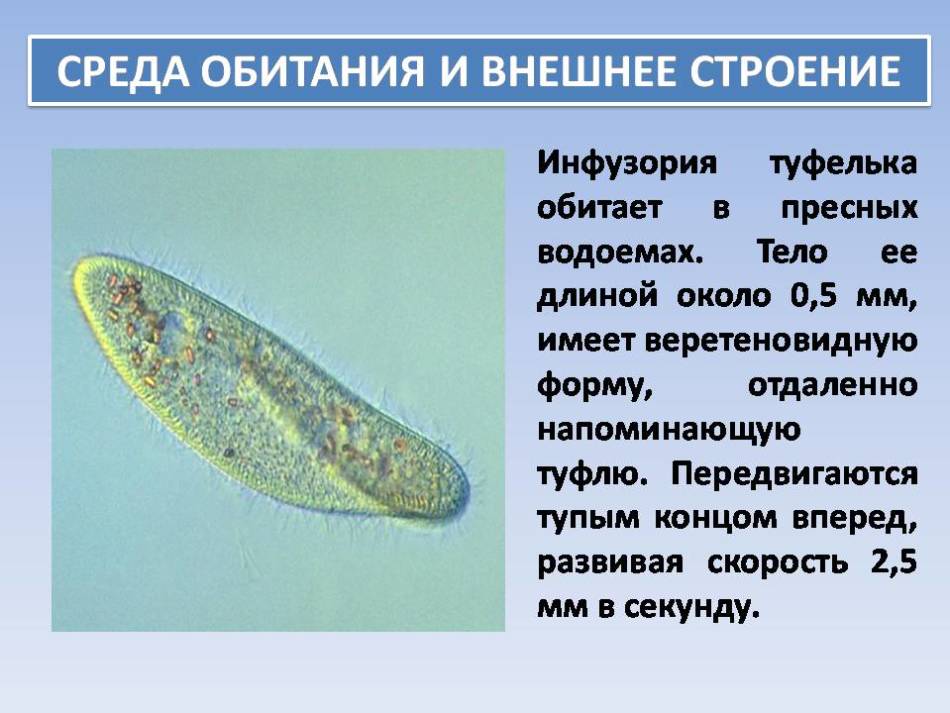 По сравнению с другими группами простейших инфузории имеют наиболее сложное строение, являясь вершиной организации одноклеточных животных. Инфузория-туфелька обитает почти во всех пресноводных водоемах и являются составной частью «пыли». Их легко можно обнаружить под микроскопом среди иловых частиц и остатков гниющих растений, взятых из аквариума.
По сравнению с другими группами простейших инфузории имеют наиболее сложное строение, являясь вершиной организации одноклеточных животных. Инфузория-туфелька обитает почти во всех пресноводных водоемах и являются составной частью «пыли». Их легко можно обнаружить под микроскопом среди иловых частиц и остатков гниющих растений, взятых из аквариума.
Среди простейших инфузории-туфельки — довольно крупные организмы, размеры которых обычно колеблются от 0,1 до 0,3 мм. Свое название инфузория-туфелька получила благодаря форме своего тела, напоминающего дамскую туфельку.
Она сохраняет постоянную форму тела благодаря тому, что наружный слой ее цитоплазмы плотный. Все тело инфузории покрыто продольными рядами многочисленных мелких ресничек, которые совершают волнообразные движения. С их помощью туфелька плавает тупым концом вперед. От переднего конца до середины тела проходит желобок с более длинными ресничками. На конце желобка имеется ротовое отверстие, ведущее в глотку. Питаются инфузории главным образом бактериями, подгоняя их ресничками ко рту.
Помимо бактерий инфузории питаются дрожжами и водорослями. При кормлении их водорослями следует избегать влияния прямого солнечного света, так как кислород, выделяемый только что съеденными водорослями, может разорвать инфузорий. Следует учитывать, что инфузории могут отфильтровывать и заглатывать любые частицы, не зависимо от их питательности. Поэтому следует избегать наличия в сосуде с инфузориями посторонних взвешенных частиц, поскольку переполнив свое ротовое отверстие посторонней взвесью, инфузории могут погибнуть.
Инфузория туфелька достаточно подвижна. Скорость ее перемещения при комнатной температуре составляет 2,0 — 2,5 мм/сек. Это большая скорость: за 1 секунду туфелька преодолевает расстояние, превышающее длину ее тела в 10- 15 раз. Это обстоятельство необходимо учитывать при выкармливании мелких, малоподвижных личинок некоторых икромечущих рыб, которые даже при высокой концентрации инфузорий могут оставаться голодными.
Это большая скорость: за 1 секунду туфелька преодолевает расстояние, превышающее длину ее тела в 10- 15 раз. Это обстоятельство необходимо учитывать при выкармливании мелких, малоподвижных личинок некоторых икромечущих рыб, которые даже при высокой концентрации инфузорий могут оставаться голодными.
Для разведения инфузорий в домашних условиях лучше использовать чистую культуру, предварительно убедившись под микроскопом в ее чистоте. При отсутствии чистой культуры ее можно получить самому. Для этого на стекло помещают несколько капель взвеси ила с растительными остатками, взятыми со дна аквариума, к которым добавляют каплю молока или крупинку соли. Рядом с ней со стороны света, капают каплю свежей отстоянной воды. Обе капли соединяют водным мостиком с помощью отточенной спички. Туфелька устремляется в сторону свежей воды и света с большей скоростью, чем все остальные микроорганизмы. Размножаются туфельки очень быстро: для достижения максимальной их концентрации в 40 тыс.
Для разведения туфельки обычно используют цельностеклянные сосуды объемом от 3 л. Хорошие результаты достигаются при комнатной температуре, но пик размножения инфузорий наблюдается при 22 — 26°С. В первые дни культивирования желательна слабая продувка, однако при этом не должен подниматься со дна банки осадок. При наличии продувки инфузории располагаются в нижней части банки, а при недостатке кислорода они устремляются к поверхности воды. Это их свойство обычно используют для концентрирования инфузорий перед скармливанием их личинкам.
В качестве корма для инфузорий можно использовать сеный настой, высушенные корки банана, тыквы, дыни, желтой брюквы, нарезанную кружками морковь, гранулы рыбьего комбикорма, молоко, сушеные листья салата, кусочки печени, дрожжи, водоросли, т.е. те субстанции, которые или непосредственно потребляются туфельками (дрожжи, водоросли), или являются субстратом для развития бактерий.
При использовании сена, его берут 10 г и помещают в 1 л воды, кипятят в течение 20 мин, затем фильтруют и разбавляют равным количеством или двумя третями отстоянной воды. Во время кипячения погибают все микроорганизмы, но сохраняются споры бактерий. Через 2 — 3 дня из спор развиваются сенные палочки, служащие пищей для инфузорий. По мере необходимости настой добавляют в культуру. Настой хранится в прохладном месте в течение месяца.
Туфельку можно разводить на сушеных листьях салата или кусочках печени, помещенных в мешочек из марли.
Кожуру спелых, неповрежденных бананов, дынь, брюквы, тыквы высушивают и хранят в сухом месте. Перед внесением в культуру берут кусочек размером 1 — 3 см, ополаскивают и заливают 1 л воды. Гидролизные дрожжи вносят из расчета 1 г на 100 литров. Наиболее простым способом является разведение туфелек на снятом, кипяченом или сгущенном (без сахара) молоке: его вносят в культуру 1 — 2 капли на 1 л) один раз в неделю.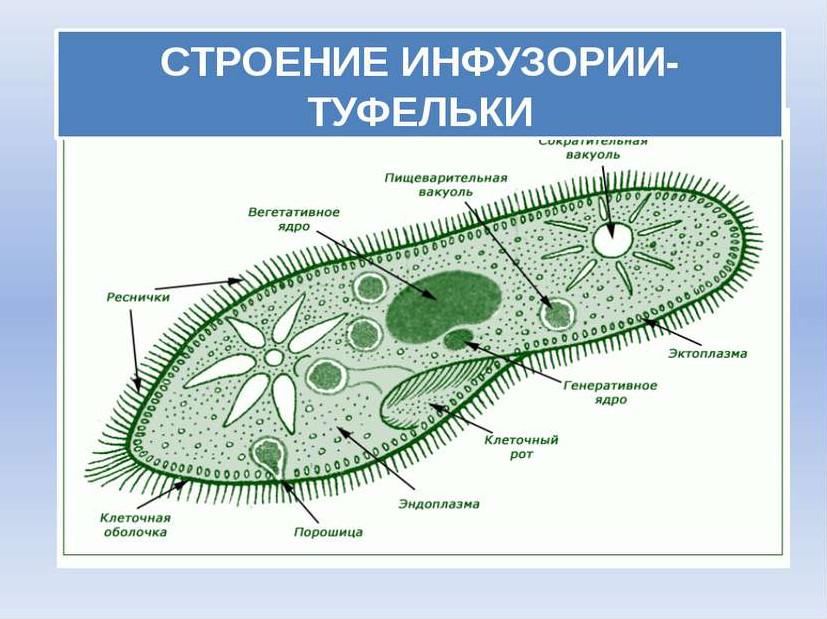 Туфельки используют молочнокислых бактерий.
Туфельки используют молочнокислых бактерий.
При использовании вышеуказанных кормов важно не передозировать питание. В противном случае быстро размножающиеся бактерии оставят инфузорий без кислорода. При выращивании инфузории на бактериях они обладают положительным фототаксисом, т.е. стремятся к свету. Можно разводить инфузорий на водорослях сценедесмусе и хлорелле. Хороших результатов можно добиться при культивировании инфузорий со слабой продувкой, когда на 1 л водорослей вносится 1 гранула карпового комбикорма. Инфузории, накормленные водорослями, обладают отрицательным фототаксисом: они стремятся в темноту. Это их свойство можно использовать при выкармливании тенелюбивых личинок рыб. Используют культуру инфузорий, как правило, не дольше 20 дней. Для постоянного поддержания культуры ее заряжают в двух банках с интервалом в неделю, при этом каждую банку перезаряжают каждые две недели. Для длительного хранения культуры инфузорий, ее помещают в холодильник и хранят при температуре + 3°- + 10°С.
Сбор инфузорий производят в местах наивысшей их концентрации с помощью резинового шланга. Концентрировать инфузорий можно при помощи аккуратного внесения в культуру солевого раствора, который, опускаясь на дно банки, заставляет инфузорий концентрироваться у поверхности. Более простой способ сбора инфузорий заключается во внесении в культуру молока с одновременным отключением продувки. Через 2 часа инфузории концентрируются у поверхности с освещенной стороны банки.
Особенно хороших результатов можно добиться, если культуру поместить в цилиндр, добавив в него молоко и соль. В этом случае на поверхность жидкости кладут вату и затем на вату осторожно доливают свежую воду, при этом верхнюю часть цилиндра освещают. Через полчаса большинство туфелек перемещается в свежую воду и эту воду с инфузориями переносят в сосуд с личинками рыб.
Способ постоянного поступления инфузорий в аквариумДля выкармливания многих харациновых и ряда других рыб, личинки которых не выносят присутствия бактерий, инфузорий в чистой воде выдерживают сутки-двое.