Колониальные жгутиконосцы — Студопедия
Поделись
Тема: Жгутиконосцы. Инфузории.
Жгутиконосцы — одноклеточные организмы, органоидами движения которых служат длинные выросты, называемые жгутиками. Число жгутиков у разных видов разное — от одного до нескольких сотен. Большинство жгутиковых имеют постоянную форму тела, поскольку оно покрыто тонкой и эластичной оболочкой — пелликулой.
Пелликула — наружный плотный слой цитоплазмы, обеспечивающий сохранение постоянной формы клетки.
Эвглена зелёная
Эвглена зелёная распространена в пресноводных водоёмах. В передней части её клетки имеется один жгутик, а около жгутика расположены: сократительная вакуоль, которая выводит излишек воды из организма, и ярко-красный светочувствительный глазок — стигма, который воспринимает изменения освещённости.
- Ближе к задней части клетки располагается ядро.
- В цитоплазме эвглены содержатся хлоропласты, заполненные хлорофиллом.

- Питание
Эвглена способна изменять свой характер питания в зависимости от условий окружающей среды. На свету она питается автотрофно, а в темноте — гетеротрофно (поедает частицы органических веществ, мелких животных, одноклеточные водоросли). Такой тип питания называется миксотрофный (смешанный).
- Эвглена зелёная обладает положительным фототаксисом – движение к свету.
- Выделение
Через сократительную вакуоль вредные вещества (продукты распада) и избыток воды выводятся наружу.
- Дыхание
Эвглена дышит кислородом, растворённым в воде. Газообмен происходит, как и у амёбы, через всю поверхность тела.
- Размножение
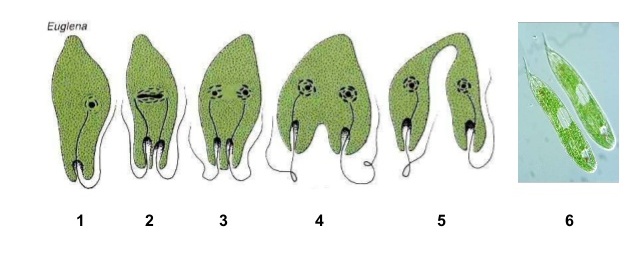
Размножается эвглена зелёная продольным делением надвое:
Колониальные жгутиконосцы
Тела колониальных жгутиконосцев состоят из многих клеток.
Вольвокс представляет собой крупную шарообразную колонию диаметром около 8 мм, на поверхности которой в один слой располагаются клетки, соединённые цитоплазматическими «мостиками», а внутренняя полость шара занята жидкой слизью.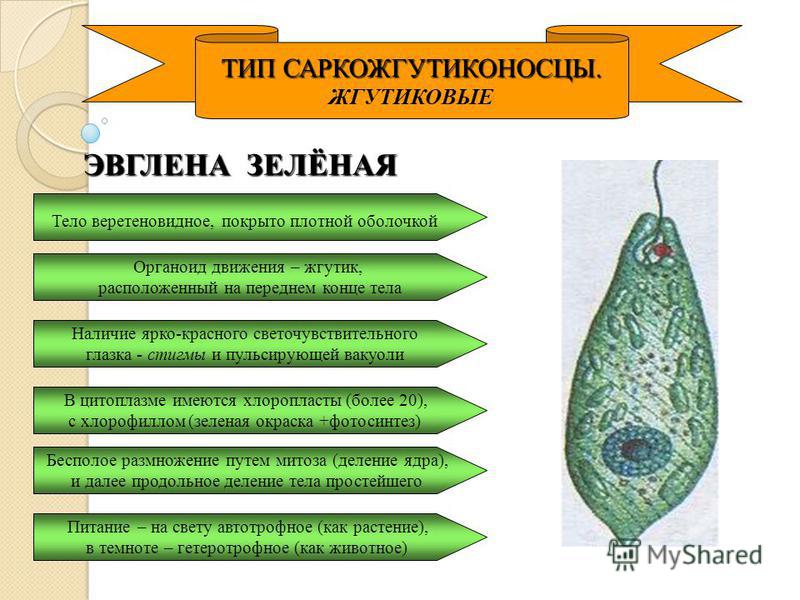 Клетки имеют жгутики, обращённые наружу.
Клетки имеют жгутики, обращённые наружу.
Тип Инфузории
Представители Типа Инфузории, или Ресничные — наиболее высокоорганизованные простейшие животные.
Характерные особенности инфузорий:
- на поверхности тела у них имеются реснички (органы передвижения), которые находятся в постоянном движении, что обеспечивает быстрое перемещение инфузорий.
- В клетке инфузорий два ядра, разных по размеру и функциям. Большое (вегетативное) ядро — макронуклеус — отвечает за питание, дыхание, движение, обмен веществ; малое (генеративное) ядро — микронуклеус — участвует в половом процессе.
Инфузория туфелька
В тех же водоёмах, где живут амёба протей и эвглена зелёная, встречается и это одноклеточное животное длиной 0,5 мм с формой тела, напоминающей туфельку — инфузория туфелька.
- Передвижение
Инфузории-туфельки быстро плавают тупым концом вперёд, передвигаясь при помощи ресничек.
- Питание
На теле инфузории имеется углубление — клеточный рот, который переходит в клеточную глотку. Около рта располагаются более крупные реснички. Они загоняют в глотку вместе с потоком воды бактерий — основную пищу туфельки. На дне глотки формируется пищеварительная вакуоль, в которую попадает пища. Пищеварительные вакуоли перемещаются в теле инфузории током цитоплазмы. В пищеварительной вакуоли происходит переваривание пищи, переваренные продукты поступают в цитоплазму и используются для жизнедеятельности инфузории.
- Оставшиеся в пищеварительной вакуоли непереваренные остатки выбрасываются наружу через особую структуру в заднем конце тела — порошицу.
- Выделение
В организме инфузории-туфельки находятся две сократительные вакуоли, которые располагаются у переднего и заднего концов тела.
Каждая вакуоль состоит из центрального резервуара и 5–7 направленных к этим резервуарам каналов. Весь цикл сокращения этих вакуолей проходит один раз за 10–20 секунд: сначала заполняются жидкостью каналы, потом она попадает в центральный резервуар, а затем жидкость изгоняется наружу.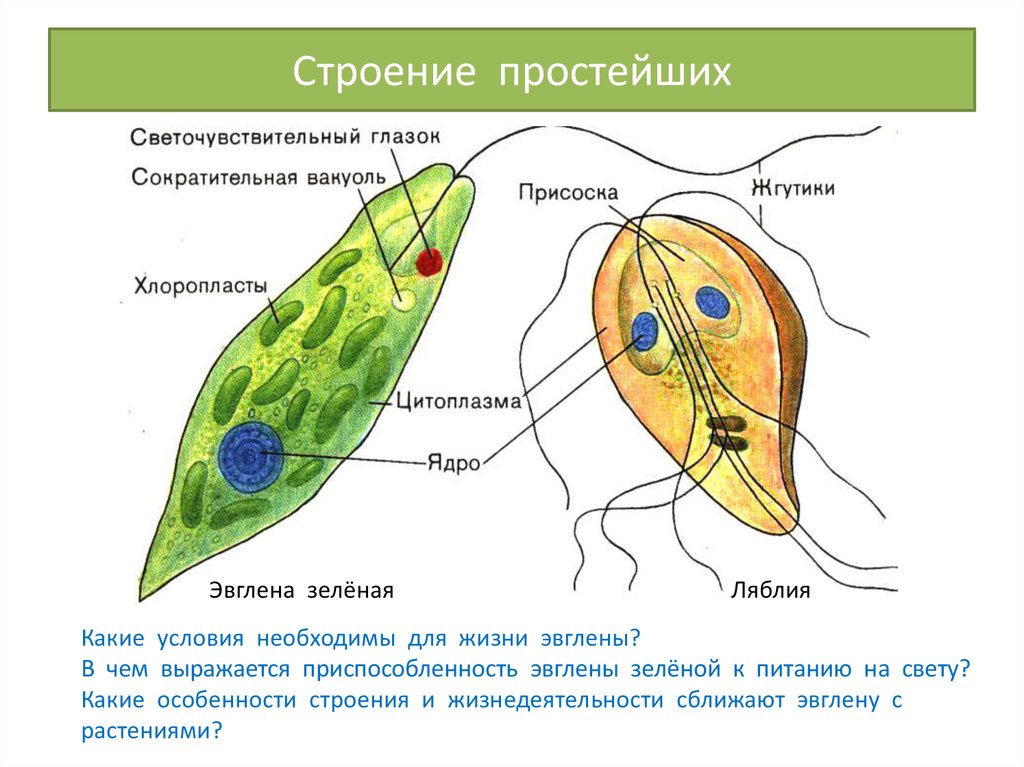
· Дыхание
Как и у других свободноживущих одноклеточных животных, у инфузорий дыхание происходит через покровы тела.
· Бесполое размножение
Инфузории-туфельки обычно размножаются бесполым путём — делением надвое. Однако, в отличие от жгутиковых, инфузории делятся поперёк тела: посреди тела инфузории образуется перетяжка и, таким образом, из одной клетки образуются две.
Инфузории-туфельки делятся один-два раза в сутки.
Половой процесс
Ядра делятся на две части, и в каждой новой инфузории оказывается по одному большому и по одному малому ядру. Каждая из двух дочерних инфузорий получает часть органоидов, а другие образуются заново.
Половой процесс инфузории туфельки называется конъюгацией. Он происходит в несколько стадий.
Конъюгация — половой процесс одноклеточных животных, при котором те обмениваются своим наследственным материалом.
Класс жгутиконосцы
Содержание:
- Одиночные жгутиконосцы
- Колониальные жгутиконосцы
Жгутиконосцы (или жгутиковые) — широко распространенные простейшие, у которых имеются органоиды движения в виде жгутиков. В настоящее время известно около 6-8 тыс. видов одиночных и колониальных форм, населяющих морские и речные водоемы, где они являются главным образом составной частью планктона. Среди жгутиконосцев многие виды паразитируют в тканях растений и особенно в организме различных беспозвоночных и позвоночных животных, включая и человека. Часть из них вызывает тяжелые заболевания у человека (сонную болезнь, пендинскую язву, холецистит), а также у крупного рогатого скота (нагану, сурру).
В настоящее время известно около 6-8 тыс. видов одиночных и колониальных форм, населяющих морские и речные водоемы, где они являются главным образом составной частью планктона. Среди жгутиконосцев многие виды паразитируют в тканях растений и особенно в организме различных беспозвоночных и позвоночных животных, включая и человека. Часть из них вызывает тяжелые заболевания у человека (сонную болезнь, пендинскую язву, холецистит), а также у крупного рогатого скота (нагану, сурру).
Некоторые свободноживущие жгутиконосцы занимают промежуточное положение между растительными и животными организмами, сочетая в себе признаки тех и других. Вот почему часть жгутиконосцев составляет предмет изучения ботаников, а другая часть интересует зоологов. Все жгутиконосцы, в отличие от саркодовых, обладают плотной оболочкой (пелликулой), которая придает им постоянную форму тела. Вместо ложноножек у них появились особые органеллы движения — жгутики (один, два или много — в зависимости от вида). Однако между этими классами простейших существует родственная связь, на что указывает наличие в природе таких форм, у которых сочетаются признаки саркодовых (ложноножки) и жгутиконосцев (жгутики). К ним относится, например, живущая в болотной воде жгутиковая амеба.
К ним относится, например, живущая в болотной воде жгутиковая амеба.
Кроме органоидов движения часть жгутиконосцев имеет еще один органоид — глазок, или стигму. Он помещается обычно у основания жгутика. Этот светочувствительный аппарат воспринимает световые раздражения и определяет направление движении животного в сторону источника спета.
Одиночные жгутиконосцы
Одиночные жгутиконосцы — эвглены. Описанная в школьном учебнике зоологии эвглона золеная принадлежит к числу одиночных жгутиконосцев. Это — один из видов рода эвглеп, живущих в наших пресных водоемах. Она относится к жгутиконосцам промежуточного тина и может рассматриваться как простейшее, находящееся на грани между растительным и животным миром, подтверждая своим существованием общность происхождения этих двух ветвей органической жизни.
Под микроскопом эвглены выглядят как маленькие вытянутые в длину тельца размером около 50 мк (или 0,05 мм). Хорошо видно поступательное, с легким покачиванием вращательное движение, которое зависит от работы жгутика, как бы ввинчивающегося в воду.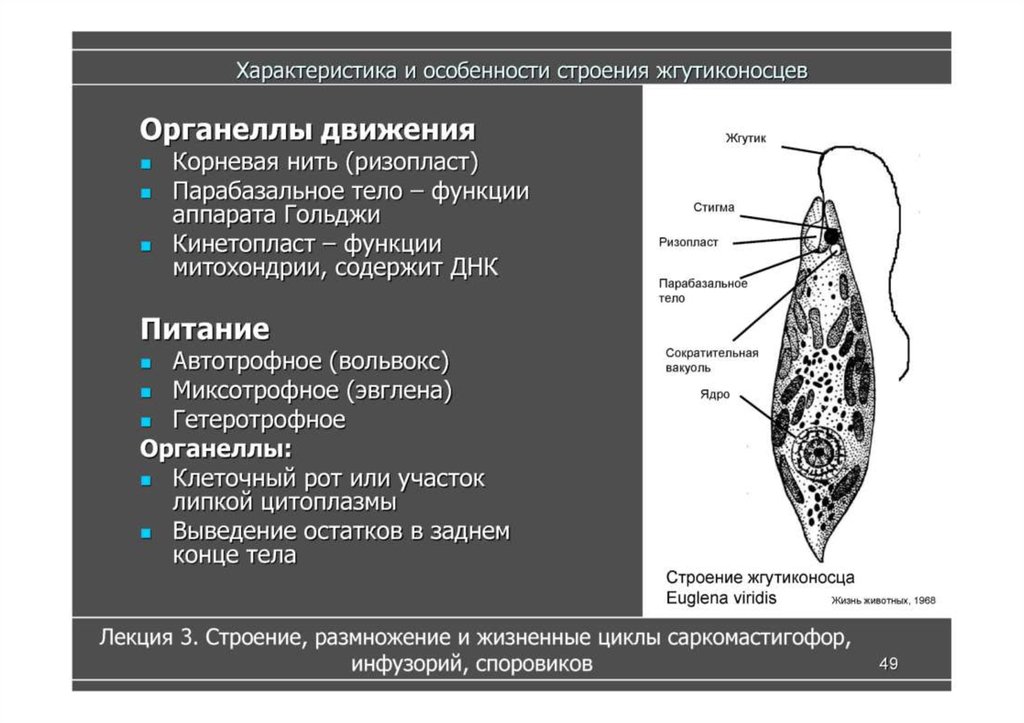 Иногда можно заметить на переднем тупом конце красное пятнышко — стигму. Подробности строения эвглены следует рассматривать при большом увеличении. Жгутик становится хорошо заметным после добавления капли йодной настойки, которая убивает живых эвглен и окрашивает их в темно-бурый цвет.
Иногда можно заметить на переднем тупом конце красное пятнышко — стигму. Подробности строения эвглены следует рассматривать при большом увеличении. Жгутик становится хорошо заметным после добавления капли йодной настойки, которая убивает живых эвглен и окрашивает их в темно-бурый цвет.
Эвглена зеленая служит хорошим показателем степени биологической очистки сточных вод. Ее численность в планктоне контактных прудов сильно возрастает при снижении бактериальных загрязнений. Так, например, при полной очистке воды количество эвглен в 1 мл равно 18,9 тыс. при общей численности простейших в том же объеме в 22 тыс. Таким образом, качество воды в водоемах определяется не только наличием или отсутствием организма-индикатора, но и его количеством в единице объема.
Кроме эвглены зеленой, в пробе воды могут оказаться и другие виды эвглен, на которых следует обратить внимание учащихся. Так, например, эвглена акус имеет сильно вытянутое, более узкое и заостренное на обоих концах тело. В отличие от эвглены зеленой акус не может сокращаться и сохраняет постоянные очертания. Почти в два раза крупнее эвглены зеленой — эвглена спирогира, у которой пелликула имеет спиральные ряды утолщений, идущих вдоль удлиненного и несколько изогнутого тела. Примерно такой же величины (до 100 мк) достигает эвглена оксиурис, имеющая вид тонкой колбаски с острым и узким кончиком задней части тела. Из других свободноживущих жгутиконосцев могут попадаться особи из рода факус по форме, напоминающие сердце (с хвостиком). Так же как и эвглены, факусы имеют зеленые хроматофоры. Отличаются медленным движением. Размеры тела около 0,5 мм.
Почти в два раза крупнее эвглены зеленой — эвглена спирогира, у которой пелликула имеет спиральные ряды утолщений, идущих вдоль удлиненного и несколько изогнутого тела. Примерно такой же величины (до 100 мк) достигает эвглена оксиурис, имеющая вид тонкой колбаски с острым и узким кончиком задней части тела. Из других свободноживущих жгутиконосцев могут попадаться особи из рода факус по форме, напоминающие сердце (с хвостиком). Так же как и эвглены, факусы имеют зеленые хроматофоры. Отличаются медленным движением. Размеры тела около 0,5 мм.
Ознакомление учащихся с многообразием форм свободноживущих жгутиконосцев позволяет коснуться вопроса дивергентной эволюции.
В качестве примера паразитического жгутиконосца самым удобным объектом может служить лягушачья опалина.
Колониальные жгутиконосцы
Колониальные жгутиконосцы — вольвоксы. Общим для всех колониальных жгутиконосцев является то, что каждый из них состоит из особей, тождественных по своему строению с одноклеточными водорослями — хламидомонадами.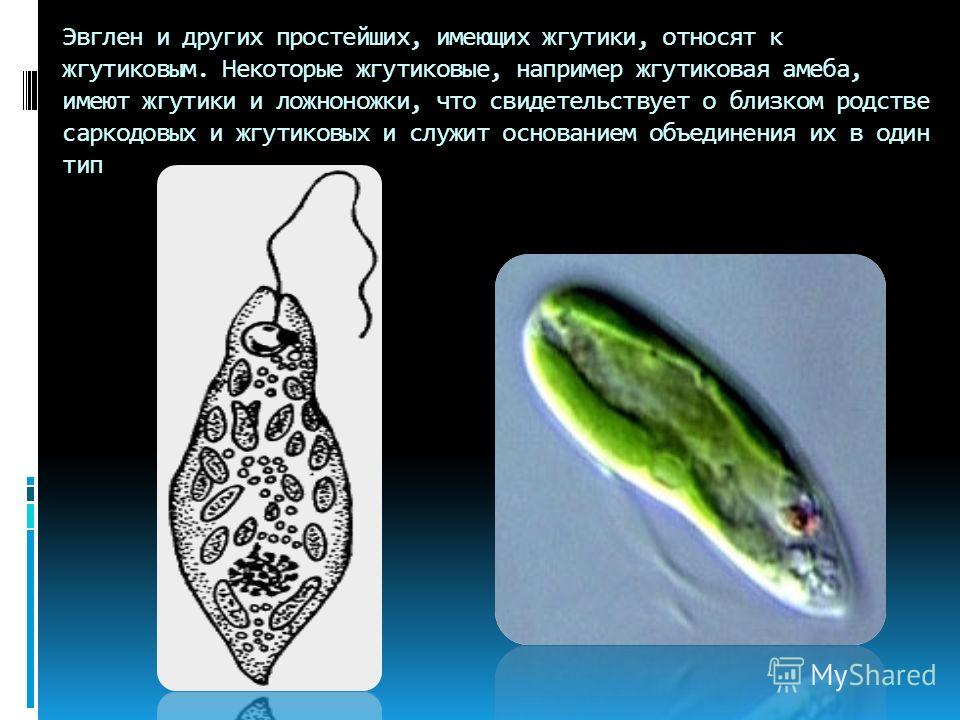 Следовательно, они имеют по 2 жгутика, красный глазок — стигму, зеленые хроматофоры и т. д. Различия заключаются лишь в числе особей, входящих в колонию, в их взаимном расположении и в общей конфигурации всей колонии в целом. Колониальные жгутиковые разной степени сложности массами населяют наши стоячие водоемы весной в период так называемого «цветения» воды. Если взять пробу этой воды, то в ней можно обнаружить необходимый для работы живой материал.
Следовательно, они имеют по 2 жгутика, красный глазок — стигму, зеленые хроматофоры и т. д. Различия заключаются лишь в числе особей, входящих в колонию, в их взаимном расположении и в общей конфигурации всей колонии в целом. Колониальные жгутиковые разной степени сложности массами населяют наши стоячие водоемы весной в период так называемого «цветения» воды. Если взять пробу этой воды, то в ней можно обнаружить необходимый для работы живой материал.
Кратко охарактеризован лишь один представитель колониальных жгутиконосцев из числа более сложных, а именно вольвокс авреус. Он встречается чаще других видов вольвоксов, образуя колонию диаметром до 850 мк, состоящую из очень большого количества особей, между которыми существует разделение функций. Большинство клеток при помощи согласованных движений жгутиков осуществляет перемещение всей колонии в воде, они не способны делиться. Функцию размножения несут другие клетки, в результате деления которых образуются бесполым путем молодые колонии.
Помимо вегетативного размножения у вольвоксов наблюдается и половой процесс. Внутри колонии вольвокса формируются микрогаметы и макрогаметы. После образования зигот шары вольвокса распадаются, а новые шары возникают уже из зигот. Таким образом, вольвоксы как бы приближаются к многоклеточным организмам тем, что образуют два рода клеток — обычных, выполняющих только функции передвижения и питания (автотрофного) и клеток с функцией размножения (бесполого и полового). Однако у вольвокса нет настоящих тканей с дифференцированными клетками, которые свойственны многоклеточным организмам.
Крупные формы вольвоксов можно рассматривать под микроскопом при малом увеличении без покровного стекла. Следует обратить внимание учащихся на перекатывающееся движение колонии за счет биения жгутиков многочисленных клеток, связанных друг с другом протоплазматическими мостиками. Клетки располагаются по периферии шара, имеющего плотную оболочку, которая придает определенную форму всей колонии и окружает более жидкую внутреннюю студенистую массу.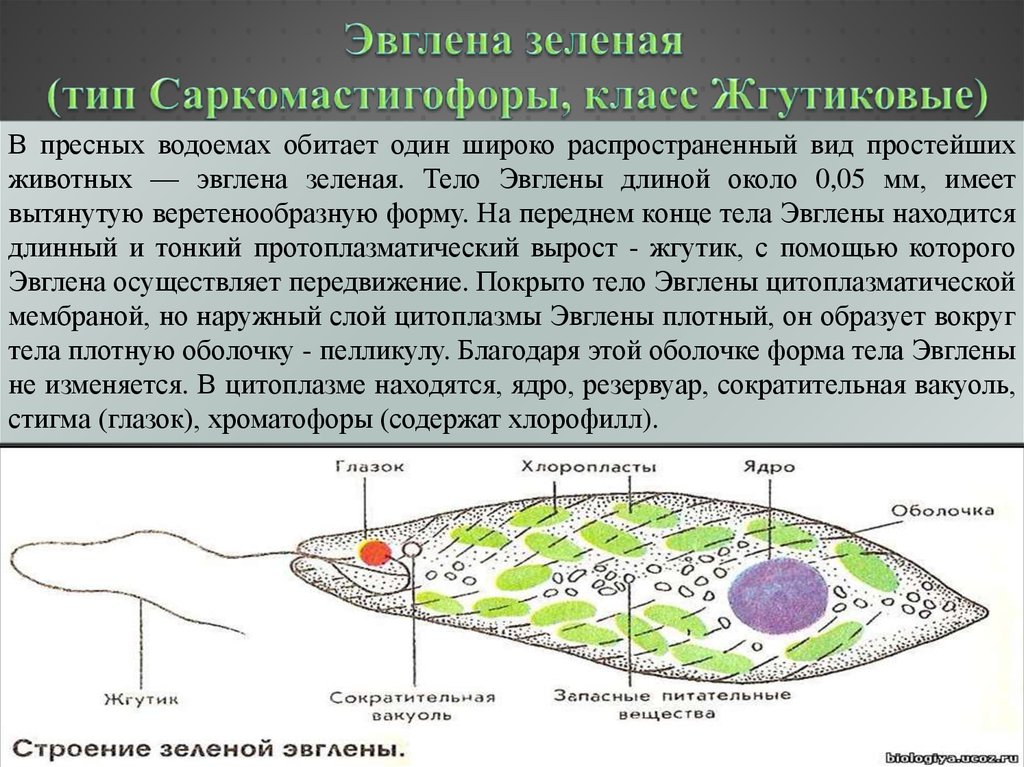 Внутри некоторых колоний можно рассмотреть образовавшиеся в них дочерние колонии (лучше при большом увеличении).
Внутри некоторых колоний можно рассмотреть образовавшиеся в них дочерние колонии (лучше при большом увеличении).
У вольвокса легко наблюдать положительный фототаксис. Для этого достаточно часовое стекло с жидкостью, в которой плавают вольвоксы, поместить около окна. Вскоре можно заметить скопление вольвоксов на стороне, обращенной к окну. Если повернуть стекло па 180°, то вольвоксы переплывут к тому краю стекла, па который падает свет от окна. То же наблюдается при освещении электролампой — вольвоксы перемещаются в более освещенную зону.
Открыт хищный родственник красных водорослей • Сергей Ястребов • Новости науки на «Элементах» • Микробиология, Альгология, Систематика, Эволюция
Не дело философа определять, как далеко простирается царство растений и где начинается класс животных или где начинается жизнь. Это проблемы, относящиеся к отдельным наукам. Скорее всего, до самого конца мира мы так и не узнаем, где в точности проходят эти границы.
Стефан Свежавски, «Святой Фома, прочитанный заново»
Описан новый род одноклеточных организмов, которые являются ближайшими родственниками красных водорослей, но совершенно не похожи на них по образу жизни: это хищные жгутиконосцы, успевшие вторично утратить способность к фотосинтезу. По всей вероятности, это означает, что общие предки красных водорослей и зеленых растений были одноклеточными хищниками, которые даже после приобретения хлоропластов долго сохраняли смешанный тип питания (хищничество + фотосинтез). Жгутиконосец Rhodelphis — это дожившее до наших дней одноклеточное хищное растение.
По всей вероятности, это означает, что общие предки красных водорослей и зеленых растений были одноклеточными хищниками, которые даже после приобретения хлоропластов долго сохраняли смешанный тип питания (хищничество + фотосинтез). Жгутиконосец Rhodelphis — это дожившее до наших дней одноклеточное хищное растение.
30 мая 2019 года безвременно, в возрасте всего лишь 66 лет, умер известный российский биолог Александр Петрович Мыльников. Доктор наук, сотрудник Института биологии внутренних вод имени И. Д. Папанина (ИБВВ РАН), он был одним из крупнейших современных протистологов. Мыльников прославился как мастер электронной микроскопии и сделал много открытий, серьезно прояснивших наши представления об эволюции одноклеточных организмов. Установленные им факты уже давно вошли в университетские курсы. Мыльников был очень активным исследователем, признанным во всем мире (см. его страницу на
 В числе ее авторов есть и другие известные протистологи, например сотрудник ИБВВ Денис Викторович Тихоненков и канадский профессор Патрик Килинг (Patrick Jonhn Keeling). Эта работа посвящена описанию удивительного одноклеточного организма, устройство которого позволяет нам узнать кое-что новое об истоках эволюции растений (рис. 1).
В числе ее авторов есть и другие известные протистологи, например сотрудник ИБВВ Денис Викторович Тихоненков и канадский профессор Патрик Килинг (Patrick Jonhn Keeling). Эта работа посвящена описанию удивительного одноклеточного организма, устройство которого позволяет нам узнать кое-что новое об истоках эволюции растений (рис. 1). Клетки в клетках
В последние два с лишним миллиарда лет облик жизни на Земле определяют в основном эукариоты, обладатели сложных клеток с ядрами. К ним относятся животные, растения, грибы и многочисленные одноклеточные существа, которых собирательно называют протистами. Отличие сложной эукариотной клетки от простой прокариотной огромно: не вдаваясь сейчас в детали, вполне можно сказать, что это принципиально разные уровни организации живой материи. Понятно, что проблема становления эукариот очень важна для эволюционной биологии.
Основой для ответа на вопрос «откуда взялись эукариоты?» является симбиогенетическая теория, согласно которой эукариотная клетка возникла в результате взаимовыгодного объединения (симбиоза) двух или нескольких прокариот. Принципиально важно, что при этом происходило вселение одних клеток в другие (эндосимбиоз). Эту теорию нельзя назвать новой: она сформировалась на рубеже XIX–XX веков, после долгого периода забвения возродилась в 1960-х благодаря Линн Маргулис (Lynn Margulis), а на русском языке её современную версию впервые изложил еще в 1973 году Армен Леонович Тахтаджян (А. Л. Тахтаджян, 1973. Четыре царства органического мира (DjVu, 6 Мб)). Молекулярная биология подтверждает симбиогенетическую теорию настолько однозначно, что споры о её верности или неверности давно прекратились. Иное дело — как конкретно всё это происходило. Поток данных, добываемых современными биологами, порождает множество вопросов на эту тему, и исследователи планомерно ищут ответы на них.
Принципиально важно, что при этом происходило вселение одних клеток в другие (эндосимбиоз). Эту теорию нельзя назвать новой: она сформировалась на рубеже XIX–XX веков, после долгого периода забвения возродилась в 1960-х благодаря Линн Маргулис (Lynn Margulis), а на русском языке её современную версию впервые изложил еще в 1973 году Армен Леонович Тахтаджян (А. Л. Тахтаджян, 1973. Четыре царства органического мира (DjVu, 6 Мб)). Молекулярная биология подтверждает симбиогенетическую теорию настолько однозначно, что споры о её верности или неверности давно прекратились. Иное дело — как конкретно всё это происходило. Поток данных, добываемых современными биологами, порождает множество вопросов на эту тему, и исследователи планомерно ищут ответы на них.
У эукариот есть два типа внутриклеточных структур (органелл), которые точно имеют симбиотическое происхождение, то есть являются бывшими бактериями. Это митохондрии, обеспечивающие дыхание, и хлоропласты, обеспечивающие фотосинтез. В наши дни никто из серьезных биологов не сомневается, что эти органеллы возникли эндосимбиотически. Симбиоз с предками митохондрий начался очень давно, на заре становления эукариот. Есть все основания считать, что у общего предка всех современных эукариот митохондрии уже были (см. Теория симбиогенеза 50 лет спустя: параллельной эукариотизации, скорее всего, не было, «Элементы», 22.11.2017). Сейчас на наших глазах идут оживленные дискуссии о том, в какой именно момент и по какому сценарию предок эукариот, который сам был не бактерией, а археей, вступил в симбиоз с предком митохондрий (см. Генеалогия белков свидетельствует о позднем приобретении митохондрий предками эукариот, «Элементы», 08.02.2016). Но в любом случае это было до того, как сложились «нормальные» эукариотные клетки, знакомые нам из современной живой природы. В общем, союз с митохондриями по большому счету относится скорее к предыстории эукариот.
Симбиоз с предками митохондрий начался очень давно, на заре становления эукариот. Есть все основания считать, что у общего предка всех современных эукариот митохондрии уже были (см. Теория симбиогенеза 50 лет спустя: параллельной эукариотизации, скорее всего, не было, «Элементы», 22.11.2017). Сейчас на наших глазах идут оживленные дискуссии о том, в какой именно момент и по какому сценарию предок эукариот, который сам был не бактерией, а археей, вступил в симбиоз с предком митохондрий (см. Генеалогия белков свидетельствует о позднем приобретении митохондрий предками эукариот, «Элементы», 08.02.2016). Но в любом случае это было до того, как сложились «нормальные» эукариотные клетки, знакомые нам из современной живой природы. В общем, союз с митохондриями по большому счету относится скорее к предыстории эукариот.
С хлоропластами дело обстоит совсем иначе. Во-первых, они есть далеко не у всех эукариот: многие современные группы (в том числе и та, к которой относится человек) не имели их никогда.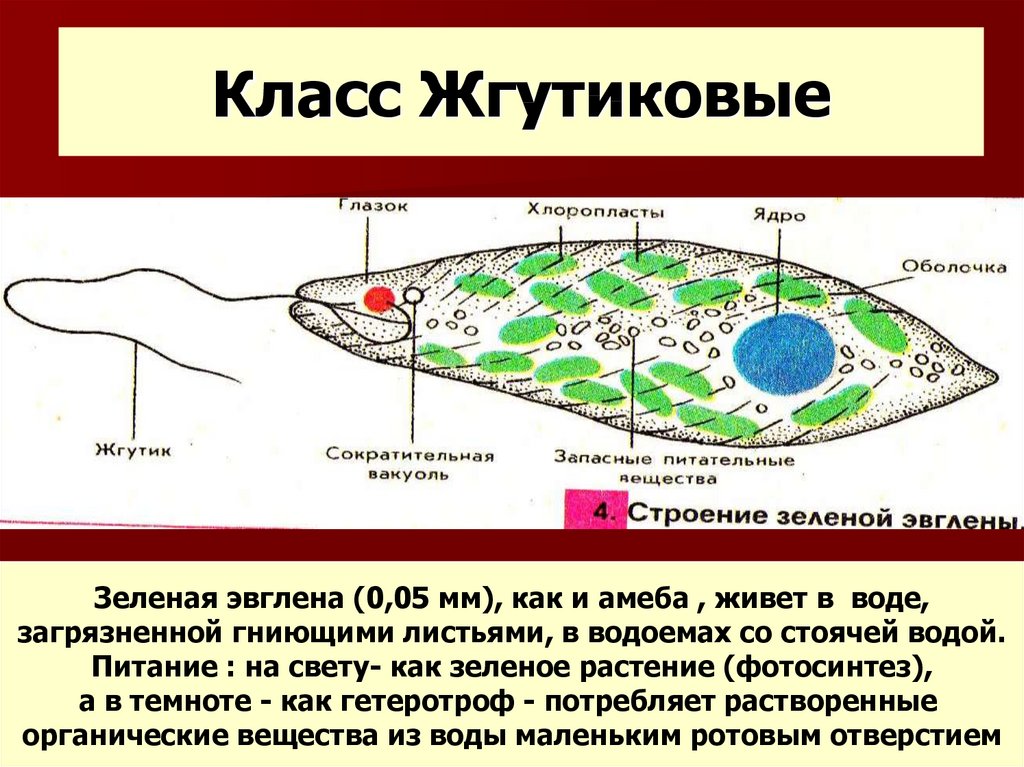 Во-вторых, в отличие от приобретения митохондрий, которое, по-видимому, было уникальным и неповторимым событием, приобретение хлоропластов совершенно точно происходило много раз. Хлоропласты имеют богатейшую историю, насыщенную неожиданными явлениями (см., например: P. J. Keeling, 2013. The number, speed, and impact of plastid endosymbioses in eukaryotic evolution; рис. 2). Тому, кто захочет разобраться в ней детально, можно посоветовать сначала взглянуть на современную версию эволюционного древа эукариот (её беглое описание можно найти, например, в статье: Случайно открытый жгутиконосец обновляет систему эукариот, «Элементы», 06.02.2019). Здесь же достаточно сказать, что это древо включает в себя от 6 до 10 (в зависимости от способа подсчета) крупных ветвей, ни одна из которых — увы — не соответствует традиционным царствам животных, растений или грибов. Хорошо это или плохо, но система живой природы, знакомая нам из учебников XX века, ушла в прошлое безвозвратно. Крупные эволюционные ветви эукариот, приблизительно соответствующие по значению классическим царствам, сейчас принято называть супергруппами (supergroup).
Во-вторых, в отличие от приобретения митохондрий, которое, по-видимому, было уникальным и неповторимым событием, приобретение хлоропластов совершенно точно происходило много раз. Хлоропласты имеют богатейшую историю, насыщенную неожиданными явлениями (см., например: P. J. Keeling, 2013. The number, speed, and impact of plastid endosymbioses in eukaryotic evolution; рис. 2). Тому, кто захочет разобраться в ней детально, можно посоветовать сначала взглянуть на современную версию эволюционного древа эукариот (её беглое описание можно найти, например, в статье: Случайно открытый жгутиконосец обновляет систему эукариот, «Элементы», 06.02.2019). Здесь же достаточно сказать, что это древо включает в себя от 6 до 10 (в зависимости от способа подсчета) крупных ветвей, ни одна из которых — увы — не соответствует традиционным царствам животных, растений или грибов. Хорошо это или плохо, но система живой природы, знакомая нам из учебников XX века, ушла в прошлое безвозвратно. Крупные эволюционные ветви эукариот, приблизительно соответствующие по значению классическим царствам, сейчас принято называть супергруппами (supergroup).
Краткая история хлоропластов
Итак, предками всех хлоропластов в конечном счете являются цианобактерии, прокариотные организмы, более известные как синезеленые водоросли. Наша история началась с того, что некий жгутиконосец поглотил цианобактерию, которая превратилась в хлоропласт. Потомки этого жгутиконосца разделились на три эволюционные ветви: микроскопические глаукофитовые водоросли, красные водоросли и зеленые растения (см. рис. 3). Все вместе они образуют супергруппу Archaeplastida. Именно с возникновения эволюционного ствола архепластид началась история фотосинтезирующих эукариот. Другое название этой супергруппы — Plantae, что значит попросту «растения». Здесь и далее мы будем использовать названия «архепластиды» и «растения» как синонимы.
Цианобактерии относятся к грамотрицательным бактериям, главная особенность которых состоит в уникальном строении клеточной оболочки. Любая грамотрицательная бактерия имеет две настоящие клеточные мембраны — внутреннюю и наружную.
Но это — только часть разнообразия хлоропластов. Другая часть, причем с некоторой точки зрения гораздо более значительная, образуется вот как: хищный эукариот поглощает другого эукариота, внутри которого уже есть первичный хлоропласт, и заставляет этого эукариота в свою очередь работать хлоропластом. Такие хлоропласты называются вторичными. В одних случаях они возникли из зеленых водорослей, в других — из красных.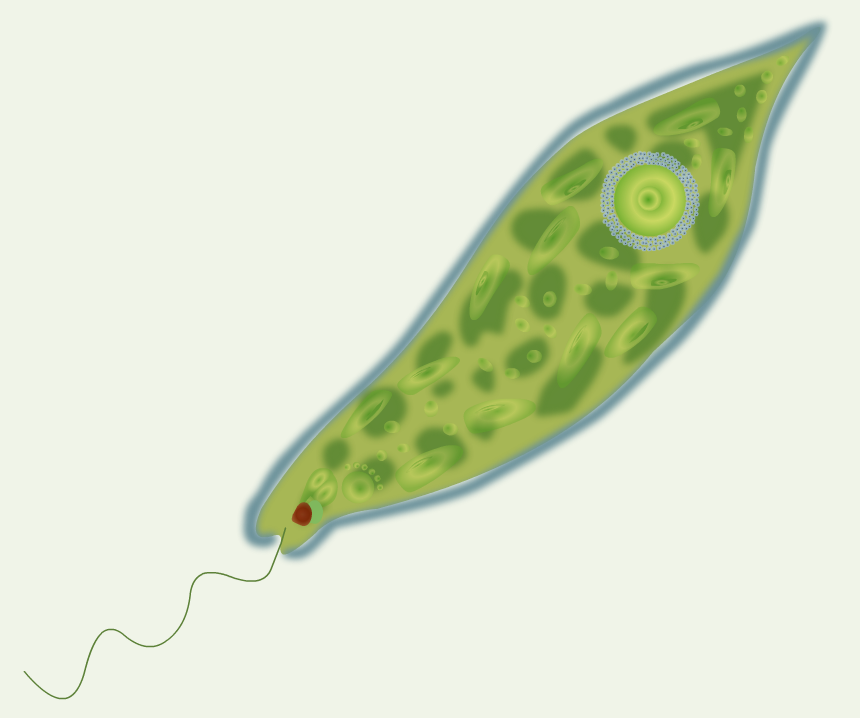 Типичный вторичный хлоропласт имеет четыре мембраны: к двум мембранам цианобактерии добавляется внешняя мембрана первого хозяина (зеленой или красной водоросли) и мембрана пищеварительной вакуоли второго хозяина (хищника, захватившего эту водоросль). Как правило, обладатели вторичных хлоропластов рано или поздно теряют хищничество и обращаются сами в истинные водоросли, то есть в организмы, питающиеся только путем фотосинтеза.
Типичный вторичный хлоропласт имеет четыре мембраны: к двум мембранам цианобактерии добавляется внешняя мембрана первого хозяина (зеленой или красной водоросли) и мембрана пищеварительной вакуоли второго хозяина (хищника, захватившего эту водоросль). Как правило, обладатели вторичных хлоропластов рано или поздно теряют хищничество и обращаются сами в истинные водоросли, то есть в организмы, питающиеся только путем фотосинтеза.
Зеленые водоросли стали вторичными хлоропластами у эвгленовых жгутиконосцев (супергруппа Discoba) и у микроскопических морских хлорарахниофитовых водорослей, которые часто имеют своеобразный облик фотосинтезирующих амеб (супергруппа Rhizaria). Во времена, когда это не было известно, такой характер эволюции изрядно мешал исследователям разобраться в родственных связях эукариот. Например, ботаников постоянно сбивал с толку тот факт, что эвглена зелёная по структуре хлоропластов очень близка к зеленым водорослям, но при этом ни по каким другим признакам ничего общего с зелеными водорослями у нее нет! Разгадка состоит в том, что зеленые водоросли родственны не эвглене — она относится к совершенно другой супергруппе, — а ее хлоропластам.
Судьба тех вторичных хлоропластов, которые образовались из красных водорослей, была еще сложнее. В числе их обладателей — бурые, золотистые, желтозеленые и диатомовые водоросли, входящие в супергруппу Stramenopiles, а также еще три группы преимущественно одноклеточных водорослей: динофлагелляты (супергруппа Alveolata), криптофиты (супергруппа Cryptista) и гаптофиты (супергруппа Haptista; тут надо отметить, что родственные связи криптофит и гаптофит до сих пор неясны, и их отнесение к самостоятельным супергруппам может оказаться временным). Ситуация дополнительно усложняется тем, что многие обладатели вторичных хлоропластов потом их потеряли. Например, в супергруппе Alveolata есть две большие группы, потеря хлоропластов у которых подтверждена электронной микроскопией и молекулярной генетикой, причем обе они фигурируют в школьных учебниках зоологии. Это паразитические споровики, к которым относится малярийный плазмодий, и инфузории, к которым относится всем известная туфелька. Строго говоря, как минимум у споровиков вторичный хлоропласт, происходящий из красной водоросли, даже и не исчез: он сохранился в виде бесцветной структуры, называемой апикопластом, которая утратила способность к фотосинтезу, но продолжает выполнять кое-какие другие биохимические функции.
В ходе эволюции устройство вторичных хлоропластов может упрощаться. Например, у эвглен и у панцирных водорослей динофлагеллят они имеют уже не четыре мембраны, а три (исчезает, скорее всего, та мембрана, которая соответствует внешней мембране зеленой или красной водоросли — она наименее физиологически необходима). У криптомонад и у хлорарахниофит между второй и третьей мембранами хлоропласта сохраняется нуклеоморф — маленькое, но функционирующее ядро красной (у криптомонад) или зеленой (у хлорарахниофит) поглощенной водоросли. В других группах оно успело исчезнуть.
У некоторых эукариот приобретение хлоропластов происходило неоднократно: они теряли их, а потом опять приобретали. Особенно это свойственно почему-то динофлагеллятам. Такого бешеного разнообразия хлоропластов, как у динофлагеллят, нет ни в одной другой группе эукариот. Представим себе одноклеточную динофлагелляту, которая потеряла хлоропласт, вернулась к хищничеству, а потом «приняла решение» завести хлоропласт заново. Как она может это сделать? Очевидный и давно опробованный способ — поглотить другого эукариота, у которого хлоропласт уже есть. В роли этого эукариота может оказаться зеленая, криптофитовая, гаптофитовая или диатомовая водоросль (все эти варианты реально известны). Если поглощена будет зеленая водоросль, то она просто-напросто превратится в новый вторичный хлоропласт. Поглощение криптофитовой, гаптофитовой или диатомовой водоросли по результату ничем не отличается… кроме того, что их собственные хлоропласты — вторичные, образовавшиеся из красных водорослей. Поэтому, если такая водоросль, в свою очередь, становится хлоропластом, то возникает конструкция из четырех последовательно вставленных друг в друга клеток — трех эукариотных и одной прокариотной: динофлагеллята заключает в себе криптофитовую, гаптофитовую либо диатомовую водоросль, внутри которой находится некогда поглощенная красная водоросль, а уж внутри той — бывшая цианобактерия. Такие хлоропласты называются третичными.
Как она может это сделать? Очевидный и давно опробованный способ — поглотить другого эукариота, у которого хлоропласт уже есть. В роли этого эукариота может оказаться зеленая, криптофитовая, гаптофитовая или диатомовая водоросль (все эти варианты реально известны). Если поглощена будет зеленая водоросль, то она просто-напросто превратится в новый вторичный хлоропласт. Поглощение криптофитовой, гаптофитовой или диатомовой водоросли по результату ничем не отличается… кроме того, что их собственные хлоропласты — вторичные, образовавшиеся из красных водорослей. Поэтому, если такая водоросль, в свою очередь, становится хлоропластом, то возникает конструкция из четырех последовательно вставленных друг в друга клеток — трех эукариотных и одной прокариотной: динофлагеллята заключает в себе криптофитовую, гаптофитовую либо диатомовую водоросль, внутри которой находится некогда поглощенная красная водоросль, а уж внутри той — бывшая цианобактерия. Такие хлоропласты называются третичными.
Как мы видим, большинство случаев приобретения эукариотами хлоропластов связано с поглощением не цианобактерий (как можно было бы ожидать), а других эукариот, внутри которых поглощенные цианобактерии уже есть. Таким образом, в конечном счете все эукариоты обязаны своими хлоропластами общему предку супергруппы Archaeplastida, который некогда «приручил» захваченную цианобактерию и тем самым сделал возможными все описанные эволюционные авантюры. Известно одно-единственное исключение: пресноводная раковинная амеба Paulinella chromatophora, относящаяся к супергруппе Rhizaria, использует в качестве хлоропластов именно захваченных цианобактерий, причем таких же, какими хищные виды тех же паулинелл обычно питаются. Это уникальный пример независимого приобретения первичных хлоропластов. Но это случилось по меркам истории эукариот совсем недавно — от 90 до 140 миллионов лет назад — и никаких масштабных эволюционных последствий пока не имело (L. Delaye et al., 2016. How really ancient is Paulinella chromatophora?).
За этим исключением, вся живая природа Земли обязана своими хлоропластами архепластидам, то есть растениям в эволюционном, а не экологическом смысле этого слова. Вот почему так важно понять, как именно они их приобрели.
Родельфис и эволюция
О том, как появились самые первые хлоропласты, существуют разные мнения. Например, знаменитый биоинформатик Евгений Викторович Кунин с коллегами в свое время отважились допустить, что в эволюционной линии растений вообще никогда не существовало фагоцитоза, то есть свойственного хищным эукариотам механизма активного поглощения пищевых объектов (N. Yutin et al., 2009. The origins of phagocytosis and eukaryogenesis (PDF, 1 Мб)). Тогда способ приобретения первичных хлоропластов архепластид должен быть принципиально иным, чем способ приобретения всех вторичных хлоропластов (и первичных хлоропластов паулинеллы тоже), поскольку уж в этих-то случаях фагоцитоз определенно был задействован. Действительно, предполагать тут можно всякое: ранние этапы эволюции растений, прямо скажем, очень темны.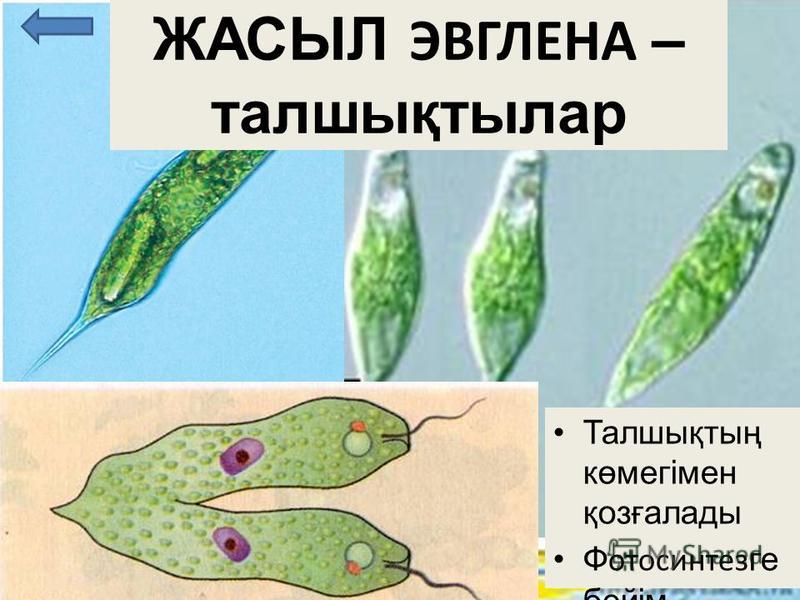
Новое исследование российских, канадских и немецких протистологов бросает луч света на эти таинственные события. Героем статьи стал хищный жгутиконосец Rhodelphis, один вид которого открыли в небольшом пресном озере в бассейне реки Десна, а другой — в морском песке у берега Южно-Китайского моря. По внешнему облику родельфисы — довольно заурядные бесцветные жгутиконосцы с двумя жгутиками. Однако анализ транскриптомов показал, что на эволюционном древе эукариот родельфисы занимают довольно неожиданное положение, а именно — являются сестринской группой по отношению ко всем красным водорослям. Это означает, что они входят в супергруппу Archaeplastida, и не просто входят, а располагаются на древе этой группы довольно близко к ее общему предку, хотя и не у самого корня.
Между тем родельфис вовсе не похож ни на какое растение. Он — настоящий хищник. С помощью ложноножек, образующихся в задней части клетки, он запросто поглощает не только бактерий, но и других эукариот. Надо сказать, что для примитивных эукариот такое хищничество в целом довольно обычно — ни по общему облику, ни по образу жизни, ни по способу питания родельфис среди них особо не выделяется (см. , например: Выделена новая супергруппа эукариот, «Элементы», 18.04.2018). Нет оснований сомневаться, что хищничество родельфиса — примитивная черта. А это, в свою очередь, означает, что предки растений все-таки были хищниками, владевшими фагоцитозом. И более того, даже внутри эволюционного ствола Archaeplastida хищничество продержалось еще довольно долго.
, например: Выделена новая супергруппа эукариот, «Элементы», 18.04.2018). Нет оснований сомневаться, что хищничество родельфиса — примитивная черта. А это, в свою очередь, означает, что предки растений все-таки были хищниками, владевшими фагоцитозом. И более того, даже внутри эволюционного ствола Archaeplastida хищничество продержалось еще довольно долго.
Интересной особенностью родельфисов, которую отметили исследователи, оказались трубчатые кристы митохондрий. Что это значит? Митохондрии образовались из альфа-протеобактерий, которые, как и цианобактерии, являются грамотрицательными. Поэтому митохондрия, точно так же как и первичный хлоропласт, имеет две мембраны — наружную и внутреннюю. Кристами называются складки внутренней мембраны, предназначенные для увеличения ее поверхности (этого требует физиологическая функция митохондрии). Самые распространенные варианты формы крист — пластинчатые и трубчатые, причем еще в 1970-х было замечено, что в крупных эволюционных ветвях этот признак очень стабилен.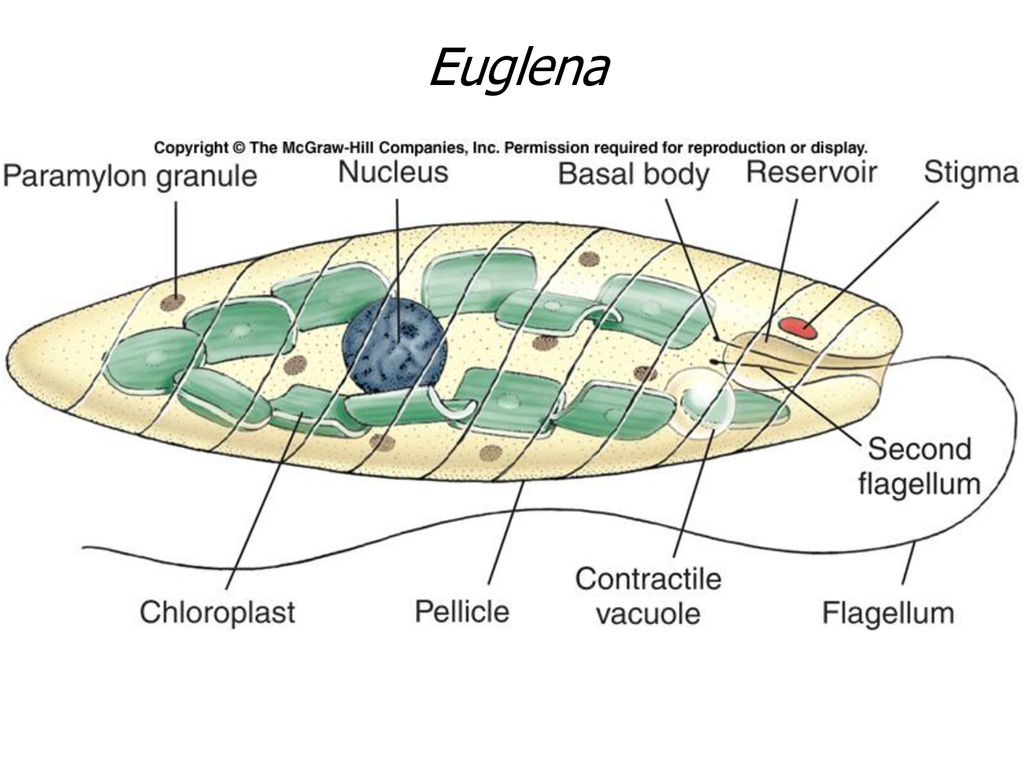 Предлагалось даже разделить большинство эукариот на группы Lamellicristata (с пластинчатыми кристами) и Tubulicristata (с трубчатыми кристами; см. Я. И. Старобогатов, 1986. К вопросу о числе царств эукариотных организмов (DjVu, 1 Мб)). И хотя эта идея столкновения с фактами не выдержала, форма крист митохондрий осталась признаком, важным для крупномасштабной системы. Интересно то, что — как опять же давно известно — у представителей супергруппы Archaeplastida, то есть у растений, кристы, как правило, пластинчатые. Трубчатые кристы родельфиса — редкий для этой супергруппы признак, который может оказаться очень древним.
Предлагалось даже разделить большинство эукариот на группы Lamellicristata (с пластинчатыми кристами) и Tubulicristata (с трубчатыми кристами; см. Я. И. Старобогатов, 1986. К вопросу о числе царств эукариотных организмов (DjVu, 1 Мб)). И хотя эта идея столкновения с фактами не выдержала, форма крист митохондрий осталась признаком, важным для крупномасштабной системы. Интересно то, что — как опять же давно известно — у представителей супергруппы Archaeplastida, то есть у растений, кристы, как правило, пластинчатые. Трубчатые кристы родельфиса — редкий для этой супергруппы признак, который может оказаться очень древним.
Ну а как же с хлоропластами? Они есть у глаукофитовых водорослей, которые, по общепринятой версии, являются древнейшей эволюционной ветвью растений (более древней, чем ветвь красных водорослей и родельфиса). У красных водорослей они тоже есть. Все это означает, что хлоропласты наверняка уже были у ближайшего общего предка всех современных архепластид. Но тогда родельфис тоже должен был бы их получить в наследство. Ну, и где они у него?
Ну, и где они у него?
Электронная микроскопия не обнаружила у родельфиса хлоропластов (во всяком случае, пока). Но вот молекулярная биология, как оказалось, может к этому кое-что добавить. Хорошо известно, что белки, необходимые для работы хлоропластов, но кодируемые ядерными генами, всегда синтезируются за пределами хлоропласта и только потом транспортируются в него. При этом они обязательно распознаются специальными белковыми комплексами, которые встроены во внешнюю и внутреннюю мембраны хлоропласта (см. TIC/TOC complex). Так вот у родельфиса удалось обнаружить не менее четырех белков, входящих в эти комплексы. Нашлись у него и некоторые другие белки, связанные с хлоропластами — в их числе ферредоксин, обычно участвующий в фотосинтезе. В то же время большинство других белков фотосинтеза у родельфиса не найдено, и клетки его, как уже говорилось бесцветные, а не окрашенные, как у фотосинтезирующих растений. Вывод: у родельфиса, вероятно, всё-таки есть первичный хлоропласт, но только маленький, рудиментарный и бесцветный.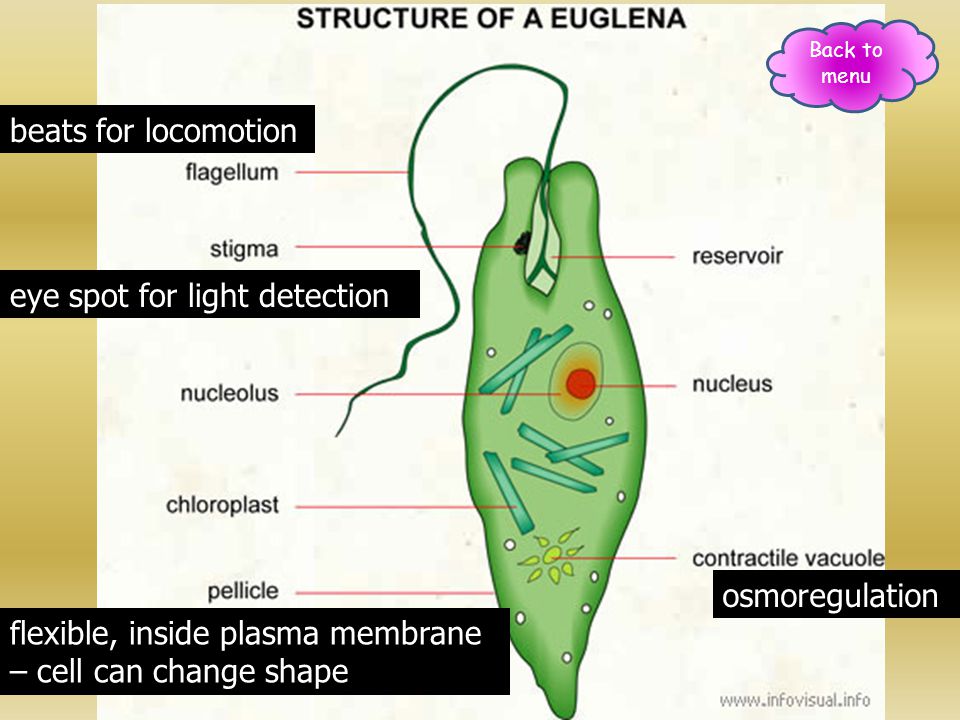 От фотосинтеза эта эволюционная линия успела отказаться.
От фотосинтеза эта эволюционная линия успела отказаться.
Подводя итог, родельфис вполне можно описать как одноклеточное хищное растение. Причем, что самое главное, его хищность — первичная, унаследованная прямо от общего предка всех современных эукариот, а не вторичная, как у растущей в наших болотах росянки или у триффидов из великого романа Уиндема.
Что касается общих предков родельфисов и красных водорослей, то они скорее всего были миксотрофами, то есть организмами со смешанным типом питания. Они совмещали фотосинтез и хищничество. Затем красные водоросли (как и зеленые растения) отказались от хищничества, а родельфис — от фотосинтеза. Ну а общий предок всех архепластид, вероятно, был обыкновенным хищным жгутиконосцем.
Таким образом, последовательность древнейшей эволюции хлоропластов теперь проясняется. Очевидно, все началось с хищного жгутиконосца, который просто захватывал цианобактерий как пищевые объекты. Потом цианобактерии были «приручены» и наступил этап миксотрофного питания, который, судя по положению родельфисов на эволюционном древе, был достаточно долгим: следуя этой логике, приходится сделать вывод, что даже общий предок красных и зеленых водорослей еще мог быть только миксотрофом. И наконец, в нескольких эволюционных ветвях миксотрофия исчезла. Так возникли растения в наиболее классическом смысле слова — организмы, относящиеся к эволюционной ветви Archaeplastida (= Plantae) и питающиеся только фотосинтезом.
И наконец, в нескольких эволюционных ветвях миксотрофия исчезла. Так возникли растения в наиболее классическом смысле слова — организмы, относящиеся к эволюционной ветви Archaeplastida (= Plantae) и питающиеся только фотосинтезом.
Загадка красных водорослей
Уже упоминалось, что ближайшими современными родственниками родельфисов оказались красные водоросли. Эти организмы давно и хорошо знакомы человеку; многие из них удостоились народных названий, например ирландский мох (Irish moss, Chondrus crispus), в изобилии заселяющий литораль Атлантического океана. Красные водоросли живут почти исключительно в морях, хотя надо отметить, что пресноводные формы среди них все же попадаются: например, известный научно-популярный журнал «Батрахоспермум» получил свое название именно в честь пресноводной красной водоросли. Иногда красные водоросли бывают одноклеточными, но чаще они многоклеточные — нитчатые, пластинчатые или ветвящиеся. Благодаря особым фотосинтетическим пигментам они могут жить глубоко в море, там, где никаким другим водорослям света для фотосинтеза уже не хватает, уходя таким образом от конкуренции.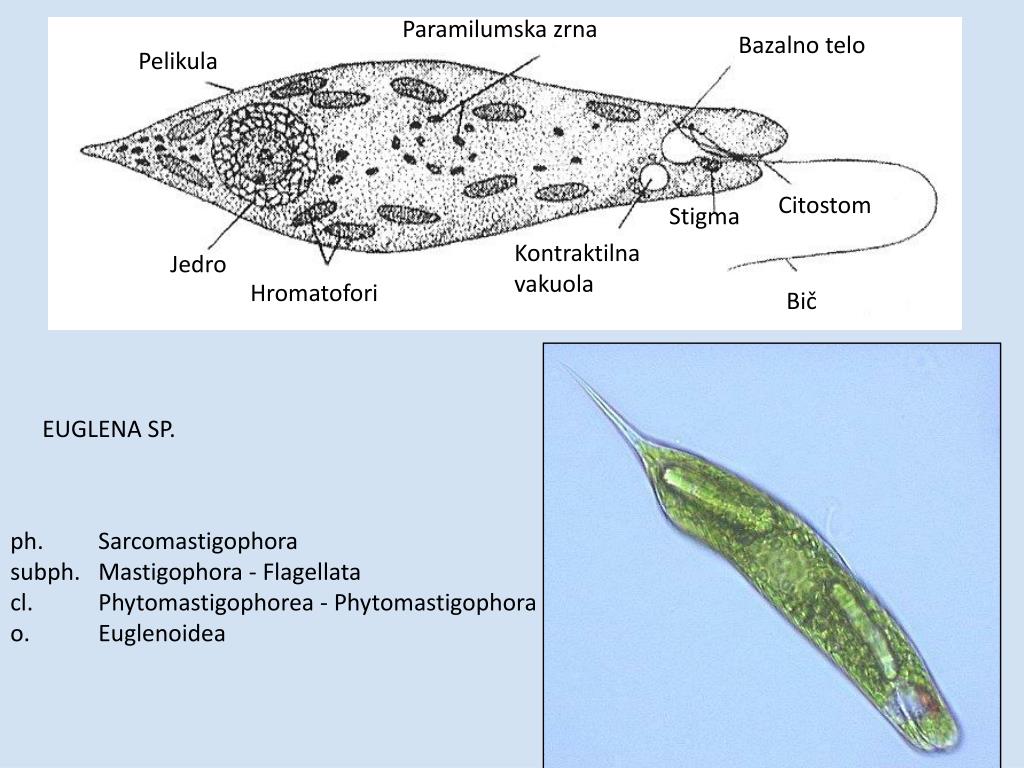 Группа эта очень древняя: самые ранние красные водоросли, обнаруженные палеонтологами, имеют возраст 1,2 миллиарда лет (см. N. J. Butterfield, 2015. Proterozoic photosynthesis — a critical review). Причем они относятся к современному классу бангиевых водорослей, которые, таким образом, являют собой поразительный по глубине пример живых ископаемых (для сравнения — ближайшие ископаемые родичи прославленной латимерии имеют возраст всего-то 70 миллионов лет). По-видимому, это самые древние живые ископаемые среди всех многоклеточных организмов — во всяком случае, эукариотных (вездесущие колониальные цианобактерии не в счет).
Группа эта очень древняя: самые ранние красные водоросли, обнаруженные палеонтологами, имеют возраст 1,2 миллиарда лет (см. N. J. Butterfield, 2015. Proterozoic photosynthesis — a critical review). Причем они относятся к современному классу бангиевых водорослей, которые, таким образом, являют собой поразительный по глубине пример живых ископаемых (для сравнения — ближайшие ископаемые родичи прославленной латимерии имеют возраст всего-то 70 миллионов лет). По-видимому, это самые древние живые ископаемые среди всех многоклеточных организмов — во всяком случае, эукариотных (вездесущие колониальные цианобактерии не в счет).
У красных водорослей есть одна удивительная особенность, давно ставящая биологов в тупик. Это — полное отсутствие жгутиков. В этой статье уже не раз встречалось слово «жгутиконосцы», которое, собственно, и обозначает эукариот, имеющих жгутики. Когда-то такими были все эукариоты без исключения. Жгутики — это универсальные двигательные структуры, унаследованные современными эукариотами от их одноклеточного общего предка.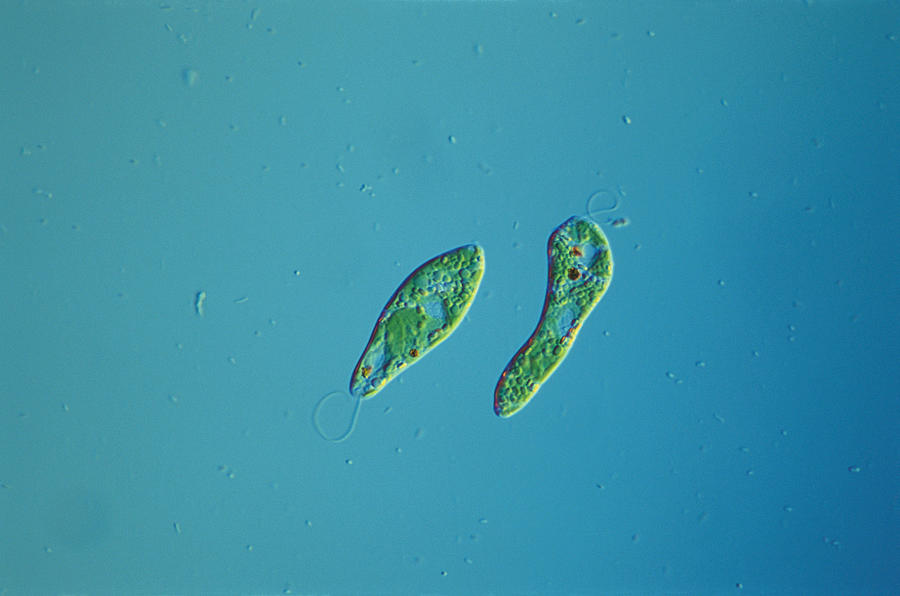 Они часто сохраняются и после перехода к многоклеточности: например, у большинства многоклеточных животных, включая человека, с помощью жгутиков движутся сперматозоиды. Случаи отказа от жгутиков не очень многочисленны и связаны, как правило, с наземным образом жизни. Например, жгутики совершенно утрачены у высших грибов и у цветковых растений. Этим организмам они просто не нужны: жизненные циклы высших грибов и цветковых растений рассчитаны на полностью сухопутное существование, поэтому размножение у них давным-давно идет без участия активно плавающих половых клеток. Но вот многоклеточные животные такой высокой степени адаптации к наземности не достигли. А красные водоросли — это вообще чисто водные существа. Никаких видимых причин для отказа от жгутиков у них нет. Однако ни у одной известной красной водоросли жгутики не появляются ни на какой стадии жизненного цикла. Это очень странно, тем более что красные водоросли испытывают по этой причине явные трудности: например, из-за того, что мужские половые клетки у них неподвижны, им приходится «изобретать» специальные сложные структуры для оплодотворения, хотя со жгутиковыми половыми клетками всё было бы намного проще.
Они часто сохраняются и после перехода к многоклеточности: например, у большинства многоклеточных животных, включая человека, с помощью жгутиков движутся сперматозоиды. Случаи отказа от жгутиков не очень многочисленны и связаны, как правило, с наземным образом жизни. Например, жгутики совершенно утрачены у высших грибов и у цветковых растений. Этим организмам они просто не нужны: жизненные циклы высших грибов и цветковых растений рассчитаны на полностью сухопутное существование, поэтому размножение у них давным-давно идет без участия активно плавающих половых клеток. Но вот многоклеточные животные такой высокой степени адаптации к наземности не достигли. А красные водоросли — это вообще чисто водные существа. Никаких видимых причин для отказа от жгутиков у них нет. Однако ни у одной известной красной водоросли жгутики не появляются ни на какой стадии жизненного цикла. Это очень странно, тем более что красные водоросли испытывают по этой причине явные трудности: например, из-за того, что мужские половые клетки у них неподвижны, им приходится «изобретать» специальные сложные структуры для оплодотворения, хотя со жгутиковыми половыми клетками всё было бы намного проще.
Лет тридцать назад было популярно мнение, что красные водоросли — это чрезвычайно примитивные эукариоты, у которых жгутики еще просто не успели появиться. Увы, современная филогенетика отвергает эту гипотезу напрочь. Здесь надо искать какое-то другое объяснение.
В 2015 году вышла очень интересная работа, указывающая путь к решению этой проблемы (H. Qiu et al., 2015. Evidence of ancient genome reduction in red algae (Rhodophyta)). Она посвящена геномам красных водорослей. Прежде всего, оказалось, что эти геномы по меркам эукариот маленькие — всего 5–10 тысяч генов. Причем это относится не только к одноклеточным, но и к достаточно крупным и сложным многоклеточным красным водорослям, включая тот же ирландский мох. Детальный анализ показал, что многие гены, свойственные почти всем эукариотам, у красных водорослей почему-то потеряны. В частности, у них отсутствует целый набор генов, обеспечивающих сборку жгутиков и работу центриолей (опорных структур, которые всегда располагаются в основаниях жгутиков).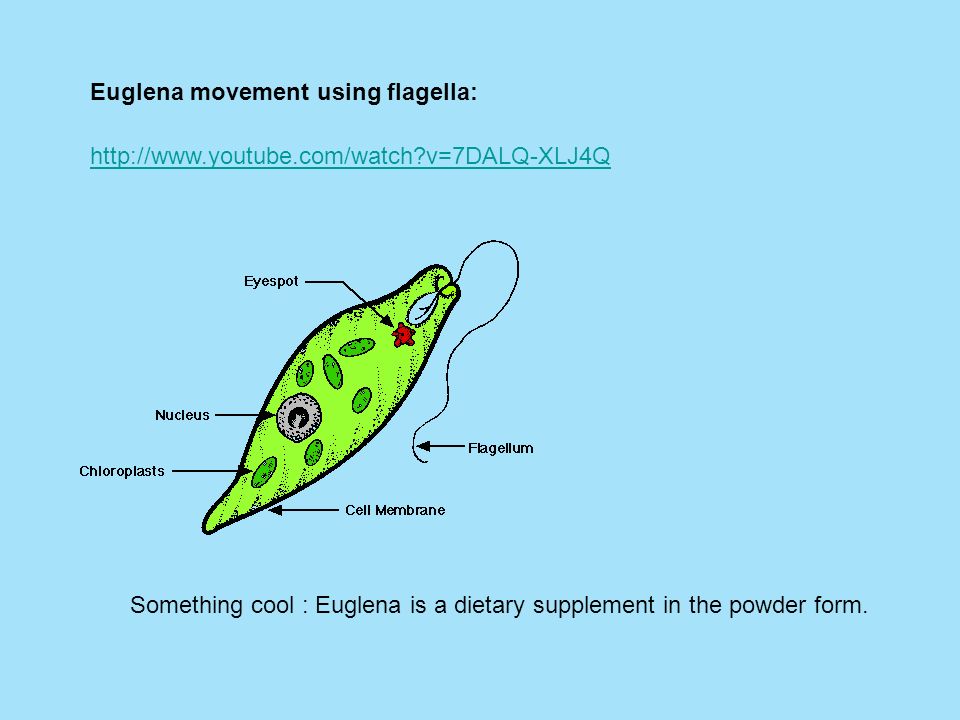 Красные водоросли не образуют жгутиков не потому, что им это не пригодилось бы, а потому, что они на это физически неспособны: у них нет генов, кодирующих необходимые белки. Ни жгутик, ни центриоль они сформировать не могут. Кроме того, они потеряли ряд генов, никак не связанных со жгутиками, но имеющих отношение к разным другим клеточным структурам и механизмам. Например, у красных водорослей не оказалось генов, обычно контролирующих синтез некоторых компонентов клеточных мембран (см. гликозилфосфатидилинозитол). Причем известно, что для многих самых разных эукариот — грибы, трипаносома, мышь — потеря этих генов вообще смертельна. За счет утраты множества генов у красных водорослей заметно обеднен метаболизм, то есть обмен веществ; некоторые биохимические пути у них целиком исчезли.
Красные водоросли не образуют жгутиков не потому, что им это не пригодилось бы, а потому, что они на это физически неспособны: у них нет генов, кодирующих необходимые белки. Ни жгутик, ни центриоль они сформировать не могут. Кроме того, они потеряли ряд генов, никак не связанных со жгутиками, но имеющих отношение к разным другим клеточным структурам и механизмам. Например, у красных водорослей не оказалось генов, обычно контролирующих синтез некоторых компонентов клеточных мембран (см. гликозилфосфатидилинозитол). Причем известно, что для многих самых разных эукариот — грибы, трипаносома, мышь — потеря этих генов вообще смертельна. За счет утраты множества генов у красных водорослей заметно обеднен метаболизм, то есть обмен веществ; некоторые биохимические пути у них целиком исчезли.
Авторы делают твердый вывод: все современные красные водоросли произошли от «генетически обнищавшего предка» (gene depauperate ancestor). И это «обнищание» в самом деле составляет для них проблему: показано, что для восполнения недостающих элементов метаболизма красные водоросли склонны «рекрутировать» бактериальные гены, проникающие в их клетки путем постоянно идущего в природе горизонтального переноса генов (ГПГ). А вот жгутики восстановить так легко не получается.
А вот жгутики восстановить так легко не получается.
Возможно, что именно из-за сужения адаптивных возможностей, вызванного массовой потерей генов, красные водоросли не смогли завоевать сушу (J. Collen, 2015. Win some, lose some: genome evolution in red algae (PDF)). В конце концов, почему бы земным лесам и травам не быть красными? Однако зеленым растениям освоить сушу удалось, а красным водорослям нет. Зато красные водоросли внесли в эволюцию жизни на Земле другой важный вклад: как мы уже знаем, они «подарили» хлоропласты многим другим группам эукариот — бурым водорослям и иже с ними.
У современных морских или пресноводных красных водорослей нет ни малейших причин отказываться ни от жгутиков, ни от многих других полезных вещей. Это означает, что их эволюционный путь был на редкость непрямым. Судя по всему, в начале эволюционной ветви красных водорослей произошла какая-то генетическая катастрофа: за короткое (конечно, по эволюционным меркам) время они, по грубой оценке, потеряли около четверти генов, свойственных зеленым растениям и большинству других эукариот. Почему это произошло — пока никто не знает. Может быть, предки красных водорослей на каком-то эволюционном этапе были паразитами — ведь известно, что паразитизм часто приводит к редукции генома (см. Бубонная чума была уже 3800 лет назад, «Элементы», 15.08.2018). Но тогда совершенно непонятно, почему они сохранили фотосинтез. А может быть, потеря генов была связана с жизнью в каком-то экстремальном местообитания, но в каком — пока трудно даже представить. Интересующая нас «генная катастрофа» должна была произойти не менее полутора миллиардов лет назад (позже разные ветви красных водорослей уже разделились), так что реконструировать ее условия — дело не самое простое.
Почему это произошло — пока никто не знает. Может быть, предки красных водорослей на каком-то эволюционном этапе были паразитами — ведь известно, что паразитизм часто приводит к редукции генома (см. Бубонная чума была уже 3800 лет назад, «Элементы», 15.08.2018). Но тогда совершенно непонятно, почему они сохранили фотосинтез. А может быть, потеря генов была связана с жизнью в каком-то экстремальном местообитания, но в каком — пока трудно даже представить. Интересующая нас «генная катастрофа» должна была произойти не менее полутора миллиардов лет назад (позже разные ветви красных водорослей уже разделились), так что реконструировать ее условия — дело не самое простое.
Открытие родельфиса добавляет к складывающемуся «пазлу» очень важный фрагмент. У родельфиса нет ни малейших признаков той массивной потери генов, которая произошла у красных водорослей. Все те гены, отсутствие которых специфично для красных водорослей, у него оказались на месте. Общий предок красных водорослей и родельфисов был в этом отношении совершенно «нормален».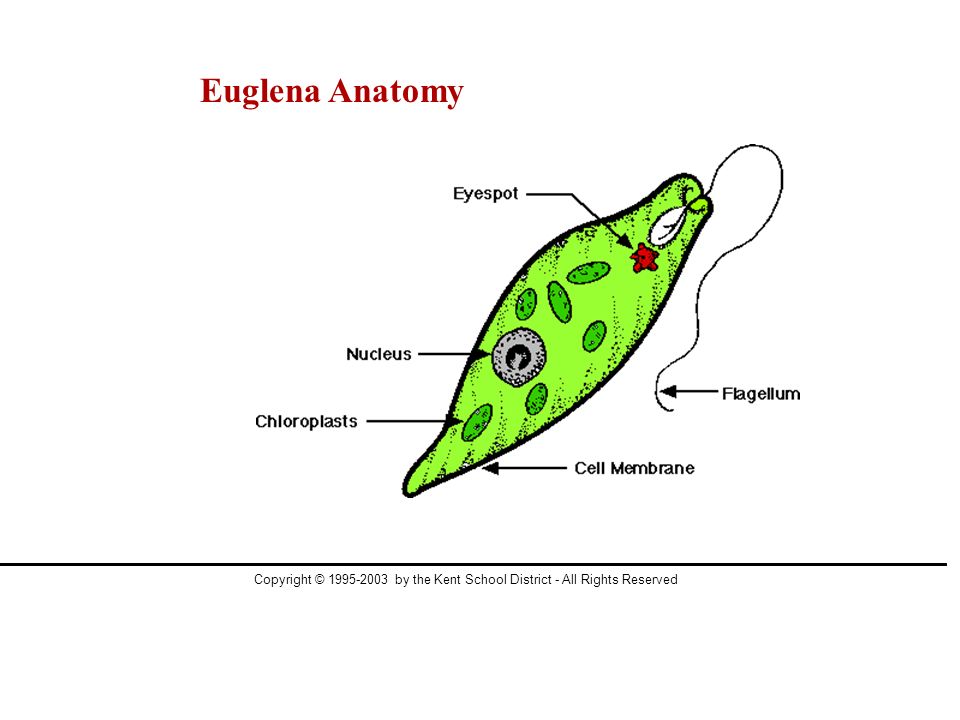 Особенно интересно, что геном родельфиса богат внутригенными некодирующими последовальностями — интронами, в то время как у красных водорослей число интронов резко уменьшено. Дело в том, что интроны сами по себе нефункциональны. Их массовая потеря обычно бывает связана просто с уменьшением общего размера генома, которое, в свою очередь, связано с уменьшением размера клеток (см. Геномы хвостатых амфибий с самого начала были большими, «Элементы», 24.06.2015). Итак, возможно, что одним из факторов постигшей красные водоросли «генной катастрофы» было предельное уменьшение абсолютного размера клеток, случившееся на стадии, когда эти водоросли еще были одноклеточными. Такие примеры в других эволюционных ветвях известны (H. Qiu, 2016. Travel light: reductive genome evolution in free-living eukaryotes (PDF, 1 Мб)). Полной разгадки тайны красных водорослей эти соображения не дают, но ключ к ней — быть может.
Особенно интересно, что геном родельфиса богат внутригенными некодирующими последовальностями — интронами, в то время как у красных водорослей число интронов резко уменьшено. Дело в том, что интроны сами по себе нефункциональны. Их массовая потеря обычно бывает связана просто с уменьшением общего размера генома, которое, в свою очередь, связано с уменьшением размера клеток (см. Геномы хвостатых амфибий с самого начала были большими, «Элементы», 24.06.2015). Итак, возможно, что одним из факторов постигшей красные водоросли «генной катастрофы» было предельное уменьшение абсолютного размера клеток, случившееся на стадии, когда эти водоросли еще были одноклеточными. Такие примеры в других эволюционных ветвях известны (H. Qiu, 2016. Travel light: reductive genome evolution in free-living eukaryotes (PDF, 1 Мб)). Полной разгадки тайны красных водорослей эти соображения не дают, но ключ к ней — быть может.
Источник: Ryan M. R. Gawryluk, Denis V. Tikhonenkov, Elisabeth Hehenberger, Filip Husnik, Alexander P. Mylnikov and Patrick J. Keeling. Non-photosynthetic predators are sister to red algae // Nature. 2019. Published 17 July 2019. DOI: 10.1038/s41586-019-1398-6
Mylnikov and Patrick J. Keeling. Non-photosynthetic predators are sister to red algae // Nature. 2019. Published 17 July 2019. DOI: 10.1038/s41586-019-1398-6
Сергей Ястребов
Тип Саркомастигофоры. Представители. Строение, распространение, значение — ЖИВОТНЫЕ — ЕГЭ 100 баллов. Биология. Самостоятельная подготовка к ЕГЭ — ЕГЭ 2018 — Произведения школьной программы
Тип Саркомастигофоры. Представители. Строение, распространение, значение
Амеба обыкновенная относится к надклассу Корненожек, все представители которого отличаются непостоянной формой тела. Движение и питание происходит с помощью ложноножек, число и форма которых у разных видов неодинаковы. Среди представителей корненожек есть виды, которые имеют наружную раковинку или внутренний скелет разнообразной формы.
Обыкновенная амеба обитает на дне пресных стоячих водоемов.
Тело амебы покрыто только плазматической мембраной, поэтому форма клетки изменчива. Животное ползает с помощью ложноножек — временных выпячиваний тела, образованных эктоплазмой и эндоплазмой. Если на пути амебы встречается пища: бактерии, водоросли, мелкие простейшие, ложноножки «обтекают» пищевую частицу со всех сторон, смыкаются, и образуется пищеварительная вакуоль. Этот процесс называется фагоцитозом. Непереваренные остатки пищи выбрасываются из вакуоли в любом месте поверхности тела. У амебы одновременно могут образовываться несколько пищеварительных вакуолей.
Если на пути амебы встречается пища: бактерии, водоросли, мелкие простейшие, ложноножки «обтекают» пищевую частицу со всех сторон, смыкаются, и образуется пищеварительная вакуоль. Этот процесс называется фагоцитозом. Непереваренные остатки пищи выбрасываются из вакуоли в любом месте поверхности тела. У амебы одновременно могут образовываться несколько пищеварительных вакуолей.
Сократительная вакуоль одна, ее опорожнение происходит в любом месте поверхности тела амебы. Частота сокращений зависит от многих факторов: температуры воды, концентрации в ней солей и т.д. Главная функция пульсирующей вакуоли — осморегуляция.
Газообмен осуществляется всей поверхностью тела.
Удаление продуктов обмена — аммиака и избытка солей — происходит также через всю поверхность тела амебы.
Размножение амебы происходит только бесполым способом — делением клетки на две. Делению цитоплазмы предшествует митотическое деление диплоидного ядра.
Амеба способна к хемотаксису и отрицательному фототаксису.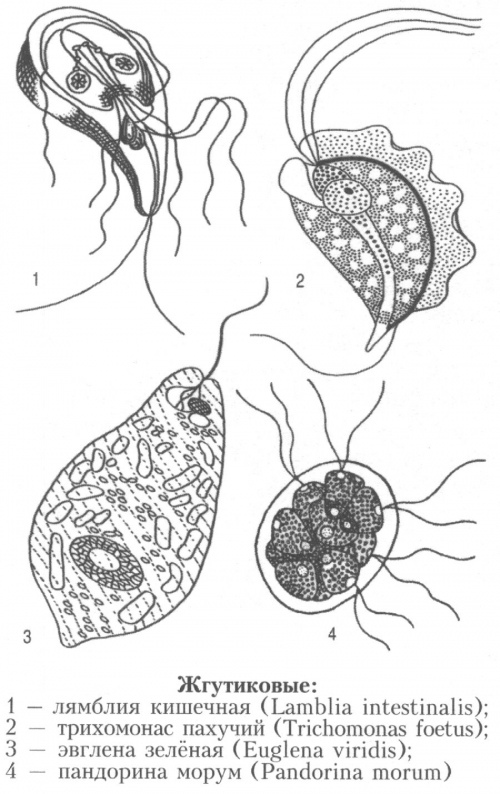
Амеба способна инцистироваться. В состоянии цисты организм переживает неблагоприятные условия.
Дизентерийная амеба — паразит человека, обитающий в толстой кишке. Заражение происходит при употреблении воды, содержащей цисты амебы, а также с загрязненными продуктами питания. Амебы внедряются в слизистую кишечника и питаются эритроцитами. Из-за изъязвления кишечника у человека развивается тяжелое заболевание — амебная дизентерия, или амебиаз.
Эвглена зеленая — это одноклеточный организм с признаками животного и растения. Эвглена зеленая относится к классу Жгутиковых. Движение у представителей этого класса происходит с помощью жгутиков, число которых может колебаться от одного до нескольких сотен. По типу питания жгутиковые делятся на две группы: автотрофы — растительные жгутиконосцы, и гетеротрофы — животные жгутиконосцы.
Эвглена зеленая принадлежит к растительным жгутиконосцам. Она обитает в мелких стоячих водоемах, вода которых содержит много растворенных органических веществ.
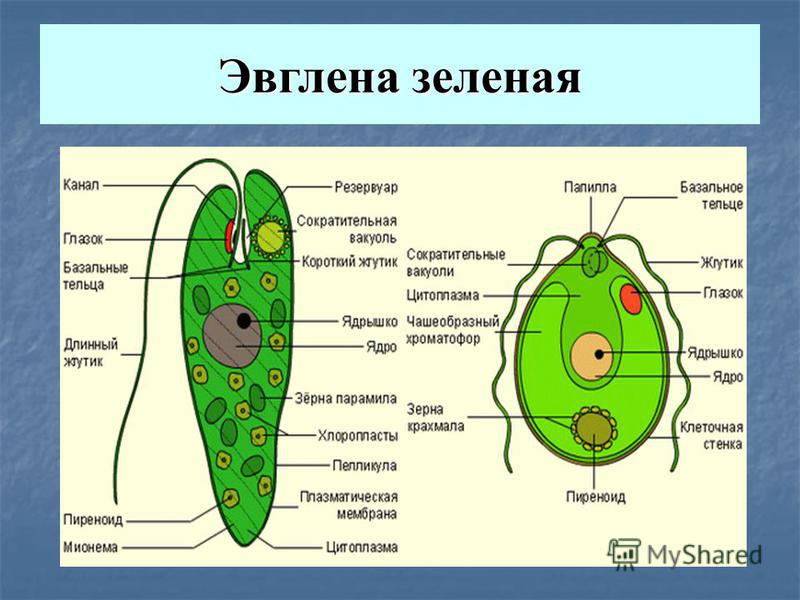
Тело эвглены веретеновидное, на заднем конце заострено, а на переднем — притуплено. Форма его постоянна благодаря плотной эластичной пелликуле. На переднем конце тела расположено углубление — глотка, около которого выходит один жгутик, связанный в цитоплазме с базальным тельцем. Рядом с клеточной глоткой находится красный светочувствительный глазок. В глотку происходит опорожнение единственной сократительной вакуоли. В цитоплазме клетки имеется одно гаплоидное ядро, несколько десятков некрупных хлоропластов.
На свету эвглена зеленая питается как зеленое растение: происходит процесс фотосинтеза, и образуются питательные вещества. Минеральные вещества, кислород и углекислый газ эвглена поглощает из воды через всю поверхность тела.
В темноте при наличии в воде растворенных органических веществ эвглена теряет хлорофилл, становится бесцветной и переходит к гетеротрофному питанию. В клеточной глотке образуются микроскопические пищеварительные вакуоли. Этот тип питания называется миксотрофным, или смешанным, встречается у многих растительных жгутиконосцев.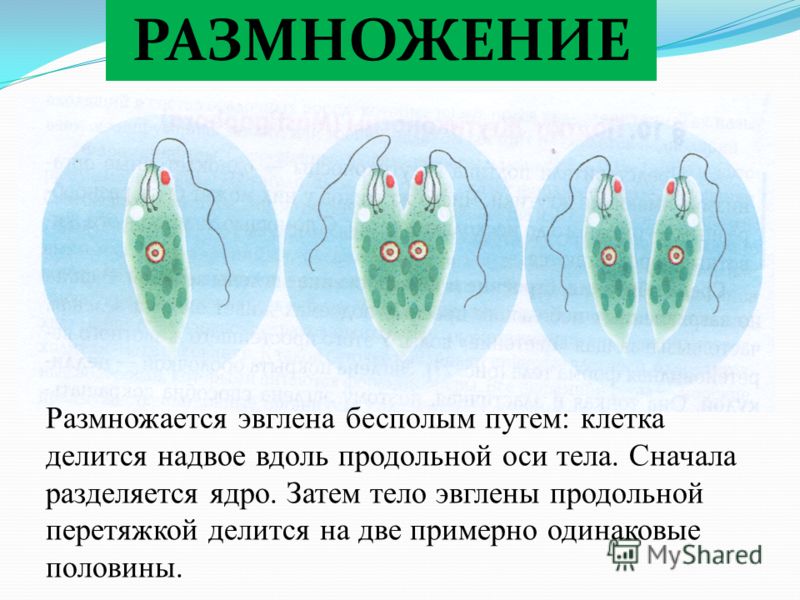 Наличие у эвглены двух способов питания сближает этот организм как с животными, так и с растениями и свидетельствует о единстве происхождения этих групп организмов от общего предка.
Наличие у эвглены двух способов питания сближает этот организм как с животными, так и с растениями и свидетельствует о единстве происхождения этих групп организмов от общего предка.
Функцию осморегуляции у эвглены выполняет сократительная вакуоль. Выделение происходит через всю поверхность тела.
Эвглена обладает положительным фототаксисом, свет улавливается светочувствительным глазком, и она перемещается в более освещенную часть водоема — это связано с питанием.
Размножаются эвглены только бесполым путем — продольным делением клетки на две. Ядро делится митотически. От переднего конца тела к заднему проходит борозда деления. На переднем конце образуется новый жгутик и глотка, а старый жгутик вместе с глоткой остается у одной из дочерних клеток. При неблагоприятных условиях эвглена инцистируется.
Вольвокс — колониальное простейшее. Колония состоит из нескольких десятков тысяч отдельных клеток и имеет вид шарика. Каждая клетка по строению напоминает хламидомонаду: два жгутика на переднем конце, чашевидный пристеночный хроматофор, две пульсирующие вакуоли.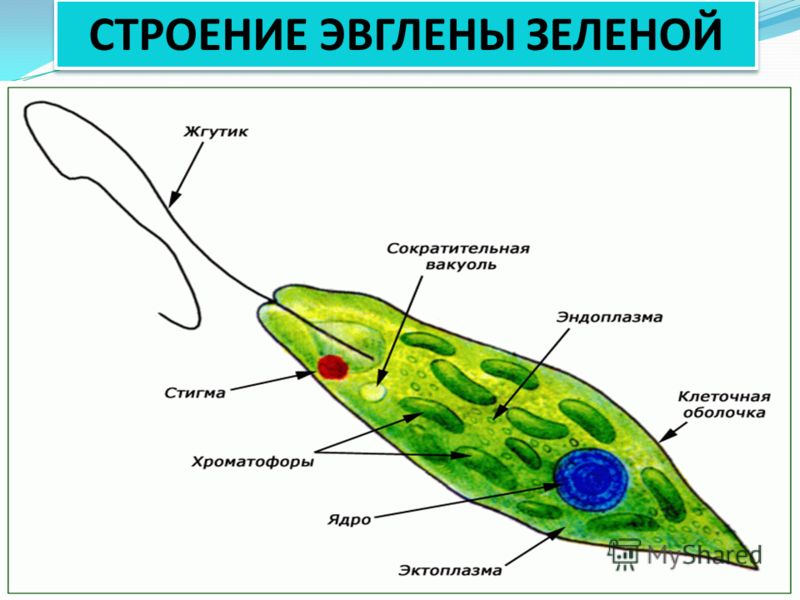 Между собой клетки колонии соединены цитоплазматическими мостиками. Внутри колонии находится студенистое вещество. Движение колонии происходит в результате согласованной работы жгутиков. У вольвокса имеется половой процесс. Одни клетки колонии растут, теряют жгутики и образуют макрогаметы. Другие клетки многократно делятся без последующего роста, в результате чего формируются микрогаметы. При слиянии гамет возникает зигота, которая опускается внутрь колонии и делится мейотически, в результате чего восстанавливается гаплоидный набор хромосом в клетках.
Между собой клетки колонии соединены цитоплазматическими мостиками. Внутри колонии находится студенистое вещество. Движение колонии происходит в результате согласованной работы жгутиков. У вольвокса имеется половой процесс. Одни клетки колонии растут, теряют жгутики и образуют макрогаметы. Другие клетки многократно делятся без последующего роста, в результате чего формируются микрогаметы. При слиянии гамет возникает зигота, которая опускается внутрь колонии и делится мейотически, в результате чего восстанавливается гаплоидный набор хромосом в клетках.
Среди жгутиконосцев животного происхождения много паразитов. Они вызывают опасные заболевания животных и человека. Трипаносома — возбудитель африканской «сонной» болезни. Природным резервуаром возбудителей служат антилопы, а переносчиками — мухи цеце. Внутриклеточные паразиты — лейшмании, переносятся москитами, а резервуаром лейшманий в природе являются грызуны и собаки. В месте укуса москита на теле человека появляется долго незаживающая язва.
В двенадцатиперстной кишке человека паразитируют лямблии, вызывающие тяжелую форму колита.
Предыдущая
СтраницаСледующая
СтраницаЗоология. Жгутиконосцы, Инфузории, Споровики. Тип Кишечнополостные – StudyWay
В рамках подготовки к ЕГЭ по биологии мы с вами плавно подошли к Зоологии-науке о представителях царства Животных. Давайте отправимся в увлекательное изучение животного мира и сегодня с вами начнем изучать простейшие микроорганизмы животного Царства. Кстати, простейших изучает раздел зоологии – протозоология. Кого же мы относим к классу простейших организмов? Это амебы, инфузории, жгутиконосцев, споровиков. Часть представителей этих классов вызывает протозойные болезни (лямблиоз, плазмодии и так далее). Все эти организмы встретятся вам в ЕГЭ по биологии, поэтому отнеситесь серьезно к изучению, тем более, что данный курс дан там в максимально удобной форме для восприятия и запоминания.
Класс Жгутиконосцы
Представителем класса является Эвглена зеленая. Клетка Эвглены зеленой обладает жгутиком, выполняющим функцию передвижения и захвата пищи. Клетка покрыта пелликулой с винтовой насечкой, которая помогает ввинчиваться в воду, также выполняет барьерную функцию. Далее идет стигма, внутри клетки содержатся сократительные вакуоли и хлоропласты. Кстати, зеленый оттенок обеспечивают клетке хроматофоры. Именно в их происходит процесс фотосинтеза.
Клетка Эвглены зеленой обладает жгутиком, выполняющим функцию передвижения и захвата пищи. Клетка покрыта пелликулой с винтовой насечкой, которая помогает ввинчиваться в воду, также выполняет барьерную функцию. Далее идет стигма, внутри клетки содержатся сократительные вакуоли и хлоропласты. Кстати, зеленый оттенок обеспечивают клетке хроматофоры. Именно в их происходит процесс фотосинтеза.
Эвглена относится к миксотрофам. То есть способна получать питание из различных источников: фотосинтез и поглощение органических веществ. На свету происходит питание по типу растений. А при лишении источников света – происходит переход к гетеротрофному питанию – усвоению растворенных в воде питательных веществ.
Размножение.
Размножение бесполое. Деление бинарное в продольной плоскости. Доступно инцистирование – жгутик отбрасывается, тело эвглены округляется и покрывается плотной защитной оболочкой. Такой механизм запускается при возникновении неблагоприятных условий (например, зимовка или пересыхание водоема). К представителям жгутиконосцев относятся лямблии (паразитируют в стенках кишечника, в печени и желчных протоках), трипаносомы (паразиты крови, вызывают сонную болезнь)
К представителям жгутиконосцев относятся лямблии (паразитируют в стенках кишечника, в печени и желчных протоках), трипаносомы (паразиты крови, вызывают сонную болезнь)
Класс Инфузории
Инфузории – класс простейших организмов, подразделяющиеся на ресничные и сосущие.
Ресничные инфузории.
Характеристикой этого вида является наличие по всему телу ресничного эпителия (до пятнадцати тысяч ресничек) . Основная функция ресничек –передвижение. Внутри клетки содержатся микронуклеус (генеративное ядро) и макронуклеус (вегетативное ядро), приводящие каналы (от пяти до семи штук), сократительные вакуоли (работают попеременно через 20-30 секунд). На внешних стенках расположены трихоциста (для защиты и нападения), пелликула, порошица.
Размножение происходит продольным делением (бесполое деление клетки), а также присущ половой процесс в форме конъюгации. Вегетативное ядро рассасывается микронуклеус мейотически делится. В результате образуется стационарное ядро и мигрирующее. Между двумя клетками образуется цитоплазматический мостик при помощи которого происходит обмен мигрирующими ядрами. Стационарное и чужое ядро сливаются и образуется синкарион.
Между двумя клетками образуется цитоплазматический мостик при помощи которого происходит обмен мигрирующими ядрами. Стационарное и чужое ядро сливаются и образуется синкарион.
Основные представители: сувойка, инфузория-трубач, бурсария.
Помимо безобидных видов есть и инфузории-паразиты и симбиотические инфузории. Симбиотические инфузории обитают в желудке жвачных животных, помогая усвоению целлюлозы. К паразитирующим видам относят балантидий – обитателя внутренних стенок кишечника человека и свиньи. Разрушают стенки кишечника, образуя язвы.
Класс Споровики
Наиболее известный представитель этого класса- малярийный плазмодий. Вызывает малярию, распространяется комарами из рода Анофелес (самками). Как происходит процесс заражения и развития малярийного плазмодия?
Комар является промежуточным хозяином малярийного плазмодия. Конечный – млекопитающее.
Цикл развития плазмодия включает несколько стадий. Первая протекает в организме насекомого.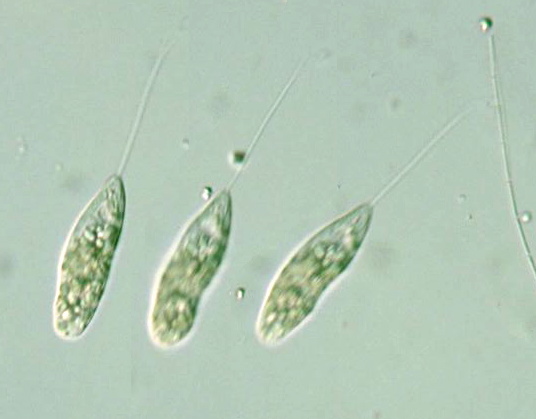 Плазмодии попадают в желудок комара и начинают процесс трансформации на микро и макрогаметы. Гаметы сливаются друг с другом с образованием зиготы, которая спустя несколько часов преобразуется в окинете. Оокинета мейотически делится на 4 споры –ооцисты. Последние делятся путём митоза на тысячи спорозоитов, которые скапливаются в слюнных железах комара.
Плазмодии попадают в желудок комара и начинают процесс трансформации на микро и макрогаметы. Гаметы сливаются друг с другом с образованием зиготы, которая спустя несколько часов преобразуется в окинете. Оокинета мейотически делится на 4 споры –ооцисты. Последние делятся путём митоза на тысячи спорозоитов, которые скапливаются в слюнных железах комара.
После повреждения кожных покровов слюна насекомого попадает непосредственно в кровь. В слюне содержатся спорозоиты, которые с током крови перемещаются к печени и селезенки, где начинается процесс шизогонии (множественного деления клеток). Так как цитоплазматического деления нет, то в шизонте просто увеличивается количество ядер. Когда оно достигает максимума – происходит деление цитоплазмы и обособление новых клеток. Клетки печени и селезенки разрушаются, из них выходят десятки тысяч мерозоитов, которые встраиваются дальше в клетки эритроцитов. Процесс шизогонии запускается вновь.
Различают двух- и трехдневную лихорадку – выход плазмодиев в кровь.
Меры профилактики
- Биологический способ – гамбузии питаются личинками комара;
- Хлорирование открытых водоемов;
- Наблюдение СЭС;
- Механическое истребление комаров;
- Создание искусственных мест для размножения с последующим их уничтожением;
- Отселение людей из мест скопления;
- Осушение болот;
- Вакцинация.
Тип Кишечнополостные
Кишечнополостные подразделяются на гидроидные полипы, сцифоидные полипы, коралловые полипы.
Общая характеристика
- Двуслойные животные (имеют эктодерму и энтодерму).
- Слои соединяются бесструктурной прослойкой – мезоглеей.
- Радиальная или лучевая симметрия – характерная для малоподвижных или неподвижных представителей.
- Имеется кишечная полость.
- Появляется нервная система звездчатого или диффузного типа.
- Происходит дифференциация клеток: кожномускульные, стрекательные, нервные, половые, железистые, пищеварительные, промежуточные.

- Удаление непереваренных остатков через рот.
- Выраженная способность к регенерации.
- Размножение бесполое почкованием и половой процесс (большинство является гермафродитами)
Пресноводный полип гидра.
Полип состоит из туловища в длину порядка 1 сантиметра, подошва и щупалец. Длина щупалец около 7-15 сантиметров. Щупальца расположены вокруг ротового отверстия, ведущего в кишечную полость. Подошвой гидра прикрепляется к субстрату.
Строение тела гидры
Слой эктодермы состоит из:
1. Кожномускульных клеток, образующих покровы тела и участвующих в движении. Формы движения – кувыркание, пядиницей, скольжение на подошве.
2. Стрекательных или крапивных клеток. Стрекательная клетка имеет на конце чувствительный волосок, внутри клетки содержится стрекательная жидкость, окружающая стрекательную капсулу со стрекательной нитью.
3. Промежуточных клеток – недифференцированные клетки с крупными ядрами, которые способны превращаться в любые клетки. Обеспечивают регенерацию.
Обеспечивают регенерацию.
4. Половых.
Клетки энтодермы
- Железистые Клетки содержат вакуоли с пищеварительным соком.
- Пищеварительный клетки (имеют ложноножки и пищеварительные вакуоли). Эти клетки обеспечивают два этапа: а) внутриполостной, б) внутриклеточный.
- Нервные клетки. Нервная система звездчатого и диффузного типа. Нервные клетки распределены равномерно по всему телу.
Полип обладает рефлексами – ответной реакцией организма на внешний раздражитель.
Размножение пресноводной гидры.
При благоприятных условиях размножается почкованием. А при неблагоприятных (как правило это низкая температура) приходит время половому процессу размножения. Гидра может быть раздельнополым организмом. Есть женские и мужские особи, либо гермафродиты. Оплодотворение перекрестное. Сперматозоиды и яйцеклетки образуются из промежуточных клеток. После слияния яйцеклетки и сперматозоида происходит образование зиготы, которая покрывается плотной защитной оболочкой, образуется гаструла.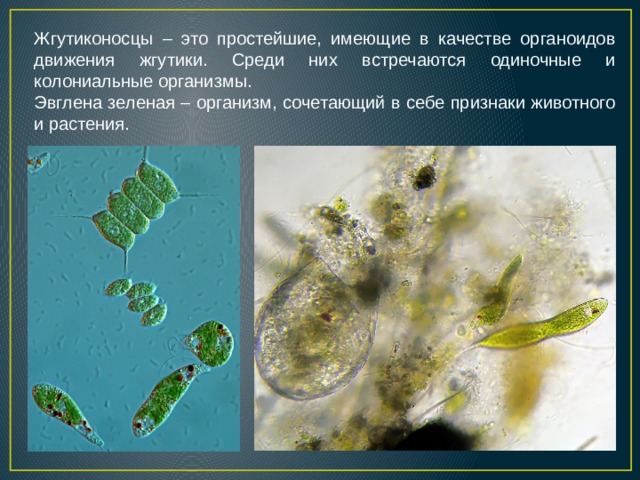 Материнский организм погибает. При наступлении весны гаструла развивается в новую гидру.
Материнский организм погибает. При наступлении весны гаструла развивается в новую гидру.
Класс Сцифоидные полипы (сцифозои)
Данный класс объединяет медуз.
Сцифоидные медузы (они же сцифоидные полипы) распространены повсеместно. Место обитания – соленая вода морей и океанов.
Строение тела
Медуза имеет форму купола или зонта. В центре вогнутой части купола располагается рот, переходящий в ротовые полости для захвата пищи. Далее пища направляется в кишечную полость. Сцифоиды имеют желудок с системой радиальных канальцев. Способствуют распространению питательных веществ из кишечной полости по всему телу.
Тело двухслойное. Состоит из эктодермы, мезоглеи и эндодерма. Мезоглея – желеобразная ткань. По краям купола медуз располагаются органы равновесия – ропалии.
Размножение
Медузы – раздельнополые животные. Половые железы располагаются на вершине купола. Половые клетки созревают в карманах желудочной полости. Гаметы выпускаются в воду через ротовое отверстие. Далее клетки сливаются с образованием яйца, из которого после созревания выходит планула (личинка медузы). Она опускается на дно и крепится к субстрату. Образуется полипоидная форма, которая посредством бокового почкования начинает размножение. Через некоторое время данный полип преобразуется в стробилу. На теле последней образуются перетяжки. Начинается стробиляция (деление исходного тела) на эфиры, из которых в дальнейшем появятся взрослые особи.
Гаметы выпускаются в воду через ротовое отверстие. Далее клетки сливаются с образованием яйца, из которого после созревания выходит планула (личинка медузы). Она опускается на дно и крепится к субстрату. Образуется полипоидная форма, которая посредством бокового почкования начинает размножение. Через некоторое время данный полип преобразуется в стробилу. На теле последней образуются перетяжки. Начинается стробиляция (деление исходного тела) на эфиры, из которых в дальнейшем появятся взрослые особи.
Представители: ропилемы, аурелия, корнерот, цианея.
Тип Саркомастигофоры. Класс Жгутиковые
Тип Саркомастигофоры, или Саркожгутиконосцы, объединяет простейших, использующих для передвижения и захвата пищи жгутики или псевдоподии. Ранее простейших со жгутиками (класс Жгутиковые, или Жгутиконосцы) и с псевдоподиями (класс Саркодовые) относили к разным типам. При более тщательном изучении выяснилось, что саркодовые, размножающиеся половым путем, образуют гаметы со жгутиками.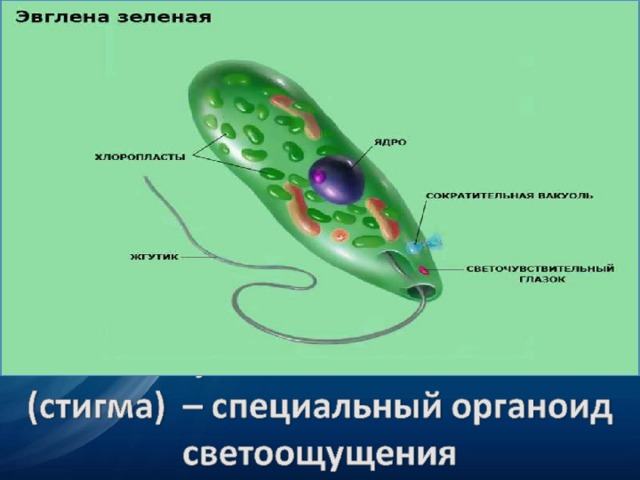 В дальнейшем оказалось, что и некоторые жгутиконосцы способны образовывать псевдоподии. Эти и некоторые другие особенности строения послужили основой для объединения жгутиковых и саркодовых в единый тип — Саркомастигофоры.
В дальнейшем оказалось, что и некоторые жгутиконосцы способны образовывать псевдоподии. Эти и некоторые другие особенности строения послужили основой для объединения жгутиковых и саркодовых в единый тип — Саркомастигофоры.
Знакомство с типом мы начнем с класса Жгутиковые, представители которого ближе всего стоят к предковым группам простейших. Именно у жгутиковых наблюдается максимальное разнообразие типов питания, органоидов движения, типов оболочек и других особенностей.
Класс Жгутиковые (Жгутиконосцы). Жгутиконосцы — многообразная группа простейших, насчитывающая около 8 тыс. видов. Они обитают в соленых и пресных водоемах, в почве, а также могут паразитировать в организмах растений и животных. Размеры жгутиконосцев варьируют от 1—2 мкм до нескольких миллиметров. Форма тела может быть овальной, веретеновидной, шарообразной, с отростками и т. д. Представителям класса характерны следующие морфофизиологические особенности:
• органоиды движения — жгутики; число жгутиков и их расположение на теле может варьировать, наиболее характерно наличие двух жгутиков;
• постоянная форма тела благодаря наличию пелликулы или панциря из диоксида кремния или углекислого кальция;
• размножение обычно бесполое при помощи спор или вегетативным способом путем продольного деления; реже половое размножение с образованием гамет.
По способу питания представителей класса можно разделить на две группы: растительные жгутиконосцы, способные к фотосинтезу, и животные жгутиконосцы — гетеротрофы. Большинство растительных жгутиконосцев совмещают способность к фотосинтезу с потреблением готовых органических веществ, т. е. являются миксотрофами.
Некоторые растительные жгутиконосцы образуют колонии, напоминающие гипотетических предков многоклеточных животных. Это является основанием для выдвижения гипотезы происхождения многоклеточных животных от жгутиконосцев.
Значение жгутиконосцев в природе чрезвычайно велико. Оки играют важную роль в круговороте веществ. Растительные жгутиконосцы — продуценты органического вещества, а животные жгутиконосцы, являясь консументами и редуцентами, перерабатывают и минерализуют органику. Многие жгутиконосцы составляют основу планктона и служат объектом питания для более крупных организмов. Некоторые виды жгутиконосцев являются симбионтами животных.
У некоторых насекомых (например, термитов, жуков-точильщиков) и других членистоногих в кишечнике обитают жгутиковые из отряда Hypermastigina (Многожгутиковые). В пищеварительном тракте термитов эти простейшие вырабатывают ферменты, расщепляющие клетчатку на простые сахара. Без своих симбионтов термиты погибают от голода, потому что собственного фермента для переваривания целлюлозы у них нет. В свою очередь, жгутиковые получают в организме хозяина благоприятные условия для размножения и питательные вещества.
Растительные жгутиконосцы: эвглена зеленая. Типичным представителем растительных жгутиконосцев является эвглена зеленая.
Среда обитания, строение и передвижение. Эвглена зеленая обитает в мелких стоячих пресных водоемах, загрязненных большим количеством растворенных органических веществ. При массовом размножении эвглен вода «цветёт», т.е. приобретает зеленоватый оттенок.
Тело эвглены веретеновидное, длиной не более 0,05 мм.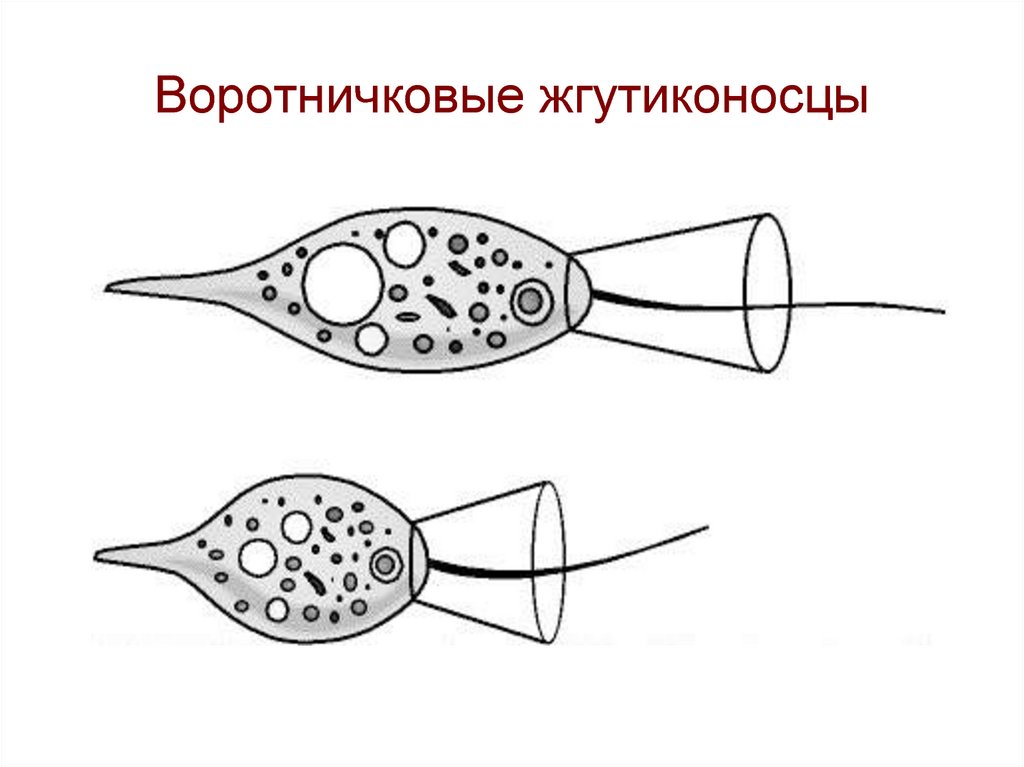 Передний конец притуплён, а задний — заострен. Форма тела постоянна, благодаря наличию плотной эластичной оболочки — пелликулы. На переднем конце тела расположен единственный жгутик (рис. 2). Быстрые вращательные движения жгутика, до нескольких десятков оборотов в секунду, обеспечивают движение эвглены тупым концом вперед.
Передний конец притуплён, а задний — заострен. Форма тела постоянна, благодаря наличию плотной эластичной оболочки — пелликулы. На переднем конце тела расположен единственный жгутик (рис. 2). Быстрые вращательные движения жгутика, до нескольких десятков оборотов в секунду, обеспечивают движение эвглены тупым концом вперед.
У основания жгутика находится небольшое ярко-красное пятно, так называемый глазок, или стигма. Предполагают, что он служит для восприятия света, что помогает эвгленам двигаться по направлению к источнику света (положительный фототаксис).
В цитоплазме, ближе к заднему концу клетки, находится одно ядро с гаплоидным набором хромосом.
Питание. Эвглена зеленая является миксотрофом, т. е. совмещает фотосинтез с потреблением готовых органических веществ. На свету эвглена питается как зеленое растение, В ее цитоплазме находится более 20 овальных хлоропластов, содержащих зеленый пигмент. — хлорофилл.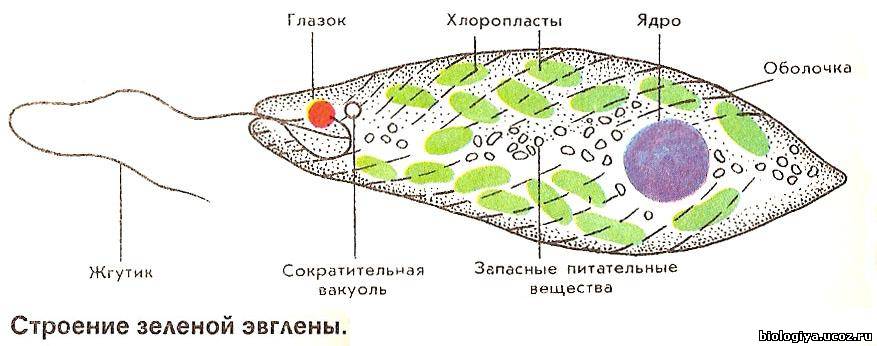 Именно они и придают эвглене зеленый цвет. В результате фотосинтеза образуются полисахариды, которые откладываются в цитоплазме в виде многочисленных гранул. Минеральные вещества, кислород и углекислый газ эвглена поглощает из воды всей поверхностью тела.
Именно они и придают эвглене зеленый цвет. В результате фотосинтеза образуются полисахариды, которые откладываются в цитоплазме в виде многочисленных гранул. Минеральные вещества, кислород и углекислый газ эвглена поглощает из воды всей поверхностью тела.
Если эвглену поместить на длительное время в темноту, хлорофилл у нее исчезает и она становится бесцветной. Вследствие этого фотосинтез прекращается, и эвглена переодит к гетеротрофному питанию-начинает усваивать растворённые в воде органические вещества, образующиеся при разложении различных отмерших отганизмах.
Выделение и осморегуляция. Функцию осморегуляции у эвглены выполняет сократительная вакуоль, расположенная в переднем конце тела. Выделение продуктов метаболизма и газообмен осуществляются через всю поверхность тела.
Размножение. Эвглена размножается только бесполым способом, путем продольного деления клетки на две дочерние. Борозда деления проходит от переднего конца тела к заднему. При этом ядро делится путем митоза. Органоиды удваиваются и распределяются между дочерними клетками. Интересно, что жгугик остается у одной из дочерних клеток, а в другой образуется заново.
При этом ядро делится путем митоза. Органоиды удваиваются и распределяются между дочерними клетками. Интересно, что жгугик остается у одной из дочерних клеток, а в другой образуется заново.
Инцистирование. При неблагоприятных условиях эвглена инцистируется. При этом жгутик отпадает, а тело эвглены округляется и покрывается плотной защитной оболочкой. В таком состоянии эвглена проводит зиму или переносит высыхание водоема.
1234
Ориентация зеленого жгутиконосца Euglena gracilis в вертикальном столбе воды | FEMS Микробиология Экология
Журнальная статья
Донат-П. Хедер,
Донат-П. Хедер
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Кай Грибенов
Кай Грибенов
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
FEMS Microbiology Ecology , Volume 4, Issue 3-4, May 1988, Pages 159–167, https://doi. org/10.1111/j.1574-6968.1988.tb02660.x
org/10.1111/j.1574-6968.1988.tb02660.x
- 3
Последний
Самые читаемые
Самые цитируемые
- 1 Кафедра генетики, Факультет естественных наук, Университет Коменского, 842 15 Братислава, Словакия.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Кафедра генетики, Факультет естественных наук, Университет Коменского, 842 15 Братислава, Словакия; Кафедра биологии и экологии, Факультет естественных наук, Остравский университет, 701 03 Острава, Чешская Республика.
- 3 Департамент биологических наук, Мемфисский университет, Мемфис, Теннесси, 38152-3560, США.
- PMID: 25527385
- DOI: 10.1016/j.jbiotec.2014.11.035
- 1 Кафедра генетики, Факультет естественных наук, Университет Коменского, 842 15 Братислава, Словакия. Электронный адрес: [email protected].
- 2 Кафедра генетики, Факультет естественных наук, Университет Коменского, 842 15 Братислава, Словакия; Кафедра биологии и экологии, Факультет естественных наук, Остравский университет, 701 03 Острава, Чешская Республика.

- 3 Департамент биологических наук, Мемфисский университет, Мемфис, Теннесси, 38152-3560, США.
- PMID: 25527385
- DOI: 10.1016/j.jbiotec.2014.11.035
Молекулярные инструменты и применение Euglena gracilis: от биоперерабатывающих заводов до биоремедиации.
Хативада Б., Сунна А., Невалайнен Х. Хативада Б. и соавт. Биотехнология Биоинж. 2020 дек;117(12):3952-3967. дои: 10.1002/бит.27516. Epub 2020 6 августа. Биотехнология Биоинж. 2020. PMID: 32710635 Обзор.
Селекция и характеристика Euglena anabaena var. minor в качестве нового вида Euglena-кандидата для промышленного применения.
Судзуки К., Митра С., Ивата О., Исикава Т., Като С., Ямада К. Судзуки К. и др. Биоски Биотехнолог Биохим. 2015;79(10):1730-6. дои: 10.1080/051.2015.1045828. Epub 2015 19 мая.
 Биоски Биотехнолог Биохим. 2015.
PMID: 25988946
Биоски Биотехнолог Биохим. 2015.
PMID: 25988946Ферментация восковых эфиров и ее применение для производства биотоплива.
Инуи Х., Исикава Т., Тамой М. Инуи Х. и др. Adv Exp Med Biol. 2017;979:269-283. doi: 10.1007/978-3-319-54910-1_13. Adv Exp Med Biol. 2017. PMID: 28429326 Обзор.
Повышенный синтез α-токоферола, парамилона и тирозина Euglena gracilis в условиях высокой продукции биомассы.
Родригес-Завала Х.С., Ортис-Крус М.А., Мендоса-Эрнандес Г., Морено-Санчес Р. Родригес-Завала Дж. С. и др. J Appl Microbiol. 2010 декабрь; 109(6):2160-72. doi: 10.1111/j.1365-2672.2010.04848.x. Epub 2010 21 сентября. J Appl Microbiol. 2010. PMID: 20854454
Эволюционное происхождение эвглены.

Закрысь Б., Милановский Р., Карнковска А. Закрысь Б. и соавт. Adv Exp Med Biol. 2017;979:3-17. doi: 10.1007/978-3-319-54910-1_1. Adv Exp Med Biol. 2017. PMID: 28429314 Обзор.
Автоматизированная многолуночная станция визуализации с открытым оборудованием для наблюдения за микроорганизмами.
Герваси А., Кардол П., Мейер П.Е. Герваси А. и др. Микромашины (Базель). 2022 26 мая; 13 (6): 833. дои: 10.3390/ми13060833. Микромашины (Базель). 2022. PMID: 35744447 Бесплатная статья ЧВК.
Солевой стресс вызывает накопление парамилона и тонкую настройку макроорганизации тилакоидных мембран в клетках Euglena gracilis .

Канна С.Д., Домонкос И., Кобори Т.О., Дергез А., Бёде К., Нагьяпати С., Зирос О., Юннеп Р., Надь Г., Гараб Г., Силак Л., Солимоши К., Ковач Л., Уги Б. Канна С.Д. и др. Фронт завод науч. 2021 ноя 16;12:725699. doi: 10.3389/fpls.2021.725699. Электронная коллекция 2021. Фронт завод науч. 2021. PMID: 34868111 Бесплатная статья ЧВК.
Agrobacterium tumefaciens — Опосредованная ядерная трансформация биотехнологически важной микроводоросли — Euglena gracilis .
Беккер И., Прасад Б., Нтефиду М., Дайкер В., Рихтер П., Леберт М. Беккер I и др. Int J Mol Sci. 2021 11 июня; 22 (12): 6299. doi: 10.3390/ijms22126299. Int J Mol Sci. 2021. PMID: 34208268 Бесплатная статья ЧВК.
Стратегический подход к применению бактериальных веществ для увеличения производства метаболитов Euglena gracilis в биореакторе.

Ким Д.Х., Ким Дж.И., О Джей-Джей, Чон М.С., Ан Х.С., Джин Ч.Р., Чхве Й.Е. Ким Д.Х. и др. Приложение Microbiol Biotechnol. 2021 июль; 105 (13): 5395-5406. doi: 10.1007/s00253-021-11412-w. Epub 2021 26 июня. Приложение Microbiol Biotechnol. 2021. PMID: 34173846
Научное заключение об обновлении списка рекомендованных QPS биологических агентов, преднамеренно добавляемых в пищевые продукты или корма, как было уведомлено EFSA (2017-2019).
Группа экспертов EFSA по биологическим опасностям (BIOHAZ), Кутсуманис К., Альенде А., Альварес-Ордоньес А., Болтон Д., Бовер-Сид С., Чемали М., Дэвис Р., Де Чезаре А., Гилберт Ф., Линдквист Р., Наута М., Пейше Л., Ру Г., Симмонс М., Скандамис П., Суффредини Э., Коккончелли П.С., Фернандес Эскамес П.С., Марадона М.П., Керол А., Суарес Х.Е., Сунд И., Влак Дж., Бариццоне Ф., Коррейя С., Герман Л.
 Группа экспертов EFSA по биологическим опасностям (BIOHAZ) и др.
EFSA J. 3 февраля 2020 г.; 18 (2): e05966. doi: 10.2903/j.efsa.2020.5966. Электронная коллекция 2020 февраль.
EFSA J. 2020.
PMID: 32874212
Бесплатная статья ЧВК.
Группа экспертов EFSA по биологическим опасностям (BIOHAZ) и др.
EFSA J. 3 февраля 2020 г.; 18 (2): e05966. doi: 10.2903/j.efsa.2020.5966. Электронная коллекция 2020 февраль.
EFSA J. 2020.
PMID: 32874212
Бесплатная статья ЧВК.Baldauf, S.L. Обзор филогении и разнообразия эукариот.
 Дж. Сист. Эвол. 46 , 263–273 (2008).
Дж. Сист. Эвол. 46 , 263–273 (2008).Google ученый
Гиббс, С. П. Хлоропласты Euglena, возможно, произошли от симбиотических зеленых водорослей. Кан. Дж. Бот. 56 , 2883–2889 (1978).
Артикул Google ученый
Хедер Д. П., Хеммерсбах Р., Леберт М. Жгутиконосцы в Гравитация и поведение одноклеточных организмов . (редакторы Бард, Дж. Б. Л., Барлоу, П. В. и Кирк, Д. Л.) 75–105 (Cambridge University Press, 2005).
Хедер, Д. П. Влияние солнечного и искусственного УФ-облучения на подвижность и фототаксис жгутиковых. Эвглена изящная. Фотохим. Фотобиол. 44 , 651–656 (1986).
Артикул Google ученый
Портерфилд, Д. Ориентация подвижных одноклеточных водорослей на кислород: окситаксис у Euglena.
 биол. Бык. 193 , 229–230 (1997).
биол. Бык. 193 , 229–230 (1997).КАС Статья пабмед Google ученый
Strauch, S., Richter, P., Schuster, M. & Häder, D.P. Характер биения жгутика Euglena gracilis при изменении силы тяжести во время параболических полетов. J. Физиол растений. 167 , 41–46 (2010).
КАС Статья пабмед Google ученый
Насир, А. и др. . Влияние микрогравитации на Euglena gracilis , изученное в Шэньчжоу 8. Plant Biol. 16 , 113–119 (2014).
Артикул пабмед Google ученый
Леберт, М. и Хедер, Д. П. Как Эвглена отличает верх от низа. Природа 379 , 590 (1996).
ОБЪЯВЛЕНИЕ КАС Статья пабмед Google ученый
«>Хедер, Д. П., Рихтер, П. и Леберт, М. Преобразование сигналов при грависенсорных исследованиях жгутиковых. Signal Transduction 6 , 422–431 (2006).
Артикул Google ученый
Дайкер, В., Хедер, Д. П., Рихтер, П. Р. и Леберт, М. Участие протеинкиназы в фототаксисе и гравитации Euglena gracilis . Planta 233 , 1055–62 (2011).
КАС Статья пабмед Google ученый
«>Tao-Cheng, J.H., Vinade, L., Pozzo-Miller, L., Reese, T. & Dosemeci, A. Кластеры кальций/кальмодулин-зависимой протеинкиназы II в срезах гиппокампа взрослых крыс. Неврология 115 , 435–440 (2002).
КАС Статья пабмед Google ученый
Johnsons, C.K. & Harms, GS. Отслеживание и локализация кальмодулина в живых клетках. Биохим. Биофиз. Акта 1863 , 2017–2026 (2016).
Артикул Google ученый
Lindemann, C.B. & Lesich, K.A. Биение жгутиков и ресничек: доказано и возможно.
 J. Cell Sci. 123 , 519–528 (2010).
J. Cell Sci. 123 , 519–528 (2010).КАС Статья пабмед Google ученый
Буркхард П., Стетефельд Дж. и Стрелков С. В. Спиральные спирали: очень универсальный мотив свертывания белка. Trends Cell Biol. 11 , 82–88 (2001).
КАС Статья пабмед Google ученый
Firat-Karalar, E.N., Sante, J., Elliott, S. & Stearns, T. Протеомный анализ сперматозоидов млекопитающих идентифицирует новые компоненты центросомы. J. Cell Sci. 127 , 4128–4133 (2014).
КАС Статья пабмед ПабМед Центральный Google ученый
Boesger, J., Wagner, V., Weisheit, W. & Mittag, M. Анализ жгутиковых фосфопротеинов из Chlamydomonas reinhardtii . Эукариот. Сотовый 8 , 922–932 (2009).

КАС Статья пабмед ПабМед Центральный Google ученый
Schlösser, UG SAG-Sammlung von Algenkulturen в Каталоге штаммов Геттингенского университета. Бот. Акта 107 , 113–186 (1994).
Артикул Google ученый
Чекуччи, А., Коломбетти, Г., Феррара, Р. и Ленчи, Ф. Спектры действия для фотоаккумуляции зеленой и бесцветной эвглены: данные для идентификации рецепторных пигментов. Фотохим. Фотобиол. 23 , 51–54 (1976).
КАС Статья пабмед Google ученый
Lebert, M. & Häder, D. P. Анализ изображений: универсальный инструмент для множества приложений. GIT Labor-Fachzeitschrift 1/99 , 5–6 (1999).
Google ученый
«>Хедер, Д. П. и Фогель, К. Одновременное отслеживание жгутиковых в режиме реального времени с помощью анализа изображений. Дж. Матем. биол. 30 , 63–72 (1991).
ОБЪЯВЛЕНИЕ Статья МАТЕМАТИКА Google ученый
Исеки М. и др. . Активируемая синим светом аденилатциклаза опосредует фотоизбегание у Euglena gracilis . Природа 415 , 1047–1051 (2002).
ОБЪЯВЛЕНИЕ КАС Статья пабмед Google ученый
Ngo, H., Tschudi, C., Gull, K.
 & Ullu, E. Двухцепочечная РНК индуцирует деградацию мРНК у Trypanosoma brucei . П. Натл. акад. науч. США 95 , 14687–14692 (1998).
& Ullu, E. Двухцепочечная РНК индуцирует деградацию мРНК у Trypanosoma brucei . П. Натл. акад. науч. США 95 , 14687–14692 (1998).ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Frohman, M. On Beyond classic RACE (быстрая амплификация концов кДНК). Рез. генома. 4 , S40–S58 (1994).
КАС Статья Google ученый
Тессье, Л. и др. . Короткие лидерные последовательности могут быть перенесены с малых РНК на незрелые мРНК путем транс-сплайсинга у Euglena. EMBO J. 10 , 2621 (1991).
КАС пабмед ПабМед Центральный Google ученый
James, P., Halladay, J. & Craig, E.A. Геномные библиотеки и штамм-хозяин, предназначенный для высокоэффективной двухгибридной селекции дрожжей.
 Генетика 144 , 1425–1436 (1996).
Генетика 144 , 1425–1436 (1996).КАС пабмед ПабМед Центральный Google ученый
Гитц, Р. Д. и Вудс, Р. А. Трансформация дрожжей методом ацетата лития/одноцепочечной ДНК-носителя/полиэтиленгликоля. Метод Фермент. 350 , 87–96 (2002).
КАС Статья Google ученый
Браун, М. К. и др. . Влияние технологии иммунизации и применения анализов на эффективность антител – систематическая сравнительная оценка. PloS one 6 , e28718, https://doi.org/10.1371/journal.pone.0028718 (2011).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google ученый
Крюгер, Нью-Джерси. Метод Брэдфорда для количественного определения белка. В Справочник по белковым протоколам (изд.
 Уокер, Дж. М.) 17–24 (Springer, 2009 г.).).
Уокер, Дж. М.) 17–24 (Springer, 2009 г.).).Laemmli, U.K. Расщепление структурных белков при сборке головки бактериофага Т4. Природа 227 , 680–685 (1970).
ОБЪЯВЛЕНИЕ КАС Статья пабмед Google ученый
Малик, Н. и Берри, А. Новый фиксатор пятен для белков, разделенных изоэлектрическим фокусированием геля на основе кумасси бриллиантового синего. Анал. Биохим. 49 , 173–176 (1972).
КАС Статья пабмед Google ученый
Хедер, Д. П. и Леберт, М. Фоторецептор для фототаксиса у фотосинтезирующего жгутиконосца Euglena gracilis . Фотохим. Фотобиол. 68 , 260–265 (1998).
Артикул Google ученый
Мермельштейн, К. и др. .
 Распределение F-актина, α-актинина, тропомиозина, тубулина и органелл в Euglena gracilis с помощью иммунофлуоресцентной микроскопии. Tissue Cell 30 , 545–553 (1998).
Распределение F-актина, α-актинина, тропомиозина, тубулина и органелл в Euglena gracilis с помощью иммунофлуоресцентной микроскопии. Tissue Cell 30 , 545–553 (1998).КАС Статья пабмед Google ученый
Cell biology department, Friedrich Alexander University, Erlangen, Germany
Adeel Nasir, Aude Le Bail, Viktor Daiker, Peter Richter & Michael Lebert
Biochemistry department, Friedrich Alexander Университет, Эрланген, Германия
Janine Klima
- Adeel Nasir
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Aude Le Bail
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Viktor Daiker
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Janine Klima
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Peter Richter
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Michael Lebert
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Изменения экспрессии генов у Euglena gracilis, полученные в ходе 29-й кампании DLR Parabolic Flight
- Юлия Крюгер
- Питер Рихтер
- Майкл Леберт
Научные отчеты (2019)
- 1 Обзор
- 2 вида жгутиконосцев
- 2.1 Фитофлагелляты
- 2.2 Зоофлагелляты
- 3 Репродукция
- 4 Каталожные номера
- Эвглена
- Как и у всех жгутиковых, у эвглены есть жгутик. Они зеленые, потому что у них есть хлоропласты, которые являются органеллами, которые помогают в фотосинтезе и содержат хлорофилл. У них есть плазматическая мембрана, которая содержит их цитоплазму и другие органеллы. Пелликула представляет собой гибкую мембрану, поддерживающую плазматическую мембрану. Сократительная вакуоль удаляет лишнюю воду из клетки, а резервуар, расположенный вблизи жгутика, вытесняет лишнюю воду. У них также есть красное пятно под глазами, называемое стигмой, которое чувствительно к свету и помогает направлять их движения.
- Volvox
- Volvox — это колония пресноводных водорослей, которая образует полый шар и может состоять из 500–200 000 отдельных клеток. Их жгутики направлены наружу, и они движутся вместе, как одно целое, вращаясь.
 Они могут быть достаточно большими, чтобы их можно было увидеть невооруженным глазом. Жгутиковые соединены тонкими нитями цитоплазмы и могут быть зелеными, красными или коричневыми.
Они могут быть достаточно большими, чтобы их можно было увидеть невооруженным глазом. Жгутиковые соединены тонкими нитями цитоплазмы и могут быть зелеными, красными или коричневыми. - Паразиты
- Жгутиконосцы-паразиты классифицируются под названием зоофлагелляты, потому что у них нет средств для производства пищи посредством фотосинтеза.
 Одним из примеров паразитического жгутиконосца является Giardia. Лямблии вызывают заболевания у людей, когда их форма кисты попадает в организм через загрязненную воду. Форма кисты служит защитным спящим состоянием для лямблий до тех пор, пока они не попадут в тонкую кишку хозяина, вызывая диарею и нарушение всасывания. Некоторые кисты лямблий проходят через организм хозяина, позволяя ему заражать других.
Одним из примеров паразитического жгутиконосца является Giardia. Лямблии вызывают заболевания у людей, когда их форма кисты попадает в организм через загрязненную воду. Форма кисты служит защитным спящим состоянием для лямблий до тех пор, пока они не попадут в тонкую кишку хозяина, вызывая диарею и нарушение всасывания. Некоторые кисты лямблий проходят через организм хозяина, позволяя ему заражать других. - Жгутиконосцы размножаются бесполым путем, но в некоторых случаях, например, в колонии Volvox, они могут размножаться и половым путем. Форма бесполого размножения бинарное деление . Это процесс, при котором организм дублирует свою ДНК и разделяется на две дочерние клетки. Большинство жгутиконосцев используют этот процесс. Volvox использует немного другой процесс. В центре колонии находятся сферы, представляющие собой колонии дочерних клеток. Эти клетки происходят из середины колонии и претерпевают множество клеточных делений, пока не образуют сферу.
 Они удерживаются внутри Volvox до тех пор, пока родитель не распадется, а дочерние клетки не вывернут свои жгутики наружу и не станут новой колонией.
Они удерживаются внутри Volvox до тех пор, пока родитель не распадется, а дочерние клетки не вывернут свои жгутики наружу и не станут новой колонией. - [1] Адам, Родни Д. «Тело Giardia Lamblia». Американское общество микробиологии, июль 2001 г. [1] .
- [2] Бейли, Регина. «Юджина Клетки». ThoughtCo, 26 января 2018 г., [2].
- [3] Фигл, Мэдисон и Дж. Д. Френч. «Вольвокс Катери». Microbe Wiki, 28 апреля 2018 г., [3].
- [4] «Жгутиконосцы». Экологический рычаг, 2003, [4].
- [5] «Жгутиковые (протозойные)». Точка назначения, [5].
- [6] Паланде, Лина. «Факты о Вольвокс». Биология Мудрая, [6].
- [7] «Простейшие паразиты». Парасайт, [7].
- [8] Сетиа, Вину и Тинли Калсанг Бхутиа. «Бичеватье». Британика, 28 марта 2018 г., [8].
- [9] «Структура и иллюстрация Эвглены». Время снов, [9].
- [10] Britannica, T. Editors of Encyclopaedia. «Фитофлагеллят». Британская энциклопедия, 17 декабря 2012 г.
 https://www.britannica.com/science/phytoflagellate.
https://www.britannica.com/science/phytoflagellate. - [11] Хантер, С.Х. Провасоли, Луиджи. 1951. Фитофлагелляты. Биохимия и физиология простейших. стр. 28-127. https://doi.org/10.1016/B978-1-4832-3139-6.50006-9
- [12] Cavalier, Smith T. 1955. Филогенез и классификация зоофлагеллят. Цитология. 37(11):1010-29. https://pubmed.ncbi.nlm.nih.gov/8868448/
- Бринкманн, К. (1968). Keine Geotaxis bei Euglena. З. Пфланценфизиол. 59, 12-16.
- Хедер, Д.-П. (1991). Фототаксис и гравитаксис у Euglena грацилис. В Биофизика фоторецепторов и фотодвижений in Microorganisms (ред. Lenci, F., Ghetti, F., Colombetti, Г., Хедер, Д.-П. и Песня, П.-С.). Пленум Пресс, Нью-Йорк и Лондон, 203-221.
- Хедер, Д.-П. (1987). Поляротаксис, гравитационный и вертикальный фототаксис у зеленого жгутиконосца Euglena gracilis. Арх. микробиол. 147, 179-183.
- Кесслер, Дж. О., Хилл, Н. А. и Хедер, Д.-П. (1992). Ориентация плавающих жгутиконосцев при одновременном воздействии внешние факторы. J. Phycol. 28, 816-822.
- Галланд, П. и Липсон, Э. Д. (1985). Модифицированные спектры действия фотогеотропное равновесие у мутантов Phycomyces blakesleeanus с дефектами в генах madA, madß, madC и madH. Фотохим. Фотобиол. 41, 331-335.
- Старр, RC (1964).
 Коллекция культур водорослей в Индиане
Университет. амер. Дж. Бот. 51, 1013-1044.
Коллекция культур водорослей в Индиане
Университет. амер. Дж. Бот. 51, 1013-1044. - Хедер, Д.-П. и Фогель, К. (1991). Одновременное отслеживание жгутиконосцев в режиме реального времени с помощью анализа изображений. Дж. Матем. биол. 30, 63-72.
- Хедер, Д.-П. и Фогель, К. (1991). Отслеживание в режиме реального времени микроорганизмы. В Анализ изображений в биологии . (Д.-П. Хадер). CRC-Пресс, 289-313.
- Хедер, Д.-П., Фогель, К. и Шефер, Дж. (1990). Ответы фотосинтезирующего жгутиконосца Euglena gracilis, микрогравитация. Микрогравитация III/2, 110-116.
- Фогель, К., Хеммерсбах-Краузе, Р., Кюнель, К. и Хедер, Д.-П. (1993). Плавающее поведение одноклеточного жгутиконосца, Euglena gracilis в смоделированной и реальной условиях микрогравитации. микрограв. науч. Технол. 5, 232-237.
- Махемер, Х., Махемер-Рёниш, С., Бройкер, Р. и
Такахаши, К. (1991). Гравикинез у Paramecium: теория и
выделение физиологической реакции на естественную гравитацию
вектор.
 Дж. Комп. физ. 168, 1-12.
Дж. Комп. физ. 168, 1-12. - Хеммерсбах-Краузе Р., Бриглеб В., Фогель К. и Хедер Д.- П. (1993). Скорость плавания Paramecium в условиях невесомости. Акта Протозол. 32, 229-236.
- Кюнель-Кратц, К., Шефер, Дж. и Хедер, Д.-П. (1993). Фототаксис у жгутиконосца Euglena gracilis под эффект микрогравитации. Микрогр. науч. Технол. 4, 188-193.
- Хедер, Д.-П., Розум, А., Шефер, Дж. и Хеммерсбах, Р. (1995). Гравитаксис у жгутиковых Euglena gracilis контролируется активным гравирецептором. Дж. Завод Физиол. 146, 474-480
Опубликовано:
3
33
3 май 1988 г. История статьи
Получен:
09 октября 1987 г.
Полученная ревизия:
07 декабря 1987 г.
Принято:
10 декабря 1987 г.
Опубликовано:
01 мая 1988
Фильтр поиска панели навигации
FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic
Термин поиска на микросайте
Advanced Search
Под воздействием солнечной радиации популяция двигалась вниз по колонке, вероятно, руководствуясь отрицательным фототаксисом, и образовывала плотный слой внизу. Предполагается, что такое поведение дает организмам возможность убежать от пагубного яркого света. Движение вниз происходит быстрее, чем позволяет скорость плавания клеток, и может быть ускорено гидромеханическим эффектом. Восходящее движение, наблюдаемое ночью, может быть связано с точным отрицательным гравитационным полем, наблюдаемым в организмах. Эти антагонистические типы поведения позволяют организмам активно искать и оставаться в районах с подходящими условиями. Автоматический подсчет клеток, Euglena gracilis , Жгутиконосец, Гравитаксис, Фотодвижение, Вертикальное распределение
[1]
Häder
D.-P.
(
1987
)
Фотодвижение у эукариотических микроорганизмов
Фотобиохим. Фотобиофиз. Доп.
Фотобиофиз. Доп.
,
203
–
214
.
[2]
Нульч
В.
Хедер
Д.-П.
(
1987
)
Фотодвижение в подвижных микроорганизмах II
Photochem. Фотобиол.
, в печати.
[3]
Дин
Б.
(
1969
)
Фототаксическая реакция Euglena на одиночные и повторяющиеся импульсы актинического света
Exp. Клетка. Рез.
,
56
,
375
–
381
.
[4]
Даути
M.J.
Diehn
B.
(
1980
)
Флавины как пигменты фоторецепторов для поведенческих реакций
Struct. Связь.
,
41
,
45
–
70
.
[5]
Даути
М.Дж.
Дин
Б.
(
1983
)
Фотосенсорная трансдукция у жгутиковых водорослей, Euglena gracilis . IV. Долгосрочные эффекты ионов и pH на проявление понижающего фотоповедения
Arch. микробиол.
,
134
,
204
–
207
.
[6]
Даути
М. Дж.
Дин
Б.
(
1984
)
Анионная чувствительность подвижности и снижение фотофобных реакций Euglena gracilis
Arch. микробиол.
,
138
,
329
–
332
.
[7]
Волкен
Дж.Дж.
Голень
E.
(
1958
)
Фотодвижение в Euglena gracilis . I. Фотокинез. II. Фототаксис
J. Protozool.
,
5
,
39
–
46
.
[8]
Дженнингс
Х.С.
(
1904
)
Реакции на свет у инфузорий и жгутиковых
, В
Вклад в изучение поведения микроорганизмов
стр.
29
–
71
Институт Карнеги. Вашингтон
, Вашингтон.
[9]
Будер
Дж.
(
1917
)
Zur Kenntnis der phototaktischen Richtungsbewegungen
Jahrber. Wissenschaftl. Ботаник
,
58
,
105
–
220
.
[10]
Мачта
S.O.
(
1911
)
Свет и поведение организмов
John Wiley & Sons
New York Chapman & Hall London.
[11]
Colombetti
G.
Häder
D.-P.
Lenci
F.
Quaglia
M.
(
1982
)
Фототакси в Euglena gracilis : Влияние азида натрия и иона трифенилметилфосфония на цепь фотосенсорной трансдукции
Curr. микробиол.
,
7
,
281
–
284
.
[12]
Хедер
Д. -П.
-П.
Коломбетти
Г.
Ленчи
Ф.
Куалья
М.
(
1981
)
Фототаксис у жгутиковых, Euglena gracilis и Ochromonas danica
Arch. микробиол.
,
130
,
78
–
82
.
[13]
Хедер
Д.-П.
(
1986
)
Влияние солнечного и искусственного УФ-облучения на подвижность и фототаксис жгутиковых, Euglena gracilis
Фотохим. Фотобиол.
,
44
,
651
–
656
.
[14]
Хедер
Д.-П.
(
1987
)
Поляротаксис, гравитационный и вертикальный фототаксис у зеленых жгутиконосцев, Euglena gracilis
Arch. микробиол.
,
147
,
179
–
183
.
[15]
Кесслер
Дж.О.
(
1985
)
Гидродинамическая фокусировка мотивных клеток водорослей
Природа (Лондон)
,
313
,
218
—
2209
.
[16]
Кесслер
Дж.О.
(
1986
)
Внешняя динамика плавающих микроорганизмов
В
Прогресс в фикологических исследованиях
(
Chapman
, PP
258
—
307
Biopress Ltd
4.
[17]
Senger
H.
(
1987
) 8-е изд.,
Том. I и II
, In
Реакции синего света: явления и встречаемость в растениях и микроорганизмах
CRC Press
, Бока-Ратон, Флорида.
[18]
Бенедетти
П. А.
А.
Чекуччи
А.
(
1975
)
Пигменты Paraflagellar body (PFB), изученные с помощью флуоресцентной микроскопии у Euglena gracilis
Plant Sci. лат.
,
4
,
47
–
51
.
[19]
Гетти
F.
Colombetti
G.
Lenci
F.
Campani
E.
Polacco
E.
Quaglia
M.
(
1985
)
Флуоресценция фоторецепторного пигмента Euglena gracilis : микроспектрофлуориметрическое исследование in vivo
Photochem. Фотобиол.
,
42
,
29
–
33
.
[20]
Бэнкрофт
F.W.
(
1913
)
Гелиотропизм, дифференциальная чувствительность и гальванотропизм у Euglena
J. Exp. Зоол.
,
15
,
383
–
420
.
[21]
Хедер
Д.-П.
Леберт
М.
ДиЛена
М.Р.
(
1986
)
Новые данные о механизме фототаксической ориентации Euglena gracilis
Curr. микробиол.
,
14
,
157
–
163
.
[22]
Хедер
Д.-П.
Леберт
М.
(
1985
)
Компьютерное отслеживание подвижных микроорганизмов в режиме реального времени
Photochem. Фотобиол.
,
42
,
509
–
514
.
[23]
Чеккучи
А.
Коломбетти
Г.
Феррара
Р.
Ленчи 903
4
2.
( 1976
)
Дальнейший анализ массовых фотоответов Euglena gracilis Klebs (жгутиковая эвгленоидина)
Monit. Зоол. итал.
,
10
,
271
–
277
.
[24]
Хедер
Д.-П.
(
1985
)
Влияние УФ-В на подвижность и фотоповедение зеленых жгутиконосцев, Euglena gracilis
Arch. микробиол.
,
141
,
159
–
163
.
[25]
Lenci
F.
Colombetti
G.
Häder
D.-P.
(
1983
)
Роль флавиновых гасителей и ингибиторов в сенсорной передаче отрицательного фототаксиса у жгутиконосцев, Euglena gracilis
Curr. микробиол.
,
9
,
285
–
290
.
[26]
Хедер
Д.-П.
Грибенов
К.
(
1987
)
Универсальный анализ цифровых изображений с помощью микрокомпьютера для подсчета микроорганизмов
EDV Med. биол.
,
18
,
37
–
42
.
[27]
Хедер
Д.-П.
(
1986
)
The effect of enhanced solar UV-B radiation on motile microorganisms
In
Stratospheric Ozone Reduction, Solar Ultraviolet Radiation and Plant Life
(
Worrest
R. C.
C.
Caldwell
MM
, ред.), стр.
223
–
233
Springer Verlag
, Берлин, Гейдельберг, Нью-Йорк.
[28]
Верма
М.Н.
(
1967
)
Суточные колебания в рыбном пруду в Сеони, Индия
Hydrobiol.
,
30
,
129
–
137
.
Этот контент доступен только в формате PDF.
© 1988 Федерация европейских микробиологических обществ
© 1988 Федерация европейских микробиологических обществ
Раздел выпуска:
Статьи
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Оповещение о текущей проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Конвергентная структура с дивергентными адаптациями в комбинаторных микробиомных сообществах
Литоавтотрофный образ жизни широко распространенного рода Roseovarius, выявленный при физиологической и геномной характеристике Roseovarius autotrophicus sp. ноябрь
ноябрь
Летучие вещества, выделяемые Beauveria bassiana, вызывают поведение яйцекладки осенней совки Spodoptera frugiperda (Lepidoptera: Noctuidae)
Сезонные колебания температурной чувствительности бактериального роста в почве и озере умеренного пояса
Отслеживание порчи бактерий в микробиоме тунца
Реклама
жгутиконосцев эвгленоидных: многогранная биотехнологическая платформа
Обзор
. 2015 20 мая; 202:135-45.
doi: 10.1016/j.jbiotec.2014.11.035.
Epub 2014 16 декабря.
Юрай Крайчович 1 , Матей Вестег 2 , Стивен Д. Шварцбах 3
Принадлежности
Обзор
Юрай Крайчович и др.
Дж Биотехнолог. .
. 2015 20 мая; 202:135-45.
doi: 10.1016/j.jbiotec.2014.11.035.
Epub 2014 16 декабря.
Авторы
Юрай Крайчович 1 , Матей Вестег 2 , Стивен Д. Шварцбах 3
Принадлежности
Абстрактный
Эвгленоидные жгутиконосцы — это в основном пресноводные протисты, растущие в самых разных средах, что делает их хорошо подходящими для множества биотехнологических приложений. Фототрофные эвглениды обладают сложными хлоропластами зелено-водорослевого происхождения, ограниченными тремя мембранами. Организация ядерного и пластидного генома эвглены, структура генов и экспрессия генов заметно отличаются от других организмов. Наши наблюдения на модельном организме Euglena gracilis показывают, что транскрипция как пластидного, так и ядерного генома нечувствительна к изменениям окружающей среды и что экспрессия генов регулируется в основном на посттранскрипционном уровне. Пластиды Euglena были предложены в качестве места для производства белков и метаболитов с добавленной стоимостью, представляющих биотехнологический интерес. Было показано, что эвглена является подходящим видом простейших для производства нескольких соединений, используемых в производстве космецевтических и нутрицевтических препаратов, таких как α-токоферол, эфиры воска, полиненасыщенные жирные кислоты, биотин и тирозин. Запасной полисахарид парамилон обладает иммуностимулирующими свойствами и перспективен для производства биоматериалов. Биомасса эвглены может использоваться в качестве пищевой добавки в аквакультуре и в кормах для животных. Различные применения эвглены в экологической биотехнологии включают оценку экотоксикологического риска, биоремедиацию тяжелых металлов, биоремедиацию промышленных сточных вод и загрязненной воды.
Пластиды Euglena были предложены в качестве места для производства белков и метаболитов с добавленной стоимостью, представляющих биотехнологический интерес. Было показано, что эвглена является подходящим видом простейших для производства нескольких соединений, используемых в производстве космецевтических и нутрицевтических препаратов, таких как α-токоферол, эфиры воска, полиненасыщенные жирные кислоты, биотин и тирозин. Запасной полисахарид парамилон обладает иммуностимулирующими свойствами и перспективен для производства биоматериалов. Биомасса эвглены может использоваться в качестве пищевой добавки в аквакультуре и в кормах для животных. Различные применения эвглены в экологической биотехнологии включают оценку экотоксикологического риска, биоремедиацию тяжелых металлов, биоремедиацию промышленных сточных вод и загрязненной воды.
Ключевые слова: хлоропласты; экотоксикология; парамилон; токоферол; Эфиры воска.
Copyright © 2014 Elsevier B.V. Все права защищены.
Похожие статьи
Посмотреть все похожие статьи
Цитируется
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Идентификация жгутикового белка, участвующего в гравитаксисе у жгутиковых Euglena gracilis
Abstract
Жгутиковые клетки имеют большое эволюционное значение для всех видов животных и растений. В отличие от высших растений жгутиковые клетки участвуют в размножении макроводорослей, а также у ранних дивергирующих наземных растений. Euglena gracilis — новый жгутиковый модельный организм. В текущем исследовании сообщается, что специфический кальмодулин (CaM2), участвующий в гравитации E. gracilis , взаимодействует с эволюционно консервативным жгутиковым белком EgPCDUF4201. Последующий молекулярный анализ ясно показал, что EgPCDUF4201 также участвует в гравитации. Мы выполнили субклеточную локализацию CaM2 с помощью иммуноблотинга и непрямой иммунофлуоресценции. С помощью двухгибридного скрининга дрожжей EgPCDUF4201 был идентифицирован как партнер по взаимодействию с CaM2. С-конец EgPCDUF4201 отвечает за взаимодействие с CaM2. Замалчивание N- и C-концов EgPCDUF4201 с помощью РНКи приводило к нарушению гравитации. Более того, анализ непрямой иммунофлуоресценции показал, что EgPCDUF4201 представляет собой белок, ассоциированный с жгутиками. В текущем исследовании были специально рассмотрены некоторые важные вопросы, касающиеся цепи передачи сигнала гравитаксиса в Е. gracilis . Помимо того факта, что это улучшило текущее понимание механизмов восприятия гравитации у E. gracilis , оно также породило несколько интересных исследовательских вопросов, касающихся функции домена неизвестной функции 4201 в жгутиковых клетках.
gracilis , взаимодействует с эволюционно консервативным жгутиковым белком EgPCDUF4201. Последующий молекулярный анализ ясно показал, что EgPCDUF4201 также участвует в гравитации. Мы выполнили субклеточную локализацию CaM2 с помощью иммуноблотинга и непрямой иммунофлуоресценции. С помощью двухгибридного скрининга дрожжей EgPCDUF4201 был идентифицирован как партнер по взаимодействию с CaM2. С-конец EgPCDUF4201 отвечает за взаимодействие с CaM2. Замалчивание N- и C-концов EgPCDUF4201 с помощью РНКи приводило к нарушению гравитации. Более того, анализ непрямой иммунофлуоресценции показал, что EgPCDUF4201 представляет собой белок, ассоциированный с жгутиками. В текущем исследовании были специально рассмотрены некоторые важные вопросы, касающиеся цепи передачи сигнала гравитаксиса в Е. gracilis . Помимо того факта, что это улучшило текущее понимание механизмов восприятия гравитации у E. gracilis , оно также породило несколько интересных исследовательских вопросов, касающихся функции домена неизвестной функции 4201 в жгутиковых клетках.
Введение
Euglena gracilis представляет собой фотосинтезирующий эукариотический одноклеточный организм, который является представителем Euglenozoa вместе с паразитами родов Трипанозома и Leishmania 1 . Хотя эта филогенетическая группа развилась независимо от Archaeplastida (включая зеленые водоросли), E. gracilis содержит хлоропласты, окруженные тремя мембранами, вероятно, приобретенными в результате вторичного эндосимбиоза зеленой водоросли 2 . Кроме того, в отсутствие достаточного источника света E. gracilis также могут потреблять питательные вещества гетеротрофно.
E. gracilis реагирует на различные сигналы окружающей среды, такие как кислород, свет и гравитация 3,4 . Среди этих раздражителей большое значение для E. gracilis имеют свет и гравитация, поскольку баланс между отрицательным гравитационным движением (направленным движением от гравитации) и положительным фототаксисом (направленным движением к источнику света) помогает клеткам достичь оптимальной ниши в воде. столбец 5 .
столбец 5 .
Преимущественно E. gracilis демонстрирует отрицательное поведение гравитации. Однако, как показано в стандартных лабораторных условиях, клетки демонстрируют переход от положительного к отрицательному гравитаксису по мере роста культуры от молодых к старым соответственно. Показано, что в условиях параболического полета (переход от гипер-g к микро-g, а также от микро-g к гипер-g) такая ориентация является активным физиологическим процессом, в котором участвует биение жгутиков и контролируется гравитацией 6 . Влияние условий микрогравитации на экспрессию генов изучалось также во время полета космического корабля 7 . Однако точная природа рецептора, ответственного за гравитаксис, еще не выяснена у E. gracilis . Первоначальное исследование ингибиторов установило участие чувствительных к растяжению кальциевых ионных каналов (SSCIC) в гравитации 8 . Кроме того, участие предполагаемого переходного рецепторного потенциала (TRP) было предложено в последующем исследовании с использованием РНК-интерференции 9 (РНКи). Однако в этом направлении требуются дополнительные исследования, так как несколько предполагаемых чувствительных к растяжению/механочувствительных каналов были идентифицированы в библиотеке мРНК E. gracilis (неопубликованные данные). Помимо этого открытого вопроса относительно точной природы SSCIC, специфичного для гравитаксиса, был достигнут разумный прогресс в отношении лежащего в основе молекулярного механизма гравитаксиса у E. gracilis . Например, текущая рабочая модель гравитации была создана на основе серии экспериментов 9.1155 10 . Рабочая модель предполагает, что SSCIC активируются, когда клетки отклоняются от своего пути вертикального плавания, что приводит к притоку ионов кальция. В свою очередь, кальций связывается с кальмодулином, который дополнительно активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназу А, которая, как предполагается, модулирует функции различных белков жгутиков. Недавно подавление специфической протеинкиназы А (PKA) с помощью РНКи прояснило ее участие в гравитации, а также в фототаксисе 11 .
Однако в этом направлении требуются дополнительные исследования, так как несколько предполагаемых чувствительных к растяжению/механочувствительных каналов были идентифицированы в библиотеке мРНК E. gracilis (неопубликованные данные). Помимо этого открытого вопроса относительно точной природы SSCIC, специфичного для гравитаксиса, был достигнут разумный прогресс в отношении лежащего в основе молекулярного механизма гравитаксиса у E. gracilis . Например, текущая рабочая модель гравитации была создана на основе серии экспериментов 9.1155 10 . Рабочая модель предполагает, что SSCIC активируются, когда клетки отклоняются от своего пути вертикального плавания, что приводит к притоку ионов кальция. В свою очередь, кальций связывается с кальмодулином, который дополнительно активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназу А, которая, как предполагается, модулирует функции различных белков жгутиков. Недавно подавление специфической протеинкиназы А (PKA) с помощью РНКи прояснило ее участие в гравитации, а также в фототаксисе 11 . В другом исследовании подавление специфического белка кальмодулина 2 (CaM2) привело только к нарушению гравитации у E. gracilis 12 .
В другом исследовании подавление специфического белка кальмодулина 2 (CaM2) привело только к нарушению гравитации у E. gracilis 12 .
В этом отчете представлена информация о субклеточной локализации CaM2, а также об идентификации партнера по взаимодействию с использованием дрожжевого двухгибридного скрининга. Полученный партнер по связыванию был дополнительно охарактеризован гетерологичной экспрессией, анализом in silico и его субклеточной локализацией.
Результаты
CaM2 присутствует в теле клетки и жгутиках
E. gracilis Чтобы лучше понять функцию CaM2, мы стремились идентифицировать его субклеточную локализацию с помощью непрямой иммунофлуоресценции (IIF) и клеточного фракционирования с последующим вестерн-блоттингом с использованием геномных антител против CaM2. Перед экспериментами по иммунолокализации определяли специфичность коммерчески выращенного геномного антитела против CaM2. Были использованы геномные антитела, облегчающие обнаружение антигена в его денатурированной и нативной конформации. Их реакция на 9Белковый лизат 1334 E. gracilis (дополнительный рисунок 1a) и CaM2, слитый с глутатион-S-трансферазой (GST, дополнительный рисунок 1b), проверяли в денатурирующих условиях с помощью вестерн-блоттинга. Оба эксперимента показали одну полосу ожидаемого размера. Специфичность была дополнительно подтверждена путем создания нокдаун-мутанта (дополнительная фигура 1c). Белковые лизаты дикого типа и мутанта анализировали вестерн-блоттингом с антителом против CaM2. В то время как контроль с антителом против тубулина показал равное количество белков в двух образцах, в нокдаун-мутанте с антителом против CaM2 белок не был обнаружен. В целом эти данные подтвердили специфичность антитела против CaM2.
Были использованы геномные антитела, облегчающие обнаружение антигена в его денатурированной и нативной конформации. Их реакция на 9Белковый лизат 1334 E. gracilis (дополнительный рисунок 1a) и CaM2, слитый с глутатион-S-трансферазой (GST, дополнительный рисунок 1b), проверяли в денатурирующих условиях с помощью вестерн-блоттинга. Оба эксперимента показали одну полосу ожидаемого размера. Специфичность была дополнительно подтверждена путем создания нокдаун-мутанта (дополнительная фигура 1c). Белковые лизаты дикого типа и мутанта анализировали вестерн-блоттингом с антителом против CaM2. В то время как контроль с антителом против тубулина показал равное количество белков в двух образцах, в нокдаун-мутанте с антителом против CaM2 белок не был обнаружен. В целом эти данные подтвердили специфичность антитела против CaM2.
Определение субклеточной локализации CaM2 проводили путем исследования клеточного фракционирования с последующим вестерн-блоттингом и анализом IIF. Было проведено разделение клеточного тела и фракции жгутиков, и чистота была подтверждена микроскопически (дополнительная фигура 2). Количественный Вестерн-блот четко показал, что CaM2 был в изобилии во фракции тел клеток, тогда как видимый сигнал CaM2 не наблюдался во фракции жгутиков (рис. 1a). Кроме того, анализ IIF показал, что CaM2 рассеян по всему телу клетки в виде пятен, но слабый сигнал также был виден в жгутике (рис. 1b, c). Чтобы подтвердить специфичность сигнала, культура клеток с нокдауном CaM2 9Было создано 1334 E. gracilis . Как в клетках дикого типа, так и в нокдаун-мутантных клетках сигнал проявлялся в виде пятен (дополнительная фигура 3). Однако количественный анализ показал, что количество пятен значительно уменьшилось в мутантных клетках с нокдауном, что доказывает, что пятнистый узор представляет собой специфический сигнал (дополнительная фигура 3c). Хотя CaM обычно являются растворимыми белками, CaM2 проявлялся в виде агрегированных пятен. Чтобы определить, является ли CaM2 цитоплазматическим белком, был создан слитый белок GST-CaM2, который был экспрессирован в кишечная палочка . Использовали растворимую фракцию приготовленного неочищенного белкового лизата GST-CaM2 трансформированных клеток E.
Количественный Вестерн-блот четко показал, что CaM2 был в изобилии во фракции тел клеток, тогда как видимый сигнал CaM2 не наблюдался во фракции жгутиков (рис. 1a). Кроме того, анализ IIF показал, что CaM2 рассеян по всему телу клетки в виде пятен, но слабый сигнал также был виден в жгутике (рис. 1b, c). Чтобы подтвердить специфичность сигнала, культура клеток с нокдауном CaM2 9Было создано 1334 E. gracilis . Как в клетках дикого типа, так и в нокдаун-мутантных клетках сигнал проявлялся в виде пятен (дополнительная фигура 3). Однако количественный анализ показал, что количество пятен значительно уменьшилось в мутантных клетках с нокдауном, что доказывает, что пятнистый узор представляет собой специфический сигнал (дополнительная фигура 3c). Хотя CaM обычно являются растворимыми белками, CaM2 проявлялся в виде агрегированных пятен. Чтобы определить, является ли CaM2 цитоплазматическим белком, был создан слитый белок GST-CaM2, который был экспрессирован в кишечная палочка . Использовали растворимую фракцию приготовленного неочищенного белкового лизата GST-CaM2 трансформированных клеток E. coli , и слитый белок очищали. Экспрессия GST-CaM2 из растворимой фракции клеточного лизата указывает на то, что GST-CaM2 экспрессируется в виде растворимого белка в E. coli (рис. 2).
coli , и слитый белок очищали. Экспрессия GST-CaM2 из растворимой фракции клеточного лизата указывает на то, что GST-CaM2 экспрессируется в виде растворимого белка в E. coli (рис. 2).
Рисунок 1 CaM2 находится в теле клетки E. gracilis . ( a ) Вестерн-блоты клеточных фракций с антителом CaM2 (верхняя панель) и антителом к тубулину (средняя панель). ( b , c ) Непрямой иммунофлуоресцентный анализ с антителом против CaM2. Масштабная линейка = 20 мкм.
Полноразмерное изображение
Рисунок 2 Гетерологическая экспрессия и очистка GST-CaM2. ( a ) Окрашенный кумасси SDS-полиакриламидный гель неочищенного (пропускание и промывка) и очищенного (элюирование) GST (слева) и GST-CaM2 (справа). ( b ) Вестерн-блоттинг, обнаруженный с помощью моноклонального антитела к GST.
Изображение полного размера
CaM2 взаимодействует с белком неизвестной функции
Чтобы лучше понять роль CaM2 в гравитационном движении E. gracilis , был проведен двухгибридный скрининг дрожжей для поиска их предполагаемых партнеров по взаимодействию с использованием нормализованной библиотеки кДНК E. gracilis , выращенной в коммерческих целях. Четыре клона, идентифицированные при скрининге, оказались положительными в анализе ретрансформации. Среди них был обнаружен белок, содержащий домен неизвестной функции (DUF) 4201, названный EgPCDUF4201. 5′- и 3′-ПЦР RACE проводили для получения полноразмерной последовательности кДНК Например, PCDUF4201 . Полученная полноразмерная последовательность кДНК EgPCDUF4201 кодировала белок из 372 аминокислот. Анализ in silico для выявления потенциальных дополнительных консервативных доменов показал, что, в дополнение к домену DUF4201, 5 спирально-спиральным доменам, предсказанный мотив IQ (104–123 остатка) и предполагаемый сайт связывания кальмодулина (202–221 остат. ) присутствовали (рис. 3а). Поиск потенциальных сайтов фосфорилирования выявил 6 сайтов фосфорилирования серина, 2 треонина и 1 сайт фосфорилирования тирозина в различных положениях в последовательности EgPCDUF4201 (рис.
gracilis , был проведен двухгибридный скрининг дрожжей для поиска их предполагаемых партнеров по взаимодействию с использованием нормализованной библиотеки кДНК E. gracilis , выращенной в коммерческих целях. Четыре клона, идентифицированные при скрининге, оказались положительными в анализе ретрансформации. Среди них был обнаружен белок, содержащий домен неизвестной функции (DUF) 4201, названный EgPCDUF4201. 5′- и 3′-ПЦР RACE проводили для получения полноразмерной последовательности кДНК Например, PCDUF4201 . Полученная полноразмерная последовательность кДНК EgPCDUF4201 кодировала белок из 372 аминокислот. Анализ in silico для выявления потенциальных дополнительных консервативных доменов показал, что, в дополнение к домену DUF4201, 5 спирально-спиральным доменам, предсказанный мотив IQ (104–123 остатка) и предполагаемый сайт связывания кальмодулина (202–221 остат. ) присутствовали (рис. 3а). Поиск потенциальных сайтов фосфорилирования выявил 6 сайтов фосфорилирования серина, 2 треонина и 1 сайт фосфорилирования тирозина в различных положениях в последовательности EgPCDUF4201 (рис. 3а). Для более точного определения области, взаимодействующей с CaM2, было протестировано взаимодействие полноразмерного белка-приманки CaM2 с полной длиной (1–372 аминокислоты), N-концевым укорочением (1–198 аминокислот) и укорочение С-конца (199–372 аминокислоты) EgPCDUF4201. Результаты показали, что C-концевой домен (199–372 аминокислоты) EgPCDUF4201 взаимодействует с CaM2, тогда как N-концевой домен не взаимодействует (рис. 3b). Более того, полноразмерный EgPCDUF4201 также был способен взаимодействовать с CaM2, но в меньшей степени (рис. 3б).
3а). Для более точного определения области, взаимодействующей с CaM2, было протестировано взаимодействие полноразмерного белка-приманки CaM2 с полной длиной (1–372 аминокислоты), N-концевым укорочением (1–198 аминокислот) и укорочение С-конца (199–372 аминокислоты) EgPCDUF4201. Результаты показали, что C-концевой домен (199–372 аминокислоты) EgPCDUF4201 взаимодействует с CaM2, тогда как N-концевой домен не взаимодействует (рис. 3b). Более того, полноразмерный EgPCDUF4201 также был способен взаимодействовать с CaM2, но в меньшей степени (рис. 3б).
Рисунок 3 EgPCDUF4201 взаимодействует с CaM2. ( a ) Белковые домены EgPCDUF4201. ( b ) Двухгибридный анализ дрожжей между CaM2 и усечениями EgPCDUF4201. BD = связывающий домен. AD = домен активации. FL = полная длина. C-ter = C-конец. N-тер = N-конец. SD-TL (синтетическая определяющая среда без лейцина и триптофана). SD-TLAH (синтетическая определяющая среда без лейцина, триптофана, аденина и гистидина).
Изображение в натуральную величину
Функциональный анализ предполагаемого партнера по взаимодействию CaM2
Чтобы понять функцию идентифицированного предполагаемого партнера по взаимодействию CaM2, с использованием РНКи было проведено молчание EgPCDUF4201 . Были выбраны две области генов, первая в N-концевой области, вторая в домене DUF4201. Понижающая регуляция гена была подтверждена ПЦР в реальном времени (дополнительная фигура 4). Оба нокдаун-мутанта EgPCDUF4201 продемонстрировал нарушение гравитации со случайной ориентацией их схемы плавания, аналогично CaM2 нокдаун-мутантам 12 и в отличие от дикого типа, где большинство клеток плывут вверх (рис. 4, дополнительная фигура 6) . Однако скорость плавания мутантов не изменилась (дополнительная таблица 1), что может исключить дефектное образование жгутиков. Эти результаты предоставили доказательства того, что EgPCDUF4201 участвует в гравитации E. gracilis и разделяет функциональную ассоциацию с CaM2.
Рисунок 4 EgPCDUF4201 участвует в гравитаксисе Euglena gracilis . Репрезентативные гистограммы направленных перемещений дикого типа ( a ) и EgPCDUF4201 С-концевой мишени ( b ) и N-концевой мишени ( c ) нокдаун-мутантов. Размер угловых секторов (обозначенных черным цветом) отражает количество клеток, движущихся в соответствующем направлении.
Изображение в натуральную величину
EgPCDUF4201 представляет собой растворимый жгутиковый белок
Для иммунолокализации EgPCDUF4201 на субклеточном уровне использовали поликлональную мышиную антисыворотку, полученную с использованием полноразмерного белка EgPCDUF4201. Анализ IIF ясно показал, что EgPCDUF4201 присутствует в жгутиках E. gracilis от основания к вершине в виде пунктирной схемы (рис. 5a,b), тогда как в преиммунной сыворотке не наблюдалось никакой иммунной реактивности. (Дополнительный рисунок 5а). Для дальнейшей проверки этого сигнала, 9Культура нокдаун-мутанта 1334 EgPCDUF4201 была получена. У мутанта с нокдауном по сравнению с диким типом наблюдалось снижение интенсивности флуоресценции и количества пятен, что подтверждает специфичность антисыворотки против EgPCDUF4201 (дополнительная фигура 5a). Кроме того, длину жгутиков мутанта с нокдауном также определяли, чтобы понять их предполагаемое участие в структуре жгутиков. Не наблюдалось статистически значимой разницы в длине жгутиков EgPCDUF4201 нокдаун-мутантных клеток по сравнению с клетками дикого типа (дополнительная фигура 5c). Наконец, локализация EgPCDUF4201 не изменилась у нокдаун-мутанта CaM2 (дополнительная фигура 6).
У мутанта с нокдауном по сравнению с диким типом наблюдалось снижение интенсивности флуоресценции и количества пятен, что подтверждает специфичность антисыворотки против EgPCDUF4201 (дополнительная фигура 5a). Кроме того, длину жгутиков мутанта с нокдауном также определяли, чтобы понять их предполагаемое участие в структуре жгутиков. Не наблюдалось статистически значимой разницы в длине жгутиков EgPCDUF4201 нокдаун-мутантных клеток по сравнению с клетками дикого типа (дополнительная фигура 5c). Наконец, локализация EgPCDUF4201 не изменилась у нокдаун-мутанта CaM2 (дополнительная фигура 6).
Рисунок 5 EgPCDUF4201 представляет собой растворимый белок, локализованный в жгутиках E. gracilis . ( a , b ) Непрямой иммунофлуоресцентный анализ с использованием иммунной сыворотки против EgPCDUF4201. ( c ) Вестерн-блот слияния GST-EgPCDUF4201 с антителом GST.
Изображение в полный размер
Кроме того, чтобы определить, является ли белок ассоциированным с мембраной или растворимым, слитый белок GST-EgPCDUF4201 экспрессировали в E. coli , и с растворимой фракцией проводили вестерн-блоттинг. Антитело к GST обнаружило слитый белок, показав, что EgPCDUF4201 экспрессируется в виде растворимого белка в E. coli (рис. 5c).
coli , и с растворимой фракцией проводили вестерн-блоттинг. Антитело к GST обнаружило слитый белок, показав, что EgPCDUF4201 экспрессируется в виде растворимого белка в E. coli (рис. 5c).
DUF 4201 присутствует в широком диапазоне организмов
Был проведен поиск BLAST, чтобы определить, какие организмы обладают белками с DUF 4201. Помимо присутствия в близкородственных организмах Trypanosoma и Leishmania этот домен был обнаружен у очень широкого круга видов. У водорослей и растений этот домен присутствует в доступных геномах жгутиковых водорослей (, например, Chlamydomonas ), бурых водорослей Ectocarpus siliculosus , чьи гаметы и споры жгутиковые, и ранних дивергирующих наземных растений, использующих сперматозоиды. размножаться ( например мохообразные Physcomitrella и Marchantia и ликофиты Sellaginella ), но не обнаружен в геномах покрытосеменных растений. Этот домен был обнаружен не только в геномах растений, но также присутствует в грибах и животных. Эти данные показали, что домен DUF 4201 чрезвычайно консервативен во всех филогенетических группах, которые в какой-то момент своего жизненного цикла обладают жгутиковыми клетками.
Эти данные показали, что домен DUF 4201 чрезвычайно консервативен во всех филогенетических группах, которые в какой-то момент своего жизненного цикла обладают жгутиковыми клетками.
Обсуждение
Предыдущий отчет показал участие специфического кальмодулина, CaM2, в цепи передачи гравитационного сигнала E. gracilis в результате гравитаксиса 12 . Текущее исследование предоставляет подробный отчет о субклеточной локализации CaM2 и определяет новый фактор, участвующий в гравитации.
Исследование фракционирования клеток показало, что CaM2 находится в теле клетки E. gracilis , но во фракции жгутиков не было обнаружено сигнала. Однако анализы IIF показали, что CaM2 в изобилии присутствует в теле клетки и в незначительном количестве также в жгутиках. Кроме того, в растворимой фракции клеточного лизата были обнаружены как эндогенные, так и гетерологичные белки CaM2 (GST-CaM2). Однако анализ IIF показывает, что белок агрегирует и проявляется в виде пятен. Аналогичная закономерность была обнаружена и для других растворимых белков. Например, было показано, что в нейрональных клетках CaM-зависимая протеинкиназа II (CaMKII) самоагрегируется вблизи эндоплазматического ретикулума при определенных стрессовых условиях 13 . Следовательно, у E. gracilis , как и в нейрональных клетках, клеточный стресс перед фиксацией клеток может привести к агрегации CaM2 в теле клетки. Более того, недавно было показано, что при высоком уровне Ca 2+ , который может быть вызван клеточным стрессом, CaM группируются в четко определенные области, указывая на их связь с клеточными комплексами 14 . Напротив, при низких концентрациях Ca 2+ CaM являются очень подвижными белками, которые быстро доступны для распространения сигналов 14 . Даже если фиксация могла слегка изменить локализацию CaM2, CaM2 был обнаружен повсюду вокруг тела клетки, что соответствует текущей рабочей модели гравитаксиса 10 .
Аналогичная закономерность была обнаружена и для других растворимых белков. Например, было показано, что в нейрональных клетках CaM-зависимая протеинкиназа II (CaMKII) самоагрегируется вблизи эндоплазматического ретикулума при определенных стрессовых условиях 13 . Следовательно, у E. gracilis , как и в нейрональных клетках, клеточный стресс перед фиксацией клеток может привести к агрегации CaM2 в теле клетки. Более того, недавно было показано, что при высоком уровне Ca 2+ , который может быть вызван клеточным стрессом, CaM группируются в четко определенные области, указывая на их связь с клеточными комплексами 14 . Напротив, при низких концентрациях Ca 2+ CaM являются очень подвижными белками, которые быстро доступны для распространения сигналов 14 . Даже если фиксация могла слегка изменить локализацию CaM2, CaM2 был обнаружен повсюду вокруг тела клетки, что соответствует текущей рабочей модели гравитаксиса 10 . Действительно, ионы кальция, поступающие из притока, вызванного активацией SSCIC, связываются с CaM2. CaM2, будучи одним из основных участников сигнальной цепи, должен быть быстро доступен со всех сторон клетки, поскольку приток кальция может возникнуть в любой части плазматической мембраны, в зависимости от направления плавательного отклонения.
Действительно, ионы кальция, поступающие из притока, вызванного активацией SSCIC, связываются с CaM2. CaM2, будучи одним из основных участников сигнальной цепи, должен быть быстро доступен со всех сторон клетки, поскольку приток кальция может возникнуть в любой части плазматической мембраны, в зависимости от направления плавательного отклонения.
Клетки, отклоняющиеся от восходящего движения, должны быть переориентированы, чтобы оставаться в наиболее подходящем месте в толще воды. Эта переориентация достигается за счет изменения биения жгутиков. Очень интересно, что мы идентифицировали нового предполагаемого партнера взаимодействия CaM2, EgPCDUF4201, локализованного в жгутиках. Взаимодействие происходило специфически с С-концом белка, содержащего DUF4201. Одна часть этого домена также обладает предполагаемым сайтом связывания кальмодулина, что указывает на то, что взаимодействие может происходить более специфически на этой части белка и дополнительно усиливает результаты двойного гибрида дрожжей. IIF показал, что EgPCDUF4201 распределяется пятнистым образом по всему жгутику, включая его основание. Мы предполагаем, что этот белок является промежуточным фактором между CaM2 и белками динеином, которые создают молекулярную движущую силу, необходимую для биения жгутиков 9.1155 15 .
IIF показал, что EgPCDUF4201 распределяется пятнистым образом по всему жгутику, включая его основание. Мы предполагаем, что этот белок является промежуточным фактором между CaM2 и белками динеином, которые создают молекулярную движущую силу, необходимую для биения жгутиков 9.1155 15 .
EgPCDUF4201 содержит DUF 4201. Этот домен характеризуется спиральной спиралью и присутствует только в реснитчатых и жгутиковых клетках. Сообщается, что доменные белки, содержащие спиральную спираль, функционируют как скелетные белки, моторные белки, pH-зависимые переключатели спиральной катушки и системы молекулярного распознавания, что делает их группой многогранных белков 16 . Имеется несколько сообщений о белках, содержащих DUF4201. Примечательно, что два DUF4201, содержащие белки Homo sapiens , CCDC113 и CCDC96 участвуют в формировании ресничек сперматозоидов и, как сообщается, локализованы в центриолярных сателлитах и центросомах 17 . Эти структуры необходимы для зарождения аксонем жгутиков. Хотя CCDC113 и CCDC96 имеют 30% и 38% сходства (аминокислоты) с EgPCDUF4201 соответственно, их роль, вероятно, отличается от EgPCDUF4201. Этот последний расположен в жгутиках, но не участвует в их формировании, так как его подавление не изменяет длину жгутиков.
Хотя CCDC113 и CCDC96 имеют 30% и 38% сходства (аминокислоты) с EgPCDUF4201 соответственно, их роль, вероятно, отличается от EgPCDUF4201. Этот последний расположен в жгутиках, но не участвует в их формировании, так как его подавление не изменяет длину жгутиков.
Интересно, что два гомолога EgPCDUF4201, называемые ассоциированным с жгутиками белком FAP 184 и FAP 263, присутствуют в Chlamydomonas и описаны как фосфопротеины 18 . Биоинформатический анализ также предсказал, что EgPCDUF4201 является фосфопротеином. Следовательно, вполне вероятно, что посттрансляционные модификации EgPCDUF4201 посредством фосфорилирования играют роль в модуляции его функции. Более того, текущая модель цепочки передачи гравитационного сигнала из E. gracilis включает киназу PKA 11 . Поэтому мы можем предположить, что PKA может фосфорилировать EgPCDUF4201. В любом случае это подтверждает тот факт, что фосфорилирование играет роль в цепи трансдукции гравитаксиса у E. gracilis .
gracilis .
Ранее в экспериментах с микро- и гипергравитацией было показано, что биение жгутиков является активным процессом, контролируемым гравитацией 6 , но специфический жгутиковый белок, играющий роль в гравитаксисе, еще не идентифицирован. Таким образом, идентификация EgPCDUF4201 вносит новый важный фактор в текущую рабочую модель и является первым шагом в объяснении изменения жгутиковых сокращений для переориентации клеток. Однако механизм действия EgPCDUF4201 еще предстоит изучить. Обнаружение партнеров по взаимодействию поможет понять, действует ли белок на биение жгутиков, взаимодействуя непосредственно с динеинами, или является только промежуточным звеном сигнального пути, приводящего к правильному паттерну биений.
Заключение
Белок CaM2, ранее идентифицированный как член цепи передачи гравитационного сигнала E. gracilis , расположен в теле клетки и жгутиках в виде пятен. Кроме того, CaM2 взаимодействует с EgPCDUF4201, локализованным в жгутике. Понижающая регуляция белка приводит к нарушению гравитации. Таким образом, исследование продемонстрировало роль нового белка в цепи передачи гравитационного сигнала у E. gracilis . Этот новый белок представляет гомологов у других организмов, обладающих ресничками или жгутиками, но их функции до сих пор в значительной степени неизвестны и, скорее всего, не связаны только с гравитаксисом.
Понижающая регуляция белка приводит к нарушению гравитации. Таким образом, исследование продемонстрировало роль нового белка в цепи передачи гравитационного сигнала у E. gracilis . Этот новый белок представляет гомологов у других организмов, обладающих ресничками или жгутиками, но их функции до сих пор в значительной степени неизвестны и, скорее всего, не связаны только с гравитаксисом.
Материалы и методы
Клеточная культура и условия роста
Экспериментальный организм , Euglena gracilis KLEBS, штамм Z, был получен из коллекции культур водорослей Геттингенского университета, Германия 19 . Все эксперименты выполнены с аксеническими культурами клеток, выращенными в органической среде 20 . Культуры выращивали при 20 °C при постоянном освещении интенсивностью 54 мкмоль/(м -2 с -1 ) от смешанных флуоресцентных ламп холодного белого и теплого тона.
Анализ движения
Анализ движения был выполнен с использованием программного обеспечения для отслеживания клеток Wintrack 2000 21 в сочетании с изготовленным на заказ устройством (Manual Ecotox), которое состоит из микроскопа с горизонтальным направлением луча и ПЗС-камеры для наблюдения за движением клеток. относительно направления вектора силы тяжести. Светодиод синего света обеспечивает фототактический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки переносили в изготовленную на заказ одноразовую стеклянную кювету (два простых предметных стекла, склеенных U-образной двойной клейкой лентой, с промежутком между ними для заливки клеточной суспензии) и помещали вертикально в горизонтальный микроскоп для определения гравитационной ориентации. . Поступившие видеоизображения анализировались программой Wintrack 2000 с целью одновременного определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и др.) и статистических параметров плавающих клеток. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все клетки плывут случайным образом) до 1 (когда все клетки плывут в одном направлении). Движение наблюдаемых клеток представлено в виде круговой гистограммы с 64 угловыми секторами 23 .
относительно направления вектора силы тяжести. Светодиод синего света обеспечивает фототактический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки переносили в изготовленную на заказ одноразовую стеклянную кювету (два простых предметных стекла, склеенных U-образной двойной клейкой лентой, с промежутком между ними для заливки клеточной суспензии) и помещали вертикально в горизонтальный микроскоп для определения гравитационной ориентации. . Поступившие видеоизображения анализировались программой Wintrack 2000 с целью одновременного определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и др.) и статистических параметров плавающих клеток. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все клетки плывут случайным образом) до 1 (когда все клетки плывут в одном направлении). Движение наблюдаемых клеток представлено в виде круговой гистограммы с 64 угловыми секторами 23 . Направление вверх на гистограмме (0°) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество клеток, движущихся в соответствующем направлении.
Направление вверх на гистограмме (0°) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество клеток, движущихся в соответствующем направлении.
Молекулярно-генетический анализ
Суммарную РНК экстрагировали с использованием реагента Trizol (Invitrogen, кат. № 1559).6-026) и его концентрацию определяли спектрофотометрически с помощью нанокапельного фотометра (Thermoscientific, США). Культуру мутантных клеток с нокдауном оценивали путем количественного определения уровней экспрессии мРНК с помощью ПЦР в реальном времени. Равное количество тотальной РНК транскрибировали в кДНК с использованием набора для обратной транскрипции QuantiTECT (Qiagen). Количественную оценку уровней мРНК проводили в системе обнаружения ПЦР в реальном времени CFX96 TouchTM с использованием наборов QuantiTect SYBR Green PCR (Qiagen, отжиг/удлинение в течение 30 секунд при 60 °C, 40 циклов). кДНК разводили (1:3 или 1:500) деионизированной водой перед ПЦР, и для амплификации использовали специфические для гена праймеры (перечисленные в дополнительной таблице 2), тогда как актин использовали в качестве эталонного гена.
Для исследований подавления генов был принят подход РНКи. Целевую последовательность гена амплифицировали (праймеры перечислены в дополнительной таблице 2) с использованием полимеразы Taq. Амплифицированный продукт ПЦР лигировали со специально синтезированным промотором Т7 с использованием фермента ДНК-лигазы Т4 (New England BioLabs). Продукт ПЦР, конъюгированный с промотором Т7, использовали для получения дцРНК с использованием набора MEGAscript® RNAi Kit (Ambion). Впоследствии примерно 10 6 клеток на 100 мкл органической среды трансформировали электропорацией с 15–20 мкг дцРНК для получения нокдаун-мутантных клеток, тогда как контрольные клетки подвергали электропорации только с элюирующим буфером. Электропорацию проводили, как описано ранее 11,24,25 .
Для проведения RACE-ПЦР общую РНК экстрагировали, как описано выше, и осуществляли синтез кДНК с использованием набора для синтеза кДНК Mint2 (Evrogen), как описано Frohman 26 . Набор специфических для гена смысловых и антисмысловых праймеров (перечисленных в дополнительной таблице 2) был разработан для нацеливания на известную последовательность гена различной длины. Для проведения 5′-RACE ПЦР использовали геноспецифические антисмысловые праймеры в сочетании с праймером кэпа индивидуальной конструкции, который закрепляет транс-сплайсинговую структуру 5′-кэпа, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier et al. . 27 , тогда как 3′-RACE ПЦР проводили с использованием специфических для гена смысловых праймеров и специально разработанного олиго-dT праймера с двумя вырожденными нуклеотидами. Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и набор FirstChoice® RLM-RACE от Ambion).
Для проведения 5′-RACE ПЦР использовали геноспецифические антисмысловые праймеры в сочетании с праймером кэпа индивидуальной конструкции, который закрепляет транс-сплайсинговую структуру 5′-кэпа, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier et al. . 27 , тогда как 3′-RACE ПЦР проводили с использованием специфических для гена смысловых праймеров и специально разработанного олиго-dT праймера с двумя вырожденными нуклеотидами. Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и набор FirstChoice® RLM-RACE от Ambion).
Экспрессия плазмидных конструкций
Полноразмерная кодирующая область CaM2 (номер доступа EU935858) была амплифицирована, и продукт ограниченного расщепления был лигирован в pGBKT7 (Clonetech) для экспрессии под промотором T7. Точно так же кодирующая область полной длины CaM2 и EgPCDUF4201 амплифицировали и лигировали в pCR™II-Blunt-TOPO® (Invitrogen). Впоследствии вставки были подвергнуты рестрикционному расщеплению и субклонированы в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния GST под промотором TAC. Кроме того, две укороченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и сначала лигированы в pCR™II-Blunt-TOPO®, а затем субклонированы в pGADHA (Dualsystemsbiotech). для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием корректорной ДНК-полимеразы Phusion (Thermo Scientific).
Впоследствии вставки были подвергнуты рестрикционному расщеплению и субклонированы в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния GST под промотором TAC. Кроме того, две укороченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и сначала лигированы в pCR™II-Blunt-TOPO®, а затем субклонированы в pGADHA (Dualsystemsbiotech). для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием корректорной ДНК-полимеразы Phusion (Thermo Scientific).
Конструирование библиотеки кДНК
E. gracilis и двухгибридный скрининг дрожжей Для определения партнера по взаимодействию CaM2 проводили двухгибридный скрининг дрожжей с использованием нормализованной библиотеки кДНК E. gracilis . Для создания библиотеки кДНК РНК выделяли из клеток E. gracilis , подвергшихся различным химическим и физическим стрессам (тяжелые металлы, ультрафиолетовое излучение, яркое освещение, культура клеток в разном возрасте, в условиях микрогравитации, на клиностате и др. ). Извлеченные образцы РНК объединяли и передавали коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в активационный домен (AD), содержащий плазмиду pGAD-HA (Mobitech). 9Штамм 1334 Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой pGBKT7-CaM2 с использованием метода полиэтиленгликоля (ПЭГ)/ацетата лития/одноцепочечной ДНК-носителя, как описано ранее 29 . Впоследствии культуру дрожжевых клеток-трансформантов-приманок повторно трансформировали с помощью 50 мкг библиотеки кДНК с использованием протокола трансформации в масштабе библиотеки, как описано в руководстве пользователя MatchMaker GAL4 Two-Hybrid System (Clonetech). Эффективность трансформации дрожжевых клеток определяли на чашках SD-TL, тогда как взаимодействие между двумя белками определяли на среде для селекции SD-TLAH. Точно так же взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селекционной среде SD-TLAH.
). Извлеченные образцы РНК объединяли и передавали коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в активационный домен (AD), содержащий плазмиду pGAD-HA (Mobitech). 9Штамм 1334 Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой pGBKT7-CaM2 с использованием метода полиэтиленгликоля (ПЭГ)/ацетата лития/одноцепочечной ДНК-носителя, как описано ранее 29 . Впоследствии культуру дрожжевых клеток-трансформантов-приманок повторно трансформировали с помощью 50 мкг библиотеки кДНК с использованием протокола трансформации в масштабе библиотеки, как описано в руководстве пользователя MatchMaker GAL4 Two-Hybrid System (Clonetech). Эффективность трансформации дрожжевых клеток определяли на чашках SD-TL, тогда как взаимодействие между двумя белками определяли на среде для селекции SD-TLAH. Точно так же взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селекционной среде SD-TLAH. Автоактивацию белка-приманки или добычи определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами.
Автоактивацию белка-приманки или добычи определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами.
Антитела
Производство индивидуальных антител против CaM2 было поручено коммерческой фирме SDIX, США. Антитело было получено с использованием подхода геномного антитела против 91 аминокислоты (58–148) CaM2 30 . Точно так же производство неочищенной мышиной антисыворотки против белка E. gracilis , содержащего домен с неизвестной функцией (EgPCDUF4201), было поручено коммерческой фирме Eurogenetec, Бельгия. Антисыворотку против EgPCDUF4201 получали методом генетической ДНК-иммунизации против цельного белка. Также использовали антитело против альфа-цепи тубулина кролика (каталожный номер AS10 680, Agrisera, Швеция) и антитело против мышиной антиглутатион-S-трансферазы (GST) (Sigma Aldrich, США). И имеющиеся в продаже антитела к IgG-пероксидазе кролика (Sigma Aldrich, США), антитела к пероксидазе IgG мыши (Sigma Aldrich, США) и Alexa Fluor® 488-Anti-Rabbit IgG (H + L) (иммунологическое исследование Джексона). Laboratories, США) в данном исследовании использовали в качестве вторичных антител.
Laboratories, США) в данном исследовании использовали в качестве вторичных антител.
Подготовка образца белка из
E. gracilis Клетки собирали центрифугированием (11000×g, 10 мин) и дважды промывали деионизированной водой. Осадок клеток суспендировали в лизирующем буфере (40 мМ Tris-HCl, pH 8) с добавлением смеси ингибиторов протеазы и фосфатазы (10 мкл -1 мл, номер продукта 78443, Thermoscientific). Разрушение клеток проводили с помощью ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия), подавая три импульса по 20 с при интенсивности 35% от общей мощности. Образцы хранились на льду в течение всего процесса в холодильной камере (4 °C). Полученный неочищенный лизат ресуспендировали в 100% ацетоне (втрое больше объема клеточного лизата) и осаждали белок при -20°С в течение ночи. Осажденную белковую фракцию осаждали центрифугированием (24000 g, 4°C, 1 ч) и дважды промывали 80%-ным ацетоном. Высушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевины, 2 М тиомочевины, 2% CHAPS, 40 мМ ДТТ) и переносили в 1,5 мл микроцентрифужную пробирку, а солюбилизацию белка проводили в течение 1 ч (30°С). C, 1400 циклов/мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем солюбилизированную белковую фракцию собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию белков в образцах определяли методом Бредфорда 9.1155 31 .
Высушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевины, 2 М тиомочевины, 2% CHAPS, 40 мМ ДТТ) и переносили в 1,5 мл микроцентрифужную пробирку, а солюбилизацию белка проводили в течение 1 ч (30°С). C, 1400 циклов/мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем солюбилизированную белковую фракцию собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию белков в образцах определяли методом Бредфорда 9.1155 31 .
SDS-PAGE и иммуноблоттинг
SDS-PAGE проводили, как описано Laemmli 32 . Разделение белковых образцов проводили в 12% полиакриламидном геле с ДСН. Полиакриламидные гели с ДСН окрашивали с использованием раствора кумасси бриллиантового синего R250 для анализа, как описано ранее 33 для визуального наблюдения. Для иммуноблоттинга образцы белка из SDS-PAGE переносили на мембрану из поливинилиденфторида (PVDF) (Roti®-Fluoro PVDF, размер пор 0,2 мкм, Carl Roth, Германия) с использованием полусухой ячейки для переноса Trans-Blot SD (Bio-Rad). , США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном солевом растворе (W/V) с 0,5% Tween 20 (V/V) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхивание (20 циклов/мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов/мин), после чего трижды промывали буфером TBS-T в течение 10 мин и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения улучшенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7™ Advance Chemiluminescence System (Peqlab, Германия).
, США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном солевом растворе (W/V) с 0,5% Tween 20 (V/V) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхивание (20 циклов/мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов/мин), после чего трижды промывали буфером TBS-T в течение 10 мин и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения улучшенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7™ Advance Chemiluminescence System (Peqlab, Германия).
Фракционирование органелл
Разделение жгутиков и тела клетки проводили с использованием метода, описанного в 34 , с использованием 15 л позднелогарифмической клеточной культуры. Первоначально метод был разработан для выделения жгутиков, связанных с паражгутиковым телом (PFB). Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка.
Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка.
Конфокальная микроскопия с непрямой иммунофлуоресценцией
Для анализа с помощью непрямой иммунофлуоресценции (IIF) образцы готовили, как описано ранее 35 , и клетки анализировали с использованием вторичного антитела, конъюгированного с флуорофором (Alexa 488). Конфокальные изображения генерировали с помощью лазерного сканирующего микроскопа TCS SP2 (Leica), оснащенного иммерсионным объективом HC PL APO 20×. Alexa 488 возбуждалась на длине волны 495 нм, а изображения отображались в диапазоне 510–580 нм. Для сравнения контрольных и нокдаун-мутантов параметры получения изображения оставались идентичными.
Сверхэкспрессия белков, слитых с GST, и очистка
Электрокомпетентные клетки штамма E. coli BL21 (DE3) pLysS (Invitrogen) трансформировали экспрессионными плазмидами pGEX4T2- CaM2 и pGEX4T2- EgPCDUF4201 . Положительные трансформанты отбирали на твердой среде LB, содержащей 1,5% (масса/объем) агара и 100 мкг/мл -1 ампициллина. Затем одну трансформантную колонию суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг.мл -1), для роста в течение ночи (37 °C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной трансформантной культурой pGEX4T2-9.1334 CaM2 и pGEX4T2- EgPCDUF4201 соответственно. После этого экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигали определенной плотности клеток (OD600 0,6–0,7). Клетки собирали после 5 ч роста (37 °C, 200 циклов в минуту) центрифугированием (6000g, 4 °C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 9).1742 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой коктейля ингибиторов протеаз (Complete ингибиторов протеаз коктейль, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 секунд при мощности 30% с использованием ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия).
Затем одну трансформантную колонию суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг.мл -1), для роста в течение ночи (37 °C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной трансформантной культурой pGEX4T2-9.1334 CaM2 и pGEX4T2- EgPCDUF4201 соответственно. После этого экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигали определенной плотности клеток (OD600 0,6–0,7). Клетки собирали после 5 ч роста (37 °C, 200 циклов в минуту) центрифугированием (6000g, 4 °C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 9).1742 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой коктейля ингибиторов протеаз (Complete ингибиторов протеаз коктейль, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 секунд при мощности 30% с использованием ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия). Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4°C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца объемом 2 мл с помощью адаптера ввода-люэра Portino® (Macherey-Nagel, Германия).
Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4°C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца объемом 2 мл с помощью адаптера ввода-люэра Portino® (Macherey-Nagel, Германия).
Анализ in silico Анализ предсказанных доменов EgPCDUF4201 был выполнен с использованием онлайн-инструмента expasy COILS (http://embnet.vital-it.ch/software/COILS_form.html) и онлайн-базы данных для прогнозирования Сайты связывания кальмодулина (http://calcium.uhnres.utoronto.ca/ctdb/ctdb/home.html). Предсказание сайтов фосфорилирования в EgPCDUF4201 было выполнено с использованием сервера NetPhos 2.0 (http://www.cbs.dtu.dk/services/NetPhos-2.0/).
Ссылки
Хедер, Д. П., Рихтер, П., Шустер, М., Дайкер, В. и Леберт, М. Молекулярный анализ передачи сигнала гравиперцепции у жгутиковых Euglena gracilis : участие временного рецепторного потенциала, подобного канал и кальмодулин. Доп. Космический Рез. 43 , 1179–1184 (2009 г.)).
ОБЪЯВЛЕНИЕ
Статья
Google ученый
Дайкер, В., Леберт, М., Рихтер, П.Р. и Хедер, Д.П. Молекулярная характеристика кальмодулина, участвующего в цепи передачи сигнала гравитаксиса у Euglena gracilis . Планта 231 , 1229–1236 (2010).
КАС
Статья
пабмед
Google ученый
Тахедль, Х. и Хедер, Д. П. Автоматизированный биомониторинг с использованием анализа движения в реальном времени Euglena gracilis . Экотокс. Окружающая среда. Сейф 48 , 161–169 (2001).
КАС
Статья
Google ученый
Ссылки для скачивания
Благодарности
Антимышиное антитело Alexa Fluor® 488 было любезно предоставлено профессором доктором Георгом Краймером из отделения клеточной биологии Университета Фридриха-Александра Эрланген-Нюрнберг, Германия, и мы благодарим Себастьяна Штрауха. за полезное обсуждение. Мы признательны за поддержку Deutsche Forschungsgemeinschaft и Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) в рамках программы финансирования Open Access Publishing. Работа частично финансировалась Немецким космическим агентством (DLR) от имени Bundesministerium für Bildung und Forschung (гранты 50WB0828, 50WB1128 и 50WB1528).
Author information
Authors and Affiliations
Авторы
Contributions
А. Н. и М.Л. проектировал эксперименты. А.Н., А.Л.Б., В.Д., Ж.К. и PR провели эксперименты. А.Н. и А.Л.Б. писал М.С.
Н. и М.Л. проектировал эксперименты. А.Н., А.Л.Б., В.Д., Ж.К. и PR провели эксперименты. А.Н. и А.Л.Б. писал М.С.
Автор, ответственный за переписку
Переписка с
Од Ле Бей.
Декларация этики
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Электронный дополнительный материал
Дополнительная информация
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате при условии, что вы указываете соответствующие права на первоначальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Жгутиконосцы — Soil Ecology Wiki
Содержание
Обзор
Жгутиконосцы — одноклеточные микроорганизмы, принадлежащие к группе простейших. Для них характерно наличие одного или нескольких жгутиков, которые представляют собой органеллы, похожие на волоски, и очень различимы. Существует много разных видов жгутиконосцев, и все они ведут разный образ жизни. Некоторые образуют колонии, а другие живут как одиночные клетки. Двумя основными категориями являются фитофлагелляты и зоофлагелляты. Фитофлагелляты — это зеленые и похожие на растения существа, которые используют фотосинтез для производства пищи. Зоофлагелляты бесцветны и похожи на животных. Паразитические жгутиконосцы также попадают в эту категорию.
Паразитические жгутиконосцы также попадают в эту категорию.
Как фитофлагелляты, так и зоофлагелляты могут быть найдены в прудах, лагунах и даже неглубоких лужах. Везде, где есть большое количество растворимой пищи, могут размножаться жгутиконосцы. Однако паразитические зоофлагелляты живут внутри кишечника или кровотока хозяина и могут вызывать опасные заболевания, такие как лямблиоз.
Виды жгутиковых
Фитофлагелляты
Эта группа жгутиковых простейших имеет много общего с типичными водорослями. Некоторые действительно содержат пигмент хлорофилл и используют фотосинтетический тип питания [10]. Жгутиконосцы, которые не используют фотосинтез в качестве источника пищи, также могут поглощать питательные вещества через поверхность своего тела или заглатывать частицы пищи. Виды, которые являются членами этой группы, включают, помимо прочего, Euglena, Chloromonad, Dinoflagellate, Cryptomonad, Chrysomonad. Фитофлагелляты рассматриваются как группа из-за (1) наличия ядра в общепринятом понимании и центриолярного митоза (2) подвижности за счет жгутиков (3) фотосинтетических пигментов, находящихся в пластидах [11].
Эвглена [9]
Колония Volvox [3]
Зоофлагелляты
Эта группа жгутиконосцев не является фотосинтезирующим организмом по сравнению с другой группой жгутиконосцев, обсуждавшейся в предыдущем разделе [12]. У этих жгутиковых отсутствуют клеточные стенки, и они питаются либо фагоцитозом, либо эндоцитозом. Эта группа жгутиковых является одной из самых разнообразных среди всех эукариот и дала начало большинству других частей эукариотических клеток, которые мы видим сегодня. Зоофлагелляты классифицируются по тринадцати или четырнадцати типам и распространены по четырем из семи царств эукариот, которые мы классифицировали на сегодняшний день [12].
Giardia [1]
Размножение
Ссылки
Гравитаксис и фототаксис у жгутиковых эвглен, изученных в ходе миссий TEXUS
Гравитаксис и фототаксис у жгутиковых эвглен, изученных в ходе миссий TEXUS
Д.-П. Häder
Institüt für Botanik und
Pharmazeutische Biologie, Университет Фридриха-Александра,
Staudtstr. 5, Д-
Эрланген, Германия
Введение
Несмотря на то, что коэффициентом освещенности можно легко управлять в
лаборатории, эффекты гравитации не могут быть изучены с помощью
такая же легкость, потому что земное гравитационное поле не может быть
выключен. Это может быть одной из причин, почему наши знания
относительно гравирецептора жгутиконосцев еще довольно
ограничено. Согласно более ранней гипотезе, ориентация
клетки обусловлены пассивной физической ориентацией в воде
колонна, предполагая, что задний конец тяжелее переднего
конец.¹ Альтернативная гипотеза состоит в том, что клетка обладает
активный физиологический гравирецептор, определяющий вектор
гравитационного поля.² В дополнение к гравитации,
жгутиковые используют свет как сигнал для ориентации в воде
столбец,³ как указано выше. Эксперименты со светом и
гравитация в различных векторных комбинациях при земных
условия показали, что клетки интегрируются по двум
стимулы и генерировать интегрированный ответ. 4 А
аналогичная проблема существует для грибов и высших растений, у которых
фототропизм накладывается на гравитропизм под земными
условия. 5
Согласно более ранней гипотезе, ориентация
клетки обусловлены пассивной физической ориентацией в воде
колонна, предполагая, что задний конец тяжелее переднего
конец.¹ Альтернативная гипотеза состоит в том, что клетка обладает
активный физиологический гравирецептор, определяющий вектор
гравитационного поля.² В дополнение к гравитации,
жгутиковые используют свет как сигнал для ориентации в воде
столбец,³ как указано выше. Эксперименты со светом и
гравитация в различных векторных комбинациях при земных
условия показали, что клетки интегрируются по двум
стимулы и генерировать интегрированный ответ. 4 А
аналогичная проблема существует для грибов и высших растений, у которых
фототропизм накладывается на гравитропизм под земными
условия. 5
Целью экспериментов TEXUS было, во-первых, продемонстрировать
что гравитация действительно является фактором, который направляет движения Е. gracilis ; во-вторых, чтобы охарактеризовать ориентацию под
условия мкг; и, в-третьих, изучать как положительные, так и
отрицательный фототаксис в невесомости.
Материалы и методы
Одноклеточный фотосинтезирующий пресноводный жгутиконосец, Euglena gracilis Klebs , штамм Z, использовали для всех
эксперименты (рис. 1). Клетки выращивали, как описано ранее.
в минеральной среде. 6 Клетки были собраны после
две недели роста и перенесли в круглую кювету (0,2
глубина мм и диаметр 55 мм) из нержавеющей стали; это было
поддерживается при температуре 22,5±1°С четырьмя элементами Пельтье. Окно
обращенный к микроскопу источник света был сделан из инфракрасного
передающий фильтр (RG 715, Schott & Gen., Майнц, Германия).
кювета была ориентирована вертикально в экспериментальном модуле (ТЭМ 06-
19, разработанный и изготовленный MBB-ERNO в Бремене), в то время как
Ракета стояла вертикально перед пуском. Кювета может быть
вращается вокруг своей короткой оси с помощью дистанционного управления для перераспределения
клетки. Кювету постоянно вращали (35 об/мин) в течение
запустить, чтобы свести к минимуму эффекты ускорения. луч актиничного света, падающий под углом
15° по отношению к поверхности кюветы.
луч актиничного света, падающий под углом
15° по отношению к поверхности кюветы.
Рис. 1. Фотосинтезирующая одноклеточная жгутиконосица Euglena.
грацилис.
Изображение движущихся клеток было записано ПЗС-камерой и
передается на землю для записи. Во время воспроизведения
видеосигнал оцифровывался в реальном времени с пространственным разрешением
512 x 512 пикселей с 256 возможными уровнями серого. Отслеживание
программное обеспечение было написано на языке C с
модули языка ассемблера для критичных по времени ввода и вывода
процедуры, а также математический анализ данных. 7, г.
8 Точность ориентации определялась с помощью
Тест Рэлея.
Результаты и обсуждение
Первый эксперимент на TEXUS 23 показал, что Земля
гравитационное поле действительно ответственно за ориентацию E. gracilis при отсутствии других ориентировочных факторов,
например свет. В условиях мкг клетки двигались беспорядочно,
такая ориентация по отношению к силовым линиям магнитного поля или
температурные градиенты можно было бы исключить (рис. 2а-2б). 9 Аналогичные результаты были получены на быстровращающемся горизонтальном
клиностат. 10 Происходит переориентация клеток внутри
меньше минуты. В земных условиях клетки
подвергаются осаждению, так как имеют удельный вес
1,04, выше, чем у окружающей воды. В соответствии
с законом Рэлея это приводит к более быстрому плаванию вниз
скорость и более медленная скорость плавания вверх по сравнению со скоростью
в горизонтальном направлении. Следовательно, клетки перемещаются с
более высокая скорость в условиях мкг. Напротив,
инфузория Paramecium частично компенсирует более медленный рост
движения за счет гравикинеза. 11, 12
2а-2б). 9 Аналогичные результаты были получены на быстровращающемся горизонтальном
клиностат. 10 Происходит переориентация клеток внутри
меньше минуты. В земных условиях клетки
подвергаются осаждению, так как имеют удельный вес
1,04, выше, чем у окружающей воды. В соответствии
с законом Рэлея это приводит к более быстрому плаванию вниз
скорость и более медленная скорость плавания вверх по сравнению со скоростью
в горизонтальном направлении. Следовательно, клетки перемещаются с
более высокая скорость в условиях мкг. Напротив,
инфузория Paramecium частично компенсирует более медленный рост
движения за счет гравикинеза. 11, 12
Рис. 2. Распределение направлений плавания E. gracilis
при 1 g перед полетом TEXUS (a) и 0 g во время первого
минута на TEXUS 23 (b).
На рейсах TEXUS 28-30 фототактическая ориентация была
расследовано. Клетки показали как положительные, так и отрицательные
фототаксис в условиях мкг. 13 Флуенс
частота этих ответов сопоставима с таковой при 1 г.
Однако фототаксическая ориентация достигалась быстрее, чем при 1 г.
Кроме того, точность ориентирования в пространстве была выше, чем в пространстве.
контроль, измеренный одновременно в наземных условиях.
Подтвержденные ранее измерения распределений скоростей
результаты экспериментов по гравитаксису в космосе. Измерения
после того, как полеты TEXUS показали аналогичное поведение как для
фототаксис и гравитаксис, как и до полета, что указывает на то, что
клетки не адаптировались к условиям при 0 g. Недавний
эксперименты во время международной микрогравитации космического корабля «Шаттл»
Миссия Лаборатория-2 с использованием медленно вращающейся центрифуги
микроскоп (NIZEMI) показал, что порог гравитационного
ориентация в E. gracilis составляет около 0,16 г. 14 Также не было адаптации к измененной гравитации под
длительные условия при 0g.
13 Флуенс
частота этих ответов сопоставима с таковой при 1 г.
Однако фототаксическая ориентация достигалась быстрее, чем при 1 г.
Кроме того, точность ориентирования в пространстве была выше, чем в пространстве.
контроль, измеренный одновременно в наземных условиях.
Подтвержденные ранее измерения распределений скоростей
результаты экспериментов по гравитаксису в космосе. Измерения
после того, как полеты TEXUS показали аналогичное поведение как для
фототаксис и гравитаксис, как и до полета, что указывает на то, что
клетки не адаптировались к условиям при 0 g. Недавний
эксперименты во время международной микрогравитации космического корабля «Шаттл»
Миссия Лаборатория-2 с использованием медленно вращающейся центрифуги
микроскоп (NIZEMI) показал, что порог гравитационного
ориентация в E. gracilis составляет около 0,16 г. 14 Также не было адаптации к измененной гравитации под
длительные условия при 0g.
Благодарности
Работа выполнена при финансовой поддержке Немецкого
Agentur für Luftund Raumfahrtangelegenheiten (DARA).
Каталожные номера
О|
Поиск|
Обратная связь
СП1206
Опубликовано в апреле 1997 г.
Разработано ESA-ESRIN ID/D. лагунные системы
лагунные системы Лагунные микроорганизмы… Водоросли…
Что такое водоросли? : Термин «водоросли» используется для обозначения некоторых низших растений и многих, часто не связанных между собой групп водорослей. микроорганизмы, способные осуществлять фотосинтез. Фотосинтез (преобразование энергии света в химическую энергию)
осуществляется в частях клетки, называемых хлоропластами. Их можно найти в различных формах и цветах и во многих различных организмах. Не все эти организмы зеленые. Диатомовые водоросли, хризофиты и динофлагелляты имеют хлоропласты от желтого до коричневого цвета. Существуют бурые водоросли (Phaeophyta), красные водоросли (Rhodophyta) и многие другие группы одноклеточных водорослей.
во многих оттенках зеленого. Сине-зеленые цианобактерии также фотосинтезируют.
микроорганизмы, способные осуществлять фотосинтез. Фотосинтез (преобразование энергии света в химическую энергию)
осуществляется в частях клетки, называемых хлоропластами. Их можно найти в различных формах и цветах и во многих различных организмах. Не все эти организмы зеленые. Диатомовые водоросли, хризофиты и динофлагелляты имеют хлоропласты от желтого до коричневого цвета. Существуют бурые водоросли (Phaeophyta), красные водоросли (Rhodophyta) и многие другие группы одноклеточных водорослей.
во многих оттенках зеленого. Сине-зеленые цианобактерии также фотосинтезируют. Очень разнообразными группами пресноводных водорослей являются хлорофиты или зеленые водоросли. На основе соединений
фотосинтетические пигменты и некоторые другие характеристики, по-видимому, наиболее близки к растениям. Распространенной зеленой водорослью является Hydrodictyon, водяная сеть. Он связан с Pediastrum (верхнее изображение), но образует колонию в форме мешка. Как Педиаструм
каждая отдельная клетка может развиться в новую колонию. Вы можете себе представить, что, поскольку колония содержит тысячи клеток, Hydrodictyon может воспроизводиться очень быстро. И в отличие от Pediastrum, Hydrodictyon может вырасти большим, почти 30 см. в длину.
Цветение Hydrodictyon может стать настоящей проблемой для водоочистных сооружений. На изображении показана часть небольшой колонии (слева).
и три отдельные клетки большой колонии. Внутри каждой из этих клеток может образоваться новая колония.
Вы можете себе представить, что, поскольку колония содержит тысячи клеток, Hydrodictyon может воспроизводиться очень быстро. И в отличие от Pediastrum, Hydrodictyon может вырасти большим, почти 30 см. в длину.
Цветение Hydrodictyon может стать настоящей проблемой для водоочистных сооружений. На изображении показана часть небольшой колонии (слева).
и три отдельные клетки большой колонии. Внутри каждой из этих клеток может образоваться новая колония.
Если у вас есть птичья ванночка с водой, которая стала красной, вы можете найти зеленые водоросли Haematococcus pluvialis. Этот вид показывает, что зеленые водоросли не всегда должны выглядеть как зеленые водоросли. Хлоропласты часто краснеют, когда условия становятся неблагоприятными. Гематококк плавает с помощью двух длинных жгутиков. Многие виды являются жгутиковыми и подвижными, другие неподвижны, но часто имеют жгутиковую стадию в какой-то момент своего жизненного цикла. Безусловно, одна из самых эффектных жгутиковых зеленых водорослей — Volvox. Образует шаровидную колонию. Все мелкие клетки колонии имеют два жгутика и
маленькое глазное пятно. Благодаря этому колония может плыть к свету. Volvox имеет интересные способы размножения.
Узнайте больше об этом в статье Micscape Volvox, одном из семи чудес микромира. Мелкая, довольно невзрачная зеленая водоросль без ундулиподий – это хлорелла. Его можно найти в виде эндосимбионта внутри инфузорий, гидр
и другие животные. Они выращивают хлореллу, как если бы выращивали урожай в теплице.
Образует шаровидную колонию. Все мелкие клетки колонии имеют два жгутика и
маленькое глазное пятно. Благодаря этому колония может плыть к свету. Volvox имеет интересные способы размножения.
Узнайте больше об этом в статье Micscape Volvox, одном из семи чудес микромира. Мелкая, довольно невзрачная зеленая водоросль без ундулиподий – это хлорелла. Его можно найти в виде эндосимбионта внутри инфузорий, гидр
и другие животные. Они выращивают хлореллу, как если бы выращивали урожай в теплице.
Многие зеленые водоросли образуют длинные нити. Клетки остаются прикрепленными после деления. Некоторые роды, такие как Spirogyra, Mougeotia
и Zygnema могут стать настолько многочисленными, что образуют плотные маты роста на поверхности прудов, так называемую прудовую пену. Этот пруд
накипь интересна для изучения под микроскопом. Если вы сожмете его в банку, вы соберете много интересного.
организмы. И нитчатые водоросли не менее интересны. Хлоропласты имеют четкую форму. У спирогиры хлоропласт проходит через клетку в виде спирали. На изображении также видно ядро, висящее на тонких нитях. Спирогира и родственные водоросли, такие как десмиды, представляют собой сопряженные зеленые водоросли. Эти десмиды настолько красивы, что заслуживают отдельной страницы.
На изображении также видно ядро, висящее на тонких нитях. Спирогира и родственные водоросли, такие как десмиды, представляют собой сопряженные зеленые водоросли. Эти десмиды настолько красивы, что заслуживают отдельной страницы.
Бактерии…
Бактерии — самые древние формы жизни. Большинство бактерий настолько малы, что под световым микроскопом их можно увидеть только в виде маленьких точек. Однако некоторые группы вырастают до больших размеров и имеют впечатляющие формы.
На верхнем рисунке показан пример красоты одной из наиболее продвинутых групп бактерий, цианобактерий или сине-зеленых водорослей. Долгое время их считали водорослями, так как они осуществляли фотосинтез. Но в настоящее время их считают бактериями: у них отсутствует связанное с мембраной ядро. ДНК присутствует в виде петли в цитоплазме.
Поскольку они имеют очень отчетливый сине-зеленый цвет, цветение цианобактерий отчетливо видно, когда пруд или канава становятся голубовато-зелеными.
Бактерии были наиболее выдающимися существами на ранних стадиях истории жизни почти от 4000 миллионов лет до 600 миллионов лет назад. Окаменелости, называемые строматолитами, все еще можно найти, и они были созданы цианобактериями.
Цианобактерии были необходимы для развития более сложных форм жизни. Они производили кислород в нашей атмосфере. Этот кислород необходим для гораздо более эффективного метаболизма многоклеточных организмов. Более того, фотосинтетические способности бактерий, по-видимому, были переняты более развитыми организмами. В настоящее время бактерии играют существенную роль в переработке вещества. Бактерии есть везде. Внутри вашего рта живет больше бактерий, чем количество людей, которые когда-либо жили.
На небольшой анимации слева показаны бактерии спирохеты. Они быстро передвигаются, у них много жгутиков, которые, в отличие от других бактерий, лежат внутри клетки. Многие другие бактерии используют жгутики (хлыстообразные структуры) для передвижения. Жгутики бактерий довольно интересны, так как имеют простую, но очень изобретательную конструкцию. Бактериальный жгутик представляет собой миниатюрное механическое устройство, движение которого вызывается вращением стержня, той части, где жгутик прикрепляется к клетке. Это внеклеточная структура, которая работает как маленький пропеллер.
Жгутики бактерий довольно интересны, так как имеют простую, но очень изобретательную конструкцию. Бактериальный жгутик представляет собой миниатюрное механическое устройство, движение которого вызывается вращением стержня, той части, где жгутик прикрепляется к клетке. Это внеклеточная структура, которая работает как маленький пропеллер.
Nostoc – это цианобактерия, образующая большие сферические колонии. Они распространены и их можно увидеть невооруженным глазом. Большинство бактерий видны только в самые сильные линзы микроскопа. Самый простой способ собрать их (а также множество мелких простейших) — положить покровное стекло на поверхность прудовой воды. Через ночь на нижней стороне покровного стекла вырастут целые колонии бактерий. Осторожно помещенный на предметное стекло (можно добавить дополнительную каплю воды), рост под покровным стеклом можно наблюдать с помощью объектива 40X или 100X, чтобы увидеть мельчайшие детали.
Коловратки…
Коловратки — многоклеточные животные. Поскольку они настолько малы, что большинство людей никогда не слышали об их существовании. Они есть
примерно такого же размера, как и более крупные одноклеточные организмы. Клеток у них немного, меньше 1000, но есть
некоторые очень специальные атрибуты. Это чудеса миниатюрного дизайна. В передней части тела у них есть корона волосовидных ресничек. Они передвигаются, используя корону ресничек (корону), чтобы двигаться. Некоторые виды ходят с
голова и нога. Их лапы могут выделять липкое вещество, которое позволяет им прикрепляться к поверхности. Они также используют
коронка ресничек, чтобы замахивать едой в рот. Там пища попадает в «мастакс», где находятся два так называемых «трофуса».
обрабатывать пищу до того, как она попадет в кишечник. Коловратки настолько прозрачны, что все эти органы можно легко наблюдать. У них есть одно или два светочувствительных красных пятна под глазами.
Поскольку они настолько малы, что большинство людей никогда не слышали об их существовании. Они есть
примерно такого же размера, как и более крупные одноклеточные организмы. Клеток у них немного, меньше 1000, но есть
некоторые очень специальные атрибуты. Это чудеса миниатюрного дизайна. В передней части тела у них есть корона волосовидных ресничек. Они передвигаются, используя корону ресничек (корону), чтобы двигаться. Некоторые виды ходят с
голова и нога. Их лапы могут выделять липкое вещество, которое позволяет им прикрепляться к поверхности. Они также используют
коронка ресничек, чтобы замахивать едой в рот. Там пища попадает в «мастакс», где находятся два так называемых «трофуса».
обрабатывать пищу до того, как она попадет в кишечник. Коловратки настолько прозрачны, что все эти органы можно легко наблюдать. У них есть одно или два светочувствительных красных пятна под глазами. Существует огромное разнообразие впечатляющих форм тела, подходящих для разных образов жизни или условий окружающей среды. Поскольку многие виды образуют так называемые покоящиеся споры, которые легко переносятся ветром, их можно найти где угодно, если
есть немного воды. Даже в водосточных желобах или в поилках для птиц. Корона, коронка ресничек, может различаться по дизайну. Некоторые виды не используют его для передвижения, но разработали специальные приспособления для захвата. Коловратки из рода Collotheca живут прикрепленными к субстрату и собирают крошечные микробы, такие как бактерии с чрезвычайно удлиненными ресничками. Увидеть
эти рыболовы под микроскопом представляют собой прекрасное зрелище.
Поскольку многие виды образуют так называемые покоящиеся споры, которые легко переносятся ветром, их можно найти где угодно, если
есть немного воды. Даже в водосточных желобах или в поилках для птиц. Корона, коронка ресничек, может различаться по дизайну. Некоторые виды не используют его для передвижения, но разработали специальные приспособления для захвата. Коловратки из рода Collotheca живут прикрепленными к субстрату и собирают крошечные микробы, такие как бактерии с чрезвычайно удлиненными ресничками. Увидеть
эти рыболовы под микроскопом представляют собой прекрасное зрелище.
Амебы…
Что такое амебы? : Амебы (Phylum Rhizopoda) — одноклеточные протисты, способные постоянно менять свою форму. Каждый вид имеет свой собственный репертуар форм. Как передвигается амеба? : Амебы передвигаются по путям цитоплазматического движения. (цитоплазма — это клеточное содержимое вокруг ядра клетки) Амеба образует псевдоподии (ложные ножки), с помощью которых они «текут» по поверхности. Цитоплазма не только течет, но и переходит из жидкого состояния в твердое. Эти псевдоподии также используются для захвата
добыча, они просто поглощают пищу. Они могут определять тип добычи и использовать различные «тактики поглощения». Изображение
показывает несколько клеточных органелл. Слева от центра мы видим шаровидный пузырек, извергающий воду, и справа от него:
можно увидеть единственное ядро этого вида. Другие виды могут иметь много ядер. Клетка полна коричневой еды
вакуоли, а также содержит мелкие кристаллы.
Цитоплазма не только течет, но и переходит из жидкого состояния в твердое. Эти псевдоподии также используются для захвата
добыча, они просто поглощают пищу. Они могут определять тип добычи и использовать различные «тактики поглощения». Изображение
показывает несколько клеточных органелл. Слева от центра мы видим шаровидный пузырек, извергающий воду, и справа от него:
можно увидеть единственное ядро этого вида. Другие виды могут иметь много ядер. Клетка полна коричневой еды
вакуоли, а также содержит мелкие кристаллы.
Амебы могут достигать исключительно больших размеров для одноклеточного организма. Некоторые виды имеют длину 5 миллиметров. Они
могут достигать таких размеров, имея много ядер в своей единственной клетке. Узнайте больше об Amoeba в Micscape
article Амебы — это больше, чем просто «кляксы». Известно, что амебы не имеют какого-либо полового способа размножения. Они только
размножаются делением клеток.
Солнечные анималисты: или Heliozoa, тип Actinopoda (=лученогие) имеют аксоподии, длинные жесткие выступы цитоплазмы. Они не могут так много передвигаться с ними, но они отлично подходят для поимки добычи. Добыча, как правило, мелкие простейшие,
прилипает к аксоподам и покрывается потоком цитоплазмы, идущим по аксоподам и транспортируемым к
клетка Иногда можно встретить Heliozoa, питающихся той же добычей. На этом изображении 2 особи вида Actinophrys sol.
лакомятся диатомовыми водорослями.
Они не могут так много передвигаться с ними, но они отлично подходят для поимки добычи. Добыча, как правило, мелкие простейшие,
прилипает к аксоподам и покрывается потоком цитоплазмы, идущим по аксоподам и транспортируемым к
клетка Иногда можно встретить Heliozoa, питающихся той же добычей. На этом изображении 2 особи вида Actinophrys sol.
лакомятся диатомовыми водорослями.
Некоторые амебы образуют панцирь из найденного материала, который они склеивают, образуя защитное покрытие. Часто песчинки или другие частицы используются для укрепления конструкции, называемой «тестом». Вы можете видеть, как эта панцирная амеба висит в
его тест поддерживает контакт с помощью тонких ложноножек. Длинные ложноножки вытягиваются для захвата добычи.
Инфузории…
Что такое инфузории? : Инфузории — одноклеточные протисты, которых можно узнать по волосовидным «ресничкам». Они используют их для передвижения и для питания. Некоторые инфузории очень маленькие, ненамного крупнее самых крупных бактерий. Другим нравится
«трубчатый анималистик» Stentor может достигать размера двух миллиметров, поэтому его можно увидеть невооруженным глазом. Парамеций не становится намного больше 0,3 мм.
Некоторые инфузории очень маленькие, ненамного крупнее самых крупных бактерий. Другим нравится
«трубчатый анималистик» Stentor может достигать размера двух миллиметров, поэтому его можно увидеть невооруженным глазом. Парамеций не становится намного больше 0,3 мм. Над центром организма вы видите отверстие для кормления. Реснички создают ток, чтобы сметать бактерии и другие частицы пищи. В основании кормового отверстия пища заключена в вакуоли. Пищевые вакуоли служат для транспортировки пищи по клетке. Звездообразные сократительные вакуоли или пузырьки, выделяющие воду, используются для балансировки количества воды в клетке. Два ядра несут генетическую информацию.
Почему реснички? : Когда размер вашего тела меньше миллиметра, вода действует как густой сироп, поэтому плавает, как
рыба не была бы эффективным средством передвижения. Если вы хотите плавать быстро и маневренно, вам нужны реснички,
крошечные волоски, действующие как весла. Большинство инфузорий превосходно плавают, некоторые виды настолько быстры, что их едва видно
при наблюдении.
В многоклеточных организмах многие клетки специализированы (дифференцированы). Различные типы клеток способны выполнять
все виды задач (т.е. действуют как нервные клетки, мышечные клетки, клетки крови и т. д.). Одноклеточные организмы обладают органеллами, особыми структурами внутри или на клетке, которые помогают выполнять всевозможные задачи. Такими органеллами являются пищевые вакуоли и везикулы, выделяющие воду. У многих инфузорий развились всевозможные особые органеллы. Paramecium использует так называемые трихоцисты; крошечные заостренные нити, которыми можно выстрелить в хищника, когда ему угрожают.
Мионемы : Это волокна, которые действуют как мышцы. Мы можем видеть их в стеблях анималистических колокольчиков, таких как
Вортицелла и Карчесиум. Они способны сокращать стебель с исключительной скоростью. На правом изображении
мионемы видны в виде светлых волнистых полос внутри стеблей. У многих инфузорий можно увидеть сросшиеся реснички. Группы
реснички сливаются в пластинчатые мембранеллы. В виде волнистых листов они заметают частицы пищи. Их можно увидеть в
колокольчики. У других инфузорий есть толстые круглые пучки ресничек, называемые цирри, которые действуют как ноги и позволяют организму фактически ходить по поверхности. Для независимой координации этих усиков у них есть нервоподобные органеллы, называемые нейрофибриллами. На верхнем изображении Euplotes и Stylonychia показаны оба типа ресничек.
В виде волнистых листов они заметают частицы пищи. Их можно увидеть в
колокольчики. У других инфузорий есть толстые круглые пучки ресничек, называемые цирри, которые действуют как ноги и позволяют организму фактически ходить по поверхности. Для независимой координации этих усиков у них есть нервоподобные органеллы, называемые нейрофибриллами. На верхнем изображении Euplotes и Stylonychia показаны оба типа ресничек.
Трубач Stentor — одна из самых крупных инфузорий. В расширенном виде они могут быть 2 миллиметра в длину и едва заметны.
невооруженным глазом. Эти зеленые Stentors демонстрируют хитрый трюк, который используют некоторые другие мелкие организмы. Они зеленые, потому что
они используют симбиотические зеленые водоросли под названием хлорелла. На странице о зеленых водорослях эти водоросли будут показаны крупным планом.
Инфузории обычно размножаются бесполым путем делением. Клетка делится на две особи. Здесь мы видим, как Paramecium подвергается делению. Время от времени мы также можем столкнуться с процессом, который называется конъюгацией. Эти две инфузории
рода Spirostomum цепляются друг за друга бок о бок и сливаются вместе. В сложном процессе они обмениваются
генетический материал из их ядер. После конъюгации потомства нет, особи «обновились».
вместо этого сами. У большинства животных, даже у человека, есть реснички, похожие на реснички инфузорий. Эти реснички используются внутрь
наше тело, например, для транспортировки частиц пищи или другого материала.
Эти две инфузории
рода Spirostomum цепляются друг за друга бок о бок и сливаются вместе. В сложном процессе они обмениваются
генетический материал из их ядер. После конъюгации потомства нет, особи «обновились».
вместо этого сами. У большинства животных, даже у человека, есть реснички, похожие на реснички инфузорий. Эти реснички используются внутрь
наше тело, например, для транспортировки частиц пищи или другого материала.
Сделайте свой собственный сенокос : Не так уж сложно вырастить Paramecium или других простейших с помощью сена. Просто
кипятите немного сухой травы в течение 15 или более минут. Налейте воду в миску. Подождите несколько дней, пока слой бактерий
начинает развиваться на поверхности. Затем добавьте несколько экземпляров, которые вы собрали из прудовой воды (стереомикроскоп всегда очень полезен для их сортировки). Но вы также можете поставить миску с водой за окном (не под прямыми солнечными лучами) и просто ждать, что принесет ветер. Многие покоящиеся споры микроорганизмов переносятся ветром.
Ракообразные…
Что такое ракообразные? : Это группа животных, наиболее известная своими крабами и омарами. Но у них много микроскопических родственников. Вместе с насекомыми они принадлежат к большой группе, называемой членистоногими. Все они имеют сегментированные конечности и прочный внешний скелет из хитина. Каких ракообразных можно найти в пресной воде? : Существуют три основные группы микроскопических ракообразных, с которыми вы можете столкнуться, глядя на каплю воды в пруду: водяные блохи, остракоды и веслоногие ракообразные. Самый знакомый
являются водяные блохи. Это самые многочисленные организмы в пресноводном зоопланктоне. Их можно увидеть невооруженным глазом, потому что некоторые виды могут достигать размера почти шести миллиметров. С хорошим ручным объективом можно наблюдать много интересных особенностей.
Одной из наиболее очевидных особенностей являются большие антенны. Они используют их для передвижения. Над усиками видны большие глаза. Он выглядит как один глаз, но состоит из двух сложных глаз, сросшихся вместе. Внутри двустворчатой защитной оболочки, называемой панцирем, находится ряд из пяти или шести пар ножек, которые они используют для фильтрации пищи (мелких водорослей).
пищу можно рассматривать как желто-коричневое вещество. Слева от кишки видны яйца. Узнайте больше о водяных блохах
в статье Micscape Анатомия водяной блохи! Маленькое сердце легко заметить, когда вы исследуете живой образец под
микроскоп. С помощью карандаша и секундомера можно посчитать темпы сердечных сокращений. Просто коснитесь карандашом кусочка
бумаги в темпе сердца дафнии в течение одной минуты.
Они используют их для передвижения. Над усиками видны большие глаза. Он выглядит как один глаз, но состоит из двух сложных глаз, сросшихся вместе. Внутри двустворчатой защитной оболочки, называемой панцирем, находится ряд из пяти или шести пар ножек, которые они используют для фильтрации пищи (мелких водорослей).
пищу можно рассматривать как желто-коричневое вещество. Слева от кишки видны яйца. Узнайте больше о водяных блохах
в статье Micscape Анатомия водяной блохи! Маленькое сердце легко заметить, когда вы исследуете живой образец под
микроскоп. С помощью карандаша и секундомера можно посчитать темпы сердечных сокращений. Просто коснитесь карандашом кусочка
бумаги в темпе сердца дафнии в течение одной минуты.
Остракоды (см. верхнее изображение) — очень интересные маленькие ракообразные. Их панцирь еще более защитный, чем у
водяные блохи. Они могут полностью сомкнуть две половинки и уйти в нее. Их панцири настолько прочны, что хорошо окаменевают. Их окаменелости очень важны при изучении слоев древней земли. Доисторические слои земли могут быть
датируется определением вида, населявшего этот слой.
Доисторические слои земли могут быть
датируется определением вида, населявшего этот слой.
Последняя группа микроскопических ракообразных, изображенных здесь, — веслоногие. Их тело не имеет панцирного вида, а более тонкое и сегментированное. В пресной воде их не так много, как дафний, но в океане
их можно найти в астрономических числах. Мы можем даже считать их самыми многочисленными животными на планете. Они есть
основной источник пищи для рыб и даже китов.
Диатомеи…
Что такое диатомовые водоросли? : Диатомовые водоросли — хрупкие одноклеточные организмы с желто-коричневым хлоропластом, который позволяет
их к фотосинтезу. Их клеточные стенки сделаны из кремнезема почти как стеклянный дом. Конструкция клеточной стенки, называемая панцирем, состоит из двух клапанов, которые входят друг в друга наподобие маленькой таблетницы. Цвет хлоропласта
имеет желто-коричневый цвет, а не зеленый, который мы знаем о других существах, использующих свет в качестве источника энергии. Существуют две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В пресной воде
большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу.
Существуют две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В пресной воде
большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу. Где можно найти диатомовые водоросли? : В конце зимы наиболее многочисленны в пресной воде. Ими покроют поверхности водных растений или столбы и деревянные бордюры прудов. Если вам нравится изучать их, вы можете очистить коричневый
роста с помощью плоского куска пластика. Вы также можете использовать губку. Для свободноживущих (планктона) видов предусмотрен специальный штраф.
сетка для планктона очень полезна.
Многие виды диома остаются связанными после деления клеток. Образуют колонии, длинные цепочки. Иногда соединяются только кончики и они образуют зигзагообразный узор. Клетки диатомовых водорослей — идеальные объекты для изучения под микроскопом. Они
имеют сложные узоры из очень тонких точек и часто имеют всевозможные орнаменты. Лучший способ сделать видимыми красивые структуры панциря — удалить содержимое из клетки. Для этого можно использовать перекись водорода. Но это
также можно найти пустые панцири мертвых диатомовых водорослей. Чрезвычайно тонкие поры в панцире некоторых видов диатомовых водорослей используются для проверки разрешающей способности линз микроскопа.
Для этого можно использовать перекись водорода. Но это
также можно найти пустые панцири мертвых диатомовых водорослей. Чрезвычайно тонкие поры в панцире некоторых видов диатомовых водорослей используются для проверки разрешающей способности линз микроскопа.
Передвижение диатомовых водорослей : Пеннатные диатомеи, появившиеся позднее в истории Земли, способны передвигаться в
медленная скользящая мода в направлении длины клетки. Механизм этого еще недостаточно изучен, но
кажется, что через щель рядом с клеткой (швом) выпячиваются крошечные микрофибриллы. С ними они могут передвигаться
поверхность. На снимке очищенной диатомей над швом видна тонкая центральная горизонтальная линия. Там
представляют собой две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В
в пресной воде большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу. В морских водах большое разнообразие форм тела.
больше. В океане они составляют основную часть фитопланктона — фотосинтезирующих организмов, плавающих вместе с водой. Текущий. На этом изображении показан вид сверху на крупного косцинодиска, морского вида, которого можно просто увидеть с помощью
невооруженным глазом. Хорошо видна тонкая сетчатая структура кремнистой клеточной стенки. Желто-коричневые хлоропласты
используемые для фотосинтеза, также легко увидеть.
Текущий. На этом изображении показан вид сверху на крупного косцинодиска, морского вида, которого можно просто увидеть с помощью
невооруженным глазом. Хорошо видна тонкая сетчатая структура кремнистой клеточной стенки. Желто-коричневые хлоропласты
используемые для фотосинтеза, также легко увидеть.
Простейшие и жгутиковые простейшие…
Что такое простейшие? : Название «простейшие» используется для более похожих на животных одноклеточных организмов, таких как амебы.
и инфузории. Термин «водоросли» используется для более похожих на растения микроорганизмов. Но различие часто неопределенно.
У динобриона (верхнее изображение) есть хлоропласты для фотосинтеза, но он также может питаться органическими веществами. Он даже умеет плавать. Такой организм не может быть ни животным, ни растительным. В наши дни все эти одноклеточные организмы, которые не являются ни животными, ни
растения, бактерии или грибы называются «протистами».
Что такое жгутики? : Жгутик, также называемый ундулиподием, представляет собой хлыстообразную структуру, используемую для передвижения, для
кормления или других целей. Почти у всех организмов есть жгутики (на каком-то этапе их жизни). У нас, людей, они есть в наших телах. Даже наши собственные сперматозоиды можно считать жгутиконосцами. Все эти жгутики имеют сходную базовую конструкцию.
Только бактерии имеют жгутики совершенно другого типа. Реснички инфузорий — это просто более короткие версии, которые действуют
другой. Ресничка бьется, как маленькая педаль, и создает боковое движение. Большинство ундулиподий действуют скорее как
пропеллерные, волнообразные движения толкают или тянут организм в переднем направлении.
Одно ядро содержит генетический материал. Ярко-зеленые хлоропласты преобразуют свет в энергию. Энергия хранится в зернохранилище. Длинный гибкий ундулиподий, используемый для передвижения. У основания жгутика находим круглую сократительную вакуоль. Он помогает организмам удалять избыток воды. Поскольку живая ткань засолена, организмы, живущие в пресной воде, поглощают воду. Хорошо видно красное пятно. На самом деле настоящим светочувствительным органом является припухлость у основания
жгутик. Красная область обеспечивает обнаружение света только с одного направления. Так как светочувствительный орган
непосредственно связанная со жгутиком, эвглена прекрасно умеет плыть к источнику света.
Он помогает организмам удалять избыток воды. Поскольку живая ткань засолена, организмы, живущие в пресной воде, поглощают воду. Хорошо видно красное пятно. На самом деле настоящим светочувствительным органом является припухлость у основания
жгутик. Красная область обеспечивает обнаружение света только с одного направления. Так как светочувствительный орган
непосредственно связанная со жгутиком, эвглена прекрасно умеет плыть к источнику света.
Интересным жгутиковым протистом для изучения является Euglena. Здесь показаны некоторые из его многочисленных функций. Эвглена может стать настолько многочисленной, что вода в пруду может стать ярко-зеленой. Помимо использования своего ундулиподия, эвглениды также могут передвигаться, сгибая свое тело и изменяя форму тела, так называемое эвгленоидное движение. Эвглениды обладают способностью терять свои хлоропласты. Если вы будете держать эвгленид в темноте, они начнут питаться органическими веществами и могут потерять свой пигмент. Есть много видов без хлоропластов.
Большинство жгутиковых простейших имеют два или даже больше жгутиков. Часто мы видим, как один жгутик тянется сзади, как своего рода
руль. Жгутики и реснички прозрачные и тонкие, поэтому их нелегко увидеть под микроскопом. Специальные контрастные методы, такие как освещение темным полем или фазовый контраст, помогают сделать эти структуры видимыми. Динофлагелляты
(Dinophyta) — жгутиковые протисты. Многие виды имеют красивый фактурный панцирь из пластин целлюлозы. Один из
их два жгутика проходят по спирали через бороздку вдоль клетки. Другие проекты вниз. Эффектный вид
является Ceratium hirundinella. Жгутиками для передвижения пользуются не только простейшие. Даже наши собственные сперматозоиды имеют жгутик. Не все жгутиковые формы свободно плавают. Многие ведут сидячий образ жизни. Spongomonas — колония жгутиконосцев, живущих в студенистой матрице. они используют свои жгутики для сбора пищи.
Создайте свою собственную культуру Euglena : Сравнительно легко создать так называемую «земную культуру» для нескольких видов фотосинтезирующих простейших и водорослей, включая Euglena.
История статьи
Получен:
09 октября 1987 г.
Полученная ревизия:
07 декабря 1987 г.
Принято:
10 декабря 1987 г.
Опубликовано:
01 мая 1988
Фильтр поиска панели навигации FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic Термин поиска на микросайте
Advanced Search
Под воздействием солнечной радиации популяция двигалась вниз по колонке, вероятно, руководствуясь отрицательным фототаксисом, и образовывала плотный слой внизу. Предполагается, что такое поведение дает организмам возможность убежать от пагубного яркого света. Движение вниз происходит быстрее, чем позволяет скорость плавания клеток, и может быть ускорено гидромеханическим эффектом. Восходящее движение, наблюдаемое ночью, может быть связано с точным отрицательным гравитационным полем, наблюдаемым в организмах. Эти антагонистические типы поведения позволяют организмам активно искать и оставаться в районах с подходящими условиями.Автоматический подсчет клеток, Euglena gracilis , Жгутиконосец, Гравитаксис, Фотодвижение, Вертикальное распределение
[1]
Häder
D.-P.
(
1987
)
Фотодвижение у эукариотических микроорганизмов
Фотобиохим. Фотобиофиз. Доп.
Фотобиофиз. Доп.
,
203
–
214
.
[2]
Нульч
В.
Хедер
Д.-П.
(
1987
)
Фотодвижение в подвижных микроорганизмах II
Photochem. Фотобиол.
, в печати.
[3]
Дин
Б.
(
1969
)
Фототаксическая реакция Euglena на одиночные и повторяющиеся импульсы актинического света
Exp. Клетка. Рез.
,
56
,
375
–
381
.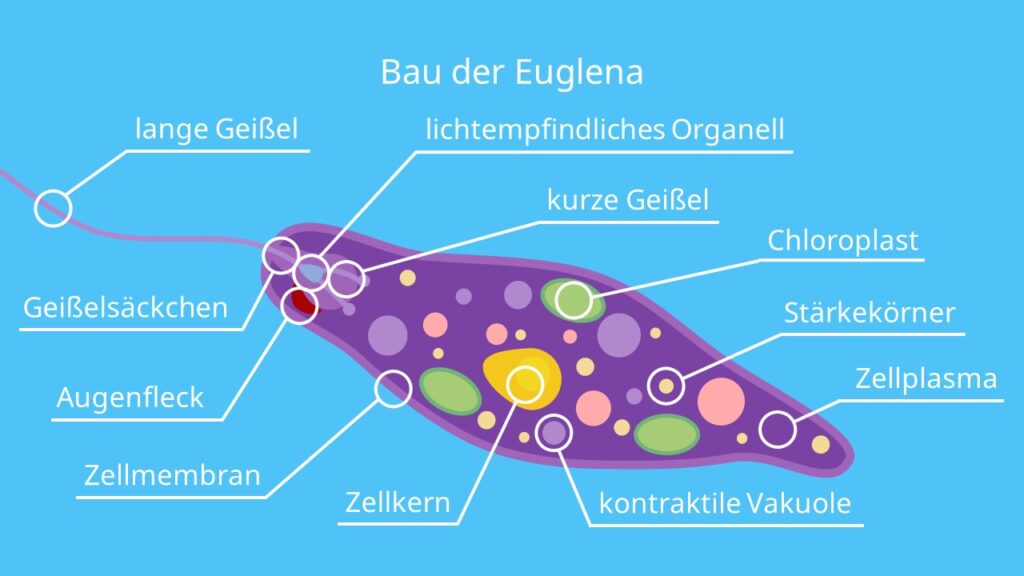
[4]
Даути
M.J.
Diehn
B.
(
1980
)
Флавины как пигменты фоторецепторов для поведенческих реакций
Struct. Связь.
,
41
,
45
–
70
.
[5]
Даути
М.Дж.
Дин
Б.
(
1983
)
Фотосенсорная трансдукция у жгутиковых водорослей, Euglena gracilis . IV. Долгосрочные эффекты ионов и pH на проявление понижающего фотоповедения
Arch. микробиол.
,
134
,
204
–
207
.
[6]
Даути
М. Дж.
Дин
Б.
(
1984
)
Анионная чувствительность подвижности и снижение фотофобных реакций Euglena gracilis
Arch. микробиол.
,
138
,
329
–
332
.
[7]
Волкен
Дж.Дж.
Голень
E.
(
1958
)
Фотодвижение в Euglena gracilis . I. Фотокинез. II. Фототаксис
J. Protozool.
,
5
,
39
–
46
.
[8]
Дженнингс
Х.С.
(
1904
)
Реакции на свет у инфузорий и жгутиковых
, В
Вклад в изучение поведения микроорганизмов
стр.
29
–
71
Институт Карнеги. Вашингтон
, Вашингтон.
[9]
Будер
Дж.
(
1917
)
Zur Kenntnis der phototaktischen Richtungsbewegungen
Jahrber. Wissenschaftl. Ботаник
,
58
,
105
–
220
.
[10]
Мачта
S.O.
(
1911
)
Свет и поведение организмов
John Wiley & Sons
New York Chapman & Hall London.
[11]
Colombetti
G.
Häder
D.-P.
Lenci
F.
Quaglia
M.
(
1982
)
Фототакси в Euglena gracilis : Влияние азида натрия и иона трифенилметилфосфония на цепь фотосенсорной трансдукции
Curr. микробиол.
,
7
,
281
–
284
.
[12]
Хедер
Д. -П.
-П.
Коломбетти
Г.
Ленчи
Ф.
Куалья
М.
(
1981
)
Фототаксис у жгутиковых, Euglena gracilis и Ochromonas danica
Arch. микробиол.
,
130
,
78
–
82
.
[13]
Хедер
Д.-П.
(
1986
)
Влияние солнечного и искусственного УФ-облучения на подвижность и фототаксис жгутиковых, Euglena gracilis
Фотохим. Фотобиол.
,
44
,
651
–
656
.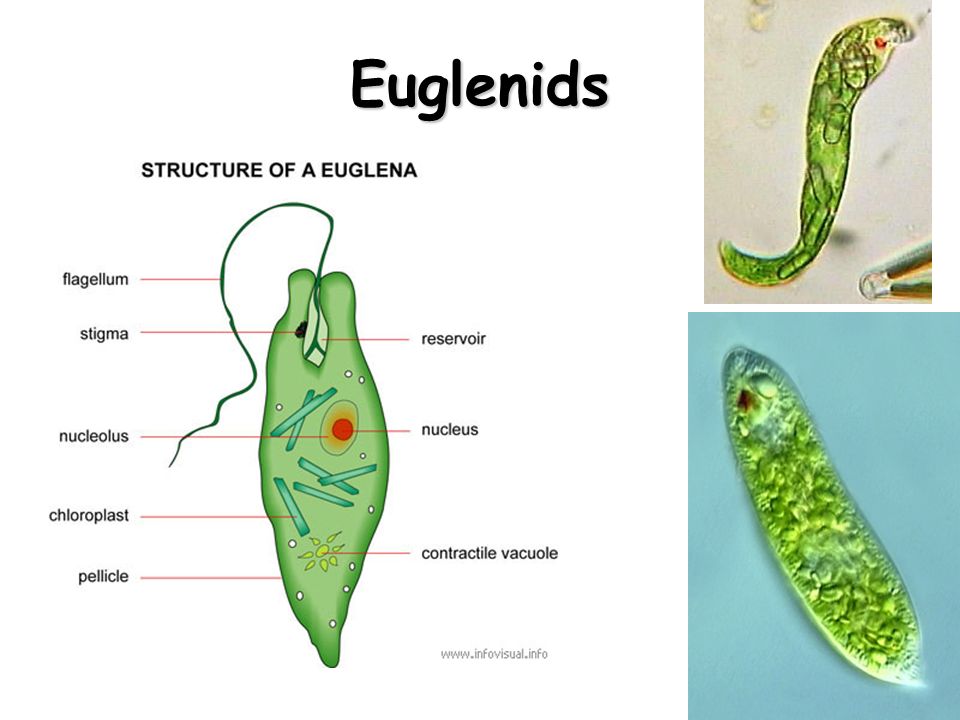
[14]
Хедер
Д.-П.
(
1987
)
Поляротаксис, гравитационный и вертикальный фототаксис у зеленых жгутиконосцев, Euglena gracilis
Arch. микробиол.
,
147
,
179
–
183
.
[15]
Кесслер
Дж.О.
(
1985
)
Гидродинамическая фокусировка мотивных клеток водорослей
Природа (Лондон)
,
313
,
218
—
2209
.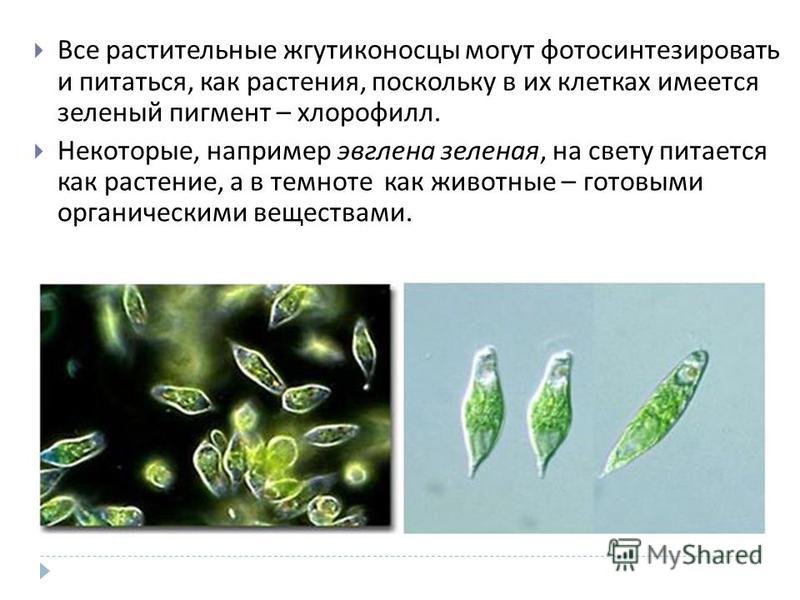
[16]
Кесслер
Дж.О.
(
1986
)
Внешняя динамика плавающих микроорганизмов
В
Прогресс в фикологических исследованиях
(
Chapman
, PP
258
—
307
Biopress Ltd
4.
[17]
Senger
H.
(
1987
) 8-е изд.,
Том. I и II
, In
Реакции синего света: явления и встречаемость в растениях и микроорганизмах
CRC Press
, Бока-Ратон, Флорида.
[18]
Бенедетти
П. А.
А.
Чекуччи
А.
(
1975
)
Пигменты Paraflagellar body (PFB), изученные с помощью флуоресцентной микроскопии у Euglena gracilis
Plant Sci. лат.
,
4
,
47
–
51
.
[19]
Гетти
F.
Colombetti
G.
Lenci
F.
Campani
E.
Polacco
E.
Quaglia
M.
(
1985
)
Флуоресценция фоторецепторного пигмента Euglena gracilis : микроспектрофлуориметрическое исследование in vivo
Photochem. Фотобиол.
,
42
,
29
–
33
.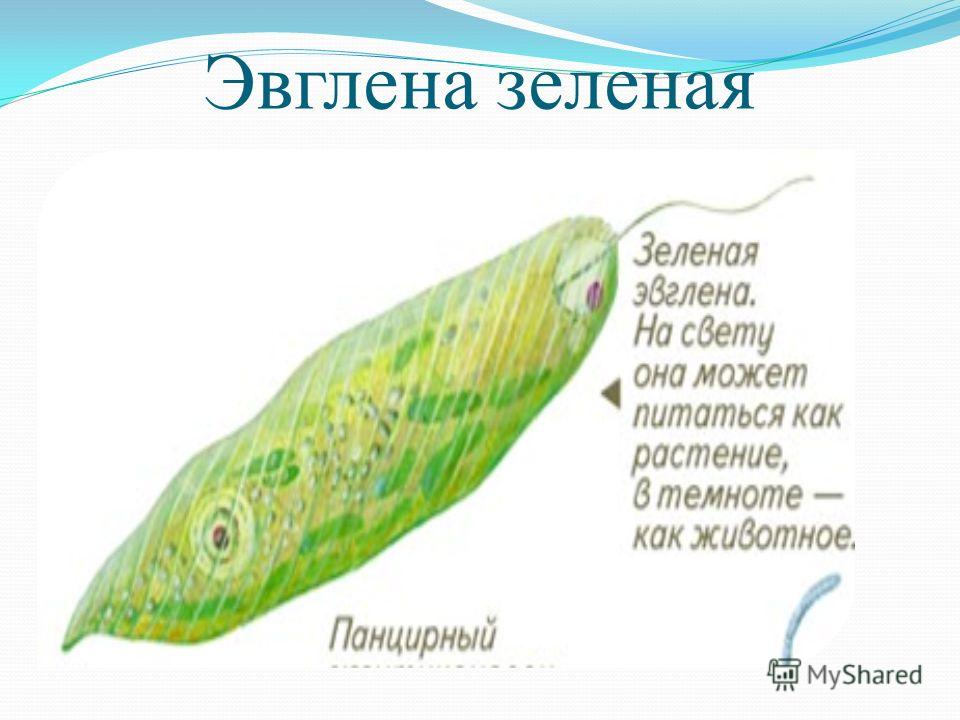
[20]
Бэнкрофт
F.W.
(
1913
)
Гелиотропизм, дифференциальная чувствительность и гальванотропизм у Euglena
J. Exp. Зоол.
,
15
,
383
–
420
.
[21]
Хедер
Д.-П.
Леберт
М.
ДиЛена
М.Р.
(
1986
)
Новые данные о механизме фототаксической ориентации Euglena gracilis
Curr. микробиол.
,
14
,
157
–
163
.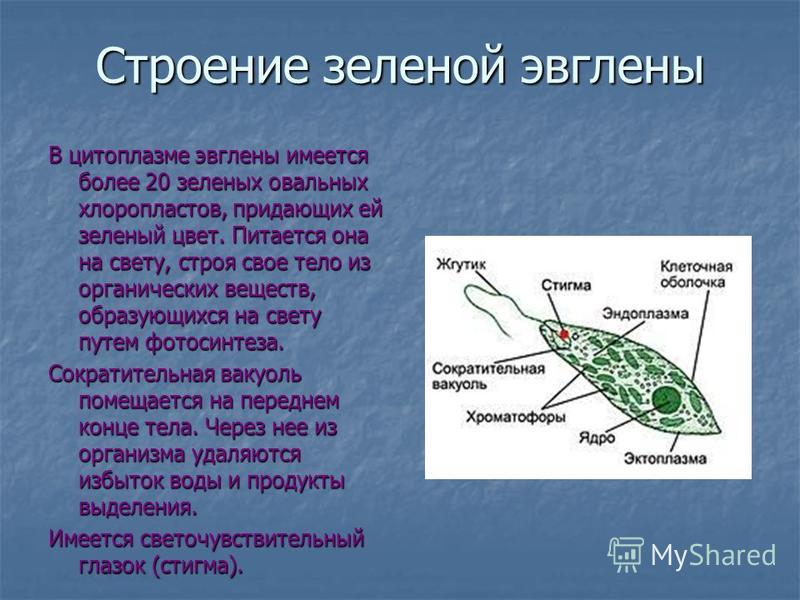
[22]
Хедер
Д.-П.
Леберт
М.
(
1985
)
Компьютерное отслеживание подвижных микроорганизмов в режиме реального времени
Photochem. Фотобиол.
,
42
,
509
–
514
.
[23]
Чеккучи
А.
Коломбетти
Г.
Феррара
Р.
Ленчи 903
4
2.
( 1976
)
Дальнейший анализ массовых фотоответов Euglena gracilis Klebs (жгутиковая эвгленоидина)
Monit. Зоол. итал.
,
10
,
271
–
277
.
[24]
Хедер
Д.-П.
(
1985
)
Влияние УФ-В на подвижность и фотоповедение зеленых жгутиконосцев, Euglena gracilis
Arch. микробиол.
,
141
,
159
–
163
.
[25]
Lenci
F.
Colombetti
G.
Häder
D.-P.
(
1983
)
Роль флавиновых гасителей и ингибиторов в сенсорной передаче отрицательного фототаксиса у жгутиконосцев, Euglena gracilis
Curr. микробиол.
,
9
,
285
–
290
.
[26]
Хедер
Д.-П.
Грибенов
К.
(
1987
)
Универсальный анализ цифровых изображений с помощью микрокомпьютера для подсчета микроорганизмов
EDV Med. биол.
,
18
,
37
–
42
.
[27]
Хедер
Д.-П.
(
1986
)
The effect of enhanced solar UV-B radiation on motile microorganisms
In
Stratospheric Ozone Reduction, Solar Ultraviolet Radiation and Plant Life
(
Worrest
R. C.
C.
Caldwell
MM
, ред.), стр.
223
–
233
Springer Verlag
, Берлин, Гейдельберг, Нью-Йорк.
[28]
Верма
М.Н.
(
1967
)
Суточные колебания в рыбном пруду в Сеони, Индия
Hydrobiol.
,
30
,
129
–
137
.
Этот контент доступен только в формате PDF.
© 1988 Федерация европейских микробиологических обществ
© 1988 Федерация европейских микробиологических обществ
Раздел выпуска:
Статьи
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Оповещение о текущей проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Конвергентная структура с дивергентными адаптациями в комбинаторных микробиомных сообществах
Литоавтотрофный образ жизни широко распространенного рода Roseovarius, выявленный при физиологической и геномной характеристике Roseovarius autotrophicus sp. ноябрь
ноябрь
Летучие вещества, выделяемые Beauveria bassiana, вызывают поведение яйцекладки осенней совки Spodoptera frugiperda (Lepidoptera: Noctuidae)
Сезонные колебания температурной чувствительности бактериального роста в почве и озере умеренного пояса
Отслеживание порчи бактерий в микробиоме тунца
Реклама
жгутиконосцев эвгленоидных: многогранная биотехнологическая платформа
Обзор
. 2015 20 мая; 202:135-45.
doi: 10.1016/j.jbiotec.2014.11.035.
Epub 2014 16 декабря.
Юрай Крайчович 1 , Матей Вестег 2 , Стивен Д. Шварцбах 3
Принадлежности
Обзор
Юрай Крайчович и др.
Дж Биотехнолог. .
. 2015 20 мая; 202:135-45.
doi: 10.1016/j.jbiotec.2014.11.035.
Epub 2014 16 декабря.
Авторы
Юрай Крайчович 1 , Матей Вестег 2 , Стивен Д. Шварцбах 3
Принадлежности
Абстрактный
Эвгленоидные жгутиконосцы — это в основном пресноводные протисты, растущие в самых разных средах, что делает их хорошо подходящими для множества биотехнологических приложений. Фототрофные эвглениды обладают сложными хлоропластами зелено-водорослевого происхождения, ограниченными тремя мембранами. Организация ядерного и пластидного генома эвглены, структура генов и экспрессия генов заметно отличаются от других организмов. Наши наблюдения на модельном организме Euglena gracilis показывают, что транскрипция как пластидного, так и ядерного генома нечувствительна к изменениям окружающей среды и что экспрессия генов регулируется в основном на посттранскрипционном уровне. Пластиды Euglena были предложены в качестве места для производства белков и метаболитов с добавленной стоимостью, представляющих биотехнологический интерес. Было показано, что эвглена является подходящим видом простейших для производства нескольких соединений, используемых в производстве космецевтических и нутрицевтических препаратов, таких как α-токоферол, эфиры воска, полиненасыщенные жирные кислоты, биотин и тирозин. Запасной полисахарид парамилон обладает иммуностимулирующими свойствами и перспективен для производства биоматериалов. Биомасса эвглены может использоваться в качестве пищевой добавки в аквакультуре и в кормах для животных. Различные применения эвглены в экологической биотехнологии включают оценку экотоксикологического риска, биоремедиацию тяжелых металлов, биоремедиацию промышленных сточных вод и загрязненной воды.
Пластиды Euglena были предложены в качестве места для производства белков и метаболитов с добавленной стоимостью, представляющих биотехнологический интерес. Было показано, что эвглена является подходящим видом простейших для производства нескольких соединений, используемых в производстве космецевтических и нутрицевтических препаратов, таких как α-токоферол, эфиры воска, полиненасыщенные жирные кислоты, биотин и тирозин. Запасной полисахарид парамилон обладает иммуностимулирующими свойствами и перспективен для производства биоматериалов. Биомасса эвглены может использоваться в качестве пищевой добавки в аквакультуре и в кормах для животных. Различные применения эвглены в экологической биотехнологии включают оценку экотоксикологического риска, биоремедиацию тяжелых металлов, биоремедиацию промышленных сточных вод и загрязненной воды.
Ключевые слова: хлоропласты; экотоксикология; парамилон; токоферол; Эфиры воска.
Copyright © 2014 Elsevier B.V. Все права защищены.
Похожие статьи
Посмотреть все похожие статьи
Цитируется
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Идентификация жгутикового белка, участвующего в гравитаксисе у жгутиковых Euglena gracilis
Abstract
Жгутиковые клетки имеют большое эволюционное значение для всех видов животных и растений. В отличие от высших растений жгутиковые клетки участвуют в размножении макроводорослей, а также у ранних дивергирующих наземных растений. Euglena gracilis — новый жгутиковый модельный организм. В текущем исследовании сообщается, что специфический кальмодулин (CaM2), участвующий в гравитации E. gracilis , взаимодействует с эволюционно консервативным жгутиковым белком EgPCDUF4201. Последующий молекулярный анализ ясно показал, что EgPCDUF4201 также участвует в гравитации. Мы выполнили субклеточную локализацию CaM2 с помощью иммуноблотинга и непрямой иммунофлуоресценции. С помощью двухгибридного скрининга дрожжей EgPCDUF4201 был идентифицирован как партнер по взаимодействию с CaM2. С-конец EgPCDUF4201 отвечает за взаимодействие с CaM2. Замалчивание N- и C-концов EgPCDUF4201 с помощью РНКи приводило к нарушению гравитации. Более того, анализ непрямой иммунофлуоресценции показал, что EgPCDUF4201 представляет собой белок, ассоциированный с жгутиками. В текущем исследовании были специально рассмотрены некоторые важные вопросы, касающиеся цепи передачи сигнала гравитаксиса в Е. gracilis . Помимо того факта, что это улучшило текущее понимание механизмов восприятия гравитации у E. gracilis , оно также породило несколько интересных исследовательских вопросов, касающихся функции домена неизвестной функции 4201 в жгутиковых клетках.
gracilis , взаимодействует с эволюционно консервативным жгутиковым белком EgPCDUF4201. Последующий молекулярный анализ ясно показал, что EgPCDUF4201 также участвует в гравитации. Мы выполнили субклеточную локализацию CaM2 с помощью иммуноблотинга и непрямой иммунофлуоресценции. С помощью двухгибридного скрининга дрожжей EgPCDUF4201 был идентифицирован как партнер по взаимодействию с CaM2. С-конец EgPCDUF4201 отвечает за взаимодействие с CaM2. Замалчивание N- и C-концов EgPCDUF4201 с помощью РНКи приводило к нарушению гравитации. Более того, анализ непрямой иммунофлуоресценции показал, что EgPCDUF4201 представляет собой белок, ассоциированный с жгутиками. В текущем исследовании были специально рассмотрены некоторые важные вопросы, касающиеся цепи передачи сигнала гравитаксиса в Е. gracilis . Помимо того факта, что это улучшило текущее понимание механизмов восприятия гравитации у E. gracilis , оно также породило несколько интересных исследовательских вопросов, касающихся функции домена неизвестной функции 4201 в жгутиковых клетках.
Введение
Euglena gracilis представляет собой фотосинтезирующий эукариотический одноклеточный организм, который является представителем Euglenozoa вместе с паразитами родов Трипанозома и Leishmania 1 . Хотя эта филогенетическая группа развилась независимо от Archaeplastida (включая зеленые водоросли), E. gracilis содержит хлоропласты, окруженные тремя мембранами, вероятно, приобретенными в результате вторичного эндосимбиоза зеленой водоросли 2 . Кроме того, в отсутствие достаточного источника света E. gracilis также могут потреблять питательные вещества гетеротрофно.
E. gracilis реагирует на различные сигналы окружающей среды, такие как кислород, свет и гравитация 3,4 . Среди этих раздражителей большое значение для E. gracilis имеют свет и гравитация, поскольку баланс между отрицательным гравитационным движением (направленным движением от гравитации) и положительным фототаксисом (направленным движением к источнику света) помогает клеткам достичь оптимальной ниши в воде. столбец 5 .
столбец 5 .
Преимущественно E. gracilis демонстрирует отрицательное поведение гравитации. Однако, как показано в стандартных лабораторных условиях, клетки демонстрируют переход от положительного к отрицательному гравитаксису по мере роста культуры от молодых к старым соответственно. Показано, что в условиях параболического полета (переход от гипер-g к микро-g, а также от микро-g к гипер-g) такая ориентация является активным физиологическим процессом, в котором участвует биение жгутиков и контролируется гравитацией 6 . Влияние условий микрогравитации на экспрессию генов изучалось также во время полета космического корабля 7 . Однако точная природа рецептора, ответственного за гравитаксис, еще не выяснена у E. gracilis . Первоначальное исследование ингибиторов установило участие чувствительных к растяжению кальциевых ионных каналов (SSCIC) в гравитации 8 . Кроме того, участие предполагаемого переходного рецепторного потенциала (TRP) было предложено в последующем исследовании с использованием РНК-интерференции 9 (РНКи). Однако в этом направлении требуются дополнительные исследования, так как несколько предполагаемых чувствительных к растяжению/механочувствительных каналов были идентифицированы в библиотеке мРНК E. gracilis (неопубликованные данные). Помимо этого открытого вопроса относительно точной природы SSCIC, специфичного для гравитаксиса, был достигнут разумный прогресс в отношении лежащего в основе молекулярного механизма гравитаксиса у E. gracilis . Например, текущая рабочая модель гравитации была создана на основе серии экспериментов 9.1155 10 . Рабочая модель предполагает, что SSCIC активируются, когда клетки отклоняются от своего пути вертикального плавания, что приводит к притоку ионов кальция. В свою очередь, кальций связывается с кальмодулином, который дополнительно активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназу А, которая, как предполагается, модулирует функции различных белков жгутиков. Недавно подавление специфической протеинкиназы А (PKA) с помощью РНКи прояснило ее участие в гравитации, а также в фототаксисе 11 .
Однако в этом направлении требуются дополнительные исследования, так как несколько предполагаемых чувствительных к растяжению/механочувствительных каналов были идентифицированы в библиотеке мРНК E. gracilis (неопубликованные данные). Помимо этого открытого вопроса относительно точной природы SSCIC, специфичного для гравитаксиса, был достигнут разумный прогресс в отношении лежащего в основе молекулярного механизма гравитаксиса у E. gracilis . Например, текущая рабочая модель гравитации была создана на основе серии экспериментов 9.1155 10 . Рабочая модель предполагает, что SSCIC активируются, когда клетки отклоняются от своего пути вертикального плавания, что приводит к притоку ионов кальция. В свою очередь, кальций связывается с кальмодулином, который дополнительно активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназу А, которая, как предполагается, модулирует функции различных белков жгутиков. Недавно подавление специфической протеинкиназы А (PKA) с помощью РНКи прояснило ее участие в гравитации, а также в фототаксисе 11 . В другом исследовании подавление специфического белка кальмодулина 2 (CaM2) привело только к нарушению гравитации у E. gracilis 12 .
В другом исследовании подавление специфического белка кальмодулина 2 (CaM2) привело только к нарушению гравитации у E. gracilis 12 .
В этом отчете представлена информация о субклеточной локализации CaM2, а также об идентификации партнера по взаимодействию с использованием дрожжевого двухгибридного скрининга. Полученный партнер по связыванию был дополнительно охарактеризован гетерологичной экспрессией, анализом in silico и его субклеточной локализацией.
Результаты
CaM2 присутствует в теле клетки и жгутиках
E. gracilis Чтобы лучше понять функцию CaM2, мы стремились идентифицировать его субклеточную локализацию с помощью непрямой иммунофлуоресценции (IIF) и клеточного фракционирования с последующим вестерн-блоттингом с использованием геномных антител против CaM2. Перед экспериментами по иммунолокализации определяли специфичность коммерчески выращенного геномного антитела против CaM2. Были использованы геномные антитела, облегчающие обнаружение антигена в его денатурированной и нативной конформации. Их реакция на 9Белковый лизат 1334 E. gracilis (дополнительный рисунок 1a) и CaM2, слитый с глутатион-S-трансферазой (GST, дополнительный рисунок 1b), проверяли в денатурирующих условиях с помощью вестерн-блоттинга. Оба эксперимента показали одну полосу ожидаемого размера. Специфичность была дополнительно подтверждена путем создания нокдаун-мутанта (дополнительная фигура 1c). Белковые лизаты дикого типа и мутанта анализировали вестерн-блоттингом с антителом против CaM2. В то время как контроль с антителом против тубулина показал равное количество белков в двух образцах, в нокдаун-мутанте с антителом против CaM2 белок не был обнаружен. В целом эти данные подтвердили специфичность антитела против CaM2.
Были использованы геномные антитела, облегчающие обнаружение антигена в его денатурированной и нативной конформации. Их реакция на 9Белковый лизат 1334 E. gracilis (дополнительный рисунок 1a) и CaM2, слитый с глутатион-S-трансферазой (GST, дополнительный рисунок 1b), проверяли в денатурирующих условиях с помощью вестерн-блоттинга. Оба эксперимента показали одну полосу ожидаемого размера. Специфичность была дополнительно подтверждена путем создания нокдаун-мутанта (дополнительная фигура 1c). Белковые лизаты дикого типа и мутанта анализировали вестерн-блоттингом с антителом против CaM2. В то время как контроль с антителом против тубулина показал равное количество белков в двух образцах, в нокдаун-мутанте с антителом против CaM2 белок не был обнаружен. В целом эти данные подтвердили специфичность антитела против CaM2.
Определение субклеточной локализации CaM2 проводили путем исследования клеточного фракционирования с последующим вестерн-блоттингом и анализом IIF. Было проведено разделение клеточного тела и фракции жгутиков, и чистота была подтверждена микроскопически (дополнительная фигура 2). Количественный Вестерн-блот четко показал, что CaM2 был в изобилии во фракции тел клеток, тогда как видимый сигнал CaM2 не наблюдался во фракции жгутиков (рис. 1a). Кроме того, анализ IIF показал, что CaM2 рассеян по всему телу клетки в виде пятен, но слабый сигнал также был виден в жгутике (рис. 1b, c). Чтобы подтвердить специфичность сигнала, культура клеток с нокдауном CaM2 9Было создано 1334 E. gracilis . Как в клетках дикого типа, так и в нокдаун-мутантных клетках сигнал проявлялся в виде пятен (дополнительная фигура 3). Однако количественный анализ показал, что количество пятен значительно уменьшилось в мутантных клетках с нокдауном, что доказывает, что пятнистый узор представляет собой специфический сигнал (дополнительная фигура 3c). Хотя CaM обычно являются растворимыми белками, CaM2 проявлялся в виде агрегированных пятен. Чтобы определить, является ли CaM2 цитоплазматическим белком, был создан слитый белок GST-CaM2, который был экспрессирован в кишечная палочка . Использовали растворимую фракцию приготовленного неочищенного белкового лизата GST-CaM2 трансформированных клеток E.
Количественный Вестерн-блот четко показал, что CaM2 был в изобилии во фракции тел клеток, тогда как видимый сигнал CaM2 не наблюдался во фракции жгутиков (рис. 1a). Кроме того, анализ IIF показал, что CaM2 рассеян по всему телу клетки в виде пятен, но слабый сигнал также был виден в жгутике (рис. 1b, c). Чтобы подтвердить специфичность сигнала, культура клеток с нокдауном CaM2 9Было создано 1334 E. gracilis . Как в клетках дикого типа, так и в нокдаун-мутантных клетках сигнал проявлялся в виде пятен (дополнительная фигура 3). Однако количественный анализ показал, что количество пятен значительно уменьшилось в мутантных клетках с нокдауном, что доказывает, что пятнистый узор представляет собой специфический сигнал (дополнительная фигура 3c). Хотя CaM обычно являются растворимыми белками, CaM2 проявлялся в виде агрегированных пятен. Чтобы определить, является ли CaM2 цитоплазматическим белком, был создан слитый белок GST-CaM2, который был экспрессирован в кишечная палочка . Использовали растворимую фракцию приготовленного неочищенного белкового лизата GST-CaM2 трансформированных клеток E. coli , и слитый белок очищали. Экспрессия GST-CaM2 из растворимой фракции клеточного лизата указывает на то, что GST-CaM2 экспрессируется в виде растворимого белка в E. coli (рис. 2).
coli , и слитый белок очищали. Экспрессия GST-CaM2 из растворимой фракции клеточного лизата указывает на то, что GST-CaM2 экспрессируется в виде растворимого белка в E. coli (рис. 2).
Рисунок 1 CaM2 находится в теле клетки E. gracilis . ( a ) Вестерн-блоты клеточных фракций с антителом CaM2 (верхняя панель) и антителом к тубулину (средняя панель). ( b , c ) Непрямой иммунофлуоресцентный анализ с антителом против CaM2. Масштабная линейка = 20 мкм.
Полноразмерное изображение
Рисунок 2 Гетерологическая экспрессия и очистка GST-CaM2. ( a ) Окрашенный кумасси SDS-полиакриламидный гель неочищенного (пропускание и промывка) и очищенного (элюирование) GST (слева) и GST-CaM2 (справа). ( b ) Вестерн-блоттинг, обнаруженный с помощью моноклонального антитела к GST.
Изображение полного размера
CaM2 взаимодействует с белком неизвестной функции
Чтобы лучше понять роль CaM2 в гравитационном движении E. gracilis , был проведен двухгибридный скрининг дрожжей для поиска их предполагаемых партнеров по взаимодействию с использованием нормализованной библиотеки кДНК E. gracilis , выращенной в коммерческих целях. Четыре клона, идентифицированные при скрининге, оказались положительными в анализе ретрансформации. Среди них был обнаружен белок, содержащий домен неизвестной функции (DUF) 4201, названный EgPCDUF4201. 5′- и 3′-ПЦР RACE проводили для получения полноразмерной последовательности кДНК Например, PCDUF4201 . Полученная полноразмерная последовательность кДНК EgPCDUF4201 кодировала белок из 372 аминокислот. Анализ in silico для выявления потенциальных дополнительных консервативных доменов показал, что, в дополнение к домену DUF4201, 5 спирально-спиральным доменам, предсказанный мотив IQ (104–123 остатка) и предполагаемый сайт связывания кальмодулина (202–221 остат. ) присутствовали (рис. 3а). Поиск потенциальных сайтов фосфорилирования выявил 6 сайтов фосфорилирования серина, 2 треонина и 1 сайт фосфорилирования тирозина в различных положениях в последовательности EgPCDUF4201 (рис.
gracilis , был проведен двухгибридный скрининг дрожжей для поиска их предполагаемых партнеров по взаимодействию с использованием нормализованной библиотеки кДНК E. gracilis , выращенной в коммерческих целях. Четыре клона, идентифицированные при скрининге, оказались положительными в анализе ретрансформации. Среди них был обнаружен белок, содержащий домен неизвестной функции (DUF) 4201, названный EgPCDUF4201. 5′- и 3′-ПЦР RACE проводили для получения полноразмерной последовательности кДНК Например, PCDUF4201 . Полученная полноразмерная последовательность кДНК EgPCDUF4201 кодировала белок из 372 аминокислот. Анализ in silico для выявления потенциальных дополнительных консервативных доменов показал, что, в дополнение к домену DUF4201, 5 спирально-спиральным доменам, предсказанный мотив IQ (104–123 остатка) и предполагаемый сайт связывания кальмодулина (202–221 остат. ) присутствовали (рис. 3а). Поиск потенциальных сайтов фосфорилирования выявил 6 сайтов фосфорилирования серина, 2 треонина и 1 сайт фосфорилирования тирозина в различных положениях в последовательности EgPCDUF4201 (рис. 3а). Для более точного определения области, взаимодействующей с CaM2, было протестировано взаимодействие полноразмерного белка-приманки CaM2 с полной длиной (1–372 аминокислоты), N-концевым укорочением (1–198 аминокислот) и укорочение С-конца (199–372 аминокислоты) EgPCDUF4201. Результаты показали, что C-концевой домен (199–372 аминокислоты) EgPCDUF4201 взаимодействует с CaM2, тогда как N-концевой домен не взаимодействует (рис. 3b). Более того, полноразмерный EgPCDUF4201 также был способен взаимодействовать с CaM2, но в меньшей степени (рис. 3б).
3а). Для более точного определения области, взаимодействующей с CaM2, было протестировано взаимодействие полноразмерного белка-приманки CaM2 с полной длиной (1–372 аминокислоты), N-концевым укорочением (1–198 аминокислот) и укорочение С-конца (199–372 аминокислоты) EgPCDUF4201. Результаты показали, что C-концевой домен (199–372 аминокислоты) EgPCDUF4201 взаимодействует с CaM2, тогда как N-концевой домен не взаимодействует (рис. 3b). Более того, полноразмерный EgPCDUF4201 также был способен взаимодействовать с CaM2, но в меньшей степени (рис. 3б).
Рисунок 3 EgPCDUF4201 взаимодействует с CaM2. ( a ) Белковые домены EgPCDUF4201. ( b ) Двухгибридный анализ дрожжей между CaM2 и усечениями EgPCDUF4201. BD = связывающий домен. AD = домен активации. FL = полная длина. C-ter = C-конец. N-тер = N-конец. SD-TL (синтетическая определяющая среда без лейцина и триптофана). SD-TLAH (синтетическая определяющая среда без лейцина, триптофана, аденина и гистидина).
Изображение в натуральную величину
Функциональный анализ предполагаемого партнера по взаимодействию CaM2
Чтобы понять функцию идентифицированного предполагаемого партнера по взаимодействию CaM2, с использованием РНКи было проведено молчание EgPCDUF4201 . Были выбраны две области генов, первая в N-концевой области, вторая в домене DUF4201. Понижающая регуляция гена была подтверждена ПЦР в реальном времени (дополнительная фигура 4). Оба нокдаун-мутанта EgPCDUF4201 продемонстрировал нарушение гравитации со случайной ориентацией их схемы плавания, аналогично CaM2 нокдаун-мутантам 12 и в отличие от дикого типа, где большинство клеток плывут вверх (рис. 4, дополнительная фигура 6) . Однако скорость плавания мутантов не изменилась (дополнительная таблица 1), что может исключить дефектное образование жгутиков. Эти результаты предоставили доказательства того, что EgPCDUF4201 участвует в гравитации E. gracilis и разделяет функциональную ассоциацию с CaM2.
Рисунок 4 EgPCDUF4201 участвует в гравитаксисе Euglena gracilis . Репрезентативные гистограммы направленных перемещений дикого типа ( a ) и EgPCDUF4201 С-концевой мишени ( b ) и N-концевой мишени ( c ) нокдаун-мутантов. Размер угловых секторов (обозначенных черным цветом) отражает количество клеток, движущихся в соответствующем направлении.
Изображение в натуральную величину
EgPCDUF4201 представляет собой растворимый жгутиковый белок
Для иммунолокализации EgPCDUF4201 на субклеточном уровне использовали поликлональную мышиную антисыворотку, полученную с использованием полноразмерного белка EgPCDUF4201. Анализ IIF ясно показал, что EgPCDUF4201 присутствует в жгутиках E. gracilis от основания к вершине в виде пунктирной схемы (рис. 5a,b), тогда как в преиммунной сыворотке не наблюдалось никакой иммунной реактивности. (Дополнительный рисунок 5а). Для дальнейшей проверки этого сигнала, 9Культура нокдаун-мутанта 1334 EgPCDUF4201 была получена. У мутанта с нокдауном по сравнению с диким типом наблюдалось снижение интенсивности флуоресценции и количества пятен, что подтверждает специфичность антисыворотки против EgPCDUF4201 (дополнительная фигура 5a). Кроме того, длину жгутиков мутанта с нокдауном также определяли, чтобы понять их предполагаемое участие в структуре жгутиков. Не наблюдалось статистически значимой разницы в длине жгутиков EgPCDUF4201 нокдаун-мутантных клеток по сравнению с клетками дикого типа (дополнительная фигура 5c). Наконец, локализация EgPCDUF4201 не изменилась у нокдаун-мутанта CaM2 (дополнительная фигура 6).
У мутанта с нокдауном по сравнению с диким типом наблюдалось снижение интенсивности флуоресценции и количества пятен, что подтверждает специфичность антисыворотки против EgPCDUF4201 (дополнительная фигура 5a). Кроме того, длину жгутиков мутанта с нокдауном также определяли, чтобы понять их предполагаемое участие в структуре жгутиков. Не наблюдалось статистически значимой разницы в длине жгутиков EgPCDUF4201 нокдаун-мутантных клеток по сравнению с клетками дикого типа (дополнительная фигура 5c). Наконец, локализация EgPCDUF4201 не изменилась у нокдаун-мутанта CaM2 (дополнительная фигура 6).
Рисунок 5 EgPCDUF4201 представляет собой растворимый белок, локализованный в жгутиках E. gracilis . ( a , b ) Непрямой иммунофлуоресцентный анализ с использованием иммунной сыворотки против EgPCDUF4201. ( c ) Вестерн-блот слияния GST-EgPCDUF4201 с антителом GST.
Изображение в полный размер
Кроме того, чтобы определить, является ли белок ассоциированным с мембраной или растворимым, слитый белок GST-EgPCDUF4201 экспрессировали в E. coli , и с растворимой фракцией проводили вестерн-блоттинг. Антитело к GST обнаружило слитый белок, показав, что EgPCDUF4201 экспрессируется в виде растворимого белка в E. coli (рис. 5c).
coli , и с растворимой фракцией проводили вестерн-блоттинг. Антитело к GST обнаружило слитый белок, показав, что EgPCDUF4201 экспрессируется в виде растворимого белка в E. coli (рис. 5c).
DUF 4201 присутствует в широком диапазоне организмов
Был проведен поиск BLAST, чтобы определить, какие организмы обладают белками с DUF 4201. Помимо присутствия в близкородственных организмах Trypanosoma и Leishmania этот домен был обнаружен у очень широкого круга видов. У водорослей и растений этот домен присутствует в доступных геномах жгутиковых водорослей (, например, Chlamydomonas ), бурых водорослей Ectocarpus siliculosus , чьи гаметы и споры жгутиковые, и ранних дивергирующих наземных растений, использующих сперматозоиды. размножаться ( например мохообразные Physcomitrella и Marchantia и ликофиты Sellaginella ), но не обнаружен в геномах покрытосеменных растений. Этот домен был обнаружен не только в геномах растений, но также присутствует в грибах и животных. Эти данные показали, что домен DUF 4201 чрезвычайно консервативен во всех филогенетических группах, которые в какой-то момент своего жизненного цикла обладают жгутиковыми клетками.
Эти данные показали, что домен DUF 4201 чрезвычайно консервативен во всех филогенетических группах, которые в какой-то момент своего жизненного цикла обладают жгутиковыми клетками.
Обсуждение
Предыдущий отчет показал участие специфического кальмодулина, CaM2, в цепи передачи гравитационного сигнала E. gracilis в результате гравитаксиса 12 . Текущее исследование предоставляет подробный отчет о субклеточной локализации CaM2 и определяет новый фактор, участвующий в гравитации.
Исследование фракционирования клеток показало, что CaM2 находится в теле клетки E. gracilis , но во фракции жгутиков не было обнаружено сигнала. Однако анализы IIF показали, что CaM2 в изобилии присутствует в теле клетки и в незначительном количестве также в жгутиках. Кроме того, в растворимой фракции клеточного лизата были обнаружены как эндогенные, так и гетерологичные белки CaM2 (GST-CaM2). Однако анализ IIF показывает, что белок агрегирует и проявляется в виде пятен. Аналогичная закономерность была обнаружена и для других растворимых белков. Например, было показано, что в нейрональных клетках CaM-зависимая протеинкиназа II (CaMKII) самоагрегируется вблизи эндоплазматического ретикулума при определенных стрессовых условиях 13 . Следовательно, у E. gracilis , как и в нейрональных клетках, клеточный стресс перед фиксацией клеток может привести к агрегации CaM2 в теле клетки. Более того, недавно было показано, что при высоком уровне Ca 2+ , который может быть вызван клеточным стрессом, CaM группируются в четко определенные области, указывая на их связь с клеточными комплексами 14 . Напротив, при низких концентрациях Ca 2+ CaM являются очень подвижными белками, которые быстро доступны для распространения сигналов 14 . Даже если фиксация могла слегка изменить локализацию CaM2, CaM2 был обнаружен повсюду вокруг тела клетки, что соответствует текущей рабочей модели гравитаксиса 10 .
Аналогичная закономерность была обнаружена и для других растворимых белков. Например, было показано, что в нейрональных клетках CaM-зависимая протеинкиназа II (CaMKII) самоагрегируется вблизи эндоплазматического ретикулума при определенных стрессовых условиях 13 . Следовательно, у E. gracilis , как и в нейрональных клетках, клеточный стресс перед фиксацией клеток может привести к агрегации CaM2 в теле клетки. Более того, недавно было показано, что при высоком уровне Ca 2+ , который может быть вызван клеточным стрессом, CaM группируются в четко определенные области, указывая на их связь с клеточными комплексами 14 . Напротив, при низких концентрациях Ca 2+ CaM являются очень подвижными белками, которые быстро доступны для распространения сигналов 14 . Даже если фиксация могла слегка изменить локализацию CaM2, CaM2 был обнаружен повсюду вокруг тела клетки, что соответствует текущей рабочей модели гравитаксиса 10 . Действительно, ионы кальция, поступающие из притока, вызванного активацией SSCIC, связываются с CaM2. CaM2, будучи одним из основных участников сигнальной цепи, должен быть быстро доступен со всех сторон клетки, поскольку приток кальция может возникнуть в любой части плазматической мембраны, в зависимости от направления плавательного отклонения.
Действительно, ионы кальция, поступающие из притока, вызванного активацией SSCIC, связываются с CaM2. CaM2, будучи одним из основных участников сигнальной цепи, должен быть быстро доступен со всех сторон клетки, поскольку приток кальция может возникнуть в любой части плазматической мембраны, в зависимости от направления плавательного отклонения.
Клетки, отклоняющиеся от восходящего движения, должны быть переориентированы, чтобы оставаться в наиболее подходящем месте в толще воды. Эта переориентация достигается за счет изменения биения жгутиков. Очень интересно, что мы идентифицировали нового предполагаемого партнера взаимодействия CaM2, EgPCDUF4201, локализованного в жгутиках. Взаимодействие происходило специфически с С-концом белка, содержащего DUF4201. Одна часть этого домена также обладает предполагаемым сайтом связывания кальмодулина, что указывает на то, что взаимодействие может происходить более специфически на этой части белка и дополнительно усиливает результаты двойного гибрида дрожжей. IIF показал, что EgPCDUF4201 распределяется пятнистым образом по всему жгутику, включая его основание. Мы предполагаем, что этот белок является промежуточным фактором между CaM2 и белками динеином, которые создают молекулярную движущую силу, необходимую для биения жгутиков 9.1155 15 .
IIF показал, что EgPCDUF4201 распределяется пятнистым образом по всему жгутику, включая его основание. Мы предполагаем, что этот белок является промежуточным фактором между CaM2 и белками динеином, которые создают молекулярную движущую силу, необходимую для биения жгутиков 9.1155 15 .
EgPCDUF4201 содержит DUF 4201. Этот домен характеризуется спиральной спиралью и присутствует только в реснитчатых и жгутиковых клетках. Сообщается, что доменные белки, содержащие спиральную спираль, функционируют как скелетные белки, моторные белки, pH-зависимые переключатели спиральной катушки и системы молекулярного распознавания, что делает их группой многогранных белков 16 . Имеется несколько сообщений о белках, содержащих DUF4201. Примечательно, что два DUF4201, содержащие белки Homo sapiens , CCDC113 и CCDC96 участвуют в формировании ресничек сперматозоидов и, как сообщается, локализованы в центриолярных сателлитах и центросомах 17 . Эти структуры необходимы для зарождения аксонем жгутиков. Хотя CCDC113 и CCDC96 имеют 30% и 38% сходства (аминокислоты) с EgPCDUF4201 соответственно, их роль, вероятно, отличается от EgPCDUF4201. Этот последний расположен в жгутиках, но не участвует в их формировании, так как его подавление не изменяет длину жгутиков.
Хотя CCDC113 и CCDC96 имеют 30% и 38% сходства (аминокислоты) с EgPCDUF4201 соответственно, их роль, вероятно, отличается от EgPCDUF4201. Этот последний расположен в жгутиках, но не участвует в их формировании, так как его подавление не изменяет длину жгутиков.
Интересно, что два гомолога EgPCDUF4201, называемые ассоциированным с жгутиками белком FAP 184 и FAP 263, присутствуют в Chlamydomonas и описаны как фосфопротеины 18 . Биоинформатический анализ также предсказал, что EgPCDUF4201 является фосфопротеином. Следовательно, вполне вероятно, что посттрансляционные модификации EgPCDUF4201 посредством фосфорилирования играют роль в модуляции его функции. Более того, текущая модель цепочки передачи гравитационного сигнала из E. gracilis включает киназу PKA 11 . Поэтому мы можем предположить, что PKA может фосфорилировать EgPCDUF4201. В любом случае это подтверждает тот факт, что фосфорилирование играет роль в цепи трансдукции гравитаксиса у E. gracilis .
gracilis .
Ранее в экспериментах с микро- и гипергравитацией было показано, что биение жгутиков является активным процессом, контролируемым гравитацией 6 , но специфический жгутиковый белок, играющий роль в гравитаксисе, еще не идентифицирован. Таким образом, идентификация EgPCDUF4201 вносит новый важный фактор в текущую рабочую модель и является первым шагом в объяснении изменения жгутиковых сокращений для переориентации клеток. Однако механизм действия EgPCDUF4201 еще предстоит изучить. Обнаружение партнеров по взаимодействию поможет понять, действует ли белок на биение жгутиков, взаимодействуя непосредственно с динеинами, или является только промежуточным звеном сигнального пути, приводящего к правильному паттерну биений.
Заключение
Белок CaM2, ранее идентифицированный как член цепи передачи гравитационного сигнала E. gracilis , расположен в теле клетки и жгутиках в виде пятен. Кроме того, CaM2 взаимодействует с EgPCDUF4201, локализованным в жгутике. Понижающая регуляция белка приводит к нарушению гравитации. Таким образом, исследование продемонстрировало роль нового белка в цепи передачи гравитационного сигнала у E. gracilis . Этот новый белок представляет гомологов у других организмов, обладающих ресничками или жгутиками, но их функции до сих пор в значительной степени неизвестны и, скорее всего, не связаны только с гравитаксисом.
Понижающая регуляция белка приводит к нарушению гравитации. Таким образом, исследование продемонстрировало роль нового белка в цепи передачи гравитационного сигнала у E. gracilis . Этот новый белок представляет гомологов у других организмов, обладающих ресничками или жгутиками, но их функции до сих пор в значительной степени неизвестны и, скорее всего, не связаны только с гравитаксисом.
Материалы и методы
Клеточная культура и условия роста
Экспериментальный организм , Euglena gracilis KLEBS, штамм Z, был получен из коллекции культур водорослей Геттингенского университета, Германия 19 . Все эксперименты выполнены с аксеническими культурами клеток, выращенными в органической среде 20 . Культуры выращивали при 20 °C при постоянном освещении интенсивностью 54 мкмоль/(м -2 с -1 ) от смешанных флуоресцентных ламп холодного белого и теплого тона.
Анализ движения
Анализ движения был выполнен с использованием программного обеспечения для отслеживания клеток Wintrack 2000 21 в сочетании с изготовленным на заказ устройством (Manual Ecotox), которое состоит из микроскопа с горизонтальным направлением луча и ПЗС-камеры для наблюдения за движением клеток. относительно направления вектора силы тяжести. Светодиод синего света обеспечивает фототактический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки переносили в изготовленную на заказ одноразовую стеклянную кювету (два простых предметных стекла, склеенных U-образной двойной клейкой лентой, с промежутком между ними для заливки клеточной суспензии) и помещали вертикально в горизонтальный микроскоп для определения гравитационной ориентации. . Поступившие видеоизображения анализировались программой Wintrack 2000 с целью одновременного определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и др.) и статистических параметров плавающих клеток. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все клетки плывут случайным образом) до 1 (когда все клетки плывут в одном направлении). Движение наблюдаемых клеток представлено в виде круговой гистограммы с 64 угловыми секторами 23 .
относительно направления вектора силы тяжести. Светодиод синего света обеспечивает фототактический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки переносили в изготовленную на заказ одноразовую стеклянную кювету (два простых предметных стекла, склеенных U-образной двойной клейкой лентой, с промежутком между ними для заливки клеточной суспензии) и помещали вертикально в горизонтальный микроскоп для определения гравитационной ориентации. . Поступившие видеоизображения анализировались программой Wintrack 2000 с целью одновременного определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и др.) и статистических параметров плавающих клеток. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все клетки плывут случайным образом) до 1 (когда все клетки плывут в одном направлении). Движение наблюдаемых клеток представлено в виде круговой гистограммы с 64 угловыми секторами 23 . Направление вверх на гистограмме (0°) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество клеток, движущихся в соответствующем направлении.
Направление вверх на гистограмме (0°) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество клеток, движущихся в соответствующем направлении.
Молекулярно-генетический анализ
Суммарную РНК экстрагировали с использованием реагента Trizol (Invitrogen, кат. № 1559).6-026) и его концентрацию определяли спектрофотометрически с помощью нанокапельного фотометра (Thermoscientific, США). Культуру мутантных клеток с нокдауном оценивали путем количественного определения уровней экспрессии мРНК с помощью ПЦР в реальном времени. Равное количество тотальной РНК транскрибировали в кДНК с использованием набора для обратной транскрипции QuantiTECT (Qiagen). Количественную оценку уровней мРНК проводили в системе обнаружения ПЦР в реальном времени CFX96 TouchTM с использованием наборов QuantiTect SYBR Green PCR (Qiagen, отжиг/удлинение в течение 30 секунд при 60 °C, 40 циклов). кДНК разводили (1:3 или 1:500) деионизированной водой перед ПЦР, и для амплификации использовали специфические для гена праймеры (перечисленные в дополнительной таблице 2), тогда как актин использовали в качестве эталонного гена.
Для исследований подавления генов был принят подход РНКи. Целевую последовательность гена амплифицировали (праймеры перечислены в дополнительной таблице 2) с использованием полимеразы Taq. Амплифицированный продукт ПЦР лигировали со специально синтезированным промотором Т7 с использованием фермента ДНК-лигазы Т4 (New England BioLabs). Продукт ПЦР, конъюгированный с промотором Т7, использовали для получения дцРНК с использованием набора MEGAscript® RNAi Kit (Ambion). Впоследствии примерно 10 6 клеток на 100 мкл органической среды трансформировали электропорацией с 15–20 мкг дцРНК для получения нокдаун-мутантных клеток, тогда как контрольные клетки подвергали электропорации только с элюирующим буфером. Электропорацию проводили, как описано ранее 11,24,25 .
Для проведения RACE-ПЦР общую РНК экстрагировали, как описано выше, и осуществляли синтез кДНК с использованием набора для синтеза кДНК Mint2 (Evrogen), как описано Frohman 26 . Набор специфических для гена смысловых и антисмысловых праймеров (перечисленных в дополнительной таблице 2) был разработан для нацеливания на известную последовательность гена различной длины. Для проведения 5′-RACE ПЦР использовали геноспецифические антисмысловые праймеры в сочетании с праймером кэпа индивидуальной конструкции, который закрепляет транс-сплайсинговую структуру 5′-кэпа, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier et al. . 27 , тогда как 3′-RACE ПЦР проводили с использованием специфических для гена смысловых праймеров и специально разработанного олиго-dT праймера с двумя вырожденными нуклеотидами. Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и набор FirstChoice® RLM-RACE от Ambion).
Для проведения 5′-RACE ПЦР использовали геноспецифические антисмысловые праймеры в сочетании с праймером кэпа индивидуальной конструкции, который закрепляет транс-сплайсинговую структуру 5′-кэпа, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier et al. . 27 , тогда как 3′-RACE ПЦР проводили с использованием специфических для гена смысловых праймеров и специально разработанного олиго-dT праймера с двумя вырожденными нуклеотидами. Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и набор FirstChoice® RLM-RACE от Ambion).
Экспрессия плазмидных конструкций
Полноразмерная кодирующая область CaM2 (номер доступа EU935858) была амплифицирована, и продукт ограниченного расщепления был лигирован в pGBKT7 (Clonetech) для экспрессии под промотором T7. Точно так же кодирующая область полной длины CaM2 и EgPCDUF4201 амплифицировали и лигировали в pCR™II-Blunt-TOPO® (Invitrogen). Впоследствии вставки были подвергнуты рестрикционному расщеплению и субклонированы в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния GST под промотором TAC. Кроме того, две укороченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и сначала лигированы в pCR™II-Blunt-TOPO®, а затем субклонированы в pGADHA (Dualsystemsbiotech). для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием корректорной ДНК-полимеразы Phusion (Thermo Scientific).
Впоследствии вставки были подвергнуты рестрикционному расщеплению и субклонированы в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния GST под промотором TAC. Кроме того, две укороченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и сначала лигированы в pCR™II-Blunt-TOPO®, а затем субклонированы в pGADHA (Dualsystemsbiotech). для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием корректорной ДНК-полимеразы Phusion (Thermo Scientific).
Конструирование библиотеки кДНК
E. gracilis и двухгибридный скрининг дрожжей Для определения партнера по взаимодействию CaM2 проводили двухгибридный скрининг дрожжей с использованием нормализованной библиотеки кДНК E. gracilis . Для создания библиотеки кДНК РНК выделяли из клеток E. gracilis , подвергшихся различным химическим и физическим стрессам (тяжелые металлы, ультрафиолетовое излучение, яркое освещение, культура клеток в разном возрасте, в условиях микрогравитации, на клиностате и др. ). Извлеченные образцы РНК объединяли и передавали коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в активационный домен (AD), содержащий плазмиду pGAD-HA (Mobitech). 9Штамм 1334 Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой pGBKT7-CaM2 с использованием метода полиэтиленгликоля (ПЭГ)/ацетата лития/одноцепочечной ДНК-носителя, как описано ранее 29 . Впоследствии культуру дрожжевых клеток-трансформантов-приманок повторно трансформировали с помощью 50 мкг библиотеки кДНК с использованием протокола трансформации в масштабе библиотеки, как описано в руководстве пользователя MatchMaker GAL4 Two-Hybrid System (Clonetech). Эффективность трансформации дрожжевых клеток определяли на чашках SD-TL, тогда как взаимодействие между двумя белками определяли на среде для селекции SD-TLAH. Точно так же взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селекционной среде SD-TLAH.
). Извлеченные образцы РНК объединяли и передавали коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в активационный домен (AD), содержащий плазмиду pGAD-HA (Mobitech). 9Штамм 1334 Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой pGBKT7-CaM2 с использованием метода полиэтиленгликоля (ПЭГ)/ацетата лития/одноцепочечной ДНК-носителя, как описано ранее 29 . Впоследствии культуру дрожжевых клеток-трансформантов-приманок повторно трансформировали с помощью 50 мкг библиотеки кДНК с использованием протокола трансформации в масштабе библиотеки, как описано в руководстве пользователя MatchMaker GAL4 Two-Hybrid System (Clonetech). Эффективность трансформации дрожжевых клеток определяли на чашках SD-TL, тогда как взаимодействие между двумя белками определяли на среде для селекции SD-TLAH. Точно так же взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селекционной среде SD-TLAH. Автоактивацию белка-приманки или добычи определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами.
Автоактивацию белка-приманки или добычи определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами.
Антитела
Производство индивидуальных антител против CaM2 было поручено коммерческой фирме SDIX, США. Антитело было получено с использованием подхода геномного антитела против 91 аминокислоты (58–148) CaM2 30 . Точно так же производство неочищенной мышиной антисыворотки против белка E. gracilis , содержащего домен с неизвестной функцией (EgPCDUF4201), было поручено коммерческой фирме Eurogenetec, Бельгия. Антисыворотку против EgPCDUF4201 получали методом генетической ДНК-иммунизации против цельного белка. Также использовали антитело против альфа-цепи тубулина кролика (каталожный номер AS10 680, Agrisera, Швеция) и антитело против мышиной антиглутатион-S-трансферазы (GST) (Sigma Aldrich, США). И имеющиеся в продаже антитела к IgG-пероксидазе кролика (Sigma Aldrich, США), антитела к пероксидазе IgG мыши (Sigma Aldrich, США) и Alexa Fluor® 488-Anti-Rabbit IgG (H + L) (иммунологическое исследование Джексона). Laboratories, США) в данном исследовании использовали в качестве вторичных антител.
Laboratories, США) в данном исследовании использовали в качестве вторичных антител.
Подготовка образца белка из
E. gracilis Клетки собирали центрифугированием (11000×g, 10 мин) и дважды промывали деионизированной водой. Осадок клеток суспендировали в лизирующем буфере (40 мМ Tris-HCl, pH 8) с добавлением смеси ингибиторов протеазы и фосфатазы (10 мкл -1 мл, номер продукта 78443, Thermoscientific). Разрушение клеток проводили с помощью ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия), подавая три импульса по 20 с при интенсивности 35% от общей мощности. Образцы хранились на льду в течение всего процесса в холодильной камере (4 °C). Полученный неочищенный лизат ресуспендировали в 100% ацетоне (втрое больше объема клеточного лизата) и осаждали белок при -20°С в течение ночи. Осажденную белковую фракцию осаждали центрифугированием (24000 g, 4°C, 1 ч) и дважды промывали 80%-ным ацетоном. Высушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевины, 2 М тиомочевины, 2% CHAPS, 40 мМ ДТТ) и переносили в 1,5 мл микроцентрифужную пробирку, а солюбилизацию белка проводили в течение 1 ч (30°С). C, 1400 циклов/мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем солюбилизированную белковую фракцию собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию белков в образцах определяли методом Бредфорда 9.1155 31 .
Высушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевины, 2 М тиомочевины, 2% CHAPS, 40 мМ ДТТ) и переносили в 1,5 мл микроцентрифужную пробирку, а солюбилизацию белка проводили в течение 1 ч (30°С). C, 1400 циклов/мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем солюбилизированную белковую фракцию собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию белков в образцах определяли методом Бредфорда 9.1155 31 .
SDS-PAGE и иммуноблоттинг
SDS-PAGE проводили, как описано Laemmli 32 . Разделение белковых образцов проводили в 12% полиакриламидном геле с ДСН. Полиакриламидные гели с ДСН окрашивали с использованием раствора кумасси бриллиантового синего R250 для анализа, как описано ранее 33 для визуального наблюдения. Для иммуноблоттинга образцы белка из SDS-PAGE переносили на мембрану из поливинилиденфторида (PVDF) (Roti®-Fluoro PVDF, размер пор 0,2 мкм, Carl Roth, Германия) с использованием полусухой ячейки для переноса Trans-Blot SD (Bio-Rad). , США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном солевом растворе (W/V) с 0,5% Tween 20 (V/V) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхивание (20 циклов/мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов/мин), после чего трижды промывали буфером TBS-T в течение 10 мин и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения улучшенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7™ Advance Chemiluminescence System (Peqlab, Германия).
, США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном солевом растворе (W/V) с 0,5% Tween 20 (V/V) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхивание (20 циклов/мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов/мин), после чего трижды промывали буфером TBS-T в течение 10 мин и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения улучшенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7™ Advance Chemiluminescence System (Peqlab, Германия).
Фракционирование органелл
Разделение жгутиков и тела клетки проводили с использованием метода, описанного в 34 , с использованием 15 л позднелогарифмической клеточной культуры. Первоначально метод был разработан для выделения жгутиков, связанных с паражгутиковым телом (PFB). Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка.
Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка.
Конфокальная микроскопия с непрямой иммунофлуоресценцией
Для анализа с помощью непрямой иммунофлуоресценции (IIF) образцы готовили, как описано ранее 35 , и клетки анализировали с использованием вторичного антитела, конъюгированного с флуорофором (Alexa 488). Конфокальные изображения генерировали с помощью лазерного сканирующего микроскопа TCS SP2 (Leica), оснащенного иммерсионным объективом HC PL APO 20×. Alexa 488 возбуждалась на длине волны 495 нм, а изображения отображались в диапазоне 510–580 нм. Для сравнения контрольных и нокдаун-мутантов параметры получения изображения оставались идентичными.
Сверхэкспрессия белков, слитых с GST, и очистка
Электрокомпетентные клетки штамма E. coli BL21 (DE3) pLysS (Invitrogen) трансформировали экспрессионными плазмидами pGEX4T2- CaM2 и pGEX4T2- EgPCDUF4201 . Положительные трансформанты отбирали на твердой среде LB, содержащей 1,5% (масса/объем) агара и 100 мкг/мл -1 ампициллина. Затем одну трансформантную колонию суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг.мл -1), для роста в течение ночи (37 °C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной трансформантной культурой pGEX4T2-9.1334 CaM2 и pGEX4T2- EgPCDUF4201 соответственно. После этого экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигали определенной плотности клеток (OD600 0,6–0,7). Клетки собирали после 5 ч роста (37 °C, 200 циклов в минуту) центрифугированием (6000g, 4 °C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 9).1742 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой коктейля ингибиторов протеаз (Complete ингибиторов протеаз коктейль, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 секунд при мощности 30% с использованием ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия).
Затем одну трансформантную колонию суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг.мл -1), для роста в течение ночи (37 °C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной трансформантной культурой pGEX4T2-9.1334 CaM2 и pGEX4T2- EgPCDUF4201 соответственно. После этого экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигали определенной плотности клеток (OD600 0,6–0,7). Клетки собирали после 5 ч роста (37 °C, 200 циклов в минуту) центрифугированием (6000g, 4 °C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 9).1742 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой коктейля ингибиторов протеаз (Complete ингибиторов протеаз коктейль, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 секунд при мощности 30% с использованием ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия). Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4°C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца объемом 2 мл с помощью адаптера ввода-люэра Portino® (Macherey-Nagel, Германия).
Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4°C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца объемом 2 мл с помощью адаптера ввода-люэра Portino® (Macherey-Nagel, Германия).
Анализ in silico Анализ предсказанных доменов EgPCDUF4201 был выполнен с использованием онлайн-инструмента expasy COILS (http://embnet.vital-it.ch/software/COILS_form.html) и онлайн-базы данных для прогнозирования Сайты связывания кальмодулина (http://calcium.uhnres.utoronto.ca/ctdb/ctdb/home.html). Предсказание сайтов фосфорилирования в EgPCDUF4201 было выполнено с использованием сервера NetPhos 2.0 (http://www.cbs.dtu.dk/services/NetPhos-2.0/).
Ссылки
Хедер, Д. П., Рихтер, П., Шустер, М., Дайкер, В. и Леберт, М. Молекулярный анализ передачи сигнала гравиперцепции у жгутиковых Euglena gracilis : участие временного рецепторного потенциала, подобного канал и кальмодулин. Доп. Космический Рез. 43 , 1179–1184 (2009 г.)).
ОБЪЯВЛЕНИЕ
Статья
Google ученый
Дайкер, В., Леберт, М., Рихтер, П.Р. и Хедер, Д.П. Молекулярная характеристика кальмодулина, участвующего в цепи передачи сигнала гравитаксиса у Euglena gracilis . Планта 231 , 1229–1236 (2010).
КАС
Статья
пабмед
Google ученый
Тахедль, Х. и Хедер, Д. П. Автоматизированный биомониторинг с использованием анализа движения в реальном времени Euglena gracilis . Экотокс. Окружающая среда. Сейф 48 , 161–169 (2001).
КАС
Статья
Google ученый
Ссылки для скачивания
Благодарности
Антимышиное антитело Alexa Fluor® 488 было любезно предоставлено профессором доктором Георгом Краймером из отделения клеточной биологии Университета Фридриха-Александра Эрланген-Нюрнберг, Германия, и мы благодарим Себастьяна Штрауха. за полезное обсуждение. Мы признательны за поддержку Deutsche Forschungsgemeinschaft и Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) в рамках программы финансирования Open Access Publishing. Работа частично финансировалась Немецким космическим агентством (DLR) от имени Bundesministerium für Bildung und Forschung (гранты 50WB0828, 50WB1128 и 50WB1528).
Author information
Authors and Affiliations
Авторы
Contributions
А. Н. и М.Л. проектировал эксперименты. А.Н., А.Л.Б., В.Д., Ж.К. и PR провели эксперименты. А.Н. и А.Л.Б. писал М.С.
Н. и М.Л. проектировал эксперименты. А.Н., А.Л.Б., В.Д., Ж.К. и PR провели эксперименты. А.Н. и А.Л.Б. писал М.С.
Автор, ответственный за переписку
Переписка с
Од Ле Бей.
Декларация этики
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Электронный дополнительный материал
Дополнительная информация
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате при условии, что вы указываете соответствующие права на первоначальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Жгутиконосцы — Soil Ecology Wiki
Содержание
Обзор
Жгутиконосцы — одноклеточные микроорганизмы, принадлежащие к группе простейших. Для них характерно наличие одного или нескольких жгутиков, которые представляют собой органеллы, похожие на волоски, и очень различимы. Существует много разных видов жгутиконосцев, и все они ведут разный образ жизни. Некоторые образуют колонии, а другие живут как одиночные клетки. Двумя основными категориями являются фитофлагелляты и зоофлагелляты. Фитофлагелляты — это зеленые и похожие на растения существа, которые используют фотосинтез для производства пищи. Зоофлагелляты бесцветны и похожи на животных. Паразитические жгутиконосцы также попадают в эту категорию.
Паразитические жгутиконосцы также попадают в эту категорию.
Как фитофлагелляты, так и зоофлагелляты могут быть найдены в прудах, лагунах и даже неглубоких лужах. Везде, где есть большое количество растворимой пищи, могут размножаться жгутиконосцы. Однако паразитические зоофлагелляты живут внутри кишечника или кровотока хозяина и могут вызывать опасные заболевания, такие как лямблиоз.
Виды жгутиковых
Фитофлагелляты
Эта группа жгутиковых простейших имеет много общего с типичными водорослями. Некоторые действительно содержат пигмент хлорофилл и используют фотосинтетический тип питания [10]. Жгутиконосцы, которые не используют фотосинтез в качестве источника пищи, также могут поглощать питательные вещества через поверхность своего тела или заглатывать частицы пищи. Виды, которые являются членами этой группы, включают, помимо прочего, Euglena, Chloromonad, Dinoflagellate, Cryptomonad, Chrysomonad. Фитофлагелляты рассматриваются как группа из-за (1) наличия ядра в общепринятом понимании и центриолярного митоза (2) подвижности за счет жгутиков (3) фотосинтетических пигментов, находящихся в пластидах [11].
Эвглена [9]
Колония Volvox [3]
Зоофлагелляты
Эта группа жгутиконосцев не является фотосинтезирующим организмом по сравнению с другой группой жгутиконосцев, обсуждавшейся в предыдущем разделе [12]. У этих жгутиковых отсутствуют клеточные стенки, и они питаются либо фагоцитозом, либо эндоцитозом. Эта группа жгутиковых является одной из самых разнообразных среди всех эукариот и дала начало большинству других частей эукариотических клеток, которые мы видим сегодня. Зоофлагелляты классифицируются по тринадцати или четырнадцати типам и распространены по четырем из семи царств эукариот, которые мы классифицировали на сегодняшний день [12].
Giardia [1]
Размножение
Ссылки
Гравитаксис и фототаксис у жгутиковых эвглен, изученных в ходе миссий TEXUS
Гравитаксис и фототаксис у жгутиковых эвглен, изученных в ходе миссий TEXUS
Д.-П. Häder
Institüt für Botanik und
Pharmazeutische Biologie, Университет Фридриха-Александра,
Staudtstr. 5, Д-
Эрланген, Германия
Введение
Несмотря на то, что коэффициентом освещенности можно легко управлять в
лаборатории, эффекты гравитации не могут быть изучены с помощью
такая же легкость, потому что земное гравитационное поле не может быть
выключен. Это может быть одной из причин, почему наши знания
относительно гравирецептора жгутиконосцев еще довольно
ограничено. Согласно более ранней гипотезе, ориентация
клетки обусловлены пассивной физической ориентацией в воде
колонна, предполагая, что задний конец тяжелее переднего
конец.¹ Альтернативная гипотеза состоит в том, что клетка обладает
активный физиологический гравирецептор, определяющий вектор
гравитационного поля.² В дополнение к гравитации,
жгутиковые используют свет как сигнал для ориентации в воде
столбец,³ как указано выше. Эксперименты со светом и
гравитация в различных векторных комбинациях при земных
условия показали, что клетки интегрируются по двум
стимулы и генерировать интегрированный ответ. 4 А
аналогичная проблема существует для грибов и высших растений, у которых
фототропизм накладывается на гравитропизм под земными
условия. 5
Согласно более ранней гипотезе, ориентация
клетки обусловлены пассивной физической ориентацией в воде
колонна, предполагая, что задний конец тяжелее переднего
конец.¹ Альтернативная гипотеза состоит в том, что клетка обладает
активный физиологический гравирецептор, определяющий вектор
гравитационного поля.² В дополнение к гравитации,
жгутиковые используют свет как сигнал для ориентации в воде
столбец,³ как указано выше. Эксперименты со светом и
гравитация в различных векторных комбинациях при земных
условия показали, что клетки интегрируются по двум
стимулы и генерировать интегрированный ответ. 4 А
аналогичная проблема существует для грибов и высших растений, у которых
фототропизм накладывается на гравитропизм под земными
условия. 5
Целью экспериментов TEXUS было, во-первых, продемонстрировать
что гравитация действительно является фактором, который направляет движения Е. gracilis ; во-вторых, чтобы охарактеризовать ориентацию под
условия мкг; и, в-третьих, изучать как положительные, так и
отрицательный фототаксис в невесомости.
Материалы и методы
Одноклеточный фотосинтезирующий пресноводный жгутиконосец, Euglena gracilis Klebs , штамм Z, использовали для всех
эксперименты (рис. 1). Клетки выращивали, как описано ранее.
в минеральной среде. 6 Клетки были собраны после
две недели роста и перенесли в круглую кювету (0,2
глубина мм и диаметр 55 мм) из нержавеющей стали; это было
поддерживается при температуре 22,5±1°С четырьмя элементами Пельтье. Окно
обращенный к микроскопу источник света был сделан из инфракрасного
передающий фильтр (RG 715, Schott & Gen., Майнц, Германия).
кювета была ориентирована вертикально в экспериментальном модуле (ТЭМ 06-
19, разработанный и изготовленный MBB-ERNO в Бремене), в то время как
Ракета стояла вертикально перед пуском. Кювета может быть
вращается вокруг своей короткой оси с помощью дистанционного управления для перераспределения
клетки. Кювету постоянно вращали (35 об/мин) в течение
запустить, чтобы свести к минимуму эффекты ускорения. луч актиничного света, падающий под углом
15° по отношению к поверхности кюветы.
луч актиничного света, падающий под углом
15° по отношению к поверхности кюветы.
Рис. 1. Фотосинтезирующая одноклеточная жгутиконосица Euglena.
грацилис.
Изображение движущихся клеток было записано ПЗС-камерой и
передается на землю для записи. Во время воспроизведения
видеосигнал оцифровывался в реальном времени с пространственным разрешением
512 x 512 пикселей с 256 возможными уровнями серого. Отслеживание
программное обеспечение было написано на языке C с
модули языка ассемблера для критичных по времени ввода и вывода
процедуры, а также математический анализ данных. 7, г.
8 Точность ориентации определялась с помощью
Тест Рэлея.
Результаты и обсуждение
Первый эксперимент на TEXUS 23 показал, что Земля
гравитационное поле действительно ответственно за ориентацию E. gracilis при отсутствии других ориентировочных факторов,
например свет. В условиях мкг клетки двигались беспорядочно,
такая ориентация по отношению к силовым линиям магнитного поля или
температурные градиенты можно было бы исключить (рис. 2а-2б). 9 Аналогичные результаты были получены на быстровращающемся горизонтальном
клиностат. 10 Происходит переориентация клеток внутри
меньше минуты. В земных условиях клетки
подвергаются осаждению, так как имеют удельный вес
1,04, выше, чем у окружающей воды. В соответствии
с законом Рэлея это приводит к более быстрому плаванию вниз
скорость и более медленная скорость плавания вверх по сравнению со скоростью
в горизонтальном направлении. Следовательно, клетки перемещаются с
более высокая скорость в условиях мкг. Напротив,
инфузория Paramecium частично компенсирует более медленный рост
движения за счет гравикинеза. 11, 12
2а-2б). 9 Аналогичные результаты были получены на быстровращающемся горизонтальном
клиностат. 10 Происходит переориентация клеток внутри
меньше минуты. В земных условиях клетки
подвергаются осаждению, так как имеют удельный вес
1,04, выше, чем у окружающей воды. В соответствии
с законом Рэлея это приводит к более быстрому плаванию вниз
скорость и более медленная скорость плавания вверх по сравнению со скоростью
в горизонтальном направлении. Следовательно, клетки перемещаются с
более высокая скорость в условиях мкг. Напротив,
инфузория Paramecium частично компенсирует более медленный рост
движения за счет гравикинеза. 11, 12
Рис. 2. Распределение направлений плавания E. gracilis
при 1 g перед полетом TEXUS (a) и 0 g во время первого
минута на TEXUS 23 (b).
На рейсах TEXUS 28-30 фототактическая ориентация была
расследовано. Клетки показали как положительные, так и отрицательные
фототаксис в условиях мкг. 13 Флуенс
частота этих ответов сопоставима с таковой при 1 г.
Однако фототаксическая ориентация достигалась быстрее, чем при 1 г.
Кроме того, точность ориентирования в пространстве была выше, чем в пространстве.
контроль, измеренный одновременно в наземных условиях.
Подтвержденные ранее измерения распределений скоростей
результаты экспериментов по гравитаксису в космосе. Измерения
после того, как полеты TEXUS показали аналогичное поведение как для
фототаксис и гравитаксис, как и до полета, что указывает на то, что
клетки не адаптировались к условиям при 0 g. Недавний
эксперименты во время международной микрогравитации космического корабля «Шаттл»
Миссия Лаборатория-2 с использованием медленно вращающейся центрифуги
микроскоп (NIZEMI) показал, что порог гравитационного
ориентация в E. gracilis составляет около 0,16 г. 14 Также не было адаптации к измененной гравитации под
длительные условия при 0g.
13 Флуенс
частота этих ответов сопоставима с таковой при 1 г.
Однако фототаксическая ориентация достигалась быстрее, чем при 1 г.
Кроме того, точность ориентирования в пространстве была выше, чем в пространстве.
контроль, измеренный одновременно в наземных условиях.
Подтвержденные ранее измерения распределений скоростей
результаты экспериментов по гравитаксису в космосе. Измерения
после того, как полеты TEXUS показали аналогичное поведение как для
фототаксис и гравитаксис, как и до полета, что указывает на то, что
клетки не адаптировались к условиям при 0 g. Недавний
эксперименты во время международной микрогравитации космического корабля «Шаттл»
Миссия Лаборатория-2 с использованием медленно вращающейся центрифуги
микроскоп (NIZEMI) показал, что порог гравитационного
ориентация в E. gracilis составляет около 0,16 г. 14 Также не было адаптации к измененной гравитации под
длительные условия при 0g.
Благодарности
Работа выполнена при финансовой поддержке Немецкого
Agentur für Luftund Raumfahrtangelegenheiten (DARA).
Каталожные номера
О|
Поиск|
Обратная связь
СП1206
Опубликовано в апреле 1997 г.
Разработано ESA-ESRIN ID/D. лагунные системы
лагунные системы Лагунные микроорганизмы… Водоросли…
Что такое водоросли? : Термин «водоросли» используется для обозначения некоторых низших растений и многих, часто не связанных между собой групп водорослей. микроорганизмы, способные осуществлять фотосинтез. Фотосинтез (преобразование энергии света в химическую энергию)
осуществляется в частях клетки, называемых хлоропластами. Их можно найти в различных формах и цветах и во многих различных организмах. Не все эти организмы зеленые. Диатомовые водоросли, хризофиты и динофлагелляты имеют хлоропласты от желтого до коричневого цвета. Существуют бурые водоросли (Phaeophyta), красные водоросли (Rhodophyta) и многие другие группы одноклеточных водорослей.
во многих оттенках зеленого. Сине-зеленые цианобактерии также фотосинтезируют.
микроорганизмы, способные осуществлять фотосинтез. Фотосинтез (преобразование энергии света в химическую энергию)
осуществляется в частях клетки, называемых хлоропластами. Их можно найти в различных формах и цветах и во многих различных организмах. Не все эти организмы зеленые. Диатомовые водоросли, хризофиты и динофлагелляты имеют хлоропласты от желтого до коричневого цвета. Существуют бурые водоросли (Phaeophyta), красные водоросли (Rhodophyta) и многие другие группы одноклеточных водорослей.
во многих оттенках зеленого. Сине-зеленые цианобактерии также фотосинтезируют. Очень разнообразными группами пресноводных водорослей являются хлорофиты или зеленые водоросли. На основе соединений
фотосинтетические пигменты и некоторые другие характеристики, по-видимому, наиболее близки к растениям. Распространенной зеленой водорослью является Hydrodictyon, водяная сеть. Он связан с Pediastrum (верхнее изображение), но образует колонию в форме мешка. Как Педиаструм
каждая отдельная клетка может развиться в новую колонию. Вы можете себе представить, что, поскольку колония содержит тысячи клеток, Hydrodictyon может воспроизводиться очень быстро. И в отличие от Pediastrum, Hydrodictyon может вырасти большим, почти 30 см. в длину.
Цветение Hydrodictyon может стать настоящей проблемой для водоочистных сооружений. На изображении показана часть небольшой колонии (слева).
и три отдельные клетки большой колонии. Внутри каждой из этих клеток может образоваться новая колония.
Вы можете себе представить, что, поскольку колония содержит тысячи клеток, Hydrodictyon может воспроизводиться очень быстро. И в отличие от Pediastrum, Hydrodictyon может вырасти большим, почти 30 см. в длину.
Цветение Hydrodictyon может стать настоящей проблемой для водоочистных сооружений. На изображении показана часть небольшой колонии (слева).
и три отдельные клетки большой колонии. Внутри каждой из этих клеток может образоваться новая колония.
Если у вас есть птичья ванночка с водой, которая стала красной, вы можете найти зеленые водоросли Haematococcus pluvialis. Этот вид показывает, что зеленые водоросли не всегда должны выглядеть как зеленые водоросли. Хлоропласты часто краснеют, когда условия становятся неблагоприятными. Гематококк плавает с помощью двух длинных жгутиков. Многие виды являются жгутиковыми и подвижными, другие неподвижны, но часто имеют жгутиковую стадию в какой-то момент своего жизненного цикла. Безусловно, одна из самых эффектных жгутиковых зеленых водорослей — Volvox. Образует шаровидную колонию. Все мелкие клетки колонии имеют два жгутика и
маленькое глазное пятно. Благодаря этому колония может плыть к свету. Volvox имеет интересные способы размножения.
Узнайте больше об этом в статье Micscape Volvox, одном из семи чудес микромира. Мелкая, довольно невзрачная зеленая водоросль без ундулиподий – это хлорелла. Его можно найти в виде эндосимбионта внутри инфузорий, гидр
и другие животные. Они выращивают хлореллу, как если бы выращивали урожай в теплице.
Образует шаровидную колонию. Все мелкие клетки колонии имеют два жгутика и
маленькое глазное пятно. Благодаря этому колония может плыть к свету. Volvox имеет интересные способы размножения.
Узнайте больше об этом в статье Micscape Volvox, одном из семи чудес микромира. Мелкая, довольно невзрачная зеленая водоросль без ундулиподий – это хлорелла. Его можно найти в виде эндосимбионта внутри инфузорий, гидр
и другие животные. Они выращивают хлореллу, как если бы выращивали урожай в теплице.
Многие зеленые водоросли образуют длинные нити. Клетки остаются прикрепленными после деления. Некоторые роды, такие как Spirogyra, Mougeotia
и Zygnema могут стать настолько многочисленными, что образуют плотные маты роста на поверхности прудов, так называемую прудовую пену. Этот пруд
накипь интересна для изучения под микроскопом. Если вы сожмете его в банку, вы соберете много интересного.
организмы. И нитчатые водоросли не менее интересны. Хлоропласты имеют четкую форму. У спирогиры хлоропласт проходит через клетку в виде спирали. На изображении также видно ядро, висящее на тонких нитях. Спирогира и родственные водоросли, такие как десмиды, представляют собой сопряженные зеленые водоросли. Эти десмиды настолько красивы, что заслуживают отдельной страницы.
На изображении также видно ядро, висящее на тонких нитях. Спирогира и родственные водоросли, такие как десмиды, представляют собой сопряженные зеленые водоросли. Эти десмиды настолько красивы, что заслуживают отдельной страницы.
Бактерии…
Бактерии — самые древние формы жизни. Большинство бактерий настолько малы, что под световым микроскопом их можно увидеть только в виде маленьких точек. Однако некоторые группы вырастают до больших размеров и имеют впечатляющие формы.
На верхнем рисунке показан пример красоты одной из наиболее продвинутых групп бактерий, цианобактерий или сине-зеленых водорослей. Долгое время их считали водорослями, так как они осуществляли фотосинтез. Но в настоящее время их считают бактериями: у них отсутствует связанное с мембраной ядро. ДНК присутствует в виде петли в цитоплазме.
Поскольку они имеют очень отчетливый сине-зеленый цвет, цветение цианобактерий отчетливо видно, когда пруд или канава становятся голубовато-зелеными.
Бактерии были наиболее выдающимися существами на ранних стадиях истории жизни почти от 4000 миллионов лет до 600 миллионов лет назад. Окаменелости, называемые строматолитами, все еще можно найти, и они были созданы цианобактериями.
Цианобактерии были необходимы для развития более сложных форм жизни. Они производили кислород в нашей атмосфере. Этот кислород необходим для гораздо более эффективного метаболизма многоклеточных организмов. Более того, фотосинтетические способности бактерий, по-видимому, были переняты более развитыми организмами. В настоящее время бактерии играют существенную роль в переработке вещества. Бактерии есть везде. Внутри вашего рта живет больше бактерий, чем количество людей, которые когда-либо жили.
На небольшой анимации слева показаны бактерии спирохеты. Они быстро передвигаются, у них много жгутиков, которые, в отличие от других бактерий, лежат внутри клетки. Многие другие бактерии используют жгутики (хлыстообразные структуры) для передвижения. Жгутики бактерий довольно интересны, так как имеют простую, но очень изобретательную конструкцию. Бактериальный жгутик представляет собой миниатюрное механическое устройство, движение которого вызывается вращением стержня, той части, где жгутик прикрепляется к клетке. Это внеклеточная структура, которая работает как маленький пропеллер.
Жгутики бактерий довольно интересны, так как имеют простую, но очень изобретательную конструкцию. Бактериальный жгутик представляет собой миниатюрное механическое устройство, движение которого вызывается вращением стержня, той части, где жгутик прикрепляется к клетке. Это внеклеточная структура, которая работает как маленький пропеллер.
Nostoc – это цианобактерия, образующая большие сферические колонии. Они распространены и их можно увидеть невооруженным глазом. Большинство бактерий видны только в самые сильные линзы микроскопа. Самый простой способ собрать их (а также множество мелких простейших) — положить покровное стекло на поверхность прудовой воды. Через ночь на нижней стороне покровного стекла вырастут целые колонии бактерий. Осторожно помещенный на предметное стекло (можно добавить дополнительную каплю воды), рост под покровным стеклом можно наблюдать с помощью объектива 40X или 100X, чтобы увидеть мельчайшие детали.
Коловратки…
Коловратки — многоклеточные животные. Поскольку они настолько малы, что большинство людей никогда не слышали об их существовании. Они есть
примерно такого же размера, как и более крупные одноклеточные организмы. Клеток у них немного, меньше 1000, но есть
некоторые очень специальные атрибуты. Это чудеса миниатюрного дизайна. В передней части тела у них есть корона волосовидных ресничек. Они передвигаются, используя корону ресничек (корону), чтобы двигаться. Некоторые виды ходят с
голова и нога. Их лапы могут выделять липкое вещество, которое позволяет им прикрепляться к поверхности. Они также используют
коронка ресничек, чтобы замахивать едой в рот. Там пища попадает в «мастакс», где находятся два так называемых «трофуса».
обрабатывать пищу до того, как она попадет в кишечник. Коловратки настолько прозрачны, что все эти органы можно легко наблюдать. У них есть одно или два светочувствительных красных пятна под глазами.
Поскольку они настолько малы, что большинство людей никогда не слышали об их существовании. Они есть
примерно такого же размера, как и более крупные одноклеточные организмы. Клеток у них немного, меньше 1000, но есть
некоторые очень специальные атрибуты. Это чудеса миниатюрного дизайна. В передней части тела у них есть корона волосовидных ресничек. Они передвигаются, используя корону ресничек (корону), чтобы двигаться. Некоторые виды ходят с
голова и нога. Их лапы могут выделять липкое вещество, которое позволяет им прикрепляться к поверхности. Они также используют
коронка ресничек, чтобы замахивать едой в рот. Там пища попадает в «мастакс», где находятся два так называемых «трофуса».
обрабатывать пищу до того, как она попадет в кишечник. Коловратки настолько прозрачны, что все эти органы можно легко наблюдать. У них есть одно или два светочувствительных красных пятна под глазами. Существует огромное разнообразие впечатляющих форм тела, подходящих для разных образов жизни или условий окружающей среды. Поскольку многие виды образуют так называемые покоящиеся споры, которые легко переносятся ветром, их можно найти где угодно, если
есть немного воды. Даже в водосточных желобах или в поилках для птиц. Корона, коронка ресничек, может различаться по дизайну. Некоторые виды не используют его для передвижения, но разработали специальные приспособления для захвата. Коловратки из рода Collotheca живут прикрепленными к субстрату и собирают крошечные микробы, такие как бактерии с чрезвычайно удлиненными ресничками. Увидеть
эти рыболовы под микроскопом представляют собой прекрасное зрелище.
Поскольку многие виды образуют так называемые покоящиеся споры, которые легко переносятся ветром, их можно найти где угодно, если
есть немного воды. Даже в водосточных желобах или в поилках для птиц. Корона, коронка ресничек, может различаться по дизайну. Некоторые виды не используют его для передвижения, но разработали специальные приспособления для захвата. Коловратки из рода Collotheca живут прикрепленными к субстрату и собирают крошечные микробы, такие как бактерии с чрезвычайно удлиненными ресничками. Увидеть
эти рыболовы под микроскопом представляют собой прекрасное зрелище.
Амебы…
Что такое амебы? : Амебы (Phylum Rhizopoda) — одноклеточные протисты, способные постоянно менять свою форму. Каждый вид имеет свой собственный репертуар форм. Как передвигается амеба? : Амебы передвигаются по путям цитоплазматического движения. (цитоплазма — это клеточное содержимое вокруг ядра клетки) Амеба образует псевдоподии (ложные ножки), с помощью которых они «текут» по поверхности. Цитоплазма не только течет, но и переходит из жидкого состояния в твердое. Эти псевдоподии также используются для захвата
добыча, они просто поглощают пищу. Они могут определять тип добычи и использовать различные «тактики поглощения». Изображение
показывает несколько клеточных органелл. Слева от центра мы видим шаровидный пузырек, извергающий воду, и справа от него:
можно увидеть единственное ядро этого вида. Другие виды могут иметь много ядер. Клетка полна коричневой еды
вакуоли, а также содержит мелкие кристаллы.
Цитоплазма не только течет, но и переходит из жидкого состояния в твердое. Эти псевдоподии также используются для захвата
добыча, они просто поглощают пищу. Они могут определять тип добычи и использовать различные «тактики поглощения». Изображение
показывает несколько клеточных органелл. Слева от центра мы видим шаровидный пузырек, извергающий воду, и справа от него:
можно увидеть единственное ядро этого вида. Другие виды могут иметь много ядер. Клетка полна коричневой еды
вакуоли, а также содержит мелкие кристаллы.
Амебы могут достигать исключительно больших размеров для одноклеточного организма. Некоторые виды имеют длину 5 миллиметров. Они
могут достигать таких размеров, имея много ядер в своей единственной клетке. Узнайте больше об Amoeba в Micscape
article Амебы — это больше, чем просто «кляксы». Известно, что амебы не имеют какого-либо полового способа размножения. Они только
размножаются делением клеток.
Солнечные анималисты: или Heliozoa, тип Actinopoda (=лученогие) имеют аксоподии, длинные жесткие выступы цитоплазмы. Они не могут так много передвигаться с ними, но они отлично подходят для поимки добычи. Добыча, как правило, мелкие простейшие,
прилипает к аксоподам и покрывается потоком цитоплазмы, идущим по аксоподам и транспортируемым к
клетка Иногда можно встретить Heliozoa, питающихся той же добычей. На этом изображении 2 особи вида Actinophrys sol.
лакомятся диатомовыми водорослями.
Они не могут так много передвигаться с ними, но они отлично подходят для поимки добычи. Добыча, как правило, мелкие простейшие,
прилипает к аксоподам и покрывается потоком цитоплазмы, идущим по аксоподам и транспортируемым к
клетка Иногда можно встретить Heliozoa, питающихся той же добычей. На этом изображении 2 особи вида Actinophrys sol.
лакомятся диатомовыми водорослями.
Некоторые амебы образуют панцирь из найденного материала, который они склеивают, образуя защитное покрытие. Часто песчинки или другие частицы используются для укрепления конструкции, называемой «тестом». Вы можете видеть, как эта панцирная амеба висит в
его тест поддерживает контакт с помощью тонких ложноножек. Длинные ложноножки вытягиваются для захвата добычи.
Инфузории…
Что такое инфузории? : Инфузории — одноклеточные протисты, которых можно узнать по волосовидным «ресничкам». Они используют их для передвижения и для питания. Некоторые инфузории очень маленькие, ненамного крупнее самых крупных бактерий. Другим нравится
«трубчатый анималистик» Stentor может достигать размера двух миллиметров, поэтому его можно увидеть невооруженным глазом. Парамеций не становится намного больше 0,3 мм.
Некоторые инфузории очень маленькие, ненамного крупнее самых крупных бактерий. Другим нравится
«трубчатый анималистик» Stentor может достигать размера двух миллиметров, поэтому его можно увидеть невооруженным глазом. Парамеций не становится намного больше 0,3 мм. Над центром организма вы видите отверстие для кормления. Реснички создают ток, чтобы сметать бактерии и другие частицы пищи. В основании кормового отверстия пища заключена в вакуоли. Пищевые вакуоли служат для транспортировки пищи по клетке. Звездообразные сократительные вакуоли или пузырьки, выделяющие воду, используются для балансировки количества воды в клетке. Два ядра несут генетическую информацию.
Почему реснички? : Когда размер вашего тела меньше миллиметра, вода действует как густой сироп, поэтому плавает, как
рыба не была бы эффективным средством передвижения. Если вы хотите плавать быстро и маневренно, вам нужны реснички,
крошечные волоски, действующие как весла. Большинство инфузорий превосходно плавают, некоторые виды настолько быстры, что их едва видно
при наблюдении.
В многоклеточных организмах многие клетки специализированы (дифференцированы). Различные типы клеток способны выполнять
все виды задач (т.е. действуют как нервные клетки, мышечные клетки, клетки крови и т. д.). Одноклеточные организмы обладают органеллами, особыми структурами внутри или на клетке, которые помогают выполнять всевозможные задачи. Такими органеллами являются пищевые вакуоли и везикулы, выделяющие воду. У многих инфузорий развились всевозможные особые органеллы. Paramecium использует так называемые трихоцисты; крошечные заостренные нити, которыми можно выстрелить в хищника, когда ему угрожают.
Мионемы : Это волокна, которые действуют как мышцы. Мы можем видеть их в стеблях анималистических колокольчиков, таких как
Вортицелла и Карчесиум. Они способны сокращать стебель с исключительной скоростью. На правом изображении
мионемы видны в виде светлых волнистых полос внутри стеблей. У многих инфузорий можно увидеть сросшиеся реснички. Группы
реснички сливаются в пластинчатые мембранеллы. В виде волнистых листов они заметают частицы пищи. Их можно увидеть в
колокольчики. У других инфузорий есть толстые круглые пучки ресничек, называемые цирри, которые действуют как ноги и позволяют организму фактически ходить по поверхности. Для независимой координации этих усиков у них есть нервоподобные органеллы, называемые нейрофибриллами. На верхнем изображении Euplotes и Stylonychia показаны оба типа ресничек.
В виде волнистых листов они заметают частицы пищи. Их можно увидеть в
колокольчики. У других инфузорий есть толстые круглые пучки ресничек, называемые цирри, которые действуют как ноги и позволяют организму фактически ходить по поверхности. Для независимой координации этих усиков у них есть нервоподобные органеллы, называемые нейрофибриллами. На верхнем изображении Euplotes и Stylonychia показаны оба типа ресничек.
Трубач Stentor — одна из самых крупных инфузорий. В расширенном виде они могут быть 2 миллиметра в длину и едва заметны.
невооруженным глазом. Эти зеленые Stentors демонстрируют хитрый трюк, который используют некоторые другие мелкие организмы. Они зеленые, потому что
они используют симбиотические зеленые водоросли под названием хлорелла. На странице о зеленых водорослях эти водоросли будут показаны крупным планом.
Инфузории обычно размножаются бесполым путем делением. Клетка делится на две особи. Здесь мы видим, как Paramecium подвергается делению. Время от времени мы также можем столкнуться с процессом, который называется конъюгацией. Эти две инфузории
рода Spirostomum цепляются друг за друга бок о бок и сливаются вместе. В сложном процессе они обмениваются
генетический материал из их ядер. После конъюгации потомства нет, особи «обновились».
вместо этого сами. У большинства животных, даже у человека, есть реснички, похожие на реснички инфузорий. Эти реснички используются внутрь
наше тело, например, для транспортировки частиц пищи или другого материала.
Эти две инфузории
рода Spirostomum цепляются друг за друга бок о бок и сливаются вместе. В сложном процессе они обмениваются
генетический материал из их ядер. После конъюгации потомства нет, особи «обновились».
вместо этого сами. У большинства животных, даже у человека, есть реснички, похожие на реснички инфузорий. Эти реснички используются внутрь
наше тело, например, для транспортировки частиц пищи или другого материала.
Сделайте свой собственный сенокос : Не так уж сложно вырастить Paramecium или других простейших с помощью сена. Просто
кипятите немного сухой травы в течение 15 или более минут. Налейте воду в миску. Подождите несколько дней, пока слой бактерий
начинает развиваться на поверхности. Затем добавьте несколько экземпляров, которые вы собрали из прудовой воды (стереомикроскоп всегда очень полезен для их сортировки). Но вы также можете поставить миску с водой за окном (не под прямыми солнечными лучами) и просто ждать, что принесет ветер. Многие покоящиеся споры микроорганизмов переносятся ветром.
Ракообразные…
Что такое ракообразные? : Это группа животных, наиболее известная своими крабами и омарами. Но у них много микроскопических родственников. Вместе с насекомыми они принадлежат к большой группе, называемой членистоногими. Все они имеют сегментированные конечности и прочный внешний скелет из хитина. Каких ракообразных можно найти в пресной воде? : Существуют три основные группы микроскопических ракообразных, с которыми вы можете столкнуться, глядя на каплю воды в пруду: водяные блохи, остракоды и веслоногие ракообразные. Самый знакомый
являются водяные блохи. Это самые многочисленные организмы в пресноводном зоопланктоне. Их можно увидеть невооруженным глазом, потому что некоторые виды могут достигать размера почти шести миллиметров. С хорошим ручным объективом можно наблюдать много интересных особенностей.
Одной из наиболее очевидных особенностей являются большие антенны. Они используют их для передвижения. Над усиками видны большие глаза. Он выглядит как один глаз, но состоит из двух сложных глаз, сросшихся вместе. Внутри двустворчатой защитной оболочки, называемой панцирем, находится ряд из пяти или шести пар ножек, которые они используют для фильтрации пищи (мелких водорослей).
пищу можно рассматривать как желто-коричневое вещество. Слева от кишки видны яйца. Узнайте больше о водяных блохах
в статье Micscape Анатомия водяной блохи! Маленькое сердце легко заметить, когда вы исследуете живой образец под
микроскоп. С помощью карандаша и секундомера можно посчитать темпы сердечных сокращений. Просто коснитесь карандашом кусочка
бумаги в темпе сердца дафнии в течение одной минуты.
Они используют их для передвижения. Над усиками видны большие глаза. Он выглядит как один глаз, но состоит из двух сложных глаз, сросшихся вместе. Внутри двустворчатой защитной оболочки, называемой панцирем, находится ряд из пяти или шести пар ножек, которые они используют для фильтрации пищи (мелких водорослей).
пищу можно рассматривать как желто-коричневое вещество. Слева от кишки видны яйца. Узнайте больше о водяных блохах
в статье Micscape Анатомия водяной блохи! Маленькое сердце легко заметить, когда вы исследуете живой образец под
микроскоп. С помощью карандаша и секундомера можно посчитать темпы сердечных сокращений. Просто коснитесь карандашом кусочка
бумаги в темпе сердца дафнии в течение одной минуты.
Остракоды (см. верхнее изображение) — очень интересные маленькие ракообразные. Их панцирь еще более защитный, чем у
водяные блохи. Они могут полностью сомкнуть две половинки и уйти в нее. Их панцири настолько прочны, что хорошо окаменевают. Их окаменелости очень важны при изучении слоев древней земли. Доисторические слои земли могут быть
датируется определением вида, населявшего этот слой.
Доисторические слои земли могут быть
датируется определением вида, населявшего этот слой.
Последняя группа микроскопических ракообразных, изображенных здесь, — веслоногие. Их тело не имеет панцирного вида, а более тонкое и сегментированное. В пресной воде их не так много, как дафний, но в океане
их можно найти в астрономических числах. Мы можем даже считать их самыми многочисленными животными на планете. Они есть
основной источник пищи для рыб и даже китов.
Диатомеи…
Что такое диатомовые водоросли? : Диатомовые водоросли — хрупкие одноклеточные организмы с желто-коричневым хлоропластом, который позволяет
их к фотосинтезу. Их клеточные стенки сделаны из кремнезема почти как стеклянный дом. Конструкция клеточной стенки, называемая панцирем, состоит из двух клапанов, которые входят друг в друга наподобие маленькой таблетницы. Цвет хлоропласта
имеет желто-коричневый цвет, а не зеленый, который мы знаем о других существах, использующих свет в качестве источника энергии. Существуют две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В пресной воде
большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу.
Существуют две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В пресной воде
большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу. Где можно найти диатомовые водоросли? : В конце зимы наиболее многочисленны в пресной воде. Ими покроют поверхности водных растений или столбы и деревянные бордюры прудов. Если вам нравится изучать их, вы можете очистить коричневый
роста с помощью плоского куска пластика. Вы также можете использовать губку. Для свободноживущих (планктона) видов предусмотрен специальный штраф.
сетка для планктона очень полезна.
Многие виды диома остаются связанными после деления клеток. Образуют колонии, длинные цепочки. Иногда соединяются только кончики и они образуют зигзагообразный узор. Клетки диатомовых водорослей — идеальные объекты для изучения под микроскопом. Они
имеют сложные узоры из очень тонких точек и часто имеют всевозможные орнаменты. Лучший способ сделать видимыми красивые структуры панциря — удалить содержимое из клетки. Для этого можно использовать перекись водорода. Но это
также можно найти пустые панцири мертвых диатомовых водорослей. Чрезвычайно тонкие поры в панцире некоторых видов диатомовых водорослей используются для проверки разрешающей способности линз микроскопа.
Для этого можно использовать перекись водорода. Но это
также можно найти пустые панцири мертвых диатомовых водорослей. Чрезвычайно тонкие поры в панцире некоторых видов диатомовых водорослей используются для проверки разрешающей способности линз микроскопа.
Передвижение диатомовых водорослей : Пеннатные диатомеи, появившиеся позднее в истории Земли, способны передвигаться в
медленная скользящая мода в направлении длины клетки. Механизм этого еще недостаточно изучен, но
кажется, что через щель рядом с клеткой (швом) выпячиваются крошечные микрофибриллы. С ними они могут передвигаться
поверхность. На снимке очищенной диатомей над швом видна тонкая центральная горизонтальная линия. Там
представляют собой две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В
в пресной воде большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу. В морских водах большое разнообразие форм тела.
больше. В океане они составляют основную часть фитопланктона — фотосинтезирующих организмов, плавающих вместе с водой. Текущий. На этом изображении показан вид сверху на крупного косцинодиска, морского вида, которого можно просто увидеть с помощью
невооруженным глазом. Хорошо видна тонкая сетчатая структура кремнистой клеточной стенки. Желто-коричневые хлоропласты
используемые для фотосинтеза, также легко увидеть.
Текущий. На этом изображении показан вид сверху на крупного косцинодиска, морского вида, которого можно просто увидеть с помощью
невооруженным глазом. Хорошо видна тонкая сетчатая структура кремнистой клеточной стенки. Желто-коричневые хлоропласты
используемые для фотосинтеза, также легко увидеть.
Простейшие и жгутиковые простейшие…
Что такое простейшие? : Название «простейшие» используется для более похожих на животных одноклеточных организмов, таких как амебы.
и инфузории. Термин «водоросли» используется для более похожих на растения микроорганизмов. Но различие часто неопределенно.
У динобриона (верхнее изображение) есть хлоропласты для фотосинтеза, но он также может питаться органическими веществами. Он даже умеет плавать. Такой организм не может быть ни животным, ни растительным. В наши дни все эти одноклеточные организмы, которые не являются ни животными, ни
растения, бактерии или грибы называются «протистами».
Что такое жгутики? : Жгутик, также называемый ундулиподием, представляет собой хлыстообразную структуру, используемую для передвижения, для
кормления или других целей. Почти у всех организмов есть жгутики (на каком-то этапе их жизни). У нас, людей, они есть в наших телах. Даже наши собственные сперматозоиды можно считать жгутиконосцами. Все эти жгутики имеют сходную базовую конструкцию.
Только бактерии имеют жгутики совершенно другого типа. Реснички инфузорий — это просто более короткие версии, которые действуют
другой. Ресничка бьется, как маленькая педаль, и создает боковое движение. Большинство ундулиподий действуют скорее как
пропеллерные, волнообразные движения толкают или тянут организм в переднем направлении.
Одно ядро содержит генетический материал. Ярко-зеленые хлоропласты преобразуют свет в энергию. Энергия хранится в зернохранилище. Длинный гибкий ундулиподий, используемый для передвижения. У основания жгутика находим круглую сократительную вакуоль. Он помогает организмам удалять избыток воды. Поскольку живая ткань засолена, организмы, живущие в пресной воде, поглощают воду. Хорошо видно красное пятно. На самом деле настоящим светочувствительным органом является припухлость у основания
жгутик. Красная область обеспечивает обнаружение света только с одного направления. Так как светочувствительный орган
непосредственно связанная со жгутиком, эвглена прекрасно умеет плыть к источнику света.
Он помогает организмам удалять избыток воды. Поскольку живая ткань засолена, организмы, живущие в пресной воде, поглощают воду. Хорошо видно красное пятно. На самом деле настоящим светочувствительным органом является припухлость у основания
жгутик. Красная область обеспечивает обнаружение света только с одного направления. Так как светочувствительный орган
непосредственно связанная со жгутиком, эвглена прекрасно умеет плыть к источнику света.
Интересным жгутиковым протистом для изучения является Euglena. Здесь показаны некоторые из его многочисленных функций. Эвглена может стать настолько многочисленной, что вода в пруду может стать ярко-зеленой. Помимо использования своего ундулиподия, эвглениды также могут передвигаться, сгибая свое тело и изменяя форму тела, так называемое эвгленоидное движение. Эвглениды обладают способностью терять свои хлоропласты. Если вы будете держать эвгленид в темноте, они начнут питаться органическими веществами и могут потерять свой пигмент. Есть много видов без хлоропластов.
Большинство жгутиковых простейших имеют два или даже больше жгутиков. Часто мы видим, как один жгутик тянется сзади, как своего рода
руль. Жгутики и реснички прозрачные и тонкие, поэтому их нелегко увидеть под микроскопом. Специальные контрастные методы, такие как освещение темным полем или фазовый контраст, помогают сделать эти структуры видимыми. Динофлагелляты
(Dinophyta) — жгутиковые протисты. Многие виды имеют красивый фактурный панцирь из пластин целлюлозы. Один из
их два жгутика проходят по спирали через бороздку вдоль клетки. Другие проекты вниз. Эффектный вид
является Ceratium hirundinella. Жгутиками для передвижения пользуются не только простейшие. Даже наши собственные сперматозоиды имеют жгутик. Не все жгутиковые формы свободно плавают. Многие ведут сидячий образ жизни. Spongomonas — колония жгутиконосцев, живущих в студенистой матрице. они используют свои жгутики для сбора пищи.
Создайте свою собственную культуру Euglena : Сравнительно легко создать так называемую «земную культуру» для нескольких видов фотосинтезирующих простейших и водорослей, включая Euglena.


 C.
C.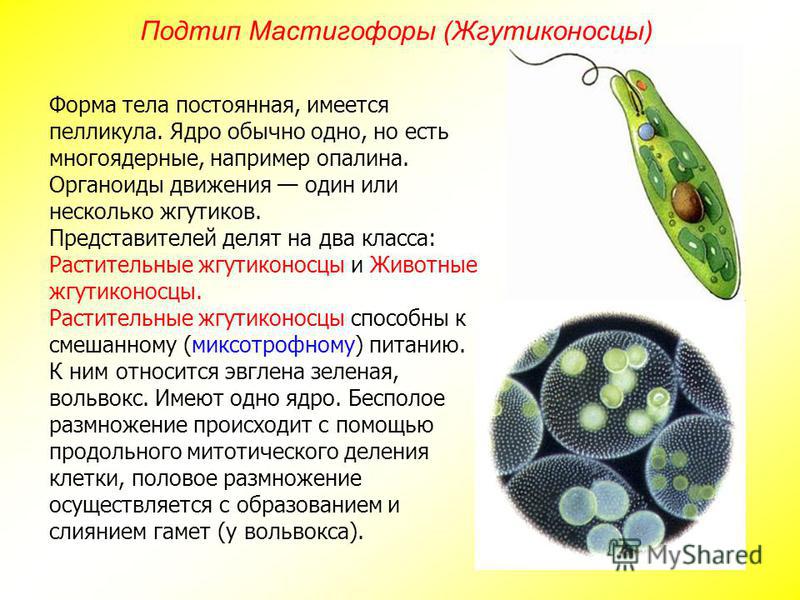 ноябрь
ноябрь
 Пластиды Euglena были предложены в качестве места для производства белков и метаболитов с добавленной стоимостью, представляющих биотехнологический интерес. Было показано, что эвглена является подходящим видом простейших для производства нескольких соединений, используемых в производстве космецевтических и нутрицевтических препаратов, таких как α-токоферол, эфиры воска, полиненасыщенные жирные кислоты, биотин и тирозин. Запасной полисахарид парамилон обладает иммуностимулирующими свойствами и перспективен для производства биоматериалов. Биомасса эвглены может использоваться в качестве пищевой добавки в аквакультуре и в кормах для животных. Различные применения эвглены в экологической биотехнологии включают оценку экотоксикологического риска, биоремедиацию тяжелых металлов, биоремедиацию промышленных сточных вод и загрязненной воды.
Пластиды Euglena были предложены в качестве места для производства белков и метаболитов с добавленной стоимостью, представляющих биотехнологический интерес. Было показано, что эвглена является подходящим видом простейших для производства нескольких соединений, используемых в производстве космецевтических и нутрицевтических препаратов, таких как α-токоферол, эфиры воска, полиненасыщенные жирные кислоты, биотин и тирозин. Запасной полисахарид парамилон обладает иммуностимулирующими свойствами и перспективен для производства биоматериалов. Биомасса эвглены может использоваться в качестве пищевой добавки в аквакультуре и в кормах для животных. Различные применения эвглены в экологической биотехнологии включают оценку экотоксикологического риска, биоремедиацию тяжелых металлов, биоремедиацию промышленных сточных вод и загрязненной воды.
 gracilis , взаимодействует с эволюционно консервативным жгутиковым белком EgPCDUF4201. Последующий молекулярный анализ ясно показал, что EgPCDUF4201 также участвует в гравитации. Мы выполнили субклеточную локализацию CaM2 с помощью иммуноблотинга и непрямой иммунофлуоресценции. С помощью двухгибридного скрининга дрожжей EgPCDUF4201 был идентифицирован как партнер по взаимодействию с CaM2. С-конец EgPCDUF4201 отвечает за взаимодействие с CaM2. Замалчивание N- и C-концов EgPCDUF4201 с помощью РНКи приводило к нарушению гравитации. Более того, анализ непрямой иммунофлуоресценции показал, что EgPCDUF4201 представляет собой белок, ассоциированный с жгутиками. В текущем исследовании были специально рассмотрены некоторые важные вопросы, касающиеся цепи передачи сигнала гравитаксиса в Е. gracilis . Помимо того факта, что это улучшило текущее понимание механизмов восприятия гравитации у E. gracilis , оно также породило несколько интересных исследовательских вопросов, касающихся функции домена неизвестной функции 4201 в жгутиковых клетках.
gracilis , взаимодействует с эволюционно консервативным жгутиковым белком EgPCDUF4201. Последующий молекулярный анализ ясно показал, что EgPCDUF4201 также участвует в гравитации. Мы выполнили субклеточную локализацию CaM2 с помощью иммуноблотинга и непрямой иммунофлуоресценции. С помощью двухгибридного скрининга дрожжей EgPCDUF4201 был идентифицирован как партнер по взаимодействию с CaM2. С-конец EgPCDUF4201 отвечает за взаимодействие с CaM2. Замалчивание N- и C-концов EgPCDUF4201 с помощью РНКи приводило к нарушению гравитации. Более того, анализ непрямой иммунофлуоресценции показал, что EgPCDUF4201 представляет собой белок, ассоциированный с жгутиками. В текущем исследовании были специально рассмотрены некоторые важные вопросы, касающиеся цепи передачи сигнала гравитаксиса в Е. gracilis . Помимо того факта, что это улучшило текущее понимание механизмов восприятия гравитации у E. gracilis , оно также породило несколько интересных исследовательских вопросов, касающихся функции домена неизвестной функции 4201 в жгутиковых клетках.
 столбец 5 .
столбец 5 . Однако в этом направлении требуются дополнительные исследования, так как несколько предполагаемых чувствительных к растяжению/механочувствительных каналов были идентифицированы в библиотеке мРНК E. gracilis (неопубликованные данные). Помимо этого открытого вопроса относительно точной природы SSCIC, специфичного для гравитаксиса, был достигнут разумный прогресс в отношении лежащего в основе молекулярного механизма гравитаксиса у E. gracilis . Например, текущая рабочая модель гравитации была создана на основе серии экспериментов 9.1155 10 . Рабочая модель предполагает, что SSCIC активируются, когда клетки отклоняются от своего пути вертикального плавания, что приводит к притоку ионов кальция. В свою очередь, кальций связывается с кальмодулином, который дополнительно активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназу А, которая, как предполагается, модулирует функции различных белков жгутиков. Недавно подавление специфической протеинкиназы А (PKA) с помощью РНКи прояснило ее участие в гравитации, а также в фототаксисе 11 .
Однако в этом направлении требуются дополнительные исследования, так как несколько предполагаемых чувствительных к растяжению/механочувствительных каналов были идентифицированы в библиотеке мРНК E. gracilis (неопубликованные данные). Помимо этого открытого вопроса относительно точной природы SSCIC, специфичного для гравитаксиса, был достигнут разумный прогресс в отношении лежащего в основе молекулярного механизма гравитаксиса у E. gracilis . Например, текущая рабочая модель гравитации была создана на основе серии экспериментов 9.1155 10 . Рабочая модель предполагает, что SSCIC активируются, когда клетки отклоняются от своего пути вертикального плавания, что приводит к притоку ионов кальция. В свою очередь, кальций связывается с кальмодулином, который дополнительно активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназу А, которая, как предполагается, модулирует функции различных белков жгутиков. Недавно подавление специфической протеинкиназы А (PKA) с помощью РНКи прояснило ее участие в гравитации, а также в фототаксисе 11 . В другом исследовании подавление специфического белка кальмодулина 2 (CaM2) привело только к нарушению гравитации у E. gracilis 12 .
В другом исследовании подавление специфического белка кальмодулина 2 (CaM2) привело только к нарушению гравитации у E. gracilis 12 . Были использованы геномные антитела, облегчающие обнаружение антигена в его денатурированной и нативной конформации. Их реакция на 9Белковый лизат 1334 E. gracilis (дополнительный рисунок 1a) и CaM2, слитый с глутатион-S-трансферазой (GST, дополнительный рисунок 1b), проверяли в денатурирующих условиях с помощью вестерн-блоттинга. Оба эксперимента показали одну полосу ожидаемого размера. Специфичность была дополнительно подтверждена путем создания нокдаун-мутанта (дополнительная фигура 1c). Белковые лизаты дикого типа и мутанта анализировали вестерн-блоттингом с антителом против CaM2. В то время как контроль с антителом против тубулина показал равное количество белков в двух образцах, в нокдаун-мутанте с антителом против CaM2 белок не был обнаружен. В целом эти данные подтвердили специфичность антитела против CaM2.
Были использованы геномные антитела, облегчающие обнаружение антигена в его денатурированной и нативной конформации. Их реакция на 9Белковый лизат 1334 E. gracilis (дополнительный рисунок 1a) и CaM2, слитый с глутатион-S-трансферазой (GST, дополнительный рисунок 1b), проверяли в денатурирующих условиях с помощью вестерн-блоттинга. Оба эксперимента показали одну полосу ожидаемого размера. Специфичность была дополнительно подтверждена путем создания нокдаун-мутанта (дополнительная фигура 1c). Белковые лизаты дикого типа и мутанта анализировали вестерн-блоттингом с антителом против CaM2. В то время как контроль с антителом против тубулина показал равное количество белков в двух образцах, в нокдаун-мутанте с антителом против CaM2 белок не был обнаружен. В целом эти данные подтвердили специфичность антитела против CaM2. Количественный Вестерн-блот четко показал, что CaM2 был в изобилии во фракции тел клеток, тогда как видимый сигнал CaM2 не наблюдался во фракции жгутиков (рис. 1a). Кроме того, анализ IIF показал, что CaM2 рассеян по всему телу клетки в виде пятен, но слабый сигнал также был виден в жгутике (рис. 1b, c). Чтобы подтвердить специфичность сигнала, культура клеток с нокдауном CaM2 9Было создано 1334 E. gracilis . Как в клетках дикого типа, так и в нокдаун-мутантных клетках сигнал проявлялся в виде пятен (дополнительная фигура 3). Однако количественный анализ показал, что количество пятен значительно уменьшилось в мутантных клетках с нокдауном, что доказывает, что пятнистый узор представляет собой специфический сигнал (дополнительная фигура 3c). Хотя CaM обычно являются растворимыми белками, CaM2 проявлялся в виде агрегированных пятен. Чтобы определить, является ли CaM2 цитоплазматическим белком, был создан слитый белок GST-CaM2, который был экспрессирован в кишечная палочка . Использовали растворимую фракцию приготовленного неочищенного белкового лизата GST-CaM2 трансформированных клеток E.
Количественный Вестерн-блот четко показал, что CaM2 был в изобилии во фракции тел клеток, тогда как видимый сигнал CaM2 не наблюдался во фракции жгутиков (рис. 1a). Кроме того, анализ IIF показал, что CaM2 рассеян по всему телу клетки в виде пятен, но слабый сигнал также был виден в жгутике (рис. 1b, c). Чтобы подтвердить специфичность сигнала, культура клеток с нокдауном CaM2 9Было создано 1334 E. gracilis . Как в клетках дикого типа, так и в нокдаун-мутантных клетках сигнал проявлялся в виде пятен (дополнительная фигура 3). Однако количественный анализ показал, что количество пятен значительно уменьшилось в мутантных клетках с нокдауном, что доказывает, что пятнистый узор представляет собой специфический сигнал (дополнительная фигура 3c). Хотя CaM обычно являются растворимыми белками, CaM2 проявлялся в виде агрегированных пятен. Чтобы определить, является ли CaM2 цитоплазматическим белком, был создан слитый белок GST-CaM2, который был экспрессирован в кишечная палочка . Использовали растворимую фракцию приготовленного неочищенного белкового лизата GST-CaM2 трансформированных клеток E. coli , и слитый белок очищали. Экспрессия GST-CaM2 из растворимой фракции клеточного лизата указывает на то, что GST-CaM2 экспрессируется в виде растворимого белка в E. coli (рис. 2).
coli , и слитый белок очищали. Экспрессия GST-CaM2 из растворимой фракции клеточного лизата указывает на то, что GST-CaM2 экспрессируется в виде растворимого белка в E. coli (рис. 2). gracilis , был проведен двухгибридный скрининг дрожжей для поиска их предполагаемых партнеров по взаимодействию с использованием нормализованной библиотеки кДНК E. gracilis , выращенной в коммерческих целях. Четыре клона, идентифицированные при скрининге, оказались положительными в анализе ретрансформации. Среди них был обнаружен белок, содержащий домен неизвестной функции (DUF) 4201, названный EgPCDUF4201. 5′- и 3′-ПЦР RACE проводили для получения полноразмерной последовательности кДНК Например, PCDUF4201 . Полученная полноразмерная последовательность кДНК EgPCDUF4201 кодировала белок из 372 аминокислот. Анализ in silico для выявления потенциальных дополнительных консервативных доменов показал, что, в дополнение к домену DUF4201, 5 спирально-спиральным доменам, предсказанный мотив IQ (104–123 остатка) и предполагаемый сайт связывания кальмодулина (202–221 остат. ) присутствовали (рис. 3а). Поиск потенциальных сайтов фосфорилирования выявил 6 сайтов фосфорилирования серина, 2 треонина и 1 сайт фосфорилирования тирозина в различных положениях в последовательности EgPCDUF4201 (рис.
gracilis , был проведен двухгибридный скрининг дрожжей для поиска их предполагаемых партнеров по взаимодействию с использованием нормализованной библиотеки кДНК E. gracilis , выращенной в коммерческих целях. Четыре клона, идентифицированные при скрининге, оказались положительными в анализе ретрансформации. Среди них был обнаружен белок, содержащий домен неизвестной функции (DUF) 4201, названный EgPCDUF4201. 5′- и 3′-ПЦР RACE проводили для получения полноразмерной последовательности кДНК Например, PCDUF4201 . Полученная полноразмерная последовательность кДНК EgPCDUF4201 кодировала белок из 372 аминокислот. Анализ in silico для выявления потенциальных дополнительных консервативных доменов показал, что, в дополнение к домену DUF4201, 5 спирально-спиральным доменам, предсказанный мотив IQ (104–123 остатка) и предполагаемый сайт связывания кальмодулина (202–221 остат. ) присутствовали (рис. 3а). Поиск потенциальных сайтов фосфорилирования выявил 6 сайтов фосфорилирования серина, 2 треонина и 1 сайт фосфорилирования тирозина в различных положениях в последовательности EgPCDUF4201 (рис. 3а). Для более точного определения области, взаимодействующей с CaM2, было протестировано взаимодействие полноразмерного белка-приманки CaM2 с полной длиной (1–372 аминокислоты), N-концевым укорочением (1–198 аминокислот) и укорочение С-конца (199–372 аминокислоты) EgPCDUF4201. Результаты показали, что C-концевой домен (199–372 аминокислоты) EgPCDUF4201 взаимодействует с CaM2, тогда как N-концевой домен не взаимодействует (рис. 3b). Более того, полноразмерный EgPCDUF4201 также был способен взаимодействовать с CaM2, но в меньшей степени (рис. 3б).
3а). Для более точного определения области, взаимодействующей с CaM2, было протестировано взаимодействие полноразмерного белка-приманки CaM2 с полной длиной (1–372 аминокислоты), N-концевым укорочением (1–198 аминокислот) и укорочение С-конца (199–372 аминокислоты) EgPCDUF4201. Результаты показали, что C-концевой домен (199–372 аминокислоты) EgPCDUF4201 взаимодействует с CaM2, тогда как N-концевой домен не взаимодействует (рис. 3b). Более того, полноразмерный EgPCDUF4201 также был способен взаимодействовать с CaM2, но в меньшей степени (рис. 3б).

 У мутанта с нокдауном по сравнению с диким типом наблюдалось снижение интенсивности флуоресценции и количества пятен, что подтверждает специфичность антисыворотки против EgPCDUF4201 (дополнительная фигура 5a). Кроме того, длину жгутиков мутанта с нокдауном также определяли, чтобы понять их предполагаемое участие в структуре жгутиков. Не наблюдалось статистически значимой разницы в длине жгутиков EgPCDUF4201 нокдаун-мутантных клеток по сравнению с клетками дикого типа (дополнительная фигура 5c). Наконец, локализация EgPCDUF4201 не изменилась у нокдаун-мутанта CaM2 (дополнительная фигура 6).
У мутанта с нокдауном по сравнению с диким типом наблюдалось снижение интенсивности флуоресценции и количества пятен, что подтверждает специфичность антисыворотки против EgPCDUF4201 (дополнительная фигура 5a). Кроме того, длину жгутиков мутанта с нокдауном также определяли, чтобы понять их предполагаемое участие в структуре жгутиков. Не наблюдалось статистически значимой разницы в длине жгутиков EgPCDUF4201 нокдаун-мутантных клеток по сравнению с клетками дикого типа (дополнительная фигура 5c). Наконец, локализация EgPCDUF4201 не изменилась у нокдаун-мутанта CaM2 (дополнительная фигура 6). coli , и с растворимой фракцией проводили вестерн-блоттинг. Антитело к GST обнаружило слитый белок, показав, что EgPCDUF4201 экспрессируется в виде растворимого белка в E. coli (рис. 5c).
coli , и с растворимой фракцией проводили вестерн-блоттинг. Антитело к GST обнаружило слитый белок, показав, что EgPCDUF4201 экспрессируется в виде растворимого белка в E. coli (рис. 5c). Эти данные показали, что домен DUF 4201 чрезвычайно консервативен во всех филогенетических группах, которые в какой-то момент своего жизненного цикла обладают жгутиковыми клетками.
Эти данные показали, что домен DUF 4201 чрезвычайно консервативен во всех филогенетических группах, которые в какой-то момент своего жизненного цикла обладают жгутиковыми клетками. Аналогичная закономерность была обнаружена и для других растворимых белков. Например, было показано, что в нейрональных клетках CaM-зависимая протеинкиназа II (CaMKII) самоагрегируется вблизи эндоплазматического ретикулума при определенных стрессовых условиях 13 . Следовательно, у E. gracilis , как и в нейрональных клетках, клеточный стресс перед фиксацией клеток может привести к агрегации CaM2 в теле клетки. Более того, недавно было показано, что при высоком уровне Ca 2+ , который может быть вызван клеточным стрессом, CaM группируются в четко определенные области, указывая на их связь с клеточными комплексами 14 . Напротив, при низких концентрациях Ca 2+ CaM являются очень подвижными белками, которые быстро доступны для распространения сигналов 14 . Даже если фиксация могла слегка изменить локализацию CaM2, CaM2 был обнаружен повсюду вокруг тела клетки, что соответствует текущей рабочей модели гравитаксиса 10 .
Аналогичная закономерность была обнаружена и для других растворимых белков. Например, было показано, что в нейрональных клетках CaM-зависимая протеинкиназа II (CaMKII) самоагрегируется вблизи эндоплазматического ретикулума при определенных стрессовых условиях 13 . Следовательно, у E. gracilis , как и в нейрональных клетках, клеточный стресс перед фиксацией клеток может привести к агрегации CaM2 в теле клетки. Более того, недавно было показано, что при высоком уровне Ca 2+ , который может быть вызван клеточным стрессом, CaM группируются в четко определенные области, указывая на их связь с клеточными комплексами 14 . Напротив, при низких концентрациях Ca 2+ CaM являются очень подвижными белками, которые быстро доступны для распространения сигналов 14 . Даже если фиксация могла слегка изменить локализацию CaM2, CaM2 был обнаружен повсюду вокруг тела клетки, что соответствует текущей рабочей модели гравитаксиса 10 . Действительно, ионы кальция, поступающие из притока, вызванного активацией SSCIC, связываются с CaM2. CaM2, будучи одним из основных участников сигнальной цепи, должен быть быстро доступен со всех сторон клетки, поскольку приток кальция может возникнуть в любой части плазматической мембраны, в зависимости от направления плавательного отклонения.
Действительно, ионы кальция, поступающие из притока, вызванного активацией SSCIC, связываются с CaM2. CaM2, будучи одним из основных участников сигнальной цепи, должен быть быстро доступен со всех сторон клетки, поскольку приток кальция может возникнуть в любой части плазматической мембраны, в зависимости от направления плавательного отклонения. IIF показал, что EgPCDUF4201 распределяется пятнистым образом по всему жгутику, включая его основание. Мы предполагаем, что этот белок является промежуточным фактором между CaM2 и белками динеином, которые создают молекулярную движущую силу, необходимую для биения жгутиков 9.1155 15 .
IIF показал, что EgPCDUF4201 распределяется пятнистым образом по всему жгутику, включая его основание. Мы предполагаем, что этот белок является промежуточным фактором между CaM2 и белками динеином, которые создают молекулярную движущую силу, необходимую для биения жгутиков 9.1155 15 . Хотя CCDC113 и CCDC96 имеют 30% и 38% сходства (аминокислоты) с EgPCDUF4201 соответственно, их роль, вероятно, отличается от EgPCDUF4201. Этот последний расположен в жгутиках, но не участвует в их формировании, так как его подавление не изменяет длину жгутиков.
Хотя CCDC113 и CCDC96 имеют 30% и 38% сходства (аминокислоты) с EgPCDUF4201 соответственно, их роль, вероятно, отличается от EgPCDUF4201. Этот последний расположен в жгутиках, но не участвует в их формировании, так как его подавление не изменяет длину жгутиков. gracilis .
gracilis . Понижающая регуляция белка приводит к нарушению гравитации. Таким образом, исследование продемонстрировало роль нового белка в цепи передачи гравитационного сигнала у E. gracilis . Этот новый белок представляет гомологов у других организмов, обладающих ресничками или жгутиками, но их функции до сих пор в значительной степени неизвестны и, скорее всего, не связаны только с гравитаксисом.
Понижающая регуляция белка приводит к нарушению гравитации. Таким образом, исследование продемонстрировало роль нового белка в цепи передачи гравитационного сигнала у E. gracilis . Этот новый белок представляет гомологов у других организмов, обладающих ресничками или жгутиками, но их функции до сих пор в значительной степени неизвестны и, скорее всего, не связаны только с гравитаксисом. относительно направления вектора силы тяжести. Светодиод синего света обеспечивает фототактический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки переносили в изготовленную на заказ одноразовую стеклянную кювету (два простых предметных стекла, склеенных U-образной двойной клейкой лентой, с промежутком между ними для заливки клеточной суспензии) и помещали вертикально в горизонтальный микроскоп для определения гравитационной ориентации. . Поступившие видеоизображения анализировались программой Wintrack 2000 с целью одновременного определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и др.) и статистических параметров плавающих клеток. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все клетки плывут случайным образом) до 1 (когда все клетки плывут в одном направлении). Движение наблюдаемых клеток представлено в виде круговой гистограммы с 64 угловыми секторами 23 .
относительно направления вектора силы тяжести. Светодиод синего света обеспечивает фототактический стимул, а инфракрасный светодиод (λ = 875 нм) позволяет наблюдать, не влияя на клетки. Клетки переносили в изготовленную на заказ одноразовую стеклянную кювету (два простых предметных стекла, склеенных U-образной двойной клейкой лентой, с промежутком между ними для заливки клеточной суспензии) и помещали вертикально в горизонтальный микроскоп для определения гравитационной ориентации. . Поступившие видеоизображения анализировались программой Wintrack 2000 с целью одновременного определения векторов движения, различных физиологических (подвижность клеток, форма клеток, скорость, площадь объектов и др.) и статистических параметров плавающих клеток. Точность ориентации (значение r) определяли, как описано ранее 22 . Значение r находится в диапазоне от 0 (когда все клетки плывут случайным образом) до 1 (когда все клетки плывут в одном направлении). Движение наблюдаемых клеток представлено в виде круговой гистограммы с 64 угловыми секторами 23 . Направление вверх на гистограмме (0°) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество клеток, движущихся в соответствующем направлении.
Направление вверх на гистограмме (0°) соответствует направлению ячеек вверх. Длина угловых секторов отражает количество клеток, движущихся в соответствующем направлении.
 Для проведения 5′-RACE ПЦР использовали геноспецифические антисмысловые праймеры в сочетании с праймером кэпа индивидуальной конструкции, который закрепляет транс-сплайсинговую структуру 5′-кэпа, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier et al. . 27 , тогда как 3′-RACE ПЦР проводили с использованием специфических для гена смысловых праймеров и специально разработанного олиго-dT праймера с двумя вырожденными нуклеотидами. Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и набор FirstChoice® RLM-RACE от Ambion).
Для проведения 5′-RACE ПЦР использовали геноспецифические антисмысловые праймеры в сочетании с праймером кэпа индивидуальной конструкции, который закрепляет транс-сплайсинговую структуру 5′-кэпа, обнаруженную в большинстве мРНК E. gracilis , как описано Tessier et al. . 27 , тогда как 3′-RACE ПЦР проводили с использованием специфических для гена смысловых праймеров и специально разработанного олиго-dT праймера с двумя вырожденными нуклеотидами. Были использованы два имеющихся в продаже набора (набор RACE 2-го поколения от Roche и набор FirstChoice® RLM-RACE от Ambion). Впоследствии вставки были подвергнуты рестрикционному расщеплению и субклонированы в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния GST под промотором TAC. Кроме того, две укороченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и сначала лигированы в pCR™II-Blunt-TOPO®, а затем субклонированы в pGADHA (Dualsystemsbiotech). для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием корректорной ДНК-полимеразы Phusion (Thermo Scientific).
Впоследствии вставки были подвергнуты рестрикционному расщеплению и субклонированы в pGEX4T2 (GE Healthcare) для осуществления экспрессии белка слияния GST под промотором TAC. Кроме того, две укороченные (1–594 и 595–1119) и полноразмерные кодирующие области EgPCDUF4201 со стоп-кодоном были амплифицированы и сначала лигированы в pCR™II-Blunt-TOPO®, а затем субклонированы в pGADHA (Dualsystemsbiotech). для экспрессии под промотором ADh2. Амплификацию соответствующих вставок проводили с использованием корректорной ДНК-полимеразы Phusion (Thermo Scientific). ). Извлеченные образцы РНК объединяли и передавали коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в активационный домен (AD), содержащий плазмиду pGAD-HA (Mobitech). 9Штамм 1334 Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой pGBKT7-CaM2 с использованием метода полиэтиленгликоля (ПЭГ)/ацетата лития/одноцепочечной ДНК-носителя, как описано ранее 29 . Впоследствии культуру дрожжевых клеток-трансформантов-приманок повторно трансформировали с помощью 50 мкг библиотеки кДНК с использованием протокола трансформации в масштабе библиотеки, как описано в руководстве пользователя MatchMaker GAL4 Two-Hybrid System (Clonetech). Эффективность трансформации дрожжевых клеток определяли на чашках SD-TL, тогда как взаимодействие между двумя белками определяли на среде для селекции SD-TLAH. Точно так же взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селекционной среде SD-TLAH.
). Извлеченные образцы РНК объединяли и передавали коммерческому поставщику (LGC Genomics GmbH, Берлин, Германия) для создания библиотеки кДНК. Нормализованную библиотеку кДНК лигировали в активационный домен (AD), содержащий плазмиду pGAD-HA (Mobitech). 9Штамм 1334 Saccharomyces cerevisiae PJ692a 28 трансформировали плазмидой-приманкой pGBKT7-CaM2 с использованием метода полиэтиленгликоля (ПЭГ)/ацетата лития/одноцепочечной ДНК-носителя, как описано ранее 29 . Впоследствии культуру дрожжевых клеток-трансформантов-приманок повторно трансформировали с помощью 50 мкг библиотеки кДНК с использованием протокола трансформации в масштабе библиотеки, как описано в руководстве пользователя MatchMaker GAL4 Two-Hybrid System (Clonetech). Эффективность трансформации дрожжевых клеток определяли на чашках SD-TL, тогда как взаимодействие между двумя белками определяли на среде для селекции SD-TLAH. Точно так же взаимодействие между двумя выбранными белками определяли, наблюдая за ростом дрожжевых клеток на селекционной среде SD-TLAH. Автоактивацию белка-приманки или добычи определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами.
Автоактивацию белка-приманки или добычи определяли, наблюдая за ростом дрожжевых клеток, котрансформированных пустыми плазмидами. Laboratories, США) в данном исследовании использовали в качестве вторичных антител.
Laboratories, США) в данном исследовании использовали в качестве вторичных антител. Высушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевины, 2 М тиомочевины, 2% CHAPS, 40 мМ ДТТ) и переносили в 1,5 мл микроцентрифужную пробирку, а солюбилизацию белка проводили в течение 1 ч (30°С). C, 1400 циклов/мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем солюбилизированную белковую фракцию собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию белков в образцах определяли методом Бредфорда 9.1155 31 .
Высушенный на воздухе белковый осадок суспендировали в 100 мкл буфера для ресуспендирования (7 М мочевины, 2 М тиомочевины, 2% CHAPS, 40 мМ ДТТ) и переносили в 1,5 мл микроцентрифужную пробирку, а солюбилизацию белка проводили в течение 1 ч (30°С). C, 1400 циклов/мин) с использованием нагревательного шейкера (Thermomixer comfort, Eppendorf, США). Затем солюбилизированную белковую фракцию собирали центрифугированием (20000 g, 5 мин, комнатная температура). Концентрацию белков в образцах определяли методом Бредфорда 9.1155 31 . , США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном солевом растворе (W/V) с 0,5% Tween 20 (V/V) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхивание (20 циклов/мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов/мин), после чего трижды промывали буфером TBS-T в течение 10 мин и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения улучшенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7™ Advance Chemiluminescence System (Peqlab, Германия).
, США). Затем мембрану замачивали в блокирующем буфере, 5% обезжиренном сухом молоке в трис-буферном солевом растворе (W/V) с 0,5% Tween 20 (V/V) (TBS-T) в течение 1 ч при комнатной температуре с постоянным встряхивание (20 циклов/мин). После этого мембрану зондировали соответствующим первичным антителом в блокирующем буфере (30 циклов/мин), после чего трижды промывали буфером TBS-T в течение 10 мин и инкубировали с блокирующим буфером, содержащим соответствующее вторичное антитело. После трех промывок буфером TBS-T блоты визуализировали с помощью имеющегося в продаже набора для обнаружения улучшенной хемилюминесценции (ECL) (PerkinElmer, США), а изображения получали с помощью системы FUSION FX7™ Advance Chemiluminescence System (Peqlab, Германия). Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка.
Полученные разделенные жгутики и фракции клеточных тел собирали для экстракции белка. Затем одну трансформантную колонию суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг.мл -1), для роста в течение ночи (37 °C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной трансформантной культурой pGEX4T2-9.1334 CaM2 и pGEX4T2- EgPCDUF4201 соответственно. После этого экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигали определенной плотности клеток (OD600 0,6–0,7). Клетки собирали после 5 ч роста (37 °C, 200 циклов в минуту) центрифугированием (6000g, 4 °C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 9).1742 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой коктейля ингибиторов протеаз (Complete ингибиторов протеаз коктейль, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 секунд при мощности 30% с использованием ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия).
Затем одну трансформантную колонию суспендировали в 5 мл бульона LB, содержащего ампициллин (100 мкг.мл -1), для роста в течение ночи (37 °C, 200 циклов в минуту). На следующий день 1000 мл среды LB инокулировали ночной трансформантной культурой pGEX4T2-9.1334 CaM2 и pGEX4T2- EgPCDUF4201 соответственно. После этого экспрессию белка индуцировали добавлением изопропилтио-β-D-галактопиранозида (IPTG) до конечной концентрации 1 мМ по мере того, как растущие культуры достигали определенной плотности клеток (OD600 0,6–0,7). Клетки собирали после 5 ч роста (37 °C, 200 циклов в минуту) центрифугированием (6000g, 4 °C, 10 мин). После двух промывок деионизированной водой осадок клеток растворяли в буфере TIF (20 мМ Трис, pH 8,0, 150 мМ NaCl, 1 мМ MgCl 9).1742 2 , 0,1% NP40, 10% глицерин) с уже смешанной таблеткой коктейля ингибиторов протеаз (Complete ингибиторов протеаз коктейль, Roche). Затем клетки обрабатывали ультразвуком, подавая три импульса по 20 секунд при мощности 30% с использованием ультразвукового гомогенизатора (ультразвуковой преобразователь Bandelin, Sonoplus hd UW 2070 и ВЧ-генератор, GM 2070, Германия). Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4°C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца объемом 2 мл с помощью адаптера ввода-люэра Portino® (Macherey-Nagel, Германия).
Растворимую фракцию (супернатант) собирали центрифугированием (7000 g, 4°C, 10 мин). Очистку слитых белков GST из растворимой фракции проводили с использованием колонок Portino® GST (Macherey-Nagel, Германия) с объемом слоя 1 мл. Ручная процедура очистки была принята с использованием шприца объемом 2 мл с помощью адаптера ввода-люэра Portino® (Macherey-Nagel, Германия).Хедер, Д. П., Рихтер, П., Шустер, М., Дайкер, В. и Леберт, М. Молекулярный анализ передачи сигнала гравиперцепции у жгутиковых Euglena gracilis : участие временного рецепторного потенциала, подобного канал и кальмодулин. Доп. Космический Рез. 43 , 1179–1184 (2009 г.)).
ОБЪЯВЛЕНИЕ Статья Google ученый
Дайкер, В., Леберт, М., Рихтер, П.Р. и Хедер, Д.П. Молекулярная характеристика кальмодулина, участвующего в цепи передачи сигнала гравитаксиса у Euglena gracilis . Планта 231 , 1229–1236 (2010).
КАС Статья пабмед Google ученый
Тахедль, Х. и Хедер, Д. П. Автоматизированный биомониторинг с использованием анализа движения в реальном времени Euglena gracilis . Экотокс. Окружающая среда. Сейф 48 , 161–169 (2001).
КАС Статья Google ученый
 Н. и М.Л. проектировал эксперименты. А.Н., А.Л.Б., В.Д., Ж.К. и PR провели эксперименты. А.Н. и А.Л.Б. писал М.С.
Н. и М.Л. проектировал эксперименты. А.Н., А.Л.Б., В.Д., Ж.К. и PR провели эксперименты. А.Н. и А.Л.Б. писал М.С. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое. Паразитические жгутиконосцы также попадают в эту категорию.
Паразитические жгутиконосцы также попадают в эту категорию.
 Согласно более ранней гипотезе, ориентация
клетки обусловлены пассивной физической ориентацией в воде
колонна, предполагая, что задний конец тяжелее переднего
конец.¹ Альтернативная гипотеза состоит в том, что клетка обладает
активный физиологический гравирецептор, определяющий вектор
гравитационного поля.² В дополнение к гравитации,
жгутиковые используют свет как сигнал для ориентации в воде
столбец,³ как указано выше. Эксперименты со светом и
гравитация в различных векторных комбинациях при земных
условия показали, что клетки интегрируются по двум
стимулы и генерировать интегрированный ответ. 4 А
аналогичная проблема существует для грибов и высших растений, у которых
фототропизм накладывается на гравитропизм под земными
условия. 5
Согласно более ранней гипотезе, ориентация
клетки обусловлены пассивной физической ориентацией в воде
колонна, предполагая, что задний конец тяжелее переднего
конец.¹ Альтернативная гипотеза состоит в том, что клетка обладает
активный физиологический гравирецептор, определяющий вектор
гравитационного поля.² В дополнение к гравитации,
жгутиковые используют свет как сигнал для ориентации в воде
столбец,³ как указано выше. Эксперименты со светом и
гравитация в различных векторных комбинациях при земных
условия показали, что клетки интегрируются по двум
стимулы и генерировать интегрированный ответ. 4 А
аналогичная проблема существует для грибов и высших растений, у которых
фототропизм накладывается на гравитропизм под земными
условия. 5 
 луч актиничного света, падающий под углом
15° по отношению к поверхности кюветы.
луч актиничного света, падающий под углом
15° по отношению к поверхности кюветы.Рис. 1. Фотосинтезирующая одноклеточная жгутиконосица Euglena. грацилис.
 2а-2б). 9 Аналогичные результаты были получены на быстровращающемся горизонтальном
клиностат. 10 Происходит переориентация клеток внутри
меньше минуты. В земных условиях клетки
подвергаются осаждению, так как имеют удельный вес
1,04, выше, чем у окружающей воды. В соответствии
с законом Рэлея это приводит к более быстрому плаванию вниз
скорость и более медленная скорость плавания вверх по сравнению со скоростью
в горизонтальном направлении. Следовательно, клетки перемещаются с
более высокая скорость в условиях мкг. Напротив,
инфузория Paramecium частично компенсирует более медленный рост
движения за счет гравикинеза. 11, 12
2а-2б). 9 Аналогичные результаты были получены на быстровращающемся горизонтальном
клиностат. 10 Происходит переориентация клеток внутри
меньше минуты. В земных условиях клетки
подвергаются осаждению, так как имеют удельный вес
1,04, выше, чем у окружающей воды. В соответствии
с законом Рэлея это приводит к более быстрому плаванию вниз
скорость и более медленная скорость плавания вверх по сравнению со скоростью
в горизонтальном направлении. Следовательно, клетки перемещаются с
более высокая скорость в условиях мкг. Напротив,
инфузория Paramecium частично компенсирует более медленный рост
движения за счет гравикинеза. 11, 12 Рис. 2. Распределение направлений плавания E. gracilis при 1 g перед полетом TEXUS (a) и 0 g во время первого минута на TEXUS 23 (b).
 13 Флуенс
частота этих ответов сопоставима с таковой при 1 г.
Однако фототаксическая ориентация достигалась быстрее, чем при 1 г.
Кроме того, точность ориентирования в пространстве была выше, чем в пространстве.
контроль, измеренный одновременно в наземных условиях.
Подтвержденные ранее измерения распределений скоростей
результаты экспериментов по гравитаксису в космосе. Измерения
после того, как полеты TEXUS показали аналогичное поведение как для
фототаксис и гравитаксис, как и до полета, что указывает на то, что
клетки не адаптировались к условиям при 0 g. Недавний
эксперименты во время международной микрогравитации космического корабля «Шаттл»
Миссия Лаборатория-2 с использованием медленно вращающейся центрифуги
микроскоп (NIZEMI) показал, что порог гравитационного
ориентация в E. gracilis составляет около 0,16 г. 14 Также не было адаптации к измененной гравитации под
длительные условия при 0g.
13 Флуенс
частота этих ответов сопоставима с таковой при 1 г.
Однако фототаксическая ориентация достигалась быстрее, чем при 1 г.
Кроме того, точность ориентирования в пространстве была выше, чем в пространстве.
контроль, измеренный одновременно в наземных условиях.
Подтвержденные ранее измерения распределений скоростей
результаты экспериментов по гравитаксису в космосе. Измерения
после того, как полеты TEXUS показали аналогичное поведение как для
фототаксис и гравитаксис, как и до полета, что указывает на то, что
клетки не адаптировались к условиям при 0 g. Недавний
эксперименты во время международной микрогравитации космического корабля «Шаттл»
Миссия Лаборатория-2 с использованием медленно вращающейся центрифуги
микроскоп (NIZEMI) показал, что порог гравитационного
ориентация в E. gracilis составляет около 0,16 г. 14 Также не было адаптации к измененной гравитации под
длительные условия при 0g.
 микроорганизмы, способные осуществлять фотосинтез. Фотосинтез (преобразование энергии света в химическую энергию)
осуществляется в частях клетки, называемых хлоропластами. Их можно найти в различных формах и цветах и во многих различных организмах. Не все эти организмы зеленые. Диатомовые водоросли, хризофиты и динофлагелляты имеют хлоропласты от желтого до коричневого цвета. Существуют бурые водоросли (Phaeophyta), красные водоросли (Rhodophyta) и многие другие группы одноклеточных водорослей.
во многих оттенках зеленого. Сине-зеленые цианобактерии также фотосинтезируют.
микроорганизмы, способные осуществлять фотосинтез. Фотосинтез (преобразование энергии света в химическую энергию)
осуществляется в частях клетки, называемых хлоропластами. Их можно найти в различных формах и цветах и во многих различных организмах. Не все эти организмы зеленые. Диатомовые водоросли, хризофиты и динофлагелляты имеют хлоропласты от желтого до коричневого цвета. Существуют бурые водоросли (Phaeophyta), красные водоросли (Rhodophyta) и многие другие группы одноклеточных водорослей.
во многих оттенках зеленого. Сине-зеленые цианобактерии также фотосинтезируют. Очень разнообразными группами пресноводных водорослей являются хлорофиты или зеленые водоросли. На основе соединений
фотосинтетические пигменты и некоторые другие характеристики, по-видимому, наиболее близки к растениям. Распространенной зеленой водорослью является Hydrodictyon, водяная сеть. Он связан с Pediastrum (верхнее изображение), но образует колонию в форме мешка. Как Педиаструм
каждая отдельная клетка может развиться в новую колонию. Вы можете себе представить, что, поскольку колония содержит тысячи клеток, Hydrodictyon может воспроизводиться очень быстро. И в отличие от Pediastrum, Hydrodictyon может вырасти большим, почти 30 см. в длину.
Цветение Hydrodictyon может стать настоящей проблемой для водоочистных сооружений. На изображении показана часть небольшой колонии (слева).
и три отдельные клетки большой колонии. Внутри каждой из этих клеток может образоваться новая колония.
Вы можете себе представить, что, поскольку колония содержит тысячи клеток, Hydrodictyon может воспроизводиться очень быстро. И в отличие от Pediastrum, Hydrodictyon может вырасти большим, почти 30 см. в длину.
Цветение Hydrodictyon может стать настоящей проблемой для водоочистных сооружений. На изображении показана часть небольшой колонии (слева).
и три отдельные клетки большой колонии. Внутри каждой из этих клеток может образоваться новая колония.
Если у вас есть птичья ванночка с водой, которая стала красной, вы можете найти зеленые водоросли Haematococcus pluvialis. Этот вид показывает, что зеленые водоросли не всегда должны выглядеть как зеленые водоросли. Хлоропласты часто краснеют, когда условия становятся неблагоприятными. Гематококк плавает с помощью двух длинных жгутиков. Многие виды являются жгутиковыми и подвижными, другие неподвижны, но часто имеют жгутиковую стадию в какой-то момент своего жизненного цикла. Безусловно, одна из самых эффектных жгутиковых зеленых водорослей — Volvox. Образует шаровидную колонию. Все мелкие клетки колонии имеют два жгутика и
маленькое глазное пятно. Благодаря этому колония может плыть к свету. Volvox имеет интересные способы размножения.
Узнайте больше об этом в статье Micscape Volvox, одном из семи чудес микромира. Мелкая, довольно невзрачная зеленая водоросль без ундулиподий – это хлорелла. Его можно найти в виде эндосимбионта внутри инфузорий, гидр
и другие животные. Они выращивают хлореллу, как если бы выращивали урожай в теплице.
Образует шаровидную колонию. Все мелкие клетки колонии имеют два жгутика и
маленькое глазное пятно. Благодаря этому колония может плыть к свету. Volvox имеет интересные способы размножения.
Узнайте больше об этом в статье Micscape Volvox, одном из семи чудес микромира. Мелкая, довольно невзрачная зеленая водоросль без ундулиподий – это хлорелла. Его можно найти в виде эндосимбионта внутри инфузорий, гидр
и другие животные. Они выращивают хлореллу, как если бы выращивали урожай в теплице.
Многие зеленые водоросли образуют длинные нити. Клетки остаются прикрепленными после деления. Некоторые роды, такие как Spirogyra, Mougeotia
и Zygnema могут стать настолько многочисленными, что образуют плотные маты роста на поверхности прудов, так называемую прудовую пену. Этот пруд
накипь интересна для изучения под микроскопом. Если вы сожмете его в банку, вы соберете много интересного.
организмы. И нитчатые водоросли не менее интересны. Хлоропласты имеют четкую форму. У спирогиры хлоропласт проходит через клетку в виде спирали. На изображении также видно ядро, висящее на тонких нитях. Спирогира и родственные водоросли, такие как десмиды, представляют собой сопряженные зеленые водоросли. Эти десмиды настолько красивы, что заслуживают отдельной страницы.
На изображении также видно ядро, висящее на тонких нитях. Спирогира и родственные водоросли, такие как десмиды, представляют собой сопряженные зеленые водоросли. Эти десмиды настолько красивы, что заслуживают отдельной страницы.

Бактерии были наиболее выдающимися существами на ранних стадиях истории жизни почти от 4000 миллионов лет до 600 миллионов лет назад. Окаменелости, называемые строматолитами, все еще можно найти, и они были созданы цианобактериями. Цианобактерии были необходимы для развития более сложных форм жизни. Они производили кислород в нашей атмосфере. Этот кислород необходим для гораздо более эффективного метаболизма многоклеточных организмов. Более того, фотосинтетические способности бактерий, по-видимому, были переняты более развитыми организмами. В настоящее время бактерии играют существенную роль в переработке вещества. Бактерии есть везде. Внутри вашего рта живет больше бактерий, чем количество людей, которые когда-либо жили.
На небольшой анимации слева показаны бактерии спирохеты. Они быстро передвигаются, у них много жгутиков, которые, в отличие от других бактерий, лежат внутри клетки. Многие другие бактерии используют жгутики (хлыстообразные структуры) для передвижения. Жгутики бактерий довольно интересны, так как имеют простую, но очень изобретательную конструкцию. Бактериальный жгутик представляет собой миниатюрное механическое устройство, движение которого вызывается вращением стержня, той части, где жгутик прикрепляется к клетке. Это внеклеточная структура, которая работает как маленький пропеллер.
Жгутики бактерий довольно интересны, так как имеют простую, но очень изобретательную конструкцию. Бактериальный жгутик представляет собой миниатюрное механическое устройство, движение которого вызывается вращением стержня, той части, где жгутик прикрепляется к клетке. Это внеклеточная структура, которая работает как маленький пропеллер.
Nostoc – это цианобактерия, образующая большие сферические колонии. Они распространены и их можно увидеть невооруженным глазом. Большинство бактерий видны только в самые сильные линзы микроскопа. Самый простой способ собрать их (а также множество мелких простейших) — положить покровное стекло на поверхность прудовой воды. Через ночь на нижней стороне покровного стекла вырастут целые колонии бактерий. Осторожно помещенный на предметное стекло (можно добавить дополнительную каплю воды), рост под покровным стеклом можно наблюдать с помощью объектива 40X или 100X, чтобы увидеть мельчайшие детали.
 Поскольку они настолько малы, что большинство людей никогда не слышали об их существовании. Они есть
примерно такого же размера, как и более крупные одноклеточные организмы. Клеток у них немного, меньше 1000, но есть
некоторые очень специальные атрибуты. Это чудеса миниатюрного дизайна. В передней части тела у них есть корона волосовидных ресничек. Они передвигаются, используя корону ресничек (корону), чтобы двигаться. Некоторые виды ходят с
голова и нога. Их лапы могут выделять липкое вещество, которое позволяет им прикрепляться к поверхности. Они также используют
коронка ресничек, чтобы замахивать едой в рот. Там пища попадает в «мастакс», где находятся два так называемых «трофуса».
обрабатывать пищу до того, как она попадет в кишечник. Коловратки настолько прозрачны, что все эти органы можно легко наблюдать. У них есть одно или два светочувствительных красных пятна под глазами.
Поскольку они настолько малы, что большинство людей никогда не слышали об их существовании. Они есть
примерно такого же размера, как и более крупные одноклеточные организмы. Клеток у них немного, меньше 1000, но есть
некоторые очень специальные атрибуты. Это чудеса миниатюрного дизайна. В передней части тела у них есть корона волосовидных ресничек. Они передвигаются, используя корону ресничек (корону), чтобы двигаться. Некоторые виды ходят с
голова и нога. Их лапы могут выделять липкое вещество, которое позволяет им прикрепляться к поверхности. Они также используют
коронка ресничек, чтобы замахивать едой в рот. Там пища попадает в «мастакс», где находятся два так называемых «трофуса».
обрабатывать пищу до того, как она попадет в кишечник. Коловратки настолько прозрачны, что все эти органы можно легко наблюдать. У них есть одно или два светочувствительных красных пятна под глазами. Существует огромное разнообразие впечатляющих форм тела, подходящих для разных образов жизни или условий окружающей среды. Поскольку многие виды образуют так называемые покоящиеся споры, которые легко переносятся ветром, их можно найти где угодно, если
есть немного воды. Даже в водосточных желобах или в поилках для птиц. Корона, коронка ресничек, может различаться по дизайну. Некоторые виды не используют его для передвижения, но разработали специальные приспособления для захвата. Коловратки из рода Collotheca живут прикрепленными к субстрату и собирают крошечные микробы, такие как бактерии с чрезвычайно удлиненными ресничками. Увидеть
эти рыболовы под микроскопом представляют собой прекрасное зрелище.
Поскольку многие виды образуют так называемые покоящиеся споры, которые легко переносятся ветром, их можно найти где угодно, если
есть немного воды. Даже в водосточных желобах или в поилках для птиц. Корона, коронка ресничек, может различаться по дизайну. Некоторые виды не используют его для передвижения, но разработали специальные приспособления для захвата. Коловратки из рода Collotheca живут прикрепленными к субстрату и собирают крошечные микробы, такие как бактерии с чрезвычайно удлиненными ресничками. Увидеть
эти рыболовы под микроскопом представляют собой прекрасное зрелище.
Как передвигается амеба? : Амебы передвигаются по путям цитоплазматического движения. (цитоплазма — это клеточное содержимое вокруг ядра клетки) Амеба образует псевдоподии (ложные ножки), с помощью которых они «текут» по поверхности. Цитоплазма не только течет, но и переходит из жидкого состояния в твердое. Эти псевдоподии также используются для захвата
добыча, они просто поглощают пищу. Они могут определять тип добычи и использовать различные «тактики поглощения». Изображение
показывает несколько клеточных органелл. Слева от центра мы видим шаровидный пузырек, извергающий воду, и справа от него:
можно увидеть единственное ядро этого вида. Другие виды могут иметь много ядер. Клетка полна коричневой еды
вакуоли, а также содержит мелкие кристаллы.
Цитоплазма не только течет, но и переходит из жидкого состояния в твердое. Эти псевдоподии также используются для захвата
добыча, они просто поглощают пищу. Они могут определять тип добычи и использовать различные «тактики поглощения». Изображение
показывает несколько клеточных органелл. Слева от центра мы видим шаровидный пузырек, извергающий воду, и справа от него:
можно увидеть единственное ядро этого вида. Другие виды могут иметь много ядер. Клетка полна коричневой еды
вакуоли, а также содержит мелкие кристаллы.
Амебы могут достигать исключительно больших размеров для одноклеточного организма. Некоторые виды имеют длину 5 миллиметров. Они могут достигать таких размеров, имея много ядер в своей единственной клетке. Узнайте больше об Amoeba в Micscape article Амебы — это больше, чем просто «кляксы». Известно, что амебы не имеют какого-либо полового способа размножения. Они только размножаются делением клеток.
Солнечные анималисты: или Heliozoa, тип Actinopoda (=лученогие) имеют аксоподии, длинные жесткие выступы цитоплазмы. Они не могут так много передвигаться с ними, но они отлично подходят для поимки добычи. Добыча, как правило, мелкие простейшие,
прилипает к аксоподам и покрывается потоком цитоплазмы, идущим по аксоподам и транспортируемым к
клетка Иногда можно встретить Heliozoa, питающихся той же добычей. На этом изображении 2 особи вида Actinophrys sol.
лакомятся диатомовыми водорослями.
Они не могут так много передвигаться с ними, но они отлично подходят для поимки добычи. Добыча, как правило, мелкие простейшие,
прилипает к аксоподам и покрывается потоком цитоплазмы, идущим по аксоподам и транспортируемым к
клетка Иногда можно встретить Heliozoa, питающихся той же добычей. На этом изображении 2 особи вида Actinophrys sol.
лакомятся диатомовыми водорослями.
Некоторые амебы образуют панцирь из найденного материала, который они склеивают, образуя защитное покрытие. Часто песчинки или другие частицы используются для укрепления конструкции, называемой «тестом». Вы можете видеть, как эта панцирная амеба висит в его тест поддерживает контакт с помощью тонких ложноножек. Длинные ложноножки вытягиваются для захвата добычи.
 Некоторые инфузории очень маленькие, ненамного крупнее самых крупных бактерий. Другим нравится
«трубчатый анималистик» Stentor может достигать размера двух миллиметров, поэтому его можно увидеть невооруженным глазом. Парамеций не становится намного больше 0,3 мм.
Некоторые инфузории очень маленькие, ненамного крупнее самых крупных бактерий. Другим нравится
«трубчатый анималистик» Stentor может достигать размера двух миллиметров, поэтому его можно увидеть невооруженным глазом. Парамеций не становится намного больше 0,3 мм. Над центром организма вы видите отверстие для кормления. Реснички создают ток, чтобы сметать бактерии и другие частицы пищи. В основании кормового отверстия пища заключена в вакуоли. Пищевые вакуоли служат для транспортировки пищи по клетке. Звездообразные сократительные вакуоли или пузырьки, выделяющие воду, используются для балансировки количества воды в клетке. Два ядра несут генетическую информацию.
Почему реснички? : Когда размер вашего тела меньше миллиметра, вода действует как густой сироп, поэтому плавает, как
рыба не была бы эффективным средством передвижения. Если вы хотите плавать быстро и маневренно, вам нужны реснички,
крошечные волоски, действующие как весла. Большинство инфузорий превосходно плавают, некоторые виды настолько быстры, что их едва видно
при наблюдении.
В многоклеточных организмах многие клетки специализированы (дифференцированы). Различные типы клеток способны выполнять все виды задач (т.е. действуют как нервные клетки, мышечные клетки, клетки крови и т. д.). Одноклеточные организмы обладают органеллами, особыми структурами внутри или на клетке, которые помогают выполнять всевозможные задачи. Такими органеллами являются пищевые вакуоли и везикулы, выделяющие воду. У многих инфузорий развились всевозможные особые органеллы. Paramecium использует так называемые трихоцисты; крошечные заостренные нити, которыми можно выстрелить в хищника, когда ему угрожают.
Мионемы : Это волокна, которые действуют как мышцы. Мы можем видеть их в стеблях анималистических колокольчиков, таких как
Вортицелла и Карчесиум. Они способны сокращать стебель с исключительной скоростью. На правом изображении
мионемы видны в виде светлых волнистых полос внутри стеблей. У многих инфузорий можно увидеть сросшиеся реснички. Группы
реснички сливаются в пластинчатые мембранеллы. В виде волнистых листов они заметают частицы пищи. Их можно увидеть в
колокольчики. У других инфузорий есть толстые круглые пучки ресничек, называемые цирри, которые действуют как ноги и позволяют организму фактически ходить по поверхности. Для независимой координации этих усиков у них есть нервоподобные органеллы, называемые нейрофибриллами. На верхнем изображении Euplotes и Stylonychia показаны оба типа ресничек.
В виде волнистых листов они заметают частицы пищи. Их можно увидеть в
колокольчики. У других инфузорий есть толстые круглые пучки ресничек, называемые цирри, которые действуют как ноги и позволяют организму фактически ходить по поверхности. Для независимой координации этих усиков у них есть нервоподобные органеллы, называемые нейрофибриллами. На верхнем изображении Euplotes и Stylonychia показаны оба типа ресничек.
Трубач Stentor — одна из самых крупных инфузорий. В расширенном виде они могут быть 2 миллиметра в длину и едва заметны. невооруженным глазом. Эти зеленые Stentors демонстрируют хитрый трюк, который используют некоторые другие мелкие организмы. Они зеленые, потому что они используют симбиотические зеленые водоросли под названием хлорелла. На странице о зеленых водорослях эти водоросли будут показаны крупным планом.
Инфузории обычно размножаются бесполым путем делением. Клетка делится на две особи. Здесь мы видим, как Paramecium подвергается делению. Время от времени мы также можем столкнуться с процессом, который называется конъюгацией. Эти две инфузории
рода Spirostomum цепляются друг за друга бок о бок и сливаются вместе. В сложном процессе они обмениваются
генетический материал из их ядер. После конъюгации потомства нет, особи «обновились».
вместо этого сами. У большинства животных, даже у человека, есть реснички, похожие на реснички инфузорий. Эти реснички используются внутрь
наше тело, например, для транспортировки частиц пищи или другого материала.
Эти две инфузории
рода Spirostomum цепляются друг за друга бок о бок и сливаются вместе. В сложном процессе они обмениваются
генетический материал из их ядер. После конъюгации потомства нет, особи «обновились».
вместо этого сами. У большинства животных, даже у человека, есть реснички, похожие на реснички инфузорий. Эти реснички используются внутрь
наше тело, например, для транспортировки частиц пищи или другого материала.
Сделайте свой собственный сенокос : Не так уж сложно вырастить Paramecium или других простейших с помощью сена. Просто
кипятите немного сухой травы в течение 15 или более минут. Налейте воду в миску. Подождите несколько дней, пока слой бактерий
начинает развиваться на поверхности. Затем добавьте несколько экземпляров, которые вы собрали из прудовой воды (стереомикроскоп всегда очень полезен для их сортировки). Но вы также можете поставить миску с водой за окном (не под прямыми солнечными лучами) и просто ждать, что принесет ветер. Многие покоящиеся споры микроорганизмов переносятся ветром.
Каких ракообразных можно найти в пресной воде? : Существуют три основные группы микроскопических ракообразных, с которыми вы можете столкнуться, глядя на каплю воды в пруду: водяные блохи, остракоды и веслоногие ракообразные. Самый знакомый являются водяные блохи. Это самые многочисленные организмы в пресноводном зоопланктоне. Их можно увидеть невооруженным глазом, потому что некоторые виды могут достигать размера почти шести миллиметров. С хорошим ручным объективом можно наблюдать много интересных особенностей.
Одной из наиболее очевидных особенностей являются большие антенны. Они используют их для передвижения. Над усиками видны большие глаза. Он выглядит как один глаз, но состоит из двух сложных глаз, сросшихся вместе. Внутри двустворчатой защитной оболочки, называемой панцирем, находится ряд из пяти или шести пар ножек, которые они используют для фильтрации пищи (мелких водорослей).
пищу можно рассматривать как желто-коричневое вещество. Слева от кишки видны яйца. Узнайте больше о водяных блохах
в статье Micscape Анатомия водяной блохи! Маленькое сердце легко заметить, когда вы исследуете живой образец под
микроскоп. С помощью карандаша и секундомера можно посчитать темпы сердечных сокращений. Просто коснитесь карандашом кусочка
бумаги в темпе сердца дафнии в течение одной минуты.
Они используют их для передвижения. Над усиками видны большие глаза. Он выглядит как один глаз, но состоит из двух сложных глаз, сросшихся вместе. Внутри двустворчатой защитной оболочки, называемой панцирем, находится ряд из пяти или шести пар ножек, которые они используют для фильтрации пищи (мелких водорослей).
пищу можно рассматривать как желто-коричневое вещество. Слева от кишки видны яйца. Узнайте больше о водяных блохах
в статье Micscape Анатомия водяной блохи! Маленькое сердце легко заметить, когда вы исследуете живой образец под
микроскоп. С помощью карандаша и секундомера можно посчитать темпы сердечных сокращений. Просто коснитесь карандашом кусочка
бумаги в темпе сердца дафнии в течение одной минуты.
Остракоды (см. верхнее изображение) — очень интересные маленькие ракообразные. Их панцирь еще более защитный, чем у
водяные блохи. Они могут полностью сомкнуть две половинки и уйти в нее. Их панцири настолько прочны, что хорошо окаменевают. Их окаменелости очень важны при изучении слоев древней земли. Доисторические слои земли могут быть
датируется определением вида, населявшего этот слой.
Доисторические слои земли могут быть
датируется определением вида, населявшего этот слой.
Последняя группа микроскопических ракообразных, изображенных здесь, — веслоногие. Их тело не имеет панцирного вида, а более тонкое и сегментированное. В пресной воде их не так много, как дафний, но в океане их можно найти в астрономических числах. Мы можем даже считать их самыми многочисленными животными на планете. Они есть основной источник пищи для рыб и даже китов.
 Существуют две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В пресной воде
большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу.
Существуют две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В пресной воде
большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу. Где можно найти диатомовые водоросли? : В конце зимы наиболее многочисленны в пресной воде. Ими покроют поверхности водных растений или столбы и деревянные бордюры прудов. Если вам нравится изучать их, вы можете очистить коричневый роста с помощью плоского куска пластика. Вы также можете использовать губку. Для свободноживущих (планктона) видов предусмотрен специальный штраф. сетка для планктона очень полезна.
Многие виды диома остаются связанными после деления клеток. Образуют колонии, длинные цепочки. Иногда соединяются только кончики и они образуют зигзагообразный узор. Клетки диатомовых водорослей — идеальные объекты для изучения под микроскопом. Они
имеют сложные узоры из очень тонких точек и часто имеют всевозможные орнаменты. Лучший способ сделать видимыми красивые структуры панциря — удалить содержимое из клетки. Для этого можно использовать перекись водорода. Но это
также можно найти пустые панцири мертвых диатомовых водорослей. Чрезвычайно тонкие поры в панцире некоторых видов диатомовых водорослей используются для проверки разрешающей способности линз микроскопа.
Для этого можно использовать перекись водорода. Но это
также можно найти пустые панцири мертвых диатомовых водорослей. Чрезвычайно тонкие поры в панцире некоторых видов диатомовых водорослей используются для проверки разрешающей способности линз микроскопа.
Передвижение диатомовых водорослей : Пеннатные диатомеи, появившиеся позднее в истории Земли, способны передвигаться в
медленная скользящая мода в направлении длины клетки. Механизм этого еще недостаточно изучен, но
кажется, что через щель рядом с клеткой (швом) выпячиваются крошечные микрофибриллы. С ними они могут передвигаться
поверхность. На снимке очищенной диатомей над швом видна тонкая центральная горизонтальная линия. Там
представляют собой две разные группы диатомовых водорослей: перистые, имеющие форму пера, и центрические, похожие на цилиндр. В
в пресной воде большинство диатомовых водорослей, которые вы увидите, относятся к пеннатному типу. В морских водах большое разнообразие форм тела.
больше. В океане они составляют основную часть фитопланктона — фотосинтезирующих организмов, плавающих вместе с водой. Текущий. На этом изображении показан вид сверху на крупного косцинодиска, морского вида, которого можно просто увидеть с помощью
невооруженным глазом. Хорошо видна тонкая сетчатая структура кремнистой клеточной стенки. Желто-коричневые хлоропласты
используемые для фотосинтеза, также легко увидеть.
Текущий. На этом изображении показан вид сверху на крупного косцинодиска, морского вида, которого можно просто увидеть с помощью
невооруженным глазом. Хорошо видна тонкая сетчатая структура кремнистой клеточной стенки. Желто-коричневые хлоропласты
используемые для фотосинтеза, также легко увидеть.

Что такое жгутики? : Жгутик, также называемый ундулиподием, представляет собой хлыстообразную структуру, используемую для передвижения, для кормления или других целей. Почти у всех организмов есть жгутики (на каком-то этапе их жизни). У нас, людей, они есть в наших телах. Даже наши собственные сперматозоиды можно считать жгутиконосцами. Все эти жгутики имеют сходную базовую конструкцию.
Только бактерии имеют жгутики совершенно другого типа. Реснички инфузорий — это просто более короткие версии, которые действуют другой. Ресничка бьется, как маленькая педаль, и создает боковое движение. Большинство ундулиподий действуют скорее как пропеллерные, волнообразные движения толкают или тянут организм в переднем направлении.
Одно ядро содержит генетический материал. Ярко-зеленые хлоропласты преобразуют свет в энергию. Энергия хранится в зернохранилище. Длинный гибкий ундулиподий, используемый для передвижения. У основания жгутика находим круглую сократительную вакуоль. Он помогает организмам удалять избыток воды. Поскольку живая ткань засолена, организмы, живущие в пресной воде, поглощают воду. Хорошо видно красное пятно. На самом деле настоящим светочувствительным органом является припухлость у основания
жгутик. Красная область обеспечивает обнаружение света только с одного направления. Так как светочувствительный орган
непосредственно связанная со жгутиком, эвглена прекрасно умеет плыть к источнику света.
Он помогает организмам удалять избыток воды. Поскольку живая ткань засолена, организмы, живущие в пресной воде, поглощают воду. Хорошо видно красное пятно. На самом деле настоящим светочувствительным органом является припухлость у основания
жгутик. Красная область обеспечивает обнаружение света только с одного направления. Так как светочувствительный орган
непосредственно связанная со жгутиком, эвглена прекрасно умеет плыть к источнику света.
Интересным жгутиковым протистом для изучения является Euglena. Здесь показаны некоторые из его многочисленных функций. Эвглена может стать настолько многочисленной, что вода в пруду может стать ярко-зеленой. Помимо использования своего ундулиподия, эвглениды также могут передвигаться, сгибая свое тело и изменяя форму тела, так называемое эвгленоидное движение. Эвглениды обладают способностью терять свои хлоропласты. Если вы будете держать эвгленид в темноте, они начнут питаться органическими веществами и могут потерять свой пигмент. Есть много видов без хлоропластов.
Большинство жгутиковых простейших имеют два или даже больше жгутиков. Часто мы видим, как один жгутик тянется сзади, как своего рода руль. Жгутики и реснички прозрачные и тонкие, поэтому их нелегко увидеть под микроскопом. Специальные контрастные методы, такие как освещение темным полем или фазовый контраст, помогают сделать эти структуры видимыми. Динофлагелляты (Dinophyta) — жгутиковые протисты. Многие виды имеют красивый фактурный панцирь из пластин целлюлозы. Один из их два жгутика проходят по спирали через бороздку вдоль клетки. Другие проекты вниз. Эффектный вид является Ceratium hirundinella. Жгутиками для передвижения пользуются не только простейшие. Даже наши собственные сперматозоиды имеют жгутик. Не все жгутиковые формы свободно плавают. Многие ведут сидячий образ жизни. Spongomonas — колония жгутиконосцев, живущих в студенистой матрице. они используют свои жгутики для сбора пищи.
Создайте свою собственную культуру Euglena : Сравнительно легко создать так называемую «земную культуру» для нескольких видов фотосинтезирующих простейших и водорослей, включая Euglena.

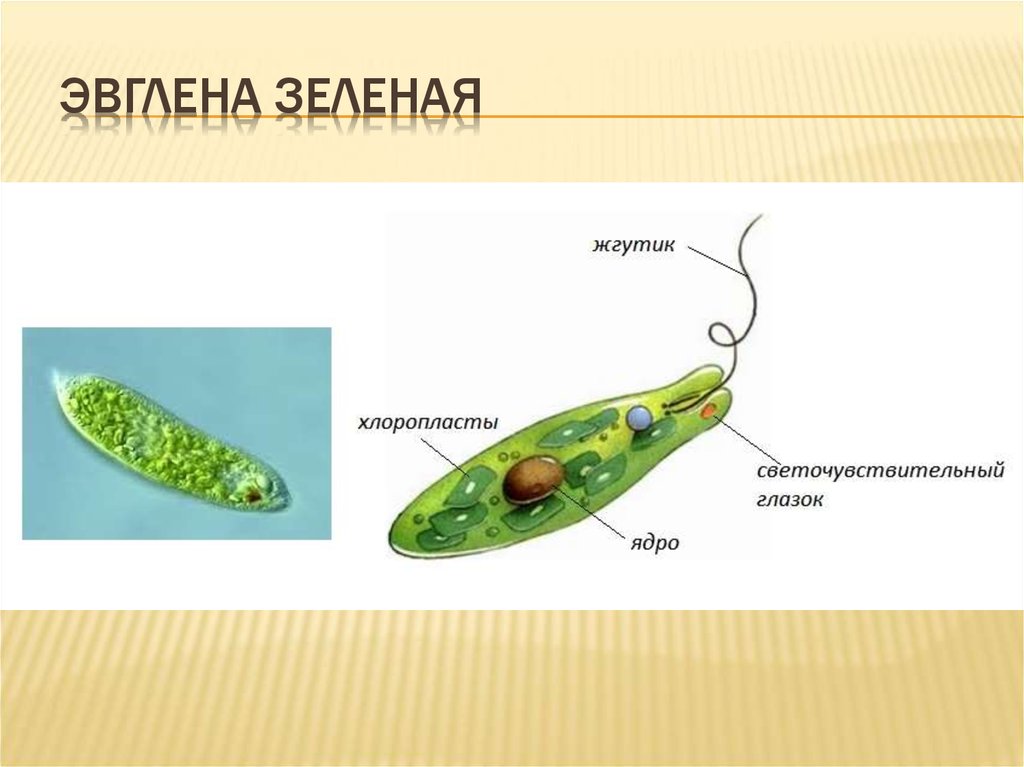
 Хедер, Кай Грибенов, Ориентация зеленых жгутиковых, Euglena gracilis , в вертикальном столбе воды, FEMS Microbiology Ecology , Volume 4, Issue 3-4, May 1988, Pages 159–167, https://doi .org/10.1111/j.1574-6968.1988.tb02660.x
Хедер, Кай Грибенов, Ориентация зеленых жгутиковых, Euglena gracilis , в вертикальном столбе воды, FEMS Microbiology Ecology , Volume 4, Issue 3-4, May 1988, Pages 159–167, https://doi .org/10.1111/j.1574-6968.1988.tb02660.x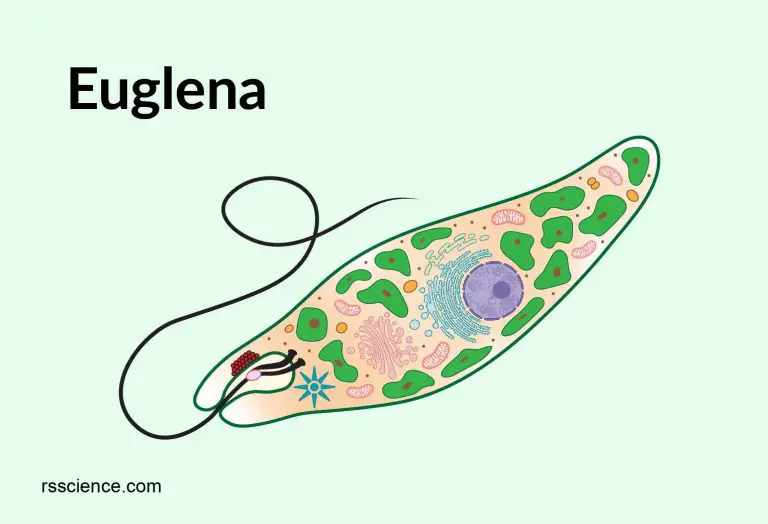 Электронный адрес:
Электронный адрес: