Вольвокс строение, фото
Вольвокс — зеленая водоросль. В водоемах можно встретить организмы шаровидной формы, которые растут в виде колоний. Это вольвокс, который ученые относят и к растениям, и к животным.
Этот живой организм имеет способности к гетеротрофному и автотрофному питанию. Подобные свойства появились у вольвокса из-за того, что он является переходной формой между многоклеточными и одноклеточными растениями и животными.
Организм относится к одноклеточным простейшим, которые способны создавать колонии. Внутри вольвокс соединены цитоплазматическими мостиками. Размер одной колонии достигает 2-3 миллиметров.
Колония шаровидной формы имеет внутри от 70 тыс. до 75 тыс. клеток. Они расположены в один слой по периферии, а полость заполнена слизью студневидного характера. Каждая клетка обладает двумя жгутиками, а сзади расположен пристеночный хроматофор.
Соединение клеток происходит благодаря протопластам, которые связываются тонкими нитями.
Для колонии вольвокс характерно два вида размножения:
- Половой
- Бесполый.
Для первого способа – полового – характерно следующее: Происходит образование оогониев и антеридиев, которые могут развиваться в нескольких шарах или в одном из них. Оогонии состоят из 8-10 клеток, которые отличаются большими размерами, способствуют образованию одной неподвижной яйцеклетки.
Антеридии формируют множество двужгутиковых сперматозоидов.
Когда происходит разрыв оболочки антеридия, то сперматозоиды направляются к оогонию, проникают туда, и порисходит оплодотворение яйцеклетки.
Зигота находится некоторое время в состоянии покоя, покрываясь постепенно толстой оболочкой и заполняясь необходимыми питательными элементами.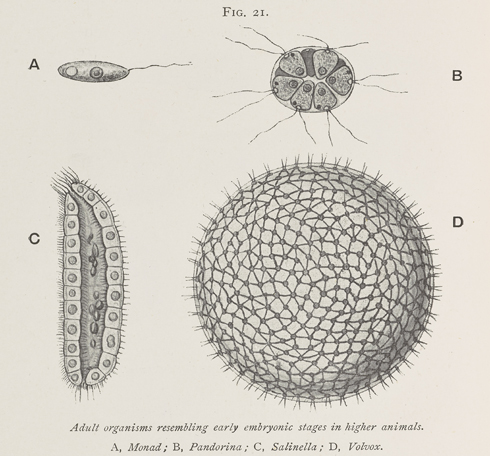
После зимы начинается деление зиготы. Клетки, которые образуются в результате этого процесса, создают шар полого типа, а потом постепенно выходят наружу. В бесполом размножении принимают участие клетки, которые еще сохраняют способность делиться. Они создают пластинки клеток, которые при достижении нужных размеров, загибаются в чашеобразную форму.
Потом происходит выворачивание формы наизнанку, смыкаясь в полый шар. Он проваливается в центральную часть материнской колонии. В результате этого процесса происходит создание от 8 до 15 новых колоний. На периферических клетках формируются жгутики. Выход наружу происходит, когда молодые колонии достигают полного созревания. При этом материнская колония гибнет.
- Жгутики клеток ищут минеральные вещества в окружающей среде
- Важное значение для развития и размножения играют нитраты и фосфаты, которые присутствуют в озерах и реках
- Вольвокс потребляют в пищу бактерии, органику и растения, из которых они «готовят» пищу в процессе фотосинтеза.
 Колонии вольвокс перемещаются, за этот процесс ответственными являются периферийные клетки.
Колонии вольвокс перемещаются, за этот процесс ответственными являются периферийные клетки. - Движение происходит туда, где колония видит свет.
Для ученых вольвокс является интересным организмом, который изучают уже много лет. Исследования позволяют увидеть процесс, вызвавший переход одноклеточных организмов к многоклеточных. Вольвокс сохраняет черты и тех, и других организмов, что прослеживается в способе питания, размножении, росте клеток.
Вольвокс шаровидный питание. Блог, факты, фото
Содержание статьи:
Фото Вольвокс строение, фото Видео Похожие статьи
Питание. Эвглена способна менять характер питания в зависимости от условий среды. На свету, благодаря способности к фотосинтезу, ей свойственно автотрофное питание — синтез органических веществ из неорганических. Вольвокс (Volvox globator) – пресноводная планктонная колония жгутиконосцев, клетки колонии называются зооидами (рис. 2В). Различают вегетативные и генеративные зооиды, те и другие – гаплоидные. Колония имеет шаровидную форму.
2В). Различают вегетативные и генеративные зооиды, те и другие – гаплоидные. Колония имеет шаровидную форму.
Вольвоксы – род Volvox (тип Саркомастигофоры, класс Жгутиковые, подкласс Растительные жгутиковые) это несколько видов колониальных жгутиковых одноклеточных, которые подобно Эвглене зеленой относятся одновременно и к царству Животные, и к царству Растения (ботаники изучают их как представителей отдела Зеленые водоросли). Вольвоксы обитают в летнее время в воде прудов, озер, самые обычные представители гидробионтов. Строение.
Кроме того, вольвокс является переходной ступенью между простейшими организмами и многоклеточными. У вольвокса чередуется половое и бесполое размножение. Половое размножение происходит путем слияния макрогаметы и микрогаметы с образованием зиготы. Перед этим происходит преобразование клеток вольвокса в макрогаметы и микрогаметы. Зигота развивается в центре колонии вольвокса и образует новую колонию.
Подписи к рисунку выполняются ручкой.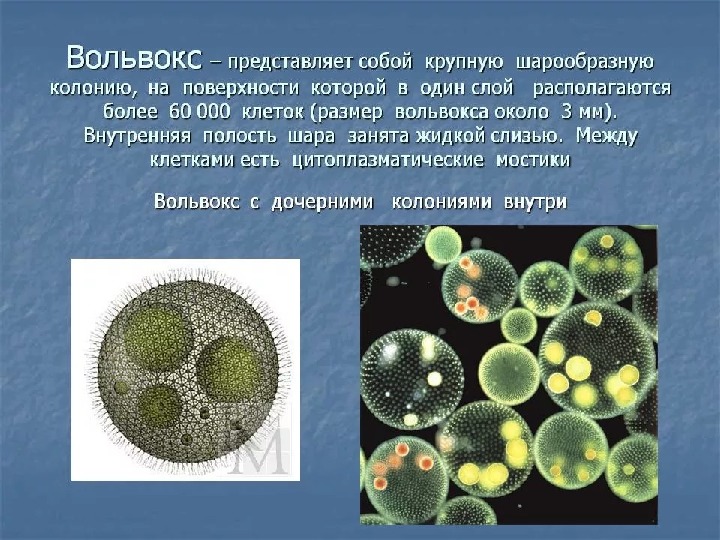 Ориентировка животного при движении у некоторых жгутиконосцев, например, у эвглены зеленой, совершается при помощи особых аппаратов, служащих для восприятия световых ощущений. У некоторых видов у основания жгутиков имеется клеточный рот, а в цитоплазме образуются пищеварительные вакуоли. Я почему-то ее не вижу, дифференцированные клетки есть в обоих случаях, единая организация тоже присутствует.
Ориентировка животного при движении у некоторых жгутиконосцев, например, у эвглены зеленой, совершается при помощи особых аппаратов, служащих для восприятия световых ощущений. У некоторых видов у основания жгутиков имеется клеточный рот, а в цитоплазме образуются пищеварительные вакуоли. Я почему-то ее не вижу, дифференцированные клетки есть в обоих случаях, единая организация тоже присутствует.
Почему вольвокс относят к одноклеточным организмам? Строение водоросли вольвокс
Изучить систематическое положение, образ жизни, строение тела, размножение, значение в природе и для человека Амебы обыкновенной, Эвглены зеленой, Вольвокса, Инфузории туфельки. Следует выполнить конспект в тетради. Рассмотреть под микроскопом, найти и отметить главные составные части тела Амебы обыкновенной, Эвглены зеленой, Вольвокса, Инфузории туфельки. В работе используются готовые микропрепараты животных. В альбоме зарисовать и обозначить строение тела Амебы обыкновенной, Эвглены зеленой, Вольвокса, Инфузории туфельки.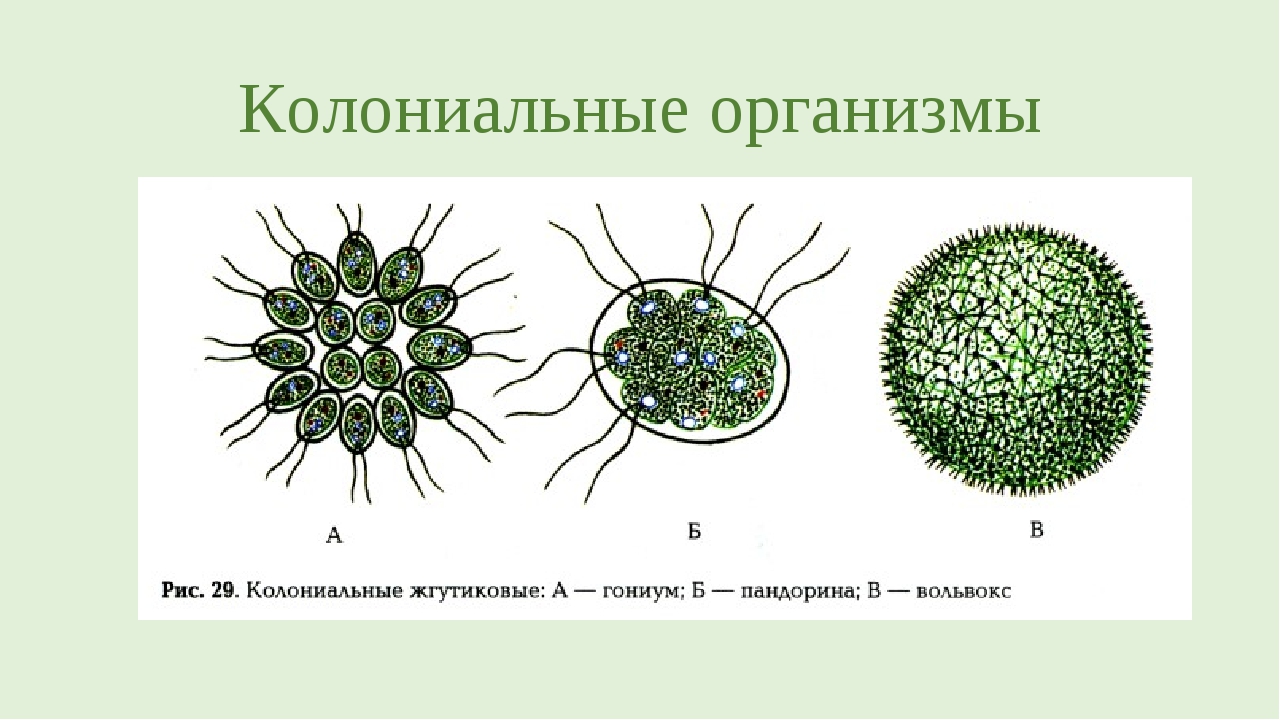
Рисунок выполняется простым карандашом, возможна растушевка цветными карандашами. Подписи к рисунку выполняются ручкой. Во всех случаях перед рисунком требуется записывать систематическое положение изображенного животного. Систематическое положение это полное название биологического вида изучаемого животного, его принадлежность к отряду, классу, типу. Следует выполнить рисунки, обозначенные в печатной методичке V красной галочкой , а в данной электронной методичке эти рисунки помещены в конце всего текста стр.
Изучить систематическое положение, образ жизни и болезни, вызываемые Амебой дизентерийной, Трипаносомами, Лейшманиями, Трихомонадами, Лямблией, Балантидием. Выполнить конспект в тетради. Выучить систематическое положение и подробный цикл развития Плазмодия малярийного и кокцидии из рода Эймерия. В альбоме зарисовать схему цикла развития жизненного цикла Плазмодия малярийного и кокцидии Эймерия магна. Общая характеристика подцарства Одноклеточные.
Систематическое положение, образ жизни, строение тела, размножение, значение в природе и для человека Амебы обыкновенной, Эвглены зеленой, Вольвокса, Инфузории туфельки.
Систематическое положение, образ жизни и болезни, вызываемые Амебой дизентерийной, Трипаносомами, Лейшманиями, Трихомонадами, Лямблией, Балантидием, меры профилактики этих болезней. Систематическое положение и цикл развития Плазмодия малярийного и кокцидии из рода Эймерия, меры профилактики малярии и кокцидиоза.
В подцарстве Одноклеточные выделяют пять типов животных: Свободноживущие виды встречаются среди представителей типов Саркомастигофоры и Инфузории. Амеба обыкновенная — вид Amoeba proteus тип Саркомастигофоры, класс Саркодовые обитает в воде в прудах, канавах с илистым дном. Похожа эта Амеба на крошечную капельку киселя, которая постоянно изменяет форму своего тела. Размеры ее тела достигают 0,2 — 0,7 мм. Тело Амебы покрыто цитоплазматической мембраной , за которой идет слой прозрачной плотной эктоплазмы.
Далее располагается полужидкая эндоплазма , составляющая основную массу амебы. В цитоплазме есть ядро. Цитоплазма находится в непрерывном движении, в результате которого возникают цитоплазматические выросты — псевдоподии , или ложноножки.
Амеба охватывает пищевые частицы бактерии, водоросли ложноножками и втягивает их внутрь тела. Вокруг бактерий образуются пищеварительные вакуоли. В них благодаря ферментам происходит переваривание пищи.
Вакуоли с не переваренными остатками подходят к поверхности тела, и эти остатки выбрасываются наружу. Жидкие продукты жизнедеятельности выделяются через сократительную , или иначе пульсирующую вакуоль. Вода из окружающей среды постоянно поступает в тело Амебы осмотически через наружную мембрану.
Дикая планета. ASTKRAS.RU
Вольвокс одноклеточный или многоклеточный
Организм
относится к одноклеточным простейшим,
которые способны создавать колонии.
Внутри вольвокс соединены цитоплазматическими
мостиками. Размер одной колонии достигает
2-3 миллиметров.
Размер одной колонии достигает
2-3 миллиметров.
Строение вольвокс
Колония шаровидной формы имеет внутри от 70 тыс. до 75 тыс. клеток. Они расположены в один слой по периферии, а полость заполнена слизью студневидного характера. Каждая клетка обладает двумя жгутиками, а сзади расположен пристеночный хроматофор.
Соединение клеток происходит благодаря протопластам, которые связываются тонкими нитями. Клетки похожи на хламидомонады, имеющие округлые формы. Большинство клеток внутри колонии вольвокса являются вегетативными и питающимися. И только 7-10 клеток имеют способность к размножению.
Размножение и жизненный цикл вольвокса
Для колонии вольвокс характерно два вида размножения:
Половой
Бесполый.
Для
первого способа – полового – характерно
следующее: Происходит образование
оогониев и антеридиев, которые могут
развиваться в нескольких шарах или в
одном из них. Оогонии состоят из 8-10
клеток, которые отличаются большими
размерами, способствуют образованию
одной неподвижной яйцеклетки.
Оогонии состоят из 8-10
клеток, которые отличаются большими
размерами, способствуют образованию
одной неподвижной яйцеклетки.
Антеридии формируют множество двужгутиковых сперматозоидов. Когда происходит разрыв оболочки антеридия, то сперматозоиды направляются к оогонию, проникают туда, и порисходит оплодотворение яйцеклетки. Зигота находится некоторое время в состоянии покоя, покрываясь постепенно толстой оболочкой и заполняясь необходимыми питательными элементами.
После зимы начинается деление зиготы. Клетки, которые образуются в результате этого процесса, создают шар полого типа, а потом постепенно выходят наружу. В бесполом размножении принимают участие клетки, которые еще сохраняют способность делиться. Они создают пластинки клеток, которые при достижении нужных размеров, загибаются в чашеобразную форму.
Потом
происходит выворачивание формы наизнанку,
смыкаясь в полый шар. Он проваливается
в центральную часть материнской колонии. В результате этого процесса происходит
создание от 8 до 15 новых колоний. На
периферических клетках формируются
жгутики. Выход наружу происходит, когда
молодые колонии достигают полного
созревания. При этом материнская колония
гибнет.
В результате этого процесса происходит
создание от 8 до 15 новых колоний. На
периферических клетках формируются
жгутики. Выход наружу происходит, когда
молодые колонии достигают полного
созревания. При этом материнская колония
гибнет.
Интересные факты
Жгутики клеток ищут минеральные вещества в окружающей среде
Важное значение для развития и размножения играют нитраты и фосфаты, которые присутствуют в озерах и реках
Вольвокс потребляют в пищу бактерии, органику и растения, из которых они «готовят» пищу в процессе фотосинтеза. Колонии вольвокс перемещаются, за этот процесс ответственными являются периферийные клетки.
Движение происходит туда, где колония видит свет.
Вольвокс
– род колониальных растений из
отдела зеленых
водорослей.
В настоящее время изучено около 20 видов
данного рода. Эти подвижные колониальные
организмы распространены в пресных
водоемах со стоячей водой.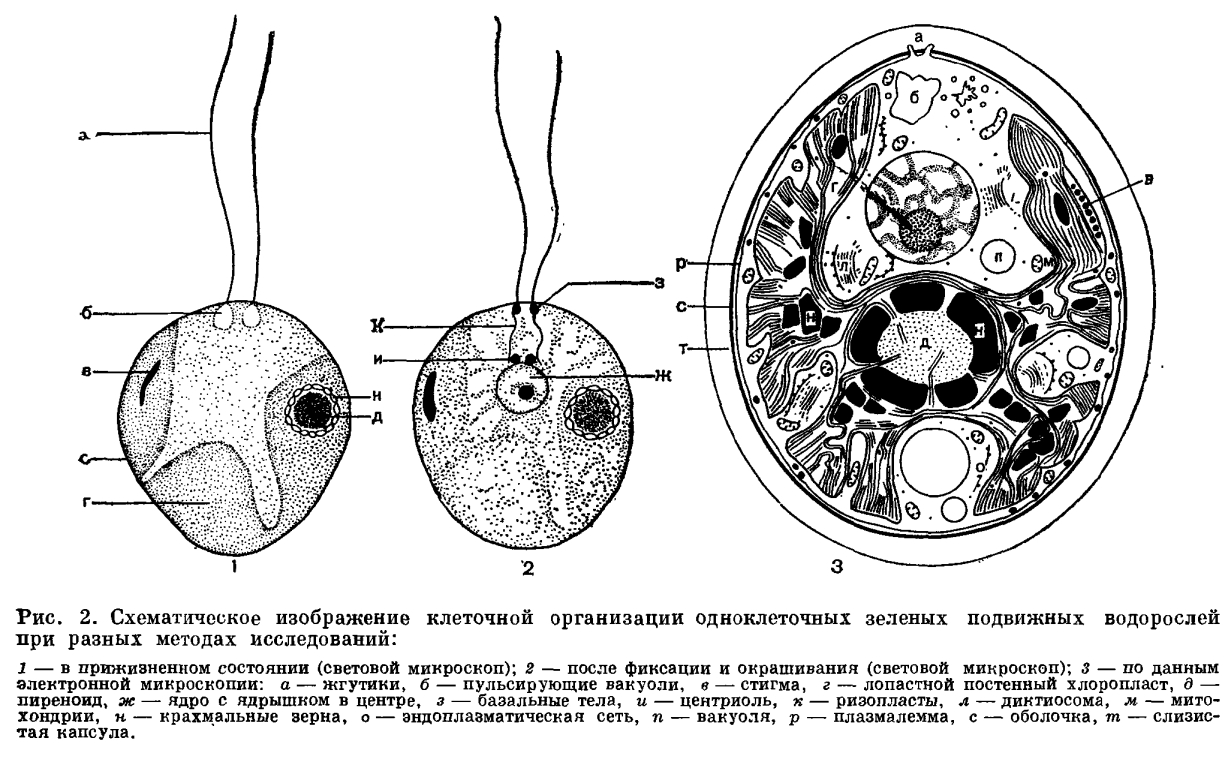 В период
массового размножения окрашивают воду
в зеленый цвет. Появляется так называемое
«цветение» воды.
В период
массового размножения окрашивают воду
в зеленый цвет. Появляется так называемое
«цветение» воды.
Строение. Колония вольвокса выглядит как небольшой подвижный зеленый шар (до 2-3 мм в диаметре). Каждая колония объединяет от сотен до десятков тысяч клеток вольвокса, расположенных на поверхности шара. Между собой клетки соединены особыми протоплазматическими нитями. Внутренняя полость сферы заполнена жидким слизистым веществом. Клетки вольвокса по строению сходны с хламидомонадой. Парные жгутики каждой клетки обращены кнаружи.
Размножение вольвокса осуществляется
как бесполым, так и половым путем. На
уровне колонии вольвокса отмечается
специализация клеток. Основная масса
клеток – вегетативные. Между ними
находятся крупные генеративные клетки,
участвующие в размножении. В оогониях
образуются яйцеклетки, в антеридиях –
сперматозоиды. После слияния гамет
формируется зигота – ооспора. Прорастание
ооспоры наблюдается в весенний период. В жизненном цикле вольвокса только у
зиготы имеется двойной набор хромосом,
вегетативные клетки гаплоидны.
В жизненном цикле вольвокса только у
зиготы имеется двойной набор хромосом,
вегетативные клетки гаплоидны.
В бесполом размножении участвуют особые клетки партеногонидии. Деление данных клеток осуществляется перпендикулярно к поверхности шара, в результате чего появляется дочерний шар.
Изучение вольвокса позволяет сделать научное предположение о том, что в процессе эволюции развитие живых организмов от одноклеточных к многоклеточным происходило через формирование колониальных форм. Эти растения вызывают большой интерес ученых как типичный пример колониальных форм среди водорослей.
2. Видоизменения листьев.
Колючки
Это видоизменение характерно для растений, обитающих в сухом и жарком климате, хотя нередко они возникают и у растений других климатических зон. Колючки уменьшают транспирацию и защищают растения от поедания животными.
Метаморфоз
всего листа в колючку характерен для
кактусов. У многих астрагалов, эспарцетов
в колючку превращается рахис сложного
листа, у белой акации — прилистники.
У многих астрагалов, эспарцетов
в колючку превращается рахис сложного
листа, у белой акации — прилистники.
Есть растения, у которых листья видоизменены в усики. Этими усиками растение цепляется за опору и удерживается в вертикальном положении. Примером растениями с усиками являются горох, чина, вика и другие бобовые. У гороха в усики превращены верхние части листьев.
Это нитевидные образования, чувствительные к прикосновению и приспособленные для лазания. У вики, чечевицы, гороха в усик преобразуются верхняя часть рахиса и несколько верхних листочков. У чины безлистной все листочки редуцируются, а рахис представляет собой единственный усик (функцию фотосинтеза берут на себя прилистники.
Ловчие аппараты
Встречаются
у растений, произрастающих на болотистых,
торфяных, бедных минеральными веществами
почвах. При помощи ловчих аппаратов
росянка в средней полосе, венерина
мухоловка в Северной Америке, непентес
в тропической Азии используют богатую
азотом и фосфором органическую пищу,
переваривая животных. Строение ловчих
аппаратов различно (кувшинчики непентесов,
ловушки венериной мухоловки, листья
росянки), но все они способны улавливать
и переваривать насекомых и других мелких
животных с помощью ферментов, выделяемых
особыми пищеварительными железками.
Строение ловчих
аппаратов различно (кувшинчики непентесов,
ловушки венериной мухоловки, листья
росянки), но все они способны улавливать
и переваривать насекомых и других мелких
животных с помощью ферментов, выделяемых
особыми пищеварительными железками.
Главными функциями листьев можно назвать фотосинтез и испарение воды. Чтобы выполнять эти функции наиболее эффективно, лист должен иметь форму пластинки, т. е. обладать большой поверхностью и быть тонким. Таковыми и являются листья большинства растений. Однако у некоторых растений листья в процессе эволюции видоизменились (претерпели изменения) и стали непохожими на обычные листья. Причина данного явления заключается в том, что листья начали выполнять другие функции, не связанные с фотосинтезом и испарением.
Листья
ряда растений засушливых мест обитания
видоизменились в колючки.
Такие листья, с одной стороны, почти не
испаряют воду, с другой стороны, защищают
растения от поедания животными. Примером
растений пустынных мест с колючками
являются различные кактусы. Фотосинтез
у них протекает в расположенных ближе
к поверхности клетках толстого стебля.
Также в стебле запасается вода. Таким
образом, видоизмененные в колючки листья
утратили обе свои главные функции
(фотосинтез и испарение), но в замен
стали выполнять защитную функцию.
Примером
растений пустынных мест с колючками
являются различные кактусы. Фотосинтез
у них протекает в расположенных ближе
к поверхности клетках толстого стебля.
Также в стебле запасается вода. Таким
образом, видоизмененные в колючки листья
утратили обе свои главные функции
(фотосинтез и испарение), но в замен
стали выполнять защитную функцию.
Листья-колючки можно наблюдать не только у растений пустынь и полупустынь. Колючки есть у барбариса, кустов розы, шиповника и др. Однако у этих растений не все листья видоизменены в колючки, а только некоторые. При этом функция колючек здесь такая же как у кактусов — защита от поедания животными.
Листья
других растений засушливых мест обитания
приспособились к недостатку влаги иным
способом. Так у алоэ и агавы листья
видоизменились в толстые
и сочные образования, в которых запасается
вода.
А чтобы уменьшить испарение такие листья
покрыты восковым налетом, волосками,
имеют меньше устьиц. В данном случае
листья видоизменились так, что не
утратили свои основные функции, при
этом приобрели дополнительную —
запасание воды.
В природе существуют насекомоядные растения. Их листья видоизменены в своеобразные ловчие аппараты. Когда насекомое садится на лист растения росянки, то приклеивается к нему, т. к. лист покрыт волосками, выделяющими вязкую массу. После этого волоски и сам лист сворачиваются. Внутри образовавшейся полости насекомое переваривается за счет выделяемых листом ферментов. Из насекомого росянка усваивает богатые азотом органические вещества. Именно из-за нехватки азота и других микроэлементов в местах своего обитания листья росянки приобрели столь специфическую функцию.
Еще одним видоизменением листьев являются чешуи. При этом чешуи бывают разными, т. к. выполняют различные функции. Например, у лука в луковице листья превращены в сочные чешуи, в которых откладывается запас питательных веществ. Другие чешуи покрывают почки. В этом случае они выполняют защитную функцию.
1.
Строение и цикл развития представителей
бурых водорослей на примере ламинарии.
У бурых водорослей встречаются все формы размножения: вегетативное,
бесполое и половое. Большинство бурых водорослей
встречается в виде двух самостоятельных форм развития — спорофита
и гаметофита, которые у разных видов бывают как сходного размера
и строения, так и различного. Иными словами, существуют изоморфная
и гетероморфная смены форм развития. При гетероморфной смене
форм развития одна из них бывает микроскопической, чаще всего
это гаметофит. Так происходит, в частности, именно у ламинарии,
где мы имеем дело с крупным многоклеточным спорофитом и невидимым
невооруженным глазом гаметофитом.
Размножение осуществляется спорами. Спорофиты всех ламинариевых
образуют одноклеточные одногнездные спорангии. Число
зооспор в них колеблется в зависимости от вида и от внешних условий
от 16 до 128. Образование зооспор сопровождается мейозом.
После созревания и выхода зооспор спороносные участки пластины
разрушаются. Массовое развитие спорангиев происходит
в конце
Массовое развитие спорангиев происходит
в конце
лета — начале осени. Цикл годовой активности бурых водорослей
обычно таков: весна — начало роста и развития; лето — «расцвет»;
осень — замедление развития и отмирание листовидной пластинки;
зима — покой.
Рис. 14. Цикл развития ламинарии [15].
1 — зрелый спорофит с пятном спорангиев;
2 — зооспоры;
3 — эмбриоспоры;
4 — эмбриоспоры с проростковой трубкой;
5 — гаметофиты: справа — мужской, с вышедшим из антеридия антерозоидом;
слева — одноклеточный женский после выхода яйцеклетки из оогония;
6-7 — развивающееся слоевище спорофита.
1, 6, 7 — макростадии; 2-5 ~ микростадии
Число спор у ламинарии огромно. Одно слоевище длиной 250
см и шириной 20 см может дать до 36 млн спор. Зооспоры грушевидные,
длиной 5-10 мкм, с двумя жгутиками, отходящими сбоку, и
одним хлоропластом внутри. Строение их типично для подвижных
клеток
бурых водорослей.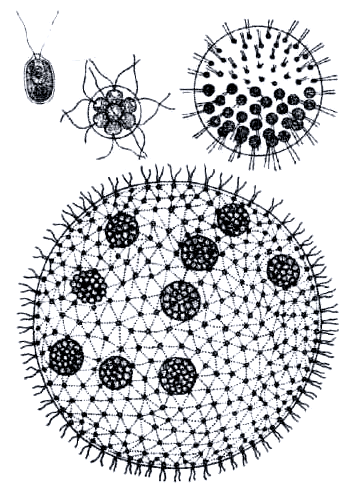 Споры рассеиваются
из зрелых талломов
Споры рассеиваются
из зрелых талломов
в окружающую воду, разносятся течениями и оседают на субстрат.
При подходящих температурных условиях зооспоры способны к
активному движению в течение 2 суток. Не найдя места для прикрепления,
они погибают. Встретив твердую поверхность, зооспора
прикрепляется к ней передним жгутиком, который сокращается и
подтягивает тело зооспоры к субстрату. Затем зооспора теряет жгутики
и округляется, у нее появляется хорошо заметная оболочка, и
она превращается в эмбриоспору [31].
В течение 1-2 суток эмбриоспора дает вырост — проростковую
трубку, куда перетекает протоплазма, отделяющаяся затем перегородкой
от опустевшей эмбриоспоры. Так образуется первая клетка
гаметофита. Затем на гаметофитах будут созревать гаплоидные половые
клетки, которые сольются в диплоидную зиготу, и уже из зиготы
вырастет зрелое растение — спорофит (рис. 14). Оболочка эмбриоспоры
еще долго сохраняется у гаметофита, даже тогда, когда
на
нем вырастает спорофит. Именно спора
является той ключевой
Именно спора
является той ключевой
стадией, от которой в конечном счете зависит урожай водорослей,
или многоклеточных спорофитов, ибо массовый выход спор крайне
важен для их успешного прикрепления (в соответствующее время)
и всего последующего развития культивируемых водорослей.
Микроскопические гаметофиты ламинариевых обычно представляют
собой однорядные разветвленные стелющиеся нити.
Мужские гаметофиты — многоклеточные, женские могут быть одноклеточными
и многоклеточными, но и многоклеточные не превышают
в диаметре 300 мкм [49]. Обычно они существуют не более
1-4 месяцев до созревания гаметангиев.
Половой процесс у ламинариевых — оогамия. Антеридри в виде
мелких бесцветных клеток группами или по одной располагаются
на поверхности вегетативных клеток. В антеридиях образуется по
одному антерозоиду, после выхода которых мужские гаметофиты
погибают. В случае многоклеточного женского гаметофита в оого-
нии обычно превращаются конечные клетки ветвей, в случае одноклеточного
—
единственные клетки [49]. На севере
гаметофиты ламинарий
На севере
гаметофиты ламинарий
зимуют на одноклеточной стадии и не растут из-за нехватки
света, в Северном море созревают в феврале, причем женские
гаметофиты остаются одноклеточными [49]. В каждом оогонии образуется
по одной яйцеклетке, которая выходит через отверстие на
вершине оогония, но не отделяется, а остается прикрепленной к
стенкам отверстия. В таком положении происходит ее оплодотворение
и рост спорофита. После выхода всех яйцеклеток гаметофит
отмирает, и на месте одного многоклеточного женского гаметофита
развивается несколько спорофитов. Женские гаметофиты не пре49
доставляют развивающимся спорофитам никаких питательных веществ,
но они обеспечивают им место на грунте. Это важно, так как
основная масса зачатков морских донных водорослей, спор и гамет
погибает из-за того, что не попадает на твердую поверхность [39].
Оплодотворенная яйцеклетка вырабатывает оболочку и начинает
расти,
образуя вначале однорядную нить из 7
клеток.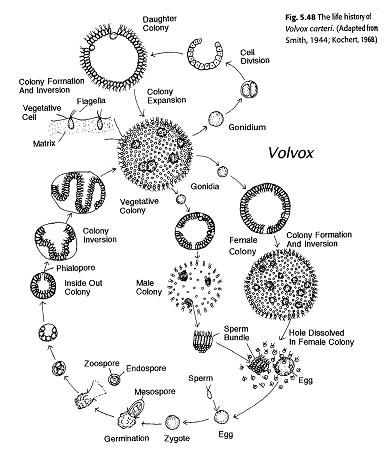 Затем,
Затем,
наряду с поперечными перегородками, появляются продольные и
образуется однослойная пластинка спорофита. Из нижних клеток
пластинки вырастают тонкие ризоиды. По мере роста пластинки
увеличивается число слоев клеток, происходит их специализация,
появляются ствол и многорядные ризоиды. На этом этапе спорофит
представляет собой хорошо знакомое нам растение. Таким образом,
важно помнить, что известные нам водоросли — это зрелые спорофиты,
макроскопическая стадия жизненного цикла ламинариевых.
Споры, гаметофиты и ювенильные спорофиты относятся к микроскопическим
стадиям, не видным невооруженным глазом.
Ламинариевым — крупным водорослям — для роста нужны условия,
при которых обеспечивалось бы поступление питательных
веществ к слоевищам. Поэтому они обычно растут в местах с сильным
течением или прибоем, в водах, обогащенных питательными
веществами.
2. Растения-паразиты.
Растения-паразиты.
презентация
1. Внешнее и внутреннее строение мохообразных.
Завоевание растениями суши произошло 420 миллионов лет назад. По-видимому, первыми организмами, заселившими сушу, стали потомки зелёных водорослей. Выход на сушу – это качественный скачок в эволюции, типичный пример аромогенеза (последовательности ароморфозов), потребовавший от растений преодолеть следующие трудности:
— Интенсивные потери воды требуют приспособления для её добычи и запасания. У наземных растений развивается кутикула – защитный восковой слой, уменьшающий испарение воды.
— Половые клетки водорослей могли оплодотворяться только в воде. В ходе эволюции у наземных растений образовались различные приспособления, помогающие решить эту проблему.
— Воздух в отличие от воды не может служить опорой растениям. Тело наземных растений должно быть сравнительно жёстким.
—
Растениям для роста и размножения
требуется свет и минеральные вещества. Часть растения должна остаться над
землёй и осуществлять фотосинтез, а
другая часть – уйти под землю, снабжая
растение водой и минеральными веществами
и удерживая его в почве.
Часть растения должна остаться над
землёй и осуществлять фотосинтез, а
другая часть – уйти под землю, снабжая
растение водой и минеральными веществами
и удерживая его в почве.
— Газообмен CO2 и O2 должен происходить не в воде, а в воздухе.
— Колебания условий окружающей среды (температура, влажность, концентрация различных веществ) более не сглаживаются водной средой.
Все эти приспособления мы можем наблюдать у современных мхов – наиболее примитивных организмов из группы высших растений. Моховидные (Bryophyta) – это отдел царства растений, объединяющий многоклеточные, просто устроенные растения, у которых отсутствует проводящая ткань (флоэма либо ксилема). Именно с последним фактом связаны небольшие размеры этих растений. Тело представителей этого отдела невелико (1–50 см) и слегка дифференцировано на условные «стебель» и «листья», хотя настоящих листьев и стеблей у них нет. Нет у мхов и корней, «стебель» прикрепляется к земле ризоидами – нитевидными выростами стебля, состоящими из одной или нескольких клеток (настоящие корни, в отличие ризоидов, содержат клетки проводящей ткани).
строение мхов |
Мхи достаточно плохо приспособлены к жизни на суше. Они растут, в основном, в сырых и затенённых местах, нередко на гниющей древесине или под водой. Мхи образуют основной растительный покров тундры и торфяных болот. Из-за почти полного отсутствия кутикулы поверхность таллома интенсивно испаряет воду; её недостаток восполняется за счёт поглощения всей поверхностью тела. Некоторые моховидные, однако, могут выдерживать продолжительные периоды засухи, используя какие-то не совсем понятные механизмы. Другие могут расти на открытых скалах.
Как и у всех высших растений, у мхов наблюдается чередование поколений. В течение одного жизненного цикла гаплоидный гаметофит в антеридиях образует сперматозоиды, которые с током воды по таллому достигают архегония и сливаются с яйцеклеткой в диплоидную зиготу. Зигота вырастает в диплоидный спорофит – поколение, размножающееся бесполым путём. В результате мейоза на спорофите появляются гаплоидные споры, из которых прорастают гаплоидные гаметофиты, и всё повторяется вновь. У мхов гаметофит является доминирующим поколением, а спорофит, развиваясь и питаясь за счёт гаметофита, полностью зависит от него. Споры образуются в споровой коробочке, возвышающейся над гаметофитом на тонкой ножке.
Чередование поколений у высших споровых растений |
Как мы убедимся в дальнейшем, «листья» и «стебли» мхов не являются настоящими стеблями и листьями не только из-за отсутствия сложного тканевого строения, но и потому, что развиваются на другой стадии жизненного цикла – на гаметофите, преобладающей стадии жизненного цикла мхов, а не на спорофитной стадии, как у сосудистых растений.
Так спорофит прикрепляется к гаметофиту |
У мхов также хорошо развито вегетативное размножение при помощи специализированных почек и клубеньков. Почти каждая вегетативная клетка, если её изолировать от прочих, способна вырасти в самостоятельное растение.
2. Типы опыления покрытосеменных растений. Итак, опыление — процесс, без которого невозможно половое размножение растений. В ходе опыления пыльца переносится с тычинок на рыльце пестика, который ее захватывает. Существует два вида опыления: самоопыление и перекрестное.
1. Самоопыление — перенос пыльцы с тычинок на пестики одного цветка. Это крайне невыгодный для растений вид опыления, при котором гены не обновляются, сорта вырождаются. Но вот для селекционеров самоопыление может быть значимым — выводятся чистые сорта. Распространено самоопыление у таких растений, как фиалка, ячмень, соя, помидор, нектарин. Необходимое условие для самоопыления — одновременное созревание на цветках одного растения и тычинок с пыльцой и рылец пестиков. У некоторых самоопыляющихся растений этого не происходит, и тут уж начинается суета! Нужно, чтоб ветер или насекомые перенесли пыльцу с одних цветков, на которых вызрели тычинки, на другие, где вызрели рыльца. Впрочем, есть растения, которые могут размножаться и путем самоопыления, и с помощью перекрестного опыления, например, подсолнечник или крыжовник.
2. Перекрестное опыление — перенос пыльцы с одного цветка на другой, где она попадает на рыльце. Транспортировать пыльцу могут ветер, насекомые или, например, вода. Такой вид опыления преобладает в природе, и недаром: он наиболее эволюционно выгоден. Резко возрастает возможность для рекомбинации генетического материала, а это в свою очередь приводит к расширению внутривидового разнообразия, появлению крепких, живучих растений.
Признаки самоопыляющихся растений
1. Цветки не выделяют нектар и не имеют запаха, — действительно, для кого стараться? Насекомые все равно им для опыления не нужны.
2. Тычинки как правило находятся выше, чем пестики, — так пыльца точно попадет на рыльца.
3. У некоторых растений пыльца созревает еще в бутоне, и самоопыление идет в нераспустившемся цветке (гусмания, горох, арахис). У фиалки удивительной, недаром так названной, весной появляются красивые некрупные цветы, в которых нет особого смысла — они не дают семян. А вот летом у фиалки семена образуются в нераскрывающихся цветках. Различают два типа опыления – это перекрестное (естественное и искусственное) опыление и самоопыление. Рисунок 1. Самоопыление Самоопыление свойственно растениям с двуполыми цветками. Большинства растений при опылении дают семена. К растениям самоопылителям можно отнести такие растения как ячмень, овес, горох, просо. Самоопыление характерно для цветков, которые совсем не раскрываются, т.е. там, где невозможно перекрестное опыление. Таким образом, благодаря самоопылению, мелки невзрачные цветки дают семена. Потомство, полученное от самоопыления, является мало прогрессивным. Таким растениям непосредственно угрожает вырождение. Поэтому у растений-самоопылителей мизерный процент цветков должен подвергнуться внутривидовому опылению. Полученные от него растения имеют несколько другие отцовские и материнские зачатки, их приспособительные способности больше, они выживают в процессе естественного отбора. Все это предусматривает сохранению вида.
. Перекрестное опыление Замечание 1 Перекрестное опыление зависит от внешних факторов: птиц, насекомых, ветра и воды. Анемофилия – ветроопыление. Данное опыление характерно для растений у которых мелкие цветки часто собранные в соцветия. Цветки имеют достаточно много пыльцы. Пыльца сухая и мелкая, выбрасывается она наружу при помощи пыльника. При чем пыльник находится на длинных тонких нитях. Рыльца пестика широкие и длинные, высовываются из цветков, что способствует лучшему попаданию на них пыльцы. Такое опыление характерно для злаковых, и для тех у кого соцветие сережка, например, ольха, береза, орех, хмель, тополь. Для крапивы и конопли, у которых цветок состоит из чашелистиков, простого околоцветника, что не привлекают внимание опылителей. Энтомофилия – опыление насекомыми. Растения, которые имеют нектар, аромат, цвет и размер цветков, липкую пыльцу с выростами опыляются насекомыми. Насекомые переносят пыльцу из одного цветка на рыльца другого цветка, обеспечивая, таким образом, опыление для двуполых растений. Например, маки, ромашки, калина, шалфей ,молочай, гречиха и др.
Орнитофилия – опыление птицами. Такое опыление характерно для тропических растений с яркими цветками птичкой колибри. Гидрофилия – опыление водой. Водные растения, имеющие пыльцу и рыльце нитеобразной формы переносятся водой, или иногда слизнями. К водным гидрофильным растениям относят резуху, взморника, роголистку, наяда, элодею, рунию. Искусственное опыление В плодовом и декоративном садоводстве, овощеводстве, лесном хозяйстве применяется искусственное оплодотворение. Оно заключается в искусственном перенесении пыльцы с тычинок на рыльце пестика. Другими словами искусственное опыление называется скрещивание. Селекционеры, применяя метод скрещивания, получают новые виды и сорта растений.
Опыление у покрытосеменных растений Покрытосеменные растения опыляются обоими способами, при которых пыльцевые зерна непосредственно попадают на рыльца пестиков. Рассмотрим опыление на примере винограда. Для этого растения присущи два способа опыления – перекрестное и самоопыление. При самоопылении у винограда наблюдается клейстогамия. Клейстогамия – опыление, с последующим оплодотворением. В основном для винограда характерно опыление ветром (анемофилия), так как строение цветка приспособлен к такому перекрестному опыления. Во время опыления выделяется секретная жидкость на рыльце, в то время когда оно готово к получению пыльцы. Таким образом рыльце способствует прилипанию пыльцы, защищает ее от инфекции, и задает благоприятные условия для ее прорастания. Для винограда характерен переход от перекрестного опыления к самоопылению. Это способность сохраняет вид на протяжение многих столетий. Растения имея такую способность, будет всегда развиваться, и давать хороший урожай. Селекционеры прибегают к искусственному оплодотворению. Это в своем роде напоминает перекрестное опыление, но уже не с помощью биотических и абиотических факторов, а с помощью антропогенных.
1. Жизненный цикл мохообразных на примере листостебельных мхов.
Гаметофит
Листостебельные мхи, представители которых изображены на фото, мы привыкли видеть как сплошной зеленый ковер. Это и есть половое поколение растений. Если рассмотреть его поближе, можно увидеть, что он состоит из небольших стебельков с мелкими сидячими листиками линейного типа. Как и все мхи, они прикрепляются к субстрату ризоидами. На побегах листостебельных мхов формируются гаметангии, в которых формируются половые клетки. При наличии воды они сливаются, образуя бесполое поколение мхов — спорофит.
Спорофит
Бесполое поколение мхов развивается на зеленом гаметофите. Оно имеет вид тонкой ножки, на которой расположена коробочка. Внутри нее развиваются споры — клетки бесполого размножения. Когда коробочка открывается, они попадают в почву, прорастают и вновь образуют гаметофит, который преобладает в жизненном цикле моховидных растений. Далее половое поколение формирует зиготу, которая делится путем мейоза и образует споры. И таким образом, жизненный цикл осуществляется снова. Спорофит неспособен к самостоятельному питанию, поскольку практически не содержит в своих клетках хлорофилла. Именно поэтому он прикреплен к листостебельному гаметофиту, за счет которого питается. Отличаются эти поколения и хромосомным набором. У спорофита он диплоидный. А вот половое поколение имеет одинарный набор, поскольку половые клетки при формировании зиготы сливаются. М. относятся к числу растений с чередованием поколений. В их жизненном цикле часто преобладает гаметофит (половое поколение, им является практически всё растение). Наряду с осн. предназначением (образованием половых клеток) гаметофит участвует также в выполнении вегетативных функций – в фотосинтезе, водоснабжении и минер. питании. Диплоидный спорофит (бесполое поколение) в течение всей своей жизни прикреплён к гаметофиту и получает от него воду и питат. вещества. У большинства М. спорофит значительно мельче гаметофита и выглядит как спорообразующий орган (отсюда второе название спорофита – спорогоний
У мн. листостебельных мхов быстро растущая ножка вызывает обрыв ткани в основании архегония, который остаётся в виде колпачка на верхушке ножки. Впоследствии под колпачком развивается коробочка. У андреевых и сфагновых мхов ножка остаётся короткой, под спорогонием развивается ложная ножка – продолжение стебля гаметофита; архегоний разрывается поздно из-за разрастания самой коробочки. У печёночников ножка спорофита остаётся короткой до созревания спор, а затем за неск. часов сильно удлиняется благодаря насасыванию воды и растяжению своих клеток, вследствие чего архегоний разрывается и коробочка оказывается во внешней среде. Длинные истинные или ложные ножки выносят коробочку из развивающихся вокруг архегониев защитных образований и тем самым обеспечивают беспрепятственное рассеивание спор.
Споры и спорообразование. Споры образуются в коробочке в результате мейоза и потому содержат гаплоидный набор хромосом в ядре. У антоцеротовидных и печёночников в коробочке наряду со спорами развиваются диплоидные нитевидные элатеры, гигроскопич. движения которых разрыхляют массу спор. У антоцеротовидных и листостебельных мхов по оси коробочки располагается тяж стерильной ткани – колонка. Коробочка со зрелыми спорами вскрывается продольными щелями (андреевые мхи), створками (мн. печёночники), кольцевой поперечной щелью, отделяющей крышечку (сфагновые и зелёные мхи), неправильно разрывается или сгнивает (некоторые печёночники). По краю устья вскрывшейся коробочки у зелёных мхов обычно хорошо заметны располагающиеся в 1 или 2 ряда зубцы, в совокупности составляющие перистом и участвующие в рассеивании спор. Обычно споры имеют сферич. форму, мелкие (5–50 мкм в диаметре), распространяющиеся воздушными потоками, у большинства М. одинаковые в пределах вида (изо- или гомоспоровые растения), но у некоторых видов в одной коробочке развиваются в равном числе крупные и мелкие споры (анизоспоровые растения).
2. Многообразие покрытосеменных растений на примере семейств Губоцветные и Березовые.
Доклад про водоросль вольвокс виды. Тенденции, отзывы, фотографии
Содержание статьи:Фото Вольвокс — строение, размножение Видео Похожие статьи
Доклады, рефераты, лекции, конспекты, шпаргалки. Биология. Наибольшей сложности среди многоклеточных колониальных зеленых водорослей достигает вольвокс (Volvox) (рис.
Вольвокс – род колониальных растений из отдела зеленых водорослей. В настоящее время изучено около 20 видов данного рода.
Громадное большинство вольвоксовых — одноклеточные организмы, но есть также ценобиальные формы, а у видов рода вольвокс (Volvox) таллом Эта линия эволюции привела к формированию протококковых водорослей, составляющих.
Помимо одноклеточных зелёных водорослей существуют многоклеточные, колониальные. Все, что им нужно — это довольно чистая и теплая вода, богатая питательными веществами. Еластикотаксис — свойство клеток найдена пока только у бактерии Myxococcus xanthus ориентироваться в направлении слабых эластичных сил в слое полимерного материала, на котором они находятся. Независимо от строения тела слагающие его клетки всегда несут на переднем конце два, реже четыре одинаковых жгутика; лишь у небольшого числа примитивных форм могут наблюдаться два или три неравных жгутика; очень редко бывает только один жгутик. Половое размножение осуществляется при участии дводжгутикових гамет.
Вольвокс — строение, размножение
Обитают в стоячих пресных водоёмах. При массовом размножении вызывают цветение воды , окрашивая её в зелёный цвет. Вероятнее всего это была первая идентификация в истории микроводорослей. Через свой микроскоп он наблюдал зрелищную зелёную сферу, которая неторопливо вращаясь, перемещалась вперёд.
Клетки соединены протоплазматическими нитями, в центре колонии имеется полость, содержащая жидкую слизь. Клетки внешнего слоя схожи по строению с хламидомонадой. Они имеют по два жгутика , обращенных наружу. В пределах колонии вольвокса наблюдается специализация клеток. Между ними разбросаны генеративные клетки, принимающие участие в процессе размножения.
Генеративные клетки крупные и не имеют жгутиков. В оогониях развиваются яйцеклетки , имеющие зелёную окраску из-за запасных веществ. В антеридиях развиваются сперматозоиды. Ооспора прорастает обычно весной. Происходит сперва мейоз , а затем множество митотических делений.
Новый вольвокс вновь гаплоиден. В жизненном цикле лишь зигота имеет двойной набор хромосом. Происходит перпендикулярное поверхности шара митотическое деление этих клеток. В результате формируется пластинка, которая выворачивается, смыкается краями и образует дочерний шар. Объект интересен как яркий пример колониального организма среди водорослей.
Исследование особенностей строения вольвокса даёт возможность сделать предположение, что развитие организмов от одноклеточных к многоклеточным происходило через колониальные формы. Вы не представились системе Обсуждение Вклад Создать учётную запись Войти. Создать книгу Скачать как PDF Версия для печати. Текст доступен по лицензии Creative Commons Attribution-ShareAlike ; в отдельных случаях могут действовать дополнительные условия..
Вы можете помочь проекту, дополнив её.
Царство Грибы. Урок биологии №76.
Зачем студенту зеленый шарик Вольвокса?
Колониальная зеленая водоросль вольвокс — хрестоматийный объект, на примере которого студентам и школьникам объясняют, каким образом из одноклеточных организмов получились многоклеточные. В статье профессора МГУ Н. А. Заренкова «Неевклидов Вольвокс, или почему не следует преподавать вольвокса в курсе зоологии», опубликованной в Журнале общей биологии, оспаривается правомочность такой интерпретации этого необычного организма.
Вольвокс, как мы помним из школьного курса биологии, — это зеленая водоросль, клетки которой группируются в сферу. Сфера может состоять из нескольких тысяч клеток, каждая из них имеет два жгутика и красный глазок. Этот многоклеточный шарик передвигается за счет движения жгутиков, обращенных наружу. Вольвоксов можно увидеть летом в любом водоеме, а любители поразглядывать всякую мелочь под микроскопом считают вольвокса одним из чудес микромира.
Студенты изучают вольвокса более подробно. В классическом курсе зоологии В. А. Догеля вольвокс приведен в качестве примера самого примитивного многоклеточного существа на Земле. Действительно, это всего лишь сфера из соединенных между собой фотосинтезирующих клеток в слизистом матриксе. Правда, при этом подчеркивается, что у такого простого многоклеточного организма уже имеется клеточная дифференциация: одни клетки выполняют роль соматических, а другие становятся репродуктивными. Только из репродуктивных клеток могут сформироваться дочерние колонии. Как и у других водорослей, в жизненном цикле вольвокса имеется бесполое и половое поколение, то есть одни колонии получаются вегетативным путем (без оплодотворения), а другие — в результате слияния половых клеток.
Традиционно считается, что в основе развития живого лежит движение «от простого к сложному». В соответствии с этим принципом, становление многоклеточности рассматривается как движение от простых колониальных форм к сложным. Индивидуальное развитие самого простого многоклеточного организма интерпретируется как модель происхождения многоклеточности. Зародыш вольвокса представляет собой диск, который заворачивается в маленькую сферу. Предполагается, что дальнейшие эволюционные преобразования проходили по принципу миграции части клеток внутрь сферы и последующей дифференциации клеток в ткани и органы. Вольвокс же остановился на стадии полой сферы. Студентам предлагается именно эта схема.
Однако Н. А. Заренков акцентирует внимание на том, что механизмы дифференциации клеток на соматические и репродуктивные у вольвокса и механизмы дифференциации клеток у зародышей настоящих многоклеточных разные. Причем это касается в равной мере и реальных зародышей многоклеточных животных, и гипотетического предка многоклеточных — фагоцителлы И. И. Мечникова. Рассуждения автора основаны прежде всего на геометрии зародышей вольвокса и настоящих многоклеточных.
Дифференциация клеток происходит из-за неравномерного распределения ресурсов (любых ресурсов!) в пределах ассоциации клеток. Равномерное распределение ресурсов между клетками может теоретически достигаться только тогда, когда контакт всех клеток со всеми одинаков или легко и быстро устанавливается. Понятно, что чем больше клеток, тем труднее устанавливается контакт всех со всеми. Мало того, в зависимости от того, в какую фигуру организованы клетки, эта неравномерность контактов будет различна.
В фигуре типа «плоский диск» (такая стадия есть в развитии вольвокса, но отсутствует у настоящих многоклеточных) сильнее всего будут отличаться от других клетки наружного края, то есть возникнет радиальный градиент условий. У фигуры типа «шар» неоднородность контактов будет направлена от центра шара к периферии. Все эти неравномерности будут создавать различные типы дифференциации. У сферы будут создаваться отдельные ассоциации клеток, которые связаны между собой сильнее, чем с соседними группами. У шара дифференциация будет послойная. И при этом один тип дифференциации никак не выводится из другого, здесь нет движения от простого к сложному, здесь есть, как подчеркивает автор статьи, лишь разнообразие типов дифференциации.
Необходимо заметить, что данная работа — это лишь отсвет того взрыва публикаций, который наблюдается в современной научной литературе по проблеме формообразования и становления многоклеточности у животных. И сейчас вполне утвердилось мнение о том, что вольвокс не является примитивной формой многоклеточного организма. Самые древние формы вольвокса известны из отложений среднего карбона (около 300-320 млн лет назад), а древнейшие многоклеточные регистрируются палеонтологической летописью около 580 млн. лет назад. А молекулярные данные говорят о более древнем происхождении многоклеточных (1 млрд лет назад).
Развитие вольвокса имеет ряд удивительных особенностей, и он никак не может считаться примитивным. Например, в нем присутствует стадия выворачивания дочерней колонии наизнанку. Но вместе с тем аналоги некоторых генов, отвечающих за дифференциацию клеток у вольвокса, известны у всех других многоклеточных. Однако самым любопытным фактом, на мой взгляд, является то, что столь важное эволюционное событие, как появление многоклеточности, происходило неоднократно у разных групп животных и растений. Причем рекордсменом, достойным книги Гиннеса, является то семейство водорослей, к которому принадлежит вольвокс: многоклеточность в нем возникала независимо не менее 9 раз!
Источник: Н. А. Заренков. Неевклидов Вольвокс, или Почему не следует преподавать вольвокса в курсе зоологии // Журнал общей биологии, 2006, т. 67, № 1, с. 53-61.
См. также:
1) David L. Kirk. A twelve-step program for evolving multicellularity and a division of labor. Pdf, 502 Кб // BioEssays 27: 299–310 (2005).
2) I. Nishii, S. Ogihara, D. L. Kirk. A kinesin, invA, plays an essential role in volvox morphogenesis // Cell. 2003. 113(6): 743-753.
Елена Наймарк
4.Рассмотрите под микроскопом вольвокс, изучите строение вольвокса.
Открытый урок по теме:
Открытый урок по теме: «Значение дыхания. Органы дыхательной системы. Заболевания дыхательных путей. Круги кровообращения». Эпиграф урока: «Пока дышу, надеюсь» Овидий римский поэт Цель урока: Изучить строение
ПодробнееДыхательная система человека
Дыхательная система человека Этапы процесса дыхания Дыхание это совокупность процессов, в результате которых происходит потребление организмом кислорода и выделение углекислого газа. Этапы процесса дыхания
ПодробнееУрок 60. Системы органов млекопитающих
Урок 60. Системы органов млекопитающих Каково строение сердца у птиц? Рассмотрим основные процессы жизнедеятельности млекопитающих и те системы органов, которые их обеспечивают. МОДУЛЬ 1 Маршрут 1 Прочитайте
ПодробнееТема: Органы дыхания
Глава V. Дыхание На дом: 24 Тема: Органы дыхания Задачи: Изучить строение и функции органов дыхания Пименов А.В. 2006 Легочное и клеточное дыхание Вы уже знаете, что живые организмы для своего существования,
ПодробнееL/O/G/O. Дыхательная система
L/O/G/O Дыхательная система Дыхание совокупность физиологических процессов, обеспечивающих поступление в организм кислорода и выделение во внешнюю среду углекислого газа (внешнее дыхание), а также использование
Подробнее«Семейная энциклопедия здоровья»
УДК 616.2 ББК 54.12 П 49 «Семейная энциклопедия здоровья» Полякова Елена Александровна Орлов Александр Владимирович Легкое дыхание дыхательная система Научно-популярное издание Научный редактор доктор
ПодробнееПояснительная записка
Пояснительная записка Календарно-тематическое планирование составлено в соответствии с федеральным компонентом государственного стандарта общего образования. Программа предназначена для изучения по специальной
ПодробнееЗадания на смена (Основная школа)
Задания на 07.02.2017 1 смена (Основная школа) урока Предмет Задание Учитель 5А 1 Технология (девочки) стр.112, параграф 118 читать, ответить на вопросы (письменно). Загирова А.А 2 Английский язык Учебник
ПодробнееФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования «ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» УТВЕРЖДАЮ Зав. каф. промышленной и медицинской
Подробнее428 ОГЛАВЛЕНИЕ ОГЛАВЛЕНИЕ
428 ОГЛАВЛЕНИЕ ОГЛАВЛЕНИЕ Введение… 3 Глава 1. Основные этапы индивидуального развития человека… 5 Пренатальный онтогенез… 6 Постнатальный онтогенез… 14 Глава 2. Cтроение тела человека… 22 Клетка:
ПодробнееТребования к результатам обучения
Требования к результатам обучения 1. Учащиеся должны имеет представления: о жизненно-важных потребностях человека об основах регуляции физиологических функций, принципах обратной связи, механизме кодирования
Подробнее«Не теряйте времени зря»
«Не теряйте времени зря» Класс Домашнее задание 8А Русский язык: 39, упр.300, 308, 310, 311, 312. Литература: А.Т. Твардовский. «Василий Тёркин» — прочитать, «О награде» — наизусть, стр. 161-163. История:
ПодробнееПояснительная записка
Пояснительная записка Программа по курсу «Виртуальная лаборатория» в 5-6 классе составлена на основе методических рекомендаций в системе развивающего обучения Д.Б.Эльконина В.В.Давыдова кандидата психологических
ПодробнееБИОЛОГИЯ. 9 класс ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
БИОЛОГИЯ 9 класс ПОЯСНИТЕЛЬНАЯ ЗАПИСКА В программе раздела «Человек» предусматривается сообщение элементарных сведений о строении и жизнедеятельности основных органов и в целом всего организма человека.
ПодробнееУрок Серик О.В. «Вольвокс, губка, ульва
Чугуевская общеобразовательная школа І-ІІІ ступеней № 2
Чугуевского городского совета Харьковськой области
Урок биологии
6 класс
Тема: «Вольвокс, губка, ульва – многоклеточные организмы»
Автор: Серик Ольга Вадимовна,
учитель биологии, специалист І
категории
Чугуев
Тема: Вольвокс, губка, ульва – многоклеточные организмы.
Задание: сформулировать в учеников понятие многоклеточный простоорганизованный организм; изучить среду обитания, строение и процессы жизнедеятельности вольвокса, губки и ульвы; развивать в учащихся умение выделить главное, обобщать материал, правильно делать выводы; воспитывать научное биологическое мировоззрение.
Формы роботы: фронтальная, парная.
Методы: словесне (беседа), словесно – наглядне (работа с нагляднстью, слайдами презентации, видеофрагмент ), практические (составление таблиц, схем).
Инновационные технологии: методика развития критического мышления, мультимедиа технологи, игровые технологи, интерактивные технологи.
Оборудование и материалы: презентация «Вольвокс, губка, ульва – многоклеточные организмы», дидактические карточки, проекты – таблицы (формат А4), видеофрагменты: «Вольвокс», «Губки», «Ульва». учебники.
Тип урока: урок усвоения новых знаний.
Вид урока: урок – путешествие.
Ход урока | Вид деятельнсти учителя и ученика | Время | ||||||||||||||||||||||||||||
Организационный момент. Здравствуйте, ребята! Я рада преветствовать вас на уроке биология. Сегодня вашу активность на уроке, ответы, дополнения, правильно сделанные выводы мне помогут оценивать смайлики. | Приветствие учеников. Сообщение учителя. | 1 мин. | ||||||||||||||||||||||||||||
І. Актуализация опорных знаний. Терминология:
Игра «Верно – не верно»: 1. Макроскопические размеры – «-»; 2. Организм состоит из 2 и более клеток – «-»; 3. Передвигаются с помощью псевдоподий, жгутиков или ресничек — «+»; 4. Имеют разнообразную форму и симметрию – «+». Установите соответствие:
|
Фронтальная беседа.
Игра «верно- не верно». Работа в парах с цветными карточками.
Работа со схемой. Фронтальная беседа. | 7 мин.
| ||||||||||||||||||||||||||||
ІІ. Мотивация учебной деятельности. Обсудим вместе…На слайде представлены организмы:
|
Создание проблемной ситуации. Беседа. | 3 мин. | ||||||||||||||||||||||||||||
ІІІ. Сообщение теми, заданий урока. Тема урока: Вольвокс, губка, ульва – многоклеточные организмы. Задание: сформулировать понятие многоклеточный простоорганизованный организм; изучить среду обитания, строение и процессы жизнедеятельности вольвокса, губки и ульвы; развивать умение выделить главное, обобщать материал, правльно делать выводы; воспитывать научное биологическое мировоззрение. Чтобы справится с задачами урока предлагаю нам отправиться в путешествие: Транспорт – корабль «Успех», он плывет под. девизом «Достигает успеха тот, кто к нему стремится. Желаю каждому достичь успеха на уроке!». Остановки: Итак, отправляемся в путешествие, а по пути заполняем маршрутне листы. | Сообщение учителя. Запись на доске.
| 3 мин. | ||||||||||||||||||||||||||||
ІV. Первостеренное восприятие и осмысления нового материала. Маршрутная таблица
Дидактический материал Вольвокс Во́львoкс (лат.Volvox) – это подвижные колониальные организмы, относящийся к отделу зелёных водорослей.
Среда обитания: стоячие пресные водоёмы — в прудах, озерах, старицах рек, где имеется хорошо развитая водная растительность.
Особенности строения: размер одной колонии — до 2 мм. Колония шарообразная, включает 50 тысяч клеток со жгутиками, направленными наружу. Клетки соединены цитоплазмотическими мостиками, в центре колонии имеется полость, содержащая жидкую слизь. Клетки внешнего слоя схожи по строению с хламидомонадой. Они имеют по два жгутика, обращенных наружу.
Процессы жизнедеятельности:
Вывод: вольвокс — колониальный организм:
Губки Губки (лат. Porifera) – это многоклеточные животные организмы, ведущих прикреплённый образ жизни.
Среда обитания: пресные и морские водоёмы.
Особенности строения: размер тела 1см — до 2м. Губка имеет бокаловидную форму тела.
Стенки губки пронизаны порами. Сквозь поры вода поступает в губку, а выходит через устье. Между внешним и внутренним слоем находится желеобразное основное вещество – мезоглея, содержащая клетки – амебообразные, которые могут превращаться в клетки других типов.
Процессы жизнедеятельности:
Вывод: губка — многоклеточный организм:
Ульва Ульва (лат. Ulva) – это многоклеточная зеленая водоросль.
Среда обитания: морские водоёмы (Черное и Азовское море).
Особенности строения: размер тела 50 см. Тело образовано двумя слоями схожих по строению и функциям клеток. Ульва ведет прикрепленный образ жизни (крепится к субстрату с помощью крупных клеток с ризоидами), а затем отрывается и свободно плавает.
Процессы жизнедеятельности:
Вывод: ульва — многоклеточный организм:
|
Просмотр видеофрагмента. Работа в парах с дидактическим материалом и марштутными таблицями. Отчет каждой пары. Запись в маршрутних листах.
| 18 мин. | ||||||||||||||||||||||||||||
V.Закрепление изученного материала. 1, 2, 3, 4, 5 — все умеем мы считать. Раз! Подняться, потянуться. Два! Согнуться, разогнуться. Три! В ладоши три хлопка, головою три кивка. На четыре — руки шире. Пять — руками помахать. Шесть — за парту тихо сесть. 5 остановка: Заключительная: 1. В чем заключается отличие одноклеточных от колониальных и многоклеточных? 2. В чем заключается отличие колониальных организмов от многоклеточных организмов? |
Физкультминутка.
Сообщение учителя. Беседа.
Составление схемы. | 8 мин. | ||||||||||||||||||||||||||||
VІ. Домашнее задание. Проработать § 18,19. Таблица на стр. 84-85 письменно (високий уровень). | Запись на доске, обьяснение. | 2 мин. | ||||||||||||||||||||||||||||
VІІ. Подведение итога урока. Сегодня на уроке мы с вами сформулировали понятие многоклеточный организм; изучить среду обитания, строение и процессы жизнедеятельности вольвокса, губки и ульвы; развивали умение выделить главное, обобщать материал, правильно делать выводы; воспитывали научное биологическое мировоззрение. | Сообщение учащихся, что нового узнали, какими знаниями овладели. | 3 мин. | ||||||||||||||||||||||||||||
Список используемых источников
- Барна М.М.Ботаніка. Терміни. Поняття. Персоналії.-К.: Академія, 1997. — 272 с.
- Бугай О. В. Біологія у визначеннях, таблицях, схемах. – Х.: Ранок, 2008. – 128 с.
- Грин Н., Стаут У., Тейлор Д. Биология. Том 1. – М.: Мир, 1996. – 368 с.
- Заведея Т. Л. Біологія. – Донецьк.: ВКФ, БАО, 2011. – 688 с.
- Мусиенко Н.Н. Биология. 7 класс.-К.: Генеза, 2007.-288 с.
- Програма для загальноосвітніх навчальних закладів. Біологія 6 – 9 класи. – К., Освіта, 2012.
- Стеблянко М.І., Гончарова К.Д., Закорко Н.Г. Ботаніка: Анатомія і морфологія рослин. –К.: Вища шк.., 1995.-384 с.
Вольвокс
Во́львoкс (лат.Volvox) – это подвижные колониальные организмы, относящийся к отделу зелёных водорослей.
Среда обитания: стоячие пресные водоёмы — в прудах, озерах, старицах рек, где имеется хорошо развитая водная растительность.
Особенности строения: размер одной колонии — до 2 мм. Колония шарообразная, включает 50 тысяч клеток со жгутиками, направленными наружу. Клетки соединены цитоплазмотическими мостиками, в центре колонии имеется полость, содержащая жидкую слизь. Клетки внешнего слоя схожи по строению с хламидомонадой. Они имеют по два жгутика, обращенных наружу.
Процессы жизнедеятельности:
- Питание. Автотрофный тип питания (фотосинтез).
- Размножение. Они делятся, но после деления дочерние клетки остаются соединенными общей слизью (цитоплазмотическими мостиками).
Вывод: вольвокс — колониальный организм:
- состоящие из множества одинаковых клеток, приспособленных для самостоятельного существования;
- клетки недифференцированные;
- клетки соединены цитоплазмотическими мостиками;
- каждая клетка сохраняет способность к размножению.
Губки
Губки (лат. Porifera) – это многоклеточные животные организмы, ведущих прикреплённый образ жизни.
Среда обитания: пресные и морские водоёмы.
Особенности строения: размер тела 1см — до 2м. Губка имеет бокаловидную форму тела.
- внешний слой – покровные клетки, функция покровных клеток – защитная;
- внутренний слой – жгутиковые клетки, функция – благодаря движению жгутиков поступает вода в полость.
Стенки губки пронизаны порами. Сквозь поры вода поступает в губку, а выходит через устье. Между внешним и внутренним слоем находится желеобразное основное вещество – мезоглея, содержащая клетки – амебообразные, которые могут превращаться в клетки других типов.
Процессы жизнедеятельности:
- Питание. Гетеротрофный тип питания. Жгутиковые клетки напрвляют пищу – бактерии, водоросли, отмершие остатки. Пища захватывается в процессе фагоцитоза, а затем отправляется в основное вещество→к амебообразным клеткам → непереваренные остатки вместе с водой выбрасываются через устье.
- Размножение. Бесполое размножение – почкованием и с помощью геммул (специализированные клетки, в которых находятся амебоцитыи имеют плотную оболочку) и половым путем.
Вывод: губка — многоклеточный организм:
- состоящие из множества клеток;
- клетки дифференцированы, так как клетки отличаются по строению;
- клетки специализированные, так как выполняют определенные функции;
- каждая из этих клеток не может существовать самостоятельно, все они взаимодействуют между собой.
Ульва
Ульва (лат. Ulva) – это многоклеточная зеленая водоросль.
Среда обитания: морские водоёмы (Черное и Азовское море).
Особенности строения: размер тела 50 см. Тело образовано двумя слоями схожих по строению и функциям клеток. Ульва ведет прикрепленный образ жизни (крепится к субстрату с помощью крупных клеток с ризоидами), а затем отрывается и свободно плавает.
Процессы жизнедеятельности:
- Питание. Автотрофный тип питания (фотосинтез).
- Размножение. Бесполое размножение и половое.
Вывод: ульва — многоклеточный организм:
- состоящие из 2-х слоев ктеток;
- клетки схожие по строению;
- клетки выполняют подобные функции;
- каждая из этих клеток не может существовать самостоятельно, все они взаимодействуют между собой.
Маршрутная таблица
Признаки | Организмы | ||
Вольвокс | Губка | Ульва | |
1. Среда обитания |
|
|
|
2. Особенности строения |
|
|
|
3.Процессы жизнедеятельности: |
|
|
|
3.1. Питание | |||
3.2. Размножение |
|
|
|
4. Усложнение в сравнение с одноклеточными |
|
|
|
Полярность жгутиков, клеток и организмов у Volvox carteri
% PDF-1.7 % 1 0 объект > / Metadata 2 0 R / Outlines 5 0 R / Pages 3 0 R / StructTreeRoot 6 0 R / Type / Catalog / Viewer Настройки >>> эндобдж 2 0 obj > поток application / pdf
2.12: Организация клеток — Биология LibreTexts
Можно сказать, что организация ведет к эффективности. И в вас клетки организованы в ткани, которые организованы в органы, которые организованы в системы органов, которые образуют вас. И можно сказать, что человеческий организм — очень организованная и эффективная система.
Организация клеток
Биологическая организация существует на всех уровнях организмов. Его можно увидеть на самом маленьком уровне, в молекулах, из которых состоят такие вещи, как ДНК и белки, на самом большом уровне, в организме, таком как синий кит, самое большое млекопитающее на Земле.Точно так же одноклеточные прокариоты и эукариоты демонстрируют порядок в расположении своих клеток. Одноклеточные организмы, такие как амеба, свободно плавают и живут независимо. Их одноклеточные «тела» способны выполнять все жизненные процессы, такие как обмен веществ и дыхание, без помощи других клеток. Некоторые одноклеточные организмы, например бактерии, могут группироваться вместе и образовывать биопленку. Биопленка — это большая группа многих бактерий, которые прилипают к поверхности и создают защитное покрытие на себе.Биопленки могут иметь сходство с многоклеточными организмами. Разделение труда — это процесс, в котором одна группа клеток выполняет одну работу (например, создает «клей», который прикрепляет биопленку к поверхности), а другая группа клеток выполняет другую работу (например, поглощает питательные вещества). Многоклеточные организмы осуществляют свои жизненные процессы за счет разделения труда. У них есть специализированные ячейки, которые выполняют определенную работу. Однако биопленки не считаются многоклеточными организмами, а вместо этого называются колониальными организмами.Разница между многоклеточным организмом и колониальным организмом состоит в том, что отдельные организмы из колонии или биопленки могут, если они разделены, выжить сами по себе, в то время как клетки многоклеточного организма (например, клетки печени) — нет.
Колониальные водоросли рода Volvox .
Колониальные организмы
Колониальные организмы , вероятно, были одним из первых эволюционных шагов к многоклеточным организмам. Водоросли из рода Volvox являются примером границы между колониальными и многоклеточными организмами.
Каждый Volvox , показанный на Рис. выше, является колониальным организмом. Он состоит из от 1000 до 3000 фотосинтезирующих водорослей, которые сгруппированы в полую сферу. У сферы есть четкие передний и задний конец. У клеток есть глазные пятна, которые более развиты в клетках ближе к передней части. Это позволяет колонии плыть навстречу свету.
Происхождение многоклеточности
Самый старый из известных многоклеточных организмов — красные водоросли Bangiomorpha pubescens , окаменелости которых были найдены в 1.Камень возрастом 2 миллиарда лет. Поскольку первые организмы были одноклеточными, эти организмы должны были развиться в многоклеточные.
Ученые считают, что многоклеточность возникла в результате сотрудничества многих организмов одного вида. Колониальная теория предполагает, что это сотрудничество привело к развитию многоклеточного организма. Наблюдается множество примеров сотрудничества между организмами в природе. Например, определенные виды амеб (одноклеточные протисты) группируются во время нехватки пищи и образуют колонию, которая перемещается как единое целое на новое место.Затем некоторые из этих амеб немного отличаются друг от друга. Volvox , показанный на рисунке выше, является еще одним примером колониального организма. Большинство ученых признают, что колониальная теория объясняет, как развивались многоклеточные организмы.
Многоклеточные организмы — это организмы, которые состоят из более чем одного типа клеток и имеют специализированные клетки, сгруппированные вместе для выполнения специализированных функций. Большая часть жизни, которую вы можете увидеть без микроскопа, многоклеточна.Как обсуждалось ранее, клетки многоклеточного организма не могут выжить как независимые клетки. Тело многоклеточного организма, такого как дерево или кошка, демонстрирует организацию на нескольких уровнях: ткани, органы и системы органов. Подобные клетки сгруппированы в ткани, группы тканей составляют органы, а органы с аналогичной функцией сгруппированы в систему органов.
Уровни организации в многоклеточных организмах
Простейшие живые многоклеточные организмы, губки, состоят из многих специализированных типов клеток, которые работают вместе для достижения общей цели.К таким типам клеток относятся пищеварительные клетки, тубулярные поровые клетки и эпидермальные клетки. Хотя разные типы клеток создают большую организованную многоклеточную структуру — видимую губку — они не организованы в действительно взаимосвязанные ткани. Если губку разбить, пропустив ее через сито, губка сформируется с другой стороны. Однако, если клетки губки отделены друг от друга, отдельные типы клеток не могут выжить в одиночку. Более простые колониальные организмы, такие как представители рода Volvox , как показано на рис. выше, отличаются тем, что их отдельные клетки являются свободноживущими и могут выжить сами по себе, если их отделить от колонии.
Этот многоклеточный организм круглого червя был окрашен, чтобы выделить ядра всех клеток в его теле (красные точки).
Ткань — это группа связанных клеток, которые выполняют аналогичную функцию в организме. Более сложные организмы, такие как медузы, кораллы и актинии, имеют тканевый уровень организации. Например, у медуз есть ткани, которые выполняют отдельные защитные, пищеварительные и сенсорные функции.
Даже более сложные организмы, такие как аскариды, показанные на рис. выше, хотя также имеют дифференцированные клетки и ткани, имеют уровень развития на уровне органов.Орган — это группа тканей, которая выполняет определенную функцию или группу функций. Органы могут быть столь же примитивными, как мозг плоского червя (группа нервных клеток), такими большими, как ствол секвойи (до 90 метров в высоту), или сложными, как человеческая печень.
У самых сложных организмов (например, млекопитающих, деревьев и цветов) есть системы органов. Система органов — это группа органов, которые действуют вместе для выполнения сложных взаимосвязанных функций, при этом каждый орган сосредоточен на определенной части задачи.Примером может служить пищеварительная система человека, в которой пища поглощается ртом, желудок измельчает и разжижает ее, поджелудочная железа и желчный пузырь вырабатывают и выделяют пищеварительные ферменты, а кишечник поглощает питательные вещества в кровь.
Volvox aureus — Volvox aureus
.Volvox aureus — это вид зеленых водорослей, обитающих в пресных водах и принадлежащих к семейству Volvocaceae. Эти водоросли живут раздельнополыми колониями, состоящими из примерно 300–3200 клеток и диаметром от 5 до 8 микрон. [2] [3]
Описание
Volvox aureus образует сферические колонии (диаметр приблизительно 0,5 мм), по крайней мере, от 200 до 3200 отдельных клеток (диаметр от пяти до восьми микрон). Отдельные клетки имеют почти круглую форму и связаны между собой тонкими плазменными волокнами или пучками плазмы. Хлоропласты накапливают крахмал и обладают фотосинтетическими пигментами, такими как хлорофиллы a и b, помимо -каротина. В отличие от других зеленых водорослей, в клетках Volvox есть только две сократительные вакуоли.Эти две клетки покидают каждую ячейку через маленькие отверстия в тонком студенистом листе, который их покрывает. Внутри колонии насчитывается от четырех до десяти размножающихся колоний. В колонии есть два типа клеток: половые клетки (называемые гонидиями) и соматические клетки. [4]
Размножение
При бесполом размножении гонидии начинают несколько раз размножаться, образуя полый шар из клеток со жгутиками на полюсах (acroconta), расположенными внутри полой сферы материнской колонии.Дочерние колонии высвобождаются эвагинацией, вызывая разрыв и гибель материнской колонии. [4]
Половое размножение происходит через оплодотворение яйцеклетки (оогамия). Volvox aureus раздельнополы, то есть есть мужские и женские колонии. Мужские колонии производят табличные пакеты спермы, которые впоследствии высвобождаются, а женские колонии, в свою очередь, образуют сферические яйца. После оплодотворения образуется колония. [4]
Среда обитания
Volvox aureus обычно обитает в эвтрофных и застойных пресных водах.Днем колонии располагаются больше на поверхности пруда, а ночью перемещаются на более глубокие участки.
Распространение
Volvox aureus — это своего рода глобальное распространение. Ему указали на следующие страны: Австралия, [5] Бразилия, [6] Китай, [7] Испания, [8] [9] США, [ 10] Япония, [11] Новая Зеландия, [5] [12] Пакистан, [13] Португалия, [9] Соединенное Королевство, [14] [15] Румыния [16] [17] и Сингапур. [18]
Ссылки
- ↑ Ehrenberg, CG 1832: О развитии и продолжительности жизни инфузионных животных; наряду с дальнейшим вкладом в сравнение их органических систем. Трактаты Королевской академии наук в Берлине, физический класс 1831: 1-154, pls I-IV.
- ↑ Грелль, Карл Г. 1973: Протозоология. Springer-Verlag — Берлин. 556с. ISBN 3-540-06239-4 ISBN 0-387-06239-4
- ↑ Ян, Теодор Л., Бови, Ойген. К. и Ян, Фрэнсис Флоед. A b c Ламоте, М. и Л’Этерите, П. 1975: Общая биология. Развитие и морфогенез. От редакции Альгамбра, SA Мадрид. 309стр. ISBN 84-205-0525-0
- ↑ a b Day, S.A., Wickham, R.P., Entwisle, T.J. И Тайлер П.А. 1995: Библиографический список неморских водорослей Австралии.Менезес М. 2010: Chlorophyceae. В: Каталог растений и грибов Бразилии. Vol. 1. (Forzza, RC Eds), стр. 335-352. Рио-де-Жанейро: Андреа Якобссон Estúdio; Научно-исследовательский институт ботанического сада Рио-де-Жанейро.
- ↑ Ху, Х. и Вэй, Ю. 2006: Пресноводные водоросли Китая. Систематика, систематика и экология. С. [4 пл из 16 инжир], [i-iv], i-xv, 1-1023. Китай: www.sciencep.com.
- ↑ Альварес Кобелас, М. и Галлардо, Т. 1986: Каталог испанских континентальных водорослей.IV. Chlorophyceae Wille in Warming 1884. Prasinophyceae T. Christensen ex Silva 1980. Acta Bot. Малачитана 11: 17-38.
- ↑ до b Камбра Санчес, Дж., Альварес Кобелас, М. и Абоал Санджурджо, М. 1998: Список флоры и библиографические хлорофиты (Chlorophyta) на Пиренейском полуострове, Балеарские и Канарские острова. С. 1-614. Бургос: Испанская ассоциация лимнологов.
- ↑ Прескотт, Г.В. 1961: Водоросли в западной части района Великих озер. С иллюстрированным определителем родов десмидовых и пресноводных диатомовых водорослей.Исправленное издание. С. i-xiii, 1-977. Дубьюк, Айова: Умм. К. Браун.
- ↑ Исака, Н., Кавай-Тоёока, Х., Мацузаки, Р., Накада, Т. и Нозаки, Х. 2012: Описание двух новых однодомных видов Volvox sect. Volvox (Volvocaceae, Chlorophyceae), основанный на сравнительной морфологии и молекулярной филогении культивируемого материала. Журнал психологии 48 (3): 759-767.
- ↑ Broady, P.A., Flint, E.A., Nelson, W.A., Cassie Coope, V., De Winton, M.D. & Novis, P.M. 2012. Phylum Chlorophyta и Charophyta: зеленые водоросли.В: Инвентаризация биоразнообразия Новой Зеландии. Том третий. Царства бактерий, простейших, хромистов, растений, грибов. (Gordon, D.P. Eds), стр. 347-381. Крайстчерч: Издательство Кентерберийского университета.
- ↑ Шахназ, А., Зарина, А., Масуд-уль-Хасан и Шамиль, М. 2007: Исследование некоторых видов Volvocophyta Shameel из Лахора, Пакистан. Международный журнал психологии и фикохимии 3 (2): 205-212.
- ↑ Pentecost, A. 2002: Order Volvocales. В: Пресноводная водорослевая флора Британских островов.Руководство по идентификации пресноводных и наземных водорослей. (Джон Д.М., Уиттон Б.А. и Брук, А.Дж. Редакторы), стр. 303-327. Кембридж: Издательство Кембриджского университета.
- ↑ Уиттон, Б.А., Джон, Д.М., Келли, М.Г. И Хаворт, Э. 2003: закодированный список пресноводных водорослей Британских островов. Второе издание. . . Электронное издание во всемирной паутине.
- ↑ Caraus, I. 2002: Водоросли Румынии. Исследования и исследования, Университет Бакэу, Биология 7: 1-694.
- ↑ Караус, И.2012: Водоросли Румынии. Контрольный список распространения настоящих водорослей. Версия 2.3 третьей ревизии. . Бакэу: Univ. Бакэу.
- ↑ Фам, М.Н., Тан, Х.Т.В., Митрович, С., Йео, Х.Х.Т. 2011: Контрольный список водорослей Сингапура. С. 1-100. Сингапур: Музей исследований биоразнообразия Raffles, Национальный университет Сингапура.
внешние ссылки
Gonium — обзор | ScienceDirect Topics
Водоросли «вкус и запах»
Широкий спектр пресноводных планктонных и бентосных водорослей, включая многочисленные цианобактерии и охрофиты (Ochrophyta: некоторые диатомовые водоросли, хризофиты, синурофиты и трибофиты), но также криптоформомониты ( криптоформониты) Skuja), динофлагелляты ( Peridinium sp., Gymnodinium sp.) И хлорофитов (например, Scenedesmus subspicatus Chodat, Chlorella sorokiniana Shihira et Krauss, C. homosphaera Skuja, Eudorina, Chlamydomonas, Chacumber-like , хламидомонаса, гониума, вольвокса), , рыбные, прогорклые, маслянистые или «скунсовые» пахучие соединения. Были идентифицированы многие летучие органические соединения водорослей (ЛОК), некоторые из которых также продуцируются бактериями или грибами. Относительно небольшое количество АВОК — определенных терпеноидов, соединений серы и производных полиненасыщенных жирных кислот (ПНЖК) — вызывают большинство проблем со вкусом и запахом, связанных с водорослями, и среди них лишь немногие АВОК были полезны в качестве индикаторов видов.Высокая вариабельность продукции AVOC наблюдается как среди видов, так и среди штаммов внутри данного вида в одинаковых условиях окружающей среды. В качестве примеров доступны ограниченные данные по продукции AVOC штаммами цианобактерий Anabaena laxa и Phormidium calcicola при высоких и низких уровнях света, температуры, P i и N i . Большая часть геосмина удерживалась внутри клеток A. laxa во всех условиях, за исключением обработки с низким P i , а низкая плотность клеток продуцировала высокие уровни геосмина при этой обработке.Напротив, Phormidium calcicola высвобождает большую часть геосмина в окружающую среду, независимо от возраста культивирования или условий окружающей среды. Источники воды часто содержат различные летучие органические соединения, но полученные запахи могут иметь мало отношения к изобилию этих компонентов, которые значительно различаются по силе и могут действовать синергетически с другими летучими органическими соединениями или маскировать их. Системы с низким содержанием питательных веществ редко имеют заметный запах; скорее, ПНЖК встречаются часто и в большем количестве в эвтрофных системах, что позволяет предположить, что изменения в пахучих соединениях могут иметь потенциал при оценке исходной воды и целостности бассейна.
В синтез АВОК вовлечены несколько биосинтетических путей: некоторые синтезируются во время нормального роста (монотерпены, сесквитерпены, терпеноиды, уникальные вторичные метаболиты, продукты ферментации и биоконверсии). Другие образуются, когда нарушается целостность клетки и активируются липоксигеназы и каротиноксигеназы, в результате чего образуются чрезвычайно мощные низкомолекулярные продукты расщепления жирных кислот и каротиноидов. Также могут быть вовлечены реакции перекисного окисления, вызванные светом в сочетании с тяжелыми металлами или пестицидами.Эти индуцированные реакции следуют за потерей клеточной целостности и часто возникают во время разложения цветения цианобактерий или сезонной смены видов водорослей, или после обновления и расслоения озера и / или перехода от насыщенных кислородом к бескислородным условиям. Кроме того, для цианобактерий, содержащих γ-линоленовую кислоту, опосредованное медью или [другим] гербицидом перекисное окисление может привести к высвобождению ПНЖК. Таким образом, обычная химическая обработка цветков цианобактерий может иногда способствовать образованию соединений с сильным запахом.ПНЖК в основном продуцируются при разрушении клеточной мембраны, обычно в конце популяционного цикла водорослей. Они также могут вырабатываться во время роста (например, планктонными диатомовыми водорослями Asterionella formosa ) и могут действовать как половые феромоны или обеспечивать химическую защиту от травоядных животных.
Несколько моно- и сесквитерпенов были обнаружены в пресноводных цианобактериях и эукариотических водорослях, но заметными исключениями являются цианобактериальный геосмин ( транс, -1,10-диметил- транс, -2-декалол) и 2-метилизоборнеол (G-MIB ).Большинство инцидентов, связанных со вкусом и запахом, придают «землистый, затхлый или мутный» запах и были связаны с G-MIB, которые в основном производятся планктонными и бентосными цианобактериями, включая некоторые потенциально токсичные виды (, рис. 13, ). Они могут вызвать проблемы со вкусом и запахом при концентрации всего несколько нанограммов на литр. Производство G-MIB цианобактериями связано с контролем по качеству и количеству света. В целом, оптимальные темпы роста цианобактерий совпадают с низким уровнем продукции G-MIB.Цианобактерии синтезируют G-MIB на протяжении всего роста, и этот синтез связан с фотосинтезом и синтезом пигментов. Клетки водорослей могут накапливать и / или выделять G-MIB, в зависимости от вида, окружающей среды и фазы роста. Повреждение клеток также может увеличивать уровень G-MIB в исходной воде, который не удаляется эффективно с помощью обычных процессов обработки (коагуляция-седиментация-хлорирование) и по-разному удаляется активированным углем.
Рис. 13. Исследование 45 видов цианобактерий на предмет запаха (геосмин, 2-метилизоборнеол или β-циклоцитраль) и продукции цианотоксинов (микроцистины и / или нейротоксины).От Watson (2004) Водный вкус и запах: основной сигнал о целостности питьевой воды. Журнал токсикологии и гигиены окружающей среды 67: 1779–1795, с разрешения Тейлора и Фрэнсиса (www.informaworld.com).
Вырабатывается множество других пахучих веществ. Например, цианобактерии выделяют сильнодействующие алкилсульфиды, такие как диметилдисульфид (многие виды) и изопропилсульфиды (некоторые штаммы Microcystis ). Основные пахучие соединения, продуцируемые эукариотическими водорослями, — это продукты ферментации, которые в основном образуются различными жгутиконосцами в условиях кислородного стресса (например,g., ochrophytes Poteriochromis stipitata Scherffel, Synura petersenii ). Соединения серы уникальной структуры, 4-метилтио-1,2-дитиолан и 5-метилтио-1,2,3-тритиан, с резким запахом «скунса» выделяются Chara globularis Thuillier, а также обладают аллелопатическими свойствами в отношении личинки комаров и некоторые микроводоросли. В целом, однако, еще предстоит изучить влияние окружающей среды на продукцию AVOC видами и штаммами, а также экологическую роль большинства AVOC.
Классификация протистов | Биология II
Цели обучения
К концу этого раздела вы выполните следующие задачи:
- Определите эволюционные взаимоотношения растений, животных и грибов в шести признанных в настоящее время супергруппах эукариот
- Опишите репрезентативных простейших организмов из каждой из шести признанных в настоящее время супергрупп эукариот
За несколько десятилетий Королевство Протиста было разобрано, потому что анализ последовательностей выявил новые генетические (и, следовательно, эволюционные) отношения между этими эукариотами.Более того, у протистов, которые демонстрируют сходные морфологические особенности, могут развиться аналогичные структуры из-за сходного давления отбора, а не из-за недавнего общего происхождения. Это явление, называемое конвергентной эволюцией, является одной из причин, по которой классификация протистов является такой сложной задачей. Возникающая схема классификации группирует весь домен Eukaryota в шесть «супергрупп», которые включают всех простейших, а также животных, растений и грибов, которые произошли от общего предка (рис. 1).Супергруппы считаются монофилетическими, что означает, что все организмы внутри каждой супергруппы произошли от одного общего предка, и, таким образом, все члены более тесно связаны друг с другом, чем с организмами за пределами этой группы. Доказательства монофилии некоторых групп все еще отсутствуют.
Рисунок 1. На этой диаграмме показана предлагаемая классификация домена Eukara. В настоящее время домен Eukarya разделен на шесть супергрупп. Внутри каждой супергруппы есть несколько королевств.Пунктирными линиями обозначены предполагаемые эволюционные отношения, которые остаются предметом споров.
Классификация эукариот все еще находится в процессе развития, и шесть супергрупп могут быть изменены или заменены более подходящей иерархией по мере накопления генетических, морфологических и экологических данных. Имейте в виду, что представленная здесь классификационная схема — лишь одна из нескольких гипотез, и истинные эволюционные отношения еще предстоит определить. Изучая протистов, полезно уделять меньше внимания номенклатуре и больше — общности и различиям, которые определяют сами группы.
Экскавата
Многие виды простейших, классифицируемые в супергруппу Excavata, представляют собой асимметричные одноклеточные организмы с желобом для кормления, «вырытым» с одной стороны. В эту супергруппу входят гетеротрофные хищники, фотосинтезирующие виды и паразиты. Его подгруппы — дипломонады, парабазалиды и эвгленозойские.
Дипломонады
Рис. 2. Кишечный паразит млекопитающих Giardia lamblia, визуализированный здесь с помощью сканирующей электронной микроскопии, является водным протистом, который при проглатывании вызывает тяжелую диарею.(кредит: модификация работы Дженис Карр, CDC; данные шкалы от Мэтта Рассела)
Среди Excavata есть дипломатонады, в том числе кишечные паразиты, Giardia lamblia (рис. 2). До недавнего времени считалось, что у этих протистов отсутствуют митохондрии. Остаточные митохондриальные органеллы, названные митосомами , с тех пор были идентифицированы у дипломонад, но эти митосомы по существу нефункциональны. Дипломонады существуют в анаэробной среде и используют альтернативные пути, такие как гликолиз, для выработки энергии.Каждая клетка дипломонады имеет два идентичных ядра и использует несколько жгутиков для передвижения.
Парабазалиды
Вторая подгруппа Excavata, парабазалиды, также демонстрирует полуфункциональные митохондрии. У парабазалидов эти структуры функционируют анаэробно и называются гидрогеносомами , потому что они производят водород в качестве побочного продукта. Парабазалиды перемещаются с жгутиками и волнистыми мембранами. Trichomonas vaginalis , парабасалид, вызывающий у людей заболевания, передающиеся половым путем, использует эти механизмы для прохождения через мужские и женские мочеполовые пути. T. vaginalis вызывает трихамониаз, который ежегодно встречается примерно в 180 миллионах случаев во всем мире. В то время как мужчины редко проявляют симптомы во время заражения этим протистом, инфицированные женщины могут стать более восприимчивыми к вторичной инфекции вирусом иммунодефицита человека (ВИЧ) и с большей вероятностью разовьется рак шейки матки. Беременные женщины, инфицированные вирусом T. vaginalis , подвергаются повышенному риску серьезных осложнений, таких как преждевременные роды.
Евгленозойские
Euglenozoans включает паразитов, гетеротрофов, автотрофов и миксотрофов размером от 10 до 500 мкм.Эвгленоиды перемещаются по своей водной среде обитания, используя два длинных жгутика, которые направляют их к источникам света, воспринимаемым примитивным глазным органом, называемым глазным пятном. Знакомый род Euglena включает несколько миксотрофных видов, которые проявляют фотосинтетические способности только при наличии света. В темноте хлоропласты Euglena сжимаются и временно перестают функционировать, а вместо этого клетки поглощают органические питательные вещества из окружающей среды.
Паразит человека, Trypanosoma brucei , принадлежит к другой подгруппе Euglenozoa, кинетопластид.Подгруппа кинетопластид названа в честь кинетопласта , массы ДНК, содержащейся в одной огромной митохондрии, которой обладает каждая из этих клеток. В эту подгруппу входят несколько паразитов, вместе называемых трипаносомами, которые вызывают опустошительные болезни человека и инфицируют различные виды насекомых в течение определенного периода их жизненного цикла. T. brucei развивается в кишечнике мухи цеце после того, как муха укусила инфицированного человека или другого млекопитающего-хозяина. Затем паразит попадает в слюнные железы насекомых, где передается другому человеку или другому млекопитающему, когда инфицированная муха цеце съедает еще одну кровяную муку. T. brucei распространен в Центральной Африке и является возбудителем африканской сонной болезни, заболевания, связанного с тяжелой хронической усталостью, комой, и может привести к летальному исходу, если его не лечить.
Рис. 3. Trypanosoma brucei, возбудитель сонной болезни, часть своего жизненного цикла проводит у мухи цеце, а часть — у человека. (кредит: модификация работы CDC)
Ссылка на обучение
Посмотрите это видео, чтобы увидеть плавание T. brucei .
Хромальвеолата
Текущие данные свидетельствуют о том, что виды, классифицируемые как хромальвеолаты, произошли от общего предка, который поглотил фотосинтетическую клетку красных водорослей, которая сама уже развила хлоропласты в результате эндосимбиотических отношений с фотосинтетическими прокариотами.Следовательно, считается, что предок хромальвеолатов возник в результате вторичного эндосимбиотического события. Однако некоторые хромальвеолаты, по-видимому, утратили пластидные органеллы, происходящие из красных водорослей, или вообще лишены пластидных генов. Следовательно, эту супергруппу следует рассматривать как рабочую группу, основанную на гипотезах, которая может быть изменена. Хромальвеолаты включают очень важные фотосинтезирующие организмы, такие как диатомовые водоросли, бурые водоросли, и важные возбудители болезней животных и растений. Хромальвеолаты можно разделить на альвеоляты и страменопилы.
Альвеоляты: динофлагелляты, апикомплексы и инфузории
Рис. 4. Динофлагелляты очень разнообразны по форме. Многие заключены в целлюлозную броню и имеют два жгутика, которые вставляются в канавки между пластинами. Движение этих двух перпендикулярных жгутиков вызывает вращательное движение.
Большой объем данных подтверждает, что альвеолаты происходят от общего общего предка. Альвеолаты названы в честь присутствия альвеол или мембранных мешочков под клеточной мембраной.Точная функция альвеолы неизвестна, но она может участвовать в осморегуляции. Альвеоляты далее подразделяются на некоторые из наиболее известных протистов: динофлагелляты, апикомплексаны и инфузории.
Динофлагелляты демонстрируют обширное морфологическое разнообразие и могут быть фотосинтетическими, гетеротрофными или миксотрофными. Многие динофлагелляты заключены в сцепляющиеся пластинки из целлюлозы. Два перпендикулярных жгутика входят в канавки между пластинами целлюлозы, причем один жгутик проходит продольно, а второй окружает динофлагеллату (рис. 4).Вместе жгутики вносят свой вклад в характерное вращательное движение динофлагеллят. Эти протисты существуют в пресноводных и морских средах обитания и являются компонентом планктона , обычно микроскопических организмов, которые дрейфуют в воде и служат важным источником пищи для более крупных водных организмов.
Рис. 5. Биолюминесценция излучается динофлагеллятами в обрушивающейся волне, как видно с побережья Нью-Джерси. (кредит: «catalano82» / Flickr)
Некоторые динофлагелляты излучают свет, называемый биолюминесценцией , когда они сотрясаются или подвергаются стрессу.Большое количество морских динофлагеллят (миллиарды или триллионы клеток на волну) могут излучать свет и заставлять целую волну мерцать или приобретать ярко-синий цвет (рис. 5). Приблизительно для 20 видов морских динофлагеллят всплески популяций (также называемые цветением) в летние месяцы могут окрасить океан мутно-красным цветом. Это явление называется красным приливом и возникает из-за большого количества красных пигментов, присутствующих в пластидах динофлагеллат. В больших количествах эти виды динофлагеллят выделяют удушающий токсин, который может убивать рыб, птиц и морских млекопитающих.Красные приливы могут нанести огромный ущерб коммерческому рыболовству, и люди, потребляющие этих протистов, могут стать отравленными.
Апикомплексные протисты названы так потому, что их микротрубочки, фибрин и вакуоли асимметрично распределены на одном конце клетки в структуре, называемой апикальным комплексом (Рис. 6). Апикальный комплекс специализируется на проникновении и заражении клеток-хозяев. Действительно, все apicomplexans паразитируют. В эту группу входит род Plasmodium , вызывающий малярию у людей.Жизненные циклы Apicomplexan сложны, включают несколько хозяев и стадии полового и бесполого размножения.
Рис. 6. (a) Apicomplexans — паразитические протисты. У них есть характерный апикальный комплекс, который позволяет им инфицировать клетки-хозяева. (b) Plasmodium, возбудитель малярии, имеет сложный жизненный цикл, типичный для apicomplexans. (кредит b: модификация работы CDC)
Инфузории, включая Paramecium и Tetrahymena , представляют собой группу протистов длиной от 10 до 3000 микрометров, которые покрыты рядами, пучками или спиралями крошечных ресничек.Ударяя ресничками синхронно или волнообразно, инфузории могут координировать направленные движения и глотать частицы пищи. У некоторых инфузорий есть слитые структуры на основе ресничек, которые функционируют как лопасти, воронки или плавники. Инфузории также окружены пленкой, обеспечивающей защиту без ущерба для подвижности. Род Paramecium включает протистов, которые организовали свои реснички в пластинчатый примитивный рот, называемый оральной бороздой, который используется для захвата и переваривания бактерий (рис. 7).Пища, захваченная в полости рта, попадает в пищевую вакуоль, где соединяется с пищеварительными ферментами. Частицы отходов вытесняются экзоцитарными пузырьками, которые сливаются в определенной области клеточной мембраны, называемой анальной порой. В дополнение к пищеварительной системе, основанной на вакуолях, Paramecium также использует сократительных вакуолей , которые представляют собой осморегуляторные пузырьки, которые заполняются водой, когда она попадает в клетку посредством осмоса, а затем сжимаются, выжимая воду из клетки.
Рисунок 7.У Paramecium есть примитивный рот (называемый ротовой канавкой) для приема пищи и анальная пора для ее выделения. Сократительные вакуоли позволяют организму выводить лишнюю воду. Реснички позволяют организму двигаться. (кредит «Микрофотография парамеция»: модификация работы NIH; данные шкалы от Мэтта Рассела)
Ссылка на обучение
Посмотрите видео, как сократительная вакуоль Paramecium вытесняет воду, чтобы поддерживать осмотическое равновесие клетки.
Paramecium имеет два ядра, макроядро и микроядро, в каждой клетке.Микронуклеус необходим для полового размножения, тогда как макронуклеус управляет бесполым бинарным делением и всеми другими биологическими функциями. Процесс полового размножения в Paramecium подчеркивает важность микроядра для этих простейших. Paramecium и большинство других инфузорий размножаются половым путем путем спряжения. Этот процесс начинается, когда два разных типа спаривания Paramecium вступают в физический контакт и соединяются с цитоплазматическим мостиком (рис. 8).Затем диплоидное микроядро в каждой клетке подвергается мейозу с образованием четырех гаплоидных микроядер. Три из них дегенерируют в каждой клетке, оставляя одно микроядро, которое затем подвергается митозу, образуя два гаплоидных микроядра. Каждая из клеток обменивается одним из этих гаплоидных ядер и удаляется друг от друга. Похожий процесс происходит у бактерий, у которых есть плазмиды. Слияние гаплоидных микроядер генерирует совершенно новое диплоидное пре-микроядро в каждой конъюгативной клетке. Это пре-микроядро проходит три раунда митоза, чтобы произвести восемь копий, и исходный макронуклеус распадается.Четыре из восьми пре-микроядер становятся полноценными микроядрами, тогда как четыре других выполняют несколько циклов репликации ДНК и становятся новыми макронуклеарами. Затем два деления клеток дают четыре новых Paramecia из каждой исходной конъюгативной клетки.
Art Connection
Рис. 8. Сложный процесс полового размножения Paramecium создает восемь дочерних клеток из двух исходных клеток. Каждая клетка имеет макронуклеус и микронуклеус. Во время полового размножения макронуклеус растворяется и заменяется микронуклеусом.(кредит «микрофотография»: модификация работы Яна Саттона; данные шкалы от Мэтта Рассела)
Какое из следующих утверждений о половом размножении Paramecium является ложным?
- Макронуклеусы происходят из микроядер.
- И митоз, и мейоз происходят во время полового размножения.
- Конъюгированная пара меняет местами макронуклеусы.
- Каждый родитель производит четыре дочерних клетки.
Утверждение 3 неверно.
Stramenopiles: диатомовые водоросли, бурые водоросли, золотые водоросли и оомицеты
Рисунок 9.Эта страменопильная клетка имеет единственный волосатый жгутик и вторичный гладкий жгутик.
Другая подгруппа хромальвеолатов, страменопилы, включает фотосинтезирующие морские водоросли и гетеротрофные протисты. Объединяющим признаком этой группы является наличие текстурированного или «волосатого» жгутика. У многих страменопилов также есть дополнительный жгутик без волосковидных выступов (рис. 9). Члены этой подгруппы варьируются по размеру от одноклеточных диатомовых до массивных и многоклеточных водорослей.
Диатомовые водоросли — одноклеточные фотосинтезирующие протисты, которые заключают себя в стеклянные клеточные стенки с замысловатым узором, состоящие из диоксида кремния в матрице органических частиц (рис. 10). Эти простейшие являются составной частью пресноводного и морского планктона. Большинство видов диатомовых водорослей размножаются бесполым путем, хотя существуют и некоторые примеры полового размножения и споруляции. У некоторых диатомовых водорослей в панцире кремнезема есть щель, которая называется швом . Выбрасывая поток мукополисахаридов из шва, диатомовые водоросли могут прикрепляться к поверхностям или двигаться в одном направлении.
Рис. 10. Различные диатомовые водоросли, представленные здесь с помощью световой микроскопии, живут среди однолетних морских льдов в проливе Мак-Мердо в Антарктиде. Размер диатомовых водорослей колеблется от 2 до 200 мкм. (Источник: профессор Гордон Т. Тейлор, Университет Стоуни-Брук, NSF, NOAA)
В периоды доступности питательных веществ популяции диатомовых водорослей увеличиваются в количестве, превышающем их возможности потреблять водные организмы. Избыточные диатомовые водоросли погибают и опускаются на морское дно, где они не могут быть легко доступны сапробам, питающимся мертвыми организмами.В результате углекислый газ, который диатомеи потребили и включили в свои клетки во время фотосинтеза, не возвращается в атмосферу. В общем, этот процесс, посредством которого углерод транспортируется глубоко в океан, описывается как биологический углеродный насос , потому что углерод «перекачивается» в глубины океана, где он недоступен для атмосферы в виде углекислого газа. Биологический углеродный насос является важным компонентом углеродного цикла, который поддерживает более низкие уровни углекислого газа в атмосфере.
Как и диатомовые водоросли, золотые водоросли в основном одноклеточные, хотя некоторые виды могут образовывать большие колонии. Их характерный золотой цвет является результатом широкого использования каротиноидов, группы фотосинтетических пигментов, которые обычно имеют желтый или оранжевый цвет. Золотые водоросли встречаются как в пресноводной, так и в морской среде, где они составляют основную часть сообщества планктона.
Бурые водоросли — это в первую очередь морские многоклеточные организмы, которые в просторечии известны как водоросли.Гигантские водоросли — это разновидность бурых водорослей. У некоторых бурых водорослей развились специализированные ткани, напоминающие наземные растения, с корнями-фиксаторами, стеблевыми ножками и листовыми пластинками, способными к фотосинтезу. Ножки гигантских водорослей огромны, достигая в некоторых случаях 60 метров. Существует множество жизненных циклов водорослей, но наиболее сложным является чередование поколений, в котором как гаплоидная, так и диплоидная стадии связаны с многоклеточностью. Сравните этот жизненный цикл, например, с человеческим.Гаплоидные гаметы, продуцируемые мейозом (сперма и яйцеклетка), объединяются при оплодотворении, образуя диплоидную зиготу, которая проходит множество раундов митоза, чтобы произвести многоклеточный эмбрион, а затем плод. Однако отдельные сперматозоиды и яйцеклетки никогда не становятся многоклеточными существами. Наземные растения тоже эволюционировали с чередованием поколений. В роде бурых водорослей Laminaria гаплоидные споры развиваются в многоклеточные гаметофиты, которые продуцируют гаплоидные гаметы, которые в совокупности образуют диплоидные организмы, которые затем становятся многоклеточными организмами, структура которых отличается от гаплоидной формы (рис. 11).Некоторые другие организмы осуществляют чередование поколений, в которых и гаплоидная, и диплоидная формы выглядят одинаково.
Art Connection
Рис. 11. Несколько видов бурых водорослей, таких как показанная здесь ламинария, развили жизненные циклы, в которых как гаплоидная (гаметофит), так и диплоидная (спорофит) формы являются многоклеточными. Гаметофит по строению отличается от спорофита. (кредит «фотография ламинарии»: модификация работы Клэр Факлер, CINMS, NOAA Photo Library)
Какое из следующих утверждений о жизненном цикле ламинарии Laminaria неверно?
- 1 n зооспоры образуются в спорангиях.
- Спорофит — растение 2 n .
- Гаметофит диплоидный.
- Стадии гаметофита и спорофита многоклеточны.
Утверждение 3 неверно.
Рис. 12. Сапробный оомицет поглощает мертвое насекомое. (кредит: модификация работы Томаса Брессона)
Водяные плесени, оомицеты («яичный гриб»), были названы так на основании их грибковой морфологии, но молекулярные данные показали, что водяные плесени не имеют тесного родства с грибами.Оомицеты характеризуются клеточной стенкой на основе целлюлозы и разветвленной сетью нитей, которые позволяют поглощать питательные вещества. Как диплоидные споры, многие оомицеты имеют два противоположно направленных жгутика (один волосатый и один гладкий) для передвижения. Оомицеты нефотосинтетические и включают множество сапробов и паразитов. Сапробионты выглядят как белые пушистые наросты на мертвых организмах (рис. 12). Большинство оомицетов водные, но некоторые паразитируют на наземных растениях. Один из патогенов растений — это Phytophthora infestans , возбудитель фитофтороза картофеля, который имел место во время картофельного голода в Ирландии в XIX веке.
Ризария
Рис. 13. Ammonia Tepida под фазово-контрастным световым микроскопом (предоставлено: модификация работы Скотта Фея, Калифорнийский университет в Беркли; данные шкалы от Мэтта Рассела)
Супергруппа Rhizaria включает многие амебы, большинство из которых имеют нитевидные или игольчатые псевдоподии (аммиак тепида, вид Rhizaria, можно увидеть на рис. 13). Функция псевдоподий заключается в улавливании и поглощении частиц пищи, а также в управлении движением простейших ризариев. Эти псевдоножки выступают наружу из любого места на поверхности клетки и могут прикрепляться к субстрату.Затем протист переносит свою цитоплазму в ложноножку, тем самым перемещая всю клетку. Этот тип движения, называемый потоком цитоплазмы , используется несколькими различными группами простейших в качестве средства передвижения или метода распределения питательных веществ и кислорода.
Ссылка на обучение
Посмотрите это видео, чтобы увидеть потоки цитоплазмы в зеленой водоросли.
Форамы
Рис. 14. Эти раковины фораминифер опустились на морское дно.(Источник: Deep East 2001, NOAA / OER)
Фораминиферы, или форамы, представляют собой одноклеточные гетеротрофные протисты, длина которых варьируется от примерно 20 микрометров до нескольких сантиметров и иногда напоминает крошечных улиток (рис. 14). В целом пенопласты имеют пористые оболочки, называемые test , которые построены из различных органических материалов и, как правило, отверждены карбонатом кальция. В тестах могут содержаться фотосинтезирующие водоросли, которые пены могут собирать для питания. Псевдоподии Foram проходят через поры и позволяют им перемещаться, питаться и собирать дополнительные строительные материалы.Обычно пены связаны с песком или другими частицами в морских или пресноводных средах обитания. Фораминиферы также полезны в качестве индикаторов загрязнения и изменений в глобальных погодных условиях.
Радиолярии
Рис. 15. Эта окаменелая раковина радиолярий была получена с помощью сканирующего электронного микроскопа. (кредит: модификация работы Ханнеса Гроба, Институт Альфреда Вегенера; данные шкалы от Мэтта Рассела)
Второй подтип Rhizaria, радиолярии, демонстрируют замысловатый внешний вид из стекловидного кремнезема с радиальной или двусторонней симметрией (рис. 15).Иглоподобные псевдоножки, поддерживаемые микротрубочками, исходят наружу от клеточных тел этих протистов и служат для улавливания частиц пищи. Раковины мертвых радиолярий опускаются на дно океана, где они могут накапливаться на глубинах до 100 метров. Сохранившиеся осажденные радиолярии очень часто встречаются в летописи окаменелостей.
Archaeplastida
Красные водоросли и зеленые водоросли входят в супергруппу Archaeplastida. Именно от общего предка этих простейших произошли наземные растения, поскольку их ближайшие родственники находятся в этой группе.Молекулярные данные подтверждают, что все Archaeplastida являются потомками эндосимбиотических отношений между гетеротрофным протистом и цианобактериями. Красные и зеленые водоросли включают одноклеточные, многоклеточные и колониальные формы.
Красные водоросли
Красные водоросли, или родофиты, в основном многоклеточные, без жгутиков и варьируются по размеру от микроскопических одноклеточных протистов до крупных многоклеточных форм, сгруппированных в категорию неформальных морских водорослей. Жизненный цикл красных водорослей — это смена поколений.Некоторые виды красных водорослей содержат фикоэритрины, вспомогательные фотосинтетические пигменты, которые имеют красный цвет и превосходят зеленый оттенок хлорофилла, благодаря чему эти виды выглядят как различные оттенки красного. Другие простейшие, классифицируемые как красные водоросли, лишены фикоэритринов и являются паразитами. Красные водоросли распространены в тропических водах, где они были обнаружены на глубине 260 метров. Другие красные водоросли существуют в наземных или пресноводных средах.
Зеленые водоросли: хлорофиты и харофиты
Самая многочисленная группа водорослей — зеленые водоросли.Зеленые водоросли имеют сходные черты с наземными растениями, особенно с точки зрения структуры хлоропластов. То, что эта группа протистов имела относительно недавнего общего предка с наземными растениями, хорошо подтверждается. Зеленые водоросли подразделяются на хлорофиты и харофиты. Харофиты являются ближайшими живыми родственниками наземных растений и напоминают их по морфологии и репродуктивным стратегиям. Харофиты распространены во влажных средах обитания, и их присутствие часто свидетельствует о здоровой экосистеме.
Хлорофиты обладают большим разнообразием форм и функций. Хлорофиты в основном населяют пресноводную и влажную почву и являются обычным компонентом планктона. Chlamydomonas — простой одноклеточный хлорофит с грушевидной морфологией и двумя противоположными передними жгутиками, которые направляют этого протиста к свету, воспринимаемому его глазным пятном. Более сложные виды хлорофитов демонстрируют гаплоидные гаметы и споры, которые напоминают Chlamydomonas .
Хлорофит Volvox — один из немногих примеров колониальных организмов, которые в некоторых отношениях ведут себя как совокупность отдельных клеток, а в других — как специализированные клетки многоклеточного организма (рис. 16). Колонии Volvox содержат от 500 до 60 000 клеток, каждая с двумя жгутиками, содержащихся в полой сферической матрице, состоящей из гелеобразного секрета гликопротеина. Отдельные клетки Volvox перемещаются согласованно и связаны между собой цитоплазматическими мостиками. Только несколько клеток воспроизводятся с образованием дочерних колоний, что является примером основной клеточной специализации этого организма.
Рис. 16. Volvox aureus — зеленая водоросль в супергруппе Archaeplastida.Этот вид существует как колония, состоящая из клеток, погруженных в гелеподобный матрикс и переплетенных друг с другом посредством волосковых удлинений цитоплазмы. (кредит: д-р Ральф Вагнер)
Рис. 17. Caulerpa taxifolia — хлорофит, состоящий из одной клетки, потенциально содержащей тысячи ядер. (кредит: NOAA)
Настоящие многоклеточные организмы, такие как морской салат, Ulva , представлены среди хлорофитов. Кроме того, некоторые хлорофиты существуют в виде больших многоядерных одиночных клеток.Виды из рода Caulerpa демонстрируют уплощенную, похожую на папоротник листву, и могут достигать длины до 3 метров (рис. 17). Caulerpa видов подвергаются ядерному делению, но их клетки не завершают цитокинез, оставаясь вместо этого массивными и сложными одиночными клетками.
Амебозоа
Для амеб характерно наличие псевдоподий, которые выступают в виде трубок или плоских долей, а не волосовидных псевдоподий ризариевых амеб (рис. 18). Amoebozoa включает несколько групп одноклеточных амебоподобных организмов, которые являются свободноживущими или паразитическими.
Рис. 18. Амебы с трубчатыми и лопастными псевдоподиями видны под микроскопом. Эти изоляты морфологически классифицируются как амебозойные.
Формы для слизи
Подмножество амебозойных, слизистые плесени, имеет несколько морфологических сходств с грибами, которые, как полагают, являются результатом конвергентной эволюции. Например, во время стресса некоторые слизистые плесени развиваются в плодовые тела, образующие споры, подобно грибам.
Слизневые плесени классифицируются на основе их жизненного цикла на плазмодийные и клеточные типы.Формы плазмодийной слизи состоят из больших многоядерных клеток и перемещаются по поверхностям, как аморфная капля слизи во время фазы питания (рис. 19). Частицы пищи поднимаются и захватываются слизистой формой, когда она скользит по ней. После созревания плазмодий приобретает сетчатый вид со способностью образовывать плодовые тела или спорангии во время стресса. Гаплоидные споры образуются в результате мейоза внутри спорангиев, и споры могут распространяться по воздуху или воде и потенциально приземляться в более благоприятных условиях.Если это происходит, споры прорастают с образованием амебоидных или жгутиковых гаплоидных клеток, которые могут объединяться друг с другом и производить диплоидную зиготическую слизистую плесень для завершения жизненного цикла.
Рис. 19. Показан жизненный цикл плазмодиальной слизистой плесени. Ярко окрашенный плазмодий на врезке представляет собой одноклеточную многоядерную массу. (кредит: модификация работы доктора Джонаты Готт и Центра молекулярной биологии РНК, Университет Кейс Вестерн Резерв)
Клеточные слизистые плесени функционируют как независимые амебоидные клетки, когда питательных веществ много (рис. 20).Когда пища истощается, клеточные слизистые формы накапливаются друг на друга, образуя массу клеток, которые ведут себя как единое целое, называемое слизью. Некоторые клетки в слизняке способствуют образованию стебля диаметром 2–3 миллиметра, высыхая и отмирая в процессе. Клетки на вершине стебля образуют бесполое плодовое тело, содержащее гаплоидные споры. Как и в случае с плазмодиальными слизистыми плесневыми грибами, споры распространяются и могут прорасти, если попадут во влажную среду. Один представительный род ячеистых плесневых грибов — это Dictyostelium , который обычно встречается во влажных лесных почвах.
Рис. 20. Ячеистые формы слизи могут существовать в виде отдельных или агрегированных амеб. (кредит: модификация работы «thatredhead4» / Flickr)
Ссылка на обучение
Посмотрите это видео, чтобы увидеть, как клеточная слизистая плесень формирует плодовое тело.
Опистоконта
К опистоконтам относятся хоанофлагелляты, похожие на животных, которые, как полагают, напоминают общего предка губок и, фактически, всех животных. Хоанофлагелляты включают одноклеточные и колониальные формы и насчитывают около 244 описанных видов.У этих организмов один апикальный жгутик, окруженный сократительной воротничкой, состоящей из микроворсинок. Ошейник использует механизм, аналогичный губкам, для фильтрации бактерий, которые могут проглотить простейшие. Морфология хоанофлагеллят была признана на раннем этапе похожей на воротниковые клетки губок и предполагающей возможную связь с животными.
Mesomycetozoa образуют небольшую группу паразитов, в первую очередь рыб, и по крайней мере одну форму, которая может паразитировать на людях.Их жизненные циклы плохо изучены. Эти организмы представляют особый интерес, поскольку кажутся очень близкими к животным. В прошлом они были сгруппированы с грибами и другими простейшими на основе их морфологии.
Сводка раздела
Процесс классификации простейших в значимые группы продолжается, но генетические данные за последние 20 лет прояснили многие взаимосвязи, которые ранее были неясными или ошибочными. В настоящее время большинство считает, что все эукариоты разделены на шесть супергрупп: Excavata, Chromalveolata, Rhizaria, Archaeplastida, Amoebozoa и Opisthokonta.Целью этой классификационной схемы является создание кластеров видов, происходящих от общего предка. В настоящее время монофилия одних супергрупп лучше подтверждается генетическими данными, чем других. Хотя внутри супергрупп существуют огромные различия, можно выделить общие черты на морфологическом, физиологическом и экологическом уровнях.
Глоссарий
биологический углеродный насос: процесс, посредством которого неорганический углерод фиксируется фотосинтезирующими видами, которые затем умирают и падают на морское дно, где они не могут быть достигнуты сапробиями, а их потребление углекислого газа не может быть возвращено в атмосферу
биолюминесценция: генерация и испускание света организмом, как у динофлагеллят
сократительная вакуоль: везикула, которая заполняется водой (когда она попадает в клетку посредством осмоса), а затем сжимается, выдавливая воду из клетки; осморегуляторный пузырь
поток цитоплазмы: перемещение цитоплазмы в расширенный псевдопод, так что вся клетка транспортируется к месту расположения псевдопода
гидрогеносома: органелла, переносимая парабазалидами (Excavata), которая функционирует анаэробно и выделяет газообразный водород в качестве побочного продукта; вероятно произошли от митохондрий
кинетопласт: масса ДНК, содержащаяся в одной большой митохондрии, характерной для кинетопластид (тип: Euglenozoa)
митосома: нефункциональных органелл, содержащихся в клетках дипломонад (Excavata), которые, вероятно, произошли от митохондрии
планктон: разнообразная группа в основном микроскопических организмов, которые дрейфуют в морских и пресноводных системах и служат источником пищи для более крупных водных организмов
раф: разрез в кремнеземной оболочке диатомовых водорослей, через который протист выделяет поток мукополисахаридов для передвижения и прикрепления к субстратам
испытание: пористая оболочка пенопласта, изготовленная из различных органических материалов и обычно отвержденная карбонатом кальция
Полногеномный анализ альтернативного сплайсинга у Volvox carteri | BMC Genomics
Chen L, Bush SJ, Tovar-Corona JM, Castillo-Morales A, Urrutia AO: Корректировка дифференциального покрытия транскриптов показывает сильную взаимосвязь между альтернативным сплайсингом и сложностью организма. Mol Biol Evol. 2014, 31 (6): 1402-1413. 10.1093 / molbev / msu083.
PubMed Central PubMed Google Scholar
Stamm S, Ben-Ari S, Rafalska I, Tang Y, Zhang Z, Toiber D, Thanaraj TA, Soreq H: функция альтернативного сращивания.Ген. 2005, 344: 1-20.
CAS PubMed Google Scholar
Керен Х., Лев-Маор Г., Аст Г.: Альтернативный сплайсинг и эволюция: диверсификация, определение экзона и функция. Nat Rev Genet. 2010, 11 (5): 345-355. 10.1038 / nrg2776.
CAS PubMed Google Scholar
Редди А.С.: ядерный сплайсинг пре-мРНК в растениях. Crit Rev Plant Sci. 2001, 20 (6): 523-571.10.1016 / S0735-2689 (01) 80004-6.
CAS Google Scholar
Редди А.С.: Альтернативный сплайсинг пре-мессенджерных РНК в растениях в эпоху генома. Annu Rev Plant Biol. 2007, 58: 267-294. 10.1146 / annurev.arplant.58.032806.103754.
CAS PubMed Google Scholar
Gassmann W: Альтернативное сращивание для защиты растений. Curr Top Microbiol Immunol. 2008, 326: 219-233.
CAS PubMed Google Scholar
Касерес Дж. Ф., Корнблихтт АР: Альтернативное сращивание: множественные механизмы контроля и участие в заболеваниях человека. Тенденции Genet. 2002, 18 (4): 186-193. 10.1016 / S0168-9525 (01) 02626-9.
PubMed Google Scholar
Грабовски П.Дж .: Регуляция сплайсинга в нейронах: возня с клеточно-специфическим контролем. Клетка. 1998, 92 (6): 709-712.10.1016 / S0092-8674 (00) 81399-9.
CAS PubMed Google Scholar
Грабовски П.Дж., Блэк Д.Л.: Альтернативный сплайсинг РНК в нервной системе. Prog Neurobiol. 2001, 65 (3): 289-308. 10.1016 / S0301-0082 (01) 00007-7.
CAS PubMed Google Scholar
Stamm S, Zhang MQ, Marr TG, Helfman DM: компиляция и сравнение последовательностей экзонов, которые альтернативно сплайсируются в нейронах.Nucleic Acids Res. 1994, 22 (9): 1515-1526. 10.1093 / nar / 22.9.1515.
CAS PubMed Central PubMed Google Scholar
Licatalosi DD, Darnell RB: Процессинг РНК и его регулирование: глобальное понимание биологических сетей. Nat Rev Genet. 2010, 11 (1): 75-87.
CAS PubMed Central PubMed Google Scholar
Black DL: Механизмы альтернативного сплайсинга пре-мессенджеров РНК.Анну Рев Биохим. 2003, 72: 291-336. 10.1146 / annurev.biochem.72.121801.161720.
CAS PubMed Google Scholar
Johnson JM, Castle J, Garrett-Engele P, Kan Z, Loerch PM, Armor CD, Santos R, Schadt EE, Stoughton R, Shoemaker DD: полногеномный обзор альтернативного сплайсинга пре-мРНК человека с микромассивы соединений экзонов. Наука. 2003, 302 (5653): 2141-2144. 10.1126 / science.10.
CAS PubMed Google Scholar
Kampa D, Cheng J, Kapranov P, Yamanaka M, Brubaker S, Cawley S, Drenkow J, Piccolboni A, Bekiranov S, Helt G, Tammana H, Gingeras TR: новые РНК, идентифицированные в результате углубленного анализа транскриптома хромосомы человека 21 и 22. Genome Res. 2004, 14 (3): 331-342. 10.1101 / gr.2094104.
CAS PubMed Central PubMed Google Scholar
Пан К., Шай О., Ли Л.Дж., Фрей Б.Дж., Бленкоу Б.Дж.: Глубокое исследование сложности альтернативного сплайсинга в человеческом транскриптоме с помощью высокопроизводительного секвенирования.Нат Жене. 2008, 40 (12): 1413-1415. 10.1038 / нг.259.
CAS PubMed Google Scholar
Ван Э.Т., Сандберг Р., Ло С., Хребтукова И., Чжан Л., Майр С., Кингсмор С.Ф., Шрот Г.П., Бердж CB: Альтернативная регуляция изоформ в транскриптомах тканей человека. Природа. 2008, 456 (7221): 470-476. 10.1038 / природа07509.
CAS PubMed Central PubMed Google Scholar
Грейвли Б.Р., Брукс А.Н., Карлсон Дж. В., Дафф М. О., Ландолин Дж. М., Ян Л., Артьери К. Г., ван Барен М. Дж., Боули Н., Бут Б. В., Браун Дж. Б., Чербас Л., Дэвис К. А., Добин А., Ли Р., Лин В., Мэлоун Дж. Х., Маттиуццо Н. Р., Миллер Д., Стерджилл Д., Туч Б. Б., Залески К., Чжан Д., Бланшетт М., Дудуа С., Идс Б., Грин Р. Э., Хэммондс А., Цзян Л., Капранов П. и др.: Транскриптом развития . Drosophila melanogaster . Природа. 2011, 471 (7339): 473-479. 10.1038 / природа09715.
CAS PubMed Central PubMed Google Scholar
Филичкин С.А., Прист HD, Гиван С.А., Шен Р., Брайант Д.В., Фокс С.Е., Вонг В.К., Моклер ТК: Полногеномное картирование альтернативного сплайсинга в Arabidopsis thaliana . Genome Res. 2010, 20 (1): 45-58. 10.1101 / гр.093302.109.
CAS PubMed Central PubMed Google Scholar
Marquez Y, Brown JW, Simpson C, Barta A, Kalyna M: Обзор Transcriptome показывает повышенную сложность альтернативного ландшафта сращивания в Arabidopsis .Genome Res. 2012, 22 (6): 1184-1195. 10.1101 / гр.134106.111.
CAS PubMed Central PubMed Google Scholar
Бараш Ю., Каларко Дж. А., Гао В., Пан К., Ван Х, Шай О., Бленкоу Б. Дж., Фрей Б. Дж.: Расшифровка кода сращивания. Природа. 2010, 465 (7294): 53-59. 10.1038 / природа09000.
CAS PubMed Google Scholar
Ramani AK, Calarco JA, Pan Q, Mavandadi S, Wang Y, Nelson AC, Lee LJ, Morris Q, Blencowe BJ, Zhen M, Fraser AG: анализ альтернативного сплайсинга в геноме Caenorhabditis elegans .Genome Res. 2011, 21 (2): 342-348. 10.1101 / gr.114645.110.
CAS PubMed Central PubMed Google Scholar
Чжу В., Шлютер С.Д., Брендель В. Уточненная аннотация генома Arabidopsis путем полного картирования меток экспрессированной последовательности. Plant Physiol. 2003, 132 (2): 469-484. 10.1104 / стр.102.018101.
CAS PubMed Central PubMed Google Scholar
Иида К., Секи М., Сакураи Т., Сато М., Акияма К., Тойода Т., Конагая А., Шинозаки К.: Полногеномный анализ альтернативного сплайсинга пре-мРНК в Arabidopsis thaliana на основе полноразмерных последовательностей кДНК. Nucleic Acids Res. 2004, 32 (17): 5096-5103. 10.1093 / нар / гх845.
CAS PubMed Central PubMed Google Scholar
Кэмпбелл М.А., Хаас Б.Дж., Гамильтон Дж.П., Маунт С.М., Буэлл К.Р.: Всесторонний анализ альтернативного сращивания риса и сравнительный анализ с Arabidopsis .BMC Genomics. 2006, 7: 327-10.1186 / 1471-2164-7-327.
PubMed Central PubMed Google Scholar
Хори К., Ватанабе Я. Анализ контекста терминационных кодонов в мРНК, которые распознаются NMD растений. Physiol растительной клетки. 2007, 48 (7): 1072-1078. 10.1093 / pcp / pcm075.
CAS PubMed Google Scholar
Барбазук В.Б., Фу Й., МакГиннис К.М.: Полногеномный анализ альтернативного сплайсинга у растений: возможности и проблемы.Genome Res. 2008, 18 (9): 1381-1392. 10.1101 / gr.053678.106.
CAS PubMed Google Scholar
Goodall GJ, Filipowicz W: Различные эффекты интронного нуклеотидного состава и вторичной структуры на сплайсинг пре-мРНК у однодольных и двудольных растений. EMBO J. 1991, 10 (9): 2635-2644.
CAS PubMed Central PubMed Google Scholar
McCullough AJ, Schuler MA: AU-богатые интронные элементы влияют на выбор сайта сплайсинга 5′-пре-мРНК в Drosophila melanogaster .Mol Cell Biol. 1993, 13 (12): 7689-7697.
CAS PubMed Central PubMed Google Scholar
Lim LP, Burge CB: вычислительный анализ особенностей последовательности, участвующих в распознавании коротких интронов. Proc Natl Acad Sci U S. A. 2001, 98 (20): 11193-11198. 10.1073 / pnas.201407298.
CAS PubMed Central PubMed Google Scholar
Goodall GJ, Filipowicz W: AU-богатые последовательности, присутствующие в интронах ядерных пре-мРНК растений, необходимы для сплайсинга.Клетка. 1989, 58 (3): 473-483. 10.1016 / 0092-8674 (89)
-5.
CAS PubMed Google Scholar
Инициатива по геному арабидопсиса: Анализ последовательности генома растения-низшего растения Arabidopsis thaliana . Природа. 2000, 408 (6814): 796-815. 10.1038 / 35048692.
Google Scholar
Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W, Funke R, Gage D, Harris K, Heaford A, Howland J , Kann L, Lehoczky J, LeVine R, McEwan P, McKernan K, Meldrim J, Mesirov JP, Miranda C, Morris W, Naylor J, Raymond C, Rosetti M, Santos R, Sheridan A, Sougnez C и др .: Начальный секвенирование и анализ генома человека.Природа. 2001, 409 (6822): 860-921. 10.1038 / 35057062.
CAS PubMed Google Scholar
Александров Н.Н., Трухан М.Е., Бровер В.В., Татаринова Т., Флавелл Р.Б., Фельдманн К.А.: Особенности генов Arabidopsis и генома , обнаруженные с использованием полноразмерных кДНК. Завод Мол Биол. 2006, 60 (1): 69-85. 10.1007 / s11103-005-2564-9.
CAS PubMed Google Scholar
Ван BB, Брендель В.: Сравнительный анализ альтернативного сплайсинга в геноме растений. Proc Natl Acad Sci U S. A. 2006, 103 (18): 7175-7180. 10.1073 / pnas.0602039103.
CAS PubMed Central PubMed Google Scholar
White O, Soderlund C, Shanmugan P, Fields C: Информационное содержание и динуклеотидные составы последовательностей интронов растений меняются в зависимости от эволюционного происхождения. Завод Мол Биол. 1992, 19 (6): 1057-1064.10.1007 / BF00040537.
CAS PubMed Google Scholar
Yu J, Hu S, Wang J, Wong GK, Li S, Liu B, Deng Y, Dai L, Zhou Y, Zhang X, Cao M, Liu J, Sun J, Tang J, Chen Y , Хуанг X, Линь В., Йе Ц, Тонг В., Конг Л., Гэн Дж., Хань И, Ли Л., Ли В., Ху Г, Ли Дж., Лю З., Ци Кью, Ли Т, Ван Х и другие: A проект последовательности генома риса ( Oryza sativa L. ssp. indica ). Наука. 2002, 296 (5565): 79-92. 10.1126 / наука.1068037.
CAS PubMed Google Scholar
Бэк Дж. М., Хан П., Иандолино А., Кук Д. Р.: Характеристика и сравнение структуры интрона и альтернативного сплайсинга между Medicago truncatula , Populus trichocarpa, Arabidopsis и рисом. Завод Мол Биол. 2008, 67 (5): 499-510. 10.1007 / s11103-008-9334-4.
CAS PubMed Google Scholar
Luehrsen KR, Taha S, Walbot V: Ядерный процессинг пре-мРНК в высших растениях. Prog Nucleic Acid Res Mol Biol. 1994, 47: 149-193.
CAS PubMed Google Scholar
Джордан Т., Шорнак С., Лахайе Т.: Альтернативный сплайсинг транскриптов, кодирующих Toll-подобные белки устойчивости растений — каково функциональное значение для врожденного иммунитета ?. Trends Plant Sci. 2002, 7 (9): 392-398. 10.1016 / S1360-1385 (02) 02311-7.
CAS PubMed Google Scholar
Танабе Н., Йошимура К., Кимура А., Ябута Ю., Шигеока С. Дифференциальная экспрессия альтернативно сплайсированных мРНК гомологов белка Arabidopsis SR, atSR30 и atSR45a, в ответ на стресс окружающей среды. Physiol растительной клетки. 2007, 48 (7): 1036-1049. 10.1093 / pcp / pcm069.
CAS PubMed Google Scholar
Эгава С., Кобаяси Ф., Ишибаши М., Накамура Т., Накамура С., Такуми С.: Дифференциальная регуляция накопления транскриптов и альтернативный сплайсинг гомолога DREB2 в условиях абиотического стресса у мягкой пшеницы.Genes Genet Syst. 2006, 81 (2): 77-91. 10.1266 / ggs.81.77.
CAS PubMed Google Scholar
Christensen AH, Sharrock RA, Quail PH: Гены полиубиквитина кукурузы: структура, тепловое нарушение экспрессии и сплайсинг транскриптов, а также активность промотора после переноса в протопласты с помощью электропорации. Завод Мол Биол. 1992, 18 (4): 675-689. 10.1007 / BF00020010.
CAS PubMed Google Scholar
Хопф Н., Плесофски-Виг Н., Брамбл Р.: Реакция на тепловой шок пыльцы и других тканей кукурузы. Завод Мол Биол. 1992, 19 (4): 623-630. 10.1007 / BF00026788.
CAS PubMed Google Scholar
Mazzucotelli E, Mastrangelo AA, Crosatti C, Guerra D, Stanca AM, Cattivelli L: Абиотический стрессовый ответ у растений: когда транскрипционная и посттрансляционная регуляции контролируют транскрипцию. Plant Sci. 2008, 174: 420-431.10.1016 / j.plantsci.2008.02.005.
CAS Google Scholar
Али Г.С., Редди А.С.: Регулирование альтернативного сплайсинга пре-мРНК стрессами. Curr Top Microbiol Immunol. 2008, 326: 257-275.
CAS PubMed Google Scholar
Сайед Н.Х., Калина М., Маркес Й., Барта А., Браун Дж. У.: Альтернативное сращивание растений — взросление. Trends Plant Sci. 2012, 17 (10): 616-623.10.1016 / j.tplants.2012.06.001.
CAS PubMed Central PubMed Google Scholar
Джеймс А.Б., Сайед Н.Х., Бордедж С., Маршалл Дж., Ниммо Г.А., Дженкинс Г.И., Херзик П., Браун Дж. В., Ниммо Х.Г.: Альтернативное сращивание опосредует реакцию циркадных часов арабидопсиса на изменения температуры. Растительная клетка. 2012, 24 (3): 961-981. 10.1105 / tpc.111.093948.
CAS PubMed Central PubMed Google Scholar
Huber O, Sumper M: Algal-CAMs: изоформы молекулы клеточной адгезии в эмбрионах водоросли Volvox с гомологией с Drosophila fasiclin I. EMBO J. 1994, 13 (18): 4212-4222.
CAS PubMed Central PubMed Google Scholar
Kianianmomeni A, Nematollahi G, Hallmann A: Гендерный белок, связанный с ретинобластомой, в Volvox carteri подразумевает роль семейства белков ретинобластомы в половом развитии.Растительная клетка. 2008, 20 (9): 2399-2419. 10.1105 / tpc.107.057836.
CAS PubMed Central PubMed Google Scholar
Феррис П., Олсон Б.Дж., Де Хофф П.Л., Дуглас С., Касеро Д., Прочник С., Гэн С., Рай Р., Гримвуд Дж., Шмутц Дж., Нишии И., Хамаджи Т., Нодзаки Х, Пеллегрини М., Умен JG: Эволюция расширенного локуса определения пола в Volvox . Наука. 2010, 328 (5976): 351-354. 10.1126 / science.1186222.
CAS PubMed Central PubMed Google Scholar
Fuhrmann M, Stahlberg A, Govorunova E, Rank S, Hegemann P: Обильный белок сетчатки глаза Chlamydomonas не является фоторецептором для фототаксиса и фотофобных реакций. J Cell Sci. 2001, 114 (Pt 21): 3857-3863.
CAS PubMed Google Scholar
Schroda M, Vallon O, Whitelegge JP, Beck CF, Wollman FA: хлоропластный гомолог GrpE Chlamydomonas : две изоформы, полученные дифференциальным сплайсингом.Растительная клетка. 2001, 13 (12): 2823-2839. 10.1105 / tpc.13.12.2823.
CAS PubMed Central PubMed Google Scholar
Labadorf A, Link A, Rogers MF, Thomas J, Reddy AS, Ben-Hur A: Полногеномный анализ альтернативного сплайсинга у Chlamydomonas reinhardtii . BMC Genomics. 2010, 11: 114-10.1186 / 1471-2164-11-114.
PubMed Central PubMed Google Scholar
Herron MD, Hackett JD, Aylward FO, Michod RE: Триасовое происхождение и ранняя радиация многоклеточных водорослей volvocine. Proc Natl Acad Sci U S. A. 2009, 106 (9): 3254-3258. 10.1073 / pnas.0811205106.
CAS PubMed Central PubMed Google Scholar
Сандерсон MJ: Молекулярные данные 27 белков не подтверждают докембрийское происхождение наземных растений. Am J Bot. 2003, 90 (6): 954-956. 10.3732 / ajb.90.6.954.
CAS PubMed Google Scholar
Петерсон К.Дж., Баттерфилд, штат Нью-Джерси: Происхождение Эуметазоа: проверка экологических предсказаний молекулярных часов на фоне летописи окаменелостей протерозоя. Proc Natl Acad Sci U S. A. 2005, 102 (27): 9547-9552. 10.1073 / pnas.0503660102.
CAS PubMed Central PubMed Google Scholar
Кирк Д.Л.: Программа из двенадцати шагов для развития многоклеточности и разделения труда. Биологические исследования. 2005, 27 (3): 299-310. 10.1002 / bies.20197.
PubMed Google Scholar
Прочник С.Е., Умен Дж., Неделку А.М., Халльманн А., Миллер С.М., Ниший И., Феррис П., Куо А., Митрос Т., Фриц-Лейлин Л.К., Хеллстен Ю., Чепмен Дж., Симаков О., Ренсинг С.А., Терри А., Пангилинан Дж., Капитонов В., Юрка Дж., Саламов А., Шапиро Х., Шмутц Дж., Гримвуд Дж., Линдквист Е., Лукас С., Григорьев И. В., Шмитт Р., Кирк Д., Рохсар Д. С.: Геномный анализ сложности организма в многоклеточных системах. зеленая водоросль Volvox carteri .Наука. 2010, 329 (5988): 223-226. 10.1126 / science.1188800.
CAS PubMed Central PubMed Google Scholar
Merchant SS, Prochnik SE, Vallon O, Harris EH, Karpowicz SJ, Witman GB, Terry A, Salamov A, Fritz-Laylin LK, Marechal-Drouard L, Marshall WF, Qu LH, Nelson DR, Sanderfoot AA, Spalding MH, Капитонов В.В., Ren Q, Ferris P, Lindquist E, Shapiro H, Lucas SM, Grimwood J, Schmutz J, Cardol P, Cerutti H, Chanfreau G, Chen CL, Cognat V, Croft MT, Dent R, и др.: Геном Chlamydomonas раскрывает эволюцию ключевых функций животных и растений.Наука. 2007, 318 (5848): 245-250. 10.1126 / science.1143609.
CAS PubMed Central PubMed Google Scholar
Pennisi E: Volvox Геном показывает, что для того, чтобы быть многоклеточным, не нужно много времени. Наука. 2010, 329 (5988): 128-129.
CAS PubMed Google Scholar
Иримиа М., Пенни Д., Рой С.В.: Коэволюция числа интронов в геноме и сайтов сплайсинга.Тенденции Genet. 2007, 23 (7): 321-325. 10.1016 / j.tig.2007.04.001.
CAS PubMed Google Scholar
Holland LZ, Short S: Альтернативный сплайсинг в развитии и функционировании хордовых эндокринных систем: внимание к генам Pax. Интегр Комп Биол. 2010, 50 (1): 22-34. 10.1093 / icb / icq048.
CAS PubMed Google Scholar
Грабовски П. Альтернативный сплайсинг формируется во время развития нейронов.Curr Opin Genet Dev. 2011, 21 (4): 388-394. 10.1016 / j.gde.2011.03.005.
CAS PubMed Google Scholar
Лозада-Чавес И., Стадлер П.Ф., Прохаска С.Дж.: «Гипотеза современного мира РНК»: повсеместная некодирующая генетическая регуляция, основанная на РНК, является предпосылкой для возникновения многоклеточной сложности. Orig Life Evol Biosph. 2011, 41 (6): 587-607. 10.1007 / s11084-011-9262-1.
PubMed Google Scholar
Ким Э., Маген А., Аст Г.: Различные уровни альтернативного сплайсинга среди эукариот. Nucleic Acids Res. 2007, 35 (1): 125-131.
CAS PubMed Central PubMed Google Scholar
Рой М., Ким Н., Син Y, Ли К. Влияние длины интрона на соотношение создания экзонов во время эволюции геномов млекопитающих. РНК. 2008, 14 (11): 2261-2273. 10.1261 / rna.1024908.
CAS PubMed Central PubMed Google Scholar
Kent WJ: BLAT — инструмент для выравнивания типа BLAST. Genome Res. 2002, 12 (4): 656-664. 10.1101 / gr.229202. Статья опубликована в сети до марта 2002 г.
CAS PubMed Central PubMed Google Scholar
Спаркс М.Э., Брендель В. Включение моделей вероятности сайтов сплайсинга для неканонических интронов улучшает предсказание генной структуры растений. Биоинформатика. 2005, 21 Приложение 3: iii20-iii30.
PubMed Google Scholar
Yu AY, Houry WA: ClpP: особенное семейство цилиндрических энергозависимых сериновых протеаз. FEBS Lett. 2007, 581 (19): 3749-3757. 10.1016 / j.febslet.2007.04.076.
CAS PubMed Google Scholar
Majeran W, Friso G, van Wijk KJ, Vallon O: Хлоропластный комплекс ClpP в Chlamydomonas reinhardtii содержит необычную высокомолекулярную субъединицу с большим апикальным доменом. FEBS J. 2005, 272 (21): 5558-5571.10.1111 / j.1742-4658.2005.04951.x.
CAS PubMed Google Scholar
Ekici OD, Paetzel M, Dalbey RE: Нетрадиционные сериновые протеазы: варианты каталитической конфигурации триады Ser / His / Asp. Protein Sci. 2008, 17 (12): 2023-2037. 10.1110 / пс 035436.108.
CAS PubMed Central PubMed Google Scholar
Ван Дж., Хартлинг Дж. А., Фланаган Дж. М.: Структура ClpP в 2.Разрешение 3 Å предлагает модель АТФ-зависимого протеолиза. Клетка. 1997, 91 (4): 447-456. 10.1016 / S0092-8674 (00) 80431-6.
CAS PubMed Google Scholar
Бове Дж., Ким С.Ю., Гибсон К.А., Ассманн С.М.: Характеристика реагирующих на рану РНК-связывающих белков и их вариантов сплайсинга в Arabidopsis . Завод Мол Биол. 2008, 67 (1-2): 71-88.
CAS PubMed Google Scholar
Moll AG, Lindenmeyer MT, Kretzler M, Nelson PJ, Zimmer R, Cohen CD: профили экспрессии, специфичные для транскриптов, полученные на основе анализа последовательностей стандартных микрочипов. PLoS One. 2009, 4 (3): e4702-10.1371 / journal.pone.0004702.
PubMed Central PubMed Google Scholar
Чемберлен К.Л., Миллер С.Х., Келлер Л.Р.: Профилирование генной экспрессии разборки жгутиков у Chlamydomonas reinhardtii . Генетика.2008, 179 (1): 7-19. 10.1534 / genetics.107.082149.
CAS PubMed Central PubMed Google Scholar
Амон П., Хаас Э., Сампер М.: Феромон, вызывающий секс, и нанесение ран запускают один и тот же набор генов в многоклеточной зеленой водоросли Volvox . Растительная клетка. 1998, 10 (5): 781-789. 10.1105 / tpc.10.5.781.
CAS PubMed Central PubMed Google Scholar
Hallmann A: Ферофорины: общие, универсальные строительные блоки в эволюции архитектуры внеклеточного матрикса в Volvocales. Плант Дж. 2006, 45 (2): 292-307. 10.1111 / j.1365-313X.2005.02627.x.
CAS PubMed Google Scholar
Nematollahi G, Kianianmomeni A, Hallmann A: Количественный анализ экспрессии генов, специфичных для клеточного типа, в зеленой водоросли Volvox carteri . BMC Genomics. 2006, 7 (1): 321-10.1186 / 1471-2164-7-321.
PubMed Central PubMed Google Scholar
Fraga D, Meulia T, Fenster S: ПЦР в реальном времени. Текущие протоколы Основные лабораторные методы. Отредактировано: Gallagher SR, Wiley EA. 2008, Нью-Йорк: John Wiley & Sons
Google Scholar
Hilgenfeld R: Регулирующие GTPases. Curr Opin Struct Biol. 1995, 5 (6): 810-817. 10.1016 / 0959-440X (95) 80015-8.
CAS PubMed Google Scholar
Agirrezabala X, Frank J: Элонгация при трансляции как динамическое взаимодействие между рибосомой, тРНК и факторами элонгации EF-G и EF-Tu. Q Rev Biophys. 2009, 42 (3): 159-200. 10.1017 / S00335835099.
CAS PubMed Central PubMed Google Scholar
Kjeldgaard M, Nyborg J: Уточненная структура фактора удлинения EF-Tu из Escherichia coli .J Mol Biol. 1992, 223 (3): 721-742. 10.1016 / 0022-2836 (92) -Т.
CAS PubMed Google Scholar
Кавасима Т., Бертет-Коломинас С., Вульф М., Кьюсак С., Леберман Р.: Структура комплекса Escherichia coli EF-Tu.EF-Ts при разрешении 2,5 Å. Природа. 1996, 379 (6565): 511-518. 10.1038 / 379511a0.
CAS PubMed Google Scholar
Bourne HR, Sanders DA, McCormick F: Суперсемейство GTPase: консервативная структура и молекулярный механизм. Природа. 1991, 349 (6305): 117-127. 10.1038 / 349117a0.
CAS PubMed Google Scholar
Berchtold H, Reshetnikova L, Reiser CO, Schirmer NK, Sprinzl M, Hilgenfeld R: Кристаллическая структура активного фактора удлинения Tu выявляет основные доменные перестройки. Природа. 1993, 365 (6442): 126-132. 10.1038 / 365126a0.
CAS PubMed Google Scholar
Nissen P, Kjeldgaard M, Thirup S, Polekhina G, Reshetnikova L, Clark BF, Nyborg J: Кристаллическая структура тройного комплекса Phe-tRNAPhe, EF-Tu и аналога GTP. Наука. 1995, 270 (5241): 1464-1472. 10.1126 / science.270.5241.1464.
CAS PubMed Google Scholar
Адамс MW: Структура и механизм гидрогеназ железа. Biochim Biophys Acta. 1990, 1020 (2): 115-145. 10.1016 / 0005-2728 (90)
-5.
CAS PubMed Google Scholar
Przybyla AE, Robbins J, Menon N, Peck HD: Структурно-функциональные отношения между никельсодержащими гидрогеназами. FEMS Microbiol Rev.1992, 8 (2): 109-135.
CAS PubMed Google Scholar
Хаппе Т., Камински А: Дифференциальная регуляция Fe-гидрогеназы во время анаэробной адаптации у зеленой водоросли Chlamydomonas reinhardtii . Eur J Biochem. 2002, 269 (3): 1022-1032. 10.1046 / j.0014-2956.2001.02743.x.
CAS PubMed Google Scholar
Forestier M, King P, Zhang L, Posewitz M, Schwarzer S, Happe T., Ghirardi ML, Seibert M: Экспрессия двух [Fe] -гидрогеназ в Chlamydomonas reinhardtii в анаэробных условиях. Eur J Biochem. 2003, 270 (13): 2750-2758. 10.1046 / j.1432-1033.2003.03656.
CAS PubMed Google Scholar
Петерс Дж. В., Ланзилотта В. Н., Лимон Б. Дж., Зеефельдт LC: рентгеновская кристаллическая структура Fe-only гидрогеназы (CpI) от Clostridium pasteurianum до разрешения 1,8 Ангстрема. Наука. 1998, 282 (5395): 1853-1858.
CAS PubMed Google Scholar
Shimizu T, Inoue T., Shiraishi H: Клонирование и характеристика новых экстенсиноподобных кДНК, которые экспрессируются во время поздней фазы соматических клеток в зеленой водоросли Volvox carteri .Ген. 2002, 284 (1-2): 179-187.
CAS PubMed Google Scholar
Киношита Т., Фукудзава Х., Шимада Т., Сайто Т., Мацуда Ю.: Первичная структура и экспрессия литического фермента гамет в Chlamydomonas reinhardtii : сходство функциональных доменов с матриксными металлопротеазами. Proc Natl Acad Sci U S. A. 1992, 89 (10): 4693-4697. 10.1073 / pnas.89.10.4693.
CAS PubMed Central PubMed Google Scholar
Hallmann A, Amon P, Godl K, Heitzer M, Sumper M: Активация транскрипции половым феромоном и ранение: новое семейство генов из Volvox , кодирующих модульные белки с (гидрокси) пролин-богатыми и гомологичными доменами металлопротеиназы. Плант Дж. 2001, 26 (6): 583-593. 10.1046 / j.1365-313x.2001.01059.x.
CAS PubMed Google Scholar
Heitzer M, Hallmann A: Металлопротеиназа, локализованная во внеклеточном матриксе, с исключительным сайтом связывания металла QEXXH предпочитает медь для каталитической активности.J Biol Chem. 2002, 277 (31): 28280-28286. 10.1074 / jbc.M203925200.
CAS PubMed Google Scholar
Хупер Н.М.: Семейства металлопротеаз цинка. FEBS Lett. 1994, 354 (1): 1-6. 10.1016 / 0014-5793 (94) 01079-Х.
CAS PubMed Google Scholar
Соедзима Х, Чжао В., Мукаи Т: Эпигенетическое молчание гена MGMT при раке. Biochem Cell Biol.2005, 83 (4): 429-437. 10.1139 / о05-140.
CAS PubMed Google Scholar
Каина Б., Кристманн М., Науманн С., Роос В.П.: MGMT: ключевой узел в битве против генотоксичности, канцерогенности и апоптоза, вызванных алкилирующими агентами. Ремонт ДНК (Amst). 2007, 6 (8): 1079-1099. 10.1016 / j.dnarep.2007.03.008.
CAS Google Scholar
Марджисон Г.П., Повей А.С., Каина Б., Сантибаньес Кореф М.Ф .: Изменчивость и регуляция O 6 -алкилгуанин-ДНК-алкилтрансферазы.Канцерогенез. 2003, 24 (4): 625-635. 10.1093 / carcin / bgg005.
CAS PubMed Google Scholar
Daniels DS, Mol CD, Arvai AS, Kanugula S, Pegg AE, Tainer JA: Активные и алкилированные структуры AGT человека: новый сайт цинка, ингибитор и связывание внеспиральных оснований. EMBO J. 2000, 19 (7): 1719-1730. 10.1093 / emboj / 19.7.1719.
CAS PubMed Central PubMed Google Scholar
Дэниэлс Д.С., Ву Т.Т., Луу К.Х., Нолл Д.М., Кларк Н.Д., Пегг А.Е., Тайнер Дж.А.: Связывание ДНК и переключение нуклеотидов белком репарации ДНК человека AGT. Nat Struct Mol Biol. 2004, 11 (8): 714-720. 10.1038 / nsmb791.
CAS PubMed Google Scholar
Дугуид Е.М., Райс П.А., He C: Структура человеческого белка AGT, связанного с ДНК, и ее значение для обнаружения повреждений. J Mol Biol. 2005, 350 (4): 657-666. 10.1016 / j.jmb.2005.05.028.
CAS PubMed Google Scholar
Дрейфус Дж., Ким В.Н., Катаока Н.: Белки, связывающие РНК-мессенджер, и сообщения, которые они несут. Nat Rev Mol Cell Biol. 2002, 3 (3): 195-205. 10.1038 / nrm760.
CAS PubMed Google Scholar
Марис С., Домингес С., Аллен Ф. Х .: Мотив распознавания РНК, пластиковая платформа для связывания РНК для регуляции посттранскрипционной экспрессии генов.FEBS J. 2005, 272 (9): 2118-2131. 10.1111 / j.1742-4658.2005.04653.x.
CAS PubMed Google Scholar
Cléry A, Blatter M, Allain FH: Мотивы распознавания РНК: скучно? не совсем. Curr Opin Struct Biol. 2008, 18 (3): 290-298. 10.1016 / j.sbi.2008.04.002.
PubMed Google Scholar
Oubridge C, Ito N, Evans PR, Teo CH, Nagai K: Кристаллическая структура на 1.Разрешение 92 Å РНК-связывающего домена сплайсосомного белка U1A в комплексе со шпилькой РНК. Природа. 1994, 372 (6505): 432-438. 10.1038 / 372432a0.
CAS PubMed Google Scholar
Low SC, Берри MJ: Знать, когда не останавливаться: включение селеноцистеина в эукариотах. Trends Biochem Sci. 1996, 21 (6): 203-208. 10.1016 / 0968-0004 (96) 10025-6.
CAS PubMed Google Scholar
Ван П., Хейтман Дж .: Циклофилины. Genome Biol. 2005, 6 (7): 226-10.1186 / GB-2005-6-7-226.
PubMed Central PubMed Google Scholar
Maleszka R, Lupas A, Hanes SD, Miklos GL: Семейство генов dodo кодирует новый белок, участвующий в передаче сигнала и сворачивании белка. Ген. 1997, 203 (2): 89-93. 10.1016 / S0378-1119 (97) 00522-2.
CAS PubMed Google Scholar
Горовиц Д.С., Ли Э.Дж., Мабон С.А., Мистели Т .: Циклофилин участвует в сплайсинге пре-мРНК. EMBO J. 2002, 21 (3): 470-480. 10.1093 / emboj / 21.3.470.
CAS PubMed Central PubMed Google Scholar
Ingelfinger D, Gothel SF, Marahiel MA, Reidt U, Ficner R, Luhrmann R, Achsel T: два сайта белок-белкового взаимодействия на связанном со сплайсосомой циклофилине человека CypH. Nucleic Acids Res. 2003, 31 (16): 4791-4796.10.1093 / нар / гкг660.
CAS PubMed Central PubMed Google Scholar
He Z, Li L, Luan S: иммунофилины и парвулины. суперсемейство пептидилпролилизомераз Arabidopsis. Plant Physiol. 2004, 134 (4): 1248-1267. 10.1104 / стр.103.031005.
CAS PubMed Central PubMed Google Scholar
Романо П., Грей Дж., Хортон П., Луан С.: Иммунофилины растений: функциональная универсальность за пределами созревания белка.Новый Фитол. 2005, 166 (3): 753-769. 10.1111 / j.1469-8137.2005.01373.x.
CAS PubMed Google Scholar
Каллен Дж., Шпицфаден С., Цурини М.Г., Уайдер Дж., Видмер Х., Вутрих К., Уолкиншоу М.Д.: Структура человеческого циклофилина и его сайт связывания для циклоспорина А, определенные с помощью рентгеновской кристаллографии и ЯМР-спектроскопии. Природа. 1991, 353 (6341): 276-279. 10.1038 / 353276a0.
CAS PubMed Google Scholar
Pflügl G, Kallen J, Schirmer T, Jansonius JN, Zurini MG, Walkinshaw MD: Рентгеновская структура декамерного кристаллического комплекса циклофилин-циклоспорин. Природа. 1993, 361 (6407): 91-94. 10.1038 / 361091a0.
PubMed Google Scholar
Zydowsky LD, Etzkorn FA, Chang HY, Ferguson SB, Stolz LA, Ho SI, Walsh CT: Мутанты по активному центру человеческого циклофилина A отделяют активность пептидил-пролилизомеразы от связывания циклоспорина A и ингибирования кальциневрина.Protein Sci. 1992, 1 (9): 1092-1099. 10.1002 / pro.5560010903.
CAS PubMed Central PubMed Google Scholar
Cardenas ME, Lim E, Heitman J: Мутации, которые нарушают лиганд-связывающий карман циклофилина A, придают устойчивость к циклоспорину A в Saccharomyces cerevisiae . J Biol Chem. 1995, 270 (36): 20997-21002. 10.1074 / jbc.270.36.20997.
CAS PubMed Google Scholar
Tam LW, Кирк DL: Идентификация специфичных для клеточного типа генов Volvox carteri и характеристика их экспрессии в течение бесполого жизненного цикла. Dev Biol. 1991, 145 (1): 51-66. 10.1016 / 0012-1606 (91) -Л.
CAS PubMed Google Scholar
Meissner M, Stark K, Cresnar B, Kirk DL, Schmitt R: Volvox гены, специфичные для зародышевой линии, которые являются предполагаемыми мишенями репрессии RegA, кодируют хлоропластные белки.Curr Genet. 1999, 36 (6): 363-370. 10.1007 / s002940050511.
CAS PubMed Google Scholar
Mayfield SP, Bennoun P, Rochaix JD: Экспрессия ядерного белка OEE1 необходима для выделения кислорода и стабильности частиц фотосистемы II в Chlamydomonas reinhardtii . EMBO J. 1987, 6 (2): 313-318.
CAS PubMed Central PubMed Google Scholar
Yi X, McChargue M, Laborde S, Frankel LK, Bricker TM: Белок, стабилизирующий марганец, необходим для сборки / стабильности фотосистемы II и фотоавтотрофии у высших растений. J Biol Chem. 2005, 280 (16): 16170-16174. 10.1074 / jbc.M501550200.
CAS PubMed Google Scholar
Гарсия-Химено М.А., Муньос И., Ариньо Дж., Санс П.: Молекулярная характеристика Ypi1, нового ингибитора протеинфосфатазы Saccharomyces cerevisiae типа 1.J Biol Chem. 2003, 278 (48): 47744-47752. 10.1074 / jbc.M306157200.
PubMed Google Scholar
Пазур Г.Дж., Агрин Н., Лешик Дж., Уитман Г.Б.: Протеомный анализ ресничек эукариот. J Cell Biol. 2005, 170 (1): 103-113. 10.1083 / jcb.200504008.
CAS PubMed Central PubMed Google Scholar
Модрек Б., Реш А., Грассо С., Ли С. Обнаружение альтернативного сплайсинга по всему геному в экспрессируемых последовательностях генов человека.Nucleic Acids Res. 2001, 29 (13): 2850-2859. 10.1093 / nar / 29.13.2850.
CAS PubMed Central PubMed Google Scholar
Zavolan M, Kondo S, Schonbach C, Adachi J, Hume DA, Hayashizaki Y, Gaasterland T: Влияние альтернативной инициации, сплайсинга и терминации на разнообразие транскриптов мРНК, кодируемых транскриптомом мыши. Genome Res. 2003, 13 (6B): 1290-1300.
CAS PubMed Central PubMed Google Scholar
Гупта С., Цинк Д., Корн Б., Вингрон М., Хаас С.А.: Идентификация и классификация альтернативного сплайсинга по всему геному на основе данных EST. Биоинформатика. 2004, 20 (16): 2579-2585. 10.1093 / биоинформатика / bth388.
CAS PubMed Google Scholar
Окадзаки Ю., Фуруно М., Касукава Т., Адачи Дж., Боно Х, Кондо С., Никайдо И., Осато Н., Сайто Р., Судзуки Х, Яманака И., Киёсава Х, Яги К., Томару Ю., Хасэгава Ю. , Nogami A, Schönbach C, Gojobori T, Baldarelli R, Hill DP, Bult C, Hume DA, Quackenbush J, Schriml LM, Kanapin A, Matsuda H, Batalov S, Beisel KW, Blake JA, Bradt D, et al: Анализ транскриптома мыши на основе функциональной аннотации 60 770 полноразмерных кДНК.Природа. 2002, 420 (6915): 563-573. 10.1038 / природа01266.
PubMed Google Scholar
Nilsen TW, Graveley BR: Расширение эукариотического протеома путем альтернативного сплайсинга. Природа. 2010, 463 (7280): 457-463. 10.1038 / природа08909.
CAS PubMed Central PubMed Google Scholar
Клафф П., Ризнер Д., Стегер Г.: Структура РНК и регуляция экспрессии генов.Завод Мол Биол. 1996, 32 (1-2): 89-106.
CAS PubMed Google Scholar
Накли А.Г., Шабалина С.А., Чивилева И.Е., Саттерфилд К., Корчинский О., Макаров С.С., Майкснер В., Дьяченко Л. Гаплотипы катехол-О-метилтрансферазы человека модулируют экспрессию белка, изменяя вторичную структуру мРНК. Наука. 2006, 314 (5807): 1930-1933. 10.1126 / science.1131262.
CAS PubMed Google Scholar
Kudla G, Murray AW, Tollervey D, Plotkin JB: Детерминанты кодирующей последовательности экспрессии генов в Escherichia coli . Наука. 2009, 324 (5924): 255-258. 10.1126 / science.1170160.
CAS PubMed Central PubMed Google Scholar
Gommans WM, Mullen SP, Maas S: Редактирование РНК: движущая сила адаптивной эволюции ?. Биологические исследования. 2009, 31 (10): 1137-1145. 10.1002 / bies.200
CAS PubMed Central PubMed Google Scholar
Surdej P, Riedl A, Jacobs-Lorena M: Регулирование стабильности мРНК в развитии. Анну Рев Жене. 1994, 28: 263-282. 10.1146 / annurev.ge.28.120194.001403.
CAS PubMed Google Scholar
Gamazon ER, Stranger BE: Геномика альтернативного сплайсинга: эволюция, развитие и патофизиология. Hum Genet. 2014, 133 (6): 679-687. 10.1007 / s00439-013-1411-3.
CAS PubMed Google Scholar
Федорова Л., Федоров А: Загадки генома человека: зачем нам наши интроны ?. Curr Genomics. 2005, 6 (8): 589-595. 10.2174 / 138920205775811416.
CAS Google Scholar
Галанте П.А., Сакабе, штат Нью-Джерси, Киршбаум-Слагер Н., де Соуза С.Дж.: Обнаружение и оценка событий удержания интронов в человеческом транскриптоме. РНК. 2004, 10 (5): 757-765. 10.1261 / rna.5123504.
CAS PubMed Central PubMed Google Scholar
Stamm S, Zhu J, Nakai K, Stoilov P, Stoss O, Zhang MQ: База данных альтернативных экзонов и ее статистический анализ. ДНК Cell Biol. 2000, 19 (12): 739-756. 10.1089 / 1044540058107.
CAS PubMed Google Scholar
Zheng CL, Fu XD, Gribskov M: Характеристики и регуляторные элементы, определяющие конститутивный сплайсинг и различные способы альтернативного сплайсинга у человека и мыши. РНК. 2005, 11 (12): 1777-1787.10.1261 / rna.2660805.
CAS PubMed Central PubMed Google Scholar
McGuire AM, Pearson MD, Neafsey DE, Galagan JE: Схемы альтернативного сращивания и распознавания сращивания в разных странах. Genome Biol. 2008, 9 (3): R50-10.1186 / GB-2008-9-3-R50.
PubMed Central PubMed Google Scholar
Кандул Н.П., Нур М.А.: Большие интроны в отношении альтернативного сплайсинга и эволюции генов: тематическое исследование Drosophila bruno-3.BMC Genet. 2009, 10: 67-
PubMed Central PubMed Google Scholar
Fox-Walsh KL, Dou Y, Lam BJ, Hung SP, Baldi PF, Hertel KJ: Архитектура пре-мРНК влияет на механизмы сплайсинга сайтов. Proc Natl Acad Sci U S. A. 2005, 102 (45): 16176-16181. 10.1073 / pnas.0508489102.
CAS PubMed Central PubMed Google Scholar
Янофски М.Ф., Ма Х., Боумен Д.Л., Дрюс Г.Н., Фельдманн К.А., Мейеровиц Е.М.: Белок, кодируемый гомеотическим геном Arabidopsis , похож на факторы транскрипции.Природа. 1990, 346 (6279): 35-39. 10.1038 / 346035a0.
CAS PubMed Google Scholar
Хонг Р.Л., Хамагучи Л., Буш М.А., Вейгель Д.: Регуляторные элементы цветочного гомеотического гена AGAMOUS, идентифицированные с помощью филогенетического следа и затенения. Растительная клетка. 2003, 15 (6): 1296-1309.
CAS PubMed Central PubMed Google Scholar
Bruggmann R, Bharti AK, Gundlach H, Lai J, Young S, Pontaroli AC, Wei F, Haberer G, Fuks G, Du C, Raymond C, Estep MC, Liu R, Bennetzen JL, Chan AP , Rabinowicz PD, Quackenbush J, Barbazuk WB, Wing RA, Birren B, Nusbaum C, Rounsley S, Mayer KF, Messing J: Неравномерное сокращение и расширение хромосом в геноме кукурузы.Genome Res. 2006, 16 (10): 1241-1251. 10.1101 / гр.5338906.
CAS PubMed Central PubMed Google Scholar
Kobayashi Y, Dokiya Y, Sugiura M, Niwa Y, Sugita M: Геномная организация и органоспецифическая экспрессия ядерного гена, кодирующего РНК-полимеразу фагового типа в Nicotiana sylvestris . Ген. 2001, 279 (1): 33-40. 10.1016 / S0378-1119 (01) 00729-6.
CAS PubMed Google Scholar
Tadege M, Sheldon CC, Helliwell CA, Upadhyaya NM, Dennis ES, Peacock WJ: Взаимный контроль времени цветения с помощью OsSOC1 в трансгенном Arabidopsis и с помощью FLC в трансгенном рисе. Plant Biotechnol J. 2003, 1 (5): 361-369. 10.1046 / j.1467-7652.2003.00034.x.
CAS PubMed Google Scholar
Haddrill PR, Charlesworth B, Halligan DL, Andolfatto P: Паттерны эволюции интронной последовательности у Drosophila зависят от длины и содержания GC.Genome Biol. 2005, 6 (8): R67-10.1186 / GB-2005-6-8-r67.
PubMed Central PubMed Google Scholar
Marais G, Nouvellet P, Keightley PD, Charlesworth B: Размер интрона и эволюция экзона у Drosophila . Генетика. 2005, 170 (1): 481-485. 10.1534 / genetics.104.037333.
CAS PubMed Central PubMed Google Scholar
Иримиа М., Руков Дж. Л., Пенни Д., Рой С.В.: Функциональный и эволюционный анализ альтернативно сплайсированных генов согласуется с ранним эукариотическим происхождением альтернативного сплайсинга.BMC Evol Biol. 2007, 7: 188-10.1186 / 1471-2148-7-188.
PubMed Central PubMed Google Scholar
Луко Р.Ф., Алло М., Шор И.Е., Корнблихтт А.Р., Мистели Т .: Эпигенетика в альтернативном сплайсинге пре-мРНК. Клетка. 2011, 144 (1): 16-26. 10.1016 / j.cell.2010.11.056.
CAS PubMed Central PubMed Google Scholar
Танери Б., Снайдер Б., Новорадовский А., Гаастерланд Т.: Альтернативный сплайсинг факторов транскрипции мыши влияет на архитектуру их ДНК-связывающих доменов и является тканеспецифичным.Genome Biol. 2004, 5 (10): R75-10.1186 / GB-2004-5-10-r75.
PubMed Central PubMed Google Scholar
Умен Дж. Г., Гуденаф Ю. В.: Контроль деления клеток с помощью гомолога белка ретинобластомы в Chlamydomonas . Genes Dev. 2001, 15 (13): 1652-1661. 10.1101 / гад.892101.
CAS PubMed Central PubMed Google Scholar
Умень JG: Эволюция пола и локусов спаривания: увеличенное изображение с вольвоциновых водорослей.Curr Opin Microbiol. 2011, 14 (6): 634-641. 10.1016 / j.mib.2011.10.005.
PubMed Central PubMed Google Scholar
Xiao YL, Smith SR, Ishmael N, Redman JC, Kumar N, Monaghan EL, Ayele M, Haas BJ, Wu HC, Town CD: Анализ кДНК гипотетических генов на хромосоме 2 Arabidopsis показывает многочисленные варианты транскриптов. Plant Physiol. 2005, 139 (3): 1323-1337. 10.1104 / pp.105.063479.
CAS PubMed Central PubMed Google Scholar
Меламуд Э., Моулт Дж .: Стохастический шум в сварочном оборудовании. Nucleic Acids Res. 2009, 37 (14): 4873-4886. 10.1093 / нар / gkp471.
CAS PubMed Central PubMed Google Scholar
Пикрелл Дж. К., Пай А. А., Гилад Ю., Притчард Дж. К.: Шумный сплайсинг стимулирует разнообразие изоформ мРНК в клетках человека. PLoS Genet. 2010, 6 (12): e1001236-10.1371 / journal.pgen.1001236.
PubMed Central PubMed Google Scholar
Resch A, Xing Y, Alekseyenko A, Modrek B, Lee C: Доказательства субпопуляции консервативных альтернативных событий сплайсинга под давлением отбора для сохранения рамки считывания белка. Nucleic Acids Res. 2004, 32 (4): 1261-1269. 10.1093 / нар / гх384.
CAS PubMed Central PubMed Google Scholar
Адамс С.Р., Стамер К.А., Миллер Дж.К., МакНалли Дж.Г., Кирк М.М., Кирк Д.Л.: Паттерны наследования органеллы и ядра среди потомков двух географически изолированных штаммов Volvox carteri .Curr Genet. 1990, 18 (2): 141-153. 10.1007 / BF00312602.
CAS PubMed Google Scholar
Provasoli L, Pintner IJ: Искусственные среды для пресноводных водорослей: проблемы и предложения. Симпозиум «Экология водорослей», проведенный в лаборатории полевой биологии Пиматунинга 18 и 19 июня 1959 г. Под редакцией: Tryon CA, Hartman RT. 1959, Питтсбург, Пенсильвания: Симпозиумы Пиматунинга по экологии, Специальная публикация № 2., Университет Питтсбурга, 84-96.1
Google Scholar
Starr RC, Jaenicke L: Очистка и характеристика гормона, инициирующего половой морфогенез в Volvox carteri f. nagariensis Айенгар. Proc Natl Acad Sci U S. A. 1974, 71 (4): 1050-1054. 10.1073 / pnas.71.4.1050.
CAS PubMed Central PubMed Google Scholar
Sambrook J, Russell DW: Molecular Cloning: A Laboratory Manual (3rd Edition), Vol.1-3, 3-е изд. 2001, Колд-Спринг-Харбор, Нью-Йорк: Лабораторный пресс Колд-Спринг-Харбор
Google Scholar
Cresnar B, Mages W, Müller K, Salbaum JM, Schmitt R: Структура и экспрессия одного гена актина в Volvox carteri . Curr Genet. 1990, 18 (4): 337-346. 10.1007 / BF00318215.
CAS PubMed Google Scholar
Бустин С.А.: Абсолютное количественное определение мРНК с использованием анализов полимеразной цепной реакции с обратной транскрипцией в реальном времени.J Mol Endocrinol. 2000, 25 (2): 169-193. 10.1677 / jme.0.0250169.
CAS PubMed Google Scholar
Pfaffl MW: новая математическая модель для относительного количественного определения в RT-PCR в реальном времени. Nucleic Acids Res. 2001, 29 (9): e45-10.1093 / nar / 29.9.e45.
CAS PubMed Central PubMed Google Scholar
протистология 11-4.indd
% PDF-1.4 % 1 0 объект > эндобдж 7 0 объект /Заголовок /Предмет / Автор /Режиссер / Ключевые слова / CreationDate (D: 20210607100012-00’00 ‘) / ModDate (D: 20180113175535 + 03’00 ‘) >> эндобдж 2 0 obj > эндобдж 3 0 obj > эндобдж 4 0 obj > эндобдж 5 0 obj > эндобдж 6 0 obj > поток PScript5.dll Версия 5.2.22018-01-13T17: 55: 35 + 03: 002018-01-13T17: 49: 27 + 03: 002018-01-13T17: 55: 35 + 03: 00application / pdf
