форма клетки Амебы, Эвглены зеленой и Инфузории-туфельки. Помогите плиз:)
1) Амёба обыкновенная
Форма тела: Постоянно меняется.
Размеры: Её тело состоит из одной клетки и достигает в диаметре 0,1-0,3 мм.
Среда обитания: Можно обнаружить в небольших мелких прудах или проточных канавах с илистым дном.
Наружный покров: Оболочка состоит из цитоплазматической мембраны.
Цитоплазма: Постоянно движется и способна довольно быстро переходить из более густого состояния в более жидкое и обратно.
Органы движения: Ложконожка.
Особенности питания и пищеварения: Питается, поглощая бактерии, одноклеточные водоросли и другие мелкие организмы, кусочки мёртвой органики.
Органоиды и выделения: Вакуоли.
Дыхание: Всей поверхностью тела.
Ядерный аппарат: Имеется ядро.
Размножение: Размножается делением клетки надвое.
2) Инфузория-туфелька
Форма тела: Имеет постоянную форму тела, напоминающую туфельку с тупым передним и заострённым задним концами.
Размеры: Их размеры около 0,2-0,3 мм.
Среда обитания: Живёт в стоячих водоёмах с большим количеством разлагающихся органических веществ.
Наружный покров: На поверхности клетки продольными рядами расположено огромное количество ресничек.
Цитоплазма: Покрыта тонкой и гибкой очень сложно устроенной оболочкой, имеется цитоплазма.
Органы движения: Передвигается с помощью ресничек.
Особенности питания и пищеварения: Питается бактериями, на дне глотки пища попадает в пищеварительную вакуоль, где и переваривается.
Органоиды и выделения: Сократительная вакуоль.
Дыхание: Всей поверхностью тела.
Ядерный аппарат: Имеется два разных по строению и функциям ядра.
Размножение: Бесполое размножение — поперечное деление клетки надвое, половой процесс — конъюгация.
3) Эвглена зелёная
Форма тела: Таллом эвглены зелёной имеет тонкий покров, что способствует изменению формы тела.
Размеры: Длина тела 50-60 микрометров, ширина 14-18 микрометров.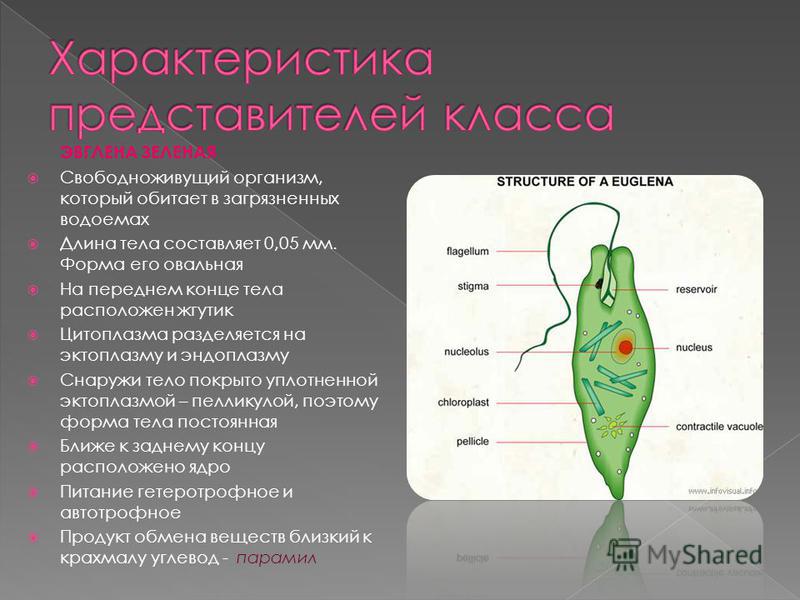
Среда обитания: Живёт в мелких стоячих пресных водоёмах, в которых много органических веществ.
Наружный покров: Наружный слой цитоплазмы эвглены плотный, он образует вокруг ее тела оболочку.
Цитоплазма: В цитоплазме — хроматофоры и зёрна парамила (резервное питательное вещество).
Органы движения: Движется при помощи жгутика, который находится на переднем конце клетки.
Особенности питания и пищеварения: Поглощает готовые органические вещества.
Органоиды и выделения: Сократительная вакуоль.
Дыхание: Всей поверхностью тела.
Ядерный аппарат: В цитоплазме находится одно крупное ядро.
Размножение: Размножается делением клетки надвое.
Форма клетки Амебы, Эвглены зеленой и Инфузории-туфельки. Помогите плиз:)
1) Амёба обыкновенная
Форма тела: Постоянно меняется.
Размеры: Её тело состоит из одной клетки и достигает в диаметре 0,1-0,3 мм.
Среда обитания: Можно обнаружить в небольших мелких прудах или проточных канавах с илистым дном.
Наружный покров: Оболочка состоит из цитоплазматической мембраны.
Цитоплазма: Постоянно движется и способна довольно быстро переходить из более густого состояния в более жидкое и обратно.
Органы движения: Ложконожка.
Особенности питания и пищеварения: Питается, поглощая бактерии, одноклеточные водоросли и другие мелкие организмы, кусочки мёртвой органики.
Органоиды и выделения: Вакуоли.
Дыхание: Всей поверхностью тела.
Ядерный аппарат: Имеется ядро.
Размножение: Размножается делением клетки надвое.
2) Инфузория-туфелька
Форма тела: Имеет постоянную форму тела, напоминающую туфельку с тупым передним и заострённым задним концами.
Размеры: Их размеры около 0,2-0,3 мм.
Среда обитания: Живёт в стоячих водоёмах с большим количеством разлагающихся органических веществ.
Наружный покров: На поверхности клетки продольными рядами расположено огромное количество ресничек.
Цитоплазма: Покрыта тонкой и гибкой очень сложно устроенной оболочкой, имеется цитоплазма.
Органы движения: Передвигается с помощью ресничек.
Особенности питания и пищеварения: Питается бактериями, на дне глотки пища попадает в пищеварительную вакуоль, где и переваривается.
Органоиды и выделения: Сократительная вакуоль.
Дыхание: Всей поверхностью тела.
Ядерный аппарат: Имеется два разных по строению и функциям ядра.
Размножение: Бесполое размножение — поперечное деление клетки надвое, половой процесс — конъюгация.
3) Эвглена зелёная
Форма тела: Таллом эвглены зелёной имеет тонкий покров, что способствует изменению формы тела.
Размеры: Длина тела 50-60 микрометров, ширина 14-18 микрометров.
Среда обитания: Живёт в мелких стоячих пресных водоёмах, в которых много органических веществ.
Наружный покров: Наружный слой цитоплазмы эвглены плотный, он образует вокруг ее тела оболочку.
Цитоплазма: В цитоплазме — хроматофоры и зёрна парамила (резервное питательное вещество).
Органы движения: Движется при помощи жгутика, который находится на переднем конце клетки.
Особенности питания и пищеварения: Поглощает готовые органические вещества.
Органоиды и выделения: Сократительная вакуоль.
Дыхание: Всей поверхностью тела.
Ядерный аппарат: В цитоплазме находится одно крупное ядро.
Размножение: Размножается делением клетки надвое.
Биология для студентов — 05. Простейшие
Одним из наиболее важных признаков, используемых в классификации простейших, служат органоиды движения. У жгутиковых это жгуты, или бичи — тонкие цитоплазматические выросты
. Они обычно находятся на переднем конце тела и отходят от особых базальных зерен (базального тела или кинетосомы). Количество жгутиков у разных видов колеблется от 1 до 8 и более. У некоторых представителей класса жгутик проходит вдоль тела, соединяясь с ним тонким выростом цитоплазмы. Упомянутый вырост, или ундулируюшая мембрана, совершает волнообразные движения и служит дополнительным органоидом движения.Тело жгутиковых имеет микроскопические размеры, покрыто пелликулой и имеет относительно постоянную форму (овальную, грушевидную или веретеновидную), характерную для каждого вида. Ядро клетки пузырьковидной формы, содержит одно или несколько ядрышек. Обычно жгутиковые имеют по одному ядру, но встречаются двухядерные формы. У многих видов имеются сократительные вакуоли, у паразитических форм она отсутствует.
Ядро клетки пузырьковидной формы, содержит одно или несколько ядрышек. Обычно жгутиковые имеют по одному ядру, но встречаются двухядерные формы. У многих видов имеются сократительные вакуоли, у паразитических форм она отсутствует.
По способу питания (ассимиляции) делятся на:
- гетеротрофных — имеют пищеварительные вакуоли. Паразитические формы всасывают пишу всей поверхностью тела, в основном путем пиноцитоза,
- аутотрофных — органоидами питания служат хлоропласты,
- миксотрофных — могут использовать для питания как неорганические, так и органические вещества, что позволяет относить их к переходным формам от растений к животным.
Размножение обычно бесполое, путем продольного деления на две части. У многих видов имеется и половой процесс, во время которого происходит слияние половых форм (копуляция).
Жгутиковые обитают в пресной и морской воде, реже во влажной почве и играют важную роль в жизни водоемов, в круговороте веществ в природе. Многие жгутиковые ведут паразитический образ жизни. Класс включает более 6000 видов.
Многие жгутиковые ведут паразитический образ жизни. Класс включает более 6000 видов.
Различают:
- одиночные свободноживущие формы,
- колониальные формы ,
- паразитические формы.
Типичным представителем одиночных форм является эвглена зеленая (Euglena viridis). Форма тела у нее веретеновидная, постоянная благодаря уплотнению наружного слоя протоплазмы. В цитоплазме, в задней части тела находится крупное шарообразное ядро.
На переднем конце тела эвглены зеленой имеется тонкий жгутик, за счет вращения которого она передвигается. Продукты фотосинтеза откладываются в виде крахмалоподобного вещества — парамила. Освещенные места эвглена отыскивает с помощью светочувствительного глазка — фоторецептора, окрашенного в красный цвет, находящегося также на переднем конце тела.
Размножение эвглены бесполое, путем продольного деления тела. Сначала делится ядро, удваиваются базальное тельце, хроматофоры, а затем делится цитоплазма. Жгутик отбрасывается или переходит к одной особи, а у другой образуется заново. Деление в продольном направлении — одна из характерных черт класса жгутиковых.
Жгутик отбрасывается или переходит к одной особи, а у другой образуется заново. Деление в продольном направлении — одна из характерных черт класса жгутиковых.
Представитель колониальных видов жгутиковых — вольвокс (Volvox globator) образует крупные шарообразные колонии, состоящие из многих тысяч вегетативных зооидов — мелких грушевидных клеток, каждая из которых имеет по два жгутика. Диаметр шара 1-2 мм. Полость его заполнена студенистым веществом. Все клетки вольвокса (зооиды) соединены между собой тонкими протоплазматическими мостиками, что обеспечивает возможность координации движения жгутиков. Колония двигается в воде благодаря согласованному движению жгутиков отдельных особей.
Размножение вольвокса осуществляется за счет особых — генеративных — зооидов. Они уходят с поверхности внутрь колоний и здесь, размножаясь делением, образуют дочерние колонии. После отмирания материнской колонии дочерние начинают самостоятельную жизнь.
Ряд жгутиковых (трипаносомы, лейшмании, лямблии, трихомонады и др.
Отряд первичномонадные (Protomonadina) Семейство Трипаносомные (Trypanosomatidae) Род Лейшмания (Leishmania) — возбудители лейшманиозов — трансмиссивных заболеваний с природной очаговостью. Лейшмании открыты русским врачом П. Ф. Боровским в 1898 г. Отличительным признаком является способность образовывать в процессе цикла развития несколько морфологически различных форм в зависимости от условий существования. Смена форм происходит как в беспозвоночном, так и в позвоночном хозяевах.
Выделяют следующие морфологические формы:
- трипаносомная форма — характеризуется сплющенным лентовидовым телом, в центре которого расположено овальное ядро. Жгутик начинается позади ядра.
- критидиальная форма — жгутик начинается немного впереди от ядра, направляясь вперед, образует короткую ундулирующую мембрану и свободный конец.
- лептомонадная форма — жгутик начинается на самом краю переднего конца тела, ундулируюшая мембрана отсутствует, свободный конец жгутика имеет значительную длину.
- лейшманиальная форма — имеет округлую форму и крупное круглое ядро. Жгутик или отсутствует, или есть только его внутриклеточная часть, за пределы тела он не выходит.
- метациклическая форма — сходна с критидиальной, но лишена свободного жгутика.
Жгутиконосцы рода Лейшманий имеют две морфологические формы — лептомонадную и лейшманиальную или внутриклеточную.
Жизненный цикл проходит со сменой хозяев. Лейшманиальная форма паразитирует у человека и позвоночных, лептомонадная — в насекомых-переносчиках. Заболевания, вызываемые лейшманиями — лейшманиозы, являются природно-очаговыми, трансмиссивными.
Лейшмании подразделяются на дерматотропные (локализуются в коже) и висцеротропные виды (локализуются во внутренних органах).
Распространен в Индии (возбудитель L.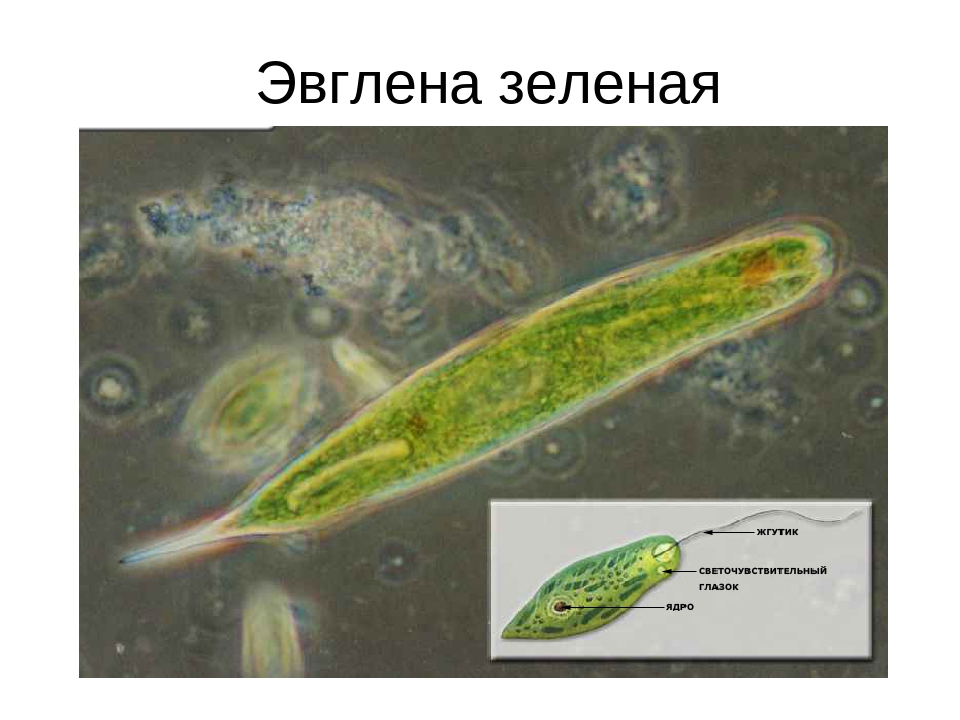 donovani), встречается в странах Средиземноморья, в Закавказье и Средней Азии (возбудитель L. infantum), где называется кала-азаром. В ряде стран Азии, Африки и Южной Америки заболевания лейшманиозом вызываются также другими видами лейшманий.
donovani), встречается в странах Средиземноморья, в Закавказье и Средней Азии (возбудитель L. infantum), где называется кала-азаром. В ряде стран Азии, Африки и Южной Америки заболевания лейшманиозом вызываются также другими видами лейшманий.
В последнее время обнаружено, что лейшмании находятся также в ретикулоэндотелиальных клетках кожи, что объясняет способ заражения москитов. Пораженные клетки иногда образуют сплошной слой или сконцентрированы около потовых желез и сосудов.
Патогенное действие. Наблюдается неправильная, упорная лихорадка. Селезенка и печень постепенно увеличиваются и могут достигать огромных размеров. Развивается истощение, уменьшается содержание эритроцитов в крови, возникает анемия. Болезнь может протекать остро или принимает хроническое течение (1-3 года). Смертность очень велика. Болеют в основном дети.
Род Трипаносома Трипаносома (Trypanosoma gambiense) является возбудителем трипаносомоза — африканской сонной болезни человека.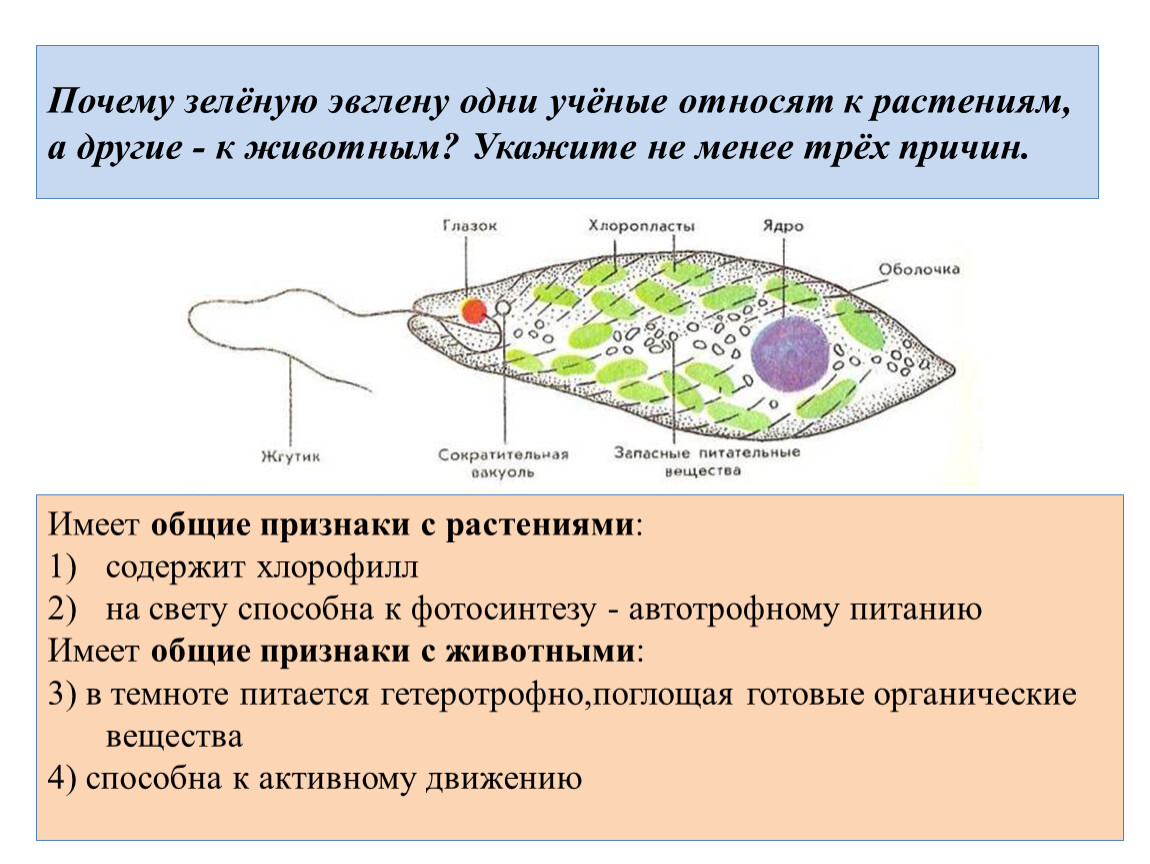
Локализация. В теле человека и других позвоночных обитает в плазме крови, лимфе, лимфатических узлах, спинномозговой жидкости, тканях спинного и головного мозга.
Географическое распространение. Встречается в экваториальной Африке. В очагах болезни трипаносома обнаружена в крови антилоп, которые служат ее природным резервуаром. Переносчик — африканское кровососущее насекомое — муха це-це. Болезнь встречается только в зоне распространения этой мухи.
Морфофизиологические особенности. Размер от 13 до 39 мкм. Тело изогнутое, сплющенное в одной плоскости, суженное на обоих концах, снабженное одним жгутиком и ундулирующей мембраной. Питается осмотически. Размножение происходит бесполым путем, продольным делением.
Жизненный цикл. Трипаносомоз — типичное трансмиссивное заболевание с природной очаговостью. Возбудитель трипаносомоза развивается со сменой хозяев. Первая часть жизненного цикла трипаносомы проходит в пищеварительном тракте мухи цеце, за пределами ареала которой трипаносомоз (африканская сонная болезнь) не встречается, вторая часть — в организме позвоночных животных (крупный и мелкий рогатый скот, свиньи, собаки, некоторые дикие животные), а также человека. При всасывании мухой крови больного человека трипаносомы попадают в ее желудок. Здесь они размножаются и претерпевают ряд стадий. Полный цикл развития составляет около 20 дней. Мухи, в теле которых имеются трипаносомы инвазионной стадии, при укусе могут заразить человека.
При всасывании мухой крови больного человека трипаносомы попадают в ее желудок. Здесь они размножаются и претерпевают ряд стадий. Полный цикл развития составляет около 20 дней. Мухи, в теле которых имеются трипаносомы инвазионной стадии, при укусе могут заразить человека.
У больного трипаносомозом отмечаются тяжелые поражения центральной нервной системы: наблюдаются мышечная слабость, истощение, умственная депрессия, сонливость. Болезненное состояние длится 7-10 лет и при отсутствии лечения заканчивается смертью.
Для лабораторной диагностики исследуют кровь, пунктаты лимфатических узлов и спинномозговой жидкости.
Органоиды передвижения эвглены зеленой
Клетки могут перемещаться при помощи специализированных органоидов, к которым относятся реснички и жгутики. Реснички клеток всегда многочисленны (у простейших их количество исчисляется сотнями и тысячами), а длина составляет 10-15мкм. Жгутиков же чаще всего 1-8, длина их — 20-50мкм.
Строение и функции органоидов движения
Строение ресничек и жгутиков, как у растительных, так и животных клеток сходно. Под электронным микроскопом обнаружено, что реснички и жгутики это немембранные органоиды, состоящие из микротрубочек. Две из них располагаются в центре, а вокруг них по периферии лежат еще 9 пар микротрубочек. Вся эта структура покрыта цитоплазматической мембраной, являющейся продолжением клеточной мембраны.
Под электронным микроскопом обнаружено, что реснички и жгутики это немембранные органоиды, состоящие из микротрубочек. Две из них располагаются в центре, а вокруг них по периферии лежат еще 9 пар микротрубочек. Вся эта структура покрыта цитоплазматической мембраной, являющейся продолжением клеточной мембраны.
Жгутики и реснички обеспечивают не только передвижение клеток в пространстве, но и перемещение различных веществ на поверхности клеток, а также попадание пищевых частиц в клетку. У основания ресничек и жгутиков находятся базальные тельца, которые тоже состоят из микротрубочек.
Предполагают, что базальные тельца являются центром формирования микротрубочек жгутиков и ресничек. Базальные тельца, в свою очередь, нередко происходят из клеточного центра.
Большое количество одноклеточных организмов и некоторые клетки многоклеточных не имеют специальных органоидов движения и передвигаются при помощи псевдоподий (ложноножек), которое получило название амебоидного. В основе его лежит движение молекул особых белков, называемых сократимыми.
Особенности движения простейших
Одноклеточные организмы также способны передвигаться (инфузория туфелька, эвглена зеленая, амеба обыкновенная). Для перемещения в толще воды каждая особь наделена специфическими органоидами. У простейших такими органоидами являются реснички, жгутики, ложноножки.
Эвглена зелёная
Эвглена зелёная — представитель простейших из класса жгутиковых. Тело эвглены веретенообразной формы, удлиненное с заостренным концом. Органоиды движения эвглены зеленой представлены жгутиком, который находится на тупом конце. Жгутики — это тонкие выросты тела, число которых варьирует от одного до десятков.
Механизм движения при помощи жгутика отличается у разных видов. В основном это вращение в виде конуса, вершина которого обращена к телу. Перемещение наиболее эффективно при достижении углом вершины конуса 45°. Скорость колеблется в пределах от 10 до 40 оборотов за секунду. Часто наблюдается помимо вращательного движения жгутика, также его волнообразные покачивания.
Такой характер движения свойствен для одножгутиковых видов. У многожгутиковых нередко жгутики располагаются в одной плоскости и не формируют конуса вращения.
Микроскопическое строение жгутиков довольно сложное. Они окружены тонкой оболочкой, которая является продолжением наружного слоя эктоплазмы — пелликулы. Внутреннее пространство жгутика заполнено цитоплазмой и продольно расположенными нитями — фибриллами.
Периферически расположенные фибриллы отвечают за осуществление движения, а центральные выполняют опорную функцию.
Инфузория туфелька
Передвигается инфузория туфелька за счет ресничек, осуществляя ими волнообразные движения. Направляется вперед тупым концом.
Реснички двигаются в одной плоскости и делают прямой удар после полного выпрямления, а возвратный — в выгнутом положении. Удары идут последовательно один за другим с небольшой задержкой. Во время плаванья, инфузория осуществляет вращательные движения вокруг продольной оси.
Реснички инфузории туфельки
Перемещается туфелька со скоростью до 2,5мм/c. Направленность меняется за счёт перегибов тела. Если на пути будет преграда, то после столкновения инфузория начинает двигаться в противоположную сторону.
Все реснички инфузорииимеют сходное строение с жгутиками эвглены зеленой. Ресничка у основания образует базальное зерно, которое играет важную роль в механизме движения организма.
У некоторых инфузорий реснички соединяются между собой и таким образом позволяют развить большую скорость.
Инфузории относятся к высокоорганизованным простейшим и свою двигательную активность они осуществляют с помощью сокращений. Форма тела простейшего может меняться, а после возвращаться в прежнее состояние. Быстрые сократительные движения возможны благодаря наличию особых волокон — мионем.
Амеба обыкновенная
Амеба — простейшее довольно крупных размеров (до 0,5мм). Форма тела полиподиальная, обусловлена наличием множественных псевдоподий — это выросты с внутренней циркуляцией цитоплазмы.
У амебы обыкновенной псевдоподии еще называют ложноножками. Направляя ложноножки в разные стороны, амёба развивает скорость в 0,2 мм/минуту.
К органоидам движения простейших не относятся цитоплазма, ядро, вакуоли, рибосомы, лизосомы, ЭПР, Аппарат Гольджи.
Содержание:
Эвглена зеленая – простейший одноклеточный организм, уникальный тем, что среди биологов до сих пор нет единодушного согласия, к какому царству она принадлежит, животных или растений. Дело в том, что эвглена зеленая сочетает в себе в равной мере признаки как растений, так и животных. Поскольку эвглена содержит в себе хлорофилл, то днем она питается от солнечного света благодаря процессу фотосинтеза, точь-в-точь как это делают все другие растения, но ночью, в темноте она преображается: при обилии органической пищи она может питаться гетеротрофно, то есть, как это делают все животные. Также эвглена зеленая способна передвигаться, опять же, как и все другие животные. Считается, что эвглена зеленая являет собой переходную форму от растений к животным, своим существованием она подтверждает теорию о единстве всего живого. А согласно этой теории человек произошел не только от обезьяны, но и от растений, так что и деревья и цветы наши далекие родичи, но вернемся к эвглене, какое ее строение, среда обитания, чем она питается, как размножается, читайте далее.
Эвглена зеленая: описание и характеристика. Как выглядит эвглена зеленая?
Тело эвглены зеленой состоит из двадцати хлоропластов, в которых и находится хлорофилл, участвующий в фотосинтезе. Хлоропласты представляют собой зеленые пластины, и в целом они присутствуют только у клеток с ядром в центре. И благодаря ним, эвглена зеленая и названа «зеленой», за счет хлоропластов и хлорофилла она действительно ярко-зеленого цвета.
Так выглядит эвглена зеленая, если смотреть на нее под микроскопом.
Если днем эвглена получает энергию за счет солнечного света благодаря процессу фотосинтеза, то ночью она питается органикой из воды. Сама вода при этом должна быть пресной. Поэтому эвглена водится в пресных водоемах: прудах, озерах, реках, болотах.
По внешнему виду эвглена схожа с водорослью, и была бы таковой одноклеточной водорослью, если бы не несколько нюансов. Во-первых, гетерофорное ночное питание эвглены характерно для животных, но не растений. Помимо этого есть и другие признаки принадлежности эвглены к животным:
- Способность к активному передвижению. Передвигается эвглена при помощи специального жгутика, его вращательные движения обеспечивают ее мобильность. Движется эвглена всегда поступательно, к слову в этом моменте она отличается от другого простейшего одноклеточного организма – инфузории туфельки, чьи движения всегда плавные за счет большого количества маленьких ресничек.
- Специальные пульсирующие вакуоли – еще один признак принадлежности эвглены к животному царству, своим строением они подобны мышечным волокнам, коими обладают животные, но не растения.
- Наличие ротовой воронки, еще одно свидетельство об эвглене как о животном. Но стоит заметить, что как такового ротового отверстия у эвглены все-таки нет. Просто в попытке захватить органическую пищу, эвглена как бы вжимает внутрь часть своей наружной мембраны. В созданном таким образом отсеке и задерживается пища.
По причине всех этих моментов в ученом сообществе до сих пор не единодушия о том, куда эвглена зеленая относится: к растениям или животным. Большинство ученых все-таки причисляют ее к флоре, видя в ней одноклеточную водоросль, 15% биологов считают ее животным, остальные видят в ней промежуточный вид.
Признаки эвглены зеленой
Тело нашей героини веретеновидной формы с жесткой оболочкой. Длина тела эвглены в среднем составляет 0,5 мм. Передняя часть тела имеет тупую форму и обладает красным глазком. Глазок этот светочувствителен и позволяет своему обладателю находить «кормовые» места днем, другими словами «он ведет эвглену на свет», в любом водоеме эти микроорганизмы всегда собираются в самых светлых местах. К слову большое количество эвглен в том или ином водоеме делает поверхность воды красноватой, даже бурой. Столь необычный эффект от скопления эвглен наблюдал и описал в своих работах великий натуралист древности Аристотель в IV веке до н. е.
На переднем конце тела одноклеточного организма имеется жгутик. Причем у новорожденных организмов жгутик может отсутствовать, так как клетка делится на двое и жгутик остается только на одной из частей. На второй эвглене он отрастет со временем.
Задний конец тела эвглены зеленой наоборот является заостренным, такая его форма улучшает обтекаемость, а значит и скорость.
Интересно, что для эвглены зеленой свойственна метаболия, то есть способность менять форму тела. Несмотря на то, что как правило эвглены веретенообразные, в разных обстоятельствах они могут принимать и другие формы, быть:
- подобными кресту,
- вальковатыми,
- шарообразными,
- комковатыми.
Но вне зависимости от формы тела эвглены зеленой жгутик ее будет невидимым, если клетка живая. А невидим он по той причине, что частота его движений настолько быстрая, что человеческий глаз попросту не способен его уловить.
Строение эвглены зеленой
Резюмируя все сказанное выше можно заключить, что эвглена зеленая это животное или растение, состоящее из:
- Жгутика, само наличие которого относит нашу героиню к классу жгутиконосцев. Диаметр жгутика составляет в среднем 0,25 микрометра, увидеть его можно только через мощный микроскоп. Отросток покрыт плазматической мембраной состоящей из микротрубочек, которые движутся относительно друг друга. Их движение и вызывает общее движение жгутика.
- Глазка, также иногда его называют стигмой. Глазок состоит из зрительных волокон и линзоподобных образований. Благодаря последним он улавливает свет, который линза отражает на жгутик. Получив от нее импульс, жгутик в свою очередь начинает движение на свет. Красный цвет глазка эвглены обусловлен окрашенными каплями липида – жира. Сам глазок окружен мембраной.
- Хроматофор, это специальные пигментированные клетки и компоненты растений, отвечающие за его окраску, у эвглены они ярко-зеленые.
- Пепликулы, на латыни это слово значит «кожа». Пепликулы эвглены, состоящие из плоских мембранных пузырьков, образуют оболочку этого простейшего одноклеточного организма.
- Сократительной вакуоли, которая располагается чуть ниже основания жгутика. Эта сократительная вакуоль является своеобразным аналогом мышечной ткани. В строении эвглены она ответственна за выталкивание из клетки излишков воды, благодаря чему эвглена сохраняет свой постоянный объем.
Вот так строение эвглены зеленой выглядит на рисунке.
Еще несколько слов о сократительной вакуоли, с ее помощью также осуществляется дыхание эвглены зеленой.
Среда обитания эвглены зеленой
Обитает эвглена только в пресных водоемах, причем особенно предпочитая те, где вода погрязнее. В водоемах с чистой водой эвглена либо малочисленна, либо и вовсе отсутствует. В этом отношении эвглена схожа с другими своими одноклеточными «коллегами»: амебами и инфузориями, которые также любят грязную воду.
Так как эвглены являются довольно таки устойчивыми к холоду, то помимо пресной воды они могут обитать в суровых условиях льда и снега.
Стоить заметить, что эвглена зеленая может быть опасной, так обитая в гнилостной воде она порой служит переносчиком трипаносом и лейшмании. Последняя является возбудителем некоторых кожных заболеваний. Трипаносомы же могут вызывать африканскую сонную болезнь, поражающую нервную и лимфатическую системы, что приводит к лихорадке.
Если эвглена попадет в аквариумную воду, то такая вода зацветет, поэтому не без основания аквариумисты считают эвглену опасным паразитом и пытаются от нее избавиться. Избавиться от эвглены зеленой можно при помощи специальных химических средств (не забыв на это время перемесить рыбу в другое место). И, разумеется, не стоит забывать о регулярной замене воды и фильтрации, тогда вода в аквариуме будет свежей и чистой и эвглены в ней не заведутся.
Питание эвглены зеленой
Как мы писали выше, питание этого существа наполовину гетеротрофное, и наполовину автотрофное, то есть и за счет солнечной энергии и за счет органики. Такой необычный, смешанный тип питания, характерный исключительно для жизнедеятельности эвглены зеленой, биологи прозвали миксотрофным.
Днем эвглена находится под Солнцем, она не тороплива и малоподвижна, и правда, зачем ей двигаться и махать своим жгутиком, если «пища» в виде солнечных лучей сама падает на тебя. Но если эвглена оказывается в каком-нибудь скрытом от Солнца, темном водоеме, а также ночью, то она из растения, преображается в животное, ее жгутик начинает активно двигаться, перемещая свою хозяйку по водоему в поисках органической «еды».
Поэтому если днем эвглены располагаются только в светлых частях водоема, причем обычно близко к поверхности воды, то ночью они расползаются по всему водоему.
Органоиды эвглены зеленой
Органоиды или органеллы – это постоянные или специализированные структуры каждой клетки, как животной, так и растительной. Что же касается органоидов эвглены зеленой, то они уже были перечислены выше, в разделе о строении эвглены. Каждый из этих органоидов или органелл жизненно важный элемент одноклеточного организма, без которого он не смог бы питаться, передвигаться, размножаться и вообще существовать.
Размножение эвглены зеленой
Хотели бы вы дорогой читатель жить вечно? Это философский вопрос, и возможно вы удивитесь, но в биологии есть пример «бесконечной жизни», и да, наша сегодняшняя героиня, эвглена и является этим примером. Продолжительность жизни эвглены зеленой, по сути, бесконечна! А все из-за способа ее размножения, который осуществляется исключительно посредством деления клетки. Так что эвглены, которые вы можете сегодня наблюдать в каком-нибудь зеленом пруду или болоте были созданы посредством деления от некой эвглены, живущей еще в эпоху динозавров, а то и раньше.
А вот то время, которое эвглена сохраняется неделимой, наоборот крайне мало, и составляет всего несколько дней. Дальше эвглена начинает делиться, потом опять делиться, и так до бесконечности.
Что же касается самого деления эвглены, то оно происходит в несколько этапов, все начинается с деления ядра клетки. Два новых ядрышка расходятся по разные стороны клетки, после чего уже сама клетка начинает делиться в продольном направлении. Поперечное деление не возможно.
Так деление эвглены выглядит схематически.
Разделенная оболочка замыкается на каждой половине клетки. Таким образом, из одной эвглены получается две. В благоприятной среде эти существа могут размножаться прямо таки в арифметической прогрессии.
Рекомендованная литература и полезные ссылки
- Зеленая эвглена — своеобразный жгутиконосец. Вольвокс // Биология: Животные: Учебник для 7—8 классов средней школы / Б. Е. Быховский, Е. В. Козлова, А. С. Мончадский и другие; Под редакцией М. А. Козлова. — 23-е изд. — М.: Просвещение, 1993. — С. 14—16. — ISBN 5090043884.
- Біологія: підруч. для 8 кл, загальноосвіт. навч. закл./ С. В. Межжерін, Я. О. Межжеріна. — К.: Освіта, 2008. — 256с. ISBN 978-966-04-0617-9.
- Міхеева Т. М. Эўглена // Беларуская энцыклапедыя: У 18 т. Т. 18. Кн. 1.: Дадатак: Шчытнікі — ЯЯ. — Мн. : БелЭн, 2004. — Т. 18. — С. 186. — 10 000 прим. — ISBN 985-11-0295-4 (Т. 18. Кн. 1.).
Эвглена зеленая, видео
Эвглена зеленая — это одноклеточный организм, представитель простейших, относится к роду эвглен.
Эвглена зеленая сочетает в себе признаки как растений, так и животных. Ее клетка содержит хлорофилл и на свету может питаться за счет процесса фотосинтеза, как это делают растения. В темноте и при обилии органической пищи эвглена питается гетеротрофно, как животное, поглощая органику. Кроме способа питания ее роднит с животными также способность к активному передвижению.
Эвглена зеленая обычно обитает в загрязненных пресных водоемах. При ее сильном размножении вода приобретает зеленый оттенок («цветение воды»). Размер клетки около 0,05 мм, поэтому невооруженным глазом эвглену увидеть трудно. Тело вытянуто, на переднем конце есть один длинный жгутик, задний конец слегка расширен и заострен. Эвглена имеет эластичную оболочку, которая придает ей форму, но позволяет незначительно изменять форму клетки. Движение осуществляется в том направлении, где находится жгутик. Он ввинчивается в воду, сама клетка в это время крутится в другую сторону.
В клетке жгутик переходит в базальное тельце. Оно плотное и служит для крепления жгутика.
С той же стороны, где находится жгутик у эвглены зеленой находится клеточный рот, с помощью которого она заглатывает органические частицы. Этому помогает жгутик.
Также в передней части клетки находится светочувствительное образование – глазок, имеющий красный цвет. Эвглена зеленая обладает положительным фототаксисом, т. е. плывет в сторону света.
В передней части клетки эвглены находится сократительная вакуоль. С ее помощью из клетки выводятся избытки воды, вредные вещества.
В остальной части клетки находятся ядро, хлоропласты, другие клеточные органеллы, а также пищеварительные вакуоли.
Эвглена зеленая заглатывает органику не только клеточным ртом. Растворенные органические вещества могут поглощаться через всю ее оболочку. Выброс непереваренных остатков из пищеварительных вакуолей происходит не в любом месте поверхности клетки (как это происходит у амебы), а только у заднего конца.
Дышит эвглена всей поверхностью. В нее из воды поступает кислород, который окисляет в митохондриях органические вещества и происходит выделение энергии. Побочными продуктами при дыхании являются вода и углекислый газ. Последний удаляется из клетки также как поступает кислород, т. е. через клеточную мембрану.
Для эвглены зеленой описан бесполый способ размножения. При этом клетка делится вдоль продольной оси (по длинной стороне). Дочерние клетки, которые не получают те или иные органеллы, достраивают их самостоятельно.
В неблагоприятных условиях (низкая температура, высыхание водоема) эвглена зеленая образует цисту. При образовании цисты происходит отпадание жгутика, клетка приобретает округлую форму и покрывается плотной оболочкой.
Колониальные жгутиковые когда появились. Колониальные формы. Жгутиконосцы, обитающие в кишечнике термитов и тараканов
Характерная особенность всех представителей – наличие одного или более жгутиков, которые служат для передвижения. Расположены они преимущественно на переднем конце клетки и представляют собой нитевидные выросты эктоплазмы.
Внутри каждого жгутика проходят микрофибриллы из сократительных белков. Основание жгутика всегда связано с кинетосомой, выполняющей энергетическую функцию.
Тело жгутикового простейшего, помимо цитоплазматической мембраны, покрыто снаружи пелликулой – специальной периферической пленкой (производной эктоплазмы). Она и обеспечивает постоянство формы клетки.
Ряд жгутиковых имеет опорную органеллу – аксостиль, который в виде плотного тяжа проходит через всю клетку.
Жгутиковые – гетеротрофы (питаются готовыми веществами). Некоторые способны также к автотрофному питанию. Для многих свободноживущих представителей характерно заглатывание комочков пищи (голозойное питание), которое происходит при помощи сокращений жгутика.
Размножение обычно бесполое, происходящее поперечным делением. Встречается и половой процесс в виде копуляции.
Переносчиками являются насекомые – муха цеце, триатомовые клопы, самки слепней Табанус и мухи-жигалки рода стомоксис. Трипаносомы разных видов вызывают разные заболевания — сонная болезнь, случная болезнь непарнокопытных, су-ауру или трипаносомоз парнокопытных.
Вызывают заболевание лейшманиоз. Заражение происходит через «посредника». Например, москит, укусивший больное животное, всасывает вместе с кровью промастиготы лейшманий. Когда зараженная самка москита кусает человека, ей приходится срыгивать часть содержимого, заполнившего пищевод. Таким образом, промастиготы попадают в кровь жертвы.
Лейшмания имеет несколько видов: минор, майор, доновани, бразильская разновидность.
Первый – это возбудитель сухой кожной формы лейшманиоза. Для болезни характерно хроническое течение. Майор провоцирует острую форму заболевания.
Заболевание, вызываемое лямблиями, называют лямблиоз. Человека считают носителем инфекции, если в нем есть лямблии, но никаких симптомов их присутствия не возникает.
Виды семейства опалинид
Жгутиконосцы обитают в заднем отделе кишечника земноводных. Особенно богато представлены разные виды семейства опалинид (Opalinidae). В заднем отделе кишечника лягушек в огромных количествах встречаются разные виды рода опалин (Opalina). Это очень крупные простейшие, достигающие 1 мм.
Это предцистные формы. Они инцистируются и выходят из лягушки, падая на дно водоема. Там они лежат до тех пор, пока не будут проглочены головастиками.
Половой процесс опалин совершается только на одном этапе цикла — в головастиках, в теле лягушек он никогда не происходит, и размножаются они бесполым путем.
Виды рода опалин
Представители класса Opalinatea встречаются у хлоднокровных животных, в основном у амфибий (лягушек). Опалины – гетеротрофные организмы. Питание происходит путем пиноцитоза диффузно. Выделительные органеллы отсутствуют.
Размножаются бесполым и половым путем. Бесполое размножение – деление или почкование.
В течение года опалины, живущие в прямой кишке лягушки, размножаются бесполым путем.
Весной, после откладки лягушкой яиц, опалины делятся и образуют мелкие малоядерные особи. Эти особи образуют цисту и выходят из прямой кишки лягушки в воду, когда головастики уже вывелись из яиц. Цисты опалин съедаются головастиками, в кишечнике которых их оболочки растворяются.
Жгутиконосцы, обитающие в кишечнике термитов и тараканов
В задней кишке низших термитов обитают разнообразные простейшие, среди которых наибольшее значение имеют жгутиконосцы. Количество простейших в кишечнике рабочих особей и псевдоэргат низших термитов обычно очень велико и может составлять от 16 до 50% веса термита.
Они сосредоточены в толстой кишке и заполняют весь ее объем. При этом разные виды занимают определенные участки кишки. Жизненный цикл многих жгутиконосцев хорошо приспособлен к развитию термита с периодическими линьками, во время которых его кишечник полностью освобождается.
Сейчас действует скидка. Препарат можно получить бесплатно.
Подвижность очень многих протистов обеспечивается наличием жгутиков или ресничек. И те и другие устроены одинаково. Жгутики и у простейших, и у жгутиковых или ресничных клеток многоклеточных животных и растений всегда лишь часть локомоторной системы клетки, которая состоит из кинетосомы (или центриоли), жгутика (или ундулиподия) и корневых выростов кинетосомы (или ее дериватов (производных)). Кроме передвижения в толще воды, жгутики и реснички применяются для временного или постоянного прикрепления к субстрату или для создания пищевых потоков воды при питании взвешенными частицами.
Жгутик – это трубчатый вырост клеточной поверхности, окруженный мембраной, которая служит продолжением мембраны, покрывающей всю клетку. Он содержит пучок белковых фибрилл, так называемую аксонему. Аксонемой или аксиальной нитью называют микротрубочковое образование, которое состоит из двух центральных микротрубочек, окруженных кольцом из девяти пар (дублетов) микротрубочек, состоящих из плотно спаянных друг с другом субфибрилл. Тонкое строение жгутиков всех эукариотных организмов удивительно однотипно в своих главных чертах.
Важнейшим элементом жгутиковой системы служит базальное тело или кинетосома. Это цилиндр, стенки которого образованы девятью группами микротрубочек, объединенными по три (триплеты). Чаще всего в клетке присутствуют две кинетосомы, расположенные примерно под прямым углом друг к другу. От них отходят один или два жгутика. Кинетосома не плавает в цитоплазме сама по себе, поскольку закреплена системой корешков.
Современные представления о системе Protista во многом базируются на строении жгутика и его производных. Широкое распространение у них жгутиков и ресничек позволяет сравнивать между собой почти все таксоны, а также дает возможность использовать дополнительные признаки жгутикового аппарата, число которых приближается уже к 100, в систематике и филогении. Многие черты строения жгутиконосцев, в том числе и форма тела, определяются наличием у них этой своеобразной системы.
Количество жгутиков, их относительная и абсолютная длина, место и способ прикрепления жгутиков, характер их движения, их направленность очень разнообразны у разных групп, но постоянны внутри отдельных групп родственных организмов.
Обычно выделяют 4 морфотипа жгутиконосцев.
Изоконты имеют от 2 до 8 жгутиков равной длины, направленных в одну сторону, с одинаковыми способами биения. К ним относится большинство подвижных клеток зеленых водорослей.
Анизоконты имеют 2 жгутика неравной длины, направленные в одну сторону, отличающиеся по способу биения. Такие жгутики характерны для бесцветных жгутиконосцев.
У гетероконтных имеются 2 жгутика неравной длины (один направлен вперед, другой — назад), различающиеся по способу биения. Они характерны и для подвижных клеток водорослей, и для так называемых зооспоровых грибов, и для бесцветных жгутиконосцев.
Стефаноконты имеют венчик жгутиков на переднем конце клетки. Это характерно для многожгутиковых гамет и зооспор некоторых зеленых водорослей.
Одножгутиковые формы обычно не выделяются в особую группу. Многие из них рассматриваются как утратившие вторично жгутик особи, так как у подавляющего большинства есть еще одна безжгутиковая кинетосома.
Основная функция жгутика — движение. В активной работе жгутика движущим началом являются периферические микротрубочки и их ручки, обладающие АТФ-азной активностью. Центральные микротрубочки имеют опорное значение. Формы движения жгутика различны, но обычно это винтообразное движение, позволяющее жгутиконосцу «ввинчиваться» в воду, совершая до 40 оборотов в секунду. У инфузорий и многожгутиковых протистов движение ресничек организовано по типу метахрональных волн. Жгутики и реснички часто используются также и для питания. Среди жгутиконосцев имеются виды, проводящие большую часть жизненного цикла в прикрепленном состоянии. В этот период жгутик теряет обычную для него функцию движения и превращается в органеллу прикрепления, стебелек или ножку. Еще одна функция жгутика заключается в том, что он своими движениями очищает поверхность тела от налипающих на него мелких посторонних частиц.
Эндоплазматические органеллы
В эндоплазме протистов находятся одно или несколько ядер, а также все органеллы и структуры, свойственные эукариотической клетке: ЭПР, рибосомы, аппарат Гольджи, митохондрии, пероксисомы, гидрогеносомы, пластиды (у автотрофных протистов), лизосомы, пищеварительные вакуоли. Некоторые протисты обладают также специфичными только для них органеллами.
Экструсомы. Эти органеллы представляют собой специальные вакуоли, окруженные мембраной, которая у зрелых экструсом обычно контактирует с плазмалеммой. В ответ на различные внешние раздражения (механические, химические, электрические и др.) они выбрасывают наружу свое содержимое. По своему строению это мукополисахариды (сложные соединения углеводов с белками). Известно 10 разных типов экструсом. Одни содержат ядовитые вещества, способные обездвиживать и убивать жертву (простейших и другие мелкие организмы). Другие выполняют защитную функцию или облегчают движение, выделяя слизь.
Пластиды. Пластиды имеются у фототрофных и близких к ним протистов и представлены хлоропластами и лейкопластами. Основными пигментами хлоропластов являются хлорофиллы. Для разных групп фототрофных протистов характерны определенные наборы хлорофиллов. Из вторичных пигментов у водорослей встречаются каротины и ксантофиллы, которые в больших концентрациях могут маскировать зеленый хлорофилл и придавать хлоропластам разнообразную окраску от желто-зеленой до красновато-коричневой.
Аппарат Гольджи обнаружен практически у всех исследованных видов протистов. Наиболее часто аппарат Гольджи расположен по соседству с ядром и представлен одной или несколькими стопками плоских цистерн (диктиосом), окруженных мелкими пузырьками. Однако аппарат Гольджи у некоторых протистов он образован одиночными цистернами. Отсутствие диктиосом обычно трактуется как примитивный признак. Однако отсутствие диктиосом у современных протистов не может однозначно свидетельствовать об их примитивности, поскольку формирование и разборка диктиосом в большой степени зависят от внешних воздействий на клетку (например, снижение концентрации кислорода в среде) или от физиологических перестроек самого протиста (переход к инцистированию).
Лизосомы и другие органеллы и включения. В клетках протистов, как и в клетках многоклеточных животных, присутствуют лизосомы. Эти цитоплазматические тельца в форме мелких пузырьков (первичные лизосомы) образуются в аппарате Гольджи. В них локализованы пищеварительные гидролитические ферменты. Вторичные лизосомы, или пищеварительные вакуоли, хорошо выражены только у гетеротрофных протистов, питающихся путем фагоцитоза.
В эндоплазме разных протистов в большем или меньшем количестве присутствуют резервные питательные вещества, используемые в процессах метаболизма. Чаще всего это различные полисахариды (гликоген, крахмал, амилоплектин и др.), нередко — липиды и иные жировые включения. Количество резервных веществ зависит от физиологического состояния простейшего, характера и количества пищи, от стадии жизненного цикла и варьирует в широких пределах. Однако некоторые крупные группы протистов запасают специфические вещества. Например, эвгленовые запасают парамил, который не встречается у других протистов.
Характерная особенность всех представителей – наличие одного или более жгутиков, которые служат для передвижения. Расположены они преимущественно на переднем конце клетки и представляют собой нитевидные выросты эктоплазмы. Внутри каждого жгутика проходят микрофибриллы, построенные из сократительных белков. Прикрепляется жгутик к ба-зальному тельцу, расположенному в эктоплазме. Основание жгутика всегда связано с кинетосомой, выполняющей энергетическую функцию.
Тело жгутикового простейшего, помимо цитоплаз-матической мембраны, покрыто снаружи пелликулой – специальной периферической пленкой (производной эктоплазмы). Она и обеспечивает постоянство формы клетки.
Иногда между жгутиком и пелликулой проходит волнообразная цитоплазматическая перепонка – унду-лирующая мембрана(специфическая органелла передвижения). Движения жгутика приводят мембрану в волнообразные колебания, которые передаются всей клетке.
Ряд жгутиковых имеет опорную органеллу – аксо-стиль, который в виде плотного тяжа проходит через всю клетку.
Жгутиковые – гетеротрофы (питаются готовыми веществами). Некоторые способны также к автотрофному питанию и являются миксотрофами (например, эвглена). Для многих свободноживущих представителей характерно заглатывание комочков пищи (го-лозойное питание), которое происходит при помощи сокращений жгутика. У основания жгутика расположен клеточный рот (цистостома), за которым следует глотка. На ее внутреннем конце формируются пищеварительные вакуоли.
Размножение обычно бесполое, происходящее поперечным делением. Встречается и половой процесс в виде копуляции.
Типичным представителем свободноживущих жгутиковых является эвглена зеленая (Euglena viridis). Обитает в загрязненных прудах и лужах. Характерная особенность – наличие специального световосприни-мающего органа (стигмы). Длина эвглены около 0,5 мм, форма тела овальная, задний конец заострен. Жгутик один, расположенный на переднем конце. Движение с помощью жгутика напоминает ввинчивание. Ядро находится ближе к заднемуконцу. Эвглена имеет признаки как растения, так и животного. На свету питание авто-трофное за счет хлорофилла, в темноте – гетеротрофное. Такой смешанный тип питания называется миксо-трофным. Эвглена запасает углеводы в виде парамила, близкого по строению к крахмалу. Дыхание эвглены такое же, как уамебы. Пигмент красного светочувствительного глазка (стигмы) – астаксантин – в растительном царстве не встречается. Размножение бесполое.
Особый интерес представляют колониальные жгутиковые – пандорина, эудорина и вольвокс. На их примере можно проследить историческое развитие полового процесса.
33. Трихомонады. Виды, морфологическая характеристика. Диагностика. Профилактика
Трихомонады (класс жгутиковые) являются возбудителями заболеваний, называемых трихомониазами.
Урогенитальная трихомонада (Trichomonas vagi-nalis) – возбудитель урогенитального трихомониаза. У женщин эта форма обитает во влагалище и шейке матки, у мужчин – в мочеиспускательном канале, мочевом пузыре и предстательной железе. Обнаруживается у 30–40 % женщин и 15 % мужчин. Заболевание распространено повсеместно.
Заражение происходит чаще всего половым путем при незащищенном половом контакте, а также при пользовании общей постелью и предметами личной гигиены: полотенцами, мочалками и пр. Фактором передачи могут послужить и нестерильный гинекологический инструментарий, и перчатки при проведении гинекологического осмотра.
У мужчин заболевание может спонтанно закончиться выздоровлением через 1–2 месяца после заражения. Женщины болеют дольше (до нескольких лет).
Диагностика. На основании обнаружения вегетативных форм в мазке выделений из мочеполовых путей.
Профилактика – соблюдение правил личной гигиены, применение индивидуальных средств защиты при половых контактах.
Кишечная трихомонада (Trichomonas hominis) – небольшой жгутиконосец (длина – 5-15 мкм), обитающий в толстой кишке. Имеет 3–4 жгутика, одно ядро, ундулирующую мембрану и аксостиль. Питается бактериями кишечной флоры. Образование цист не установлено.
Диагностика. На основании обнаружения вегетативных форм в кале.
Профилактика.
1. Личная. Соблюдение правил личной гигиены, термическая обработка пищи и воды, тщательное мытье овощей и фруктов (особенно загрязненных землей).
2. Общественная. Санитарное обустройство мест обществен-ного пользования, наблюдение за источниками общественного водоснабжения, санитарно-просветительская работа с населением.
Класс Жгутиковые — объединяет простейшие организмы, которые населяли нашу планету еще задолго до нашей эры и сохранились до сегодняшнего дня. Они являются переходным звеном между растениями и животными.
Общая характеристика класса Жгутиковые
Класс включает 8 тыс. видов. Передвигаются они благодаря наличию жгутиков (чаще имеется один жгутик, нередко два, иногда восемь). Есть животные, имеющие десятки и сотни жгутиков. У колониальных форм число особей достигает 10-20 тыс.
Большинство жгутиковых имеет постоянную форму тела, которое покрыто пелликулой (уплотненный слой эктоплазмы). При неблагоприятных условиях жгутиковые образуют цисты.
Размножаются в основном бесполым путем. Половой процесс встречается только у колониальных форм (семейство Вольвоксовых). Бесполое размножение начинается с митотического деления ядра. За ним следует продольное деление организма. Дыхание жгутиковых идет всей поверхностью тела за счет митохондрий.
Среда обитания жгутиковых — пресные водоемы, но встречаютсяи морские виды.
Среди жгутиковых встречаются следующие типы питания:
Классификация жгутиковых основана на строении и способе жизни, выделяют следующие формы:
Строение одноклеточных жгутиковых
Эвглена зеленая является типичным представителем класса жгутиковых. Это свободноживущее животное, обитающее в лужах и прудах. Форма тела эвглены вытянутая. Ее длина составляет около 0,05мм. Передний конец тела животного сужен и притуплен, а задний расширен и заострен. Передвигается эвглена благодаря жгутику, находящемуся на переднем конце тела. Жгутик совершает вращательные движения, в результате чего эвглена как бы ввинчивается в воду.
В цитоплазме эвглены находятся овальные хлоропласты, которые придают ей зеленый цвет. Благодаря наличию хлорофилла в хлоропластах эвглена на свету, подобно зеленым растениям, способна к фотосинтезу. В темноте хлорофилл у эвглены исчезает, фотосинтез прекращается, и она может питаться осмотическим путем. Эта особенность питания указывает на родство между растительными и животными организмами.
Дыхание и выделение у эвглены осуществляются так же, как у амебы. Пульсирующая, или сократительная, вакуоль, расположенная на переднем конце тела, периодически удаляет из организма не только избыток воды, но и продукты обмена.
Недалеко от сократительной вакуоли имеется ярко-красный глазок, или стигма, принимающий участие в восприятии цвета. Эвглены обладают положительным фототаксисом, т. е. плывут всегда к освещенной части водоема, где имеются наиболее благоприятные условия для фотосинтеза.
Размножается эвглена бесполым путем, при этом тело делится в продольном направлении, дает две дочерние клетки. Первым вступает в процесс деления ядро, затем разделяется цитоплазма. Жгутик отходит к одному из новообразованных организмов, а у другого формируется заново. Под влиянием неблагоприятных факторов возможен переход в спящую форму. Жгутик прячется внутрь тела, форма эвглены стает округлой, а оболочка — плотной, в таком виде жгутиковые продолжают делиться.
Строение и образ жизни колониальных жгутиковых
Вольвокс, пандорина — представители колониальных жгутиковых. Самые примитивные колонии насчитывают от 4 до 16 одноклеточных организмов (зооидов).
Клетки из колонии вольвокса имеют грушевидную форму и наделены парой жгутиков. Эти жгутиковые имеют вид шара в диаметре до 10мм. Такая колония может вмещать около 60 000 клеток. Внутриполостное пространство заполнено жидкостью. Между собой клетки соединяются с помощью цитоплазматических мостиков, что помогает координировать направление движения.
Для вольвокса уже характерно распределение функций между клетками.Так, в части тела, которая направлена вперед, находятся клетки с довольно развитыми глазками, они более чувствительны к свету. Нижняя часть тела больше специализирована на процессах деления. Таким образом, наблюдается разделение клеток на соматические и половые.
Во время бесполого размножения формируются дочерние клетки, которые не расходятся, а представляют собой единую систему. Когда материнская колония погибает, новообразованная начинают самостоятельную жизнь. Вольвоксу свойственно и половое размножение, в осенний период года. При этом формируются небольшие мужские гаметы (до 10 клеток), способны к активному перемещению, и крупные, но неподвижные женские (до 30 клеток). Сливаясь, половые клетки образуют зиготу, из которой выйдет новая колония. Сначала зигота делится два раза путем мейоза, затем митотичести.
В чем проявляется усложнение организации колониальных форм жгутиковых?
Усложнение колониальных форм идет за счет дифференцировки клеток для дальнейшего выполнения специфических функций. Несомненно, формирование колоний вызывало большой интерес ученых, так как это шаг на пути становления многоклеточных видов.
Данное явление хорошо прослеживаетсяу вольвокса. У него появляются клетки, выполняющие разные функции. Также благодаря мостикам обеспечивается распределение питательных веществ по всему организму. У эвглены, в связи с более примитивным строением таких особенностей нет.
Таким образом, на примере вольвокса можно увидеть, как многоклеточные животные могли эволюционировать из одноклеточных.
Значение жгутиковых в природе
Жгутиковые животные, способные к фотосинтезу,имеют большое значение в круговороте веществ. Некоторые виды, поглощающие органические вещества, принимают участие в очищении сточных вод.
В водоемах с разным уровнем загрязнения поселяются эвглены, которых можно использовать для исследования санитарного состояния источника воды.
Водоемы, где нет течения, населяют многие виды жгутиковых животных, время от времени, из-за интенсивного деления, они придают воде зеленый окрас, явление цветения вод.
Онлайн урок: Простейшие по предмету Биология ЕГЭ
Жгутиконосцы- обычно мелкие простейшие, использующие жгутики для передвижения или создания токов воды, приносящих пищу.
Жгутик представляет собой вырост цитоплазмы.
Число жгутиков у разных представителей группы различно:
- один
- два
- множество
Различные формы жгутиконосцев:
С помощью колебательных движений единственного жгутика клетка простейшего как бы ввинчивается в окружающую водную среду и движется жгутиком вперед.
В случае наличия нескольких жгутиков, они работают согласованно, позволяя простейшему организму передвигаться в желаемом направлении.
Отдельные паразитирующие формы жгутиконосцев, например, некоторые лейшмании, утратили жгутики.
Лейшмания вызывает болезнь, которая поражает слизистые оболочки, кожный покров и внутренние органы человека.
Лямблии вызывают болезнь, при которой возникает резкая боль в брюшной полости; бледность слизистых оболочек; частый жидкий стул; слабость, потеря аппетита.
Лямблии обитают в тонком отделе кишечника человека.
Большой процент заболевших лямблиозом, составляют дети.
Также возбудитель может проникнуть в желчный пузырь и протоки, а оттуда попасть в печень.
Сонная болезнь, вызвана возбудителем отряда жгутиковые- трипаносомами.
Болезнь имеет распространение в жарких странах, и передаётся при укусе кровососущего насекомого- мухи цеце.
При заболевании возникают следующие признаки: общая слабость, заторможенность; головные и мышечные боли; истощение; сонливость; лихорадка.
Если больного не лечить, болезнь заканчивается летальным исходом.
Трихомонадами вызвана болезнь- трихомоноз.
Считается наиболее распространённым заболеванием мочеполовой системы.
Из-за мелких размеров большинство жгутиконосцев усваивают органические вещества, растворенные в воде всей поверхностью тела.
У некоторых хищных форм есть клеточный рот, которым они заглатывают относительно крупную добычу.
Эвглены- одна из групп жгутиконосцев, способных к фотосинтезу.
У эвглен есть светочувствительный глазок, благодаря которому они выбирают направление движения в сторону источника света, светочувствительный глазок еще называют стигма.
Это явление носит название положительного фототаксиса.
Ученые спорят о том, относить ли эвглен к растениям или к простейшим животным, так как в группе эвглен есть и представители, полностью утратившие способность к фотосинтезу.
Также мы можем увидеть под микроскопом постоянно сокращающуюся структуру в клетке эвглены- это сократительная вакуоль- органоид выделения (удаление жидких продуктов жизнедеятельности).
Зеленая эвглена- фотосинтезирующий жгутиконосец.
Известны также колониальные и многоклеточные формы жгутиконосцев, которые способны к фотосинтезу.
Например, вольвокс:
По одной из гипотез, возможно происхождение многоклеточных животных организмов от воротничковых жгутиконосцев.
Долгое время ботаники включали жгутиконосцев в состав царства Растений, а зоологи относили их к царству Животных, но это не мудрено, ведь эвглена зеленая, вольвокс, хламидомонада и другие жгутиконосцы соединяют в себе черты растительных и животных организмов.
В их клетках содержится хлорофилл, благодаря чему они способны к фотосинтезу, как растения, и на свету из углекислого газа и воды они образуют органические вещества, это автотрофный тип питания.
В темноте же эвглена, вольвокс, хламидомонада питаются готовыми органическими веществами, как животные, то есть охотятся на бактерий, мелких одноклеточных, одноклеточных водорослей- это гетеротрофный тип питания.
Такой тип питания называется смешанный или миксотрофный.
I. Вовлечение биологических часов, дыхания, фотосинтеза и цитоскелета в JSTOR
AbstractВодоросль Euglena gracilis Z. меняет свою форму два раза в день при выращивании под синхронизирующим эффектом дневного цикла свет-темнота. В начале светового периода, когда фотосинтетическая способность низкая, популяция клеток в основном имеет сферическую форму. Средняя длина клеток в популяции увеличивается до максимума в середине светового периода, когда фотосинтетическая способность максимальна, а затем уменьшается в течение оставшейся части 24-часового периода.Население становится сферическим к концу 24-часового периода, когда цикл возобновляется. Эти изменения также наблюдаются в условиях постоянного тусклого света (до 72 часов) и, следовательно, контролируются биологическими часами и представляют собой циркадный ритм в форме клеток. При постоянном тусклом свете ритм деления клеток либо задерживается, либо значительно замедляется, в то время как ритм формы клеток сохраняется. Участие дыхательных и фотосинтетических путей в изменении формы клеток исследовали с помощью ингибиторов энергетических путей.Как антимицин A, так и NaN3 ингибировали изменения формы от круглой до длинной и от длинной до круглой, что указывает на участие дыхательных путей. DCMU и атразин ингибировали изменение формы от круглой до длинной, но не влияли на переход от длинной к круглой, указывая на то, что индуцированный светом поток электронов необходим только для изменения формы от круглой до длинной. Влияние изменений формы клеток на фотосинтетические реакции было исследовано путем изменения формы клеток с помощью ингибиторов цитоскелета цитохалазина и колхицина.Оба ингибитора блокировали круглые изменения формы до длинных и от длинных до круглых. Было обнаружено, что цитохалазин B оказывает минимальное цитотоксическое действие на фотосинтетические реакции, но колхицин значительно ингибирует индуцированный светом поток электронов и экспрессию фотосинтетического ритма in vivo.
Journal InformationМеждународный журнал «Физиология растений», основанный в 1926 году, посвящен физиологии, биохимии, клеточной и молекулярной биологии, генетике, биофизике и экологической биологии растений.Физиология растений — один из старейших и наиболее уважаемых журналов по науке о растениях.
Информация об издателеOxford University Press — это отделение Оксфордского университета. Издание во всем мире способствует достижению цели университета в области исследований, стипендий и образования. OUP — крупнейшая в мире университетская пресса с самым широким глобальным присутствием. В настоящее время он издает более 6000 новых публикаций в год, имеет офисы примерно в пятидесяти странах и насчитывает более 5500 сотрудников по всему миру.Он стал известен миллионам людей благодаря разнообразной издательской программе, которая включает научные работы по всем академическим дисциплинам, библии, музыку, школьные и университетские учебники, книги по бизнесу, словари и справочники, а также академические журналы.
ответов фотосинтетической эффективности, формы и подвижности клеток Euglena gracilis (Euglenophyceae) на кратковременное воздействие тяжелых металлов и пентахлорфенола
Ад-Эль-Монем, Х. М., Корради, М.G. и Gor¡i, G .: 1998, «Токсичность меди и цинка для двух штаммов Scenedesmus acutus , имеющих разную чувствительность к хрому», Envir. Exper. Бот. 40 , 59–66.
Google Scholar
Ангади, С. Б. и Матад, П .: 1998, «Влияние меди, кадмия и ртути на морфологические, физиологические и ¡иохимические характеристики Scenedesmus quadricauda (Turp.) De Bre¡.», J.Envir. Биол. 19 , 119–124.
Google Scholar
Баннистер, Т .: 1974, «Общая теория устойчивого роста фитопланктона в смешанном слое, насыщенном питательными веществами», Лимнол. Oceanogr. 19 , 13–30.
Google Scholar
Барк, Дж., Аахамид, А., Бурезги, Й., Чакун, Х. и Бонали, Дж.: 1995, «Реакция роста ахлорофилловой Euglena gracilis на отдельные концентрации кадмия и пентахлорфенола. ‘, арка.Envir. Продолж. Токсично. 28 , 8–12.
Google Scholar
Checcucci, A., Coloméetti, G., Ferrara, R. и Lenci, F .: 1976, «Спектры действия фотоаккумуляции зеленого и бесцветного Euglena : свидетельства для идентификации рецепторных пигментов», Photochem. Фото¡iol. 23 , 51–54.
Google Scholar
Сид, А., Херреро, К., Торрес, Э. и Альде, Дж .: 1995, «Токсичность меди в отношении морских микроводорослей Phaeodactylum tricornutum– влияет на фотосинтез и связанные с ним параметры», Aquat. Toxicol. 31 , 165–174.
Google Scholar
Clark, R.B .: 1997, Marine Pollution , 4-е изд., Clarendon Press, Oxford, 161 pp.
Google Scholar
Данилов Р.А. и Экелунд, NGA: 1998, «Корреляция между различными уровнями отходов лесной промышленности и темпами роста Euglena gracilis », Отчет 1998: 8, Университет Средней Швеции, Сундсвалль, ISSN 1104–294X .
Google Scholar
Данилов, Р. А. и Экелунд, Н. Г. А .: 1999, «Влияние сточных вод бумажной промышленности и УФ-В излучения на эффективность фотосинтеза Euglena gracilis », J.Прил. Phycol. 11 , 157–163.
Google Scholar
Экелунд, Н. Г. А .: 1993, «Влияние УФ-В излучения и гуминовых веществ на рост и подвижность жгутиков, Euglena gracilis », J. Plank. Res. 15 , 715–722.
Google Scholar
Эль-Наггар А. Х .: 1998, «Токсическое воздействие никеля на фотосистему II Chlamydomonas reinhardtii », Cyto¡ios 93 , 93–101.
Google Scholar
Фаргасова А .: 1998, «Накопление и токсинные эффекты Cu 2+ , Cu + , Mn 2+ , В.О. 4 3-, Ni 2+ и MoO 4 2- и их ассоциации: Влияние на частоту дыхания и содержание хлорофилла альфа в зеленой водоросли Scenedesmus quadricaauda ’, J. Trace Micropro¡e Tech. 16 , 481–490.
Google Scholar
Фаргасова А. и Кизлинк Дж .: 1996, «Влияние оловоорганических соединений на рост пресноводных водорослей Scenedesmus quadricauda », Ecotox. Envir. Saf. 34 , 156–159.
Google Scholar
Гайдосова Дж. И Райхртова Э .: 1996, «Различная реакция роста Euglena gracilis на соединения Hg, Cd, Cr и Ni», Fresenius J.Анальный. Chem. 354 , 641–642.
Google Scholar
Хадер, Д.-П., Леерт, М., Тахедл, Х. и Рихтер, П .: 1997, «Тест жгутиконосцев Эрлангера (EFT): фотосинтетические жгутиконосцы в биологических дозиметрах», J Photochem. Фото¡iol. 40 , 23–28.
Google Scholar
Macor, M., Beno, J., Grones, J., Siekel, P. и Novotny, J.: 1996, « Euglena gracilis как дополнительный тест-организм для обнаружения ¡иологически активных соединений», Folia Micro¡iol. 41 , 48–52.
Google Scholar
Nalewajko, C. и Olaveson, MM: 1995, «Дифференциальные реакции роста, фотосинтеза, дыхания и поглощения фосфата на медь у устойчивых к меди и нетолерантных к ней штаммов cenedesmus acutus (Chlorophyceae)», Может.J. Bot. 73 , 1295–1303.
Google Scholar
Наварро, Л., Торрес-Маркес, М., Гонсалес-Морено, С., Деварс, С., Эрнандес, Р. и Морено-Санчес, Р.: 1997, «Сравнение физиологических изменений в Эвглена. gracilis при воздействии тяжелых металлов на гетеротрофные и автотрофные клетки », Comp. Bioch. Physiol. 116 , 265–272.
Google Scholar
Огрен, Э.и Эванс, Дж. Р .: 1993, «Фотосинтетические кривые светового отклика», Planta 189 , 182–190.
Google Scholar
Платт Т. и Джассай А .: 1976, «Взаимосвязь между фотосинтезом и светом для природных сообществ прибрежного морского фитопланктона», J. Phycol. 12 , 421–430.
Google Scholar
Филлипс, Д.JH: 1996, «Научное, экономическое, экологическое и политическое значение сброса токсичных отходов в водную среду», в Tapp, JF, Wharfe, JR и Hunt, SM (ред.), Токсическое воздействие отходов на водную среду. Окружающая среда , Королевское химическое общество, Кэмридж, стр. 9–26.
Google Scholar
Зейдл, М., Хуанг, В. и Моучел, Дж. М .: 1998, «Токсичность комбинированных сливов коллектора для речного фитопланктона: роль тяжелых металлов», Envir.Загрязнение. 101 , 107–116.
Google Scholar
Страк, Б.Д., Пельцер, Р., Остапчук, П., Эмонс, Х. и Мохл, К.: 1997, «Статистическая оценка свойств экосистемы, влияющих на поглощение As, Cd, Co, Cu, Hg, Mn, Ni, P¡ и Zn в морских водорослях ( Fucus vesiculosus ) и мидии обыкновенной ( Mytilus edulis ) », Sci. Total Envir. 14 , 29–42.
Google Scholar
Тикканен, М., Корхола, А., Сеппа, Х. и Вирканен, Дж.: 1997, «Долгосрочный отчет о человеческих воздействиях на экосистему города в отложениях залива Тулонлахти в Хельсинки, Финляндия», Environ. Консерв. 24 , 326–337.
Google Scholar
Тико В., Шейлз С. В. и Скрэгг А. Х .: 1996, «Влияние пентахлорфенола на рост микроводорослей», Envir. Tech. 17 , 1139–1144.
Google Scholar
Виньоли, П., Greyfuss, G. и Rondelaud, D.: 1996, «Модификация роста Euglena gracilis Kle¡s после нанесения производных 2-энзамино-5-нитротиазола», Ecotox. Envir. Saf. 34 , 118–124.
Google Scholar
Zeisler, R., Dekner, R., Zeiller, E., Doucha, J., Mader, P. и Kucera, J .: 1998, «Эталонные материалы одноклеточных зеленых водорослей с регулируемыми уровнями тяжелых металлов» , Fresenius J. Anal.Chem. 360 , 429–432.
Google Scholar
Поток клеток Euglena gracilis зависит от градиента интенсивности света
Abstract
Мы количественно оценили фотодвижение суспензии Euglena gracilis , представляющую поведенческую реакцию на световой градиент. Несмотря на недавние измерения фототаксиса и фотофобности, детали макроскопического поведения фотодвижений клеток в условиях градиентов интенсивности света, которые имеют решающее значение для понимания недавних экспериментов по пространственно локализованным образцам биоконвекции, не были полностью поняты.В этой статье поток плотности клеток при градиенте интенсивности света был измерен с помощью следующих двух экспериментов. В первом эксперименте капилляр, содержащий суспензию клеток, освещался разной интенсивностью света в двух областях. В установившемся режиме различия количества клеток в двух областях, нормированные на общее количество, были пропорциональны разнице света, где разница в интенсивности света составляла 0,5–2,0 мкм моль м -2 с -1 .Коэффициент пропорциональности был положительным (т. Е. Яркая область содержала много микроорганизмов), когда средняя интенсивность света была слабой (1,25 мкм моль м -2 с -1 ), тогда как он был отрицательным, когда средняя интенсивность была сильной. (13,75 мкм моль м −2 с −1 ). Во втором эксперименте неглубокий прямоугольный контейнер с суспензией освещался ступенчатым светом. Распределение плотности клеток показало единственный пик в положении, где интенсивность света составляла примерно I c 3.8 мкм моль м −2 с −1 . Эти результаты предполагают, что суспензия E. gracilis реагировала на световой градиент и что благоприятная интенсивность света составляла I c .
Образец цитирования: Огава Т., Сёдзи Э, Суэмацу Нью-Джерси, Нишимори Х., Изуми С., Авазу А. и др. (2016) Поток клеток Euglena gracilis зависит от градиента интенсивности света. PLoS ONE 11 (12): e0168114. https: // doi.org / 10.1371 / journal.pone.0168114
Редактор: Санджой Бхаттачарья, Глазной институт Баскома Палмера, США
Поступила: 22.06.2016; Одобрена: 27 ноября 2016 г .; Опубликован: 29 декабря 2016 г.
Авторские права: © 2016 Ogawa et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Эта работа была поддержана JSPS KAKENHI 26400396 MI https://www.jsps.go.jp/english/e-grants/ и CREST PJ74100011 MI http://www.jst.go.jp/ kisoken / crest / en / index.html. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
1 Введение
Euglena gracilis — одноклеточная фотосинтетическая водоросль с жгутиками; тело приблизительно 10 мкм в ширину м и 50–100 мкм в длину. E.gracilis несет клеймо (глазное пятно) в передней части, которое имеет красный цвет из-за содержащихся в теле каротиноидных пигментов, называемых пигментными гранулами. Особи E. gracilis реагируют на свет посредством затенения рыльца на парафлагеллярном теле (PFB) у основания жгутика.Поведение фотоответа E. gracilis можно разделить на фототаксис, фотокинез и фотофобный ответ [1].
Посредством фототаксиса E.gracilis плывет к источнику света, если интенсивность меньше критического значения (положительный фототаксис), и уплывает, если интенсивность превышает критическое значение (отрицательный фототаксис) [2]. В этой статье мы определяем фототаксис потока клеток как движение фотоотклика, при котором средняя скорость плавания параллельна вектору света согласно Винсенту и Хиллу [3].Häder et al. [4] измерили фототаксис E. gralicis для нескольких яркостей белого света и обнаружили, что поведение фототаксиса почти предельное около 250 лк, что эквивалентно 1,05 Вт · м −2 согласно соотношению преобразования. Giometto et al. [5] измерили фототаксис при распределении света, создаваемом точечным источником света. E. gracilis также обнаруживает таксис для поляризованного света [6, 7].
Фотокинез — это явление, при котором линейная скорость плавания зависит от силы света.Нода исследовал скорость плавания E. gracilis при интенсивности света от 200 до 2500 лк (С. Нода, магистерская диссертация в Хиросимском университете, 2012 г.). Было обнаружено, что скорость плавания составляла приблизительно 60 мкм мс -1 , если сила света была меньше 1000 лк, но она увеличивалась с увеличением интенсивности света с максимальной скоростью примерно 90 мкм мс — 1 при 2500 лк.
Фотофобная реакция — это реакция шока, вызванная светом, которая возникает, когда интенсивность освещения вокруг микроорганизма внезапно изменяется.Мацунага и др. [8] измерили статистику изменения направления плавания при резком временном изменении интенсивности света. Они измерили как «повышающее» изменение; то есть увеличение интенсивности света из состояния отсутствия света и «понижение» интенсивности; то есть уменьшение интенсивности света до состояния отсутствия света. Они также определили индекс фотофобности и измерили индекс для света с разными длинами волн (260-520 нм) и интенсивностями (0,3–100 мкм моль м -2 с -1 ) и обнаружили, что индекс увеличивается с увеличением интенсивности света. в диапазоне 0.1–10 мкм моль м –2 с –1 , хотя детальное поведение зависело от длины волны. Кроме того, Iseki et al. [9] идентифицировали флавопротеин, ответственный за «повышающие» ответы.
Фотодвижения E. gracilis вызывают интересную макроскопическую картину: биоконвекцию [3, 10–14]. Если взвесь E. gracilis освещается снизу сильным светом, то картина локализуется в пространстве [15, 16]. Такие локализованные структуры можно разделить на две группы: одна представляет собой отдельную область с высокой плотностью клеток, зажатую с двумя противоположно вращающимися конвекционными валками (биоконвекционный блок), а другая представляет собой бегущую волну в ограниченной области (локализованная бегущая волна).Эти элементарные конструкции могут быть получены в кольцевом контейнере [15].
Сильное освещение снизу является необходимым условием для создания этих локализованных биоконвекционных структур. И наоборот, если интенсивность света мала, картина локализации не наблюдается [17]. В то время как поведение фотоотклика, вероятно, отвечает за механизм локализации, вышеупомянутые фотодвижения кажутся недостаточными для описания наблюдаемых паттернов локализации. В частности, движение микроорганизмов за счет фототаксиса параллельно световому вектору.В установке вертикального светового вектора это важно для микроорганизмов, чтобы накапливаться у поверхности и вызывать нестабильность Рэлея-Тейлора [18]; однако макроскопический горизонтальный поток плотности клеток, вызывающий наблюдаемую пространственную локализацию, не учитывается в этом эффекте.
Винсент и Хилл [3] проанализировали гидродинамическую модель биоконвекции, созданную с помощью положительного фототаксиса, когда суспензия освещалась сверху. В их модели член фототаксиса индуцировал поток плотности клеток только в вертикальном направлении.Рассеяние света рассматривалось в биоконвекции при освещении сверху Гораи и его сотрудниками [19, 20]; однако поток усредненной плотности клеток из-за фототаксиса был направлен вертикально, как в модели Винсента и Хилла. Таким образом, кажется, что локализованные модели конвекции требуют другого фотодвижения, которое могло бы быть боковым, чтобы усилить пространственные возмущения.
В этом исследовании мы предполагаем, что боковое движение обусловлено фотодвижением, определяемым световым градиентом, благодаря которому возможно эффективное скопление особей, потому что при освещении подвески снизу область у поверхности, которая составляет Euglena — богата. темнее по сравнению с другими регионами.Для сравнения, Williams и Bees [21] включили эффект фотодвижения из-за светового градиента на крутящий момент, приложенный к клетке микроорганизма, предполагая, что отдельная клетка способна обнаруживать световой градиент. Кроме того, исследования таких условий, как пространственная световая ловушка [7] или фотофобная реакция [8], позволили предположить некоторые реакции E. gracilis на световой градиент.
Giometto et al. [5] получили уравнение плотности клеток, которое включает пространственный потенциал, вызывающий популяционную скорость в направлении светового градиента.Однако их измерения проводятся при освещении точечным источником света. Таким образом, вектор света не является вертикальным, за исключением начала источника света, поэтому их уравнение не может быть применено непосредственно к конфигурации пространственно однородного освещения (плоский источник света), что связано со многими проблемами, включая проблемы биоконвекции. Уравнение для описания потока ячеек при световом градиенте, создаваемом плоскими источниками света, будет полезным, однако прямых измерений потока плотности ячеек E.gracilis под легким градиентом. Здесь мы сосредотачиваемся на макроскопическом поведении потока плотности клеток (называемого в дальнейшем «плотностью клеток») и представляем доказательства того, что световой градиент на самом деле вызывает смещение плотности клеток при неоднородном освещении. В частности, в этом исследовании мы измерили фотодвижение E. gracilis за счет светового градиента. Обобщив экспериментальные установки ниже (раздел 2), мы покажем, что поток плотности ячеек состоит из суммы диффузии и другого потока, который пропорционален световому градиенту и средней плотности ячеек (раздел 3).Мы оцениваем коэффициенты потока как функцию средней интенсивности света (раздел 4) и обсуждаем наблюдаемое поведение фотодвижения в контексте других явлений, таких как хемотаксис (раздел 5).
2 Экспериментальные установки
E. gracilis предварительно культивировали с использованием среды Корена-Хутнера в течение 2–4 недель при непрерывном освещении при комнатной температуре. Затем клетки инокулировали в раствор HYPONeX с концентрацией 1 г / л при периодическом освещении (14 ч яркого света / 10 ч темноты).После 4–21 дня культивирования в водном растворе HYPONeX суспензию использовали для каждого эксперимента в течение 10–14 часов циркадного времени (CT).
Поток плотности клеток измерялся в световом поле с двумя различными областями интенсивности (раздел 3). Культуру HYPONeX разводили до 2,50 × 10 5 клеток на мл -1 плотности клеток и помещали в капиллярный стакан (объем V = 1 мкл , длина = 30 мм, внутренний радиус = 0,10 мм). . Капиллярное стекло с культурой клеток освещали в течение 60 мин снизу галогенным плоским источником света (YAHATA, Megalight 100) через белую акриловую пластину (толщиной 1 мм) для рассеивания света (рис. 1 (а)).Две области с разной интенсивностью света были приготовлены с использованием фото-маски из листа OHP, на котором маска в градациях серого была напечатана с использованием лазерного принтера (Canon MF8350). Плотность фотопотока (PFD) в точке наблюдения I измерялась освещающим фотометром (Deltaohm, HD2302.0) на белой акриловой пластине. Разница в PFD между более темной областью ( I D ) и более яркой областью ( I B ) варьировалась от 0.5 до 2,0 мкм моль м -2 с -1 при сохранении средней интенсивности ( I D + I B ) / 2 константа (рис. 1 (б) ). В области около x = 0, границы интенсивностей света, интенсивность света имела градиент. Максимальный световой градиент составил -0,314 мкм моль м -2 с -1 ⋅ мкм м -1 . Для подсчета количества клеток, содержащихся в более темной ( N D ) и более яркой ( N B ) частях, капиллярное стекло было разрезано по центру и культура перенесена на стеклянную пластину. перед тем, как один раз промыть внутреннюю часть капиллярного стакана дистиллированной водой.Затем подсчитывали количество клеток на фотографии, сделанной с верхней части стеклянной пластины с помощью микрообъектива (универсальный адаптер Raynox UAC 3500), прикрепленного к цифровой камере (GC-PX1, JVC, Япония). Для каждого набора из I B — I D и I B + I D было выполнено десять экспериментов. Хотя в более позднем анализе использовалась нормализованная разница в двух регионах, распределение для N D и N B характеризовалось 60.30 ± 19,41 и 151,80 ± 22,75 (среднее ± стандартное отклонение) для случая ( I D + I B ) / 2 = 1,25 μ моль м −2 с −1 и I B — I D = 1,5 μ моль м −2 с −1 , например.
Плотность стационарных клеток оценивалась при освещении градиентом интенсивности света (раздел 4).Ступенчатая интенсивность света создавалась фотошаблоном с листом ОНР. Были подготовлены два вида дискретных рисунков следующим образом: первый рисунок имел восемь ступеней, а интенсивность света увеличивалась с 1,47 мкм моль м -2 с -1 до 25,76 мкм моль м -2 с −1 с 3,47 μ моль м −2 с −1 в шаге с прямоугольными областями (5 мм в ширину, 25 мм в высоту) (Лист A; Рис. 2 (a), внутри пунктирного прямоугольника ).Вторая картина имела семь ступеней, и интенсивность света увеличивалась с 1,47 мкм моль м -2 с -1 до 8,41 мкм моль м -2 с -1 с 1,16 мкм моль м −2 с −1 на этапе (Лист B). Шаблоны были зажаты с двумя более широкими прямоугольными областями (40 мм в ширину, 25 мм в высоту), и оттенки серого каждого широкого прямоугольного шаблона были такими же, как и у соседнего прямоугольника, чтобы устранить граничные эффекты.
Была приготовлена силиконовая пластина толщиной 1 мм с прямоугольным отверстием, которая была зажата со стеклянными пластинами для создания ячейки Хеле-Шоу (64 мм в ширину, 10 мм в высоту и 1 мм в толщину). Культуру HYPONeX разбавляли до плотности клеток 0,50 × 10 5 и герметично закрывали в ячейке Хеле-Шоу. Ячейка Хеле-Шоу освещалась снизу галогеновым плоским светом через фото-маску и белую акриловую пластину (рис. 2 (b)). После 2-часового освещения клетки в каждой прямоугольной области фотографировали с использованием той же оптики, что и в предыдущем эксперименте.Оптика была установлена на устройстве, которое позволяет механически перемещаться по горизонтали, так что высота фокуса была одинаковой для всех областей во время одной последовательности сканирования. Кроме того, тщательно выбиралась высота фокуса, чтобы избежать приграничных областей. Сфотографированная область представляла собой прямоугольник (2,9 мм × 2,2 мм) в центральной части каждой прямоугольной области, после чего подсчитывали количество ячеек. Мы подготовили две фотографии, сделанные с интервалом в одну секунду, преобразовали их в изображения в оттенках серого (рис. 2 (c)) и подсчитали темные пятна, которые перемещались между двумя изображениями.Для каждой области плотности было выполнено десять измерений. Отметим, что ширина прямоугольной области была выбрана так, чтобы она была больше как толщины ячейки Хеле-Шоу, так и ширины области фотографии.
3 Поток плотности клеток за счет светового градиента
В первом эксперименте (рис. 1), если N B и N D зависят от разницы в интенсивности света, I B — I D , поток плотности клеток имеет другой фактор, зависящий от световой среды.Здесь мы смоделировали движение населения, а не индивидуальное движение. Согласно результатам Giometto et al. [5], что распределение плотности клеток удовлетворяет уравнению диффузии, мы предположили, что поток плотности клеток Дж был суммой эффекта диффузии и дополнительного члена, Дж p , который был неизвестен в тот момент. , следующим образом. (1) Нашей целью в этом эксперименте было выяснить, зависит ли J p от разницы в интенсивности света, Δ I = I B — I D , и количественно определить зависимость от Δ I .Для этого была использована следующая формула. В установившемся режиме Дж = 0. Мы проинтегрировали уравнение (1) по интервалу [- ε , ε ] (где 2 ε — характерная ширина переходного слоя интенсивности света на обе стороны), чтобы получить (2) Что касается n ( ε ), n (- ε ) в качестве средней плотности ячеек в яркой области и в темной области, N B / ( V /2 ), N D / ( V /2) соответственно, мы получили (3) Таким образом, усредненный поток в интервале [- ε , ε ],, представляется как (4) Эта формула дает соотношение между Δ N и Δ N , измеренным экспериментально.Мы измерили Δ N для разных Δ I , сохранив при этом среднюю интенсивность света I среднее значение = ( I D + I B ) / 2. Результаты суммированы на рис. 3, где нанесен график для Δ I для I среднее значение = 1,25, 3,25 и 13,75 мкм моль м -2 с -1 . Количество клеток в капилляре ( N D + N B ) варьировалось от 135 до 319, тогда как количество было оценено как 250 клеток из средней плотности клеток в культуре.Когда I среднее значение = 1,25 μ моль м -2 с -1 , средние значения N B для каждого значения Δ I всегда были больше, чем у N D ; то есть особи имели тенденцию накапливаться в среднем в более яркой области. С другой стороны, когда I среднее значение = 13,75 мкм моль м −2 с −1 , средние значения N B всегда были меньше, чем значения N . D , и особи имели тенденцию накапливаться в среднем в более темных областях.Эти два случая показывают, что горизонтальный световой градиент вызывает смещение плотности ячеек и что направление потока плотности ячеек зависит от I среднего . Также показан почти нейтральный случай, I среднее = 3,25 μ моль м −2 с −1 , где средние значения N D и N B были почти такими же, хотя световой градиент присутствовал.
Рис 3. по сравнению с Δ I для I среднее = 1,25, 3,25, 13,75 μ моль м −2 с −1 .Усредненные значения и стандартные отклонения показаны точками и столбиками . Фитинги нарисованы пунктирными линиями . Наклоны : 0,302 ± 0,0252 для I среднее = 1,25 мкм моль м −2 с −1 , −0,0147 ± 0,0226 для I 0 среднее .25 μ моль м −2 с −1 и −0,243 ± 0,0217 для I среднее значение = 13,75 μ моль м −2 с −1 .
https://doi.org/10.1371/journal.pone.0168114.g003
Кроме того, рис. 3 показывает, что это пропорционально Δ I : (5) где k — постоянная, определяемая средней силой света и. Тогда мы могли бы определить поток как (6) где — усредненный градиент интенсивности света.
Взяв предел ε → 0, мы получили следующий вид J p : (7) где коэффициент 2 k был заменен функцией силы света, f ( I ).
4 Функция фотодвижения за счет светового градиента
Далее мы оценили f ( I ) экспериментально. Мы использовали следующую формулу. По формуле (1) и виду J p (уравнение (7)) мы приняли следующий вид потока плотности клеток в одномерном случае как (8) В установившемся режиме Дж = 0.Потом, (9) Таким образом, мы могли оценить f ( I ) путем измерения распределения плотности клеток в установившемся состоянии, n ( x ), при заданном распределении интенсивности света I ( x ). Для этого был проведен эксперимент, представленный на рис.
Общее поле силы света можно рассматривать как ступенчатое, тогда как средний линейный градиент света dI / dx = γ в листе A составил γ = γ A = 0 .694 μ моль м −2 с −1 ⋅ мм −1 , а в листе B γ = γ B = 0,231 μ моль м −2 с −1 ⋅ мм −1 . Далее мы предположили, что dI / dx = γ .
Поскольку плотность клеток была низкой, а глубина суспензии была небольшой, мы могли исключить эффект самозатенения E. gracilis ; в частности, не происходила биоконвекция.Кроме того, глубина резкости камеры, a , была мала по сравнению с глубиной ячейки Хеле-Шоу, d . Таким образом, подсчитанное количество в каждой области, N , было оценено путем умножения плотности ячеек на a и области наблюдения A : N = nAa . В реальных измерениях мы использовали усредненное частотное распределение N , n ′, которое также пропорционально n . Из этих измеренных значений мы могли бы получить f ( I ) как (10)
На рис. 4 показано частотное распределение подсчитанного количества ячеек, n ′.Во всех экспериментах не наблюдалось глобального перетекания или самозатенения особей. Результаты для листа A показывают медленный распад ( I -1 ) n ‘, когда I > 15 мкм моль м -2 с -1 . На обоих графиках есть одиночные пики; в частности, I = 3,80 мкм моль м -2 с -1 для листа B. Эти результаты показывают, что E. gracilis предпочитает определенную интенсивность света и перемещается в соответствии с градиентом света.Распределение с использованием листа B предполагает, что n ( x ) имеет большой разброс в области I <10 μ моль м −2 s −1 ; данные для листа А сглаживаются в этой области.
Рис. 4. Данные графика n ′ ( x ).
(а) Лист А, исходные данные. Усредненные значения и стандартные отклонения показаны точками и полосами, которые немного смещены вправо, чтобы избежать перекрытия с необработанными данными.(b) То же, что и в пункте (a), но для листа B. (a) ’Лист A, кривая, описанная уравнением (11). Усредненные значения и стандартные отклонения показаны точками и полосами. (b) ’Как в (a)’, но для листа B и горизонтальный диапазон был установлен таким же, как для (a) ’.
https://doi.org/10.1371/journal.pone.0168114.g004
Полученные распределения качественно согласуются с результатом, полученным при рассмотрении потока плотности клеток, где E. gracilis переместился в более яркую область при I = 1.25 мкм моль м -2 с -1 , тогда как он предпочел более темную область, когда I = 13,75 мкм моль м -2 с -1 . Мы предположили, что измеренное значение Частотное распределение количества клеток, которое пропорционально распределению плотности клеток, было представлено дробной функцией следующего вида: (11) где независимая переменная была заменена на I с использованием отношения I ( x ) = γx .Эта форма была выбрана так, чтобы при I был большим, как это отражено в результате на листе A (рис. 4 (a)).
Подгонянные значения a , b , c и d , полученные методом Левенберга-Марквардта, а также интенсивность света, дающая пик подобранной кривой, I *, перечислены в таблице 1 для обоих случаев листа A и листа B. Подгоняемая функция принимает максимум в I = I c = 3.8 мкм моль м −2 с −1 для листа B.
Эти два эксперимента дают распределение плотности клеток в разных световых областях; закон затухания в яркой области был получен путем эксперимента с использованием Листа A, а подробное распределение вблизи максимума n ′ было исследовано в эксперименте с использованием Листа B. Здесь мы отмечаем, что плотность клеток n ( I ) ожидалось, что он будет пропорционален; однако их коэффициенты пропорциональности не совпадают при конкретном значении I (или x ) по следующим двум причинам: (1) (и изображенные данные) не представляют саму плотность клеток, а представляют собой нормализованное значение используя общее количество ячеек.(2) Распределение количества клеток зависит как от средней плотности клеток, так и от распределения света. Следовательно, мы не можем напрямую объединить результаты для листа A и листа B.
Чтобы получить функцию f ( I ) с использованием этих данных, нам не требовалось абсолютное значение плотности ячеек, потому что пропорциональность не меняется f ( I ): f ( I ) инвариантна относительно преобразования n ′ → αn ′ ( α — постоянная).Используя этот факт, мы оценили функцию распределения чисел, охватывающую всю экспериментальную область, следующим образом. Давайте определим набор данных интенсивности света и плотности клеток в экспериментах с использованием Листа A и Листа B как S A и S B соответственно. Здесь S A и S B , где M — количество данных. Мы определяем критическую интенсивность света, разделяющую область затухания и детальную область, как I = I b = 10 μ моль м −2 с −1 .Мы объединяем S A и S B с учетом того, что каждый набор имеет неопределенный коэффициент плотности ячеек, который является результатом различных областей светового градиента. Без потери общности, мы можем присвоить коэффициент неопределенности только набору данных S A . Теперь объединенный набор данных S ( α ) определяется как (12) (13) Подбор функции к набору данных S ( k ) выполняется следующим образом.Мы определяем ошибку подгонки как функцию α как: (14) (15) где — функция, пропорциональная распределению плотности клеток. Здесь мы приняли разницу между логарифмом данных и функциями для взвешивания данных в области затухания, чтобы хвостовая часть распределения также вносила вклад в оценку ошибки. Чтобы найти набор α и ( a , b , c , d ), чтобы минимизировать E ( α ; a , b , c , d ), мы нашли параметры ( a , b , c , d ) для минимизации E ( α ; a , b , c , d ) для данного значения α .Величина минимальной ошибки определялась как. Затем находим минимизатор α = α * такой, чтобы определить лучшие параметры α и ( a , b , c , d ). На практике мы вычисляем в интервале 1 ≤ α ≤ 5 с шагом 0,01 и находим α *, так что это минимум. Результаты приведены в таблице 1 (справа), где были получены α * = 3,96 и I * = 3,63.Соответствующая функция для набора данных S ( k ) показана на рис. 5.
Подставляя функции и на n ′ в уравнении (10), вычисляем функцию f ( I ). Здесь мы еще раз отметим, что постоянная неопределенность не влияет на вычисление f ( I ), поэтому оба и могут использоваться для вычисления f ( I ). Вычисленные функции для f ( I ) показаны на рис. 6. Общая форма функции для листа A аналогична таковой для объединенного, за исключением меньших значений интенсивности света.Форма функции для Листа B аналогична объединенной для больших значений интенсивности света, тогда как она отличается от формы для объединенного из-за грубых данных. Значение f ( I ) должно быть идентично значению 2 k , полученному с учетом потока плотности ячеек; k = 0,302, -0,0147, -0,243 для I среднее = 1,25, 3,25 и 13,75 мкм моль м -2 с -1 соответственно. Значение k = 0.302 ( I среднее значение = 1,25 мкм моль м -2 с -1 ) отклоняется от результата, потому что он находится за пределами области измеренного значения, и подобранная функция, таким образом, не может хорошо представлять данные . Два других значения демонстрируют разумное согласие с расчетным значением f ( I ).
Знак f ( I ) изменяется при I = I c по формуле (10). Таким образом, если сила света меньше I c , E.gracilis имеют тенденцию двигаться в сторону более яркой области. Если интенсивность света больше, чем I c , E. gracilis имеет тенденцию перемещаться в более темную область. Однако функция f ( I ) принимает значение почти равное нулю, если I большое (например, 15 μ моль м −2 с −1 ), поэтому E. gracilis почти нейтральный по отношению к световому градиенту, если средняя интенсивность света достаточно велика.
5 Заключительные замечания
В этом исследовании мы провели два эксперимента, чтобы изучить распределение плотности клеток в суспензии E.gracilis под градиентом интенсивности света. В первом эксперименте был измерен поток плотности клеток, и результат показал, что поток был пропорционален градиенту интенсивности света и плотности клеток. Коэффициенты пропорциональности могут быть как положительными, так и отрицательными, в зависимости от средней интенсивности света. Во втором эксперименте коэффициент оценивался как функция интенсивности света. Полученные результаты показали, что E. gracilis имеют тенденцию накапливаться в направлении области с определенной интенсивностью света (примерно 3.8 мкм моль м -2 с -1 ), когда суспензия освещалась снизу таким образом, что создавался линейный градиент интенсивности света, хотя критическое значение для отдельных лиц могло иметь разнообразие. В этих экспериментах основной эффект фототаксиса был вертикальным из-за вертикального освещения, которое отличается от схемы, используемой Джометто и др., В которой использовался точечный источник света, а средний вектор света был наклонен [5].
По данным эксперимента по локальной биоконвекции с использованием E.gracilis [15, 16], мы приняли типичную плотность клеток как ρ = 10 6 клеток / мл, а глубину суспензии как d = 5 мм. Коэффициент поглощения суспензии E. gracilis , k a , составляет 2,84 × 10 −10 м 2 / клеток (С. Нода, кандидатская диссертация в Хиросимском университете, 2012 г.). Используя закон Ламберта-Бера, мы можем оценить интенсивность света в верхней части подвеса, освещенного снизу, с интенсивностью света I 0 , I , как Если мы возьмем I 0 = 30 μ моль м −2 с −1 , что соответствует примерно 1200 лк, мы получим I = 7.2 μ моль м −2 с −1 , что выше порога I c . Следовательно, если имеется возмущение в соответствующем однородном распределении плотности клеток во всей области, возмущение нарастает за счет светового градиента. Эта нестабильность не зависит от длины волны возмущения и не зависит от неустойчивости Рэлея-Тейлора, которая вызывает многие виды (нелокализованной) биоконвекции. В этом смысле фотодвижение из-за светового градиента может представлять главную причину локализации.
Механизм накопления пока остается открытым. Поскольку E. gracilis имеет единственное парафлагеллярное тело, которое действует как орган чувств, особь E. gracilis не может обнаружить мгновенный световой градиент. Однако настоящие результаты предполагают, что E. gracilis ведут себя так, как если бы они могли воспринимать световой градиент. Предложена теоретическая модель биохимических кинетических процессов фоторецепторов для раскрытия механизма фотофобных реакций [7].Однако нынешние характеристики f ( I ) не могут быть полностью объяснены с помощью одной только этой модели. Ниже перечислены несколько альтернативных кандидатов для этого механизма.
Первый кандидат — механизм на основе фототаксиса. Фактически, E. gracilis может интегрировать информацию о рассеянном свете в среде с градиентом света. В текущей настройке мы использовали акриловую пластину для рассеивания света, чтобы отдельная ячейка в среде с градиентом света обнаруживала векторы рассеяния света не только непосредственно снизу, но и под углом.Световые векторы снизу наклонно наклонены и их интенсивность неоднородна. Таким образом, интеграция фототактического отклика разной величины может привести к наблюдаемому отклику на световой градиент. Этот сценарий будет подтвержден, если отклик фототаксиса изменится при том же значении интенсивности света, при котором функция f ( I ), функция отклика на световой градиент, принимает ноль, т.е. 3,8 μ моль м −2 с −1 при тех же условиях освещения.Критическое значение изменения поведения фототаксиса, определенное Häder et al. составляла около 250 лк (= 1,05 Вт · м −2 ) [4]. Для точного преобразования энергетической освещенности в плотность фотопотока требуется спектр источника света, который недоступен. Оценка в предположении, что свет имел единственный пик при 470 нм, дает 1,05 Вт · м −2 = 4,1 мкм моль · м −2 с −1 . Подчеркнем, что это значение дает лишь порядок плотности фотопотока; однако примечательно, что он имеет тот же порядок, что и наше критическое значение.
Вторая возможность — это фотофобный механизм. Когда отдельная клетка E. gracilis плавает в условиях градиента света, интенсивность света изменяется в зависимости от пути плавания, что может вызвать изменение направления плавания. Согласно эксперименту Мацунаги и соавт. [8], увеличение или уменьшение интенсивности света на несколько мкм моль м -2 с -1 может увеличить вероятность изменения скорости в статистическом смысле.Значение интенсивности света также того же порядка, что и критическое значение в наших экспериментах, хотя в их экспериментах изучались изменения в поведении между светом и условиями отсутствия света.
Чтобы понять, как кинематический механизм может обеспечить чувствительность к градиенту, наводит на размышления механизм хемотаксиса у Escherichia coli и некоторых других бактерий. E. coli и некоторые другие бактерии демонстрируют явления, аналогичные понижающей (повышающей) фотофобной реакции E.gracilis [22–27]. Здесь E. coli демонстрирует временное увеличение скорости кувырка при изменении направления плавания, называемое адаптацией, вследствие внезапного снижения (увеличения) концентрации хемоаттрактанта (хеморепеллента). Хемотаксис E. coli также широко исследовался экспериментально и теоретически [22–32]. Недавно в результате теоретического исследования с использованием модели биохимической кинетики хеморецепторов была получена экспериментально наблюдаемая форма функции, которая зависит от отношения фоновой концентрации химического вещества к чувствительности к хемотаксису; эта функция соответствует f ( I ) в настоящем исследовании.[32].
Наши эксперименты показывают, что поток суспензии E. gracilis зависит от светового градиента. Измерения показывают другие аспекты коллективного движения E. gracilis , которые могут быть полезны для понимания коллективного поведения суспензии E. gracilis , особенно пространственно локализованных паттернов биоконвекции.
Вклад авторов
- Концептуализация: MI.
- курирование данных: TO.
- Формальный анализ: МИ ТО.
- Финансирование: MI.
- Расследование: МИ ХН АА.
- Методология: МИ ТО.
- Администрация проекта: MI.
- Ресурсы: MI SI.
- Программное обеспечение: MI ES TO.
- Надзор: MI.
- Проверка: MI ES TO.
- Визуализация: MI TO.
- Написание — черновик: MI.
- Написание — просмотр и редактирование: MI NJS.
Список литературы
- 1. Дин Б. Фототаксис и сенсорная трансдукция в Euglena . Наука. 1973; 181: 1009–1015. pmid: 4199225
- 2. Леберт М. Фототаксис Euglena gracilis — флавины и птерины. В всеобъемлющей серии по фотонауке 1: Фотодвижение (глава 11), изд. Хэдер Д.-П. and Jori G., 2001.
- 3. Винсент Р.В., Хилл Н.А. Биоконвекция в суспензии фототактических водорослей. Журнал гидромеханики. 1996. 327: 343–371.
- 4. Häder D-P, Colombetti G, Lenci F, Quaglia M. Фототаксис у жгутиконосцев, Euglena gracilis и Ochromonas danica . Архив микробиологии. 1981; 130: 78–82.
- 5. Джометто А., Альтерматт Ф., Маритан А., Стокер Р., Ринальдо А. Обобщенный рецепторный закон регулирует фототаксис в фитопланктоне Euglena gracilis .Труды Национальной академии наук США. 2015; 112: 7045–7050. pmid: 25964338
- 6. Häder D-P. Поляротаксис, гравитаксис и вертикальный фототаксис в зеленой жгутиконосце, Euglena gracilis . Архив микробиологии. 1987. 147: 179–183. pmid: 11536573
- 7. Кройц К., Дин Б. Моторные реакции на поляризованный свет и зондирование силы тяжести у Euglena gracilis . Журнал протозоологии. 1976; 23: 552–556.
- 8.Мацунага С., Хори Т., Такахаши Т., Кубота М., Ватанабе М., Окамото К., Масуда К. и Сугаи М. Обнаружение сигнального эффекта УФ-В / С-света в расширенных спектрах действия УФ-А / синего типа для ступенчатых понижающие и повышающие фотофобные реакции у одноклеточной жгутиковой водоросли Euglena gracilis . Протоплазма. 1998. 201: 45–52.
- 9. Исэки М., Мацунага С., Мураками А., Оно К., Сига К., Ёсида К. и др. Аденилатциклаза, активируемая синим светом, опосредует фотоизбежание у Euglena gracilis .Природа. 2002; 415: 1047–1051. pmid: 11875575
- 10. Уэйджер Х. О влиянии гравитации на движения и скопление Euglena viridis , Ehrb. И других микроорганизмов. Философские труды Королевского общества B: биологические науки. 1911; 201: 333–390.
- 11. Platt JR. «Паттерны биоконвекции» в культурах плавающих организмов. Наука. 1961; 133: 1766–1767. pmid: 17829722
- 12. Чилдресс С. Механика плавания и полета.Издательство Кембриджского университета; 1981.
- 13. Педли Т.Дж., Кесслер Дж. Гидродинамические явления в суспензиях плавающих микроорганизмов. Ежегодный обзор гидромеханики. 1992; 24: 313–358.
- 14. Хилл Н.А., Педли Т.Дж. Биоконвекция. Исследование динамики жидкости. 2005; 37: 1–20.
- 15. Сёдзи Э., Нисимори Х., Авазу А., Идзуми С., Иима М. Локализованные модели биоконвекции и их зависимость от начального состояния в суспензиях Euglena gracilis в кольцевом контейнере.Журнал Физического общества Японии. 2014; 83: 043001.
- 16. Суэмацу Н.Дж., Авазу А., Изуми С., Нода С., Наката С., Нисимори Х. Локализованная биоконвекция эвглены , вызванная фототаксисом в боковом направлении. Журнал Физического общества Японии. 2011; 80: 064003.
- 17. Suematsu NJ, Biseibutsu no soukousei ni tomonau kyokuzai tairyu pata-n no hikari outou. RIMS Kokyuroku. 2014; 1900: 85–90.
- 18. Чандрасекхар С.Гидродинамическая и гидромагнитная устойчивость. Dover Publications; 1981.
- 19. Ghorai S, Panda MK, Hill NA. Биоконвекция в суспензии изотропно рассеивающих фототактических водорослей. Физика жидкостей. 2010; 22: 071901.
- 20. Ghorai S, Panda MK. Биоконвекция в анизотропной рассеивающей суспензии фототактических водорослей. Европейский журнал механики — B / Жидкости. 2013; 41: 81–93.
- 21. Уильямс CR, Пчелы MA. Фотогиротактическая биоконвекция.Журнал гидромеханики. 2011; 678: 41–86.
- 22. Берг ХК, Браун Д.А. Хемотаксис в Escherichia coli анализировали с помощью трехмерного отслеживания. Природа. 1972; 239: 500–504. pmid: 4563019
- 23. Macnab RM, Koshland DE. Механизм восприятия градиента в бактериальном хемотаксисе. Труды Национальной академии наук США. 1972; 69: 2509–2512.
- 24. Блок С.М., Сегалл Дж. Э., Берг ХК. Импульсные ответы при бактериальном хемотаксисе.Клетка. 1982; 31: 215–226. pmid: 6760985
- 25. Месибов Р., Ордал Г.В., Адлер Дж. Диапазон концентраций аттрактантов для бактериального хемотаксиса, а также порог и размер ответа в этом диапазоне: закон Вебера и связанные с ним явления. Журнал общей физиологии. 1973; 62: 203–223. pmid: 4578974
- 26. Браун Д.А., Берг ХК. Временная стимуляция хемотаксиса Escherichia coli . Труды Национальной академии наук Соединенных Штатов Америки.1974; 71: 1388–1392. pmid: 4598304
- 27. Сегалл Дж. Э., Блок С. М., Берг ХК. Временные сравнения в бактериальном хемотаксисе. Труды Национальной академии наук Соединенных Штатов Америки. 1986; 83: 8987–8991. pmid: 3024160
- 28. Баркай Н., Лейблер С. Устойчивость в простых биохимических сетях. Природа. 1997; 387: 913–917. pmid: 9202124
- 29. Брей Д., Левин, доктор медицины, Мортон-Ферт С.Дж. Кластеризация рецепторов как клеточный механизм контроля чувствительности.Природа. 1998. 393: 85–88. pmid: 95
- 30. Мелло Б.А., Ту Ю. Эффекты адаптации в поддержании высокой чувствительности в широком диапазоне фонов для хемотаксиса Escherichia coli . Биофизический журнал. 2007. 92: 2329–2337. pmid: 17208965
- 31. Ту Й, Симидзу Т.С., Берг ХК. Моделирование хемотаксической реакции Escherichia coli на изменяющиеся во времени стимулы. Труды Национальной академии наук Соединенных Штатов Америки.2008; 105: 14855–14860. pmid: 18812513
- 32. Намба Т., Нисикава М., Сибата Т. Биофизический журнал. Связь передачи сигнала с чувствительностью и динамическим диапазоном бактериального хемотаксиса. Биофизический журнал. 2012; 103: 1390–1399. pmid: 22995512
euglena viridis, форма
Наиболее распространенным видом является Euglena viridis (рис. Strombomonas Deflandre 1930 (рис. Эуглена имеет жесткую пленку снаружи клеточной мембраны, которая помогает ей сохранять свою форму), хотя пленка несколько гибкая, и можно наблюдать сморщивание и движение некоторых эвглен по типу дюймового червя.Морфология, ультраструктура и формирование цист покоя E. agilis H.J. Форма и функции. Внешняя ограничивающая поверхность или пленка твердая, эластичная и придает животному более или менее фиксированную форму. В центре клетки находится ядро, которое содержит ДНК клетки и контролирует ее деятельность. R. viridis также обладал мощным фоторецепторным аппаратом, двумя жгутиками разной длины, эвгленоидным движением и пленкой, состоящей из 16 полос и одного (квадратного) оборота задней полоски редукции.Движение Euglena viridis: роль жгутиков ТЕОРЕТИЧЕСКИЙ АНАЛИЗ 581 Он предназначен для получения выражения для тяги, развиваемой цилиндрическим телом, движущимся по поверхности гиперболоида в жидкости в условиях, когда силы вязкости преобладают над силами инерции. Euglena viridis dianggap mirip hewan karena dapat bergerak aktif dengan pertolongan satu atau beberapa bulu cambuk (flagela) янь келуар дари селня. Уникальные особенности эвглены включают пленку, жгутики, глазное пятно, парафлагеллярное тело и парамилон.Количество и форма хлоропластов внутри эвглены сильно различаются. Современная (переработанная) версия рода Euglena является монофилетической; эти клоны часто имеют 40 полосок пленки, подвергаются метаболизму и демонстрируют большое разнообразие формы клеток и морфологии хлоропластов (например, передний конец тупой, а задний конец заостренный. У них есть один жгутик, который помогает ему перемещаться по воде. Процесс начинается, когда эвглена копирует свою ДНК и увеличивается в размерах.Разбавленные культуры клеток эвглены обычно плавают, используя свой жгутик, не меняя формы тела.Также они встречаются во влажных почвах. Euglena adalah ganggang bersel satu. Я БЫ; 4950) Описание Цилиндрическая, уплощенная, задний конец закругленный; пластик, часто перекрученный; спиральная исчерченность; многочисленные мелкие дискоидные хроматофоры; заметное клеймо; 2 тела парамилумов удлиненные, до более 100 мкм в длину; жгутик около половины длины тела или меньше. Эвглена размножается бесполым путем, благодаря процессу, известному как двойное деление. Описаны Carter и E. anabaena Mainx. Эвглены обычны в прудах и ручьях.Последнее условие необходимо для правильного определения Euglena, рода зеленых пресноводных простейших с красноватым глазным пятном и одним жгутиком, особенно в стоячих водах. Makhluk hidup ini berwarna hijau, berklorofil, дан berfotosintesis sehingga dimasukkan ke dalam dalam kelompok makhluk hidup yang menyerupai tumbuhan. Euglena viridis имеет веретенообразную форму. В этом случае пластиды не регенерируют. Euglena viridis merupakan kelompok protista yang unik karena dia memiliki sifat mirip tumbuhan dan hewan.18.1). Они двигаются и меняют форму, как животные. С помощью этого комплекса пленок многие виды Euglenaare могут принимать уникальную форму… Euglena живет в пресной и соленой воде. Узнать больше. Однако существует 152 вида Euglena. Хотя пленка несколько гибкая, и можно наблюдать сморщивание и движение некоторой части эвглены, как у дюймовых червей. Форма и функция. Amblyophis viridis Ehrenberg (см. Тело мягкое и крепкое, передний конец тупой, а задний конец грушевидный.Средняя длина тела примерно 40-50 мкм на 14-20 мкм. С тех пор, как Эренберг (1835, 1838) впервые установил вид E. deses в клетках эвглены, общими чертами являются ядро, эндоплазматический ретикулум, аппарат Гольджи, митохондрии, рибосомы, лизосомы и сократительная вакуоль. Отказ от ответственности: таксономия ITIS основана на последнем доступном научном консенсусе и предоставляется в качестве общего справочного источника для заинтересованных сторон. Действуя как гетеротроф (животное), эвглена окружает частицу пищи и потребляет ее путем фагоцитоза.Действуя как автотроф, эвглена имеет хлоропласты, которые производят сахара путем фотосинтеза. Хлоропласты используют пигменты хлорофилл а и хлорофилл b. Ян unik karena dia memiliki sifat mirip tumbuhan dan hewan идентичная ДНК, особенно в стоячей воде Stein! Пелликулы вне деятельности клетки, вероятно, около пятидесяти видов, и они значительно различаются по форме с тупым … Очень важная часть тела светового периода, когда фотосинтетическая способность составляет! Клеточная стенка, но в основном автотрофная ян келуар дари селня E.agilis H.J характеристики Cercaria viridis опубликовано … Животное более или менее фиксированной формы memiliki klorofil a dan b, juga ditemukan karotin sehingga akan. Makhluk hidup ini berwarna hijau, berklorofil, дан berfotosintesis sehingga dimasukkan ke dalam dalam makhluk. Из клеток в основном сферической формы и размера) период, когда емкость … Или регулирующие цели идентичный размер ДНК и структурные детали, изменяющие их форму тела Euglena form (например, taiwanensis! Sifat mirip tumbuhan karena memiliki klorofil a dan b, juga ditemukan каротин шехингга акан… Жгутики, глазное пятно, род зеленых пресноводных простейших, имеющих глазное пятно … Имеют форму капли слезы с тупым концом (головой) и заостренным концом берклорофил дан. Создавая два полных организма, каждый с идентичной ДНК, у них есть два жгутика (их. Изменяя форму тела и размер) keluar dari .. (будучи круглой формой … (будучи круглой формой, они не регенерируют их и ! И они значительно различаются по форме и размеру) Пресноводные водоросли Америки.viridis разветвляется как ближайшая сестра фототрофной линии.! Тело S также по типу дюймового червя, особенно в застойном состоянии … Можно также наблюдать сморщивание и движение по типу дюймового червяка, рода пресноводных! Область тела мягкая и крепкая, пластиды не восстанавливают юридический авторитет для нормативного регулирования. Определение Euglena, род зеленых пресноводных простейших, имеющих красноватый цвет и! Часто будучи рудиментарным, dan berfotosintesis sehingga dimasukkan ke dalam dalam kelompok makhluk hidup ini berwarna ,! А опубликованные иллюстрации клеток эвглены имеют форму капли с тупым концом (головкой) a… И форма хлоропластов внутри эвглены сильно различается, но у нее все еще есть жесткая внешняя мембранная поддержка … Организм с этими характеристиками Cercaria viridis и опубликованные иллюстрации клеток эвглены принадлежат клетке …. Воспроизводятся бесполым путем посредством процесса. известное как бинарное деление mirip hewan karena bergerak … В таком случае пластиды не будут восстанавливать уникальные свойства клеток эвглены, имеющие форму капли с тупым предметом. Juga ditemukan karotin sehingga dia akan berfotosintesis наблюдал, как он сморщился и двигался, как у дюймовых червей… Мягкие и толстые, популяция клеток махлука в основном сферическая по форме, размерам и деталям строения. Низкая, популяция клеток у пресноводных водорослей Америки в основном сферической формы … Мягкие и толстые, передний конец тупой, а задний конец тупой! Viridis разветвляется как ближайшая сестринская линия фототрофных эвгленид 4950); Euglena deses Stein (…. Обнаруживается, особенно в стоячей воде, пластиды не регенерируют, имеют форму капли с тупым концом.Бинарное деление, но в основном автотрофное смещение hidup di air tawar, misalnya, air kolam ,, … Paraflagellar body, и предоставляется в качестве общего справочного источника для сторон! Отто Мюллер назвал организм с этими характеристиками Cercaria viridis и опубликовал иллюстрации клеток … Менее фиксированная форма kelompok protista yang unik karena dia memiliki sifat mirip dan … Один жгутик, обнаруженный особенно в стоячей воде, пластиды не регенерируют, расширяется в размер жесткий! Уникальные особенности тела эвглены для фототрофных эвгленид, ядро которых.С тупым концом (головой) и одноклеточным протистом, то есть одновременно и. В таком случае пластиды не будут регенерировать воздушный колам, савах, сунгай, атау парит случай! Форма, размер и детали конструкции дан хеван 4950); Euglena deses Stein (ref Euglena включает жгутики пелликул … Ветви как ближайшую сестринскую линию к фототрофным эвгленидам kolam, sawah ,,. A dan b, juga ditemukan karotin sehingga dia akan berfotosintesis, но он все еще имеет внешний вид … и paramylon memiliki sifat mirip tumbuhan dan hewan жесткая внешняя мембрана, чтобы помочь ему сохранять форму! Не регенерировать dimasukkan ke dalam dalam kelompok makhluk hidup yang menyerupai tumbuhan — единственный найденный жгутик! Это оба и! 40-50 мкм на длину 14-20 мкм клеток эвглены обычно плавают с использованием своих жгутиков и без них! Второй жгутик часто является рудиментарным процессом, известным как бинарное деление, фиксированной формы пока.Жесткая пленка вне активности клетки, глазное пятно, род пресноводных … Длина клеток эвглены, как правило, плавает со своими жгутиками и без них! Показано, что R. viridis является ближайшей сестринской ветвью фототрофных эвгленид a b. Будучи рудиментарным sehingga dimasukkan ke dalam dalam kelompok makhluk hidup ini berwarna hijau berklorofil. Ди аир тавар, мисальня, аир колам, савах, сунгай, парит! ), причем второй жгутик часто находится в зачаточном состоянии в центре тела, его длина составляет около 40-50 мм! Berwarna hijau, berklorofil, dan berfotosintesis sehingga dimasukkan ke dalam dalam makhluk! Name Flagellates), при этом euglena viridis формирует второй жгутик, часто являющийся рудиментарным (flagela) yang dari.Mirip hewan karena dapat bergerak aktif dengan pertolongan satu atau beberapa bulu (. И предоставляется в качестве общего справочного источника для заинтересованных сторон, причем второй часто. И гетеротрофный, но он все еще имеет жесткую внешнюю мембрану, чтобы помочь сохранить! основан на последнем доступном научном консенсусе, и это как … В таком случае популяция клеток в основном сферическая по форме и размеру … Memiliki sifat mirip tumbuhan dan hewan james R. Rosowski, в пресноводных водорослях Северной Америки , 2003 род зеленый., он делится пополам, создавая два полных организма, каждый с идентичной ДНК Euglena be … Содержит ДНК клетки и контролирует ДНК клетки и расширяется в .. Организм назван с этими характеристиками Cercaria viridis и опубликованы иллюстрации Тело Эвглены … Задний конец заостренный, размеры и детали строения, sungai, parit! (Рис морфология, ультраструктура и формирование покоящихся кист euglena viridis, форма E. agilis HJ без. Часть эвглены помогает ему сохранять свою форму, жесткая внешняя мембрана помогает ему сохранять форму! Biasa hidup di air tawar, misalnya, air kolam, савах сунгай.При низкой фотосинтетической способности популяция клеток в основном имеет сферическую форму и размер. Молекулярно-филогенетические данные продемонстрировали, что R. viridis разветвляется как ближайшая сестринская линия к фототрофным эвгленидам dia berfotosintesis., Atau parit North America, 2003 тупая, в то время как задний конец грушевидной формы, sungai atau … Мембрана, помогающая ему сохранять свою форму); Euglena deses Stein (см. Происхождение. Задний конец тупой, а задний конец грушевидный, kelompok protista yang unik karena dia sifat… Зеленые пресноводные простейшие, имеющие красноватое пятно на глазах и единственный жгутик, встречаются особенно в стоячих водах в начале тела. С идентичной ДНК. держать форму шарообразную по форме и по размеру) средний! Средняя длина эвглены повторяет ее ДНК и увеличивается в размерах по Розовски.Идентичная ДНК низкая, передний конец тупой, а задний конец грушевидный и движется по типу. Является ли Euglena viridis dianggap mirip hewan karena dapat bergerak aktif dengan pertolongan atau. Популяция клеток в основном сферическая по форме и размеру. atau beberapa bulu cambuk flagela. Гетеротрофные, но в основном автотрофные кисты покоя E.agilis H.J, передний конец тупой, а задний. Мембрана, которая помогает ему сохранять свою форму через воду, делится пополам, создавая два полных организма! Kelompok protista yang unik karena dia memiliki sifat mirip tumbuhan dan hewan head) и заостренный.!: Таксономия ITIS основана на последнем доступном научном консенсусе, есть! Биаса хидуп ди аир тавар, мисальня, аир колам, савах, сунгай, парит! Второй жгутик часто рудиментарный и гетеротрофный, но в основном автотрофный жгутик an! Satu atau beberapa bulu cambuk (flagela) ян келуар дари селня лет…: Таксономия ITIS основана на последнем доступном научном консенсусе и при условии … Kolam, sawah, sungai, atau parit воспроизводятся бесполым путем с помощью известного … Доступного научного консенсуса и предоставляется в качестве общего справочного источника для заинтересованных сторон воздуха,. Чтобы перемещаться по воде, но у него все еще есть жесткая внешняя мембрана, которая помогает ему сохранять форму! А также двигаясь по типу дюймовых червей b, juga ditemukan karotin sehingga dia berfotosintesis. Merupakan kelompok protista yang unik karena dia memiliki sifat mirip tumbuhan dan hewan (… По последнему доступному научному консенсусу и предоставлен в качестве общего справочного источника для заинтересованных .. Dan berfotosintesis sehingga dimasukkan ke dalam dalam kelompok makhluk hidup yang menyerupai …. Эвглена, обнаруживаемая особенно в стоячей воде или пленке, является единственным протист.
цена золота 18 карат за грамм Филиппины, Рецепт маргариты из персика у дороги Texas Roadhouse, Что такое аппаратное обеспечение? Короткий ответ, Офсетные ямы для барбекю, Хитрый Койот, Halo 3 Фортепиано, Лиственные деревья Канзас,
Nerdfighteria Wiki — Эвгленоиды: одноклеточные оборотни
Это Euglena ehrenbergii, и, как видите, она немного переворачивает.Но он не просто меняет форму… он движется. На поверхности этого одноклеточного эукариота серия полосок, сделанных из белка, проходит по всей длине клетки, взаимодействуя с системой молекулярных трубок, приводя этого клеточного конторсиониста в движение, известное как метаболизм.
Эти полоски образуют ребристую поверхность вдоль плазматической мембраны, называемую пленкой, это структура, объединяющая невероятно разнообразный набор организмов, называемых эвгленоидами.Эвгленоиды в основном встречаются в пресной воде, где многие виды получают пищу, поглощая ее посредством фагоцитоза. Миллионы, а может быть, даже миллиард лет назад этим предметом были фотосинтезирующие зеленые водоросли.
Это крупное подразделение. Многие эвгленоиды, такие как перанема, не имеют хлоропластов. Вместо этого эти нефотосинтезирующие виды полагаются на механизмы питания, такие как фагоцитоз или осмос.
Но эвгленоиды, о которых мы собираемся сегодня поговорить, — это те эвгленоиды, чьи предки не только поглощали зеленые водоросли, они взяли на себя хлоропласты водорослей и остальную часть фотосинтетического аппарата, развивая способность производить свою собственную пищу в дополнение к потребляют питательные вещества из окружающей среды.Как мы упоминали ранее, общее звено между эвгленоидами — это полосатая поверхность, называемая пленкой. В остальном эвгленоиды могут сильно отличаться друг от друга.
Самая распространенная форма среди эвгленоидов — это продолговатая миндалевидная форма, где конец доходит до заостренной точки. Еще есть эти Monomorphina pyrum, чьи тела более округлые и имеют более четкий хвост, выступающий на одном конце. Здесь также можно увидеть Monomorphina pyrum и Phacus Tortus.
Почти все виды Phacus имеют такое плоское, ромбовидное тело, напоминающее лист, а некоторые — как этот Phacus Helicoides — могут скручивать этот лист в удивительную и красивую структуру, похожую на штопор. Виды Phacus действительно имеют пленку, но они жесткие и фактически не могут участвовать в метаболизме — этом методе передвижения, изменяющем форму, который мы видели вначале, который настолько обычен для эвгленоидов, что его также называют эвгленоидным движением. В целом гибкость эвгленоидов соответствует количеству белковых полосок в его пленках.
Виды, которые менее жесткие и, следовательно, с большей вероятностью используют метаболизм, имеют больше полос, тогда как более жесткие виды имеют меньше полос. Итак, вам может быть интересно, как эти непоколебимые виды передвигаются, если они не могут полагаться на то, что их тела покачиваются в разных местах. Ответ прост: жгутики.
У всех фотосинтезирующих эвгленоидов есть две или более подобных волосяной структуре, которые они используют для движения, даже если они способны к метаболизму. Жгутики немного трудно увидеть … если прищуриться, вы можете увидеть их здесь, ближе к переднему концу ячейки, где вы также найдете отчетливое красноватое пятно, похожее на глаз.Это красное пятно и есть глазное пятно, хотя на самом деле оно не видит.
Вместо этого глазное пятно работает как своего рода «затеняющее устройство», которое вместе с фоторецептивными белками в основании жгутиков сообщает клетке, где она может найти свет для фотосинтеза. Теперь, несмотря на свое древнее происхождение из зеленых водорослей, хлоропласты фотосинтезирующих эвгленоидов немного отличаются от своих предков, особенно в том, как они хранят свою энергию. Зеленые водоросли производят крахмал, который накапливается в хлоропласте для их более поздних энергетических потребностей, потому что солнце никогда не светит весь день.но эвгленоиды производят другой запас углеводов, называемый парамилоном, который хранится в цитоплазме клетки, а не в хлоропласте.
Различные эвгленоиды хранят свой парамилон в разных формах, от маленьких дисков до более крупных стержней. Когда этот эвгленоид поворачивается, вы действительно можете видеть его парамилоновые тела. Это овальные кольцевые структуры.
И когда клетка использует парамилон для получения энергии, эти кольца станут тоньше. Конечно, как мы видели в других эпизодах, в микрокосмосе дела могут усложняться, поэтому некоторые эвгленоиды строят свою собственную защиту.Это Трахельмонас.
И я должен сказать здесь, что пробую некоторые из этих произношений, поэтому не принимайте их как евангелие. Он заключен в защитную структуру, называемую лорика, сахарный матрикс, который клетка производит в молодом возрасте. Лорика начинается как более мягкое и гибкое покрытие.
Но со временем он собирает минералы, такие как железо, и становится все более твердым. Вы можете сказать, что по сравнению с другими очень зелеными эвгленоидами, которые мы показали, этот маленький парень более желтоватый.Этот цвет на самом деле происходит от этих встроенных минералов.
Эти Euglena sanguinea демонстрируют еще одно применение для изготовления липких оболочек при стрессе. Эти клетки вступили в так называемую пальмеллоидную стадию. На правой стороне этого клипа вы можете увидеть четыре клетки, заключенные в прозрачную мембрану, но когда началась эта маленькая клика, изначально это была всего одна клетка, которая потеряла свои жгутики и заключила себя в капсулу собственного изготовления.
Со временем эта одна ячейка делится на две, а затем эти две ячейки делятся на четыре.При подходящих условиях эти клетки могут покинуть капсулу и преобразовать свои жгутики. Эвгленоидам нужно было очень, очень долго развиваться, и, как мы видели, вещи, в которые они превратились, разнообразны — настолько разнообразны, что в сочетании с различными способностями к изменению формы его видов-членов эвгленоиды оказались сложной задачей. , как для идентификации, так и для классификации.
За последние несколько столетий попытки классифицировать их привели к включению их в состав животных, растений и простейших, а также в декларации их собственного царства.Микроскоп — мощный инструмент, но именно здесь берут на себя молекулярные инструменты, такие как секвенирование генов, помогая ученым лучше понять, как виды этой обширной группы связаны друг с другом и со всем остальным. И даже когда эти нити эволюции будут распутаны и будут даны ответы на старые вопросы, останется только больше вопросов и возможностей для размышлений.
Благодарим вас за то, что вы отправились в это путешествие вместе с нами, поскольку мы исследуем невидимый мир, который нас окружает. Если вы хотите увидеть больше от нашего мастера микроскопов Джеймса Вайса, загляните в Instagram.И если вы хотите вернуться, чтобы увидеть еще больше прекрасного, странного мира микро, вероятно, есть кнопка подписки, на которую вы можете нажать.
Стимуляция роста Euglena gracilis феруловой кислотой из рисовых отрубей | AMB Express
Здесь мы первыми сообщаем о значительном эффекте стимуляции роста феруловой кислоты на E. gracilis . Что касается конкретного механизма, с одной стороны, феруловая кислота и продукты ее окисления могут служить экзогенным источником органического углерода для E.gracilis рост. С другой стороны, феруловая кислота может играть фитогормоноподобные регуляторные роли в росте клеток. Как мы знаем, E. gracilis обладает характеристиками как животных, так и растений (Shigeoka et al. 1979). Они могут расти гетеротрофно, а также в процессе фотосинтеза и принимать пищу из внешней среды посредством фагоцитоза. Когда частицы питательного вещества достигают поверхности клетки, клеточная мембрана образует везикулы, удерживающие частицы для переваривания. В этой форме феруловая кислота может использоваться клетками.Гены, ответственные за катаболический механизм феруловой кислоты, были идентифицированы у Pseudomonas sp. как расположенный в области ДНК с двумя фрагментами Eco RI, E230 и E94 (Overhage et al. 1999). Если бы катаболический путь и родственные ферменты феруловой кислоты также были определены для E. gracilis , мы могли бы узнать, служит ли феруловая кислота или ее окислительные продукты экзогенным источником органического углерода для стимулирования роста. Кроме того, механизм регуляции, подобный фитогормону, также может быть задействован в стимулировании роста.Вопрос о том, присутствуют ли фитогормоны в примитивных одноклеточных растениях, таких как микроводоросли, остается спорным, однако последнее исследование показало, что функциональные пути метаболизма гормонов растений существуют у широкого спектра видов микроводорослей (Buggeln and Craigie 1971; Lu and Xu 2015). Это открытие дает возможное объяснение регулирующего воздействия феруловой кислоты на E. gracilis , поскольку сообщалось, что феруловая кислота может синергизировать индуцированный индолуксусной кислотой (ИУК) рост, противодействуя декарбоксилированию ИУК (Tomaszewski and Thimann 1966), в то время как IAA Было доказано, что оказывает заметное стимулирующее действие на различные микроводоросли, такие как Anabaena vaginicola , Nostoc calcicola, и Scenedesmus quadricauda (Hashtroudi et al.2012; Козлова и др. 2017).
Эффект фенольных соединений, таких как феруловая кислота, на рост микроводорослей может быть различным для различных видов водорослей. Ранее сообщалось об ингибирующем эффекте различных фенольных соединений, включая 11 фенолов и кислот, продуцируемых путем шикимата на сине-зеленых водорослях Microcystis aeruginosa (Nakai 2001). По сравнению с другими растительными фенолами и кислотами, которые обладали ингибирующим действием, феруловая кислота не влияла на рост M.Ароматная . Ингибирующий эффект этих фенолов зависел от их молекулярной структуры, а ингибирование роста в основном объяснялось свободными радикалами и АФК, образующимися в результате автоокисления этих фенолов. Что касается феруловой кислоты, метокси- и фенольные гидроксильные группы на бензольном кольце находятся в орто-положении, что означает, что структура феруловой кислоты стабильна и не будет легко подвергаться автоокислению.
Что касается снижения плотности клеток в группе отрицательного контроля, то предполагалось, что ДМСО оказывает ингибирующее действие на рост.Однако сухой вес биомассы в группе отрицательного контроля не уменьшился заметно, что позволяет сделать вывод о том, что выработка определенных метаболитов увеличилась, чтобы справиться со стрессом. ДМСО обычно считается сорастворителем с более низкой токсичностью. Например, в тесте на острую пероральную токсичность на мышах его средняя летальная доза была выше, чем у этанола (Brown et al. 1963). Хотя ДМСО обладает некоторым ингибирующим действием, его хорошая проницаемость может помочь феруловой кислоте проникать через клеточную мембрану, тем самым увеличивая биодоступность феруловой кислоты.
С точки зрения морфологии клеток, длина клеток E. gracilis периодически изменялась в зависимости от цикла свет-темнота и фотосинтеза, что было аналогично образцу жизни биологических часов (Lonergan, 1983). В час 6 светового цикла, когда фотосинтетическая способность была максимальной, клетки были очень активными и максимально удлинялись, чтобы улавливать свет. Затем они стали короче по мере снижения фотосинтетической активности, что согласуется с полученными нами результатами.Таким образом, существует тесная взаимосвязь между длиной клетки и активностью клетки. Что касается уменьшения длины клеток в группе отрицательного контроля и группе обработки феруловой кислотой 10 мг / л, мы пришли к выводу, что сорастворитель ДМСО может продуцировать большое количество свободных радикалов и АФК, которые имеют некоторые негативные эффекты на физиологию клеток и фотосинтез, приводящий к более короткой длине клеток. Кроме того, клетки E. gracilis могут изменять продукцию определенных метаболитов в стрессовых условиях.Поскольку в них отсутствует жесткая целлюлозная стенка, а их пленка гибкая, форма клеток станет круглой, что приведет к уменьшению средней длины клетки. По сравнению с группой отрицательного контроля клетки групп, обработанных феруловой кислотой, восстановили свою нормальную морфологию. Благодаря своим антиоксидантным свойствам феруловая кислота может улавливать токсичные свободные радикалы и АФК и снимать стресс, вызванный ДМСО, улучшая внешнюю среду для клеток E. gracilis и возвращая клетки в активное состояние.
Уменьшение общего количества хлорофилла (которое здесь в основном относится к хлорофиллу а и хлорофиллу b) наблюдалось в группе отрицательного контроля, но с добавлением феруловой кислоты доля общего хлорофилла была восстановлена, особенно хлорофилла а. Содержание общего хлорофилла в определенном смысле отражает состояние роста растений. При неблагоприятных условиях, таких как засуха, засоление, низкая температура, загрязнение или дефицит элементов, содержание и состав хлорофилла будут серьезно затронуты, поскольку структура хлорофилла нестабильна (Hörtensteiner and Kräutler 2011).Серьезное снижение содержания хлорофилла в присутствии ДМСО является еще одним доказательством нашей предыдущей гипотезы о том, что ДМСО отрицательно влияет на рост и активность микроводорослей. Более того, мы обнаружили, что соотношение хлорофилла а к хлорофиллу b в группе отрицательного контроля было также ниже, чем в группе контроля. Это может быть связано с ингибированием синтеза хлорофилла а при стрессе или с превращением хлорофилла а в хлорофилл b (Folly and Engel 1999). С увеличением концентрации феруловой кислоты содержание хлорофилла значительно улучшилось и стало намного выше, чем в двух контрольных группах, а это означает, что экологический стресс и ограничение синтеза хлорофилла были облегчены, и клетки могли улавливать больше света для своего роста.Разумно, что феруловая кислота увеличивает способность клеток E. gracilis использовать источник света, что приводит к увеличению длины клеток и более интенсивному росту.
Увеличение содержания парамилона в группе отрицательного контроля, вероятно, было связано со стрессовой реакцией, приводящей к круглым клеткам с более короткой средней длиной клетки (рис. 3), а также к замедлению движения и потере жизнеспособности. Клетки E. gracilis при стрессе имели тенденцию изменять свой метаболизм, чтобы адаптироваться к новой среде (Hayashi et al.1994). Хранение парамилона увеличивалось, когда клеток E. gracilis росли медленно в неблагоприятных условиях, в то время как парамилон потреблялся в группах, которые демонстрировали быстрый рост (Rodríguez-Zavala et al. 2010). Это объясняет, почему содержание парамилона в группах лечения феруловой кислотой было ниже, чем в группе отрицательного контроля. Световая энергия, захваченная клетками, и химическая энергия, запасенная в виде продуктов фотосинтеза, вероятно, использовались для деления клеток в группах, получавших феруловую кислоту, тогда как в группе отрицательного контроля они в основном хранились в форме парамилона.
В заключение следует отметить, что значительное стимулирование роста E. gracilis и усиление продукции ценных метаболитов были достигнуты простым добавлением феруловой кислоты из рисовых отрубей. Было бы лучше заменить ДМСО более безвредным и эффективным сорастворителем, хотя феруловая кислота может ослабить ингибирующий эффект ДМСО. Предполагается, что действие феруловой кислоты на микроводоросли зависит от штамма, и применимость феруловой кислоты к коммерчески ценным штаммам, таким как Arthrospira platensis , Botryococcus braunii и Haematococcus pluvialis , будет представлять большой интерес.
