МЕДИЦИНСКАЯ ПАРАЗИТОЛОГИЯ
14
1. ОСНОВЫ МЕДИЦИНСКОЙ ПРОТОЗООЛОГИИ
РАБОТА 2
ПРОСТЕЙШИЕ – ПАРАЗИТЫ ЧЕЛОВЕКА И ЖИВОТНЫХ
Цели занятия:
1. Ознакомиться с характерными признаками класса жгутиковых,
сарко-довых, инфузорий, споровиков, паразитирующих у человека.
2. По микропрепаратам изучить морфологию лямблий, лейшманий,
трипаносом, трихомонад, балантидия, дизентерийной амебы, токсоплазмы
и малярийных плазмодиев.
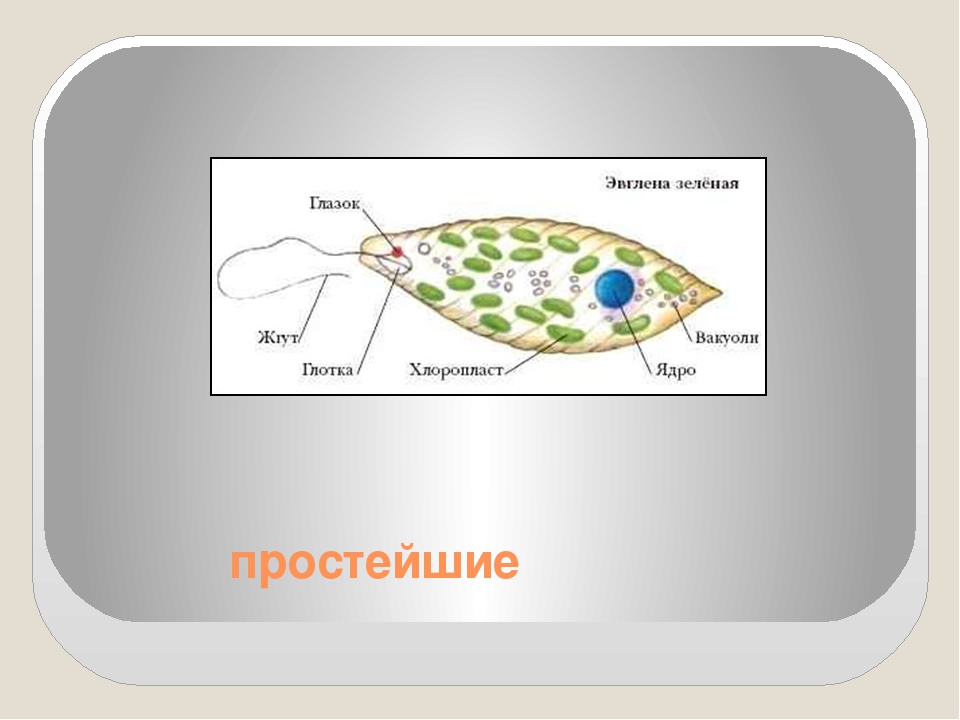
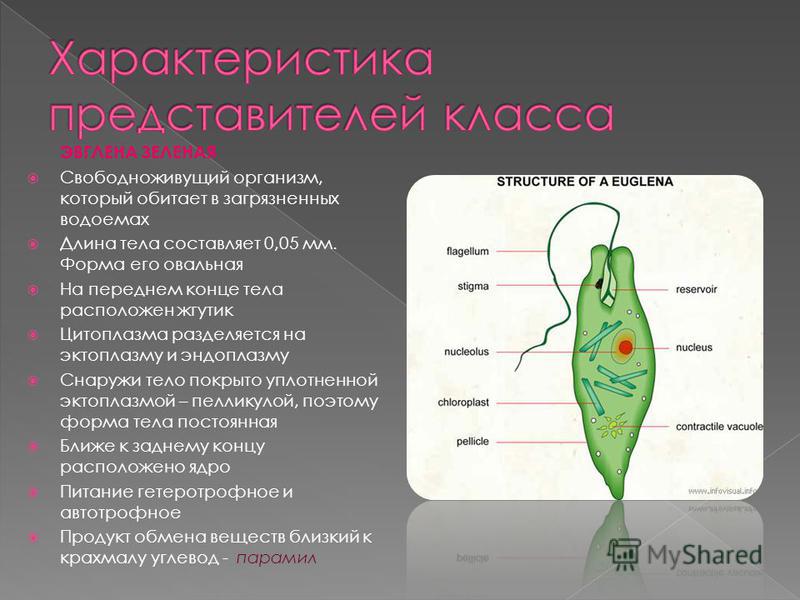
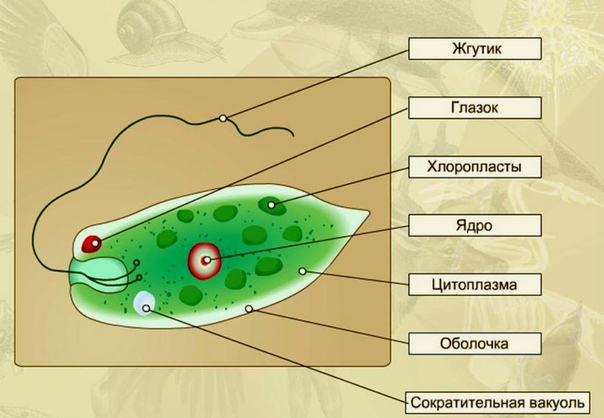
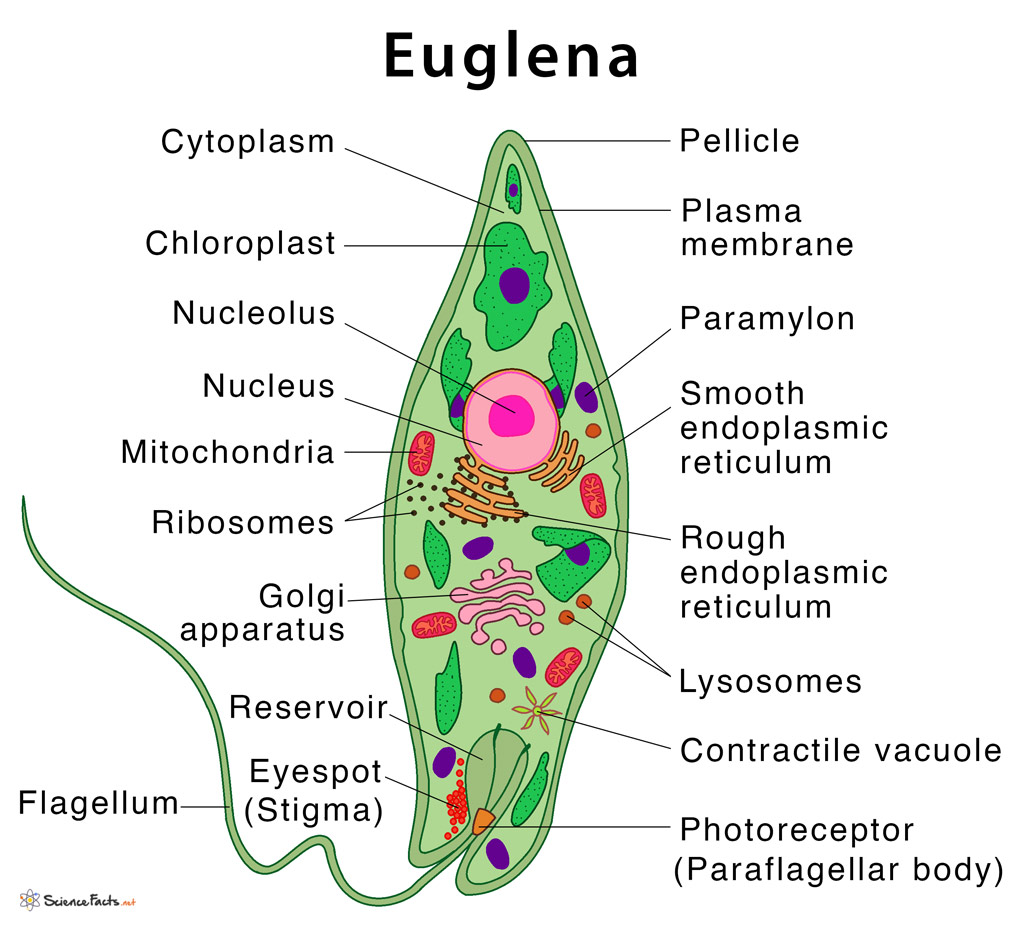
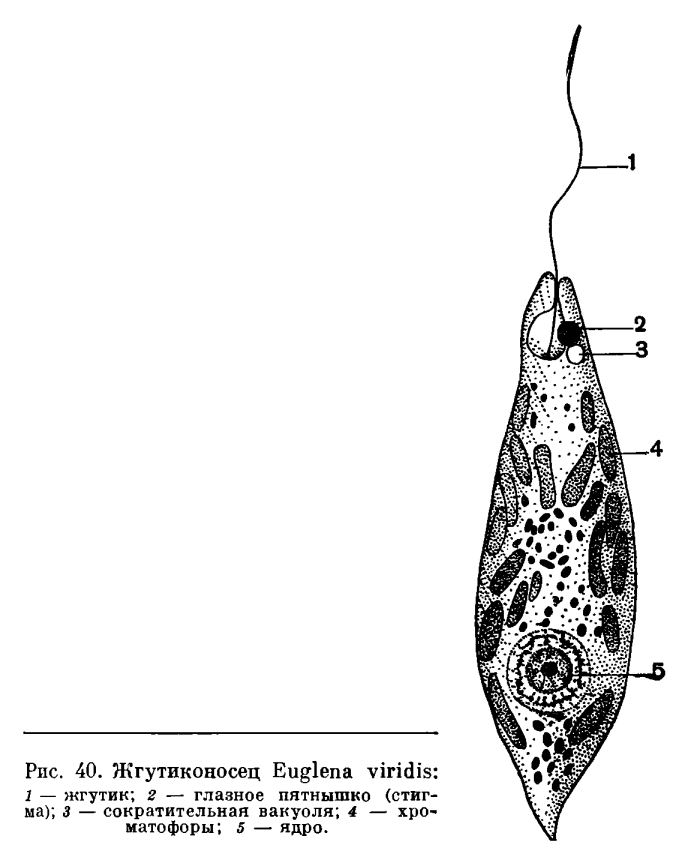
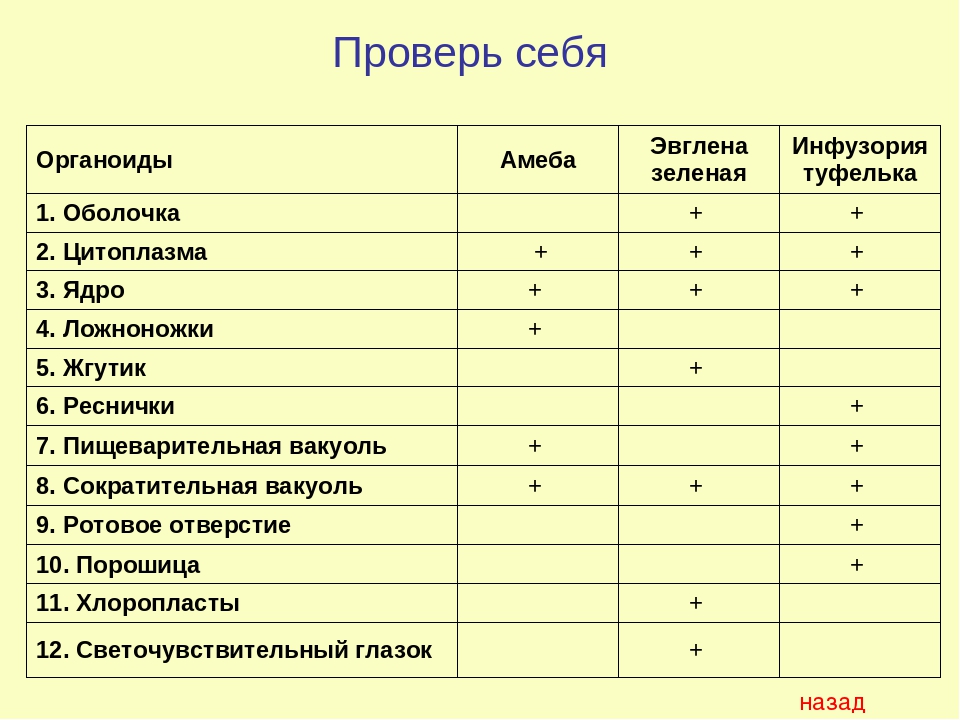
2.1. Краткая характеристика подцарства Protozoa — простейшие
К простейшим относятся организмы, тело которых состоит из одной
клетки. Помимо органоидов общего значения, присущих всем эукариотам,
они имеют органоиды специального значения, выполняющие функции це-
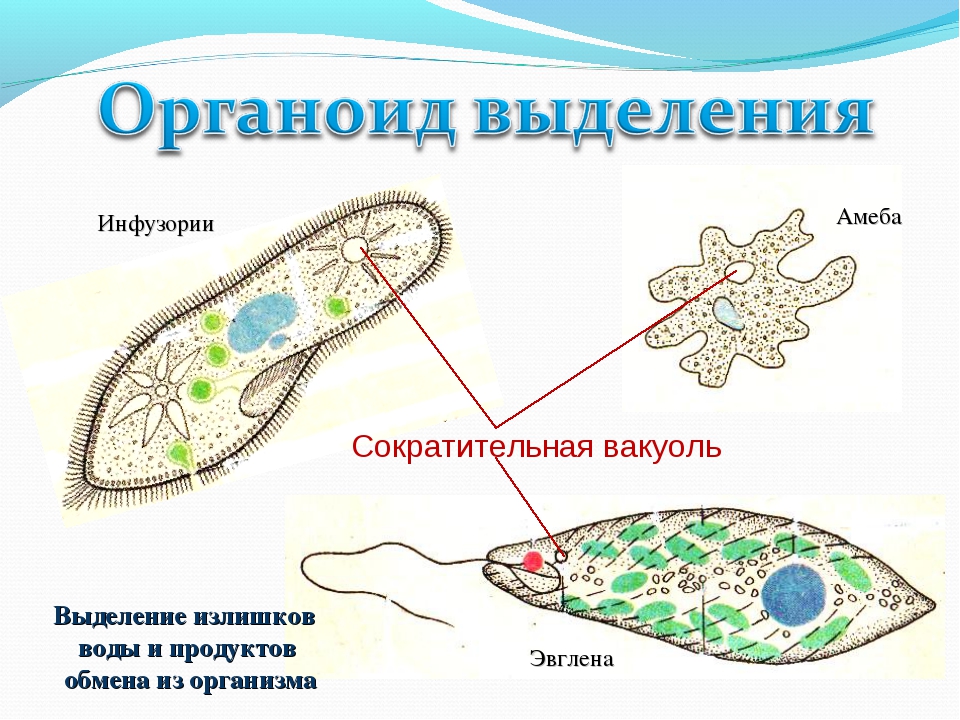
лых органов: сократительные и пищеварительные вакуоли (саркодовые,
жгутиковые, инфузории), цитостом, цитофаринкс (инфузории), светочув-
ствительные глазки (эвглены), а также органоиды движения (псевдоподии
– саркодовые, жгутики – жгутиковые, реснички – инфузории).
Размножение у простейших бесполое – путем бинарного деления
(саркодовые, жгутиковые, инфузории) или множественного деления (ши-
зогония) и внутреннего почкования (споровики) и половое – копуляция
(жгутиковые), конъюгация (инфузории), гаметогония (споровики).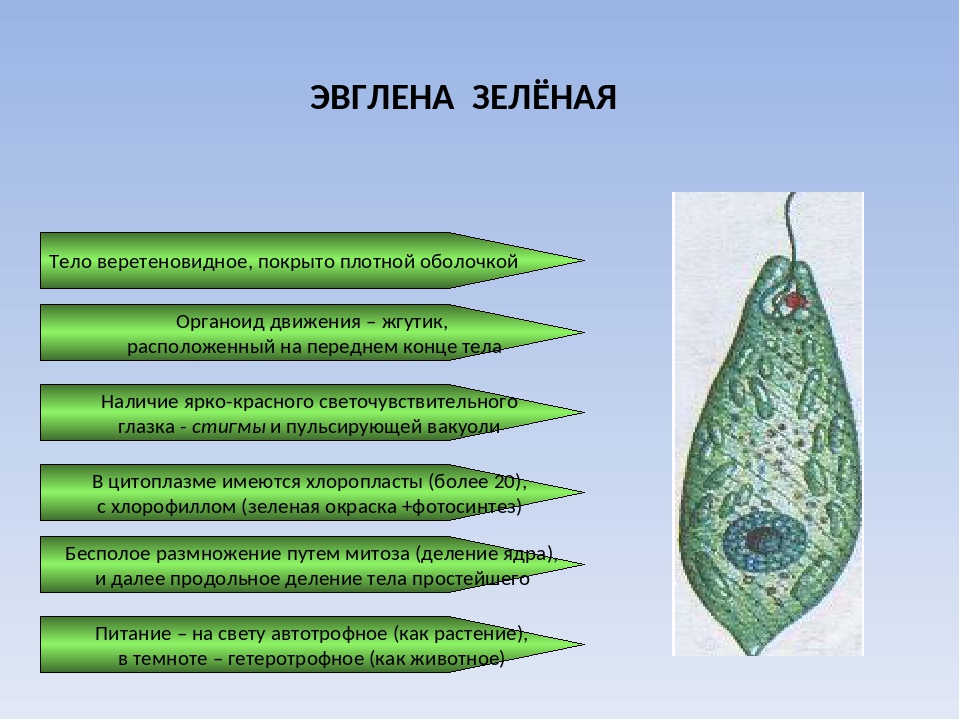
Характерной чертой большинства простейших является прохожде-
ние сложных циклов развития. В неблагоприятных условиях многие про-
стейшие образуют цисту, в состоянии которой легко расселяются.
Известно 65 тысяч видов простейших, из них несколько десятков
видов паразитируют в организме человека. Простейшие проникают в са-
мые различные органы и ткани человека, и именно поэтому болезни, вы-
зываемые ими, так многообразны по клинической картине и требуют тща-
тельной лабораторной диагностики. У человека паразитируют представи-
тели следующих классов:
Саркодовые
(Sarcodina),
Жгутиковые
(Masti-
gophora),
Инфузории
(Ciliata),
Споровики
(Sporozoa).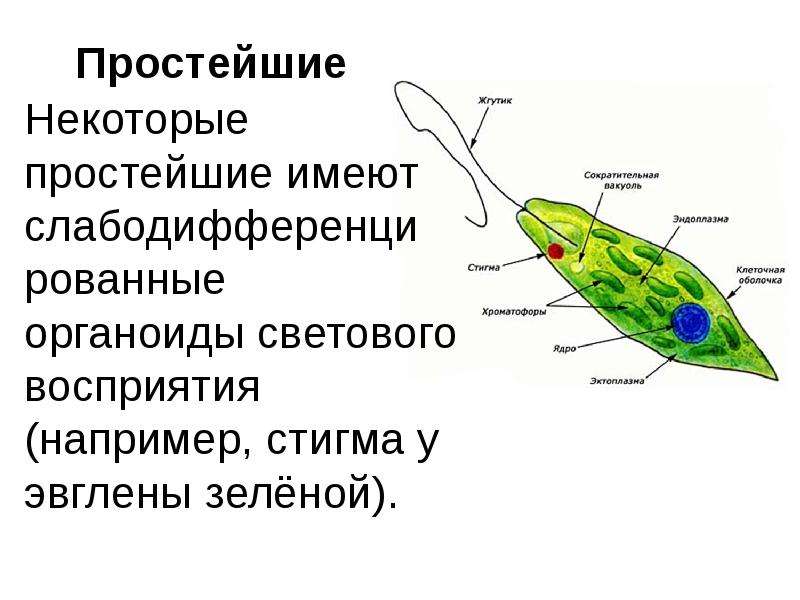
Среди представи-
телей подцарства Простейшие, помимо возбудителей заболеваний, у чело-
века встречаются также комменсалы (ротовая амеба) и условно патоген-
ные формы (лямблия).
1. Сравнительная характеристика клеток представителей различных царств
На Земле обитает огромное количество видов живых организмов, отличающихся по внешним признакам и по особенностям жизнедеятельности.
О единстве всех видов свидетельствует сходство строения и функционирования их клеток: все клетки похожи по химическому составу; имеется наследственный материал, цитоплазма с органоидами и плазматическая мембрана; во всех клетках сходные механизмы обмена веществ, размножения и т. д. Но есть и отличия, связанные с особенностями жизнедеятельности организмов разных царств.
Клетки растений
В растительных клетках:
- имеются пластиды;
- оболочка состоит из плазматической мембраны и клеточной стенки;
- содержатся крупные вакуоли, заполненные клеточным соком;
- запасное вещество — крахмал.
Рис. \(1\). Строение растительной клетки
Вакуоль — одномембранный органоид, выполняющий различные функции (секреция, экскреция и хранение запасных веществ, аутофагия, автолиз и др.). Оболочка этой вакуоли называется тонопласт, а её содержимое — клеточный сок.
Рис. \(2\). Вакуоль
Пластиды имеют некоторое сходство с митохондриями: они двумембранные, содержат кольцевые молекулы ДНК и рибосомы, способны самостоятельно делиться
Существует три группы пластид: лейкопласты (бесцветные), хлоропласты (зелёные)и хромопласты (оранжевые, красные, жёлтые).
Лейкопласты располагаются в тех частях растения, которые не освещаются солнечным светом, и выполняют запасающую роль. В них накапливаются питательные вещества. Под действием света в лейкопластах может образуется хлорофилл и они превращаются в хлоропласты. Это можно наблюдать в клубнях картофеля, если подержать их некоторое время в освещённом месте. Клубни начинают зеленеть.
Хлоропласты — зелёные пластиды, которые встречаются в клетках фотосинтезирующих эукариот (растений). В одной зелёной клетке находится несколько десятков хлоропластов. Хлоропласты содержат хлорофилл, и в них происходит процесс фотосинтеза, сущность которого заключается в превращении солнечной энергии во внутреннюю энергию химических связей органических веществ.
Под наружной гладкой мембраной хлоропласта находится складчатая внутренняя мембрана. Складки внутренней мембраны образуют стопки (граны) плоских мембранных мешочков (тилакоидов).
Рис. \(3\). Хлоропласт
Хромопласты — это жёлтые, красные или оранжевые пластиды, придающие окраску пожелтевшим листьям, лепесткам цветков, оболочкам плодов. Яркий цвет лепестков привлекает насекомых-опылителей, а окраска плодов — животных, распространяющих семена.
Хромопласты образуются из хлоропластов, когда происходит разрушение хлорофилла.
Клетки животных
В животных клетках:
- отсутствует клеточная стенка;
- имеется клеточный центр, образованный двумя центриолями;
- есть
- запасное вещество — гликоген;
- могут быть органоиды движения.
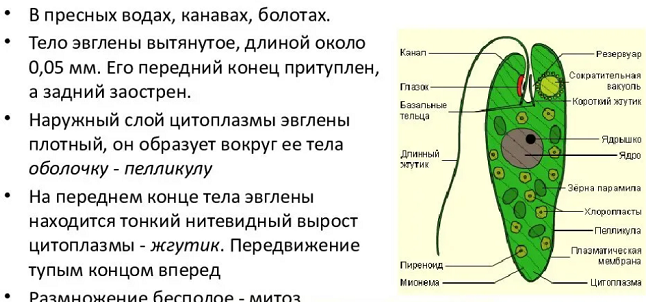
Рис. \(5\). Животная клетка
Животные клетки окружены только плазматической мембраной, плотная клеточная стенка отсутствует. Снаружи их плазматической мембраны расположен гликокаликс.
Гликокаликс — надмембранный комплекс, принимающий участие в образовании контактов между клетками.
Рис. \(4\). Мембрана животной клетки
Также в клетках животных нет крупных вакуолей, но в них есть центриоли (в клеточном центре) и лизосомы.
Клеточный центр — немембранный органоид, состоящий из двух центриолей. Каждая центриоль
представляет собой полую цилиндрическую систему, образованную \(9\) триплетами микротрубочек.
Клеточный центр принимает участие в делении клетки. В начале процесса центриоли передвигаются к полюсам клетки и между ними формируются нити веретена деления.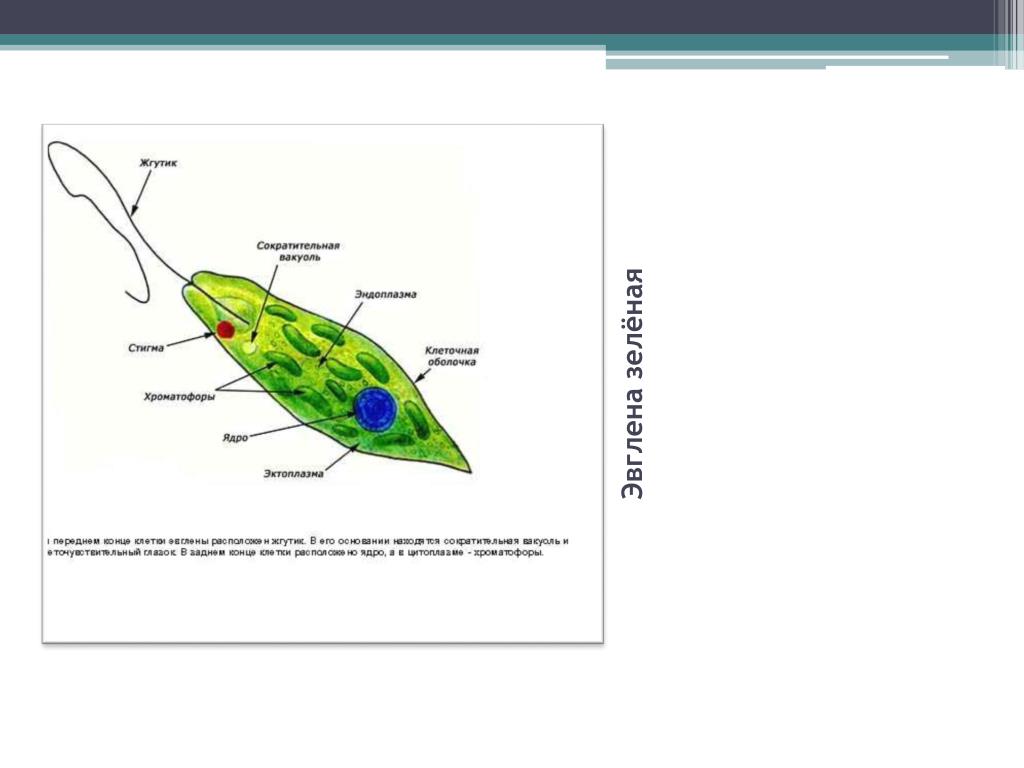 Клеточный центр участвует также в образовании цитоскелета, придающего клетке форму и направляющего движение органоидов по цитоплазме.
Клеточный центр участвует также в образовании цитоскелета, придающего клетке форму и направляющего движение органоидов по цитоплазме.
Лизосомы — это одномембранные органоиды, заполненные гидролитическими ферментами. Функция лизосом — переваривание поступивших в клетку пищевых частиц, расщепление сложных органических соединений до простых. Лизосомы уничтожают также не нужные клетке органоиды и вещества. Иногда лизосомы разрушают и саму клетку, в которой образовались.
Пример:
так, лизосомы постепенно переваривают все клетки хвоста головастика при его превращении в лягушку. Таким образом, питательные вещества не теряются, а расходуются на формирование новых органов у лягушки.
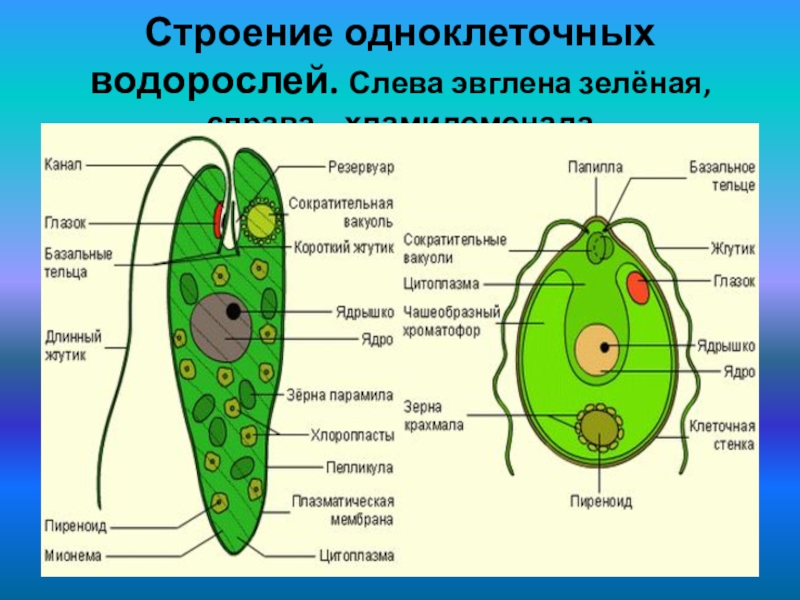
Многие животные клетки способны к движению, например инфузория туфелька, эвглена зелёная, сперматозоиды многоклеточных животных. Для передвижения существуют особые органоиды — реснички и жгутики, состоящие из таких же микротрубочек, что и центриоли. Основания органоидов движения закреплены в цитоплазме базальными тельцами. Движение жгутиков и ресничек обусловлено скольжением микротрубочек друг относительно друга. Работа жгутиков и ресничек требует затрат АТФ.
Основания органоидов движения закреплены в цитоплазме базальными тельцами. Движение жгутиков и ресничек обусловлено скольжением микротрубочек друг относительно друга. Работа жгутиков и ресничек требует затрат АТФ.
Клетки грибов
В грибных клетках:
- имеется клеточная стенка, состоящая в основном из хитина;
- запасным веществом является гликоген.
Рис. \(6\). Грибная клетка
Пластид и хлорофилла клетки грибов не содержат, а крупные вакуоли в них формируются в процессе старения клеток.
Органоиды | Растения | Грибы | Животные |
Пластиды | есть | нет | нет |
Вакуоль | крупная центральная вакуоль | центральная вакуоль | нет крупных вакуолей |
Наличие клеточной стенки | из целлюлозы | из хитина | нет |
Наличие центриолей | есть у низших | не у всех | есть у всех |
Запасное вещество | крахмал | гликоген | гликоген |
Источники:
Рис.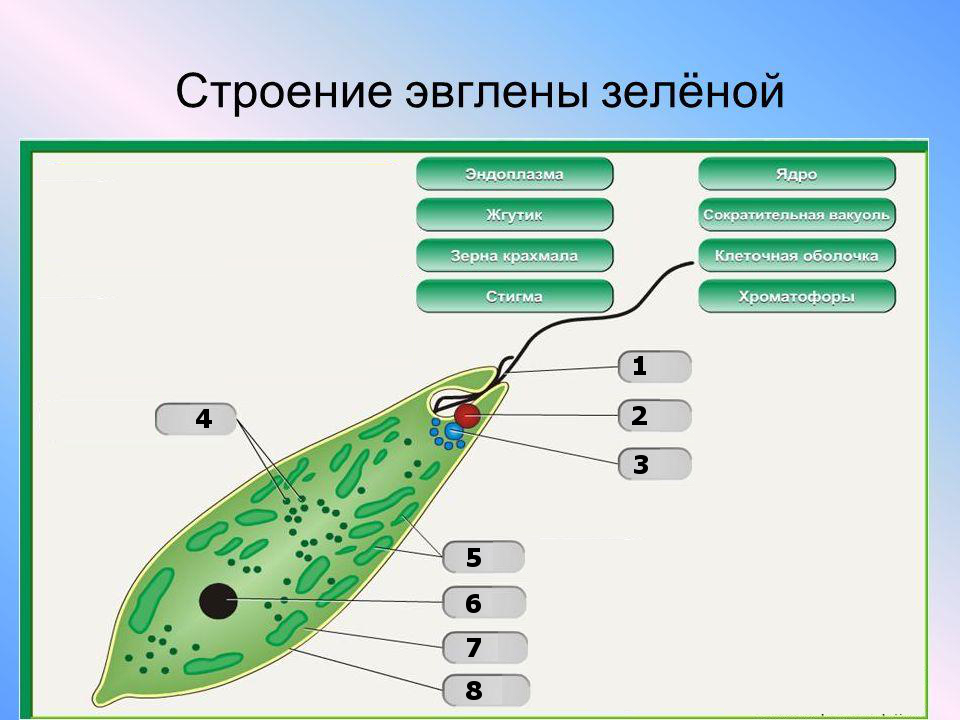 1. Строение растительной клетки https://image.shutterstock.com/image-vector/vector-plant-cell-anatomy-diagram-600w-543156751.jpg
1. Строение растительной клетки https://image.shutterstock.com/image-vector/vector-plant-cell-anatomy-diagram-600w-543156751.jpg
Рис. 2. Вакуоль © ЯКласс
Рис. 3. Хлоропласт https://www.shutterstock.com/ru/image-vector/structure-typical-higherplant-chloroplast-diagram-749518939
Рис. 4. Мембрана животной клетки https://shutterstock.puzzlepix.hu/kep/376416385
Рис. 5. Животная клетка © ЯКласс
Рис. 6. Грибная клетка https://image.shutterstock.com/image-vector/cross-section-fungal-hyphae-cells-600w-1220244697.jpg
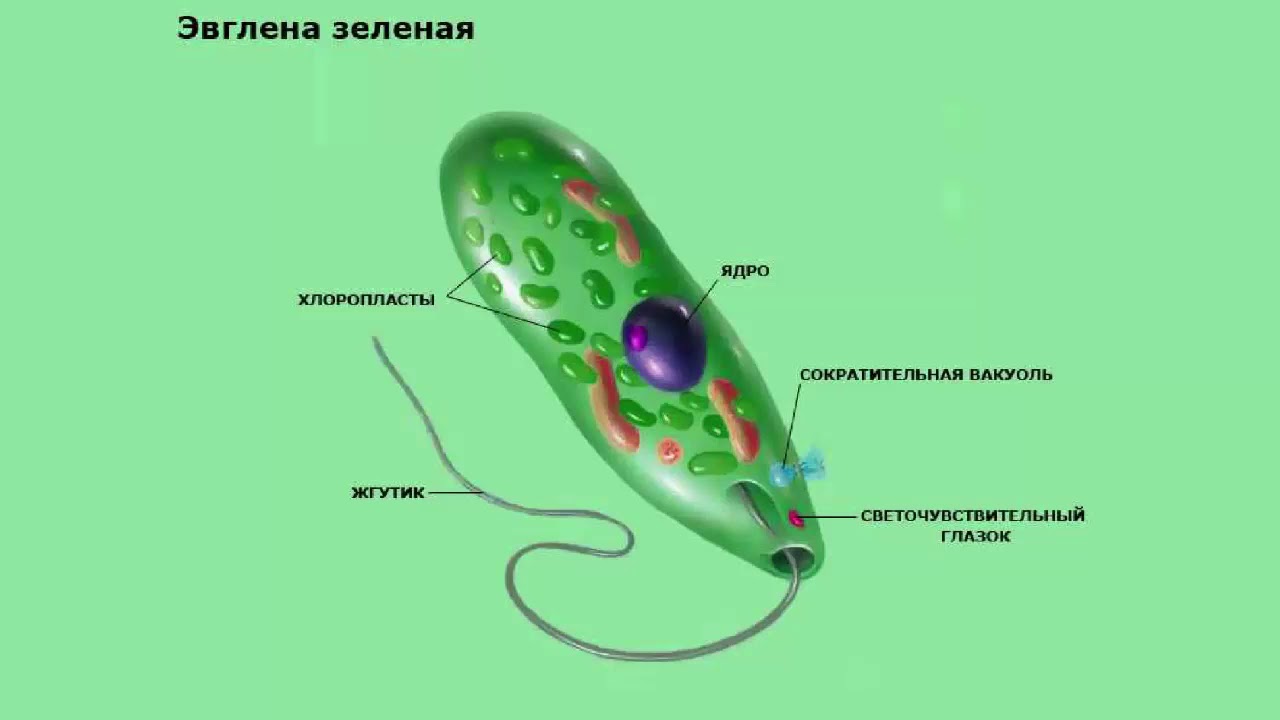
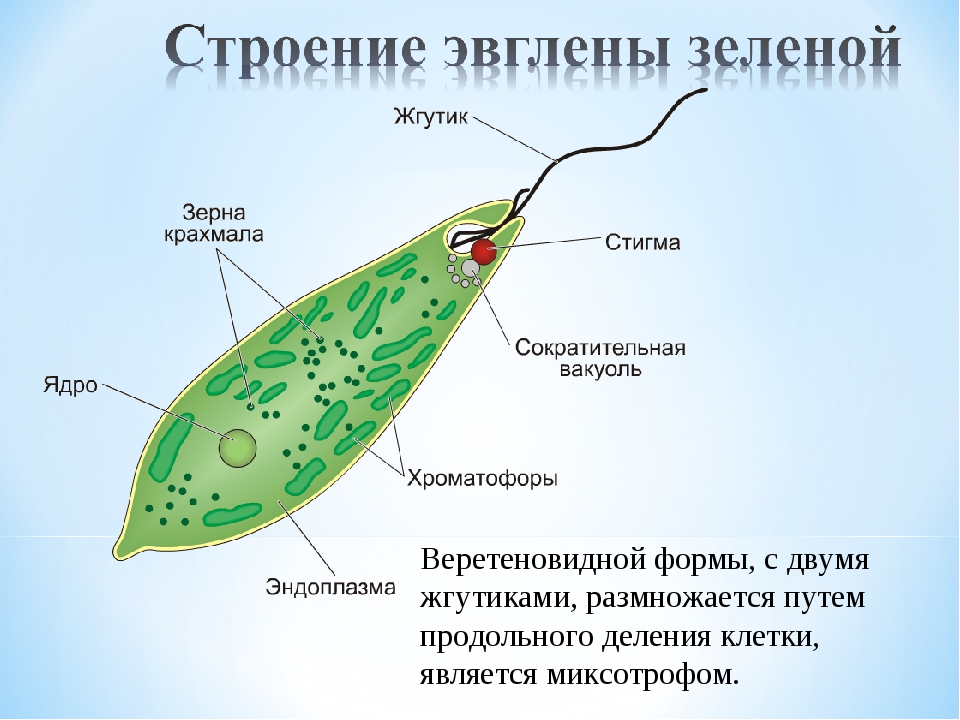
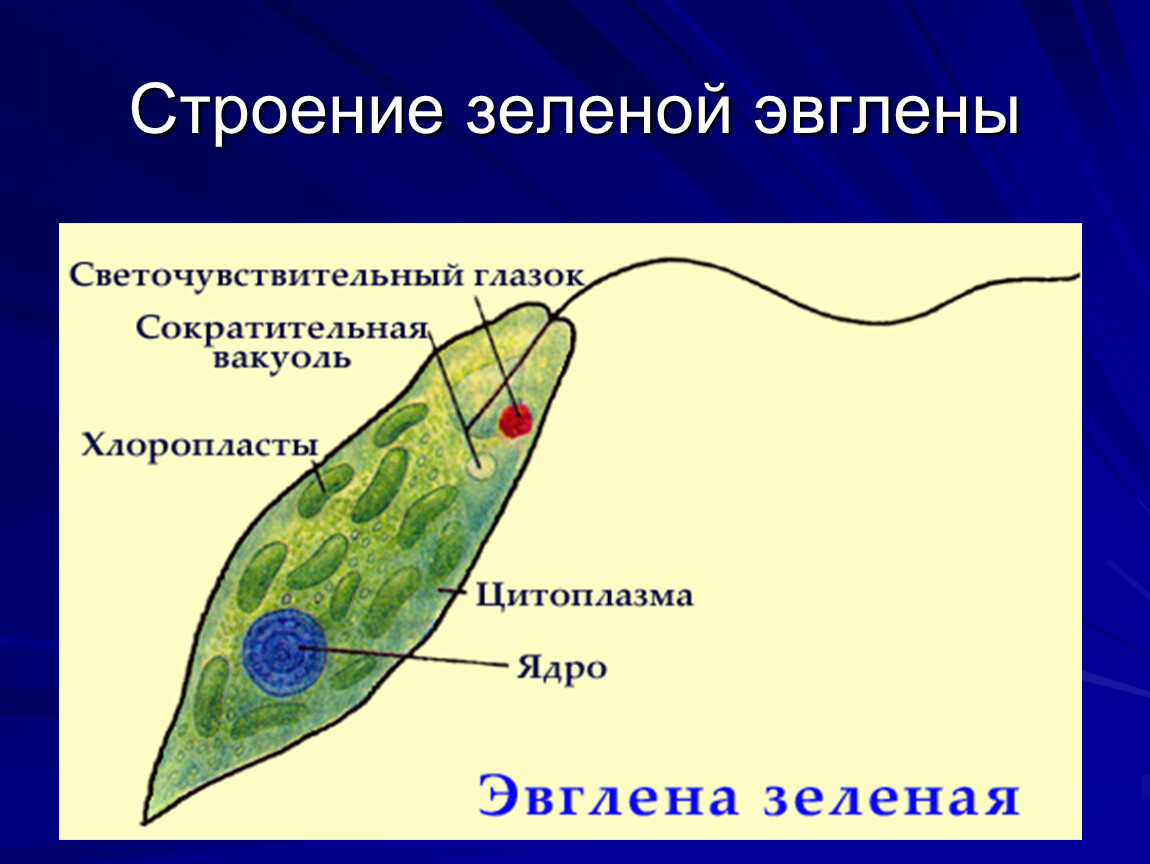
Как называется органоид эвглены зеленой, реагирующий на свет? — сократительная вакуоль
Как называется органоид эвглены зеленой, реагирующий на свет?— сократительная вакуоль
(*ответ*) стигма
— хроматофор
— ядро
Укажите органоиды клетки эвглены зеленой, расположенные у основания жгутика.
— хроматофор, сократительная вакуоль
(*ответ*) светочувствительный глазок, сократительная вакуоль
— ядро, хроматофор
— светочувствительный глазок, ядро
Продукты жизнедеятельности инфузории туфельки поступают в сократительные вакуоли…
— с током цитоплазмы
— с помощью ресничек
(*ответ*) по приводящим канальцам
— через порошицу
У какого представителя простейших одноклеточных животных в клетке имеется два ядра?
— эвглена зеленая
— амёба обыкновенная
— вольвокс
(*ответ*) инфузория туфелька
Что является пищей для инфузории туфельки?
— водоросли
— минеральными веществами, растворенными в воде
— планктон
(*ответ*) бактерии
Какие процессы у инфузории туфельки контролируются макронуклеусом?
— питание, половое размножение
(*ответ*) питание, движение, выделение
— половое и бесполое размножение
— движение, раздражимость
Для какого представителя простейших животных характерно наличие ресничек?
— амёба обыкновенная
(*ответ*) инфузория туфелька
— эвглена зеленая
— фораминифера
Какой представитель типа простейших животных имеет ротовое отверстие?
— эвглена зеленая
— малярийный паразит
— амёба
(*ответ*) инфузория туфелька
В каком возрасте начинают размножаться молодые инфузории при благоприятных условиях?
(*ответ*) в возрасте 2-х дней
— в 2-х недельном возрасте
— в возрасте 5-ти дней
— через полгода
Продукты обмена у инфузории туфельки удаляются посредством…
— поверхности тела
(*ответ*) сократительных вакуолей
— ресничек
— органов выделения
Укажите временной интервал, через который осуществляется сокращение сократительных вакуолей?
(*ответ*) 20-25 сек
— 1 час
— 1-2 сек
— 25-30 сек
Где у инфузории туфельки располагаются чувствительные палочковидные тельца?
— в микронуклеусе
— в сократительных вакуолях
— в макронуклеусе
(*ответ*) под оболочкой клетки
Что обеспечивает половой процесс у инфузории туфельки?
— раздражимость
— дыхание
— питание
(*ответ*) обмен наследственной информацией
Ответов: 1 | Категория вопроса: Подготовка к ЕГЭ
Трехмерная реконструкция органоидов Euglena gracilis Z.
 II. Качественные и количественные изменения хлоропластов и митохондриального ретикулума в синхронных культурах при обесцвечивании | Журнал клеточной науки
II. Качественные и количественные изменения хлоропластов и митохондриального ретикулума в синхронных культурах при обесцвечивании | Журнал клеточной науки С помощью ультратонких серийных срезов у Euglena gracilis Z при отбеливании в темноте с добавлением ацетата натрия в культуральную среду наблюдались морфологические и объемные изменения пластидома и хондриома.Чтобы не вносить никаких изменений в картину синхронизации при обесцвечивании, зеленые клетки предварительно выращивали фотоавтотрофно на среде Крамера и Майерса при непрерывном освещении и синхронизировали циклами температуры и (2) ацетата натрия и темноты на пластидоме и хондриоме фотоавтотрофных клеток. синхронизированы циклами свет-темнота, как описано ранее. У фотоавтотрофных клеток пластидом, состоящий примерно из десяти дискоидальных хлоропластов, занимает 15% объема клетки.Хондриом в виде одной гигантской митохондрии, разветвленной по всей клетке, составляет 6% объема клетки. Синхронизация циклами температуры при непрерывном освещении не изменяет морфологию и объем этих органелл. Однако пиреноиды исчезают. В фотогетеротрофной культуре с добавлением ацетата натрия тонкая структура пластидома не изменяется, но его объем уменьшается на 19–25%. Таким образом, в это время пластидом занимает 12–13% объема клетки. Ацетат натрия вызывает, напротив, гипертрофию тонких нитей митохондриального ретикулума, который выглядит как сеть с узкими ячейками вокруг других органелл.Таким образом, хондриом занимает 10–11% объема клетки. В гетеротрофных клетках комбинированное воздействие ацетата натрия и темноты подчеркивает регрессию пластидома, в то время как хондриом выглядит как фенестрированная париетальная оболочка, занимающая 15-16% объема клетки. Максимальная гипертрофия достигается через 24 часа. Для полной дедифференцировки хлоропластов требуется 6–9 последовательных поколений в гетеротропных условиях. Эти результаты обсуждаются в связи с многочисленными светомикроскопическими и ультраструктурными наблюдениями.
Синхронизация циклами температуры при непрерывном освещении не изменяет морфологию и объем этих органелл. Однако пиреноиды исчезают. В фотогетеротрофной культуре с добавлением ацетата натрия тонкая структура пластидома не изменяется, но его объем уменьшается на 19–25%. Таким образом, в это время пластидом занимает 12–13% объема клетки. Ацетат натрия вызывает, напротив, гипертрофию тонких нитей митохондриального ретикулума, который выглядит как сеть с узкими ячейками вокруг других органелл.Таким образом, хондриом занимает 10–11% объема клетки. В гетеротрофных клетках комбинированное воздействие ацетата натрия и темноты подчеркивает регрессию пластидома, в то время как хондриом выглядит как фенестрированная париетальная оболочка, занимающая 15-16% объема клетки. Максимальная гипертрофия достигается через 24 часа. Для полной дедифференцировки хлоропластов требуется 6–9 последовательных поколений в гетеротропных условиях. Эти результаты обсуждаются в связи с многочисленными светомикроскопическими и ультраструктурными наблюдениями. Показано, как и у фотоавтотрофных клеток эвглены, синхронизированных циклами свет-темнота, пластидом гетеротрофных клеток состоит примерно из десяти органелл, тогда как хондриом содержит одну-единственную гигантскую митохондрию. Вопреки мнению, что изменения пластидома и хондриома связаны реципрокно, здесь доказывается, что дедифференцировка хлоропластов и гипертрофия хондриома происходят с разной скоростью и могут быть независимыми друг от друга.
Показано, как и у фотоавтотрофных клеток эвглены, синхронизированных циклами свет-темнота, пластидом гетеротрофных клеток состоит примерно из десяти органелл, тогда как хондриом содержит одну-единственную гигантскую митохондрию. Вопреки мнению, что изменения пластидома и хондриома связаны реципрокно, здесь доказывается, что дедифференцировка хлоропластов и гипертрофия хондриома происходят с разной скоростью и могут быть независимыми друг от друга.
Геном и транскриптом Euglena gracilis: органеллы, стратегии сборки ядерного генома и начальные признаки.
Соглашение об использовании изображения
Загружая, копируя или каким-либо образом используя изображения, расположенные на этом веб-сайте («Сайт»), вы подтверждаете, что прочитали, поняли и согласны с условиями настоящего Соглашения об использовании изображений, а также с условиями, изложенными на на веб-странице с юридическими уведомлениями, которые в совокупности регулируют использование вами изображений, как указано ниже. Если вы не согласны с такими условиями, не загружайте, не копируйте и не используйте изображения каким-либо образом, если у вас нет письменного разрешения, подписанного уполномоченным представителем Pacific Biosciences.
Если вы не согласны с такими условиями, не загружайте, не копируйте и не используйте изображения каким-либо образом, если у вас нет письменного разрешения, подписанного уполномоченным представителем Pacific Biosciences.
В соответствии с условиями настоящего Соглашения и условиями, представленными на веб-странице с юридическими уведомлениями (в той мере, в какой они не противоречат условиям настоящего Соглашения), вы можете использовать изображения на Сайте исключительно для (а) редакционного использования в прессе и/или отраслевых аналитиков, (b) в связи с обычной рецензируемой научной публикацией, книгой или презентацией и т.п. Вы не можете изменять или модифицировать любое изображение, полностью или частично, по любой причине. Вы не имеете права использовать какое-либо изображение таким образом, который искажает связанный с ним продукт, услугу или технологию Pacific Biosciences или любые связанные с ними характеристики, данные или свойства.Вы также не имеете права использовать какое-либо изображение таким образом, который означает какое-либо заявление или гарантию (прямую, подразумеваемую или предусмотренную законом) от Pacific Biosciences в отношении продукта, услуги или технологии. Права, предоставленные настоящим Соглашением, являются вашими личными и не могут быть переданы вами другому лицу.
Права, предоставленные настоящим Соглашением, являются вашими личными и не могут быть переданы вами другому лицу.
Вы, а не Pacific Biosciences, несете ответственность за использование изображений. Вы признаете и соглашаетесь с тем, что любое неправильное использование изображений или нарушение настоящего Соглашения нанесет компании Pacific Biosciences непоправимый ущерб.Pacific Biosciences является либо владельцем, либо лицензиатом изображения, а не агентом владельца. Вы соглашаетесь предоставить Pacific Biosciences кредитную линию следующим образом: «Предоставлено Pacific Biosciences of California, Inc., Менло-Парк, Калифорния, США», а также включить любые другие кредиты или подтверждения, отмеченные Pacific Biosciences. Вы должны включать любые уведомления об авторских правах, изначально включенные в изображения, на всех копиях.
ИЗОБРАЖЕНИЯ ПРЕДОСТАВЛЕНЫ Pacific Biosciences НА ОСНОВЕ «КАК ЕСТЬ». Pacific Biosciences ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ЗАЯВЛЕНИЙ И ГАРАНТИЙ, ЯВНЫХ, ПОДРАЗУМЕВАЕМЫХ ИЛИ ЗАКОННЫХ, ВКЛЮЧАЯ, ПОМИМО ПРОЧЕГО, НЕНАРУШЕНИЕ ПРАВ СОБСТВЕННОСТИ, КОММЕРЧЕСКУЮ ПРИГОДНОСТЬ И ПРИГОДНОСТЬ ДЛЯ ОПРЕДЕЛЕННОЙ ЦЕЛИ. НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ Pacific Biosciences НЕ НЕСЕТ ОТВЕТСТВЕННОСТИ ЗА ЛЮБЫЕ ПРЯМЫЕ, КОСВЕННЫЕ, СЛУЧАЙНЫЕ, ШТРАФНЫЕ ИЛИ КОСВЕННЫЕ УБЫТКИ ЛЮБОГО РОДА В ОТНОШЕНИИ ИЗОБРАЖЕНИЙ.
НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ Pacific Biosciences НЕ НЕСЕТ ОТВЕТСТВЕННОСТИ ЗА ЛЮБЫЕ ПРЯМЫЕ, КОСВЕННЫЕ, СЛУЧАЙНЫЕ, ШТРАФНЫЕ ИЛИ КОСВЕННЫЕ УБЫТКИ ЛЮБОГО РОДА В ОТНОШЕНИИ ИЗОБРАЖЕНИЙ.
Вы соглашаетесь с тем, что Pacific Biosciences может прекратить ваш доступ к изображениям, размещенным на веб-сайте PacificBiosciences.com, и их использование в любое время и без предварительного уведомления, если она сочтет, что вы нарушили какие-либо условия настоящего Соглашения об использовании изображений. Вы соглашаетесь возмещать ущерб, защищать и ограждать Pacific Biosciences, ее должностных лиц, директоров, сотрудников, агентов, лицензиаров, поставщиков и любых сторонних поставщиков информации на Сайте от любых убытков, расходов, убытков и издержек, включая разумные гонорары адвокатов. , в результате любого нарушения вами условий настоящего Соглашения об использовании изображений или прекращения компанией Pacific Biosciences вашего доступа к Сайту или его использования.Прекращение действия не повлияет на права или ваши обязательства Pacific Biosciences, возникшие до прекращения действия.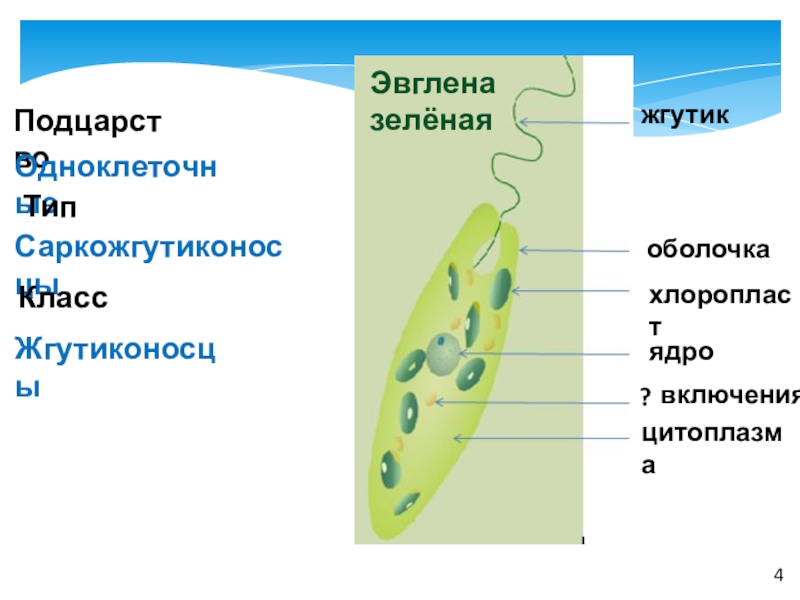
циклов клеточного деления и циркадианные осцилляторы в эвглене
Эдмундс, Леланд Н. и Лаваль-Мартин, Даниэль Л. «Циклы клеточного деления и циркадные осцилляторы у эвглены». Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. , под редакцией Hainfried E.А. Шенк и Вернер Швеммлер, Берлин, Бостон: De Gruyter, 2019, стр. 309-328. https://doi.org/10.1515/9783110841237-033 Эдмундс, Л. и Лаваль-Мартин, Д. (2019). Циклы клеточного деления и циркадные осцилляторы у эвглены. В H. Schenk & W. Schwemmler (Ed.), Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г., (стр. 309–328). Берлин, Бостон: Де Грюйтер.https://doi.org/10.1515/9783110841237-033 Эдмундс, Л.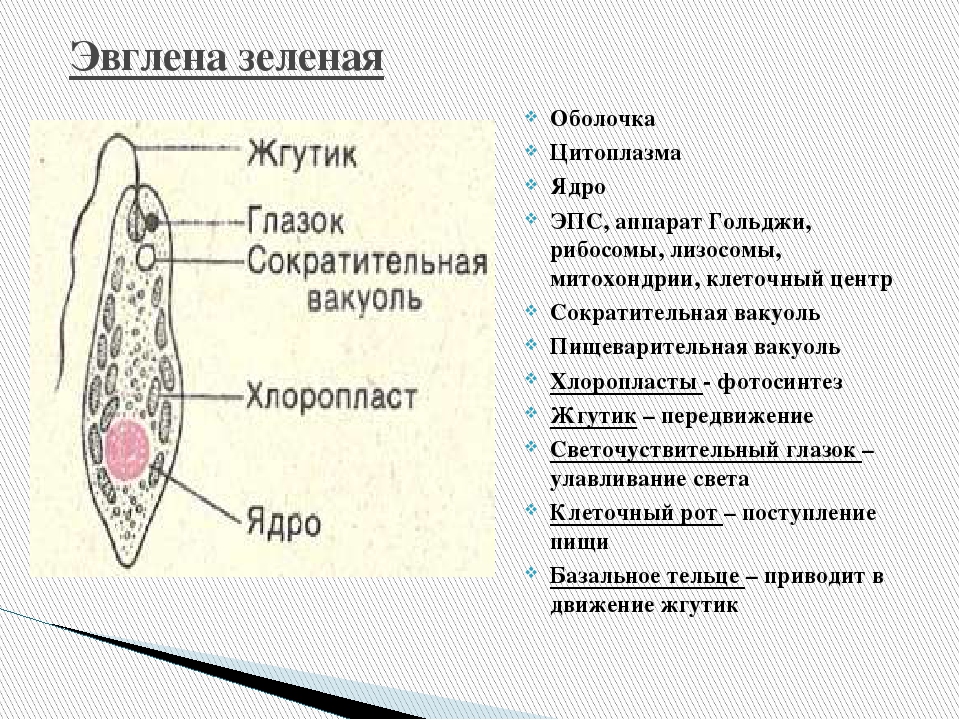 и Лаваль-Мартин, Д. 2019. Циклы клеточного деления и циркадные осцилляторы у эвглены. В: Шенк, Х. и Швеммлер, В. изд. Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. . Берлин, Бостон: Де Грюйтер, стр. 309–328. https://doi.org/10.1515/9783110841237-033
Эдмундс, Леланд Н.и Лаваль-Мартин, Даниэль Л. «Циклы клеточного деления и циркадные осцилляторы у Euglena» In Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. , под редакцией Хайнфрида Э. А. Шенка и Вернера Швеммлера, 309–328. Берлин, Бостон: Де Грюйтер, 2019 г. https://doi.org/10.1515/9783110841237-033.
Эдмундс Л., Лаваль-Мартин Д. Циклы клеточного деления и циркадные осцилляторы у эвглены.В: Шенк Х., Швеммлер В. (ред.
и Лаваль-Мартин, Д. 2019. Циклы клеточного деления и циркадные осцилляторы у эвглены. В: Шенк, Х. и Швеммлер, В. изд. Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. . Берлин, Бостон: Де Грюйтер, стр. 309–328. https://doi.org/10.1515/9783110841237-033
Эдмундс, Леланд Н.и Лаваль-Мартин, Даниэль Л. «Циклы клеточного деления и циркадные осцилляторы у Euglena» In Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. , под редакцией Хайнфрида Э. А. Шенка и Вернера Швеммлера, 309–328. Берлин, Бостон: Де Грюйтер, 2019 г. https://doi.org/10.1515/9783110841237-033.
Эдмундс Л., Лаваль-Мартин Д. Циклы клеточного деления и циркадные осцилляторы у эвглены.В: Шенк Х., Швеммлер В. (ред. ) Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. . Берлин, Бостон: Де Грюйтер; 2019. С.309-328. https://doi.org/10.1515/9783110841237-033
) Внутриклеточное пространство как олигогенетическая экосистема. Материалы: Второй международный коллоквиум по эндоцитобиологии, Тюбинген, Германия, 10–15 апреля 1983 г. . Берлин, Бостон: Де Грюйтер; 2019. С.309-328. https://doi.org/10.1515/9783110841237-033Хлоропласты Euglena, возможно, произошли от симбиотических зеленых водорослей
Цитируется по
1. De Novo Transcriptome Meta-Assembly of Mixotrophic Freshwater Microalga Euglena gracilis
2. Происхождение симбиогенеза: аннотированный английский перевод статьи Мерешковского 1910 года о теории двух плазменных линий translocator family
6. Центральные метаболические пути эвглены и их субклеточное расположение
7. Мутагенный скрининг основных пластидных генов биогенеза у малярийных паразитов человека
8. Низкотемпературный стресс изменяет экспрессию генов фитоендесатуразы ( crtP1 и crtP2 ) и ген ζ-каротиндесатуразы ( crtQ ) Вместе с клеточным содержанием каротиноидов Euglena gracilis
9. Идентификация жгутикового белка, участвующего в гравитаксисе жгутиковых Euglena gracilis
Идентификация жгутикового белка, участвующего в гравитаксисе жгутиковых Euglena gracilis
10. Внутриродовое сравнение хлоропластного генома рода Euglena (Phylum: Euglena of chloromesplenophyta) с аннотацией Клара
11. Эпипласты: мембранные скелеты и белки эпипластина у эвгленид, глаукофитов, криптофитов, инфузорий, динофлагеллят и апикомплексов
12. Внутриродовая изменчивость между хлоропластными геномами Трахеломонас великий и Трахеломонас вольвоцина и филогеномный анализ фототрофных эвгленоидов
13. Изменения содержания мембранных липидов, коррелирующие с развитием хлоропластов и митохондрий у Euglena gracilis
14. Влияние питания и выпаса цветущего эвгленофита Eupteptiella eupharyngea на морские эубактерии и цианобактерии
15. Эволюционировали ли некоторые пластиды, полученные из красных водорослей с помощью клептопластиды? Гипотеза
16. Царство Chromista и его восемь типов: новый синтез с акцентом на перипластидный белок, эволюцию цитоскелета и перипластидов и древние расхождения эндосимбиотическая теория
Царство Chromista и его восемь типов: новый синтез с акцентом на перипластидный белок, эволюцию цитоскелета и перипластидов и древние расхождения эндосимбиотическая теория
18. Физиология, анаэробы и происхождение митозирующих клеток 50 лет спустя
19. Повторный анализ генов «водорослей» предполагает сложную эволюционную историю оомицетов
20. Физиология, филогения, ранняя эволюция и
21. Обзор: происхождение сложных водорослей путем вторичного эндосимбиоза: путешествие во времени
22. Редкий случай дупликации гена, кодирующего пластидный белок, в хлоропластном Эвглена археопластиата (Euglenophyta)
23. Путь синтеза тетрапиррола как модель горизонтального переноса генов у эвгленоидов
24. Хлоропластный геном Эвглена мутабилис Кластерное расположение, интронный анализ и внутриродовые тенденции Пластида Эвглены
30. Запутанная эволюция эукариот со сложными пластидами
Запутанная эволюция эукариот со сложными пластидами
31. Вторичные пластиды эвгленофитов
33. Идентификация и функциональный анализ гена биосинтеза геранилгеранилпирофосфатсинтазы (crtE) для синтеза эвкретеноидсинтазы инкаретеноиды gracilis
34. Раннее захоронение в кремнеземе сводит к минимуму молекулярную деградацию микроорганизмов во время расширенного диагенеза
35. Террестриализация стрептофитов в свете пластидной эволюции
36. Хлоропластный геном Факус круговой (Euglenophyceae): начальная исходная точка для phacaceae
37. Эволюционная история ферментов, участвующих в цикле Кальвина-Бенсона у эвгленид
38. Геномные перспективы рождения и распространения пластид
Импорт белка и происхождение красных комплексных пластид40. Эвгленоидные жгутиконосцы: многогранная биотехнологическая платформа
41. Характеристика ферментов окислительного фосфорилирования у
Эвглена изящная
и его белый мутантный штамм
Вт
гм
ZOflL
Характеристика ферментов окислительного фосфорилирования у
Эвглена изящная
и его белый мутантный штамм
Вт
гм
ZOflL
42. Фотосинтетические эвгленоиды
43. Небольшая часть пластидных транскриптов полиаденилирована в жгутиконосцах Euglena gracilis
44. Применение секвенирования нового поколения для раскрытия истории эволюции водорослей
45. Изучение профилей накопления полярных липидов в Эвглена изящная с использованием LipidBlast, спектральной библиотеки MS/MS, созданной В SILICO
46. 46. APICOPLAST и Mitochondrion Toxoplasma Gondii
47. Nucleomorph Сравнительная геномика
48. Фотосинтеза Paulinella: Рекапитурирование первичного пластида
49. Молекулярное разнообразие эндосимбиотического Nephroselmis (Nephroselmidophyceae) у Hatena arenicola (Katablepharidophycota)
50. Ультраструктура и молекулярно-филогенетическая позиция
Гетеронема скафурум
: Еукаристые эвгленид с цитопроцепным
Ультраструктура и молекулярно-филогенетическая позиция
Гетеронема скафурум
: Еукаристые эвгленид с цитопроцепным
51. Комплекс водорослей Origins
52. Эволюция генома хлоропласта в фотосинтетических евленоидах: сравнение эвтрептиозных виридис и евглас Грасилис (Euglenophyta)
53. Сравнительная геномика хлоропластов между Эвглена виридис и Эвглена изящная (Euglenophyta)
54. Кодируемые ядром мРНК белков хлоропластов GapA, PetA и PsbO Транс -сращивание в бичевательном Эвглена изящная Независимо от света и функции пластид
55. Пластидный геном эутрептиелл дает представление о процессе вторичного эндосимбиоза пластид у эвгленид
56. Эволюция водорослей путем вторичного и третичного эндосимбиоза
62. Прогнозирование и моделирование вредоносного цветения водорослей в прибрежной зоне
63. Филогенетический мозаичный пластидный протеом и необычные сигналы нацеливания пластид в зелено- окрашенный динофлагеллят Lepidodinium chlorophorum
Филогенетический мозаичный пластидный протеом и необычные сигналы нацеливания пластид в зелено- окрашенный динофлагеллят Lepidodinium chlorophorum
64. Реконструкция эволюционных взаимоотношений эвгленоидов с использованием трех генов: ядерных SSU и LSU и последовательностей рДНК SSU хлоропластов и описания Euglenaria gen. ноябрь (Euglenophyta)
65.
65. Возможная роль для кратковременных интронов в приобретении нацелевых нацелевых пептидов в жгутике Euglena Gracilis
66. Эндосимбиотическое происхождение, диверсификация и судьба пластид
68. транскриптома анализ пластидной хромосомы Euglena gracilis
69. О происхождении хлоропластов, механизмах импорта белков, нацеленных на хлоропласты, и потере фотосинтетической способности — обзор
70. Экспрессия кодируемых ядром генов хлоропластных белков у жгутиконосцев Euglena gracilis
71. Загадка эволюции пластид
72. ГИПОТЕЗА ЭВОЛЮЦИИ ПЛАСТИД В ХРОМАЛЬВЕОЛАТАХ
1
ГИПОТЕЗА ЭВОЛЮЦИИ ПЛАСТИД В ХРОМАЛЬВЕОЛАТАХ
1
73. Макроэволюция через вторичный эндосимбиоз: взгляд неогольдшмидта на одноклеточных полных надежд монстров и первичную промежуточную форму Дарвина
74. Разработка системы экспрессии генов у морской диатомовой водоросли с использованием вирусных промоторов самого разного происхождения
75. История генома у симбиотического гибрида Euglena gracilis
76. Сортировка пшеницы от мякины в мультигенном анализе хлорофилла c-содержащие пластиды
77. Геномы нуклеоморфов: структура, функция, происхождение и эволюция
78. ячеистые отсеки
79. Паттерны экспрессии генов у Euglena gracilis: взгляд на клеточный ответ на стресс окружающей среды
80. Пластидный эндосимбиоз: источники и время основных событий
81. Апикопласт и митохондрия Toxoplasma gondii 2.
50025 2. Полный хлоропластный геном хлорарахниофита Bigelowiella natans: свидетельство независимого происхождения хлорарахниофитов и вторичных эндосимбионтов эвгленид 83. Транспортировка белков в сложные хлоропласты эвглены
Транспортировка белков в сложные хлоропласты эвглены
84. Импорт белков в хлоропласты: кто, когда и как?
86. Геномный и филогенетический взгляд на эндосимбиоз и происхождение водорослей
87. Возникла ли пластида перидинина в результате третичного эндосимбиоза? Гипотеза
88. Новое понимание апикопласта Sarcocystis с помощью просвечивающей электронной томографии
89. Модель для морфогенеза морфогенеза полосовых узоров в фототрофических эвтелидах: доказательства гетерохронного в эволюции гранулирования
90. Филогения фотосинтетических евленофитов на основе комбинированного хлоропласта и цитоплазматического SSU RDNA-последовательности Анализ1
91. Глядя на жизнь: От бинокля к электронному микроскопу
92. Ультраструктурные особенности и деление вторичных пластид
93. ПОДДЕРЖИВАЮТ ЛИ ПЛАСТИДОВЫЕ ПРИЗНАКИ ХРОМАЛЬВЕОЛАТНУЮ ГИПОТЕЗУ?1
Гомологичная и гетерологичная реконструкция Гольджи для транспорта хлоропластов и импорта белка в сложные хлоропласты Euglena
95. Нацеливание белков на хлоропласты фотосинтезирующих эукариот: добраться туда — половина удовольствия Фосфоглицераткиназа хлоропластов Euglena gracilis
Нацеливание белков на хлоропласты фотосинтезирующих эукариот: добраться туда — половина удовольствия Фосфоглицераткиназа хлоропластов Euglena gracilis
98. Были ли у трипаносоматидных паразитов фотосинтезирующие предки?
99. Белковые филогенисты надежно разрешают глубокоуровневые отношения в пределах EUGLENOZOA
100039
100. Протуисты и микроводоросники: антагонистические и взаимные ассоциации и симбиогенез пластид
101. Протозонный пропутанный простейший Phyla Metamonada Grase. (Anaeromonadea, Parabasalia, Carpediemonas, Eopharyngia) и Loukozoa emend. (Якобеа, Малавимонас): их эволюционное сходство и новые высшие таксоны
102. Синхротронная инфракрасная визуализация одиночных клеток Euglena gracilis
103. Эволюция нацеливания белков в «сложные» пластиды: «Гипотеза секреторного транспорта»
104. Филогенез и таксономическая ревизия Сравнение последовательностей SSU рДНК и синапоморфные сигнатуры во вторичной структуре SSU рРНК 1
106. Геномная редукция и эволюция новых генетических мембран и механизма нацеливания на белок у эукариотических-эукариотических химер (метаводорослей)
Геномная редукция и эволюция новых генетических мембран и механизма нацеливания на белок у эукариотических-эукариотических химер (метаводорослей)
107. Пластидное деление: его происхождение и эволюция falciparum и другие паразиты
109. Фотосинтетические эвгленоиды
110. Пластиды водорослей: их тонкая структура и свойства
111. Водоросли и их общая характеристика. сигналы нацеливания многокомпонентных пластид диатомовых водорослей
115. Геномика симбиоза: Хозяева держат ребенка и воду в ванне
116. ПРИСУТСТВУЮТ ЛИ ЦИТОПЛАЗМАТИЧЕСКИЕ КАРМАНЫ (MTR/POCKET) ВО ВСЕХ ФОТОСИНТЕТИЧЕСКИХ ЕВГАЛЕНОГЕННЫХ? 1
117. Кластер генов rpl23 хлоропластов Spirogyra maxima (Charophyceae) имеет много общего с опероном rpl23 покрытосеменных растений
118. Транспорт белков во вторичные пластиды и эволюция первичных и вторичных пластид множественные мембраны сложных пластид
120. ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ ЭНДОСИМБИОЗ И ПРОИСХОЖДЕНИЕ ПЛАСТИД
ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ ЭНДОСИМБИОЗ И ПРОИСХОЖДЕНИЕ ПЛАСТИД
121. ТЕНДЕНЦИИ В ЭВОЛЮЦИИ ЭВГЛЕНИДНОЙ ПЕЛЛИКУЛЫ 2 121. Обзор эндосимбиотических моделей происхождения эукариот, их АТФ-продуцирующих органелл (митохондрий и гидрогеносом) и их гетеротрофного образа жизни
123. Эволюция признаков у гетеротрофных эвгленид EUGLENID PELLICLE
125. Происхождение и интеграция хлоропластов
126. Транслокация белков внутри хлоропластов одинакова у Euglena и высших растений
127. Энолаза из Trypanosoma brucei, из амитохондриального простейшего Mastigamoeba balamuth и из хлоропласта и цитозоля Euglena gracilis: кусочки эволюционной головоломки эукариотического гликолитического пути
128. Филогенетический анализ различных эвгленоидных таксонов (эвгленозоа) на основе данных последовательности 18s rdna
130. Цикл Кальвина и его регулирование
131. Прослеживая нить пластидного разнообразия через гобелен жизни
132.
133. Кратко аргументированный случай, что митохондрии и пластиды являются потомками эндосимбионтов, но что ядерный компартмент не является
135. Пластиды и нацеливание на белок
136. Принципы нацеливания белков и липидов во вторичном симбиогенезе: происхождение эвгленоидных, динофлагеллятных и споровых пластид и генеалогическое древо эукариот, 2
137. 9002 137. Несъемно-фотосинтетический пластид в малярийных паразитах и других апакомплекселезанах получен из-за пределов зеленой пластидной линии
138. Динофит хлоропластов и филогения — обзор
139. Доказательства для наличие глутатионредуктазы и трипанотионредуктазы у нетрипаносоматид Euglenozoa: Эвглена изящная Z
141. Загадочные одноклеточные протисты: действительно ли они загадочны? Дело о водорослях
142. Топология
Эвглена
Прекурсоры белка хлоропластов в пределах эндоплазматического ретикулума до Гольджи и до хлоропластных транспортных везикул
Топология
Эвглена
Прекурсоры белка хлоропластов в пределах эндоплазматического ретикулума до Гольджи и до хлоропластных транспортных везикул
143. Эволюция пластид: происхождение, разнообразие, тенденции
145. Распределение F-актина, α-актинина, тропомиозина, тубулина и органелл у Euglena gracilis методом иммунофлюоресцентной микроскопии
146. Филогенетическое положение альфа- и бета-тубулинов из Chlorarachnion Host и Cercomonas (Cercozoa)
3
3 147. Функциональная консервативность кальретикулина у Euglena gracilis 148. Перенос генов в ядро и эволюция хлоропластов
149. Происхождение и эволюция пластид и их геномов 5.3002 14003
0036 Импорт белка в цианеллы и сложные хлоропласты 151. Jäger — Hirten — Chimären: Über Die Zellevolution
152. Бетаинские липиды и цвиттериональные фосфолипиды в растениях и грибках
153. Механизм белка нацеливается на Пластиды хлорарахниофитов и эволюция сложных пластид с четырьмя мембранами. Гипотеза
Механизм белка нацеливается на Пластиды хлорарахниофитов и эволюция сложных пластид с четырьмя мембранами. Гипотеза
154. Электронно-непрозрачная кольцевидная структура, опоясывающая стягивающий перешеек делящихся хлоропластов Heterosigma akashiwo (Raphidophyceae, Chromophyta)
2
2
Внехромосомная ДНК в апикомплексе 156. Что ест Eu? Роль эндосимбиозионов эукарит / эукарит в пластном происхождении
157. Эукариотизм, к новой интерпретации
158. Происхождение и эволюция хлоропластов: текущее состояние и будущие перспективы
159. Маленькая субъединица рибосомальной РНК последовательности выбранных динофлагеллят: проверка классических эволюционных гипотез методами молекулярной систематики
160. Происхождение пластида и их распространение через вторичный симбиоз
161. Секреторская дорожка протостов: пространственная и функциональная организация и эволюция
162. Хлорофилл-каротиноидные белки кислородного фотосинтеза
Хлорофилл-каротиноидные белки кислородного фотосинтеза
163. Systematic и Эволюция водорослей: эндоцитобиоз и эволюция основных линий водорослей
164. Молекулярная филогения хлорарахниофитов на основе последовательностей пластидной рРНК и rbcL
165. Что-то заимствованное, что-то зеленое: латеральный перенос хлоропластов путем вторичного эндосимбиоза
166. Молекулярный анализ пластидной эволюции
167. Клонирование и характеристика ядерного гена, кодирующего пластидную глицеральдегид-3-фосфатдегидрогеназу морского красного красного водоросли Gracilaria verrucosa
168. ОЧИСТКА И ХАРАКТЕРИСТИКА РИБОФЛАВИНСВЯЗЫВАЮЩЕГО БЕЛКА ИЗ ЖГУЧКОВ
Euglena grcrcilis
169. Гипотеза эволюции трехспиральных Chl a/b и Chl a/c светособирающих антенных белков от двухспиральных и четырехспиральных предков
170. Наличие нуклеоморфного гена hsp70 является общим Cryptophyta и HLORACHNIOPHYTA
171. Происхождение хлоропластов и эволюция
Происхождение хлоропластов и эволюция
172. Королевство протокола и его 18 Phyla
6 173. Симбиогенетическая эволюция сложных клеток и сложных пластид
174. Вторичные хлоропласты: эволюция водорослей Cryptomonad
175. Эндосимбиотическое происхождение хлоропластов
176. Новый кальций-связывающий белок Euglena gracilis. Характеристика кДНК, кодирующей белок кислотного повтора массой 74 кДа, направленный через эндоплазматический ретикулум
177. Идентификация гомолога гена secA, кодируемого хлоропластами, у хромофитной водоросли: возможная роль в транслокации белка хлоропластов
178. Направление белков через три мембраны оболочки хлоропластов Euglena.
179. Субъединица АТФ-синтазы c/III/9 как инструмент для молекулярной филогении между царствами и метафитами 0 Генофилогенез и эндосимбиотическое происхождение пластид
182. Четыре генома водоросли Pyrenomonas salina (Cryptophyta)
183. Количество симбиотиков Organelles
Количество симбиотиков Organelles
184. Эндосимбионная гипотеза Revisized
185. Происхождение и эволюция пластид из хлорофилла-A + C-содержащих водорослей: Предлагаемые предложенные отношения к красном и зеленым альгальным пластидам
186. Молекулярная филогения пластид водорослей: краткий обзор развития генома хозяина/эндосимбионта на основе сравнения последовательностей
187. Филогенетическое происхождение пластид
188. Происхождение, убытки и выгоды хлоропластов
189. Вероятная эволюционная история Cryptomonad Algae
190. От добычи через Эндосимбион до Пластида: Сравнительные исследования в динофлагеллятах
191. Эволюция альгальных хлоропластов
192.
192. Membranes и Plastid Origins
193. Китосимбиоз и его значение в эволюции клеток
194. Демонстрация нуклеоморфакодируемой эукариотической малой субъединицы рибосомальной РНК в криптомонадах
195. Молекулярные доказательства происхождения пластид от цианобактериоподобного предка прокариоты Prochlorothrix hollandica
Молекулярные доказательства происхождения пластид от цианобактериоподобного предка прокариоты Prochlorothrix hollandica
197. Архамебы: предки эукариот?
198. Происхождение и эволюция пластидных геномов и генов
199. Потеря органелл у эндосимбионта Gymnodinium acidotum (Dinophyceae)
200. Светособирающие белки диатомовых водорослей: их связь со связывающими хлорофилл a/b белками высших растений и их способ транспорта в пластиды
901. Взаимоотношения между основными группами протистанов на основе экономичной сети последовательностей 5S рРНК
202. Фотоповедение эвгленоидных жгутиконосцев: теоретические и эволюционные перспективы
203. Euglena gracilis Модель сборки поверхности жгутиков со ссылкой на другие клетки, несущие жгутиковые мастигонемы и чешуйки
204. Появление эукариотических водорослей среди простейших: молекулярная филогения, основанная на секвенировании рибосомной РНК
9 205035 Эволюция хлоропластов водорослей
206. Выделение и характеристика клона кДНК фермента синтеза хлорофилла из Euglena gracilis. Фермент хлоропластов гидроксиметилбилансинтаза (порфобилиногендезаминаза) синтезируется с очень длинным транзитным пептидом у Euglena
Выделение и характеристика клона кДНК фермента синтеза хлорофилла из Euglena gracilis. Фермент хлоропластов гидроксиметилбилансинтаза (порфобилиногендезаминаза) синтезируется с очень длинным транзитным пептидом у Euglena
207. Свидетельство того, что нуклеоморфы хлорачачниона рептанов (хлорарачниофийкие) являются русские ядра: морфология, разделение и ДНК-дапи Флуоресценция
210. Полирибосомы, рибосомы и рибосомальные РНК
211. Филогенетическое сравнение малого субъединицы рибосом ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК COSTARIA COSTATA (PHAEOPHYTA) С ПОСЛЕДОВАТЕЛЬНОСТЬЮ ДРУГИХ ВОДОРОСЛЕЙ, СОСУДИСТЫХ РАСТЕНИЙ И ООМИКЕТОВ
212. ФИКОГЕНЕТИЧЕСКОЕ СРАВНЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ МАЛОЙ СУБЪЕДИНИЦЫ РИБОСОМНОЙ ДНК COSTARIA COSTATA (PHAEOPHYTA) С ПОСЛЕДОВАТЕЛЬНОСТЬЮ ДРУГИХ
213. Cryptophycean-подобный двойной мембраносвязанный хлоропласт у динофлагеллят,
динофиз
Ehrenb.: Эволюционные, филогенетические и токсикологические последствия
214. Кладистический анализ рибосомных РНК — филогения эукариот в связи с эндосимбиотической теорией
Кладистический анализ рибосомных РНК — филогения эукариот в связи с эндосимбиотической теорией
215. Селективное сохранение хлоропластов хлоропластами
216. Являются ли нуклеоморфы криптомонад и хлорарахнионов рудиментарными ядрами эукариотических эндосимбионтов?
217. Entosiphon Sulcatum (EUGLENOPHYCEAE): жгучие корни базального корпуса комплекса и водохранилища1,2
218. Прокариотический характер хлоропластов и митохондрий — настоящие знания
219. Entosiphon Sulcatum (EUGLENOPHYCEAE): жгучкие корни Базальный комплекс корпуса и область водохранилища1,2
220. Протей филогения и эукаригенез
221. Кладистический анализ 5S RRNA и 16S RRNA Вторичная и первичная структура — эволюция эукариот и их отношение к археабактериям
222. Прокариотические эндосимбионы в хлоропластов Строма динофлагеллатволошинской паслери
223. Необычные хлоропластские структуры в эндосимбиотических динофлагеллях: подсказка к эволюционному дифлагмату в геносусимбиодинии (DinophyCeae)
224. Cryptic Cytostome присутствует INEGLENA
Cryptic Cytostome присутствует INEGLENA
225. О пластидном симбиозе Totononia appendiculariformis (Ciliophora, Oligotrichina)
226. РЕЗЮМЕ ФИЛОГЕНИИ И КЛАССИФИКАЦИИ ЗЕЛЕНЫХ РАСТЕНИЙ
227. Взгляд на эволюцию гелиозоа (Protozoa, Sarcodina), полученный в результате ультраструктурных исследований нового вида жгутиковых из рода Pteridomonas
228. присутствует в нуклеоморфе криптомонад: еще одно доказательство того, что хлоропласт произошел от эукариотического эндосимбионта
230. Цитостом/цитофаринкс у зеленых эвгленоидных жгутиконосцев (эвгленовых) и его филогенетические последствия
231. Цитологическое обследование рода Cryptomonas (CryptophyCeae) с комментариями к его таксономии
232. Heliobacterium и происхождение Chrysoplasts
233. Гимнодиниальная кислорода Nygaard (Пиррофита), Динофлагелл с эндосимбиотическим Cryptomonad1
234. Эволюция динофлагеллят
235. Эволюционные аспекты эукариотической клетки и ее органелл
Эволюционные аспекты эукариотической клетки и ее органелл
236. Динофлагелляты: исследование и филогенетическое предположение
9003 Функциональная и филогенетическая значимость динофлагелляционных глаз 238. Происхождение зародышеобразных организмов II
239. Контроль для подразделения Plastid
6 240. Процессы уборки света в Algae
241. Algen /Wirbellosen-Endosymbiosen
242. Происхождение пластид
243. Фотосинтетическая активность изолированных хлоропластов Euglena gracilis
244. Молекулярная структура хлоропласта с особой ссылкой на тилакоиды и конверты
246.
246. Systematics и эволюция водорослей
247. Возникновение и распределение филиппин-стероловных комплексов в оболочке хлоропласта в оболочке водорослей и высших растений. -перелом
248. ЖГУТИЧНЫЙ АППАРАТ CHILOMONAS PARAMECIUM (CRYPTOPHYCEAE) И ЕГО СРАВНЕНИЕ С НЕКОТОРЫМИ ЗООЖНИЧИСТЫМИ1
249. ЖГУТОЧНЫЙ АППАРАТ
ХИЛОМОНАС ПАРАМЕЦИУМ
(CRYPTOPHYCEAE) И ЕГО СРАВНЕНИЕ С НЕКОТОРЫМИ ЗООФЛАГЕЛЛЯТАМИ
1
ЖГУТОЧНЫЙ АППАРАТ
ХИЛОМОНАС ПАРАМЕЦИУМ
(CRYPTOPHYCEAE) И ЕГО СРАВНЕНИЕ С НЕКОТОРЫМИ ЗООФЛАГЕЛЛЯТАМИ
1
250.
250. Эволюция хлоропласта? Древние и современные
6 251. Глаторасты некоторых групп водорослей могут развиваться от эндосимбиотических эукариотических водорослей 252. Хлоропласт Эволюция
253. Хлоропласт эндоплазматический ретикулум : Структура, функция и эволюционное значение
254. НУКЛЕОМОРФ КРИПТОМОНАД: ЕЕ УЛЬТРАСТРУКТУРА И ЭВОЛЮЦИОННОЕ ЗНАЧЕНИЕ1
255. НУКЛЕОМОРФ КРИПТОМОНАД: ЕЕ УЛЬТРАСТРУКТУРА И ЭВОЛЮЦИОННОЕ ЗНАЧЕНИЕ
1
256.
256. Подзнание strueldurale et fonctencelel des erveloppes хлоропластики d’euglena: etude ImmunoCytologiquicique et en Cryofracture
257. Биохимическая и ультраструктурная оценка таксономического положения Глаукосфара Вакулата Корша.
258. Спектры поглощения и флуоресценции хлорофиллированных белков, изолированных от Euglena Gracilis
Спектры поглощения и флуоресценции хлорофиллированных белков, изолированных от Euglena Gracilis
259. Соотношение между репликацией хлоропластов и делением клеток в Olisthodiscus Luteus
261. Plastid ДНК — Пластоме
262. Эволюция пластид и фотосинтетического аппарата
263. Реверсия эндосимбиоза?
264. Происхождение и эволюция хлоропластов
265. Поиски хлоропластов: путешествие из цитозоля в хлоропласты и дальше
266. Геномный и филогенетический взгляд на эндосимбиоз и происхождение водорослей
Органеллы, стратегии сборки ядерного генома и исходные характеристики
138
3 эти дисциплины. Констебль, Лондон, Великобритания. Перепечатано
1958 Russell and Russell, New York, New York, USA
Dolezel J, Bartos J, Voglmayr H, Greilhuber J (2003)
Ядерная ДНК и размер генома форели и человека.
Cytometry 51:127–128
Dooijes D, Chaves I, Kieft R, Dirks-Mulder A, Martin W,
Borst P (2000) Основание J, первоначально обнаруженное в Kinetoplastida
, также является второстепенным компонентом ядерной ДНК Euglena
gracilis.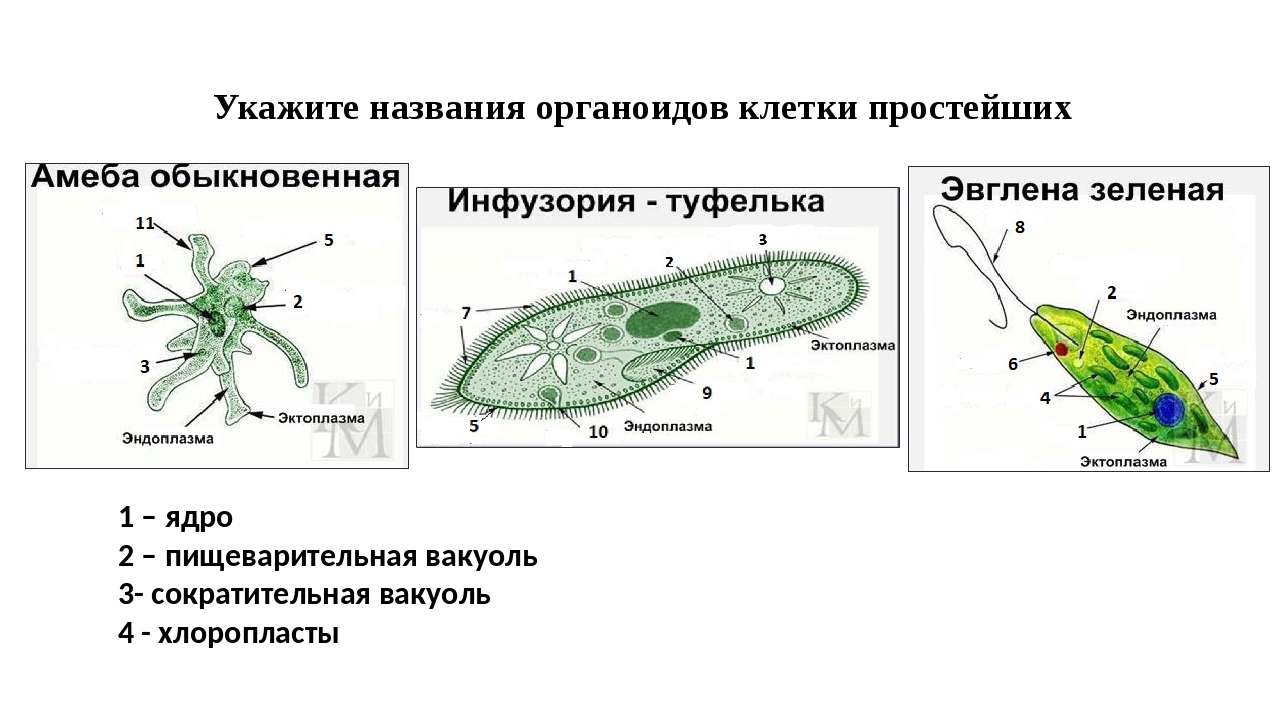 Nucl Acids Res 28(16):3017–3021.
Nucl Acids Res 28(16):3017–3021.
doi:10.1093/nar/28163017
Дос Сантос Феррейра В., Роккетта И., Конфорти В., Бенч С.,
Фельдман Р., Левин М.Дж. (2007) Паттерны экспрессии генов в понимании Euglena gracilis:
ответ на экологический стресс.Gene 389:136–145
Ebel C, Frantz C, Paulus F, Imbault P (1999) Транс-
сплайсинг и цис-сплайсинг у бесцветного Euglenoid,
Entosiphon sulcatum. Карр Жене 35:542–550
Эбенезер Т.Э., О’Нил Э., Золтнер М., Обадо С., Хэмпл В.,
Джинджер М., Джексон А., де Конинг Х., Люкс Дж., Дакс Дж.,
Леберт М., Кэррингтон M, Kelly S, Field M et al (2017)
Комплемент генов и экспрессия у Euglena gracilis
(в процессе подготовки)
El-Metwally S, Hamza T, Zakaria M, Helmy M (2013)
Следующее поколение сборка последовательности: четыре этапа
обработки данных и вычислительных задач.PLoS
Comput Biol 9(12):1–19
Epstein HT, Allaway E (1967) Свойства выборочно
голодающих Euglena. Biochim Biophys Acta 142:195–207
Biochim Biophys Acta 142:195–207
Flegontov P, Gray MW, Burger G, Lukes J (2011) Фрагментация гена
: ключ к эволюции митохондриального генома
Euglenozoa? Карр Жене 57: 225–232.
doi:10.1007/s00294-011-0340-8
Gibbs SP (1978) Хлоропласты эвглены могут иметь
эволюционировавших из симбиотических зеленых водорослей.Can J Bot
56:2883–2889
Gnerre S, MacCallum I, Przybylski D, Ribeiro F, Burton
J, Walker B, Sharpe T, Hall G, Shea T, Sykes S, Berlin
A, Aird D, Costello M, Daza R, Williams L, Nicol R,
Gnirke A, Nusbaum C, Lander ES, Jaffe DB (2011)
Высококачественные черновые сборки геномов млекопитающих
из массивно параллельных данных о последовательностях. Proc Natl Acad
Sci USA 108(4):1513–1518
Gojdics M (1953) Род Euglena Madison.
University of Wisconsin Press, Wisconsin
Goto K, Beneragama CK (2010) Циркадные часы и
антивозрастные: выявляют ли что-нибудь нестареющие микроводоросли, такие как Euglena
? Aging Res Rev 9:91–100
Gray MW, Doolittle WF (1982) Была ли доказана гипотеза эндосимбионта
? Microbiol Rev 46:1–42
Gull K (2001) Тубулины протистов: новые поступления, эволюционные отношения и понимание функции цитоскелета.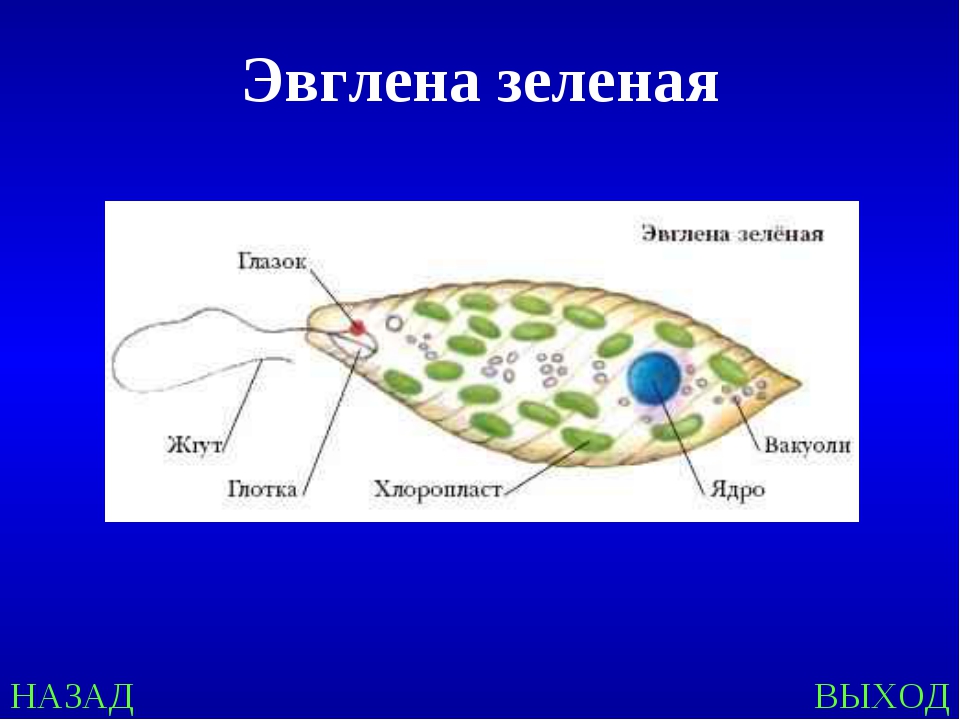
Curr Opin Microbiol 4:427–432
Гуревич А., Савельев В., Вяхи Н., Теслер Г. (2013)
QUAST: инструмент оценки качества геномных сборок.Биоинформатика 29 (8): 1072–1075. doi:10.1093/
биоинформатика/btt086
Хадер Д.-П., Хеммерсбах Р., Леберт М. (2005a) Гравитация
и поведение одноклеточных организмов. Cambridge
University Press, Cambridge
Хадер Д.-П., Хеммерсбах Р., Леберт М. (2005b) Гравитация
и поведение одноклеточных организмов. Разработка
и серия по клеточной биологии (№ 40). Cambridge University
Press, Cambridge
Hallick RB, Hong L, Drager RG, Favreau MR, Monfort
A, Orsat B, Spielmann A, Stutz E (1993) Полная последовательность
хлоропластной ДНК Euglena gracilis.Nucleic
Acids Res 21:3537–3544
Hill HZ, Epstein HT, Schiff JA (1966) Исследования развития пластов хлор-
у Euglena. XIV. Последовательное взаимодействие ультрафиолетового света и фотореактивирующего света
при образовании зеленых колоний. Biophys J 6:135–144
Biophys J 6:135–144
Hornett EA, Wheat CW (2012) Количественный анализ RNA-Seq
у немодельных видов: оценка сборок транскриптома
в качестве каркаса и полезности эволюционных
расходящихся геномных эталонных видов.BMC Genomics
13:361. doi: 10.1186/1471-2164-13-361
Айвенс А.С., Пикок К.С., Уорти Э.А., Мерфи Л., Аггарвал
Г., Берриман М., Сиск Э., Раджандрим М.А., Адлем Э.,
Аэрт Р., Анупама А., Apostolou Z, Attipoe P, Bason N,
Bauser C, Beck A, Beverley SM, Bianchettin G,
Borzym K, Bothe G, Bruschi CV, Collins M, Cadag E,
Ciarloni L, Clayton C, Coulson RM , Cronin A, Cruz
AK, Davies RM, De Gaudenzi J, Dobson DE,
Duesterhoeft A, Fazelina G, Fosker N, Frasch AC,
Fraser A, Fuchs M, Gabel C, Goble A, Goffeau A,
Harris D, Hertz-Fowler C, Hilbert H, Horn D, Huang Y,
Klages S, Knights A, Kube M, Larke N, Litvin L, Lord
A, Louie T, Marra M, Masuy D, Matthews K, Michaeli
S, Mottram JC, Müller-Auer S, Munden H, Nelson S,
Norbertczak H, Oliver K, O’Neil S, Pentony M, Pohl
TM, Price C, Purnelle B, Quail Массачусетс, Раббинович Э. ,
,
Рейнхардт Р., Ригер М., Ринта Дж., Роббен Дж., Робертсон
Л., Руис Дж. К., Руттер С., Сондерс Д., Шефер М., Шейн Дж.,
Шварц Д.С., Сигер К., Сейлер А., Шарп С., Шин Х.,
Sivam D, Squares R, Squares S, Tosato V, Vogt C,
Volckaert G, Wambutt R, Warren T, Wedler H,
Woodward J, Zhou S, Zimmermann W, Smith DF,
Blackwell JM, Stuart KD, Barrell B, Myler PJ (2005)
Геном кинетопластидного паразита Leishmania
major.Science 309(5733):436–442
Jackson AP, Vaughan S, Gull K (2006) Эволюция массивов генов tubu-
lin у трипаносоматидных паразитов: реструктуризация генома
у Leishmania. BMC Genomics 7:261
Джексон А.П., Сандерс М., Берри А., Маккуиллан Дж., Аслетт
М.А., Куэйл М.А., Чукуалим Б., Кейпуэлл П., Маклауд
А, Мелвилл С.Е., Гибсон В., Барри Д.Д., Берриман М.,
Hertz-Fowler C (2010) Последовательность генома
Trypanosoma brucei gambiense, возбудителя
хронического африканского трипаносомоза человека. PLoS Negl
PLoS Negl
Trop Dis 4(4):e658
Jackson AP, Otto TD, Aslett M, Armstrong SD, Bringaud
F, Schlacht A, Hartley C, Sanders M, Wastling JM,
Dacks JB, Acosta- Серрано А., Филд М.С., Джинджер М.Л.,
Берриман М. (2016) Kinetoplastid phylogenomics
раскрывает эволюционные инновации, связанные с
происхождением паразитизма. Curr Biol 26:161–172
Kawasaki H, Kretsinger RH (1995) Кальций-связывающие белки
1: EF-hands.Белковый профиль 2(4):297–490
Т.Е. Эбенезер и др.
Euglena gracilis Геном и транскриптом: органеллы, стратегии сборки ядерного генома и начальные признаки – Отпечаток пальца – Discovery
Euglena gracilis Геном и транскриптом: органеллы, стратегии сборки ядерного генома и начальные признаки – отпечаток пальца
— Discovery — Исследовательский портал Университета Данди- Сортировать по
- Масса
- По алфавиту
Медицина и науки о жизни
- Эвглена изящная
100%
- Органеллы
56%
- Транскриптом
53%
- Геном
39%
- Пластидные геномы
22%
- пластиды
18%
- информатика
14%
- Митохондриальный геном
14%
- Повторяющиеся последовательности нуклеиновых кислот
14%
- Государственный сектор
13%
- Экосистема
12%
- Кальмодулин
12%
- Тубулин
12%
- Библиотеки
10%
- ДНК
6%
Какие специализированные органеллы имеют общие черты с растениями у эвглены и какова их функция? – Рестораннорман.
 ком
ком
Какая специализированная органелла у эвглены общая с растениями и какова ее функция?
Некоторые виды Euglena обладают органеллами, которые можно найти как в растительных, так и в животных клетках. Euglena viridis и Euglena gracilis являются примерами Euglena, которые содержат хлоропласты, как и растения. У них также есть жгутики и нет клеточной стенки, что характерно для клеток животных.
Какая органелла используется эвгленой для движения?
Эвглена передвигается с помощью жгутика (множественное число ‚ жгутики), который представляет собой длинную хлыстообразную структуру, действующую как небольшой двигатель.Жгутик расположен на переднем (переднем) конце и закручивается таким образом, чтобы тянуть клетку по воде. Он прикреплен к внутреннему карману, называемому резервуаром.
Какова классификация эвглены?
Эвгленоиды
Каковы основные характеристики эвглены?
Euglena характеризуется удлиненной клеткой (15–500 микрометров [1 микрометр = 10–6 метров] или 0,0006–0,02 дюйма) с одним ядром, многочисленными хлорофиллсодержащими хлоропластами (органеллами клетки, которые являются местом фотосинтеза), сократительная вакуоль (органелла, регулирующая цитоплазму), глазное пятно и один …
Почему эвглена не растение?
Эвглена не является растительной клеткой, хотя и содержит хлоропласты.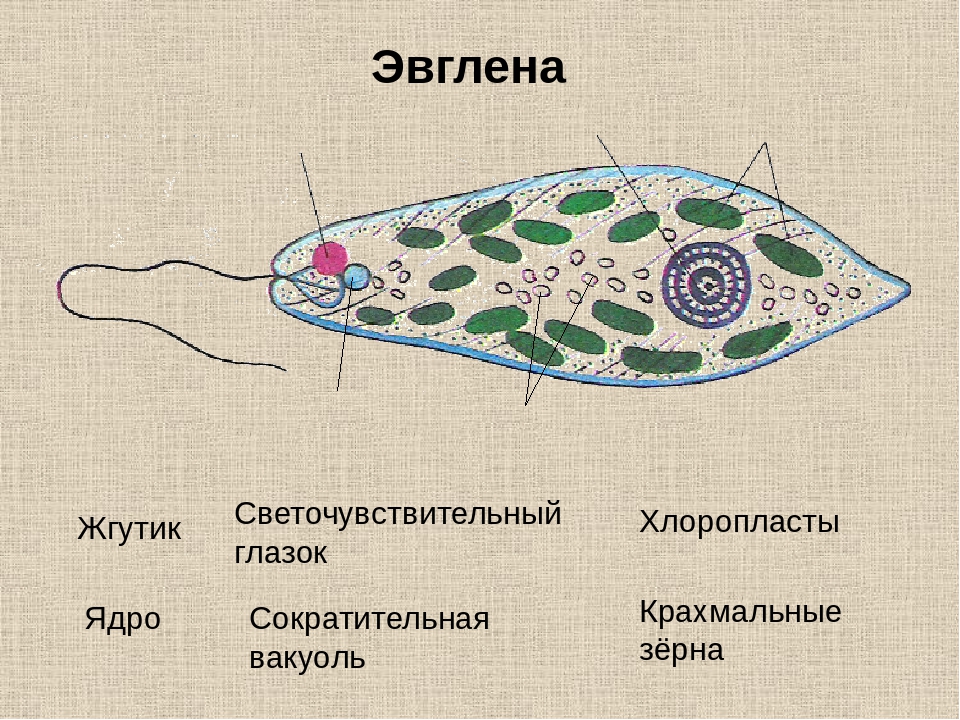 У эвглены есть глазное пятно, которое используется для обнаружения. Это помогает ему находить солнечный свет, чтобы двигаться к нему, и, следовательно, производить пищу путем фотосинтеза.
У эвглены есть глазное пятно, которое используется для обнаружения. Это помогает ему находить солнечный свет, чтобы двигаться к нему, и, следовательно, производить пищу путем фотосинтеза.
Способна ли эвглена фотосинтезировать?
Эвглена необычна тем, что она одновременно гетеротрофна, как животные, и автотрофна, как растения. Это означает, что он может потреблять пищу, такую как зеленые водоросли и амебы, путем фагоцитоза (поглощения клеток), но они также способны генерировать энергию из солнечного света путем фотосинтеза, что, возможно, является предпочтительным методом.
Дерево одноклеточное или многоклеточное?
Деревья — это многоклеточные организмы. Они состоят из эукариотических клеток, которые представляют собой сложные клетки, полные органелл.
Слон одноклеточный или многоклеточный?
В то время как многоклеточные организмы имеют множество клеток, объединенных в ткани и органы, так что каждый орган может выполнять разные функции.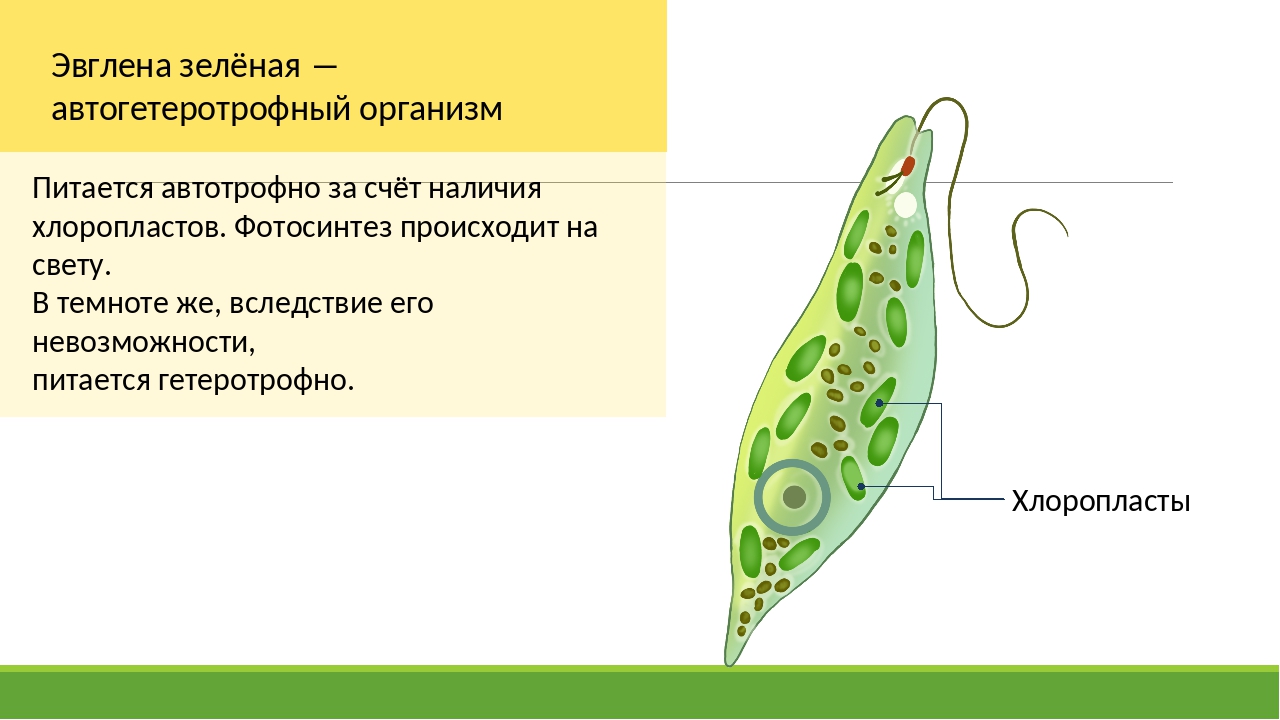
 Механизм белка нацеливается на Пластиды хлорарахниофитов и эволюция сложных пластид с четырьмя мембранами. Гипотеза
Механизм белка нацеливается на Пластиды хлорарахниофитов и эволюция сложных пластид с четырьмя мембранами. Гипотеза156. Что ест Eu? Роль эндосимбиозионов эукарит / эукарит в пластном происхождении
157. Эукариотизм, к новой интерпретации
158. Происхождение и эволюция хлоропластов: текущее состояние и будущие перспективы
159. Маленькая субъединица рибосомальной РНК последовательности выбранных динофлагеллят: проверка классических эволюционных гипотез методами молекулярной систематики
160. Происхождение пластида и их распространение через вторичный симбиоз
161. Секреторская дорожка протостов: пространственная и функциональная организация и эволюция
162. Хлорофилл-каротиноидные белки кислородного фотосинтеза
Хлорофилл-каротиноидные белки кислородного фотосинтеза
163. Systematic и Эволюция водорослей: эндоцитобиоз и эволюция основных линий водорослей
164. Молекулярная филогения хлорарахниофитов на основе последовательностей пластидной рРНК и rbcL
165. Что-то заимствованное, что-то зеленое: латеральный перенос хлоропластов путем вторичного эндосимбиоза
166. Молекулярный анализ пластидной эволюции
167. Клонирование и характеристика ядерного гена, кодирующего пластидную глицеральдегид-3-фосфатдегидрогеназу морского красного красного водоросли Gracilaria verrucosa
168. ОЧИСТКА И ХАРАКТЕРИСТИКА РИБОФЛАВИНСВЯЗЫВАЮЩЕГО БЕЛКА ИЗ ЖГУЧКОВ Euglena grcrcilis
169. Гипотеза эволюции трехспиральных Chl a/b и Chl a/c светособирающих антенных белков от двухспиральных и четырехспиральных предков
170. Наличие нуклеоморфного гена hsp70 является общим Cryptophyta и HLORACHNIOPHYTA
171. Происхождение хлоропластов и эволюция
Происхождение хлоропластов и эволюция
172. Королевство протокола и его 18 Phyla
6173. Симбиогенетическая эволюция сложных клеток и сложных пластид
174. Вторичные хлоропласты: эволюция водорослей Cryptomonad
175. Эндосимбиотическое происхождение хлоропластов
176. Новый кальций-связывающий белок Euglena gracilis. Характеристика кДНК, кодирующей белок кислотного повтора массой 74 кДа, направленный через эндоплазматический ретикулум
177. Идентификация гомолога гена secA, кодируемого хлоропластами, у хромофитной водоросли: возможная роль в транслокации белка хлоропластов
178. Направление белков через три мембраны оболочки хлоропластов Euglena.
179. Субъединица АТФ-синтазы c/III/9 как инструмент для молекулярной филогении между царствами и метафитами 0 Генофилогенез и эндосимбиотическое происхождение пластид
182. Четыре генома водоросли Pyrenomonas salina (Cryptophyta)
183. Количество симбиотиков Organelles
Количество симбиотиков Organelles
184. Эндосимбионная гипотеза Revisized
185. Происхождение и эволюция пластид из хлорофилла-A + C-содержащих водорослей: Предлагаемые предложенные отношения к красном и зеленым альгальным пластидам
186. Молекулярная филогения пластид водорослей: краткий обзор развития генома хозяина/эндосимбионта на основе сравнения последовательностей
187. Филогенетическое происхождение пластид
188. Происхождение, убытки и выгоды хлоропластов
189. Вероятная эволюционная история Cryptomonad Algae
190. От добычи через Эндосимбион до Пластида: Сравнительные исследования в динофлагеллятах
191. Эволюция альгальных хлоропластов
192.
192. Membranes и Plastid Origins
193. Китосимбиоз и его значение в эволюции клеток
194. Демонстрация нуклеоморфакодируемой эукариотической малой субъединицы рибосомальной РНК в криптомонадах
195. Молекулярные доказательства происхождения пластид от цианобактериоподобного предка прокариоты Prochlorothrix hollandica
Молекулярные доказательства происхождения пластид от цианобактериоподобного предка прокариоты Prochlorothrix hollandica
197. Архамебы: предки эукариот?
198. Происхождение и эволюция пластидных геномов и генов
199. Потеря органелл у эндосимбионта Gymnodinium acidotum (Dinophyceae)
200. Светособирающие белки диатомовых водорослей: их связь со связывающими хлорофилл a/b белками высших растений и их способ транспорта в пластиды
901. Взаимоотношения между основными группами протистанов на основе экономичной сети последовательностей 5S рРНК
202. Фотоповедение эвгленоидных жгутиконосцев: теоретические и эволюционные перспективы
203. Euglena gracilis Модель сборки поверхности жгутиков со ссылкой на другие клетки, несущие жгутиковые мастигонемы и чешуйки
204. Появление эукариотических водорослей среди простейших: молекулярная филогения, основанная на секвенировании рибосомной РНК
9 205035 Эволюция хлоропластов водорослей
206. Выделение и характеристика клона кДНК фермента синтеза хлорофилла из Euglena gracilis. Фермент хлоропластов гидроксиметилбилансинтаза (порфобилиногендезаминаза) синтезируется с очень длинным транзитным пептидом у Euglena
Выделение и характеристика клона кДНК фермента синтеза хлорофилла из Euglena gracilis. Фермент хлоропластов гидроксиметилбилансинтаза (порфобилиногендезаминаза) синтезируется с очень длинным транзитным пептидом у Euglena
207. Свидетельство того, что нуклеоморфы хлорачачниона рептанов (хлорарачниофийкие) являются русские ядра: морфология, разделение и ДНК-дапи Флуоресценция
210. Полирибосомы, рибосомы и рибосомальные РНК
211. Филогенетическое сравнение малого субъединицы рибосом ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК COSTARIA COSTATA (PHAEOPHYTA) С ПОСЛЕДОВАТЕЛЬНОСТЬЮ ДРУГИХ ВОДОРОСЛЕЙ, СОСУДИСТЫХ РАСТЕНИЙ И ООМИКЕТОВ
212. ФИКОГЕНЕТИЧЕСКОЕ СРАВНЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ МАЛОЙ СУБЪЕДИНИЦЫ РИБОСОМНОЙ ДНК COSTARIA COSTATA (PHAEOPHYTA) С ПОСЛЕДОВАТЕЛЬНОСТЬЮ ДРУГИХ
213. Cryptophycean-подобный двойной мембраносвязанный хлоропласт у динофлагеллят, динофиз Ehrenb.: Эволюционные, филогенетические и токсикологические последствия
214. Кладистический анализ рибосомных РНК — филогения эукариот в связи с эндосимбиотической теорией
Кладистический анализ рибосомных РНК — филогения эукариот в связи с эндосимбиотической теорией
215. Селективное сохранение хлоропластов хлоропластами
216. Являются ли нуклеоморфы криптомонад и хлорарахнионов рудиментарными ядрами эукариотических эндосимбионтов?
217. Entosiphon Sulcatum (EUGLENOPHYCEAE): жгучие корни базального корпуса комплекса и водохранилища1,2
218. Прокариотический характер хлоропластов и митохондрий — настоящие знания
219. Entosiphon Sulcatum (EUGLENOPHYCEAE): жгучкие корни Базальный комплекс корпуса и область водохранилища1,2
220. Протей филогения и эукаригенез
221. Кладистический анализ 5S RRNA и 16S RRNA Вторичная и первичная структура — эволюция эукариот и их отношение к археабактериям
222. Прокариотические эндосимбионы в хлоропластов Строма динофлагеллатволошинской паслери
223. Необычные хлоропластские структуры в эндосимбиотических динофлагеллях: подсказка к эволюционному дифлагмату в геносусимбиодинии (DinophyCeae)
224. Cryptic Cytostome присутствует INEGLENA
Cryptic Cytostome присутствует INEGLENA
225. О пластидном симбиозе Totononia appendiculariformis (Ciliophora, Oligotrichina)
226. РЕЗЮМЕ ФИЛОГЕНИИ И КЛАССИФИКАЦИИ ЗЕЛЕНЫХ РАСТЕНИЙ
227. Взгляд на эволюцию гелиозоа (Protozoa, Sarcodina), полученный в результате ультраструктурных исследований нового вида жгутиковых из рода Pteridomonas
228. присутствует в нуклеоморфе криптомонад: еще одно доказательство того, что хлоропласт произошел от эукариотического эндосимбионта
230. Цитостом/цитофаринкс у зеленых эвгленоидных жгутиконосцев (эвгленовых) и его филогенетические последствия
231. Цитологическое обследование рода Cryptomonas (CryptophyCeae) с комментариями к его таксономии
232. Heliobacterium и происхождение Chrysoplasts
233. Гимнодиниальная кислорода Nygaard (Пиррофита), Динофлагелл с эндосимбиотическим Cryptomonad1
234. Эволюция динофлагеллят
235. Эволюционные аспекты эукариотической клетки и ее органелл
Эволюционные аспекты эукариотической клетки и ее органелл
236. Динофлагелляты: исследование и филогенетическое предположение
9003 Функциональная и филогенетическая значимость динофлагелляционных глаз238. Происхождение зародышеобразных организмов II
239. Контроль для подразделения Plastid
6240. Процессы уборки света в Algae
241. Algen /Wirbellosen-Endosymbiosen
242. Происхождение пластид
243. Фотосинтетическая активность изолированных хлоропластов Euglena gracilis
244. Молекулярная структура хлоропласта с особой ссылкой на тилакоиды и конверты
246.
246. Systematics и эволюция водорослей
247. Возникновение и распределение филиппин-стероловных комплексов в оболочке хлоропласта в оболочке водорослей и высших растений. -перелом
248. ЖГУТИЧНЫЙ АППАРАТ CHILOMONAS PARAMECIUM (CRYPTOPHYCEAE) И ЕГО СРАВНЕНИЕ С НЕКОТОРЫМИ ЗООЖНИЧИСТЫМИ1
249. ЖГУТОЧНЫЙ АППАРАТ
ХИЛОМОНАС ПАРАМЕЦИУМ
(CRYPTOPHYCEAE) И ЕГО СРАВНЕНИЕ С НЕКОТОРЫМИ ЗООФЛАГЕЛЛЯТАМИ
1
ЖГУТОЧНЫЙ АППАРАТ
ХИЛОМОНАС ПАРАМЕЦИУМ
(CRYPTOPHYCEAE) И ЕГО СРАВНЕНИЕ С НЕКОТОРЫМИ ЗООФЛАГЕЛЛЯТАМИ
1
250.
250. Эволюция хлоропласта? Древние и современные
6 251. Глаторасты некоторых групп водорослей могут развиваться от эндосимбиотических эукариотических водорослей252. Хлоропласт Эволюция
253. Хлоропласт эндоплазматический ретикулум : Структура, функция и эволюционное значение
254. НУКЛЕОМОРФ КРИПТОМОНАД: ЕЕ УЛЬТРАСТРУКТУРА И ЭВОЛЮЦИОННОЕ ЗНАЧЕНИЕ1
255. НУКЛЕОМОРФ КРИПТОМОНАД: ЕЕ УЛЬТРАСТРУКТУРА И ЭВОЛЮЦИОННОЕ ЗНАЧЕНИЕ 1
256.
256. Подзнание strueldurale et fonctencelel des erveloppes хлоропластики d’euglena: etude ImmunoCytologiquicique et en Cryofracture
257. Биохимическая и ультраструктурная оценка таксономического положения Глаукосфара Вакулата Корша.
258. Спектры поглощения и флуоресценции хлорофиллированных белков, изолированных от Euglena Gracilis
Спектры поглощения и флуоресценции хлорофиллированных белков, изолированных от Euglena Gracilis
259. Соотношение между репликацией хлоропластов и делением клеток в Olisthodiscus Luteus
261. Plastid ДНК — Пластоме
262. Эволюция пластид и фотосинтетического аппарата
263. Реверсия эндосимбиоза?
264. Происхождение и эволюция хлоропластов
265. Поиски хлоропластов: путешествие из цитозоля в хлоропласты и дальше
266. Геномный и филогенетический взгляд на эндосимбиоз и происхождение водорослей
Органеллы, стратегии сборки ядерного генома и исходные характеристики
138
3 эти дисциплины. Констебль, Лондон, Великобритания. Перепечатано
1958 Russell and Russell, New York, New York, USA
Dolezel J, Bartos J, Voglmayr H, Greilhuber J (2003)
Ядерная ДНК и размер генома форели и человека.
Cytometry 51:127–128
Dooijes D, Chaves I, Kieft R, Dirks-Mulder A, Martin W,
Borst P (2000) Основание J, первоначально обнаруженное в Kinetoplastida
, также является второстепенным компонентом ядерной ДНК Euglena
gracilis. Nucl Acids Res 28(16):3017–3021.
Nucl Acids Res 28(16):3017–3021.
doi:10.1093/nar/28163017
Дос Сантос Феррейра В., Роккетта И., Конфорти В., Бенч С.,
Фельдман Р., Левин М.Дж. (2007) Паттерны экспрессии генов в понимании Euglena gracilis:
ответ на экологический стресс.Gene 389:136–145
Ebel C, Frantz C, Paulus F, Imbault P (1999) Транс-
сплайсинг и цис-сплайсинг у бесцветного Euglenoid,
Entosiphon sulcatum. Карр Жене 35:542–550
Эбенезер Т.Э., О’Нил Э., Золтнер М., Обадо С., Хэмпл В.,
Джинджер М., Джексон А., де Конинг Х., Люкс Дж., Дакс Дж.,
Леберт М., Кэррингтон M, Kelly S, Field M et al (2017)
Комплемент генов и экспрессия у Euglena gracilis
(в процессе подготовки)
El-Metwally S, Hamza T, Zakaria M, Helmy M (2013)
Следующее поколение сборка последовательности: четыре этапа
обработки данных и вычислительных задач.PLoS
Comput Biol 9(12):1–19
Epstein HT, Allaway E (1967) Свойства выборочно
голодающих Euglena. Biochim Biophys Acta 142:195–207
Biochim Biophys Acta 142:195–207
Flegontov P, Gray MW, Burger G, Lukes J (2011) Фрагментация гена
: ключ к эволюции митохондриального генома
Euglenozoa? Карр Жене 57: 225–232.
doi:10.1007/s00294-011-0340-8
Gibbs SP (1978) Хлоропласты эвглены могут иметь
эволюционировавших из симбиотических зеленых водорослей.Can J Bot
56:2883–2889
Gnerre S, MacCallum I, Przybylski D, Ribeiro F, Burton
J, Walker B, Sharpe T, Hall G, Shea T, Sykes S, Berlin
A, Aird D, Costello M, Daza R, Williams L, Nicol R,
Gnirke A, Nusbaum C, Lander ES, Jaffe DB (2011)
Высококачественные черновые сборки геномов млекопитающих
из массивно параллельных данных о последовательностях. Proc Natl Acad
Sci USA 108(4):1513–1518
Gojdics M (1953) Род Euglena Madison.
University of Wisconsin Press, Wisconsin
Goto K, Beneragama CK (2010) Циркадные часы и
антивозрастные: выявляют ли что-нибудь нестареющие микроводоросли, такие как Euglena
? Aging Res Rev 9:91–100
Gray MW, Doolittle WF (1982) Была ли доказана гипотеза эндосимбионта
? Microbiol Rev 46:1–42
Gull K (2001) Тубулины протистов: новые поступления, эволюционные отношения и понимание функции цитоскелета.
Curr Opin Microbiol 4:427–432
Гуревич А., Савельев В., Вяхи Н., Теслер Г. (2013)
QUAST: инструмент оценки качества геномных сборок.Биоинформатика 29 (8): 1072–1075. doi:10.1093/
биоинформатика/btt086
Хадер Д.-П., Хеммерсбах Р., Леберт М. (2005a) Гравитация
и поведение одноклеточных организмов. Cambridge
University Press, Cambridge
Хадер Д.-П., Хеммерсбах Р., Леберт М. (2005b) Гравитация
и поведение одноклеточных организмов. Разработка
и серия по клеточной биологии (№ 40). Cambridge University
Press, Cambridge
Hallick RB, Hong L, Drager RG, Favreau MR, Monfort
A, Orsat B, Spielmann A, Stutz E (1993) Полная последовательность
хлоропластной ДНК Euglena gracilis.Nucleic
Acids Res 21:3537–3544
Hill HZ, Epstein HT, Schiff JA (1966) Исследования развития пластов хлор-
у Euglena. XIV. Последовательное взаимодействие ультрафиолетового света и фотореактивирующего света
при образовании зеленых колоний. Biophys J 6:135–144
Biophys J 6:135–144
Hornett EA, Wheat CW (2012) Количественный анализ RNA-Seq
у немодельных видов: оценка сборок транскриптома
в качестве каркаса и полезности эволюционных
расходящихся геномных эталонных видов.BMC Genomics
13:361. doi: 10.1186/1471-2164-13-361
Айвенс А.С., Пикок К.С., Уорти Э.А., Мерфи Л., Аггарвал
Г., Берриман М., Сиск Э., Раджандрим М.А., Адлем Э.,
Аэрт Р., Анупама А., Apostolou Z, Attipoe P, Bason N,
Bauser C, Beck A, Beverley SM, Bianchettin G,
Borzym K, Bothe G, Bruschi CV, Collins M, Cadag E,
Ciarloni L, Clayton C, Coulson RM , Cronin A, Cruz
AK, Davies RM, De Gaudenzi J, Dobson DE,
Duesterhoeft A, Fazelina G, Fosker N, Frasch AC,
Fraser A, Fuchs M, Gabel C, Goble A, Goffeau A,
Harris D, Hertz-Fowler C, Hilbert H, Horn D, Huang Y,
Klages S, Knights A, Kube M, Larke N, Litvin L, Lord
A, Louie T, Marra M, Masuy D, Matthews K, Michaeli
S, Mottram JC, Müller-Auer S, Munden H, Nelson S,
Norbertczak H, Oliver K, O’Neil S, Pentony M, Pohl
TM, Price C, Purnelle B, Quail Массачусетс, Раббинович Э. ,
Рейнхардт Р., Ригер М., Ринта Дж., Роббен Дж., Робертсон
Л., Руис Дж. К., Руттер С., Сондерс Д., Шефер М., Шейн Дж.,
Шварц Д.С., Сигер К., Сейлер А., Шарп С., Шин Х.,
Sivam D, Squares R, Squares S, Tosato V, Vogt C,
Volckaert G, Wambutt R, Warren T, Wedler H,
Woodward J, Zhou S, Zimmermann W, Smith DF,
Blackwell JM, Stuart KD, Barrell B, Myler PJ (2005)
Геном кинетопластидного паразита Leishmania
major.Science 309(5733):436–442
Jackson AP, Vaughan S, Gull K (2006) Эволюция массивов генов tubu-
lin у трипаносоматидных паразитов: реструктуризация генома
у Leishmania. BMC Genomics 7:261
Джексон А.П., Сандерс М., Берри А., Маккуиллан Дж., Аслетт
М.А., Куэйл М.А., Чукуалим Б., Кейпуэлл П., Маклауд
А, Мелвилл С.Е., Гибсон В., Барри Д.Д., Берриман М.,
Hertz-Fowler C (2010) Последовательность генома
Trypanosoma brucei gambiense, возбудителя
хронического африканского трипаносомоза человека. PLoS Negl
PLoS Negl
Trop Dis 4(4):e658
Jackson AP, Otto TD, Aslett M, Armstrong SD, Bringaud
F, Schlacht A, Hartley C, Sanders M, Wastling JM,
Dacks JB, Acosta- Серрано А., Филд М.С., Джинджер М.Л.,
Берриман М. (2016) Kinetoplastid phylogenomics
раскрывает эволюционные инновации, связанные с
происхождением паразитизма. Curr Biol 26:161–172
Kawasaki H, Kretsinger RH (1995) Кальций-связывающие белки
1: EF-hands.Белковый профиль 2(4):297–490
Т.Е. Эбенезер и др.
Euglena gracilis Геном и транскриптом: органеллы, стратегии сборки ядерного генома и начальные признаки – Отпечаток пальца – Discovery
Euglena gracilis Геном и транскриптом: органеллы, стратегии сборки ядерного генома и начальные признаки – отпечаток пальца — Discovery — Исследовательский портал Университета Данди- Сортировать по
- Масса
- По алфавиту
Медицина и науки о жизни
- Эвглена изящная 100%
- Органеллы 56%
- Транскриптом 53%
- Геном 39%
- Пластидные геномы 22%
- пластиды 18%
- информатика 14%
- Митохондриальный геном 14%
- Повторяющиеся последовательности нуклеиновых кислот 14%
- Государственный сектор 13%
- Экосистема 12%
- Кальмодулин 12%
- Тубулин 12%
- Библиотеки 10%
- ДНК 6%
Какие специализированные органеллы имеют общие черты с растениями у эвглены и какова их функция? – Рестораннорман.
 ком
ком У эвглены есть глазное пятно, которое используется для обнаружения. Это помогает ему находить солнечный свет, чтобы двигаться к нему, и, следовательно, производить пищу путем фотосинтеза.
У эвглены есть глазное пятно, которое используется для обнаружения. Это помогает ему находить солнечный свет, чтобы двигаться к нему, и, следовательно, производить пищу путем фотосинтеза.
